FAJRIATI RAFELIA HAPSARI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Semen Characteristic of Domestic Cat (Felis catus). Under direction of R. IIS ARIFIANTINI and Rr SOESATYORATIH.
This study aims to determined the characteristics of domestic cats (Felis catus) semen collected by electroejaculator. Semen was collected from 21 sexually mature tomcats. Stimulation of electroejaculator were 1 V, 2 V and 3 V with 10 repetition at each voltage with a time of stimulation 5 seconds and rest 5 seconds (on-off). During stimulation reaction of the cats were recorded. Ejaculate semen was evaluated macroscopically and microscopically. The results showed at any level of stimulation lead to different clinical symptoms. At 0 V stimulation the cat was unconsciousness; at 1 V stimulation the abdominal muscles was contracted, muscles around praeputium was twitched, legs trembled and convulsions, cats did inspiration and gasped when the stimulation was on, then returned to normal when stimulation stopped; at 2 V stimulation abdominal contractions got stronger, the cats were vocalize, the hind legs and praeputium were contraction, and the penis was erected; at 3 V stimulation the vocalize was louder, contraction of the hind legs was getting stronger, cloning occurred and then ejaculation; at 0 V cat was breathe more deeply and returned to normal. Cats were erectioned at 57.14 ± 26.63 seconds and ejaculation was occured at 94 ± 27.85 second. Macroscopic evaluation demonstrated that semen volume was 48.09 ± 17.71 mL, whitish in color, pH 7 ± 0.65, and the semen consistency was aqueous. Microscopic evaluation demonstrated no visible of mass movements due the slightly of sperm concentration. Semen motility was 68 ± 9:09% with the individual scoring of 4:39 ± 0.61. Viable spermatozoa was 86.84 ± 6.93% with a spermatozoa concentration was 387.4 x 106 ± 457.93 x 106/ml and sperm normality 87 ± 4.71%
FAJRIATI RAFELIA HAPSARI. Reaksi Stimulasi Elektroejakulator dan Karakteristik Semen Kucing Domestik (Felis catus). Dibimbing oleh R. IIS ARIFIANTINI dan Rr SOESATYORATIH.
Penelitian ini bertujuan untuk mengetahui karakteristik semen kucing domestik (Felis catus) yang dikoleksi menggunakan elektroejakulator. Sebanyak 21 ekor kucing jantan digunakan dalam penelitian ini. Stimulasi elektroejakulator diberikan bertingkat mulai dari 1 V, 2 V, dan 3 V pada masing-masing voltase diberikan 10 kali ulangan dengan waktu rangsangan dan istirahat masing-masing 5 detik. Reaksi yang terjadi saat kucing diberi stimulasi dicatat. Semen yang diejakulasikan dievaluasi secara makroskopis dan mikroskopis. Hasil penelitian menunjukkan setiap tingkat stimulasi elektrik menimbulkan gejala klinis berbeda.
FAJRIATI RAFELIA HAPSARI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa skripsi Reaksi Stimulasi Elektroejakulator dan Karakteristik Semen Kucing Domestik (Felis catus) adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2011
© Hak Cipta milik IPB, tahun 2011 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebut sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
LEMBAR PENGESAHAN
Judul Skripsi : Reaksi Stimulasi Elektroejakulator dan Karakteristik Semen Kucing Domestik (Felis catus)
Nama : Fajriati Rafelia Hapsari
NIM : B04070108
Lokasi Penelitian : Laboratorium URR Fakultas Kedokteran Hewan Institut Pertanian Bogor
Menyetujui Komisi Pembimbing
Dr Dra R Iis Arifiantini MSi drh Rr. Soesatyoratih MSi
Pembimbing I Pembimbing II
Mengetahui
Dr. Nastiti Kusumorini.
Wakil Dekan Fakultas Kedokteran Hewan
Penulis dilahirkan di Salatiga pada tanggal 23 Juni 1989 dari ayah Bahrudin SH, MM. dan ibu drh Sri Hartiyani. Penulis merupakan putri pertama dari dua bersaudara.
Penulis bersekolah di Taman Kanak-kanak Pertiwi pada tahun 1993. Penulis menyelesaikan pendidikan Sekolah Dasar di SDN Susukan 1 selama 4 tahun, kemudian pindah ke SDN Cebongan 2 selama 1 tahun, dan terakhir SDN Gondoriyo 1 selama 1 tahun dari tahun 1995 sampai 2000. Pada tahun 2001 penulis melanjutkan studinya pada Sekolah Menengah Pertama di SMPN 3
Salatiga. Kemudian melanjutkan ke jenjang Sekolah Menengah Atas di SMAN 1 Tengaran. Setelah lulus pada tahun 2007, penulis diterima di Institut Pertanian Bogor sebagai mahasiswa Kedokteran Hewan melalui Undangan Seleksi Masuk IPB (USMI).
sayang dan karunia-Nya sehingga skripsi yang berjudul “Reaksi Stimulasi Elektroejakulator dan Karakteristik Semen Kucing Domestik (Felis catus)” ini dapat diselesaikan dengan baik. Skripsi ini disusun sebagai salah satu syarat untuk menyelesaikan Program Sarjana (S1) di Fakultas Kedokteran Hewan Institut Pertanian Bogor. Penulis juga ingin menyampaikan terima kasih yang sebesar-besarnya kepada:
1. Dr. Dra. R. Iis Arifiantini, M.Si selaku pembimbing skripsi pertama 2. Drh. Rr. Soesatyoratih M.Si selaku pembimbing skripsi kedua.
3. Dr. drh. Joko Pamungkas M.Sc selaku dosen pembimbing akademik.
4. Bapak, dan ndut yang selalu mendukung baik secara material maupun
spiritual.
5. Keluarga besar Laboratorium unit Rehabilitasi Reproduksi (URR) Bagian Reproduksi dan Kebidanan, Departemen Klinik Patologi, dan Reproduksi Fakultas Kedokteran Hewan IPB.
6. Rumah Sakit Hewan IPB.
7. Seluruh dosen dan staf FKH IPB.
8. Para sahabat: Niken, Sandra, Yasmin, Divo, Riri, Ayu Jegeg, Bundi, Lisa, Lia, Otonk, Acox, Amel, dan Rina.
9. Sahabat-sahabat Gi44nuzzi, Ruminers, dan Steril crews.
10.Teman-teman angkatan lain: 41, 42, 43, 45, 46, dan 47 atas dukungan moralnya.
11.Teman-teman Puri Sembilan Inez, Ivon, Sri, Anis, Nela, bu Yanti dan banyak lagi.
12.Partner penelitian dan perjuangan : Angel dan Adit.
13.And last but not least : drh. Sri Hartiyani, my beloved mom, as the first and
biggest supporter for my life, whose words had inspiring me to be a great
person, and a great veterinarian.
Bogor, Agustus 2011
DAFTAR ISI
MATERI DAN METODE PENELITIAN ... 16
HASIL DAN PEMBAHASAN ... 20
Karakteristik Semen Kucing Hasil Elektroejakulator ... 23
Volume Semen ... 23
Derajat Keasaman (pH) Semen ... 24
Warna dan Konsistensi Semen ... 24
Gerakan Massa ... 24
Motilitas Spermatozoa ... 24
Rasio Spermatozoa Hidup Mati ... 25
Konsentrasi ... 25
Morfologi Spermatozoa Normal ... 26
KESIMPULAN ... 28
DAFTAR PUSTAKA ... 29
DAFTAR TABEL
Halaman
1 Bobot badan, diameter testis, waktu ereksi dan ejakulasi kucing domestik Felis catus ... 21 2.Gejala-gejala klinis akibat penggunaan elektroejakulator pada kucing
DAFTAR GAMBAR
Halaman
1 Kucing domestik ... 4
2 Skema anatomi organ reproduksi jantan ... 5
3 Testikel kucing A. sudut pandang lateral ... 6
B. sudut pandang medial ... 6
4 Kelenjar prostata kucing sudut pandang dorsal ... 7
5 Penis kucing ... 7
6 Vagina buatan ... 9
7 Morfologi spermatozoa mamalia A. Primata ... 14
B. Rodensia... 14
8 Morfologi spermatozoa kucing ... 15
PENDAHULUAN
Latar Belakang
Peningkatan minat terhadap hewan kesayangan terutama kucing menimbulkan adanya keinginan untuk menjaga atau meningkatkan kualitas keturunan. Hal ini menjadi salah satu alasan dilakukannya Inseminasi Buatan (IB) pada kucing, terutama kucing ras. Semen kucing dapat dikoleksi menggunakan vagina buatan, elektroejakulator (EE) pada kucing jantan yang dianastesi, pembilasan vagina setelah kawin (postcoitum recovery) dan dengan koleksi dari urin secara cystocentesis (penghisapan pada vesica urinaria) kucing jantan setelah ejakulasi (Johnston et al. 2001) serta dari cauda epididymis (Tittarelli et al. 2006; Zambeli & Cunto 2006). Penggunaan EE terutama ditujukan untuk koleksi semen pada hewan liar seperti harimau, rusa ataupun pada
monyet. Model EE yang digunakan pada hewan bervariasi baik ukuran panjang dan diameter tongkat perangsang (probe) maupun tingkat rangsangan yang diberikan. Rangsangan umumnya diberikan secara bertingkat dari voltase (V) rendah perlahan-lahan dinaikkan secara gradual dengan intensitas rangsangan dan istirahat yang sama (Arifiantini et al. 2005).
Upaya perlindungan terhadap jenis kucing liar yang hampir punah menjadikan IB sebagai hal yang patut diperhitungkan. Inseminasi buatan merupakan serangkaian kegiatan mulai dari koleksi, evaluasi, pengolahan semen sampai dengan deposisi semen di alat reproduksi kucing betina yang sedang estrus. Untuk mendapatkan kualitas keturunan yang baik maka kualitas semen yang akan digunakan untuk IB juga harus baik.
Keberhasilan IB ditentukan oleh berbagai faktor diantaranya kualitas semen segar yang di preservasi. Kualitas semen segar dapat di evaluasi secara makroskopis dan mikroskopis. Secara makroskopis kualitas semen yang dapat di uji adalah volume (banyaknya semen yang diejakulasikan), warna semen, kekentalan, dan derajat keasaman. Warna semen normal adalah putih keruh sampai krem. Pemeriksaan kualitas semen segarsecara mikroskopis adalahuntuk menghitung konsentrasi, motilitas, morfologi spermatozoa normal, persentase
Mengingat pentingnya dilakukan pengujian kualitas semen segar sebelum proses preservasi, penelitian ini dilakukan untuk menguji kualitas semen dari ejakulat menggunakan elektroejakulator pada kucing jantan domestik.
Tujuan
Penelitian ini bertujuan untuk:
(1) Mempelajari reaksi kucing domestik jantan terhadap stimulasi elektrik menggunakan elektroejakulator.
TINJAUAN PUSTAKA
Felis catus
Kucing domestik (Felis catus) menempati sebagian besar penjuru dunia. Bukti arkeologi menunjukkan domestikasi kucing terjadi di Near East sekitar 9000 – 10 000 tahun yang lalu. Namun, inisiasi domestikasi mungkin dimulai ribuan tahun yang lalu di mana manusia dan nenek moyang kucing menjadi semakin saling ketergantungan. Proses domestikasi mungkin dimulai selama periode ketika manusia berhenti berburu kawanan hewan liar dan mengadopsi lebih banyak gaya hidup pertanian, terutama di Fertile Crescent. Perubahan ini terjadi 10 000 – 11 000 tahun yang lalu dan dimungkinkan oleh domestikasi serealia liar tertentu dan rumput-rumputan. Hubungan manusia dan kucing bermanfaat untuk mengontrol tikus yang merusak tanaman, yang juga telah
bergabung dengan peradaban manusia. Menurut Wastlhuber (1991) kucing domestik yang ada sekarang ini merupakan evolusi dari kucing liar Afrika (F.
silvestris lybica) di zaman Mesir kuno sekitar 3000 – 4000 tahun lampau. Meskipun banyak kucing yang menjadi hewan peliharaan, kucing modern tidak didomestikasi secara penuh dalam pengertian klasik. Kucing modern tetap mandiri jika diperlukan, dengan mempertahankan kemampuan berburu yang tajam bahkan ketika makanan tersedia, dan menunjukkan spektrum perilaku mulai dari hewan peliharaan yang tidak dapat dijinakkan hingga hewan peliharaan yang sangat lembut.
penyakit zoonosis terkait (Lipinski et al. 2007). Adapun klasifikasi F. catus menurut LaBruna (2001) adalah sebagai berikut:
kingdom : Animalia filum : Chordata kelas : Mammalia ordo : Carnivora famili : Felidae genus : Felis spesies : Felis catus
Famili kucing (felidae) terdiri dari 76 spesies. Menurut laporan
Convention of International Trade of Endangered Species (CITES 2011). Kucing domestik adalah salah satu felidae yang tidak termasuk dalam spesies hewan liar (Hermansson 2006).
Gambar 1 Kucing domestik.
Anatomi organ reproduksi kucing jantan
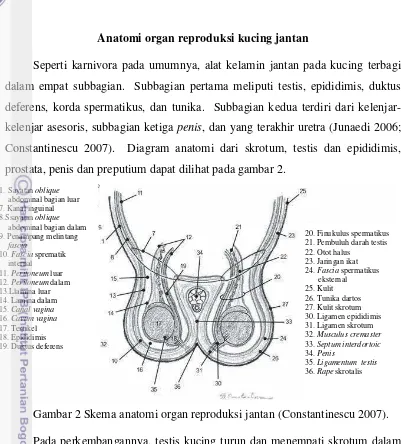
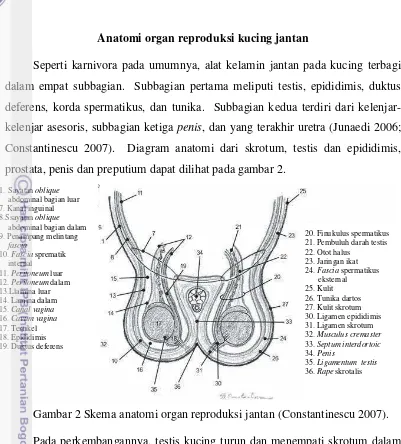
Seperti karnivora pada umumnya, alat kelamin jantan pada kucing terbagi dalam empat subbagian. Subbagian pertama meliputi testis, epididimis, duktus deferens, korda spermatikus, dan tunika. Subbagian kedua terdiri dari kelenjar-kelenjar asesoris, subbagian ketiga penis, dan yang terakhir uretra (Junaedi 2006; Constantinescu 2007). Diagram anatomi dari skrotum, testis dan epididimis, prostata, penis dan preputium dapat dilihat pada gambar 2.
Gambar 2 Skema anatomi organ reproduksi jantan (Constantinescu 2007).
Pada perkembangannya, testis kucing turun dan menempati skrotum dalam
A B
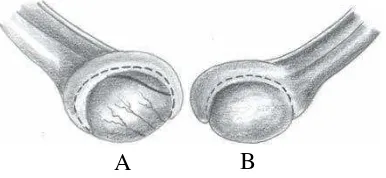
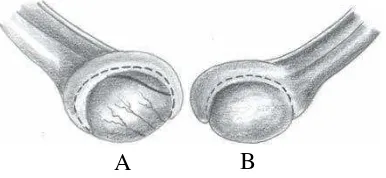
Gambar 3 Testis kucing: A. testikel kucing sudut pandang lateral; B. testikel kucing sudut pandang medial (Constantinescu 2007).
Epididimis melekat pada perbatasan dorsolateral dari testis. Kaput epididimis di mulai dari medial permukaan testis, namun saat mencapai posisi dorsolateral dilanjutkan menjadi korpus dan kauda. Kaput epididimis sedikit melebihi kepala testis. Tunika albuginea epididimis lebih tipis dibandingkan dengan albuginea testis. Panjang duktus epididimis 1.5 sampai 3 mm dan berliku-liku. Kauda epididimis melekat pada ekor testis dengan ligamentum pendek dari testis dan untuk fascia spermatic internal secara langsung (karena fascia
spermatic internal melekat pada kauda epididimis). Ligamen skrotum bergabung dengan fascia spermatic internal menuju dartos. Duktus deferens dimulai sebagai
plexus sepanjang perbatasan epididimis dari testis dan medial ke epididimis dengan arah kaudokranial karena posisi testis. Setelah melewati duktus deferens, kaput epididimis masuk ke dalam korda spermatikus dan berlanjut hingga cincin vaginal. Dalam rongga perut, duktus deferens membuat kurva dalam arah dorsokaudal untuk memasuki rongga panggul dan mencapai uretra. Dalam rute dari awal sampai akhir, mesoduktus deferens yang juga merupakan bagian dari funikulus spermatikus, melekat ke duktus deferens. Sebelum mencapai uretra, duktus deferens melintasi ureter di bagian ventral, kemudian melintasi bagian dorsal dari ligamen lateral kandung kemih. Untuk mencapai uretra, duktus deferens menembus kelenjar prostat dan membuka sisi lateral dari colliculus
seminalis (Constantinescu 2007).
diameter lebih dari 5 mm) dan melekat pada dinding uretra bagian dorsolateral yaitu pada arcus ischiadicus seperti terlihat pada gambar 4 (Constantinescu 2007).
Gambar 4 Kelenjar prostata kucing sudut pandang dorsal (Constantinescu 2007).
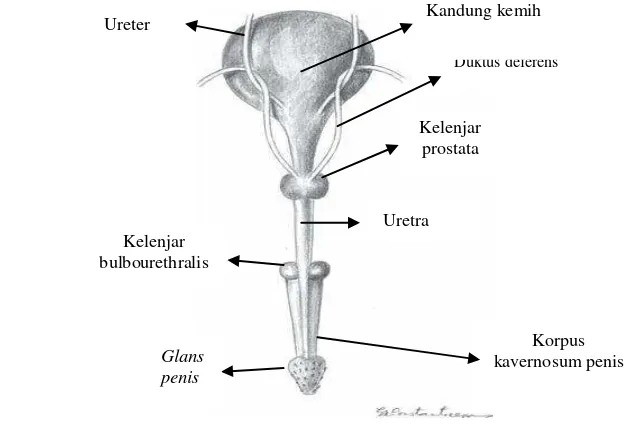
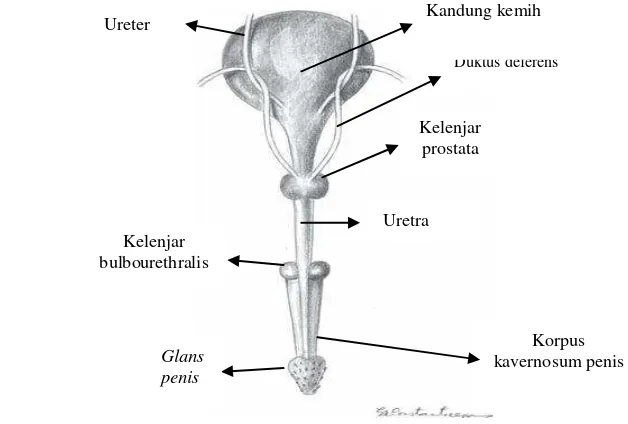
Penis pada kucing (gambar 5) berada di ventral skrotum. Penis disusun oleh dua buah corpora cavernosa, satu pada tiap sisi dan sebuah korpus spongiosum yang berada di tengah. Pejantan dewasa memiliki glans penis pada bagian ujung penis dengan panjang 5 sampai 10 mm, berbentuk kerucut yang mengarah ke caudal dan memiliki 120 sampai 150 buah duri penis (penile spines) tergantung kadar androgen setiap individu. Duri-duri penis dengan panjang dan diameter dasarnya sebesar 0.1 sampai 0.7 mm ini berjejer membentuk 6 hingga 8 buah lingkaran (Johnston et al. 2001).
Gambar 5 Penis kucing (Constantinescu 2007).
Korpus kavernosum penis Duktus deferens Kandung kemih
Kelenjar prostata
Kelenjar bulbourethralis
Glans penis
Ureter
Uretra
Duri penis
Secara histologi, duri penis disusun oleh jaringan ikat inti diselimuti epitel tanduk yang mirip dengan papilla pada lidah kucing. Peran duri pada proses kopulasi belum diketahui secara pasti namun diperkirakan duri ini berfungsi memberikan stimulasi seksual pada betina, menghalangi penarikan penis dari vagina (oleh karena itu lokasinya adalah di ujung penis), atau meningkatkan stimulasi betina untuk induksi ovulasi. Os penis pada kucing berukuran panjang 3 sampai 5 mm dan berada di ujung glans penis pada kucing jantan dewasa. Kucing tidak memiliki muskulus cremaster tetapi memiliki musculus levator scrota yang berasal dari musculus sphincter anal externus dan masuk ke dalam septum scrotal (Johnston et al. 2001).
Endokrinologi Reproduksi Kucing Jantan
Fisiologi reproduksi hewan jantan dikontrol secara endokrin oleh sekresi
Hypothalamic Gonadotropin Releasing Hormone (GnRH) pada tingkat paracrine di hipotalamus. GnRH merangsang kelenjar hipofise anterior untuk mengekskresikan dua hormon gonadotropin, yaitu Luteinizing Hormone (LH) dan
Follicle Stimulating Hormone (FSH). Hipofise anterior bertanggung jawab untuk berbagai hormon yang mengontrol banyak aspek dari aktivitas fisiologis. LH merupakan perangsang utama testosteron di dalam testis. Testosteron disekresikan oleh sel-sel leydig yang dirangsang oleh LH di dalam testis. Jumlah testosteron yang diekskresikan akan berbanding lurus dengan jumlah LH yang tersedia. Sedangkan FSH merupakan perangsang utama terjadinya spermatogenesis. FSH akan berikatan dengan reseptor-reseptor FSH spesifik yang melekat pada sel-sel sertoli dalam tubulus seminiferus. Pengikatan ini mengakibatkan sel-sel tumbuh dan mengekresikan berbagai unsur spermatogenik.
Teknik Koleksi Semen Kucing
Semen kucing telah dapat dikoleksi menggunakan: 1) vagina buatan dengan ejakulasi kucing jantan secara sadar, 2) elektroejakulator pada kucing jantan yang teranestesi, 3) membilas vagina setelah kawin (postcoitus recovery), dan 4) koleksi dari urine secara cystocentesis (penghisapan pada vesica urinaria) kucing jantan setelah ejakulasi (Johnston et al. 2001).
Vagina buatan
Vagina buatan (artificial vagina) berbentuk pipet karet silinder 2 mL dengan ujung depan berupa lubang untuk penis dan ujung belakang disambungkan dengan tabung koleksi (test tube) sebesar 3 x 44 mm. Johnston et al. (2001) menyebutkan tabung vagina buatan dan tabung koleksi dimasukkan ke dalam botol polyethylene yang diisi dengan air 52 ˚C untuk membuat suhu vagina buatan
sekitar 44 ˚ sampai 46 ˚C.
Gambar 6 Vagina buatan (Zambelli & Cunto 2006).
Elektroejakulator
Elektroejakulasi (EE) pertama dilaporkan dilakukan pada kucing yang teranastesi dengan ketamin HCL. Ejakulat diperoleh dengan cara memberikan 180 stimulus sebesar 2-8 Volt (V) menggunakan rectal probe Teflon dan stainless steel. Penelitian dilakukan dengan melihat penggunaan ejakulator dengan waktu yang pendek berangkaian dan dalam waktu yang lama, serta mengenai efek tegangan dan aplikasi perubahan tegangan terhadap kualitas semen pada kucing jantan yang teranastesi dengan ketamin HCL yang di rangsang menggunakan
automatic stimulus delivery ejaculator (Johnston et al. 2001).
Johnston et al. (2001) menyebutkan ketika 4 rangkaian ejakulat diperoleh pada koleksi seminal tunggal mingguan selama 22 minggu, tampak adanya efek yang signifikan pada rangkaian ejakulat tersebut yaitu volume semen dan jumlah spermatozoa per ejakulat. Pengulangan mingguan anastesi dan ejakalutor tidak mengubah kualitas semen secara signifikan, walaupun terdapat kecenderungan
bahwa volume ejakulat menjadi meningkat. Pada penelitian aplikasi tegangan, tampak adanya efek pada jumlah spermatozoa per ejakulat kucing akibat jenis kucing dan akibat besarnya aplikasi besarnya tegangan yang digunakan.
Menurut Hermansson (2006), spermatozoa kucing hasil penampungan dengan rangsangan EE mempunyai spesifikasi yang lebih baik. Sperma mempunyai integritas membran dan akrosom yang lebih baik daripada pengambilan spermatozoa melalui epididimis dari individu yang sama. Spermatozoa kucing juga tidak menampakkan cold shock pada saat cooling.
Osmolaritas antara hasil ejakulasi dari vagina buatan dan elektroejakulator tidak berbeda nyata. Osmolaritas semen yang dikoleksi sebanding dengan semakin tinggi tegangan voltase, hal ini menunjukkan efek voltase pada osmolaritas hasil ejakulasi. Motilitas sperma lebih rendah dengan koleksi menggunakan EE (Johnston et al. 2001).
Membilas Vagina Setelah Kawin
dilakukan segera setelah kawin antara 5 kucing normal betina dan 5 kucing normal jantan, didapatkan 40 000 sampai 10 240 000 spermatozoa (Johnston et al. 2001).
Koleksi dari Urin Secara Cystocentesis Kucing Jantan Setelah Ejakulasi
Kucing jantan dilaporkan 15 sampai 90% (rata-rata 46.80%) dari ejakulat mengalami aliran balik (retrograde) ke dalam vesika urinaria selama ejakulasi. Koleksi semen dengan cystocentesis (pengisapan pada vesika urinaria) dari kucing jantan setelah ejakulasi diikuti dengan pemeriksaan sedimen urin untuk menemukan spermatozoa adalah prosedur yang berguna pada praktek hewan kecil untuk melihat kucing tersebut memproduksi sperma atau tidak (Johnston et al. 2001).
Sediaan Anastesi
Teknik koleksi semen menggunakan elektroejakulator membutuhkan anastesi selama prosedur berlangsung. Anastesi berfungsi untuk menenangkan hewan dan salah satu prosedur keamanan selama percobaan. Anastesi merupakan metode yang dapat dipercaya, aman, dan cocok untuk teknik koleksi semen dengan menggunakan elektroejakulator (Axnér & Linde-Forsberg 2002). Salah satu metode anestesi yang dapat digunakan untuk penanganan selama percobaan adalah iv (intravenous anaesthesia). Metode iv mempunyai kelebihan yaitu efek
yang lebih cepat. Kombinasi ketamin HCl dan diazepam dapat dipakai secara iv. Ketamin adalah anastetik umum dengan cara kerja yang cepat. Sediaan ini juga bersifat analgesik dan menekan kerja kardiopulmonari. Sinner & Graf (2008) menyatakan metabolisme ketamin diperantarai oleh enzim mikrosomal hati. Potensi anestetik ketamin terletak pada isomer S(+) yang tiga sampai empat kali lebih tinggi dari isomer R(-). Ketamin dengan bagian S(+) dapat digunakan untuk premedikasi, sedasi, induksi, dan maintenance untuk anastesi umum.
Sediaan ini termasuk dalam “dissociative anaesthesia”. Ketamin dengan isomer S(+) adalah anestetik ideal untuk pasien yang mengalami trauma, pasien dengan
hypovolemic dan septic shock, serta pasien dengan penyakit pulmonum.
Tidak seperti anastesi iv lainnya, ketamin juga bersifat analgesik. Aksi
dengan sediaan lain. Profil kardiovaskular berhubungan dengan stimulasi simpatetik sentral dan menghambat uptake katekolamin neuronal sehingga ketamin lebih dipilih untuk pasien yang kurang stabil secara hemodinamis. Aktivasi simpatetik dapat menetralkan efek negatif inotropik ketamin pada miokardium secara langsung (Bovil 2006; Sinner & Graf 2008). Hasil yang bagus dapat dilihat pada individu sehat adalah efek inotropik positif dengan meningkatnya tekanan darah arterial, detak jantung, dan cardiac output. Pasien yang mengalami kegagalan pada miokardium akan berkurang kemampuan kontraksi saat diekspose dengan ketamin, akan terjadi kemunduran tampilan kardiak dan ketidakstabilan kardiovaskular (Bovil 2006). Efek bronkodilatori pada ketamin membuat sediaan ini dapat digunakan untuk menginduksi dan
maintenance anastesi pada pasien dengan penyakit asma dan bronchial akut (Sinner & Graf 2008).
Diazepam dimetabolisme dalam hati dan sisa obat yang tak dapat diubah
akan diekskresikan dalam urin. Dua jalur utama metabolisme diazepam adalah formasi N-desmethyldiazepam dan temazepam yang dikatalisatori oleh CYP
(cytochrome P450) isoform yang berbeda. Metabolit potensial ketiga adalah
4-hydroxydiazepam atau oxazepam dengan kegunaan yang lebih sedikit dibanding
N-desmethyldiazepam dan temazepam(Sinner & Graf 2008).
Diazepam menekan level subkortikal (limbik primer, talamus, dan hipotalamus). Diazepam menghasilkan anxiolytic, sedatif, relaksan otot lurik, dan efek antikovulsan. Mekanisme secara detail belum diketahui, tetapi mekanisme postulat seperti serotonin antagonis, akitifitas peningkatan pelepasan
gamma-aminobutyric acid (GABA), mengurangi pelepasan asetilkolin di Sistem Saraf Pusat (SSP). Reseptor spesifik diazepam pada mamalia berada di otak, ginjal, hati, paru-paru, dan jantung. Pada hampir semua spesies, reseptor terletak lebih sedikit pada bagian white matter (Plumb & Pharm 1999).
Spermatogenesis
pembelahan sel diikuti dengan metamorfosis dari sel yang mempunyai kemampuan diferensiasi yang tinggi dan berpotensiasi motil (spermatozoon). Fase testikular dari spermatogenesis terdiri dari fase diploid atau spermatositogenesis dan fase haploid atau spermiogenesis (Pineda & Faulkner 2003; Manandhar & Sutovsky 2007).
Spermatositogenesis atau tahap ploriferatif adalah tahap dimana primitive
germ cell berlipat ganda dengan pembelahan secara mitosis dan diikuti dengan pembelahan secara meiosis. Sedangkan spermiogenesis adalah tahap diferensiasi dimana nukleus dan sitoplasma mengalami perubahan morfologi menjadi bentuk sel sperma (Pineda & Faulkner 2003).
Spermatositogenesis dimulai dengan berkumpulnya spermatogonia primordial pada tepi membran basal dari epitel germinativum dan diproses menuju lumen. Spermatogonia diaktivasi dalam bentuk aktif spermatogonia tipe A, terdapat beberapa generasi dari spermatogonia tipe A, tergantung dari
spesiesnya. Sebagian besar spermatogonia tipe A dibagi dalam bentuk spermatogonia intermediet (Pineda & Faulkner 2003). Spermatogonia tipe A ini akan membelah empat kali untuk membentuk 16 sel yang lebih sedikit berdiferensiasi, yaitu spermatogonia tipe B. Spermatogonia tipe B akan bermigrasi ke arah sentral di antara sel-sel sertoli. Setiap spermatogonia tipe B di dalam lapisan sel sertoli akan mengalami modifikasi dan melakukan pembelahan mitosis terakhir untuk menjadi spermatosit primer (Guyton & Hall 2005). Spermatositogenesis dibentuk dari pembelahan spermatozoon secara mitosis yang akan berubah menjadi spermatosit sekunder (Pineda & Faulkner 2003).
Morfologi Sel Spermatozoa
Spermatozoa pada hewan mamalia merupakan sel panjang yang motil. Sebuah sel sperma memiliki kepala dan ekor. Kepala terdiri dari sebuah nukleus dengan kepadatan tinggi, kromatin kental yang diselimuti teka perinuklear, sebuah akrosom dan membran plasma. Fungsi utama dari bagian kepala adalah untuk penetrasi pada oosit, membawa genom haploid jantan, dan inisiasi perkembangan embrionik setelah fertilisasi (Manandhar & Sutovsky 2007).
Gambar 7 Morfologi spermatozoa mamalia: A. Primata; B. Rodensia (Manandhar & Sutovsky 2007).
Ekor dapat terbagi menjadi bagian penghubung(connecting piece), bagian tengah(mid-piece), bagian utama(principle piece), dan bagian ujung (end-piece). Bagian penghubung merupakan bagian rangkaian penghubung yang pendek antar kepala dengan ekor yang terdiri dari segmen-segmen, jaringan fibrosa dan kapitulum. Bagian tengah berfungsi sebagai membran pelindung mitokondria yang merupakan pengatur energi untuk motilitas sperma. Bagian ini dimulai dari distal bagian penghubung sampai annulus (struktur yang membatasi bagian tengah dengan bagaian utama). Bagian utama ekor merupakan daerah yang dimulai dari annulus sampai ujung ekor. Secara keseluruhan, ekor berguna untuk
1 2
3
4
5
A B
1. Kepala Ekor:
mendorong spermatozoa bergerak melalui uterus dan tuba falopii hingga bertemu dan berpenetrasi pada oosit. (Manandhar & Sutovsky 2007).
Spermatozoa kucing memiliki panjang kira-kira 26 μm, lebih pendek
dibandingkan dengan spermatozoa anjing yang memiliki panjang sekitar 36 μm.
Persentase spermatozoa yang memiliki morfologi abnormal pada ejakulat ditentukan dengan pemeriksaan 200 spermatozoa menggunakan phase-contrast
microscopy atau mikroskop cahaya setelah dilakukan perwarnaan dengan Diff-Quik* atau perwarnaan eosin-nigrosin (Johnston et al. 2001).
Gambar 8 Morfologi spermatozoa kucing.
Morfologi spermatozoa kucing diperiksa dengan mikroskop cahaya dan mikroskop scanning elektron. Persentase rata-rata spermatozoa yang memiliki morfologi normal di atas 70% pada kucing. Abnormalitas morfologi dari spermatozoa kucing berupa macrocephalus, microcephalus, kepala ganda, ekor ganda, ekor memuntir ke depan, badan (mid-piece) bengkok, adanya droplet sitoplasma pada distal, kepala lepas, dan ekor putus (Johnston et al. 2001).
Bagian tengah Kepala
Bagian ujung
MATERI DAN METODE PENELITIAN
Waktu dan Tempat Penelitian
Pengambilan sampel dan penelitian dilaksanakan di laboratorium Unit Rehabilitasi Reproduksi (URR), Bagian Reproduksi dan Kebidanan, Fakultas Kedokteran Hewan IPB. Waktu pengambilan sampel bulan Juli 2010 sampai bulan Mei 2011.
Materi Penelitian
Hewan percobaan
Semen yang digunakan berasal dari kucing domestik (Felis catus) jantan sebanyak 21 ekor dalam kondisi sehat dan telah dewasa kelamin. Bobot badan kucing domestik berkisar antara 3 sampai 4 kg. Kucing dipelihara dalam kandang
secara individual dan diberi pakan dry cat food (My Dear Cat®) sebanyak 50 g/hari. Pemberian pakan dilakukan dua kali sehari, yaitu pagi dan sore. Kucing diadaptasikan satu minggu sebelum dikoleksi agar terbiasa dengan kandang dan pakan. Pemeriksaan darah untuk setiap kucing dilakukan setelah kucing diadaptasikan, pemeriksaan ini diperlukan untuk mengetahui kesehatan kucing dan kelayakan untuk model pengambilan semen segar.
Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah gel, NaCl fisiologis, aqua destilata, perwarna eosin-nigrosin, formosaline, alkohol 70%, ketamin 10 mg/kg BB, dan diazepam 0.25 mg/kg BB.
Alat Penelitian
cahaya listrik (Olympus CH 20), kamar hitung Neubauer, mikropipet dan tip, tissue, syringe 1 mL, alat hitung, dan heating table.
Metode Penelitian
Kucing yang akan dikoleksi semennya dianastesi terlebih dahulu dengan ketamin HCl 10 mg/kg BB dan diazepam 0.25 mg/kg BB secara intravena pada
vena chepalica antibrachii dorsalis. Setelah kucing dianastesi, daerah di sekitar praeputium dibersihkan menggunakan NaCl fisiologis. Semen kucing koleksi menggunakan elektroejakulator (EE) dengan berbagai tingkat voltase satu minggu sekali dengan mengadopsi teknik koleksi semen yang dilakukan oleh Howard (1990). Probe yang digunakan untuk perangsangan adalah Teflon rectal probe dengan 3 elektroda stainless-steel longitudinal. Probe dimasukkan ke arah ventral rektum ± 5 cm, feses dikosongkan agar tidak menghambat stimulasi elektrik dari EE. Pemberian rangsangan dilakukan secara bertahap, mulai 1 V, 2 V, dan 3 V, pada masing-masing voltase diberikan 10 kali pengulangan dengan waktu rangsangan 5 detik setiap kali pengulangan dan waktu istirahat 5 detik (
on-off).
Respon yang dilihat selama perangsangan adalah kedutan daerah praeputium, konvulsi kaki belakang, tremor, suara erangan, waktu ereksi, dan ejakulasi. Waktu ereksi adalah waktu mulai diberikannya stimulasi sampai
terjadinya ereksi, sedangkan ereksi adalah peningkatan turgiditas (pembesaran) organ (Arifiantini et al. 2005). Waktu ejakulasi adalah lama waktu mulai diberikannya stimulasi sampai terjadinya ejakulasi, sedangkan ejakulasi adalah gerak untuk mengosongkan epididimis, uretra dan kelenjar assesoris pada hewan jantan (Arifiantini et al. 2005). Semen hasil ejakulasi dikoleksi dengan tabung Eppendorf, segera setelah ejakulasi semen kucing dievaluasi secara makroskopis dan mikroskopis.
Evaluasi semen
Evaluasi semen secara makroskopis
Warna. Warna semen dinilai secara visual. Pada kucing semen normal berwarna
putih keruh. Warna kuning menunjukkan kontaminasi dengan urin atau eksudat peradangan, warna hijau mungkin menunjukkan eksudat purulen, warna merah menunjukkan adanya darah, warna coklat menunjukkan adanya darah lama yang biasanya berasal dari kelenjar prostata, dan sampel jernih menunjukkan azoospermia.
Kekentalan/Konsistensi. Konsistensi diamati dengan cara memiringkan tabung
Eppendorf dan dikembalikan ke tempat semula. Kriteria penilaian, encer, sedang sampai kental.
Derajat keasaman (pH). pH ditentukan dengan menggunakan pH special indicator paper. pH normal kucing antara 6.6 sampai 8.8.
Evaluasi semen secara mikroskopis
Gerakan Massa. Gerakan massa dilakukan dengan cara meletakkan 1 tetes
semen segar pada sebuah gelas objek yang dihangatkan, gerakan massa dinilai di bawah mikroskop dengan perbesaran 100 X.
Persentase motilitas spermatozoa. Penilaian persentase motilitas spermatozoa dilakukan secara subjektif kuantitatif, dengan cara meletakkan satu tetes semen pada objek gelas yang hangat, ditambah dengan NaCL fisiologis satu berbanding satu, dihomogenkan dan ditutup dengan cover glass. Persentase motilitas dinilai dengan membandingkan jumlah spermatozoa yang bergerak progresif dengan spermatozoa yang tidak progresif, dibawah mikroskop dengan 400 X pada lima lapang pandang berbeda. Penilaian diberikan dari 0 (mati semua) sampai 100% (motil semua).
Persentase spermatozoa hidup. Satu tetes semen diletakkan pada satu buah
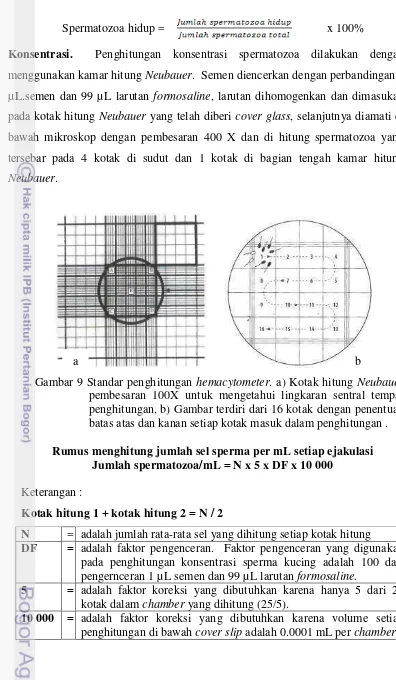
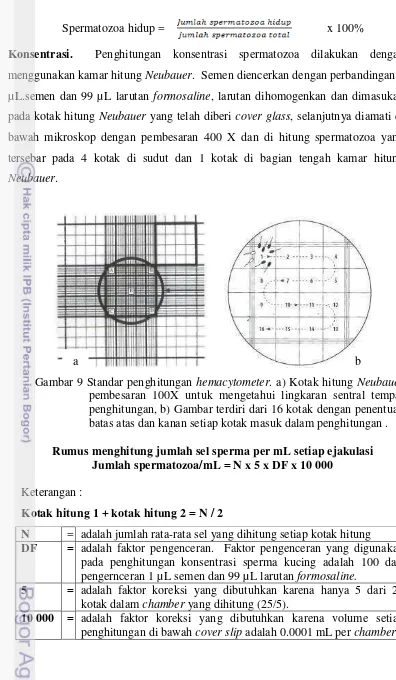
Spermatozoa hidup = x 100%
Konsentrasi. Penghitungan konsentrasi spermatozoa dilakukan dengan
menggunakan kamar hitung Neubauer. Semen diencerkan dengan perbandingan 1 µL.semen dan 99 µL larutan formosaline, larutan dihomogenkan dan dimasukan pada kotak hitung Neubauer yang telah diberi cover glass, selanjutnya diamati di bawah mikroskop dengan pembesaran 400 X dan di hitung spermatozoa yang tersebar pada 4 kotak di sudut dan 1 kotak di bagian tengah kamar hitung
Neubauer.
Gambar 9 Standar penghitungan hemacytometer. a) Kotak hitung Neubauer pembesaran 100X untuk mengetahui lingkaran sentral tempat penghitungan, b) Gambar terdiri dari 16 kotak dengan penentuan batas atas dan kanan setiap kotak masuk dalam penghitungan .
Rumus menghitung jumlah sel sperma per mL setiap ejakulasi Jumlah spermatozoa/mL = N x 5 x DF x 10 000
Keterangan :
Kotak hitung 1 + kotak hitung 2 = N / 2
N = adalah jumlah rata-rata sel yang dihitung setiap kotak hitung
DF = adalah faktor pengenceran. Faktor pengenceran yang digunakan
pada penghitungan konsentrasi sperma kucing adalah 100 dari pengernceran 1 µL semen dan 99 µL larutan formosaline.
5 = adalah faktor koreksi yang dibutuhkan karena hanya 5 dari 25
kotak dalam chamber yang dihitung (25/5).
10 000 = adalah faktor koreksi yang dibutuhkan karena volume setiap
penghitungan di bawah cover slip adalah 0.0001 mL per chamber. b
HASIL DAN PEMBAHASAN
Kualitas semen kucing domestik dipengaruhi oleh berbagai faktor diantaranya genetik, teknik pengambilan semen dan teknik evaluasi semen. Produksi semen pada satu individu jantan dipengaruhi oleh aktifitas reproduksi, yang terjadi secara optimal setelah dewasa kelamin. Kucing domestik yang digunakan dalam penelitian ini tidak diketahui umurnya, sehingga menggunakan
parameter berat badan. Kucing yang dipakai pada penelitian ini memiliki bobot badan rata-rata 3.73 ± 0.33 kg, bobot 3 sampai 4 kg diasumsikan sudah memiliki umur yang cukup (dewasa) untuk dilakukan pengoleksian semen. Ukuran testis berkisar antara 1.19 ± 0.31 cm untuk testis kanan dan 1.12 ± 0.09 cm untuk testis kiri (Tabel 1).
Waktu ereksi pada kucing dicapai dalam waktu 57.14 ± 26.63 detik. Waktu ereksi tercepat terjadi pada detik ke 5 dengan pemberian stimulasi 1 V pertama dan terlama pada pemberian stimulasi 3 V kedua detik ke 110. Variasi waktu terjadinya ereksi pada kucing dapat terjadi karena faktor sensitifitas syaraf kucing terhadap rangsangan EE. Menurut Arifiantini et al. (2005) semakin tinggi tegangan yang diberikan, maka stimulasi terhadap syaraf parasimpatis dari
medulla spinalis sacrum ke bagian genitalia eksternal semakin tinggi untuk merangsang terjadinya ereksi. Ereksi distimulasi oleh refleks yang timbul dari suatu input (sensor taktil non-genital, bau yang khas, penglihatan dan pendengaran) serta refleks spinal berupa stimulasi genital yang ditimbulkan menuju kortek serebral (Martin 1978).
Ejakulasi pada kucing rata-rata terjadi pada detik ke 94.00 ± 27.85, ejakulasi tercepat terjadi pada stimulasi 2 V pertama pada detik ke 55 sedangkan
Tabel 1 Bobot badan, diameter testis, waktu ereksi dan ejakulasi pada kucing
Waktu ereksi (detik) 57.14 ± 26.63
Waktu ejakulasi (detik) 94.00 ± 27.85
Penggunaan EE pada saat koleksi semen menimbulkan perubahan gejala klinis pada kucing yang diberi perlakuan. Gejala klinis yang muncul berbeda-beda bergantung pada tingkat rangsangan yang diberikan. Pada saat penetrasi
probe ke dalam rektum, kucing yang telah dianastesi tidak memperlihatkan adanya reaksi dan tidak ada kesadaran terhadap pengaruh lingkungan. Pemberian obat bius kombinasi ketamin HCl 10 mg/kg BB dan diazepam 0.25 mg/kg BB secara iv membantu menenangkan kucing tersebut.
Pada stimulasi 1 V pertama, otot abdomen mulai berkontraksi, abdomen menegang dan nafas tertahan saat arus listrik menginduksi kontraksi pada kucing. Kucing akan melakukan inspirasi ketika terjadi kontraksi. Kaki mulai bergetar dan kejang serta praeputium berkedut-kedut. Kontraksi abdomen semakin kuat pada pemberian stimulasi 2 V. Peningkatan stimulasi ini membuat kontraksi pada kaki belakang dan daerah praeputium semakin kuat sehingga terjadi ereksi. Kucing mulai mengerang pada pemberian stimulasi 2 V. Bunyi erangan ini merupakan indikator adanya kesakitan pada kucing tersebut meskipun pembiusan
telah dilakukan. Seperti dinyatakan oleh Palmer (2005) stimulasi EE merangsang peningkatan serum progesteron, yang akan menginduksi sapi untuk mengeluarkan
suara sebagai indikator adanya kesakitan. Pada pemberian stimulasi 3 V, kucing mengerang semakin kuat, kontraksi otot kaki belakang semakin kuat dan terjadi
cloning kemudian ejakulasi.
Rangsangan ejakulasi terjadi akibat stimulasi pada nervous hypogastric, menyebabkan kontraksi otot halus pada epididimisdanduktus deferensyang akan mendorong spermatozoa dan cairan plasma menuju ampula (Martin 1978).
pada pelvis. Pendapat ini sesuai dengan Watson (1978), yang menyatakan bahwa pengeluaran spermatozoa dan cairan seminal dari ampula dan kelenjar asesoris ke dalam uretra merupakan suatu aksi dari sistem syaraf simpatis.
Hubungan antara reaksi ereksi dan ejakulasi pada kambing dengan penggunaan EE dapat terjadi sebagai berikut, yaitu terjadi reaksi ereksi lebih dahulu baru disusul ejakulasi, ataupun terjadi ejakulasi baru disusul dengan reaksi ereksi serta terjadi ejakulasi tanpa disertai reaksi ereksi (Arifiantini et al. 2005). Tetapi pada kucing reaksi yang terjadi selalu berurutan, yakni reaksi ereksi yang kemudian diikuti oleh ejakulasi, setelah stimulasi voltase ditingkatkan (Tabel 2).
Tabel 2 Gejala-gejala klinis akibat penggunaan elektroejakulator pada kucing domestik jantan yang dianastesi
Prosedur anastesi pada koleksi semen kucing menggunakan EE diperlukan untuk mempermudah penanganan dan mengurangi tingkat stres hewan kucing selama proses pengambilan semen. Pada penelitian ini anastesi dilakukan dengan kombinasi ketamin HCl dan diazepam. Souza et al. (2009) menggunakan kombinasi tiletamin dan zolazepam yang mirip cara kerjanya dengan ketamin dan diazepam sebagai protokol anastesi selama dilakukan perangsangan dengan EE. Zolazepam bekerja pada GABA mendorong terjadinya relaksasi otot dan mengurangi kejang. Tiletamin bekerja dengan menekan kerja Sistem Syaraf Pusat (SSP). Tiletamin bekerja mengikat reseptor N-metil-D-aspartat (NMDA) dan non-NMDA glutamat yang bersifat eksitatori (menghasilkan eksitasi) dengan menurunkan efek eksitatori, mengurangi iritasi jaringan dan tetap menjaga refleks okular selama anastesi. Denyut jantung, laju pernapasan, dan tekanan darah lebih
Voltase
(V) Keterangan
0 Kesadaran tidak ada
1 Otot abdomen berkontraksi dan praeputium berkedut-kedut. Saat arus listrik diberikan, kucing melakukan inspirasi dan nafas tertahan, kemudian kembali normal saat arus listrik dihentikan. Kaki bergetar dan kejang. 2 Kontraksi abdomen makin kuat, terdengar bunyi erangan, kaki belakang
dan praeputium mulai kontraksi, kemudian terjadi ereksi.
3 Erangan semakin keras, kontraksi kaki belakang semakin kuat dan terjadi
cloning, kemudian ejakulasi.
tinggi pada kucing yang dianastesi menggunakan kombinasi ketamin-diazepam (Ozkan et al. 2010).
Pada penelitian ini digunakan kombinasi ketamin dan diazepam karena mempunyai waktu anastesi yang pendek ± 30 menit. Kombinasi ketamin diazepam lebih mampu merangsang terjadinya ereksi dan ejakulasi dibanding ketamin-xilazine.
Karakteristik Semen Kucing Hasil Elektroejakulator
Karakteristik semen berbeda-beda, bergantung pada jenis hewan dan teknik koleksi yang dilakukan. Pada kucing karakteristik semennya sangat bervariasi antar individu ataupun antar waktu koleksi semen dilakukan.
Volume semen
Kucing merupakan hewan dengan volume semen yang sedikit dan sulit untuk dikoleksi (Zambelli et al. 2010). Volume semen kucing hasil penelitian ini adalah 47.37 ± 18.44 µL, sangat beragam dengan kisaran 20 sampai dengan 100
µL. Nilai ini sangat kecil jika dibandingkan dengan volume semen ternak dengan ukuran tubuh dan berat yang hampir sama, seperti pada semen ayam mencapai 600 µL (Johari et al. 2009) dan kelinci 600.00 ± 0.08 µL (Mourvaki et al. 2010).
Volume semen kucing menggunakan teknik koleksi yang sama rata-rata adalah 186.75 ± 38.62 µL (Baran et al. 2004); 50-300 µL (Malandain 2005); 75-220 µL (Thuwanut 2010); dan 89.00 ± 54.00 µL (Zambelli et al. 2010). Volume semen yang didapatkan pada penelitian ini lebih sedikit daripada volume semen yang dilaporkan oleh beberapa peneliti tersebut namun masih dalam kisaran normal menurut Axnér dan Linde-Forsberg (2002) yang melaporkan bahwa volume semen kucing dengan elektroejakulator berkisar antara 19-740 µL.
Derajat keasaman (pH) semen
Semen kucing hasil penelitian ini menunjukkan pH 7.00 ± 0.65, nilai pH ini termasuk normal menurut Axnér dan Linde-Forsberg (2002) dan Thuwanut (2010), yang melaporkan pH semen kucing berkisar antara 6.60 sampai dengan 8.80.
Warna dan Konsistensi Semen
Semen kucing hasil penelitian ini umumnya berwarna putih keruh. Warna semen ini berasal dari cairan seminal plasma yang dikeluarkan oleh kelenjar asesoris, warna semen juga dipengaruhi oleh konsentrasi spermatozoa yang terkandung didalamnya. Semakin tinggi konsentrasi spermatozoa, warna semen akan semakin keputih-putihan (whitish) (Axner & Linde-Forsberg 2002).
Warna semen yang jernih menunjukkan azoospermia (tidak terdapat spermatozoa dalam ejakulatnya), sedangkan warna semen yang kuning menunjukkan kontaminasi dengan urin. Kucing mempunyai konsistensi lebih
encer jika dibandingkan dengan semen domba dan sapi. Konsistensi semen kucing yang encer juga berhubungan dengan konsentrasi spermatozoa yang terkandung dalam semen tersebut.
Gerakan massa
Gerakan massa adalah gerakan bersama dari sekelompok spermatozoa sehingga membentuk seperti awan. Karakteristik semen kucing yang encer dengan konsentrasi yang rendah menyebabkan gerakan masa dari spermatozoanya tidak bisa dinilai. Gelombang awan dari massa spermatozoa terlihat jarang, dan sel spermatozoa terlihat secara individu.
Motilitas spermatozoa
melaporkan motilitas spermatozoa kucing dapat mencapai 78%. Menurut Axnér dan Linde-Forsberg (2002), motilitas spermatozoa pada semen kucing sangat bervariasi antar individu ataupun antar waktu koleksi dalam individu yang sama, dengan kisaran motilitas antara 56 sampai dengan 85%. Sementara itu Johnston
et al. (2001) menyampaikan bahwa motilitas spermatozoa kucing yang normal berkisar antara 60 sampai 90%.
Rasio Spermatozoa Hidup dan Mati
Pada penelitian ini jumlah spermatozoa hidup (viable) cukup tinggi dengan rata-rata adalah 86.84 ± 6.93% dengan kisaran 76.00 sampai dengan 93.60%. Pengujian ratio spermatozoa yang hidup dan mati jarang dilaporkan pada semen kucing, hal ini kemungkinan karena jumlah volume semen yang sedikit, sehingga parameter pengujiannya dikurangi. Viabilitas spermatozoa kucing hanya dilaporkan oleh Siemieniuch dan Dubiel (2007). Pada penelitiannya digunakan dua jenis pewarnaan eosin-nigrosin dan pewarnaan fluoresen
(SYBR-14/PI) , dan hasilnya ternyata hampir sama yaitu 84.90 ± 7.80% dengan pewarnaan eosin-nigrosin dan 82.20 ± 8.00% dengan pewarnaan fluoresen.
Konsentrasi
Konsentrasi spermatozoa kucing hasil penelitian ini adalah 387.40 ± 457.93 x 106 per mL, dengan kisaran 90 x 106 sampai dengan 1633.75 x 106 per mL. Nilai standar deviasi yang sangat besar disebabkan oleh tingginya variasi antar individu kucing yang digunakan. Koleksi semen dengan menggunakan elektroejakulator akan menghasilkan volume dan konsentrasi yang bervariasi (Hafez & Hafez 2000).
konsentrasi spermatozoa sebesar 1730 x 106 per mL dengan kisaran antara 96 x 106 sampai 5101 x 106 per mL. Kisaran tertinggi pada hasil penelitian lebih tinggi nilainya dibandingkan dengan rata-rata konsentrasi spermatozoa yang pernah dilaporkan. Hal ini dapat terjadi karena pengaruh faktor genetik kucing percobaan yang digunakan.
Morfologi Spermatozoa Normal
Morfologi spermatozoa terbagi atas morfologi spermatozoa normal dan abnormal. Pada penelitian ini morfologi spermatozoa yang normal adalah 87.00 ± 4.71%. Nilai ini termasuk normal karena menurut Zambelli dan Cunto (2006) spermatozoa kucing yang baik harus memiliki normalitas di atas 70%. Hasil penelitian ini sedikit lebih tinggi dibandingkan dengan laporan Baran et al. (2004) dan Baran et.al (2009) yaitu 82.70 ± 4.95 %. Normalitas spermatozoa kucing domestik di Swedia berkisar antara 38.20 sampai dengan lebih dari 90% (Axnér & Linde-Forsberg 2002) bergantung pada teknik koleksi semen yang digunakan.
Tabel 3 Karakteristik semen kucing domestik (Felis catus)
Parameter Rata-rata Rentan hasil
Tertinggi Terendah
Konsentrasi spermatozoa (106/mL) 387.40 ± 457.93 90 1633.75
Morfologi spermatozoa normal (%) 87.00 ± 4.71 79 95.5
* Warna semen : + putih, ++ putih agak keruh, +++putih keruh
yang lebih sedikit dibandingkan peneliti lainnya. Johnston et al. (2001) menggunakan aplikasi tegangan maksimum sebesar 2-3 V sedangkan Zambelli dan Cunto (2006) menggunakan tegangan 4-8 V menghasilkan jumlah spermatozoa yang lebih tinggi konsentrasinya dibandingkan dengan tegangan 1-2 V.
KESIMPULAN
Dari hasil penelitian ini dapat disimpulkan bahwa :
1. Stimulasi elektroejakulator dengan voltase bertingkat (1 V, 2 V, 3 V) pada 21 ekor kucing jantan 100% berhasil dikoleksi semennya.
2. Ereksi terjadi 47.62% pada stimulasi 2 V pertama dan kedua.
3. Ejakulasi pada kucing terjadi beragam mulai dari stimulasi 3 V pertama sampai dengan keenam.
DAFTAR
PUSTAKA
Arifiantini RI, Yusuf TL, Riyadhi M. 2005. Stimulasi bailey elektrojakulator pada voltase yang berbeda terhadap volume semen dan konsentrasi spermatozoa domba lokal. JPengemb Pet Trop 30: 135-141.
Axnér E, Linde-Forsberg C. 2002. Semen collection and assessment, and artificial insemination. Recent Advances in Small Animal Reproduction. Di dalam: Concannon PW, England G, Verstegen J, Linde-Forsberg C, editor. Recent Advances in Small Animal Reproduction. USA: Int Vet Inform Service. Baran A, Bacinoúlu SL, Evecen M, Þahün K, Alkan S, Demür K, Kemal AK,
Ülerü ÜK. 2004. Freezing of cat semen in straws with different glycerol levels containing tris extender. Turk J Anim Sci 28: 545-552.
Baran A. Demir K, Sahin BE, Evecen M, Bacinoglu S, Alkan S, Ileri IK. 2009. Short-therm storage of cat semen extended with and without taurine containing milk extender. J Anim Vet Adv 8: 1367-1371.
Bovil JG. 2006. Intravenous anesthesia for the patient with left ventricular dysfunction. Semin Cardiothorac Vasc Anesth. Sage Publication 10: 43. Constantinescu GM. 2007. Anatomy of reproductive organs. Di dalam: Schatten
H, Constantinescu GM, editor. Comparative Reproductive Biology. Lowa: Blackwell Publishing. Hlm: 5-23.
Edwars A. 2005. The Ultimate Encyclopedia of Cats. Cat Breeds & Cat Care. China: Anness Publishing.
Guyton AC, Hall JE. 2005. Buku Ajar Fisiologi Kedokteran. Ed ke-11. Di dalam: Setiawan I, Tengadi LMAKA, Santoso A, penerjemah; Setiawan I, editor. Philadelphia: W.B Saunders Company. Terjemahan: dari Textbook of Medical Physiology. Hlm: 1265-1277
Hafez ESE, Hafez B. 2000. Reproduction in Farm Animals. Ed ke-7. Philadelphia: Lippincott Williams & Wilkins.
Hermansson U. 2006. Studies of canine and feline sperm viability under different storage procedures, with special reference to chilling, freezing, and use of zona pellucida binding assays Uppsala: Tryck, SLU Service/Repro.
Howard JG, Brown JL, Bush M, Wildt D. 1990. Teratospermic and normospermic domestic cats: Ejaculate traits, pituitary-gonadal hormones, and improvement of motility and morphology after swim-up processing. J Androl 11: 204-215.
Johari S, Ondho YS, Wuwuh S, Henry YB, Ratnaningrum. 2009. Karakteristik dan kualitas semen berbagai galur ayam kedu. Sem Nas Kebangkitan Pet. Johnston SD, Kustritz MVR, Olson PNS. 2001. Canine and Feline
Theriogenology. Philadelphia: Saunders.
LaBruna D. 2001. Introduce spesies summary project domestic cat (Felis catus). [terhubung berkala]. http : // www.columbia.edu/ itc/ cerc/ danoffburg/ invasion_bio/ inv_spp_summ/ Felis_catus. html. [7 Juli 2011].
Lipinski, MJ, Froenicke L, Baysac KC, Billings NC, Leutenegger CM, Levy AM, Longeri M, Niini T, Ozpinar H, Slater MR, Pedersen NC, Lyons LA. 2007. The ascent of cat breeds: genetic evaluations of breeds and worldwide random bred populations. Genomics 91(1): 12–21.
Malandain E. 2005. Artificial insemination in cat. In: Reproduction in Companion, Exotic and Laboratory Animal. Proceeding; Nantes, 12-17 September 2005. Nantes: Royal Canin, Aimargues, France. Hlm 251-256. Manandhar G, Stutovsky P. 2006. Mammalian spermatogenesis and sperm
structure: anatomical and compartmental analysis. Di dalam: Jonge C de, Barrat C, editor. The Sperm Cell Production, Maturation, Fertilization, Regeneration. Cambridge: Cambridge University Press hlm: 1-30.
Manandhar G, Sutovsky P. 2007. Comparative histology and subcellular structure of mammalian spermatogenesis and spermatozoa. Di dalam: Schatten H, Constantinescu GM, editor. Comparative Reproductive Biology. Lowa: Blackwell Publishing. Hlm 81-98.
Martin ICA. 1978. The Principles and Practice of Electroejaculation of Mammals. Artificial Breeding of Non-Domestic Animal. London: Academic Press Inc. Mourvaki E, Cardinali R, Dal Bosco A, Castellini C. 2010. In vitro antioxidant activity of the prostatic secretory granules in rabbit semen after exposureto organic peroxides. Repro Biol and Endocrinol hlm: 8:16.
Ozkan F, Cakır-Ozkan N, Eyibilen A, Yener T, Erkorkmaz U. 2010. Comparison of ketamine-diazepam with ketamine xylazine anesthetic combinations in sheep spontaneously breathing and undergoing maxillofacial surgery. Bosnia J Bas Med Sci 10: 297-302.
Palmer CW. 2005. Welfare aspects of theriogenology: Investigating alternatives to electroejaculation of bulls. Theriogenology 64: 469–479.
Pineda MH, Faulkner LC. 2003. The biology of sex. Di dalam McDonald LE, editor. Veterinary Endocrinology And Reproduction. London: Lea & Febiger, hlm: 208-234.
Plumb DC, Pharm D. 1999. Veterinary Drug Book. Ed ke-3. Minnesota: PharmaVet Publishing.
Rosenfeld CS. 2001. Overview of male reproductive organs. Schatten H, Constantinescu GM, editor. Comparative Reproductive Biology. Lowa: Blackwell Publishing. 69-80
Sinner B, Graf BM. 2008. Ketamin. Schuttler J, Schwilden H, editor. Modern
Anesthetics. handbook of experimental pharmacology. Springer-Verlag
Berlin Heidelberg : 313-329
Souza ALP et al. 2009. Evaluation of anesthetic protocol for the collection of semen from captive collared peccaries (Tayassu tajacu) by electroejaculation. Anim Repro Sci 116: 370–375.
Tittarelli et al. 2006. Effect of storage media and storage time on survival of spermatozoa recovered from canine and feline epididymides. Theriogenology 66: 1637–1640.
Thuwanut P. 2010. Role of oxidative stress and antioxidants in domestic and non- domestic cat spermatozoa with special reference to cryopreservation. [Thesis]. Uppsala: Faculty of Veterinary Medicine and Animal Science Department of Clinical Sciences Swedish University of Agricultural Sciences.
Thuwanut P, Chatdarong K, Techakumphu M, Axne´r E. 2008. The effect of antioxidants on motility, viability, acrosome integrity and DNA integrity of frozen-thawed epididymal cat spermatozoa. Theriogenology 70: 233– 240.
UNEP-WCMC. 2011. UNEP-WCMC species database. [terhubung berkala] http://www.unep-wcmc-apps.org/isdb/CITES/Taxonomy/tax-family-result.cfm/isdb. [28 Juli 2011]
Wastlhuber J. 1991. History of domestic cats and cat breeds in feline husbandry: diseases and management in the multiple cat environment. American Veterinary Publications Inc, pp. 1–59.
Watson PF. 1978. Artificial Breeding of Non-Domestic Animal. London: Academic Press Inc. Hlm: 101-102.
Zambelli D, Cunto M. 2006. Semen collection in cats: Techniques and analysis. Vet Clinic Dept, Obst-Gynec Sect, Univ of Bologna, Theriogenology 66:159–165.
Semen Characteristic of Domestic Cat (Felis catus). Under direction of R. IIS ARIFIANTINI and Rr SOESATYORATIH.
This study aims to determined the characteristics of domestic cats (Felis catus) semen collected by electroejaculator. Semen was collected from 21 sexually mature tomcats. Stimulation of electroejaculator were 1 V, 2 V and 3 V with 10 repetition at each voltage with a time of stimulation 5 seconds and rest 5 seconds (on-off). During stimulation reaction of the cats were recorded. Ejaculate semen was evaluated macroscopically and microscopically. The results showed at any level of stimulation lead to different clinical symptoms. At 0 V stimulation the cat was unconsciousness; at 1 V stimulation the abdominal muscles was contracted, muscles around praeputium was twitched, legs trembled and convulsions, cats did inspiration and gasped when the stimulation was on, then returned to normal when stimulation stopped; at 2 V stimulation abdominal contractions got stronger, the cats were vocalize, the hind legs and praeputium were contraction, and the penis was erected; at 3 V stimulation the vocalize was louder, contraction of the hind legs was getting stronger, cloning occurred and then ejaculation; at 0 V cat was breathe more deeply and returned to normal. Cats were erectioned at 57.14 ± 26.63 seconds and ejaculation was occured at 94 ± 27.85 second. Macroscopic evaluation demonstrated that semen volume was 48.09 ± 17.71 mL, whitish in color, pH 7 ± 0.65, and the semen consistency was aqueous. Microscopic evaluation demonstrated no visible of mass movements due the slightly of sperm concentration. Semen motility was 68 ± 9:09% with the individual scoring of 4:39 ± 0.61. Viable spermatozoa was 86.84 ± 6.93% with a spermatozoa concentration was 387.4 x 106 ± 457.93 x 106/ml and sperm normality 87 ± 4.71%
PENDAHULUAN
Latar Belakang
Peningkatan minat terhadap hewan kesayangan terutama kucing menimbulkan adanya keinginan untuk menjaga atau meningkatkan kualitas keturunan. Hal ini menjadi salah satu alasan dilakukannya Inseminasi Buatan (IB) pada kucing, terutama kucing ras. Semen kucing dapat dikoleksi menggunakan vagina buatan, elektroejakulator (EE) pada kucing jantan yang dianastesi, pembilasan vagina setelah kawin (postcoitum recovery) dan dengan koleksi dari urin secara cystocentesis (penghisapan pada vesica urinaria) kucing jantan setelah ejakulasi (Johnston et al. 2001) serta dari cauda epididymis (Tittarelli et al. 2006; Zambeli & Cunto 2006). Penggunaan EE terutama ditujukan untuk koleksi semen pada hewan liar seperti harimau, rusa ataupun pada
monyet. Model EE yang digunakan pada hewan bervariasi baik ukuran panjang dan diameter tongkat perangsang (probe) maupun tingkat rangsangan yang diberikan. Rangsangan umumnya diberikan secara bertingkat dari voltase (V) rendah perlahan-lahan dinaikkan secara gradual dengan intensitas rangsangan dan istirahat yang sama (Arifiantini et al. 2005).
Upaya perlindungan terhadap jenis kucing liar yang hampir punah menjadikan IB sebagai hal yang patut diperhitungkan. Inseminasi buatan merupakan serangkaian kegiatan mulai dari koleksi, evaluasi, pengolahan semen sampai dengan deposisi semen di alat reproduksi kucing betina yang sedang estrus. Untuk mendapatkan kualitas keturunan yang baik maka kualitas semen yang akan digunakan untuk IB juga harus baik.
Keberhasilan IB ditentukan oleh berbagai faktor diantaranya kualitas semen segar yang di preservasi. Kualitas semen segar dapat di evaluasi secara makroskopis dan mikroskopis. Secara makroskopis kualitas semen yang dapat di uji adalah volume (banyaknya semen yang diejakulasikan), warna semen, kekentalan, dan derajat keasaman. Warna semen normal adalah putih keruh sampai krem. Pemeriksaan kualitas semen segarsecara mikroskopis adalahuntuk menghitung konsentrasi, motilitas, morfologi spermatozoa normal, persentase
Mengingat pentingnya dilakukan pengujian kualitas semen segar sebelum proses preservasi, penelitian ini dilakukan untuk menguji kualitas semen dari ejakulat menggunakan elektroejakulator pada kucing jantan domestik.
Tujuan
Penelitian ini bertujuan untuk:
(1) Mempelajari reaksi kucing domestik jantan terhadap stimulasi elektrik menggunakan elektroejakulator.
TINJAUAN PUSTAKA
Felis catus
Kucing domestik (Felis catus) menempati sebagian besar penjuru dunia. Bukti arkeologi menunjukkan domestikasi kucing terjadi di Near East sekitar 9000 – 10 000 tahun yang lalu. Namun, inisiasi domestikasi mungkin dimulai ribuan tahun yang lalu di mana manusia dan nenek moyang kucing menjadi semakin saling ketergantungan. Proses domestikasi mungkin dimulai selama periode ketika manusia berhenti berburu kawanan hewan liar dan mengadopsi lebih banyak gaya hidup pertanian, terutama di Fertile Crescent. Perubahan ini terjadi 10 000 – 11 000 tahun yang lalu dan dimungkinkan oleh domestikasi serealia liar tertentu dan rumput-rumputan. Hubungan manusia dan kucing bermanfaat untuk mengontrol tikus yang merusak tanaman, yang juga telah
bergabung dengan peradaban manusia. Menurut Wastlhuber (1991) kucing domestik yang ada sekarang ini merupakan evolusi dari kucing liar Afrika (F.
silvestris lybica) di zaman Mesir kuno sekitar 3000 – 4000 tahun lampau. Meskipun banyak kucing yang menjadi hewan peliharaan, kucing modern tidak didomestikasi secara penuh dalam pengertian klasik. Kucing modern tetap mandiri jika diperlukan, dengan mempertahankan kemampuan berburu yang tajam bahkan ketika makanan tersedia, dan menunjukkan spektrum perilaku mulai dari hewan peliharaan yang tidak dapat dijinakkan hingga hewan peliharaan yang sangat lembut.
penyakit zoonosis terkait (Lipinski et al. 2007). Adapun klasifikasi F. catus menurut LaBruna (2001) adalah sebagai berikut:
kingdom : Animalia filum : Chordata kelas : Mammalia ordo : Carnivora famili : Felidae genus : Felis spesies : Felis catus
Famili kucing (felidae) terdiri dari 76 spesies. Menurut laporan
Convention of International Trade of Endangered Species (CITES 2011). Kucing domestik adalah salah satu felidae yang tidak termasuk dalam spesies hewan liar (Hermansson 2006).
Gambar 1 Kucing domestik.
Anatomi organ reproduksi kucing jantan
Seperti karnivora pada umumnya, alat kelamin jantan pada kucing terbagi dalam empat subbagian. Subbagian pertama meliputi testis, epididimis, duktus deferens, korda spermatikus, dan tunika. Subbagian kedua terdiri dari kelenjar-kelenjar asesoris, subbagian ketiga penis, dan yang terakhir uretra (Junaedi 2006; Constantinescu 2007). Diagram anatomi dari skrotum, testis dan epididimis, prostata, penis dan preputium dapat dilihat pada gambar 2.
Gambar 2 Skema anatomi organ reproduksi jantan (Constantinescu 2007).
Pada perkembangannya, testis kucing turun dan menempati skrotum dalam
A B
Gambar 3 Testis kucing: A. testikel kucing sudut pandang lateral; B. testikel kucing sudut pandang medial (Constantinescu 2007).
Epididimis melekat pada perbatasan dorsolateral dari testis. Kaput epididimis di mulai dari medial permukaan testis, namun saat mencapai posisi dorsolateral dilanjutkan menjadi korpus dan kauda. Kaput epididimis sedikit melebihi kepala testis. Tunika albuginea epididimis lebih tipis dibandingkan dengan albuginea testis. Panjang duktus epididimis 1.5 sampai 3 mm dan berliku-liku. Kauda epididimis melekat pada ekor testis dengan ligamentum pendek dari testis dan untuk fascia spermatic internal secara langsung (karena fascia
spermatic internal melekat pada kauda epididimis). Ligamen skrotum bergabung dengan fascia spermatic internal menuju dartos. Duktus deferens dimulai sebagai
plexus sepanjang perbatasan epididimis dari testis dan medial ke epididimis dengan arah kaudokranial karena posisi testis. Setelah melewati duktus deferens, kaput epididimis masuk ke dalam korda spermatikus dan berlanjut hingga cincin vaginal. Dalam rongga perut, duktus deferens membuat kurva dalam arah dorsokaudal untuk memasuki rongga panggul dan mencapai uretra. Dalam rute dari awal sampai akhir, mesoduktus deferens yang juga merupakan bagian dari funikulus spermatikus, melekat ke duktus deferens. Sebelum mencapai uretra, duktus deferens melintasi ureter di bagian ventral, kemudian melintasi bagian dorsal dari ligamen lateral kandung kemih. Untuk mencapai uretra, duktus deferens menembus kelenjar prostat dan membuka sisi lateral dari colliculus
seminalis (Constantinescu 2007).
diameter lebih dari 5 mm) dan melekat pada dinding uretra bagian dorsolateral yaitu pada arcus ischiadicus seperti terlihat pada gambar 4 (Constantinescu 2007).
Gambar 4 Kelenjar prostata kucing sudut pandang dorsal (Constantinescu 2007).
Penis pada kucing (gambar 5) berada di ventral skrotum. Penis disusun oleh dua buah corpora cavernosa, satu pada tiap sisi dan sebuah korpus spongiosum yang berada di tengah. Pejantan dewasa memiliki glans penis pada bagian ujung penis dengan panjang 5 sampai 10 mm, berbentuk kerucut yang mengarah ke caudal dan memiliki 120 sampai 150 buah duri penis (penile spines) tergantung kadar androgen setiap individu. Duri-duri penis dengan panjang dan diameter dasarnya sebesar 0.1 sampai 0.7 mm ini berjejer membentuk 6 hingga 8 buah lingkaran (Johnston et al. 2001).
Gambar 5 Penis kucing (Constantinescu 2007).
Korpus kavernosum penis Duktus deferens Kandung kemih
Kelenjar prostata
Kelenjar bulbourethralis
Glans penis
Ureter
Uretra
Duri penis
Secara histologi, duri penis disusun oleh jaringan ikat inti diselimuti epitel tanduk yang mirip dengan papilla pada lidah kucing. Peran duri pada proses kopulasi belum diketahui secara pasti namun diperkirakan duri ini berfungsi memberikan stimulasi seksual pada betina, menghalangi penarikan penis dari vagina (oleh karena itu lokasinya adalah di ujung penis), atau meningkatkan stimulasi betina untuk induksi ovulasi. Os penis pada kucing berukuran panjang 3 sampai 5 mm dan berada di ujung glans penis pada kucing jantan dewasa. Kucing tidak memiliki muskulus cremaster tetapi memiliki musculus levator scrota yang berasal dari musculus sphincter anal externus dan masuk ke dalam septum scrotal (Johnston et al. 2001).
Endokrinologi Reproduksi Kucing Jantan
Fisiologi reproduksi hewan jantan dikontrol secara endokrin oleh sekresi
Hypothalamic Gonadotropin Releasing Hormone (GnRH) pada tingkat paracrine di hipotalamus. GnRH merangsang kelenjar hipofise anterior untuk mengekskresikan dua hormon gonadotropin, yaitu Luteinizing Hormone (LH) dan
Follicle Stimulating Hormone (FSH). Hipofise anterior bertanggung jawab untuk berbagai hormon yang mengontrol banyak aspek dari aktivitas fisiologis. LH merupakan perangsang utama testosteron di dalam testis. Testosteron disekresikan oleh sel-sel leydig yang dirangsang oleh LH di dalam testis. Jumlah testosteron yang diekskresikan akan berbanding lurus dengan jumlah LH yang tersedia. Sedangkan FSH merupakan perangsang utama terjadinya spermatogenesis. FSH akan berikatan dengan reseptor-reseptor FSH spesifik yang melekat pada sel-sel sertoli dalam tubulus seminiferus. Pengikatan ini mengakibatkan sel-sel tumbuh dan mengekresikan berbagai unsur spermatogenik.