STUDY OF ANTIOXIDANT AND ANTIMICROBIAL ACTIVITY OF LEAF AND TWIG EXTRACTS OF JARAK PAGAR (Jatropha Curca L) AND ITS UTILIZATION IN PERSONAL
HYGIENE PRODUCT
KAJIAN AKTIVITAS ANTIOKSIDAN DAN ANTIMIKROBA FRAKSI EKSTRAK DAUN DAN RANTING JARAK PAGAR (Jatropha Curcas L.) SERTA PEMANFAATANNYA PADA
PRODUK PERSONAL HYGIENE
Dayu Dian Perwatasari1)*, Chilwan Pandji1), Dwi Setyaningsih1,2) 1)Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor
Kampus IPB Darmaga, PO BOX 220 Jawa Barat, Indonesia e-mail: dayu.dian.p@gmail.com
2)
Pusat Penelitian Surfaktan dan Bioenergi, LPPM-Institut Pertanian Bogor. Kampus IPB Baranangsiang, Jl. Raya Pajajaran No. 1, Bogor.
ABSTRACT
The development of jarak pagar (Jatropha curcas L) in Indonesia need to be followed by the optimum utilization of all parts of the plants, including the leaves and twigs. Assessment of antioxidant and antimicrobial activity of leaves and twigs extract/extract fraction of Jatropha curcas L and their use in personal hygiene products, is an effort to increase added value of Jatropha curcas’s leaves. Extract of Jatropha curcas in this study were obtained trough a solvent extraction process using ethanol 96% by the method of soxhlet and maceration. Extract fraction obtained by performing advanced stages in the extract called fractination. Antioxidant activity was analized by using DPPH method at concentration of 4, 6, 8, 10, 12, and 20 ppm. While the analysis of antimicrobial activity performes by well diffusion method against Candida albicans, Microsporum gypseum, and Pseudomonas aeruginosa at the concentration of extract/extract fraction 1, 2, and 3%. The result showed that crude extract of maceration and ethyl acetate fraction of soxhlet have the highest antioxidant activity with IC50 values of 7.2 and 7.8 ppm where this values were not significantly different. In other side, the result of antimicrobial activity indicated the present of antimicrobial inhibitory of maceration crude extract against Microsporum gypseum. It proved by the formation of clear zones of inhibition around the wells with diameter of 12, 14, and 20 mm for concentration 1, 2, and 3%. The ethyl acetate fraction showed the inhibitory against Microsporum gypseum only at concentration of 3% extract with diameter of inhibitory zones 14 mm. The extract/extract fraction showed no inhibitory activity against other microbes. Utilization of selected extract fraction applied to one of personal hygiene product, transparent soap, by utilizing its antioxidant activity. Soap with the addition of ethyl acetate fraction of Jatropha curcas at a concentration level of 1.0% produces soap with antioxidant activity of 37.25% and the rate of foam stability about 83.23%.
Keywords: Jatropha curcas L, antioxidant, antimicrobial
I.
PENDAHULUAN
A.
LATAR BELAKANG
Pengembangan jarak pagar sebagai salah satu tanaman penghasil Bahan Bakar Nabati (BBN) di Indonesia cukup pesat. Terlebih setelah dikeluarkannya Peraturan Presiden RI No. 5 Tahun 2006 tentang kebijakan energi nasional dan Instruksi Presiden No. 1 Tahun 2006 tentang penyediaan dan pemanfaatan BBN. Keunggulan yang dimiliki oleh tanaman jarak pagar menyebabkan pesatnya perkembangan jarak pagar sebagai bahan baku BBN. Keunggulan tersebut antara lain merupakan tanaman tropis yang mudah dibudidayakan dan mampu beradaptasi dengan lahan kering, mempunyai kandungan minyak yang tinggi, serta tidak termasuk dalam tanaman pangan sehingga pemanfaatannya sebagai bahan baku energi diharapkan tidak mengganggu stabilitas harga pangan.
Demam jarak pagar sebagai bahan baku BBN membuat banyak kalangan hanya memfokuskan pemanfaatan tanaman ini pada bagian buah dan biji untuk diambil minyaknya. Padahal, tingginya minat dan penanaman terhadap tanaman jarak pagar akan lebih bermanfaat bila diikuti dengan pemanfaatan yang maksimal terhadap seluruh bagian tanamannya. Salah satu bagian tanaman jarak pagar yang berpotensi untuk dikembangkan adalah daun jarak pagar. Daun dapat diperoleh saat dilakukan pemangkasan terhadap tanaman jarak pagar. Pemangkasan itu sendiri dilakukan untuk mengontrol pembentukan cabang yang berkorelasi positif dengan produksi buah dan biji. Pemangkasan ini dilakukan pada akhir tahun pertama dan akhir tahun kedua dengan memotong bagian tanaman sehingga hanya tersisa 30 cm sampai 1/3 bagian tanaman dari tanah. Pemangkasan juga dilakukan pada tahun-tahun berikutnya untuk menjaga jumlah cabang agar tidak melebihi 60 cabang per pohon.
Selama ini daun jarak biasa digunakan sebagai alternatif pengobatan tradisional. Selain untuk menurunkan panas, daun jarak juga biasa digunakan untuk menghilangkan kembung, mengobati diare, gatal-gatal, dan borok kronis. Beberapa penelitian yang dilakukan terhadap daun jarak menunjukkan bahwa ekstrak daun jarak memiliki aktivitas antimikroba. Menurut Pase (2009), berdasarkan uji antimikroba dengan metode difusi sumur terhadap bakteri uji S. aureus dan E.coli, sabun jarak, baik yang berbentuk opaque maupun transparan mempunyai aktivitas antimikroba lebih tinggi daripada sabun kelapa maupun sabun antimikroba yang beredar di pasaran. Nurmillah (2009) dalam penelitiannya juga mendapatkan hasil bahwa ekstrak metanol dan heksan dari daun dan ranting jarak pagar menunjukkan aktivitas antimikroba terhadap E. coli dan S. aureus dengan diameter hambat > 6 mm menggunakan metode uji difusi sumur.
Tanaman umumnya mengandung berbagai senyawa aktif dan metabolit sekunder yang dapat berfungsi sebagai zat antimikroba dan antioksidan. Menurut Naengchomong et al. (1994) senyawa kimia yang terisolasi dari bagian daun dan ranting jarak pagar meliputi siklik triterpene stigmasterol, kampesterol, -sitosterol dan 7-keto- -sitosterol. Senyawa-senyawa tersebut diduga bertanggung jawab terhadap efek antimikroba dari ekstrak daun jarak. Selain itu, bagian daun dan ranting juga mengandung senyawa flavonoid yang memiliki aktivitas antioksidan.
Ehsan et al. (2011) dalam penelitiannya menemukan adanya kehadiran senyawa asam galat dan pyrogallol (golongan fenolik), rutin dan myrcetin (golongan flavonoid), serta daidzein (golongan isoflavonoid) dari hasil analisis HPLC terhadap ekstrak metanol jarak pagar. Metabolit lainnya yang berhasil dideteksi dengan GC-MS yaitu 2-(hydroxymethyl)-2nitro-1,3-propanediol,
Adapun pada ekstrak air ditemukan senyawa 2-furancarboxaldehyde, 5-(hydroxymethy), acetic acid dan furfural (2-furancarboxaldehyde). Ekstrak metanol dan ekstrak air dari jarak pagar ini menunjukkan aktivitas antimikroba terhadap bakteri gram positif dan bakteri gram negatif.
Selain itu, penelitian yang dilakukan oleh Windarwati (2011) juga menunjukkan bahwa fraksi metanol ekstrak daun jarak pagar mengandung senyawa berupa 2,3-dihydro-3,5 – dihydroxy-6-methyl 4-Phyran-4-one yang merupakan produk reaksi Maillard yang bertanggung jawab terhadap aktivitas antioksidan dari fraksi ini. Selain itu terdapat pula senyawa n-hexadecanoid acid dan 2-furancarboxaldehyde, 5-hydroxymethyl yang juga bertanggung jawab terhadap aktivitas antioksidan.
Adanya senyawa-senyawa yang memberi efek antimikroba dan antioksidan pada daun jarak pagar perlu dikaji lebih lanjut serta dapat dimanfaatkan untuk membuat produk-produk personal hygiene seperti shampoo dan sabun. Tindakan ini akan meningkatkan added value dari jarak pagar itu sendiri karena selain nilai ekonomisnya yang cukup tinggi, produk personal hygiene juga digunakan oleh hampir seluruh masyarakat sehingga akan menjadi produk yang berdaya jual di pasaran. Pada penelitian ini akan dikaji mengenai aktivitas antioksidan serta antimikroba dari ekstrak jarak pagar. Aktivitas antimikroba akan dilihat dari besarnya penghambatan esktrak dan fraksi ekstrak terhadap beberapa jenis fungi dan mikroba yang umumnya menyerang kulit, rambut, ataupun kuku manusia seperti Candida albicans, Microsporum gypseum, dan Pseudomonas aeruginosa. Fraksi eksrak dengan aktivitas antioksidan dan antimikroba terbaik selanjutnya akan dikembangkan menjadi salah satu produk personal hygiene.
B.
TUJUAN
Tujuan dilakukannya penelitian ini adalah:
1. Mengetahui aktivitas antioksidan dari ekstrak dan fraksi ekstrak daun dan ranting jarak pagar.
2. Mengetahui aktivitas antimikroba dari ekstrak dan fraksi ekstrak daun dan ranting jarak pagar terhadap Candida albicans, Microsporum gypseum, dan Pseudomonas aeruginosa. 3. Mengetahui potensi penerapan sifat antioksidan dan antimikroba fraksi ekstrak jarak pagar
II.
TINJAUAN PUSTAKA
A.
JARAK PAGAR
Jarak termasuk dalam keluarga Euphorbiaceae. Di Indonesia setidaknya ada empat jenis pohon jarak yang pernah tercatat, yakni jarak kaliki/kastor (Ricinus communis), jarak pagar (Jatropha curcas L.), jarak gurita (Jatropha multifida), dan jarak landi (Jatropha gossypifolia) (Tim Jarak Pagar RNI 2006).
Menurut Hyene (1987), klasifikasi tanaman jarak pagar adalah sebagai berikut: Divisi : Spermatophyta
Subdivisi : Angiospermae Kelas : Dicotyledonae Ordo : Euphorbiales Famili : Euphorbiaceae Genus : Jatropha Spesies : Jatropha curcas Linn
Tanaman jarak pagar telah dikenal masyarakat Indonesia, meski manfaat jarak pagar hanya diketahui oleh masyarakat sebagai tanaman obat tradisional dan pagar hidup. Tanaman jarak pagar berupa perdu dengan ketinggian 1-7 m, bercabang tidak teratur, dan batangnya berbentuk kayu silindris. Daun tanamannya berlekuk dan bersudut tiga atau lima. Panjang daun berkisar antara 5-15 cm dengan tulang daun menjari (Hambali et al. 2007).
Buah tanaman jarak pagar berbentuk bulat telur dengan diameter 2-3 cm. Panjang buah 2 cm, dengan ketebalan sekitar 1 cm. Buah jarak terbagi atas tiga ruang, masing-masing ruang berisi satu biji. Biji berbentuk bulat lonjong berwarna coklat kehitaman. Biji mengandung minyak dengan kadar 30-50% (Hambali et al 2007).
Jarak pagar tidak memerlukan banyak perawatan dan relatif tidak banyak membutuhkan air. Jarak pagar bisa beradaptasi pada daerah dengan curah hujan rata-rata 480-2380 mm per tahun. Namun, curah hujan yang cocok antara 200-1500 mm per tahun. Tumbuhan ini juga bisa bertahan hidup di musim kemarau panjang dengan cara menggugurkan daun. Ketinggian lahan yang dibutuhkan untuk tumbuh yaitu 300 m di atas permukaan laut. Jarak pagar tidak memerlukan banyak pupuk dan dapat beradaptasi pada suhu udara yang tinggi (Prihandana dan Hendroko 2007).
Gambar 1. Percabangan tanaman jarak pagar (sumber: Syakir 2008)
Pemangkasan pada tanaman jarak pagar terutama ditujukan untuk membentuk kanopi tanaman seperti semak atau payung. Hal ini penting karena tanaman jarak pagar berbunga terminal, sehingga jumlah cabang berkorelasi positif dengan produksi buah dan biji. Untuk itu, pada akhir tahun pertama perlu dilakukan pemangkasan pertama dengan memotong tanaman hingga tersisa hanya 30 cm dari permukaan tanah, untuk merangsang pertumbuhan cabang-cabang. Hasil pemangkasan tanaman jarak pagar pada akhir tahun pertama dan kedua dapat dilihat pada Gambar 2. Selanjutnya pada akhir tahun kedua pemangkasan berikutnya dilakukan dengan memotong cabang-cabang tanaman sepanjang 2/3 bagian dan menyisakan 1/3 bagian cabang-cabang tersebut. Khusus untuk tanaman yang berasal dari setek, cabang hasil pangkasan tahun kedua ini dapat dipakai sebagai perbanyakan tanaman untuk ditanam di tempat lain. Untuk mendapatkan produktivtas dan kualitas biji yang optimum, jumlah cabang hendaknya dipertahankan maksimal tidak lebih dari 60 cabang per pohon (Syakir 2008).
Gambar 2. Hasil pemangkasan tanaman jarak pagar (sumber: Syakir 2008)
Seluruh bagian tanaman jarak pagar dapat dimanfaatkan. Daun, ranting, batang, akar, serta biji jarak pagar diketahui mengandung berbagai macam senyawa kimia, beberapa diantaranya merupakan senyawa-senyawa aktif. Senyawa kimia yang terisolasi dari bagian daun dan ranting jarak pagar meliputi siklik triterpene stigmaterol, kampesterol, sitosterol, dan 7keto -sitosterol. Selain itu, bagian daun dan ranting mengandung senyawa flavonoid (Naengchomnong et al. 1994).
Naidu (2000) menambahkan bahwa flavonoid memiliki spektrum aktivitas antimikroba yang luas dengan mengurangi kekebalan pada organisme sasaran.
Pemanfaatan jarak pagar selain sebagai bioenergi juga terdapat potensi yang besar untuk pengembangan produk di bidang obat-obatan, pertanian maupun industri kimia. Daun jarak pagar di sejumlah daerah di Indonesia secara tradisional telah digunakan untuk penyembuh batuk, zat antiseptik setelah melahirkan, pereda panas, pereda kembung, obat cacing, obat gusi bengkak, anti ketombe dan lain-lain. Daun jarak juga dilaporkan sebagai obat malaria di Mali (Henning 1997) dan sebagai haemostatik di Afrika (Gubitz et al. 1999). Minyak jarak digunakan sebagai obat pencahar, mengobati penyakit kulit, mengurangi rasa sakit akibat reumatik. Sedangkan biji jarak digunakan langsung sebagai obat pencahar dan anthelmintic di Afrika (Gubitz et al. 1999).
Kajian mengenai aktivitas senyawa aktif pada tanaman jarak pagar juga telah dilakukan oleh beberapa peneliti. Igbinosa et al. (2009) melakukan pengujian aktivitas antimikroba dari ekstrak etanol, metanol dan ekstrak air kulit batang jarak pagar. Kemampuan ekstrak kasar dalam menghambat pertumbuhan bakteri dan kapang merupakan indikasi adanya potensi yang besar sebagai produk antimikroba. Pase (2009) melakukan pengujian aktivitas antimikroba dari sabun transparan dan sabun opaque berbahan baku minyak jarak pagar. Adanya aktivitas antimikroba pada sabun jarak membuka peluang untuk pengembangan sabun kesehatan alami. Produk lain seperti antioksidan juga dapat dikembangkan dari jarak pagar. Diwani et al. (2009) mendapatkan bahwa ekstrak metanol dari akar tanaman jarak pagar menunjukkan aktivitas antioksidan yang tinggi yang dapat meningkatkan stabilitas oksidasi dari minyak dan biodiesel jarak pagar, jelantah dan minyak zaitun.
B.
EKSTRAKSI
Ekstraksi merupakan suatu cara untuk memisahkan campuran beberapa zat menjadi komponen-komponen yang terpisah (Winarno et al. 1973). Menurut Hunt (1988), ekstraksi merupakan metode pemisahan satu atau lebih senyawa yang diinginkan dari larutan atau padatan yang mengandung campuran senyawa-senyawa tersebut secara fisik maupun kimiawi.
Dalam proses ekstraksi, terjadi peristiwa difusi pelarut ke dalam sel bahan. Pelarut yang masuk ke dalam sel bahan tersebut akan melarutkan senyawa bila kelarutan senyawa yang diekstrak sama dengan pelarut. Dengan cara tersebut akan tercapai kesetimbangan antara zat terlarut dan pelarut. Pengeluaran bahan aktif dari bahan tergantung kepada laju difusi substansi zat ke dalam pelarut, waktu kontak, dan laju pelarut menembus bahan (Bombardelli 1991).
Harborne (1987) menyebutkan bahwa kelarutan zat dalam pelarut bergantung pada kepolarannya. Zat yang polar hanya larut dalam pelarut polar begitu pula zat non polar hanya larut dalam pelarut non polar. Pemilihan pelarut dalam ekstraksi harus memperhatikan selektivitas pelarut, kemampuan untuk mengekstraksi komponen sasaran, toksisitas, kemudahan untuk diuapkan, dan harga pelarut.
Menurut Durran (1933), pemilihan pelarut merupakan faktor penting dalam melakukan ekstraksi suatu senyawa. Jenis pelarut yang digunakan dalam proses ekstraksi akan mempengaruhi jenis senyawa bioaktif yang terekstrak karena masing-masing pelarut memiliki efisiensi dan selektifitas yang berbeda untuk melarutkan komponen bioaktif dalam bahan. Kelarutan suatu senyawa dalam pelarut tergantung dari gugus-gugus yang terikat pada pelarut tersebut. Pelarut yang digunakan dalam ekstraksi harus dapat menarik komponen aktif dalam campuran.
ekstraksi, dan tahapan pemekatan larutan ekstrak. Persiapan bahan baku mencakup proses pengeringan bahan hingga mencapai kadar air tertentu dan penggilingan bahan untuk mempermudah proses ekstraksi. Tingkat kemudahan ekstraksi bahan kering ditentukan oleh ukuran partikel bahan. Bahan yang akan diekstrak sebaiknya berukuran seragam untuk mempermudah kontak antara bahan dan pelarut (Purseglove et al. 1981).
Ekstraksi dengan pelarut dilakukan dengan melarutkan bahan ke dalam suatu pelarut organik sehingga komponen pembentuk bahan akan terlarut ke dalam pelarut. Proses perpindahan komponen bioaktif dari dalam bahan ke pelarut dapat dijelaskan dengan teori difusi. Proses difusi merupakan pergerakan bahan secara spontan dan tidak dapat kembali (irreversible) dari fase yang memiliki konsentrasi lebih tinggi menuju ke fase dengan konsentrasi yang lebih rendah (Danesi 1992). Proses ini akan terus menerus berlangsung selama komponen bahan padat yang akan dipisahkan menyebar di antara kedua fase dan akan berakhir bila kedua fase berada dalam kesetimbangan. Kesetimbangan akan terjadi bila seluruh zat terlarut sudah larut seluruhnya di dalam zat cair dan konsentrasi larutan yang terbentuk menjadi seragam.
Perpindahan massa komponen bahan dari dalam padatan ke cairan terjadi melalui dua tahapan pokok. Tahap pertama adalah difusi dari dalam padatan ke permukaan padatan dan tahap kedua adalah perpindahan massa dari permukaan padatan ke cairan. Kedua proses tersebut berlangsung secara seri. Bila salah satu proses berlangsung lebih cepat, maka kecepatan ekstraksi ditentukan oleh proses yang lambat, tetapi bila kedua proses berlangsung dengan kecepatan yang tidak jauh berbeda, maka kecepatan ekstraksi ditentukan oleh kedua proses tersebut (Sediawan 1997).
Terdapat beberapa metode ekstraksi. Metode ekstraksi dipilih berdasarkan beberapa faktor seperti sifat dari bahan yang akan diekstrak, daya penyesuaian dengan tiap macam metode ekstraksi, dan kepentingan dalam memperoleh ekstrak yang sempurna. Metode pembuatan ekstrak yang umum digunakan antara lain adalah maserasi, perkolasi, soxhletasi, partisi, dan ekstraksi ultrasonik (Ansel 1989). Menurut Kurnia (2010), ekstraksi dengan pelarut dapat dilakukan dengan cara dingin dan panas. Cara dingin yaiu metode maserasi dan perkolasi, sedangkan cara panas antara lain yaitu metode reflux, soxhlet, digesti, destilasi uap, dan infus.
Maserasi merupakan proses pengambilan komponen target yang dilakukan dengan cara merendam serbuk simplisia ke dalam pelarut yang sesuai dalam jangka waktu tertentu. Isi sel akan larut karena adanya perbedaan konsentrasi antara larutan di dalam sel dan di luar sel. Larutan dengan konsentrasi tinggi akan terdesak keluar dan diganti oleh pelarut dengan konsentrasi rendah (proses difusi). Peristiwa tersebut berulang sampai terjadi kesetimbangan konsentrasi antara larutan di luar sel dan di dalam sel. Selama proses maserasi sesekali dilakukan pengadukan dan juga pergantian pelarut. Residu yang diperoleh dipisahkan kemudian filtratnya diuapkan (Sudjadi 1986).
Adapun menurut Houghton (1998), maserasi merupakan suatu metode ekstraksi dengan cara merendam sampel menggunakan pelarut dengan atau tanpa pengadukan. Metode maserasi digunakan untuk mengekstrak sampel yang relatif mudah rusak oleh panas. Metode ini dilakukan dengan merendam contoh dalam suatu pelarut baik tunggal maupun campuran dengan lama waktu tertentu (umumnya 1-2 hari perendaman) tanpa pemanasan.
ekstraksi padat cair dipengaruhi oleh banyak faktor yaitu lama ekstraksi, suhu yang digunakan, pengadukan, dan banyaknya pelarut yang digunakan (Harborne 1996).
Menurut List (1989), metode maserasi memiliki kelebihan dan kekurangan. Kelebihan metode ini relatif sederhana yaitu tidak memerlukan alat-alat yang rumit, relatif mudah, murah, dan dapat menghindari rusaknya komponen senyawa akibat panas. Kelemahan metode ini diantaranya waktu yang diperlukan relatif lama dan penggunaan pelarut yang tidak efektif dan efisien (Meloan 1999).
Sedangkan metode ekstraksi soxhlet adalah metode ekstraksi dengan prinsip pemanasan dan perendaman sampel. Hal itu menyebabkan terjadinya pemecahan dinding dan membran sel akibat perbedaan tekanan antara di dalam dan diluar sel. Dengan demikian, metabolit sekunder yang ada di dalam sitoplasma akan terlarut ke dalam pelarut organik. Larutan itu kemudian menguap ke atas dan melewati pendingin udara yang akan mengembunkan uap tersebut menjadi tetesan yang akan terkumpul kembali. Bila larutan melewati batas lubang pipa samping soxhlet maka akan terjadi sirkulasi. Sirkulasi yang berulang itulah yang menghasilkan ekstrak yang baik (Harborne 1987).
Harborne (1987) menambahkan keuntungan metode ekstraksi soxhlet adalah sebagai berikut: 1) cairan pelarut yang digunakan lebih sedikit dan secara langsung diperoleh hasil yang lebih pekat; 2) simplisia disari oleh pelarut yang selalu baru sehingga dapat menarik zat aktif yang lebih banyak; 3) penyarian dapat diteruskan sesuai keperluan tanpa menambah volume pelarut. Sementara itu, kelemahannya adalah: 1) tidak baik untuk zat aktif yang tidak tahan panas, tetapi kondisi itu dapat diperbaiki dengan menambahkan peralatan untuk mengurangi tekanan udara; 2) adanya pendidihan pelarut terus menerus sehingga mempengaruhi kualitas pelarut.
Adapun ekstraksi cair-cair bertahap merupakan teknik ekstraksi cair-cair yang paling sederhana yaitu cukup dengan cara menambahkan pelarut pengekstrak yang tidak saling bercampur kemudian dilakukan pengocokan sehingga terjadi distribusi zat terlarut di antara kedua pelarut (Khopkar 2003). Pada penelitian ini, pemisahat zat yang berbeda kepolarannya dilakukan dengan ekstraksi cair-cair/partisi pelarut dalam corong pemisah. Pengocokan yang dilakukan pada saat proses partisi ini bertujuan untuk memperluas area permukaan kontak di antara kedua pelarut sehingga pendistribusian zat terlarut di anatara keduanya dapat berlangsung dengan baik. Harvey (2000) menambahkan syarat pelarut untuk ekstraksi cair-cair adalah memiliki kepolaran yang sesuai dengan bahan yang diekstraksi dan harus terpisah setelah pengocokan.
C.
ANTIOKSIDAN
Menurut Supari (1995), radikal bebas adalah sebuah molekul yang memiliki satu atau lebih elektron yang tidak berpasangan pada orbital kulit terluarnya dan terbentuk melalui dua cara yaitu secara endogen (sebagai respon normal dari peristiwa biokimia dalam tubuh) dan secara eksogen (radikal bebas didapat dari polusi yang berasal dari luar tubuh dan bereaksi di dalam tubuh melalui pernafasan, pencernaan, injeksi, dan penyerapan kulit).
Radikal bebas juga merupakan molekul atau senyawa yang mempunyai satu atau lebih elektron yang tidak berpasangan dan dapat menimbulkan kerusakan pada biomolekul. Sifat radikal bebas yang sangat labil dan elektron yang tidak berpasangan dapat dianggap sebagai perebut elektron dari molekul lain yang terdapat di sekitarnya maupun yang berjarak jauh untuk memenuhi keganjilan elektronnya. Radikal bebas ini dapat berbentuk anion superoksida (O2-),
Antioksidan adalah zat yang dapat melawan pengaruh bahaya dari radikal bebas atau Reactive Oxygen Species (ROS) yang terbentuk sebagai hasil dari metabolisme oksidatif yaitu hasil dari reaksi-reaksi kimia dan proses metabolik yang terjadi dalam tubuh. Antioksidan dapat diklasifikasikan menjadi dua jenis yaitu antioksidan sintetik dan antioksidan alami. Antioksidan sintetik adalah antioksidan yang diperoleh dari hasil sintesa reaksi kimia (Trilaksani 2003). Beberapa contoh antioksidan sintetik adalah butil hidroksi anisol (BHA), butil hidroksi toluene (BHT), dan tert-butil hidroksi quinon (TBHQ). Antioksidan-antioksidan tersebut merupakan antioksidan yang telah diproduksi secara sintetis untuk tujuan komersial.
Adapun senyawa antioksidan alami adalah senyawa antioksidan yang diperoleh dari hasil ekstraksi bahan alami seperti tumbuh-tumbuhan. Antioksidan alami antara lain tokoferol, lesitin, fosfatida, sesamol, gosipol, karoten, dan asam askorbat yang banyak dihasilkan oleh tumbuhan. Antioksidan alami yang paling banyak ditemukan dalam minyak nabati adalah tokoferol yang mempunyai keaktifan vitamin E dan terdapat dalam bentuk α, , , δ-tokoferol (Winarno 2008). Charalampos et al. (2008) menambahkan senyawa kimia lainnya yang tergolong antioksidan dan berasal dari tumbuhan adalah golongan flavonoid dan polifenol.
Flavonoid dalam tanaman berfungsi sebagai pigmen yang memberikan warna pada bunga, buah, dan daun tanaman., contohnya adalah antosianin. Flavonoid dapat berperan sebagai antioksidan dalam tubuh manusia. Senyawa ini tidak terlalu beracun dibanding alkaloid sehingga flavonoid dapat dikonsumsi dalam jumlah besar. Contoh flavonoid yang berfungsi sebagai antioksidan adalah quercetin, xanthohumol, isoxanthohumol, dan genistein (Murray et al. 2003).
Antioksidan golongan flavonoid lainnya adalah proantosianidin yang sering pula disebut procyanidin, oligometric proanthocyanidin (OPC), dan condensed tannins. Proantosianidin merupakan bagian dari flavanol, seperti katekin. Proantosianidin merupakan antioksidan yang 20 kali lebih kuat dari vitamin C dan memiliki potensi 50 kali lebih besar dibanding vitamin E (Kakuda et al. 2003).
Antioksidan dari golongan polifenol merupakan senyawa kimia yang dapat larut dengan mudah dalam air dan lemak. Senyawa antioksidan tersebut umumnya digunakan untuk mencegah kerusakan akibat reaksi oksidasi yang terjadi pada makanan, kosmetik, dan farmasi. Senyawa polifenol memiliki fungsi sebagai penangkap dan pengikat radikal bebas dari ion-ion logam yang mengalami kerusakan (Perron 2009).
Perron (2009) juga menyebutkan bahwa senyawa antioksidan lainnya adalah golongan terpenoid, berasal dari unit isoprena yang dimodifikasi dengan bermacam-macam cara. Terpenoid memiliki fungsi sebagai senyawa yang memberi aroma pada tanaman,. Terpenoid juga diduga memiliki fungsi antibakteri.
Contoh antioksidan lainnya adalah vitamin C. Vitamin C merupakan suatu senyawa asam L-askorbat dan memiliki fungsi yang beragam. Selain sebagai antioksidan, vitamin C juga memiliki fungsi sebagai proantioksidan, pengikat logam, pereduksi, dan penangkap oksigen. Vitamin lainnya yang memiliki fungsi antioksidan adalah vitamin E. Vitamin E merupakan vitamin yang larut dalam lemak dan memiliki sifat antioksidan yang cukup kuat. Vitamin E berfungsi untuk memproteksi sel-sel membrane dari proses oksidasi, membantu memperlambat penuaan, dan melindungi tubuh dari kerusakan sel yang dapat menyebabkan penyakit kanker (Tuminah 2000).
dan amino-fenol. Adapun penggolongan antioksidan tersebut menurut Ketaren (2008) sebagai berikut:
a) Antioksidan golongan fenol
Antioksidan yang termasuk dalam golongan ini biasanya mempunyai intensitas warna yang rendah atau kadang-kadang tidak berwarna. Antioksidan golongan fenol meliputi sebagian besar antioksidan yang dihasilkan oleh alam dan sejumlah kecil antioksidan sintetis. Beberapa contoh antioksidan yang termasuk golongan ini antara lain hidrokuinon, gosipol, katekol, resorsinol, dan eugenol.
b) Antioksidan golongan amin
Antioksidan yang mengandung gugus amino atau diamino yang terikat pada cincin benzena biasanya mempunyai potensi tinggi sebagai antioksidan, namun beracun dan umumnya menghasilkan warna yang intensif jika dioksidasi atau bereaksi dengan ion logam. Senyawa golongan ini juga stabil terhadap panas serta ekstraksi dengan kaustik. Beberapa contoh antioksidan golongan ini adalah N,N difenil p-fenilenediamin, difenilhidrazin, difenilguanidin, dan difenil amin.
c) Antioksidan golongan amino-fenol
Antioksidan golongan ini biasanya mengandung gugus fenolat dan amino yang merupakan gugus fungsional penyebab aktivitas antioksidan. Golongan ini banyak digunakan dalam industry petroleum untuk mencegah terbentuknya gum dalam gasolin. Contoh antioksidan golongan ini yaitu N-butil-p-amino-fenol dan N-sikloheksil-p-amino-fenol.
Jenis antioksidan sangat beragam. Menurut Gordon (1990), berdasarkan mekanisme kerjanya, antioksidan digolongkan menjadi antioksidan primer (chain breaking antioxidant) dan antioksidan sekunder (preventive antioxidant). Antioksidan primer dapat bereaksi dengan radikal lipid dan mengubahnya menjadi bentuk yang lebih stabil. Sebuah senyawa dapat disebut sebagai antioksidan primer apabila senyawa tersebut dapat mendonorkan atom hidrogennya dengan cepat ke radikal lipid dan radikal antioksidan yang dihasilkan lebih stabil dari radikal lipid atau dapat diubah menjadi produk lain yang lebih stabil. Adapun antioksidan sekunder adalah antioksidan pencegah yang berfungsi menurunkan kecepatan inisiasi dengan berbagai mekanisme, seperti melalui pengikatan ion-ion logam, penangkapan oksigen, dan penguraian hidroperoksida menjadi produk-produk non radikal. Pada dasarnya, tujuan antioksidan sekunder adalah mencegah terjadinya radikal yang paling berbahaya yaitu radikal hidroksil.
Mekanisme antioksidan dalam menghambat oksidasi atau menghentikan reaksi berantai pada radikal bebas dari lemak yang teroksidasi, dapat disebabkan oleh empat macam mekanisme reaksi (Ketaren 2008) yaitu:
a) Pelepasan hidrogen dari antioksidan. b) Pelepasan elektron dari antioksidan.
c) Adisi lemak ke dalam cincin aromatic pada antioksidan.
d) Pembentukan senyawa kompleks antara lemak dan cincin aromatik dari antioksidan.
antioksi inisiasi Gamb A metode sederha pendete bebas y DPPH t P radikal menyeb dalam z picrylhy antioksi K diamagn radikal kimia D Gambar G A reaksi delokal membe dua rad radikal DPPH. pada ke idan (Gordon dan propagas Keterang
bar 3. Reaksi p
Aktivitas antio DPPH meru ana dengan eksi. Simanju yang dapat ber
tereduksi. Pada metode
bebas. Jika s babkan kerusa zat yang dieks ydrazine. Peru idan dari baha Ketika DPPH netik yang st hidrogen aka DPPH dari ben
r 4.
ambar 4. Stru
Ada tiga tahap antara DPPH isasi satu ele rikan atom hi dikal fenoksil DPPH. Tahap Pembentukan estabilan dan p
Inisias
Propag
n 1990). Reak si dapat dilihat
gan: R* ROO* AH A* ROOH penghambatan oksidan dapat upakan salah menggunaka untak et al. (2
reaksi dengan
DPPH free r senyawa ini m akan fungsi se
strak akan ber ubahan serapa an tersebut (H H menerima e tabil. Interaks an menetralka ntuk radikal b
uktur kimia D
p reaksi antara H dengan se
ektron pada drogen untuk yang akan m p terakhir ada n dimer maup potensial reak
si : R
gasi : R
ksi penghamb t pada Gamba
: radikal l : radikal p : antioksid : radikal a : hidroper n oleh antioksi
t diukur deng satu metode an 1,1-diphen 2002) menge n atom hidroge
radical scave masuk ke dala
l. Dalam uji in reaksi dengan
an yang dihas Hatano et al. 19
elektron atau i antioksidan an karakter ra
bebas menjadi
PPH dari bent ( Molyn
a DPPH denga enyawa mono gugus yang mereduksi D mentransfer rad alah pembentu pun kompleks ksi dari struktu
batan radikal ar 3. lipida peroksida dan antioksidan ya roksida R* ROO*
idan primer te
gan metode D e untuk meng nyl-2-picrylhy emukakan bah en yang beras
enging activity am tubuh ma ni, metanol di DPPH dan m silkan oleh rea
988). radikal hidro
dengan DPP adikal bebas d i bentuk komp
tuk radikal be neux 2004)
an zat antioks ofenolar (anti terssubtitusi DPPH. Tahap b
dikal hidrogen ukan komplek antara zat an ur molekulnya
+ AH Æ
+ AH Æ
bebas oleh a
ang terbentuk
antioksidan ppada tahap
ÆRH
erhadap radika
DPPH. Menuru ganalisa aktiv ydrazil (DPP hwa DPPH a al dari suatu a
ty, DPPH dig anusia dan tid igunakan seba mengubahnya m
aksi ini menja
ogen, maka a H baik secara dari DPPH (S
pleks non rad
ebas menjadi b
sidan yang dap ioksidan). Ta
oleh senyaw berikutnya me n dan akan be ks antara radi ntioksidan den a (Suratmo 200 ÆROOH
+ A*
+ A*
al lipid (Gordo
ut Miller et a vitas antioksi PH) sebagai adalah senyaw antioksidan m gunakan sebag dak terkendali agai pelarut, an
menjadi 1,1-d adi ukuran ke
akan terbentuk a transfer elek uratmo 2009) dikal dapat di
bentuk non rad
pat dicontohk ahap pertama wa tersebut, eliputi dimeris ereaksi kemba ikal aril deng ngan DPPH b
09).
on 1990)
D.
ANTIMIKROBA
Menurut Jay (1992), senyawa antimikroba adalah senyawa biologis atau kimia yang dapat menghambat pertumbuhan atau aktivitas mikroba. Fardiaz (1992) menyatakan bahwa senyawa antimikroba dapat bersifat bakterisidal (membunuh bakteri), bakteristatik (menghambat pertumbuhan bakteri), fungisidal (membunuh kapang), fungistatik (menghambat kapang), dan germisidal (menghambat germinasi spora bakteri). Antimikroba yang berfungsi untuk menghambat maupun membunuh mikroba dari golongan fungi dikenal dengan istilah antifungal.
Menurut Prindle (1983), mekanisme kerja dari senyawa antimikroba ada beberapa cara yaitu: (1) merusak dinding sel sehingga menyebabkan terjadinya lisis; (2) mengubah permeabilitas membran sitoplasma sehingga menyebabkan kebocoran zat nutrisi dari dalam sel; (3) denaturasi protein sel; dan (4) merusak metabolisme sel dengan cara menghambat kerja enzim intraseluler.
Pelczar et al. (1993) menyebutkan bahwa senyawa kimia yang memiliki sifat sebagai antimikroba adalah senyawa fenolik, alkohol, halogen, logam berat, detergen, dan senyawa ammonium kuartener. Senyawa-senyawa tersebut dapat digunakan untuk menghambat pertumbuhan mikroba atau membunuh mikroba dengan mekanisme kerja sebagai berikut:
1. Senyawa fenolik : merusak sel mikroba dengan mengubah permeabilitas membran sitoplasma, menyebabkan kebocoran bahan-bahan intraseluler, serta mendenaturasi dan menginaktifkan protein seperti enzim.
2. Alkohol : mendenaturasi protein, merusak struktur lemak dan membran sel mikroba.
3. Halogen : terdiri dari yodium, klor, dan bromine yang merupakan pengoksidasi kuat dan perusak organel yang penting dari sel mikroba.
4. Logam berat : menginaktifkan protein seluler.
5. Detergen : merusak membran siroplasma dan menyebabkab kebocoran bahan intraseluler.
6. Senyawa ammonium kuartener : mendenaturasi protein, mengganggu proses metabolism, dan merusak membran sitoplasma.
Mekanisme senyawa fenol sebagai zat antimikroba adalah dengan cara meracuni protoplasma, merusak dan menembus dinding sel, serta mengendapkan protein sel mikroba. Komponen fenol juga dapat mendenaturasi enzim yang bertanggung jawab terhadap germinasi spora atau berpengaruh terhadap asam amino yang terlibat dalam proses germinasi. Senyawa fenolik bermolekul besar mampu menginaktifkan enzim esensial di dalam sel mikroba meskipun pada konsentrasi yang sangat rendah (Prindle 1983).
E.
CANDIDA ALBICANS, MICROSPORUM GYPSEUM,
DAN
PSEUDOMONAS AERUGINOSA
Candida albicans merupakan jamur dimorfik karena kemampuannya untuk tumbuh dalam dua bentuk yang berbeda yaitu sebagai sel tunas yang akan berkembang menjadi blastospora dan menghasilkan kecambah yang akan membentuk hifa semu. Perbedaan bentuk ini tergantung pada faktor eksternal yang mempengaruhinya. Sel ragi (blastospora) berbentuk bulat, lonjong atau bulat lonjong dengan ukuran 2-5 μ x 3-6 μ hingga 2-5,5 μ x 5-28 μ (Riana 2006).
Riana (2006) juga menyebutkan bahwa C. albicans memperbanyak diri dengan membentuk tunas yang akan terus memanjang membentuk hifa semu. Hifa semu terbentuk dengan banyak kelompok blastospora berbentuk bulat atau lonjong di sekitar septum. Pada beberapa strain, blastospora berukuran besar, berbentuk bulat atau seperti botol, dalam jumlah sedikit. Sel ini dapat berkembang menjadi klamidospora yang berdinding tebal dan bergaris tengah sekitar 8-12 μ.
Morfologi koloni C. albicans pada medium padat agar Sabouraud Dekstrosa, umumnya berbentuk bulat dengan permukaan sedikit cembung, halus, licin dan kadang-kadang sedikit berlipat-lipat terutama pada koloni yang telah tua. Umur biakan mempengaruhi besar kecil koloni. Warna koloni putih kekuningan dan berbau asam seperti aroma tape. Dalam medium cair seperti glucose yeast, extract pepton, C. albicans tumbuh di dasar tabung (Suprihatin 1982).
C. albicans dapat tumbuh pada variasi pH yang luas, tetapi pertumbuhannya akan lebih baik pada pH antara 4,5-6,5. Jamur ini dapat tumbuh dalam perbenihan pada suhu 28oC - 37oC. C. albicans membutuhkan senyawa organik sebagai sumber karbon dan sumber energi untuk pertumbuhan dan proses metabolismenya. Unsur karbon ini dapat diperoleh dari karbohidrat. Jamur ini merupakan organisme anaerob fakultatif yang mampu melakukan metabolisme sel, baik dalam suasana anaerob maupun aerob. Proses peragian (fermentasi) pada C. albicans dilakukan dalam suasana aerob dan anaerob. Karbohidrat yang tersedia dalam larutan dapat dimanfaatkan untuk melakukan metabolisme sel dengan cara mengubah karbohidrat menjadi CO
2 dan H2O
dalam suasana aerob (Suprihatin 1982).
Sedangkan dalam suasana anaerob hasil fermentasi berupa asam laktat atau etanol dan CO
2. Proses akhir fermentasi anaerob menghasilkan persediaan bahan bakar yang diperlukan
untuk proses oksidasi dan pernafasan. Pada proses asimilasi, karbohidrat dipakai oleh C. albicans sebagai sumber karbon maupun sumber energi untuk melakukan pertumbuhan sel.
Klasifikasi Candida albicans adalah sebagai berikut: Kingdom : Fungi
Filum : Ascomycota Subfilum : Saccharomycotina Kelas : Saccharomycetes Ordo : Saccharomycetales Famili : Saccharomycetaceae Genus : Candida
Spesies : Candida albicans
Sinonim : Candida stellatoidea dan Oidium albicans
paru-paru, limpa dan kelenjar gondok. Mata dan otak sangat jarang terinfeksi. Pada wanita, C. albicans sering menimbulkan vaginitis dengan gejala utama fluor albus yang sering disertai rasa gatal. Infeksi ini terjadi akibat tercemar setelah defekasi, tercemar dari kuku atau air yang digunakan untuk membersihkan diri; sebaliknya vaginitis Candida dapat menjadi sumber infeksi di kuku, kulit di sekitar vulva dan bagian lain.
Adapun Microsporum gypseum merupakan cendawan keratophilik geofilik. Kelembapan, pH, dan kontaminasi faeces menjadi faktor yang mempengaruhi pertumbuhannya (Emmons et al. 1977). Mikroorganisme ini memiliki dinding sel yang mengandung kitin bersifat heterotrof, menyerap nutrient melalui dinding selnya, dan mengekskresikan enzim-enzim ekstraseluker ke lingkungannya (Indrawati 2006).
Klasifikasi Microsporum gypseum menurut Wicaksana (2008) adalah sebagai berikut: Kingdom : Fungi
Filum : Ascomycota Kelas : Eurotiomycetes Ordo : Onygenales Famili : Arthrodermataceae Genus : Microsporum
Spesies : Microsporum gypseum
Jamur Microsporum gypseum dapat ditularkan secara langsung baik melalui epitel kulit, rambut yang mengandung jamur, ataupun dari tanah. Beberapa penyakit yang disebabkan oleh jamur ini antara lain adalah tinea capitis, tinea favosa, dan tinea unguinum. Tinea capitis merupakan salah satu akibat dari infeksi dermatofita yang mengenai kulit kepala dan rambut (Moschella 1992). Tinea favosa merupakan salah satu bentuk infeksi kronik dari Microsporum gypseum yang infeksinya dapat dimulai semenjak kanak-kanak dan jika tidak dapat ditangani dengan baik maka penderita akan menjadi carier selama hidupnya. Adapun tinea unguinum adalah kerusakan pada dasar kuku yang dimulai dari tepi kuku. Pada kuku yang terinfeksi maka akan tampak ukuran kukunya mengecil, memiliki batas yang lebih tegas dibandingkan dengan kuku yang sehat, dan ada bercak-bercak kuning atau putih yang tersebar pada basis kuku (Rippon 1974).
Adapun Pseudomonas aeruginosa merupakan mikroorganisme yang tergolong ke dalam bakteri gram negatif aerob obligat, berkapsul, dan mempunyai flagella polar sehingga bakteri ini bersifat motil. Menurut Tranggono (2007) Pseudomonas aeruginosa merupakan salah satu jenis bakteri yang seringkali menyerang kosmetik. Bakteri ini dapat menghasilkan enzim pyocynase yang dapat menyebabkan penggunaan zat pengawet menjadi tidak berguna lagi. Kontaminasi Pseudomonas aeruginosa dapat menyebabkan pembusukan kornea mata dan kebutaan. Adapun yang dimaksud kosmetik untuk daerah mata mencakup produk-produk yang mungkin kontak dengan kornea mata, misalnya sampo, pembilas rambut, conditioner, krim-krim wajah, lotion, dan cleanser.
F.
PERSONAL HYGIENE
DAN SABUN TRANSPARAN
kurang diperhatikan. Hal ini terjadi karena mengganggap masalah kebersihan adalah masalah sepele, padahal jika hal tersebut kurang diperhatikan dapat mempengaruhi kesehatan secara umum (Maria 2010).
Sedangkan menurut Tarwoto (2003), personal hygiene berasal dari bahasa Yunani yaitu personal yang artinya perorangan dan hygiene berarti sehat. Kebersihan seseorang adalah suatu tindakan untuk memelihara kebersihan dan kesehatan seseoran untuk kesejahteraan fisik dan psikis. Macam-macam personal hygiene yaitu perawatan kulit kepala dan rambut, perawatan mata, perawatan hidung, perawatan telingga, perawatan kuku kaki dan tangan, perawatan genetalia, perawatan kulit seluruh tubuh, dan perawatan tubuh secara keseluruhan.
Adapun tujuan personal hygiene yaitu meningkatkan derajat kesehatan seseorang, memelihara kebersihan diri seseorang, memperbaiki personal hygiene yang kurang, mencegah penyakit, menciptakan keindahan, dan meningkatkan rasa percaya diri. Produk-produk yang berfungsi sebagai perangkat personal hygiene antara lain adalah sabun, shampoo, pencuci mulut, salep, cream, dan produk perawatan tubuh lainnya.
Sabun menurut SNI (1994) adalah sabun natrium yang umumnya ditambahkan zat pewangi atau antiseptik dan digunakan untuk membersihkan tubuh manusia dan tidak membahayakan kesehatan. Sabun merupakan pembersih tubuh sehari-hari dimana dengan air sabun dapat membersihkan kotoran dari permukaan kulit seperti minyak, keringat, sel-sel kulit yang telah mati dan sisa kosmetik.
Berdasarkan jenisnya, sabun dibedakan atas tiga macam yaitu sabun opaque, sabun translucent, dan sabun transparan. Menurut Mitsui (1997), sabun transparan pada dasarnya sama dengan sabun mandi lainnya yaitu hasil reaksi penyabunan antara asam lemak dengan basa kuat. Hal yang membedakan hanyalah penampakannya yang transparan.
Sabun transparan dapat dihasilkan dengan sejumlah cara berbeda. Salah satu metode adalah dengan cara melarutkan sabun dalam alkohol dengan pemanasan lembut untuk membentuk larutan jernih yang kemudian diberi pewarna, pewangi, maupun zat antioksidan. Untuk membentuk struktur transparan pada sabun maka dalam formulasi sabun transparan ditambahkan beberapa bahan seperti gliserin, sukrosa, dan alcohol serta transparent agent lainnya. Mitsui (1997) menyatakan untuk melengkapi fungsi yang sama dengan gliserin dapat ditambahkan beberapa bahan seperti propilen glikol, sorbitol, polietilen glikol, surfaktan amfoterik, dan surfaktan anionik.
III.
METODOLOGI PENELITIAN
A.
ALAT DAN BAHAN
Alat yang digunakan pada penelitian kali ini meliputi pisau dan wadah untuk pengambilan sampel, seperangkat destilator, seperangkat alat ekstraksi soxhlet, pompa vacuum, whatman 41, vacuum rotary evaporator, freeze dryer, corong pemisah, spektrofotometer, inkubator, autoclaf, neraca analitik, gelas piala, gelas ukur, tabung reaksi, cawan petri, ose, bunsen, dan hotplate beserta stirer. Adapun bahan yang diperlukan yaitu daun dan ranting jarak pagar segar yang diambil dari kebun Leuwikopo IPB sebagai bahan baku utama untuk pembuatan ekstrak, pelarut berupa etanol, etil asetat, dan n-heksana, serta kultur Candida albicans, Pseudomonas Aeruginosa, dan Microsporum gypseum. Sedangkan bahan-bahan kimia yang digunakan adalah bahan-bahan kimia untuk analisis proksimat, anlisis total fenol (asam tanat, aquades, Na2CO3, reagen Follin-Ciocalteu, dan etanol PA), analisis antioksidan (DPPH, dan methanol PA), serta analisis aktivitas penghambatan mikroba (nutrient broth, nutrient agar, PDB, PDA, dan ketokonazol).
B.
METODE PENELITIAN
Secara umum penelitian ini dilakukan dalam beberapa tahapan. Pada tahap pertama dilakukan proses persiapan sampel daun dan ranting jarak pagar berupa pengecilan ukuran, pengeringan, dan pembuatan serbuk. Selanjutnya dilakukan beberapa analisis terhadap serbuk yang dihasilkan untuk mengetahui karakteristik bahan yang akan diekstraksi. Kemudian serbuk diekstraksi dengan metode soxhlet dan metode maserasi menggunakan pelarut etanol yang telah di destilasi sebelumnya. Ekstrak kasar yang diperoleh lalu dipekatkan dan dikeringkan untuk selanjutnya mengalami proses fraksinasi (partisi cair-cair). Proses fraksinasi dilakukan dengan menggunakan pelarut etil asetat dan n-heksan (yang telah didestilasi sebelummnya) untuk memisahkan zat sesuai kepolarannya. Fraksi ekstrak yang didapat kemudian dipekatkan dan dikeringkan hingga menjadi bahan yang siap untuk dianalisis.
Daun dan ranting jarak pagar
Diperkecil ukurannya, dikeringkan, dan dibuat men
Gambar 5. Ekstraksi, fraksinasi, dan pengujian ekstrak/fraksi ekstrak dari jarak pagar jadi serbuk
Analisis kadar air, abu, lemak, dan protein terhadap serbuk daun dan ranting jarak pagar
Ekstraksi serbuk dengan metode soxhlet Ekstraksi serbuk dengan metode maserasi (pelarut etanol 96% yang telah didestilasi) (pelarut etanol 96% yang telah didestilasi)
Ekstrak kasar (soxhlet) Ekstrak kasar (maserasi)
Fraksinasi (partisi) dengan pelarut etanol-air (2:3), etil asetat, dan heksan
Fraksi etanol air Fraksi etil asetat Fraksi heksan
Uji total fenol, aktivitas antioksidan, aktivitas antimikroba, dan identifikasi senyawa kimia dengan
GC-MS Disaring dengan Whatman 41, dipekatkan dengan
vacuum rotary evaporator (40-600C), lalu dikeringkan dengan freeze dryer
Disaring dengan Whatman 41, dipekatkan dan dikeringan dalam ruangan ber-AC (180C) [tidak
menggunakan proses panas sama sekali]
Disaring dengan Whatman 41, dipekatkan dengan vacuum rotary eva
Ekstrak/fraksi ekstrak terpilih
porator (40-600C), lalu dikeringkan dengan freeze dryer
Fraksi etanol air Fraksi etil asetat
Ekstrak/fraksi ekstrak terpilih
Penambahan ekstrak pada sabun komersil tanpa BHT (650C)
Sabun transparan dengan ekstrak
Gambar 6. Aplikasi ekstrak/fraksi ekstrak terpilih pada sabun transparan a. Persiapan Sampel
Sampel daun jarak pagar diambil pada saat dilakukan pemangkasan tanaman jarak. Sampel basah yang ada dipisahkan bagian daun dan ranting. Masing-masing bagian sampel segar kemudian dirajang dan dikeringanginkan selama ± 7 hari hingga benar-benar kering. Sampel kering lalu digiling dengan blender hingga menjadi serbuk untuk memudahkan proses ekstraksi. Sampel serbuk kering dikemas dalam kantong plastik dan disimpan dalam freezer sebelum dilakukan proses ekstraksi. Karakterisasi yang dilakukan terhadap sampel serbuk kering sebelum digunakan dalam penelitian meliputi analisa kadar air, kadar abu, kadar lemak, dan kadar protein. Prosedur analisa proksimat sampel jarak pagar disajikan pada Lampiran 1.
b. Ekstraksi Senyawa Aktif
Proses ekstraksi dilakukan dengan dua metode ekstraksi yaitu sokhlet (mewakili metode ekstraksi panas) dan maserasi (mewakili metode ekstraksi dingin). Metode ekstraksi soxhlet dilakukan dengan cara menimbang ± 40-45 gram serbuk sampel kering lalu memasukkannya ke dalam selongsong yang terbuat dari kertas saring. Selongsong kemudian dimasukkan ke dalam alat ekstraksi soxhlet dan diekstraksi menggunakan pelarut etanol 96% yang telah didestilasi sebelumnya. Proses ekstraksi dilakukan hingga terjadi refluks sebanyak sepuluh kali. Waktu yang dibutuhkan untuk satu kali refluks mencapai 50-60 menit. Esktrak yang diperoleh kemudian disaring dengan kertas saring Whatman 41 dengan bantuan pompa vakum, lalu dipisahkan dari pelarut (dipekatkan) dengan menggunakan vacuum rotary evaporator hingga diperoleh ekstrak kental. Ekstrak yang didapat kemudian dikeringkan dengan pengering beku (freeze dryer) hingga didapat ekstrak kasar kering.
Adapun metode maserasi dilakukan dengan cara menimbang serbuk sampel kering sebanyak 120 gram lalu diekstraksi menggunakan pelarut etanol 96% (3 x 240 ml) yang telah didestilasi sebelumnya. Serbuk sampel kering yang telah ditimbang direndam dalam pelarut selama 24 jam pada suhu kamar. Ekstrak yang diperoleh kemudian dipekatkan
jarak pagar
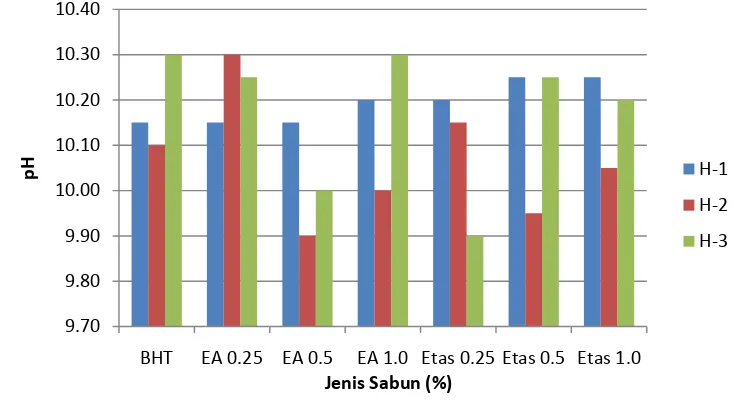
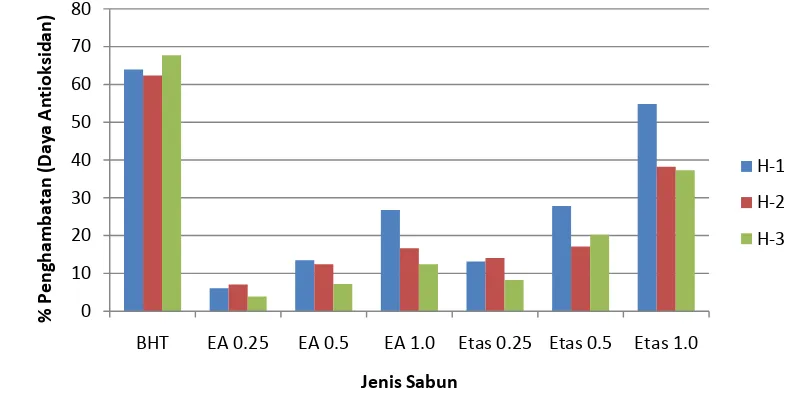
Analisis sabun (bagian tak larut dalam alkohol, pH, stabilitas busa, aktivitas antioksidan) serta uji kesukaan (warna dan aroma) oleh
dengan cara dikeringanginkan dalam ruangan ber-AC hingga pelarut menguap dan ekstrak megering (tanpa menggunakan panas sama sekali). Ekstrak kering kemudian dikerik dan dikemas dalam kemasan plastik, lalu disimpan di dalam freezer sebelum digunakan sebagai bahan analisis.
c. Proses Fraksinasi
Proses fraksinasi kasar yang dilakukan mengacu pada metode Windarwati (2011) yaitu proses partisi menggunakan pelarut etanol-air (2:3), heksan dan etil asetat. Ekstrak kasar dilarutkan dalam pelarut Sebanyak 50 gram ekstrak kasar dilarutkan dalam 500 ml pelarut campuran etanol air. Larutan selanjutnya dipartisi dengan menambahkan 1000 ml pelarut n-heksan, dikocok dalam labu pemisah dan didiamkan selama 30-60 menit hingga terdapat dua lapisan (lapisan etanol air di bagian bawah dan lapisan n-heksan di bagian atas). Kedua lapisan yang terbentuk kemudian dipisahkan. Proses penambahan heksan pada lapisan atas etanol air diulangi tiga kali. Lapisan heksan yang terbentuk selama tiga kali penambahan digabungkan menjadi satu dan disebut sebagai fraksi heksan.
Lapisan etanol air sisa dari proses partisi heksan kemudian dipartisi lebih lanjut dengan etil asetat. Proses yang terjadi sama dengan proses partisi dengan pelarut heksan hanya saja pelarut heksan digantikan dengan etil asetat. Sebanyak 1000 ml pelarut etil asetat ditambahkan dalam lapisan etanol air, dikocok dalam labu pemisah dan didiamkan selama 30-60 menit hingga terdapat dua lapisan (lapisan etanol air di bagian bawah dan lapisan etil asetat di bagian atas). Kedua lapisan yang terbentuk kemudian dipisahkan. Proses penambahan etil asetat pada lapisan atas etanol air diulangi tiga kali. Lapisan etil asetat yang terbentuk selama tiga kali penambahan digabungkan menjadi satu dan disebut sebagai fraksi etil asetat. Adapun lapisan etanol air disebut sebagai fraksi etanol air.
Fraksi etil asetat dan fraksi etanol air adalah fraksi yang diinginkan pada penelitian ini. Oleh karena itu, kedua fraksi ini harus diproses lebih lanjut. Fraksi etil asetat dan fraksi etanol air yang diperoleh selanjutnya dipisahkan dari pelarutnya (dipekatkan) menggunakan vacuum rotary evaporator pada suhu 500C hingga diperoleh ekstrak kental. Ekstrak kental tersebut kemudian dikeringkan menggunakan pengering beku (freeze dryer) hingga diperoleh fraksi ekstrak. Perhitungan rendemen proses ekstraksi dan fraksi ekstrak terhadap bobot serbuk kering yang digunakan adalah sebagai berikut:
% %
% %
d. Analisis Ekstrak dan Fraksi Ekstrak
e. Uji Total Fenol
Sebanyak 0.1 ml cairan ekstrak dalam metanol (konsentrasi 1 mg ekstrak/ml) diencerkan menjadi 1 ml dengan aquadest. Ke dalam larutan tersebut dimasukkan 0.5 ml reagen Folin Ciocalteu yang diikuti dengan penambahan 2 ml larutan Na2CO3 7.5%. Cairan
kemudian divortex dan dibiarkan (diinkubasi) selama 30 menit pada suhu 400C. Absorbansi sampel diukur pada panjang gelombang 760 nm. Absorbansi yang terbaca merupakan nilai y yang dimasukkan ke dalam persamaan garis yang didapat dari pembuatan kurva standar asam tanat pada konsentrasi 25-125 mg/L. Dengan demikian akan diperoleh kandungan total fenol (nilai x) sampel yang dinyatakan sebagai mg ekuivalen asam tanat/g sampel ekstrak. Perhitungan total fenol adalah sebagai berikut:
⁄
.
f. Uji Aktivitas Antioksidan dengan Metode Efek Perendaman terhadap Radikal Bebas DPPH (1,1-diphenyl-2-picrylhidrazil) (Liyana dan Shahidi, 2005)
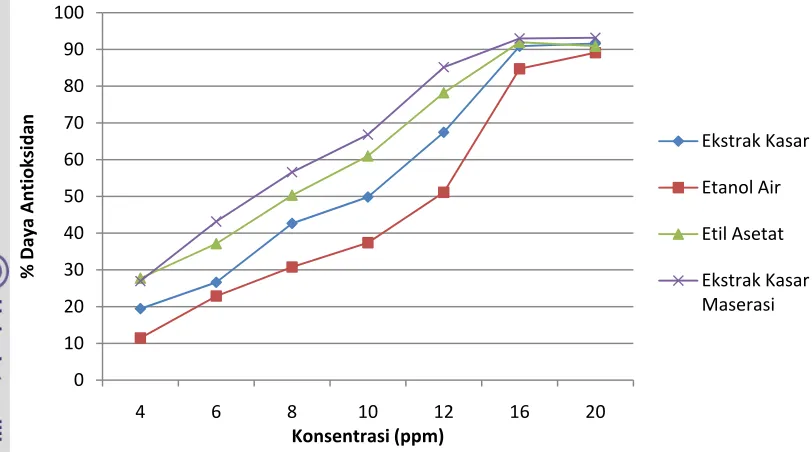
Prinsip pengujian aktivitas antioksidan dengan metode DPPH adalah ketika larutan DPPH bercampur dengan senyawa yang dapat mendonorkan atom hidrogen (zatn antioksidan), maka DPPH akan tereduksi dan akan kehilangan warna ungunya. Sebanyak 2 ml DPPH 0.136 mM dalam metanol dicampurkan dengan 2 ml ekstrak dalam metanol yang terdiri dari konsentrasi 4, 6, 8, 10, 12, 16, dan 20 ppm. Setelah itu cairan disimpan di ruang gelap pada suhu ruang selama 30 menit, kemudian absorbansi diukur dengan spektrofotometer pada panjang gelombang 517 nm. Vitamin C digunakan sebagai pembanding. Sebagai kontrol, disiapkan metanol sebanyak 4 ml tanpa penambahan ekstrak dan ditetapkan sebagai 0% absorban. Kapasitas antioksidan ( persen penghambatan) dapat dihitung dengan rumus berikut:
% %
g. Uji Aktivitas Penghambatan Mikroba
Aktivitas penghambatan mikroba dianalisa dengan metode difusi sumur. Pada metode ini kultur uji berupa Candida albicans, Microsporum gypseum, dan Pseudomonas aeruginosa yang akan digunakan disegarkan terlebih dahulu dengan cara diambil satu ose, lalu ditumbuhkan pada media pertumbuhan PDB 10 ml untuk golongan khamir dan kapang serta ditumbuhkan pada media NB 10 ml untuk bakteri. Kultur Candida albicans dan Pseudomonas aeruginosa lalu diinkubasi pada suhu 300C selama 24 jam sementara itu kultur Microsporum gypseum diinkubasi pada suhu 300C selama 48-72 jam.
dahulu dalam cawan petri dan dibiarkan mengeras. Setelah itu biakan cair mikroorganisme dituang di atas agar dan diratakan. Kemudian barulah dibuat sumur dan fraksi uji diteteskan.
Adapun pada metode disc diffusion, kertas cakram yang terbuat dari Whatman 42 berdiameter 6 mm dicelupkan ke dalam larutan ekstrak 1%, 2%, dan 3%. Kertas ini selanjutnya diletakkan di atas agar cawan yang telah diinokulasikan mikroorganisme Pseudomonas aeruginosa dengan metode tuang. Inkubasikan agar pada suhu 370C selama 24 jam.
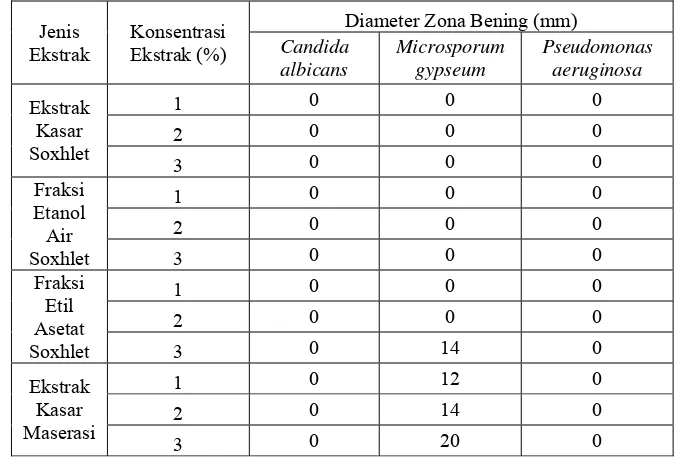
Amati penghambatan pertumbuhan mikroba yang terjadi dan ukur zona penghambatan yang terbentuk yang ditandai dengan tidak terdapatnya pertumbuhan mikroba di sekeliling sumur. Tentukan jenis mikroba yang mampu mengalami penghambatan paling tinggi dan ekstrak atau fraksi ekstrak mana yang memberikan penghambatan paling tinggi tersebut.
h. Identifikasi Senyawa Kimia dengan GC-MS
Identifikasi senyawa kimia dalam ekstrak terpilih dilakukan menggunakan GC-MS (Gas Chromatography-Mass Spectrometry) Agilent 19091S-433. Analisis dilakukan di Puslabfor Mabes Polri Jakarta. Sejumlah kecil ekstrak dilarutkan dalam pelarut yang digunakan saat pembuatan ekstrak. Bila masih terdapat ekstrak yang tidak larut maka dilakukan proses sentrifugasi. Larutan ekstrak kemudian diambil dengan jarum inject khusus lalu disuntikan ke dalam alat GC-MS. Metode yang digunakan pada analisis ini adalam metode umum dengan suhu inlet untuk ekstrak soxhlet 1000C dan 400C untuk ekstrak maserasi.
i. Penambahan Fraksi Ekstrak Terpilih pada Sabun Batang Transparan
Penambahan fraksi ekstrak terpilih pada sabun batang transparan dilakukan dengan cara melelehkan sabun transparan komersial tanpa penambahan BHT pada suhu 600C. Kemudian ekstrak/fraksi ekstrak terpilih ditambahkan pada suhu 650C dan diaduk menggunakan stirrer selama 5-7 menit. Sabun kemudian dicetak dalam wadah. Penambahan ekstrak dilakukan pada tiga tingkat konsentrasi yaitu 0.2 gram, 0.4 gram, dan 0.8 gram pada tiap batch proses yang berisi 300 gram sabun.
IV.
HASIL DAN PEMBAHASAN
A.
EKSTRAKSI DAN FRAKSINASI SENYAWA AKTIF
Senyawa aktif yang terkandung pada tanaman atau bahan alam dapat kita peroleh melalui proses ekstraksi. Ekstraksi yaitu proses pemisahan komponen tertentu dari suatu bahan sehingga didapatkan zat yang terpisah baik secara fisik maupun kimiawi. Sebelum dimulai proses ekstraksi, bahan baku berupa daun dan ranting jarak pagar (Jatropha curcas Linn) mengalami beberapa perlakuan pendahuluan berupa pengecilan ukuran dan pengeringan hingga diperoleh serbuk (simplisia) yang siap untuk diekstraksi.
Penghalusan atau pengecilan ukuran akan menyebabkan rusaknya sel tanaman sehingga senyawa aktif yang terkadung di dalamnya akan dengan mudah larut saat kontak dengan pelarut yang dikenal dengan istilah pencucian oleh pelarut. Semakin halus ukuran simplisia maka semakin optimal jalannya proses pencucian tersebut. Selain itu, ukuran partikel yang lebih halus juga menyebabkan luas permukaan bahan menjadi semakin luas sehingga semakin besar kontak yang terjadi antara bahan dan pelarut yang menyebabkab proses ekstraksi menjadi lebih optimal. Gambar 7 memperlihatkan gambar campuran serbuk daun dan ranting jarak pagar sebelum dan sesudah proses ekstraksi.
Gambar 7. Campuran serbuk daun dan ranting jarak pagar sebelum (A) dan setelah (B) proses ekstraksi
Bahan yang sudah halus dan menjadi serbuk siap untuk mengalami proses ekstraksi. Sebelum dilakukan proses ekstraksi, dilakukan analisis terhadap kadar air, abu, lemak dan protein untuk mengetahui komposisi kimia bahan baku yang digunakan. Hasil analisis terhadap kadar air, abu, lemak dan protein daun dan ranting jarak pagar kering dapat dilihat pada Tabel 1.
Tabel 1. Hasil analisis kadar air, abu, lemak, dan protein serbuk daun dan ranting Jatropha curcas Linn kering
A
Komponen Nilai (%)
Air 10.44 Abu 8.16 Lemak 5.46 Protein 11.86
Kadar air merupakan salah satu karakteristik bahan baku yang penting untuk diketahui karena akan mempengaruhi mutu hasil ekstraksi. Setyowati (2009) menyatakan bahwa dalam proses ekstraksi, maksimum kadar air yang disyaratkan agar proses ekstraksi dapat berjalan lancar yaitu sebesar 11%. Pada penelitian ini, kadar air serbuk daun dan ranting jarak pagar kering bernilai 10.44%. Nilai tersebut berada di bawah nilai kadar air maksimum yang
dipersyaratkan sehingga masih layak digunakan sebagai bahan baku proses ekstraksi. Adapun bila dibandingkan dengan penelitian sebelumnya yang dilakukan oleh Windarwati (2011), kadar air sampel pada penelitian ini bernilai sedikit lebih tinggi. Kadar air serbuk daun dan ranting jarak pagar pada penelitian Windarwati (2011) bernilai 9.58%.
Komponen lainnya yang diukur dari sampel bahan adalah kadar abu. Analisis kadar abu dilakukan untuk mengetahui kandungan mineral sampel. Hasil penelitian menunjukkan bahwa kadar abu sampel bernilai 8.16%. Nilai ini lebih rendah bila dibandingkan dengan penelitian Windarwati (2011) dimana nilai kadar abu sampel adalah 13.74%. Begitupula hal nya bila dibandingkan dengan penelitian Nurmillah (2009) dimana kadar abu sampel daun dan ranting jarak pagar yang ia teliti bernilai 10.58%. Tinggi rendahnya kadar abu dipengaruhi oleh habitat dimana tanaman jarak pagar tersebut tumbuh. Bahan baku jarak pagar pada penelitian ini diperoleh dari kebun Lewikopo IPB dimana kondisi lahannya tidak terlalu berkapur. Sementara itu, bahan baku jarak pagar pada penelitian Windarwati (2011) dan Nurmillah (2009) berasal dari kebun jarak pagar PT. Indocement Tunggal Prakarsa, Tbk yang memiliki kondisi lahan berkapur sehingga kandungan mineral seperti Fe, Mg, Ca, Zn, K, Si, Al, dan mineral lainnya cukup tinggi.
Setelah pengukuran kadar abu, dilakukan pengukuran kadar lemak. Menurut Lehninger (1982), lemak merupakan senyawa organik yang tidak larut dalam air dan dapat diekstrak dari suatu bahan dengan menggunakan pelarut non polar seperti kloroform dan eter. Lemak merupakan bahan bakar utama bagi hampir semua organisme. Hasil pengujian kadar lemak menunjukkan bahwa sampel mengandung lemak sebesar 5.46% bk. Nilai ini jauh lebih rendah bila dibandingkan dengan nilai kadar lemak daun dan ranting jarak pagar pada penelitian Windarwati (2011) yaitu sebesar 12.47%.
Komponen terakhir yang diukur adalah kadar protein. Protein merupakan sumber asam amino yang mengandung unsur C, H, O, dan N yang tidak dimiliki oleh lemak ataupun karbohidrat. Pengukuran yang dilakukan menunjukkan bahwa kadar protein sampel bernilai 11.86%.
Setelah penentuan kadar air, abu, lemak, dan protein selesai, dilakukan proses ekstraksi serbuk daun dan ranting Jatropha curcas Linn menggunakan pelarut etanol teknis 96% yang telah mengalami proses destilasi terlebih dahulu. Pemilihan etanol sebagai pelarut pada proses ekstraksi didasarkan pada sifatnya yang merupakan pelarut universal sehingga dapat melarutkan hampir semua senyawa. Penggunaan etanol juga didasarkan oleh keunggulannya sebagai pelarut zat bioaktif. Menurut Voight (1994), pelarut etanol tidak bersifat toksik, tidak menyebabkan pembengkakan membran sel, dan mampu mengendapkan albumin serta menghambat kerja enzim. Etanol juga efektif menghasikan bahan aktif yang optimal karena hanya terdapat sedikit kehilangan (loss) produk yang larut dalam pelarut.
Penelitian terhadap bahan lain seperti tembakau yang dilakukan oleh Stanisavlejic et al. (2009) juga menunjukkan hasil yang sama. Stanisavlejic et al. (2009) mengemukakan bahwa proses ekstraksi benih tembakau dengan metode soxhletasi menghasilkan rendemen tertinggi (31.1 g/100 g) dibandingkan dengan metode maserasi (19.9 g/100 g) dan ultrasonifikasi langsung (21.0 g/100 g). Sehingga dapat disimpulkan bahwa dari segi pertimbangan rendemen yang akan diperoleh, metode soxhlet lebih baik dibandingkan metode maserasi.
Sedangkan dari segi senyawa bioaktif yang akan diperoleh, penelitian Gunawan et al. (2008) mengenai ekstraksi herba meniran menunjukkan bahwa daya hambat fraksi n–heksana hasil maserasi adalah 1 mm terhadap bakteri Escherichia coli dan 0,5 mm terhadap bakteri Staphylococcus aureus, sedangkan daya hambat fraksi n–heksana hasil soxhletasi yaitu 10 mm terhadap bakteri Escherichia coli dan 12 mm terhadap bakteri Staphylococcus aureus. Hasil tersebut menunjukkan bahwa senyawa yang diperoleh dari proses ekstraksi soxhlet memiliki daya hambat yang jauh lebih tinggi dibandingkan senyawa yang di dapat dari metode maserasi. Hal ini mengindikasikan bahwa proses ekstraksi soxhlet lebih bisa menarik senyawa bioaktif yang memiliki efek antimikroba. Dengan demikian, metode soxhlet merupakan rekomendasi terbaik utnuk mengekstrak sampel bahan pada penelitian ini dengan harapan diperoleh rendemen dan senyawa bioaktif yang tinggi.
Selain metode ekstraksi soxhlet, pada penelitian ini juga dilakukan ekstraksi dengan metode maserasi untuk mewakili cara dingin. Metode maserasi dilakukan untuk mengetahui pengaruh panas pada saat proses ekstraksi terhadap kualitas ekstrak yang dihasilkan. Metode maserasi pada penelitian ini dilakukan dengan cara merendam bahan di dalam pelarut dengan perbandingan 1:2 b/v selama 24 jam. Setelah 24 jam, pelarut yang telah berisi senyawa-senyawa yang berhasil diekstrak dipisahkan dan diganti dengan pelarut baru sebanyak tiga kali penambahan.
Ekstraksi lainnya yang dilakukan pada penelitian ini adalah ekstraksi cair-cair (partisi pelarut) atau proses fraksinasi yang juga bertujuan untuk mendapatkan bahan uji berdasarkan tingkat kepolarannya. Proses fraksinasi ini dilakukan terhadap hasil ekstraksi soxhlet (ekstrak kasar soxhlet) dengan menggunakan pelarut etanol air, etil asetat dan heksan. Hasil yang diperoleh selanjtnya disebut sebagai fraksi etanol air dan fraksi etil asetat.
Rendemen ketiga bahan uji berupa ekstrak kasar, fraksi etanol air, dan fraksi etil asetat hasil metode ekstraksi soxhlet setelah freeze dryer terhadap berat sampel kering yang diekstraksi disajikan pada Tabel 2. Adapun ekstrak kasar yang diperoleh dari hasil ekstraksi dengan metode maserasi tidak diukur rendemennya karena hanya ingin dilihat pengaruh panasnya saja.
Tabel 2. Rendemen (bb) ekstrak kasar soxhlet, fraksi etanol air, dan fraksi etil asetat terhadap simplisia uji
Jenis Zat Rendemen (%) Ekstrak Kasar 12.879 Fraksi Etanol-Air 2.956 Fraksi Etil Asetat 2.605
(a) (b) (c) Gambar 8. a) Ekstrak kasar; b) Fraksi etanol air; c) Fraksi etil asetat.
B.
KOMPOSISI SENYAWA EKSTRAK/FRAKSI EKSTRAK DAUN DAN
RANTING JARAK PAGAR
Kromatografi gas-spektrometer massa (GC-MS) adalah metode yang mengkombinasikan kromatografi gas dan spektrometri massa untuk mengidentifikasi senyawa yang berbeda dalam analisis sampel. GC-MS terdiri dari dua blok bangunan utama yaitu kromatografi gas dan spektrometer massa. Kromatografi gas menggunakan kolom kapiler yang tergantung pada dimensi kolom (panjang, diameter, ketebalan film) serta sifat fase. Perbedaan sifat kimia antara molekul-molekul yang berbeda dalam suatu campuran dipisahkan dari molekul dengan melewatkan sampel sepanjang kolom. Molekul-molekul memerlukan jumlah waktu yang berbeda (disebut waktu retensi/retention time) untuk keluar dari kromatografi gas. Hal ini memungkinkan spektrometer massa untuk menangkap, mengionisasi, mempercepat, membelokkan, dan mendeteksi molekul terionisasi secara terpisah. Spektrometer massa melakukan hal ini dengan memecah masing-masing molekul menjadi ion dan mendeteksi fragmen ion menggunakan massa untuk memperoleh rasio (Anonim 2009).
Hasil analisis GC-MS yang dilakukan di Pusat Laboratorium Forensik (Puslabfor) Mabes Polri menunjukkan bahwa kandungan ekstrak/fraksi ekstrak daun dan ranting jarak pagar terdiri dari senyawa golongan steroid, terpenoid, flavonoid, dan beberapa senyawa lainnya. Senyawa-senyawa inilah yang diduga bertanggung jawab atas aktivitas antimikroba dan antioksidan yang dimiliki oleh bagian daun dan ranting tanaman jarak pagar. Tabel 3 menunjukkan senyawa yang teridentifikasi dari ekstrak kasar soxhlet, fraksi etanol air soxhlet, dan fraksi etil asetat soxhklet.
Tabel 3. Senyawa yang teridentifikasi dari ekstrak/fraksi ekstrak soxhlet daun dan ranting jarak pagar
No RT (menit) Quality (%) Berat Molekul (g/mol) Nama Senyawa Area (%) Keterangan Esktrak
Kasar Fraksi Fraksi Soxhlet Etanol
Air
Etil Asetat Terpenoid
1 8.91 94 296.53 Phytol 1.67
Diterpen (antimicrobial, anticancer, anti-inflammatory)
2 8.55 94 196.24 Loliolide 2.64 Monoterpen
3 9.24 99 278.52 Neophytadiene 5.31 1.04 Diterpen
4 10.86 97 296.53 Phytol Isomer 1.07 Diterpen
5 14.95 91 296.53 Trans-Phytol 5.63 Diterpen
6 19.87 78 218.33 Aristolone 6.38 Sesquiterpene
7 25.23 93 410.72 Squalene 7.91 Triterpen (antioksidan)
8 34.69 90 298.55 1-Dotricontanol/1-Eicosanol 7.25 Triterpen Phenolic
9 7.16 91 144.12 2,3-dihydro-3,5
–dihydroxy-6-methyl 4-Phyran-4-one 1.49 1.2
Flavonoid fraction (antimicrobial, anti-inflammatory)
10 7.76 81 290.26 Catechin 1.21 1.5 Flavonoid (antioxidant) 11 15.21 96 264.45 9,12,15-Octadecatrien-1-ol 2.04 Phenolic
Steroid
12 17.3 99 414.71 Gamma Sitosterol 33.16 6.78 Steroid Vitamin E
13 33.19 93 416.68 Gamma Tocopherol 4.59 Vitamin E/antioksidan 14 37.02 99 430.71 Alpha Tocopherol 12.92 Vitamin E/antioksidan Hydrocarbon
15 10.77 78 282.46 9-Octadecenoic Acid 4.76 Carboxylic acids 16 10.93 97 298.50 Methyl Stearate 1.21 Ester
17 11.15 97 222.24 Diethyl Phthalate/Pthalol 0.79 0.87 Organic ester
18 11.39 95 310.60 Docosane 0.95 Hydrocarbons
19 12.01 99 324.63 Tricosane 1.35 Hydrocarbons
20 12.21 93 268.48 16-Octadecanal 1.52 Aldehydes and ketones 21 12.29 90 228.38 Tetradecanoic Acid 0.44 Carboxylic acids
22 12.8 94 226.44 Hexadecane 0.75 Hydrocarbons
23 13.21 98 282.55 Eicosane 3.42 Hydrocarbons
24 13.44 89 268.48 Octadecanal 3.79 Aldehydes and ketones 25 13.47 99 256.42 Hexadecanoic Acid 4.4 6.36 2.73 Carboxylic acids
(antioksidan)
26 13.76 99 Emersol 9.03 6.28 hydrocarbons
27 14.82 99 282.25 8-Octadecanoic Acid 5.27 Carboxylic acids 28 15.31 94 282.25 Octadecanoic Acid/Vanicol 2.07 Carboxylic acids 29 16.97 95 72.06 2-Propenoic Acid 2.06 Carboxylic acids
30 26.98 97 364.69 1-Hexacosene 5.05 Hydrocarbons
Senyawa Furan
31 7.84 91 96.08 2-Furancarboxaldehyde 1.49 7.64
Pada tabel tersebut terlihat bahwa beberapa senyawa yang berhasil diidentifikasi dari ekstrak/fraksi ekstrak daun dan ranting jarak pagar antara lain adalah phytol (diterpen alcohol), diethyl phthalate (organic ester), -sitosterol (sterol), serta n-hexadecanoic acid dan octadecanoic acid (fatty acids). Senyawa-senyawa ini juga berhasil ditemukan oleh Velanggani (2011) dalam penelitiannya terhadap ekstrak etanol dari daun Mallotus philippensis (Lam.) yang juga berasal dari family Euphorbiaceae seperti jarak pagar.
Pada ekstrak kasar soxhlet dan fraksi etanol air dalam penelitian ini teridentifikasi adanya senyawa diethyl phthalate. Dalam kaitannya dengan efek pengobatan, diethyl phthalate telah digunakan untuk pembuatan 67 formulasi produk perawatan kuku, kulit, dan rambut Menurut (Kamrin 1991). WHO (2003) menyebutkan bahwa diethyl phthalate juga digunakan sebagai komponen dalam produk insektisida dan repelan penolak nyamuk sebagai pengganti kamper.
Senyawa-senyawa berupa squalene, phytol, dan vitamin E yang ditemukan pada ekstrak/fraksi ekstrak daun dan ranting jarak pagar pada penelitian ini, juga ditemukan pada tanaman obat Solanum surattense dari famili Solanaceae yang sejak dulu dipercaya memiliki khasiat obat sebagai anti kanker dan antibakteri (Hema 2011). Senyawa yang bertanggung jawab terhadap aktivitas anti kanker pada tanaman ini adalah trans-squalene (31.55%), 9,12,15-octadecatrienoic acid (Z,Z,Z)- (10.20%), phytol (8.17%) and vitamin E (7.86%).
Tabel 4 menunjukkan aktivitas biologis dari beberapa senyawa yang teridentifikasi dari ekstrak/fraksi ekstrak daun dan ranting jarak pagar dalam penelitian ini, yang juga ditemukan pada ekstrak daun Solanum surattense.
Tabel 4. Aktivitas biologis beberapa senyawa pada Jatropha curcas Linn dan Solanum surattense
No Nama Senyawa Aktivitas Biologis
1 Hexadecanoic acid, ethyl Ester
Antioxidant, hypocholesterolemic nematicide, pesticide, anti-androgenic flavor, hemolytic, 5- Alpha reductase inhibitor
2 Trans-squalene Antibacterial, Antioxidant, Antitumor, Cancer-Preventive, Chemopreventive, Immunostimulant, Lipoxygenase-Inhibitor, Perfumery, Pesticide and Sunscreen
3 Phytol Cancer-Preventive
4 Vitamin E (tocopherol) Antilupus, Antimastalgic, Antineuritic, Antinitrosaminic, Antiophthalmic, Antiosteoarthritic, Antioxidant,
Antiparkinsonian, Cancer-Preventive
Sumber: Hema (2011) berdasarkan Dr. Duke’s Phytochemical and Ethnobotanical Databases by Dr. Jim Duke of the Agricultural Research Service/USDA.
Kajian tentang kandungan senyawa aktif dari Jatropha curcas Linn juga pernah diteliti oleh Ehsan et al. (2011). Hasil analisis GC-MS menunjukkan adanya beberapa senyawa pada sampel penelitian ini yang sama seperti yang ditemukan oleh Ehsan et al. (2011) dalam penelitiannya. Senyawa tersebut adalah 2-furancarboxaldehyde dan sitosterol yang ditemukan pada fraksi ekstrak etanol air daun dan ranting jarak pagar dan bertanggung jawab terhadap aktivitas antimikroba.
dan pestisida. Furfural digunakan sebagai pemberi flavor dalam makanan dan produk lainnya, seperti kosmetik, wewangian, pestisida, herbisida, fungisida, insektisida, dan bahan pembasmi kuman (Ehsan et al. 2011).
Senyawa terpenoid merupakan metabolit utama yang ditemukan dalam famili Euphorbiaceae. Di antara golongan terpen, senyawa golongan diterpenoid-lah yang mendominasi penelitian pada spesies Jatropha sehubungan dengan struktur kimia dan aktivitasnya sebagai obat-obatan (Devappa 2011).
Sterol yang khas pada tumbuhan, sitosterol dan stigmasterol, muncul sebgai komponen sterol utama. Sementara, kolesterol hadir dalam konsentrasi yang dapat diabaikan. Sitosterol memiliki aktivitas anti-hiperlipopreteinamic, antibakteri, dan antimikotik serta telah terbukti bertindak sebagai inhibitor bagi tumor promotion secara in vivo (Yasukawa et al. 1991) dan menghambat karsinogenesis (Raicht et al. 1980). Stigmasterol terbukti secara nyata menghambat promosi tumor dalam dua tahap karsinogenesis pada tikus (Kasahara et al. 1994 dan Yasukawa et al. 1991) dan secara signifikan menunjukkan efek penghambatan pada transkripsi HIV (Akihisa et al. 2001). Adapun campuran stigmasterol dan sitosterol terbukti memiliki aktivitas anti-inflamasi setelah aplikasi secara topikal (Gomez et al. 1999). Oleh karena itu, kehadiran sterol di dalam suatu tumbuhan sangatlah berguna.
Hasil analisis GC-MS yang dilakukan terhadap ekstrak maupun fraksi ekstrak daun dan ranting jarak pagar pada penelitian ini menunjukkan adanya beberapa senyawa golongan carboxylic acid berupa dodecanoic acid, tetradecanoic acid, dan hexadecanoic acid. Senyawa-senyawa ini juga ditemukan pada penelitian yang dilakukan oleh Maya (2003) tentang kandungan senyawa tanaman Carthamus lanatus L. Selain senyawa-senyawa golongan carboxylic acid, ekstrak/fraksi ekstrak daun dan ranting jarak pagar dan Carthamus lanatus L juga mengandung komponen volatil yang sama yaitu docosane dan tricosane, komponen triterpen yaitu eicosanol, dan komponen aldehid yaitu dodecanal.
Menurut Ringbom et al. (2001), di antara senyawa-senyawa golongan asam karboksilat, asam hexadecanoid merupakan senyawa yang banyak ditemukan pada tanaman.