ABSTRACT
IRENA TITIN KARTIKA Longevity and Viability of Friesian Holstein, Simmental, and Brahman Spermatozoa of Frozen Semen in Skim Milk Extender. Directed by Prof. Dr. Dra. R. Iis Arifiantini, MSi.
Indonesia had two artificial insemination centre and more than 17 regional artificial insemination centre. Before distributed to farmers, the quality of frozen semen has to be laboratory tested periodically. According to the Indonesian National Standard the parameters assessed in the laboratory are sperm motility and individual scoring. The aim of this study was to test the sperm motility, viability and longevity of frozen semen from three cow breeds which are FH, Simmental and Brahman produced by one of the regional artificial insemination centers and to fine out the relationship between sperm motility and its viability among breed. Results showed that post thawing motility of the FH bull was 50.00±0.00% which was significantly higher than Simmental 43.50±2.42% or Brahman 43.33±2.50% bull. A decrease in motility and viability showed an association motility with the percentage of live spermatozoa. They were no differences in sperm longevity among breeds. The motility of all samples decreased and reached 0% motility in 5 hours. The decrease in sperm motility and viability is caused by the decrease in energy sources and the accumulation of toxic waste of metabolized diluents. In conclusion, the FH bull had the best post thawing motility and viability compared to Simmental and Brahman bull. Based on the Indonesian National Standard all sample could be used for insemination.
RINGKASAN
IRENA TITIN KARTIKA Longivitas dan Viabilitas Spermatozoa Sapi Friesian Holstein, Simmental, dan Brahman dalam Semen Beku Menggunakan Pengencer Skim. Dibimbing oleh Prof. Dr. Dra. R. Iis Arifiantini, MSi.
Indonesia memiliki dua Balai Inseminasi Buatan Nasional dan lebih dari 17 Balai Inseminasi Buatan Daerah (BIBD). Sebelum didistribusikan ke peternak, semen beku yang diproduksi diuji secara berkala di laboratorium yang memiliki kompetensi sama. Berdasarkan Standar Nasional Indonesia (SNI), parameter yang diuji di laboratorium adalah motilitas spermatozoa dan skoring individu. Penelitian ini bertujuan untuk menguji motilitas, viabilitas dan longivitas spermatozoa dari semen beku sapi FH, Simmental dan Brahman yang diproduksi oleh salah satu BIBD dan untuk mempelajari hubungan antara motilitas dan viabilitas spermatozoa dari masing-masing bangsa sapi. Hasil penelitian ini menunjukkan nilai post thawing motility (PTM) sapi FH 50.00±0.00% yang secara signifikan lebih tinggi dibandingkan Simmental 43.50±2.42% dan Brahman 43.33±2.50%. Penurunan motilitas yang sebanding dengan penurunan viabilitas menunjukkan hubungan antara persentase spermatozoa hidup dengan motilitas spermatozoa. Tidak ada perbedaan longivitas spermatozoa yang nyata antara ketiga bangsa sapi. Seluruh bangsa sapi mengalami penurunan motilitas dan mencapai motilitas 0% pada jam ke-5 inkubasi. Penurunan motilitas dan viabilitas spermatozoa disebabkan oleh penurunan ketersediaan sumber energi dan akumulasi toksik dari sisa metabolisme bahan pengencer. Dari penelitian ini, dapat disimpulkan bahwa Sapi FH memiliki motilitas dan viabilitas post thawing terbaik jika dibandingkan dengan Simmental dan Brahman. Berdasarkan SNI, seluruh sampel dapat digunakan untuk inseminasi buatan.
LONGIVITAS DAN VIABILITAS SPERMATOZOA
SAPI FRIESIAN HOLSTEIN, SIMMENTAL, DAN
BRAHMAN DALAM SEMEN BEKU MENGGUNAKAN
PENGENCER SKIM
IRENA TITIN KARTIKA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul Longivitas dan Viabilitas Spermatozoa Sapi Friesian Holstein, Simmental, dan Brahman dalam Semen Beku Menggunakan Pengencer Skim adalah karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal dan dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka pada bagian akhir skripsi ini.
Bogor, Juli 2012
ABSTRACT
IRENA TITIN KARTIKA Longevity and Viability of Friesian Holstein, Simmental, and Brahman Spermatozoa of Frozen Semen in Skim Milk Extender. Directed by Prof. Dr. Dra. R. Iis Arifiantini, MSi.
Indonesia had two artificial insemination centre and more than 17 regional artificial insemination centre. Before distributed to farmers, the quality of frozen semen has to be laboratory tested periodically. According to the Indonesian National Standard the parameters assessed in the laboratory are sperm motility and individual scoring. The aim of this study was to test the sperm motility, viability and longevity of frozen semen from three cow breeds which are FH, Simmental and Brahman produced by one of the regional artificial insemination centers and to fine out the relationship between sperm motility and its viability among breed. Results showed that post thawing motility of the FH bull was 50.00±0.00% which was significantly higher than Simmental 43.50±2.42% or Brahman 43.33±2.50% bull. A decrease in motility and viability showed an association motility with the percentage of live spermatozoa. They were no differences in sperm longevity among breeds. The motility of all samples decreased and reached 0% motility in 5 hours. The decrease in sperm motility and viability is caused by the decrease in energy sources and the accumulation of toxic waste of metabolized diluents. In conclusion, the FH bull had the best post thawing motility and viability compared to Simmental and Brahman bull. Based on the Indonesian National Standard all sample could be used for insemination.
RINGKASAN
IRENA TITIN KARTIKA Longivitas dan Viabilitas Spermatozoa Sapi Friesian Holstein, Simmental, dan Brahman dalam Semen Beku Menggunakan Pengencer Skim. Dibimbing oleh Prof. Dr. Dra. R. Iis Arifiantini, MSi.
Indonesia memiliki dua Balai Inseminasi Buatan Nasional dan lebih dari 17 Balai Inseminasi Buatan Daerah (BIBD). Sebelum didistribusikan ke peternak, semen beku yang diproduksi diuji secara berkala di laboratorium yang memiliki kompetensi sama. Berdasarkan Standar Nasional Indonesia (SNI), parameter yang diuji di laboratorium adalah motilitas spermatozoa dan skoring individu. Penelitian ini bertujuan untuk menguji motilitas, viabilitas dan longivitas spermatozoa dari semen beku sapi FH, Simmental dan Brahman yang diproduksi oleh salah satu BIBD dan untuk mempelajari hubungan antara motilitas dan viabilitas spermatozoa dari masing-masing bangsa sapi. Hasil penelitian ini menunjukkan nilai post thawing motility (PTM) sapi FH 50.00±0.00% yang secara signifikan lebih tinggi dibandingkan Simmental 43.50±2.42% dan Brahman 43.33±2.50%. Penurunan motilitas yang sebanding dengan penurunan viabilitas menunjukkan hubungan antara persentase spermatozoa hidup dengan motilitas spermatozoa. Tidak ada perbedaan longivitas spermatozoa yang nyata antara ketiga bangsa sapi. Seluruh bangsa sapi mengalami penurunan motilitas dan mencapai motilitas 0% pada jam ke-5 inkubasi. Penurunan motilitas dan viabilitas spermatozoa disebabkan oleh penurunan ketersediaan sumber energi dan akumulasi toksik dari sisa metabolisme bahan pengencer. Dari penelitian ini, dapat disimpulkan bahwa Sapi FH memiliki motilitas dan viabilitas post thawing terbaik jika dibandingkan dengan Simmental dan Brahman. Berdasarkan SNI, seluruh sampel dapat digunakan untuk inseminasi buatan.
©
Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
LONGIVITAS DAN VIABILITAS SPERMATOZOA
SAPI FRIESIAN HOLSTEIN, SIMMENTAL, DAN
BRAHMAN DALAM SEMEN BEKU MENGGUNAKAN
PENGENCER SKIM
IRENA TITIN KARTIKA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Longivitas dan Viabilitas Spermatozoa Sapi Friesian Holstein, Simmental, dan Brahman dalam Semen Beku Menggunakan Pengencer Skim.
Nama : Irena Titin Kartika
NRP : B04080063
Program Studi : Kedokteran Hewan, Institut Pertanian Bogor
Disetujui
Pembimbing
Prof. Dr. Dra. R. Iis Arifiantini, MSi NIP. 19600804 198103 2 001
Diketahui
Wakil Dekan Fakultas Kedokteran Hewan IPB
Drh. Agus Setiyono, MS, Ph.D, AP Vet NIP. 19630810 198803 1 004
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Kuasa yang telah memberikan
Kasih, Rahmat dan Karunia-Nya kepada penulis sehingga penulisan skripsi yang
berjudul “Longivitas dan Viabilitas Spermatozoa Sapi Friesian Holstein,
Simmental, dan Brahman dalam Semen Beku Menggunakan Pengencer Skim.” dapat diselesaikan.
Pada kesempatan ini, penulis ingin mengucapkan terima kasih kepada:
1. Prof. Dr. Dra. R. Iis Arifiantini, MSi selaku pembimbing yang telah mengarahkan, membimbing, dan membantu penulis selama ini.
2. Prof. Dr. Drh. I Wayan Teguh Wibawan, MS dan Drh Adi Winarto, PhD, PAVet sebagai dosen penguji.
3. Drh. Abdulgani Amri Siregar, MS selaku dosen pembimbing akademik penulis atas segala bimbingannya selama ini.
4. Dr. drh. Amrozi selaku kepala Unit Rehabilitasi dan Reproduksi (URR) FKH IPB yang telah memberikan izin melakukan penelitian di laboratorium fisiologi reproduksi, serta kepada Bapak Bondan, Bapak dan Ibu Anda serta segenap staf URR atas bantuan yang diberikan selama penelitian.
5. Bapak, Bunda, Dek Arnold, dan seluruh keluarga besar penulis yang selalu memberikan kasih sayang, doa, semangat, dan dukungannya kepada penulis.
6. Teman-teman satu penelitian; Ines, Rizal, dan Rice yang telah membantu penulis hingga dapat menyelesaikan penelitian ini.
7. Sahabatku Hana, Moniq, Lynn, Arca, Rio, Titus atas dukungan dan kebersamaannya.
8. Teman-teman Kos Kenanga 14; Tante Soebadi, Moniq, Riri, Rio, Irwan, Josia, Davin, Eka, Anand, Andrew.
9. Keluarga Puella Domini, terimakasih untuk menjadi tempatku berpulang dan berbagi, Team VLC, Team Choir VLD, Koor Paroki Katedral BMV Bogor. 10. Kak Fitri, Kak Tendy, Kak Imel, Ko Melvin, Kak Leo, Kak Isye, Kak Yuni, Kak
Ayu dan Kak Luci atas kebersamaan, dukungan, doa dan ilmunya.
11. Keluarga besar Himpro Satwaliar FKH IPB dan Forum Chelonia Indonesia. 12. Semua pihak yang telah membantu penulis dalam menyelesaikan skripsi ini.
Penulis menyadari skripsi ini masih jauh dari sempurna, untuk itu penulis
mengucapkan terima kasih atas kritik dan saran yang sifatnya membangun dari
semua pihak demi kesempurnaan skripsi ini. Penulis berharap semoga skripsi ini
dapat bermanfaat bagi pembaca.
RIWAYAT HIDUP
Penulis lahir di Bukittinggi, Sumatera Barat pada tanggal 10 Oktober 1990
dari Ayah Antonius Didik Triyanto dan Ibunda Margaretha Nusana
Kusumaningsih. Penulis merupakan putri pertama dari dua bersaudara.
Penulis menempuh pendidikan dasar di SD Fransiskus Bukittinggi dan lulus
pada tahun 2002, kemudian melanjutkan pendidikan formal di SMP Xaverius
Bukittinggi dan lulus pada tahun 2005. Pendidikan SMA penulis selesaikan di
SMA Negeri 1 Kota Bukittinggi, Sumatera Barat dan lulus pada tahun 2008. Pada
tahun yang sama penulis diterima di Fakultas Kedokteran Hewan Institut
Pertanian Bogor melalui jalur Undangan Saringan Masuk IPB (USMI).
Selama menjadi mahasiswa, penulis aktif dalam organisasi intrakampus
seperti menjadi anggota PSM Agriaswara IPB, anggota Himpunan Minat Profesi
Satwaliar FKH IPB, menjadi pengurus UKM Keluarga Mahasiswa Katolik IPB
DAFTAR ISI
Halaman
DAFTAR TABEL ...xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 2
Manfaat ... 2
TINJAUAN PUSTAKA Tinjauan Umum Sapi FH, Simmental, dan Brahman ... 3
Sapi Friesian Holstein ... 3
Sapi Simmental ... 3
Sapi Brahman ... 4
Semen Beku ... 5
Viabilitas dan Longivitas ... 5
MATERI DAN METODE Materi ... 7
Sampel ... 7
Metode ... 7
Thawing Semen Beku ... 7
Pengujian Kualitas ... 7
Analisis Data... 8
HASIL DAN PEMBAHASAN Kualitas Semen Beku Sapi FH ... 9
Kualitas Semen Beku Sapi Simmental ... 10
Kualitas Semen Beku Sapi Brahman ... 11
Longivitas Spermatozoa ... 11
Viabilitas Spermatozoa ... 14
SIMPULAN ... 18
DAFTAR PUSTAKA ... 19
DAFTAR TABEL
Halaman
Tabel 1 Motilitas (%) spermatozoa sapi FH, Simmental, dan Brahman yang diinkubasi pada suhu 37oC selama 5 jam ... 12
DAFTAR GAMBAR
Halaman
Gambar 1 Sapi Friesian Holstein ... 3
Gambar 2 Sapi Simmental ... 4
Gambar 3 Sapi Brahman ... 4
Gambar 4 Grafik Longivitas dan Viabilitas Spermatozoa Sapi Friesian Holstein 10
Gambar 5 Grafik Longivitas dan Viabilitas Spermatozoa Sapi Simmental ... 10
Gambar 6 Grafik Longivitas dan Viabilitas Spermatozoa Sapi Brahman ... 11
Gambar 7 Grafik Longivitas Spermatozoa Sapi Friesian Holstein, Simmental, dan Brahman ... 13
Gambar 8 a dan b Gambar spermatozoa mati, c Gambar spermatozoa hidup dengan pewarnaan Eosin Nigrosin ... 14
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Persentase Motilitas dan Viabilitas Spermatozoa Sapi Friesian Holstein ... 23
Lampiran 2 Persentase Motilitas dan Viabilitas Spermatozoa Sapi Simmental 23
Lampiran 3 Persentase Motilitas dan Viabilitas Spermatozoa Sapi Brahman. .. 24
Lampiran 4 Analisis Motilitas Sapi... 24
PENDAHULUAN
Latar Belakang
Sapi merupakan ternak ruminansia dari famili Bovidae, seperti halnya
bison, banteng, kerbau (Bubalus), kerbau Afrika (Syncherus), dan anoa. Secara umum bahwa ternak sapi dapat dikelompokkan dalam empat bagian besar
berdasarkan tujuannya yaitu ternak sapi potong, sapi perah, sapi pekerja dan
sapi dwiguna. Jenis sapi yang dikembangkan di Indonesia antara lain Sapi
Friesian Holstein (FH), Sapi Brahman, Sapi Simmental, Sapi Limousin, Sapi
Peranakan Ongol (PO), Sapi Brangus, Sapi Angus, Sapi Bali dan Sapi Madura.
Inseminasi Buatan (IB) merupakan salah satu metode peningkatan
produksi ternak yang lazim dan mudah diaplikasikan di Indonesia. Keberhasilan
IB diantaranya dipengaruhi oleh kualitas semen yang digunakan. Di Indonesia
saat ini sebagian besar program IB menggunakan semen beku dan terdapat
standar mutu yang ditetapkan dalam SNI 01-4869.1-2005, yaitu motilitas
spermatozoa dari semen beku setelah thawing atau disebut post thawing motility (PTM) minimal 40% dan gerakan individu spermatozoa minimal 2 (skala 1-5).
Penetapan standar mutu semen beku yang didistribusikan ke masyarakat juga
menggunakan manajemen mutu ISO 17025:2005 yaitu melalui uji antar
laboratorium dengan kompetensi dan standar laboratorium yang sama secara
berkala. Hal ini dilakukan untuk meningkatkan dan menjamin kualitas semen
beku yang dihasilkan oleh suatu instansi.
Fertilisasi adalah proses terjadinya pembuahan ovum oleh spermatozoa.
Menurut Morell dan Rodriguez-Martinez (2009) spermatozoa yang memiliki
kromatin yang utuh, morfologi normal, serta memiliki viabilitas dan motilitas yang
baik adalah populasi spermatozoa yang memiliki kemampuan fertilisasi.
Keberhasilan pembekuan semen juga bisa dilihat dari nilai recovery rate (RR) yaitu jumlah spermatozoa yang berhasil pulih dari proses pembekuan (Hafez
2000) dan daya tahan hidup spermatozoa in vitro setelah di-thawing yang disebut dengan longivitas (Arifiantini et al. 2005a). Mengingat pentingnya pengujian kualitas semen beku dalam menentukan keberhasilan IB, dan banyaknya semen
beku sapi FH, Simmental dan Brahman yang digunakan saat ini di masyarakat
peternak, maka penelitian ini bertujuan untuk menguji motilitas, viabilitas dan
longivitas spermatozoa dari semen beku sapi FH, Simmental dan Brahman yang
Tujuan
Penelitian ini bertujuan untuk menguji motilitas, viabilitas dan longivitas
spermatozoa dari semen beku sapi FH, Simmental dan Brahman yang diproduksi
oleh salah satu balai IB daerah dan mempelajari hubungan antara motilitas dan
viabilitas spermatozoa dari ketiga bangsa sapi tersebut.
Manfaat
Hasil penelitian ini diharapkan dapat memberikan informasi daya tahan
spermatozoa dari tiga bangsa sapi berbeda yang banyak dikembangbiakkan di
TINJAUAN PUSTAKA
Tinjauan umum sapi FH, Simmental, dan Brahman
Sapi Friesian Holstein
Sapi Friesian Holstein (FH) berasal dari provinsi Belanda Utara dan
provinsi Friesland Barat. Ciri sapi FH antara lain rambutnya berwarna belang
hitam putih. Di bagian dahi terdapat warna putih berbentuk segitiga, kaki bagian
bawah dan bulu ekornya berwarna putih, serta memiliki tanduk pendek yang
mengarah ke depan. Sapi FH tergolong sapi yang lambat dewasa. Sifat sapi FH
yang tenang dan jinak memudahkan pengendalian sapi saat diberi perlakuan.
Sapi FH memiliki kuantitas produksi susu yang paling tinggi dibandingkan
dengan bangsa sapi perah lainnya. Di Amerika Serikat produksi susunya dapat
mencapai 5.755 kg dalam satu masa laktasi (± 10 bulan). Sedangkan di
Indonesia, rata-rata produksi sapi FH adalah 10 liter per ekor per hari (Syarif &
Harianto 2011).
Sapi Simmental
Sapi Simmental merupakan sapi bangsa Bos taurus yang berasal dari Swiss. Sapi ini cocok dipelihara di daerah beriklim sedang dan bersifat dwiguna,
yaitu menghasilkan daging dan memiliki produksi susu yang baik. Sapi
Simmental memiliki warna coklat muda kemerahan dengan bagian wajah, tubuh
bagian bawah, lutut, hingga ujung ekor berwarna putih. Sapi ini memiliki tubuh
besar, kekar, dan berotot. Pertumbuhannya sangat baik dengan persentase
karkas tinggi dan sedikit lemak. Bobot badan Simmental dewasa dapat mencapai
1200 kg/ekor (Fikar & Ruhyadi 2010).
Sapi Brahman
Sapi Brahman merupakan keturunan sapi zebu (Bos indicus) yang berasal dari India. Sapi Brahman ditandai dengan punuk yang besar di atas bahu, tetapi
pada betina punuk tersebut lebih kecil. Di rahang hingga ujung dada tumbuh
gelambir yang lebar dengan banyak lipatan, memiliki berukuran tubuh besar dan
panjang. Kulit sapi jantan berwarna putih keabuan, sedangkan kulit sapi betina
berwarna putih keabuan dan kemerahan. Kepala panjang dengan telinga besar
dan rebah menghadap ke bawah (Fikar & Ruhyadi 2010). Sapi Brahman cocok
dengan kondisi Indonesia. Seperti sapi kelompok zebu, sapi Brahman mudah
beradaptasi terhadap suhu panas, makanan yang sederhana, dan tahan gigitan
caplak (Sudarmono & Sugeng 2008).
Gambar 2 Sapi Simmental (Sumber: www.teara.govt.nz)
Gambar 3 Sapi Brahman
Semen Beku
Semen beku adalah semen yang telah melalui proses pengenceran dan
disimpan dalam nitrogen cair yang memiliki suhu -196oC. Proses pembuatan
semen beku meliputi : pemeriksaan semen segar, pengenceran, pencetakan
label, pengisian dan pengemasan straw serta pembekuan. Pemeriksaan semen segar dilakukan secara makroskopis dan mikroskopis. Kemudian semen yang
memenuhi standar akan dicampurkan dengan bahan pengencer yang
mengandung sumber energi, krioprotektan, zat untuk menjaga tekanan osmotik
spermatozoa dan antibiotika dengan volume tertentu yang sesuai dengan
konsentrasi spermatozoa.
Pengenceran dilakukan untuk meningkatkan volume semen sehingga
jumlah betina yang dibuahi semakin banyak dan efisien dalam dosis yang sesuai
untuk inseminasi buatan. Semen yang digunakan untuk IB yang melalui tahap
kriopreservasi dikemas dalam straw yang memiliki volume 0,25 ml dan mengandung 20 juta sel spermatozoa (Ball & Peters 2004). Straw yang
digunakan memiliki warna yang berbeda-beda untuk tiap bangsa sapi, misalnya
warna abu-abu untuk bangsa FH, warna putih transparan untuk bangsa
Simmental dan warna biru tua untuk sapi dari bangsa Brahman. Straw terlebih dahulu diberi keterangan mengenai jenis dan nama pejantan, kode pejantan,
batch number dan produsen semen beku. Setelah itu dilanjutkan dengan proses pengisian dan pengemasan, yaitu semen cair dimasukkan ke dalam straw dan dilakukan penutupan ujung straw, diequilibrasi dan dilanjutkan proses pembekuan semen kemudian disimpan dalam Nitrogen cair (Nilna 2010). Hal
yang harus diperhatikan dalam pembuatan semen beku adalah pencegahan
kristalisasi air yang terdapat dalam sel. Karena itu bahan pengencer semen
ditambahkan gliserol yang berguna untuk mendehidrasi spermatozoa sebelum
membeku dan mengubah bentuk kristal es yang dapat membunuh spermatozoa
(Campbell et al. 2003).
Viabilitas dan Longivitas
Viabilitas spermatozoa (viable sperm) adalah salah satu indikator untuk menguji spermatozoa yang hidup dengan membran yang masih utuh. Viabilitas
spermatozoa biasanya dinilai dengan memeriksa motilitas dan rasio hidup/mati
(Barth & Oko 1989). Viabilitas spermatozoa dapat diuji dengan berbagai macam
pewarnaan Flourscent (He & Woods 2004), pewarnaan bizBenzimide Hoechst
(Asturiano 2007) atau menggunakan pewarnaan eosin nigrosin (Barth & Oko
1989). Komponen warna eosin nigrosin akan masuk ke dalam membran sel yang
rusak dan akan mewarnai membran sel menjadi merah ungu. Sel spermatozoa
yang memiliki membran utuh tidak menyerap warna yang diberikan sehingga
tetap jernih dan terlihat kontras dengan latar gelap yang ditimbulkan oleh nigrosin
pada pewarnaan eosin nigrosin. Keutuhan membran plasma spermatozoa
merupakan hal yang sangat memengaruhi fungsi spermatozoa; proses
pembekuan dan thawing dapat merusak struktur membran plasma (Gordon 2005).
Longivitas atau daya tahan hidup adalah kemampuan spermatozoa
bertahan dalam temperatur tertentu (Arifiantini et al. 2005a). Longivitas spermatozoa biasanya diuji pada suhu 37oC, Balai Inseminasi Buatan Lembang
menyebutnya incubator test, yaitu selama 4 jam masih harus memiliki motilitas spermatozoa sebanyak 10%, untuk bisa didistribusikan semen bekunya ke
Peternak. Arifiantini et al. (2005a), melakukan uji longivitas spermatozoa dari semen beku sapi FH dengan berbagai bahan pengencer dan bertahan sampai
dengan 9 jam .
Menurut Birkhead et al. (2009) Longivitas merupakan respon adaptasi spermatozoa dalam kompetisi sperma. Longivitas dapat ditentukan dengan
mengetahui kapan metabolisme spermatozoa kembali aktif dengan
menggunakan sumber energinya, atau dengan mengetahui sperm senescene (peningkatan risiko kematian dan penurunan efisiensi fertilisasi hingga
spermatozoa mati), selain aspek-aspek lain yang memengaruhi kematian
spermatozoa. Longivitas spermatozoa dapat dievaluasi dengan melihat motilitas
progresif spermatozoa dalam interval 1 jam pada suhu 37oC (Cowell & Tyler
2002). Motilitas spermatozoa merupakan indikator penting dari keberhasilan
MATERI DAN METODE
Penelitian ini dilakukan pada bulan Juli 2011 hingga Maret 2012, di
Laboratorium Fisiologi Reproduksi, Unit Reproduksi dan Rehabilitasi,
Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan,
Institut Pertanian Bogor.
Materi
Sampel
Penelitian ini menggunakan 30 straw semen beku dari salah satu balai IB daerah, masing-masing 10 straw sapi FH, 10 straw sapi Brahman dan 10 straw sapi Simmental yang menggunakan pengencer susu skim. Sampel disimpan
dalam container Nitrogen cair dengan suhu -196oC.
Metode
Thawing Semen Beku
Straw semen beku diambil dari container menggunakan pinset, kemudian di-thawing dalam air bersuhu 37oC selama 30 detik. Semen dalam straw dikeluarkan dengan cara menggunting sumbat laboratorium yang terdapat pada
bagian ujung dari straw, bagian yang terbuka diarahkan ke tabung eppendorf lalu sumbat pabrik digunting hingga seluruh semen yang terdapat dalam straw masuk dalam tabung tersebut. Tabung eppendorf selanjutnya disimpan dalam water bath suhu 37oC.
Pengujian Kualitas
a. Motilitas
Sebanyak 10 µL semen diambil menggunakan mikro pipet diteteskan pada
object glass yang telah dihangatkan kemudian ditutup dengan cover glass. Pengamatan dilakukan menggunakan mikroskop perbesaran objektif 10x10
dalam 10 lapang pandang. Penilaian diberikan dalam kisaran 0-100%.
b. Viabilitas
Sebanyak 10µL semen diletakkan pada glass object, ditambah pewarna eosin nigrosin 20µL, dihomogenkan dan dibuat preparat ulas dari campuran
10x40. Spermatozoa yang hidup tidak menyerap warna dan spermatozoa
yang mati akan menyerap warna. Spermatozoa yang hidup dan mati dihitung
dalam 10 lapang pandang, dan evaluasi dilakukan setiap 60 menit.
Persentase spermatozoa hidup dihitung menggunakan rumus:
c. Longivitas
Logivitas spermatozoa diketahui dengan mengevaluasi motilitas spermatozoa
yang diinkubasi pada suhu 37oC setiap 60 menit hingga motilitas spermatozoa
0% (Arifiantini et al. 2005a).
Analisis Data
Penelitian ini dirancang menggunakan rancangan acak lengkap (RAL).
Kemudian data yang diperoleh dianalisis menggunakan Anova dan uji lanjut
Duncans (program SAS 9.1.3.), data disajikan dalam bentuk rataan ± simpangan
HASIL DAN PEMBAHASAN
Sapi merupakan ternak yang dikembangkan di Indonesia sebagai salah
satu sumber protein hewani. Sapi FH, Simmental dan Brahman merupakan tiga
dari beberapa bangsa sapi yang dikembangkan di Indonesia yang memiliki
keunggulan masing-masing. Kualitas, kuantitas dan efisiensi produksi menjadi
hal penting dalam budidaya ternak sapi. Oleh karena itu, dibutuhkan indukan
yang unggul sehingga dapat menghasilkan keturunan yang unggul dan
menguntungkan. Salah satu cara meningkatkan kualitas keturunan adalah
menggunakan teknologi inseminasi buatan menggunakan semen yang terjamin
kualitasnya.
Semen beku adalah semen yang telah ditambahkan bahan pengencer,
dikemas dalam kemasan tertentu dan disimpan pada nitrogen cair (-196 oC ).
Kualitas spermatozoa yang diproduksi oleh suatu balai inseminasi buatan
dievaluasi secara berkala (ISO 17025:2005) melalui uji banding antar
laboratorium dengan parameter pemeriksaan motilitas, gerakan individu dan
persentase hidup mati spermatozoa. Selain parameter-parameter tersebut, yang
biasa dilakukan segera setelah thawing adalah evaluasi daya tahan dan kualitas spermatozoa yang dapat diketahui melalui evaluasi longivitas dan viabilitas
spermatozoa. Spermatozoa yang berkualitas adalah spermatozoa yang mampu
memfertilisasi ovum. Syarat spermatozoa yang mampu memfertilisasi adalah
spermatozoa yang memiliki kromatin utuh, morfologi normal, serta memiliki
viabilitas dan motilitas yang baik (Morell & Rodriguez-Martinez 2009).
Pemeriksaan motilitas dan viabilitas merupakan cara mendapatkan spermatozoa
yang berkualitas dan mendekati syarat spermatozoa yang memiliki kemampuan
fertilisasi.
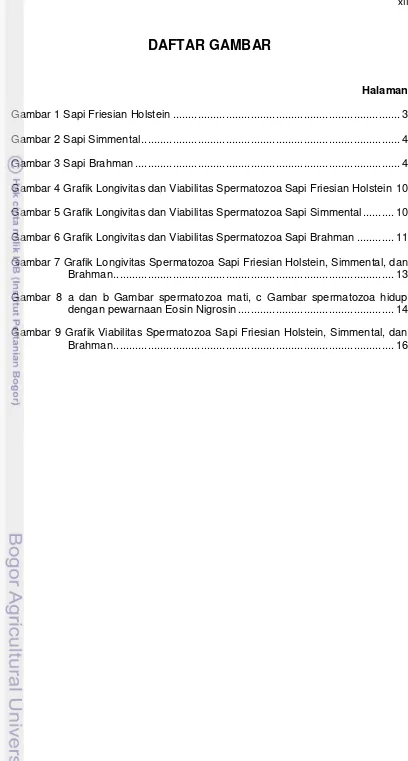
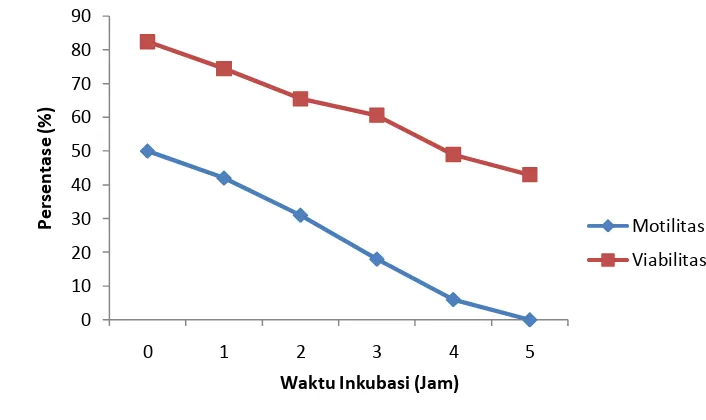
Kualitas Semen Beku Sapi FH
Pada penelitian ini, sapi FH memiliki motilitas post thawing sebesar 50.00±0.00% dan viabilitas 82.39±3.12%. Motilitas dan viabilitas spermatozoa
sapi FH semakin menurun sejalan dengan waktu inkubasi, hingga persentase
motilitas mencapai nol pada pengamatan jam ke-5 (Gambar 4). Penurunan
motilitas dan viabilitas spermatozoa pada semen sapi FH antar jam pengamatan
Kualitas Semen Beku Sapi Simmental
Motilitas dan viabilitas spermatozoa sapi Simmental post thawing menunjukkan nilai 43.50±2.42% dan 62.57±3.98%. Sapi Simmental mampu
mempertahankan motilitas (longivitas) hingga pengamatan pada jam ke-5.
Selama inkubasi pada suhu 37 oC, terlihat penurunan viabilitas spermatozoa
(Gambar 5). Penurunan motilitas dan viabilitas spermatozoa sapi Simmental
adalah antara 8.70% dan 5.79% untuk setiap jam selama 5 jam inkubasi.
0 10 20 30 40 50 60 70 80 90
0 1 2 3 4 5
P e rs e n ta se (% )
Waktu Inkubasi (Jam)
Motilitas Viabilitas 0 10 20 30 40 50 60 70
0 1 2 3 4 5
P e rs e n ta se (% )
Waktu Inkubasi (Jam)
motilitas
viabilitas
Gambar 4 Grafik Longivitas Spermatozoa Sapi Friesian Holstein
Kualitas Semen Beku Sapi Brahman
Pada evaluasi post thawing, semen beku sapi Brahman memiliki motilitas 43.33±2.50% dan viabilitas 64.65±4.62%. Pada Gambar 6, terlihat penurunan
persentase motilitas dan viabilitas hingga jam ke-5 pengamatan. Rata-rata
penurunan motilitas dan viabilitas spermatozoa sapi Brahman setiap jam selama
inkubasi adalah 8.67% dan 6.47%.
Longivitas Spermatozoa
Longivitas atau daya tahan hidup adalah kemampuan spermatozoa
bertahan dalam temperatur tertentu (Arifiantini et al. 2005a). Longivitas spermatozoa diketahui melalui evaluasi motilitas progresif dalam interval 1 jam
pada suhu 37 oC (Cowell & Tyler 2002). Motilitas spermatozoa penting untuk
fertilisasi oosit dan menopang perkembangan embrio (Foote 2003). Berdasarkan
standar mutu semen beku menurut SNI 01-4869.1-2005, yaitu motilitas
spermatozoa dari semen beku setelah pencairan atau disebut post thawing motility (PTM) minimal 40%.
Hasil evaluasi spermatozoa semen beku sapi FH, Simmental dan Brahman
pada penelitian ini menunjukkan nilai yang sesuai dengan persyaratan PTM
menurut SNI, yaitu motilitas post thawing (jam ke-0) sapi FH 50.00±0.00 %, sapi Simmental 43.50±2.42% dan sapi Brahman 43.33±2.50%.
0 10 20 30 40 50 60 70
0 1 2 3 4 5
P
e
rs
e
n
ta
se
(%
)
Waktu Inkubasi (Jam)
motilitas
viabilitas
Tabel 1 Motilitas (%) spermatozoa dari FH, Simmental, dan Brahman yang diikubasi pada suhu 37 oC selama 5 jam
Waktu Pengamatan (Jam)
Jenis Sapi
FH Simmental Brahman
0 50.00 ± 0.00a 43.50 ± 2.42b 43.33 ± 2.50b 1 41.88 ± 2.58a 34.00 ± 2.24b 33.33 ± 2.58b 2 32.35±2.44a 21.00±4.18c 25.90±3.54b 3 18.00 ± 6.75a 12.50 ± 2.64b 13.33 ± 4.08ab 4 6.00 ± 3.16a 3.75 ± 2.31a 5.00 ± 3.54a
5 0.00 ± 0.00a 0.00 ± 0.00a 0.00 ± 0.00a
Huruf kecil superskrip yang berbeda yang mengikuti angka pada baris yang sama menyatakan perbedaan yang nyata (p<0,05)
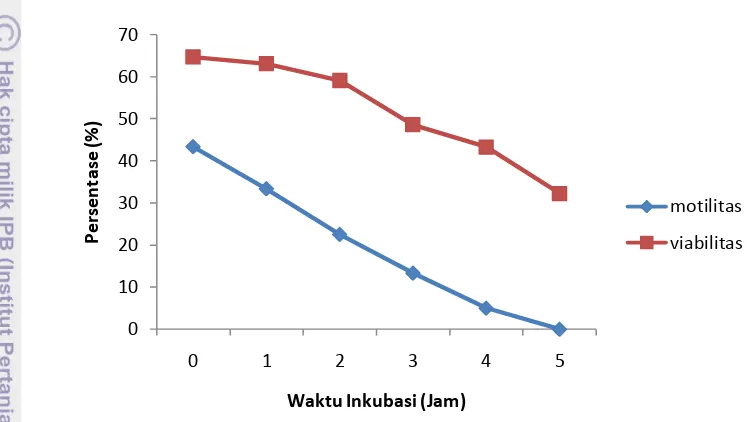
Hasil inkubasi spermatozoa pada suhu 37oC menunjukkan penurunan
motilitas spermatozoa pada seluruh jenis sapi yang diteliti hingga motilitas
menunjukkan nilai nol pada pengamatan jam ke-5 (Tabel 1). Hal ini menunjukkan
bahwa pertambahan waktu memiliki hubungan terhadap penurunan motilitas
spermatozoa. Penurunan motilitas spermatozoa sapi FH, Brahman dan
Simmental berkisar antara 3.75% sampai dengan 13% tiap jam. Penurunan
signifikan persentase motilitas spermatozoa dari semen beku yang diinkubasi
pada suhu 37oC terjadi karena suhu 37oC merupakan suhu optimal metabolisme
spermatozoa.
Pengujian longivitas spermatozoa di Balai Inseminasi Buatan Lembang
pada suhu 37oC (incubator test) mensyaratkan pada jam ke 4 spermatozoa memiliki motilitas minimal 10% sehingga semen beku dapat didistribusikan.
Namun, seluruh semen beku yang dievaluasi pada penelitian ini memiliki
motilitas dibawah 10% pada jam ke 4 pengamatan, yaitu motilitas 6.00 ± 3.16 %
sapi FH, motilitas 3.75 ± 2.31 % sapi Simmental dan motilitas 5.00 ± 3.54 % sapi
Brahman.
Penurunan motilitas dari ketiga bangsa sapi, terlihat sapi FH memiliki nilai
motilitas lebih baik dibandingkan dengan sapi Simmental dan Brahman pada
setiap jam pengamatan. Penurunan motilitas spermatozoa (Gambar 7) terjadi
karena terjadi kerusakan spermatozoa selama kriopreservasi dan thawing. Penyebab utama kerusakan sel selama kriopreservasi adalah pembentukan es
intraseluler (Mazur & Schneider 1984), menyebabkan kerusakan membran dan
hilangnya keutuhan akrosom (Szasz et al. 2000) dan adanya peningkatan tekanan osmotik dan pengaruh toksik dari gliserol yang sering digunakan sebagai
kerusakan, maka metabolisme spermatozoa akan terganggu dan mulai
kehilangan motilitasnya sehingga mengakibatkan kematian spermatozoa
(Yulnawati & Setiadi 2005). Spermatozoa yang mati mengurangi konsentrasi
sperma yang fertil, juga toksik bagi sperma lain yang masih hidup (Arifiantini et al. 2005b).
Ekor spermatozoa merupakan penggerak spermatozoa. Mitokondria yang
terdapat pada bagian midpiece ekor spermatozoa memproduksi energi untuk menggunakan aksonema dan menyebabkan spermatozoa bergerak maju
(Garner & Hafez 2000). Ketika terjadi perubahan suhu yang signifikan (cold shock) karena proses pembekuan dan thawing akan mempengaruhi membran plasma spermatozoa, yaitu terjadinya perubahan konfigurasi membran plasma.
Jika terjadi perubahan konfigurasi membran plasma pada midpiece, maka enzim aspartat aminotransferase yang berfungsi merubah ATP menjadi ADP akan
keluar dari sel, sehingga energi yang dibutuhkan untuk pergerakan spermatozoa
tidak akan terbentuk dan spermatozoa akan kehilangan motilitasnya
(Colenbrander et al. 1992).
Spermatozoa menggunakan energi yang didapatkan dari proses
metabolisme untuk bertahan hidup dan melakukan aktifitasnya selama
penyimpanan (Nazlie 2004). Selama proses penyimpanan, akan terjadi
penurunan motilitas spermatozoa yang disebabkan oleh akumulasi sisa
metabolisme spermatozoa itu sendiri. Bersamaan dengan lamanya waktu
penyimpanan, kebutuhan energi yang tersedia pada bahan pengencer akan
0 10 20 30 40 50 60
0 1 2 3 4 5
M
o
ti
li
ta
s
(%
)
Waktu Inkubasi (Jam)
FH
Simmental
Brahman
semakin berkurang, sedangkan asam laktat sebagai sisa metabolisme akan
semakin bertambah. Asam laktat merupakan sisa metabolisme spermatozoa
yang dapat menurunkan pH. Rendahnya pH pengencer dapat menjadi toksik
bagi spermatozoa dan dapat merusak enzim metabolisme spermatozoa tersebut
(Eiriani et al. 2008). Selain diakibatkan oleh akumulasi sisa metabolisme, selama preservasi akan terjadi peroksidasi lipid berupa reactive oxygen species (ROS) yang juga menyebabkan penurunan motilitas spermatozoa (Soeradi 2004).
Viabilitas Spermatozoa
Viabilitas spermatozoa (viable sperm) adalah salah satu indikator untuk menguji spermatozoa yang hidup dengan membran yang masih utuh. Viabilitas
spermatozoa biasanya dinilai dengan memeriksa motilitas dan rasio hidup/mati
(Barth & Oko 1989). Evaluasi persentase hidup / mati spermatozoa
memungkinkan untuk prediksi kesuburan potensial dalam sampel semen, karena
membran plasma yang utuh diperlukan untuk pembuahan (Challah & Brillard
1998). Viabilitas spermatozoa diuji dengan pewarnaan eosin nigrosin (Tamuli &
Watson 1994). Pewarnaan eosin nigrosin merupakan salah satu teknik
pewarnaan sel yang sering dikembangkan untuk evaluasi kerusakan
spermatozoa yang disebabkan proses kriopreservasi dan evaluasi viabilitas
spermatozoa (WHO 1999). Komponen warna eosin akan masuk ke dalam sel
yang mengalami kerusakan membran plasma dan membentuk warna merah
muda keunguan, sedangkan nigrosin akan mewarnai latar bidang yang
dievaluasi, bukan mewarnai spermatozoa (Bjorndahl et al. 2004).
Evaluasi viabilitas spermatozoa dimulai saat semen beku di-thawing sampai motilitas spermatozoa bernilai nol dalam rentang waktu 1 jam. Evaluasi
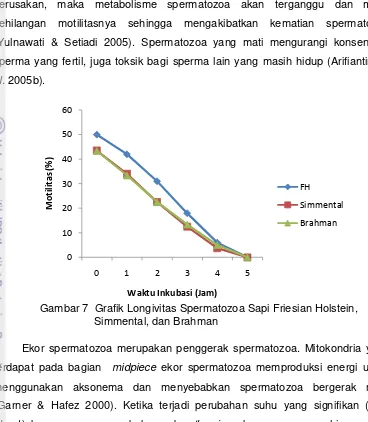
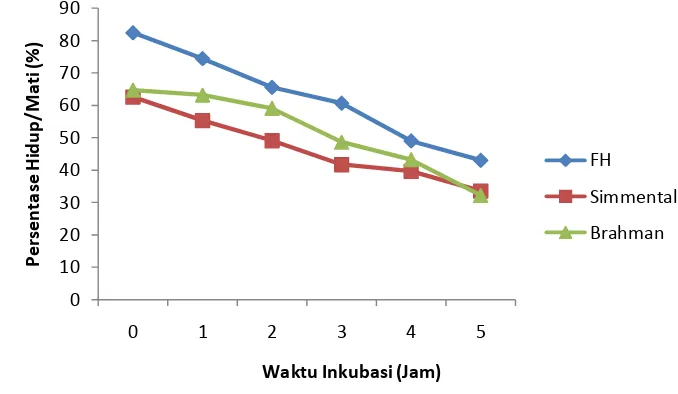
viabilitas spermatozoa post thawing (jam ke-0) menunjukkan viabilitas spermatozoa sapi FH sebesar 82.39±3.12% lebih tinggi (P<0.05) dibandingkan Gambar 8 a dan b Gambar Spermatozoa mati, c Gambar spermatozoa hidup
dengan pewarnaan Eosin Nigrosin
sapi Simmental 62.57±3.98% dan sapi Brahman 64.65±4.62%. Kemudian terjadi
penurunan persentase viabilitas spermatozoa seiring pertambahan waktu
inkubasi semen (Tabel 2). Pengamatan viabilitas spermatozoa pada jam ke-1,
ke-2, dan ke-3 menunjukkan perbedaan viabilitas antara ketiga bangsa sapi.
Pada jam ke-4 setelah inkubasi spermatozoa sapi FH memiliki nilai yang lebih
baik dibandingkan sapi Simmental dan Brahman. Ketiga breed memiliki viabilitas yang cenderung seragam pada jam ke-5 setelah inkubasi. Penurunan persentase
viabilitas spermatozoa sapi FH, Simmental dan Brahman berkisar antara
1.5-11.6% pada setiap jam pengamatan. Hal ini terjadi karena pada suhu 37 oC
spermatozoa mengalami aktivitas seluler yang hampir optimal sehingga substrat
energi cepat habis dan terdapat akumulasi asam laktat sebagai sisa
metabolisme.
Tabel 2 Viabilitas (%) spermatozoa dari FH, Simmental, dan Brahman yang diikubasi pada suhu 37 oC selama 5 jam
Waktu Pengamatan (Jam)
Jenis Sapi
FH Simmental Brahman
0 82.39±3.12a 62.57±3.98b 64.65±4.62b 1 74.39±3.23a 55.31±3.08c 63.11±4.07b 2 65.52±4.66a 49.14±6.84c 59.06±5.73b 3 60.62±7.63a 41.68±4.28c 48.62±5.29b 4 48.96±7.74a 39.65±5.00b 43.27±4.22b 5 42.98±2.18a 33.58±3.20a 32.26±12.97a Huruf kecil superskrip yang berbeda yang mengikuti angka pada baris yang sama menyatakan perbedaan yang nyata (p<0,05)
Proses kriopreservasi semen memiliki dampak negatif dan positif terhadap
kualitas spermatozoa (Blottner et al. 2001). Kriopreservasi dapat mengubah fluiditas membran sehingga spermatozoa pasca pencairan kehilangan fluiditas
lebih cepat dari yang baru ejakulasi spermatozoa, sehingga mengurangi waktu
Selama proses kriopreservasi, kerusakan membran terjadi ke daerah
akrosom spermatozoa (Blottner et al. 2001). Pendinginan dan pemanasan kembali yang terjadi pada proses pembuatan semen beku dan thawing akan merusak lipoprotein yang ada pada membran spermatozoa. Kerusakan integritas
membran sel akan mempengaruhi fungsi komponen membran sel spermatozoa
yang terdiri dari 43% lipid, 48% protein dan 9% karbohidrat (Park & Graham
1992). Apabila membran plasma spematozoa sudah mengalami kerusakan,
maka metabolisme spermatozoa akan terganggu dan mulai kehilangan
motilitasnya sehingga mengakibatkan kematian spermatozoa (Yulnawati &
Setiadi 2005). Spermatozoa yang mati ditandai dengan hilangnya permeabilitas
membran spermatozoa, sehingga zat warna eosin bebas masuk mewarnai
kepala spermatozoa.
Pada spermatozoa yang mati tidak terdapat perbedaan potensial ion
natrium dan kalium antara di dalam dan di luar sel sehingga eosin nigrosin yang
berikatan dengan natrium akan dengan mudah berdifusi ke dalam spermatozoa
dan menunjukkan penyerapan warna pada kepala saat diberi pewarnaan
(Achmadi 2001). Pada waktu pencampuran, sel-sel spermatozoa yang hidup
tidak atau sedikit sekali menyerap warna, sedangkan sel-sel spermatozoa yang
mati akan mengambil warna karena permeabilitas dinding sel meningkat waktu
mati (Hafez 2000).
Ketersediaan sumber energi dan perlindungan spermatozoa dari bahan
pengencer semen merupakan faktor yang mempengaruhi persentase viabilitas
0 10 20 30 40 50 60 70 80 90
0 1 2 3 4 5
P e rs e n ta se H id u p /Ma ti ( % )
Waktu Inkubasi (Jam)
FH
Simmental
[image:31.595.140.479.92.289.2]Brahman
spermatozoa yang semakin menurun seiring dengan lamanya waktu inkubasi
(Gambar 9). Bahan pengencer semen beku yang lazim digunakan pada
pembuatan semen beku di berbagai balai inseminasi buatan di Indonesia adalah
susu Skim, glukosa, kuning telur, gliserol, antibiotika (Penicillin dan Streptomycin)
dan aquabidest. Sumber energi pada bahan pengencer semen beku pada
penelitian ini adalah glukosa yang akan terus berkurang jumlahnya seiring
pertambahan waktu inkubasi. Fruktosa ataupun glukosa sebagai sumber energi
bagi pergerakan spermatozoa cepat habis dan menghasilkan hasil sampingan
berupa asam laktat yang dapat menurunkan pH bahan pengencer (Bearden et al. 2004). Penambahan susu skim dan kuning telur pada bahan pengencer berperan
sebagai penambah volume semen yang akan dibekukan dan mampu mereduksi
pengaruh negatif plasma semen yang terjadi pada proses penyimpanan semen
(Rigby et al. 2001).
Pada akhir evaluasi, nilai viabilitas spermatozoa masih tinggi tetapi
motilitas sudah 0%. Persentase spermatozoa hidup lebih tinggi daripada
persentase spermatozoa motil (Bearden & Fuquay 2000) karena spermatozoa
yang hidup belum tentu motil, tetapi sejumlah spermatozoa yang tidak motil
terkadang masih hidup (Campbell et al. 2003). Hal ini menunjukkan secara fungsional spermatozoa kemungkinan besar masih mampu membuahi, namun
spermatozoa tidak dapat bergerak karena mitokondria yang terdapat di dalam
midpiece ekor sudah tidak menghasilkan energi. Pengencer yang digunakan dalam penelitian ini adalah susu Skim, penelitian yang dilakukan oleh Arifiantini
et al. (2005a), menggunakan Tris Raffinosa-kuning telur, Tris Fruktosa-kuning telur, dan bahan pengencer komersial berbasis soya lechitin, longivitas sapi FH pada jam ke-5 menunjukkan motilitas 5.47±3.54%, 3.53±3.11%, dan
17.68±15.57%. Ketiga bahan pengencer tersebut dinilai dapat mempertahankan
longivitas spermatozoa lebih baik, dibandingkan pengencer skim yang digunakan
dalam penelitian ini. Tingginya viabilitas pada akhir pengamatan menggunakan
pengencer susu Skim, disebabkan kemampuan komponen lemak susu Skim
dalam melindungi spermatozoa dengan lebih baik, sehingga bahan pewarna
akan sulit menembus membran. Spermatozoa yang masih memiliki viabilitas
tinggi masih bisa dimanfaatkan menggunakan teknologi reproduksi lain, seperti
SIMPULAN DAN SARAN
Simpulan
Dari ketiga bangsa sapi, sapi FH memiliki kemampuan pemulihan post thawing yang paling baik jika dibandingkan sapi Simmental dan Brahman. Longivitas dan viabilitas merupakan dua hal yang berkaitan, keduanya menurun
seiring pertambahan longivitas. Longivitas spermatozoa dari ketiga bangsa sapi
yang diinkubasi pada suhu 37oC adalah 5 jam.
Saran
Pengujian kualitas spermatozoa sebaiknya tidak hanya menggunakan satu
paramerter dan perlu dilakukan pengujian longivitas dan viabilitas dari bangsa
DAFTAR PUSTAKA
Achmadi AS. 2001. Kaji banding kualitas dan keutuhan membran plasma semen beku sapi pada setiap jalur distribusi [Skripsi]. Fakultas Kedokteran Hewan. Institut Pertanian Bogor.
Arifiantini I, Yusuf TL dan Graha N. 2005a. Recovery Rate dan Longivitas Pasca Thawing Semen Beku Sapi FH (Friesian Holstein) Menggunakan Berbagai Bahan Pengencer. Jakarta, Bul Peternakan Vol. 29 (2), 2005.
Arifiantini I, Yusuf TL, Indah O. 2005b. Kaji banding dua teknik pengemasan menggunakan tiga macam pengencer untuk pembekuan semen sapi Friesian Holstein (FH). Seminar Nasional Teknologi Pertanian dan Veteriner 2005.
Asturiano JF. 2007. Effect of sperm cryopreservation on the European eel sperm viability and spermatozoa morphology. Reprod Domest Anim 42:162-166. Ball PHJ, Peters AR. 2004. Reproduction in Cattle 3rd edition. United Kingdom:
Blackwell Publishing Ltd.
Barth A D, Oko RJ. 1989. Abnormal Morphology of Bovine Spermatozoa. USA: Iowa State University Press.
Bearden HJ, Fuquay JW. 2000. Applied Animal Reproduction 5th ed. Missisippi State University. New Jersey. Pp 24-143.
Bearden HJ, Fuquay JW, Willard ST. 2004. Applied Animal Reproduction. 6th Ed. Pearson Education Inc: New Jersey.
Birkhead TR, Hosken DJ, Pitnick S. 2009. Sperm Biology: An Evolutionary Perspective. United Kingdom: Elsevier Ltd.
Björndahl I, Söderlund I, Johansson S, Mohammadieh M, Pourian MR, Kvist U. 2004. Why the WHO recommendation for eosin-Nigrosin staining techniques for human sperm vitality assessment must change. J Androl 2004;25:671– 8
Blottner S, Warnke C, Tuchscherer A, Heinen V, Torner H. 2001. Morphological and functional changes of stallion spermatozoa after cryopreservation during breeding and non-breeding season. Anim Reprod Sci.65:75-88. Buhr MM, Curtis EF, Kakuda SN. 1994. Composition and behaviorof head
membrane lipids of fresh and cryopreserved boar sperm. Cryobiology. 31:224-238.
Campbell JR, Campbell KL, Kenealy MD. 2003. Artificial Insemination in : Animal Sciences 4th Edition. New York:Mc Graw-Hill.
Challah T, Brillard JP. 1998. Comparison of assessment of fowl sperm viability by eosin-Nigrosin and dual fluorescence (SYBR-14/PI). Theriogenology 1998;50:487–93.
Colenbrander, Fazeli AR, Van Buiten A, Parlevliet J, Gadella BM. 1992. Assesment of sperm cell membran integrity in the horse. Acta Ve. Scand Suppl. 88: 49-58.
Eiriani K, Boediono A, Djuwita I, Sumarsono SH, Al-Azhar. 2008. Development of domestic cat embryo produced by preserved sperms. J Biosciences 15:155-160.
Fikar Samsul, Ruhyadi D. 2010. Buku Pintar Beternak dan Bisnis Sapi Potong. Jakarta: AgroMedia Pustaka.
Foote RH, 2003: Fertility estimation: a review of past experience and future prospects. Anim Reprod Sci 75 119–139.
Gage MJG, Macfarlane CP, Yeates S, Ward RG, Searle JB, Parker GA. 2004. Spermatozoal traits and sperm competition in Atlantic salmon: relative sperm velocity is the primary determinant of fertilization success. Curr Biol. 14: 44-47.
Garner DL, Hafez ESE. 2000. Spermatozoa and seminal plasma. Page 96-109 in Reproduction in Farm Animals. 7th edition. Lippincott Williams and William: Philadelphia, PA.
Gardner DK, Weissman A, Howless M, Shoham Zeev. 2001. Textbook of Assisted Reproductive Techniques Laboratory and Clinical Perspectives. United Kingdom: Martin Dunitz Ltd.
Gordon Ian. 2005. Reproductives Technologies in Farm Animals. UK: Cromwell Press.
Graham JK. 1996. Analysis of stallion semen and its relation to fertility. Vet Clin North Am, Equine Pract. 12:119-130.
Hafez ESE. 2000. Preservation and Cryopreservation of Gametes and Embryos. In Reproduction in Farm Animals. 7th ed B Hafez/ESE Hafez, editor. USA: Lippincott Wiliams & Wilkins.
Hammerstedt RH , Graham JK, Kunze E.1990. Analysis of sperm cell viability, acrosomal integrity and mitochondrial function using flow cytometry. Biol Repord 1990;43:55– 64.
He S, Woods C. 2004. Changes in motility, ultrastructure, and fertilization capacity of striped bass Morone saxatilis spermatozoa following cryopreservation. Aquaculture 236 (2004) 677–686
Mazur P, Schneider V. 1984. Osmotic consequences of cryoprotectant permeability andits relation to the survival of frozen-thawed embryos. Theriogenology 1984;21:68-79.
Morell JM, Rodriguez-Martinez H. 2009. Biomimetic Techniques for Improving Sperm Quality in Animal Breeding: A Review. The Open Andrology J 2009, Volume 1.
Nazlie C S. 2004. Kajian kualitas spermatozoa kucing asal epididimys dan duktus deferens setelah preservasi pada suhu 4C [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Nilna. 2010. Standar Operasional Pekerjaan Prosesing Semen. [terhubung berkala] http://disnak.sumbarprov.go.id/?disnak=profil&id=85 [18 Januari 2012].
Parks JE, Lynch DV, 1992. Lipid composition and thermotropic phase behavior of boar, bull, stallion and rooster sperm membranes. Cryobiology 29, 255– 266.
Rigby SL, Brinsko SP, Cochran M, Blanchard TL, Love CC, Varner DD. 2001. Advances in cooled semen technologies: seminal plasma and semen extender. Anim Reprod Sci. 68:171-180.
[SNI]. 2005. Semen beku sapi SNI 01-4869.1-2005.[terhubung berkala]
pphp.deptan.go.id/…/5.pdf [15 Januari 2012].
Soeradi O. 2004. Radikal bebas pada pria infertil. Di dalam: Paradigma Terkini Genetika dan Reproduksi. Jakarta: Departemen Biologi Kedokteran. Fakultas Kedokteran, UI. Hlm 95-101.
Sudarmono AS, Sugeng YB. 2008. Sapi Potong Cet.17 Edisi Revisi. Jakarta: Penebar Swadaya.
Syarif EK, Harianto B. 2011. Buku Pintar Beternak dan Bisnis Sapi Perah.Jakarta: AgroMedia Pustaka.
Szasz F, Sirivaidyapong S, Chen FP, Voorhout WF, Marks A, Colenbrander B, Solti L, Gadella BM. 2000. Detection of calcium ionophore induced membrane changes in dog sperm as a simple method to predict the cryopreservability of dog semen. Mol Reprod Dev. 55:289-298.
Tamuli M, Watson P. 1994. Use of a simple staining technique to distinguish acrosomal changes in the live sperm sub-population Anim Reprod Sci 1994. 35:247-254.
[WHO] World Health Organization. 1999. WHO laboratory manual for the examination of human semen and sperm cervical mucus interactions. 4th edn. Cambridge University Press, Cambridge, UK.
Wundrich K, Paasch V, Leicht M, Glander HJ. 2006. Activaton of caspaces in human spermatozoa duringcryopreservation and immunoblot study. Cell Tissue Bank 7:81-90.
LAMPIRAN
Lampiran 1 Persentase Motilitas dan Viabilitas Spermatozoa Sapi Friesian Holstein
Waktu
(Jam)
Sampel Rata-rata
1 2 3 4 5 6 7 8 9 10
0 50-45 50 50-45 55-50 50 55-50 55-50 50-45 50-45 50-45 50.00±0.00
81.63 84.80 84.89 80.43 85.71 77.70 83.70 76.87 83.69 84.43 82.39±3.12
1 45-40 45-40 40 45 40 45 40 40 45 40 41.88±2.58
78.43 77.61 78.60 71.75 76.15 72.18 74.26 68.87 73.34 72.67 74.39± 3.23
2 30-25 30 30 40-35 35 30 35 30 40-35 30 31.43±2.44
69.05 66.84 74.70 68.02 65.97 63.24 64.86 63.13 61.96 57.38 65.52 ±4.66
3 15 25 20 20 25 20 25 15 10 5 18.00 ±6.75
62.23 65.02 70.19 65.33 58.86 59.09 62.22 60.29 61.83 41.15 60.62 ±7.63
4 5 10 5 10 5 5 10 5 5 0 6.00 ± 3.16
47.27 52.36 46.89 55.21 54.46 55.37 53.93 51.15 42.36 30.61 48.96 7.74
5 0 0 0 0 0 0 0 0 0 0 0.00 ± 0.00
44.36 44.72 40.94 43.52 42.35 44.23 46.28 40.52 39.87 0 42.98 2.18
Lampiran 2 Persentase Motilitas dan Viabilitas Spermatozoa Sapi Simmental
Waktu
(Jam)
Sampel Rata-rata
1 2 3 4 5 6 7 8 9 10
0 40 45 45 45 45 40 45 45 40 45 43.50 ±2.42
55.50 60.49 60.00 66.97 59.60 61.54 65.71 63.64 63.25 68.97 62.57 ±3.98
1 30-25 35-30 35-30 35-30 35-30 35 35 30 35 35 34.00 ±2.24
52.07 57.80 52.41 52.17 55.56 58.42 61.02 55.32 55.78 52.52 55.31 ±3.08
2 20-15 15 20-15 25-20 25 20-15 20 25 25 25 22.50 ±4.18
49.96 51.79 44.60 50.68 52.41 43.42 36.52 61.07 55.19 46.07 49.14 ±6.84
3 15 15 10 15 15 15 10 10 10 10 12.50 ±2.64
40.14 37.88 39.77 45.83 36.70 42.59 35.71 46.34 43.86 47.97 41.68 ±4.28
4 5 5 5 10-5 5 10-5 5 5 0 0 3.75 ± 2.31
44.09 42.78 37.97 41.22 38.46 43.24 36.36 43.92 27.59 40.85 39.65 ±5.00
5 0 0 0 0 0 0 0 0 0 0 0.00 ± 0.00
Lampiran 3 Persentase Motilitas dan Viabilitas Spermatozoa Sapi Brahman
Waktu
(Jam)
Sampel Rata-rata
1 2 3 4 5 6 7 8 9 10
0 45 45 45 40 45 40 45 45-40 40 45 43.33 ± 2.50
60.44 64.84 74.58 63.86 64.60 58.14 68.58 66.23 60.84 64.41 64.65±4.62
1 35-30 35 30 30 35-30 35-30 35 35 35-30 35 33.33 ± 2.58
57.42 68.71 61.17 65.52 57.84 58.66 63.58 65.13 67.07 65.98 63.11 ±4.07
2 30-25 30-25 20 25-20 25-20 25 30-25 30-25 30-25 30-25 22.50 ± 3.54
59.79 65.50 54.46 65.77 52.43 54.39 52.00 58.50 60.36 67.44 59.06± 5.73
3 20 20-15 15 15-10 20-15 10 15 10 15-10 10 13.33 ± 4.08
51.35 48.31 40.07 51.96 51.60 38.24 49.16 49.07 53.71 52.77 48.62 ±5.29
4 10-5 10 10 5 5 5 5 0 5 0 5.00 ± 3.54
45.45 46.15 42.93 42.86 39.01 37.19 45.99 46.75 49.18 37.18 43.27 ±4.22
5 0 0 0 0 0 0 0 0 0 0 0.00 ± 0.00
42.23 37.16 38.51 39.71 39.00 26.19 33.34 - 34.25 - 32.26±12.97
Lampiran 4 Analisis Motilitas Sapi
Jam 0
hasil penelitian 21:20 Thursday, June 18, 2012 10 The ANOVA Procedure
Class Level Information Class Levels Values jenis 3 b f s
Number of Observations Read 30 Number of Observations Used 30
hasil penelitian 21:20 Thursday, June 18, 2012 11 The ANOVA Procedure
Dependent Variable: jam0
Sum of
Source DF Squares Mean Square F Value Pr > F Model 2 0.02482667 0.01241333 22.33 <.0001 Error 27 0.01501000 0.00055593
Corrected Total 29 0.03983667
R-Square Coeff Var Root MSE jam0 Mean 0.623211 5.189600 0.023578 0.454333
Source DF Anova SS Mean Square F Value Pr > F jenis 2 0.02482667 0.01241333 22.33 <.0001 hasil penelitian 21:20 Thursday, June 18, 2012 12 The ANOVA Procedure
Duncan's Multiple Range Test for jam0
NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05
Means with the same letter are not significantly different. Duncan Grouping Mean N jenis
A 0.49500 10 f B 0.43500 10 s B
B 0.43300 10 b
Jam 1
hasil penelitian 21:20 Thursday, June 18, 2012 13 The ANOVA Procedure Class Level Information Class Levels Values jenis 3 b f s
Number of Observations Read 30 Number of Observations Used 30
hasil penelitian 21:20 Thursday, June 18, 2012 14 The ANOVA Procedure
Dependent Variable: jam1
Sum of
Source DF Squares Mean Square F Value Pr > F Model 2 0.05554167 0.02777083 54.29 <.0001 Error 27 0.01381250 0.00051157
Corrected Total 29 0.06935417
R-Square Coeff Var Root MSE jam1 Mean 0.800841 6.297356 0.022618 0.359167
Source DF Anova SS Mean Square F Value Pr > F jenis 2 0.05554167 0.02777083 54.29 <.0001 hasil penelitian 21:20 Thursday, June 18, 2012 15 The ANOVA Procedure
Duncan's Multiple Range Test for jam1
NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05
Error Degrees of Freedom 27 Error Mean Square 0.000512 Number of Means 2 3 Critical Range .02075 .02181
Means with the same letter are not significantly different. Duncan Grouping Mean N jenis
A 0.42000 10 f B 0.33000 10 b B
B 0.32750 10 s
Jam 2
hasil penelitian 21:20 Thursday, June 18, 2012 16 The ANOVA Procedure
Class Level Information Class Levels Values jenis 3 b f s
hasil penelitian 21:20 Thursday, June 18, 2012 17 The ANOVA Procedure
Dependent Variable: jam2
Sum of
Source DF Squares Mean Square F Value Pr > F Model 2 0.06481167 0.03240583 25.15 <.0001 Error 27 0.03479250 0.00128861
Corrected Total 29 0.09960417
R-Square Coeff Var Root MSE jam2 Mean 0.650692 13.58886 0.035897 0.264167
Source DF Anova SS Mean Square F Value Pr > F jenis 2 0.06481167 0.03240583 25.15 <.0001 hasil penelitian 21:20 Thursday, June 18, 2012 18 The ANOVA Procedure
Duncan's Multiple Range Test for jam2
NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05
Error Degrees of Freedom 27 Error Mean Square 0.001289 Number of Means 2 3 Critical Range .03294 .03461
Means with the same letter are not significantly different. Duncan Grouping Mean N jenis
A 0.32350 10 f B 0.25900 10 b C 0.21000 10 s
Jam 3
hasil penelitian 21:20 Thursday, June 18, 2012 25 The ANOVA Procedure
Class Level Information Class Levels Values jenis 3 b f s
Number of Observations Read 30 Number of Observations Used 30
hasil penelitian 21:20 Thursday, June 18, 2012 26 The ANOVA Procedure
Dependent Variable: jam3
Sum of
Source DF Squares Mean Square F Value Pr > F Model 2 0.01608500 0.00804250 3.67 0.0388 Error 27 0.05912250 0.00218972
Corrected Total 29 0.07520750
R-Square Coeff Var Root MSE jam3 Mean 0.213875 31.51143 0.046794 0.148500
Source DF Anova SS Mean Square F Value Pr > F jenis 2 0.01608500 0.00804250 3.67 0.0388 hasil penelitian 21:20 Thursday, June 18, 2012 27 The ANOVA Procedure
Duncan's Multiple Range Test for jam3
NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05
Error Degrees of Freedom 27 Error Mean Square 0.00219 Number of Means 2 3 Critical Range .04294 .04511
A 0.18000 10 f A
B A 0.14050 10 b B
B 0.12500 10 s
Jam 4
hasil penelitian 21:20 Thursday, June 18, 2012 28 The ANOVA Procedure Class Level Information Class Levels Values jenis 3 b f s
Number of Observations Read 30 Number of Observations Used 30
hasil penelitian 21:20 Thursday, June 18, 2012 29 The ANOVA Procedure
Dependent Variable: jam4
Sum of
Source DF Squares Mean Square F Value Pr > F Model 2 0.00105167 0.00052583 0.55 0.5841 Error 27 0.02588500 0.00095870
Corrected Total 29 0.02693667
R-Square Coeff Var Root MSE jam4 Mean 0.039042 58.79039 0.030963 0.052667
Source DF Anova SS Mean Square F Value Pr > F jenis 2 0.00105167 0.00052583 0.55 0.5841 hasil penelitian 21:20 Thursday, June 18, 2012 30 The ANOVA Procedure
Duncan's Multiple Range Test for jam4
NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05
Error Degrees of Freedom 27 Error Mean Square 0.000959 Number of Means 2 3 Critical Range .02841 .02985
Means with the same letter are not significantly different. Duncan Grouping Mean N jenis
A 0.06000 10 f A
A 0.05250 10 b A
A 0.04550 10 s
Jam 5
hasil penelitian 21:20 Thursday, June 18, 2012 31 The ANOVA Procedure
Class Level Information Class Levels Values jenis 3 b f s
Number of Observations Read 30 Number of Observations Used 30
hasil penelitian 21:20 Thursday, June 18, 2012 32 The ANOVA Procedure
Dependent Variable: jam5
Sum of
Source DF Squares Mean Square F Value Pr > F Model 2 0 0 . .
Error 27 0 0 Corrected Total 29 0
Source DF Anova SS Mean Square F Value Pr > F jenis 2 0 0 . .
hasil penelitian 21:20 Thursday, June 18, 2012 33 The ANOVA Procedure
Duncan's Multiple Range Test for jam5
NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05
Error Degrees of Freedom 27 Error Mean Square 0 Number of Means 2 3 Critical Range 0 0
Means with the same letter are not significantly different. Duncan Grouping Mean N jenis
A 0 10 b A
A 0 10 f A
A 0 10 s
Lampiran 5 Analisis Viabilitas Sapi
Jam 0
hasil penelitian 21:20 Thursday, June 18, 2012 34 The ANOVA Procedure Class Level Information Class Levels Values jenis 3 b f s
Number of Observations Read 30 Number of Observations Used 30
hasil penelitian 21:20 Thursday, June 18, 2012 35 The ANOVA Procedure
Dependent Variable: jam0
Sum of
Source DF Squares Mean Square F Value Pr > F Model 2 2372.468409 1186.234205 75.91 <.0001 Error 27 421.912515 15.626389
Corrected Total 29 2794.380925
R-Square Coeff Var Root MSE jam0 Mean 0.849014 5.657872 3.953023 69.86767
Source DF Anova SS Mean Square F Value Pr > F jenis 2 2372.468409 1186.234205 75.91 <.0001 hasil penelitian 21:20 Thursday, June 18, 2012 36 The ANOVA Procedure
Duncan's Multiple Range Test for jam0
NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05
Error Degrees of Freedom 27 Error Mean Square 15.62639 Number of Means 2 3 Critical Range 3.627 3.811
Means with the same letter are not significantly different. Duncan Grouping Mean N jenis
A 82.386 10 f B 64.651 10 b B
B 62.566 10 s
Jam 1
Class Level Information Class Levels Values jenis 3 b f s
Number of Observations Read 30 Number of Observations Used 30
hasil penelitian 21:20 Thursday, June 18, 2012 38 The ANOVA Procedure
Dependent Variable: jam1
Sum of
Source DF Squares Mean Square F Value Pr > F Model 2 1840.883230 920.441615 75.69 <.0001 Error 27 328.353250 12.161231
Corrected Total 29 2169.236480
R-Square Coeff Var Root MSE jam1 Mean 0.848632 5.426256 3.487296 64.26707
Source DF Anova SS Mean Square F Value Pr > F jenis 2 1840.883230 920.441615 75.69 <.0001 hasil penelitian 21:20 Thursday, June 18, 2012 39 The ANOVA Procedure
Duncan's Multiple Range Test for jam1
NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05
Error Degrees of Freedom 27 Error Mean Square 12.16123 Number of Means 2 3 Critical Range 3.200 3.362
Means with the same letter are not significantly different. Duncan Grouping Mean N jenis
A 74.388 10 f B 63.107 10 b C 55.306 10 s
Jam 2
hasil penelitian 21:20 Thursday, June 18, 2012 40 The ANOVA Procedure
Class Level Information Class Levels Values jenis 3 b f s
Number of Observations Read 30 Number of Observations Used 30
hasil penelitian 21:20 Thursday, June 18, 2012 41 The ANOVA Procedure
Dependent Variable: jam2
Sum of
Source DF Squares Mean Square F Value Pr > F Model 2 1360.372722 680.186361 20.13 <.0001 Error 27 912.462982 33.794925
Corrected Total 29 2272.835704
R-Square Coeff Var Root MSE jam2 Mean 0.598535 10.03890 5.813340 57.90817
Source DF Anova SS Mean Square F Value Pr > F jenis 2 1360.372722 680.186361 20.13 <.0001 hasil penelitian 21:20 Thursday, June 18, 2012 42 The ANOVA Procedure
Duncan's Multiple Range Test for jam2
NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05
Means with the same letter are not significantly different. Duncan Grouping Mean N jenis
A 65.516 10 f B 59.064 10 b C 49.144 10 s
Jam 3