IDENTIFIKASI, TINGKAT SERANGAN, DAN POTENSI
TERBAWA BENIH
Colletotrichum
sp., PADA TANAMAN
MENTIMUN (
Cucumis sativus
L.)
FERY PURNAWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
RINGKASAN
FERY PURNAWATI. Identifikasi, Tingkat Serangan, dan Potensi Terbawa Benih Colletotrichum sp., pada Tanaman Mentimun (Cucumis Sativus L.). Dibimbing oleh SURYO WIYONO dan TITIEK SITI YULIANI.
Tanaman mentimun (Cucumis sativus L.) merupakan salah satu jenis tanaman sayuran utama dari famili cucurbitaceae yang dibudidayakan oleh petani di Indonesia, terutama di Jawa dan Sumatera. Penyebaran pertanaman mentimun di Indonesia terus meningkat dari tahun ke tahun, tetapi mengalami produksi mentimun nasional mengalami penurunan. Salah satu pembatas dalam budidaya tanaman mentimun di beberapa negara adalah penyakit antraknosa, sedangkan di Indonesia belum ada penelitian yang khusus terhadap identifikasi patogen dan kejadian penyakit ini pada tanaman mentimun. Oleh karena itu, informasi tentang arti penting penyakit antraknosa dan identifikasi patogen antraknosa pada mentimun di Indonesia sangat diperlukan.
Penelitian ini bertujuan untuk 1) menentukan kejadian penyakit di pertanaman mentimun akibat serangan penyakit antraknosa, 2) mendeskripsikan gejala penyakit antraknosa pada pertanaman mentimun, 3) mengidentifikasi patogen antraknosa pada tanaman mentimun, dan 4) menentukan potensi terbawa benih patogen antraknosa.
Penelitian dilaksanakan pada bulan Juni 2014 – Desember 2014 di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian IPB dan di pertanaman mentimun milik petani (Kabupaten Klaten dan Kabupaten Boyolali Propinsi Jawa Tengah dan Kabupaten Bogor Propinsi Jawa Barat). Benih mentimun contoh diperoleh dari toko-toko benih. Metode yang digunakan adalah identifikasi morfologi dan surveilan kejadian penyakit antraknosa. Pengambilan sampel dilakukan dengan metode purposive random sampling. Identifikasi secara morfologi dengan pemeriksaan langsung pada preparat slide terhadap 30 aservuli dari jaringan yang bergejala antraknosa. Pengamatan koloni patogen dilakukan dengan menanam aservuli dari bagian nekrotik pada daun mentimun ke dalam cawan petri berisi PDA. Pengamatan apresoria dengan memproduksi apresoria dengan teknik kultur slide. Deteksi Colletotrichum sp. sebagai patogen terbawa benih dilakukan dengan blotter test.
mendukung perkembangan penyakit, yaitu musim kemarau. Hasil uji deteksi patogen terbawa benih menunjukkan bahwa patogen antraknosa, Colletotrichum sp., merupakan patogen terbawa benih dengan tingkat infeksi 0.38 %.
SUMMARY
FERY PURNAWATI. Identification, Infection Rate, and Potential as Seed-borne Pathogen of Colletotrichum sp. on Cucumber (Cucumis sativus L.). Supervised by SURYO WIYONO dan TITIEK SITI YULIANI.
Cucumber (Cucumis sativus L.) is one of the main vegetables grown by farmers in Indonesia, particularly in Java and Sumatra. The planting area of cucumber in Indonesia continues to increase from year to year, but national production of cucumber has decreased. The cultivation of cucumber crop in several countries suffers severely because of anthracnose disease, while identification on the pathogen and disease incidence of anthracnose on cucumber crop in Indonesia has not been specifically investigated. Therefore, this study aimed to identify pathogen and study of disease incidence of the anthracnose on cucumber crop in Indonesia, also to determine its potency as seed-borne pathogens. Therefore, information about the importance of anthracnose disease and pathogen identification of anthracnose on cucumbers in Indonesia is very necessary.
This research aims to 1) determine the incidence disease in cucumber crops due to disease anthracnose, 2) describe the symptoms of anthracnose disease in cucumber cultivation, 3) identify pathogens of anthracnose on cucumber plants, and 4) determining the potency of antracnose pathogen as seed-borne pathogen.
The experiment was conducted in June 2014 - December 2014 in Plant Mycology Laboratory, Department of Plant Protection, Faculty of Agriculture of IPB and farmers' cucumber cultivation in Klaten and Boyolali (Central Java) and Bogor (West Java). Sample of cucumber seeds obtained from seeds stores. The method used was the morphological identification and surveillance of disease incidence of anthracnose. Sampling was done by purposive random sampling method. Morphological identification carried by direct examination on slide glass on 30 acervulli from symptomatic tissue of anthracnose. Colonies observations of pathogens was carried out by planting acervulli of necrotic section of cucumber leaves in a petri dish containing PDA. Observations apresoria by induced apresoria formation with slide culture techniques. Detection of Colletotrichum sp. as a seed-borne pathogens was carried out by blotter test.
Colletotrichum orbiculare and C. dematium. Colletotrichum sp. in cucumber, was a seed-borne pathogen with infection rates of 0.38%.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
IDENTIFIKASI, TINGKAT SERANGAN, DAN POTENSI
TERBAWA BENIH
Colletotrichum
SP., PADA TANAMAN
MENTIMUN (
Cucumis sativus
L.)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2014 ini ialah patogen terbawa benih, dengan judul Identifikasi, Tingkat Serangan, dan Potensi Terbawa Benih Colletotrichum sp., pada Tanaman Mentimun (Cucumis sativus L.).
Terima kasih penulis ucapkan kepada Dr Ir Suryo Wiyono, MScAgr dan Dr Ir Titiek Siti Yuliani, SU selaku pembimbing, serta Dr Ir Bonny Poernomo Wahyu Soekarno, MS selaku penguji dan Ir. Ummu Salamah Rustiani, MSi yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Badan Karantina Pertanian selaku pemberi beasiswa, Dr. drh. Syafril Daulay, MM beserta staf Balai Besar Uji Standar Karantina Pertanian, Dinas Pertanian Kabupaten Boyolali dan Ir. Joko Siswanto, MSi beserta staf Dinas Pertanian Kabupaten Klaten, yang telah membantu memberikan informasi pertanaman mentimun. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, suami, anak-anak, seluruh keluarga dan teman-teman, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, April 2015
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xiii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 4
3 BAHAN DAN METODE 10
Waktu dan Tempat 10
Bahan dan Alat 10
Metode 11 4 HASIL DAN PEMBAHASAN
Kejadian dan Keparahan Penyakit 13
Gejala Penyakit 15
Identifikasi Morfologi Colletotrichum sp. pada
Mentimun 20
Deteksi Colletotrichum sp. sebagai Patogen Terbawa
Benih 27
5 SIMPULAN 30
6. SARAN 31
DAFTAR PUSTAKA 31
DAFTAR TABEL
1 Keadaan penyakit antraknosa di lapangan 14
2 Identifikasi Colletotrichum sp. dengan bentuk konidia falcate 23 3 Identifikasi Colletotrichum sp. dengan bentuk konidia clavate 27 4 Persentase jenis Colletotrichum berdasarkan pemeriksaan langsung
pada mentimun asal lokasi pengambilan sampel 28
5 Uji potensi patogen terbawa benih 29
DAFTAR GAMBAR
1 Gejala penyakit antraknosa pada daun dan tanaman mentimun 5 2 Gejala penyakit antraknosa pada buah mentimun 5 3 Siklus penyakit antraknosa pada berbagai tanaman 7
4 Karakterisasi morfologi C. orbiculare 7
5 Gejala antraknosa pada pertanaman mentimun 17
6 Konidiomata berupa aservuli 17
7 Distribusi gejala penyakit pada tanaman mentimun 18
8 Colletotrichum dematium asal mentimun di Lumbung 22
9 Koloni C. dematium asal mentimun di Lumbung 22
10 Colletotrichum sp. pada mentimun di Lumbung 24
11 Colletotrichum sp. pada mentimun di Bantarsari 24
12 Colletotrichum sp. pada mentimun di Tegalwaru 25
13 Colletotrichum sp. pada mentimun di Klaten 25
14 Koloni Colletotrichum orbiculare asal daun mentimun 26 15 Tanda penyakit pada benih hasil uji blottertest 28 16 Koloni cendawan pada benih hasil uji blottertest 29
DAFTAR LAMPIRAN
1 Data curah hujan Kecamatan Kemang, Kabupaten Bogor 40 2 Data curah hujan Tegalwaru, Kecamatan Kemang,
Kabupaten Bogor 44
3 Data curah hujan Kecamatan Cibungbunglan, Kabupaten Bogor 45
4 Data curah hujan Kabupaten Boyolali 46
5 Data curah hujan Kabupaten Klaten 47
PENDAHULUAN
Latar Belakang
Mentimun (Cucumis sativus L.) merupakan salah satu jenis sayur dari famili cucurbitaceae yang cukup populer di hampir semua negara. Mentimun berasal dari dataran tinggi Himalaya dan pada saat ini budidayanya sudah meluas ke seluruh wilayah tropis dan subtropis (Elsya 2003). Mentimun memiliki nilai ekonomi yang penting bagi masyarakat Indonesia karena merupakan salah satu jenis sayuran pokok juga sebagai perawatan kecantikan tradisional ataupun dengan teknologi modern. Menurut Prakoso et al. (2014), manfaat penting lain buah mentimun adalah untuk terapi penyakit hipertensi. Hal tersebut karena kandungan kalium yang tinggi dalam mentimun.
Tanaman mentimun merupakan salah satu jenis tanaman sayuran utama yang dibudidayakan oleh petani di Indonesia selain bawang merah, cabai, kacang panjang, kentang, kubis, dan tomat (Anwar et al. 2005). Pada tahun 1991, luas areal panen mentimun nasional mencapai 55.792 ha dengan produksi 268.201 ton. Daerah penyebaran yang menjadi pusat pertanaman mentimun adalah propinsi Jawa Barat, Daerah Istimewa Aceh, Bengkulu, Jawa Tengah, dan Jawa Timur (Rukmana 1994). Bahkan beberapa tahun terkahir, tanaman mentimun merupakan tanaman yang penting dalam program diversifikasi dalam Arah dan Kebijakan Rencana Pembangunan Pertanian Jangka Panjang 2002-2025 Kementerian Pertanian di Kalimantan, antara lain di Kota Singkawang, Kalimantan Barat dan Kabupaten Kutai Kertanegara, Kalimantan Timur (Lestari et al. 2011, Puspitasari et al. 2013).
Penyebaran dan produksi mentimun di Indonesia dari tahun ke tahun terus meningkat, tetapi produksi mentimun nasional dari tahun 2009 sampai dengan tahun 2013 mengalami penurununan yaitu, secara berturut-turut, 583 139 ton; 547 141 ton; 521 535 ton; 511 525 ton; 491 636 ton (BPS 2014). Salah satu pembatas dalam budidaya tanaman mentimun adalah penyakit tanaman. Sumber inokulum bisa berasal dari lahan itu sendiri (sebelum tanam dan sisa tanaman), benih, atau bibit, vegetasi sekitarnya dan dari tempat yang jauh. Status kesehatan benih merupakan salah satu faktor penting untuk menentukan keberhasilan budidaya tanaman mentimun karena benih merupakan pembawa pasif dan tempat bertahan hidup berbagai jasad renik, baik yang bersifat patogenik maupun saprofitik. Oleh karena itu benih dapat berperan sebagai media pembawa yang utama dalam penyebaran patogen tanaman dan insidensi penyakit di lapangan, khususnya patogen yang bersifat terbawa benih.
2
patogen baru terbawa benih dari suatu negara yang tidak bebas ke negara yang masih bebas dari patogen tersebut.
Salah satu upaya pengendalian penyakit adalah dengan tindakan karantina, khususnya untuk patogen-patogen yang persebarannya masih terbatas. Beberapa tindakan karantina antara lain seperti deteksi patogen terbawa benih untuk memastikan bahwa benih tersebut terbebas dari patogen yang dapat menyebabkan benih tidak berkembang sebagaimana mestinya dan menjadi media pembawa masuknya organisme pengganggu tanaman (OPT) dan pemantauan OPT sebagai sistem peringatan dini status dan persebaran OPT. Salah satu penyakit penting pada tanaman adalah penyakit antraknosa yang gejalanya terutama pada daun tanaman semak, tanaman naungan maupun tanaman hias. Penyakit ini disebabkan oleh patogen terbawa benih Colletotrichum sp. pada mentimun, Discula destructive pada dogwood, Kabatiella caulivora pada Trifolium subterraneum dan Apiognomonia errabunda pada tanaman oak (Helms 1977, Lee 2013, Li 2014, Redlin 1991).
Colletotrichum sp. adalah salah satu genus cendawan patogenik yang paling umum dan penting pada tanaman. Hampir semua tanaman yang dibudidayakan di dunia rentan terhadap satu spesies Colletotrichum atau lebih. Cendawan ini menyebabkan gejala bercak antraknosa dan hawar pada bagian tanaman di atas tanah dan busuk pada komoditas pasca panen. Anggota genus ini merupakan penyebab utama kehilangan hasil dari tanaman-tanaman yang memiliki nilai ekonomi tinggi meliputi buah, sayuran dan tanaman hias. (Dean et al. 2012). Penyakit antraknosa sukar dikendalikan karena infeksi patogennya bersifat laten dan sistemik, penyebaran inokulum dilakukan melalui benih (seed borne) serta dapat bertahan pada sisa-sisa tanaman sakit dalam tanah. Serangan patogen antraknosa pada fase pembungaan menyebabkan persentase benih terinfeksi tinggi walaupun benih tampak sehat (Sinaga et al. 1992). Sedangkan menurut hasil penelitian Fitzel dan Peak (1984), penyakit antraknosa menyebar pada pohon mangga dengan konidia C. gloeosporioides var. minor yang terbawa air.
Antraknosa adalah penyakit utama pada mentimun dan famili cucurbitaceae lainnya di beberapa negara seperti Florida, Jepang, Thailand, Cina, Korea (Jeun et al. 2008, Negishi et al. 2011, Palenchar et al. 2012, Photita et al. 2005, Qi et al. 2013, Tian et al. 2008). Penyakit ini dapat berkembang di semua bagian tanaman di atas tanah dan menyebabkan hawar daun, bercak, kanker batang, dan busuk buah selama musim tanam. Serangan epidemik selama musim tanam pada musim panas yang basah dan hangat dapat menyebabkan penggundulan awal, kehilangan hasil dan penurunan kualitas buah. Buah yang terserang dapat menghasilkan benih yang terkontaminasi patogen. Penyebab penyakit antraknosa pada mentimun di berbagai negara adalah C. orbiculare (Li 2014). Banyak sekali penelitian telah menyimpulkan bahwa praktek manajemen penyakit sering tidak berhasil untuk menghilangkan penyakit. Pemuliaan untuk mengembangkan varietas tahan juga belum berhasil bertahan lama karena keterlibatan beberapa spesies Colletotrichum infeksi antraknosa (Than et al. 2008a).
3
pengendalian yang efektif dan untuk memahami epidemiologi penyakit. Sama pentingnya adalah meneliti apakah patogen yang sama atau berbeda berhubungan dengan penyakit pada jaringan inang yang berbeda. Selain itu identifikasi akurat dari patogen juga penting dalam ilmu pemuliaan untuk resistensi terhadap suatu spesies tertentu. Inang tunggal mungkin terinfeksi oleh beberapa spesies Colletotrichum, sedangkan beberapa inang juga dapat terinfeksi oleh spesies patogen (Freeman et al. 1998, Freeman 2000). Di Indonesia identifikasi penyakit antraknosa pada mentimun belum dilakukan, sedangkan penyakit antraknosa merupakan penyakit yang penting pada tanaman mentimun di beberapa negara lain dan di Indonesia merupakan penyakit penting pada tanaman lainnya seperti tanaman hias, cabai dan sengon. Oleh karena itu, perlu dilakukan penelitian untuk mengetahui secara khusus mengenai patogen penyebab penyakit antraknosa pada mentimun dan kejadian penyakit pada pertanaman di Indonesia.
Perumusan Masalah
Dari latar belakang masalah di atas didapatkan suatu perumusan masalah sebagai berikut:
1. Belum ada identifikasi Colletotrichum sp. pada mentimun di Indonesia
2. Belum ada informasi tentang kejadian/keparahan penyakit antraknosa pada tanaman mentimun di lapangan.
3. Gejala dan tanda patogen penyebab antraknosa pada mentimun belum dideskripsikan.
4. Belum diketahui arti pentingnya penyakit antraknosa pada mentimun. 5. Belum diketahui potensi Colletotrichum terbawa benih mentimun.
Tujuan Penelitian
1. Menentukan kejadian penyakit di pertanaman mentimun akibat serangan penyakit antraknosa.
2. Mendeskripsikan gejala penyakit antraknosa pada pertanaman mentimun. 3. Mengidentifikasi patogen antraknosa pada mentimun.
4. Menentukan potensi terbawa benih patogen antraknosa.
Manfaat Penelitian
4
TINJAUAN PUSTAKA
Arti Penting Penyakit Antraknosa
Antraknosa adalah penyakit tanaman yang disebabkan oleh beberapa cendawan yang menyerang tanaman semak, pohon peneduh dan tanaman budidaya. Tanaman ini akan menentukan jenis cendawan yang menyebabkan antraknosa tersebut. Sebagai contoh pada mentimun disebabkan oleh cendawan Colletotrichum sp., pada tanaman oak disebabkan oleh Apiognomonia sp. atau pada maple disebabkan oleh Kabatiella sp. Colletotrichum sp., sebagai penyebab penyakit antraknosa, mempunyai peranan penting pada ekonomi subsistem pertanian di seluruh dunia. Patogen ini menginfeksi sejumlah tanaman mulai dari monokotil hingga tanaman dikotil. Cendawan bertahan di sisa-sisa tanaman pada saat overwinter atau memproduksi spora pada bulan April dan Mei ketika dingin dan lembab. Patogen ini membentuk bintik-bintik kecil hingga bercak besar di daun. Pada tanaman berkayu penyakit dapat menyebabkan kanker pada batang, seperti mawar, yang akan membunuh batang dan bertahan selama musim dingin di batang. Pohon yang bercak antraknosa berkembang akan sering rontok daunnya pada Bulan Juni atau Juli. Pada beberapa kasus,daun dapat tumbuh kembali. Jika pohon sangat terpengaruh dari tahun ke tahun, penyakit dapat melemahkan pohon. Infeksi akan bertahan pada musim dingin sebagai kanker, pada tunas dan sisa-sisa tanaman (Denkler 2013, Dickman 1993).
Penyakit antraknosa merupakan salah satu kendala dalam pembudidayaan cabai di Indonesia. Dalam kondisi lingkungan yang optimal bagi patogen, penyakit ini dapat menghancurkan seluruh areal pertanaman cabai. Kerugian hasil selama transportasi dan penyimpanan dalam kurun waktu satu minggu dapat mencapai lebih dari 25% (Prajnanta 1999).
Pada pertanaman mentimun di Rusia, Ukraina, dan Moldova, penyakit antraknosa menyerang 30-100% pertanaman, perkembangan penyakit mencapai 50%, dan penurunan hasil mencapai 48% (Klopunova 2009). Menurut Giatgong (1980) dalam Semangun (1989), penyakit antraknosa pada mentimun, yang terdapat di Thailand dan Indonesia, disebabkan oleh C. lagenarium (Pass.) Ell. Et
Halst.
C. orbiculare (Berk. & Mont.) Arx adalah patogen penting penyebab penyakit antraknosa pada famili Cucurbitaceae, khususnya mentimun (Cucumis sativus), melon (C. melo), semangka (Citrullus lanatus), labu (Cucurbita pepo) dan squash (C. maxima), tetapi juga dilaporkan memiliki 40 tanaman inang di seluruh dunia (Farr dan Rossman 2013).
Gejala Penyakit Antraknosa
5
daun (Gambar 1), pusat bercak yang lebih tua dapat retak atau rontok seluruhnya (Palenchar et al. 2009).
Gambar 1 Gejala penyakit antraknosa pada daun dan tanaman mentimun: (a-b) bercak pada daun mentimun, (c) bercak daun 14 hari setelah inokulasi buatan, (d) tanaman dengan bercak 6 hari setelah inokulasi, (e) tanaman dengan bercak 10 hari setelah inokulasi, (f) tanaman dengan bercak 14 hari setelah inokulasi (Sumber: Khlopunova 2009, Langston 2009, Palenchar 2009)
Tangkai, pedisel buah, dan batang dapat juga terinfeksi yang berakibat defoliasi tanaman, penurunan buah, dan kematian tanaman. Buah dapat terinfeksi ketika mulai matang; bercak buah terlihat cekung, melingkar, basah, dan berwarna gelap (Gambar 2). Seringkali patogen menghasilkan spora atau konidia, pada buah yang terinfeksi, bercak terlihat basah dan pink salmon. Gejala pada buah dapat berkembang tanpa gejala ketika masih di lapangan dan terus berkembang setelah panen, sehingga buah mentimun yang terinfeksi memperlihatkan gejala ketika dalam penyimpanan dan / atau transportasi (Li2014; Seebold 2010).
Gambar 2 Gejala penyakit antraknosa pada buah mentimun (Sumber: Averre 2009)
a b c
6
Gejala antraknosa yang disebabkan oleh C. lagenarium, pada daun umumnya bercak mulai dari tulang daun, yang meluas menjadi bercak coklat, bersudut-sudut atau agak bulat, garis tengahnya mencapai 1 cm, atau bahkan dapat lebih. Daun yang masih berkembang menjadi cekungan-cekungan. Beberapa bercak dapat bersatu dan menyebabkan matinya seluruh daun. Bercak pada tangkai dan batang agak mengendap, memanjang, berwarna coklat tua. Bercak mulai tampak pada buah, saat buah mulai masak. Pada buah bercak berbentuk bulat, melekuk, tampak kebasah-basahan, dan dapat sangat meluas. Pada cuaca lembab di tengah bercak terbentuk massa spora yang berwarna merah jambu (Semangun 1989).
Biologi dan Morfologi Patogen
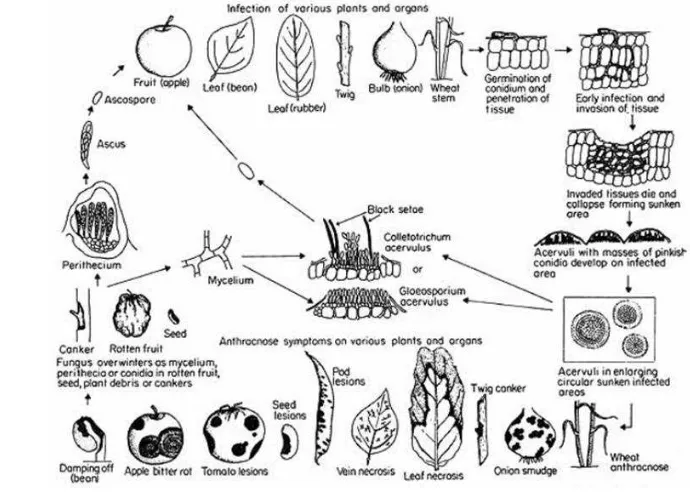
Colletotrichum (Deuteromycetes) dan bentuk teleomorfnya Glomerella (Ascomycetes) adalah cendawan patogen yang paling banyak berhasil menginfeksi tanaman dengan kisaran inang yang sangat luas pada pertanaman yang dibudidayakan di iklim sub tropis ataupun iklim tropis. Colletotrichum sp. penyebab antraknosa pada mentimun memiliki daur hidup yang sama dengan Colletotrichum lainnya, pada dasarnya melibatkan perkecambahan konidia pada inang rentan, penetrasi jaringan inang melalui apresoria, fase biotrofik intraseluler awal yang cepat berubah ke perkembangan nekrotik, perkembangan bercak sering cekung, pembentukan konidiomata berseta dan penyebaran konidia biasanya dengan percikan air. Perkembangan teleomorf pernah dilaporkan, namun tampaknya sporadis dan belum menunjukkan hubungan antara anamorf dan teleomorf (Bailey dan Jeger 1992, CABI 2007).
7
efek toksik metabolit tanaman. Penyebaran konidia dari aservuli yang muda terjadi dengan bantuan percikan air (Bailey dan Jeger 1992).
Gambar 3 Siklus penyakit antraknosa pada berbagai tanaman (Sumber: Agrios 2005)
8
Konidia dilepaskan dari aservuli dan kontak dengan tanaman inang rentan dan berkecambah ketika ada air dan suhu optimal (20-32 °C). Konidia berkecambah dan menembus jaringan inang secara langsung (Ferreira dan Boley 1992). Infeksi antraknosa pada mentimun cenderung menurun ketika suhu mencapai lebih dari 86 °F (30 °C), bahkan jika terdapat curah hujan (Thompson dan Jenkins 1985).
Setelah berkecambah, konidia membentuk apresoria, yang dipisahkan dari konidia dan tabung kecambah oleh sebuah septa. Apresoria ini sangat penting untuk proses infeksi. Pematangan apresoria ini melibatkan perkembangan dinding sel yang tebal dan multi-lapis yang mengandung melanin, yaitu sekresi lapisan tipis dari ekstraseluler berlendir (Baley et al. 1992). Melanisasi dari antifungal diasumsikan berkontribusi terhadap peningkatan daya tahan dalam kondisi yang sulit, seperti iradiasi, lisis oleh mikroorganisme lain, radikal oksigen, atau suhu tinggi (Kubo 2000). Selain penting untuk proses infeksi, apresoria ini juga merupakan karakteristik morfologi yang penting dalam genus Colletotrichum (Sutton 1992). Produksi apresoria ini dipengaruhi oleh lingkungan dan genetik (Struck 2006).
C. orbiculare (Gambar 4) dikarakterisasi dengan konidia yang lurus, ujung tumpul dan meruncing ke arah dasar, kultur berwarna coklat gelap sampai hitam atau keabu-abuan dan tingkat pertumbuhan lebih lambat daripada C. gloeosporioides (Damm et al. 2013, Sutton 1992). Penyakit ini dianggap penting di Amerika Serikat (Florida, Hawai), tempat tanaman cucurbitaceae tumbuh di bawah kondisi yang sangat terkendali, tetapi cendawan memiliki distribusi di seluruh dunia dan perlu mendapat perhatian di negara-hangat beriklim tropis atau tempat tanaman cucurbitaceae tumbuh. Inokulasi eksperimental semangka dengan C. orbiculare menyebabkan kerugian antraknosa dan hasil yang parah hingga 63% (CABI 2007). C. lagenarium merupakan anamorf dari Glomerella lagenarium sedangkan G. lagenarium merupakan bentuk seksual atau perfect stage (teleomorf) dari patogen ini (CABI 2007, Ferreira dan Bolley1992).
Kemampuan Colletotrichum sp. Terbawa Benih
9
Pengujian benih untuk patogen terbawa benih merupakan pekerjaan yang sulit. Tidak seperti jaringan tanaman vegetatif yang terinfeksi, karena benih yang terinfeksi dapat tidak memperlihatkan gejala, sehingga membuat deteksi visual tidak bisa dilakukan (Walcot 2003). Menurut Cram dan Fraedrich (2009), patogen terbawa benih didefinisikan sebagai setiap agen infeksi yang dibawa pada benih, secara internal maupun eksternal, yang memiliki potensi untuk menyebabkan penyakit baik biji atau tanaman.
Menurut Singh dan Mathur (2004), laporan jumlah mikroorganisme yang berhubungan dengan biji meningkat secara bertahap selama paruh kedua abad ke-20. Organisme yang berkaitan dengan benih baik sebagai kontaminan permukaan benih, tercampur dengan benih, atau sebagai infeksi yang ada di dalam jaringan benih. Cendawan merupakan kelompok besar patogen yang terbawa benih serta tular-benih. Daftar cendawan saprofit dan parasit yang terkait dengan benih pada tanaman yang berbeda ini sangat besar, dan meliputi semua kelas cendawan. Anggota Deuteromycotina mendominasi dan khususnya kelas Hyphomycetes dan Coelomycetes.
Menurut Nome (2002), proses infeksi benih dipengaruhi oleh kondisi tempat tanaman tumbuh. Ada dua jenis infeksi benih, yaitu infeksi sistemik benih dan kontaminasi atau infestasi benih. Infeksi sistemik benih adalah pembentukan patogen dalam setiap bagian dari benih terinfeksi, melalui sistem vaskular atau plasmodesmata atau langsung oleh luka alami atau buatan. Patogen yang sama dapat menginfeksi benih menggunakan satu atau lebih dari mekanisme ini. Infeksi sistemik dapat melalui empat cara yaitu (1) melalui bunga, buah atau funiculus; (2) Penetrasi melalui stigma yaitu selama infeksi, patogen mengikuti jalan yang sama seperti serbuk sari. Spora cendawan mencapai stigma dan berkecambah serta memproduksi hifa yang mencapai ovarium, tempat mereka bisa bertahan sebagai miselium dorman sampai perkecambahan biji; (3) Penetrasi melalui dinding ovarium atau benih belum matang, yaitu menembus dinding ovarium sebagai akibat dari perkecambahan dari teliospora pada stigma atau dinding ovarium. Pro-miselium melalui dinding dan jaringan lain sampai mencapai embrio; (4) Penetrasi melalui luka dan lubang alami. Sedangkan kontaminasi atau infestasi mengacu pada hubungan pasif dari patogen dan biji. Patogen itu sendiri atau bagian dari patogen dapat menempel atau bisa tercampur dengan biji dalam setiap proses benih: panen, ekstraksi, seleksi dan pengepakan.
Cendawan patogen terbawa benih dapat sangat mempengaruhi kualitas benih dan menyebabkan penyakit yang berdampak produksi bibit di pembibitan. Kerugian untuk patogen terbawa benih termasuk mengurangi perkecambahan biji, damping-off, dan kematian bibit yang lebih tua di bedengan. Pengaruh patogen terbawa benih pada biji dan produksi bibit diketahui dapat sampai ekstrim yaitu kegagalan perkecambahan terjadi di persemaian (Cram dan Fraederich 2009) atau kerugian yang terjadi dalam kontainer (Campbell dan Landis 1990).
Hasil percobaan di lapangan di Himalaya pada C. lindemuthianum, memperlihatkan kejadian penyakit dan keparahan penyakit paling tinggi terjadi pada kacang buncis kultivar rentan Jawala. Infeksi terjadi karena terbawa benih dan kontaminasi. Penurunan hasil yang diakibatkan kedua cara infeksi tersebut, yaitu berturut-turut 75% dan 57.24% (Sharma et al. 2008).
10
Hilangnya kemampuan berkecambah dipengaruhi oleh banyak faktor, yaitu spesifitas kultivar; tipe, jumlah dan lokasi inokulum; kondisi lingkungan; dan faktor lainnya (Agarwal dan Sinclair 1987, Sutopo 1998).
Spesies Colletotrichum umumnya mampu bertahan di dalam atau pada biji dan salah satu cara pada cabai adalah melalui transplan yang terinfeksi (Manandhar et al. 1995). Menurut Jewsakun (1978) dalam Than et al. (2008), infeksi C. capsici pada cabai terbukti memiliki dua jalur: invasi melalui kulit biji dan invasi melalui bukaan dari testa. C. capsici menyebabkan busuk akar bibit. Menurut Than et al. (2008) C. acutatum dapat menginfeksi benih cabai dengan mengurangi tingkat perkecambahan atau menyebabkan damping-off bibit.
C. truncatum berkecambah pada permukaan benih kedelai dan hifa mempenetrasi lapisan palisade dalam 24 hingga 30 jam. Setelah 48 jam mengoloni lapisan palisade, pertumbuhan hifa melalui hipodermis dan masuk dalam lapisan protein-rich aleuron. Setelah 72 jam, hifa membentuk aservuli berwarna gelap pada lapisan epidermal (Agarwal dan Sinclair 1997).
Chikuo dan Sugimoto (1989) menemukan adanya variasi keberadaan miselin C. dematium f.sp. spinaceae dalam benih yang diperoleh dari tanaman Beta vulgaris yang diinokulasi secara alami pada awal dan akhir pembentukan bunga. Infeksi menyebar pada rongga buah, dan hifa menginvasi biji yang sedang berkembang, sehingga membuat biji rontok. Tetapi pada kondisi berikutnya, miselium biasanya terbatas permukaan benih, hifa jarang terlihat pada pori apikal dan di bawah kulit biji.
11
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Juni 2014 – Desember 2014 di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian IPB dan di pertanaman mentimun milik petani (Kabupaten Klaten dan Kabupaten Boyolali Propinsi Jawa Tengah dan Kabupaten Bogor Propinsi Jawa Barat).
Bahan dan Alat
Benih mentimun contoh diperoleh dari toko-toko benih, yaitu varietas yupiter, jawara, bandana, lumintu, dynasti, kancil, Alicia F1 serta varietas local dari Klaten, Boyolali dan Sragen. Isolat cendawan diperoleh dari isolasi cendawan dari daun di pertanaman petani dan benih. Metode isolasi yang digunakan adalah blotter test (Mathur dan Kongsdal 2003), untuk uji deteksi patogen terbawa dan metode isolasi propagul langsung dari daun mentimun di potato dextrose agar (PDA). Alat yang digunakan adalah hand counter, mikroskop stereo, mikroskop compound dan hand mikroskop Digital Microscope Basic AM2111 Series Dino-Lite.
Metode
Penentuan Sampel di Lapangan
Penelitian dilakukan secara survei pada bulan Juni-Desember 2014, di tiga kabupaten sentra penghasil mentimun yaitu Bogor (Jawa Barat) serta Boyolali dan Klaten (Jawa Tengah).
Survei pendahuluan. Survei dilakukan untuk menginventaris lokasi dan penentuan kelompok sampel. Informasi yang diperlukan diperoleh dari data primer dan sekunder, serta dilakukan pengamatan di pertanaman mentimun milik petani.
12
Pengamatan Kejadian Penyakit di Lapangan
Variabel yang diamati di lapangan dan di pembibitan adalah persentase keparahan penyakit (KpP) dan persentase kejadian penyakit (KjP). Penentuan keparahan penyakit dilakukan berdasarkan nilai persentase luas daun yang terinfeksi dibanding luas daun yang sehat (Villanueva 2008). Penghitungan luas daun dilakukan dengan satuan kotak dalam kain strimin. Rumus KpP adalah sebagai berikut:
KpP = x 100%
Penentuan distribusi penyakit pada tajuk tanaman dengan menghitung keparahan penyakit dibagi dalam 3 posisi daun pada tajuk tanaman yaitu bawah, tengah dan atas. Kejadian penyakit dihitung sebagai persentase jumlah tanaman yang sakit terhadap jumlah tanaman yang diamati pada satu varietas, dengan rumus:
KjP = x 100%
Identifikasi Morfologi dan Koloni Cendawan Patogen Antraknosa pada Mentimun
Isolat Colletotrichum sp. diperoleh dengan pemeriksaan langsung pada preparat slide terhadap 30 aservuli dari jaringan yang bergejala antraknosa. Pengamatan koloni patogen dilakukan dengan menanam aservuli dari bagian nekrotik pada daun mentimun. Cawan petri yang telah berisi PDA steril, ditandai bagian tengah bawah dengan spidol permanen. Aservuli dari gejala nekrotik pada daun, diambil dengan jarum serangga secara mikroskopis dan aseptik, selanjutnya dibiakkan pada media PDA dalam cawan petri di bagian yang telah ditandai. Cawan petri diinkubasi pada suhu kamar (25-30 °C) dan diamati pertumbuhan koloni cendawan secara berkala. Pengamatan dilakukan terhadap warna, tekstur, tampilan dan pinggir koloni, bentuk, ukuran dan warna aservuli. Aservuli dibuat preparat slide dan selanjutnya bentuk, panjang dan lebar konidia dan seta diidentifikasi secara mikroskopis dengan kunci identifikasi Damm et al. (2009), Damm et al. (2013), Sutton (1980), serta Villanueva et al. (2008). Kultur murni disimpan pada suhu 18 °C pada PDA miring.
13
Deteksi Colletotrichum sp. sebagai Patogen Terbawa Benih
Benih mentimun sebanyak 800 biji dan 1600 biji ditanam dalam petridisih berisi 3 lembar kertas saring yang telah dibasahi aquades steril, masing-masing cawan petri ditanam sebanyak 25 biji, sehingga ada 16 ulangan setiap varietas (Mathur dan Kongsdal 2003). Pertumbuhan miselium dan perkembangan aservuli di sekitar benih diamati dan diidentifikasi secara morfologi di bawah mikroskop stereo dengan kunci identifikasi Damm et al. (2009), Damm et al. (2013).
Persentase infeksi Colletotrichum sp. pada benih dihitung dengan rumus: Tingkat infeksi = x 100%
14
HASIL DAN PEMBAHASAN
Kejadian dan Keparahan Penyakit
Kejadian dan keparahan penyakit di setiap lokasi penelitian ini masing-masing nilainya berbeda sangat jauh karena waktu dan keadaan agroekosistem masing-masing lokasi pengamatan berbeda mengikuti waktu tanam mentimun petani serta varietas yang berbeda di lokasi tersebut. Menurut Dodd et al. (1992), faktor lingkungan merupakan peran utama dalam perkembangan epidemi penyakit. Hubungan antara intensitas hujan, durasi dan geometri tanaman dan penyebaran inokulum menyebabkan tingkat keparahan penyakit yang berbeda.
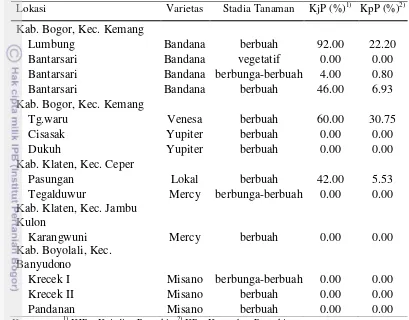
Hasil surveilan keadaan penyakit antraknosa dari 11 lokasi di lapangan (Tabel 1), menunjukkan bahwa penyakit terjadi di 4 lokasi dan kejadian penyakit paling tinggi terjadi pada stadia tanaman berbuah di Lumbung (Bogor), selanjutnya di Tegalwaru (Bogor), Bantarsari (Bogor), dan di Pasungan (Klaten) dan kejadian penyakit pada stadia tanaman berbunga-berbuah terjadi di Bantarsari, Bogor. Keparahan penyakit paling tinggi ditemukan pada stadia tanaman mentimun berbuah di Tegalwaru diikuti di Lumbung, Bantarsari dan Pasungan, sedangkan keparahan penyakit pada stadia tanaman berbunga-berbuah ditemukan di Bantarsari (Bogor). Perkembangan penyakit di empat lokasi tersebut didukung oleh kondisi iklim pada waktu tanam, terutama curah hujan dan suhu udara, serta vegetasi sekitar tanaman mentimun, kecuali di Desa Pasungan, Kabupaten Klaten, Jawa Tengah, pada pertanaman mentimun putih dengan varietas lokal. Pengamatan di Pasungan dilakukan pada bulan September dengan tidak ada hari hujan. Meskipun dengan kondisi cuaca yang kurang mendukung untuk perkembangan penyakit, tetapi ditemukannya kejadian penyakit yang mencapai 42.00% dan keparahan penyakit 5.53% menunjukkan bahwa penyakit antraknosa merupakan penyakit penting pada tanaman mentimun.
15
pembentukan konidium, pemencaran konidium, dan infeksi. Perkecambahan dan pertumbuhan cendawan paling baik terjadi pada suhu 22-27 °C.
Tabel 1 Keadaan penyakit antraknosa di pertanaman petani
Lokasi Varietas Stadia Tanaman KjP (%)1) KpP (%)2)
Kab. Bogor, Kec. Kemang
Lumbung Bandana berbuah 92.00 22.20
Bantarsari Bandana vegetatif 0.00 0.00
Bantarsari Bandana berbunga-berbuah 4.00 0.80
Bantarsari Bandana berbuah 46.00 6.93
Kab. Bogor, Kec. Kemang
Tegalduwur Mercy berbunga-berbuah 0.00 0.00
Kab. Klaten, Kec. Jambu Kulon
Karangwuni Mercy berbuah 0.00 0.00
Kab. Boyolali, Kec. Banyudono
Krecek I Misano berbunga-berbuah 0.00 0.00
Krecek II Misano berbuah 0.00 0.00
Pandanan Misano berbuah 0.00 0.00
Keterangan: 1) KJP = Kejadian Penyakit, 2) KP = Keparahan Penyakit
Hasil penelitian ini memperlihatkan bahwa Colletotrichum sp. untuk berhasil menginfeksi jaringan tanaman yang dilanjutkan dengan fase-fase lain dalam siklus hidupnya sampai fase nekrotrofik dan menimbulkan gejala penyakit antraknosa pada jaringan tanaman, membutuhkan kondisi lingkungan yang sesuai untuk perkembangan siklus hidupnya. Kondisi lingkungan ini meliputi adanya percikan air, suhu udara antara 22-30 °C, kelembaban relatif yang cukup. Pada lokasi pertanaman di Bantarsari keparahan penyakit mencapai 0.80 % pada stadia tanaman berbunga, dan meningkat pada stadia tanaman berbunga-berbuah yaitu 6.93 %, tetapi nilai ini jauh lebih kecil dari keparahan penyakit yang terjadi di Tegalwaru yaitu 30.75%, hal ini karena konidia Colletotrichum menginfeksi pertanaman di Tegalwaru pada stadia tanaman berbunga pada musim hujan, sedangkan di Bantarsari pada musim kemarau. Menurut Fitzel dan Peak (1984), kejadian penyakit antraknosa pada tanaman mangga, sejumlah besar konidia terjebak selama periode berkepanjangan hujan, dan ketika ini terjadi selama pertumbuhan aktif atau berbunga, keparahan penyakit tercatat berat.
16
menurun pada temperatur di atas 31 °C, sedangkan perkecambahan spora mencapai 73,4% pada kelembaban relatif mendekati 100% (25 °C) dan menurun pada kelembaban relatif 55-57% (27-30 °C). Selain itu insiden penyakit dan keparahan penyakit juga meningkat sebanding dengan meningkatnya periode lapisan air pada permukaan buah. Menurut Fernando et al. (2000), spora C.acutatum mencapai perkecambahan sebesar 90% pada suhu 15-35 °C, dengan kelembaban relatif 95%. Menurut Wilson et al. (1990), kejadian penyakit antraknosa buah strawberry meningkat sejalan dengan meningkatnya durasi basah permukaan buah, tetapi pada buah yang matang menurun pada suhu di atas 35 °C, dari maksimal kejadian penyakit yaitu 39%. Suhu optimal untuk terjadinya infeksi antraknosa pada buah belum matang dan matang adalah 25-35 °C, dengan kejadian penyakit lebih besar dari 80% pada periode basah permukaan buah setelah 13 hari.
Lokasi pengamatan di Kecamatan Ciampea (Jawa Barat) di 2 dusun, yaitu di dusun Cisasak dan Dukuh, kejadian penyakit dan keparahan penyakit tidak ditemukan, diduga karena pengamatan dilakukan pada bulan Juni (musim kemarau) saat kondisi iklim di lokasi tersebut rendah curah hujannya yaitu rata-rata 3.0 mm/hari. Pengamatan di Kecamatan Boyolali (Jawa Tengah), di 3 lokasi yaitu di Pandanan dan 2 lokasi di Krecek dengan varietas Misano, juga tidak ada kejadian penyakit. Hal ini karena pengamatan dilakukan pada bulan Juli, saat curah hujan bulan tersebut sangat rendah sehingga tidak dapat terukur (kurang dari 0.0 mm) dengan jumlah hari hujan 8 hari. Suhu yang tinggi ini tidak mendukung untuk perkembangan penyakit yaitu menghambat proses perkecambahan spora, dan curah hujan yang rendah tidak mendukung untuk persebaran massa konidia.
Gejala Penyakit
Pengamatan gejala dilakukan di 4 lokasi yang terinfestasi penyakit antraknosa (Tabel 1), yaitu di Kabupaten Bogor (Lumbung, Bantarsari, Tegalwaru) dan Kabupaten Klaten (Pasungan). Gejala terlihat jelas ditemukan di bagian daun (Gambar 5a, 5b, 5c) dan batang (Gambar 5d) pada tanaman stadia berbuah, selain itu gejala juga ditemukan di bagian buah (Gambar 5e), meskipun sedikit.
17
Proses infeksi C. orbiculare pada daun mentimun diawali dengan adhesi konidia, perkecambahan konidia, perkembangan appressorium dan pertumbuhan hifa yang infeksius (Jeun and Lee 2005; Jeun et al. 2008). Menurut Qi et al. (2013), dalam penelitiannya tentang proses infeksi C. orbiculare pada mentimun kultivar rentan dan tahan, 8 jam setelah inokulasi (jsi) kurang dari 10% konidia telah melekat dan berkecambah pada permukaan daun kultivar rentan dan tahan. Perkecambahan C. orbiculare dinilai dengan adanya pembentukan tabung kecambah atau generasi apresoria langsung. Konidia yang telah berkecambah pada 24 jsi mencapai lebih dari 90% pada kedua kultivar. Hampir semua spora berkecambah membentuk apresoria pada 24 jsi. Apresoria terbentuk baik secara langsung dari salah satu ujung konidium atau dari ujung tabung kecambah. Pada 24 jsi, lebih dari 50% apresoria memiliki peg penetrasi pada kedua kultivar. Pada 24 jsi, vesikel infeksi bengkak di bawah peg penetrasi. Daerah vesikel seperti leher infeksi memanjang telah dibentuk dalam sel epidermis. Hifa primer telah terbentuk dan berhasil menginvasi sel-sel epidermis pada 48 jsi. Hifa primer, berdiameter besar dan panjang tapi menyempit terdapat di lokasi penetrasi Gambar 5 Gejala antraknosa pada pertanaman mentimun: (a) gejala awal pada daun mentimun hijau, (b) gejala lanjut pada daun mentimun hijau, (c-d) pada daun mentimun putih, (e) gejala pada batang bawah bibit mengakibatkan tanaman mati sebelum berbunga, (f) pada batang mentimun, (g) gejala awal pada buah mentimun
a b c
d e f g
Gambar 6 Konidiomata berupa aservuli: (a) pada daun dan (b) pada batang
18
antarsel, telah meluas berkembang menjadi hifa sekunder yang menembus epidermis dan mesofil sel yang berdekatan pada 72 jsi pada kultivar rentan. Hifa sekunder yang menyempit tersebut mensekresikan enzim yang mendegradasikan dinding sel pada penyebaran selanjutnya dan cepat memperluas bercak nekrotik. Sejumlah besar hifa sekunder telah terbentuk pada 96 jsi pada kultivar rentan, sedangkan pada kultivar tahan, vesikel infeksi membesar dan membentuk hifa primer, lebih jarang, dan hifa sekunder lebih sedikit. Pada 120 jsi, banyak koloni dan cluster konidia yang diamati pada permukaan daun mentimun rentan, sedangkan pada kultivar tahan hanya sejumlah kecil konidia menghasilkan hifa sekunder, secara signifikan lebih sedikit dari pada kultivar rentan.
Gejala pada batang berupa bercak putih kecoklatan memanjang (elongate), sering bagian ujungnya meruncing, dan memiliki banyak massa konidia oranye salmon. Gejala pada percabangan yang berat bisa menimbulkan kepatahan yang dilanjutkan kematian cabang muda. Gejala ini ditemukan pada pertanaman mentimun di Tegalwaru. Gejala pada buah berupa bercak nekrotik putih kecoklatan dan melekuk ke dalam, terdapat massa konidia, dan menimbulkan kebusukan di jaringan sekitarnya.
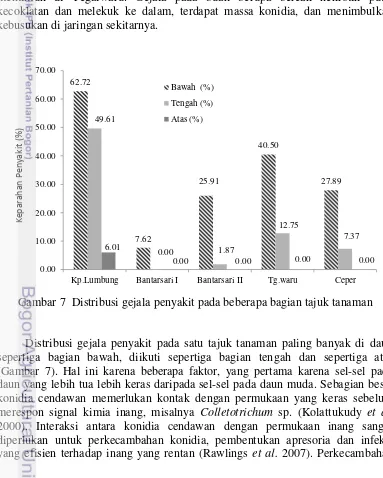
Gambar 7 Distribusi gejala penyakit pada beberapa bagian tajuk tanaman
Distribusi gejala penyakit pada satu tajuk tanaman paling banyak di daun sepertiga bagian bawah, diikuti sepertiga bagian tengah dan sepertiga atas (Gambar 7). Hal ini karena beberapa faktor, yang pertama karena sel-sel pada daun yang lebih tua lebih keras daripada sel-sel pada daun muda. Sebagian besar konidia cendawan memerlukan kontak dengan permukaan yang keras sebelum merespon signal kimia inang, misalnya Colletotrichum sp. (Kolattukudy et al. 2000). Interaksi antara konidia cendawan dengan permukaan inang sangat diperlukan untuk perkecambahan konidia, pembentukan apresoria dan infeksi yang efisien terhadap inang yang rentan (Rawlings et al. 2007). Perkecambahan
Kp.Lumbung Bantarsari I Bantarsari II Tg.waru Ceper
19
C. lagenarium lebih efektif pada permukaan membran plasma yang hidrofilik (Takano et al. 2000). Hidrofilik ini merupakan bagian dari fosfolipid berupa protein yang larut dalam air. Fosfolipid merupakan penyusun utama membran sel.
Faktor suhu pada tajuk tanaman bagian bawah, tengah dan atas juga mempengaruhi perkecambahan konidia. Suhu pada tajuk bagian bawah lebih rendah daripada suhu pada tajuk bagian atas yang langsung terpapar sinar matahari. Menurut Ferreira dan Boley (1992), konidia berkecambah dan menembus jaringan inang secara langsung ketika ada air dan suhu optimal (20-32 °C). Paparan sinar matahari ini juga berpengarauh terhadap lapisan air di permukaan daun. Lapisan air di permukaan daun mempengaruhi keparahan penyakit antraknosa. Menurut Dillard (1989) dan Wilson et al. (1990), keparahan penyakit antraknosa juga meningkat sebanding dengan meningkatnya periode lapisan air pada permukaan inang. Menurut Strucks (2006), selama fase awal dari proses infeksi sebelum menginvasi ke jaringan tanaman, perkembangan cendawan lebih banyak ditentukan oleh faktor kondisi lingkungan yang sesuai untuk perkembangannya yaitu lapisan air permukaan, kelembaban relatif, temperatur dan cahaya. Selain itu, pada proses masuknya patogen melalui penetrasi aktif dengan pembentukan apresoria, produksi apresoria dikendalikan oleh lingkungan dan genetik. Produksi apresoria C. lagenarium pada tanaman dikendalikan oleh gen homolog mitogen-ativated protein (MAP) kinase. Gen ini sangat penting untuk keberhasilan infeksi pada tanaman inang
Selain itu, banyaknya gejala yang ditemukan pada daun bagian bawah tajuk tanaman dibandingkan pada bagian tengah dan atas tajuk dikarenakan adanya ontogenik resisten. Beberapa spesies tanaman mengembangkan resistansi yang terbatas pada jaringan atau organ tertentu, yaitu ketika jaringan atau organ mencapai kematangan. Banyak penelitian lain telah menunjukkan efek penuaan daun terhadap penyakit (Develey-Rivière dan Galiana, 2007, Koch et al. 1991, Kus et al. 2002, Panter dan Jones 2002, Reuveni et al. 1998, Rupe dan Gburr 1995, Wyatt et al. 1991). Misalnya, pada pohon apel (Malus atrosanguinea), penuaan daun berkorelasi positif dengan ketahanan terhadap jamur Venturia inaequalis (Li dan Xu 2002). Pada kebanyakan tanaman, ketahanan terhadap patogen biasanya meningkat dengan bertambahnya usia tanaman, tapi dalam beberapa kasus kerentanan tanaman terhadap patogen meningkat dengan perkembangan tanaman. Hubungan antara usia-resistensi tanaman ini disebut resistensi ontogenik. Jenis resistensi terutama diperlihatkan dalam dua cara. Pertama, kepadatan bercak pada daun diikuti menurunnya inokulasi dengan bertambahnya usia daun. Kedua, lamanya periode inkubasi meningkat dengan meningkatnya usia daun. Bercak yang terlihat pada daun tua kemungkinan besar merupakan hasil dari infeksi ketika daun masih relatif muda. Ketika daun sepenuhnya melebar, resistensi ontogenik mulai terlihat, menyebabkan terhambatnya infeksi dan / atau pertumbuhan miselium (Ebrahim 2011, Li dan Xu 2002, MacHardy dan Jeger 1983, MacHardy 1996).
20
terhambat (tapi masih tanpa gejala), tetapi juga infeksi baru. Terganggunya resistensi pada daun tua terhadap V. inaequalis mungkin karena perubahan fisiologis yang terjadi pada daun pada awal penuaan. Akibatnya, daun lama dapat menjadi rentan terhadap jamur di akhir musim dan miselia yang sebelumnya terhambat pertumbuhannya dalam jaringan daun dapat melanjutkan pertumbuhannya, sehingga terlihat baru. Penelitian lainnya oleh Reuveni (1998), pada daun yang lebih tua dari bagian bawah bibit anggur menunjukkan lebih banyak kandungan β-1, 3-glukanase dan akibatnya mereka memiliki ketahanan yang lebih tinggi terhadap Plasmopara viticola daripada daun muda yang terdapat pada bagian atas bibit.
Perubahan fisiologis yang terjadi pada jaringan daun tua tanaman ini, kemungkinan juga mengakibatkan menurunnya kemampuan tanaman memproduksi protein atau senyawa kimia lainnya yang berfungsi sebagai anti cendawan dalam sistem pertahanannya terhadap cendawan patogenik. Hal ini karena pada jaringan yang lebih tua pembelahan sel dan proses metabolisme telah mengalami penurunan. Sel-sel ini merupakan tempat dihasilkannya PR protein. Menurut Edreva (2005), PR protein (pathogenesis-related protein) adalah suatu kelompok berkode-protein tanaman yang disebabkan oleh rangsangan stres yang berbeda, yang memiliki fungsi penting dalam pertahanan tanaman terhadap infeksi patogen dan adaptasi terhadap stres lingkungan.
PR memiliki lokalisasi seluler ganda yaitu vakuolar dan apoplastik, apoplast menjadi tempat utama akumulasi PR protein (Van Loon dan Van Strien 1999). Selain terdapat di dinding sel primer dan sekunder tanaman yang terinfeksi, PR juga ditemukan dalam dinding sel aposisi (papila) disimpan di bagian dalam dinding sel dalam menanggapi (Benhamou et al. 1991, Jeun 2000) infeksi cendawan. Menariknya, mereka terdeteksi di dinding sel patogen cendawan dan dalam ruang yang terbentuk antara dinding sel dan membran plasma invaginated cendawan (Jeun 2000, Jeun dan Buchenauer 2001). Menurut Neuhass (1999), hasil identifikasi dan analisa sekuen DNA, menunjukkan sebagian besar PR protein ((PR-3, PR-4, PR-4, PR-8, PR-11) dihasilkan pada ribosom yang melekat pada endoplasmik reticulum, dan PR protein asam ditemukan terakumulasi pada vakuola. Menurut Van Loon dan Van Strien (1999), PR terdapat dalam semua organ tanaman - daun, batang, akar, bunga - , terutama sangat banyak dalam daun, dalam jumlah 5-10% dari total protein daun. Dalam daun PR terdapat dalam mesofil dan epidermis jaringan.
21
atau enzim yang berhubungan dengan respon ketahanan tanaman terhadap patogen yaitu kitinase dan peroksidase. Van Loon dan Van Strein (1999), mengklasifikasikan PR protein dalam 14 famili, cucumber kitinase termasuk dalam PR-8, dengan properti kitinase tipe III.
Kitinase adalah enzim yang umum diproduksi sel bakteri, cendawan, hewan, dan tumbuhan. Enzim kitinase yang dihasilkan tumbuhan dapat menghidrolisis ikatan β-1,4 antar subunit N-asetilglukosamina (NAcGlc) pada polimer kitin. Hidrolisis polimer kitin sebagai salah satu komponen dinding sel hifa cendawan dapat menghambat pertumbuhan hifa. Oleh sebab itu, kitinase dikenal sebagai salah satu protein anti cendawan (Wang et al. 2005, Yan et al. 2008). Aktivitas kombinase antara kitinase dan β -1, 3-glucanase bekerja lebih efektif terhadap banyak cendawan daripada masing-masing enzim bekerja sendiri (Jayaraj et al. 2004, Leung dan Alizadeth 2011).
Menurut Matreaux dan Boller (1986), kitinase memberikan respon pertahanan terinduksi secara sistemik dan lokal pada tanaman mentimun yang diinfeksi dengan C. lagenarium. Pertahahanan induksi sistemik terlihat sebagai kombinasi dari beberapa mekanisme pertahanan. Pada daun mentimun, lignifikasi dinding sel terjadi lebih cepat dan lebih luas dengan adanya induksi pertahanan daripada perlakuan kontrol. Tanaman mentimun membentuk pertahanan terhadap patogen pada daun kedua setelah daun pertama diinfeksi dengan C. lagenarium. Pada daun pertama mentimun yang diinfeksi dengan C. lagenarium aktivitas kitinase meningkat hingga 100 fold pada area yang diinfeksi pada 48 jam. Pada daun kedua aktivitas kitinase hanya mencapai dua kali lebih tinggi dibandingkan pada daun kontrol, tetapi peningkatan kitinase pada daun kedua ini berkorelasi baik terhadap infeks C. lagenarium. Pada daun muda yang normal aktivitas kitinase sangat lambat, yaitu pada usia daun lebih dari 4 minggu. Oleh karena itu diduga induksi kitinase dipengaruhi oleh stimulus asal pada daun pertama.
Identifikasi Colletotrichum sp. pada Mentimun
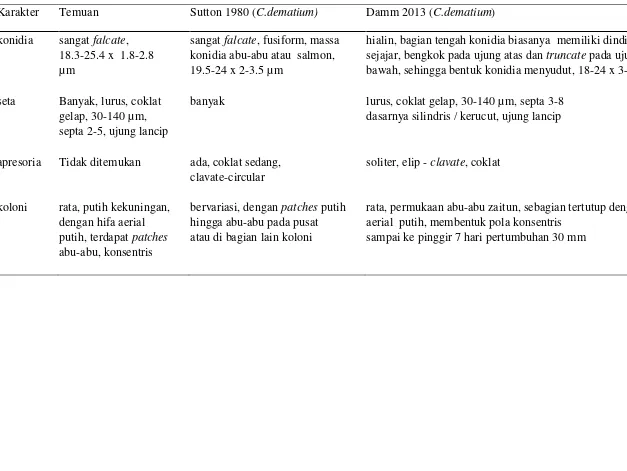
Hasil identifikasi secara morfologi dan bentuk koloni patogen dari pertanaman mentimun di Lumbung ditemukan dua jenis Colletotrichum sp., dengan konidia batang dan falcate. Pada tiga lokasi pertanaman mentimun lainnya yang ditemukan gejala antraknosa, hanya ditemukan satu jenis Colletotrichum sp. dengan bentuk konidia batang dan karakter morfologi yang sama dengan Colletotrichum sp. dengan konidia batang seperti di pertanaman mentimun di Lumbung.
22
Gambar 9 Koloni C. dematium asal mentimun di Lumbung: (a) patches abu-abu, (b) hifa aerial dan pola konsentris
Menurut Sutton (1980) dan Damm (2009), hasil pengamatan bentuk dan pengukuran bagian-bagian morfologi setelah dibandingkan dengan referensi kunci identifikasi (Tabel 2) serta karakter koloni tersebut, karakter Colletotrichum temuan dengan konidia falcate pada mentimun ini mendekati C. dematium.
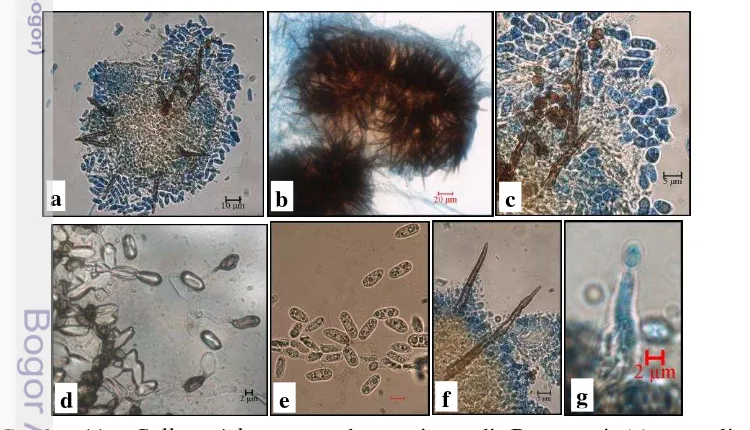
Berdasarkan karakter morfologi Colletotrichum sp. temuan dengan konidia clavate (Gambar 10, 11, 12, 13), massa konidia berupa aservuli, dengan seta lurus, coklat sedang, panjang 30-50 µm, dengan 1-4 septa, ujung lancip atau rounded. Bentuk konidia clavate atausilindris, dengan bagian ujung yang satu runcing dan ujung lainnya tumpul, ukuran (panjang x lebar) adalah 11-13.8 x 3.9-5.1 µm. Apresoria memiliki bentuk clavate atau ovate dan berwarna coklat muda. Konidiofor hialin, bersepta atau bercabang.
Koloni pada media PDA didapatkan permukaannya rata, seluruh tepi hialin, olive sampai hitam keabu-abuan, miselium udara putih sedikit berwarna keabuan. Pertumbuhan koloni lambat, mencapai 16-19 mm pada 17 hari usia koloni dan 80 mm pada 30 hari usia koloni pada media PDA (Gambar 14). Pertumbuhan koloni temuan ini sejalan dengan Sutton (1980) dan Damm (2013), yaitu salah satu karakter pertumbuhan koloni C. orbiculare adalah pertumbuhan koloni yang sangat lambat. Pengamatan terhadap karakter bentuk koloni terutama digunakan penelitian Villanueva (2008) sebagai pembanding karena menggunakan media yang sama yaitu PDA dan pertumbuhan pada berbagai kisaran suhu. Menurut Villanueva (2008), karakter koloni Colletotrichum temuan pada mentimun ini paling mendekati C. orbiculare karena warna isolat tidak bervariasi hanya rata olive sampai hitam keabu-abuan, dengan sedikit miselium udara putih keabuan.
Gambar 8 Colletotrichum dematium asal mentimun di Lumbung; (a) aservuli (400x); (b) konidia (1000x); (c) ujung seta (1000x); (d) dasar seta (1000x); (e) konidifor (1000x)
a b c d e
a
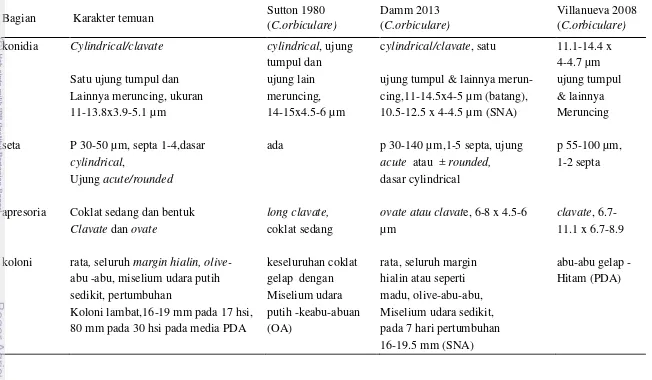
Tabel 2 Identifikasi Colletotrichum sp. dengan bentuk konidia falcate Karakter Temuan Sutton 1980 (C.dematium) Damm 2013 (C.dematium)
konidia sangat falcate, sangat falcate, fusiform, massa hialin, bagian tengah konidia biasanya memiliki dinding 18.3-25.4 x 1.8-2.8 konidia abu-abu atau salmon, sejajar, bengkok pada ujung atas dan truncate pada ujung µm 19.5-24 x 2-3.5 µm bawah, sehingga bentuk konidia menyudut, 18-24 x 3-5.5 µm
seta Banyak, lurus, coklat banyak lurus, coklat gelap, 30-140 µm, septa 3-8
gelap, 30-140 µm, dasarnya silindris / kerucut, ujung lancip
septa 2-5, ujung lancip
apresoria Tidak ditemukan ada, coklat sedang, soliter, elip - clavate, coklat
clavate-circular
koloni rata, putih kekuningan, bervariasi, dengan patches putih rata, permukaan abu-abu zaitun, sebagian tertutup dengan dengan hifa aerial hingga abu-abu pada pusat aerial putih, membentuk pola konsentris
putih, terdapat patches atau di bagian lain koloni sampai ke pinggir 7 hari pertumbuhan 30 mm abu-abu, konsentris
24
Gambar 10 Colletotrichum sp. pada mentimun di Lumbung: (a-b) aservulli (400x), (c) konidia, (d) apresoria (1000x), (e) seta (1000x); (f) konidiofor (1000x)
Gambar 11 Colletotrichum sp. pada mentimun di Bantarsari: (a) aservuli dari jaringan (400x), (b) aservuli dari PDA (200x), (c-d) appressoria (1000x dan 40x), (e) konidia (1000x), (f) seta ujung lancip (1000x), (g) konidiofor (1000x)
a b c
d e f g
a b c
25
Gambar 13 Colletotrichum sp. pada mentimun di Klaten: (a) aservuli dari jaringan (400x), (b) aservulli dari PDA (200x), (c) dasar seta (1000x), (d) apresoria, (e) konidia (1000x), (f-g) seta (1000x), (h) konidiofor (1000x)
a b c
d e f g h
Gambar 12 Colletotrichum orbiculare di Tegalwaru: (a-b) Aservuli, (c) konidia (1000x), (d) apresoria (1000x), (e-f) seta, (g) konidiofor
e f g
26
.
Hasil pengamatan bentuk dan pengukuran bagian-bagian morfologi, terutama konidia dan apresoria setelah dibandingkan dengan kunci identifikasi dan referensi Sutton (1980), Damm (2013), dan Villanueva (2008), karakter Colletotrichum temuan pada mentimun ini paling mendekati C. orbiculare (Tabel 3).
Hasil identifikasi ini menunjukkan bahwa karakter morfologi patogen antraknosa mentimun di Indonesia berbeda dengan yang disebutkan dalam Semangun (1989), yaitu bahwa patogen antraknosa pada mentimun adalah C. lagenarium. Menurut Semangun (1989), karakter morfologi C. lagenarium adalah konidium hialin berbentuk bulat telur, dengan ukuran 13-19 x 4-6 µm. Aservulus memiliki seta berwarna coklat, berdinding tebal, bersekat 2-3, panjangnya 90-120 µm, dan jumlahnya tidak tentu.
C. orbiculare merupakan patogen antraknosa yang paling banyak ditemukan dengan metode pemeriksaan langsung dari jaringan tanaman, sedangkan C. dematium ditemukan dengan frekuensi yang rendah (Tabel 4), dari 30 aservuli yang diperiksa hanya 20 % merupakan C. dematium yang didapatkan dari satu bercak nekrotik antraknosa. Hal ini membuktikan bahwa patogen antraknosa pada mentimun di Indonesia tidak hanya C. orbiculare seperti yang banyak ditemukan di negara-negara lain (Jeun et al. 2008, Photita et al. 2005, Qi et al. 2013), tetapi juga oleh C. dematium. Persentase patogen yang rendah ini diduga karena kondisi lingkungan inang yang kurang sesuai bagi perkembangan C. dematium.
Hal ini sejalan dengan yang dikemukakan oleh Freeman et al. (1998), bahwa inang tunggal mungkin terinfeksi oleh beberapa spesies Colletotrichum, sedangkan beberapa inang juga dapat terinfeksi oleh spesies patogen. Cucurbits termasuk sebagai tanaman yang sering diinfeksi oleh lebih dari spesies Colletotrichum.
Gambar 14 Koloni Colletotrichum orbiculare asal daun mentimun: (a) C. orbiculare usia koloni 7 hari, (b) C. orbiculare usia koloni 17 hari, (c) C. orbiculare usia koloni 30 hari
Tabel 3 Identifikasi Morfologi Colletotrichum sp.dengan konidia clavate
Bagian Karakter temuan Sutton 1980
(C.orbiculare)
Damm 2013 (C.orbiculare)
Villanueva 2008 (C.orbiculare) konidia Cylindrical/clavate cylindrical, ujung cylindrical/clavate, satu 11.1-14.4 x
tumpul dan 4-4.7 µm
Satu ujung tumpul dan ujung lain ujung tumpul & lainnya merun- ujung tumpul Lainnya meruncing, ukuran meruncing, cing,11-14.5x4-5 µm (batang), & lainnya 11-13.8x3.9-5.1 µm 14-15x4.5-6 µm 10.5-12.5 x 4-4.5 µm (SNA) Meruncing seta P 30-50 µm, septa 1-4,dasar ada p 30-140 µm,1-5 septa, ujung p 55-100 µm,
cylindrical, acute atau ± rounded, 1-2 septa
Ujung acute/rounded dasar cylindrical
apresoria Coklat sedang dan bentuk long clavate, ovate atau clavate, 6-8 x 4.5-6 clavate, 6.7-
Clavate dan ovate coklat sedang µm 11.1 x 6.7-8.9
koloni rata, seluruh margin hialin, olive- keseluruhan coklat rata, seluruh margin abu-abu gelap - abu -abu, miselium udara putih gelap dengan hialin atau seperti Hitam (PDA) sedikit, pertumbuhan Miselium udara madu, olive-abu-abu,
Koloni lambat,16-19 mm pada 17 hsi, putih -keabu-abuan Miselium udara sedikit, 80 mm pada 30 hsi pada media PDA (OA) pada 7 hari pertumbuhan
16-19.5 mm (SNA)
28
Tabel 4 Persentase jenis Colletotrichum berdasarkan pemeriksaan langsung pada mentimun asal lokasi pengambilan sampel
Menurut Howards et al. (1992) Strawberry dapat diinfeksi oleh tiga spesies Colletotrichum, yaitu C. fragariae, C. acutatum, dan C. gloesporioides. Sebaliknya, adalah suatu hal yang umum, satu spesies tertentu dapat memiliki inang lebih dari spesies tanaman, termasuk C. dematium, contoh lainnya adalah C. coccodes, C. capsici, dan C gloeosporioides. Sedangkan C. acutatum dilaporkan menginfeksi sejumlah besar tanaman buah antara lain alpokat, strawberry, almond, apel dan cabai (Adaskaveg et al. 1997, Bernsten et al. 1995, Dillard 1992, Freeman et al. 1998, Henz et al. 1992, Than et al. 2008).
Deteksi Colletotrichum sp. pada Mentimun sebagai Patogen Terbawa Benih
Hasil uji blotter test pada benih dilakukan pada benih yang beredar di pasaran dengan jumlah benih uji 800 biji mengikuti standar ISTA. Hasil pengamatan dengan mikroskop stereo dan digital hand mikroskop Dino-Lite, didapatkan 3 cendawan (Gambar 15 dan Gambar 16), secara berurutan dari yang paling besar persentasenya yaitu Aspergillus sp., Fusarium spp., Chaetomium spp., tetapi belum terdapat tanda patogen antraknosa (Tabel 5).
Jenis Colletotrichum Asal
Lumbung Bantarsari Tegalwaru Ceper
C. orbiculare 80% 100% 100% 100%
C. dematium 20% 0% 0% 0%
Gambar 15 Tanda patogen pada benih hasil uji blotter: (a) Aspergills sp., (b) Fusarium sp., (c), Chaetomium sp., (d) Bercak strip
a b
29
Tabel 5. Uji potensi patogen terbawa benih a)
Varietas Tingkat Infeksi (%)
Aspergillus sp. Fusarium sp. Chaetomium sp. Colletotrichum sp. Spot
Strip
Yupiter 3.5 1.6 0 0 0
Jawara 5.9 1.0 0 0 0
Bandana 83 0 0 0 0
Lumintu 12 0.5 0 0 2
Dynasti 0 0 0 0 0.62
Kancil 16 14 0 0 0
Alicia F1 35 0 0 0 0.1
Lokal KB 12 0 1.2 0 0
Lokal BT 4 0.25 4 0 0
Lokal BS 10.5 0 0 0 0
Lokal SK 49 0 0.1 0 0
Lokal BM 37.75 0.6 0 0 0
Keterangan: a) dengan jumlah benih uji 800 biji
Gambar 16 Koloni cendawan pada benih hasil uji blotter: (a) koloni Fusarium sp., (b) konidia Fusarium sp. (400x), (c) koloni Chaetomium sp., (d) peritesium Chaetomium sp. (400x)
a b
30
Menurut penelitian-penelitian sebelumnya terhadap Colletotrichum sp., pada komoditas lainnya, patogen ini bersifat terbawa benih (Choudhary et al. 2013, Opio et al. 2003, Semaškienė et al. 2008, Shovan et al. 2008, Sharma et al. 2008). Hal ini menjadi dasar untuk meningkatkan jumlah benih yang diuji, yaitu dengan jumlah benih uji sebanyak 1600 benih. Hasil uji blotter test dengan jumlah ini adalah ditemukan presentase benih terinfeksi sebesar 0.38% (Tabel 6).
Meskipun nilainya rendah, hal ini membuktikan bahwa patogen atraknosa pada mentimun bersifat sebagai patogen terbawa benih. Hal ini sejalan dengan penelitian-penelitian patogen antraknosa pada benih komoditas lainnya. Menurut Frank (1883) dalam Singh dan Mathur (2004), C. lindemuthianum merupakan cendawan terbawa benih pertama kali yang miseliumnya ditemukan melakukan penetrasi ke dalam kotiledon kacang (Phaseolus vulgaris).
Tabel 6 Tingkat infeksi antraknosa dengan ukuran benih berbeda
Jumlah Benih Infeksi (%)
800 0
1600 0.38
Gejala khas antraknosa oleh Colletotrichum spp. teramati pada akar dan hipokotil bibit lupin, dengan tingkat infeksi bervariasi dari rendah sampai tinggi, dan berbeda antara varietas yang diuji (Semaškienė et al. 2008). Menurut Begum et al. (2008), C. truncatum sangat berpotensi menginfeksi seluruh komponen benih. Infeksi maksimum tercatat mencapai 100% pada kulit benih setelah inkubasi dimulai, infeksi pada kotiledon dan embrio meningkat terus dan mencapai tingkat maksimum, secara berturut-turut, 43% dan 30% setelah empat hari inkubasi. Menurut Varma, Singh, dan Singh dalam Singh dan Mathur (2004), infeksi yang berat C. dematium ditemukan pada seluruh komponen benih Vigna aconitifolia dan Cyamopsis tetragonoloba yang dikategorikan terinfeksi secara alami. Hifa ditemukan pada kulit benih, parenkima, embrio-kotiledon, hipokotiledon, akar. Benih yang terinfeksi berat tidak dapat berkecambah.
Gambar 17 Infeksi antraknosa pada benih: (a) aservuli Colletotrichum sp. pada hipokotil, (b) Konidia perbesaran 400x
31
Infeksi Colletotrichum sp. pada benih timun dalam penelitian ini, meskipun nilai persentasenya kecil, tetapi aservuli dan konidia ditemukan pada hipokotil yang merupakan perkembangan dari embrio (Gambar 17). Menurut Singh dan Mathur (2004), pada infeksi tingkat sedang, miselium biasanya hanya terbatas pada kulit benih, ruang antara kulit benih dan endosperma, dan lapisan luar endosperma. Hifa jarang mencapai embrio. Pada infeksi yang berat, hifa inter- dan intraselular serta aservuli dapat mencapai kulit benih, endosperma, embrio.
Dalam buah berdaging, seperti mentimun, melon, terong, tomat, paprika dan lain-lain, infeksi dapat terjadi secara langsung melalui funiculus atau di tegument, selama proses pembentukan biji. C. lagenarium dalam semangka, mampu menginfeksi dari plasenta dan menembus ke ovula yang sedang berkembang atau biji yang masih dalam proses pembentukannya dan kulitnya belum mengalami lignifikasi (Nome 2002). Menurut Huber dan Gould (1949) dalam Agarwal dan Sinclair (1996), C. lagenarium menginfeksi semangka melalui bukaan luka dan menginvasi lapisan epidermal pada sel palisade dan lapisan sklerenkima dari kulit benih. Koloni hifa meluas ke parenkima dan jaringan kulit benih lainnya.
Tingkat infeksi pada benih yang rendah dalam penelitian ini disebabkan benih yang diuji telah mendapat perlakuan fungisida dari produsen benih. Menurut Setiyowati et al. (2007), perlakuan seed coating dengan benomil berpengaruh nyata terhadap penurunan tingkat infeksi cendawan C. capsici pada benih dan hipokotil cabai. Menurut Choudary et al. (2013), perlakuan benih cabai dengan fungisida bavistin paling efektif mengendalikan patogen Colletotrichum sp. pada benih cabai yaitu mencapai 68% dibandingkan fungisida thiram, captan dan indofil M-45.