1. PENDAHULUAN
1.1 Latar Belakang
Hasil perairan merupakan komoditi yang mudah sekali mengalami kerusakan atau biasa dikenal dengan istilah perishable food. Berbagai upaya dilakukan untuk mencegah hal tersebut, yaitu dengan dilakukannya pengolahan agar bahan baku dapat lebih awet. Pengawetan yang dilakukan antara lain pengeringan, pengasapan, penggaraman, penggorengan, pembekuan, fermentasi dan lain-lain.
Fermentasi merupakan suatu cara pengolahan melalui proses memanfaatkan penguraian senyawa dari bahan-bahan protein kompleks. Protein kompleks tersebut terdapat dalam tubuh ikan yang diubah menjadi senyawa-senyawa lebih sederhana dengan bantuan enzim yang berasal dari tubuh ikan atau mikroorganisme serta berlangsung dalam keadaan yang terkontrol (Adawyah 2007).
Makanan hasil fermentasi laktat tanpa disadari telah lama menjadi bagian di dalam menu makanan sehari-hari di beberapa kawasan di Indonesia. Bekasam atau bekacem, yang berasal dari Sumatera Selatan, merupakan ikan awetan dengan cara fermentasi bakteri asam laktat. Bekasam bukan saja merupakan makanan tradisional yang digemari, tetapi juga menjadi contoh pengawetan secara biologis yang luas penggunaannya. Makanan sejenis juga ditemukan di Filipina,
yaitu burongisda, di Jepang, yaitu naresushi atau funasushi (The National Academy 1992) dan di Thailand, yaitu pla-ra, pla-paeng-daeng,
pla-chao, pla-chom, pla-som, dan lain-lain. Pada penelitian sebelumnya, Tanasupawat et al. (1998) melaporkan bahwa dari produk pla-ra telah berhasil diisolasi strain Lactobacillus, Leuconostoc, Pediococcus, Enterococcus dan Staphylococcus.
dan sisanya dihasilkan secara sintetis (Hidayat et al. 2006). Produksi asam oleh bakteri asam laktat berjalan secara cepat, hal ini dapat menyebabkan pertumbuhan mikroorganisme lain yang tidak diinginkan dapat terhambat (Fardiaz 1992).
Bakteri asam laktat juga mempunyai aktivitas terapeutik pada pangan fermentasi, antara lain sebagai serum kolesterol, anti tumor dan antibakteri (Biotol 1991). Salah satu karakteristik yang paling penting dari BAL adalah kemampuannya untuk memproduksi beragam metabolit dengan sifat antimikroba, antara lain asam laktat, asam asetat, etanol, diasetil, CO2, H2O2, reuterin dan bakteriosin (Roller 2003). Sifat antibakteri serta senyawa aktif dalam BAL (bakteriosin) penting di dalam industri pangan, karena kemampuannya dapat menghambat kontaminasi mikroorganisme pembusuk dan mikroorganisme patogen, sehingga pangan menjadi lebih awet.
Beberapa penelitian yang telah dilakukan menunjukkan bahwa BAL asal pangan fermentasi mampu menghasilkan senyawa antibakteri yang menghambat pertumbuhan beberapa bakteri patogen pada pangan. Salah satu yang mempengaruhi pertumbuhan BAL adalah suhu dan kondisi lingkungan pertumbuhan. Bakteri asam laktat memiliki potensi dalam menghasilkan bioaktif yang berfungsi sebagai antibakteri, oleh karena itu perlu dilakukan karakterisasi
isolat menggunakan Bergey’s Manual (Holt et al. 1994) untuk menduga genus bakteri yang akan menghasilkan aktivitas antibakteri, selanjutnya isolat dilakukan uji aktivitas antibakteri dengan kondisi kultivasi yang berbeda untuk mengetahui pengaruh kondisi kultivasi dalam memproduksi senyawa antibakteri.
1.2 Tujuan
2. TINJAUAN PUSTAKA
2.1Fermentasi
Fermentasi merupakan suatu cara pengolahan melalui proses memanfaatkan penguraian senyawa dari bahan-bahan protein kompleks. Protein kompleks tersebut terdapat dalam tubuh ikan yang diubah menjadi senyawa-senyawa lebih sederhana dengan bantuan enzim yang berasal dari tubuh ikan atau mikroorganisme serta berlangsung dalam keadaan yang terkontrol (Adawyah 2007). Fermentasi secara teknik dapat didefinisikan sebagai suatu proses oksidasi anaerobik atau partial anaerobik karbohidrat yang menghasilkan alkohol serta beberapa asam, namun banyak proses fermentasi yang menggunakan substrat protein dan lemak (Muchtadi dan Ayustaningwarno 2010).
Fermentasi terbagi menjadi dua, yaitu fermentasi spontan dan tidak spontan (membutuhkan starter). Fermentasi spontan adalah fermentasi yang biasa dilakukan menggunakan media penyeleksi, seperti garam, asam organik, asam mineral, nasi atau pati. Media penyeleksi tersebut akan menyeleksi bakteri patogen dan menjadi media yang baik bagi tumbuh kembang bakteri selektif yang membantu jalannya fermentasi. Fermentasi tidak spontan adalah fermentasi yang dilakukan dengan penambahan kultur organisme bersama media penyeleksi sehingga proses fermentasi dapat berlangsung lebih cepat (Rahayu et al. 1992).
Hasil fermentasi diperoleh sebagai akibat metabolisme mikroba-mikroba pada suatu bahan pangan dalam keadaan anaerob. Mikroba yang melakukan fermentasi membutuhkan energi yang umumnya diperoleh dari glukosa. Dalam keadaan aerob, mikroba mengubah glukosa menjadi air, CO2 dan energi (ATP). Beberapa mikroba hanya dapat melangsungkan metabolisme dalam keadaan anaerob dan hasilnya adalah substrat yang setengah terurai. Hasil penguraiannya adalah air, CO2, energi dan sejumlah asam organik lainnya, seperti asam laktat, asam asetat, etanol serta bahan-bahan organik yang mudah menguap. Perkembangan mikroba-mikroba dalam keadaan anaerob biasanya dicirikan sebagai proses fermentasi (Muchtadi dan Ayustaningwarno 2010).
atom hidrogen, menghasilkan senyawa karbon lainnya yang lebih teroksidasi daripada glukosa, (2) senyawa yang teroksidasi tersebut direduksi kembali oleh atom hidrogen yang dilepaskan dalam tahap pertama, membentuk senyawa-senyawa lain sebagai hasil fermentasi (Fardiaz 1989).
Tahap pertama fermentasi glukosa selalu menghasilkan asam piruvat. Jasad renik melakukan pemecahan glukosa menjadi asam piruvat melalui empat jalur, yaitu:
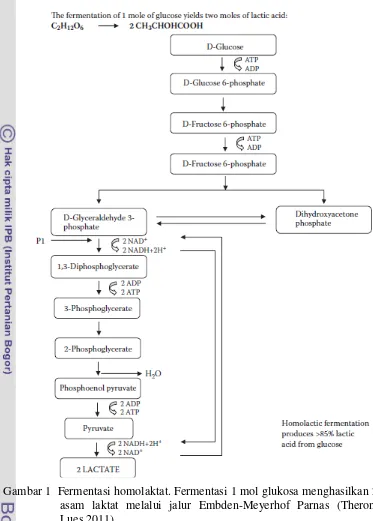
1. Jalur Embden-Meyerhof-Parnas (EMP) atau glikolisis, ditemukan pada fungi dan kebanyakan bakteri, serta hewan dan manusia.
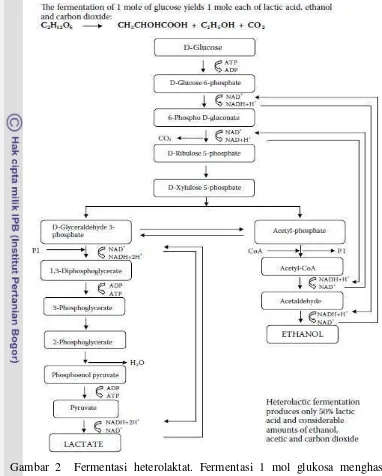
2. Jalur Entner-Doudoroff (ED), hanya ditemukan pada beberapa bakteri. 3. Jalur Heksosamonofosfat (HMF), ditemukan pada berbagai organisme. 4. Jalur Fosfoketolase (FK), hanya ditemukan pada bakteri yang tergolong
laktobasili heterofermentatif .
Jalur EMP terdiri dari beberapa tahap, masing-masing dikatalis oleh enzim tertentu. Jalur tersebut ditandai dengan pembentukan fruktosa difosfat, kemudian pemecahan menjadi dua molekul gliseraldehida fosfat. Reaksi ini dikatalis oleh enzim aldolase. Kemudian terjadi reaksi dehidrogenasi gliseraldehida fosfat yang merupakan reaksi oksidasi yang menghasilkan energi dalam bentuk ATP. Reaksi ini dikatalis oleh enzim gliseraldehida fosfat dehidrogenase. Atom hidrogen yang terlepas akan ditangkap oleh NAD membentuk NADH2. Proses fermentasi dapat berlangsung terus jika NADH2 dapat dioksidasi kembali pada tahap kedua fermentasi sehingga melepaskan atom hidrogen kembali. Jadi NAD berfungsi sebagai pembawa hidrogen dalam proses fermentasi (Fardiaz 1989).
Jalur FK merupakan percabangan dari jalur HMF, karena bakteri ini tidak mempunyai enzim aldolase yang dapat memecah fruktosa 1,6-difosfat menjadi 2 triose-fosfat, dan tidak mempunyai enzim transaldolase dan transketolase yang penting dalam jalur HMF (Fardiaz 1989).
2.2Bekasam
Bekasam merupakan produk olahan ikan dengan cara fermentasi yang rasanya asam. Olahan tersebut banyak dikenal di daerah Jawa Tengah, Sumatera Selatan dan Kalimantan Selatan. Ikan yang dapat digunakan sebagai bekasam merupakan jenis ikan air tawar. Pengolahan bekasam di daerah Kalimantan Selatan umumnya dikenal dengan nama samu. Bahan baku berupa ikan gabus, betok, sepat siam dan sepat rawa dengan penambahan garam sekitar 15-20%, dan ditambahkan samu atau beras ginseng sebanyak 15%, kemudian difermentasi sekitar satu minggu sampai menghasilkan aroma dan rasa yang khas bekasam (Adawyah 2007).
Produk-produk fermentasi ikan yang menggunakan garam dan bahan yang berfungsi sebagai sumber karbohidrat banyak terdapat di negara-negara Asia Tenggara. Burongisda adalah produk sejenis bekasam yang berasal dari Filipina. Burongisda ini dibuat dari campuran ikan air tawar, nasi, garam dan angkak
(beras merah sebagai pewarna). Proses fermentasi pada pembuatan burongisda berlangsung sampai daging ikan menjadi lembut serta rasa dan bau asam mulai berkembang. Bakteri asam laktat yang dominan pada burongisda adalah Leuconostoc mesenteroides, Pediococcus cereviceae dan Lactobacilus plantarum (Rahayu et al. 1992).
Pla-ra merupakan produk sejenis bekasam yang berasal dari Thailand
dengan waktu fermentasi selama 6 bulan. Proses pembuatan pla-ra biasanya menggunakan udang sebagai tambahan bahan baku yang berfungsi sebagai pembentuk aroma. Produk pla-ra mengandung protein sebesar 11,61-23,32%, pH sekitar 4,10-6,90 dan asam laktat sebesar 0,17-1,94%. Mikroba yang ditemukan pada produk ini adalah Pediococcus halophilus, Staphylococcus epidermidis, Micrococcus sp. dan Bacillus sp. (Rahayu et al. 1992).
lanjut menjadi komponen-komponen lain yang berperan dalam membentuk citarasa produk (Adawyah 2007).
Kualitas produk-produk ikan fermentasi dijaga untuk waktu yang relatif lama karena adanya penghambatan pertumbuhan bakteri lain oleh hidrogen peroksida dan antibiotik yang dihasilkan oleh Lactobacilli (Irianto 2008).
2.3Bakteri Asam Laktat (BAL)
Bakteri asam laktat adalah kelompok bakteri yang melakukan penguraian karbohidrat (glukosa) menjadi asam laktat yang akan menurunkan pH serta menimbulkan rasa asam (Muchtadi dan Ayutaningwarno 2010). Anggota bakteri asam laktat merupakan bakteri Gram-positif, batang atau kokus yang tunggal, berpasangan atau rantai tidak berspora, terkadang membentuk segi empat, katalase negatif, toleran terhadap asam dan anaerob fakultatif (Defigueredo dan Splittstoesser 1976; Mozzi et al. 2010). Bakteri yang termasuk kelompok bakteri asam laktat adalah Aerococcus, Carnobacterium, Enterococcus, Lactobacillus, Lactococcus, Leuconostoc,
Pediococcus (Ringo dan Gatesoupe 1998).
Gambar 2 Fermentasi heterolaktat. Fermentasi 1 mol glukosa menghasilkan masing-masing 1 mol asam laktat, etanol dan karbondioksida melalui jalur fosfoketolase (Theron dan Lues 2011).
bahkan virus. Spektrum antimikroba bervariasi tergantung pada spesifikasi metabolit (Roller 2003).
Bakteri asam laktat termasuk mikroorganisme yang aman jika ditambahkan dalam pangan karena sifatnya tidak toksik dan tidak menghasilkan toksin, maka disebut food grade microorganism atau dikenal sebagai mikroorganisme yang Generally Recognized As Safe (GRAS), yaitu mikroorganisme yang tidak beresiko terhadap kesehatan, bahkan beberapa jenis bakteri tersebut berguna bagi kesehatan. Bakteri asam laktat bermanfaat untuk peningkatan kualitas higiene dan keamanan pangan melalui penghambatan secara alami terhadap flora berbahaya yang bersifat patogen (Daeschel 1983 diacu dalam Kusmiati dan Malik 2002).
Efektivitas BAL dalam menghambat bakteri pembusuk dipengaruhi oleh kepadatan dan strainnya serta komposisi media (Jeppensen dan Huss 1993 diacu dalam Rostini 2007). Produki substansi penghambat dari BAL dipengaruhi oleh media pertumbuhan, pH, dan temperatur lingkungan (Ahn dan Stiles 1990 diacu dalam Rostini 2007).
2.4 Faktor yang Mempengaruhi Pertumbuhan Bakteri Asam Laktat
Proses fermentasi sangat dipengaruhi oleh adanya pertumbuhan bakteri asam laktat. Oleh karena itu, perlu dibuat kondisi yang ideal bagi pertumbuhan bakteri tersebut. Faktor-faktor lingkungan yang mempengaruhi pertumbuhan bakteri asam laktat antara lain adalah suhu, nilai pH, kadar garam, dan karbohidrat.
Garam sering digunakan dalam proses fermentasi ikan. Jumlah garam yang ditambahkan dalam pembuatan bekasam berkisar antara 15-20% dari berat ikan segar (Murtini 1992). Kebutuhan garam untuk pertumbuhan optimum mikroorganisme bervariasi, tergantung dari sifat dinding sel dan tekanan osmotik internalnya (Fardiaz 1992). Karbohidrat merupakan sumber energi bagi bakteri asam laktat. Penambahan karbohidrat akan membuat lingkungan yang baik bagi pertumbuhan bakteri tersebut. Selama fermentasi, karbohidrat akan diuraikan menjadi senyawa-senyawa yang sederhana seperti asam laktat, asam asetat, asam propionat dan etil alkohol. Senyawa-senyawa ini yang meyebabkan rasa asam pada produk dan dapat berfungsi sebagai pengawet (Rahayu et al. 1992).
2.5 Senyawa Antimikroba
Bakteri asam laktat dapat berfungsi sebagai pengawet makanan karena mampu memproduksi asam organik, menurunkan pH lingkungannya dan mengekskresikan senyawa yang mampu menghambat mikroorganisme pathogen, seperti H2O2, diasetil, CO2, asetaldehida, d-isomer asam asam amino dan bakteriosin (Hardy 1975 diacu dalam Kusmiati dan Malik 2002). Sifat menghambat dapat disebabkan oleh lepasnya komponen intraselular antimikroba, seperti asam organik, bakteriosin dan hidrogen peroksida, dari sel nonmetabolit bakteri asam laktat (Roller 2003).
2.5.1 Asam organik
Aksi antimikroba dari asam organik terutama berdasarkan pada kemampuannya dalam mereduksi pH pangan dalam fase air. Ketika nilai pH <4, asam menghambat pertumbuhan bakteri. Mekanisme antimikroba berdasarkan pada hambatan enzim, fungsi membran, transpor nutrien, dan keseluruhan aktivitas metabolik. Asam organik dalam pangan dapat berperan sebagai pengawet, sedangkan garam atau esternya efektif sebagai antimikroba pada pH yang mendekati netral (Roller 2003).
permukaan membran dirusak oleh asam laktat sehingga substrat antimikroba yang lain, yaitu diasetil, bakteriosin, hidrogen peroksida dan laktoperidase sistem dapat berpenetrasi ke dalam membran sitoplasma (Alokomi et al. 2000). Pertumbuhan bakteri Gram-positif dan negatif berkurang, diindikasikan oleh meningkatnya aksi bakteriosin. Asam laktat memiliki efek bakterisidal pada pH dibawah 5, khususnya pada bakteri Gram-negatif (Ray 2004).
Asam asetat digunakan pada jenis makanan berbeda-beda untuk menghambat pertumbuhan dan mengurangi kelangsungan hidup bakteri Gram-positif dan negatif, ragi dan kapang. Asam asetat umumnya bakteriostatik pada 0,2% tapi bakterisidal diatas 0,3% dan lebih efektif menghambat bakteri Gram-negatif (Ray 2004).
2.5.2 Hidrogen peroksida (H2O2)
Beberapa bakteri asam laktat memproduksi H2O2 dibawah kondisi pertumbuhan aerobik dan, karena kurangnya katalase selular, pseudokatalase, atau peroksidase, mereka melepas H2O2 ke lingkungan untuk melindungi diri mereka sendiri dari aksi antibakteri (Ray 2004). Hidrogen peroksida diproduksi oleh bakteri asam laktat sebagai hasil dari aksi flavoprotein oksidase atau nikotinamida adenine dinukleotida (NADH) peroksidase. Efek antimikroba dari H2O2 adalah hasil dari oksidasi grup sulfihidril yang menyebabkan denaturasi sejumlah enzim, dan dari peroksidase membran lipid meningkatkan permeabilitas membran (Kong dan Davison 1980 diacu dalam Ammor et al. 2006). Beberapa strain dapat memproduksi, pada kondisi pertumbuhan yang cocok, H2O2 yang cukup menyebabkan bakteriostatik (6-8 µg/ml) tapi jarang bersifat bakterisidal (30-40 µg/ml) (Ray 2004). Hidrogen peroksida dapat juga sebagai prekursor untuk produksi bakterisidal radikal bebas seperti superoksida (O2-) dan radikal hidroksil (OH-) yang dapat merusak DNA (Byczkowski dan Gessner 1988 diacu dalam Ammor et al. 2006).
menyebabkan efek yang tidak diinginkan dalam mutu pangan, seperti diskolorasi pada daging yang diproses, sehingga penggunaannya terbatas dalam pengawetan pangan (Ray 2004).
2.5.3 Karbondioksida (CO2)
Karbondioksida diproduksi terutama oleh BAL heterofermentatif. Karbon
dioksida memainkan peranan penting dalam membuat lingkungan anaerobik yang menghambat enzimatik dekarboksilase, dan akumulasi CO2 membran lipid
bilayer dapat menyebabkan disfungsi permeabilitas (Eklund 1984 diacu dalam Ammor et al. 2006). Karbon dioksida secara efektif dapat menghambat banyak mikroorganisme perusak makanan, terutama bakteri psikrotropik Gram-negatif (Farber 1991 diacu dalam Ammor et al. 2006).
2.5.4 Diasetil
Diasetil diproduksi oleh strain dalam semua genera dari BAL oleh fermentasi sitrat (Ray 2004). Diasetil menghambat pertumbuhan bakteri Gram-negatif yang bereaksi dengan pemanfaatan arginin (Jay 1986 diacu dalam Ammor et al. 2006). Antibakteri ini efektif terhadap bakteri Gram-positif dan negatif.
Bakteri Gram-negatif sebagian sensitif pada pH ≤5. Diasetil efektif pada konsentrasi 0,1-0,25%. Studi terkini menunjukkan bahwa diasetil lebih bakterisidal bila dikombinasi dengan panas. Aksi antibakteri kemungkinan diproduksi dengan deaktivasi beberapa enzim penting. Grup karbonil (-CO-CO-) bereaksi dengan arginin pada enzim dan memodifikasi situs katalitiknya (Ray 2004).
2.5.5 Bakteriosin
Kata bakteriosin biasanya digunakan pada peptida bioaktif yang diproduksi oleh banyak strain bakteri dari grup Gram-negatif dan positif. Bakteriosin yang diproduksi oleh banyak strain bakteri asam laktat dan beberapa bakteri asam propionat merupakan bagian khusus dalam mikrobiologi pangan karena efek bakterisidalnya biasanya untuk membedakan kerusakan akibat bakteri Gram-positif dan patogen, dan pada kondisi stress bakteri Gram-negatif yang penting dalam pangan (Ray 2004).
nitrogen, dan konsentrasi NaCl (Kim dan Ahn 2000 diacu dalam Usmiati dan Marwati 2007). Peptida bakteriosin disintesis di ribosom, kationik, amfipatik,
mempunyai struktur α-helical atau β-sheet, atau keduanya, dan dapat memiliki
thioether, jembatan disulfida atau grup thiol bebas. Keberadaan struktur α-helical amfipatik dengan sisi polar dan nonpolar yang berlawanan sepanjang poros yang panjang memungkinkan bakteriosin untuk berinteraksi, baik dengan fase air dan lemak, ketika mengikat permukaan membran sel bakteri yang sensitif, penting untuk destabilisasi fungsional dan kematian sel (Ray 2004).
Mekanisme aktivitas bakterisidal bakteriosin adalah sebagai berikut: (1) molekul bakteriosin kontak langsung dengan membran sel, (2) proses kontak ini mampu mengganggu potensial membran berupa destabilitas membran sitoplasma sehingga sel menjadi tidak kuat, dan (3) ketidakstabilan membran mampu memberikan dampak pembentukan lubang atau pori pada membran sel melalui proses gangguan terhadap PMF (Proton Motive Force) (Gonzalez et al. 1996 diacu dalam Usmiati 2007).
Bakteriosin dapat diproduksi oleh Lactococcus, Lactobacillus dan Pediococcus yang berasal dari berbagai bahan makanan. Beberapa kelebihan
bakteriosin sehingga potensial digunakan sebagai biopreservatif, yaitu (i) bukan bahan toksik dan mudah mengalami degradasi oleh enzim proteolitik karena merupakan senyawa protein; (ii) tidak membahayakan mikroflora usus karena mudah dicerna oleh enzim saluran pencernaan; (iii) dapat mengurangi penggunaan bahan kimia sebagai pengawet pangan; (iv) penggunaannya fleksibel; dan (v) stabil terhadap pH dan suhu yang cukup luas sehingga tahan terhadap proses pengolahan yang melibatkan asam dan basa, serta kondisi panas dan dingin (Cleveland et al. 2001 diacu dalam Usmiati dan Marwati 2007).
Beberapa studi menunjukkan bahwa strain yang berbeda dalam spesies atau bahkan spesies yang berbeda dapat memproduksi bakteriosin yang sama. Bakteriosin yang diproduksi oleh spesies/strain BAL yang berbeda memiliki karakteristik fisika dan kimia yang sangat berbeda. Bakteriosin dikelompokkan
2.6 Cara Kerja Zat Antimikrobial
Secara umum, kemungkinan situs serangan suatu zat antimikrobial dapat diduga dengan meninjau struktur serta komposisi sel mikroba. Sel hidup yang normal memiliki sejumlah besar enzim yang melangsungkan proses-proses metabolik dan juga protein lainnya, asam nukleat serta senyawa-senyawa lain. Kerusakan pada salah satu dari situs ini dapat mengawali terjadinya perubahan-perubahan yang menuju pada matinya sel tersebut. Perubahan tersebut antara lain (Pelczar dan Chan 2005):
(a) Kerusakan pada dinding sel
Struktur dinding sel dapat dirusak dengan cara menghambat pembentukannya atau mengubahnya setelah selesai terbentuk.
(b) Perubahan permeabilitas sel
Membran sitoplasma mempertahankan bahan-bahan tertentu di dalam sel serta mengatur aliran keluar masuknya bahan-bahan lain. Membran memelihara integritas komponen-komponen selular. Kerusakan pada membran ini akan mengakibatkan terhambatnya pertumbuhan sel atau matinya sel.
(c) Perubahan molekul protein dan asam nukleat
Hidupnya suatu sel bergantung pada terpeliharanya molekul-molekul protein dan asam nukleat dalam keadaan alamiahnya. Suatu kondisi atau substansi yang mengubah keadaan ini, yaitu mendenaturasikan protein dan asam-asam nukleat dapat merusak sel tanpa dapat diperbaiki kembali. Suhu tinggi dan konsentrasi pekat beberapa zat kimia dapat mengakibatkan koagulasi (denaturasi) ireversibel komponen-komponen selular yang vital ini.
(d) Penghambatan kerja enzim
Setiap enzim yang ada di dalam sel merupakan sasaran potensial bagi bekerjanya suatu penghambat. Penghambatan ini dapat mengakibatkan terganggunya metabolisme atau matinya sel.
(e) Penghambatan sintesis asam nukleat dan protein
2.7 Bakteri Uji
Bakteri uji merupakan bakteri yang bersifat patogen dan digunakan sebagai tolak ukur untuk mengetahui besarnya tingkat aktivitas antibakteri. Bakteri yang digunakan pada penelitian ini, yaitu Escherichia coli, Salmonella typhimurium, dan Listeria monocytogenes.
2.7.1 Escherichia coli
Escherichia coli merupakan bakteri Gram-negatif, motil, tidak berspora,
berbentuk batang dan anaerobik fakultatif. Escherichia coli menyebabkan penyakit diare. Escherichia coli juga penyebab utama infeksi urin dan infeksi nosokomial termasuk septisemia dan meningitis (Holt et al. 1994). Escherichia coli secara umum terdapat pada usus hewan ruminansia. Sumber makanan yang berasosiasi dengan E.coli adalah daging mentah, susu, air (Wallace et al. 2011).
Gambar 3 Escherichia coli (Bio Research Laboratories, Inc. 2010). 2.7.2 Salmonella typhimurium
Salmonella typhimurium merupakan bakteri Gram-negatif, tidak berspora,
fakultatif anaerobik, motil, tidak membentuk spora. Salmonella menghasilkan
gas ketika ditumbuhkan pada media yang mengandung glukosa (Pelczar dan Chan 2005). Salmonella mesofilik, suhu pertumbuhan optimum
35-37 oC, tapi umumnya memiliki range pertumbuhan 5-46 oC. Salmonella mati pada suhu dan waktu pasteurisasi, sensitif pada pH rendah (Ray 2004). Salmonella dapat menyebabkan gastroenteritis, diare, nausea dan muntah
Gambar 2 Salmonella typhimurium (Bio Research Laboratories, Inc. 2010). 2.7.3 Listeria monocytogenes
Listeria monocytogenes merupakan bakteri Gram-positif, psikrotropik, fakultatif anaerobik, tidak berspora, motil, batang pendek. Pada kultur segar, selnya terkadang membentuk rantai pendek. Listeria monocytogenes tumbuh pada kisaran 1-44 oC, dengan suhu pertumbuhan optimum 35-37 oC. Bakteri ini memfermentasi glukosa tanpa menghasilkan gas. Sel ini cukup resisten terhadap
pembekuan, pengeringan, kadar garam tinggi, dan pH ≥5. Listeria monocytogenes sensitif terhadap suhu pasteurisasi (Ray 2004). Bakteri ini secara alami terdapat pada tanah, usus hewan dan area pengolahan yang lembab (Wallace et al. 2011).
3. METODOLOGI
3.1. Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari-Agustus 2011, bertempat di Laboratorium Mikrobiologi Hasil Perairan dan Laboratorium Bioteknologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, serta Laboratorium Terpadu, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
3.2. Bahan dan Alat
Isolat BP (8) diisolasi dari produk bekasam ikan sepat rawa (lama fermentasi 4 hari) asal kecamatan Indralaya, Kabupaten Ogan Ilir, Sumatera Selatan. Bakteri uji yang digunakan adalah Escherichia coli, Salmonella typhimurium dan Listeria monocytogenes. Media yang digunakan adalah nutrient
agar/broth (Oxoid CM 0003), media de Man Rogosa Sharpe agar (MRSA) (Oxoid CM 0361), Lactobacillus MRSB HIMEDIA, Mueller Hinton Agar (MHA), Sulfid Indol Motility (SIM).
Bahan yang digunakan adalah malachite green (Merck), minyak immersi (Merck), H2O2 3% (Merck), fenolftalein (Merck), p-aminodimetilanilin oksalat 1% (Merck), ammonium sulfat (Merck), NaH2PO4 (Merck), Na2HPO4 (Merck), NaCl (Merck), NaOH 0,1 N (Merck), NaOH 1 N (Merck), kristal violet (Merck), lugol (Merck), safranin (Merck), kertas saring Whattman 42, kertas pH dan millipore.
Alat yang digunakan untuk penelitian ini adalah Spectronic 20, Thermolyne type 42000 incubator, Yamato shaker waterbath, Yamato SM52 autoclave, Yamato type MH61 magnetic stirrer, Hitachi Himac CR 21G
high-speed refrigerated centrifuge dan Olympus Optical mikroskop (Lampiran 1).
3.3. Metode Penelitian
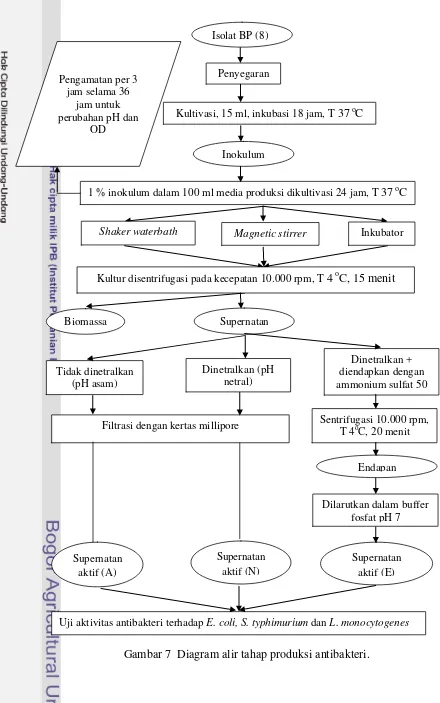
parameter yang diukur adalah optical density (OD) dan pH; c) pemanenan, supernatan diberi tiga perlakuan yaitu tidak dinetralkan, dinetralkan dan dinetralkan lalu diendapkan dengan ammonium sulfat 50% saturasi; d) uji aktivitas antibakteri menggunakan metode agar well diffusion, pada tahap ini yang diukur adalah diameter zona bening. Diagram alir penelitian dapat dilihat pada Gambar 6 dan 7.
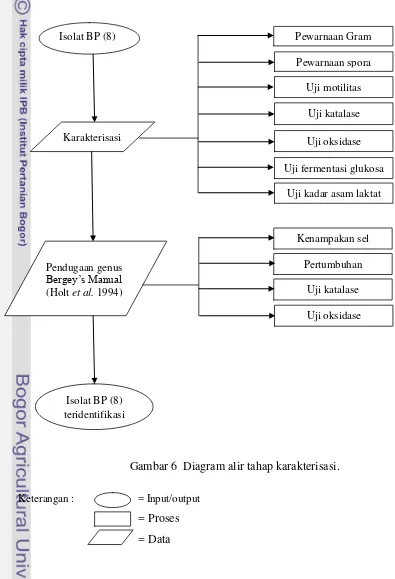
Gambar 6 Diagram alir tahap karakterisasi. Keterangan : = Input/output
= Proses = Data
Isolat BP (8) Pewarnaan Gram
Karakterisasi
Pendugaan genus Bergey’s Manual (Holt et al. 1994)
Isolat BP (8) teridentifikasi
Uji kadar asam laktat Pewarnaan spora
Uji motilitas
Uji katalase
Uji oksidase
Uji fermentasi glukosa
Kenampakan sel
Pertumbuhan
Uji katalase
Gambar 7 Diagram alir tahap produksi antibakteri. Uji aktivitas antibakteri terhadap E. coli, S. typhimurium dan L. monocytogenes
Dinetralkan (pH
1 % inokulum dalam 100 ml media produksi dikultivasi 24 jam, T 37 oC
Shaker waterbath Magnetic stirrer Inkubator
Kultur disentrifugasi pada kecepatan 10.000 rpm, T 4 oC, 15 menit
3.3.1 Karakterisasi isolat
Isolat BP (8) diperoleh dari hasil isolasi bakteri asal bekasam ikan sepat rawa yang diperoleh dari kecamatan Indralaya, Kabupaten Ogan Ilir, Sumatera Selatan. Tujuan karakterisasi adalah untuk verifikasi isolat BP (8) sebagai kelompok BAL dan menentukan pendugaan genus. Bakteri asam laktat merupakan bakteri Gram positif, batang atau kokus tunggal, berpasangan atau rantai tidak berspora, terkadang membentuk segiempat, katalase negatif, toleran terhadap asam dan anaerob fakultatif (Defigueredo dan Splittstoesser 1976; Mozzi et al. 2010). Karakterisasi isolat BP (8) untuk verifikasi meliputi pewarnaan Gram, pewarnaan spora, uji motilitas, uji katalase, oksidase, kadar asam laktat dan fermentasi glukosa. Pendugaan genus dilakukan mengikuti tahap karakterisasi menurut Bergey’s Manual (Holt et al. 1994) (Lampiran 2).
(1) Pewarnaan Gram (Fardiaz 1989)
Lapisan tipis dibuat secara aseptis dari suspensi bakteri di atas gelas objek dan dilakukan fiksasi pada udara terbuka. Lapisan tipis ini ditetesi zat warna kristal violet dan dibiarkan selama 1 menit, kemudian dibilas dengan air kran dengan cara memegang gelas objek pada posisi miring. Sisa air yang tertinggal pada gelas objek dibuang dan ditetesi dengan lugol serta dibiarkan selama 1 menit. Gelas objek dibilas kembali, kemudian dihilangkan warnanya dengan menggunakan alkohol 96% dan dibiarkan selama 10-20 detik, lalu dibilas. Olesan pada gelas objek kemudian diwarnai dengan safranin dan dibiarkan selama 10-20 detik. Objek gelas selanjutnya dibilas dengan air dan dikeringkan dengan kertas serap (tissue). Preparat ini diamati dibawah mikroskop menggunakan lensa objektif yang telah diolesi minyak immersi. Bakteri-Gram positif akan ditunjukkan dengan warna ungu, sedangkan bakteri Gram-negatif akan ditandai dengan warna merah atau merah muda.
(2) Pewarnaan spora (Fardiaz 1989)
warna safranin dan dibiarkan selama 30 detik dan dicuci dengan air mengalir serta dikeringkan. Preparat ini diamati di bawah mikroskop menggunakan lensa objektif yang telah diolesi minyak immersi. Endospora yang masih terdapat dalam sel vegetatif maupun spora bebas akan berwarna hijau biru, sedangkan sel vegetatif akan berwarna merah sampai merah muda.
(3) Uji motilitas (Fardiaz 1989)
Pengujian motilitas bakteri dilakukan dengan cara sebagai berikut: secara aseptis dengan menggunakan jarum ose yang lurus bagian ujungnya, isolat bakteri ditusukkan ke dalam media SIM. Inkubasi dilakukan pada suhu 37 °C selama 1hari. Pertumbuhan bakteri yang menyebar menunjukkan bahwa bakteri tersebut bersifat motil dan bila pertumbuhan bakteri tidak menyebar, hanya berupa garis saja, maka bakteri tersebut bersifat non motil.
(4) Uji katalase (Fardiaz 1989)
Isolat bakteri sebanyak 1 lup diambil secara aseptis dan dipindahkan pada gelas objek. Preparat tersebut ditetesi dengan larutan 3% H2O2. Adanya enzim katalase ditandai dengan terbentuknya gelembung-gelembung seperti busa sabun. (5) Uji oksidase (Fardiaz 1989)
Sebanyak 1 gram p-aminodimetilanilin oksalat dilarutkan dalam 100 cc akuades kemudian dipanaskan. Larutan tersebut diteteskan ke kertas Whatman 42 hingga warna kertas berubah menjadi ungu. Isolat bakteri yang akan diujikan dioleskan ke kertas Whatman 42. Kertas yang tetap berwarna ungu menunjukkan hasil positif, sedangkan bila berubah menjadi merah maka negatif.
(6) Uji fermentasi glukosa (Hayward 1957)
Pendeteksian produksi gas dari isolat BP (8) dilakukan dengan metode fermentasi glukosa dalam tabung Durham. Isolat BP (8) diinokulasikan secara aseptik ke dalam media MRSB + glukosa 10% dan diinkubasi selama 24 jam pada suhu 37 oC. Hasil uji heterofermentatif ditunjukkan dengan adanya gas yang terbentuk dalam tabung Durham.
(7) Total kadar asam laktat (Moore et al. 2011)
supernatan berubah kemerahan. Persentase (%) asam laktat dihitung
N NaOH = Normalitas NaOH yang terukur (0,1091) FP = Faktor Pengencer (1)
Bobot sampel = bobot supernatan (mg) 90 = BM Asam laktat
(8) Pendugaan genus (Holt et al. 1994)
Isolat BP (8) yang telah diverifikasi kemudian dilakukan pengujian ke tahap selanjutnya hingga tingkat genus dengan menggunakan buku identifikasi
Bergey’s Manual (Holt et al. 1994). Karakteristik yang diamati untuk
membedakan sifat dari genus bakteri asam laktat menurut buku Bergey’s Manual adalah sebagai berikut:
1. Kenampakan sel: sel diamati apakah berpasangan, 4 sel membentuk kelompok (tetrad), membentuk rantai (panjang, pendek, sangat panjang), atau membentuk kluster.
2. Pertumbuhan, bakteri ditumbuhkan pada:
(a) media produksi yang diinkubasi pada suhu 45 °C (b) media produksi dengan pH 9,6
(c) media produksi dengan penambahan 6,5 % NaCl 3. Reaksi katalase (uji katalase)
4. Keberadaan sitokrom (uji oksidase) 3.3.2 Produksi antibakteri
Isolat dari bakteri yang telah teridentifikasi dikultur untuk memproduksi supernatan aktif sebagai antibakteri. Tahapan ini meliputi penyegaran isolat, kultivasi BAL, pemanenan dan uji aktivitas antibakteri.
(1) Penyegaran isolat
Media yang telah siap kemudian disterilisasi menggunakan autoklaf pada suhu 121 °C dan tekanan 1 atm selama 15 menit.
Penyegaran bakteri dan persiapan inokulum dilakukan untuk mendapatkan biakan bakteri yang segar dan siap pakai. Proses penyegaran dan persiapan inokulum adalah sebagai berikut: isolat bakteri asam laktat dalam gliserol disegarkan pada media MRSA miring, disimpan pada kaleng bekas biskuit dengan dimensi kaleng 15x15x25 (cm) dengan kondisi anaerob kemudian diinkubasi pada suhu 37 oC selama 48 jam. Bakteri di MRSA miring diinokulasikan 1 lup dalam medium inokulum MRSB dengan volume kerja 15 ml. Setelah itu diinkubasi dengan shaker waterbath selama 18 jam pada suhu 37 oC kemudian diukur optical density dengan λ=660 nm (OD660 0,6-0,8).
(2) Kultivasi isolat BP (8)
Kultivasi sel bakteri merupakan proses peningkatan konsentrasi beberapa atau semua komponen suatu populasi dan biasanya secara mutlak ditentukan oleh macam pengukuran yang digunakan untuk memantau proses tersebut. Pengukuran sering digunakan untuk mencerminkan pertambahan jumlah atau massa sel (Hadiutomo 1988).
Isolat BP (8) dikultivasi dengan menggunakan tiga alat yang memiliki kondisi yang berbeda, yaitu menggunakan magnetic stirrer, shaker waterbath dan inkubator. Magnetic stirrer pada kondisi suhu ruang dan agitasi 150 rpm, shaker waterbath dengan suhu 37 °C dengan agitasi 150 rpm dan inkubator dengan
kondisi suhu 37 °C dan berada dalam kaleng yang hampa udara serta tanpa agitasi.
Sebanyak 1% inokulum dimasukkan dalam medium produksi (MRSB) dengan volume kerja 100 ml menggunakan botol Schott®. Media yang telah diinokulasi diinkubasi dengan tiga perlakuan, yaitu inkubasi dengan magnetic stirrer pada kondisi suhu ruang dan agitasi 150 rpm, inkubator dengan kondisi suhu 37 °C dan berada dalam kaleng yang hampa udara serta tanpa agitasi dan shaker waterbath dengan suhu 37 °C dengan agitasi 150 rpm. Pengamatan
(3) Pemanenan
Pemanenan dilakukan terhadap kultur yang telah berumur 24 jam. Kultur disentrifugasi dengan kecepatan 10.000 rpm dengan suhu 4 oC selama 15 menit (Nurhasanah 2004 diacu dalam Nurmalis 2008), kemudian supernatan dipisahkan dari endapan (biomassa sel).
Supernatan diberi tiga perlakuan, yaitu (1) tidak dinetralkan/pH asam (kode A), (2) dinetralkan dengan NaOH 1N/pH netral (kode N), (3) dinetralkan lalu diendapkan dengan (NH4)2SO4 (ammonium sulfat) pada konsentrasi 50% saturasi (kode E). Ammonium sulfat 50% kejenuhan adalah 341 g ammonium sulfat dilarutkan dalam 1 liter.
Supernatan yang tidak dinetralkan dan yang dinetralkan difiltrasi menggunakan millipore dengan ukuran pori 0,2 µm sehingga diperoleh supernatan bebas sel (kode A dan kode N).
Ammonium sulfat dimasukkan ke dalam supernatan netral secara perlahan-lahan sambil diaduk dengan magnetic srirrer sampai larut dan homogen, diendapkan dan disimpan dalam refrigerator selama 24 jam, kemudian disentrifugasi dengan kecepatan 10.000 rpm selama 20 menit pada suhu 4 oC (Purwanti 2003). Endapan yang diperoleh dilarutkan dalam buffer fosfat 0,1 M pH 7 (kode E). Pembuatan larutan buffer fosfat pH 7 dapat dilihat pada Lampiran 3.
(4) Uji aktivitas antibakteri
Uji aktivitas antibakteri dilakukan untuk mengetahui kemampuan isolat BAL dalam menghasilkan zat antibakteri. Uji aktivitas antibakteri dilakukan terhadap bakteri uji seperti Escherichia coli, Salmonella typhimurium dan Listeria monocytogenes menggunakan metode difusi sumur agar (well diffusion agar)
(Hilmi dan Gokalp 2000). Bakteri uji disegarkan pada media NA miring secara aseptik, dan diinkubasi pada suhu 37 oC selama 24 jam. Sebanyak 1 lup bakteri uji diinokulasikan dalam 10 ml NB dan diinkubasi dalam shaker waterbath selama 18 jam setelah itu diukur OD pada λ=600 sebesar 0,6-0,8.
4. HASIL DAN PEMBAHASAN
4.1 Karakterisasi Isolat
Karakterisasi isolat BP (8) untuk verifikasi meliputi pewarnaan Gram, pewarnaan spora, uji motilitas, uji katalase, uji oksidase, uji fermentasi glukosa, penentuan kadar asam laktat. Pendugaan genus dilakukan dengan menumbuhkan bakteri pada media produksi dengan pH 9,6, media produksi yang diinkubasi pada suhu 45 °C dan media produksi yang ditambahkan NaCl 6,5% (Holt et al. 1994). Hasil karakterisasi dapat dilihat pada Tabel 1.
Tabel 1 Karakterisasi dan pendugaan genus isolat BP (8)
Karakteristik Hasil
Verifikasi
Gram Positif
Bentuk tetrad, beberapa berpasangan
Spora -
Motilitas -
Katalase -
Oksidase -
Fermentasi glukosa Tidak menghasilkan gas
(homofermentatif)
Hasil verifikasi menunjukkan bahwa isolat BP (8) termasuk dalam anggota kelompok BAL dan pada pendugaan genus, isolat ini termasuk dalam genus Pediococcus sp.
Keterangan : (+) = memiliki aktivitas/tumbuh, (-) = tidak memiliki aktivitas/tidak tumbuh
4.1.1 Pewarnaan Gram
Gambar 8 Bentuk sel dan hasil pewarnaan Gram isolat BP (8)
Ciri-ciri bakteri Gram-positif ditandai dengan terbentuknya warna ungu pada sel bakteri. Hal tersebut disebabkan karena bakteri ini mempunyai kandungan lipid yang lebih rendah, sehingga dinding sel bakteri akan lebih mudah terdehidrasi akibat perlakuan dengan alkohol. Dinding sel yang terdehidrasi menyebabkan ukuran pori-pori sel menjadi kecil dan daya permeabilitasnya berkurang sehingga zat warna ungu kristal yang merupakan zat warna utama tidak dapat keluar dari sel dan sel akan tetap berwarna ungu. Bakteri Gram-negatif terlihat berwarna merah karena bakteri ini kehilangan pewarna kristal violet pada waktu pembilasan dengan alkohol namun mampu menyerap pewarna tandingan yaitu safranin. Bakteri Gram-negatif mengandung lipid, lemak atau substansi seperti lemak dalam persentase lebih tinggi daripada yang dikandung bakteri Gram-positif. Dinding sel bakteri Gram-negatif juga lebih tipis daripada dinding sel bakteri Gram-positif (Pelczar dan Chan 2005).
4.1.2 Pewarnaan spora
Pewarnaan spora menunjukkan bahwa isolat BP (8) tidak membentuk spora. Spora bersifat tahan terhadap kondisi lingkungan ekstrim dan adanya bahan kimia beracun. Spora dibentuk oleh spesies bakteri yang termasuk dalam genera Clostridium dan Bacillus untuk mengatasi lingkungan yang tidak menguntungkan
berwarna hijau-biru, sedangkan sel vegetatif akan berwarna merah sampai merah muda. Spora juga lebih tahan terhadap pewarnaan, akan tetapi sulit untuk melepaskan zat warna yang telah terserap ke dalamnya, sehingga tidak dapat mengikat zat warna lain yang diberikan berikutnya (counterstain). Prinsip pewarnaan ini digunakan untuk membedakan spora dari sel vegetatif (Fardiaz 1987). Hasil pewarnaan spora dapat dilihat pada Gambar 9.
Gambar 9 Hasil pewarnaan spora isolat BP (8). 4.1.3 Uji motilitas
Gambar 10 Hasil uji motilitas isolat BP (8). 4.1.4 Uji katalase
Uji katalase digunakan untuk mengetahui adanya enzim katalase pada isolat bakteri. Katalase adalah enzim yang dapat mengkatalisasi penguraian hidrogen peroksida (H2O2) menjadi air dan O2. Hidrogen peroksida bersifat toksik terhadap sel karena bahan ini dapat menginaktivasikan enzim dalam sel. Uji ini penting dilakukan untuk mengetahui sifat bakteri terhadap kebutuhan akan oksigen (Lay 1994 diacu dalam Candra 2006).
Mikroba dapat dibedakan atas tiga grup berdasarkan kebutuhannya akan oksigen, yaitu mikroba yang bersifat aerobik, anaerobik dan anaerobik fakultatif. Setiap bakteri mempunyai suatu enzim yang tergolong flavoprotein yang dapat bereaksi dengan oksigen membentuk senyawa-senyawa beracun yaitu H2O2 dan suatu radikal bebas yaitu O2*, dengan reaksi sebagai berikut:
Flavoprotein oksigen H2O2 + O2*
Bakteri yang bersifat anaerobik fakultatif juga mempunyai enzim superoksida dismutase, tetapi tidak mempunyai enzim katalase, melainkan mempunyai enzim peroksidase. Enzim tersebut dapat mengkatalis reaksi antara H2O2 dengan senyawa organik, menghasilkan senyawa yang tidak beracun (Fardiaz 1989). Reaksinya adalah sebagai berikut:
H2O2 + Senyawa organik
peroksidase
2 O2*+ 2 H+
Berbeda halnya dengan bakteri anaerobik obligat, bakteri ini tidak mempunyai enzim superoksida dismutase maupun katalase. Oleh karena itu oksigen merupakan racun bagi bakteri tersebut karena terbentuknya H2O2 dan O2* (Fardiaz 1989).
Penentuan adanya enzim katalase diuji menggunakan larutan 3 % H2O2 pada koloni terpisah. Isolat bakteri yang bersifat katalase positif akan terlihat pembentukan gelembung udara di sekitar koloni. Isolat BP (8) tidak menghasilkan gelembung (tidak memiliki enzim katalase), sehingga dapat disimpulkan bahwa bakteri tersebut bersifat anaerobik fakultatif.
4.1.5 Uji oksidase
Uji oksidase berfungsi untuk menentukan adanya sitokrom oksidase yang ditemukan pada mikroorganisme tertentu. Sitokrom oksidase merupakan enzim yang berperan sebagai katalisator dalam transfer atom hidrogen dari sitokrom yang terakhir ke molekul oksigen. Sitokrom merupakan senyawa organik yang terdapat dalam sel hidup dan berperan dalam transfer atom hidrogen dari substrat ke molekul oksigen dengan katalis enzim sehingga dapat terbentuk air (Winarno dan Fardiaz 1984).
Berdasarkan hasil uji, dapat diketahui bahwa isolat BP (8) tidak menghasilkan enzim sitokrom oksidase yang mengkatalis transfer hidrogen dari sitokrom ke molekul oksigen. Hal ini menunjukkan bahwa bakteri tersebut tidak melakukan metabolisme energi melalui proses respirasi, melainkan melalui proses fermentasi. Hal tersebut terjadi karena dalam produk bekasam terdapat senyawa organik yang mampu digunakan oleh bakteri tersebut sebagai donor dan aseptor elektron untuk menghasilkan energi (Candra 2006). Berdasarkan uji katalase dan oksidase, dapat disimpulkan bahwa bakteri yang diisolasi dari produk bekasam mempunyai sifat anaerobik fakultatif.
4.1.6 Uji fermentasi glukosa
durham yang terdapat gelembung udara menunjukkan bahwa bakteri tersebut menghasilkan CO2, sehingga tergolong dalam BAL heterofermentatif. Tabung durham yang tidak terdapat gelembung udara menunjukkan bahwa bakteri tersebut termasuk dalam golongan homofermentatif. Bakteri asam laktat yang hanya menghasilkan asam laktat pada fermentasi glukosa termasuk dalam golongan homofermentatif. Bakteri asam laktat yang menghasilkan asam laktat, CO2 dan etanol dari heksosa termasuk dalam golongan heterofermentatif (Jay et al. 2005). Isolat BP (8) tidak menghasilkan gelembung udara pada tabung Durham, maka isolat BP (8) tergolong dalam BAL homofermentatif. Hasil uji fermentasi glukosa dapat dilihat pada Gambar 11.
Gambar 11 Hasil uji fermentasi glukosa isolat BP (8). 4.1.7 Total kadar asam laktat
Pengujian kadar asam laktat berfungsi untuk mengetahui total asam laktat yang terbentuk selama pertumbuhan isolat BP (8). Asam laktat yang dihasilkan ini akan menurunkan pH. Total kadar asam laktat yang dihasilkan oleh isolat BP (8) pada perlakuan kultivasi magnetic stirrer sebesar 4,76%, shaker waterbath sebesar 4,57% dan inkubator sebesar 4,96% (Lampiran 4).
Hasil verifikasi menunjukkan bahwa isolat BP (8) termasuk kelompok bakteri Gram positif, bentuknya tetrad dan beberapa berpasangan, tidak berspora, non motil, katalase negatif, oksidase negatif. Hal ini sesuai dengan penyampaian Defigueredo dan Splittstoesser (1976) serta Mozzi et al. (2010), bahwa anggota bakteri asam laktat merupakan bakteri Gram-positif, batang atau kokus yang tunggal, berpasangan atau rantai tidak berspora, terkadang membentuk segiempat, katalase negatif. Berdasarkan hasil verifikasi isolat BP (8) termasuk dalam kelompok bakteri asam laktat. Tahap selanjutnya dilakukan beberapa pengamatan karakteristik sehingga dapat diduga genus bakteri. Hal ini masih bersifat dugaan, karena untuk mengidentifikasi genus bakteri secara pasti masih diperlukan beberapa uji yang tidak dilakukan dalam penelitian ini.
Tahappendugaangenusmenggunakan buku identifikasi Bergey’s Manual (Holt et al. 1994). Berdasarkan hasil verifikasi terhadap isolat BP (8), isolat ini tergolong dalam kelompok 17, yaitu genera Gram positive cocci, dan bersifat anaerob fakultatif, pembedaan sifat antar genus menggunakan Tabel 17.2 (Lampiran 1). Anggota bakteri genera Gram positive cocci yang anaerob fakultatif antara lain, Aerococcus, Enterococcus, Gemella, Lactococcus, Leuconostoc, Melisococcus, Pediococcus, Saccharococcus, Staphylococcus, Stomatococcus,
Streptococcus, Trichococcus dan Vagococcus. Hasil karakterisasi isolat BP (8)
untuk pendugaan genus, berdasarkan Tabel 17.2 adalah sebagai berikut:
1. Kenampakan sel: sel yang diamati menggunakan mikroskop menunjukkan bahwa sel tetrad dan ada juga beberapa yang berpasangan (Gambar 9). Genus bakteri yang mendekati sifat ini adalah Aerococcus, Enterococcus, Leuconostoc dan Pediococcus.
2. Pertumbuhan: bakteri yang ditumbuhkan pada:
(a) media produksi yang diinkubasi pada suhu 45 °C menunjukkan reaksi positif. Genus bakteri yang mendekati sifat ini adalah Enterococcus dan Pediococcus.
(b) media produksi dengan pH 9,6 menunjukkan reaksi negatif. Genus bakteri yang mendekati sifat ini adalah Pediococcus.
5. Reaksi katalase (uji katalase) menunjukkan reaksi negatif. Genus bakteri yang memiliki sifat ini adalah Pediococcus.
6. Keberadaan sitokrom (uji oksidase) menunjukkan reaksi negatif. Genus bakteri yang memiliki sifat ini adalah Pediococcus.
Berdasarkan hasil identifikasi menurut buku Bergey’s Manual (Holt et al. 1994), diduga isolat BP (8) termasuk dalam genus Pediococcus.
Pediococcus merupakan bakteri Gram-positif, nonmotil, tidak berspora, fakultatif
anaerob dan tergolong dalam bakteri asam laktat homofermentatif. Glukosa difermentasi dengan memproduksi asam tapi tidak menghasilkan gas. Katalase negatif, sitokrom negatif. Suhu pertumbuhan optimum adalah 20-40 °C. Hal ini diperkuat dengan hasil uji fermentasi glukosa yang menunjukkan bahwa isolat BP (8) merupakan BAL homofermentatif. Hasil pendugaan genus sesuai dengan pernyampaian Cai et al. (1999) yang mengkarakterisasi Pediococcus strain LA 3, LA 35 dan LS 5. Bentuknya tetrad, Gram-positif, homofermentatif dan tumbuh pada suhu 45 °C.
Pediococcus merupakan penghasil pediosin, yaitu bakteriosin kelas II. Strain yang memproduksi pediosin adalah P.acidilactici, P.pentosaceus dan P.damnosus (Papagianni dan Anastasiadou 2009). Pediosin yang dihasilkan dari strain ini umumnya kecil dan protein hidrofobik. Pediocin PA-1/Ach memiliki zona hambat terhadap L.monocytogenes, B.cereus, C.perfringens, C.botulinum, C.laramie, Lactobacillus, Leuconostoc, Enterococcus, Pediococcus dan
Lactococcus (Jeevaratnam et al. 2005).
4.2 Produksi Antibakteri
Berdasarkan hasil karakterisasi, isolat BP (8) tergolong dalam kelompok BAL dan diduga termasuk dalam genus Pediococcus. Bakteri asam laktat dapat menghasilkan metabolit yang bersifat antimikroba seperti asam organik, etanol, diasetil, CO2, H2O2 dan bakteriosin (Roller 2003). Pediococcus merupakan
penghasil pediosin, yaitu bakteriosin kelas II (Papagianni dan Anastasiadou 2009). Isolat BP (8) kemudian diproduksi untuk menghasilkan
4.2.1 Kultivasi isolat BP (8)
Tahap kultivasi ada dua parameter yang diamati, yaitu pertumbuhan bakteri dan perubahan keasaman. Pengukuran pertumbuhan bakteri dilakukan dua kali ulangan. Parameter diukur dengan tiga perlakuan kondisi pertumbuhan (dengan alat inkubasi yang berbeda), yaitu menggunakan magnetic stirrer pada kondisi suhu ruang dan agitasi 150 rpm, inkubator dengan kondisi suhu 37°C dan berada dalam kaleng yang hampa udara serta tanpa agitasi dan shaker waterbath dengan suhu 37°C dengan agitasi 150 rpm. Hasil pengukuran OD660 pertumbuhan dan pH selama inkubasi 36 jam dapat dilihat pada (Lampiran 5).
Data pertumbuhan bakteri kemudian dikonversikan ke dalam kurva sigmoid pertumbuhan, serta perubahan asam juga dikonversikan ke dalam bentuk kurva. Kurva pertumbuhan bakteri merupakan hubungan antara logaritma jumlah sel atau konsentrasi biomassa dengan waktu (Rachman 1989).
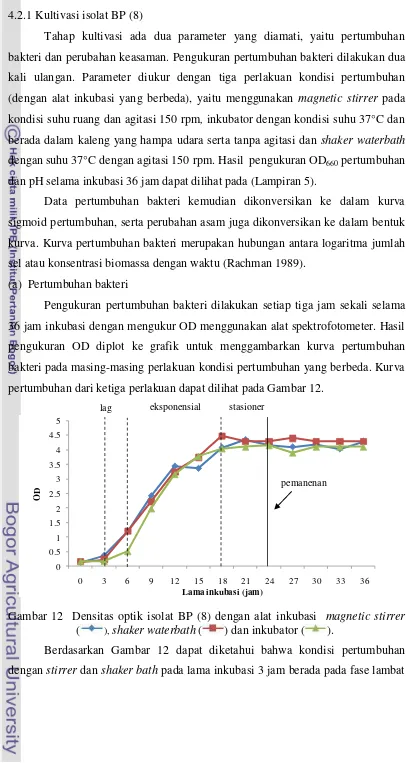
(a) Pertumbuhan bakteri
Pengukuran pertumbuhan bakteri dilakukan setiap tiga jam sekali selama 36 jam inkubasi dengan mengukur OD menggunakan alat spektrofotometer. Hasil pengukuran OD diplot ke grafik untuk menggambarkan kurva pertumbuhan bakteri pada masing-masing perlakuan kondisi pertumbuhan yang berbeda. Kurva pertumbuhan dari ketiga perlakuan dapat dilihat pada Gambar 12.
Gambar 12 Densitas optik isolat BP (8) dengan alat inkubasi magnetic stirrer ( ), shaker waterbath ( ) dan inkubator ( ).
Berdasarkan Gambar 12 dapat diketahui bahwa kondisi pertumbuhan dengan stirrer dan shaker bath pada lama inkubasi 3 jam berada pada fase lambat
(fase lag), sedangkan pada inkubator fase ini terjadi sampai jam inkubasi ke-6. Pertumbuhan sel pada perlakuan stirrer dan shaker bath lebih cepat, hal ini ditandai dengan pendeknya fase lag daripada dengan penggunaan inkubator.
Kondisi awal media diinokulasikan dengan mikroorganisme biasanya berbeda dari lingkungan inokulum sebelumnya. Seringkali organisme tidak dapat beradaptasi dengan lingkungan baru dan bahkan berada dalam kondisi yang tidak sehat (Becker 1994). Tahap ini biasanya tidak terjadi pembelahan sel. Waktu pada fase lambat dibutuhkan untuk kegiatan metabolisme dalam rangka persiapan dan penyesuaian diri dengan kondisi pertumbuhan dalam lingkungan yang baru. Fase ini dapat terjadi antara beberapa menit dan sampai beberapa jam tergantung pada spesies, umur dari sel inokulum dan lingkungannya (Buckle et al. 1985). Aktivitas fisiologis yang tinggi terdapat selama fase lag, dimana sel menjadi lebih sensitif terhadap suhu dan perubahan lingkungan lainnya daripada sel pada tahap yang hingga jam ke-18 pada inkubasi dengan stirrer dan shaker waterbath, sedangkan pada inkubasi dengan inkubator, bakteri memasuki fase log pada jam ke-6 hingga jam ke-18. Bakteri memiliki kecepatan membelah diri paling tinggi pada fase ini, waktu generasinya pendek dan konstan. Selama fase ini metabolisme paling pesat dikarenakan cahaya dan nutrisi yang berlimpah, jadi sintesis bahan sel sangat cepat dan konstan pula. Keadaan ini terus berlangsung sampai nutrien habis atau telah terjadi penimbunan atas hasil metabolisme yang bersifat racun yang menyebabkan terhambatnya pertumbuhan (Hidayat et al. 2006).
konstan (Hidayat et al. 2006). Komposisi sel-sel pada fase ini berbeda dibandingkan dengan sel-sel saat fase eksponensial dan umumnya lebih tahan terhadap perubahan-perubahan kondisi fisik (Buckle et al. 1985).
Pemanenan kultur isolat BP (8) dilakukan pada jam ke-24, dimana bakteri sudah memasuki pertengahan fase stasioner, dengan range OD berkisar antara 4-4.5. Hal ini berarti bahwa dengan ketiga perlakuan tersebut, tidak memberikan pengaruh terhadap pertumbuhan bakteri, karena waktu panen kultur sama-sama telah memasuki fase stasioner.
Jumlah populasi mikroba yang mulai stasioner menyebabkan produksi asam laktat juga stasioner atau bertambah dengan peningkatan yang relatif sedikit. Hal ini dikarenakan substrat dalam media pada fase ini sudah mengalami penurunan (Usmiati dan Marwati 2007). Substrat yang mulai habis merangsang terbentuknya enzim yang berperan untuk pembentukan metabolit sekunder, yaitu bakteriosin (Kunaepah 2008). Pemanenan dilakukan pada jam ke-24 (telah memasuki fase stasioner) karena diasumsikan asam laktat yang dihasilkan sudah stasioner dan bakteriosin sudah terbentuk.
(b) Perubahan pH
Gambar 13 menunjukkan bahwa pH menurun sampai lama inkubasi 12 jam, kemudian cenderung stabil pada akhir inkubasi (36 jam). Penurunan nilai pH dari 6 hingga 4 selama 12 jam inkubasi berkorelasi negatif dengan pertumbuhan bakteri. Pada rentang waktu tersebut bakteri sedang berada fase lag dan eksponensial dimana populasinya meningkat sehingga terjadi akumulasi hasil metabolit berupa asam laktat yang mengakibatkan penurunan pH. Jam ke-12 hingga jam ke-18 pertumbuhan bakteri mulai melambat hingga memasuki fase stasioner dari jam ke-18 sampai jam ke-36.
Jumlah dan aktivitas mikroba mempunyai peran penting dalam kemampuannya memecah substrat (Rachman 1989). Bakteri pada fase eksponensial mengalami pertumbuhan yang sangat pesat (Gambar 12). Jumlah bakteri yang meningkat menyebabkan kemampuan memecah substratnya juga meningkat sehingga banyak dihasilkan metabolit primer yang berguna untuk pertumbuhannya. Asam laktat merupakan metabolit primer yang dihasilkan oleh BAL. Asam laktat yang dihasilkan diekskresikan keluar, lalu terakumulasi dalam media sehingga menyebabkan penurunan pH (Astawan 2007 diacu dalam Kunaepah 2008). Hal inilah yang menyebabkan penurunan pH pada saat bakteri memasuki fase eksponensial. Pertumbuhan bakteri kemudian mengalami penurunan dan terhenti ketika telah mencapai fase stasioner. Jumlah populasi mikroba yang mulai stasioner menyebabkan produksi asam laktat juga stasioner atau bertambah dengan peningkatan yang relatif sedikit. Substrat yang mulai habis merangsang terbentuknya enzim yang berperan untuk pembentukan metabolit sekunder, yaitu bakteriosin (Kunaepah 2008). Pemanenan dilakukan pada jam ke-24 (telah memasuki fase stasioner) karena diasumsikan asam laktat yang dihasilkan sudah stasioner dan bakteriosin sudah terbentuk.
4.2.2 Aktivitas antibakteri
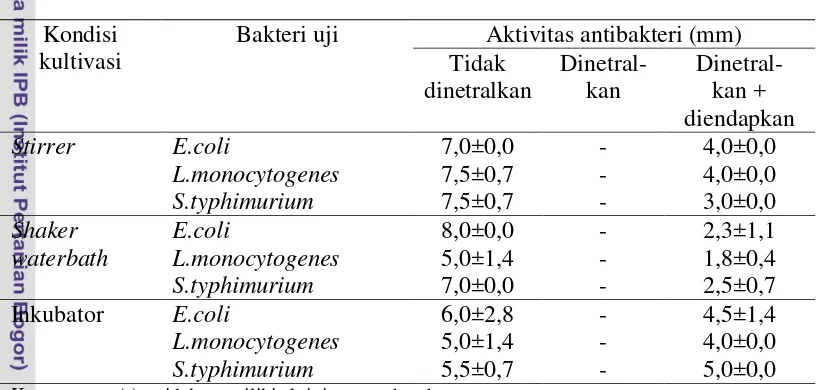
supernatan yang dinetralkan dengan NaOH, dengan tujuan untuk menghilangkan pengaruh dari asam-asam organik. Supernatan yang dinetralkan dan diendapkan diperoleh melalui tahap purifikasi parsial bakteriosin (presipitasi protein) dengan penambahan ammonium sulfat sebesar 50% saturasi (Purwanti 2003), kemudian dilarutkan dalam buffer fosfat pH 7 dengan pemekatan ±40x. Hasil dari ketiga perlakuan tersebut yaitu hanya perlakuan netral yang tidak menunjukkan aktivitas antibakteri. Hasil uji aktivitas antibakteri dapat dilihat pada Tabel 2.
Tabel 2 Aktivitas penghambatan antibakteri pada kondisi tidak dinetralkan, dinetralkan dan pengendapan
Kondisi kultivasi
Bakteri uji Aktivitas antibakteri (mm) Tidak
Keterangan : (-) = tidak memiliki aktivitas penghambatan
Berdasarkan Tabel 2 dapat diketahui terdapat aktivitas penghambatan pada perlakuan asam terhadap ketiga bakteri uji. Pada perlakuan netral tidak terdapat aktivitas penghambatan, hal ini dikarenakan pengaruh asam organik telah dihilangkan dengan penambahan NaOH. Hasil uji aktivitas dapat dilihat pada Lampran 6. Perbandingan aktivitas penghambatan pada asam dapat dilihat pada Gambar 14.
Gambar 14 Aktivitas penghambatan pada bakteri E.coli, S.typhimurium, dan L.monocytogenes oleh supernatan yang tidak dinetralkan pada inkubasi dengan ( ) magnetic stirrer, ( ) shaker waterbath dan ( ) inkubator.
Berdasarkan Gambar 14 dapat dilihat bahwa zat aktif yang memiliki aktivitas penghambatan paling kecil terhadap E. coli adalah perlakuan menggunakan inkubator dan yang paling besar adalah perlakuan menggunakan shaker waterbath. Aktivitas penghambatan paling besar terhadap S. typhimurium
dihasilkan pada perlakuan magnetic stirrer, dan yang paling kecil dihasilkan pada perlakuan inkubator. Aktivitas penghambatan paling besar terhadap L. monocytogenes dihasilkan pada perlakuan magnetic stirrer. Diantara ketiga
kondisi pertumbuhan, yang memiliki aktivitas antibakteri terendah terhadap ketiga bakteri uji adalah pada perlakuan inkubator, meskipun total kadar asam laktatnya memiliki persentasi paling tinggi diantara perlakuan yang lainnya. Hal ini diduga karena bakteri uji yang digunakan pada perlakuan inkubator memiliki nilai OD yang tinggi diantara perlakuan yang lainnya.
Menurut Hilmi dan Gokalp (2000), aktivitas antimikroba yang diproduksi oleh BAL berdasarkan zona penghambatan yang dihasilkan dikelompokkan menjadi 3, yaitu aktivitas hambat rendah (0,5-1,0 mm), sedang (1,1-3,0 mm) dan
tinggi (>3 mm). Aktivitas penghambatan oleh asam terhadap ketiga bakteri uji dengan perlakuan kondisi kultivasi yang berbeda tergolong dalam kategori tinggi.
Hasil aktivitas penghambatan pada perlakuan asam dapat dibandingkan dengan hasil aktivitas penghambatan dengan menggunakan asam asetat pada berbagai konsentrasi sebagai kontrol positif (Tabel 3).
Tabel 3. Aktivitas penghambatan antibakteri dengan menggunakan asam asetat pada berbagai konsentrasi sebagai kontrol positif
Bakteri uji Aktivitas penghambatan (mm)
0,2% 0,4% 0,6% 0,8% 1,0%
E.coli 1 2 4 6 7
L monocytogenes 2 3 2 5 6
S.typhimurium 2 3 5 6 7
Aktivitas penghambatan oleh asam laktat terhadap bakteri E.coli pada kondisi kultivasi dengan magnetic stirrer memiliki nilai yang sama dengan aktivitas penghambatan asam asetat 1,0%. Perlakuan shaker waterbath memiliki nilai yang lebih besar, sedangkan perlakuan inkubator memiliki nilai yang mendekati dengan aktivitas penghambatan asam asetat 0,8%. Aktivitas penghambatan oleh asam terhadap bakteri L. monocytogenes pada kondisi kultivasi dengan magnetic stirrer memiliki nilai yang lebih besar dengan aktivitas penghambatan asam asetat 1,0%. Perlakuan shaker waterbath dan inkubator nilai aktivitas penghambatannya mendekati aktivitas penghambatan asam asetat 0,8%. Aktivitas penghambatan oleh asam terhadap bakteri S. typhimurium pada kondisi kultivasi dengan magnetic stirrer memiliki nilai yang mendekati dengan aktivitas penghambatan asam asetat 1,0%. Perlakuan shaker waterbath aktivitas penghambatannya sama dengan asam asetat 1,0% dan inkubator nilai aktivitas penghambatannya mendekati aktivitas penghambatan asam asetat 0,6% (Lampiran 7).
terdisosiasi sebagian (Zeuthen dan Bogh-Sorensen 2000). Asam yang tidak terdisosiasi bekerja dengan menurunkan gradien proton elektrokimia, menyebabkan proton lebih cepat masuk ke dalam sel sehingga meningkatkan kebutuhan energi untuk mempertahankan pH alkali dalam sel, netralisasi kekuatan proton, dan kemudian mengurangi pH internal, menyebabkan denaturasi protein dan kehilangan viabilitas (Ammor et al. 2006; Lunggani 2007; Ray 2004). Aktivitas penghambatan supernatan yang tidak dinetralkan terhadap E.coli dan S.typhimurium (bakteri Gram-negatif) lebih besar. Hal ini dikarenakan asam laktat mampu melemahkan permeabilitas bakteri Gram-negatif dengan merusak membran luar bakteri Gram-negatif. Asam laktat merupakan molekul yang larut dalam air sehingga mampu menembus ke dalam periplasma bakteri Gram-negatif melalui protein porin pada membran luarnya. Pelindung dari permeabilitas membran luar berupa lapisan lipopolisakarida yang terletak pada permukaan membran dirusak oleh asam laktat sehingga substrat antimikroba yang lain dapat berpenetrasi ke dalam membran sitoplasma (Alakomi et al. 2000).
Perbandingan aktivitas penghambatan pada perlakuan pengendapan dapat dilihat pada Gambar 15.
Berdasarkan Gambar 15 dapat dilihat bahwa endapan yang memiliki aktivitas penghambatan paling kecil terhadap E. coli adalah perlakuan menggunakan shaker waterbath dan yang paling besar adalah perlakuan menggunakan inkubator, begitu pula dengan S. typhimurium. Aktivitas penghambatan paling kecil terhadap L. monocytogenes dihasilkan pada perlakuan shaker waterbath. Diantara ketiga perlakuan, penggunaan shaker waterbath memiliki aktivitas penghambatan yang paling kecil terhadap semua bakteri.
Kondisi kultivasi memberikan pengaruh yang relatif kecil terhadap pertumbuhan bakteri (nilai OD) dan nilai pH, namun aktivitas antibakteri yang dihasilkan bervariasi. Hasil tersebut menunjukkan bahwa sel bakteri pada nilai OD dan nilai pH yang sama tidak selalu menghasilkan aktivitas antibakteri yang sama juga.
Aktivitas antimikroba dari bakteriosin rendah akibat sensitifnya peranan asam organik. Oleh karena itu, perlu dilakukan tahap lanjutan berupa purifikasi parsial bakteriosin (Todorov et al. 2004), yaitu pengendapan dengan ammonium sulfat. Berdasarkan Tabel 2 pengendapan dengan ammonium sulfat terdapat aktivitas penghambatan. Isolat BP (8) diduga tergolong dalam genus Pediococcus, yang merupakan BAL penghasil pediosin (bakteriosin kelas II), dengan demikian dapat memeperkuat dugaan bahwa hasil positif pada endapan merupakan bakteriosin.
Supernatan yang dinetralkan dan diendapkan dengan ammonium sulfat menunjukkan jenis protein yang hidrofobik karena posisi endapan protein yang terpresipitasi berada melayang di bagian atas supernatan (Syahniar 2009). Bagian hidrofobik di dalam molekul bakteriosin merupakan hal yang diperlukan untuk aktivitasnya dalam menghambat bakteri sensitif karena inaktivasi mikroorganisme oleh bakteriosin tergantung pada interaksi hidrofobik antara sel-sel bakteri dengan molekul-molekul bakteriosin (Parada et al. 2007).
5. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Isolat BP (8) yang diisolasi dari bekasam ikan sepat rawa asal kecamatan Indralaya, kabupaten Ogan Ilir, Sumatera Selatan termasuk BAL homofermentatif. Berdasarkan hasil identifikasi menurut buku Bergey’s Manual, diduga isolat BP (8) termasuk dalam genus Pediococcus.
Kondisi kultivasi yang berbeda tidak memberikan pengaruh pada pertumbuhan isolat BP (8) serta perubahan keasaman selama inkubasi. Fase lag pada perlakuan magnetic stirrer dan shaker waterbath terjadi dari jam ke-0 hingga jam ke-3, sedangkan pada inkubator terjadi hingga jam ke-6. Fase eksponensial pada ketiga kondisi kultivasi terjadi hingga jam ke-18, sedangkan fase stasioner terjadi mulai jam ke-18 hingga jam ke-36.
Hasil uji aktivitas supernatan yang tidak dinetralkan dan yang diendapkan menunjukkan hasil positif, sedangkan pada supernatan yang dinetralkan menunjukkan hasil negatif. Senyawa dari supernatan aktif asam yang bekerja melawan bakteri uji adalah asam laktat, sedangkan pada supernatan aktif hasil pengendapan diduga terdapat bakteriosin. Sel bakteri pada nilai OD dan nilai pH yang sama tidak selalu menghasilkan aktivitas antibakteri yang sama.
5.2 Saran
BEKASAM IKAN SEPAT RAWA (
Trichogaster trichopterus
)
YULIANTI SRI REJEKI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
YULIANTI SRI REJEKI. C34070089. Pengaruh Kondisi Kultivasi terhadap Produksi Antibakteri dari Bakteri Asam Laktat Asal Bekasam Ikan Sepat Rawa (Trichogaster trichopterus). Dibimbing oleh DESNIAR dan KUSTIARIYAH.
Biota perairan merupakan komoditi yang mudah sekali mengalami kerusakan. Salah satu upaya pengawetan yang dilakukan adalah melakukan fermentasi bekasam. Proses fermentasi tersebut melibatkan bakteri asam laktat (BAL) yang memiliki sifat penting dalam menghasilkan metabolit antimikroba. Potensi BAL dalam menghasilkan antimikroba sangat besar sehingga perlu dilakukan penelitian karakterisasi isolat BP (8) serta uji aktivitas antibakteri yang dihasilkan dari isolat tersebut pada kondisi kultivasi yang berbeda.
Tujuan penelitian ini adalah untuk mengkarakterisasi isolat BP (8) sebagai BAL serta mempelajari pengaruh kondisi kultivasi yang berbeda terhadap aktivitas antibakteri yang dihasilkan. Penelitian ini dilakukan dalam dua tahapan, yaitu (1) karakterisasi isolat BP (8) sebagai BAL dan pendugaan genus dan (2) produksi antibakteri, yang meliputi a) penyegaran isolat; b) kultivasi isolat BP (8) menggunakan alat inkubasi yang berbeda, yaitu magnetic stirrer, shaker waterbath dan inkubator, pada tahap ini parameter yang diamati adalah optical density (OD) dan pH; c) pemanenan, supernatan diberi tiga perlakuan, yaitu tidak dinetralkan, dinetralkan, dan dinetralkan lalu diendapkan dengan amonium sulfat 50% saturasi; d) uji aktivitas antibakteri menggunakan metode agar well diffusion, pada tahap ini yang diukur adalah diameter zona hambat.
Isolat BP (8) memiliki karakteristik selnya bulat, tetrad dan beberapa berpasangan, Gram-positif, tidak berspora, non-motil, katalase negatif, oksidase negatif dan mampu memfermentasi glukosa tanpa menghasilkan gas (homofermentatif). Isolat BP-8 adalah bakteri asam laktat yang tergolong homofermentatif dan diduga termasuk dalam genus Pediococcus.
Kondisi kultivasi yang berbeda tidak memberikan pengaruh pada pertumbuhan isolat BP (8). Pemanenan yang dilakukan pada jam ke-24, dimana pada kurva pertumbuhan semuanya telah berada di pertengahan fase stasioner (OD660 4-4,5), begitu pula dengan kurva perubahan keasaman yang berada pada titik pH yang sama, yaitu pada pH 4,5. Pemanenan dilakukan pada jam ke-24 (telah memasuki fase stasioner) karena diasumsikan asam laktat yang dihasilkan sudah stasioner dan bakteriosin sudah terbentuk.
BEKASAM IKAN SEPAT RAWA (
Trichogaster trichopterus
)
YULIANTI SRI REJEKI C34070089
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Nama : Yulianti Sri Rejeki NRP : C34070089
Departemen : Teknologi Hasil Perairan
Menyetujui: Pembimbing 1
Desniar, S.Pi, M.Si NIP. 19701224 199702 2 001
Pembimbing 2
Dr. Kustiariyah, S.Pi, M.Si NIP. 19750818 200501 2 001
Mengetahui:
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Ruddy Suwandi, MS., MPhil. NIP: 19580511 198503 1 002
Dengan ini saya menyatakan bahwa skripsi yang berjudul ”Pengaruh Kondisi Kultivasi terhadap Produksi Antibakteri dari Bakteri Asam Laktat Asal Bekasam Ikan Sepat Rawa (Trichogaster trichopterus)” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun pada perguruan tinggi manapun. Sumber informasi yang dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, Desember 2011
© Hak cipta milik IPB, tahun 2011 Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhya dalam
Puji syukur penulis panjatkan kehadirat Allah SWT atas segenap limpahan karunia yang tak terhitung banyaknya. Shalawat serta salam semoga tetap tercurah kepada Rasulullah SAW.
Penyusunan skripsi yang berjudul: ”Pengaruh kondisi kultivasi terhadap
produksi antibakteri dari bakteri asam laktat asal bekasam ikan sepat rawa (Trichogaster trichopterus)”merupakan salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada seluruh pihak yang telah membantu dalam penyelesaian skripsi ini, diantaranya kepada:
1. Desniar, S.Pi, M.Si dan Dr. Kustiariyah, S.Pi, M.Si. sebagai komisi pembimbing atas segala saran, kritik, arahan, perbaikan, dan motivasi, serta ilmu yang telah diberikan.
2. Dr. Tati Nurhayati, S.Pi, M.Si. sebagai dosen penguji yang telah memberikan masukan dan pengarahan kepada penulis.
3. Dr. Ir. Ruddy Suwandi, MS, M.Phil selaku Ketua Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
4. Dr. Ir. Agoes M. Jacoeb, Dipl. Biol selaku komisi pendidikan Departemen Teknologi Hasil Perairan.
5. Ayah dan ibu serta adik-adik tercinta (Vindy, Nabila dan Dzafira) atas segala doa restu, motivasi dan semangatnya.
6. Bu Ema, Mba Silvi, Mba Dini, Mba Lastri, Mas Ipul, Pak Wahyu, Mba Selin dan Pak Ranta, terimakasih atas bantuan dan bimbingan selama menjalankan penelitian.
7. Seluruh staf Dosen dan TU THP terimakasih atas bantuannya selama penyusunan skripsi.