1
I. PENDAHULUAN
A. LATAR BELAKANG
Sayuran merupakan jenis makanan yang sangat dianjurkan untuk dikonsumsi dalam menu makan sehari-hari. Selain mudah diperoleh, murah harganya dan dapat diolah menjadi berbagai hidangan yang lezat, sayuran juga banyak mengandung vitamin, mineral, dan komponen antioksidan seperti asam askorbat, karotenoid, flavonoid, asam organik tertentu, peptida, tannin dan tokoferol. Antioksidan tersebut dapat berfungsi sebagai senyawa pereduksi, menangkap senyawa radikal, mengikat ion logam prooksidan dan penghambat terbentuknya singlet oksigen (Pratt, 1992). Menurut Karyadi (1996) mengkonsumsi makanan yang banyak mengandung sayuran dapat mencegah timbulnya penyakit degeneratif, mengoreksi zat gizi tubuh yang kurang, memelihara kesehatan tubuh, memperlambat proses penuaan, memelihara sistem kekebalan tubuh, mengatasi stres dan membantu penyembuhan penyakit.
Hampir seluruh daerah di Indonesia memiliki beragam jenis sayuran lokal yang menjadi ciri khas daerah tersebut. Sayuran-sayuran lokal tersebut dikenal dengan istilah sayuran indigenous. Sayuran ini dapat digunakan sebagai obat-obatan maupun jamu-jamuan karena mengandung senyawa fitokimia yang berfungsi sebagai antioksidan yang sangat menguntungkan bagi kesehatan (Sandrasari, 2008). Namun sayangnya, beranekaragamnya jenis sayuran tersebut belum dimanfaatkan secara optimal sebagai bahan pangan, bahkan masyarakat setempat sendiri belum mengetahui bahwa tanaman lokal di daerahnya dapat dikonsumsi sebagai sayur-sayuran pelengkap menu. Padahal penganekaragaman sumber makanan termasuk dalam konsumsi sayur-sayuran merupakan salah satu pemecahan dalam rangka mengurangi ketergantungan pada salah satu jenis sumber makanan tertentu apalagi bila bersumber dari kekayaan lokal sendiri.
2 Jawa Barat yang umumnya dikonsumsi oleh masyarakat lokal sebagai lalapan atau pelengkap menu. Sayuran tersebut antara lain kenikir (Cosmos caudatus H.B.K), beluntas (Pluchea indica (L.) Less.), mangkokan putih (Nothopanax scutellarium (Burm.f.) Fosb.), mangkokan (Nothopanax scutellarius (Burm.f.) Merr.), daun kendondong cina (Polyscias pinnata), kecombrang (Etlingera elatior (Jack) R.M.Sm.), kemangi (Ocimum americanum L.), katuk (Sauropus androgynus (L.) Merr.), antanan (Centelia asiatica (L.) Urb.), antanan beurit (Hydrocotyle sibthorpioides Lmk.), pohpohan (Pilea melastomoides (Poir.) Bl.), daun ginseng (Talinum triangulare (Jacq.) Willd.), krokot (Portulaca oleracea L.), bunga turi (Sesbania grandiflora (L.) Pers.), kucai (Allium schoenoprasum L.), takokak (Solanum torvum Swartz), daun kelor (Moringa pterygosperma Gaertn.), pucuk mengkudu (Morinda citrifolia L.), lembayung (Vigna unguiculata (L.) Walp.), terubuk (Saccharum edule Hassk.), daun labu (Sechium edule (Jacq.) Swartz.), bunga pepaya (Carica papaya L.), pucuk mete (Anacardium occidentale L.) dan daun pakis (Arcypteris irregularis (C.Presl) Ching.).
Hasil penelitian sebelumnya yang dilakukan oleh Batari (2007) dan Rahmat (2009) menunjukkan bahwa sayuran indigenous sebagaimana disebutkan diatas mengandung senyawa flavonoid yang berupa flavonol (quercetin, miricetin dan kaempferol) dan flavon (luteolin dan apigenin). Flavonol dan flavon merupakan flavonoid penting yang terdapat dalam tanaman sebab senyawa tersebut merupakan jenis senyawa fenol yang diketahui mempunyai aktivitas antioksidan yang berfungsi sebagai radical scavenger, sebagai senyawa pereduksi, dan penghambat terjadinya oksidasi lipid lanjut sebagaimana yang dijelaskan dalam penelitian Sandrasari (2008) mengenai kapasitas antioksidan pada sayur-sayuran indigenous tersebut.
3 dapat mendorong optimalisasi pemanfaatan sayuran indigenous tersebut sehingga dapat tercipta peluang untuk meningkatkan nilai tambah dan memperluas penggunaan sayuran-sayuran tersebut dalam khasanah pangan Indonesia.
B. TUJUAN
4
Gambar 1. Diagram alir desain penelitian sayuran indigenous Jawa Barat Meta-analisis
Analisis Potensi
1. Pengumpulan data hasil analisis utama 2. Studi literatur
3. Justiifikasi potensi
1. Hubungan antara total karotenoid, β-karoten, antosianin, dan asam askorbat
2. Hubungan antara total fenol dan total karotenoid
3. Hubungan antara total fenol dan total antosianin
4. Hubungan antara total karotenoid dan protein
1. Analisis komponen utama (PCA)
2. Uji korelasi Pearson
1. Analisis Proksimat: -Kadar air
-Kadar protein
2. Analisis Utama:
-Kadar total karotenoid -Kadar β-karoten -Kadar antosianin -Kadar asam askorbat
3. Analisis statistik:
-Analisis ragam (Anova) - Uji lanjut Duncan Analisis Sampel
Persiapan Sampel
Perolehan Sampel 1. Pasar Bogor
2. Kebun Penduduk
5
II. TINJAUAN PUSTAKA
A. SAYURAN INDIGENOUS
Indonesia memiliki keragaman sumber daya hayati yang sangat potensial untuk dikembangkan. Salah satu sumber daya hayati tersebut adalah sayur-sayuran yang memiliki kontribusi penting terhadap suplai pangan dan kesehatan masyarakat. Sejarah membuktikan bahwa nenek moyang kita telah banyak memanfaatkan sayuran indigenous sebagai bahan pangan karena rasa dan manfaat sayur-sayuran tersebut yang telah dikenal dengan baik berdasarkan pengetahuan secara turun temurun. Menurut Badan Penelitian dan Pengembangan Pertanian, sayuran indigenous adalah spesies sayuran asli Indonesia yang berasal dari daerah/wilayah/ekosistem tertentu, termasuk spesies pendatang dari wilayah geografis lain tetapi telah berevolusi dengan iklim dan geografis wilayah Indonesia. Sayuran indigenous biasanya tumbuh di pekarangan rumah maupun kebun secara alami dan dimanfaatkan untuk kepentingan keluarga, baik sebagai sayuran yang dimasak, lalapan bahkan sebagai obat dari suatu penyakit.
6 pucuk mengkudu (Morinda citrifolia L.), lembayung (Vigna unguiculata L.) Walp.), terubuk (Saccharum edule Hassk.), daun labu (Sechium edule (Jacq.) Swartz.), bunga pepaya (Carica papaya L.), pucuk mete (Anacardium occidentale L.) dan daun pakis (Arcypteris irregularis (C.Presl) Ching.). Identifikasi/determinasi tanaman sayuran diatas telah dilakukan pada penelitian sebelumnya (Sandrasari, 2008; Rahmat, 2009) oleh pihak “Herbarium Bogoriense”, Bidang Botani Pusat Penelitian Biologi-LIPI Bogor dengan Kepala Bidang Botani LIPI adalah Dr. Eko Baroto Walujo, APU. Deskripsi umum ke 24 jenis sampel tersebut yang meliputi nama suku, jenis, nama Inggris, bagian yang dapat dimakan, dan fungsi kesehatannya ditunjukan pada Tabel 1.
Batari (2007) dan Rahmat (2009) telah melakukan penelitian terhadap kandungan total fenol dan kandungan senyawa flavonoid yang terdapat dalam sayuran indigenous tersebut. Hasil penelitian menunjukkan bahwa semua sayuran indigenous yang diuji mengandung senyawa flavonoid, dengan komponen flavonoid yang diperoleh berupa senyawa flavonol dan flavon. Flavonol terdiri dari quercetin, miricetin dan kaempferol, sedangkan flavon terdiri dari apigenin dan luteolin. Akan tetapi, ternyata tidak semua sampel yang diuji mengandung kelima komponen flavonoid tersebut, namun diperoleh hasil bahwa semua sampel mengandung senyawa quercetin. Senyawa quercetin merupakan golongan flavonol yang paling banyak terdapat dalam tanaman dan merupakan senyawa paling aktif dibanding senyawa flavonol lainnya (Fuhrman dan Aviram, 2002). Berdasarkan hasil penelitian Batari (2007) dan Rahmat (2009) tersebut, diperoleh hasil bahwa kandungan total fenol terbesar terdapat pada pucuk mete (2809.5 mg/100 g dry basis) dan terkecil pada terubuk (204.4 mg/100 g dry basis). Total flavonol dan flavon yang diperoleh sangat bervariasi, dengan jumlah terbesar terdapat pada daun katuk (831.70 mg/100 g dry basis) dan terkecil terdapat pada terubuk (3.80 mg/100 g dry basis).
8
Tabel 1. Deskripsi umum (suku, jenis, nama Inggris dan nama lokal), bagian yang dapat dimakan dan fungsi kesehatan dari 24 jenis sayuran indigenous Jawa Barat
Family/suku Species/jenis Nama Inggris Nama Lokal BDD* Fungsi Kesehatan
Asteraceae
Cosmos caudatus H.B.K
Wild cosmos Kenikir Daun Antioksidan, penambah nafsu makan, obat lemah lambung, penguat tulang, dan untuk mengusir serangga (Widayanti et al., 2005).
Pluchea indica (L.) Less.
Indian
camphorweed
Beluntas Daun Meningkatkan nafsu makan (stomakik), membantu pencernaan, peluruh keringat (diaforetik), pereda demam (antipiretik), penyegar, memiliki kadar minyak atsiri 5% (v/v) yang dapat mengambat pertumbuhan bakteri Escherichia coli (Erawati, 1992 di dalam pdpersi.co.id); Menghilangkan bau badan, obat turun panas, obat batuk, obat antidiare dan obat sakit kulit (Winarno dan Sundari, 1998).
Araliaceae
Polyscias scutellaria (Burm.f.) Fosb.
Shield aralia Mangkokan putih
Daun Menghilangkan bau badan, pelumas kepala terhadap kerontokan, diuretika, dan peluruh keringat.
Nothopanax scutellarius
(Burm.f.) Merr. -
9
Tabel 1. Deskripsi umum (suku, jenis, nama Inggris dan nama lokal), bagian yang dapat dimakan dan fungsi kesehatan dari 24 jenis sayuran indigenous Jawa Barat (lanjutan)
Family/suku Species/jenis Nama Inggris Nama Lokal BDD* Fungsi Kesehatan
Araliaceae Polyscias pinnata Balfour aralia Kedondong cina
Daun
- Zingiberaceae Etlingera elatior
(Jack) R.M.Sm.
Torch ginger Kecombrang Bunga Menghambat pertumbuhan bakteri dan kapang pada makanan terutama bakteri patogen (Naufalin, 2005), penghilang bau badan (Anonim, 2003).
Lamiaceae Ocimum americanum L.
Basil Kemangi Daun Sebagai obat batuk, obat penyakit kulit, dan rematik (Siemonsma dan Piluek, 1994), antiseptik, menghilangkan bau badan, dan meningkatkan selera makan (Anonim, 2003). Phyllanthaceae Sauropus
androgynus (L.) Merr.
Chekkurmanis Katuk Daun Meningkatkan produksi ASI, sebagai antipiretik atau obat penurun demam (Soedibyo, 1998), sebagai pewarna hijau alami (Heyne, 1987).
Apiaceae Centelia asiatica (L.) Urb.
Indian pennywort
Antanan Seluruh bagian
10
Tabel 1. Deskripsi umum (suku, jenis, nama Inggris dan nama lokal), bagian yang dapat dimakan dan fungsi kesehatan dari 24 jenis sayuran indigenous Jawa Barat (lanjutan)
Family/suku Species/jenis Nama Inggris Nama Lokal BDD* Fungsi Kesehatan
Apiaceae Hydrocotyle sibthorpioides Lmk.
Lawn
marshpennywort
Antanan beurit
Seluruh bagian
Pembersih darah, pelancar peredaran darah, peluruh kencing (diuretika), penurun panas, menghentikan pendarahan, meningkatkan memori, antibakteri, tonik, antiinflamasi, insektisida, antialergi, dan stimulan (Anonim, 2008).
Urticaceae Pilea
melastomoides
(Poir.) Bl. -
Pohpohan Daun Penapisan fitokimia simplisia daun pohpohan menunjukkan adanya golongan senyawa steroid/triterpenoid, alkaloid dan flavonoid (Amalia et al., 2006).
Portulacaceae
Talinum
triangulare (Jacq.) Willd.
Ceylon spinach Daun Ginseng
Daun Mengandung saponin yang dapat merangsang selaput lendir, memecah butir darah merah hingga merangsang penambahan jumlah darah dan memperbaiki sirkulasi darah dalam tubuh; Mengandung flavonoid yang dapat mengurangi pembengkakan, bakterisidal & antivirus; mengandung minyak atsiri sebagai penambah nafsu makan (Hidayat, 2005).
Portulaca oleracea L.
Little hogweed Krokot Daun&
11
Tabel 1. Deskripsi umum (suku, jenis, nama Inggris dan nama lokal), bagian yang dapat dimakan dan fungsi kesehatan dari 24 jenis sayuran indigenous Jawa Barat (lanjutan)
Family/suku Species/jenis Nama Inggris Nama Lokal BDD* Fungsi Kesehatan
Leguminoceae Sesbania
grandiflora (L.) Pers.
Vegetable hummingbird
Turi Bunga Pelembut kulit, pencahar, dan penyejuk (IPTEKnet, 2007).
Alliaceae Allium
schoenoprasum L.
Wild chives Kucai Seluruh bagian
Mengatasi keputihan, darah tinggi, sembelit, sebagai antiseptik untuk membunuh kuman bakteri dalam usus dan menjadi perangsang dalam proses pengasaman usus, melancarkan aliran darah, menghindarkan pembekuan darah; Mengandung vitamin B, C, karoten dan komponen belerang (Anonim, 2008a).
Solanaceae Solanum torvum Swartz
12
Tabel 1. Deskripsi umum (suku, jenis, nama Inggris dan nama lokal), bagian yang dapat dimakan dan fungsi kesehatan dari 24 jenis sayuran indigenous Jawa Barat (lanjutan)
Family/suku Species/jenis Nama Inggris Nama Lokal BDD* Fungsi Kesehatan
Moringaceae Moringa pterygosperma Gaertn.
Horseradishtree Kelor Daun Menurunkan tekanan darah tinggi, diare, diabetes melitus (kencing manis), dan penyakit jantung (Anonim, 2007c). Rubiaceae Morinda citrifolia
L.
Indian mulberry Mengkudu Daun Mempunyai aktivitas antihelmintik, cukup baik melawan cacing Ascaris lumbricoides yang ada pada usus
Fabaceae Vigna unguiculata (L.) Walp.
Blackeyed pea Lembayung Daun Mengandung zat-zat protein, kalsium, fosfor, besi, belerang, magnesium, mangan, niasin, vitamin B1, B2, dan C (Anonim, 2008b).
Poaceae Saccharum edule Hassk.
Vegetable cane Terubuk Bunga Mengandung 4.6-6% protein, kalsium, fosfor dan asam askorbat (Terra, 1966).
Cucurbitaceae Sechium edule (Jacq.) Swartz.
Chayote Daun labu Daun Menurunkan hipertensi, arterioscleosis, batu ginjal, dan melancarkan sistem pernafasan dan pencernaan, serta melancarkan peredaran darah yang tersumbat (Anonim, 2008c).
13
Tabel 1. Deskripsi umum (suku, jenis, nama Inggris dan nama lokal), bagian yang dapat dimakan dan fungsi kesehatan dari 24 jenis sayuran indigenous Jawa Barat (lanjutan)
Family/suku Species/jenis Nama Inggris Nama Lokal BDD* Fungsi Kesehatan
Anacardiaceae Anacardium occidentale L.
Cashew Pucuk mete Daun Mengatasi pegal linu, daun dan kulitnya mengandung asam anakandat, kardol, zat samak, asam galat, gingkol, minyak lemak, protein, katekhin, dan sitosterin (Anonim, 2008d). Osmundaceae Arcypteris
irregularis (C.Presl) Ching.
Fern Pakis Daun
14
B. KAROTENOID DAN β-KAROTEN
Karotenoid merupakan pigmen yang berwarna kuning, jingga, merah serta larut dalam minyak/lipida. Karotenoid terdapat dalam kloroplas (0.5%) bersama-sama dengan klorofil (9.3%), terutama pada bagian atas permukaan daun, dekat dengan dinding-dinding palisade (Winarno, 1992). Karotenoid membentuk suatu kelas hidrokarbon berikatan rangkap banyak yang memiliki jumlah atom C sebanyak 40, yang disebut karoten dan turunan teroksigenasinya, yaitu santofil (Goh et al., 1987).
Menurut Meyer (1966), karotenoid dibagi atas 4 golongan, yaitu: 1) karotenoid hidrokarbon, C40H56 seperti α-, β-, -karoten, dan likopen, 2)
santofil atau oksikarotenoid dan derivat karoten yang mengandung oksigen dan hidroksil, antara lain kriptosantin (C40H55OH) dan lutein (C40H54(OH)2),
santasantin, zeasantin, dan astasantin (Stahl, Sies dan Sundquist, 1994). Oksikarotenoid ini merupakan turunan dari hidrokarbon karotenoid yang lebih polar dan mengandung setidaknya satu atom oksigen (Stahl, Sies dan Sundquist, 1994), 3) asam karotenoid yang mengandung gugusan hidroksil, 4) ester santofil asam lemak.
Struktur dasar karoten terdiri dari ikatan hirokarbon tidak jenuh, terbentuk dari 40 atom C, 8 unit isoprenil, 11 ikatan rangkap, dan memiliki 2 buah gugus cincin ionon (Winarno, 1992). Perbedaan struktur antara berbagai karoten terletak pada letak dan jumlah ikatan rangkap, serta jenis gugus pada cincin yang mempengaruhi aktivitas biologisnya sebagai provitamin A (Bauernfeind, 1972).
15 Karotenoid memiliki aktivitas vitamin A yang mengandung cincin β -ionon, disebut juga sikloheksenil, pada salah satu atau kedua ujung rantai polienanya. Cincin β-ionon dan gugus akhir dari suatu rantai, yaitu struktur retinil, menentukan aktivitas retinoid. Menurut Klaui dan Bauernfeind (1981), β-karoten memiliki dua buah cincin β-ionon dan menghasilkan 2 molekul vitamin A. Komponen lain seperti α-karoten, dimana setengah dari strukturnya identik dengan β-karoten hanya menghasilkan 1 molekul vitamin A.
Aktivitas vitamin A dari karoten juga dipengaruhi oleh bentuk isomernya. Bentuk trans karoten memiliki derajat aktivitas vitamin A lebih tinggi dibandingkan dengan bentuk cis. β-karoten memiliki 100% aktivitas vitamin A, α-karoten memiliki 50-54% aktivitas vitamin A, dan -karoten memiliki 42-50% aktivitas vitamin A.
Winarno (1992) menyatakan bahwa 1 µg retinol ekivalen atau sering disebut 1 RE setara dengan 1 µg retinol atau 6.0 µg β-karoten, juga setara dengan 12 µg provitamin A lainnya, atau 3.33 SI aktivitas retinol, serta 9.9 SI aktivitas vitamin A dari β-karoten. Di dalam tubuh, β-karoten yg berasal dari makanan akan mengalami absorpsi dan metabolisasi. Sepertiga dari molekul β-karoten yang diabsorpsi berbentuk utuh diangkut oleh kilomikron, sisanya dibuang melalui ekskresi. Setengah dari β-karoten yang di absorpsi ini diubah menjadi retinol dalam mukosa usus dengan bantuan enzim 15, 15’ β-karoten dioksigenase (E.C.1.13.11.21) (Gross, 1991).
Karotenoid stabil dalam pH netral dan basa, namun sensitif terhadap asam, oksigen, cahaya dan panas yang dapat menyebabkan perubahan (rearrangement) pada ikatan rangkap dan isomerisasi cis-trans. Di alam karotenoid bersifat stabil, namun isolatnya mudah mengalami perubahan molekul, isomerisasi cis-trans, degradasi oleh panas, cahaya, oksigen, trace element, dan asam. Oksidasi karotenoid akan lebih cepat dengan adanya cahaya dan katalis logam. Oksidasi terjadi secara acak pada rantai karbon yang mengandung ikatan ganda (Chichester dan Feeters, 1985). Adanya ikatan ganda menyebabkan karotenoid peka terhadap oksidasi.
16 enzimatis misalnya dengan enzim lipoksigenase (Gross, 1991). Selain itu, pada sayuran berdaun hijau, proses ekstraksi biasanya mengeluarkan klorofil yang diketahui sebagai photosensitizer yang dapat memicu oksidasi cahaya.
Menurut Ball (2000), metode penentuan karotenoid pada tanaman tergantung pada distribusi karotenoid pada jaringan tanaman. Penentuan ini dapat dibagi menjadi tiga kelompok, yaitu 1) penentuan berdasarkan β-karoten saja, dimana metode ini cocok untuk sayuran berdaun hijau, brokoli, ubi jalar, tomat, dan semangka; 2) penentuan α- dan β-karoten untuk wortel dan squash; 3) penentuan β-kriptosantin dan β-karoten untuk almond dan apel. Analisis karoten spesifik pada sayuran umumnya dibatasi hanya pada penentuan β -karoten saja (Gross, 1991) karena β-karoten adalah karotenoid provitamin A yang umum terdapat pada buah-buahan dan sayur-sayuran. Hampir dalam setiap sayuran dan buah segar, 85% total aktivitas vitamin A berasal dari β -karoten (Ball, 2000). Dari beberapa penelitian yang telah dilakukan, karotenoid yang dominan dalam sayuran hijau adalah golongan β-karoten dan lutein (Puspitasari-Nienaber et al., 1996; Q Su et al., 2002). Kandungan karotenoid dan β-karoten berbagai jenis sayuran dapat dilihat pada Tabel 2.
Tabel 2. Kandungan karotenoid pada berbagai jenis sayuran
Jenis Sayuran Karotenoid
(mg/100 g dry basis)
β-karoten (mg/100 g dry basis)
Katuk Sawi hijau Kangkung Daun singkong Daun melinjo Bayam Wortel Selada Daun pepaya Labu siam
43.42 13.13 15.62 52.39 45.08 24.73 13.84 4.06 36.23
0.17
6.72 3.25 3.14 7.58 6.46 6.92 8.57 1.74 10.27
17 Penyebab utama hilangnya karotenoid pada sayuran adalah oksidasi sebagai akibat tingginya struktur ikatan tak jenuh pada karotenoid. Degradasi karotenoid dapat terjadi karena: 1) autooksidasi yang berlangsung secara spontan dan menyebabkan reaksi berantai radikal bebas dengan adanya oksigen; 2) fotooksidasi yang dihasilkan oleh oksigen dengan adanya cahaya; 3) coupled oxidation dalam sistem yang mengandung lemak (Kidmose et al., 2002). Kerusakan karena reaksi enzimatis terutama karena enzim lipoksigenase. Enzim ini terdapat secara luas pada sayuran yang mengandung klorofil dan telah dilaporkan bahwa kehilangan karotenoid berhubungan dengan aktivitas enzim ini (Hutching, 1999).
Beberapa jenis karotenoid telah diketahui dapat menurunkan resiko terkena kanker, seperti likopen dapat mencegah kanker prostat. Lutein, zeasantin, dan α karoten dapat mencegah kanker paru-paru, kriptosantin dapat mencegah kanker leher rahim, β-karoten dapat mencegah kanker paru-paru dan kanker mulut (Toma et al., 1995). Adapun karotenoid yang banyak terdapat dalam sayuran hijau adalah β-karoten dan lutein (Puspitasari-Nienaber et al., 1996; Q Su et al., 2002) yang strukturnya dapat dilihat pada Gambar 2 dan 3.
Gambar 2. Struktur kimia β-karoten
18
C. ANTOSIANIN
Antosianin merupakan salah satu dari kelompok pigmen utama pada tanaman (Harborne dan Grayer, 1988). Pigmen ini berada pada sebagian besar tanaman tingkat tinggi dan terdapat pada seluruh bagian tanaman (Brouillard, 1982). Antosianin dapat memberikan warna merah, violet, ungu, dan biru pada daun, bunga, buah dan sayur (Bridle dan Timberlake (1997); Elbe dan Schwartz (1996); Francis (1989). Secara kimia, semua antosianin merupakan turunan dari kation flavilium (3,5,7,4’ tetrahidroksiflavilium) yang merupakan struktur dasar dari antosianidin (Bridle dan Timberlake, 1997) seperti terlihat pada Gambar 4. Pada molekul flavilium ini terjadi subtitusi dengan molekul OH dan OMe untuk membentuk antosianindin (Tranggono, 1990). Menurut Harborne dan Grayer (1988), semua antosianin merupakan turunan suatu struktur aromatik tunggal yaitu sianidin yang dengan penambahan atau pengurangan gugus hidroksil, metilasi, atau glikosilasi maka jenis antosianin lain terbentuk.
Gambar 4. Struktur dasar kation flavilium
19
Tabel 3. Gugus pengganti pada struktur kation flavilium untuk membentuk antosianin
Struktur Antosianidin
Gugus pada Karbon nomor
3’ 4’ 5’
Pelargonidin H OH H
Sianidin OH OH H
Delpinidin OH OH OH
Peonidin OMe OH H
Petunidin OMe OH OH
Malvidin OMe OH OMe
Jenis pigmen yang terdapat dalam bunga dan buah sebagian besar tidak berada dalam bentuk antosianidin, melainkan dalam bentuk glikosilasi. Glikosilasi diasumsikan dapat meningkatkan kestabilan dan kelarutan pigmen antosianin dalam air sebab antosianidin kurang stabil dan kurang larut dalam air dibandingkan dengan antosianin (Jackman dan Smith, 1996).
Menurut Markakis (1982), molekul antosianin disusun dari sebuah aglikon (antosianidin) yang teresterifikasi dengan satu atau lebih gula (glikon). Gula yang paling banyak dijumpai adalah monosakarida seperti glukosa, galaktosa, ramnosa, xilosa dan arabinosa. Dalam tanaman, antosianin dalam bentuk glikosida yaitu ester dengan satu molekul monosakarida disebut monoglukosida dan biosida atau diglukosida jika memiliki dua molekul gula (Winarno, 1992).
20 Stabilitas antosianin terutama dipengaruhi oleh pH, suhu, cahaya, oksigen, asam askorbat, enzim, ion logam, gula, dan kopigmentasi. Umumnya antosianin lebih stabil dalam kondisi asam, media bebas oksigen, Di dalam kondisi suhu dingin dan gelap (Nollet, 1996; Francis, 1989; Elbe dan Schwartz, 1996). Antosianin terdapat dalam empat bentuk struktur keseimbangan yaitu quinonodial base, katin flavilium berwarna merah, karbinol pseudobase, dan kalkon yang tidak berwarna. Bentuk keseimbangan ini sangat dipengaruhi pH. Pada pH rendah, struktur kation flavilium dominan, sedangkan pada pH 4-6 bentuk karbinol yang dominan (Elbe dan Schwartz, 1996). Semakin tinggi nilai pH maka warna dari antosianin menjadi semakin pucat dan akhirnya tidak berwarna. Antosianin lebih stabil pada larutan yang bersifat asam daripada larutan yang bersifat netral atau basa.
Disamping itu, warna dari pigmen antosianin juga dipengaruhi oleh pH. Kondisi yang sedikit asam akan meningkatkan intensitas warna dari pigmen tersebut. Selain itu, dengan terikatnya beberapa jenis gula juga dapat meningkatkan intensitas warna dari pigmen antosianin (Lewis et al., 1997). Warna pigmen juga dipengaruhi oleh pelarut. Warna antosianin akan menjadi lebih biru pada pelarut alkohol dibandingkan dengan pelarut air (Swain, 1976).
Tabel 4. Kandungan antosianin pada berbagai komoditi buah*
Jenis Buah Antosianin (mg/g dry basis)
Blueberries Capulin Strawberry Plum Apel
Elderberries Kulit anggur Kubis Ungu Rosella
Kulit buah duwet**
1.10-1.90 0.32 0.07-0.75
0.05 0.01-0.1
21
D. ASAM ASKORBAT
Asam askorbat atau vitamin C pertama kali diisolasi oleh Szent Gyorgi pada tahun 1928. Vitamin ini merupakan vitamin yang mudah larut dalam air dan sedikit dalam alkohol, tidak larut dalam benzene, eter, kloroform, minyak, dan sejenisnya. Vitamin ini mempunyai sifat asam dan pereduksi yang sangat kuat, sifat-sifat tersebut disebabkan oleh adanya struktur enediol yang berkonjugasi dengan gugus karbonil dalam cincin lakton (Andarwulan dan Koswara, 1992).
Vitamin C umumnya terdapat pada sayur-sayuran dan buah-buahan segar. Buah mentah umumnya lebih banyak mengandung vitamin C, karena semakin tua buah atau sayur semakin berkurang kandungan vitaminnya. Kandungan asam askorbat berbagai jenis sayuran dapat dilihat pada Tabel 5.
Tabel 5. Kandungan asam askorbat pada berbagai jenis sayuran
Jenis Sayuran Asam Askorbat
(mg/100 g dry basis)
Katuk Sawi hijau Kangkung Daun singkong Daun melinjo Bayam Bunga kol Selada Daun pepaya Labu siam
1240 1091 322 1431
290 728 1222
180 675 264 Sumber: Subeki (1998)
22 terjadi karena aktivitas enzim seperti peroksidase, asam askorbat oksidase, sitokrom oksidase dan fenolase.
Asam askorbat dapat berbentuk sebagai asam askorbat dan asam L-dehidroaskorbat, keduanya mempunyai kemampuan sebagai vitamin C. Asam askorbat mudah teroksidasi menjadi asam dehidroaskorbat dan mudah tereduksi kembali menjadi bentuk semula. Oksidasi lebih lajut dari dehidroaskorbat akan membentuk asam diketogulonat yang tidak reversible dan tidak mempunyai aktivitas sebagai vitamin C (Pike dan Brown, 1975). Struktur kimia asam askorbat dapat dilihat pada Gambar 5.
Gambar 5. Struktur kimia asam askorbat
E. META-ANALISIS
Meta-analisis merupakan studi evaluasi secara statistik berdasarkan suatu seri percobaan yang telah dilakukan. Di dalam ilmu statistik, meta-analisis mengkombinasikan dan mengaitkan hasil dari beberapa studi dengan merujuk pada suatu hipotesis penelitian yang berhubungan dengan studi tersebut. Meta-analisis menghasilkan gambaran secara keseluruhan terhadap beberapa studi sekaligus yang dapat menghasilkan perkiraan yang lebih kuat dibandingkan dengan perkiraan dari satu macam studi yang hanya dilakukan dengan satu asumsi dan satu kondisi saja.
23 golongan senyawa fenol alam yang terbesar yang berada dalam bentuk ester atau glikosida terkonjugasi dengan senyawa lain (Pratt dan Hudson, 1990). Berdasarkan hal ini, maka dilakukan metaanalisis untuk mengetahui apakah ada korelasi antara kandungan total fenol yang terkandung dalam sayuran indigenous dengan total flavonoidnya. Disamping itu, oleh karena antosianin merupakan salah satu senyawa golongan flavonoid, maka ingin diketahui pula apakah total fenol berkorelasi dengan total antosianin yang terkandung dalam sayuran indigenous tersebut.
24
III. BAHAN DAN METODE
A. BAHAN DAN ALAT
1. Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah bahan untuk membuat ekstrak sayuran dan bahan untuk analisis. Bahan-bahan yang digunakan dalam pembuatan ekstrak sayuran adalah daun kenikir, bunga kecombrang, daun kemangi, daun katuk, daun pohpohan, daun ginseng, kucai, takokak, daun lembayung, terubuk, daun labu, bunga pepaya, pucuk mete dan daun pakis yang diperoleh dari Pasar Bogor. Daun beluntas, daun mangkokan putih, daun mangkokan, daun kendondong cina, antanan, antanan beurit, krokot, bunga turi, daun kelor dan pucuk mengkudu yang diperoleh dari kebun penduduk di daerah Dramaga, Bogor.
Bahan untuk analisis total karotenoid adalah heksana dan aseton (Brataco Chemica), KOH (BDH), metanol (Merck) dan asam asetat
(Merck). Bahan untuk analisis β-karoten adalah metanol (Merck), kloroform (Merck) dan asetonitril (Merck), serta standar β-karoten (C4582-5MG, Sigma-Aldrich). Bahan yang digunakan untuk analisis antosianin adalah etanol (Merck) dan HCl (Merck). Bahan untuk analisis asam askorbat adalah soluble starch (Merck), KI (Merck) dan Iodium (Merck).
2. Alat
25 adalah pipet mohr, tabung reaksi bertutup, vortex, freezer, membran 0.22 µm, dan sistem HPLC dengan spesifikasi seperti pada Tabel 6.
Alat-alat yang digunakan untuk analisis antosianin adalah neraca analitik, sudip, gelas piala, gelas ukur, labu takar, corong, kertas saring Whatman No.1, penyaring vakum, pipet mohr, tabung reaksi, kuvet dan spektrofotometer. Alat-alat yang digunakan untuk analisis asam askorbat adalah neraca analitik, mortar/waring blender, sudip, gelas piala, magnetic stirrer, labu takar, corong, erlenmeyer, pipet mohr, pompa vakum, kertas saring Whatman No.1, dan buret mikro.
Tabel 6. Spesifikasi HPLC untuk analisis β-karoten
Komponen HPLC Tipe
Solvent cabinet Shimadzu LC-20AD
Degasser Shimadzu DGU-20A5
Pump Shimadzu LC 20-AD
Detector UV-Vis Shimadzu SPD-20A, λ= 450 nm Manual injector Hewlett Packard Series 1100
Injector Rheodyne 20 µL
Syringe Agilent Technologies, LC 50 µL
Column C-18; 4.6x150 mm; Develosil
ODS-UG-3 (Mfg. No. 2510689), Nomura Chemical
Mobile phase Metanol:asetonitril:kloroform (48.5:48.5:3.0)
Flow rate 0.8ml/min (isocratic)
B. METODE
26
1. Persiapan Sampel
Bagian tanaman kenikir, beluntas, mangkokan, kemangi, katuk, kedondong cina, pohpohan, daun ginseng, kelor, labu, lembayung, mangkokan, jambu mete, mengkudu, pakis, yang digunakan dalam penelitian ini adalah bagian daun yang masih muda. Daun muda atau pucuk ini dapat dilihat dari warna daun yang lebih muda dibandingkan dengan daun pada bagian lainnya pada tanaman tersebut. Bagian tanaman antanan, antanan beurit dan kucai yang digunakan dalam penelitian ini adalah seluruh bagiannya, sedangkan untuk tanaman kecombrang, turi, terubuk, dan pepaya, bagian yang digunakan dalam penelitian ini adalah bunganya. Bagian tanaman takokak yang digunakan dalam penelitian ini adalah buahnya dan bagian tanaman krokot yang digunakan adalah daun dan batangnya. Pemilihan bagian-bagian tanaman ini didasarkan pada bagian-bagian yang biasa dikonsumsi masyarakat.
27
Gambar 6. Diagram alir persiapan sampel sayuran untuk analisis Pengemasan dalam plastik ber-seal
Penghancuran dengan blender kering
Dry basis beku (bubuk) lolos ayakan 32 mesh Freeze drying selama 48 jam
Dry basis beku Sampel
Pencucian dan Penirisan
Pembekuan selama 24 jam Pemotongan
28
2. Analisis Sampel
a. Analisis Kadar Air (AOAC, 1984)
Penetapan kadar air merupakan cara untuk mengukur banyaknya air yang terdapat di dalam suatu bahan pangan. Analisis kadar air dilakukan pada sampel sayuran segar (awal) dan pada sampel sayuran setelah freeze drying. Penentuan kadar air ini dilakukan dengan metode pengeringan dengan oven biasa.
Persiapan yang dilakukan adalah cawan alumunium yang akan digunakan terlebih dahulu dikeringkan dalam oven pada suhu 100oC selama 15 menit kemudian didinginkan dalam desikator selama 10 menit. Selanjutnya cawan ditimbang dengan menggunakan neraca analitik. Sampel ditimbang sebanyak 3-4 gram kemudian dikeringkan dalam oven bersuhu 100-105°C selama kurang lebih 6 jam. Setelah itu, didinginkan dalam desikator kemudian ditimbang. Contoh kembali dikeringkan dalam oven selama 30 menit lalu ditimbang kembali. Perlakuan terakhir ini diulangi terus hingga diperoleh berat kering yang relatif konstan (berat dianggap konstan jika selisih berat sampel kering yang ditimbang ≤ 0,0003 gram).
Kadar air (%) = x 100%
Keterangan:
W = bobot contoh sebelum dikeringkan (g)
W1 = bobot (contoh + cawan) sesudah dikeringkan (g) W2 = bobot cawan kosong (g)
b. Analisis Kadar Protein, Metode Mikro Kjehldal (AOAC, 1995)
Sebanyak ±0.1 gram contoh ditimbang kemudian dimasukan ke dalam labu kjeldahl, lalu ditambahkan 1.0 + 0.1 gram K2SO4, 40 + 10
ml HgO, dan 2.0 + 0.1 ml H2SO4, kemudian contoh didihkan selama
1-1.5 jam sampai cairan jernih. Larutan jernih ini kemudian didinginkan, lalu dipindahkan ke dalam alat destilasi. Labu Kjehldahl dicuci dengan
29 air 5-6 kali dengan 1-2 ml air. Air cuciannnya dimasukan ke dalam alat destilasi dan ditambahkan dengan 8-10 ml larutan NaOH – Na2S2O3.
Di bawah kondensor diletakan erlenmeyer yang berisi 5 ml larutan H3BO3 3% dan 3 tetes indikator (campuran 2 bagian merah
metil 0.2% dalam alkohol). Ujung tabung kondensor harus terendam dalam larutan H3BO3 kemudian isi erlemeyer diencerkan sampai 50 ml
lalu dititrasi dengan HCl 0.02 N sampai terjadi perubahan warna menjadi abu-abu. Dilakukan pula terhadap blanko.
% 100 007 . 14 )
(
% X
Contoh mg
X HCl N X blanko HCL
ml contoh HCl
ml N
% Protein= %N X 6.25
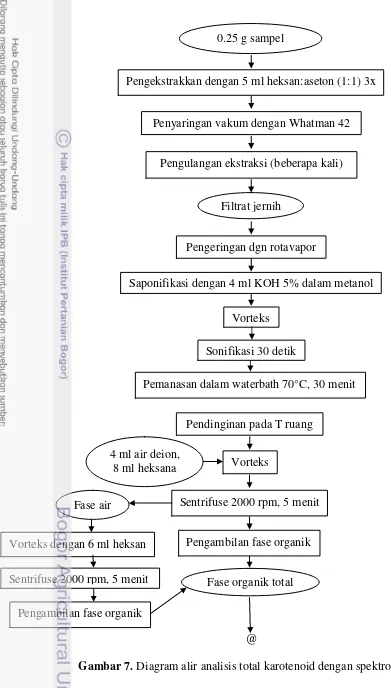
c. Analisis Total Karotenoid (Zakaria et al., 2000)
Sebanyak 0.25 gram sampel diekstrak dengan 5 ml heksan:aseton (1:1) tiga kali dan disaring vakum dengan kertas Whatman 42. Ekstraksi diulang beberapa kali hingga kertas saring dan residu menjadi jernih. Filtrat dimasukkan ke dalam tabung bertutup dan dievaporasi dengan rotavapor. Residu yang telah kering kemudian disaponifikasi dengan menambahkan 4 ml KOH 5% dalam metanol, divorteks dan dilakukan sonifikasi selama 30 detik. Ekstrak dipanaskan dalam waterbath dengan suhu 70°C selama 30 menit, kemudian didinginkan dan ditambahkan 4 ml air bebas ion dan 8 ml heksan. Setelah itu, ekstrak divorteks dan disentrifus pada 2000 rpm selama 5 menit hingga terbentuk fase organik dan fase air. Fase air ditambahkan 6 ml heksan, divorteks, dan disentrifus kembali pada 2000 rpm selama 5 menit. Fase organik yang terbentuk selanjutnya dikumpulkan.
30 menggunakan gas nitrogen untuk mengevaporasi). Untuk menghitung total karotenoid, residu kering dilarutkan dalam 4 ml heksan dan diukur absorbansinya dengan spektrofotometer pada panjang gelombang 450 nm. Sebagai blanko digunakan heksan. Prosedur analisis dapat dilihat pada Gambar 7.
Total karotenoid dihitung dengan rumus:
C= A450 x x x FP
Keterangan:
E1% = Nilai koefisien ekstingsi dari 1% larutan β-karoten (10 µg/µl) pada λ 450 nm= 2600
C = Konsentrasi total karotenoid (µg/g)
A450 = Nilai absorbansi yang diperoleh pada λ=450 nm FP = Faktor pengenceran
d. Analisis β-karoten (Zakaria et al., 2000)
1. Pembuatan Larutan Standar Β-karoten
Sebanyak 1 mg standar β-karoten dilarutkan dalam 2 ml kloroform, divorteks, ditambahkan 6 ml metanol dan divorteks kembali. Sebanyak 0.5 ml larutan diambil dan diencerkan sebanyak sepuluh kali dengan fase gerak HPLC. Selanjutnya diukur absorbansi pada panjang gelombang 450 nm dengan spektrofotometer dan sebagai blanko digunakan larutan fase gerak HPLC. Larutan standar β-karoten kemudian disuntikkan ke dalam kolom HPLC.
Konsentrasi standar β-karoten dihitung dengan rumus:
(10 mg/mL)/E1% = (X 1µg/1µL)/A450
Keterangan:
E1% = Nilai koefisien ekstingsi dari 1% larutan β-karoten (10 mg/ml) pada λ 450 nm= 2600
31 A450 = Nilai absorbansi yang diperoleh pada µ 450 nm
Nilai X dikalikan dengan % kemurnian standar β-karoten yang diperoleh dari analisis HPLC.
2. Persiapan dan Ekstraksi Karotenoid
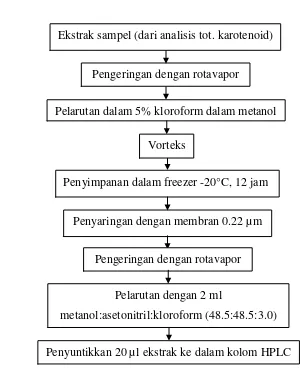
Persiapan dan ekstraksi sampel sama seperti persiapan dan ekstraksi sampel untuk analisis total karotenoid. Ekstrak yang digunakan untuk analisis total karotenoid dievaporasi dengan rotavapor (prosedur asli menggunakan gas nitrogen untuk mengevaporasi), lalu dilarutkan dalam kloroform 5% dalam metanol, divorteks dan disimpan dalam freezer bersuhu -20°C selama semalam (12 jam). Larutan kemudian disaring dengan membran 0.22 µm dan dievaporasi dengan rotavapor (prosedur asli menggunakan gas nitrogen untuk mengevaporasi). Residu kering kemudian dilarutkan dalam 2 ml fase gerak HPLC yaitu metanol:asetonitril:kloroform (48.5:48.5:3.0).
Sebanyak 20 µl ekstrak disuntikkan ke dalam kolom HPLC (Vydac C-18) dengan laju aliran rata-rata 0.8 ml/menit dan panjang gelombang 450 nm. Prosedur analisis dapat dilihat pada Gambar 8. Konsentrasi β-karoten (µg/g) di sampel dihitung dengan rumus:
C= x [ ] std β-karoten (µg/µL) x
e. Analisis Antosianin
1. Ekstraksi Antosianin (Raharja dan Dianawati, 2001)
32 dengan menggunakan penyaring vakum dan filtrat yang diperoleh dianalisa kandungan antosianinnya dengan metode Lees dan Francis (1972).
2. Penentuan Konsentrasi Total Antosianin (Lees dan Francis, 1972)
Sebanyak 5 ml filtrat hasil ekstraksi diencerkan menjadi 10 ml dengan larutan etanol 95%:HCl 1.5N (85:15). Filtrat kemudian diukur absorbansinya dengan spektrofotometer pada panjang gelombang 535 nm.
Total antosianin dihitung dengan rumus:
[ ] (mg/100g sampel) = x 100
Faktor 98.2 adalah nilai ε (serapan molar) dari pigmen antosianin dalam pelarut etanol 95%:HCl 1.5N (85:15). Prosedur analisis dapat dilihat pada Gambar 9.
f. Analisis Asam Askorbat (Jacobs, 1951)
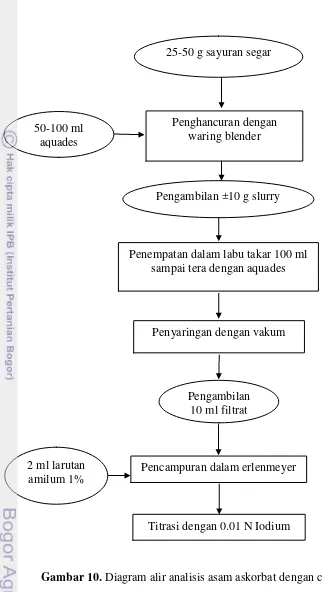
1. Ekstraksi Sampel
Sebanyak 25-50 gram sampel sayuran segar ditimbang dan ditambahkan dengan 50-100 ml aquades. Sampel kemudian dihancurkan dalam waring blender sampai diperoleh slurry (bubur). Slurry yang diperoleh sebanyak ±10 gram dimasukkan ke dalam labu takar 100 ml dan ditambahkan aquades sampai tera, kemudian disaring dengan penyaring vakum untuk memisahkan filtrat.
2. Pembuatan Larutan Iodium
Larutan iodium 0.01 N dibuat dengan cara mencampurkan 2 gram KI dan 1.269 gram I2, kemudian dilarutkan sampai volume 1
33
3. Penentuan Konsentrasi Asam Askorbat
Sebanyak 10 ml filtrat dari hasil ekstraksi dimasukkan ke dalam erlenmeyer, lalu ditambahkan dengan 2 ml larutan amilum (soluble starch) 1%. Larutan kemudian dititrasi dengan 0.01 N iodium. Titik akhir titrasi ditandai dengan perubahan warna larutan menjadi semburat biru.
Konsentrasi asam askorbat dihitung dengan rumus:
[ ] vitamin C (mg/100 g sampel) = x 100
1 ml 0.01 N Iodium setara dengan 0.88 mg asam askorbat. Prosedur analisis dapat dilihat pada Gambar 10.
3. Analisis Statistik
a. Analisis ragam (Anova)
Analisis ragam (Anova) dilakukan untuk mengetahui ada tidaknya perbedaan di dalam variabel-variabel yang diuji. Setelah itu, bila ditemukan bahwa dalam variabel-variabel yang diuji ada perbedaan yang signifikan, maka dilanjutkan dengan analisis tahap kedua, yakni uji lanjut yang mengkaji pada tingkat atau faktor-faktor di dalam variabel tersebut yang berbeda nyata dan seberapa besar perbedaan tersebut terjadi. Anova dilakukan dengan menggunakan software SPSS 13.0. Bila nilai signifikansi yang dihasilkan dari output Anova menunjukkan nilai yang kurang dari α sebesar 5% (0.05), maka ada perbedaan yang signifikan antar sampel yang diuji, dan sebaliknya. Alfa (α) merupakan besarnya kesalahan (error) yang masih bisa diterima dalam pengujian.
b. Uji Lanjut Duncan
34 mirip dengan pengurutan sebagaimana dilakukan Student-Newman-Keuls test, tetapi dalam perbandingan ini Duncan membuat “pengamanan” derajat kesalahannya dengan cara membandingkan tingkat kesalahan setiap pairwise dengan keseluruhan kesalahan setiap tingkat pasangan perlakuan yang diuji (Sumardi, 2003). Uji ini juga dilakukan dengan menggunakan software SPSS 13.00. Output yang dihasilkan berupa subset-subset dimana sampel-sampel yang berada pada subset yang sama berarti memiliki perbedaan yang tidak signifikan, sedangkan sampel pada subset yang berbeda berarti memiliki perbedaan yang signifikan pada nilai α 0.05.
c. Uji Korelasi Pearson
Uji korelasi Pearson digunakan untuk mengetahui ada tidaknya hubungan antar variabel yang tidak menunjukkan hubungan fungsional (berhubungan bukan berarti disebabkan). Korelasi antar dua variabel yang terjadi dapat berupa (Hasan, 2003):
1) Korelasi (+), yakni bila variabel yang satu (x) menaik atau menurun, maka variabel lainnya cenderung menaik atau menurun pula.
2) Korelasi (-), yakni bila variabel yang satu (x) menaik atau menurun, maka variabel lainnya cenderung menurun atau menaik. 3) Tidak ada korelasi, yakni bila kedua variabel (x dan y) tidak
menunjukkan adanya hubungan.
35 KK ke +1 dan -1, maka semakin kuat korelasinya. Jika KK bernilai 0 maka kedua variabel tidak menunjukkan adanya korelasi, sedangkan bila KK bernilai +1 atau -1 maka kedua variabel menunjukkan korelasi yang sempurna. Untuk menentukan keeratan hubungan atau korelasi antar variabel tersebut, maka digunakan patokan sebagai berikut (Hasan, 2003):
1) KK=0 (tidak ada korelasi)
2) 0<KK≤0.20 (korelasi sangat rendah/lemah) 3) 0.20<KK≤0.40 (korelasi rendah/lemah tapi pasti) 4) 0.40<KK≤0.70 (korelasi yang cukup berarti) 5) 0.70<KK≤0.90 (korelasi yang tinggi dan kuat)
6) 0.90<KK<1.00 (korelasi sangat tinggi, kuat sekali, dapat diandalkan)
7) KK=1 (korelasi sempurna)
Uji korelasi Pearson pada penelitian ini dilakukan dengan menggunakan software Minitab 15.0. Uji ini juga digunakan untuk mendapatkan kesimpulan hasil meta-analisis antar senyawa yang diidentifikasi pada penelitian ini.
d. Analisis Komponen Utama (PCA)
Analisis komponen utama (principal component analysis) merupakan teknik statistik yang dapat digunakan untuk menjelaskan struktur variansi-kovariansi dari sekumpulan variabel melalui beberapa variabel baru dimana variabel baru ini saling bebas, dan merupakan kombinasi linier dari variabel asal. Selanjutnya variabel baru ini dinamakan komponen utama (principal component).
36 yaitu: 1) Proporsi kumulatif keragaman data asal yang dijelaskan oleh k komponen utama minimal 80% , dan proporsi total variansi populasi bernilai cukup besar; 2) Dengan menggunakan scree plot yaitu plot antara i dengan i , pemilihan nilai k berdasarkan scree plot ditentukan dengan melihat letak terjadinya belokan dengan menghapus komponen utama yang menghasilkan beberapa nilai eigen kecil membentuk pola garis lurus (Rencher, 1998).
Output yang dihasilkan dari pengujian dengan PCA ini adalah data analisis eigen dari matriks korelasi yang berupa nilai akar cirri (eigen value), proporsi dan kumulatif. Dari nilai akar ciri dapat diidentifikasi komponen utama yang diperoleh, yakni variabel yang memiliki dua nilai akar ciri terbesar (nilai lebih dari 1), kemudian nilai proporsi menggambarkan persentase keragaman data yang dapat diterangkan oleh masing-masing komponen utama, dan nilai kumulatif menggambarkan keseluruhan persentase keragaman data yang dapat diterangkan oleh kedua komponen utama. Selain itu, dihasilkan pula grafik biplot untuk kebutuhan interpretasi data. Analisis komponen utama ini dilakukan dengan menggunakan software Minitab 15.0.
4. Analisis Potensi
37
[image:37.595.54.445.74.762.2]
@
Gambar 7. Diagram alir analisis total karotenoid dengan spektrofotometer Sentrifuse 2000 rpm, 5 menit Fase organik total
Pengambilan fase organik Sentrifuse 2000 rpm, 5 menit
Vorteks 4 ml air deion,
8 ml heksana
Pendinginan pada T ruang
Pemanasan dalam waterbath 70°C, 30 menit Vorteks
Saponifikasi dengan 4 ml KOH 5% dalam metanol Pengeringan dgn rotavapor
Filtrat jernih
Pengulangan ekstraksi (beberapa kali) Penyaringan vakum dengan Whatman 42
0.25 g sampel
Pengekstrakkan dengan 5 ml heksan:aseton (1:1) 3x
Sonifikasi 30 detik
Fase air
Vorteks dengan 6 ml heksan
38 @
Gambar 7. Diagram alir analisis total karotenoid (lanjutan)
Gambar 8. Diagram alir analisis β-karoten dengan HPLC Pengeringan dengan rotavapor
Sentrifuse 2000 rpm, 5 menit Pengambilan fase organik
Vorteks 3 ml CH3COOH 5%
Pelarutan dengan 4 ml heksan
Pengukuran absorbansi (450 nm)
Pelarutan dengan 2 ml
metanol:asetonitril:kloroform (48.5:48.5:3.0) Penyaringan dengan membran 0.22 µm Penyimpanan dalam freezer -20°C, 12 jam
Vorteks
Pelarutan dalam 5% kloroform dalam metanol Pengeringan dengan rotavapor
Ekstrak sampel (dari analisis tot. karotenoid)
Pengeringan dengan rotavapor
[image:38.595.142.443.358.729.2]39
Gambar 9. Diagram alir analisis total antosianin dengan spektrofotometer Pengukuran absorbansi (535 nm)
Vorteks Diencerkan sampai
10 ml dengan etanol 95%:HCl 1.5N
(85:15)
Diambil sebanyak 5 ml filtrat
Penyaringan dengan pompa vakum ±1 gram sampel
Maserasi selama 1 malam dalam botol gelap pada suhu 4°C 10 ml HCl 5%
40
Gambar 10. Diagram alir analisis asam askorbat dengan cara titrasi 2 ml larutan
amilum 1%
Titrasi dengan 0.01 N Iodium Pencampuran dalam erlenmeyer
Pengambilan 10 ml filtrat
Penyaringan dengan vakum Penempatan dalam labu takar 100 ml
sampai tera dengan aquades Pengambilan ±10 g slurry
25-50 g sayuran segar
Penghancuran dengan waring blender 50-100 ml
41
IV. HASIL DAN PEMBAHASAN
A. TOTAL KAROTENOID
Karotenoid merupakan pigmen berwarna jingga atau merah yang terdapat di berbagai macam plastida berwarna (kromoplas) di akar, batang, daun, bunga, dan buah berbagai tumbuhan. Karotenoid yang terkandung dalam sayur-sayuran dan buah-buahan mengandung 80-85% aktivitas vitamin A (De Pee, 1996).
Secara umum, proses analisis karotenoid pada penelitian ini terdiri dari ekstraksi, saponifikasi, pemisahan fase, dan pengukuran. Ekstraksi dilakukan dengan menggunakan campuran aseton dan heksana (1:1) yang merupakan pelarut non polar karena karoten sebagai senyawa non polar hanya dapat larut dalam pelarut non polar (like dissolves like). Saponifikasi dilakukan dengan menggunakan KOH dalam metanol. Proses ini merupakan prosedur pemurnian untuk membuang lipid dan klorofil yang tidak diinginkan, namun tidak merusak karotenoid yang umumnya stabil terhadap alkali. Selanjutnya adalah proses pemisahan antara fase organik (lapisan atas) dengan fase air (lapisan bawah) dalam ekstrak bahan dengan cara pemusingan (sentrifuse) menggunakan heksan. Terakhir, dilakukan proses pengukuran dengan spektrofotometer UV menggunakan panjang gelombang 450 nm. Menurut Gross (1991), karotenoid menyerap terutama pada daerah biru (430-470 nm), dengan absorbansi maksimum pada panjang gelombang 451 nm.
42 sayuran lainnya (Tabel 2), maka kandungan total karotenoid pada sayuran indigenous ini masih diatas nilai kandungan total karotenoid jenis sayuran lainnya. Lebih jelasnya, diagram batang kandungan total karotenoid pada 24 sayuran indigenous dapat dilihat pada Gambar 11.
Gambar 11. Diagram batang kandungan total karotenoid pada 24 sayuran indigenous Jawa Barat
Philip (1975) menyatakan bahwa adanya ikatan rangkap terkonjugasi dalam molekul karotenoid menandakan adanya gugus kromofor yang menyebabkan terbentuknya warna pada karotenoid, semakin banyak ikatan rangkap terkonjugasi maka semakin pekat warna karotenoid tersebut, yaitu semakin mengarah ke warna merah atau oranye. Akan tetapi, hasil penelitian ini menunjukkan bahwa tidak hanya sayuran berwarna kemerahan saja yang memiliki kandungan karotenoid, namun juga sayuran berwarna hijau memiliki total karotenoid yang bahkan lebih besar dibandingkan sayuran berwarna kemerahan. Menurut Winarno (1992), ada hubungan langsung antara derajat kehijauan sayuran dengan kadar karoten, semakin hijau daun tersebut semakin
0.00 10.00 20.00 30.00 40.00 50.00 60.00 B u n g a tu ri T ak o k ak B u n g a p ep ay a Kec o m b ran g Ku ca i T er u b u k Ma n g k o k an A n tan an b eu rit L em b ay u n g Dau n lab u P u cu k m en g k u d u Dau n … Katu k P u cu k m ete A n tan an P o h p o h an Man g k o k an p u ti h B elu n tas Kr o k o t Ken ik ir Dau n Gin sen g Dau n k elo r P ak is Kem an g i
a3.65 0.25
j45.52 1.77
i43.19 3.24
d15.17 0.08 f
22.59 1.83
b8.061 0.48
m58.41 5.56
f23.61 0.32
h32.54 2.10
e17.51 2.00
i41.58 1.68
l51.66 1.72
j45.96 1.84
a48.48 1.39
b8.374 0.71
a4.105 0.13
m56.43 0.76
f22.57 1.45
f21.18 0.57
c11.13 0.68
f21.23 0.18
b7.60 0.50
g28.25 1.87
[image:42.595.116.559.179.459.2]43 tinggi kadar karotennya, sedangkan daun-daunan yang pucat miskin akan karoten.
Sampel sayuran yang berwarna hijau pada penelitian ini cenderung memiliki total karotenoid yang lebih besar dibandingkan dengan total karotenoid yang dimiliki oleh sampel sayur yang berwarna lebih terang (kuning muda sampai merah), seperti bunga turi, kecombrang, dan bunga papaya. Menurut Sediaoetama (1976), karoten berwarna kuning, namun tidak semua warna kuning pada buah-buahan ataupun sayur-sayuran disebabkan oleh warna ini, masih terdapat pigmen lain seperti zeaxanthin dan flavoxantin yang tidak aktif, artinya tidak dapat diubah menjadi vitamin A.
Kandungan karoten dan β-karoten yang terkandung dalam sayur-sayuran dipengaruhi oleh berbagai faktor, seperti cara budidaya, varietas, dan umur tanaman (Howard et al., 1994). Dengan demikian, dapat dimungkinkan bahwa hasil karotenoid dan β-karoten yang diperoleh dari hasil penelitian ini dapat lebih rendah atau lebih tinggi dari hasil yang diperoleh dari penelitian lainnya (Portocarrero et al., 1992). Namun demikian, sampel-sampel yang digunakan dalam penelitian ini merupakan sampel dengan varietas dan umur penen yang biasa dikonsumsi (dibuat sayur/lalapan) oleh masyarakat yang diperoleh dari pasar-pasar setempat.
Pengolahan data nilai total karoten terhadap 24 sampel dengan ANOVA menghasilkan output seperti pada Lampiran 4. Hasil uji statistik tersebut menunjukkan bahwa terdapat perbedaan yang nyata terhadap nilai kandungan total karotenoid antar sampel. Hal ini terlihat dari nilai signifikansi sampel yang dihasilkan, yakni lebih kecil dari taraf α (0.05). Oleh karena adanya perbedaan yang nyata, maka dilanjutkan dengan uji Duncan.
44 sebenarnya tidak memiliki kandungan total karotenoid yang berbeda nyata karena berada pada subset yang sama. Akan tetapi, ketiga sampel tersebut memiliki kandungan total karotenoid yang berbeda secara nyata terhadap sampel bunga pepaya, kecombrang, dan kucai, serta sampel lainnya yang berada pada subset berbeda.
B. β-KAROTEN
Salah satu senyawa metabolit sekunder yang bermanfaat bagi tubuh adalah senyawa yang merupakan turunan isoprenoid. Termasuk didalamnya adalah karotenoid, dimana β-karoten sebagai prekursor vitamin A merupakan karotenoid yang paling banyak dijumpai pada tumbuhan tingkat tinggi.
Identifikasi karotenoid spesifik pada penelitian ini hanya dilakukan pada β-karoten. Hal ini dikarenakan β-karoten memiliki nilai gizi yang penting dan merupakan sumber provitamin A. Selain itu, hampir dalam setiap sayuran dan buah segar, 85% dari total aktivitas vitamin A berasal dari β-karoten. Seperti pada bayam, komponen utama karotenoidnya adalah β-karoten disusul lutein, neosantin, zeasantin, dan violasantin (Ball, 2000).
Hasil ekstrak yang diperoleh dari pengukuran total karotenoid digunakan pula dalam pengukuran β-karoten dengan melarutkan ekstrak kering hasil penguapan dengan fase gerak, yakni campuran metanol, asetonitril, dan kloroform. Pengukuran β-karoten dilakukan dengan menggunakan metode HPLC (High Performance Liquid Chromatography). Menurut Macrae (1988), keutamaan dari HPLC adalah kemampuannya untuk menangkap komponen dengan stabilitas panas yang terbatas ataupun yang bersifat volatil. HPLC merupakan metode yang sangat sensitif, tepat, selektif, dan memiliki tingkat otomatisasi yang tinggi sehingga lebih sederhana dalam pengoperasiannya.
45 pohpohan (12.03 mg/100 g sampel dry basis), sedangkan bunga kecombrang memiliki kandungan β-karoten terendah, yakni sebesar 0.01 mg/100 g dry basis. Meskipun bunga kecombrang memiliki warna kemerahan akan tetapi ternyata tanaman ini memiliki kandungan β-karoten yang rendah seperti halnya kandungan total karotennya yang rendah pula. Hal ini dapat disebabkan adanya kandungan pigmen lainnya yang jauh lebih besar yang berperan dalam menghasilkan warna kemerahan sampai keunguan pada tanaman ini, seperti pigmen antosianin.
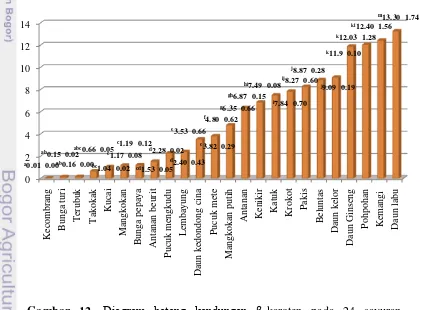
Kadar β-karoten pada 24 sayuran indigenous yang dianalisis berkisar antara 0.01 sampai 13.27 mg/100 g dry basis, sedangkan kadar rata-rata β -karoten pada 24 sayuran tersebut adalah sebesar 5.30 mg/100 g dry basis. Bila dibandingkan dengan kadar β-karoten jenis sayuran lainnya seperti yang tertera pada Tabel 2, maka kadar β-karoten yang dimiliki oleh sayuran indigenous ini pun masih tergolong lebih tinggi. Lebih jelasnya, diagram batang kandungan β-karoten pada 24 sayuran indigenous dapat dilihat pada Gambar 12.
Gambar 12. Diagram batang kandungan β-karoten pada 24 sayuran
indigenous Jawa Barat
0 2 4 6 8 10 12 14 Kec o m b ran g B u n g a tu ri T er u b u k T ak o k ak Ku ca i M an g k o k an B u n g a p ep ay a A n tan an b eu rit P u cu k m en g k u d u L em b ay u n g Dau n k ed o n d o n g cin a P u cu k m ete Ma n g k o k an p u tih A n tan an Ken ik ir Katu k Kr o k o t P ak is B elu n tas Dau n k elo r Dau n Gin sen g P o h p o h an Kem an g i Dau n lab u
gh6.87 0.15
j8.87 0.28
f4.80 0.62
c1.17 0.08
e3.53 0.66
a0.01 0.00
kl12.40 1.56
hi7.49 0.08
g6.35 0.66
cd1.53 0.05
k12.03 1.28
k11.9 0.10
i7.84 0.70
ab0.15 0.02
bc1.04 0.02
abc0.66 0.05
j9.09 0.19
d2.28 0.02
d2.40 0.43
ab0.16 0.00
m13.30 1.74
c1.19 0.12 e
3.82 0.29
[image:45.595.109.532.411.721.2]46 Kromatogram β-karoten yang diperoleh dari hasil analisis menunjukkan bahwa puncak β-karoten muncul disekitar menit ke-16 sampai menit ke-18. Namun umumnya puncak β-karoten muncul pada menit ke-17 sesuai dengan kromatogram standar β-karoten yang diperoleh (Gambar 13) , yakni muncul pada menit ke-17.584.
Gambar 13. Hasil kromatogram HPLC analisis β-karoten dari standar β-karoten dengan kemunculan puncak β-karoten pada menit ke-17.584
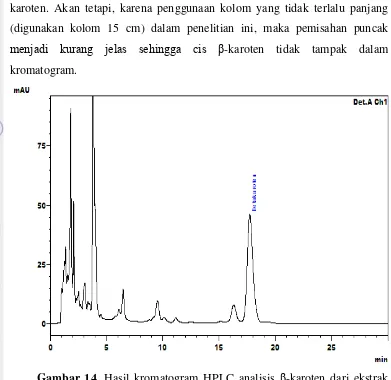
Sebagai contoh, kromatogram HPLC β-karoten dari daun kedondong cina dapat dilihat pada Gambar 14. Berdasarkan hasil kromatogram tersebut, dapat dilihat bahwa puncak β-karoten muncul pada menit ke-17.741. Hasil kromatogram tersebut menunjukkan pula adanya puncak sebelum puncak β -karoten, yakni diantara menit ke-16 sampai ke-17, puncak ini dimungkinkan adalah α-karoten, salah satu jenis karoten lain selain β- dan -karoten (Zakaria et al., 2000). Puncak ini juga muncul disebagian besar hasil kromatogram sampel sayur lainnya.
[image:46.595.119.508.196.476.2]-47 karoten. Akan tetapi, karena penggunaan kolom yang tidak terlalu panjang (digunakan kolom 15 cm) dalam penelitian ini, maka pemisahan puncak menjadi kurang jelas sehingga cis β-karoten tidak tampak dalam kromatogram.
Gambar 14. Hasil kromatogram HPLC analisis β-karoten dari ekstrak daun kedondong cina dengan kemunculan puncak β -karoten pada menit ke-17.741
Hasil kromatogram ekstrak sayuran indigenous lainnya tidak jauh berbeda dengan hasil kromatogram ekstrak daun kedondong cina. Puncak β -karoten dari ekstrak sayuran pada kromatogram yang dihasilkan umumnya muncul pada menit ke-16 sampai dengan menit ke-18.
[image:47.595.122.513.84.464.2]48 Hasil uji Duncan (Lampiran 5) memberikan informasi bahwa terdapat 12 subset yang dihasilkan. Sampel yang berada pada subset yang sama berarti tidak memiliki kandungan β-karoten yang berbeda nyata pada taraf signifikansi 5%, sedangkan sampel yang berada pada subset yang berbeda berarti memiliki kandungan β-karotenoid yang berbeda nyata pada taraf signifikansi 5% terhadap sampel yang berada pada subset lainnya. Dengan demikian, sebagai contoh dapat dikatakan bahwa daun kedondong cina dan pucuk mete tidak memiliki kandungan β-karoten yang berbeda nyata karena berada pada subset yang sama. Akan tetapi, kedua sampel tersebut memiliki kandungan β-karoten yang berbeda nyata terhadap sampel daun mangkokan putih serta sampel lainnya yang berada pada subset berbeda.
C. ANTOSIANIN
Antosianin merupakan salah satu pigmen utama dalam tumbuhan yang terdapat dalam vakuola sel bagian tanaman, yaitu organel sitoplasmik yang berisikan air, serta dibatasi oleh membran yang identik dengan membran tanaman (Kimbal, 1993). Pigmen ini berada pada sebagian besar tanaman tingkat tinggi dan terdapat pada seluruh bagian tanaman (Brouillard, 1982).
49 antosianin dalam penelitian ini adalah HCl 5% dalam aquades. Sesuai dengan pernyataan Bridle dan Timberlake (1997), bahwa antosianin merupakan pewarna alami yang berasal dari famili flavonoid yang larut dalam air (water soluble).
Antosianin memiliki cincin aromatik yang mengandung gugus polar (hidroksil, karboksil, metoksil) dan residu glikosil yang menghasilkan molekul polar dengan keadaannya yang polar, antosianin lebih mudah larut dalam pelarut polar seperti etanol, metanol, dan air (Jackman dan Smith, 1996), sedangkan asam klorida dalam pelarut akan mendenaturasi membran sel kemudian melarutkan pigmen antosianin keluar dari sel.
Kandungan antosianin dapat diketahui melalui beberapa metode, yaitu metode yang menggunakan larutan yang memiliki satu nilai pH dan metode yang menggunakan dua larutan yang memiliki dua nilai pH yang berlainan. Salah satu metode yang menggunakan satu nilai pH yang digunakan dalam penelitian ini, yaitu metode yang digunakan oleh Lees dan Francis (1972). Total antosianin dihitung dari absorbansi ekstrak yang dilarutkan dalam etanol 95%:HCl 1.5 N (85:15) pada panjang gelombang 535 nm. Nilai serapan molar yang digunakan adalah 98.2 yaitu nilai E (1%, 1 cm, 535 nm) untuk pelarut etanol yang diasamkan. Nilai ini merujuk pada absorpsi campuran antosianin buah cranberry di dalam etanol asam yang diukur didalam celah selebar 1 cm pada panjang gelombang 535 nm dalam konsentrasi 1% (w/v).
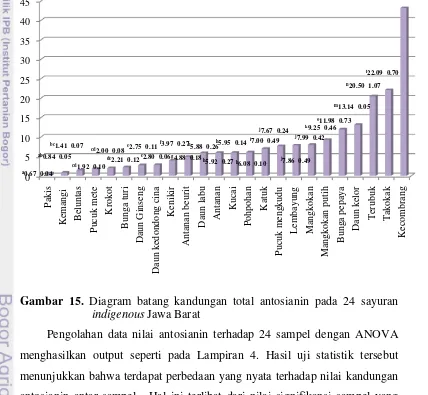
Hasil penelitian pada 24 sampel sayur menunjukkan bahwa konsentrasi antosianin tertinggi terdapat pada bunga kecombrang yaitu sebesar 43.19 mg/100 g dry basis, diikuti oleh takokak (22.09 mg/100 g dry basis) dan terubuk (20.50 mg/100 g dry basis). Sebaliknya, konsentrasi antosianin terendah terdapat pada daun pakis dengan konsentrasi sebesar 0.67 mg/100 g dry basis. Konsentrasi antosianin pada 24 sampel sayuran indigenous dapat dilihat pada Tabel 11 dan untuk perhitungan antosianin pada sampel selengkapnya dapat dilihat pada Lampiran 2.
50 basis dengan rata-rata sebesar 0.082 mg/g dry basis. Hal ini dapat disebabkan karena pigmen antosianin sebagian besar terdapat pada tanaman yang berbunga dan menghasilkan warna dari merah tua sampai biru pada bunga, buah, dan daun (Harborne dan Grayer, 1988), sedangkan 24 sampel yang diteliti sebagian besar merupakan tanaman daun yang berwarna hijau, hanya kecombrang memiliki warna merah sampai keunguan dan terbukti bahwa sampel tersebut memiliki kandungan antosianin terbesar diantara sampel lainnya. Lebih jelasnya, diagram batang kandungan total antosianin pada 24 sayuran indigenous dapat dilihat pada Gambar 15.
Gambar 15. Diagram batang kandungan total antosianin pada 24 sayuran indigenous Jawa Barat
Pengolahan data nilai antosianin terhadap 24 sampel dengan ANOVA menghasilkan output seperti pada Lampiran 4. Hasil uji statistik tersebut menunjukkan bahwa terdapat perbedaan yang nyata terhadap nilai kandungan antosianin antar sampel. Hal ini terlihat dari nilai signifikansi sampel yang dihasilkan, yakni lebih kecil dari taraf α (0.05). Oleh karena adanya perbedaan yang nyata, maka dilanjutkan dengan uji Duncan.
0 5 10 15 20 25 30 35 40 45 P ak is Kem an g i B elu n tas P u cu k m ete Kr o k o t B u n g a tu ri Dau n Gin sen g Dau n k ed o n d o n g cin a Ken ik ir A n tan an b eu rit D au n la b u A n tan an Ku ca i P o h p o h an K atuk P u cu k m en g k u d u L em b ay u n g Ma n g k o k an Man g k o k an p u ti h B u n g a p ep ay a Dau n k elo r T er u b u k T ak o k ak Kec o m b ran g
f3.97 0.27 bc1.41 0.07
k9.25 0.46 j7.99 0.42
e2.80 0.06
p43.19 1.12
ab0.84 0.05
i7.00 0.49
h5.92 0.27 g4.88 0.18
h6.08 0.10 e2.75 0.11
cd2.00 0.08 de2.21 0.12
h5.95 0.14
l22.09 0.70
m13.14 0.05
j7.67 0.24
j7.86 0.49
n20.50 1.07
h5.88 0.26
o11.98 0.73
[image:50.595.112.540.287.682.2]51 Hasil uji Duncan (Lampiran 5) memberikan informasi bahwa terdapat 16 subset yang dihasilkan. Sampel yang berada pada subset yang sama berarti tidak memiliki kandungan antosianin yang berbeda nyata pada taraf signifikansi 5%, sedangkan sampel yang berada pada subset yang berbeda berarti memiliki kandungan antosianin yang berbeda nyata pada taraf signifikansi 5% terhadap sampel yang berada pada subset lainnya. Dengan demikian, sebagai contoh dapat dikatakan bahwa daun pakis dan kemangi tidak memiliki kandungan antosianin yang berbeda nyata karena berada pada subset yang sama. Akan tetapi, kedua sampel tersebut memiliki kandungan antosianin yang berbeda nyata terhadap sampel beluntas, pucuk mete, dan krokot serta sampel lainnya yang berada pada subset berbeda.
D. ASAM ASKORBAT
Asam askorbat atau vitamin C merupakan vitamin yang mudah larut dalam air. Vitamin ini sering disebut sebagai fresh food vitamin karena banyak terdapat pada sayur dan buah-buahan segar (Winarno, 1992).
Analisis vitamin C dalam sayur-sayuran yang digunakan dalam penelitian ini menggunakan metode titrasi dengan iodium. Sampel sayur-sayuran diekstrak dengan cara menghancurkannya dan digunakan air untuk membantu melarutkan vitamin C yang terdapat dalam sampel. Ekstrak sampel yang diperoleh direaksikan dengan larutan amilum 1% sebagai indikator perubahan warna ekstrak setelah dititrasi dengan 0.01 N iodium, yakni menjadi berwarna semburat biru. Sebanyak 1 ml 0.01 N iodium ini setara dengan 0.88 mg asam askorbat, sehingga dari hasil titrasi dapat dikalkulasikan berapa banyak asam askorbat dalam sampel.
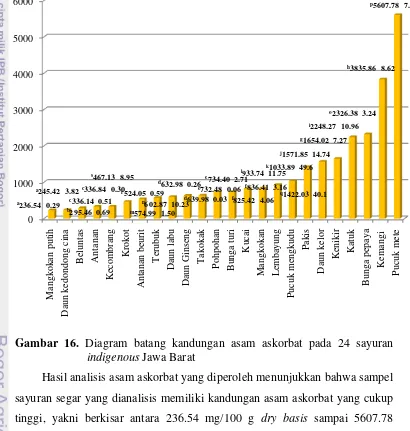
52 selengkapnya dapat dilihat pada Lampiran 2. Perbedaan nilai kandungan vitamin C beberapa jenis sayur yang dianalisa dalam penelitian ini dengan sumber lainnya dapat disebabkan oleh adanya faktor-faktor dari masing-masing sampel seperti suhu, intensitas sinar, umur tanaman, jumlah kandungan air, faktor genetik, varietas, dan kesuburan tanah (Fennema, 1985), maupun dari cara analisis yang digunakan. Lebih jelasnya, diagram batang kandungan asam askorbat dapat dilihat pada Gambar 16.
Gambar 16. Diagram batang kandungan asam askorbat pada 24 sayuran indigenous Jawa Barat
Hasil analisis asam askorbat yang diperoleh menunjukkan bahwa sampel sayuran segar yang dianalisis memiliki kandungan asam askorbat yang cukup tinggi, yakni berkisar antara 236.54 mg/100 g dry basis sampai 5607.78 mg/100 g dry basis, dengan rata-rata kandungan vitamin C sebesar 1194.70 mg/100 g dry basis. Hasil ini jauh lebih tinggi bila dibandingkan dengan kandungan asam askorbat pada berbagai jenis sayuran lainnya seperti tertera pada Tabel 5.
0 1000 2000 3000 4000 5000 6000 Ma n g k o k an p u tih Dau n k ed o n d o n g cin a B elu n tas A n tan an Kec o m b ran g Kr o k o t A n tan an b eu rit T er u b u k D au n la b u Dau n Gin sen g T ak o k ak P o h p o h an B u n g a tu ri Ku ca i Ma n g k o k an L em b ay u n g P u cu k m en g k u d u P ak is Dau n k elo r Ken ik ir K atuk B u n g a p ep ay a Kem an g i P u cu k m ete
g1654.02 7.27
b295.46 0.69
a236.54 0.29
f836.41 3.16
a245.42 3.82c336.84 0.30
h3835.86 8.62
i2248.27 10.96
c336.14 0.51
r524.05 0.59 e732.48 0.06
d632.98 0.26
s467.13 8.95 e
734.40 2.71
f825.42 4.06
d639.98 0.03
j1571.85 14.74
k1033.89 49.6
l933.74 11.75
m574.99 1.50
n602.87 10.23
o2326.38 3.24
p5607.78 7.91
[image:52.595.117.527.246.677.2]53 FDA menetapkan standar klaim untuk vitamin C yaitu minimal mengandung 20% RDA vitamin C. RDA (Recommended Dietary Allowance) atau AKG (Angka Kecukupan Gizi) vitamin C untuk wanita dan pria dewasa menurut National Academy of Science (2000) adalah sebesar 75-90 mg, sehingga suatu produk dapat diklaim mengandung vitamin C yang tinggi jika mengandung vitamin C minimal 15-18 mg/sajian. Untuk sayuran, sajian rumah tangga yang biasa digunakan adalah dalam ukuran mangkuk, bila dikonversi adalah sebanyak 50-100 gram per mangkuk. Dengan demikian, bila konsumsi terhadap sayur-sayuran indigenous tersebut dilakukan sesuai takaran, maka akan memenuhi angka kecukupan gizi vitamin C yang disarankan dengan memperhatikan kehilangan vitamin C saat pengolahan.
Menurut penelitian Subeki (1998) mengenai pengaruh cara pemasakan terhadap kandungan