PENDAHULUAN
Kakao (Theobroma cacao L.) merupakan salah satu tanaman perkebunan yang mempunyai nilai ekonomi tinggi sebagai komoditi ekspor. Indonesia termasuk dalam tiga besar produsen kakao dunia bersama Ghana dan Pantai Gading (Direktorat Jendral Bina Produksi Perkebunan 2004). Kakao mempunyai prospek yang cerah karena diperkirakan kebutuhan kakao dunia akan terus meningkat.
Kebutuhan kakao yang setiap tahun meningkat menyebabkan berbagai propinsi di Indonesia melakukan ekstensifikasi areal penanaman kakao guna untuk peningkatan produksi nasional. Salah satu provinsi yang sedang melakukan ekstensifikasi adalah propinsi Sumatra Barat dan direncanakan menjadi sentra kakao nasional pada masa yang akan datang. Pemerintah Sumatra Barat menargetkan penambahan kebun kakao mencapai 20.000 ha per tahun. Dengan adanya ekstensifikasi areal penanaman kakao, diharapkan dapat meningkatkan produksi kakao nasional dan tetap mempertahankan produksi kakao yang tinggi, sehingga dapat bersaing dengan negara produsen lainnya.
Indonesia harus menyediakan tanaman kakao yang mempunyai produktivitas tinggi dan kualitas biji yang baik untuk mempertahankan sebagai negara produsen kakao. Namun keadaan di lapangan sangat berbeda, banyak kendala yang dihadapi pekebun kakao. Kendala yang dihadapi antara lain, adanya serangan hama utama kakao, yaitu Penggerek Buah kakao (PBK), Conopomorpha cramerella snellen (Lim 1986). Serangan PBK menyebabkan kehilangan produksi kakao hingga 80% dan biji kakao yang terserang, mutunya menurun bahkan tidak laku dijual (Wardojo 1992), sehingga meskipun harga kakao akhir-akhir ini meningkat, namun tidak bisa dimanfaatkan secara optimal oleh para pekebun kakao.
Serangan hama PBK merupakan ancaman yang serius bagi kelangsungan usaha pekebun kakao karena belum ditemukan pengendalian hama yang efektif dan efisien (Santoso et al 2004). Pengendalian hama PBK secara konvensional sudah sering dilakukan, seperti pemangkasan, pemupukan, sanitasi, dan kontinuitas pemanenan. Sedangkan penelitian yang telah dilakukan antara lain
dengan kultur teknis, secara kimia dengan penyemprotan insektisida, dan secara biologis menggunakan jamur Beauveria bassiana (Zaenudin et al 2000). Pengendalian tersebut dapat dikatakan kurang efektif karena lebih dari 50 % dari siklus hidup hama PBK berada di dalam buah (Depparaba 2004).
Untuk mengatasi kendala tersebut perlu dicari suatu metode pengendalian hama PBK yang handal, yaitu dengan perakitan tanaman kakao yang unggul melalui rekayasa genetik. Telah dilaporkan bahwa gen cry dari Bacillus thuringensis teruji efektif terhadap larva PBK (Chaidamsari et al 2005 dan Santoso D et al 2004), namun adanya penolakan terhadap produk pangan transgenik karena menggunakan gen dari bakteri, telah melemahkan upaya rekayasa genetik tersebut, meskipun gen cry maupun protein yang disandinya aman dikonsumsi manusia (de Maagd et al 2001). Berdasarkan hal ini maka perlu dicari metode yang lain untuk mengendalikan PBK.
Metode lain yang mungkin dilakukan agar kakao transgenik dapat diterima masyarakat adalah dengan memanfaatkan gen pertahanan alami pada tanaman kakao itu sendiri, yaitu gen proteinase inhibitor (PIN). PIN merupakan protein berukuran kecil yang mampu menghambat aktifitas proteinase dalam sistem pencernaan serangga (Fritz 2000). Apabila termakan oleh hama PBK, PIN akan berinteraksi dengan protease yang ada di dalam usus hama tersebut, terikat dan terkunci pada situs aktif (active site) protease (Terra et al 1996 dan Walker et al 1998). Hama PBK menjadi kekurangan nutrisi karena tidak ada asam amino yang diserap, sehingga pertumbuhan dan perkembangan menjadi terhambat.
yang tahan dan tidak tahan terhadap hama PBK, yaitu klon Ary 2 (tahan) dan Bal 209 (tidak tahan) yang berasal dari Sulawesi.
Penelitian ini bertujuan untuk mengisolasi gen PIN dari biji kakao dan melihat tingkat ekspresi gen PIN terhadap klon kakao yang tahan dan tidak tahan terhadap PBK. Hipotesis penelitian ini adalah klon kakao yang tahan terhadap PBK mengekspresikan gen PIN. Hasil penelitian ini diharapkan dapat memberikan informasi apakah gen PIN berpengaruh terhadap ketahanan klon kakao terhadap PBK dan nantinya dimungkinkan untuk dibuat klon kakao transgenik yang mengekspresikan gen PIN.
TINJAUAN PUSTAKA
Kakao Sebagai Komoditi EksporKakao (Theobroma cacao L) merupakan tanaman yang berasal dari Amerika Selatan, dari biji tanaman ini dihasilkan produk olahan yang dikenal sebagai cokelat. Biji buah kakao yang telah difermentasi dijadikan serbuk yang disebut sebagai coklat bubuk. Coklat ini dipakai sebagai bahan untuk membuat berbagai macam produk makanan dan minuman. Buah kakao tanpa biji dapat difermentasi untuk dijadikan pakan ternak.
Kakao merupakan tanaman perkebunan/industri berupa pohon yang dikenal di Indonesia sejak tahun 1560, namun baru menjadi komoditi yang penting sejak tahun 1951. Budidaya kakao di Indonesia diusahakan oleh Perusahaan Perkebunan Negara dan Swasta serta Perkebunan Rakyat. Lokasi Perusahaan Perkebunan skala besar yang diusahakan negara terletak di Sumatera Utara, Jawa Tengah dan Jawa Timur. Sedangkan Perkebunan rakyat terdapat terutama di Maluku, Irian Jaya, Sulawesi Utara, Sulawesi Selatan, Sulawesi Tenggara dan Nusa Tenggara Timur. Pada tahun 1988 areal tanaman coklat mencapai 213.612 ha. Luas perkebunan pada tahun 1991 mencapai 350.422 ha dengan produksi 121.651 ton coklat di Jawa Barat pada tahun 1998 mencapai 18.66,2 ha dengan produksi 6.404,3 ton.
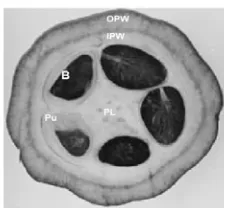
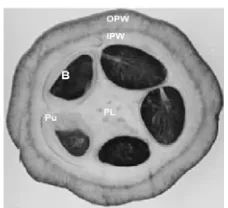
Buah kakao bila dibelah akan tampak seperti Gambar 1, dan bagiannya dapat dikarakterisasi, yaitu OPW (outer pod wall) merupakan bagian kulit terluar dari kakao,
Gambar 1 Bagian buah kakao (Chaidamsari 2005)
IPW (inner pod wall) merupakan bagian kulit lapisan kedua yang berada di dalam buah, Pu (pulp) merupakan daging buah dari kakao, B (beans) biji kakao, dan PL (placenta) bagian tengah dari kakao.
Jenis kakao yang terbanyak dibudidayakan adalah jenis Criollo (Criollo Amerika Tengah dan Amerika Selatan) yang menghasilkan biji kakao bermutu sangat baik dan dikenal sebagai kakao mulia, fine flavour cocoa, choiced cocoa atau edel cocoa. Forastero yang menghasilkan biji kakao bermutu sedang, dikenal sebagai ordinary cocoa atau bulk cocoa dan trinitario yang merupakan hibrida alami dari Criollo dan Forastero sehingga menghasilkan biji kakao yang termasuk fine flavour cocoa atau bulk cocoa. Jenis Trinitario yang banyak ditanam di Indonesia adalah Hibrid Djati Runggo (DR) dan Uppertimazone Hybrida (Kakao lindak).
Penggerek Buah Kakao (PBK)
Penggerek Buah Kakao (PBK), Conopomorpha Cramerella Snellen, merupakan hama yang menimbulkan masalah yang cukup serius di Indonesia. Saat ini PBK menyerang hampir seluruh perkebunan kakao di Indonesia dan sangat merugikan petani. Hama ini memakan plasenta yang merupakan saluran makanan menuju ke biji sehingga mengakibatkan penurunan hasil dan mutu biji. Menurut Wardoyo (1996) kerugian yang ditimbulkan oleh PBK antara lain menurunnya berat, mutu biji, dan meningkatnya biaya panen karena pemisahan biji pada buah terserang memerlukan waktu yang lama.
2
yang tahan dan tidak tahan terhadap hama PBK, yaitu klon Ary 2 (tahan) dan Bal 209 (tidak tahan) yang berasal dari Sulawesi.
Penelitian ini bertujuan untuk mengisolasi gen PIN dari biji kakao dan melihat tingkat ekspresi gen PIN terhadap klon kakao yang tahan dan tidak tahan terhadap PBK. Hipotesis penelitian ini adalah klon kakao yang tahan terhadap PBK mengekspresikan gen PIN. Hasil penelitian ini diharapkan dapat memberikan informasi apakah gen PIN berpengaruh terhadap ketahanan klon kakao terhadap PBK dan nantinya dimungkinkan untuk dibuat klon kakao transgenik yang mengekspresikan gen PIN.
TINJAUAN PUSTAKA
Kakao Sebagai Komoditi EksporKakao (Theobroma cacao L) merupakan tanaman yang berasal dari Amerika Selatan, dari biji tanaman ini dihasilkan produk olahan yang dikenal sebagai cokelat. Biji buah kakao yang telah difermentasi dijadikan serbuk yang disebut sebagai coklat bubuk. Coklat ini dipakai sebagai bahan untuk membuat berbagai macam produk makanan dan minuman. Buah kakao tanpa biji dapat difermentasi untuk dijadikan pakan ternak.
Kakao merupakan tanaman perkebunan/industri berupa pohon yang dikenal di Indonesia sejak tahun 1560, namun baru menjadi komoditi yang penting sejak tahun 1951. Budidaya kakao di Indonesia diusahakan oleh Perusahaan Perkebunan Negara dan Swasta serta Perkebunan Rakyat. Lokasi Perusahaan Perkebunan skala besar yang diusahakan negara terletak di Sumatera Utara, Jawa Tengah dan Jawa Timur. Sedangkan Perkebunan rakyat terdapat terutama di Maluku, Irian Jaya, Sulawesi Utara, Sulawesi Selatan, Sulawesi Tenggara dan Nusa Tenggara Timur. Pada tahun 1988 areal tanaman coklat mencapai 213.612 ha. Luas perkebunan pada tahun 1991 mencapai 350.422 ha dengan produksi 121.651 ton coklat di Jawa Barat pada tahun 1998 mencapai 18.66,2 ha dengan produksi 6.404,3 ton.
Buah kakao bila dibelah akan tampak seperti Gambar 1, dan bagiannya dapat dikarakterisasi, yaitu OPW (outer pod wall) merupakan bagian kulit terluar dari kakao,
Gambar 1 Bagian buah kakao (Chaidamsari 2005)
IPW (inner pod wall) merupakan bagian kulit lapisan kedua yang berada di dalam buah, Pu (pulp) merupakan daging buah dari kakao, B (beans) biji kakao, dan PL (placenta) bagian tengah dari kakao.
Jenis kakao yang terbanyak dibudidayakan adalah jenis Criollo (Criollo Amerika Tengah dan Amerika Selatan) yang menghasilkan biji kakao bermutu sangat baik dan dikenal sebagai kakao mulia, fine flavour cocoa, choiced cocoa atau edel cocoa. Forastero yang menghasilkan biji kakao bermutu sedang, dikenal sebagai ordinary cocoa atau bulk cocoa dan trinitario yang merupakan hibrida alami dari Criollo dan Forastero sehingga menghasilkan biji kakao yang termasuk fine flavour cocoa atau bulk cocoa. Jenis Trinitario yang banyak ditanam di Indonesia adalah Hibrid Djati Runggo (DR) dan Uppertimazone Hybrida (Kakao lindak).
Penggerek Buah Kakao (PBK)
Penggerek Buah Kakao (PBK), Conopomorpha Cramerella Snellen, merupakan hama yang menimbulkan masalah yang cukup serius di Indonesia. Saat ini PBK menyerang hampir seluruh perkebunan kakao di Indonesia dan sangat merugikan petani. Hama ini memakan plasenta yang merupakan saluran makanan menuju ke biji sehingga mengakibatkan penurunan hasil dan mutu biji. Menurut Wardoyo (1996) kerugian yang ditimbulkan oleh PBK antara lain menurunnya berat, mutu biji, dan meningkatnya biaya panen karena pemisahan biji pada buah terserang memerlukan waktu yang lama.
tetap tinggal di dalamnya sebelum keluar untuk menjadi kepompong. Larva memakan jaringan yang lunak (pulp, plasenta, dan saluran nutrisi menuju biji). Rusaknya pulp (daging buah) berakibat biji kakao melekat satu sama lain dan melekat pada dinding buah serta menimbulkan proses fisiologi yang menyebabkan perubahan warna (Wardojo 1996). Setelah mengakhiri tahap perkembangannya, larva berhenti makan dan keluar dari buah, melekat pada buah yang sama atau menjatuhkan diri dan melekat pada buah lain, cabang, batang atau serasah di atas tanah, lalu membentuk kokon dan berubah menjadi kepompong. Setelah tujuh hari keluar ngengat yang dapat bertahan hidup selama 3-7 hari untuk berpindah tempat, kawin dan bertelur. Ngengat berukuran kurang dari 7 mm dan aktif terbang, kawin dan bertelur pada malam hari dan pada siang hari ngengat hinggap pada cabang-cabang kakao yang tumbuh horizontal melintang tegak lurus pada sumbu cabang (Wardojo 1996).
Hasil pengamatan Wiryadiputra (1997) menunjukkan bahwa aktivitas peletakan telur paling tinggi terjadi jam 18.00 sampai dengan jam 20.00, selanjutnya secara berangsur-angsur berkurang dan akhirnya tidak ada lagi serangga betina yang meletakkan telur pada pukul 24.00, dan preferensi peletakan telur terbanyak dijumpai pada panjang buah lebih dari 16 cm dan kakao tipe hibrida lebih disukai dibanding kakao Amelonado. Imago PBK lebih tertarik pada buah yang berumur 3-4 bulan, sedangkan pada buah muda belum pernah ditemukan. Menurut Munford dan Wood (1995) bahwa 90% larva ditemukan pada buah masak awal dan masak, maka sebagian besar larva ikut terpanen dan dengan mudah dimusnakan.
Kehidupan PBK juga dipengaruhi oleh beberapa faktor, seperti iklim yang secara langsung maupun tidak langsung berpengaruh pada aspek kehidupan serangga seperti perilaku dan fisiologi. Pengaruh iklim terhadap perilaku serangga antara lain, aktivitas kawin, peletakkan telur, dan aktivitas terbang, sedangkan pengaruh terhadap populasi adalah laju kelahiran, kematian, pertambahan jumlah dan penyebaran. Suhu dan kelembaban juga berpengaruh nyata terhadap perkembangan PBK. Pada suhu 20ºC dan kelembaban 80% persentase telur menetas hanya 69,64%, sedangkan pada suhu 20ºC dengan kelembaban 40-50% persentase telur yang
menetas 95,12% (Lim et al 1982). Sinar matahari dan kecepatan angin berpengaruh terhadap fertilitas dan mortalitas. Menurut Wessel (1993) pada tanaman kakao yang sedikit terlindung, imago PBK pada siang hari istirahat pada cabang-cabang yang terlindung oleh sinar matahari. Sedangkan untuk penyebarannya dibantu oleh angin. Persyaratan hidup hama PBK umumnya selalu sama dengan persyaratan inangnya. PBK hampir dikatakan tidak mempunyai inang alternatif lain kecuali kakao. Hal ini terjadi karena kakao berbuah sepanjang tahun dengan areal yang sangat luas.
Gen Proteinase Inhibitor (PIN)
Gen proteinase inhibitor (PIN) merupakan gen yang dapat menghasilkan senyawa antinutrisi yang dapat menghambat kerja enzim proteolitik (proteinase) di dalam perut serangga (Ryan 1990). Proteinase inhibitor merupakan protein yang berhubungan dengan ketahanan tanaman terhadap hama terutama serangga-serangga yang mengunyah. Biasanya terdapat di biji pada buah dan gen yang menyandi protein ini akan terinduksi akibat adanya perlukaan yang disebabkan oleh lingkungan luar (Koiwa et al 1997). Gen proteinase inhibitor selain sebagai sistem proteksi alami bagi tanaman juga mempunyai fungsi sebagai regulasi endogen proteinase dan sebagai protein penyimpanan (Shewry 2003). Proteinase inhibitor merupakan protein yang berukuran 4 kDa sampai 85 kDa terutama pada kisaran 8-20 kDa (Hung et al 2003). Pada kakao, protein ini berukuran 21 kDa dengan homologi yang cocok dengan inhibitor tripsin pada kedelai (kumitz) dari proteinase inhibitor. Hal ini terlihat seperti yang telah dilaporkan oleh Thai et al (1991) bahwa protein tersebut diakumulasi selama perkembangan biji dan tidak didegradasi selama perkecambahan benih pada kakao.
4
antara lain pada padi (Xu et al 1996), ubi jalar (Newell et al 1995), dan tembakau (Jhonson et al 1989).
Reverse Transcriptase Polimerase Chain Reaction (RT-PCR)
Teknik RT-PCR merupakan pengembangan dari teknik PCR yang awal mulanya ditemukan oleh Karry B. Mullis pada tahun 1985. PCR adalah suatu metode enzimatis untuk melipatgandakan secara eksponensial suatu sekuen nukleotida tertentu dengan cara in-vitro.
Teknik RT-PCR merupakan suatu pengembangan dari teknik PCR untuk melakukan analisis terhadap RNA hasil transkripsi yang hanya terdapat dalam jumlah yang sedikit di dalam sel. Teknik RT PCR yang dikembangkan sangat spesifik, sehingga dapat digunakan walaupun jumlah RNA yang akan dianalisis sedikit (Yowono 2006). Oleh karena PCR tidak dapat dilakukan dengan menggunakan RNA sebagai cetakan maka harus terlebih dahulu dilakukan transkripsi balik (reverse transcription) terhadap molekul RNA sehingga diperoleh molekul cDNA (complementary DNA). Molekul cDNA tersebut selanjutnya digunakan sebagai cetakan untuk proses PCR selanjutnya. Kegunaan teknik RT PCR antara lain adalah untuk mendeteksi ekspresi gen, untuk amplifikasi RNA sebelum dilakukan kloning dan analisis, maupun untuk diagnosis agensia infektif maupun penyakit genetik (Yowono T 2006).
Metode RT-PCR memerlukan enzim transcriptase balik (reverse transcriptase). Enzim transkriptase balik adalah enzim yang digunakan untuk mensintesis cDNA dengan menggunakan RNA sebagai cetakan. cDNA yang disintesis akan bersifat komplementer dengan RNA cetakan. Beberapa enzim transkriptase yang dapat digunakan antara lain mesophilic viral reverse transcriptase (RTase) yang dikode oleh virus avian myoblastosis (AMV) maupun oleh virus moloney murine leukemia (M-MuL V), dan Tth DNA polymerase (Yowono T 2006).
Bioinformatika
Bioinformatika merupakan kajian yang memadukan disiplin biologi molekul, matematika dan teknik informasi (TI) (Aprijani 2004). Ilmu ini didefinisikan sebagai aplikasi dari alat komputasi dan
analisa untuk menangkap dan menginterpretasikan data-data biologi molekul. Biologi molekuler merupakan bidang interdisipliner, mempelajari kehidupan dalam level molekul. Bioinformatika merupakan cabang komputasi dari biologi molekuler dan merupakan teknologi pengumpulan, penyimpanan, analisis, intrepretasi, penyebaran dan aplikasi dari informasi biologi. Internet dan server World Wide Web (WWW) merupakan dua hal yang sangat diperlukan dalam penggunaan bioinformatika. Bioinformatika mengunakan Program komputer dalam menganalisa data biologi dan penyimpanan data yang dihasilkan oleh proyek genom. Bioinformatika banyak berhubungan dengan sekuen, struktur, fungsi, dan perbandingan seluruh genom dan gen, struktur 3 dimensi protein dan manajemen data.
Aplikasi dan database untuk bioinformatika yang dapat digunakan dari internet antara lain, GeneMark, National Center for Biotechnology Information (NCBI), Expasy, pada NCBI dapat diakses program PubMed, Entrez, BLAST, Bankit, OMIM, Taxonomy dan penelusuran struktur. Salah satu program yang umum digunakan adalah Basic Local Aligment Search Tool (BLAST) yang merupakan program untuk pencarian kesamaan yang dibuat untuk mengeksplorasi semua database sekuen yang diminta baik berupa DNA maupun protein. Program BLAST juga dapat digunakan untuk mendeteksi hubungan antara sekuen yang hanya mempunyai kesamaan pada daerah tertentu.
Ada beberapa variasi BLAST masing-masing dibedakan dari tipe sekuen (DNA atau Protein) yang dicari dengan yang ada di database. Terdapat beberapa jenis program BLAST, diantaranya BLASTP digunakan untuk membandingkan sekuen asam amino dengan sekuen protein dalam database, BLASTN untuk membandingkan sekuen nukleotida dengan sekuen nukleotida, dan BLASTX untuk membandingkan sekuen nukleotida yang ditranslasi pada seluruh ORF (open reading frame) dengan sekuen protein dalam database (Claverie dan Notredam 2003).
untuk bermacam-macam tujuan, yaitu meliputi perkiraan fungsi protein, struktur tiga dimensi dan organisasi domain atau identifikasi homologi dengan organisme lain.
Hasil BLAST meliputi tiga bagian yang berbeda, yaitu grafik yang menunjukkan bagaimana porsi similaritas sekuen yang dibandingkan, daftar hits yang berisi nama sekuen yang serupa dengan yang dicari berdasarkan similaritas dan penjajaran (aligment) antara sekuen yang dicari dengan sekuen yang ada di database. Tingkat homologi bisa diketahui lebih jauh dengan melihat nilai skor (bits) dan E- value. Semakin tinggi skor (bits) maka tingkat homologinya semakin baik, semakin rendah maka tingkat homologinya semakin buruk, E-value merupakan nilai dugaan yang memberikan ukuran statistik penting yang signifikan. Nilai E-value yang lebih rendah menunjukkan tingkat homologi yang lebih baik atau sekuen protein lebih mirip dan data lebih dipercaya. Untuk memastikan adanya homologi, E-value harus kurang dari e-0,4 (Claveri JM dan Notredam 2003).
BAHAN DAN METODE
Bahan dan AlatBahan yang akan digunakan antara lain, buah kakao tahan dan tidak tahan terhadap PBK, yaitu kulit buah kakao (outer pod wall dan inner pod wall) dan biji kakao, pasangan
primer F21 (5’ATGAAGACCGCAACAGCCGTA’3) dan
R11 (5’ATGCTTCGGTTAACAACTTG3’), N2 cair, N-setil-N,N,N-trimetil amonium bromida (CTAB) MERCK®, basa trizma SIGMA®, polivinil polipirolidon (PVPP), dietil pirokarbonat (DEPC), NaCl, EDTA, LiCl, Na-asetat, etanol 70%, isopropanol,
ddH2O, etanol absolut, kloroform:isoamilalkohol (24:1), fenol:kloroform:isoamilalkohol (25:24:1),
loading buffer, EtBr, Agarosa, kit RT-PCR Fermentas®.
Alat yang digunakan antara lain, PCR GeneAmp (Polymerase Chain Reaction) system 2400, sentrifus Eppendorf 5417R, sentrifus Beckman allegra 64R, mesin sekuen CEQtm 8000 genetic Analysis System Beckman Coulter, pipet Gilsan, pipet Eppendorf, pendingin Decby -70°C,
spektrofotometer UV-VIS Beckman coulter-DU 530, UV T2201 Sigma. Polaroid fuji film FP-3000B, bak elektroforesis gel agarosa, adaptor 100 volt, autoklaf, oven microwave, pipet mohr, gelas piala, dan labu erlenmeyer.
Metode Percobaan
Isolasi RNA Biji dan Kulit Buah Kakao
RNA kakao diisolasi dengan metode Chaidamsari et al (2005). 1 gram sampel biji kakao digerus sampai halus dalam mortar dengan bantuan N2 cair serta PVP 1,5 % kemudian dimasukkan ke dalam tabung sentrifuse yang berisi 15 ml buffer ekstraksi dengan suhu 65°C dan ditambah 75µl β -merkaptoetanol lalu dikocok menggunakan vortex selama 2 menit. Suspensi tersebut diinkubasi selama 1 jam pada suhu 65°C dan dikocok perlahan setiap 15 menit. Setelah itu didiamkan pada suhu ruang selama 5 menit, lalu diekstrak dengan kloroform: isoamilalkohol (KI) (24:1) sebanyak 15 ml kocok kuat-kuat sampai terbentuk emulsi selanjutnya disentrifuse 12.000 g selama 15 menit pada suhu 12°C, supernatan diambil dipindahkan ke dalam tabung sentrifuse baru. Kemudian diekstrak kembali dengan (PKI) fenol:kloroform:isoamilalkohol (25:24:1) 1 volum dan dua kali dengan KI 1 volum dengan kecepatan yang sama. Kemudian supernatan diambil lalu ditambah LiCl 10 M sampai konsentrasi 2 M dan disimpan dalam suhu 4°C selama semalam.
Setelah semalam larutan tersebut kemudian disentrifuse dengan kecepatan 17.000 g, 4°C, 30 menit. Pelet kemudian dilarutkan dalam ddH2O sebanyak 500 µl dan diekstrak dengan fenol, PKI, KI, masing-masing 1 volum, disentrifus pada 12.000 g, 15 menit, 4°C. Supernatan lalu ditempatkan ditabung mikro dan ditambahkan 0,1 volum Na-asetat 3 M, pH 5,8 dan 3 volum etanol absolut dan disimpan pada suhu -70°C selama semalam.
5
untuk bermacam-macam tujuan, yaitu meliputi perkiraan fungsi protein, struktur tiga dimensi dan organisasi domain atau identifikasi homologi dengan organisme lain.
Hasil BLAST meliputi tiga bagian yang berbeda, yaitu grafik yang menunjukkan bagaimana porsi similaritas sekuen yang dibandingkan, daftar hits yang berisi nama sekuen yang serupa dengan yang dicari berdasarkan similaritas dan penjajaran (aligment) antara sekuen yang dicari dengan sekuen yang ada di database. Tingkat homologi bisa diketahui lebih jauh dengan melihat nilai skor (bits) dan E- value. Semakin tinggi skor (bits) maka tingkat homologinya semakin baik, semakin rendah maka tingkat homologinya semakin buruk, E-value merupakan nilai dugaan yang memberikan ukuran statistik penting yang signifikan. Nilai E-value yang lebih rendah menunjukkan tingkat homologi yang lebih baik atau sekuen protein lebih mirip dan data lebih dipercaya. Untuk memastikan adanya homologi, E-value harus kurang dari e-0,4 (Claveri JM dan Notredam 2003).
BAHAN DAN METODE
Bahan dan AlatBahan yang akan digunakan antara lain, buah kakao tahan dan tidak tahan terhadap PBK, yaitu kulit buah kakao (outer pod wall dan inner pod wall) dan biji kakao, pasangan
primer F21 (5’ATGAAGACCGCAACAGCCGTA’3) dan
R11 (5’ATGCTTCGGTTAACAACTTG3’), N2 cair, N-setil-N,N,N-trimetil amonium bromida (CTAB) MERCK®, basa trizma SIGMA®, polivinil polipirolidon (PVPP), dietil pirokarbonat (DEPC), NaCl, EDTA, LiCl, Na-asetat, etanol 70%, isopropanol,
ddH2O, etanol absolut, kloroform:isoamilalkohol (24:1), fenol:kloroform:isoamilalkohol (25:24:1),
loading buffer, EtBr, Agarosa, kit RT-PCR Fermentas®.
Alat yang digunakan antara lain, PCR GeneAmp (Polymerase Chain Reaction) system 2400, sentrifus Eppendorf 5417R, sentrifus Beckman allegra 64R, mesin sekuen CEQtm 8000 genetic Analysis System Beckman Coulter, pipet Gilsan, pipet Eppendorf, pendingin Decby -70°C,
spektrofotometer UV-VIS Beckman coulter-DU 530, UV T2201 Sigma. Polaroid fuji film FP-3000B, bak elektroforesis gel agarosa, adaptor 100 volt, autoklaf, oven microwave, pipet mohr, gelas piala, dan labu erlenmeyer.
Metode Percobaan
Isolasi RNA Biji dan Kulit Buah Kakao
RNA kakao diisolasi dengan metode Chaidamsari et al (2005). 1 gram sampel biji kakao digerus sampai halus dalam mortar dengan bantuan N2 cair serta PVP 1,5 % kemudian dimasukkan ke dalam tabung sentrifuse yang berisi 15 ml buffer ekstraksi dengan suhu 65°C dan ditambah 75µl β -merkaptoetanol lalu dikocok menggunakan vortex selama 2 menit. Suspensi tersebut diinkubasi selama 1 jam pada suhu 65°C dan dikocok perlahan setiap 15 menit. Setelah itu didiamkan pada suhu ruang selama 5 menit, lalu diekstrak dengan kloroform: isoamilalkohol (KI) (24:1) sebanyak 15 ml kocok kuat-kuat sampai terbentuk emulsi selanjutnya disentrifuse 12.000 g selama 15 menit pada suhu 12°C, supernatan diambil dipindahkan ke dalam tabung sentrifuse baru. Kemudian diekstrak kembali dengan (PKI) fenol:kloroform:isoamilalkohol (25:24:1) 1 volum dan dua kali dengan KI 1 volum dengan kecepatan yang sama. Kemudian supernatan diambil lalu ditambah LiCl 10 M sampai konsentrasi 2 M dan disimpan dalam suhu 4°C selama semalam.
Setelah semalam larutan tersebut kemudian disentrifuse dengan kecepatan 17.000 g, 4°C, 30 menit. Pelet kemudian dilarutkan dalam ddH2O sebanyak 500 µl dan diekstrak dengan fenol, PKI, KI, masing-masing 1 volum, disentrifus pada 12.000 g, 15 menit, 4°C. Supernatan lalu ditempatkan ditabung mikro dan ditambahkan 0,1 volum Na-asetat 3 M, pH 5,8 dan 3 volum etanol absolut dan disimpan pada suhu -70°C selama semalam.
konsentrasinya. Untuk isolasi kulit buah kakao (outer pod wall dan inner pod wall) metode sama seperti isolasi RNA dari biji kakao.
Uji Kualitatif dan Kuantitatif Hasil Isolasi RNA
Larutan RNA hasil isolasi dianalisis kualitatif dan kuantitatif untuk mengetahui konsentrasi dan kemurniannya. Uji kualitatif dilakukan melalui teknik elektroforesis RNA dalam gel agarosa 1% untuk melihat pita hasil elektroforesis, selain itu diukur dengan melihat perbandingan serapan pada panjang gelombang 260 nm dengan 280 nm. Kemurnian RNA yang tinggi dapat dilihat dari perbandingan A260/280 yang berkisar antara 1,8-2,0 ( Sambrook et al 1989). Uji kuantitatif dilakukan dengan cara mengukur absorbansinya dengan menggunakan spektrofotometer UV pada panjang gelombang 260 nm. Konsentrasi RNA dihitung dengan perbandingan bahwa nilai 1 pada serapan 260 nm sama dengan serapan RNA dengan konsentrasi 40 ng/µl.
Isolasi Gen Proteinase Inhibitor (PIN) dan Uji Ekspresi dengan RT-PCR
Isolasi dan uji ekspresi dilakukan dengan teknik RT-PCR menggunakan primer spesifik yang dirancang berdasarkan urutan basa gen PIN pada kakao yang telah dipublikasikan (bank data gen www.ncbi.nlm.nih.gov;X56509.1). Primer kemudian digunakan dalam RT-PCR untuk amplifikasi daerah gen PIN.
RNA yang didapat dijadikan cDNA terlebih dahulu agar dapat digunakan sebagai template dalam reaksi PCR. cDNA disintesis dengan menggunakan kit dengan merk dagang Fermentas yang berisi enzim reverse transcriptase (reverd Aid). Sintesis cDNA dilakukan dengan cara, yaitu RNA yang didapat diambil sebanyak 1µg, kemudian ditambah 1µl dNTPs 10 µM, 1µl oligo-dT, ddH2O sampai volume akhir 12 µl. Setelah itu diinkubasi 65ºC selama 5 menit. Kemudian ditambah mix (buffer RT 4µl, 1µl DTT 0,1M, 1µl RNase inhibitor) kemudian inkubasi 42ºC selama 2 menit, lalu ditambah enzim reverse transcriptase (reverd Aid), inkubasi dilanjutkan pada suhu 42ºC selama 50 menit dan dilanjutkan dengan 70ºC
selama 15 menit. Reaksi PCR dilakukan dengan total volum 25µl yang di dalamnya terdapat 1 µl cDNA sebagai template, dNTPs 1 µl, ddH2O 16,75 µl, bufer 10X 2,5 µl, MgCl2 0,25 µl, pasangan primer spesifik gen PIN , yaitu F21 (forward) dan R11 (reverse) masing-masing sebanyak 1 µl dan enzim taq polimerase 2 µl. Program terdiri dari pre-denaturasi pada suhu 95°C selama 5 menit dilanjutkan dengan 35 siklus yang terdiri dari denaturasi pada suhu 95°C selama 45 detik, annealing pada suhu 58ºC selama 45 detik dan extension 72ºC selama 5 menit. Selanjutnya untuk melihat hasilnya, produk PCR dipisahkan dengan teknik elektroforesis pada gel agarosa 1%.
Sekuensing Fragmen Gen PIN
Sebelum dilakukan sekuensing, fragmen hasil RT-PCR dimurnikan terlebih dahulu. Pemurnian dilakukan dengan menggunakan kit QIAGEN. Pemurnian dilakukan dengan cara, pita DNA dipotong dari gel agarosa lalu ditambah 3 volum buffer QX1 dan QIAEX II sebanyak 10µl dan diinkubasi 50ºC selama 10 menit untuk melarutkan agarosa dan mengikat DNA. Campuran disentrifus untuk didapatkan pelletnya. Pellet dicuci dengan 500 µl buffer QX1 kemudian disentrifus dan supernatannya dibuang, lalu pellet dikeringkan. Untuk melarutkan DNA ditambahkan 18µl Tris-HCl 10mM pH 8,5 atau ddH2O. Campuran disentrifus 4000 g selama 30 detik dan supernatan diambil untuk dilakukan sekuensing.
Fragmen gen PIN yang telah dimurnikan kemudian disekuen di Lembaga Biologi Molekuler Eijkman Jakarta. Hasil sekuensing kemudian dianalisis BLASTN (www.ncbi.nih.gov)
HASIL DAN PEMBAHASAN
Isolasi RNA Total Biji Kakao6
konsentrasinya. Untuk isolasi kulit buah kakao (outer pod wall dan inner pod wall) metode sama seperti isolasi RNA dari biji kakao.
Uji Kualitatif dan Kuantitatif Hasil Isolasi RNA
Larutan RNA hasil isolasi dianalisis kualitatif dan kuantitatif untuk mengetahui konsentrasi dan kemurniannya. Uji kualitatif dilakukan melalui teknik elektroforesis RNA dalam gel agarosa 1% untuk melihat pita hasil elektroforesis, selain itu diukur dengan melihat perbandingan serapan pada panjang gelombang 260 nm dengan 280 nm. Kemurnian RNA yang tinggi dapat dilihat dari perbandingan A260/280 yang berkisar antara 1,8-2,0 ( Sambrook et al 1989). Uji kuantitatif dilakukan dengan cara mengukur absorbansinya dengan menggunakan spektrofotometer UV pada panjang gelombang 260 nm. Konsentrasi RNA dihitung dengan perbandingan bahwa nilai 1 pada serapan 260 nm sama dengan serapan RNA dengan konsentrasi 40 ng/µl.
Isolasi Gen Proteinase Inhibitor (PIN) dan Uji Ekspresi dengan RT-PCR
Isolasi dan uji ekspresi dilakukan dengan teknik RT-PCR menggunakan primer spesifik yang dirancang berdasarkan urutan basa gen PIN pada kakao yang telah dipublikasikan (bank data gen www.ncbi.nlm.nih.gov;X56509.1). Primer kemudian digunakan dalam RT-PCR untuk amplifikasi daerah gen PIN.
RNA yang didapat dijadikan cDNA terlebih dahulu agar dapat digunakan sebagai template dalam reaksi PCR. cDNA disintesis dengan menggunakan kit dengan merk dagang Fermentas yang berisi enzim reverse transcriptase (reverd Aid). Sintesis cDNA dilakukan dengan cara, yaitu RNA yang didapat diambil sebanyak 1µg, kemudian ditambah 1µl dNTPs 10 µM, 1µl oligo-dT, ddH2O sampai volume akhir 12 µl. Setelah itu diinkubasi 65ºC selama 5 menit. Kemudian ditambah mix (buffer RT 4µl, 1µl DTT 0,1M, 1µl RNase inhibitor) kemudian inkubasi 42ºC selama 2 menit, lalu ditambah enzim reverse transcriptase (reverd Aid), inkubasi dilanjutkan pada suhu 42ºC selama 50 menit dan dilanjutkan dengan 70ºC
selama 15 menit. Reaksi PCR dilakukan dengan total volum 25µl yang di dalamnya terdapat 1 µl cDNA sebagai template, dNTPs 1 µl, ddH2O 16,75 µl, bufer 10X 2,5 µl, MgCl2 0,25 µl, pasangan primer spesifik gen PIN , yaitu F21 (forward) dan R11 (reverse) masing-masing sebanyak 1 µl dan enzim taq polimerase 2 µl. Program terdiri dari pre-denaturasi pada suhu 95°C selama 5 menit dilanjutkan dengan 35 siklus yang terdiri dari denaturasi pada suhu 95°C selama 45 detik, annealing pada suhu 58ºC selama 45 detik dan extension 72ºC selama 5 menit. Selanjutnya untuk melihat hasilnya, produk PCR dipisahkan dengan teknik elektroforesis pada gel agarosa 1%.
Sekuensing Fragmen Gen PIN
Sebelum dilakukan sekuensing, fragmen hasil RT-PCR dimurnikan terlebih dahulu. Pemurnian dilakukan dengan menggunakan kit QIAGEN. Pemurnian dilakukan dengan cara, pita DNA dipotong dari gel agarosa lalu ditambah 3 volum buffer QX1 dan QIAEX II sebanyak 10µl dan diinkubasi 50ºC selama 10 menit untuk melarutkan agarosa dan mengikat DNA. Campuran disentrifus untuk didapatkan pelletnya. Pellet dicuci dengan 500 µl buffer QX1 kemudian disentrifus dan supernatannya dibuang, lalu pellet dikeringkan. Untuk melarutkan DNA ditambahkan 18µl Tris-HCl 10mM pH 8,5 atau ddH2O. Campuran disentrifus 4000 g selama 30 detik dan supernatan diambil untuk dilakukan sekuensing.
Fragmen gen PIN yang telah dimurnikan kemudian disekuen di Lembaga Biologi Molekuler Eijkman Jakarta. Hasil sekuensing kemudian dianalisis BLASTN (www.ncbi.nih.gov)
HASIL DAN PEMBAHASAN
Isolasi RNA Total Biji Kakaodalam mengisolasinya, dalam hal ini digunakan denaturan kuat seperti dietil pirokarbonat (DEPC) untuk mencegah degradasi RNA oleh RNase.
Isolasi RNA total biji kakao dilakukan dengan metode Chaidamsari (2005).Prinsip dasar isolasi RNA adalah yang pertama, menghancurkan dinding sel untuk membebaskan sitoplasma dan RNA dalam sel. Penggunaan nitrogen cair merupakan cara yang efektif untuk membekukan jaringan sehingga mudah untuk dihancurkan dan kondisi suhu yang dingin dapat menjaga RNAse berada dalam keadaan tidak aktif. Selain itu penggunaan EDTA dimaksudkan untuk mengikat Mg2+ sehingga mempermudah pemecahan dinding sel dan secara tidak langsung meng- inaktivasi ribonuklease karena EDTA mengkelat ion tersebut yang fungsinya sebagai kofaktor. Kedua, Penggunaan β-merkaptoetanol dan senyawa pengekstrak seperti kloroform: isoamilalkohol (CI) 24:1 dan fenol: kloroform:isoamilalkohol (PCI) 25:24:1, dapat menyebabkan denaturasi senyawa nukleoprotein, dan selanjutnya membuang kontaminan DNA serta protein (Promega 1996). DNase diperlukan untuk mendegradasi DNA sehingga RNA yang diperoleh terbebas dari kontaminan DNA.
Isolasi RNA total dari biji kakao berhasil dilakukan dengan baik, dilihat dari hasil analisis elektroforesis gel agarosa 1,2% dalam 0,5X larutan penyangga TBE dengan voltase 25 volt selama 1,5 jam. Pada Gambar 2, terlihat bahwa RNA yang dihasilkan mempunyai integritas yang baik. Pita yang terbentuk dalam gel agarosa merupakan rRNA yang berukuran 28S dan 18S, sesuai dengan literatur yang menyebutkan bahwa hasil isolasi RNA dikatakan baik apabila dalam elektroforesis gel agarosa menghasilkan 2 pita RNA ribosom (rRNA), yaitu 28S dan 18S yang merupakan rRNA sitoplasma utama pada tanaman (Farrel 1993).
28 S
18 S
Gambar 2 Hasil elektroforesis RNA total biji kakao
Hasil pengukuran secara kuantitatif dengan menggunakan spektrofotometer UV pada panjang gelombang 260 dan 280 nm diperoleh absorban masing-masing sebesar 0,490 dan 0,239. Berdasarkan hasil tersebut maka dengan menggunakan 2 gram sampel biji kakao didapatkan konsentrasi RNA total sebesar 2940 ng/µl dan nisbah absorban (A) 260/280 sebesar 2,050. dapat dikatakan hasil isolasi RNA total biji kakao mempunyai konsentrasi dan kemurnian yang tinggi, seperti yang dijelaskan Sambrook et al (1989) bahwa hasil isolasi RNA dikatakan murni jika mempunyai nilai A260/280 sebesar 1,8-2,0. Tingginya nilai rasio A260/280 menunjukkan bahwa RNA tersebut terbebas dari kontaminan protein. Sehingga RNA yang dihasilkan dapat digunakan untuk percobaan berikutnya.
Isolasi Gen PIN dari Biji Kakao
RNA total biji kakao yang sudah didapatkan selanjutnya digunakan untuk mengisolasi gen PIN. Biji kakao digunakan pada penelitian ini karena berdasarkan laporan Thai et al (1991) bahwa gen PIN ada pada biji kakao, gen ini mengkode protein yang berukuran 21 kDa dengan homologi yang cocok dengan inhibitor tripsin pada kedelai (kumitz) dari proteinase inhibitor. Protein tersebut diakumulasi selama perkembangan biji dan tidak didegradasi selama perkecambahan benih pada kakao.
Gen PIN diisolasi menggunakan teknik RT-PCR karena untuk mengisolasi gen-gen yang spesifik dari kromosom eukariot diperlukan cDNA (Watson et al 1987). cDNA merupakan DNA yang berkomplemen dengan mRNA (Dale 1994), sedangkan mRNA adalah transkrip dari gen-gen yang terekspresi yang membawa pesan berupa informasi genetik dari DNA ke dalam bentuk protein (Darnell et al 1990). Sehingga cDNA berbeda dengan DNA genom karena cDNA mewakili bagian dari suatu gen yang terekspresi (Davis et al 1986). Selanjutnya cDNA digunakan sebagai template untuk mengamplifikasi gen PIN dari biji kako.
8
dengan merk dagang Fermentas untuk mensintesis cDNA. Kit ini berisi enzim reverse transkriptase dan primer oligo-dT. mRNA mempunyai ekor poly-A pada ujung 3’ maka primer oligo(dT) akan berpasangan dengan ujung poly(A) mRNA sehingga cDNA dapat disintesis dari mRNA (template) dengan menggunakan enzim reverse transkriptase. Selanjutnya cDNA digunakan sebagai template dalam reaksi PCR.
Reaksi PCR dibutuhkan sepasang primer. Primer yang digunakan pada penelitian ini merupakan primer spesifik yang dibuat untuk mengamplifikasi gen PIN pada biji kakao. Primer ini dibuat berdasarkan sekuen gen PIN yang didapat dari bank data gen (www.ncbi.nih.gov), seperti yang terlihat pada Gambar 3.
Berdasarkan sekuen gen PIN yang didapat maka primer dirancang dengan melihat cds (coding segmen) yang dimilki dari gen tesebut. Urutan gen yang akan disandikan menjadi protein disebut juga sebagai cds. Urutan basa gen PIN yang didapat dari bank data gen mempunyai cds yang diawali dari basa ke-31 sampai ke-696. Sehingga dibuat primer F21 sebagai forward
dengan urutan basa (5’ATGAAGACCGCAACAGCCGTA’3)
yang dimulai dari kodon awal dan primer R11 sebagai reverse dengan urutan basa (5’ATGCTTCGGTTAACAACTTG3’) yang berada pada kodon akhir. Dengan menggunakan teknik RT-PCR yang dilakukan dengan suhu annealing 58°C dan 35 siklus maka diharapkan dengan pasangan primer tesebut akan didapatkan amplifikasi fragmen gen PIN dengan ukuran sebesar 662 bp.
Hasil RT-PCR dielektroforesis dengan gel agarosa 1% kemudian diperoleh pita sesuai dengan prediksi, yaitu menghasilkan pita yang berukuran 662 bp (Gambar 4). Hasil ini menunjukkan bahwa fragmen gen PIN pada biji kakao dapat diisolasi dengan pasangan primer F21 dan R11. Hal ini juga secara tidak langsung menggambarkan adanya ekspresi gen PIN pada biji kakao, namun perlu pembuktian lebih lanjut dengan analisis BLASTN.
Analisis Sekuen Fragmen Gen PIN dari Biji Kakao
Sekuensing diperlukan untuk menganalisis fragmen gen PIN yang berhasil diisolasi. Sekuensing dapat
dilakukan dengan menggunakan produk PCR langsung atau melalui hasil kloning. Pada penelitian ini dilakukan sekuensing menggunakan produk PCR langsung dengan total volume reaksi 100µl. Analisis sekuen meliputi analisis homologi dengan program BLASTN dari bank data gen (www.ncbi.nih.gov/BLAST). Analisis ini diperlukan untuk mengetahui apakah gen yang berhasil diisolasi sesuai dengan yang diharapkan.
Sekuensing dilakukan di Lembaga Biologi Molekuler Eijkman. Data hasil sekuensing berupa electrophoregraph yang menggambarkan urutan basa fragmen gen PIN berukuran 580 bp (Lampiran 2). Ukuran yang dihasilkan dari sekuensing berbeda dengan yang diprediksikan, hal ini disebabkan oleh sekuensing dilakukan langsung dari produk PCR sehingga primer sekuensing sama dengan primer amplifikasi akibatnya terdapat pengurangan ukuran basa. Hasil electrophoregraph memperlihatkan bahwa tidak semua basa dapat disekuen hal ini mungkin disebabkan oleh proses pemurnian yang kurang sempurna atau ada kesalahan pada sekuensing.
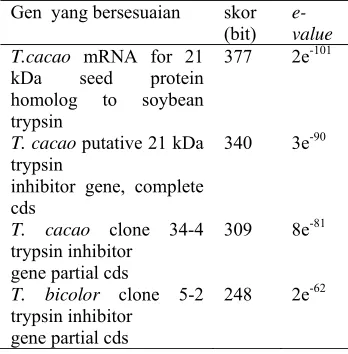
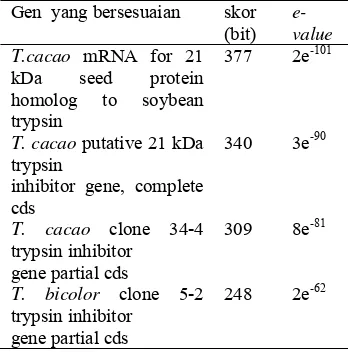
Urutan basa yang didapatkan dari hasil sekuensing kemudian dianalisis BLASTN. BLAST merupakan alat pembanding suatu sekuen yang dicari dengan sekuen yang telah diketahui dengan cepat yang dapat menjelaskan apakah sekuen tersebut memiliki similaritas cukup signifikan. Analisis BLASTN yang dilakukan terhadap urutan basa gen PIN dapat dilihat pada Tabel 1.
Berdasarkan analisis BLASTN ,dengan melihat parameter skor lebih dari 150 dan e-value yang kurang dari 10-4 maka tingkat homologi yang dihasilkan cukup baik (Claveri dan Notredam 2003). Semakin tinggi skor (bits) maka tingkat homologinya semakin baik, semakin rendah e-value maka semakin baik pula tingkat homologinya. Selain nilai skor dan e-value, tingkat homologi juga dapat dilihat dari garis berwarna merah pada grafik hasil BLASTN.
CCCACTTATCCAGCAACATTTCACTTAACCATGAAGACCGCAACAGCCGTAGTTTTACTCCTCTT Met
CGCCTTCACATCAAAATCATATTTCTTTGGGGTAGCCAACGCTGCAAACTCTCCTGTGCTTGACA
CTGATGGTGATGAGCTCCAAACTGGGGTTCAATATTACGTCTTGTCATCGATATCGGGTGCTGGG
GGTGGAGGGCTAGCCCTAGGAAGGGCTACAGGTCAAAGCTGCCCAGAAATTGTTGTCCAAAGA
CGATCCGACCTTGACAATGGTACTCCTGTAATCTTTTCAAATGCGGATAGCAAAGATGATGTTGT
CCGCGTATCTACTGATGTAAACATAGAGTTCGTTCCCATCAGAGACAGACTCTGCTCAACGTCA
ACTGTGTGGAGGCTTGACAATTATGACAACTCGGCAGGCAAATGGTGGGTGACAACTGATGGG
GTTAAAGGTGAACCTGGTCCTAACACTTTGTGCAGTTGGTTTAAGATTGAGAAGGCCGGAGTAC
TCGGTTACAAATTCAGGTTCTGTCCTTCTGTCTGTGATTCGTGCACAACTTTATGCAGCGATATT
GGAAGACATTCAGATGATGATGGACAAATACGTTTGGCTCTCAGTGACAATGAATGGGCATGGA
TGTTTAAGAAAGCAAGTAAGACAATAAAACAAGTTGTTAACGCGAAGCATTAATTTTAAGTTTA Kodon akhir
ATGTACGAAGTGTACGTCCAAAGCAGCAATACTAGCCGGTCGTTACTTTCCACTAAATAAAAGT
TAAGTATGTGGTTCCCAGCCCAGTGTTGTAATGCTATGCCTATGTAGTCAGTGTCTTGTTTGAGG
GTGGAGATGCTTAAAGGGTGTGTCTTCACAGCCCAGCTTCGTAGTCTTTCNNNNNNTTTATGAA
TAAATGACCCTCTTGCCTCTTTTATTACCA
Gambar 3 Urutan basa gen PIN , posisi primer F21 (forward)dan primer R11 (reverse) ditandai dengan panah hijau
600 bp
Bj M
Gambar 4 Hasil RT-PCR cDNA biji kakao; (Bj) merupakan fragmen gen PIN yang berukuran 662bp dan (M) marker 100bp.
dapat dikatakan hasil isolasi fargmen gen PIN dari biji kakao telah berhasil dilakukan dengan baik karena fragmen hasil amplifikasi merupakan gen PIN penyandi protein berukuran 21 kDa pada biji kakao. Selain itu fragmen ini juga mempunyai homologi dengan T. cacao putative 21 kDa trypsin, T. cacao clone 34-4 trypsin inhibitor gene partial cds, dan T. bicolor clone 5-2 trypsin inhibitor gene partial cds.
Tabel 1 Hasil analisis BLASTN urutan basa fragmen gen PIN
Gen yang bersesuaian skor (bit)
e-value T.cacao mRNA for 21
kDa seed protein homolog to soybean trypsin
377 2e-101
T. cacao putative 21 kDa trypsin
inhibitor gene, complete cds
340 3e-90
T. cacao clone 34-4 trypsin inhibitor
gene partial cds
309 8e-81
T. bicolor clone 5-2 trypsin inhibitor
gene partial cds
248 2e-62
Ekspresi Gen PIN pada Jaringan Kulit Kakao Klon Ary dan Bal
10
jaringan kulit dari dua klon yang berbeda, yaitu klon yang tahan (Ary 2) dan tidak tahan terhadap hama PBK (Bal 209). Hal ini dilakukan untuk melihat tingkat ekspresi gen PIN dari jaringan kulit pada kedua klon.
Reaksi RT-PCR memerlukan RNA sebagai template untuk mendapatkan cDNA kemudian cDNA digunakan sebagai template dalam reaksi PCR. Sebagai langkah awal dilakukan isolasi RNA dari jaringan kulit klon Ary 2 dan Bal 209. Uji ekspresi memerlukan RNA dengan konsentrasi dan kualitas tinggi, namun isolasi RNA dari jaringan kulit lebih sulit dibandingkan dari biji, karena di kulit banyak mengandung senyawa polifenol dan polisakarida sehingga sangat sulit untuk mendapatkan konsentrasi dan kemurnian RNA yang tinggi. Menurut Couch dan Fritz (1990), tanaman berkayu banyak mengandung senyawa polifenol dan polisakarida.
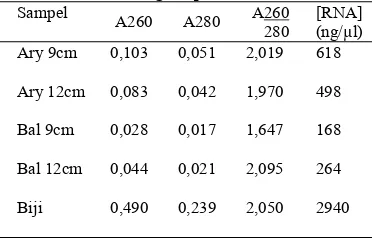
Isolasi RNA dari kulit dilakukan pada kedua klon dengan panjang buah 9 dan 12 cm. Pemilihan panjang buah disesuaikan dengan literatur yang menyatakan bahwa buah kakao dengan panjang 5-7cm dan yang sangat muda tidak pernah terserang PBK (Wardoyo 1994 dalamDepparaba F 2002 ), buah kakao mulai terserang PBK pada panjang 9 cm dan PBK lebih menyukai buah kakao yang panjangnya lebih dari 9 cm (Sulistyowati et al 2003). Oleh karena itu akan dilihat bagaimana ekspresi gen PIN pada buah yang panjangnya 9 cm dan 12 cm. Selain itu digunakan biji sebagai kontrol karena telah dipastikan bahwa gen PIN terekspresi pada biji kakao. Hasil pengukuran absorban RNA jaringan kulit kakao pada kedua klon dapat dilihat di Tabel 2.
Berdasarkan masing-masing RNA yang berhasil diisolasi dapat dikatakan bahwa RNA tersebut mempunyai kemurnian
Tabel 2 Data hasil pengukuran absorban RNA dengan spektrofotometer UV Sampel
A260 A280 A260 280
[RNA] (ng/µl) Ary 9cm
0,103 0,051 2,019 618
Ary 12cm 0,083 0,042 1,970 498
Bal 9cm
0,028 0,017 1,647 168
Bal 12cm
0,044 0,021 2,095 264
Biji 0,490 0,239 2,050 2940
yang tinggi, dilihat dari nisbah A260/280 yang mempunyai nilai 1,647-2,050. Namun pada penelitian ini sulit untuk mendapatkan konsentrasi RNA yang besar pada jaringan kulit. Seperti yang dikatakan sebelumnya bahwa jaringan kulit banyak mengandung senyawa polifenol dan polisakarida sehingga menyulitkan dalam isolasi RNA. Konsentrasi RNA yang besar mudah didapatkan dari biji, selain kandungan polifenol dan polisakarida yang lebih sedikit, biji merupakan protein storage sehingga kandungan RNAnya juga besar.
RNA dipisahkan dengan elektroforesis gel agarosa guna melihat kualitasnya, selain itu hasil elektroforesis digunakan sebagai kontrol untuk uji ekspresi. Masing-masing RNA di elektroforesis sebanyak 250 ng, untuk mengetahui apakah RNA dari masing-masing sampel mempunyai kualitas dan kuantitas yang sama ketika dielektroforesis. Hal yang perlu diperhatikan dalam uji ekspresi, yaitu pada reaksi RT-PCR, sintesis cDNA harus menggunakan konsentrasi RNA yang sama, jika terdapat perbedaan maka bisa mempengaruhi intensitas pita yang terbentuk. Penggunaan konsentrasi RNA yang lebih besar maka dimungkinkan ekspresinya juga akan besar.
Hasil elektroforesis dapat di lihat pada Gambar 5. Gambar 5 menunjukkan bahwa RNA dari masing-masing sampel mempunyai intensitas pita yang sama, tetapi hanya RNA kulit klon Ary dengan panjang buah 12 cm yang mempunyai perbedaan intensitas pita. Terlihat bahwa intensitas pita klon tersebut separuh lebih sedikit, sehingga RNA yang diperlukan untuk mensitesis cDNA 2 kali lebih besar dibanding dengan yang lainnya.
menggunakan program UN-SCAN-IT Gel 6.1. Program ini merupakan alat untuk mengkuantifikasi pita yang terbentuk pada gel agarosa, sehingga dapat diketahui konsentrasinya dengan membandingkan marker sebagai standar yang sudah diketahui konsentrasinya.. Prinsip program ini adalah membandingkan pixel sampel yang terdeteksi dengan pixel standar (marker) lalu dikonversi menjadi satuan konsentrasi dengan persamaan kurva standar.
Hasil RT-PCR yang dilakukan dengan menggunakan primer spesifik gen PIN dapat dilihat pada Gambar 5. Pita yang terbentuk kemudian dianalisis dengan program UN-SCAN-IT Gel 6.1. Analisis dengan program ini menghasilkan kurva standar (Lampiran 4) dari marker dengan persamaan y = 9,3357. 10-3 X + 7,383, dimana y dan X merupakan konsentrasi dan pixel. Selanjutnya Pixel yang dihasilkan dari masing-masing pita sampel dikonversi menjadi konsentrasi dengan menggunakan kurva standar. Konsentrasi yang dihasilkan dari pita hasil elektroforesis berbeda-beda pada tiap sampel. Hasil ini dapat dilihat dalam Tabel 3.
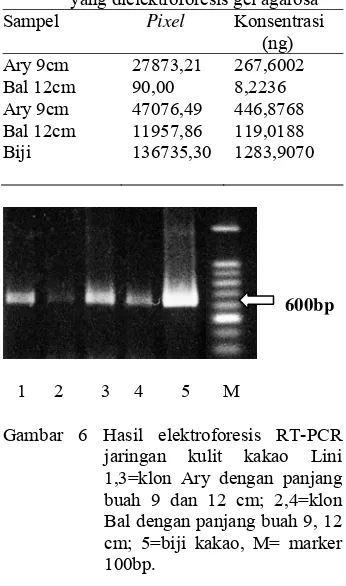
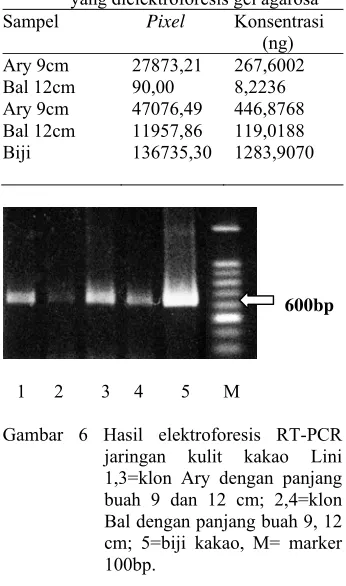
Terlihat bahwa jaringan kulit kakao baik dari klon Ary maupun klon Bal keduanya mengekspresikan gen PIN (Gambar 6), namun dilihat dari intensitas pita dan konsentrasi yang berbeda-beda dapat dikatakan bahwa tingkat ekspresi dari kedua klon tidak sama. Ditinjau dari ukuran buah, panjang buah 12 cm mempunyai konsentrasi dan intensitas pita yang lebih kuat dibanding panjang buah 9 cm. Hal ini dapat dikatakan bahwa semakin panjang ukuran buah, ekspresi gen PIN semakin meningkat.
1 2 3 4 5
Gambar 5 Hasil elektroforesis RNA total dari jaringan kulit kakao; Lini 1,3=klon Ary dengan panjang buah 9 dan 12 cm; 2,4=klon Bal dengan panjang buah 9, 12 cm; 5=biji kakao.
Tabel 3 Data pixel dan konsentrasi hasil RT-PCR jaringan kulit klon kakao yang dielektroforesis gel agarosa Sampel Pixel Konsentrasi
(ng) Ary 9cm 27873,21 267,6002 Bal 12cm 90,00 8,2236 Ary 9cm 47076,49 446,8768 Bal 12cm 11957,86 119,0188 Biji 136735,30 1283,9070
600bp
1 2 3 4 5 M
Gambar 6 Hasil elektroforesis RT-PCR jaringan kulit kakao Lini 1,3=klon Ary dengan panjang buah 9 dan 12 cm; 2,4=klon Bal dengan panjang buah 9, 12 cm; 5=biji kakao, M= marker 100bp.
Berdasarkan penelitian ini, ekspresi gen PIN pada klon Ary lebih kuat dibanding klon Bal, dengan kata lain klon kakao yang tahan terhadap PBK mengekspresikan gen PIN yang lebih kuat dibanding klon yang tidak tahan terhadap PBK. Berdasarkan perbedaan ekspresi dari kedua klon, diduga gen PIN mempunyai pengaruh terhadap ketahanan buah kakao yang tahan PBK.
ISOLASI DAN UJI EKSPRESI GEN
PROTEINASE INHIBITOR
(
PIN
) DARI BUAH KAKAO (
Theobroma cacao
L.)
YUSRON FARIEH
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
yang tahan terhadap PBK mempunyai ekspresi gen PIN yang lebih kuat dibanding klon yang tidak tahan terhadap PBK. Berdasarkan penelitian ini, diduga bahwa gen PIN mempunyai pengaruh terhadap ketahanan buah kakao yang tahan PBK.
Saran pada penelitian ini adalah perlunya dipelajari lebih detail tentang ekspresi gen PIN pada klon–klon kakao yang tahan terhadap PBK
DAFTAR PUSTAKA
Anonim. 2004. Seleksi dan karakterisasi morfologi tanaman kakao harapan tahan penggerek buah kakao (Conopomorpha cramerella Snell.) J. Sains & Teknologi 3: 109-122
Aprijani DA. 2004. Bioinformatika: Perkembangan, Disiplin Ilmu dan Penerapannya di Indonesia. http://www.gnu.org/copyleft/fdl.html.
Ashida Y et al. 2000. Isolation and sequencing of a cDNA clone encoding a 20 kDa protein with trypsin inhibitory activity. Bioschi Biotechnol Biochem 64 (6): 1305-1309.
Asif MH et al. 2000. A simple procedure for the isolation of high quality RNA from banana fruit tissue. Plant Mol. Biol. Rep. 18: 1-7.
Asrul L. 2004. Seleksi dan karakterisasi morfologi tanaman kakao harapan tahan penggerek buah kakao (Conopomorpha cramerella Snell.) J. Sains & Teknologi Vol.4 No.3: 109-122.
Atmawinata O. 1993. Hama penggerek buah kakao (PBK) suatu ancaman terhadap kelestarian perkebunan kakao di Indonesia. Warta Puslit Kopi dan Kakao 15: 1-3.
Beckler et al. 1996. Protocol and Applications Guide. Ed ke-3. USA : Promega Press.
Chaidamsari T. 1998. Transformasi genetik pada tanaman kakao menggunakan Agrobacterium tumefaciens.[tesis]. Bogor : IPB.
Chaidamsari T. 2005. Biotechnology for Cacao Pod Borer Resistance in Cacao. Plant Research International. The Netherlands : Wagenigen University.
Claveri JM, Notredame C. 2003. Bioinformatics for Dummies. Ed ke-2. New York : Wiley Publishing.
Dale JW. 1994. Molecular Genetic of Bacteria. England: John Wiley and Sons.
Darnell et al. 1990. Molecular Cell Biology. New York: Scientific American Books.
Davis LG et al. 1986. Basic Methods in Molecular Biology. New York: Elsevier Science Publishing.
de Maagd R A, Bravo A, Crickmore N. 2001. How Bacillus thuringiensis has evolved specific toxins to colonize the insect world. Trends Genet. 17: 193-199.
Depparaba F. 2002. Penggerek buah kakao (Conopomorpha cramerella Snellen)
dan penanggulangannya. Jurnal
Litbang Pertanian. 21:2.
Fan SG, Wu GJ. 2005. Characteristic of plant proteinase inhibitors and their application in combating phytophagous insects. Bot. Bull. Acad. 46:273-292.
Fritz H. 2000. Foreword. In K. Von der Helm et al. Protease as targets for therapy. Springer-Verlag. V-VI.
Glick BR, Pasternak JJ. 1994. Moleculer Biotechnology Principles and Applications of Recombinant DNA. Washington: ASM Press.
Herman. 2002. Perakitan tanaman tahan serangga melalui rekayasa genetik. Agrobio 5(1) : 1-13.
13
cramerella Snellen) di Sulawesi Selatan. [tesis]. Bogor: IPB.
Johnson R et al. 1989. Expression of proteinase inhibitors I and II in transgenic tobacco plant: effects on natural defense against man-duga sexta larvae. Proc. Natl. Acad. Sci. USA. 86: 9871-9875.
Jusuf M. 2001. Genetika I Struktur dan Ekspresi Gen. Jakarta : Sagung Seto.
Koiwa H et al. 1997. Regulation of protease inhibitors and plant defense. Trends Plant Sci. 2: 379-384.
Lim GT. Seasonal fluctuation of cocoa podborer Conopomorpha cramerella (Snellen) in Tawau, Sabah. Di dalam: Proceeding of 2ndInt. Conf.; Malaysia Plan Kuala lumpur, 1986. hlm. 114.
Muladno. 2002. Seputar Teknologi Rekayasa Genetika. Bogor : Pustaka Wirausaha Muda.
Munford YD and Wood. 1995. Preview of potensil Research Needs for Cacao Pod Borer Cenomorpha cramerella (Snellen).
Murdiyatmo U, Sugiyarta E. 1992. Peran Bioteknologi Dalam Pemuliaan Tanaman. Pasuruan : P3GI.
Nasir M. 2002. Teknik Rekayasa Genetik Tanaman. Bandung : PT Citra AB.
Perlak F J et al. 1991. Modification of the sequece enhances plant epression of insect control protein genes. Proc Natl Acad Sci. 88: 3324-3328.
Ryan CA. 1990. Proteinase Inhibitors in Plants: Genes for improving defenses against insect and pathogens. Annu. Rev.Phytopayhol 28: 425-449.
Santoso D. 2001. Pengembangan pelacak DNA spesifik gen melalui bioinformatika : identifikasi gen penyandi protein biji 21 kDa pada kakao UAH Indonesia. Menara perkebunan 69:1.
Santoso D et al. 2004. Activity of Bacillus thuringiensis toxins against cocoa pod borer larvae. Pest Manag Sci 60:735– 738 (online: 2004)
Sambrook et al. 1989. Molecular Cloning: Laboratory Manual. New York : Cold Spring Harbour Laboratory Press.
Sulistyowati et al. 2003. Analisis status penelitian dan pengembangan PHT pada pertanaman kakao. Simposium Nasional Penelitian PHT Perkebunan Rakyat. Bogor: 17-18 September 2003.
Suparno T. 1999. Infestasi hama baru penggerek buah kakao (conopomorpha cramerella sn.) pada perkebunan kakao di PT pamorganda, bengkulu utara dan kemungkinan pengendaliannya.. [tesis]. Bengkulu : Universitas Bengkulu.
Suryana A. 2005. Prospek dan Arah Pengembangan Agribisnis Kakao di Indonesia. Departemen Pertanian : Jakarta.
Terra WR, Ferreira C dan Jordao BP. 1996. Digestive enzyme. Lehane MJ (ed) Billin London, Chapman and Hall. 153-194.
Thai et al. 1991. Nucleid acid sequence of 21 kDa cocoa seed protein with homology to the soybean trypsin inhibitor (Kumitz) family of protease inhibitor. Plant Mol. Biol 16:913-915.
Ussuf KK, Laxmi NH. 2001. Proteinase inhibitors : plant-derived genes of insecticidal protein for developing insect-resistant transgenic plants. Current Science 80:7.
Yuwono T. 2006. Teori dan Aplikasi Polymerase Chain Reaction. Jogyakarta : Andi Offset.
Wahyu S A et al. 2004. Pengembangan
Walker AJ et al. 1998. Characterization of the midgut digestive proteinase activity of the two-spot ladybird
(Adalia bipunctata L.) and its
sensitivity to proteinase inhibitors. Insect Biochemistry and Molecular Biology. 28: 173-180.
Wardojo S. 1992. Major pets and diseases of cocoa in Indonesia In: Keane PJ and Putter CAJ (eds) Cocoa Pest and Disease Management in Southeast
Asia and Australia FAO. Plant
Production and Protection. 112: 63-67.
Wardojo S. 1996. PHT untuk mengatasi penggerek buah kakao. Disampaikan pada pertemuan ilmiah tentang Evaluasi Daerah Sebar Hama PBK di Indonesia. Makassar.
Watson et al. 1987. Molecular Biology of
the Gene. USA: The Benjamin
Publishing Company.
Weaver RF. 2002. Molecular Biology. Ed ke-2. New York : Mc Graw Hill.
Wessel PC. 1983. The Cocoa Pod Borer Moth (Acrocercops cromerella Sn). Review of Research Institute. 39-65.
ISOLASI DAN UJI EKSPRESI GEN
PROTEINASE INHIBITOR
(
PIN
) DARI BUAH KAKAO (
Theobroma cacao
L.)
YUSRON FARIEH
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
(
PIN
) dari Buah Kakao (
Theobroma cacao
L.). Dibimbing oleh EMAN
KUSTAMAN dan TETTY CHAIDAMSARI.
Kakao (
Theobroma cacao
L.) merupakan salah satu tanaman perkebunan
yang mempunyai nilai ekonomi tinggi sebagai komoditi ekspor. Adanya serangan
hama utama kakao, yaitu Penggerek Buah Kakao (PBK),
Conopomorpha
cramerella
Snellen menyebabkan kehilangan produksi kakao hingga 80% dan biji
kakao yang terserang, mutunya menurun bahkan tidak laku dijual. Gen
proteinase
inhibitor
(
PIN
) merupakan gen yang dapat menghasilkan senyawa antinutrisi yang
dapat menghambat kerja enzim proteolitik di dalam perut serangga.
PIN
terdapat
pada biji kakao dan berukuran 21 kDa dengan homologi yang cocok dengan
inhibitor tripsin pada kedelai. Penelitian ini bertujuan untuk mengisolasi gen
PIN
dari biji kakao dan melakukan uji ekspresi untuk mengetahui tingkat ekspresi gen
PIN
dari jaringan kulit buah kakao yang tahan (klon Ary 2) dan tidak tahan (klon
Bal 209) terhadap hama PBK.
Fragmen gen
PIN
dari biji kakao berhasil diisolasi dengan pasangan primer
spesifik gen
PIN
, yaitu F21 dan R11. Hasil sekuensing menunjukkan bahwa
fragmen tersebut berukuran 580 bp dan analisis BLASTN membuktikan bahwa
fragmen gen
PIN
yang berhasil diisolasi merupakan gen
PIN
yang mempunyai
homologi dengan gen
PIN
penyandi protein berukuran 21 kDa pada biji kakao.
Ekspresi gen
PIN
dari kedua klon pada buah yang memilki panjang 12 cm lebih
kuat dibanding buah yang memiliki panjang 9 cm. Secara umum ekspresi gen
PIN
dari jaringan kulit kakao pada klon Ary lebih kuat dibanding klon Bal, dengan
kata lain klon kakao yang tahan terhadap hama PBK, mengekspresikan gen
PIN
ABSTRACT
YUSRON FARIEH. Isolation and Expression Assay of
Proteinase Inhibitor
Gene (
PIN
) from Cacao Fruit (
Theobroma cacao
L.). Under the direction of
EMAN KUSTAMAN and TETTY CHAIDAMSARI
YUSRON FARIEH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Isolasi dan Uji Ekspresi Gen
Proteinase Inhibitor
(
PIN
) dari
Buah Kakao (
Theobroma cacao
L.)
Nama
: Yusron Farieh
NIM
: G44103036
Disetujui
Komisi Pembimbing
Ir. H. Eman Kustaman
Dr. Tetty Chaidamsari, M.Si.
Ketua
Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131473999
karena berkat rahmat dan karunia-Nya penulis dapat menyelesaikan penelitian ini.
Penelitian ini berjudul Isolasi dan Karakterisasi Gen
Proteinase Inhibitor
(
PIN
)
dari Buah Kakao (
Theobroma cacao
L.)
Penulis mengucapkan terima kasih kepada semua pihak yang telah
membantu dalam penyelesaian penelitian ini, antara lain kepada Ir. H. Eman
Kustaman selaku pembimbing utama, Dr. Tetty Chaidamsari, M.Si. selaku
pembimbing anggota, Dr. Darmono Taniwiryono, M.Sc. sebagai Kepala Balai
Penelitian Bioteknologi Perkebunan Indonesia. Penulis juga berterima kasih
kepada Mbak Herti, Mas Riza, Mbak Niyyah, Mbak Nita, Wahyu, Sesrima Afdal,
Teman-Teman Biokimia 40 dan Ekasariwan yang banyak memberikan motivasi
dan pengalamannya kepada penulis, juga Istana Ekasari yang telah setia memberi
keteduhan dari panas dan hujan kota Bogor. Ungkapan terima kasih juga
disampaikan kepada ayah, mama, serta seluruh keluarga, atas segala doa dan kasih
sayangnya.
Penulis menyadari masih banyak kekurangan dan kesalahan yang harus
diperbaiki, namun harapan penulis semoga penelitian ini dapat memberikan
manfaat bagi semua pihak yang membutuhkannya demi kemajuan ilmu
pengetahuan.
Bogor, Juli 2007
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 2 Oktober 1985 dari pasangan
Akromuddin Qohar dan Fauziah. Penulis merupakan anak kedua dari tujuh
bersaudara.
Pada tahun 2003 penulis lulus dari SMA Negeri 22 Jakarta dan pada tahun
yang sama lulus seleksi masuk IPB melalui Undangan Seleksi Masuk IPB (USMI)
pada program studi Biokimia, Departemen Kimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam. Selama mengikuti perkuliahan, penulis pernah menjadi
asisten praktikum Biokimia Umum untuk mahasiswa Biologi (2006), Biokimia I
dan II untuk mahasiswa Kimia (2006/2007), Teknik Penelitian Biokimia dan
Kultur Jaringan Tanaman untuk mahasiswa Biokimia (2007), Pengantar Biokimia
untuk mahasiswa Akademi Keperawatan, Sukabumi dan Cianjur juga Akademi
Kebidanan, Bogor (2007).
DAFTAR GAMBAR...ix
DAFTAR LAMPIRAN...ix
PENDAHULUAN...1
TINJAUAN PUSTAKA
Kakao Sebagai Komoditi Ekspor...2
Penggerek Buah Kakao (PBK)...2
Gen
Proteinase Inhibitor
(
PIN
)...3
Reverse Transcriptase Polimerase Chain Reaction
(RT-PCR)...4
Bioinformatika...4
BAHAN
DAN
METODE
Bahan dan Alat...5
Metode Penelitian...5
Isolasi RNA Total Biji Kakao...5
Uji Kualitatif dan Kuantitatif Hasil Isolasi RNA...6
Isolasi Gen
PIN
dan Uji Ekspresi dengan RT-PCR...6
Sekuensing Fragmen Gen
PIN
...6
HASIL
DAN
PEMBAHASAN
Isolasi RNA Total Biji Kakao...6
Isolasi Gen
PIN
dari Biji Kakao...6
Analisis Sekuen Fargmen Gen
PIN
dari Biji Kakao...8
Ekspresi Gen
PIN
pada Jaringan Kulit Kakao Klon Ary dan Bal...9
SIMPULAN...11
DAFTAR PUSTAKA...12
DAFTAR TABEL
Halaman
1 Hasil analisis BLASTN urutan basa fragmen gen
PIN
...9
2 Data hasil pengukuran absorban RNA dengan spektrofotometer UV...10
3
Data
pixel
dan konsentrasi hasil RT-PCR jaringan kulit klon kakao
yang dielektroforesis gel agarosa...11
DAFTAR GAMBAR
Halaman
1 Bagian buah kakao
...2
2 Hasil elektroforesis RNA total biji kakao...7
3 Urutan basa gen
PIN
...9
4 Hasil RT-PCR cDNA biji kakao... 9
5 Hasil elektroforesis RNA total dari jaringan kulit kakao...11
6 Hasil elektroforesis RT-PCR jaringan kulit kakao...11
DAFTAR LAMPIRAN
Halaman
1 Skema penelitian...16
2 Hasil analisis BLASTN (www.ncbi.nih.gov
/
BLAST)...17
3
Electrophoregraph
hasil sekuensing...20
merupakan salah satu tanaman perkebunan yang mempunyai nilai ekonomi tinggi sebagai komoditi ekspor. Indonesia termasuk dalam tiga besar produsen kakao dunia bersama Ghana dan Pantai Gading (Direktorat Jendral Bina Produksi Perkebunan 2004). Kakao mempunyai prospek yang cerah karena diperkirakan kebutuhan kakao dunia akan terus meningkat.
Kebutuhan kakao yang setiap tahun meningkat menyebabkan berbagai propinsi di Indonesia melakukan ekstensifikasi areal penanaman kakao guna untuk peningkatan produksi nasional. Salah satu provinsi yang sedang melakukan ekstensifikasi adalah propinsi Sumatra Barat dan direncanakan menjadi sentra kakao nasional pada masa yang akan datang. Pemerintah Sumatra Barat menargetkan penambahan kebun kakao mencapai 20.000 ha per tahun. Dengan adanya ekstensifikasi areal penanaman kakao, diharapkan dapat meningkatkan produksi kakao nasional dan tetap mempertahankan produksi kakao yang tinggi, sehingga dapat bersaing dengan negara produsen lainnya.
Indonesia harus menyediakan tanaman kakao yang mempunyai produktivitas tinggi dan kualitas biji yang baik untuk mempertahankan sebagai negara produsen kakao. Namun keadaan di lapangan sangat berbeda, banyak kendala yang dihadapi pekebun kakao. Kendala yang dihadapi antara lain, adanya serangan hama utama kakao, yaitu Penggerek Buah kakao (PBK), Conopomorpha cramerella snellen (Lim 1986). Serangan PBK menyebabkan kehilangan produksi kakao hingga 80% dan biji kakao yang terserang, mutunya menurun bahkan tidak laku dijual (Wardojo 1992), sehingga meskipun harga kakao akhir-akhir ini meningkat, namun tidak bisa dimanfaatkan secara optimal oleh para pekebun kakao.
Serangan hama PBK merupakan ancaman yang serius bagi kelangsungan usaha pekebun kakao karena belum ditemukan pengendalian hama yang efektif dan efisien (Santoso et al 2004). Pengendalian hama PBK secara konvensional sudah sering dilakukan, seperti pemangkasan, pemupukan, sanitasi, dan kontinuitas pemanenan. Sedangkan penelitian yang telah dilakukan antara lain
bassiana (Zaenudin et al 2000). Pengendalian tersebut dapat dikatakan kurang efektif karena lebih dari 50 % dari siklus hidup hama PBK berada di dalam buah (Depparaba 2004).
Untuk mengatasi kendala tersebut perlu dicari suatu metode pengendalian hama PBK yang handal, yaitu dengan perakitan tanaman kakao yang unggul melalui rekayasa genetik. Telah dilaporkan bahwa gen cry dari Bacillus thuringensis teruji efektif terhadap larva PBK (Chaidamsari et al 2005 dan Santoso D et al 2004), namun adanya penolakan terhadap produk pangan transgenik karena menggunakan gen dari bakteri, telah melemahkan upaya rekayasa genetik tersebut, meskipun gen cry maupun protein yang disandinya aman dikonsumsi manusia (de Maagd et al 2001). Berdasarkan hal ini maka perlu dicari metode yang lain untuk mengendalikan PBK.
Metode lain yang mungkin dilakukan agar kakao transgenik dapat diterima masyarakat adalah dengan memanfaatkan gen pertahanan alami pada tanaman kakao itu sendiri, yaitu gen proteinase inhibitor (PIN). PIN merupakan protein berukuran kecil yang mampu menghambat aktifitas proteinase dalam sistem pencernaan serangga (Fritz 2000). Apabila termakan oleh hama PBK, PIN akan berinteraksi dengan protease yang ada di dalam usus hama tersebut, terikat dan terkunci pada situs aktif (active site) protease (Terra et al 1996 dan Walker et al 1998). Hama PBK menjadi kekurangan nutrisi karena tidak ada asam amino yang diserap, sehingga pertumbuhan dan perkembangan menjadi terhambat.
2
yang tahan dan tidak tahan terhadap hama PBK, yaitu klon Ary 2 (tahan) dan Bal 209 (tidak tahan) yang berasal dari Sulawesi.
Penelitian ini bertujuan untuk mengisolasi gen PIN dari biji kakao dan melihat tingkat ekspresi gen PIN terhadap klon kakao yang tahan dan tidak tahan terhadap PBK. Hipotesis penelitian ini adalah klon kakao yang tahan terhadap PBK mengekspresikan gen PIN. Hasil penelitian ini diharapkan dapat memberikan informasi apakah gen PIN berpengaruh terhadap ketahanan klon kakao terhadap PBK dan nantinya dimungkinkan untuk dibuat klon kakao transgenik yang mengekspresikan gen PIN.
TINJAUAN PUSTAKA
Kakao Sebagai Komoditi EksporKakao (Theobroma cacao L) merupakan tanaman yang berasal dari Amerika Selatan, dari biji tanaman ini dihasilkan produk olahan yang dikenal sebagai cokelat. Biji buah kakao yang telah difermentasi dijadikan serbuk yang disebut sebagai coklat bubuk. Coklat ini dipakai sebagai bahan untuk membuat berbagai macam produk makanan dan minuman. Buah kakao tanpa biji dapat difermentasi untuk dijadikan pakan ternak.
Kakao merupakan tanaman perkebunan/industri berupa pohon yang dikenal di Indonesia sejak tahun 1560, namun baru menjadi komoditi yang penting sejak tahun 1951. Budidaya kakao di Indonesia diusahakan oleh Perusahaan Perkebunan Negara dan Swasta serta Perkebunan Rakyat. Lokasi Perusahaan Perkebunan skala besar yang diusahakan negara terletak di Sumatera Utara, Jawa Tengah dan Jawa Timur. Sedangkan Perkebunan rakyat terdapat terutama di Maluku, Irian Jaya, Sulawesi Utara, Sulawesi Selatan, Sulawesi Tenggara dan Nusa Tenggara Timur. Pada tahun 1988 areal tanaman coklat mencapai 213.612 ha. Luas perkebunan pada tahun 1991 mencapai 350.422 ha dengan produksi 121.651 ton coklat di Jawa Barat pada tahun 1998 mencapai 18.66,2 ha dengan produksi 6.404,3 ton.
Buah kakao bila dibelah akan tampak seperti Gambar 1, dan bagiannya dapat dikarakterisasi, yaitu OPW (outer pod wall) merupakan bagian kulit terluar dari kakao,
Gambar 1 Bagian buah kakao (Chaidamsari 2005)
IPW (inner pod wall) merupakan bagian kulit lapisan kedua yang berada di dalam buah, Pu (pulp) merupakan daging buah dari kakao, B (beans) biji kakao, dan PL (placenta) bagian tengah dari kakao.
Jenis kakao yang terbanyak dibudidayakan adalah jenis Criollo (Criollo Amerika Tengah dan Amerika Selatan) yang menghasilkan biji kakao bermutu sangat baik dan dikenal sebagai kakao mulia, fine flavour cocoa, choiced cocoa atau edel cocoa. Forastero yang menghasilkan biji kakao bermutu sedang, dikenal sebagai ordinary cocoa atau bulk cocoa dan trinitario yang merupakan hibrida alami dari Criollo dan Forastero sehingga menghasilkan biji kakao yang termasuk fine flavour cocoa atau bulk cocoa. Jenis Trinitario yang banyak ditanam di Indonesia adalah Hibrid Djati Runggo (DR) dan Uppertimazone Hybrida (Kakao lindak).
Penggerek Buah Kakao (PBK)
Penggerek Buah Kakao (PBK), Conopomorpha Cramerella Snellen, merupakan hama yang menimbulkan masalah yang cukup serius di Indonesia. Saat ini PBK menyerang hampir seluruh perkebunan kakao di Indonesia dan sangat merugikan petani. Hama ini memakan plasenta yang merupakan saluran makanan menuju ke biji sehingga mengakibatkan penurunan hasil dan mutu biji. Menurut Wardoyo (1996) kerugian yang ditimbulkan oleh PBK antara lain menurunnya berat, mutu biji, dan meningkatnya biaya panen karena pemisahan biji pada buah terserang memerlukan waktu yang lama.
tetap tinggal di dalamnya sebelum keluar untuk menjadi kepompong. Larva memakan jaringan yang lunak (pulp, pl