KARAKTERISASI BAKTERIOSIN
BAKTERI ASAM LAKTAT DARI SAWI FERMENTASI
NURUL HIDAYAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Karakterisasi Bakteriosin Bakteri Asam Laktat dari Sawi Fermentasi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
NURUL HIDAYAH. Karakterisasi Bakteriosin Bakteri Asam Laktat dari Sawi Fermentasi. Dibimbing oleh IMAN RUSMANA dan NISA RACHMANIA MUBARIK.
Sawi asin merupakan produk sawi fermentasi asal Indonesia. Sejumlah galur bakteri asam laktat yang berasosiasi dengan makanan menghasilkan bakteriosin. Bakteriosin merupakan senyawa protein yang memiliki aktivitas bakterisida terhadap mikrob sekerabat. Bakteriosin dapat menghambat beberapa bakteri penyebab kerusakan pada pangan. Tujuan dari penelitian ini ialah mengisolasi bakteri asam laktat dari sawi fermentasi dan mengkarakterisasi bakteriosin yang dihasilkan serta potensinya menghambat pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli.
Isolat bakteri asam laktat pada media MRSA + CaCO3 0.5% ditunjukkan
dengan adanya zona bening di sekitar koloni bakteri. Seleksi 66 isolat asam laktat menunjukkan 10 isolat dengan indeks penghambatan tertinggi terhadap bakteri S. aureus dan E. coli. Dua isolat dengan indeks penghambatan supernatan tertinggi dan berpotensi menghasilkan bakteriosin yaitu isolat PB3.6 dan PG1.9. Berdasarkan identifikasi molekuler, isolat PB3.6 menunjukkan kemiripan 96% dengan Lactobacillus plantarum JBE 160 dan isolat PG1.9 memiliki kemiripan 98% dengan Lactobacillus brevis KLAB12.
Aktivitas tertinggi bakteriosin isolat PB3.6 diperoleh pada akhir fase logaritmik sedangkan aktivitas tertinggi bakteriosin isolat PG1.9 diperoleh pada fase stasioner. Aktivitas endapan tertinggi bakteriosin isolat PB3.6 terhadap bakteri S. aureus pada konsentrasi amonium sulfat 40% sedangkan terhadap bakteri E. coli pada konsentrasi amonium sulfat 80%. Bakteriosin isolat PG1.9 memiliki aktivitas endapan tertinggi terhadap bakteri S. aureus dan E. coli pada konsentrasi amonium sulfat 70%. Bakteriosin isolat PB3.6 dan PG1.9 masih aktif menghambat bakteri S. aureus dan E. coli setelah diberi perlakuan pH 4-10 selama 30 menit dan suhu 50-100°C selama 10 menit. Aktivitas optimum bakteriosin isolat PB3.6 dan PG1.9 terhadap bakteri E. coli pada pH 4. Bakteriosin isolat PB3.6 memiliki aktivitas optimum terhadap bakteri S. aureus pada pH 6 sedangkan bakteriosin PG1.9 pada pH 7. Hasil tersebut mengindikasikan bahwa kedua isolat tersebut dapat menghasilkan bakteriosin yang diharapkan dapat digunakan sebagai pengawet pada produk pangan.
SUMMARY
NURUL HIDAYAH. Characterization of Bacteriocins Produced by Lactic Acid Bacteria Isolated from Fermented Mustard. Supervised by IMAN RUSMANA and NISA RACHMANIA MUBARIK.
Sawi asin is a fermented mustard product from Indonesia. Some strains of lactic acid bacteria associated with food produce bacteriocins. Bacteriocin is a protein that has bactericidal activity against species that closely related to the bacterial strain. Bacteriocins can inhibit some bacteria causing food spoilage. The aims of this study are to isolate lactic acid bacteria from fermented mustard and to characterize its bacteriocins in inhibiting the growth of Staphylococcus aureus and Escherichia coli.
Lactic acid bacteria were isolated using MRSA media + 0.5% CaCO3
indicated by formation of a clear zone around bacterial colonies. Screening of 66 bacterial isolates found 10 isolates of lactic acid bacteria that have good inhibition index against S. aureus and E. coli. The two highest inhibition index of their supernatant that potentially produce bacteriocins were PB3.6 and PG1.9 isolates. Based on molecular identification, PB3.6 isolate has 96% similarity with Lactobacillus plantarum JBE 160 and PG1.9 isolate has 98% similarity with Lactobacillus brevis KLAB12.
The highest bacteriocin activity of PB3.6 isolate was obtained at the end of the logarithmic phase, however the highest bacteriocin activity of PG1.9 isolate was obtained at the stationary phase. Bacteriocins precipitation using ammonium sulphate showed that the highest bacteriocin activity of PB3.6 isolate against S. aureus and E. coli was at ammonium sulphate concentration of 40% and 80%, respectively. Bacteriocins of PG1.9 isolate had the highest activity against S. aureus and E. coli at 70% concentration ammonium sulfate. Bacteriocins of PB3.6 and PG1.9 isolates were active against S. aureus and E. coli after they were treated with pH 4-10 for 30 minutes and temperature 50-100°C for 10 minutes. The optimum bacteriocins activity of PB3.6 and PG1.9 isolates against E. coli was at pH 4. However, bacteriocin of PB3.6 isolate had optimum activity against S. aureus at pH 6 while bacteriocins of PG1.9 isolate was at pH 7. These results indicated that both isolates could produce bacteriocins and they are expected to be used as a preservative agent for food products.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
KARAKTERISASI BAKTERIOSIN
BAKTERI ASAM LAKTAT DARI SAWI FERMENTASI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Penguji pada Ujian Tertutup: Dr Ir Drajat Martianto, MS
Penguji Luar Komisi pada Ujian Tesis: Dr Desniar, SPi MSi
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu wa Ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2015 ini ialah bakteriosin, dengan judul Karakterisasi Bakteriosin Bakteri Asam Laktat dari Sawi Fermentasi.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Iman Rusmana, MSi selaku ketua komisi pembimbing dan Ibu Dr Nisa Rachmania Mubarik, MSi selaku anggota komisi pembimbing, yang telah banyak memberikan bimbingan, saran, motivasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Ibu Dr Desniar, SPi MSi dan Ibu Prof Dr Anja Meryandini, MS selaku Ketua Program Studi Mikrobiologi IPB, yang telah memberikan motivasi selama studi. Terima kasih kepada DIKTI melalui Beasiswa BPPDN (Beasiswa Pendidikan Pascasarjana Dalam Negeri) 2013 atas kepercayaannya untuk memberikan beasiswa selama menempuh pendidikan pascasarjana di IPB.
Penulis juga mengucapkan terima kasih kepada Bapak Jaka dan Ibu Heni selaku staf Laboratorium Mikrobiologi IPB, Jaya, Putri, Susi, Mey, Gaby, Bang Risky, Cico, Kak Sipri, Noor, keluarga Perwira 44, Kak Udin, serta seluruh teman-teman di Laboratorium Mikrobiologi IPB, atas dukungan, motivasi, dan bantuannya selama penelitian ini. Ucapan terima kasih tak terhingga juga penulis ucapkan kepada bapak, ibu, dan adik-adikku tercinta, serta seluruh keluarga besar tersayang, atas doa, dukungan, kasih sayang, dan semangat yang diberikan. Terima kasih untuk teman-teman seperjuangan di Pascasarjana Mikrobiologi IPB angkatan 2013 serta seluruh pihak yang telah memberikan doa dan dukungannya, penulis ucapkan terima kasih.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
Manfaat Penelitian ... 2
2 TINJAUAN PUSTAKA 2 Bakteri Asam Laktat ... 2
Bakteriosin ... 3
3 METODE 7 Kerangka Penelitian ... 7
Waktu dan Tempat Penelitian ... 7
Bahan ... 8
Isolasi Bakteri Asam Laktat ... 8
Seleksi BAL Penghasil Senyawa Antimikrob ... 9
Uji Aktivitas Antimikrob Bakteriosin terhadap Bakteri Uji ... 9
Penentuan Kurva Tumbuh dan Produksi Bakteriosin ... 9
Pengendapan Bakteriosin dengan Amonium Sulfat ... 10
Dialisis ... 10
Pengukuran Konsentrasi Protein ... 10
Karakterisasi Aktivitas Bakteriosin ... 10
Identifikasi Isolat Terpilih ... 11
4 HASIL DAN PEMBAHASAN 11 Hasil ... 11
Pembahasan ... 18
5 SIMPULAN DAN SARAN 21 Simpulan ... 21
Saran ... 21
DAFTAR PUSTAKA 21
LAMPIRAN 25
RIWAYAT HIDUP 30
LAMPIRAN 13
DAFTAR TABEL
1 Bakteri asam laktat penghasil bakteriosin dan karakteristik
bakteriosinnya 5
2 Hasil isolasi bakteri asam laktat dari sawi asin Kota Bogor 12
3 Hasil uji aktivitas antimikrob isolat BAL 12
4 Hasil uji aktivitas antimikrob supernatan isolat BAL 13
5 Hasil pengendapan dan dialisis bakteriosin 15
6 Analisis homologi sekuen gen 16S rRNA isolat bakteri asam laktat
menggunakan program BLAST-N 17
DAFTAR GAMBAR
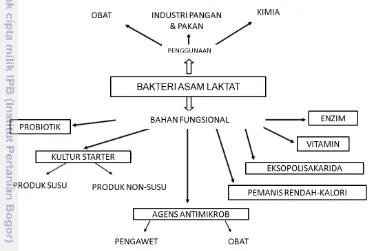
1 Pemanfaatan bakteri asam laktat terkait peranannya sebagai probiotik, penghasil bakteriosin, dan kultur starter pada makanan fermentasi 3
2 Diagram alur penelitian 8
3 Isolat bakteri asam laktat menunjukkan zona bening pada media MRSA
+ CaCO3 0.5% 11
4 Zona hambat supernatan isolat PG1.9 terhadap bakteri S. aureus dan E. coli dan isolat PB3.6 terhadap bakteri S. aureus dan E. coli 13 5 Kurva pertumbuhan isolat PB3.6 dan PG1.9 dan aktivitas bakteriosin
terhadap bakteri S. aureus dan E. coli 13
6 Aktivitas bakteriosin hasil pengendapan amonium sulfat isolat PB3.6 terhadap bakteri S. aureus dan E. coli dan isolat PG1.9 terhadap bakteri
S. aureus dan E. coli 14
7 Pengaruh perlakuan pH terhadap aktivitas bakteriosin isolat PB3.6 dan PG1.9 dan perlakuan renjatan panas terhadap aktivitas bakteriosin isolat PB3.6 dan PG1.9 terhadap bakteri S. aureus dan E. coli 16 8 Hasil pewarnaan Gram isolat PB3.6 dan PG1.9 perbesaran 1000x 16 9 Hasil elektroforesis amplifikasi isolat terpilih berdasarkan gen 16S
rRNA 17
10 Konstruksi pohon filogenetik isolat PB3.6 dan PG1.9 17
DAFTAR LAMPIRAN
1 Aktivitas antimikrob isolat bakteri asam laktat terhadap bakteri S.
aureus dan E. coli 25
2 Metode pengukuran kadar protein (Bradford 1976) 26
3 Kurva standar isolat PB3.6 dan PG1.9 27
1
PENDAHULUAN
Latar Belakang
Sawi asin merupakan produk sawi fermentasi asal Indonesia. Sawi asin telah diproduksi dan dikonsumsi di berbagai daerah di Indonesia selama bertahun-tahun. Pembuatan sawi fermentasi dilakukan dengan penambahan garam dan air rebusan nasi pada sayuran. Fermentasi terjadi dengan pertumbuhan beberapa bakteri asam laktat yaitu Leuconostoc mesenteroides, Lactobacillus confusus, L. curvatus, L. plantarum, dan Pediococcus pentosaceus (Puspito dan Fleet 1985).
Sawi fermentasi merupakan sumber yang baik untuk eksplorasi bakteri asam laktat (BAL) (Chao et al. 2009). BAL memiliki peranan penting dalam mengawetkan makanan dari mikrob pembusuk. Peranannya tersebut terkait dengan kemampuannya menghasilkan senyawa asam organik, hidrogen peroksida, diasetil, senyawa antifungi, dan bakteriosin yang bersifat antagonistik pada mikrob lainnya (Nespolo dan Brandelli 2010). Saat ini, sejumlah metode pengawetan (preservasi) telah digunakan untuk menghindari terjadinya kerusakan pangan. Teknik-teknik tersebut meliputi perlakuan panas (pasteurisasi, sterilisasi dengan panas), pengurangan aktivitas air dan pH (asidifikasi, dehidrasi), dan penambahan pengawet (antibiotik, senyawa kimia seperti propionat, sorbat, benzoat, laktat, asetat). Meskipun metode tersebut terbukti sukses, akan tetapi penggunaan pengawet kimia pada makanan dapat meninggalkan residu bahan kimia pada tubuh yang dikhawatirkan dapat memicu penyakit berbahaya lainnya. Peningkatan kasus kekebalan bakteri terhadap antibiotik dan permintaan akan pangan yang aman, dengan tambahan bahan kimia sedikit, makin meningkatkan ketertarikan untuk mencari pengganti zat aditif kimia dengan bahan alami yang lebih aman. Solusi yang ditawarkan untuk mengatasi permasalahan tersebut yaitu dengan menggunakan senyawa antimikrob yang dihasilkan oleh BAL.
Sejumlah galur BAL yang berasosiasi dengan makanan menghasilkan bakteriosin. Bakteriosin didefinisikan sebagai senyawa protein yang menunjukkan aktivitas bakterisida terhadap mikrob sekerabat (Tagg et al. 1976). Bakteriosin dapat menghambat beberapa bakteri penyebab kerusakan pada pangan seperti Listeria monocytogenes, Staphylococcus aureus, dan bakteri sekerabat lainnya (Parada et al. 2007). Bakteriosin yang dihasilkan oleh bakteri asam laktat diharapkan mampu menggantikan peranan zat aditif kimia dalam melawan bakteri patogen pada pangan sehingga nantinya akan memperpanjang masa simpan pangan tersebut. Keunggulan dari bakteriosin dibandingkan zat kimia ialah bakteriosin merupakan peptida yang dapat didegradasi oleh enzim proteolitik dalam saluran pencernaan sehingga dinilai aman untuk dikonsumsi.
2
lactis, dan Staphylococcus aureus (Crandall dan Montville 1998; Vignolo et al. 2000; Sun et al. 2009; Bergholz et al. 2013; Kawada-Matsuo et al. 2013).
Sulistiani et al. (2014) telah mengisolasi sejumlah BAL dari sayur asin (sawi asin) asal Jawa Tengah Indonesia di antaranya ialah Lactobacillus farciminis, L. fermentum, L. namurensis, L. plantarum, L. helveticus, L. brevis, L. versmoldensis, L. casei, L. rhamnosus, L. fabifermentans, dan L. satsumensis. Namun belum ada penelitian terkait bakteriosin yang dihasilkan oleh BAL yang diisolasi dari sawi asin. Berdasarkan latar belakang tersebut, maka dilakukan penelitian ini guna mencari senyawa bakteriosin yang dihasilkan oleh BAL yang memiliki aktivitas antimikrob menghambat mikrob patogen dan dapat dimanfaatkan sebagai agens biopreservatif menggantikan antibiotik dan senyawa kimia lainnya.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengisolasi bakteri asam laktat dari sawi fermentasi dan mengkarakterisasi bakteriosin yang dihasilkan serta potensinya menghambat pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli.
Manfaat Penelitian
Manfaat penelitian ini diharapkan dapat memberikan sumbangsih terhadap ilmu pengetahuan dengan diperolehnya isolat bakteri asam laktat yang menghasilkan senyawa antimikrob bakteriosin yang berpotensi untuk diaplikasikan sebagai pengawet alami pada makanan.
2
TINJAUAN PUSTAKA
Bakteri Asam Laktat
Gambaran umum dari bakteri yang termasuk dalam kelompok BAL ialah gram positif, tidak berspora, aerotoleran, kokus atau batang, memproduksi asam laktat sebagai produk akhir utama selama fermentasi karbohidrat, katalase negatif, tidak mempunyai sitokrom (Axelsson 2004; Wright dan Axelsson 2012). BAL digolongkan sebagai bakteri yang Generally Recognized As Save (GRAS) yang aman bagi manusia (Parada et al. 2007).
Jalur metabolisme glukosa BAL dapat bersifat homofermentatif atau heterofermentatif (Parada et al. 2007). Jalur homofermentatif melalui glikolisis (Jalur Embden–Meyerhof–Parnas) dan menghasilkan hanya asam laktat. Jalur heterofermentatif (juga dikenal dengan jalur pentosa fosfoketolase, heksosa monofosfat, atau jalur 6-fosfoglukonat), selain menghasilkan asam laktat juga menghasilkan sejumlah CO2 dan etanol atau asetat (Wright dan Axelsson 2012).
3 menguntungkan pada ekosistem tersebut. BAL yang tumbuh sebagai mikrob adventif makanan atau ditambahkan pada makanan sebagai kultur. BAL dianggap tidak berbahaya, bahkan memberikan keuntungan bagi kesehatan manusia. Sejak penemuannya, BAL telah mendapatkan perhatian dan pemanfaatan dalam berbagai aplikasi, seperti kultur starter dalam makanan fermentasi dan pakan, obat-obatan, probiotik, dan sebagai agen pengendalian hayati. Dalam industri makanan, BAL banyak digunakan sebagai starter untuk mendapatkan perubahan yang menguntungkan dalam tekstur, aroma, rasa, dan keasaman pada makanan (Harzallah dan Belhadj 2013). Bakteri asam laktat dapat dimanfaatkan dalam berbagai hal diantaranya sebagai probiotik, penghasil bakteriosin, dan kultur starter dalam produk makanan fermentasi (Gambar 1).
Bakteriosin
Bakteriosin didefinisikan sebagai senyawa protein yang memiliki aktivitas antimikrob terhadap mikrob sekerabat (Bali et al. 2011). Bakteriosin disintesis di ribosom, merupakan senyawa bioaktif peptida atau peptida kompleks yang dikeluarkan ekstraseluler, dan memiliki aktivitas bakterisida atau bakteriostatik (Jeevaratnam et al. 2005). Bakteriosin dapat menghambat beberapa patogen yang menyebar melalui makanan, seperti: Clostridium botulinum, Enterococcus faecalis, Listeria monocytogenes, Staphylococcus aureus, dan Bacillus spesies.
4
Oleh karena itu, bakteriosin kini diharapkan dapat berperan sebagai pengawet pada makanan terkait aktivitasnya menghambat bakteri patogen pada makanan, dan dapat menggantikan pengawet makanan yang terbuat dari senyawa kimia.
Bakteriosin berbeda dengan antibiotik dalam beberapa hal, yaitu: (a) bakteriosin disintesis di ribosom, (b) sel inang kebal terhadap bakteriosin, (c) mekanisme kerja berbeda dari antibiotik, dan (d) bakteriosin memiliki spektrum kerja sempit dan dengan demikian umumnya mampu membunuh bakteri yang hanya berkaitan erat dengan strain penghasil bakteriosin (Ouwehand dan Vesterlund 2004).
Klasifikasi Bakteriosin
Bakteriosin terdiri atas 4 kelompok berdasarkan karakteristik biokimia dan genetik (Jeevaratnam et al. 2005; Parada et al. 2007):
a. Kelas I (Lantibiotik)
Lantibiotik merupakan kelompok peptida berantai pendek, berbobot molekul kecil (< 5 kDa), tahan panas, bekerja pada struktur membran. Lantibiotik dicirikan dengan adanya asam amino thioeter lantionin dan metillantionin yang dihasilkan melalui modifikasi pascatranslasi. Contoh yang paling terkenal dari kelompok ini ialah nisin yang dihasilkan oleh Lactococcus lactis subsp. lactis. Bakteriosin kelas I ini dibagi 2 subkelas yaitu Ia dan Ib.
Subkelas Ia
Bakteriosin subkelas Ia, termasuk nisin, terdiri atas peptida kationik dan hidrofobik, bermuatan positif dan memiliki struktur yang lebih fleksibel dibandingkan subkelas 1b yang kaku, dan bekerja dengan membentuk pori pada membran sel target.
Subkelas Ib
Bakteriosin subkelas Ib merupakan peptida yang berbentuk bulat (globular), strukturnya kaku, bermuatan negatif atau tidak bermuatan, dan bekerja dengan mengganggu reaksi enzim penting dari bakteri yang sensitif.
b. Kelas II (Non-Lantibiotik)
Bakteriosin dengan bobot molekul kecil (< 10 kDa), tahan panas, mengandung asam amino regular, dan aktif pada membran. Bakteriosin kelas II dibagi 3 subkelas, yaitu IIa, IIb, dan IIc.
Subkelas IIa
Bakteriosin subkelas IIa terdiri atas peptida yang memiliki aktivitas anti-listeria, aktif terhadap Listeria, misalnya pediocin. Peptida ini mengandung N-terminal sekuens Tyr-Gly-Asn-Gly-Val dan dua Sistein membentuk jembatan S-S pada pertengahan N-terminal peptida.
Subkelas IIb
Bakteriosin subkelas IIb terbentuk dari adanya kompleks antara dua peptida yang berbeda. Contohnya lactococcin B dan plantaricin EF JK.
Subkelas IIc
5 c. Kelas III
Peptida dengan bobot molekul besar (> 30 kDa), tidak tahan terhadap panas, contohnya Helviticin J, lactacin A dan B.
d. Kelas IV
Bakteriosin kelas ini merupakan bakteriosin kompleks protein dengan gugus kimia lainnya seperti lipid atau karbohidrat.
Sejumlah bakteri asam laktat menghasilkan bakteriosin dengan berbagai karakter dan spektrum kerja penghambatan yang berbeda-beda (Tabel 1).
Tabel 1 Bakteri asam laktat penghasil bakteriosin dan karakteristik bakteriosinnya
Mikrob Penghasil Bakteriosin Spektrum Kerja Karakteristik
6
Lactobacillus casei Lactocin 705 Listeria
monocytogenes Lactobacillus plantarum
Kelas II bakteriosin 2 komponen (33
7
Lactobacillus sake Lactocin S
Sakacin P
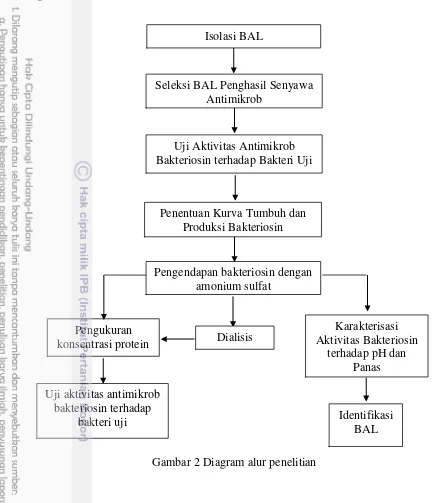
Kerangka penelitian ini (Gambar 2) meliputi isolasi bakteri asam laktat dari sawi asin, seleksi BAL penghasil bakteriosin yang menghambat pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli, pengendapan bakteriosin dengan amonium sulfat, dialisis, dan karakterisasi aktivitas bakteriosin terhadap pengaruh pH dan panas.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Februari – November 2015, bertempat di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, Institut Pertanian Bogor.
8
Gambar 2 Diagram alur penelitian
Bahan
Bahan yang digunakan dalam penelitian ini ialah sawi fermentasi yang diperoleh dari Pasar Anyar, Pasar Bogor, dan Pasar Gunung Batu, Kota Bogor, Jawa Barat. Bakteri Staphylococcus aureus dan Escherichia coli yang merupakan koleksi Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Isolasi Bakteri Asam Laktat
Sebanyak 1 g sawi fermentasi dihaluskan lalu dimasukkan ke 9 ml larutan garam fisiologis (NaCl) 0.85%. Selanjutnya dibuat pengenceran bertingkat 10-1–
Uji Aktivitas Antimikrob Bakteriosin terhadap Bakteri Uji
Pengendapan bakteriosin dengan amonium sulfat
Dialisis
Uji aktivitas antimikrob bakteriosin terhadap
bakteri uji Pengukuran konsentrasi protein
Penentuan Kurva Tumbuh dan Produksi Bakteriosin
Isolasi BAL
Seleksi BAL Penghasil Senyawa Antimikrob
Karakterisasi Aktivitas Bakteriosin
terhadap pH dan Panas
9 10-6 lalu diinokulasikan pada media MRSA (de Man Rogosa Sharpe Agar) +
CaCO3 0.5% (Desniar et al. 2013) dan diinkubasi dalam anaerobic jar pada suhu
ruang selama 48 jam. Isolat yang membentuk zona bening pada media kemudian dimurnikan. Isolat murni yang diperoleh diinokulasikan ke media agar-agar miring MRSA sebagai stok.
Seleksi BAL Penghasil Senyawa Antimikrob
Aktivitas antimikrob BAL terhadap bakteri S. aureus dan E. coli diuji dengan disc diffusion method. Sebanyak 80 µl kultur cair isolat bakteri diteteskan di atas kertas cakram. Selanjutnya 1 ml bakteri uji diinokulasi pada 100 ml media NA yang mengandung 0.8% agar-agar. Lalu dituang ke cawan petri dan dibiarkan hingga memadat. Kertas cakram kemudian diletakkan di atas permukaan media. Selanjutnya cawan petri diinkubasi pada suhu 37°C selama 24 jam. Aktivitas antimikrob ditentukan dari zona hambat (bening) yang terbentuk. Pengukuran diameter zona hambat dihitung dengan menggunakan persamaan:
IP μ diameter zonahambat (mm) – diameter kertasdiameter kertascakram (mm) cakram (mm)
Keterangan : IP = Indeks Penghambatan
Uji Aktivitas Antimikrob Bakteriosin terhadap Bakteri Uji
Isolat BAL yang memiliki aktivitas antimikrob terhadap bakteri uji selanjutnya aktivitas antimikrob bakteriosinnya diuji dengan disk diffusion method. Sebanyak 80 µl larutan supernatan diteteskan di atas kertas cakram. Selanjutnya 1 ml bakteri uji diinokulasi pada 100 ml media NA yang mengandung 0.8% agar-agar. Lalu dituang ke cawan petri dan dibiarkan hingga memadat. Kertas cakram kemudian diletakkan di atas permukaan media. Selanjutnya cawan petri diinkubasi pada suhu 37°C selama 24 jam. Aktivitas antimikrob ditentukan dari zona hambat (bening) yang terbentuk. Supernatan yang diperoleh dinetralkan pH-nya (pH 7.0±0.2) dengan 1 M NaOH.
Penentuan Kurva Tumbuh dan Produksi Bakteriosin
Sebanyak 1 ose isolat bakteri terpilih ditumbuhkan di 50 ml media MRSB kemudian diinkubasi secara anaerobik pada suhu ruang hingga sel bakteri mencapai 108 CFU/ml. Selanjutnya 1% inokulum diinokulasi ke dalam media
10
Pengendapan Bakteriosin dengan Amonium Sulfat
Supernatan diendapkan dengan amonium sulfat jenuh secara bertingkat pada kisaran 0-80 % (Scopes 1994). Penambahan tersebut disertai pengadukan selama 1 jam pada suhu 4oC. Ekstrak kasar disimpan di dalam tabung sentrifus selama
semalam pada suhu 10oC, kemudian disentrifugasi pada kecepatan 4455 x g
selama 30 menit. Endapan dilarutkan dengan bufer fosfat 0.1 M pH 7 (perbandingan 1:1). Supernatan dan endapan diukur aktivitas penghambatan serta kadar proteinnya.
Dialisis
Proses dialisis dilakukan menggunakan kantong dialisis (Sigma D0405) dengan diameter 15 mm. Kantong dialisis yang akan digunakan dipersiapkan terlebih dahulu sesuai dengan prosedur yang telah ditentukan. Membran dicuci dengan air mengalir selama 3-4 jam. Selanjutnya kantong dialisis direbus dalam larutan natrium sulfit 0.3% (b/v) pada suhu 80°C selama 1 menit. Kantong dialisis kemudian dicuci dengan air panas (60°C) selama 2 menit, diikuti dengan pengasaman dengan larutan asam sulfat 0.2% (b/v), kemudian dicuci kembali dengan air panas. Bakteriosin hasil pengendapan dilarutkan dengan bufer fosfat 0.1 M pH 7 lalu dimasukkan ke dalam kantong dialisis. Kantong dimasukkan ke dalam wadah yang berisi bufer fosfat 0.01 M pH 7 (volume total 100x volume sampel di dalam membran) sambil diaduk pelan dengan menggunakan pengaduk magnet pada suhu 4°C. Proses dialisis dilakukan selama semalam dan bufer diganti setelah jam ke-3 dan jam ke-7 dengan volume yang sama. Hasil dialisis diuji aktivitas penghambatan serta kadar proteinnya.
Pengukuran Konsentrasi Protein
Konsentrasi protein diukur dengan metode Bradford (1976). Sebanyak 100 µl sampel direaksikan dengan 1 ml pereaksi Bradford, dikocok dengan vortex dan didiamkan selama 10-20 detik. Sebanyak 100 µl akuades direaksikan dengan pereaksi yang sama sebagai blanko, sedangkan sebagai standar protein digunakan Bovine Serum Albumin (BSA), kadar protein diukur dengan spektrofotometer dengan panjang gelombang 595 nm.
Karakterisasi Aktivitas Bakteriosin
11 pada rentang suhu 50°C-100°C (selang 10°C). Endapan bakteriosin dilarutkan pada bufer dengan pH optimum (perbandingan 1:1), lalu diberikan perlakuan renjatan panas pada masing-masing suhu 50, 60, 70, 80, 90, dan 100°C selama 10 menit. Selanjutnya aktivitas penghambatannya diuji terhadap bakteri uji yang diinkubasi pada suhu 37°C.
Identifikasi Isolat Terpilih
Pewarnaan Gram dilakukan terhadap isolat terpilih. Ekstraksi DNA bakteri dilakukan dengan menggunakan Genomic DNA Mini Kit (Blood/Cultured Cell) (Geneaid GB100). DNA genom bakteri selanjutnya diamplifikasi dengan PCR. Primer yang digunakan ialah 63f (5′-CAG GCC TAA CAC ATG CAA GTC-3′)
dan 1387r (5′-GGG CGG WGT GTA CAA GGC-3′) (Marchesi et al. 1998). Total
volume reaksi PCR 50 µl terdiri atas 25 µl Go Taq Green Master Mix 2X, masing-masing primer 2 µl, template 4 µl dan 17 µl nuclease free water. PCR dengan tahapan predenaturasi (94°C 4 menit), denaturasi (94°C 30 detik), annealing (55°C 30 detik), elongation (72°C 1 menit), postelongation (72°C 7 menit), cooling (4°C 15 detik) dan berlangsung hingga 30 siklus. Hasil amplifikasi PCR selanjutnya dilakukan proses elektroforesis pada tegangan arus 100 volt selama 30 menit. Hasil elektroforesis lalu diwarnai dengan Ethidium bromida lalu diamati di bawah sinar UV pada mesin UV transiluminator (Sambrook dan Russell 2001). Hasil amplifikasi gen 16S rRNA kemudian dikirim ke PT. Genetika Science Indonesia (http://www.ptgenetika.com). Homologi sekuen 16S rRNA yang diperoleh dianalisis dengan membandingkannya dengan sekuen 16S rRNA yang tersedia di database nukleotida dari GenBank menggunakan program Basic Local Alignment Search Tool (BLAST). Pensejajaran nukleotida dan pembuatan pohon filogenetik menggunakan program MEGA 6. Pohon filogenetik dibuat dengan menggunakan metode Neighboor-Joining dengan nilai bootstrap 1000x.
4
HASIL DAN PEMBAHASAN
Hasil
Isolat Bakteri Asam Laktat Hasil Isolasi
Hasil isolasi bakteri asam laktat pada media MRSA + CaCO3 0.5% dari 6
sampel sayur asin asal Bogor diperoleh 66 isolat bakteri (Tabel 2). Isolat bakteri asam laktat ditandai dengan adanya zona bening di sekitar koloni bakteri (Gambar 3).
12
Tabel 2 Hasil isolasi bakteri asam laktat dari sawi asin Kota Bogor No. Lokasi
Aktivitas Antimikrob Bakteriosin terhadap Bakteri Uji
Sebanyak 66 isolat bakteri asam laktat yang telah dimurnikan diuji aktivitasnya menghambat bakteri S. aureus dan E. coli. Semua isolat bakteri tersebut memiliki aktivitas penghambatan terhadap bakteri S. aureus dan E. coli (Lampiran 1). Sepuluh isolat bakteri dengan indeks penghambatan (IP) tertinggi dipilih berdasarkan kejernihan zona hambatnya (Tabel 3). Isolat PB3.6 memiliki indeks penghambatan tertinggi terhadap bakteri S. aureus sebesar 1.13 dan terhadap E. coli sebesar 0.83 dan indeks penghambatan tertinggi terhadap bakteri E. coli ditunjukkan pula oleh isolat PB2.4 sebesar 0.83.
Tabel 3 Hasil uji aktivitas antimikrob isolat BAL
No. Kode Isolat BAL Indeks Penghambatan (IP)
S. aureus E. coli
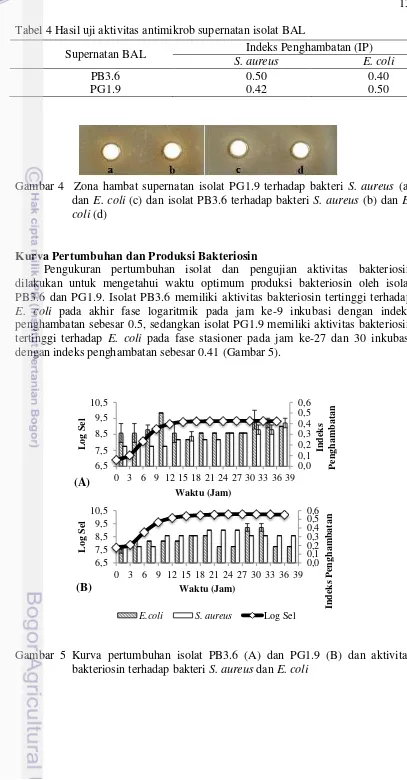
13 Tabel 4 Hasil uji aktivitas antimikrob supernatan isolat BAL
Supernatan BAL Indeks Penghambatan (IP)
S. aureus E. coli
PB3.6 0.50 0.40
PG1.9 0.42 0.50
Gambar 4 Zona hambat supernatan isolat PG1.9 terhadap bakteri S. aureus (a) dan E. coli (c) dan isolat PB3.6 terhadap bakteri S. aureus (b) dan E. coli (d)
Kurva Pertumbuhan dan Produksi Bakteriosin
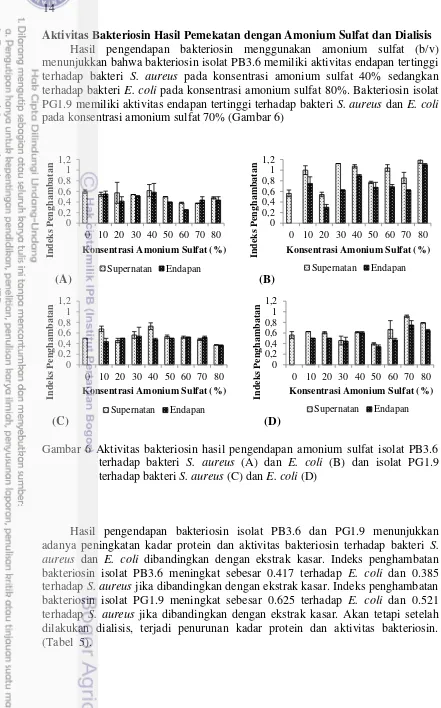
Pengukuran pertumbuhan isolat dan pengujian aktivitas bakteriosin dilakukan untuk mengetahui waktu optimum produksi bakteriosin oleh isolat PB3.6 dan PG1.9. Isolat PB3.6 memiliki aktivitas bakteriosin tertinggi terhadap E. coli pada akhir fase logaritmik pada jam ke-9 inkubasi dengan indeks penghambatan sebesar 0.5, sedangkan isolat PG1.9 memiliki aktivitas bakteriosin tertinggi terhadap E. coli pada fase stasioner pada jam ke-27 dan 30 inkubasi dengan indeks penghambatan sebesar 0.41 (Gambar 5).
Gambar 5 Kurva pertumbuhan isolat PB3.6 (A) dan PG1.9 (B) dan aktivitas bakteriosin terhadap bakteri S. aureus dan E. coli
14
Aktivitas Bakteriosin Hasil Pemekatan dengan Amonium Sulfat dan Dialisis Hasil pengendapan bakteriosin menggunakan amonium sulfat (b/v) menunjukkan bahwa bakteriosin isolat PB3.6 memiliki aktivitas endapan tertinggi terhadap bakteri S. aureus pada konsentrasi amonium sulfat 40% sedangkan terhadap bakteri E. coli pada konsentrasi amonium sulfat 80%. Bakteriosin isolat PG1.9 memiliki aktivitas endapan tertinggi terhadap bakteri S. aureus dan E. coli pada konsentrasi amonium sulfat 70% (Gambar 6)
Gambar 6 Aktivitas bakteriosin hasil pengendapan amonium sulfat isolat PB3.6 terhadap bakteri S. aureus (A) dan E. coli (B) dan isolat PG1.9 terhadap bakteri S. aureus (C) dan E. coli (D)
15 Tabel 5 Hasil pengendapan dan dialisis bakteriosin
Kode
Keterangan: Total protein = kadar protein x volume
Stabilitas Aktivitas Bakteriosin terhadap Perlakuan pH dan Suhu
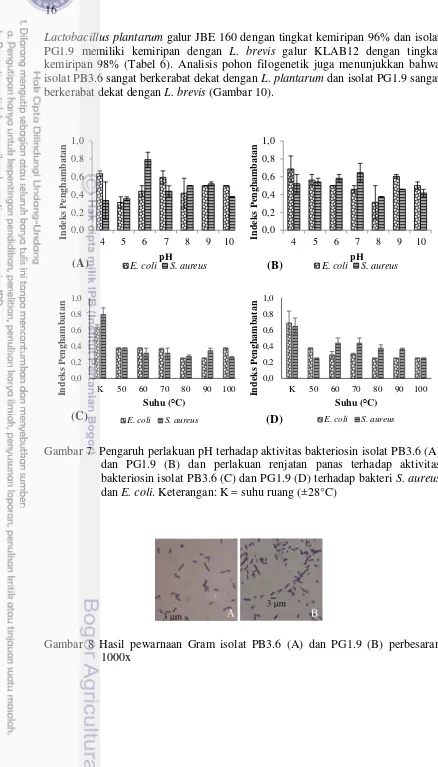
Aktivitas bakteriosin yang diproduksi oleh isolat PB3.6 dan PG1.9 dikarakterisasi aktivitasnya terhadap bakteri S. aureus dan E. coli berdasarkan pH dan suhu. Bakteriosin hasil pengendapan isolat PB3.6 dan PG1.9 aktif menghambat bakteri S. aureus dan E. coli setelah diberi perlakuan pH 4-10 selama 30 menit dan suhu 50-100°C selama 10 menit. Bakteriosin isolat PB3.6 dan PG1.9 hasil pengendapan memiliki aktivitas optimum terhadap bakteri E. coli pada pH 4. Bakteriosin isolat PB3.6 memiliki aktivitas optimum terhadap bakteri S. aureus pada pH 6 sedangkan bakteriosin PG1.9 pada pH 7. Aktivitas bakteriosin menurun setelah diberi perlakuan panas. Aktivitas bakteriosin kontrol (±28°C) lebih tinggi dibanding bakteriosin dengan perlakuan renjatan panas pada suhu 50-100°C selama 10 menit (Gambar 7).
Identifikasi Isolat Bakteri Terpilih
16
Lactobacillus plantarum galur JBE 160 dengan tingkat kemiripan 96% dan isolat PG1.9 memiliki kemiripan dengan L. brevis galur KLAB12 dengan tingkat kemiripan 98% (Tabel 6). Analisis pohon filogenetik juga menunjukkan bahwa isolat PB3.6 sangat berkerabat dekat dengan L. plantarum dan isolat PG1.9 sangat berkerabat dekat dengan L. brevis (Gambar 10).
Gambar 7 Pengaruh perlakuan pH terhadap aktivitas bakteriosin isolat PB3.6 (A) dan PG1.9 (B) dan perlakuan renjatan panas terhadap aktivitas bakteriosin isolat PB3.6 (C) dan PG1.9 (D) terhadap bakteri S. aureus dan E. coli. Keterangan: K = suhu ruang (±28°C)
17
Gambar 9 Hasil elektroforesis amplifikasi isolat terpilih berdasarkan gen 16S rRNA. M=1kb, Sumur (1) PG1.9 dan (2) PB3.6 PB3.6 Lactobacillus plantarum galur
JBE 160 96 0.0 KP887106.1
Lactobacillus plantarum galur
JBE 60 96 0.0 KP887104.1
Lactobacillus plantarum galur
IMAU11209 96 0.0 KT887228.1
Lactobacillus plantarum galur
CSI7 96 0.0 KM513642.1
PG1.9 Lactobacillus brevis galur
KLAB12 98 0.0 KM485589.1
Lactobacillus brevis galur
AT1-4 98 0.0 KM392069.1
Lactobacillus brevis galur gp71 98 0.0 KM495920.1 Lactobacillus brevis galur FJ006 98 0.0 KP889231.1 Lactobacillus brevis galur BFE
8325 98 0.0 EU147301.1
Gambar 10 Konstruksi pohon filogenetik isolat PB3.6 dan PG1.9
Lactobacillus brevis strain BFE 8325 Lactobacillus brevis strain FJ006 Lactobacillus brevis strain gp71 Lactobacillus brevis strain AT1-4 Lactobacillus brevis strain KLAB12
PG1.9
18
Pembahasan
Sawi fermentasi merupakan sumber yang baik untuk eksplorasi bakteri asam laktat (BAL) (Chao et al. 2009). Bakteri asam laktat berperan utama dalam fermentasi sayur asin (Puspito dan Fleet 1985). Isolat bakteri asam laktat pada media MRSA + CaCO3 0.5% ditandai dengan adanya zona bening di sekitar
koloni bakteri. Zona bening tersebut terbentuk karena isolat bakteri asam laktat akan menghasilkan asam yang akan bereaksi dengan CaCO3, setelah masa
inkubasi 2-3 hari, di sekitar koloni yang tumbuh pada media akan terlihat adanya daerah bening akibat terbentuknya Ca-laktat yang larut dalam media (Djide dan Wahyudin 2008). Kelompok BAL merupakan kelompok bakteri gram positif, tidak berspora, aerotoleran, kokus atau batang, memproduksi asam laktat sebagai produk akhir utama selama fermentasi karbohidrat, katalase negatif (Axelsson 2004; Wright dan Axelsson 2012).
Enam puluh enam isolat bakteri asam laktat yang telah dimurnikan selanjutnya diseleksi berdasarkan kemampuannya menghambat bakteri S. aureus dan E. coli. Sepuluh isolat BAL dipilih berdasarkan indeks penghambatan tertinggi (0.25-1.13). Aktivitas BAL tersebut menunjukkan bahwa BAL menghasilkan senyawa antimikrob yang dapat menghambat pertumbuhan bakteri S. aureus dan E. coli. Senyawa antimikrob yang dihasilkan oleh BAL, yaitu: asam organik berupa asam laktat, hidrogen peroksida, diasetil, asetaldehid, D-isomer asam amino, reuterin, dan bakteriosin (Yang et al. 2012).
Supernatan 10 isolat terpilih dinetralkan pH-nya dengan 1M NaOH. Proses tersebut bertujuan untuk menghilangkan efek antimikrob dari asam organik yang dihasilkan oleh bakteri tersebut (Todorov et al. 2004; Gao et al. 2010). Hal ini merupakan uji awal untuk menduga kemampuan isolat BAL menghasilkan bakteriosin. Dua isolat yang memiliki indeks penghambatan tertinggi yaitu isolat PB3.6 dan PG1.9. Supernatan isolat PB3.6 dan PG1.9 menghambat pertumbuhan bakteri S. aureus dan E. coli dan diduga menghasilkan bakteriosin.
Aktivitas bakteriosin yang diproduksi oleh isolat PB3.6 dan PG1.9 dideteksi sejak awal fase pertumbuhan. Aktivitas tertinggi bakteriosin isolat PB3.6 diperoleh pada akhir fase logaritmik pada jam ke-9 inkubasi dan aktivitas tertinggi bakteriosin isolat PG1.9 diperoleh pada fase stasioner pada jam ke-27. Hal ini menunjukkan bahwa bakteriosin mulai diproduksi pada fase logaritmik atau saat pertumbuhan sel bakteri berlangsung cepat. Hasil yang diperoleh serupa dengan yang dilaporkan oleh Todorov et al. (2004) bahwa aktivitas tertinggi bakteriosin ST13BR yang diproduksi oleh Lactobacillus plantarum diperoleh pada akhir fase
logaritmik. Produksi optimum bakteriosin AMA-K yang diproduksi oleh L. plantarum diperoleh pada akhir fase logaritmik (Todorov 2008). Hasil yang
diperoleh pada isolat PG1.9 sejalan dengan yang dilaporkan oleh Gautam et al. (2014) bahwa produksi maksimum bakteriosin yang diproduksi oleh L. brevis UN diperoleh pada awal fase stasioner.
19 S. aureus dan E. coli. Akan tetapi, supernatan isolat PB3.6 dan PG1.9 juga menunjukkan adanya aktivitas antimikrob terhadap bakteri S. aureus dan E. coli. Kadar protein supernatan lebih rendah dibandingkan dengan endapan. Hal ini menunjukkan bahwa aktivitas antimikrob tersebut juga disebabkan oleh adanya aktivitas senyawa nonprotein yang dapat berupa asam organik yang terdapat pada supernatan.
Bakteriosin isolat PB3.6 memiliki aktivitas endapan tertinggi terhadap bakteri S. aureus pada konsentrasi amonium sulfat 40% sedangkan terhadap bakteri E. coli pada konsentrasi amonium sulfat 80%. Bakteriosin isolat PG1.9 memiliki aktivitas endapan tertinggi terhadap bakteri S. aureus dan E. coli pada konsentrasi amonium sulfat 70%. Berbagai penelitian melaporkan bahwa bakteriosin dapat mengendap pada konsentrasi amonium sulfat yang berbeda-beda. Bakteriosin yang diproduksi oleh L. plantarum ST13BR dan L. plantarum A-1 mengendap pada konsentrasi amonium sulfat 40% (Todorov et al. 2004; Hata et al. 2010), bakteriosin L. brevis MTCC 7539 pada konsentrasi amonium sulfat 70% (Gautam dan Sharma 2009), dan bakteriosin L. salivarius SMXD51 pada konsentrasi amonium sulfat 80% (Messaoudi et al. 2012). Penambahan amonium sulfat berfungsi untuk memisahkan senyawa protein dan nonprotein dengan cara mengendapkan protein dan mengurangi kelarutannya. Cara ini merupakan tahap awal purifikasi. Ketika kelarutan protein menurun, interaksi antara sisi hidrofobik akan membentuk agregat, lalu protein dari agregat tersebut yang mengandung molekul protein yang berukuran besar akan terendapkan dan menghasilkan lebih banyak endapan hingga konsentrasi maksimal. Konsentrasi optimum tersebut disebut tingkat kejenuhan (Scopes 1994).
Hasil pengendapan protein isolat PB3.6 dan PG1.9 dengan amonium sulfat menunjukkan adanya peningkatan kadar protein dan aktivitas endapan terhadap bakteri S. aureus dan E. coli dibandingkan dengan ekstrak kasar. Hal ini menegaskan dugaan bahwa senyawa protein yang dihasilkan oleh kedua isolat tersebut merupakan bakteriosin. Proses dialisis dilakukan untuk memisahkan garam amonium sulfat yang tersisa dari proses pengendapan. Akan tetapi setelah dilakukan dialisis, terjadi penurunan kadar protein dan aktivitas bakteriosin. Hal ini disebabkan kantong dialisis yang digunakan memuat protein dengan bobot molekul 12 kDa atau lebih besar sehingga kemungkinan sebagian bakteriosin keluar melalui pori kantong dialisis. Bakteriosin umumnya merupakan protein dengan bobot molekul rendah umumnya dengan bobot < 10 kDa (Jeevaratnam et al. 2005; Parada et al. 2007). Selain itu, volume bakteriosin meningkat setelah dialisis. Hal ini menunjukkan terjadinya proses pengenceran volume bakteriosin. Proses pengenceran tersebut menyebabkan menurunnya kadar protein dan aktivitas bakteriosin dibandingkan dengan presipitat bakteriosin.
20
membunuh bakteri target mereka, sebagai contoh bakteriosin kelas II seperti lactococcin A terikat pada reseptor pembentuk-pori mannose phosphotransferase system (Man-PTS). Nisin dan beberapa bakteriosin kelas I lainnya menghambat sintesis peptidoglikan dan membentuk pori-pori. Banyak bakteriosin yang menghambat bakteri Gram-negatif mengontrol bakteri target mereka dengan mengganggu metabolisme DNA, RNA dan protein, sebagai contoh microcin B17 (MccB17) menghambat DNA girase, MccJ25 menghambat RNA polimerase, dan MccC7-C51 menghambat aspartil-tRNA synthetase. Ada juga pengecualian, seperti MccE492, yang berperan melalui pembentukan pori (Cotter et al. 2013).
Bakteriosin hasil pengendapan isolat PB3.6 dan PG1.9 aktif menghambat bakteri S. aureus dan E. coli pada kisaran pH yang luas. Keduanya memiliki aktivitas penghambatan setelah diberi perlakuan pH 4-10 selama 30 menit. Aktivitas optimum kedua bakteriosin terhadap bakteri E. coli berada pada pH 4. Aktivitas optimum bakteriosin isolat PB3.6 terhadap bakteri S. aureus berada pada pH 6 sedangkan bakteriosin PG1.9 pada pH 7. Bakteriosin telah banyak dilaporkan memiliki aktivitas berbeda pada pH yang berbeda. Beberapa di antaranya aktif pada pH netral, ada pula yang aktif pada pH asam maupun basa (Gautam et al. 2014). Hasil yang sama juga dilaporkan oleh Todorov et al. (2013) bahwa bakteriosin L. sakei ST22Ch, ST153Ch, ST154Ch stabil pada pH 4-10. Bakteriosin L. brevis maksimum aktif pada pH 7 (Gautam dan Sharma 2009); (Gautam et al. 2014). Bakteriosin L. sakei MBSa1 stabil pada pH 2-6 (Barbosa et al. 2014), plantarisin ASM1 stabil pada pH netral dan basa (Hata et al. 2010). Stabilitas bakteriosin pada pH netral cocok untuk diaplikasikan pada produk makanan dengan pH netral dan dapat digunakan sebagai alternatif menggantikan nisin yang hanya aktif pada pH 5.0 dan 5.5 (Gautam et al. 2014).
Bakteriosin hasil pengendapan isolat PB3.6 dan PG1.9 aktif menghambat bakteri S. aureus dan E. coli pada kisaran suhu yang luas. Keduanya memiliki aktivitas penghambatan setelah diberi perlakuan renjatan panas pada suhu 50-100°C selama 10 menit. Meskipun terjadi penurunan aktivitas bakteriosin setelah diberi perlakuan panas, jika dibandingkan dengan kontrol, tetapi tidak ada perbedaan aktivitas yang signifikan pada renjatan panas 50-100°C. Berbagai laporan telah menyatakan bahwa beberapa bakteriosin stabil terhadap panas dan dapat bertahan pada panas tinggi 100°C bahkan hingga suhu autoklaf 121°C (Gautam et al. 2014). Bakteriosin L. brevis MTCC 7539 mempertahankan aktivitasnya hingga suhu 121°C selama 10 menit dan hingga 100°C selama 20 menit (Gautam dan Sharma 2009). Stabilitas terhadap suhu menjadi karakter yang penting jika bakteriosin akan digunakan sebagai pengawet, karena beberapa metode preparasi makanan melibatkan pemanasan (Ogunbanwo et al. 2003).
21
5
SIMPULAN DAN SARAN
Simpulan
Hasil isolasi bakteri asam laktat dari sawi asin diperoleh 66 isolat bakteri. Dua isolat terpilih memiliki kemampuan menghambat bakteri Staphylococcus aureus dan Escherichia coli. Identifikasi gen 16S rRNA menunjukkan bahwa isolat PB3.6 memiliki kemiripan 96% dengan Lactobacillus plantarum dan isolat PG1.9 memiliki kemiripan 98% dengan Lactobacillus brevis. Bakteriosin isolat PB3.6 dapat diendapkan pada konsentrasi amonium sulfat 40% dan 80% dan bakteriosin isolat PG1.9 dapat diendapkan pada konsentrasi amonium sulfat 70%. Bakteriosin isolat PB3.6 dan isolat PG1.9 memiliki aktivitas optimum pada pH 4 terhadap Escherichia coli dan terhadap Staphylococcus aureus pada pH 6 dan pH 7. Aktivitas bakteriosin menurun setelah diberi perlakuan panas, tetapi tidak ada perbedaan aktivitas yang signifikan pada renjatan panas 50-100°C.
Saran
Karakterisasi bakteriosin misalnya pengujian dengan enzim protease terhadap bakteriosin dari isolat terpilih perlu dilakukan dan dibandingkan dengan kontrol positif dari bakteriosin komersial. Stabilitas bakteriosin perlu pengujian secara langsung yang diinkubasi pada suhu 50-100°C selama masa inkubasi tertentu.
DAFTAR PUSTAKA
Axelsson L. 2004. Lactic acid bacteria: classification and physiology. Di dalam: Salminen S, Ouwehand A, Wright AV, editor. Lactic Acid Bacteria Microbiological and Functional Aspects. Edisi ke-3. New York (US): Marcel Dekker.
Bali V, Panesar PS, Bera MB. 2011. Isolation, screening and evaluation of antimicrobial activity of potential bacteriocin producing lactic acid bacteria isolate. Microbiol J. 1: 113-119.
Barbosa MS, Todorov SD, Belguesmia Y, Choiset Y, Rabesona H, Ivanova IV, Chobert JM, Haertle T, Franco BDGM. 2014. Purification and characterization of the bacteriocin produced by Lactobacillus sakei MBSa1 isolated from Brazilian salami. J Appl Microbiol. 116: 1195–1208.
Bergholz TM, Tang S, Wiedmann M, Boorb KJ. 2013. Nisin resistance of Listeria monocytogenes is increased by exposure to salt stress and is mediated via LiaR. Appl Environ Microbiol. 79: 5682–5688.
22
Chao SH, Wu RJ, Watanabe K, Tsai YC. 2009. Diversity of lactic acid bacteria in suan-tsai and fu-tsai, traditional fermented mustard products of Taiwan. lnt J Food Microbiol. 135: 203-210.
Cotter PD, Ross RP, Hill C. 2013. Bacteriocins – a viable alternative to antibiotics? Nature Rev Microbiol. 11: 95-105.
Crandall AD, Montville TJ. 1998. Nisin resistance in Listeria monocytogenes ATCC 700302 is a complex phenotype. Appl Environ Microbiol. 64: 231–237. Desniar, Rusmana I, Suwanto A, Mubarik NR. 2013. Characterization of lactic
acid bacteria isolated from an Indonesian fermented fish (bekasam) and their antimicrobial activity against pathogenic bacteria. Emir J Food Agric. 25: 484-494.
Djide MN, Wahyudin E. 2008. Isolasi bakteri asam laktat dari air susu ibu, dan potensinya dalam menurunkan kadar kolesterol secara in vitro. Majal Farm Falmakol. 12: 73-78.
Gao Y, Jia S, Gao Q, Tan Z. 2010. A novel bacteriocin with broad inhibitory spectrum produced by Lactobacillus sake C2, isolated from traditional Chinese fermented cabbage. Food Control. 21: 76-81.
Gautam N, Sharma N. 2009. Purification and characterization of bacteriocin produced by strain of Lactobacillus brevis MTCC 7539. Ind J Biochem Biophys. 46: 337-341.
Gautam N, Sharma N, Ahlawat OP. 2014. Purification and characterization of bacteriocin produces by Lactobacillus brevis UN isolated from Dhulliachar: a traditional food product of North East India. Ind J Microbiol. 54: 185-189. Harzallah D, Belhadj H. 2013. Lactic acid bacteria as probiotics: characteristics,
selection criteria and role in immunomodulation of human GI muccosal barrier. Di dalam: Kongo M, editor. Lactic Acid Bacteria – R & D for Food, Health and Livestook Purposes. Rijeka (HR): Intech.
Hata T, Tanaka R, Ohmomo S. 2010. Isolation and characterization of plantaricin ASM1: a new bacteriocin produced by Lactobacillus plantarum A-1. Int J Food Microbiol. 137: 94-99.
Jeevaratnam K, Jamuna M, Bawa AS. 2005. Biological preservation of foods-bacteriocins of lactic acid bacteria. Ind J Biotechnol. 4: 446-454.
Kawada-Matsuo M, Yoshida Y, Zendo T, Nagao J, Oogai Y, Nakamura Y, Sonomoto K, Nakamura N, Komatsuzawa H. 2013. Three distinct two-component systems are involved in resistance to the class I bacteriocins, nukacin ISK-1 and nisin A, in Staphylococcus aureus. PLoS ONE. 8: 1-10. Marchesi JR, Sato T, Weightman AJ, Martin TA, Fry JC, Hiom SJ, Wade WG.
1998. Design and evaluation of useful bacterium-specific pcr primers that amplify genes coding for bacterial 16S rRNA. Appl Environ Microbiol. 64: 795–799.
Messaoudi S, Kergourlay G, Dalgalarrondo M, Choiset Y, Ferchichi M, Prévost H, Pilet MF, Chobert JM, Manai M, Dousset X. 2012. Purification and characterization of a new bacteriocin active against Campylobacter produced by Lactobacillus salivarius SMXD51. Food Microbiol. 32: 129-134.
23 Ogunbanwo ST, Sanni AI, Onilude AA. 2003. Characterization of bacteriocin produced by Lactobacillus plantarum F1 and Lactobacillus brevis OG1. Afr J Biotechnol. 2: 219-227.
Ouwehand AC dan Vesterlund S. 2004. Antimicrobial components from lactic acid bacteria. Di dalam: Salminen S, Wright AV, Ouwehand A, editor. Lactic Acid Bacteria Microbiological and Functional Aspects. Edisi ke-3. New York (US): Marcel Dekker.
Paneri PF, Christaki E, Bonos E. 2013. Lactic acid bacteria as source of functional ingredients. Di dalam: Kongo M, editor. Lactic Acid Bacteria – R & D for Food, Health and Livestook Purposes. Rijeka (HR): Intech.
Parada JL, Caron CR, Medeiros ABP, Soccol CR. 2007. Bacteriocins from lactic acid bacteria: purification, properties and use as biopreservatives. Braz Arch Biol Technol. 50: 521-542.
Puspito H, Fleet GH. 1985. Microbiology of sayur asin fermentation. Appl Microbiol Biotechnol. 22: 442-445.
Sambrook J, Russell DW. 2001. Molecular Cloning a Laboratory Manual. Edisi ke-3. New York (US): Cold Spring Harbor Laboratory Pr.
Scopes RK. 1994. Protein Purification: Principle and Practice. Edisi ke-3. New York (US): Springer-Verlag.
Sulistiani, Abinawanto, Sukara E, Salamah A, Dinoto A, Mangunwardoyo W. 2014. Identification of lactic acid bacteria in sayur asin from Central Java (Indonesia) based on 16S rDNA sequence. Int Food Res J. 21: 527-532.
Sun Z, Zhong J, Liang X, Liu J, Chen X, Huan L. 2009. Novel mechanism for nisin resistance via proteolytic degradation of nisin by the nisin resistance protein NSR. Antimicrob Agents Chemother. 53: 1964 – 1973.
Tagg JR, Dajani AS, Wannamaker LW. 1976. Bacteriocins of Gram-positive bacteria. Bacteriol Rev. 40: 722-756.
Todorov SD, van Reenan CA, Dicks LMT. 2004. Optimization of bacteriocin production by Lactobacillus plantarum ST13BR, a strain isolated from barley beer. J Gen Appl Microbiol. 50: 149-157.
Todorov SD. 2008. Bacteriocin production by Lactobacillus plantarum AMA-K isolated from Amasi, a Zimbabwean fermented milk product and study of the adsorption of bacteriocin AMA-K to Listeria sp. Braz J Microbiol. 39: 178-187. Todorov SD. 2009. Bacteriocins from Lactobacillus plantarum – production,
genetic organization and mode of action. Braz J Microbiol. 40: 209-221.
Todorov SD, Vas-Velho M, Franco BDGM, Holzapfel WH. 2013. Partial characterization of bacteriocins produced by three strains of Lactobacillus sakei, isolated from salpicao, a fermented meat product from North-West of Portugal. Food Control. 30: 111-121.
Vignolo G, Palacios J, Farias ME, Sesma F, Schillinger U, Holzapfel W, Oliver G. 2000. Combined effect of bacteriocins on the survival of various Listeria species in broth and meat system. Curr Microbiol. 41: 410-416.
24
25
LAMPIRAN
Lampiran 1 Aktivitas antimikrob isolat bakteri asam laktat terhadap bakteri S. aureus dan E. coli
Kode Isolat Indeks Penghambatan (IP)
26
Keterangan: Isolat yang diuji lebih lanjut aktivitas supernatannya terhadap bakteri S. aureus dan E. coli
Lampiran 2 Metode pengukuran kadar protein (Bradford 1976) Pereaksi Blanko
27 Kurva standar Bovine Serum Albumin (BSA)
Konsentrasi BSA (mg/ml)
Absorbansi ( 5λ5 nm)
Ulangan 1 Ulangan 2 Rata-rata
0 0.000 0.000 0.000
0.01 0.079 0.039 0.059
0.02 0.148 0.162 0.155
0.03 0.210 0.233 0.222
0.04 0.294 0.296 0.295
30
RIWAYAT HIDUP
Penulis dilahirkan di Enrekang pada tanggal 23 September 1990 sebagai anak pertama dari tiga bersaudara dari pasangan ayah Guntur Mula dan ibu Rachmiah Husain. Pendidikan sarjana (S1) ditempuh di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Hasanuddin, lulus pada tahun 2012. Pada tahun 2013, penulis diterima di Program Studi Mikrobiologi (MIK) pada Sekolah Pascasarjana IPB dengan beasiswa pendidikan pascasarjana dalam negeri (BPPDN) calon dosen DIKTI tahun 2013.
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains (MSi),
penulis melakukan penelitian dengan judul “Karakterisasi Bakteriosin Bakteri