Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006
RINGKASAN
Penelitian tahun I mempunyai tujuan: memperoleh data keragaman bakteri kitinolitik
baik keragaman morfologi, biokimia, dan genetik; mengetahui aktifitas kitinase dari bakteri
yang diisolasi; dan mengetahui indikasi awal kemampuan menghambat pertumbuhan beberapa
jamur patogen tanaman dari bakteri yang diisolasi.
Untuk mencapai tujuan di atas dilakukan pekerjaan antara lain: melakukan penapisan
bakteri kitinolitik dari berbagai sumber, melakukan pengamatan morfologi dan biokimia
bakteri kitinolitik,mengukur aktifitas kitinase, melakukan uji indikasi penghambatan
pertumbuhan jamur patogen oleh bakteri kitinolitik, dan melihat keragaman genetik bakteri
kitinolitik. Semua pekerjaan ini sedang dan sudah dilakukan kecuali melihat keragaman
genetik.
Dari penelitian tahun I didapat sebanyak 41 bakteri kitinolitik yang berhasil diisolasi
dengan variasi bentuk dan warna koloni, bentuk sel, dan sifat biokimianya. Dari isolat yang
telah diuji terdapat 3 isolat yang memiliki aktifitas kitinase kasar tertinggi masing-masing
isolat BKO1, BKO2, dan PSO1. Pengujian isolat bakteri terhadap Jamur F. semitectum
mengindikasikan ada 5 isolat yang memperlihatkan kemampuan menghambat pertumbuhan
jamur tersebut.
Telaah yang dilakukan dalam penelitian ini pada gilirannya diharapkan memberikan informasi
tentang biodiversitas mikroba yang memiliki potensi (bioprospecting) sebagai model bagi
upaya pengelolaan sumber daya hayati khususnya di Sumatera, dengan keluaran yang
diharapkan berupa diketahuinya mikroba novel, dan diketahuinya mikroba yang mempunyai
potensi untuk dikembangkan sebagai agensia pengendali hayati jamur patogen tanaman dan
untuk dikembangkan di bidang industri terkait, baik dalam bentuk massa sel, enzim, atau gen.
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006
DAFT AR ISI
Halaman
LEMBAR IDENTITAS DAN PENGESAHAN ... ii
RINGKASAN... ... .... ... iii
PRAKA T A ... ... . ... ... ... iv
DAFT AR ISI... v
DAFT AR T ABEL ... ... vi
DAFT AR GAMBAR ... ... ... ... vii
DAFT AR LAMPI RAN... ... ... viii
I. PENDAHULUAN... ... 1
II. TUJUAN DAN MANFAAT PENELITIAN TAHUN KE-1 ... 4
III. TINJAUAN PUST AKA ... ... ... ... 5
IV. METODE PENELITIAN ... ... ... 10
V. HASIL DAN PEMBAHASAN ... ... ... 13
VI.KESIMPULAN DAN SARAN ... 21
VII.RENCANAIPENELITJAN TAHUN II... 22
DAFTAR PUST AKA ... ... ... ... .. ... ... ... ... 23
LAMPI RAN ... ... ... ... ... ... 26
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006
DAFT AR T ABEL
Halaman
Tabel 1. Hasil isolasi dan pengamatan morfologi serta uji biokimia
sederhana... 14
Tabel 2. Pengujian aktivitas kitinase bakteri kitinolitik setelah diinkubasi
selama 96 jam secara kualitatif ... 15
Tabel 3. Pengukuran aktivitas kitinase kasar pada sam pel secara
Kuantitatif……….. 18
Tabel 4. Pengujian kemampuan daya hambat isolat bakteri kitinolitik
terhadap pertumbuhan beberapa jamur patogen... 19
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006
DAFT AR GAMBAR
Halaman
Gambar 1. Rantai polimer kitin ... ... 5
Gambar 2. Sel isolat Bangka 01, Bangka 02, dan Sidimpuan
diamati dengan mikroskop cahaya (perbesaran 10 x 100)... 17
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006
I. PENDAHULUAN
Sebagai salah satu negara dengan biodiversitas sangat besar karena keragaman
lingkungan, Indonesia menyediakan banyak sumber isolat mikroba yang memiliki nilai
ekonomi penting. Pencarian isolat-isolat yang dapat digunakan dalam industri seperti isolat
yang mampu menghasilkan enzim-enzim komersial perlu diupayakan. Salah satu pendekatan
yang dapat dilakukan untuk mengeksplorasi kapasitas metabolisme mikroba adalah dengan
cara mempelajari gen yang menyandi enzim yang terlibat dalam proses-proses kimiawi khusus
(Cottrell et al. 2000).
Banyak organisme seperti bakteri, jamur, tumbuhan tingkat tinggi, dan hewan
menghasilkan kitinase yang mengkonversi kitin menjadi monomer atau oligomernya (Wen et
al. 2002; Tsujibo et a/. 2003). Organisme ini biasanya memiliki beragam gen kitinase yang
ekspresinya diinduksi oleh ekstraseluler kitin atau derivatnya. Bakteri memanfaatkan kitinase
untuk asimilasi kitin sebagai sumber karbon dan nitrogen. Pada tumbuhan, enzim ini
digunakan sebagai pertahanan melawan serangan organisme patogen yang mengandung kitin
(Fujii and Miyashita 1993; Wu et al. 2001). Jamur dan serangga menggunakan enzim ini
untuk morfogenesis dinding sel dan pembangun eksoskeleton (Shaikh and Desphande 1993).
Mengingat jumlah kitin yang melimpah di alam sebagai komponen penyusun dari berbagai
organisme, kitin diproduksi secara terus menerus. Dengan demikian kitin merupakan substrat
yang selalu tersedia sehingga sebagian mikroba tanah dan air merupakan pendegradasi kitin
yang baik.
Bakteri kitinolitik menarik untuk diisolasi karena kemampuannya dalam menghidrolisis
kitin menjadi derivat kitin. Derivat ini banyak dimanfaatkan dalam berbagai bidang seperti
biokimia, bioteknologi, farmakologi, medis, dan industri, misalnya sebagai bahan kosmetik,
kapsul obat, dan makanan hewan (Muzzarelli 1985). Kitin atau derivatifnya digunakan sebagai
bahan bakar biologis atau sebagai bahan berharga lainnya dalam industri seperti obat
anti-inflamatori, immunoajuvan, antitumor, flokulan dalam pengolahan limbah, agensia anti fungi
atau arthropoda hama, dan teknologi protoplast fungi (Sakka et al. 1991; Shaikh and
Deshpande 1993; Ohno at al. 1996; Patil at al. 2000).
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006
Bakteri kitinolitik juga berperan dalam pengendalian hama dan penyakit tanaman. Pleban et
al. (1997) melaporkan Bacillus cereus strain 65 dapat melindungi tanaman kapas dari penyakit
busuk akar oleh Rhizoctonia solani.
Untuk mengaksas gen-gen kitinase pada bakteri dapat dilakukan dengan menggunakan
pendekatan PCR-based dengan primer konservatif (Cottrell et al. 2000). Kitinase terdapat
tersebar mulai dari bakteri, serangga, virus, tumbuhan, dan hewan (Fujii and Miyashita 1993;
Ohno et al. 1996), dan memainkan peran yang penting dalam fisiologi dan ekologi (Ohno et
al. 1996; Saito et al. 2001). Hal ini mungkin berhubungan dengan tersebarnya bahan kitin di
alam seperti pada jamur, alga, nematoda, kelompok artropoda dan krustacea, mollusca,
coelenterata, protozoa, dan fungi (Folders et al. 2001; Orikoshi et al. 2003). Meski demikian
gen-gen penyandi kitinase bagi organisme merupakan gen non esensial (Cottrell et al. 2000).
Metihat kenyataan ini eksplorasi kitinase dapat dilakukan dimana saja mulai dari tanah,
rizosfer, air tawar, air laut, dan tumbuhan. Akhir-akhir ini, kitinase kembali menjadi perhatian
karena adanya kemungkinan penggunaan enzim ini dalam pengendalian biologi organisme
yang mengandung kitin dan juga untuk eksploitasi bahan kitin alami (Ohno et al. 1996),
disamping kegunaan dalam bidang farmasi, dan industri (Sakka et al. 1991).
Karena besarnya keragaman struktur cincin yang ada, tidak mengejutkan bahwa bakteri
seringkali menghasilkan beberapa kitinase sekaligus (Svitil et al. 1997). Variasi dan korelasi
dari gen-gen non esensial dengan filogeni gen rRNA-nya bisa jadi berbeda dari filogeni gen
rRNA dari gen-gen esensial (Cottrell et al. 2000). Meskipun primer umum untuk gen kitinase
belum bisa dirancang karena beragamnya gen ini (Fujii and Miyashita 1993; Svitil et al. 1997;
Cotrell et al. 1999; Cottrell et al. 2000), namun dengan mengkaji semua bakteri penghasil
kitinase boleh jadi konservasi gen di antara semua bakteri ini makin jelas (Cottrell et al. 1999).
Kajian mengenai konservasi gen penghasil kitinase dapat dilakukan dengan membandingkan
gen-gen melalui amplifikasi dengan menggunakan beberapa primer sekaligus (Cottrell et al.
2000).
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006 Subjek penelitian
Uji aktifitas kitinase dari bakteri, uji kemampuan menghambat pertumbuhan beberapa
jamur patogen tanaman dari bakteri kitinolitik yang telah diisolasi, dan biologi molekuler
keragaman bakteri kitinolitik.
Lokasi penelitian
Laboratorium Mikrobiologi PS Biologi FMIPA, USU, Medan
Laboratorium Biologi RCMD FMIPA IPB, Bogor
Hasil yang ditargetkan
Tahun I: Memperoleh data keragaman bakteri kitinolitik baik keragaman morfologi,
biokimia, dan genetik.
Mengetahui aktifitas kitinase dari bakteri yang diisolasi
Mengetahui indikasi awal kemampuan menghambat pertumbuhan beberapa jamur
patogen tanaman dari bakteri yag diisolasi
Tahun II: Memperoleh gambaran dari kemampuan atau aktifitas masing-masing bakteri
kitinolitik dalam mendegradasi kitin dari beberapa jamur patogen tanaman pada
kondisi lingkungan (pH, suhu, dan kadar garam) yang berbeda.
Mengetahui gen penyandi bakteri kitinolitik yang potensial dalam mengendalikan
pertumbuhan jamurpatogen tanaman.
Keterlibatan mahasiswa
Penelitian ini melibatkan beberapa orang mahasiswa S1 PS Biologi FMIPA Universitas
Sumatera Utara untuk penyelesaian skripsi. Melalui proyek ini telah 1 orang mahasiswa
menyelesaikan studi S1. Satu orang mahasiwa baru mulai melakukan penelitian. Diharapkan
beberapa mahasiswa lagi pada tahun II terlibat dalam penelitian ini.
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006
II. TUJUAN DAN MANFAAT PENELITIAN TAHUN KE-1
TUJUAN KHUSUS
Penelitian ini bertujuan untuk memperoleh data keragaman morfologi, biokimia, dan
genetik bakteri kitinolitik, dan mengetahui aktifitas enzim kitinase dari bakteri hasil isolasi,
danmengetahui indikasi awal kemampuan bakteri kitinolitik dalam menghambat pertumbuhan
beberapa jamur patogen tanaman.
MAN FAAT PENELITIAN
Secara umum penelitian tentang biokimia dan biologi molekular kitinase di Indonesia
seringkali ditekankan hanya pada 1 jenis kitinase yang berasal dari satu bakteri atau dari satu
sumber (contoh Wenuganen 1997; Yurnaliza 2001). Telaah lebih menyeluruh akan
memberikan gambaran sebaran gen ini di lingkungan serta memberikan pilihan yang lebih
banyak dalam upaya pemanfaatan sumber daya genetik khususnya gen-gen kitinase untuk
tujuan ilmu pengetahuan dan komersial seperti untuk agensia anti fungi atau arthropoda hama,
obat anti-inflamatori, immunoajuvan, antitumor, flokulan dalam pengolahan limbah, dan
teknologi protoplast fungi (Sakka et al. 1991; Shaikh & Deshpande 1993; Ohno et al. 1996;
Patil et al. 2000) di Indonesia.
Pemanfaatan mikroorganisme untuk mengendalikan penyakit tanaman merupakan
bidang yang relatif baru. Pengendalian hayati jamur penyakit tanaman acap dilakukan dengan
menggunakan mikroorganisme seperti jamur dan bakteri. Sekitar 40 produk pengendalian
hayati penyakit tanaman kini beredar di dunia (Fravel et al. 1998), tidak diketahui mengenai
produk serupa yang berasal dari Indonesia.
Telaah yang akan dilakukan ini pada gilirannya diharapkan memberikan informasi
tentang biodiversitas mikroba yang memiliki potensi (bioprospecting) sebagai model bagi
upaya pengelolaan sumber daya hayati khususnya di Sumatera. Keluaran yang diharapkan
berupa diketahuinya mikroba novel, dan diketahuinya mikroba yang mempunyai potensi untuk
dikembangkan sebagai agensia pengendali hayati jamur patogen tanaman dan untuk
dikembangkan di bidang industri terkait, baik dalam bentuk massa sel, enzim, atau gen.
III. TINJAUAN PUSTAKA
Struktur dan Sumber-Sumber Kitin di Alam
Kitin mempunyai rumus empiris (C6H9O4.NHCOCH3)n, merupakan zat padat yang
tidak larut dalam air, pelarut organik, alkali pekat, asam mineral lemah, tetapi larut dalam
asam-asam mineral yang pekat. Polisakarida ini mempunyai berat molekul tinggi dan
merupakan polimer berantai lurus dengan nama lain -(1-4 )-2-asetamida-2-dioksi-D-glukosa
(N-asetil-D-Glukosamin).
Rantai kitin antara satu dengan yang lainnya berasosiasi dengan ikatan hidrogen yang
sangat kuat antara gugus N-H dari satu rantai dan gugus C=O dari rantai yang berdekatan.
Ikatan hidrogen menyebabkan kitin tidak dapat larut dalam air dan membentuk formasi
serabut (fibril). Berdasarkan penyusun rantai polimernya, kitin fibril dibedakan menjadi tiga
jenis yaitu -kitin, -kitin dan -kitin (Cabib 1987).
Pada serangga lebih dari 80% komponen kutikulanya merupakan kitin. Pada Crustacea,
kitin melekat pada suatu matriks dari CaCO3 dan fosfat. Pada serangga matriksnya berupa
proteinaceous yaitu protein yang sudah mengalami pentaninan (Cabib 1987). Kitin pada alga
terutama ditemukan pada diatom laut dengan kandungan 10-15% berat kering. Lebih dari
80.000 ton kitin per tahun dihasilkan di perairan (Patil et al. 2000). Kitin pada jamur
berbentuk mikrofibril yang memiliki panjang yang berbeda tergantung pada spesies dan lokasi
selnya. Mikrofibril merupakan struktur utama dari dinding sel jamur yang terdiri atas jalinan
rantai polisakarida yang saling bersilangan membentuk anyaman. Kandungan kitin pada jamur
bervariasi dari 4-9% berat kering sel (Rajarathanam et al. 1998).
5
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006 Kitinase
Sistem tata nama kitinase masih menimbulkan kerancuan. Harman et a/. (1993) serta
Sahai and Manocha (1993) membagi kitinase dalam tiga tipe yaitu:
1. Endokitinase (EC 3.2.1.14), yaitu kitinase yang memotong secara acak ikatan -1,4 bagian
internal mikrofibril kitin. Produk akhir yang terbentuk bersifat mudah larut berupa
oligomer pendek N-asetilglukosamin (GIcNAc) yang mempunyai berat molekul rendah
seperti kitotetraose.
2. Eksokitinase (EC 3.2.1.14) dinamakan juga kitobiosidase atau kitin 1,4- -kitobiosidase,
yaitu enzim yang mengkatalisis secara aktif pembebasan unit-unit diasetilkitobiose tanpa
ada unit-unit monosakarida atau oligosakarida yang dibentuk. Pemotongan hanya terjadi
pada ujung non reduksi mikrofibril kitin dan tidak secara acak.
3. -1,4-N-asetilglukosaminidase (EC 3.2.1.30) merupakan suatu kitinase yang bekerja pada
pemutusan diasetilkitobiose, kitotriose, dan kitotetraose dengan menghasilkan
monomer-monomer GIcNAc.
Kitinase telah banyak dilaporkan dan diklasifikasikan dalam dua famili yaitu 18 dan 19
berdasarkan kemiripan sekuen asam amino (Tsujibo et al 2003). Famili 18 meliputi kitinase
dari virus, bakteri, jamur, dan hewan, serta klas III dan V kitinase dari tumbuhan. Famili 19
mencakup klas I, II dan IV telah diidentifikasi dari tumbuhan. Baru-baru ini ditemukan klas IV
famili 19 yang tersebar luas pada Streptomyces sp. (Watanabe et a/., 1999). Famili 18 dibagi
dalam tiga subfamili yaitu A, B, dan C (Gao et a/. 2003).
Bakteri kitinolitik seringkali menghasilkan berbagai gen kitinase, walaupun konstribusi
enzim untuk degradasi kitin belum diketahui seeara menyeluruh (Tsujibo et a/. 2003). Kitinase
yang dihasilkan mikroba memiliki berat molekul yang berkisar antara 20.000-120.000. Pada
bakteri berat molekulnya antara 60.000-110.000, sedangkan aktinomisetes yaitu 30.000 atau
lebih rendah. Pada jamur berat molekulnya lebih tinggi dari 30.000 dan pada tumbuhan sekitar
30.000 (Wang and Chang 1997).
Mikroba Yang Menghasilkan Kitinase
Aktinomisetes, bakteri, dan jamur merupakan organisme yang mampu memanfaatkan
kitin sebagai sumber karbon dan nitrogen. Genus bakteri yang sudah banyak dilaporkan
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006
memiliki kitinase antara lain Aeromonas, Alteromonas, Chromobacterium, Enterobacter,
Ewingella, Pseudoalteromonas, Pseudomonas, Serratia, Vibrio (Chernin et al., 1998),
Bacillus (Pleban et al. 1997), dan Pyrococcus (Gao et al. 2003).
Koloidal kitin merupakan salah satu substrat yang dapat digunakan untuk menginduksi
kitinase pada bakteri, jamur, dan aktinomisetes. Substrat ini mampu menginduksi enzim
hidrolitik seperti N-asetilglukosamin, endokitinase dan kitobiosidase pada Aeromonas caviae
(Inbar and Chet 1991), Enterobacter agglomerans (Chernin et a/. 1995), dan Bacillus cereus
(Pleban et a/. 1997).
Pengukuran Aktivitas Kitinase
Pengukuran aktivitas kitinase dalam memecah substrat dapat dilakukan dengan
beberapa cara seperti yang disebutkan dalam Jeaniaux (1966) dan Cabib (1987), yaitu:
1. Berdasarkan pengurangan substrat
a. Metode viskosimetri yaitu aktivitas kitinase terhadap kitosan, glikol kitin atau
karboksimetil kitin yang ditunjukkan oleh terjadinya penurunan viskositas substrat.
b. Metode nefelometri (turbidimetri) yaitu pengukuran variasi kekeruhan suspensi koloidal
kitin selama kitinolisis. Metode ini bersitat cepat dan akurat tetapi hanya cocok untuk
enzim dengan aktivitas relatif tinggi.
2. Berdasarkan pembentukan produk akhir yaitu GIcNAc yang dibebaskan dari kitin dapat
ditentukan dengan metode kolorimetrik dengan penambahan p-dimetilaminobenzaldehida
(Metode Reissig, 1955). Satu unit aktivitas kitinase dinyatakan sebagai mol GlcNAc yang
dibebaskan selama 1 jam dalam kondisi yang ditetapkan.
3. Pengujian spektrofotometri yaitu menggunakan kromogen
3,4-dinitrofenil-tetra-N-asetikitotetraose sebagai substrat.
4. Pengujian sensitifitas kitinase menggunakan radiometri yaitu substrat diberi label 14C atau
3
H. Kadar produk diuji dengan menentukan radioaktifitasnya setelah penghilangan kitin
yang belum dipecah dengan penyaringan atau dengan cara disentrifugasi.
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006
Manfaat Kitinase dan Bakteri Kitinolitik
Kitinase terdapat tersebar mulai dari bakteri, serangga, virus, tumbuhan, dan hewan
(Fujii & Miyashita 1993; Ohno et al. 1996), dan memainkan peran yang penting dalam
fisiologi dan ekologi (Ohno et a/. 1996; Saito et a/. 2001). Hal ini mungkin berhubungan
dengan tersebarnya bahan kitin di alam seperti pada jamur, alga, nematoda, kelompok
artropoda dan krustacea, mollusca, coelenterata, protozoa, dan fungi (Folders et al. 2001;
Orikoshi et a/. 2003). Meski demikian gen-gen penyandi kitinase bagi organisme merupakan
gen non esensial (Cottrell et al. 2000). Melihat kenyataan ini eksplorasi kitinase dapat
dilakukan dimana saja mulai dari tanah, rizosfer, air tawar, air laut, dan tumbuhan.
Kitinase berguna dalam produksi kitooligosakarida. Kitooligosakarida berperan sebagai
pertahanan tanaman, juga digunakan dalam kesehatan manusia. Sebagai contoh, kitoheksaose
dan kitoheptaose memperlihatkan aktivitas anti tumor. GlcNAc berguna sebagai obat anti
inflamasi. Senyawa ini dalam tubuh manusia disintesis dari glukosa dan digabungkan dengan
glikoprotein dan glikosaminoglikan (Patil et al. 2000).
Dalam teknologi protoplas jamur, dibutuhkan bantuan kitinase untuk mengisolasi
protoplas jamur. Protoplas digunakan untuk mempelajari sintesis dinding sel, sekresi enzim,
transformasi steroid, dan mutagenesis. Kitinase juga berperan dalam produksi protein sel
tunggal dari limbah kitin untuk makanan hewan (Shaikh and Desphande, 1993).
Kitinase digunakan dalam pertanian sebagai pengendalian jamur patogen tanaman dan
hama serangga. Organisme ini memiliki kitin pada penutup tubuhnya sehingga dapat
didegradasi oleh enzim tersebut (Patil et al. 2000). Pseudomonas flourescens dapat
mengendalikan Pythium ultimum dan Rhizoctonia solani dengan menekan pertumbuhannya
(Nielsen et al. 1998). Sampson and Gooday (1998) meneliti kitinase dari Bacillus
thuringiensis yang diujikan terhadap Culicoides nubeculosus dan Spodoptera littoralis,
sedangkan Regev et al. (1996), meneliti sinergisme -endotoksin B. thuringiensis dan
endokitinase bakteri terhadap larva S. littoralis. Menurut mereka kitinase yang dihasilkan
bakteri dapat membunuh serangga sehingga dapat dijadikan agen pengendali biologis.
Kombinasi dari -toksin dan kitinase dilaporkan lebih efektif dalam membunuh hama
serangga (Patil et al. 2000).
Akhir-akhir ini, kitinase kembali menjadi perhatian karena adanya kemungkinan
penggunaan enzim ini dalam pengendalian biologi organisme yang mengandung kitin seperti
jamur dan serangga dan juga untuk eksploitasi bahan kitin alami (Ohno et al. 1996),disamping
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006
kegunaan dalam bidang farmasi, dan industri (Sakka et al. 1991).
Pengendalian hayati jamur dengan menggunakan mikroorganisme kitinolitik didasarkan
pada kemampuan mikroorganisme menghasilkan kitinase dan -1,3-glucanase yang dapat
melisis sel jamur (EI-Katatny et al. 2000). Kemampuan kitinolitik bakteri Aeromonas caviae
telah digunakan untuk mengendalikan beberapa jamur patogen tanaman (Inbar & Chet 1995).
Galur Serratia marcescens telah dimanfaatkan untuk mengendalikan jamur patogen seperti
Sclerotium rolfsii (Ordentlich et al. 1988). Gen chiA dari S. marcescens telah pula
dimanfaatkan melalui kloning pada Pseudomonas fIuorescens (Downing & Thomson 2000).
Bakteri lain yang juga digunakan sebagai pengendali hayati komersial seperti P. syringae,
Burkholderia cepacia, Bacillus subtilis, Agrobacterium radiobacter, Enterobacter cloacae,
dan Streptomyces griseoviridis (Fravel et al 1998; McQuilken et at. 1998). Strategi untuk
seleksi strain mikroorganisme berdasarkan kepada kriteria kemampuan kolonisasi,
kemampuan kompetisi dan kemampuan menyesuaikan diri di lingkungan. (McQuilken et al.
1998).
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006
IV. METODE PENELITIAN
Pengambilan Contoh
Contoh diambil dari berbagai habitat. Untuk bakteri tanah, contoh diambil di permukaan
tanah, rizosfer, atau lumpur perairan. Untuk bakteri pada tumbuhan diambil di lubang
tampungan air di pohon atau dalam tumbuhan pemakan serangga (Nephentes sp.). Sampai saat
ini telah diperoleh isolat bakteri kitinase dari tanah pertanian, tanah lumpur, dan lubang
tampungan air di pohon. Pengambilan contoh tanah, tumbuhan, dan air seperti dari hutan
Taman Nasional Gunung Leuser (TNGL) Tangkahan Langkat dan Taman Nasional Batang
Gadis Madina telah dilakukan. Pekerjaan isolasi sampai saat ini tetap masih dilakukan
Penapisan Bakteri Penghasil Kitinase
Bakteri kitinolitik biasa dijejak dengan pembentukan zona bening pada medium kitin
atau dengan melihat kemampuan hidrolisis pada subtrat fluorogenik analog kitin (Cotrell et al.
1999). Dalam penelitian ini mikroba kitinolitik ditapis dengan menggunakan medium
mengandung kitin. Mikroba diisolasi dari contoh dengan menggunakan medium garam
koloidal kitin disesuaikan dengan kondis! lingkungan (kadar garam dan pH) dari mana isolat
berasa!. Pembentukan halo di sekitar koloni sebagai hasil degradasi kitin dievaluasi. Nilai
aktivitas hidrolisis secara kualitatif diperoleh dengan membagi diameter zona hidrolisis di
sekitar koloni dengan besarnya diameter koloni isolat pada hari ke-4 (96 jam) setelah inkubasi
(Widhyastuti and Dewi, 2001). Aktivitas enzim kasar kultur bebas sel ditentukan dengan
menggunakan substrat koloidal kitin. Aktivitas khitinase dihitung berdasarkan selisih antara
kadar N-asetil glukosamin (GlcNAc) yang dibebaskan pada perlakuan dengan kadar GlcNAc
yang terdapat dalam kitinase kasar yang tidak diperlakukan (kontrol). GlcNAc yang dihasilkan
dianalisis secara kolorimetri dengan metode Reissig (1955) dalam Jeaniaux (1966).
Penampakan Morfologi dan Uji Biokimia Bakteri Penghasil Kitinase
Karakterisasi sifat morfoJogi mencakup bentuk dan warna koloni, motilitas, bentuk sel,
dan sifat gram. Motilitas diamati dengan menggunakan medium semi padat sulfide indole
motility (SIM). Pewarnaan Gram dengan menggunakan kristal violet dan safranin digunakan
untuk menentukan sifat gram. Sifat biokimia yang diamati mencakup uji sitrat dengan medium
Simmons' Citrate agar, uji gelatin dengan medium nutrien gelatin, dan uji katalase dengan
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006
menggunakan larutan 3% H2O2 (Cappuccino and Sherman, 1983).
Pengukuran Aktivitas Kitinase Kasar
Kitinase kasar diperoleh dari kultur 96 jam (Pleban et al., 1997). Kitinase kasar dari
masing-masing Isolat dan substrat kitin (1% koloidal kitin (b/v) dalam 50 mM buffer fosfat,
pH 6,8) dicampur dengan volume yang sama dan diinkubasi pada suhu 37°C selama 60 menit.
Reaksi dihentikan dengan memanaskan campuran dalam air mendidih selama 15 menit dan
kemudian disentrifugasi pada kecepatan 3000 rpm selama 20 menit. Aktivitas khitinase
dihitung berdasarkan selisih antara kadar N-asetil glukosamin (GlcNAc) yang dibebaskan
pada perlakuan dengan kadar GlcNAc yang terdapat dalam kitinase kasar yang tidak
diperlakukan (kontrol). GlcNAc yang dihasilkan dianalisis secara kolorimetri dengan metode
Reissig (1955) dalam Jeaniaux (1966). Satu unit aktivitas kitinase didefenisikan sebagai
jumlah enzim yang membebaskan sebanyak 1 mol GlcNAc/jam pada kondisi tertentu (Singh
et al., 1999).
Uji Penghambatan Pertumbuhan Beberapa Jamur Patogen Tanaman
Hifa jamur Fusarium semitectum, Ganoderma boninense, dan Penicillium citrinum
yang ditumbuhkan dalam media nutrien broth yang ditambah dengan 3% potato dextrose agar
diambil seukuran 0.5x0.5 em, kemudian dikulturkan dalam media garam kitin. Inkubasi
dilakukan pada suhu kamar (28°C) selama 2 hari. Setelah jamur terlihat tumbuh kira-kira 0.5
cm dari hifa-terluar digores lurus bakteri kitinolitik dari hasil isolasi. Pengamatan dilakukan
dengan melihat ada tidaknya zona hambat pertumbuhan setelah diinkubasi selama 2 hari.
Ekstraksi DNA
DNA genom total dari bakteri terkulturkan akan diekstraksi sebagai yang digambarkan
oleh Sambrook et al. (1989).
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006
Melihat Keragaman Genetik Bakteri Penghasil Kitinase Melalui Gen 168 rRNA
Amplifikasi gen 16S-rRNA dilakukan dengan primer 63f dan 1387r (Marchesi et al.,
1998) menggunakan Ready- To-GO PCR Beads (Pharmacia-Biotech, Uppsala, Sweden). DNA
yang teramplifikasi akan diklon pada pGEM-T dan ditransfer dalam E. coli DH5
menggunakan metode yang digambarkan oleh Sambrook et al. (1989). Analisis Restriction
Fragment Length Polymorphism (RFLP) dilakukan dengan menggunakan metode seperti yang
dilakukan oleh Desiliyarni et al. (1999) dengan elekroforesis minigel. Hubungan kekerabatan
antar isolat dianalisis dengan program komputer Treecon (Van de Peer and De Wachter 1994).
Isolat dengan pola pita yang berbeda digunakan untuk analisis selanjutnya.
Hambatan Dalam Pekerjaan
Sangat terlambatnya pencairan dana penelitian menyebabkan berubahnya beberapa
rencana pekerjaan dalam hal metode dan waktu pelaksanaan. Dana penelitian baru diterima
peneliti tanggal 13 September 2005, sedang laporan kemajuan harus diserahkan ke LP USU
paling lambat tanggal 20 September 2005. Namun demikian perubahan rencana pekerjaan dan
jadwal tidak merubah keseluruhan ini dari penelitian ini. Diharapkan sekali untuk tahun-tahun
berikutnya dana penelitian dapat diterima peneliti secepat mungkin.
Seberapa pekerjaan dalam metode yang berubah mencakup tidak digunakannya
substrat p-nitrophenyl-N-acetyl- -D-glucosamine (pNP-GlcNAc) dan p-nitrophenyl-
-D-N,N',N"-triacetylchitotriose [pNP-(GlcNAc)3 seperti yang dilakukan Folders et al. (2001)
untuk mengukur aktivitas eksokitinase dan endokitinase. Dalam tahap pengerjaan Saat ini
dilakukan uji penghambatan pertumbuhan terhadap jamur patogen tanaman seperti Fusarium
semitectum, Ganoderma boninense, dan Penicillium citrinum yang merupakan jamur-jamur
penyebab penyakit. Pekerjaan analisis genom yang dijadwalkan tengah JuliAgustus terpaksa
ditunda dan dijadwal ulang, karena pekerjaan ini melibatkan institusi lain yaitu RCMD,
Fakultas MIPA, IPS. Pekerjaan identifikasi dan uji aktivitas kitinase tetap dilakukan pada
isolat-isolat yang baru didapat.
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006
V. HASIL DAN PEMBAHASAN
Isolasi dan Karakterisasi Bakteri Kitinolitik
Isolasi yang telah dilakukan sampai saat ini dari contoh tanah, lumpur, dan cekungan
penampung air pada tumbuhan dari beberapa daerah di Sumatera Utara dan Bangka,
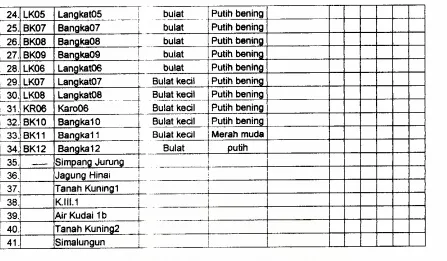
memperoleh 41 isolat bakteri kitinolitik, yaitu 22 isolat dari Sumatera Utara, 12 isolat dari
Bangka, dan 7 isolat belum diberi kode. Beberapa sampel yang sudah diambil dari lapangan
sedang dalam tahap isolasi bakteri kitinolitik. Diharapkan akan ada tambahan jumlah dan jenis
bakteri kitinolitik setelah pekerjaan penapisan dan isolasi selesai. Berdasarkan tempat sampel,
3 isolat diisolasidari lubang tampungan air pada tumbuhan, 2 sampel dari lumpur, sisanya dari
tanah.
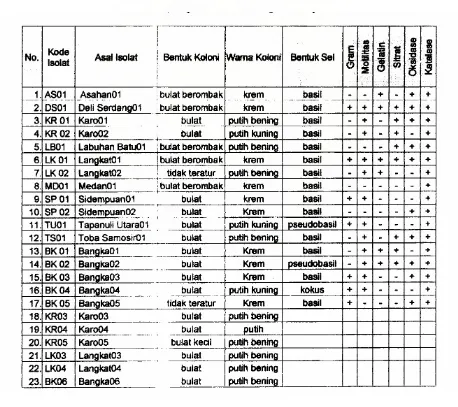
Berdasarkan pengamatan morfologi yang telah dilakukan terhadap 34 isolat tersebut,
diperoleh bentuk koloni yang bervariasi, yaitu 27 isolat berbentuk bulat, 5 isolat berbentuk
bulat berombak, dan 2 isolat tidak teratur. Warna koloni barvariasi pula, yaitu 2 isolat
berwarna putih bening, 3 isolat berwarna putih kuning, 1 isolat berwarna merah muda, dan 10
isolat berwarna krem.
Dari 17 isolat yang telah dilakukan pewarnaan gram, 7 isolat bersifat gram positif dan
10 isolat bersifat gram negatif, dengan bentuk sel basil, pseudobasil, dan kokus. Umumnya
semua isolat mempunyai sel berbentuk basil kecuali isolat BK01 dan TU01 berbentuk pse
udobasil , serta isolat BK04 berbentuk kokus. Uji motilitas yang dilakukan terhadap semua
isolat ini menunjukkan bahwa 12 isolat bersifat motil ditandai dengan adanya jejak pergerakan
bakteri di dalam medium, sedangkan 5 isolat lainnya tidak motil. Isolat lainnya sedang dalam
pengamatan sifat gram dan bentuk sel.
Uji biokimia sederhana yang telah dilakukan terhadap 17 isolat seperti uji motilitas ,
gelatin, sitrat, oksidase, dan katalase, menunjukkan 3 isolat yaitu DS01, LK01, dan BK02,
memperlihatkan reaksi positif terhadap semua uji yang dilakukan. Hasil uji katalase dengan
penambahan larutan 3% H2O2 mengindikasikan bahwa semua isolat memiliki enzim katalase,
ditandai dengan terbentuknya gelembung udara di sekitar koloni. Umumnya isolat
menunjukkan oksidase positif ditandai dengan perubahan warna pada strip Bactident®
Oxidase menjadi warna biru atau biru-violet. Uji oksidase digunakan untuk melihat adanya
enzim sitokrom oksidase sedangkan uji katalase membuktikan adanya enzim katalase yang
berfungsi dalam penguraian H2O2 yang bersifat racun. Dari uji gelatinase dan uji sitrat,
diketahui umumnya isolat tidak mampu menghidrolisis gelatin dan menggunakan sitrat.
Menurut Cappuccino and Sherman (1983), uji positif gelatinase ditandai dengan medium
gelatin yang tetap cair setelah dimasukkan ke dalam lemari pendingin selama 30 menit,
sedangkan keadaan positif pada uji sitrat ditandai dengan berubahnya medium dari hijau
menjadi biru karena terjadi penghilangan asam dan peningkatan pH dalam media. Pengujian
biokimia terhadap isolat-isolat lainnya sedang dilakukan. Hasil pengamatan morfologi dan uji
biokimia sederhana selengkapnya ditunjukkan pada Tabel 1.
Tabel 1. Hasil isolasi dan pengamatan morfologi serta uji biokimia sederhana
14
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
Semua isolat merupakan bakteri kitinolitik yang ditunjukkan dengan terbentuknya
zona hidrolisis di sekitar koloni bakteri pada medium campuran kitin agar dan nutrient broth
(3:1) setelah masa inkubasi 96 jam (Tabel 2). Isolat-isolat tersebut menunjukkan kemampuan
yang berbeda-beda dalam merombak kitin. Aktivitas hidrolisis tertinggi dijumpai pada isolat
KR04, SPO1, BKO1, dan BKO2, sedangkan yang paling rendah dijumpai pada isolat BKO7
dan BKO9. Aktivitas hidrolisis merupakan gambaran dari kemampuan isolat bakteri kitinolitik
dalam merombak kitin, semakin besar nilai aktivitas hidrolisis, semakin besar diameter zona
bening yang terbentuk di sekitar koloni.
Tabel 2. Pengujian aktivitas kitinase bakteri kitinolitik setelah diinkubasi selama 96 jam secara kualitatif
15
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
Menurut Chemin et al. (1995), bakteri dapat menghidrolisis koloidal kitin setelah 72-96 jam
yang ditumbuhkan pada campuran semiminimal agar dan nutrient broth dengan perbadingan
3:1, yang dicampur dengan koloidal kitin sebagai sumber karbon. Pleban et al. (1997)
melaporkan zona jernih yang terbentuk di sekitar pertumbuhan bakteri menandakan adanya
aktivitas kitinolitik di medium pertumbuhan. Besamya nilai perbandingan zona bening dengan
zona pertumbuhan koloni bakteri menunjukkan besamya aktivitas nisbi enzim (Widhyastuti
and Dewi 2001).
16
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
Tiga isolat yang menunjukkan aktivitas hidrolisis yang paling tinggi yakni SPO1,
BKO1, dan BKO2 telah dilakukan pengujian aktivitas enzim kasar, sedang isolat KRO4 belum
dilakukan uji aktivitasnya. Ketiga isolat ini memiliki bentuk koloni dan warna koloni yang
sama yaitu bulat dan krem. Isolat BKO1 dan BKO2 bersifat gram negatif (-) dengan sel
berbentuk basil dan pseudobasil, sedangkan SPO1 bersifat gram positif (+) dengan sel
berbentuk basil (Gambar 2).
Pengujian Aktivitas Kitinase
Ketiga isolat yang terpilih di atas ditumbuhkan pada medium kitin cair untuk
mengetahui kemampuannya dalam merombak kitin secara kuantitatif. Menurut Shaikh and
Deshpande (1993), degradasi kitin secara enzimatik untuk menghasilkan GlcNAc bebas
dilakukan oleh sistem kitinolitik, yang telat ditemukan pada mikroba, tumbuhan-tumbuhan
dan hewan. Connell et al. (1998) mengatakan degradasi kitin oleh prokariot dan eukariot
terjadi dalam dua tahap yang prosesnya melibatkan hidrolisis ikatan -1,4 glikosida yang
menghubungkan subunit GlcNAc. Pertama, endokitinase mengikat tetramer dan polimer
GlcNAc untuk menghasilkan disakarida kitobiose. Kitobiase menghidrolisis kitobiose menjadi
monomer GlcNAc pada tahap kedua. Enzim pendegradasi kitin umumnya oleh beberapa
organisme diinduksi oleh kitosan, kitobiose, GlcNAc atau glukosamin.
17
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
Hasil pengujian aktivitas kitinase kasar menuniukkan isolat BKO1 memiliki aktivitas
enzim yang tertinggi yaitu 0,0636 Unit, sedangkan aktivitas enzim terendah dihasilkan oleh
isolat BK02 yaitu 0,0452 Unit. Isolat SP01 dengan aktivitas hidrolisis tertinggi yaitu 2,942
hanya menghasilkan aktivitas enzim sebesar 0,0550 Unit, sedangkan isolat BK01 dengan
aktivitas hidrolisis 2,253 temyata menghasilkan aktivitas enzim tertinggi yaitu 0,0636 Unit
(Tabel 3). Menurut Yurnaliza (2001), beberapa faktor yang diduga menjadi penyebab tidak
berkolerasinya nilai aktivitas hidrolisis secara kualitatif dengan nilai aktivitas enzim secara
kuantitatif adalah perbedaan jenis mikroba, kecepatan pertumbuhan setiap isolat pada medium
padat dan cair, jumlah inokulum yang diberikan pada kedua medium, dan tipe enzim kitinase
yang dihasilkan.
Tabel 3. Pengukuran aktivitas kitinase kasar pada sampel secara kuantitatif
Kehadiran enzim kitinolitik pada medium pertumbuhan yang diuji dapat dilihat dari
reaksi pelepasan GlcNAc dari koloidal kitin. Jeuniaux (1966), melaporkan endokitinase adalah
spesifik untuk polimer linier dari N-asetil-D glokosamin, tetapi tidak memutuskan kitobiose.
Enzim ini menghidrolisis kitin menjadi kitobiose, kitotrinose, dan asetilglukosamin bebas juga
dapat diproduksi ketika substrat adalah koloidal kitin.
Uji Penghambatan Pertumbuhan Beberapa Jamur Patogen Tanaman
Hasil pengujian daya hambat pertumbuhan beberapa jamur patogen tanaman
mengindikasikan ada 5 isolat bakteri kitinolitik yang mampu menghambat pertumbuhan jamur
ini. Pengujian baru dilakukan terhadap 1 jenis jamur saja (F. semitectum), dan 2 jenis jamur
lainnya sedang dimulai untuk dilakukan pengujian. Diharapkan dan pengujian ini akan ada
beberapa jenis isolat bakteri kitinolitik yang mampu menghambat pertumbuhan 2 jenis jamur
ini. Kemungkinan adanya 1 isolat yang mampu menghambat pertumbuhan 2 atau 3 jenis jamur
patogen ini sekaligus masih harus menunggu hasil uji.
18
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
19
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006
Keragaman Genetik Bakteri Penghasil Kitinase Melalui Gen 16S rRNA
Pengamatan terhadap keragaman genetik bakteri penghasil kitinase melalui gen 16S
rRNA belum dapat dilakukan karena keterlambatan pencairan dana. Diharapkan pekerjaan ini
dapat dilakukan setelah semua sampel telah ditapis. Perkiraan pekerjaan dapat dilakukan di
bulan Desember 2005.
Dwi Suryanto: Eksplorasi Bakteri Kitinolitik: Keragaman Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri,2005
USU Repository©2006
VII. RENCANA /PENELITIAN TAHUN II
Penelitian tahun II bertujuan untuk melihat pengaruh lingkungan terhadap kemampuan
bakteri menghidrolisis kitin jamur patogen dan kitin lainnya, dan memperoleh data keragaman
gen penyandi kitinase dari bakteri kitinolitik yang berpotensi sebagai agen pengendali hayati
jamur patogen tanaman dengan menganalisis keragaman genetik dengan teknik PCR-RFLP
dari gen kitinase yang diamplifikasi dengan menggunakan primer gen chiA, chiB, dan chiC.
Dari kegiatan pokok tersebut diharapkan dapat menjadi dasar bagi pengembangan strain-strain
lokal, atau gen penyandi kitinase untuk pengendalian jamur patogen tanaman atau tujuan lain
proteksi tanaman.
Untuk mencapai tujuan di atas disusun metode seperti: asai keriap, asai pada beberapa
jamur patogen tanaman in vitro, asai aktivitas antifungi filtrat kultur isolat bakteri, asai
pengaruh lingkungan terhadap aktivitas hidrolitik isolat bakteri, PCR dan kloning gen
penyandi kitinase, dan melihat keragaman genetik gen kitinase.