KEANEKARAGAMAN FUNGI MIKORIZA ARBUSKULA PADA
AREAL TANAMAN KELAPA SAWIT (STUDI KASUS DI
PTPN III KEBUN BATANG TORU KABUPATEN
TAPANULI SELATAN)
TESIS
Oleh
NABILAH SIREGAR
117030049/BIO
PROGRAM PASCASARJANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
KEANEKARAGAMAN FUNGI MIKORIZA ARBUSKULA PADA
AREAL TANAMAN KELAPA SAWIT (STUDI KASUS DI
PTPN III KEBUN BATANG TORU KABUPATEN
TAPANULI SELATAN)
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh
gelar Magister Sains dalam Program Studi Biologi pada Program Pascasarjana Fakultas MIPA Universitas Sumatera Utara
Oleh
NABILAH SIREGAR
117030049/BIO
PROGRAM PASCASARJANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PERNYATAAN ORISINALITAS
KEANEKARAGAMAN FUNGI MIKORIZA ARBUSKULA PADA AREAL TANAMAN KELAPA SAWIT (STUDI KASUS DI PTPN III KEBUN
BATANG TORU KABUPATEN TAPANULI SELATAN)
TESIS
Dengan ini saya nyatakan bahwa saya mengakui semua karya tesis ini adalah hasil kerja saya sendiri kecuali kutipan dan ringkasan yang tiap satunya telah dijelaskan sumbernya dengan benar.
Medan, 15 Juli 2014
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademis Universitas Sumatera Utara, saya yang bertanda tangan di bawah ini:
Nama : Nabilah Siregar
NIM : 117030049
Program Studi : Magister Biologi Jenis Karya Ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Eksklusif (Non-Exclusive Royalty Free Right) atas Tesis saya yang berjudul:
Keanekaragaman Fungi Mikoriza Arbuskula Pada Areal Tanaman Kelapa Sawit (Studi Kasus Di PTPN III Kebun Batang Toru Kabupaten Tapanuli Selatan)
Beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Non-Eksklusif ini, Universitas Sumatera Utara berhak menyimpan, mengalih media, memformat, mengelola dalam bentuk data-base, merawat dan mempublikasikan Tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan sebagai pemegang dan atau sebagai pemilik hak cipta.
Demikian pernyataan ini dibuat dengan sebenarnya.
Medan, 15 Juli 2014
Telah diuji pada Tanggal 15 Juli 2014
PANITIA PENGUJI TESIS
KETUA : Dr. Delvian, S.P., M.P
ABSTRACT
The first thing that must be known to study the potential of vesicular arbuscular mycorrhizal is to know the diversity of these organisms. Data of diversity vesicular arbuscular mycorrhizal used to obtain the selection of of potential and effective isolates. The aim of this research was to know the density of spore, colonization percentage, and types of vesicular arbuscular mycorrhizal of oil palm tree in PTPN III Batang Toru Estate at different soil fertility conditions. Methods of soil and root were sampling directly from the field (Afdeling I, II, and III) and trapping. The soil chemical characters was observed at Laboratory of Research Technology, Faculty of Agriculture, North Sumatera University. The observation chemical of the soil showed that the soil conditions in all of Afdeling are less fertile. The highest number of spores were found in the field and trapping in Afdeling I; 248 and 336 spores/50 g soils respectively. Percentage of vesicular arbuscular mycorrhizal colonization were highest in Afdeling I by 42%. Vesicular arbuscular mycorrhizal spores knowed that there consisted of two genera Glomus (42 types) and
Acaulospora (3 types).
ABSTRAK
Hal pertama yang harus diketahui untuk mempelajari potensi fungi mikoriza arbuskula adalah mengetahui keanekaragaman dari organisme tersebut. Dengan adanya data keanekaragaman fungi mikoriza arbuskula, maka dapat dilakukan seleksi guna mendapatkan isolat fungi mikoriza arbuskula yang potensial dan efektif. Penelitian ini bertujuan untuk mengetahui kepadatan spora, persentase kolonisasi, dan tipe fungi mikoriza arbuskula pada areal tanaman kelapa sawit PTPN III Kebun Batang Toru dengan kondisi kesuburan tanah yang berbeda. Metode pengambilan sampel tanah dan akar dilakukan secara langsung dari lapangan (Afdeling I,II dan III) serta trapping. Pengamatan sifat kimia tanah dilakukan di Laboratorium Riset dan Teknologi Fakultas Pertanian Universitas Sumatera Utara. Hasil pengamatan sifat kimia tanah menunjukkan bahwa kondisi tanah pada ketiga Afdeling tergolong rendah. Jumlah spora tertinggi dari hasil lapangan dan tarpping
diperoleh pada Afdeling I, yaitu masing-masing 248 dan 336 spora/50 g tanah. Persentase kolonisasi fungi mikoriza arbuskula yang tertinggi juga pada Afdeling I, yaitu 42%. Tipe spora fungi mikoriza arbuskula yang diperoleh terdiri dari dua genus, yaitu Glomus (42 tipe) dan Acaulospora (3 tipe).
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah Swt atas segala tahmat dan
karuni-NYA sehingga tesis ini dapat diselesaikan dengan judul “Keanekaragaman
Fungi Mikoriza Arbuskula pada Areal Tanaman Kelapa Sawit, Studi Kasus Di PTPN
III Kebun Batang Toru Kabupaten Tapanuli Selatan”.
Selama pelaksanaan penelitian ini penulis telah banyak mendapat bantuan dan
bimbingan dari berbagai pihak. Untuk itu pada kesempatan ini penulis ingin
menyampaikan rasa terima kasih kepada:
1. Bapak Dr. Delvian, S.P, M.P dan Prof. Dr. Dwi Suryanto, M.Sc sebagai dosen
pembimbing atas segala bantuan, bimbingan, dan arahan yang telah diberikan
kepada penulis.
2. Bapak Prof. Dr. Erman Munir, M.Sc dan Dr. It Jamilah, M.Sc sebagai dosen
penguji yang telah banyak memberikan saran dan kritikan demi kesempurnaan
tesis ini.
3. Pimpinan serta staf pegawai di Departement Biologi FMIPA USU dan
Laboratorium Biologi Tanah Fakultas Pertanian USU
4. Manajer dan staf pegawai PTPN III Kebun Batang Toru di Kabupaten Tapanuli
Selatan.
5. Ayahanda dan Ibunda serta keluarga yang telah banyak memberikan doa dan
motivasi kepada penulis.
6. Seluruh rekan-rekan yang namanya tidak bisa penulis sebutkan satu persatu.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna. Oleh karena itu,
dengan segala kerendahan hati menerima kritik dan saran yang membangun dari
semua pihak. Penulis berharap semoga hasil penelitian ini dapat menambah khasanah
ilmu pengetahuan dan akhir kata penulis mengucapkan terima kasih.
RIWAYAT HIDUP
DATA PRIBADI
Nama : Nabilah Siregar
Tempat dan Tanggal Lahir : Padangsidimpuan, 23 November 1988 Alamat Rumah : Jl. Raja Inal Siregar Gg. Ar-Raihan No. 4
Padangsidimpuan
Telepon/Hp : 081370273489
DATA PENDIDIKAN
SD : Negeri 142437 Padangsidimpuan Tamat : 2001 SMP : Negeri 2 Padangsidimpuan Tamat : 2004
SMA : Negeri 2 Plus Sipirok Tamat : 2007
DAFTAR ISI
2.2.3 Faktor-Faktor yang Mempengaruhi Keberadaan FMA 6 2.2.4 Keanekaragaman FMA dari Hasil Penelitian 9
BAB V. KESIMPULAN DAN SARAN 32
5.1 Kesimpulan 32
5.2 Saran 32
DAFTAR PUSTAKA 33
DAFTAR TABEL
Halaman
Tabel 1. Keanekaragaman FMA dari hasil penelitian 9
Tabel 2. Hasil analisis tanah yang dijadikan sampel isolasi spora FMA 15
Tabel 3. Tipe dan karakteristik spora FMA dari lapangan 22
DAFTAR GAMBAR
Halaman
Gambar 1. Klasifikasi FMA 5
Gambar 2. Ilustrasi petak contoh pengambilan sampel tanah dan akar 12
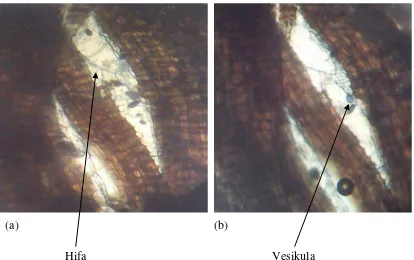
Gambar 3. Kepadatan spora FMA lapangan dan hasil trapping 16 Gambar 4. Kolonisasi akar oleh FMA yang ditandai dengan adanya (a) hifa
dan (b) vesikula 19
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Data hasil analisis tanah 39
ABSTRACT
The first thing that must be known to study the potential of vesicular arbuscular mycorrhizal is to know the diversity of these organisms. Data of diversity vesicular arbuscular mycorrhizal used to obtain the selection of of potential and effective isolates. The aim of this research was to know the density of spore, colonization percentage, and types of vesicular arbuscular mycorrhizal of oil palm tree in PTPN III Batang Toru Estate at different soil fertility conditions. Methods of soil and root were sampling directly from the field (Afdeling I, II, and III) and trapping. The soil chemical characters was observed at Laboratory of Research Technology, Faculty of Agriculture, North Sumatera University. The observation chemical of the soil showed that the soil conditions in all of Afdeling are less fertile. The highest number of spores were found in the field and trapping in Afdeling I; 248 and 336 spores/50 g soils respectively. Percentage of vesicular arbuscular mycorrhizal colonization were highest in Afdeling I by 42%. Vesicular arbuscular mycorrhizal spores knowed that there consisted of two genera Glomus (42 types) and
Acaulospora (3 types).
ABSTRAK
Hal pertama yang harus diketahui untuk mempelajari potensi fungi mikoriza arbuskula adalah mengetahui keanekaragaman dari organisme tersebut. Dengan adanya data keanekaragaman fungi mikoriza arbuskula, maka dapat dilakukan seleksi guna mendapatkan isolat fungi mikoriza arbuskula yang potensial dan efektif. Penelitian ini bertujuan untuk mengetahui kepadatan spora, persentase kolonisasi, dan tipe fungi mikoriza arbuskula pada areal tanaman kelapa sawit PTPN III Kebun Batang Toru dengan kondisi kesuburan tanah yang berbeda. Metode pengambilan sampel tanah dan akar dilakukan secara langsung dari lapangan (Afdeling I,II dan III) serta trapping. Pengamatan sifat kimia tanah dilakukan di Laboratorium Riset dan Teknologi Fakultas Pertanian Universitas Sumatera Utara. Hasil pengamatan sifat kimia tanah menunjukkan bahwa kondisi tanah pada ketiga Afdeling tergolong rendah. Jumlah spora tertinggi dari hasil lapangan dan tarpping
diperoleh pada Afdeling I, yaitu masing-masing 248 dan 336 spora/50 g tanah. Persentase kolonisasi fungi mikoriza arbuskula yang tertinggi juga pada Afdeling I, yaitu 42%. Tipe spora fungi mikoriza arbuskula yang diperoleh terdiri dari dua genus, yaitu Glomus (42 tipe) dan Acaulospora (3 tipe).
BAB I PENDAHULUAN
1.1Latar Belakang
Fungi mikoriza arbuskula (FMA) adalah kelompok fungi tanah yang bersifat
obligat dan merupakan sumberdaya hayati potensial yang terdapat di alam. Smith dan
Read (2008) menyatakan bahwa FMA mampu bersimbiosis dengan 90% jenis
tanaman. Pembentukan simbiosis mutualisme antara FMA dengan akar tanaman
ditandai dengan pergerakan nutrisi. Fungi akan memperoleh unsur karbon dan nutrisi
yang diserap oleh FMA akan ditransfer ke tanaman. Oleh karena itu, kemampuan
FMA untuk meningkatkan
Selain bersifat obligat, FMA juga bersifat kosmopolitan (
ketersediaan nutrisi bagi tanaman dapat meningkatkan
pertumbuhan tanaman.
dapat ditemukan
pada berbagai kondisi tanah) dengan cara menyebar secara aktif pada miselium dalam
tanah
Potensi FMA sebagai pupuk hayati dapat digunakan untuk meningkatkan
kesuburan tanah agar produktivitas tanaman kelapa sawit dapat meningkat. Hal ini
disebabkan tanaman kelapa sawit merupakan jenis tanaman perkebunan yang
menduduki posisi penting di sektor pertanian. Namun, penggunaan pupuk kimia
menyebabkan rendahnya kesuburan tanah sehingga produktivitas tanaman kelapa
sawit menurun. Dengan demikian, pemanfaatan FMA sebagai pupuk hayati dapat
dijadikan alternatif lain untuk mengurangi penggunaan pupuk kimia.
(Suhardi, 1988). Keberadaan FMA dapat merangsang perakaran dan
meningkatkan daya tahan tanaman terhadap kekeringan (Brundrett et al., 1996); meningkatkan unsur hara (P, Zn dan Fe) pada daun, kandungan minyak esensial
(essensial oil), dan artemisinin pada tanaman Artemisia annua L. (Chaudhary et al.,
2008). Dengan demikian, FMA mulai banyak mendapat perhatian dan sering
dijadikan sebagai bahan dalam suatu penelitian terutama untuk mempelajari
Hal pertama yang harus diketahui untuk mempelajari potensi suatu organisme
ialah melihat keberadaan dan keberagaman dari organisme tersebut. Demikian juga
dengan studi keanekaragaman FMA pada areal tanaman kelapa sawit. Adanya data
keanekaragaman FMA di areal tanaman kelapa sawit dapat dilakukan seleksi untuk
memperoleh isolat FMA yang potensial dan spesifik pada tanaman kelapa sawit.
Namun, keanekaragaman tipe-tipe FMA pada tanaman kelapa sawit masih kurang.
Menurut Mansur et al. (2002), hampir 70% kegiatan penelitian FMA diarahkan pada manfaatnya dalam pertumbuhan tanaman dan kurang dari 15% yang mempelajari
keanekaragaman FMA pada suatu ekosistem.
1.2Perumusan Masalah
Eksplorasi tipe-tipe FMA yang dilakukan pada areal tanaman kelapa sawit
merupakan studi awal yang penting untuk dapat mengisolasi dan mengidentifikasi
tipe-tipe FMA dominan dan spesifik yang ada. Informasi yang diperoleh dari
keanekaragaman tipe-tipe FMA dijadikan sebagai material penting untuk
memperoleh isolat FMA yang potensial. Berdasarkan pernyataan di atas, maka perlu
dilakukan penelitian keanekaragaman FMA pada areal tanaman kelapa sawit PTPN
III Kebun Batang Toru.
1.3Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui kepadatan spora, persentase
kolonisasi, dan tipe spora FMA pada areal tanaman kelapa sawit PTPN III Kebun
Batang Toru dengan kondisi kesuburan tanah yang berbeda.
1.4Manfaat Penelitian
Manfaat penelitian ini adalah memberikan informasi tentang keanekaragaman
FMA pada areal tanaman kelapa sawit PTPN III Kebun Batang Toru sehingga dapat
BAB II
TINJAUAN PUSTAKA
2.1 Kelapa Sawit (Elaeis guineensis Jacq.)
Kelapa sawit (Elaeis guinensis Jacq.) merupakan jenis tanaman tropis yang berasal dari Afrika Barat. Salah satu negara penghasil minyak sawit terbesar adalah
Indonesia karena memiliki lahan yang subur dan luas, sehingga sesuai untuk
pertumbuhan kelapa sawit. Tanaman ini dapat menghasilkan minyak makanan,
minyak industri, bahan farmasi, maupun bahan bakar nabati (biodiesel) (Ebongue dan
Paul, 2012).
Tanaman kelapa sawit tumbuh subur di dataran rendah dengan ketinggian
300-400 m dpl (diatas permukaan laut), suhu optimal 27-280
Tanaman kelapa sawit dapat tumbuh pada jenis tanah podzolik, latosol,
hidromorfik kelabu, regosol, dan aluvial. Untuk memperoleh hasil yang maximal
tanaman kelapa sawit tumbuh baik pada tanah yang gembur, subur, datar, berdrainase
baik, dan memiliki lapisan solum cukup dalam (80 cm) tanpa lapisan padas
(Balitbang Pertanian, 2008). Tanah dengan kondisi seperti ini akan meningkatkan
pertumbuhan dan produksi dari tanaman kelapa sawit. Jadi, peranan kesuburan tanah
sangat penting dalam meningkatkan produktivitasnya.
C dan pH 5,5-7,0. Curah
hujan yang baik antara 2000-2500 mm/tahun. Panjang penyinaran 6 jam/hari dengan
kelembapan optimal 75%. Perakaran tanaman kelapa sawit berupa akar primer,
sekunder, tersier, dan kuartener. Sistem perakaran yang ekstensif akan menghasilkan
penyerapan hara dan air yang semakin tinggi dengan kesuburan tanah yang baik
(Verhey, 2010).
2.2 Fungi Mikoriza Arbuskula (FMA)
Mikoriza terdiri dari dua kata yang berasal dari bahasa Yunani, yaitu myces
dan Martin, 2010). Mikoriza untuk tumbuh dan berkembang memerlukan karbohidrat
dari tanaman dan tanaman memerlukan unsur hara serta air melalui hifa selama siklus
hidupnya.
Berdasarkan bentuk dan cara menginfeksi inangnya, mikoriza dikelompokkan
menjadi dua tipe, yaitu ektomikoriza dan endomokoriza (Smith dan Read, 2008).
Ektomikoriza memiliki jaringan hifa yang tidak masuk ke sel korteks, tetapi
berkembang di antara sel membentuk mantel pada permukaan akar, memiliki batang
tubuh dengan bentuk dan warna yang beragam dan dapat diperbanyak tanpa tanaman
inang. Sedangkan endomikoriza memiliki jaringan hifa yang masuk ke dalam sel
korteks, membentuk struktur khas seperti oval yang disebut vesikula atau bercabang
yang disebut arbuskula. Dengan demikian, jenis endomokoriza disebut sebagai fungi
mikoriza arbuskula atau mikoriza vesikula yang tidak memiliki batang tubuh dan
tidak dapat diperbanyak tanpa tanaman inang (INVAM, 2013).
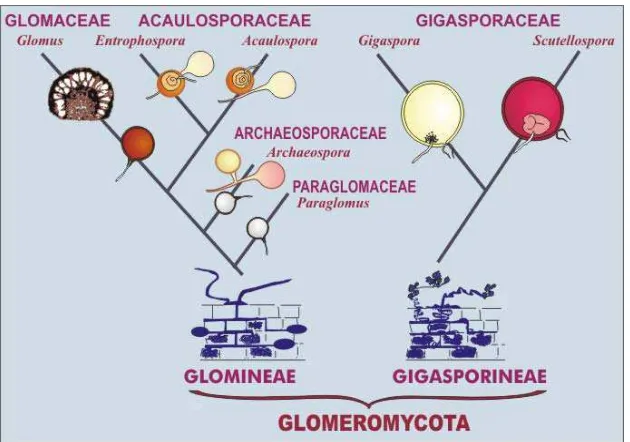
Fungi mikoriza arbuskula (FMA) termasuk dalam filum Glomeromycota,
kelas Zygomycetes, dan ordo Glomales yang mempunyai 2 sub-ordo, yaitu
Gigasporineae dan Glomineae. Gigasporineae dengan famili Gigasporaceae
Gambar 1. Klasifikasi FMA (Sumber: INVAM, 2013)
2.2.1 Struktur FMA
Fungi mikoriza arbuskula (FMA) dibentuk oleh berbagai struktur yang
berfungsi untuk pertumbuhan dan perkembangbiakan pada akar tanaman inang.
Struktur tersebut adalah hifa intraradikal, arbuskula (struktur hifa bercabang-cabang),
vesikula (berdinding tipis yang mengandung cairan lemak), Auxiliary cell (sel pelengkap), dan spora (berwarna hialin sampai hitam)
Fungi mikoriza arbuskula (FMA) dapat diidentifikasi secara morfologi dengan
melakukan observasi terhadap mikoriza tunggal yang diisolasi untuk memisahkan
FMA dengan sampel tanah. Kriteria morfologis tidak dapat digunakan untuk melihat
perbedaan mikoriza pada tingkat spesies karena mikoriza memiliki morfologi yang
hampir sama. Namun, beberapa spesies memiliki perbedaan pada morfologi vesikula,
diameter hifa, dan pola pertumbuhan akar. Oleh karena itu, tanah yang mengandung
mikoriza akan menunjukkan morfologi akar dari tanaman perantara tertentu. Jika
morfologi tersebut didefenisikan, maka kuantifikasi pembentukan mikoriza oleh
2.2.2 Simbiosis FMA pada Akar
Fungi mikoriza arbuskula (FMA) merupakan simbion yang paling luas
penyebarannya. Simbiosis FMA diawali dari pergerakan hifa ekstraradikal (HE) yang
berasal dari perkecambahan spora dalam tanah atau dari akar terkolonisasi, karena
tanaman mengeksudasikan senyawa flavonoid. Hifa kemudian menyentuh permukaan
akar, membentuk appresoria, dan menembus dinding sel akar untuk membentuk hifa
intraradikal. Hifa intraradikal (HI) tumbuh menjalar di antara sel atau menembus sel
epidermis dan mengolonisasi ruang intra- dan interseluler korteks akar. Selanjutnya
HI berdiferensiasi membentuk arbuskula, vesikel, sel pelengkap, ataupun spora
intraradikal.
Kemudian jaringan HE di dalam tanah segera terbentuk setelah terjadinya
kolonisasi akar. Hifa ekstraradikal berfungsi untuk mengangkut hara dan air, produksi
spora, agregasi tanah, dan melindungi tanaman inang dari serangan patogen.
Keberadaan HE pada garis tengahnya yang jauh lebih kecil dibandingkan dengan
garis tengah akar mampu menembus pori mikro untuk mendapatkan air yang tidak
dapat dijangkau oleh akar. Hal ini menyebabkan tanaman bermikoriza menjadi lebih
adaptif menghadapi cekaman kekeringan. Sumbangan FMA terhadap serapan P dan
air dipengaruhi oleh jenis FMA, tanaman, dan lingkungan. Hal ini mengindikasikan
kesesuaian fungsional di antara FMA dan tanaman tidak selalu berkaitan dengan
kolonisasinya (Smith dan Read, 2008).
2.2.3 Faktor-Faktor yang Mempengaruhi Keberadaan FMA
Faktor-faktor yang mempengaruhi keberadaan FMA adalah sebagai berikut:
a. Suhu
Suhu berpengaruh terhadap perkembangan spora, hifa pada sel akar dan
perkembangan pada korteks akar. Selain itu, suhu juga berpengaruh pada ketahanan
dan simbiosis. Suhu terbaik untuk perkembangan arbuskula adalah 300 C, koloni
Schroder, 1974). Menurut hasil penelitian Daniel dan Trappe (1980) Glomus epigaens berkecambah pada suhu 18-250
b. Cahaya dan ketersediaan hara
C.
Intensitas cahaya yang tinggi, kekahatan nitrogen dan fosfor yang sedang akan
meningkatkan jumlah karbohidrat di dalam akar sehingga tanaman lebih peka
terhadap kolonisasi FMA. Pertumbuhan perakaran yang sangat aktif jarang
terkolonisasi FMA. Oleh karena itu, menurunnya pertumbuhan dan perkembangan
akar akan meningkatkan kolonisasi FMA. Peranan FMA terhadap ketersediaan P bagi
tanaman menunjukkan keterikatan antara FMA dan P tanah. Pada wilayah beriklim
sedang, konsentrasi P yang tinggi menyebabkan kolonisasi FMA menurun. Hal ini
disebabkan karena tingginya konsentrasi P dalam jaringan inang (Smith dan Read,
1997).
c. Kadar air tanah
Kandungan air tanah dapat berpengaruh baik secara langsung atau tidak
langsung terhadap infeksi dan pertumbuhan fungi mikoriza. Pengaruh secara
langsung tanaman bermikoriza dapat memperbaiki dan meningkatkan kapasitas
serapan air. Sedangkan pengaruh tidak langsung karena adanya miselia eksternal
yang menyebabkan FMA efektif dalam mengagregasi butir-butir tanah. Dengan
demikian, kemampuan tanah menyerap air meningkat (Rothwell, 1984). Hasil
penelitian Menge (1984) menunjukkan bahwa perkecambahan yang baik pada
Glomus epigaeus jika kandunga air tanah di antara kapasitas lapang. d. pH Tanah
Fungi mikoriza arbuskula (FMA) pada umumnya lebih tahan terhadap
perubahan pH tanah. Meskipun demikian, daya adaptasi masing-masing spesies FMA
terhadap pH tanah berbeda-beda. Hal ini karena pH tanah mempengaruhi
pH optimum untuk perkecambahan spora berbeda-beda tergantungan pada
adaptasi FMA terhadap lingkungan. Hasil penelitian Bertham (2003) menunjukkan
bahwa perkecambahan maksimum Glomus mosseae pada pH 6-9, sedangkan
Gigaspora corallodea dan Gigaspora heterogama dari jenis yang lebih asam dapat berkecambah dengan baik pada pH 4-6.
e. Bahan organik
Bahan organik merupakan salah satu komponen dalam tanah yang penting
selain air dan udara. Jumlah spora FMA berhubungan erat dengan kandungan bahan
organik dalam tanah. Jumlah maksimum spora ditemukan pada tanah yang
mengandung bahan organik 1-2% dan kandungan spora sangat rendah pada tanah
berbahan organik kurang dari 0,5%. Residu akar mempengaruhi ekologi FMA. Hal
ini disebabkan serasah akar yang terkolonisasi mikoriza merupakan sarana penting
untuk mempertahankan generasi FMA dari satu tanaman ke tanaman berikutnya.
Serasah akar tersebut mengandung hifa, vesikel, dan spora yang dapat
mengkolonisasi FMA (Whiffen, 2007).
f. Logam berat dan unsur lain
Adanya logam berat dalam larutan tanah dapat mempengaruhi perkembangan
mikoriza. Beberapa spesies FMA diketahui mampu beradaptasi dengan tanah yang
tercemar seng (Zn), tetapi sebagian besar spesies FMA peka terhadap kandungan Zn
yang tinggi. Pada beberapa penelitian lain diketahui bahwa FMA tertentu toleran
terhadap kandungan Mn, Al, dan Na yang tinggi (Janouskova et al., 2006).
g. Fungisida
Fungisida merupakan racun kimia yang digunakan untuk membunuh fungi
penyebab penyakit tanaman. Penggunaan fungisida dalam dosis yang rendah
disamping mampu memberantas fungi penyebab penyakit juga terbukti dapat
menyebabkan turunnya kolonisasi FMA yang mengakibatkan terhambatnya
2.2.4 Keanekaragaman FMA dari Hasil Penelitian
Keanekaragaman FMA dari hasil penelitian sudah dilakukan oleh sebagian
peneliti dengan lokasi dan rizosfer tanaman yang berbeda. Nurhalisyah (2012),
menyatakan bahwa pada lahan perkebunan kelapa sawit Kampung Jambuk,
Kalimantan Timur jenis FMA yang diperoleh adalah Glomus dan Acalauspora. Tipe
Glomus terdiri dari 19 dan tipe Acalauspora terdiri dari 3. Hasil penelitian lainnya dapat dilihat pada Tabel 1 berikut:
Tabel 1. Keanekaragaman FMA dari Hasil Penelitian
Peneliti Lokasi Jenis Tanaman Tipe FMA
Nadarajah dan
Kelapa sawit (Elaeis guineensis Jacq.)
7 tipe Glomus,1tipe Sclerocystis, 2 tipe Acaulospora, dan 2 tipe Gigaspora. Acaulospora, dan 1 tipe Archaeospora.
Muleta et al. (2007)
Hutan Kopi Bonga (Ethiopia)
Kopi (Coffea arabica) Glomus, Gigaspora,
Acaulospora, Entrophospora, dan Scutellospora.
Muzakkir (2010) Tanjung Alai (Sumatera Barat)
Jarak pagar (Jatropha curcas)
8 tipe Glomus, 3 tipe Acaulospora, 2 tipe Gigaspora, 2 tipe Scutellospora, 1 tipe Entrophospora, dan 1 tipe Sclerocystis.
Pulungan (2010) PTPN II Kebun Sei Semayang
Meghalaya (India) Sohphlang
(Flemingia vestita)
60 tipe Glomus, 23 tipe Acaulospora, 6 tipe Gigaspora, 16 tipe Scutellospora, 2 tipe Ambispora dan 1 tipe
Lanjutan
Hindumathi dan Reddy (2011)
Andhra Pradesh, India (Adilabad, Nizamabad dan Karimnagar)
Kedelai (Glycine max) 12 tipe Glomus, 8 tipe Acaulospora, 3 tipe Gigaspora, dan 1 tipe Sclerocystis.
Puspitasari et al. (2012)
Desa Torjun (Madura)
Jagung (Zea mays)
11 tipe Glomus, 1 tipe Acaulospora, dan 2 tipe Gigaspora.
Nurhandayani et al. (2013)
Desa Rasau Jaya Umum (Pontianak)
BAB III
METODELOGI PENELITIAN
3.1 Waktu dan Tempat
Pengambilan sampel tanah dan akar tanaman dilakukan di Perkebunan Kelapa
Sawit PTPN III Kebun Batang Toru pada bulan September 2013. Ekstraksi spora,
identifikasi, dan penghitungan kolonisasi FMA dilakukan di Laboratorium Biologi
Tanah Universitas Sumatera Utara pada bulan September-Desember 2013.
3.2 Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah sampel tanah dan akar
tanaman kelapa sawit; larutan glukosa 60%; larutan Melzer’s; polyvinyl alcohol lactoglycerol (PVLG); KOH 2,5%; HCL 2%; trypan blue 0,05%; chlorox 5,25%;
hyponex merah (25-5-20); dan benih Zea mays. Alat yang digunakan adalah saringan bertingkat dengan ukuran 250, 125, dan 53 µm serta pinset spora.
3.3 Pengambilan Sampel Tanah dan Akar
Teknik pengambilan sampel tanah dan akar dilakukan berdasarkan tingkat
kesuburan tanah (rendah, sedang dan tinggi) yang diambil dari 3 Afdeling. Kesuburan
tanah diasumsikan dari hasil produksi tanaman. Pembuatan plot pengamatan
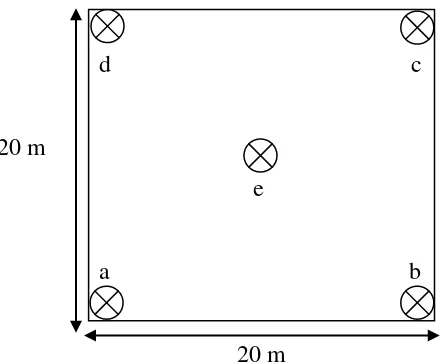
berdasarkan metode international center research in agroforestry (ICRAF) (Ervayenri et al., 1997). Plot diukur 20 m × 20 m secara acak dengan replikasi 3 kali pada setiap Afdeling (Gambar 2). Setelah itu, dilakukan penentuan titik pengambilan
sampel tanah pada setiap sudut dan tengah plot. Pengambilan sampel tanah dilakukan
pada rizosfer dengan kedalaman 0-20 cm. Sampel tanah diambil ± 1 kg. Pengambilan
sampel akar pada 2 sudut plot (2 titik). Selanjutnya dilakukan analisis kimia pada
sampel tanah yang diambil untuk mengetahui sifat kimia tanah berupa kapasitas tukar
d c
20 m
e
a b
20 m
Gambar 2. Ilustrasi petak contoh pengambilan sampel tanah dan akar
3.4 Pengamatan Sampel Tanah dan Akar
Pengamatan kelimpahan spora FMA dapat dilakukan dengan cara menghitung
kepadatan spora dan persentase kolonisasi FMA pada akar tanaman inang (Abbot dan
Robson, 1996). Dalam penelitian ini, dilakukan identifikasi tipe FMA dan persentase
kolonisasi FMA.
3.4.1 Ekstraksi Spora dan Identifikasi FMA
Ekstraksi spora FMA berfungsi memisahkan spora FMA dengan sampel tanah
sehingga dapat dilakukan identifikasi untuk mengetahui jumlah dan tipe spora FMA.
Teknik dalam mengekstraksi spora FMA adalah tuang saring dan sentrifugasi
(Brundrett et al., 1996) dilakukan dengan mengambil 50 g sampel tanah kemudian dimasukkan kedalam gelas ukur, ditambahkan 200 ml air, diaduk dan dibiarkan
selama 30 menit. Campuran sampel tanah disaring menggunakan satu set saringan
bertingkat dengan ukuran 250, 125, 53 µm. Sampel tanah yang tertinggal pada
saringan paling atas disemprot dengan air. Saringan paling atas dilepas, kemudian
saringan ke-2 kembali disemprot. Saringan ke-2 dilepas, sampel tanah yang tertinggal
hasil saringan tadi ditambahkan larutan glukosa 60% sebanyak 3 ml. Tabung sentrifus
ditutup rapat dan dilakukan sentrifugasi dengan kecepatan 2500 rpm selama 3 menit.
Cairan supernatan hasil sentrifugasi dipindahkan kedalam saringan 53 µm, dicuci,
kemudian dipindahkan ke cawan petri dan diamati dibawah mikroskop untuk
penghitungan kepadatan spora dan pembuatan preparat untuk identifikasi spora FMA.
Pembuatan preparat spora dilakukan dengan meletakkan spora hasil ekstraksi
dalam larutan Melzer’s dan PVLG dengan cara terpisah pada satu object class. Setelah itu, spora-spora tersebut ditutup dengan menggunakan cover class dan diamati dibawah mikroskop. Perubahan warna spora pada larutan Melzer’
menentukan tipe spora yang ada.
3.4.2 Kolonisasi FMA pada Akar Tanaman
Pengamatan kolonisasi FMA pada sampel akar tanaman kelapa sawit dilakukan
dengan pewarnaan akar (root staining). Langkah pertama adalah memilih akar-akar halus dengan diameter 0,5-2,0 mm dan dicuci dengan air mengalir hingga bersih.
Sampel akar dimasukkan ke dalam larutan KOH 2,5% dan dibiarkan selama 7 hari
sehingga akar berwarna putih atau pucat. Tujuannya adalah untuk mengeluarkan
semua isi sitoplasma dari sel akar sehingga memudahkan pengamatan struktur
kolonisasi FMA. Larutan KOH kemudian dibuang dan sampel akar dicuci pada air
mengalir selama 5-10 menit. Selanjutnya sampel akar direndam dalam larutan HCl
2% dan dibiarkan selama dua malam. Larutan HCl 2% dibuang dengan
mengalirkannya secara perlahan-lahan. Kemudian sampel akar direndam di dalam
larutan trypan blue 0,05% selama 24 jam (Kormanik dan McGraw, 1982).
Penghitungan persentase kolonisasi akar menggunakan metode panjang akar
terkolonisasi (Giovanetti dan Mosse, 1980). Potongan akar yang telah diwarnai
diambil secara acak dengan panjang ± 1 cm sebanyak 10 potongan akar dan disusun
tanda-tanda kolonisasi diberi tanda negatif (-). Persentase kolonisasi akar dihitung
dengan menggunakan rumus:
% kolonisasi akar = ∑ bidangpandangbertanda (+)
∑ bidangpandangkeseluruhan × 100 %
3.5 Pemerangkapan (Trapping)
Teknik ini dilakukan untuk mendapatkan keanekaragaman spora FMA.
Langkah pertama yang dilakukan adalah menyiapkan media tanam Zea mays dengan menggunakan pasir. Pasir dicuci sampai bersih dan dimasukkan dalam bak
persemaian. Benih-benih Zea mays yang digunakan sebagai tanaman inang terlebih dahulu direndam dalam larutan chlorox 5,25% selama 5 menit sebagai upaya sterilisasi permukaan. Kemudian direndam dalam air selama 5 menit untuk
memecahkan dormansi yang mungkin terjadi. Benih-benih tersebut disemaikan dalam
bak persemaian hingga muncul dua helai daun. Setelah itu, penanaman dilakukan
untuk trapping.
Teknik trapping yang digunakan dalam penelitian ini berdasarkan metode Brundrett et al. (1996) dengan menggunakan pot kultur terbuka. Media tanam yang digunakan berupa campuran sampel tanah ± 50 g dan pasir ± 150 g. Teknik pengisian
media tanam dalam pot kultur adalah pot kultur diisi dengan pasir sampai sepertiga
volume pot, kemudian dimasukkan sampel tanah dan terakhir ditutup dengan pasir
sehingga media tanam tersusun atas pasir - sampel tanah dari lapangan - pasir.
Setelah itu, pemeliharaan kultur dilakukan yang meliputi penyiraman, pemberian
hara, dan pengendalian hama. Larutan hara yang digunakan adalah hyponex merah
(25-5-20) dengan konsentarsi 1 g/L. Pemberian larutan hara dilakukan setiap minggu
sebanyak 20 mL tiap pot kultur. Teknik ini dilakukan selama 8 minggu, kemudian
BAB IV
HASIL DAN PEMBAHASAN
4.1 Sifat Kimia Tanah
Hasil pengukuran sifat kimia tanah dari lapangan dengan kedalaman 0-20 cm
dapat diketahui dengan menganalisis beberapa parameternya, seperti pH, C-organik,
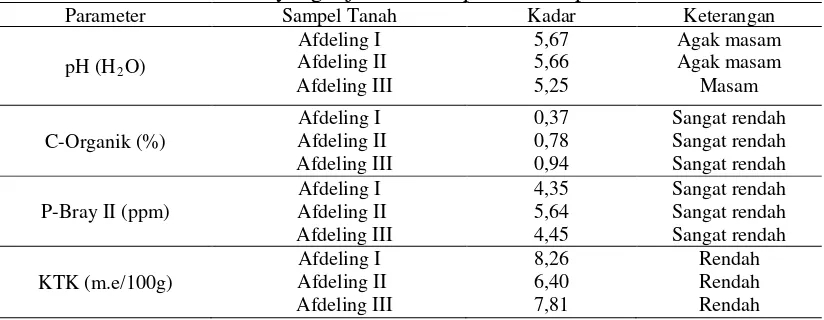
fosfor (P), dan kapasitas tukar kation (KTK) yang dapat dilihat pada Tabel 2.
Tabel 2. Hasil analisis tanah yang dijadikan sampel isolasi spora FMA
Parameter Sampel Tanah Kadar Keterangan
pH (H2
Hasil analisis menunjukkan bahwa tingkat kesuburan tanah pada Afdeling I,
II, dan III tergolong rendah. Kadar pH tanah yang rendah menunjukkan bahwa FMA
yang diperoleh mampu beradaptasi pada pH masam. Tingginya kemasaman tanah
disebabkan oleh banyaknya konsentrasi ion hidrogen (H+) di dalam tanah. Semakin
banyak ion H+
Dalam penelitian ini, kandungan fosfor (P) yang diperoleh sangat rendah. Hal
ini menunjukkan bahwa kemasaman tanah mempengaruhi ketersediaan unsur hara
terutama P. Purwowidodo (2000) menyatakan ketersediaan P akan menurun pada pH maka pH tanah akan semakin masam (Sutedjo dan Kartasapoetra,
2002). Kadar C-organik yang diperoleh (sangat rendah) sejalan dengan pH tanah.
Menurut Hariyono (2009) kandungan C-organik yang rendah diikuti dengan
tukar kation (KTK). Rendahnya kadar KTK yang diperoleh menunjukkan bahwa
kondisi tanah pada areal penelitian memiliki tingkat kesuburan yang rendah. Menurut
Hardjowogeno dan Rayes (2003), KTK merupakan sifat kimia tanah yang erat
kaitannya dengan ketersediaan hara bagi tanaman. Tinggi rendahnya kadar KTK
dipengaruhi oleh C-organik dalam tanah. Dengan demikian, hasil analisis tanah
menunjukkan bahwa kondisi tanah pada areal penelitian dapat digolongkan sama.
4.2 Kepadatan Spora Fungi Mikoriza Arbuskula (FMA)
Kepadatan spora FMA yang diperoleh dari lapangan maupun setelah trapping
dalam 50 g sampel tanah dapat dilihat pada Gambar 3. Jumlah spora hasil trapping
lebih tinggi dibandingkan hasil lapangan. Kepadatan spora yang tertinggi dari hasil
lapangan dan trapping terdapat pada Afdeling I, masing-masing 248 dan 336 spora/50 g tanah.
Kepadatan spora FMA yang diperoleh dari hasil lapangan maupun trapping
pada Afdeling I, II, dan III tergolong sama. Hal ini disebabkan oleh adanya sifat
kimia tanah yang sama dari setiap Afdeling sehingga mengakibatkan kondisi tanah
pada setiap Afdeling juga sama. Berdasarkan Smith dan Read (1997), kepadatan
spora FMA yang diperoleh pada setiap Afdeling dari hasil lapangan tergolong tinggi
(225-248 spora/50 g tanah) dan trapping sangat tinggi (307-336 spora/50 g tanah). Hasil yang diperoleh ini lebih tinggi dibandingkan dari hasil penelitian Nadarajah
(1999); Widiastuti (2004); dan Nurhalisyah (2012) pada areal perkebunan kelapa
sawit yang masing-masing memperoleh 55-57; 2-52; dan 8 spora/50 g tanah.
Perbedaan kepadatan spora ini dapat disebabkan oleh sifat kimia tanah yang berbeda
pada masing-masing lokasi sehingga tingkat kepadatan spora yang diperoleh juga
berbeda.
Dalam penelitian ini, kepadatan spora FMA yang tinggi disebabkan oleh sifat
kimia tanah yang rendah sehingga menunjukkan adanya hubungan yang tidak sejalan
antara sifat kimia tanah dengan kepadatan spora. Songachan dan Kayang (2011)
menunjukkan bahwa kepadatan spora yang sangat tinggi (2.550 dan 2.522 spora/50 g
tanah) diperoleh pada kandungan P 0,15% dan 0,47% (rendah) dengan pH 5,89 dan
5,66. Penelitian lainnya juga memperoleh hasil yang sama, yaitu kepadatan spora
yang tinggi ditemukan pada sifat kimia tanah yang rendah (Setiadi dan Setiawan,
2011; Songachan dan Kayang, 2011). Dengan demikian, kepadatan spora yang tinggi
dipengaruhi oleh kadar P yang rendah. Selain itu, beberapa hasil penelitian, seperti
Hindumathi dan Reddy (2011); Songachan et al. (2011); Puspitasari et al. (2012); dan Margarettha (2010) menunjukkan bahwa kepadatan spora FMA yang tinggi diperoleh
pada kondisi tanah (pH, C-organik, dan KTK) yang tinggi. Oleh karena itu, kepadatan
spora yang tinggi tidak hanya ditemukan pada kadar pH, C-organik, dan KTK yang
rendah melainkan pada kadar yang tinggi juga.
tinggi dibandingkan dari lapangan. Perbedaan ini diduga karena adanya perlakuan
stressing pada saat trapping. Perlakuan stressing menyebabkan tanaman inang mengalami cekaman kekeringan, dan merangsang pembentukan spora yang lebih
banyak. Widiastuti (2004) juga memperoleh hasil yang sama, bahwa kepadatan spora
hasil trapping (1-237 spora/50 g tanah) lebih tinggi dibandingkan lapangan (2-52 spora/50 g tanah) pada areal perkebunan kelapa sawit. Hasil penelitian Pulungan
(2010); Adawiyah (2009); dan Hartoyo et al. (2011) juga menunjukkan bahwa kepadatan spora hasil trapping lebih tinggi dibandingkan lapangan. Oleh karena itu, perlakuan stressing berpengaruh terhadap jumlah spora FMA. Delvian (2006) menyatakan bahwa produksi spora FMA meningkat pada kondisi kering. Hernandez
et al. (1986) juga menyatakan bahwa pada kondisi kering (cekaman air) akan merangasang pembentukan spora lebih awal.
Perbedaan jumlah spora hasil lapangan dengan trapping terjadi karena kondisi tanaman dan faktor kemampuan infeksi dari FMA terhadap akar tanaman inang. Hal
ini menunjukkan bahwa eksudat akar juga berpengaruh terhadap kepadatan spora.
Eksudat yang dihasilkan mempengaruhi perkecambahan spora FMA, seperti laporan
Bakhtiar (2002) bahwa komposisi eksudat tanaman inang mampu meningkatkan
perkecambahan spora. Selain itu, Viierheilig (2003) menyatakan bahwa eksudat akar
merupakan faktor penting yang mempengaruhi perkecambahan spora pada tahap
awal.
4.3 Persentase Kolonisasi Akar
Hasil pengamatan persentase kolonisasi akar pada tanaman kelapa sawit
menunjukkan asosiasi antara FMA dengan akar yang membentuk hifa atau vesikula
pada struktur akar tanaman (Gambar 4). Rata-rata persentase kolonisasi sampel akar
(a) (b)
Hifa Vesikula
Persentase kolonisasi pada Afdeling I,II, dan III memiliki nilai yang hampir
sama dan tergolong sedang. Setiadi et al. (1992) menyatakan bahwa persentase kolonisasi tergolong sedang jika berada di antara 26-50%. Hasil penelitian
Nurhalisyah (2012) juga memperoleh persentase kolonisasi yang tergolong sedang
(35%) pada areal perkebunan kelapa sawit. Dalam penelitian ini, persentase
kolonisasi yang diperoleh menunjukkan adanya hubungan yang sejalan atau
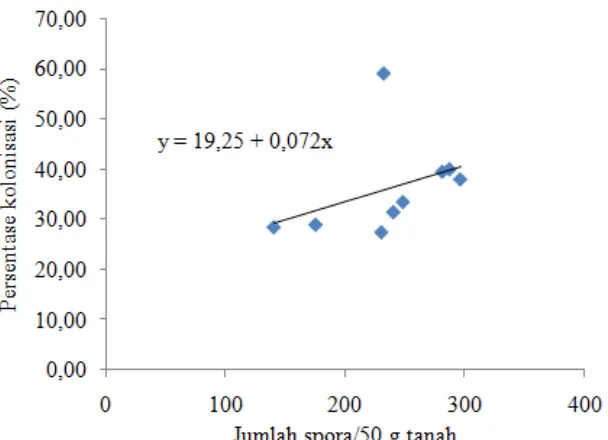
berkorelasi positif dengan kepadatan spora (Gambar 6).
Gambar 6. Korelasi persentase kolonisasi dengan kepadatan spora (x) jumlah spora, (y) persentase kolonisasi
Berdasarkan Gambar 6, menunjukkan bahwa peningkatan persentase
kolonisasi FMA dipengaruhi oleh peningkatan jumlah spora. Persentase kolonisasi
akan meningkat sebesar 0,072% setiap penambahan 1 spora. Smith dan Read (1997)
menyatakan bahwa persentase kolonisasi FMA akan meningkat seiring dengan
peningkatan jumlah spora. Penelitian lainnya juga memperoleh hasil yang sama,
bahwa persentase kolonisasi sejalan dengan kepadatan spora (Delvian, 2010;
Kemampuan kolonisasi akar oleh FMA dalam penelitian ini dipengaruhi oleh
kandungan P yang sangat rendah. Oleh karena itu, kandungan P yang sangat rendah
dapat merangsang kolonisasi FMA. Smith dan Read (1997) menyatakan bahwa pada
ketersediaan P yang rendah akan merangsang kolonisasi FMA. Oleh karena itu,
kolonisasi FMA lebih cepat terbentuk pada kondisi kandungan P yang rendah.
Faktor lain yang juga mempengaruhi persentase kolonisasi adalah curah
hujan. Pada saat pengambilan sampel, curah hujan bulanan di lapangan berkisar 269
mm. Kriteria ini tergolong sedang karena berada di antara 101-300 mm (BMKG,
2013). Pada kondisi seperti ini kecepatan perkecambahan spora meningkat sehingga
kolonisasi pada akar tanaman juga meningkat. Clark (1997) menyatakan bahwa
adanya air yang cukup dari curah hujan akan membantu proses perkecambahan spora
FMA sehingga meningkatkan kolonisasi FMA. Pengaruh perubahan musim ini
berhubungan dengan aktivitas tanaman inang dan FMA itu sendiri. FMA adalah
simbion obligat. Oleh karena itu, semua faktor yang mempengaruhi tanaman inang
juga mempengaruhi FMA. Kondisi terbaik bagi pertumbuhan dan perkembangan
tanaman inang akan memberikan pertumbuhan dan perkembangan terbaik bagi FMA.
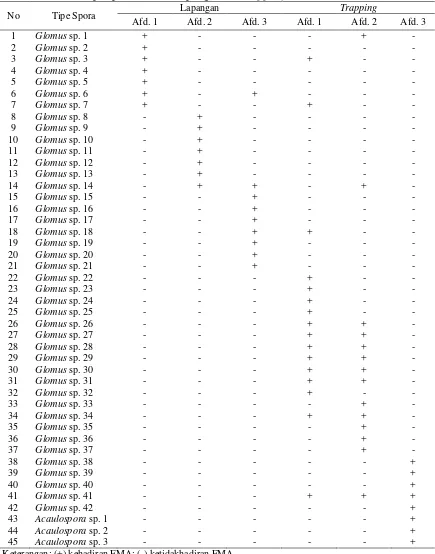
4.4 Tipe dan Karakteristik Spora FMA
Pengamatan spora FMA yang ditemukan dari lapangan maupun trapping
memiliki tipe dan karakteristik yang berbeda. Perbedaan karakteristik yang
ditemukan berdasarkan bentuk spora, permukaan spora, dinding spora, warna, dan
tangkai spora (Hyphal attachment). Hasil isolasi dan identifikasi dari lapangan hanya terdapat 1 genus spora FMA yaitu Glomus yang terdiri dari 21 tipe spora. Kemudian hasil trapping terdapat 2 genus spora FMA yaitu Glomus 26 tipe spora dan
Tabel 3. Tipe dan karakteristik spora FMA dari lapangan dan trapping Tipe spora Reaksi dengan
Melzer’s Karakteristik Lapangan Trapping
Glomus sp. 1
Tidak bereaksi Spora berwarna coklat kehitaman, berbentuk bulat, permukaan relatif kasar dan berdinding tebal. Tidak mempunyai tangkai spora (Hyphal attachment)
Glomus sp. 2
−
Tidak bereaksi Spora berwarna coklat, berbentuk bulat, permukaan relatif kasar dan berdinding tebal. Tidak mempunyai tangkai spora (Hyphal attachment)
Glomus sp. 3
Tidak bereaksi Spora berwarna coklat, berbentuk bulat, permukaan relatif kasar dan berdinding tipis. Tidak mempunyai tangkai spora (Hyphal attachment)
Glomus sp. 4
−
Tidak bereaksi Spora berwarna coklat, berbentuk bulat, permukaan halus dan berdinding tebal. Tidak mempunyai tangkai spora (Hyphal attachment)
Glomus sp. 5
−
Tidak bereaksi Spora berwarna coklat kekuningan, berbentuk bulat, permukaan agak kasar, terdapat lipatan pada bagian dalam dan berdinding tipis. Tidak mempunyai tangkai spora (Hyphal attachment)
Glomus sp. 6
−
Lanjutan
Glomus sp. 7
Tidak bereaksi Spora berwarna coklat kehijauan, berbentuk bulat, permukaan kasar dan berdinding tipis. Tidak mempunyai tangkai spora (Hyphal attachment)
Glomus sp. 8
−
Tidak bereaksi Spora berwarna coklat kekuningan, berbentuk bulat, permukaan relatif kasar, terdapat lipatan pada bagian dalam dan berdinding tipis. Tidak mempunyai tangkai spora (Hyphal attachment)
Glomus sp. 9
− Tidak bereaksi
Spora berwarna coklat, berbentuk bulat, permukaan kasar dan berdinding tebal. Tidak mempunyai tangkai spora (Hyphal attachment)
Glomus sp. 10
− Tidak bereaksi
Spora berwarna coklat kekuningan, berbentuk bulat, permukaan halus, terdapat lipatan pada bagian dalam dan berdinding tebal. Tidak mempunyai tangkai spora (Hyphal attachment)
Glomus sp. 11
− Tidak bereaksi
Spora berwarna coklat kekuningan, berbentuk bulat, permukaan agak kasar dan berdinding tebal. Tidak mempunyai tangkai spora (Hyphal attachment)
Glomus sp. 12
− Tidak bereaksi
Lanjutan permukaan agak kasar dan berdinding tipis. Tidak mempunyai tangkai spora (Hyphal attachment)
Glomus sp. 14 (Hyphal attachment)
Glomus sp. 15 (Hyphal attachment)
Glomus sp. 16 (Hyphal attachment)
Glomus sp. 17
− Tidak bereaksi
Spora berwarna coklat kehitaman, berbentuk bulat, permukaan agak kasar dan berdinding tebal. Tidak mempunyai tangkai spora (Hyphal attachment)
Glomus sp. 18
Tidak bereaksi
Lanjutan terdapat lipatan pada bagian dalam dan berdinding tipis. Tidak mempunyai tangkai spora (Hyphal attachment)
Glomus sp. 20
− Tidak bereaksi
Spora berwarna coklat, berbentuk bulat, permukaan halus, terdapat lingkaran hitam pada bagian dalam dan berdinding tebal. Tidak mempunyai tangkai spora (Hyphal attachment)
Glomus sp. 21
− Tidak bereaksi
Spora berwarna coklat kehijauan, berbentuk bulat, permukaan relatif kasar dan berdinding tipis. Tidak mempunyai tangkai spora (Hyphal attachment)
− (Hyphal attachment)
− (Hyphal attachment)
− (Hyphal attachment)
− Tidak bereaksi
Lanjutan (Hyphal attachment)
− permukaan agak kasar dan berdinding tipis. Tidak mempunyai tangkai spora (Hyphal attachment)
−
Glomus sp. 28
Tidak bereaksi
Spora berwarna coklat, berbentuk bulat, permukaan agak kasar dan berdinding tipis. Tidak mempunyai tangkai spora (Hyphal attachment) permukaan relatif kasar dan berdinding tipis. Tidak mempunyai tangkai spora (Hyphal attachment)
− permukaan agak kasar dan berdinding tipis. Tidak mempunyai tangkai spora (Hyphal attachment)
−
Glomus sp. 31
Tidak bereaksi
Spora berwarna coklat kemerahan, berbentuk bulat, permukaan agak kasar dan berdinding tebal. Tidak mempunyai tangkai spora (Hyphal attachment)
−
Glomus sp. 32
Tidak bereaksi
Lanjutan kasar dan berdinding tebal. Tidak mempunyai tangkai spora (Hyphal attachment)
−
Glomus sp. 34
Tidak bereaksi
Spora berwarna coklat kemerahan, berbentuk bulat, permukaan arelatif kasar dan berdinding tebal. Tidak mempunyai tangkai spora (Hyphal attachment)
− lingkaran pada bagian dalam dan berdinding tebal. Tidak mempunyai tangkai spora (Hyphal attachment)
− (Hyphal attachment)
− (Hyphal attachment)
−
Glomus sp. 38
Tidak bereaksi
Spora berwarna coklat kekuningan, berbentuk bulat, permukaan relatif kasar dan berdinding tebal. Tidak mempunyai tangkai spora (Hyphal attachment)
Lanjutan tangkai spora (Hyphal attachment) permukaan agak kasar dan berdinding tebal, terdiri dari 2 lapis. Tidak mempunyai tangkai spora (Hyphal attachment) (Hyphal attachment)
−
Acaulospora sp. 1
Bereaksi
Spora berwarna kuning, berbentuk bulat, permukaan kasar dan berdinding tebal. Tidak mempunyai tangkai spora (Hyphal attachment)
− (Hyphal attachment)
−
Acaulospora sp. 3
Bereaksi
Berdasarkan Tabel 3 tipe spora hasil trapping lebih beragam dibandingkan dari lapangan. Hal ini diduga karena jumlah spora yang ditemukan di lapangan lebih
sedikit dibandingkan hasil trapping. Jumlah spora yang lebih banyak pada saat isolasi kemungkinana akan diikuti dengan bertambahnya tipe spora FMA.
Dalam penelitian ini, jumlah keseluruhan spora FMA yang dihasilkan
sebanyak 45 tipe spora yaitu, 42 tipe Glomus dan 3 tipe Acaulospora. Hal ini menunjukkan bahwa tipe Glomus mempunyai tingkat penyebaran yang lebih luas dibandingkan Acaulospora (Tabel 4). Hasil penelitian Nadarajah dan Nawawi (1993); Nurhalisyah (2012); Widiastuti dan Kramadibrata (1993); dan Kartika (2006) juga
menunjukkan bahwa tipe Glomus lebih sering ditemukan daripada tipe lainnya pada areal perkebunan kelapa sawit yang masing-masing memperoleh 7 tipe Glomus, 1 tipe Sclerocystis, 2 tipe Acaulospora, dan 2 tipe Gigaspora; 19 tipe Glomus dan 3 tipe
Acaulospora; 7 tipe Glomus dan 4 tipe Acaulospora; dan 7 tipe Glomus dan 5 tipe
Acaulospora. Selain itu, penelitian lain yang juga menunjukkan bahwa tipe Glomus
memiliki kehadiran paling tinggi (Songachan dan Kayang, 2011; Hindumathi dan
Reddy, 2011; Muzakkir, 2010; Shi et al., 2007; Puspitasari et al., 2012; Pulungan, 2010; Nurhandayani et al., 2013). Dengan demikian, dapat disimpulkan bahwa tingginya tingkat penyebaran tipe Glomus disebabkan oleh daya adaptasi yang tinggi terhadap kondisi lingkungan dibandingkan genus lainnya (Johnson-Green et al.,
Tabel 4. Sebaran tipe spora FMA di lapangan dan trapping
No Tipe Spora Lapangan Trapping
Afd. 1 Afd. 2 Afd. 3 Afd. 1 Afd. 2 Afd. 3
Puspitasari et al. (2012) menyatakan keanekaragaman tipe spora FMA yang tinggi disebabkan oleh kondisi lingkungan yang lebih sesuai, optimal, dan
kompatibel, serta tidak adanya jamur antagonis yang menghambat sporulasi FMA.
Dengan demikian, kondisi seperti ini dapat mendukung pertumbuhan dan
perkembangan spora FMA.
Faktor lain yang juga mempengaruhi tipe spora FMA adalah waktu
pengambilan sampel. Dalam penelitian ini, pengambilan sampel hanya dilakukan
dalam satu kali sehingga tipe-tipe spora FMA yang diperoleh belum tentu mewakili
seluruh spora dari genus yang berbeda. Kemungkinan ada spora yang belum
terbentuk saat dilakukan pengambilan sampel. Delvian (2003) menyatakan bahwa
adanya perubahan tipe spora FMA dalam setiap pengamatan (pengambilan sampel),
sehingga setiap tipe FMA membentuk spora pada saat yang berbeda, tergantung
fenologi dan responnya terhadap tanaman inang. Hal ini didukung oleh penelitian
Hall (1984) yang menunjukkan bahwa tipe spora FMA yang dihasilkan setiap
tahunnya tidak sama karena ada beberapa tipe spora FMA yang penyebarannya
terbatas. Oleh karena itu, spora yang terkumpul dari satu wilayah dalam satu waktu
BAB V
KESIMPULAN DAN SARAN
5.1Kesimpulan
Dari hasil penelitian yang telah dilakukan dapat disimpulkan bahwa:
1. Kepadatan spora FMA pada Afdeling I,II, dan III dari hasil lapangan maupun
trapping tergolong tinggi. Jumlah spora tertinggi dari hasil lapangan dan trapping
diperoleh pada Afdeling I, yaitu masing-masing 248 dan 336 spora/50 g tanah.
2. Persentase kolonisasi FMA yang tertinggi diperoleh pada Afdeling I, yaitu 42%.
3. Tipe spora FMA yang diperoleh pada rizosfer tanaman kelapa sawit terdiri dari
dua genus yaitu Glomus dan Acaulospora. Genus Glomus sebanyak 42 tipe dan
Acaulospora sebanyak 3 tipe.
5.2 Saran
1. Dalam penelitian eksplorasi FMA ini sebaiknya dilakukan pengambilan sampel
lebih dari satu kali agar data keanekaragaman spora FMA yang diperoleh lebih
valid.
2. Penelitian selanjutnya diperlukan identifikasi spora FMA sampai pada tingkat
DAFTAR PUSTAKA
Abbott, L.K. 1982. Comparative Anatomy of Vesicular Arbuscular Mycorrhizas Formadon Subterranean Clover. Aust. J. Bot 30: 485-499.
Abbot, L.K, dan A.D. Robson. 1996. Working with Mycorrhizas in Forestry and Agriculture. ACIAR Monograph.
Adawiyah. 2009. Status dan Keanekaragaman Fungi Mikoriza Arbuskula Berdasarkan Gardien Salinitas di Hutan Pantai Pulau Pandang Batubara, Sumatera Utara. Tesis. Program Pascasarjana Universitasa Sumatera Utara. Medan.
Bakhtiar,Y. 2002. Selection of Vascular Mycorrhiza (VAM) Fungi, Host Plants and Spore Numbers for Producing Inoculum. Jurnal Biosains dan Bioteknologi Indonesia 2 (1): 36-40.
Balitbang Pertanian. 2008. Teknologi Budidaya Kelapa Sawit. Balai Besar Pengkajian dan Pengembangan Teknologi Pertanian.
Bertham, Y.H. 2003. Teknik Pemurnian Biakan Monoxenic FMA dengan Metode Cawan Petri dan Tabung Reaksi. Jurnal Ilmu-ilmu Pertanian Indonesia 5 (1): 18-26.
BMKG. 2013. Distribusi Curah Hujan September 2013. Diakses melalui
Brundrett, M., N. Bougher, B. Dell, T. Grave, dan N. Malajezuk. 1996. Working with Mycorrizha in Forestry and Agriculture. Australia Centre for Internasional Agricultural Researche (ACIAR). Canberra.
Cavagnaro, T.R, dan A.W. Martin. 2010. The Role of Mycorrhizas in Plant Nutrition: Field and Mutant Based Approaches.
Chaudhary, V., R. Kapoor, AK. Bhatnagar. 2008. Effectiveness of Two Arbuscular Mycorrhizal Fungi on Concentrations of Essential Oil and Artemisinin in Three Accessions of Artemisia annua L. Appl Soil Ecol. 40:174–181.
Clark, R.B. 1997. Arbuscular Mycorrihiza Adaptation, Spore Germination, Root Colonization, and Host Plant Growth and Mineral Acquisition at Low pH.
Daniels, B.A. dan J.M. Trappe. 1980. Factors Affecting Spore Germination of The Vesicular-Arbuscular Mycorrhizal Fungus, Glomus epigaeus. Mycologia 72: 457-471.
Delvian. 2003. Keanekaragaman dan Potensial Pemanfaatan Fungi Mikoriza Arbuskula (FMA) di Hutan Pantai. Disertasi. Program Pascasarjana Institut Pertanian Bogor. Bogor.
Delvian. 2006. Peranan Ekologi dan Agronomi Cendawan Arbuskula Mikoriza. Karya Tulis. Medan. Departemen Kehutanan Universitas Sumatera Utara. Medan.
Delvian. 2010. Keberadaan Cendawan Mikoriza Arbuskula di Hutan Pantai Berdasarkan Gradien Salinitas. Jurnal Ilmu Dasar 11 (2): 133-142.
Ebongue, G.F.N, dan K. Paul. 2012. Control Approaches against Vascular Wilt Disease of Elaeis guineensis Jacq. Caused by Fusarium oxysporum f. sp. elaeidis. Journal of Biology and Life Science 3(1): 160-173.
Ervayenri, Y. Setiadi, N. Sukarno, dan C. Kusmana. 1997. Arbuscular Mycorrhizal Fungi (AMF) Diversity in Peat Soil Influenced by Land Vegetation Types.
Proceedings of International Confrence on Mycorrhizas in Sustainable Tropical Agriculture and Forest Ecosystems: 85-90.
Giovanetti, M, dan B. Mosse. 1980. An Evaluation of Technique for Meaning Vesikular Mycorrhiza Infection in Roots. New Phytologiest 84: 489-500. Hall, I.R. 1984. Effect of Inoculant Mycorrhizal Fungi on White Clover Growth in
Soil Cores. Journal Agriculture Sci. 102: 719-723.
Hariyono. 2009. Kandungan C-organik dan N-Total pada Seresah dan Tanah pada 3 Tipe Fisiognomi (Studi Kasus di Wanagama I, Gunung Kidul, DIY). Jurnal Ilmu Tanah dan Lingkungan 9 (1): 49-57.
Hardjowigeno, S. 1993. Ilmu Tanah. Mediyatama sarana perkasa. Jakarta
Hardjowigeno, S, dan Rayes, L. 2003. Tanah Sawah: Karakteristik, Kondisi dan Permasalahan Tanah Sawah di Indonesia. Bayumedia Publishing, Malang. Jawa Timur.
Hernandez, A.P., El-Sharkawy, E. Sieverding, dan S. Toro. 1986. Influence of Water Stress on Growth and Formation of VA Mycorrhiza of 20 Cassava Cultivars. Dalam Gianinazzi-Pearson, V. dan S. Gianinazzi (Eds). Physiological and Genetical Aspect of Mycorrhizae. Proceeding of the 1st Europens Symposium on Mycorrhizae.
Hindumathi, A. dan B.N. Reddy. 2011. Occurrence and Distribution of Arbuscular Mycorrhizal Fungi and Microbial Flora in The Rhizosphere Soils of Mungbean [Vigna radiate (L.) Wilczek] and Soybean [Glycine max (L.) Merr.] from Adilabad, Nizamabad and Karimnagar Districts of Andhra Pradesh State, India.
Advances in Bioscience and Biotechnology 2: 275-286.
INVAM. 2013. International Culture Collection of (Vesicular) Arbuscular Mycorrhizal Fungi. Diakses melalui
April 2013.
Janouskova, M., D. Pavlikova, dan M. Vosatka. 2006. Potential Contribution of Arbuscular Mychorriza to Cadmium Immobilitation in Soil. Chemosphere 07. 007
Johson-Green, P.C., N.C. Kenkel, dan T. Booth. 1995. The Distribution and Phenology of Arbuscular Mycorrhizas Along an Inland Salinity Gradient.
Can. Journal. Bot. 73: 1318-1327.
Kartika, E. 2006. Isolasi, Karakterisasi dan Pengujian Keefektivan Cendawan Mikoriza Arbuskular Terhadap Bibit Kelapa Sawit pada Tanah Gambut Bekas Hutan. Jurnal Agronomi 10 (2): 63-70
Kormanik, P.P., dan A.C. McGraw. 1982. Quantification of VA Mycorrhizae in Plant Root. Dalam N.C. Shenk (Ed) Methods and Principles of Mycorrhizae Research. The American Phytop. Soc. 46: 37-45.
Maas, E.V., dan R.H. Nieman. 1978. Physiology of Plant Tolerance to Salinity. Dalam G.A. Jung (Ed). Crop Tolerance to Suboptimal Land Conditions. ASA Spec. Pub. 277-299.
Mansur, I., Y. Setiadi, dan R. Primaturi. 2002. Status of Research on Mycorrhizas Arbuscula Associated with Tropical Tree Species. Paper Presented at The Fourth International Wood Science Symposium (4th
Margarettha. 2010. Pemanfaatan Tanah Bekas Tambang Batubara dengan Pupuk Hayati Mikoriza sebagai Media Tanam Jagung Manis. Journal Hidrolitan
1(3): 1 – 10.
IWSS) LIPI-JSPS Core University Program in The Field of Wood Science. 2-3 September 2002. Research Centre for Physic Indonesian Institute of Science, Serpong, Tangerang. Indonesia.
Menge, J.A. 1984. Inoculum Production VA Mycorrhiza. CRC Press. Boca Raton. Florida.
Muleta, D., A. Fassil, N. Sileshi, G. Ulf. 2007. Composition of Coffee Shade Tree Species and Density of Indigenous Arbuscular Mycorrhizal Fungi (AMF) Spores in Bonga Natural Coffee Forest, Southwestern Ethiopia. Forest Ecology and Management 241: 145-154.
Muzakkir. 2010. Keragaman dan Potensi Pemanfaatan FMA Indigenus Bersama Pupuk Hijau Terhadap Tanaman Jarak Pagar (Jatropha curcas L.) di Lahan Kritis. Disertasi. Program Pascasarjana Universitas Andalas. Padang.
Nadarajah, P., dan A. Nawawi. 1993. Mycorrhizal Status of Epiphytes in Malaysia Oil Palm Plantations. Mycorrhiza 4: 21-25.
Nadarajah, P. 1999. Vesicular Arbuscular Mycorrhizal Fungi in Two Malaysia Oil Palm and Cocoa Plantations and Adjacent Grassland. Makalah dalam The International Conference on Mycorrhizas. Mycorrhizas in Sustainable Tropical Agriculture and Forest Ecosystem. Research and Development Centre for Biology, Indonesian Institute of Sciences (LIPI), Bogor.
Nurhalisyah. 2012. Deteksi Keberadaan Fungi Mikoriza pada Lahan Perkebunan Kelapa Sawit di Kalimantan Timur. Jurnal Agroplantae 1 (2): 79-85.
Nurhandayani, R., R. Linda, dan S. Khotimah. 2013. Inventarisasi Jamur Mikoriza Vesikular Arbuskular dari Rhizosfer Tanah Gambut Tanaman Nanas [Ananas comosus (L.) Merr]. Protobiont 2 (3): 146 -151.
Poerwowidodo. 2000. Telaah Kesuburan Tanah. Angkasa. Bandung.
Pulungan, A.S. 2010. Keanekaragaman Fungi Mikoriza Arbuskula di Perkebunan Tebu PTPN 2 Sei Semayang Sumatera Utara. Tesis. Program Pascasarjana Universitas Sumatera Utara. Medan.
Puspitasari, D., K.I. Purwani, dan A. Muhibuddin. 2012. Eksplorasi Vesicular Arbuscular Mycorrhiza (VAM) Indigenous pada Lahan Jagung di Desa Torjun, Sampang Madura. Jurnal Sains Dan Seni Its 1: 19-22.
Rothwell, F.M. 1984. Agregation of Surface Mine Soil by Interaction Between VAM Fungi and Lignin Degradation Product of Lespedeza. Plant Soil 80: 99-104. Schenck, N.C, dan N.V. Schroder. 1974. Temperature Respone of Endogone
Micorrhiza on Soybean Roots. Mycology: 600-605.
Setiadi, Y., Mansur, dan A. Setiawan. 1992. Mikrobiologi Tanah Hutan. Pusat Antar Universitas Bioteknologi Tanaman Pangan. Institut Pertanian Bogor, Bogor.
Setiadi, Y., dan A. Setiawan. 2011. Studi Status Fungi Mikoriza Arbuskula di Areal Rehabilitasi Pasca Penambangan Nikel (Studi Kasus PT INCO Tbk. Sorowako, Sulawesi Selatan. Jurnal Silvikultur Trovika 3(1): 88-95.
Shi, Z. Y., Y.L. Zhang., L.X. Li., G. Feng., Y.C. Tian, dan P. Christie. 2007. Diversity of Arbuscular Mycorrhizal Fungi Associated With Desert Ephemerals in Plant Communities of Junggar Basin, North West China.
Journal. Applied Soil Ecology (35): 10 –20.
Siguenza, C., I. Espejel, dan E.B. Allen. 1996. Seasonality of Mycorrhizae in Coastal Sand Dunes of Baja California. Mycorryhiza 6: 151-157.
Smith, S.E., dan D.J. Read. 1997. Mycorrhizal symbiosis (Second Edition). Academic Press. Harcourt Brace dan Company Publisher. London.
Smith, S.E, dan D.J. Read. 2008. Mycorrhizal Symbiosis (Third Edition). Academic Press. Great Britain.
Songachan, L.S., I. Lyngdoh, dan H. Kayang. 2011. Colonization of arbuscular mycorrhizal fungi in moderately degraded sub-tropical forest stands of Meghalaya, Northeast India. Journal of Agricultural Technology 7(6): 1673-1684.
Suhardi. 1988. Pedoman Kuliah Mikoriza Vesikular Arbuskular (MVA). Proyek Peningkatan Perguruan Tinggi Universitas Gadjah Mada, PAU-Bioteknologi UGM.
Sutedjo, M.M, dan Kartasapoetra A.G. 2002. Pengantar Ilmu Tanah, Terbentuknya Tanah dan Tanah Pertanian. Penerbit Rineka Cipta, Jakarta 152: 99-106. Widiastuti, H, dan K. Kramadibrata. 1993. Identifikasi Jamur Mikoriza Bervesikula
Arbuskula di Beberapa Kebun Kelapa Sawit di Jawa Barat. Menara Perkebunan 61: 13-20.
Widiastuti, H. 2004. Biologi Interaksi Cendawan Mikoriza Arbuskula Kelapa Sawit pada Tanah Masam sebagai Dasar Pengembangan Teknologi Aplikasi Dini. Disertasi Doktor. Sekolah Pascasarjana, Institut Pertanian Bogor, Bogor.
Whiffen, L. 2007. Arbuscular Mycorrhizal Fungi and Carbon Sequestration in Soil. A Research Thesis Submitted to Fulfil The Requirements for The Degree of Doctor of Philosophy. School of Biological Sciences, The University of Sydney.
Verhey, W. 2010. Growth and Production of Oil Palm. In: Verheye, W. (ed.), Land Use, Land Cover and Soil Sciences. Encyclopedia of Life Support Systems (EOLSS), UNESCO-EOLSS Publishers, Oxford, UK. Diakses melalui
http://www.eolss.net
Lampiran 2. Kriteria Penilaian Sifat Kimia Tanah
Sifat Tanah Sangat
Rendah Rendah Sedang Tinggi
Sangat
Tinggi
C-Organik
(%) < 1,00 1,00-2,00 2,01-3,00 3,01-5,00 > 5,00
P-Bray II
(ppm) < 8,00 8,0-15 16-25 26-35 > 35
KTK
(m.e/100g) < 5 10-16 17-24 25-40 > 40
Sangat
Masam Masam
Agak
Masam Netral
Agak
Netral Alkalis
pH (H2O) < 4,5 4,5-5,5 5,6-6,5 6,6-7,5 7,6-8,5 > 8,5