ABSTRAK
SEKAR WINAHYU ARIADINI. Aktivitas Superoksida Dismutase dan Patologi
Anatomi pada Hati Tikus dengan Perlakuan Parasetamol dan Suplemen Kelapa
Kopyor. Dibimbing oleh HASIM, AE ZAINAL HASAN, dan AGUS
SETIYONO.
ABSTRACT
SEKAR WINAHYU ARIADINI. Superoxide Dismutase Activity and Pathology
Anatomy of Rat Liver Treated with Paracetamol and Kopyor Coconut
Supplement. Supervised by HASIM, AE ZAINAL HASAN, and AGUS
SETIYONO.
PENDAHULUAN
Radikal bebas merupakan unsur atau senyawa yang sangat reaktif dan memiliki satu atau lebih elektron yang tidak berpasangan (Kartikawati 1999). Sifat reaktif radikal bebas dapat merusak jaringan tubuh sehingga dapat menimbulkan berbagai macam penyakit metabolis, seperti kanker, penyakit pembuluh darah, disfungsi otak dan sistem saraf.
Unsur atau senyawa radikal bebas secara alami sudah terbentuk di dalam tubuh melalui berbagai proses kimiawi yang kompleks. Unsur atau senyawa ini merupakan hasil sampingan dari proses oksidasi atau pembakaran sel dalam yang berlangsung pada waktu seseorang bernafas, melakukan kegiatan olah raga yang berlebihan, mengkonsumsi alkohol, mengalami peradangan atau ketika tubuh berhadapan dengan polusi lingkungan seperti asap kendaraan bermotor, asap rokok, radiasi matahari dan sebagainya.
Antioksidan adalah zat yang mampu memperlambat atau mencegah proses oksidasi (Tejasari 2000), dan berfungsi untuk menghentikan kerusakan sel akibat radikal bebas (Saleh 2001). Untuk mengatasi bahaya yang timbul akibat radikal bebas, tubuh mengembangkan mekanisme perlindungan, yaitu antioksidan endogen yang terdiri atas enzim-enzim dan berbagai senyawa yang disintesis tubuh (Asikin 2001). Enzim-enzim seperti katalase, glutation peroksidase, dan superoksida dismutase (SOD) merupakan antioksidan endogen yang dapat ditemukan pada berbagai jaringan tubuh (Gitawati 1995).
Superoksida dismutase adalah enzim yang mengakatalisis dismutasi ion superoksida radikal (O2-) menjadi hidrogen peroksida (H2O2) dan molekul oksigen O2. Berdasarkan kofaktor logam dan distribusinya di dalam tubuh, SOD terbagi atas 3 macam, yaitu copper, zinc superoxide dismutase (Cu, Zn-SOD) yang umumnya terdapat dalam sitoplasma eukariot, manganase superoxide dismutase (Mn-SOD) yang biasanya terdapat pada mitokondria organisme aerobik, iron superoxide dismutase (Fe-SOD) yang biasanya terdapat pada prokariot (Mates et al. 1999; Nurwati 2002), dan extra-cellular superoxide dismutase (ec-SOD) yang banyak ditemukan pada cairan ekstraselular pada mamalia (West dan Prohaska 2004).
SOD tergolong enzim yang sangat stabil karena tiap subunit tergabung oleh ikatan non-kovalen dan terangkai oleh rantai disulfida (Fridovich 1986). Enzim ini memainkan peranan yang sangat penting pada garis depan sistem pertahanan antioksidan (Mates et al. 1999). Aktivitas SOD bervariasi pada beberapa organ tikus, terdapat dalam jumlah tertinggi di dalam hati, kemudian berturut-turut dalam kelenjar adrenal, ginjal, limpa, pankreas, otak, paru-paru, lambung, usus, ovarium, timus, dan lemak (Nurwati 2002)
Antioksidan dalam tubuh mempunyai batas tertentu untuk menangkal radikal bebas. Untuk meningkatkan efektivitas antioksidan, beberapa nutrien penting sangat diperlukan oleh tubuh. Efektivitas enzim SOD dapat ditingkatkan dengan adanya nutrien mineral seperti tembaga (Cu) dan Seng (Zn) dan mangan (Mn) (Kartikawati 1999; Tuminah 2000; West dan Prohaska 2004). Kandungan nutrisi yang tinggi pada kelapa kopyor dapat dimanfaatkan sebagai salah satu sumber dan mineral yang penting untuk tubuh, salah satunya adalah sebagai kofaktor antioksidan alami SOD yang terdapat dalam tubuh. Air kelapa kopyor mengandung mineral Mn, K, P, S, dan Mg dalam jumlah yang cukup tinggi, sedangkan pada daging buah kelapa kopyor, kandungan mineral terbanyak adalah Fe, Zn, dan Al (Santoso et al. 1996).
Berdasarkan latar belakang di atas, maka penelitian ini dilakukan dengan tujuan untuk membuktikan bahwa suplemen gizi dalam buah kelapa kopyor yang dapat meningkatkan kerja antioksidan SOD pada tubuh tikus yang diinduksi parasetamol. Hipotesis yang diajukan adalah bahwa kandungan nutrisi dalam daging buah kelapa kopyor dapat menaikkan kerja antioksidan alami SOD pada tikus yang mengalami stres parasetamol. Hasil penelitian yang diperoleh diharapkan dapat memberikan informasi ilmiah mengenai potensi kelapa kopyor sebagai sumber mineral untuk kofaktor antioksidan, yang dapat mencegah kerusakan oksidatif akibat induksi parasetamol, dan meningkatkan nilai tambah kelapa kopyor.
TINJAUAN PUSTAKA
Hati
PENDAHULUAN
Radikal bebas merupakan unsur atau senyawa yang sangat reaktif dan memiliki satu atau lebih elektron yang tidak berpasangan (Kartikawati 1999). Sifat reaktif radikal bebas dapat merusak jaringan tubuh sehingga dapat menimbulkan berbagai macam penyakit metabolis, seperti kanker, penyakit pembuluh darah, disfungsi otak dan sistem saraf.
Unsur atau senyawa radikal bebas secara alami sudah terbentuk di dalam tubuh melalui berbagai proses kimiawi yang kompleks. Unsur atau senyawa ini merupakan hasil sampingan dari proses oksidasi atau pembakaran sel dalam yang berlangsung pada waktu seseorang bernafas, melakukan kegiatan olah raga yang berlebihan, mengkonsumsi alkohol, mengalami peradangan atau ketika tubuh berhadapan dengan polusi lingkungan seperti asap kendaraan bermotor, asap rokok, radiasi matahari dan sebagainya.
Antioksidan adalah zat yang mampu memperlambat atau mencegah proses oksidasi (Tejasari 2000), dan berfungsi untuk menghentikan kerusakan sel akibat radikal bebas (Saleh 2001). Untuk mengatasi bahaya yang timbul akibat radikal bebas, tubuh mengembangkan mekanisme perlindungan, yaitu antioksidan endogen yang terdiri atas enzim-enzim dan berbagai senyawa yang disintesis tubuh (Asikin 2001). Enzim-enzim seperti katalase, glutation peroksidase, dan superoksida dismutase (SOD) merupakan antioksidan endogen yang dapat ditemukan pada berbagai jaringan tubuh (Gitawati 1995).
Superoksida dismutase adalah enzim yang mengakatalisis dismutasi ion superoksida radikal (O2-) menjadi hidrogen peroksida (H2O2) dan molekul oksigen O2. Berdasarkan kofaktor logam dan distribusinya di dalam tubuh, SOD terbagi atas 3 macam, yaitu copper, zinc superoxide dismutase (Cu, Zn-SOD) yang umumnya terdapat dalam sitoplasma eukariot, manganase superoxide dismutase (Mn-SOD) yang biasanya terdapat pada mitokondria organisme aerobik, iron superoxide dismutase (Fe-SOD) yang biasanya terdapat pada prokariot (Mates et al. 1999; Nurwati 2002), dan extra-cellular superoxide dismutase (ec-SOD) yang banyak ditemukan pada cairan ekstraselular pada mamalia (West dan Prohaska 2004).
SOD tergolong enzim yang sangat stabil karena tiap subunit tergabung oleh ikatan non-kovalen dan terangkai oleh rantai disulfida (Fridovich 1986). Enzim ini memainkan peranan yang sangat penting pada garis depan sistem pertahanan antioksidan (Mates et al. 1999). Aktivitas SOD bervariasi pada beberapa organ tikus, terdapat dalam jumlah tertinggi di dalam hati, kemudian berturut-turut dalam kelenjar adrenal, ginjal, limpa, pankreas, otak, paru-paru, lambung, usus, ovarium, timus, dan lemak (Nurwati 2002)
Antioksidan dalam tubuh mempunyai batas tertentu untuk menangkal radikal bebas. Untuk meningkatkan efektivitas antioksidan, beberapa nutrien penting sangat diperlukan oleh tubuh. Efektivitas enzim SOD dapat ditingkatkan dengan adanya nutrien mineral seperti tembaga (Cu) dan Seng (Zn) dan mangan (Mn) (Kartikawati 1999; Tuminah 2000; West dan Prohaska 2004). Kandungan nutrisi yang tinggi pada kelapa kopyor dapat dimanfaatkan sebagai salah satu sumber dan mineral yang penting untuk tubuh, salah satunya adalah sebagai kofaktor antioksidan alami SOD yang terdapat dalam tubuh. Air kelapa kopyor mengandung mineral Mn, K, P, S, dan Mg dalam jumlah yang cukup tinggi, sedangkan pada daging buah kelapa kopyor, kandungan mineral terbanyak adalah Fe, Zn, dan Al (Santoso et al. 1996).
Berdasarkan latar belakang di atas, maka penelitian ini dilakukan dengan tujuan untuk membuktikan bahwa suplemen gizi dalam buah kelapa kopyor yang dapat meningkatkan kerja antioksidan SOD pada tubuh tikus yang diinduksi parasetamol. Hipotesis yang diajukan adalah bahwa kandungan nutrisi dalam daging buah kelapa kopyor dapat menaikkan kerja antioksidan alami SOD pada tikus yang mengalami stres parasetamol. Hasil penelitian yang diperoleh diharapkan dapat memberikan informasi ilmiah mengenai potensi kelapa kopyor sebagai sumber mineral untuk kofaktor antioksidan, yang dapat mencegah kerusakan oksidatif akibat induksi parasetamol, dan meningkatkan nilai tambah kelapa kopyor.
TINJAUAN PUSTAKA
Hati
diafragma, berwarna coklat kemerahan (Macfarlene 2000).
Menurut Ressang (1984) hati memiliki beberapa fungsi, yaitu sekresi empedu, metabolisme protein, karbohidrat, lemak, vitamin, dan mineral, fungsi detoksifikasi, dan pembentukan sel darah merah. Selain fungsi-fungsi tersebut, hati juga memiliki peranan dalam pengaturan kadar glukosa darah. Glikogen sebagai bentuk simpanan gula dalam hati cukup tersedia untuk mempertahankan kadar glukosa darah selama beberapa jam. Bila fungsi hati terganggu, maka akan mudah terjadi hipoglikemia.
Hati merupakan organ yang paling sering mengalami kerusakan. Hal ini disebabkan sebagian besar toksik memasuki tubuh melalui gastrointestinal, dan setelah diserap toksikan dibawa oleh vena porta ke hati (Lu 1995). Beberapa kerusakan yang terdapat di hati antara lain pelemakan hati, nekrosis, degenerasi, dan sirosis.
Pelemakan hati terjadi bila hati mengandung berat lipid lebih dari 5% (Lu 1995). Pelemakan hati dapat dijumpai di tepi, pusat dan di daerah pertengahan atau diseluruh lobuli akibat pelemakan sentral atau perifer yang meluas. Pelemakan patologis disebabkan oleh hipoksemia, yaitu hati tidak dapat membakar lemak. Selain itu dapat juga disebabkan oleh toksin-toksin yang mengurangi atau menghilangkan fungsi lipotik hati. Secara makroskopis hati mengalami piknosis, karioreksis dan kariolisis (Ressang 1984).
Nekrosis hati adalah kematian hepatosit yang dapat bersifat lokal (sentral, pertengahan, perifer) atau masif. Nekrosis hati merupakan suatu manifestasi toksik yang berbahaya tetapi tidak selalu kritis karena hati mempunyai kapasitas tumbuh kembali (regenerasi) yang luar biasa (Lu 1995).
Degenerasi suram, berbutir, albuminoid atau parenkim sering terlihat pada proses-proses sepsis ataupun toksik. Secara makroskopik hati terlihat membesar, pinggirnya membundar dan konsistensi rapuh. Bidang sayatan hati berwarna belang atau terlihat seperti telah dimasak (Ressang 1984).
Sirosis merupakan bentuk peradangan hati kronis, ditandai dengan fibrosis yakni pembentukan jaringan ikat (Nabib 1987). Sirosis ditandai dengan pengerasan hati yang disebabkan oleh bermacam-macam sebab, antara lain bahan-bahan toksik dan parasit yang merusak hati dalam jangka waktu yang lama. Pengerasan terjadi karena hati kehilangan parenkim yang
diikuti dengan pembentukan jaringan ikat secara luas (Ressang 1984).
Ressang (1984) mengungkapkan bahwa daya regenerasi sel-sel hati sangat tinggi. Pada hati normal diketahui bahwa lobektomi sebanyak 70% pada hati mengakibatkan proliferasi sel-sel hati yang sangat tinggi, sehingga dalam 2-3 minggu bagian hati yang mengalami kerusakan dapat pulih kembali.
Radikal Bebas
Dalam mempertahankan kelangsungan hidupnya, makhuk hidup sangat membutuhkan oksigen untuk proses-proses metabolisme dan fisiologis yang terjadi di dalam tubuh. Senyawa oksigen reaktif dalam konsentrasi rendah sangat diperlukan dalam berbagai proses seperti pertahanan terhadap mikroorganisme, namun senyawa oksigen reaktif dalam jumlah besar dapat berbahaya bagi sel dan organisme (Mates dan Jimenez 1999). Sebagai konsekuensi logis dari proses tersebut, dihasilkan produk berupa radikal bebas dalam jumlah kecil sebagai produk antara.
Radikal bebas dalam jumlah berlebihan, pada kondisi patofisiologis tertentu, sangat berbahaya karena dapat mengakibatkan terjadinya beberapa kerusakan atau kelainan, baik proses biokimia maupun fisiologi dalam sel. Hal ini dapat menyebabkan penyimpangan metabolisme yang dapat berakhir dengan kerusakan dan kematian sel (Halliwell dan Gutteridge 1990). Tingkat radikal bebas yang sangat tinggi pada kondisi tertentu dapat merusak DNA, protein, maupun lemak, yang kemudian dapat menyebabkan terjadinya beberapa penyakit dan proses degenerasi seperti ketuaan (ageing) dan karsinogenesis pada manusia dan hewan (Wresdiyati 2003).
Radikal bebas (free radical), oksidan (oxidant) atau sering disebut senyawa oksigen reaktif (reactive oxygen species) adalah molekul yang mempunyai satu atau lebih elektron yang tidak berpasangan (unpaired electron) pada orbital luarnya (Kartikawati 1999). Termasuk didalamnya adalah radikal superoksida (O2-), hidrogen peroksida (H2O2), radikal hidroksil (.OH), nitrit oksida (.NO), peroksinitrit (.ONOO), peroksil (ROO.), dan alkoksil (RO.).
H2O2+ Cu+ Cu2++ OH.+ OH
-H2O2+ Fe2+ Fe3++ OH.+ OH
-secara kimiawi (Gitawati 1995). Elektron yang tidak berpasangan ini cenderung untuk membentuk pasangan yang menarik elektron dari senyawa lain, sehingga terbentuk radikal baru (Kartikawati 1999). Dalam upaya penstabilan diri atau pemenuhan keganjilan elektronnya, elektron yang tidak berpasangan pada radikal bebas tersebut secara cepat ditransfer atau menarik makromolekul biologis sekitarnya, seperti asam lemak tak jenuh, protein, polisakarida, asam nukleat, dan asam deoksiribonukleat. Makromolekul tersebut merupakan bagian dari sel atau organelnya, maka berakibat kerusakan sel (Tejasari 2000).
Radikal bebas dapat berasal dari dalam tubuh (endogenous), maupun luar tubuh (eksogenous). Di dalam tubuh, radikal bebas dapat terbentuk dari reaksi reduksi normal dalam mitokondria, peroksisom, detoksifikasi senyawa senobiotik, metabolisme obat-obatan, dan fagositasi. Sementara itu, dari luar tubuh, radikal bebas dapat berasal dari asap rokok, radiasi, inflamasi, latihan olahraga yang berlebihan, reperfusi, dan karsinogen (Tejasari 2000).
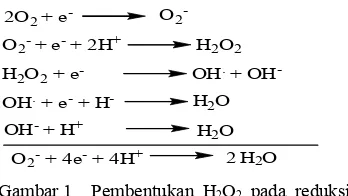
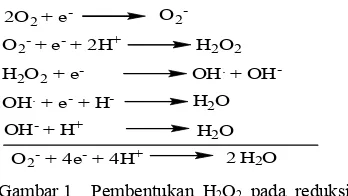
Salah satu sumber radikal bebas endogenus adalah proses transport elektron di dalam mitokondria yang dapat menghasilkan superoksida (Gambar 1), respiratory bursts oleh sel fagosit mampu menghasilkan 70%-90% superoksida dari total penggunaan oksigen, dan proses oksidasi enzimatik yang melibatkan senyawa organik maupun anorganik, seperti oksidasi Cu2+ dan Fe3+ memfasilitasi produksi radikal hidroksil (.OH) melalui reaksi Haber-Weiss:
Salah satu radikal bebas yang banyak dipelajari dan bersifat toksik bagi sel hidup adalah radikal bebas oksigen (superoksida) dan derivatnya, yaitu radikal hidroksil (Gitawati 1995). Radikal bebas superoksida terbentuk apabila satu molekul O2 menerima satu elektron. Superoksida bersifat oksidan dan reduktan, dan dapat bereaksi dengan substrat biologis. Reaktifitas O2- sangat terbatas karena adanya dismutasi spontan yang dapat terjadi pada pH fisiologis membentuk H2O dan O2. Tetapi, dengan terbatasnya reaktifitas O2, radikal ini dapat berdifusi dengan substratnya dalam jarak yang relatif lebih jauh dari tempat asalnya. Sementara itu, radikal hidroksil adalah
2O2+ e- O2
-O2-+ e-+ 2H+
H2O2+ e- OH.+ OH
-H2O2
OH.+ e-+ H- H2O
OH-+ H+ H
2O
O2-+ 4e-+ 4H+ 2 H2O
Gambar 1 Pembentukan H2O2 pada reduksi O2 menjadi H2O (Siregar 1992)
oksidan yang sangat reaktif, tidak stabil, dan dapat berarksi engan semua substat biologis. Karena sangat tidak reaktif, efek radikal ini berlangsung di daerah yang dekat dengan terbentuknya (Gitawati 1995).
Radikal bebas lain yang dapat ditemukan sebagai derivat oksigen adalah hidrogen peroksida. Radikal ini tidak sebahaya radikal superoksida dan bereaksi lambat dengan substrat organik (Gitawati 1995).
Ruxton (1994) yang dikutip oleh Subekti (1997) mengemukakan teori bahwa kondisi kronis seperti penyakit kardiovaskuler, kanker, bahkan penuaan (ageing) mungkin dimulai dan diperbanyak oleh aksi oksigen tereksitasi (superoksida radikal, hidroksil radikal, hidrogen peroksida atau oksigen tunggal) yang menyerang lipid membran sel, menyebabkan kerusakan oksidatif, dan menyebabkan sel menjadi lebih peka terhadap racun dan agen karsinogenik. Apabila diproduksi di dalam nukleus sel, dapat menyebabkan kerusakan yang cepat pada DNA yang menyebabkan mutasi sel, yang dapat menimbulkan kanker.
Parasetamol sebagai Stimulan Radikal Bebas
Parasetamol (asetaminofen, N-acetyl-p-aminophenol) merupakan turunan dari para-amino-fenol. Parasetamol tergolong obat yang relatif aman dan digunakan secara luas sebagai senyawa antipiretik, analgesik, dan anti inflamasi (Gan 1980). Parasetamol cepat diserap secara sempurna melalui saluran cerna. Konsentrasi tertinggi dalam plasma antara 1-3 jam. Obat ini tersebar ke seluruh cairan tubuh. Dalam plasma, 25% parasetamol terikat oleh protein plasma.
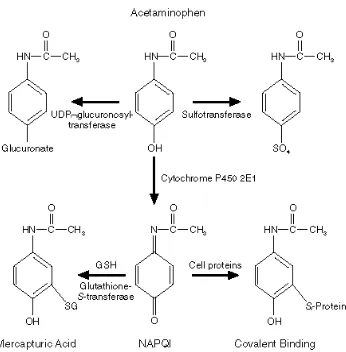
sejumlah kecil metabolit dalam bentuk terhidroksilasi dan terdeasetilasi menjadi senyawa yang larut air dan tidak beracun sehingga dapat dikeluarkan dari tubuh melalui urin (Gambar 3) (Gan 1980; Moore et al. 1985).
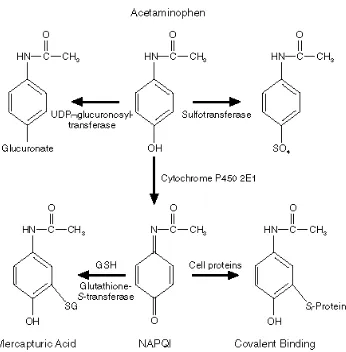
Apabila parasetamol dalam jumlah tinggi dikonsumsi, maka sisa parasetamol akan mengalami biotransformasi dengan sistem sitokrom P450. P450 yaitu suatu sistem enzim di retikulum endoplasma yang segera melakukan biotransformasi oksidatif pada 5-10% parasetamol yang masuk ke dalam tubuh. Parasetamol yang teroksidasi akan berubah menjadi N-asetiliminbenzokuninon (NAPQI) (Gambar 2), suatu senyawa yang toksik dan reaktif. Senyawa radikal ini dapat bereaksi dengan molekul penyusun sel hatim seperti fosfolipid, khususnya pada protein yang memiliki gugus
-SH. Jalur lain yang digunakan oleh sitokrom P450 adalah mengkonversi parasetamol menjadi semikuinon. Semikuinon ini dapat bereaksi dengan gugus –SH atau mereduksi oksigen menjadi O2. Oksidasi senyawa ini akan menghasilkan suatu radikal bebas lagi yag dapat mengoksidasi molekul fosfolipid lainnya, sehingga terjadi reaksi oksidasi berantai. Reaksi ini dapat menyebabkan berubahnya komposisi membran sel hati dan kemudian menyebabkan nekrosis (Murugesh et al. 2005). Jumlah radikal bebas yang melebihi ketersediaan senyawa-senyawa penetralisir dalam hati memungkinkan terjadinya reaksi antara radikal bebas dengan membran sel hati.
Salah satu tanda kerusakan hati yang diakibatkan oleh parasetamol adalah menurunnya jumlah protein total maupun glikogen. Penurunan tersebut menandakan berkurangnya jumlah sel hepatosit yang memproduksi protein dan glikogen sehingga bobot organ hati secara keseluruhan lebih kecil daripada bobot normalnya.
Gambar 2 Senyawa yang dihasilkan dari oksidasi parasetamol (Mason & Fischer 1986)
Gambar 3 Mekanisme biotransformasi parasetamol (Lee 1995)
Antioksidan
Tuminah (2000) menyatakan bahwa antioksidan adalah suatu substansi yang menghentikan atau menghambat kerusakan oksidatif terhadap molekul target. Tubuh mengembangkan mekanisme perlindungan, baik untuk mencegah pembentukan oksidan dan peroksidasi lipid maupun memperbaiki kerusakan yang terjadi akibat bahaya yang timbul dalam kehidupan aerobik. Antioksidan sebagai sistem perlindungan dapat dibedakan atas antioksidan endogen yang terdiri atas enzim-enzim dan berbagai senyawa yang disintesis tubuh, dan antioksidan eksogen yang diperoleh dari bahan makanan (Asikin 2001, Wresdiyati 2004).
Halliwell dan Gutteridge (1990) membagi antioksidan biologis berdasarkan proses enzimatik dan non-enzimatik. Termasuk kedalam antioksidan proses enzimatik adalah superoksida dismutase, katalase, glutation peroksidase, dan fosfolipid hidroperoksidase. Sedangkan yang termasuk antioksidan proses non-enzimatik adalah antioksidan larut lemak (α-tokoferol, karetinoid, quinon, dan bilirubin) dan antioksidan larut air (asam askorbat, asam urat, protein pengikat logam, dan protein pengikat heme).
tersebut dapat mengubah radikal superoksida menjadi air. (2) antioksidan sekunder yang berperan untuk mengikat radikal bebas dan mencegah amplifikasi radikal. Antioksidan sekunder terdapat pada vitamin C, vitamin B, vitamin E, betakaroten, dan senyawa-senyawa fitokimia. (3) antioksidan tersier yang berperan dalam mekanisme biomolekuler. Antioksidan tersier terdiri atas enzim perbaikan DNA dan metionin sulfoksida reduktase (Kartikawati 1999).
Antioksidan mampu memerangi radikal bebas baik dengan cara mencegah, menghentikan ataupun memperlambat proses oksidasi (Schuler 1990 dalam Wresdiyati 2004). Antioksidan melindungi sel dan jaringan sasaran dengan cara memusnahkan Spesies Oksigen Reaktif (SOR) secara enzimatik atau dengan reaksi kimia langsung, mengurangi pembentukan SOR, mengikat ion logam yang terlibat dalam pembentukan spesies yang reaktif (tranferin, seruplasmin, albumin), memperbaiki kerusakan sasaran serta menghancurkan molekul yang rusak dan menggantinya dengan yang baru (Asikin 2001).
Antioksidan bereaksi melalui pembersihan senyawa oksigen reaktif atau penurunan konsentrasinya secara lokal (eliminating oxygen), pembersihan ion logam katalitik (immobilizing catalysts or metal ion), pembersihan radikal bebas yang berfungsi sebagai inisiator seperti hidroksil, peroksil, dan alkalosil (terminating chain reaction), pemutus rantai dari rangkaian reaksi yang diinisiasi oleh radikal bebas (inhibiting radical-generating enzymes), dan peredam reaksi, serta pembersih singlet oksigen (Kartikawati 1999).
Superoksida dismutase (SOD) adalah antioksidan yang berperan dalam memerangi radikal superoksida (Gitawati 1995). Menurut Fridovich (1976), superoksida dismutase ditemukan pada organisme yang menggunakan oksigen untuk metabolismenya, tetapi tidak ditemukan pada organisme anaerob obligat.
Enzim Superoksida Dismutase (SOD)
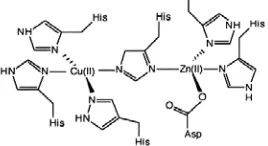
Superoksida dismutase (SOD) merupakan metaloenzim yang mengkatalisis dismutasi anion superoksida yang sangat reaktif menjadi oksigen (O2) dan senyawa yang tidak terlalu reaktif seperti hidrogen peroksida (H2O2). Sedikitnya terdapat empat jenis logam yang umumnya menjadi atom pusat pada enzim ini, yaitu tembaga (Cu) dan seng (Zn) pada
Cu,Zn-SOD (Gambar 4), mangan (Mn) pada Mn-SOD, dan besi (Fe) pada Fe-SOD.
Pada manusia, ditemukan tiga bentuk SOD, yaitu cytocolic Cu,Zn-SOD, mitochondrial Mn-SOD, dan extracellular SOD (Mates et al. 1999; Nurwati 2002), sedangkan Fe-SOD umumnya ditemukan pada organisme prokariot (West dan Prohaska 2004). Enzim SOD tidak selalu bekerja bersama-sama, terkadang satu jenis enzim SOD berperan lebih dominan dibandingkan yang lainnya. Cu,Zn-SOD terdapat di dalam sitosol berperan sebagai faktor pertahanan utama yang bertugas melindungi sel dari radikal superoksida. Mn-SOD lebih berperan dalam pertahanan sel dalam menghadapi stress etanol (Costa et al. 1997).
Cu,Zn-SOD merupakan homodimer dan terdapat pada sitoplasma eukariot, peroksisom, kloroplas, dan periplasma prokariot (Asikin 2001). Menurut Mates dan Jimenez (1999), enzim Cu,Zn-SOD adalah kelas lain dari SOD yang biasanya tersusun atas dua subunit identik dengan berat molekul sekitar 32kDa, masing-masing unit mengandung sekelompok logam, sisi aktif dan tersusun dari tembaga (Cu) dan seng (Zn) (Alscher 2002).
Enzim ini tergolong enzim yang sangat stabil karena setiap subunit tergabung oleh ikatan nonkovalen dan terangkai oleh rantai disulfida (Fridovich 1986). Cu,Zn-SOD dipercaya memainkan peranan yang sangat penting pada garis depan pertahanan antioksidan (Mates et al. 1999).
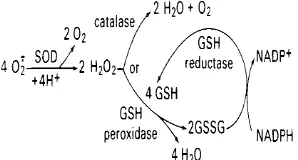
Dalam melawan radikal bebas, kerja enzim SOD dibantu oleh dua enzim lain, yaitu katalase dan glutation (GSH) peroksidase. Enzim SOD secara spontan merubah radikal O2- menjadi H2O2 dan oksigen dengan kecepatan reaksi sekitar 105 M-1 s-1 pada pH 7, reaksinya sebagai berikut: O2- + 2H+ O2 + H2O2. Reaksi tersebut berlangsung sangat cepat dan hanya dibatasi oleh frekuensi tumbukan SOD dengan superoksida. Hidrogen peroksida yang dihasilkan masih cukup berbahaya sehingga perlu pengubahan lebih lanjut oleh katalase menjadi air dan oksigen.
Glutation peroksidase merupakan golongan enzim antioksidan yang mengandung selenium yang penting dalam memerangi hidroperoksida dan senyawa xenobiotik menjadi air dan alkohol (Gambar 5). Dengan cara tersebut kerusakan molekul-molekul penyusun sel akibat serangan radikal bebas dapat dihindari.
Enzim SOD memegang peranan penting sebagai antioksidan endogen. Berdasarkan mekanismenya, enzim ini digolongkan sebagai antioksidan primer yang berperan mengurangi pembentukan radikal bebas baru dengan memutus reaksi berantai dan mengubahnya menjadi produk yang lebih stabil.
Aktivitas SOD bervarasi pada beberapa organ tikus, terdapat dalam jumlah tertinggi dalam hati, kemudian berturut-turut dalam kelenjar adrenal, ginjal, darah, limpa, pankreas, otak, paru-paru, lambung, usus, ovarium, timus, dan lemak (Nurwati 2002).
Gambar 5 Cara kerja enzim-enzim pertahanan tubuh terhadap radikal bebas
Kelapa Kopyor
Buah kelapa kopyor berasal dari tanaman kelapa yang mengalami mutasi genetik alamiah. Kelapa kopyor adalah mutan kelapa yang ditemukan diantara populasi kelapa normal (Samonthe et al. 1989; Novarianto 2000). Sebagai hasil mutasi alamiah, jumlah tanaman kelapa kopyor sangat sedikit dibandingkan dengan tanaman yang berbuah normal. Peluang terjadinya mutasi alamiah secara umum sangat rendah, yaitu sebesar 10-5 hingga 10-6 per generasi. Hal ini berarti hanya 1 diantara 100.000 hingga 1.000.000 peluang terjadinya mutasi alamiah di alam.
Kelapa kopyor (Gambar 6) merupakan buah kelapa abnormal yang memiliki gen resesif kk atau Kk pada endosperm. Karakteristik fenotip kelapa kopyor tidak terlalu berbeda dengan kelapa biasa yang bukan kopyor. Menurut Mujer et al. 1984 dalam Maskromo (2005), hasil penelitian biokimia menunjukkan bahwa pada
endosperma buah kelapa kopyor terjadi defisiensi α-D-galaktosidase. Hal ini akan mengakibatkan pembentukan endosperma tidak normal dan tidak mampu mendukung perkecambahan embrio. Gen letal pada buah kelapa kopyor menyebabkan daging buah mudah terlepas dari tempurung, sehingga hubungan jaringan endosperma dengan embrio putus, akibatnya buah kelapa ini tidak mampu berkecambah (Maskromo 2005).
Ciri-ciri kelapa kopyor antara lain: daging buah yang empuk dan mudah terlepas dari tempurungnya, ada daging buah yang terapung pada air kelapa (Santoso et al. 1996).
Kelapa kopyor termasuk kelapa yang sudah tua yang umurnya mencapai 10 hingga 11 bulan. Oleh karena itu, dibandingkan dengan kelapa tua biasa, komposisi kimia kelapa kopyor hampir sama, kecuali kadar proteinnya yang relatif rendah yaitu 1.2%, sedangkan pada kelapa tua biasa yaitu 3 hingga 4%. Dibandingkan dengan kelapa muda, kelapa kopyor mempunyai kadar lemak yang sangat tinggi, yaitu 12%. Kadar lemak tinggi akan menyebabkan kelapa kopyor mudah teroksidasi hingga menjadi tengik (Winarno 1982).
Selain rasa yang lezat serta aroma yang khas, ternyata kelapa kopyor memiliki kandungan gizi yang cukup tinggi. Pada dasarnya, kandungan nutrisi air kelapa kopyor dan daging kelapa kopyor akan tergantung pada varietas kelapa, tingkat kematangan buah, dan kandungan hara tanah tempat kelapa tersebut tumbuh. Kandungan paling banyak yang terdapat pada air dan daging kelapa kopyor adalah karbohidrat,. Selain karbohidrat yang tinggi, air buah kelapa juga diketahui mengandung α-tokoferol seperti thiamin, riboflavin, dan vitamin C (Santoso et al. 1996).
Komposisi asam amino dari protein kelapa kopyor didominasi oleh asam glutamat, arginin, dan asam aspartat. Kandungan sukrosa (92% dari total gula yang dihasilkan), glukosa, fruktosa, asam sitrat, dan asam malat yang relatif lebih tinggi diperkirakan berkontribusi terhadap rasa kelapa kopyor sehingga lebih enak.
Selain itu, daging kelapa kopyor lebih sedikit mengandung lemak ketimbang kelapa biasa tetapi dengan komposisi asam lemak yang mirip dengan kelapa biasa yang didominasi oleh asam laurat.
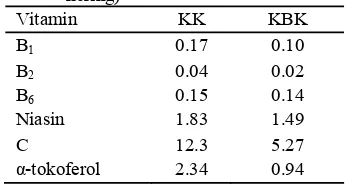
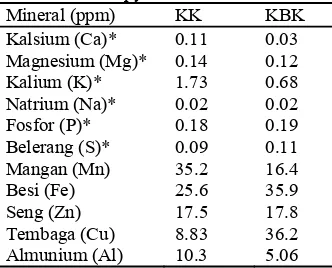
Santoso et al. (1996) menyatakan bahwa buah kelapa kopyor juga kaya akan mineral yang dibutuhkan oleh tubuh. Pada air kelapa kopyor, mineral yang terkandung dalam jumlah banyak adalah Mg, K, P, S, dan Mn. Sedangkan pada daging buah kelapa kopyor, kandungan mineral terbanyak adalah Fe, Zn, dan Mn (Tabel 1 dan Tabel 2).
Tabel 1 Kandungan vitamin dalam daging buah kelapa kopyor dan kelapa bukan kopyor (mg/100 g bobot kering)
Vitamin KK KBK
B1 0.17 0.10
B2 0.04 0.02
B6 0.15 0.14
Niasin 1.83 1.49
C 12.3 5.27
α-tokoferol 2.34 0.94
Tabel 2 Komposisi mineral dalam daging buah kelapa kopyor dan kelapa bukan kopyor
Mineral (ppm) KK KBK Kalsium (Ca)* 0.11 0.03 Magnesium (Mg)* 0.14 0.12 Kalium (K)* 1.73 0.68 Natrium (Na)* 0.02 0.02 Fosfor (P)* 0.18 0.19 Belerang (S)* 0.09 0.11 Mangan (Mn) 35.2 16.4
Besi (Fe) 25.6 35.9
Seng (Zn) 17.5 17.8
Tembaga (Cu) 8.83 36.2 Almunium (Al) 10.3 5.06 Keterangan: KK: kelapa kopyor; KBK: kelapa bukan kopyor; *: jumlah dalam % bobot kering. Sumber: Santoso et al. 1996
BAHAN DAN METODE
Bahan dan Alat
Hewan uji yang digunakan adalah tikus putih jantan galur Sprague-Dawley yang diperoleh dari Fakultas Kedokteran Hewan-Institut Pertanian Bogor (IPB), berumur 2 bulan, dan mempunyai bobot 150-200 g. Kelapa kopyor yang digunakan diperoleh dari Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI).
Bahan-bahan yang digunakan dalam penelitian ini secara umum adalah kelapa kopyor, temulawak, akuades, homogenat hati 10%, kloroform, alkohol 70%, riboflavin 0.12mM, nitrobluetetrazolium (NBT), bovine serum albumine (BSA), NaCl 0.9% (b/v), EDTA 0.1 M, KCN 0.3 mM, dan bufer fosfat 0.0067 M pH 7.8.
Alat-alat yang digunakan dalam penelitian ini adalah blender, mortar, timbangan analitik, gunting, vial, sonde oral, mikropipet, sentrifus klinis, pHmeter, microfuge, homogenizer, ultrasonikator, kertas saring, spektrofotometer UV, neraca analitik, lampu fluoroscent 20watt, vortex, pengaduk magnetik, dan alat-alat gelas lainnya.
Metode
Hewan Coba dan Rancangan Percobaan
Hewan percobaan yang digunakan adalah tikus putih galur Sprague-Dawley sebanyak 18 ekor dengan jenis kelamin jantan, sehat, dan mempunyai aktivitas normal, berusia 2 bulan dengan berat badan 150-200 gram. Tikus dipelihara dalam kandang individual berukuran 30x50x50 cm dan diadaptasikan terlebih dahulu selama 2 minggu kemudian diberi perlakuan. Sebelum dan selama perlakuan, tikus diberi pakan standar dan minum secara ad libitum. Bobot badan tikus dan jumlah pakan yang digunakan diamati setiap hari.
Induksi parasetamol dilakukan menurut metode Gupta et al. (2004) yang dimodifikasi. Induksi kerusakan hati dilakukan dengan memberikan parasetamol secara oral dengan dosis 500 mg/kg BB/hari selama 7 hari yang dilanjutkan dengan penambahan dosis menjadi 600 mg/kg BB selama 7 hari berikutnya sebagai modifikasi metode.
Selain itu, daging kelapa kopyor lebih sedikit mengandung lemak ketimbang kelapa biasa tetapi dengan komposisi asam lemak yang mirip dengan kelapa biasa yang didominasi oleh asam laurat.
Santoso et al. (1996) menyatakan bahwa buah kelapa kopyor juga kaya akan mineral yang dibutuhkan oleh tubuh. Pada air kelapa kopyor, mineral yang terkandung dalam jumlah banyak adalah Mg, K, P, S, dan Mn. Sedangkan pada daging buah kelapa kopyor, kandungan mineral terbanyak adalah Fe, Zn, dan Mn (Tabel 1 dan Tabel 2).
Tabel 1 Kandungan vitamin dalam daging buah kelapa kopyor dan kelapa bukan kopyor (mg/100 g bobot kering)
Vitamin KK KBK
B1 0.17 0.10
B2 0.04 0.02
B6 0.15 0.14
Niasin 1.83 1.49
C 12.3 5.27
α-tokoferol 2.34 0.94
Tabel 2 Komposisi mineral dalam daging buah kelapa kopyor dan kelapa bukan kopyor
Mineral (ppm) KK KBK Kalsium (Ca)* 0.11 0.03 Magnesium (Mg)* 0.14 0.12 Kalium (K)* 1.73 0.68 Natrium (Na)* 0.02 0.02 Fosfor (P)* 0.18 0.19 Belerang (S)* 0.09 0.11 Mangan (Mn) 35.2 16.4
Besi (Fe) 25.6 35.9
Seng (Zn) 17.5 17.8
Tembaga (Cu) 8.83 36.2 Almunium (Al) 10.3 5.06 Keterangan: KK: kelapa kopyor; KBK: kelapa bukan kopyor; *: jumlah dalam % bobot kering. Sumber: Santoso et al. 1996
BAHAN DAN METODE
Bahan dan Alat
Hewan uji yang digunakan adalah tikus putih jantan galur Sprague-Dawley yang diperoleh dari Fakultas Kedokteran Hewan-Institut Pertanian Bogor (IPB), berumur 2 bulan, dan mempunyai bobot 150-200 g. Kelapa kopyor yang digunakan diperoleh dari Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI).
Bahan-bahan yang digunakan dalam penelitian ini secara umum adalah kelapa kopyor, temulawak, akuades, homogenat hati 10%, kloroform, alkohol 70%, riboflavin 0.12mM, nitrobluetetrazolium (NBT), bovine serum albumine (BSA), NaCl 0.9% (b/v), EDTA 0.1 M, KCN 0.3 mM, dan bufer fosfat 0.0067 M pH 7.8.
Alat-alat yang digunakan dalam penelitian ini adalah blender, mortar, timbangan analitik, gunting, vial, sonde oral, mikropipet, sentrifus klinis, pHmeter, microfuge, homogenizer, ultrasonikator, kertas saring, spektrofotometer UV, neraca analitik, lampu fluoroscent 20watt, vortex, pengaduk magnetik, dan alat-alat gelas lainnya.
Metode
Hewan Coba dan Rancangan Percobaan
Hewan percobaan yang digunakan adalah tikus putih galur Sprague-Dawley sebanyak 18 ekor dengan jenis kelamin jantan, sehat, dan mempunyai aktivitas normal, berusia 2 bulan dengan berat badan 150-200 gram. Tikus dipelihara dalam kandang individual berukuran 30x50x50 cm dan diadaptasikan terlebih dahulu selama 2 minggu kemudian diberi perlakuan. Sebelum dan selama perlakuan, tikus diberi pakan standar dan minum secara ad libitum. Bobot badan tikus dan jumlah pakan yang digunakan diamati setiap hari.
Induksi parasetamol dilakukan menurut metode Gupta et al. (2004) yang dimodifikasi. Induksi kerusakan hati dilakukan dengan memberikan parasetamol secara oral dengan dosis 500 mg/kg BB/hari selama 7 hari yang dilanjutkan dengan penambahan dosis menjadi 600 mg/kg BB selama 7 hari berikutnya sebagai modifikasi metode.
sedangkan untuk kontrol positif diberi temulawak. Setelah perlakuan selesai, dilakukan nekropsi, pengambilan organ hati, dan pengamatan gambaran patologi anatomi hati.
Pengamatan Fisik. Pengamatan fisik hewan coba yang diamati meliputi bobot badan, konsumsi pakan, keadaan fisik, dan tingkah laku. Bobot badan dan konsumsi pakan diamati dengan menimbang tikus serta bobot pakan sebelum dan sesudah pemberian pakan. Keadaan fisik pada tikus yang diamati adalah warna mata dan kerontokan bulu sedangkan tingkah laku yang diamati meliputi mobilitas dan agresivitas.
Fraksinasi Hati untuk Analisis Enzim SOD Setelah perlakuan selesai, tikus dinekropsi dengan dekapitasi setelah dibius dengan kloroform. Tikus dibedah dan diambil hatinya. Hati dibilas dengan larutan NaCl 0,9% (cairan fisiologis) untuk membersihkan dari kotoran dan darah. 1g hati ditimbang dan ditambahkan dengan larutan NaCl 0,9% kemudian dihaluskan dengan homogenizer Potter-Elvehjem. Homogenat 10% ini kemudian disentrifus pada 700 x g suhu 4˚C selama 10 menit. Supernatan yang diperoleh dipisahkan, kemudian diambil sebanyak 1ml untuk dihancurkan dengan ultrasonikator selama 5menit.
Analisis Protein Total (Bradford 1976) Pembuatan Kurva Standar. Dalam pembuatan kurva standar digunakan larutan BSA 1.56 mg/mL dan 1.5 mg/mL sebagai larutan standar. Larutan BSA dimasukkan ke dalam tabung reaksi sebanyak 10, 30, 50, 70 dan 90 µL lalu ditambahkan larutan NaCl 0.9% sehingga volume total setiap tabung 100 µL. Sebagai blanko digunakan larutan NaCl 0.9% 100 µL, tanpa penambahan larutan BSA. Masing-masing tabung ditambahkan pereaksi Bradford sebanyak 2.9 mL kemudian dikocok dengan vortex. Sebelum diukur, larutan didiamkan selama 5 menit. Serapan larutan standar diukur pada panjang gelombang (λ) 595 nm.
Analisis Protein Total Sampel. Sebanyak 10 µL sampel dan 90 µL NaCl 0.9% dimasukkan ke dalam tabung reaksi kemudian ditambahkan 2.9 ml pereaksi Bradford kemudian dikocok hingga merata dengan vortex. Sebelum diukur, larutan didiamkan selama 5 menit. Serapan sampel juga diukur pada panjang gelombang (λ) 595 nm.
Analisis Enzim SOD (Winterbourn et al.
1975)
Prinsip pengukuran aktivitas SOD dengan metode ini berdasarkan kemampuan enzim SOD dalam menghambat reduksi NBT oleh radikal anion superoksida. NBT yang tereduksi akan membentuk kompleks formazan yang berwarna biru ungu. Adanya enzim SOD dalam sampel akan menghambat pembentukkan kompleks warna tersebut. Semakin banyak jumlah enzim SOD dalam sampel maka warna yang terbentuk pun semakin tidak pekat.
Analisis enzim dilakukan dengan memasukkan sampel yang mengandung 10 µg protein ke dalam kuvet yang mengandung 67 µL EDTA 0.1 M untuk mengukur SOD total. Kemudian ditambahkan 33 µL NBT 1.5 mM serta 850 µL bufer fosfat 0.067 M pH 7.8. Selanjutnya kuvet diinkubasi dalam kotak cahaya yang menggunakan lampu fluoresent 40 watt selama 5 menit kemudian ditambahkan 25 µL riboflavin 0.12 mM dan diinkubasi kembali dalam kotak. Setiap 1 menit diukur serapannya pada λ 560 nm. Aktivitas enzim yang terukur merupakan aktivitas spesifik, yaitu jumlah unit enzim per miligram protein dan satu unit enzim didefinikan sebagai jumlah enzim yang menyebabkan setengah penghambatan maksimum terhadap reduksi NBT.
Analisis Statistik
Data yang diperoleh diuji dengan menggunakan analisis statistik ANOVA untuk mengetahui pengaruh perlakuan pada selang kepercayaan 90% (Matjiik dan Sumertajaya 2000).
HASIL DAN PEMBAHASAN
Bobot Badan
sedangkan untuk kontrol positif diberi temulawak. Setelah perlakuan selesai, dilakukan nekropsi, pengambilan organ hati, dan pengamatan gambaran patologi anatomi hati.
Pengamatan Fisik. Pengamatan fisik hewan coba yang diamati meliputi bobot badan, konsumsi pakan, keadaan fisik, dan tingkah laku. Bobot badan dan konsumsi pakan diamati dengan menimbang tikus serta bobot pakan sebelum dan sesudah pemberian pakan. Keadaan fisik pada tikus yang diamati adalah warna mata dan kerontokan bulu sedangkan tingkah laku yang diamati meliputi mobilitas dan agresivitas.
Fraksinasi Hati untuk Analisis Enzim SOD Setelah perlakuan selesai, tikus dinekropsi dengan dekapitasi setelah dibius dengan kloroform. Tikus dibedah dan diambil hatinya. Hati dibilas dengan larutan NaCl 0,9% (cairan fisiologis) untuk membersihkan dari kotoran dan darah. 1g hati ditimbang dan ditambahkan dengan larutan NaCl 0,9% kemudian dihaluskan dengan homogenizer Potter-Elvehjem. Homogenat 10% ini kemudian disentrifus pada 700 x g suhu 4˚C selama 10 menit. Supernatan yang diperoleh dipisahkan, kemudian diambil sebanyak 1ml untuk dihancurkan dengan ultrasonikator selama 5menit.
Analisis Protein Total (Bradford 1976) Pembuatan Kurva Standar. Dalam pembuatan kurva standar digunakan larutan BSA 1.56 mg/mL dan 1.5 mg/mL sebagai larutan standar. Larutan BSA dimasukkan ke dalam tabung reaksi sebanyak 10, 30, 50, 70 dan 90 µL lalu ditambahkan larutan NaCl 0.9% sehingga volume total setiap tabung 100 µL. Sebagai blanko digunakan larutan NaCl 0.9% 100 µL, tanpa penambahan larutan BSA. Masing-masing tabung ditambahkan pereaksi Bradford sebanyak 2.9 mL kemudian dikocok dengan vortex. Sebelum diukur, larutan didiamkan selama 5 menit. Serapan larutan standar diukur pada panjang gelombang (λ) 595 nm.
Analisis Protein Total Sampel. Sebanyak 10 µL sampel dan 90 µL NaCl 0.9% dimasukkan ke dalam tabung reaksi kemudian ditambahkan 2.9 ml pereaksi Bradford kemudian dikocok hingga merata dengan vortex. Sebelum diukur, larutan didiamkan selama 5 menit. Serapan sampel juga diukur pada panjang gelombang (λ) 595 nm.
Analisis Enzim SOD (Winterbourn et al.
1975)
Prinsip pengukuran aktivitas SOD dengan metode ini berdasarkan kemampuan enzim SOD dalam menghambat reduksi NBT oleh radikal anion superoksida. NBT yang tereduksi akan membentuk kompleks formazan yang berwarna biru ungu. Adanya enzim SOD dalam sampel akan menghambat pembentukkan kompleks warna tersebut. Semakin banyak jumlah enzim SOD dalam sampel maka warna yang terbentuk pun semakin tidak pekat.
Analisis enzim dilakukan dengan memasukkan sampel yang mengandung 10 µg protein ke dalam kuvet yang mengandung 67 µL EDTA 0.1 M untuk mengukur SOD total. Kemudian ditambahkan 33 µL NBT 1.5 mM serta 850 µL bufer fosfat 0.067 M pH 7.8. Selanjutnya kuvet diinkubasi dalam kotak cahaya yang menggunakan lampu fluoresent 40 watt selama 5 menit kemudian ditambahkan 25 µL riboflavin 0.12 mM dan diinkubasi kembali dalam kotak. Setiap 1 menit diukur serapannya pada λ 560 nm. Aktivitas enzim yang terukur merupakan aktivitas spesifik, yaitu jumlah unit enzim per miligram protein dan satu unit enzim didefinikan sebagai jumlah enzim yang menyebabkan setengah penghambatan maksimum terhadap reduksi NBT.
Analisis Statistik
Data yang diperoleh diuji dengan menggunakan analisis statistik ANOVA untuk mengetahui pengaruh perlakuan pada selang kepercayaan 90% (Matjiik dan Sumertajaya 2000).
HASIL DAN PEMBAHASAN
Bobot Badan
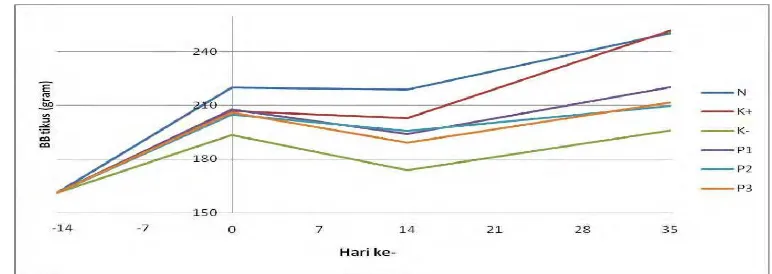
Gambar 7 Bobot badan tikus saat pemberian parasetamol (hari ke-0 hingga hari ke-14) dan pemberian suplemen kelapa kopyor (hari ke-15 hingga hari ke-35)
14 hari + suplemen kelapa kopyor 1x dosis 21 hari), P2 (induksi parasetamol 3x dosis 21 hari), dan P3 (induksi parasetamol 14 hari + suplemen kelapa kopyor 5x dosis 21 hari) juga mengalami penurunan, berkisar antara 2 hingga 8% Berdasarkan hasil tersebut diduga bahwa pemberian parasetamol dalam dosis toksik mempengaruhi nafsu makan yang berakibat pada menurunnya BB. Menurut Gan (1980), toksisitas parasetamol akan menimbulkan gejala-gejala anoreksia, mual, muntah, serta sakit perut yang terjadi dalam 24 jam pertama, dan dapat berlangsung terus menerus selama seminggu atau lebih. Gejala-gejala inilah yang menyebabkan nafsu makan menurun sehingga berpengaruh terhadap BB hewan coba tersebut. Uji statistik BB pada hari ke-14 menunjukkan adanya beda nyata (P≤0.1) antara kelompok normal dengan perlakuan (K+, K-, P1, P2, dan P3). Pengamatan pada hari ke-35 menunjukkan adanya kenaikan BB secara umum pada seluruh kelompok dengan instensitas yang berbeda. Kelompok N dan K+ merupakan kelompok yang paling banyak mengalami kenaikan BB, yaitu masing-masing 20% dan 13%. Kelompok K, P1, P2, dan P3 mengalami kenaikan BB namun tidak begitu tinggi, berkisar antara 6 hingga 11%.
Berdasarkan hasil tersebut, diduga bahwa pemberian suplemen temulawak mempengaruhi nafsu makan yang akan menaikkan BB. Hal ini sesuai dengan penelitian Liang et al. (1985) yang menyatakan bahwa temulawak dapat digunakan sebagai obat untuk mengatasi gangguan saluran pencernaan, gangguan aliran getah empedu, diare, kurang nafsu makan, radang lambung dan dapat mencegah terjadinya pelemakan dalam sel-sel hati. Selain itu kandungan kurkuminoid pada
temulawak dapat berfungsi untuk meningkatkan produksi dan sekresi empedu. Kemampuan temulawak menghasilkan senyawa antibakteri mempengaruhi kerja mikroflora usus sehingga proses pencernaan menjadi lebih optimal (Sedarnawati et al. 1991). Berbagai penelitian terhadap hewan percobaan telah membuktikan bahwa temulawak memberikan dampak positif terhadap kandungan empedu, hati dan pankreas.
Pertambahan BB juga terjadi pada kelompok P1, P2, dan P3. Berdasarkan hasil tersebut, diduga bahwa pemberian suplemen kelapa kopyor juga mempengaruhi nafsu makan. Kandungan nutrisi pada kelapa kopyor, seperti vitamin, mineral, dan asam lemak diduga dapat membantu meningkatkan nafsu makan. Berdasarkan hasil penelitian menggunakan babi yang diberi pakan yang kaya akan kandungan asam lemak jenuh, babi tersebut mengalami obesitas, peningkatan kadar kolesterol dan LDL di dalam darah sedangkan kadar lipoprotein densitas tinggi (HDL) menurun. Selain itu, babi juga mengalami penyempitan pembuluh darah atau aterosklerosis (Bruce Fife 2001 diacu dalam Sulistyo 2004). Uji statistik BB pada hari ke-35 menunjukkan adanya beda nyata (P≤0.1) antara kelompok N dengan perlakuan (K-, P1, P2, dan P3).
Enzim Superoksida Dismutase (SOD)
lebih rendah. Persentase penurunan aktivitas SOD paling tinggi terjadi pada kelompok K-, yaitu 25%, dan penurunan paling rendah terjadi pada kelompok K+ dan P3, yaitu sebesar 12%. Pada kelompok N, aktivitas enzim SOD total adalah 184,03 U/mg protein. Halliwell dan Gutteridge (1989) melaporkan bahwa aktivitas enzim SOD total pada hati mencit normal adalah 660 U/mg protein. Aktivitas enzim ini diukur dengan perbandingan KO2 dalam larutan alkalin. Aktivitas enzim SOD total pada hati tikus normal yang diukur dengan menggunakan prinsip yang sama dengan metode Winterbourn dilaporkan oleh Peeters-Joris et al. (1975) sebesar 22 U/mg protein. Perbedaan hasil yang ditunjukkan antara literatur dan hasil penelitian kemungkinan disebabkan oleh perbedaan metode yang digunakan, cara pemecahan sel yang berbeda, jarak pencahayaan saat inkubasi, dan perlakuan yang diberikan, dan jenis hewan coba yang digunakan.
Kelompok K+ (diinduksi parasetamol 14 hari + suplemen temulawak 21hari) memiliki aktivitas enzim SOD total sebanyak 158,37 U/mg protein. Nilai kelompok kontrol positif ini sedikit lebih rendah dibandingkan kelompok P3 (diinduksi parasetamol 14 hari + suplemen kelapa kopyor 5x dosis), yaitu 160,23 U/mg protein. Hal ini diduga terjadi karena kandungan mineral pada temulawak tidak sebanyak kandungan mineral yang terdapat pada kelapa kopyor.
Kelompok K- (diinduksi parasetamol 14 hari + akuades 21 hari ) mempunyai aktivitas enzim SOD total yang paling rendah dibandingan kelompok perlakuan yang lain. Hal ini diduga karena pada kelompok ini tidak didapat cukup asupan gizi yang dapat menunjang pembentukan enzim SOD, khususnya mineral.
Gambar 8 Aktivitas enzim SOD total pada hari ke-35; *: berbeda nyata dengan K- pada taraf uji 10%.
SOD merupakan metaloenzim yang sangat membutuhkan logam (mineral) pada sisi katalitiknya. Penelitian West dan Prohaska (2004) menunjukkan bahwa tikus yang dikondisikan kekurangan mineral, khususnya Cu, mengalami penurunan aktivitas enzim SOD pada sel darah merahnya.
Pada kelompok perlakuan yang diinduksi parasetamol kemudian diberi suplemen kelapa kopyor 1x dosis (P1) dan 3x dosis (P2) terjadi kenaikan aktivitas enzim SOD total, namun dalam jumlah relatif sedikit. Hal ini diduga karena jumlah mineral yang dikonsumsi oleh kelompok ini lebih sedikit, sehingga mempengaruhi aktivitas enzim SOD.
Hasil uji statistik aktivitas SOD total menunjukkan bahwa semua kelompok perlakuan (K+, K-, P1, P2, dan P3) berbeda nyata (P≤0,1) dengan kelompok normal (N). Selain itu, dapat terlihat bahwa pada kelompok K+ (diinduksi parasetamol 14 hari + suplemen temulawak 21 hari) dan P3 (diinduksi parasetamol 14 hari + suplemen kelapa kopyor 5x dosis) memberikan hasil statistik yang berbeda nyata (P≤0.1) dengan K- (diinduksi parasetamol 14 hari + akuades 21 hari). Pemberian suplemen kelapa kopyor 1x dosis (P1) dan 3x dosis (P2) mengalami peningkatan aktivitas SOD total, namun relatif lebih kecil, sehingga menurut perhitungan statistik tidak teramati perbedaannya secara nyata.
Pemberian parasetamol ditujukan untuk menghasilkan radikal bebas yang dapat menginduksi enzim SOD. Hal ini sesuai dengan penelitian Dinu et al. (2005) yang menyatakan bahwa radikal bebas yang dihasilkan etanol dapat menginduksi produksi enzim antoksidan seperti SOD. Produksi dan aktivitas enzim SOD selanjutnya sangat dipengaruhi oleh beberapa faktor, antara lain tersedianya kofaktor yang diperlukan oleh enzim tersebut, lingkungan yang sesuai sehingga enzim tersebut dapat bekerja secara optimal, dan keberadaan inhibitor dan akselerator (Voet dan Voet 2006).
Patologi Anatomi Hati
permukaan hati yang cenderung mulus. Hal ini didukung oleh penelitian yang dilakukan oleh Hadi (1985), yang menyatakan bahwa temulawak dapat mengobati gangguan hati dan kantung empedu, melancarkan sekresi empedu dan menurunkan kadar lemak serta anti peradangan (antiinflamasi). Penambahan ekstrak temulawak dalam etanol 50% nyata dapat memperbaiki sel-sel parenkim hati yang mengalami kerusakan akibat pemberian karbontertraklorida (CCl4), hal ini menandakan bahwa rimpang temulawak mempunyai khasiat antihepatotoksik. Penelitian Hidayatullah (2006) tentang hepatotoksitas temulawak pada ayam diperoleh hasil bahwa pemberian sari kering temulawak sampai 400 mg/kg bobot badan ternyata tidak menampakkan fungsi hati yang menurun.
Kelompok K- (diinduksi parasetamol 14 hari + akuades 21 hari) memperlihatkan hati dengan warna coklat kemerahan yang lebih tua dibandingkan normal.
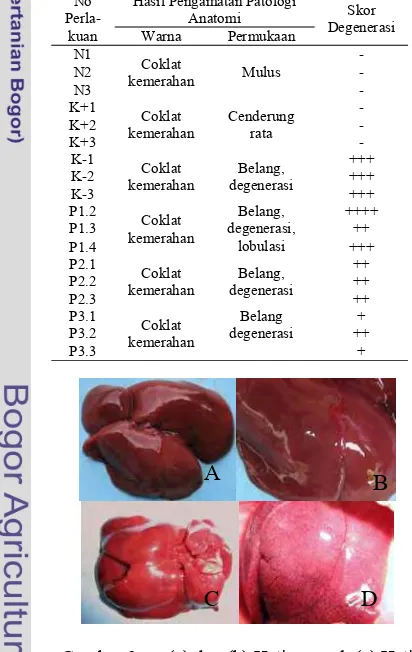
Tabel 4 Hasil pengamatan patologi anatomi
No
Perla-kuan
Hasil Pengamatan Patologi
Anatomi Skor
Degenerasi Warna Permukaan N1
Coklat
kemerahan Mulus
- N2 - N3 - K+1 Coklat kemerahan Cenderung rata - K+2 - K+3 - K-1 Coklat kemerahan Belang, degenerasi +++ K-2 +++ K-3 +++ P1.2 Coklat kemerahan Belang, degenerasi, lobulasi ++++ P1.3 ++ P1.4 +++ P2.1 Coklat kemerahan Belang, degenerasi ++ P2.2 ++ P2.3 ++ P3.1 Coklat kemerahan Belang degenerasi + P3.2 ++ P3.3 +
Gambar 9 (a) dan (b) Hati normal, (c) Hati rusak, (d) Hati rusak mengalami degenerasi dan lobulasi
Permukaan yang ditunjukkan adalah belang, dan mengalami degenerasi. Belang yang terjadi pada permukaan hati merupakan salah satu indikasi bahwa hati mengalami degenerasi, sehingga dapat menurunkan kemampuan hati dalam memperbaiki sel yang rusak (Ressang 1984). Hal ini diduga karena pada kelompok ini hanya diberi pakan standar, sehingga kurang cukup mendapat asupan nutrisi yang dapat membantu regenerasi.
Pengamatan patologi anatomi pada tikus yang diberi suplemen kopyor dengan dosis bertingkat (P1, P2, dan P3) menunjukkan adanya perbaikan kerusakan hati yang bervariasi, warna yang ditunjukkan adalah coklat kemerahan yang belang bervariasi pada setiap dosis perlakuan. Hal ini menunjukkan bahwa kelapa kopyor sebagai suplemen pada kelompok ini dapat memberikan efek perbaikan pada hati yang telah dirusak parasetamol. Pada kelompok 1x dosis (P1) dan 3x dosis (P2), belum terjadi perbaikan yang cukup baik. Hal ini ditunjukkan dengan terjadinya degenerasi dan permukaan hati yang cenderung tidak rata, namun pada kelompok 5x dosis (P3) terjadi perbaikan hati yang cukup baik. Hal ini ditunjukkan dengan tingkat degenerasi yang ringan dan permukaan hati yang cenderung rata dibandingkan kelompok perlakuan lain. Berdasarkan hasil tersebut, diduga penambahan suplemen kelapa kopyor dapat membantu perbaikan hati yang rusak. Hal ini disebabkan kandungan nutrisi pada kopyor, yaitu vitamin, mineral, dan asam lemak dapat membantu proses regenerasi sel hati. Kamath (1996) menyatakan bahwa nutrisi yang baik, konsumsi yang seimbang antara kalori, protein, lemak, karbohidrat, vitamin, serta mineral dapat membantu hati yang rusak untuk meregenerasi sel baru.
Nekropsi hewan percobaan pada hari terakhir pemberian parasetamol (hari ke-14) dilakukan untuk menunjukkan seberapa parah kerusakan yang ditimbulkan parasetamol setelah pemberian 2 minggu. Hasil nekropsi menunjukkan adanya kerusakan pada hati, antara lain terdapat bercak-bercak pada hati dan terdapat bilur steatosis yang tipis. Hal ini menunjukkan bahwa parasetamol dosis tinggi menimbulkan kerusakan organ, terutama pada hati.
Menurut Gan (1980), akibat paling serius konsumsi parasetamol dosis toksik adalah nekrosis hati. Selain itu, nekrosis tubuli renalis dan koma hipoglikemik juga dapat terjadi. Gangguan hati mulai terjadi pada hari kedua keracunan parasetamol, gejala yang ditimbulkan adalah peningkatan aktivitas
C
A
transaminase serum, dehidrogease laktat, konsentrasi bilirubin serum, serta pemanjangan masa protombin. Aktivitas fosfatase alkali dan konsentrasi albumin serum dapat tetap normal. Kerusakan hati dapat berakibat ensefalopati, koma, hingga kematian.
SIMPULAN DAN SARAN
Simpulan
Pemberian parasetamol dalam dosis toksik secara umum menurunkan BB hewan coba. Pemberian suplemen temulawak dan suplemen kelapa kopyor dapat meningkatkan BB hewan coba dengan intensitas yang berbeda. Uji aktivitas enzim SOD total pada hati tikus menunjukkan bahwa kelompok yang diberi suplemen temulawak (K+) dan kelompok yang diberi suplemen kelapa kopyor 5x dosis (P3) berbeda nyata dengan kelompok yang hanya diberi akuades (K-). Pengamatan patologi anatomi pada hati tikus pada kelompok P3 ternyata memberikan hasil perbaikan hati yang lebih baik dibandingkan kelompok K-.
Saran
Perlu dilakukan penelitian lebih lanjut untuk mengetahui pengaruh pemberian suplemen kelapa kopyor terhadap enzim-enzim antioksidan lain, seperti katalase dan glutation peroksidase.
DAFTAR PUSTAKA
Alshcer RG, Erturk N, Heath LS. 2002. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants. J Experimental Bot 53:1331-1341.
Asikin N. 2001. Antioksidan endogen dan penilaian status antioksidan. Makalah dalam kursus penyegaran dan pelatihan 2001. Radikal Bebas dan Antioksidan: Dasar, Aplikasi, dan Pemanfaatan Bahan Alam. Bagian Biokimia, Fakultas Kedokteran Universitas Indonesia. Jakarta. Hlm 1-6.
Bradford M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principal protein-dye binding. Analyt Biochem 72:248-252
Costa V, Amorim MA, Reis E, Quintanilha A, Moradas-Ferreira P. 1997. Mithocondrial superoxide dismutase is essential of ethanol tolerance of Saccharomyces cerevisiae in the post diauxic phase. Microbiol 143:1649-1956.
Dinu D, Nechifor MT, Movileanu L. 2005. Ethanol-induced alterations of the antioxidant defense system in rat kidney. J Biochem Mol Toxicology 19: 386-395.
Elchuri S et al. 2005. CuZnSOD deficiency leads to persistent and widespeard oxidative damage and hepatocarcinogenesis later in life. Oncogen
24:3 [terhubung berkala]. http://nature.com/oncogene/journal/v24/n3
[15 Mar 2007].
Fridovich I. 1986. Superoxide dismutase. Advance in Enzymology and Related Areas of Molecular Biology 58:61-97
Gan S et al.1980. Farmakologi dan Terapi edisi ke-2. Jakarta: UI Press.
Gitawati R. 1995. Radikal bebas: sifat dan peranan dalam menimbulkan kerusakan atau kematian sel. Cermin Dunia Kedokteran 102:33-36
Gordon MH. 1990. The mechanism of antioxidants action in vitro. Di dalam: Hudson BJF, editor. Food Antioxidants. London: Elsivier Applied Science.
Gupta M, Mazumder UK, Kumar TS, Gomathi P, Kumar RS. 2004. Antioxidant and hepatoprotective effect of Bauhinia racemosa against paracetamol and carbon tetrachloride induced liver damage in rats. Iranian J Pharmacol Therapeutics(IJPT) 3: 12-20.
Guzy J et al. 2004. Effect of quercetin on paracetamol-induced rat liver mitochondria dysfunction. Biologia, Bratislava 59: 399-403.
AKTIVITAS SUPEROKSIDA DISMUTASE DAN PATOLOGI
ANATOMI PADA HATI TIKUS DENGAN PERLAKUAN
PARASETAMOL DAN SUPLEMEN KELAPA KOPYOR
SEKAR WINAHYU ARIADINI
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
transaminase serum, dehidrogease laktat, konsentrasi bilirubin serum, serta pemanjangan masa protombin. Aktivitas fosfatase alkali dan konsentrasi albumin serum dapat tetap normal. Kerusakan hati dapat berakibat ensefalopati, koma, hingga kematian.
SIMPULAN DAN SARAN
Simpulan
Pemberian parasetamol dalam dosis toksik secara umum menurunkan BB hewan coba. Pemberian suplemen temulawak dan suplemen kelapa kopyor dapat meningkatkan BB hewan coba dengan intensitas yang berbeda. Uji aktivitas enzim SOD total pada hati tikus menunjukkan bahwa kelompok yang diberi suplemen temulawak (K+) dan kelompok yang diberi suplemen kelapa kopyor 5x dosis (P3) berbeda nyata dengan kelompok yang hanya diberi akuades (K-). Pengamatan patologi anatomi pada hati tikus pada kelompok P3 ternyata memberikan hasil perbaikan hati yang lebih baik dibandingkan kelompok K-.
Saran
Perlu dilakukan penelitian lebih lanjut untuk mengetahui pengaruh pemberian suplemen kelapa kopyor terhadap enzim-enzim antioksidan lain, seperti katalase dan glutation peroksidase.
DAFTAR PUSTAKA
Alshcer RG, Erturk N, Heath LS. 2002. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants. J Experimental Bot 53:1331-1341.
Asikin N. 2001. Antioksidan endogen dan penilaian status antioksidan. Makalah dalam kursus penyegaran dan pelatihan 2001. Radikal Bebas dan Antioksidan: Dasar, Aplikasi, dan Pemanfaatan Bahan Alam. Bagian Biokimia, Fakultas Kedokteran Universitas Indonesia. Jakarta. Hlm 1-6.
Bradford M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principal protein-dye binding. Analyt Biochem 72:248-252
Costa V, Amorim MA, Reis E, Quintanilha A, Moradas-Ferreira P. 1997. Mithocondrial superoxide dismutase is essential of ethanol tolerance of Saccharomyces cerevisiae in the post diauxic phase. Microbiol 143:1649-1956.
Dinu D, Nechifor MT, Movileanu L. 2005. Ethanol-induced alterations of the antioxidant defense system in rat kidney. J Biochem Mol Toxicology 19: 386-395.
Elchuri S et al. 2005. CuZnSOD deficiency leads to persistent and widespeard oxidative damage and hepatocarcinogenesis later in life. Oncogen
24:3 [terhubung berkala]. http://nature.com/oncogene/journal/v24/n3
[15 Mar 2007].
Fridovich I. 1986. Superoxide dismutase. Advance in Enzymology and Related Areas of Molecular Biology 58:61-97
Gan S et al.1980. Farmakologi dan Terapi edisi ke-2. Jakarta: UI Press.
Gitawati R. 1995. Radikal bebas: sifat dan peranan dalam menimbulkan kerusakan atau kematian sel. Cermin Dunia Kedokteran 102:33-36
Gordon MH. 1990. The mechanism of antioxidants action in vitro. Di dalam: Hudson BJF, editor. Food Antioxidants. London: Elsivier Applied Science.
Gupta M, Mazumder UK, Kumar TS, Gomathi P, Kumar RS. 2004. Antioxidant and hepatoprotective effect of Bauhinia racemosa against paracetamol and carbon tetrachloride induced liver damage in rats. Iranian J Pharmacol Therapeutics(IJPT) 3: 12-20.
Guzy J et al. 2004. Effect of quercetin on paracetamol-induced rat liver mitochondria dysfunction. Biologia, Bratislava 59: 399-403.
Halliwell B, Gutteridge JMC. 1989. Free Radical in Biology and Medicine 3rd edition. New York: Oxford University Press.
Hidayatullah S. 2006. Performa mencit (Mus musculus) jantan dan betina dengan suplementasi tepung temulawak (Curcuma xanthorrhiza Roxb.) dalam ransum [skripsi]. Bogor: Fakultas Peternakan, Institut Pertanian Bogor.
Kamath PS. 1996. Clinical approach to the patient with abnormal liver function test results. Mayo Clin Proc 71: 1084-1094.
Kartikawati D. 1999. Studi efek protektif vitamin C terhadap respon imun dan enzim antioksidan pada mencit yang dipapar paraquat [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Kuthan H, Hausmann H, Merringloer J. 1986. A spectrophotometric assay for superoxide dismutase activities in crude tissue fractions. J Biochem 237:175-180.
Lee WM. 1995. Drug-induced hepatotoxicity. Medical Progress 333(17):1118-1127.
Li Y et al. 1995. Dilated cardiomyopthy and neonatal lethality in mutant mice lacking manganese superoxide dismutase. Nat Gen
11:4 [terhubung berkala]. http://nature.com/ng/journal/v11/n4 [15
Mar 2007].
Liang, O. B., Y. Apsarton, T. Widjaja dan S. Puspa. 1985. Beberapa aspek isolasi, identifikasi dan penggunaan komponen-komponen C. Xanthorriza, Roxb dan C. Domestica, Val. PT. Darya Varia Laboratoria. Prosiding Simposium Nasional Termulawak. Bandung. 101-116.
Lu FC. 1995. Toksikologi Dasar Edisi ke-2. Diterjemahkan oleh Edi Nugroho. Jakarta: UI Press.
Macfarlane PS, Robin R, Robin C. 2000. Pathology Illustrated. London: Harcourt Publishers.
Maskromo I. 2005. Kemiripan genetik populasi kelapa berbuah kopyor berdasarkan karakter morfologi dan penanda DNA SSRs (Simple Sequence
Repeats) [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Mason RP, Fischer V. 1986. Free radicals of acetaminophen: their subsequent reactions and toxicological significance. Fed Proc. 45(10):2493-2499.
Mates JM, Gomez CP, Castro. 1999. Antioxidant enzymes and human disease. Clin Biochem. 32 (8):595-603
Mates JM, Jimenez FS. 1999. Antioxidant Enzymes and Their Implication in Pathophysiologic Processes. Frontiers in Bioscience [terhubung berkala]. http://www.bioscience.org [27 Maret 2007].
Matjik AA, Sumertajaya. 2002. Rancangan Percobaan. Bogor: IPB Pr.
Moore M et al. 1985. The toxicity of acetaminophen and N-acetyl-p-benzoquinone imine in isolated hepatocytes is associated with thiol depletion and increased cytosolic Ca2+. J Biol Chem. 260(24):13035-13040.
Moradas-Ferreira P, Costa V, Piper P, Mager W. The molecular defences against reactive oxygen species in yeast. Mol Microbiol 19:651-658.
Mujer MV, Ramirez DA, Mendoza EMT. 1984. Coconut α-D-Galactosidase isoenzim: Isolation, purification, and characterization. Phytochem 23(6):1251-1254
Murugesh KS, Yeligar VC, Maiti BC, Maity TK. 2005. Hepatoprotective and antioxidant role of Berberis tinctoria Lesch leaves on paracetamol induced hepatic damage in rats. Iranian J Pharmacol Therapeutics (IJPT) 4(1):64-69.
Nabib R. 1987. Bahan Pengajaran Patologi dan Penyakit. Bogor: PAU Bioteknologi IPB
Nurwati D. 2002. Profil imunohistokimia enzim antioksidan copper,zinc superoxide dismutase (Cu,Zn-SOD) pada ginjal tikus hiperkolesterolemia [skripsi]. Bogor: Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Peeters-Joris C, Vandevoorde A, Baudhuin P. Subselular localization pf superoxide dismutase in rat liver. Biochem 150: 31.
Prangdimurti E. 1999. Efek perlindungan ekstrak jahe terhadap respon imun mencit yang diberi stress oksidatif oleh pestisida paraquat [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Ressang AA. 1984. Patologi Khusus Veteriner. Bali: Percetakan NV.
Saleh U. 2001. Pengaruh stress terhadap gambaran imunohistokimia antioksidan superoksida dismutase (Cu,Zn-SOD) pada ginjal tikus [skripsi]. Bogor: Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Samonthe et al. 1989. Galactomanan degrading enzyme in maturing normal and macapuno and germinating normal cocnut endosperm. Phytochem 28 (9) 2269-2273
Santoso et al. 1996. Nutrient composition of kopyor coconuts (Cocos nucifera L.). J Food Chem :57 no 2 : 299-304
Sedarnawati Y, Imaizumi K, Sugano M. 1991. Effects of an Indonesian medicinal plant, Curcuma xanthorrhiza Roxb., on the levels of serum glucose and triglyceride, fatty acid desaturation, and bile acid excretion in streptozotocin-induced diabetic rats. Agric Biol Chem 55 (12): 3005-3010.
Siregar P. 1992. Metabolit oksigen radikal bebas dan kerusakan jaringan. Cermin Dunia Kedokteran 80:112-115.
Subekti EM. 1997. Pengaruh pemberian vitamin antioksidan A, E, dan C, serta minyak sawit mentah (CPO) terhadap proliferasi limfosit dan kadar malonildehida plasma tikus percobaan yang diberi ransum mengandung malathion [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Sulistyo BI. 2004. Radikal bebas, peroksidasi lipid, dan antioksidan. Cakrawala Pendidikan 1:55-61.
Tejasari. 2000. Efek proteksi bioaktif oleoresin rimpang jahe (zingiber officinale roscoe) terhadap fungsi limfosit secara in-vitro [disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Tuminah S. 2000. Radikal bebas dan antioksidan: kaitannya dengan nutrisi dan penyakit kronis. [terhubung berkala] http://www.cerminduniakedokteran.com. [18 Februari 2007].
West CW dan Prohaska JR. 2004. Cu,Zn-superoxide dismutase is lower and copper chaperone (CCS) is higher in erythrocytes of copper deficient rats and mice. Experimental Biol and Med 229:756-764
Winarno FG. 1982. Kelapa Kopyor, Molases dan Sendawa. Bogor: Institut Pertanian Bogor.
Winterbourn CC, Hawkins M, Brian C. 1975. the estimation of red cell superoxide dismutase activity. J Lab Clin Med 85:337-342
Wresdiyati T. 2003. Deteksi secara imunohistokimia oxygen-free radikal scavenger copper,zinc superoxide dismutase (Cu,Zn-SOD) pada hati tikus dibawah kondisi stress. Biota 8(3):107-112.
transaminase serum, dehidrogease laktat, konsentrasi bilirubin serum, serta pemanjangan masa protombin. Aktivitas fosfatase alkali dan konsentrasi albumin serum dapat tetap normal. Kerusakan hati dapat berakibat ensefalopati, koma, hingga kematian.
SIMPULAN DAN SARAN
Simpulan
Pemberian parasetamol dalam dosis toksik secara umum menurunkan BB hewan coba. Pemberian suplemen temulawak dan suplemen kelapa kopyor dapat meningkatkan BB hewan coba dengan intensitas yang berbeda. Uji aktivitas enzim SOD total pada hati tikus menunjukkan bahwa kelompok yang diberi suplemen temulawak (K+) dan kelompok yang diberi suplemen kelapa kopyor 5x dosis (P3) berbeda nyata dengan kelompok yang hanya diberi akuades (K-). Pengamatan patologi anatomi pada hati tikus pada kelompok P3 ternyata memberikan hasil perbaikan hati yang lebih baik dibandingkan kelompok K-.
Saran
Perlu dilakukan penelitian lebih lanjut untuk mengetahui pengaruh pemberian suplemen kelapa kopyor terhadap enzim-enzim antioksidan lain, seperti katalase dan glutation peroksidase.
DAFTAR PUSTAKA
Alshcer RG, Erturk N, Heath LS. 2002. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants. J Experimental Bot 53:1331-1341.
Asikin N. 2001. Antioksidan endogen dan penilaian status antioksidan. Makalah dalam kursus penyegaran dan pelatihan 2001. Radikal Bebas dan Antioksidan: Dasar, Aplikasi, dan Pemanfaatan Bahan Alam. Bagian Biokimia, Fakultas Kedokteran Universitas Indonesia. Jakarta. Hlm 1-6.
Bradford M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principal protein-dye binding. Analyt Biochem 72:248-252
Costa V, Amorim MA, Reis E, Quintanilha A, Moradas-Ferreira P. 1997. Mithocondrial superoxide dismutase is essential of ethanol tolerance of Saccharomyces cerevisiae in the post diauxic phase. Microbiol 143:1649-1956.
Dinu D, Nechifor MT, Movileanu L. 2005. Ethanol-induced alterations of the antioxidant defense system in rat kidney. J Biochem Mol Toxicology 19: 386-395.
Elchuri S et al. 2005. CuZnSOD deficiency leads to persistent and widespeard oxidative damage and hepatocarcinogenesis later in life. Oncogen
24:3 [terhubung berkala]. http://nature.com/oncogene/journal/v24/n3
[15 Mar 2007].
Fridovich I. 1986. Superoxide dismutase. Advance in Enzymology and Related Areas of Molecular Biology 58:61-97
Gan S et al.1980. Farmakologi dan Terapi edisi ke-2. Jakarta: UI Press.
Gitawati R. 1995. Radikal bebas: sifat dan peranan dalam menimbulkan kerusakan atau kematian sel. Cermin Dunia Kedokteran 102:33-36
Gordon MH. 1990. The mechanism of antioxidants action in vitro. Di dalam: Hudson BJF, editor. Food Antioxidants. London: Elsivier Applied Science.
Gupta M, Mazumder UK, Kumar TS, Gomathi P, Kumar RS. 2004. Antioxidant and hepatoprotective effect of Bauhinia racemosa against paracetamol and carbon tetrachloride induced liver damage in rats. Iranian J Pharmacol Therapeutics(IJPT) 3: 12-20.
Guzy J et al. 2004. Effect of quercetin on paracetamol-induced rat liver mitochondria dysfunction. Biologia, Bratislava 59: 399-403.
Kelompok percobaan
Pakan standar
+
akuades
+
parasetamol 500
mg/kg BB
selama 7 hari
dan 600 mg/kg
BB selama 7
hari berikutnya
+
kopyor (20 g/kg
BB) selama 21
hari berikutnya
Pakan standar
+
akuades
selama 35 hari
Pakan standar
+
akuades
+
parasetamol
500 mg/kg BB
selama 7 hari
dan 600 mg/kg
BB selama 7
hari berikutnya
+
kopyor (12 g/kg
BB) selama 21
hari berikutnya
Pakan standar
+
akuades
+
parasetamol
500 mg/kg BB
selama 7 hari
dan 600 mg/kg
BB selama 7
hari berikutnya
+
akuades dan
pakan standar
hingga hari
ke-35
Pakan standar
+
akuades
+
parasetamol
500 mg/kg BB
selama 7 hari
dan 600
mg/kg BB
selama 7 hari
berikutnya
+
temulawak
(3 g/kg BB)
selama 21 hari
berikutnya
Pakan standar
+
akuades
+
parasetamol
500 mg/kg BB
selama 7 hari
dan 600 mg/kg
BB selama 7
hari berikutnya
+
kopyor (4 g/kg
BB) selama 21
hari berikutnya
Kelompok N (kontrol normal)
Kelompok K+ (kontrol
positif)
Kelompok K- (kontrol negatif)
Kelompok P1 (perlakuan)
Kelompok P2 (perlakuan)
Kelompok P3 (perlakuan)
Lampiran 2 Penentuan dosis parasetamol, kelapa kopyor, dan temulawak
Dosis pemberian parasetamol
Dosis yang digunakan
: 500 mg/kg BB
Pembuatan larutan stok
:
1 tablet @ 500 mg dilarutkan dalam 5 ml akuades (100 mg/ml)
Konversi dosis untuk tikus (ex: 200 g)
200 g x 500 mg = 100 mg
≈
1 ml larutan
1000
g
Dosis pemberian daging kelapa kopyor
Dosis manusia per hari
: 250 g
Asumsi bobot badan manusia : 70 kg
Perhitungan dosis
:
Dosis per kg BB = 250 g = 3,57 g/kg BB/hari
≈
4 g/kg BB
70 kg
Konversi dosis untuk tikus (ex: 200 g)
200 g x 4 g = 0,8 g
1000
g
Dosis pemberian temulawak
Dosis pengobatan
: 3 x 2 kapsul @ 500 mg serbuk temulawak (3 g)
Asumsi bobot badan manusia : 70 kg
Perhitungan dosis
:
Pembuatan larutan stok
:
500 mg serbuk dilarutkan dalam 50 ml akuades (10 mg/ml)
Dosis per kg BB = 3000 mg = 42,86 mg/kg BB
70 kg
Konversi dosis untuk tikus (ex: 200 g)
200 g x 42,86 mg = 8,57 mg
≈
0,0086 g
≈
0,9 ml larutan
Lampiran 3 Kurva standar BSA
BSA
(mg/ml) 0 0.0156 0.0468 0.1092 0.1560
Absorban
0 0.285 0.509 0.879 1.197
Konsentrasi BSA stok yang digunakan 1.56 mg/mL
Lampiran 4 Hasil pengukuran kadar protein dan aktivitas enzim
Perlakuan Absorban
Σ
protein
(mg/mL)
Aktivitas enzim
SOD total
(U/mg protein)
N 1
0,684
0,5801
186,3
N 2
0,538
0,4472
182,9
N 3
0,538
0,4472
182,9
K+ 1
0,482
0,3962
164,1
K+ 2
0,654
0,5528
160,6
K+ 3
0,919
0,7942
150,4
K- 1
0,784
0,6211
134,7
K- 2
0,78
0,8279
141,8
K- 3
1,123
0,6129
133,3
P1.2 0,729
0,6712
139,4
P1.3 0,956
0,6676
145,6
P1.4 0,72
0,98
133,3
P2.1 0,228
0,1648
136,7
P2.2 0,711
0,6047
138,4
P2.3 1,015
0,8816
157,1
P3.1 0,569
0,4754
165,4
P3.2 0,703
0,5974
171,7
P3.3 0,943
0,816
143,6
Perhitungan:
Σ
protein total (mg/mL) diten