KOPOLIMERISASI CANGKOK TAUT-SILANG SELULOSA
AMPAS SAGU SEBAGAI MEDIA PEMISAHAN
XANTORIZOL
BAYU SEGARA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
BAYU SEGARA. Kopolimerisasi Cangkok Taut-Silang Selulosa Ampas Sagu
sebagai Media Pemisahan Xantorizol. Dibimbing oleh MUHAMMAD FARID
dan TUN TEDJA IRAWADI.
Ampas sagu (ela) merupakan limbah lignoselulosa yang dihasilkan dari
ekstraksi pati sagu yang melimpah dan tidak bernilai ekonomi. Ela mengandung
selulosa yang berpotensi untuk dimodifikasi dengan menggunakan teknik
kopolimerisasi cangkok taut-silang dan diaplikasikan menjadi fase diam
kromatografi kolom. Isolasi selulosa dilakukan dalam 2 tahap, yaitu hidrolisis pati
dengan HCl 3% dan delignifikasi dengan H
2O
25% pH 12. Isolat yang dihasilkan
mengandung 56.42%
α
-selulosa, 36.62% hemiselulosa, dan 1.32% lignin.
Kopolimerisasi dilakukan dengan monomer akrilamida dan penaut-silang
N
,
N
’
-metilenabisakrilamida. Jumlah penaut-silang diragamkan 0.1, 0.5, dan 1 g serta
nisbah isolat selulosa:akrilamida adalah 1:1. Hasil analisis nitrogen Kjeldahl dan
spektroskopi inframerah transformasi Fourier menunjukkan keberhasilan
kopolimerisasi. Ketiga produk kopolimerisasi (fase diam) dapat memisahkan
xantorizol dari ekstrak temu lawak. Fase diam terbaik adalah kopolimer dengan
penaut-silang 0.5 g yang dapat memisahkan 2357 ppm xantorizol dengan resolusi
1.467 dan persen area 34.08%.
ABSTRACT
BAYU SEGARA. Graft Crosslinked Copolymerization of Cellulose from Sago
Waste as Separation Phase for Xanthorrhizol. Supervised by MUHAMMAD
FARID and TUN TEDJA IRAWADI.
Sago waste (ela) is a lignocellulosic waste resulted from starch extraction of
sago that is abundant and do not have economic value. Ela contains cellulose that
potential to be modified using graft crosslinked copolymerization technique and to
be applied as a stationary phase in column chromatography. Cellulose was
isolated done in 2 stages, namely hydrolysis of starch using HCl 3% and
delignification using H
2O
25% under pH 12. The isolate contained 56.42
% α
KOPOLIMERISASI CANGKOK TAUT-SILANG SELULOSA
AMPAS SAGU SEBAGAI MEDIA PEMISAHAN
XANTORIZOL
BAYU SEGARA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Kopolimerisasi Cangkok Taut-Silang Selulosa Ampas Sagu sebagai
Media Pemisahan Xantorizol
Nama : Bayu Segara
NIM
: G44070072
Disetujui
Pembimbing I
Drs Muhammad Farid, MSi
NIP 19640525 199203 1 003
Pembimbing II
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
Diketahui
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yesus Kristus atas berkat dan
anugerah-Nya sehingga penulis dapat menyelesaikan karya ilmiah dengan judul
Kopolimerisasi Cangkok Taut-Silang Selulosa Ampas Sagu sebagai Media
Pemisahan Xantorizol. Karya ilmiah ini disusun berdasarkan hasil penelitian yang
dilaksanakan pada bulan Februari hingga September 2011 di Laboratorium
Terpadu IPB dan Laboratorium Organik Departemen Kimia IPB.
Penulis mengucapkan terima kasih kepada Bapak Drs Muhammad Farid,
MSi dan Ibu Prof Dr Ir Tun Tedja Irawadi, MS yang telah memberi banyak
arahan, semangat, saran, dan kritik selama penulis melaksanakan penelitian dan
penyusunan karya ilmiah ini. Penulis juga mengucapkan terima kasih kepada
Papah, Mamah, serta keluarga yang telah memberikan semangat, kasih sayang,
doa, dan bantuan materi selama penulis menempuh masa studi, penelitian, dan
penulisan karya ilmiah ini.
Terima kasih juga kepada Ibu Henny Purwaningsih Suyuti, SSi, MSi dan
Bapak M. Khotib, SSi, MSi yang telah memberikan saran dan kritik serta
semangat. Selain itu penulis juga ucapkan terima kasih kepada Baim, Indah, dan
staf analis Laboratorium Terpadu atas bantuan serta masukan selama penelitian.
Ucapan terima kasih juga penulis ucapkan kepada Ardita, Ria, Raissa, Jali, Siti,
Pertiwi, serta teman-teman Kimia 44 atas saran, semangat, dan pengalaman
selama studi dan penelitian.
Semoga karya ilmiah ini bermanfaat bagi perkembangan ilmu pengetahuan.
November 2011
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 21 November 1989 dari Ayah
Suyanto Hermandoko dan Ibu Lim Kwie Lie. Penulis adalah putra kedua dari tiga
bersaudara. Tahun 2007 penulis lulus dari SMA Negeri 2 Jakarta dan pada tahun
yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui
jalur Seleksi Penerimaan Mahasiswa Baru (SPMB). Penulis memilih Program
Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan
Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
METODE
Alat dan Bahan ... 1
Lingkup Kerja ... 2
HASIL DAN PEMBAHASAN
Isolasi Selulosa Ela ... 4
Fase Diam Selulosa-
g
-Poliakrilamida ... 6
Aplikasi Kromatografi Kolom ... 7
SIMPULAN DAN SARAN
Simpulan ... 9
Saran ... 9
DAFTAR PUSTAKA ... 9
LAMPIRAN ... 12
DAFTAR TABEL
Halaman
1 Analisis proksimat ela (%) ... 5
2 Kadar nitrogen dan kapasitas absorpsi air fase diam ... 7
3 Selisih indeks bias pelarut (×10
-4) ... 8
DAFTAR GAMBAR
Halaman
1 Foto ela halus setelah disaring 60 mesh (a), ela bebas pati (b), dan selulosa
hasil isolasi (c). ... 5
2 Struktur akrilamida (a) dan
N
,
N
’
-metilenabisakrilamida (b). ... 7
3 Struktur kimia xantorizol. ... 8
4 Foto kromatogram KLT di
bawah β54 nm.
... 9
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian... 13
2 Reaktor kopolimerisasi cangkok dan taut-silang ... 14
3 Hipotesis mekanisme reaksi kopolimerisasi cangkok dan taut-silang selulosa
dengan akrilamida ... 15
4 Hasil pengukuran kadar nitrogen dan daya absorpsi air ... 17
5 Spektrum FTIR isolat selulosa dan fase diam ... 18
6 Indeks bias pelarut ... 19
7 Kromatogram KLT dan data
R
f fraksi kromatografi kolom... 208 Kromatogram KCKT standar xantorizol dan perhitungan konsentrasi
xantorizol hasil elusi ... 21
9 Kromatogram KCKT ... 22
PENDAHULUAN
Indonesia merupakan salah satu negara penghasil sagu terbesar di dunia. Luas areal yang ditanami tanaman sagu mencapai 1.40 juta hektar dengan ±1 juta hektar terdapat di Maluku dan Papua (Bustaman 2008). Luas areal tersebut mencakup 50% dari luas areal tanaman sagu dunia yang telah mencapai 2.20 juta hektar (Susanto 2006).
Pemanfaatan tanaman sagu saat ini cenderung terfokus pada ekstraksi pati sagu. Pati sagu didapat dengan mengekstraksi hasil penggilingan empulur batang sagu dengan air. Ekstraksi pati sagu menghasilkan 3 jenis limbah, yaitu ampas sagu (ela), kulit batang, dan air limbah. Ela telah dimanfaatkan sebagai suplemen pakan ternak, media tumbuh jamur, dan pupuk organik (Kumaran
et al. 1997; Papilaya 2009). Kulit batang dimanfaatkan sebagai bahan bangunan (dinding serta lantai rumah) dan kayu bakar (Kiat 2006), sedangkan air limbah dibuang ke sungai. Namun, ela belum dimanfaatkan secara maksimal sehingga banyak terbuang dan mencemari lingkungan karena menimbulkan bau tidak sedap.
Ela merupakan limbah berlignoselulosa yang dihasilkan dari ekstraksi pati sagu yang melimpah dan tidak bernilai ekonomi. Ela mengandung sekitar 19.55% selulosa berdasarkan bobot (Kiat 2006) yang berpotensi untuk dimodifikasi secara kimia menjadi bahan yang lebih bernilai. Gugus hidroksil (–OH) selulosa dapat dimodifikasi menghasilkan turunan selulosa, contohnya asetilasi menghasilkan selulosa asetat dan kopolimerisasi cangkok menggunakan akrilamida menghasilkan kopolimer
selulosa-g-poliakrilamida(Biçak et al. 1999).
Selulosa dan turunannya, seperti selulosa asetat, telah dimanfaatkan sebagai media pemisahan dalam chiral separation phase
(CSP) (Kowalska & Sherma 2007). Keberadaan atom C kiral dalam molekul selulosa menyebabkan dirinya dapat menjerap senyawa-senyawa kiral. Selulosa yang diasetilasi akan mengurangi kepolarannya sehingga dapat meningkatkan kemampuan selulosa asetat (CA) untuk menjerap senyawa yang kurang polar (Santi 2006). Modifikasi dengan teknik kopolimerisasi cangkok akan meningkatkan kepolaran selulosa sehingga kemampuan selulosa menjerap senyawa polar diharapkan akan meningkat.
Selulosa ela yang dimodifikasi dengan cara asetilasi telah dimanfaatkan sebagai fase diam kromatografi kolom (Santi 2006;
Cahyani 2010; Irfana 2010). Santi (2006) melaporkan bahwa ampas sagu yang dimodifikasi dengan cara asetilasi memiliki kemampuan sebagai fase diam lebih baik daripada dimodifikasi dengan cara nitrasi. Cahyani (2010) dan Irfana (2010) melanjutkan penelitian tersebut dengan mengasetilasi ampas sagu yang telah dibebaskan dari pati dan dipucatkan dengan NaClO2 serta
diaplikasikan sebagai fase diam kromatografi kolom. Selulosa asetat yang disintesis berhasil memisahkan komponen kurkuminoid dari ekstrak temu lawak.
Penelitian ini bertujuan memanfaatkan selulosa dalam ela sebagai fase diam kromatografi kolom untuk memisahkan xantorizol dari ekstrak temu lawak. Xantorizol merupakan senyawa aktif yang terkandung dalam temu lawak selain kurkuminoid (Hwang et al. 2000). Selulosa diisolasi dengan menghidrolisis pati, hemiselulosa, dan lignin di dalam ela. Selulosa hasil isolasi kemudian dimodifikasi menggunakan teknik kopolimerisasi cangkok dan taut-silang dengan monomer akrilamida dan penaut-silang N,N’-metilenabisakrilamida (MBA).
METODE
Alat dan Bahan
Alat-alat yang digunakan adalah alat-alat kaca, pemanas dengan pengaduk magnet, motor pengaduk, mesin penggiling, reaktor kopolimerisasi cangkok dan taut-silang (labu bulat leher tiga serta corong tambah cairan ekualisasi tekanan), radas refluks, oven, radas analisis nitrogen Kjeldahl, radas kromatografi kolom, radas kromatografi lapis tipis, lampu UV-tampak, refraktometer Bausch & Lomb, spektrofotometer inframerah transformasi Fourier (FTIR) IRPrestige–21 Shimadzu, dan kromatografi cair kinerja tinggi (KCKT) LC-10AD VP Shimadzu.
Bahan-bahan yang digunakan adalah ela dari industri pati sagu (Cimahpar, Bogor), rimpang temu lawak dari kebun Biofarmaka (Dramaga, Bogor), standar xantorizol, HCl, pelet NaOH teknis, H2O2 teknis, amonium
2
Lingkup Kerja
Penelitian ini terbagi menjadi 3 tahapan (Lampiran 1). Tahap pertama adalah isolasi selulosa ela, tahap kedua adalah sintesis fase diam selulosa-g-poliakrilamida, dan tahap ketiga adalah pemilihan fase diam kromatografi kolom terbaik.
Preparasi Sampel Ampas Sagu
Ela yang baru diambil dari industri pati sagu di daerah Cimahpar, Bogor dijemur di bawah sinar matahari selama dua hari hingga kering. Ela kering kemudian digiling di Balai Penelitian Hutan, Bogor. Hasil penggilingan diayak hingga bagian berserabutnya terpisah. Bagian yang tidak berserabut (bagian halus ela) disimpan dalam wadah tertutup.
Isolasi Selulosa Ela
Hidrolisis Pati (modifikasi SNI 3729:2008)
Sebanyak 50 g ela halus dimasukkan ke dalam gelas piala 1 L dan ditambahkan 1 L HCl 3%. Campuran dipanaskan pada suhu 80 °C sambil diaduk menggunakan pengaduk magnet selama 1 jam hingga campuran bebas pati. Keberadaan pati diuji dengan cara menambahkan 2 tetes larutan iodin ke dalam 2 tetes campuran ela. Pemanasan dihentikan saat campuran menunjukkan hasil negatif (campuran tidak menimbulkan warna biru). Ela bebas pati kemudian disaring sambil dialiri air hingga pH-nya sama dengan pH air. Ela bebas pati lalu dikeringkan di bawah sinar matahari selama 2 hari hingga kering.
Delignifikasi (modifikasi Sun et al. 2005)
Sebanyak 50 g ela bebas pati ditambahkan 1.25 L H2O2 5% pH 12 (dikondisikan dengan
NaOH 40%) di dalam gelas piala 3 L. Campuran dipanaskan pada suhu 70–80 °C sambil diaduk menggunakan motor pengaduk dengan kecepatan pengadukan 200 rpm secara bertahap selama 2, 3, dan 3 jam. Setiap tahapan selesai, residu disaring sambil dialiri air dan sesekali dengan air panas hingga pH-nya sama dengan pH air. Setelah 8 jam, ampas sagu hasil delignifikasi dikeringkan dalam oven dengan suhu 60 °C hingga bobot konstan. Ampas sagu hasil delignifikasi digiling menggunakan mesin penggiling kemudian disaring hingga partikel berukuran 100 mesh.
Pencirian Selulosa
Pencirian selulosa yang meliputi penetapan kadar holoselulosa, α-selulosa, dan lignin dilakukan dengan bantuan laboratorium terpadu Balai Penelitian dan Pengembangan Hutan (Balitbang Hutan).
Penetapan Kadar Holoselulosa (ASTM 1104-56)
Sebanyak 2 g sampel selulosa bebas bahan ekstraktif dan kering oven dimasukkan ke dalam Erlenmeyer 250 mL dengan tutup kaca. Sampel ditambahkan 150 mL air suling dan 0.2 mL asam asetat glasial lalu ditambahkan 1 g NaClO2. Campuran dipanaskan selama 5
jam dengan suhu 70–80 °C dalam penangas air sambil ditambahkan 0.2 mL asam asetat glasial dingin dan 1 g NaClO2 setiap jam
sambil sering dikocok. Labu didinginkan di dalam air es hingga suhu 10 °C. Campuran disaring menggunakan cawan masir G2 sambil
divakum. Residu bebas ClO2 dicuci dengan air
suling hingga berwarna putih. Cawan dikeringkan di dalam oven suhu 105 °C hingga bobot tetap kemudian didinginkan dalam desikator dan timbang.
Penetapan Kadar α-Selulosa (ASTM 1103-60)
Sebanyak 2 g holoselulosa kering oven dimasukkan ke dalam Erlenmeyer 250 mL. Labu dimasukkan ke dalam penangas air untuk menjaga suhu 20 °C dan ditutup cawan petri. Sebanyak 50 mL NaOH 17.5% ditambahkan sambil diaduk selama 1 menit lalu dibiarkan selama 5 menit. Campuran disaring menggunakan cawan G2 kapasitas 30
3
Penetapan Kadar Lignin (TAPPI T 13 m - 45)
Sebanyak 2 g sampel selulosa dimasukkan ke dalam cawan G2 dan ditutup kertas saring
lalu dimasukkan ke dalam tabung Soxhlet. Ekstraksi dilakukan dengan alkohol 95% selama 4 jam. Kemudian sampel diekstraksi dengan alkohol:benzena (1:2) selama 6 jam. Setelah selesai, pelarut dikeluarkan dengan pengisapan. Sampel kemudian dipindahkan ke dalam gelas piala 500 mL dan dipanaskan dengan 400 mL air panas di atas penangas air pada suhu 100 °C selama 3 jam kemudian disaring dan dicuci dengan 100 mL air panas.
Sampel dikeringkan udara kemudian dipindahkan ke dalam gelas piala kecil dan ditambahkan asam sulfat 72% dingin perlahan-lahan sambil diaduk pada suhu 12– 15 °C selama 1 menit. Campuran didiamkan selama 2 jam dan suhu dijaga tetap 18–20 °C. Sampel dipindahkan ke dalam Erlenmeyer 1 L dan diencerkan dengan air suling 560 mL hingga konsentrasinya 3% kemudian direfluks selama 4 jam dengan volume tetap. Bahan yang tidak larut disaring dan dicuci dengan air panas hingga bebas asam. Hasilnya dikeringkan dalam oven suhu 105 °C, didinginkan dalam desikator lalu ditimbang hingga bobot tetap.
Sintesis Fase Diam
Kopolimerisasi Cangkok dan Taut-Silang
(modifikasi Liang et al. 2009)
Kopolimerisasi cangkok dan taut-silang dilakukan dengan meragamkan jumlah penaut-silang yang digunakan, yakni 0.1, 0.5, dan 1 g. Jenis penaut-silang yang digunakan dalam penelitian ini adalah N,N’ -metilenabisakrilamida. Reaktor kopolimerisasi cangkok dan taut-silang diperlihatkan dalam Lampiran 2.
Ela hasil delignifikasi berukuran 100 mesh sebanyak 15 g dimasukkan ke dalam labu bulat leher tiga dan ditambahkan 150 mL akuades. Reaktor yang telah dilengkapi dengan corong tambah cairan ekualisasi tekanan dan termometer beserta selang gas nitrogen ditempatkan di atas mantel pemanas lalu dipanaskan sambil diaduk menggunakan motor pengaduk dengan kecepatan pengadukan 200 rpm. Setelah mencapai suhu 90–95 °C, pemanasan dilanjutkan selama 30
menit sambil dialiri gas nitrogen. Suhu campuran kemudian diturunkan hingga 60–65 °C. Sebanyak 250 mg amonium persulfat (APS) yang dilarutkan dengan 12.5 mL akuades ditambahkan ke dalam campuran dan dijaga pada suhu 60–65 °C selama 15 menit. Campuran 15 g akrilamida dan MBA yang dilarutkan dengan 200 mL akuades ditambahkan ke dalam campuran sedikit demi sedikit (laju alir 2 tetes per detik) selama 20– 30 menit dengan suhu tetap 60–65 °C. Campuran direaksikan dengan menaikkan suhu menjadi 68–72 °C dan dijaga konstan selama 3 jam. Gel yang terbentuk kemudian dipindahkan ke dalam gelas piala 1 L dan ditutup rapat untuk didinginkan.
Pencucian Gel (modifikasi Al-Kawari et al.
2011; Lanthong et al. 2006)
Produk hasil pencangkokan ditambahkan 150 mL metanol dan diaduk dengan kecepatan pengadukan 200 rpm selama 30 menit. Gel kemudian ditambahkan etanol 150 mL dan diaduk cepat dengan kecepatan pengadukan 400 rpm selama 5 menit lalu disuspensikan selama 30 menit. Gel yang terbentuk dipisahkan dari alkohol dan dipotong kecil lalu direfluks dengan 200 mL aseton pada suhu 70 °C selama 1 jam. Gel kemudian dikeringkan dalam oven dengan suhu 60 °C hingga bobot konstan, dan digiling dengan mesin penggiling hingga partikel berukuran 80 mesh. Produk yang dihasilkan dinamakan polimer selulosa-g-poliakrilamida (selanjutnya disebut fase diam).
Analisis Kadar Nitrogen (Metode Kjeldahl)
Fase diam ditimbang sebanyak 0.1 g dan dimasukkan ke dalam labu Kjeldahl 100 mL, lalu ditambahkan 2 g campuran selen dan 100 mL H2SO4 pekat. Campuran didestruksi
4
penampung distilasi sekitar 150 mL atau terjadi letupan dalam labu distilasi. Proses distilasi dihentikan lalu bagian dalam kondensor dan ujung pipa dibilas dengan air suling. Hasil distilasi dititrasi dengan larutan HCl 0.1 N hingga titik akhir tercapai (warna larutan berubah dari hijau menjadi merah muda).
Keterangan:
W = bobot sampel (mg)
V1 = volume titrasi sampel (mL) V0 = volume titrasi blangko (mL) NHCl = normalitas HCl (N)
BEN = bobot ekuivalen nitrogen (14.007 g/ek)
Uji Kapasitas Absorpsi Air (modifikasi Liu et al. 2007)
Fase diam ditimbang sebanyak 0.1 g dalam botol bertutup dan ditambahkan 200 mL akuades lalu direndam selama 24 jam. Gel yang mengembang disaring dengan saringan 100 mesh hingga tidak ada air yang menetes lagi lalu ditimbang.
Keterangan:
WA = absorpsi air (%)
W0 = bobot fase diam kering (g)
W1 = bobot fase diam yang mengembang (g)
Aplikasi Kromatografi Kolom Uji Ketahanan Fase Diam terhadap Pelarut
Pelarut yang digunakan adalah n-heksana, etanol, metanol, etil asetat, aseton, dan toluena. Fase diam sebanyak 0.5 g ditambahkan 10 mL pelarut di dalam vial dan ditutup rapat. Campuran kemudian dimaserasi selama 3 hari. Setelah itu, keadaan fisik fase diam diamati dan masing-masing pelarut dianalisis dengan refraktometer. Nilai indeks bias dibandingkan dengan blangko masing-masing pelarut yang digunakan.
Penyiapan Ekstrak Temu Lawak
Serbuk kering temu lawak sebanyak 25 g dimasukkan ke dalam labu Erlenmeyer 250 mL kemudian dimaserasi dengan 100 mL etanol 96% selama 24 jam. Maserat dipisahkan dan proses maserasi diulang 2 kali dengan jenis dan jumlah pelarut yang sama.
Semua maserat dikumpulkan dalam labu bulat dan dipekatkan dengan penguap putar pada suhu 40 °C hingga diperoleh ekstrak pekat.
Kromatografi Kolom
Eluen yang digunakan adalah pelarut yang tidak bereaksi atau memengaruhi sifat fase diam. Kolom kromatografi yang berisi 8 g fase diam disiapkan dengan tinggi seragam di setiap kolom (20 cm), laju alir ±1 mL/menit, dan ekstrak kasar temu lawak yang digunakan sebanyak 0.5 mL. Ekstrak dielusi dengan mengalirkan fase gerak sampai semua fraksi keluar dari kolom. Fraksi yang keluar dari kolom ditampung sebanyak 5 mL di dalam
vial. Fraksi yang diperoleh diuji dengan KLT dan nilai retardation factor (Rf) yang
diperoleh dari masing-masing eluen dibandingkan dengan nilai Rf standar
xantorizol.
Kromatografi Lapis Tipis (Asriani 2010)
KLT dilakukan dengan menotolkan ekstrak kasar temu lawak, standar xantorizol, dan fraksi-fraksi hasil kolom pada lempeng KLT gel silika GF 254 dengan bantuan pipa kapiler lalu dielusi dengan fase gerak heksana:etil asetat (10:1). Selesai dielusi, pelat KLT dikeringkan dan pola pemisahannya dideteksi dengan sinar UV pada panjang gelombang 254 nm.
Analisis Xantorizol dengan KCKT
Fraksi yang teridentifikasi mengandung xantorizol dan standar xantorizol dengan konsentrasi 0.29% diinjeksikan ke dalam KCKT sebanyak 10 L. Fase gerak yang digunakan adalah campuran asam fosfat dan asetonitril.
HASIL DAN PEMBAHASAN
Isolasi Selulosa Ela
Ela merupakan limbah yang mengandung lignoselulosa, yaitu lignin, hemiselulosa, dan selulosa. Selulosa dibagi menjadi 3 berdasarkan kelarutannya, yaitu α-, -, dan -selulosa. α-Selulosa tidak larut dalam larutan basa kuat, sedangkan - dan -selulosa larut. Penetralan larutan tersebut mengendapkan
-selulosa sedangkan -selulosa tetap larut.
Kemurnian selulosa dinyatakan melalui parameter α-selulosa (Achmadi 1990).
5
Penelitian ini dilakukan untuk memanfaatkan selulosa dari ela. Oleh karena itu, komponen lain selain selulosa perlu dihilangkan, yaitu pati, hemiselulosa, dan lignin. Hidrolisis dilakukan untuk menghilangkan pati dan hemiselulosa, sedangkan delignifikasi menghilangkan hemiselulosa dan lignin. Lignin dapat menghambat reaksi kopolimerisasi pada tahap selanjutnya.
Metode hidrolisis pati terdiri atas 2 jenis, yaitu secara enzimatik dan dengan asam. Metode yang lebih tua dan tradisional adalah hidrolisis asam menggunakan asam mineral (pH 1–2), suhu tinggi (150–230 °C), dan tekanan tinggi (Kolusheva & Marinova 2007). Asam encer untuk hidrolisis pati juga diharapkan tidak bereaksi dengan selulosa. Asam sulfat juga dapat digunakan untuk menghidrolisis pati. Namun, asam sulfat dapat terurai menjadi ion HSO4- dan SO42- yang
reaktif dan dapat menyerang gugus hidroksil
‒OH selulosa.
Metode hidrolisis pati yang digunakan adalah hidrolisis-asam menggunakan HCl 3% dengan suhu 80 °C dan tekanan atmosfer. Suhu yang digunakan di bawah 100 °C bertujuan menghindari kerusakan bahan. Hidrolisis pati menggunakan asam encer (HCl 3%) dapat memutus ikatan glikosida pati. Namun, HCl 3% juga dapat menghidrolisis sebagian besar hemiselulosa menjadi gula dan menyerang sebagian selulosa (Achmadi 1990).
Rendemen hidrolisis pati yang mencapai 30% menunjukkan masih banyaknya pati yang terkandung dalam ela. Hal itu disebabkan industri pati sagu masih menggunakan teknologi ekstraksi yang sangat sederhana. Ela bebas pati memiliki warna lebih cokelat daripada ela awal (Gambar 1a dan 1b).
Gambar 1 Foto ela halus setelah disaring 60 mesh (a), ela bebas pati (b), dan selulosa hasil isolasi (c).
Delignifikasi menggunakan H2O2 5% pH
12 yang dikondisikan dengan NaOH 40%. Delignifikasi merupakan metode penghilangan lignin dengan mendegradasi dan melarutkannya melalui reaksi oksidatif (Achmadi 1990). Oksidator yang digunakan
adalah hidrogen peroksida yang lebih ramah lingkungan. Hidrogen peroksida bereaksi optimum dalam kondisi basa yang merupakan syarat utama proses delignifikasi.
Mekanisme reaksi delignifikasi menggunakan hidrogen peroksida melalui mekanisme radikal yang akan bereaksi dengan gugus eter lignin. Hidrogen peroksida terdisosiasi menjadi anion hidroperoksida pada pH 11.5, yang merupakan spesi aktif dalam delignifikasi (Fang et al. 2000). Doner & Hicks (1997) menyatakan, pada pH 11.6 anion hidroperoksida akan bereaksi lebih lanjut dengan hidrogen peroksida
menghasilkan radikal •OH dan •O2‾ yang juga
merupakan spesi aktif delignifikasi. Rendemen hemiselulosa hasil delignifikasi meningkat dengan menaikkan pH menjadi 12.5. Berikut adalah mekanisme reaksi pembentukan anion hidroperoksida serta
radikal •OH dan •O2‾.
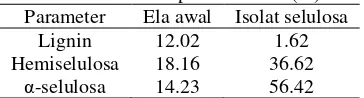
Tabel 1 menunjukkan kandungan hemiselulosa dan lignin yang masih cukup tinggi dalam isolat selulosa. Isolat selulosa berwarna keabu-abuan dan bertekstur bongkahan (Gambar 1c). Berbeda dengan selulosa murni yang berwarna putih dan memiliki tekstur serat.
Tabel 1 Analisis proksimat ela (%) Parameter Ela awal Isolat selulosa
Lignin 12.02 1.62 Hemiselulosa 18.16 36.62
α-selulosa 14.23 56.42
Lignin dan karbohidrat berikatan melalui ikatan kovalen (Achmadi 1990). Ikatan tersebut terbentuk antara lignin dan komponen hemiselulosa (unit arabinosa, xilosa, dan galaktosa). Hidrolisis menggunakan HCl 3% tidak cukup menghidrolisis hemiselulosa. Proses pulping atau pemanasan dalam larutan NaOH diperlukan untuk menghilangkan hemiselulosa dan lignin. Larutan NaOH berair lazim digunakan untuk memekarkan selulosa dan mengurangi gaya antarmolekul. Pemekaran disebabkan oleh kemampuan larutan basa mengurangi ikatan hidrogen dalam molekul selulosa yang mengakibatkan hemiselulosa larut dan melemahkan ikatan lignoselulosa. Pemekaran selulosa juga dapat membantu menghilangkan lignin dan hemiselulosa saat proses delignifikasi.
6
hingga mendapatkan selulosa hanya sekitar 10% dengan bentuk bongkahan. Karena selulosa yang digunakan untuk tahap sintesis fase diam harus berukuran 100 mesh, sehingga isolat dihaluskan dengan penggiling. Penghalusan tersebut hanya menghasilkan 40% partikel berukuran 100 mesh. Jadi, rendemen isolasi hingga mendapat isolat selulosa berukuran 100 mesh hanya sekitar 4%. Hal tersebut menunjukkan kurang efisiennya tahap isolasi selulosa ela halus.
Fase Diam Selulosa-g-Poliakrilamida
Sintesis Fase Diam
Selulosa yang diisolasi dari ampas sagu dimodifikasi dengan teknik kopolimerisasi cangkok dan taut-silang menggunakan akrilamida sebagai monomer dan MBA sebagai penaut-silang. Kopolimerisasi cangkok merupakan salah satu teknik modifikasi polimer dengan menggabungkan polimer sebagai kerangka utama dengan monomer lain melalui ikatan kovalen serta bersifat tidak dapat balik. Selain itu, modifikasi juga dilakukan dengan tautan-silang yang menghubungkan polimer melalui ikatan kimia intra- dan antarmolekul (Bhattacharya et al. 2009).
Metode sintesis kopolimer cangkok terdiri atas 2 jenis, yakni ‘mencangkok untuk’ dan
‘mencangkok dari’. Mekanisme mencangkok untuk ialah dengan memfungsionalisasi monomer, lalu bereaksi dengan polimer kerangka utama membentuk kopolimer cangkok, sedangkan mencangkok dari berlangsung dengan cara monomer bereaksi dengan polimer kerangka utama yang telah terinisiasi membentuk kopolimer cangkok (Bhattacharya et al. 2009).
Mekanisme kopolimerisasi cangkok dalam penelitian ini adalah mencangkok dari berdasarkan metode yang digunakan. Penambahan APS ke dalam selulosa akan menginisiasi terbentuknya radikal bebas pada kerangka utama selulosa. Radikal bebas tersebut mempropagasi monomer yang masuk sehingga kopolimerisasi cangkok terjadi. Bhattacharya et al. (2009) menyatakan bahwa mekanisme mencangkok dari dapat menghasilkan polimer dengan densitas tinggi. Isolat selulosa yang digunakan berukuran 100 mesh dengan tujuan meningkatkan luas permukaan partikel sehingga tapak aktif selulosa meningkat.
Mekanisme reaksi kopolimerisasi cangkok dan taut-silang terbagi dalam 3 tahap, yaitu
inisiasi, propagasi, dan terminasi (Lampiran 3). Tahap inisiasi diawali dengan terbentuknya radikal ‾O3SO• yang akan
menyerang atom H pada gugus ‒OH atom karbon-6 (C6) selulosa. Achmadi (1990) menyatakan bahwa gugus ‒OH atom C6 memiliki reaktivitas yang lebih tinggi terhadap substituen yang meruah dibandingkan dengan gugus OH lainnya. Inisiator persulfat terdekomposisi menjadi ion radikal persulfat dalam kondisi pemanasan suhu 60 °C (da Silva et al. 2007).
Tahap propagasi merupakan pembentukan
rantai samping kopolimer cangkok. Gugus O• menyerang gugus alkena (C═C) pada
monomer akrilamida sehingga ikatan rangkap terputus dan menghasilkan radikal baru, C•.
Gugus C• menyerang monomer akrilamida lain dan membentuk C• baru, reaksi tersebut
berkelanjutan hingga membentuk rantai panjang poliakrilamida. Selain itu, C• juga dapat menyerang C═C pada MBA sehingga tautan-silang terjadi pada kopolimer cangkok. Tautan-silang juga dapat terjadi pada tahap terminasi dengan bereaksinya 2 rantai selulosa yang telah tercangkok dengan MBA.
Reaksi kopolimerisasi dilakukan dalam kondisi dialiri gas nitrogen. Gas nitrogen berfungsi menghilangkan gas oksigen dalam sistem dan meminimumkan terbentuknya radikal peroksida yang menghambat reaksi kopolimerisasi serta menghindari terbentuknya homopolimer (Kurniadi 2010).
Produk hasil kopolimerisasi dipresipitasi dengan metanol dan etanol untuk menghilangkan air (Lanthong et al. 2006) serta direfluks dengan aseton untuk menghilangkan homopolimer poliakrilamida yang mungkin terbentuk (Al-Karawi et al.
2011). Selain menghilangkan air, etanol juga dapat menghilangkan sebagian homopolimer. Produk yang dihasilkan dikeringkan dalam oven dengan suhu 60 °C. Produk kering yang berbentuk bongkahan kemudian dihaluskan dengan mesin penggiling agar didapatkan produk yang halus berukuran 60–100 mesh (disebut fase diam).
Pencirian Fase Diam
Fase diam hasil sintesis dicirikan menggunakan parameter kadar nitrogen dan kapasitas absorpsi air. Banyaknya gugus
amida (O═C‒NH) yang tercangkok pada
Masing-7
masing fase diam mengandung jumlah akrilamida yang sama, tetapi jumlah penaut-silang berbeda sehingga akan memiliki kadar nitrogen yang berbeda. Hal tersebut disebabkan penaut-silang MBA juga memiliki 2 gugus amida pada strukturnya yang akan meningkatkan kandungan nitrogen fase diam (Gambar 2). Sampel CL 0.1, CL 0.5, dan CL 1 merupakan fase diam yang disintesis dengan meragamkan jumlah penaut-silangnya, yaitu 0.1, 0.5, dan 1 g. Tabel 2 memperlihatkan bahwa semakin banyak kandungan penaut-silang, semakin tinggi pula kadar nitrogen fase diam.
(a) (b)
Gambar 2 Struktur akrilamida (a) dan N,N’ -metilenabisakrilamida (b).
Tabel 2 Kadar nitrogen dan kapasitas absorpsi air fase diam
Fase diam Kadar N (%) WA (% b/b) CL 0.1 8.45 35.40 CL 0.5 9.75 18.83 CL 1 10.79 18.42
Struktur molekul fase diam yang terbentuk akibat penautan-silang sangat memengaruhi kemampuan absorpsi air. Penaut-silang yang menghubungkan kopolimer selulosa satu dengan yang lain akan membentuk ruang tiga dimensi. Jumlah penaut-silang yang semakin banyak akan membentuk struktur molekul fase diam yang semakin rapat sehingga molekul air sulit untuk masuk dan absorpsi air (WA) pun menurun (Tabel 2). Perhitungan kadar nitrogen dan daya absorpsi air ditunjukkan di Lampiran 4.
Analisis FTIR
Analisis FTIR pada selulosa hasil isolasi dan fase diam (Lampiran 5) dilakukan untuk mengidentifikasi gugus fungsi pada masing-masing sampel. Spektrum FTIR isolat selulosa menunjukkan adanya ulur ‒OH dan C‒H pada bilangan gelombang 3240 dan 2893 cm-1. Daerah di bawah 1500 cm-1 merupakan daerah sidik jari selulosa (Sun et al. 2005). Puncak 1415 dan 1369 cm-1 menunjukkan ikatan CH2
dan O‒H. Serapan pada 1γ15 cm-1
menunjukkan vibrasi kerangka C‒C dan C‒O.
Vibrasi ikatan -1,4-glukopiranosa C‒O‒C
dan C‒O terlihat pada puncak 10ββ dan 115γ
cm-1. Ikatan lignin yang terlihat pada serapan
1516 dan 1450 cm-1 menunjukkan masih adanya kandungan lignin dalam isolat selulosa (Fang et al. 2000).
Spektrum selulosa-g-poliakrilamida memiliki daerah sidik jari yang sama seperti spektrum selulosa. Perbedaan terletak pada munculnya serapan pada bilangan gelombang 3550, 1660, dan 1610 cm-1 yang menunjukkan berturut-turut ulur N‒H, ulur C═O, dan ikatan
N‒H gugus amida. Puncak 1410 cm-1 menggambarkan uluran ‒C‒N. Puncak -puncak tersebut khas untuk serapan amida tercangkok (Nakason et al. 2010; Lanthong et al. 2006).
Berdasarkan pola serapan selulosa dan selulosa-g-poliakrilamida, kopolimerisasi cangkok dan taut-silang akrilamida pada selulosa terbukti berhasil. Serapan ulur N‒H dan ulur O‒H terlihat saling bertumpang tindih (Lampiran 5). Namun, kedua serapan tersebut masih dapat dibedakan dengan terbentuknya cekungan pada daerah bilangan gelombang 3350–3450 cm-1. Perbedaan jumlah penaut-silang dalam fase diam sangat berpengaruh terhadap pola serapan FTIR. Fase diam dengan jumlah penaut-silang lebih banyak memiliki kadar nitrogen yang tinggi sehingga nilai transmitans yang terukur lebih kecil.
Aplikasi Kromatografi Kolom Uji Daya Tahan Pelarut
Kromatografi kolom merupakan teknik pemisahan campuran berdasarkan distribusi di antara fase gerak dan fase diam. Salah satu syarat pelarut agar dapat digunakan sebagai fase gerak (eluen) kromatografi kolom adalah tidak melarutkan fase diam dan bereaksi dengan eluat. Indeks bias merupakan salah satu parameter analisis kemurnian larutan yang peka terhadap interaksi pelarut dengan zat lain. Pelarut yang melarutkan atau berinteraksi dengan fase diam akan berpengaruh cukup signifikan terhadap perubahan indeks bias.
Tabel 3 memperlihatkan perubahan indeks bias 6 pelarut yang telah 3 hari merendam fase diam. Pelarut toluena, aseton, dan etanol tidak digunakan sebagai eluen karena perubahan indeks bias sebelum dan setelah maserasi lebih besar dari 5×10-4. Perbedaan tersebut memperlihatkan adanya interaksi antara pelarut dan fase diam. Lampiran 6 menunjukkan data indeks bias pelarut.
8
fase diam atau selisih indeks biasnya 0. Pelarut yang digunakan sebagai eluen adalah heksana, etil asetat, dan metanol karena perbedaan indeks biasnya kurang dari 3×10-4. Fase diam CL 0.5 dianggap sebagai fase diam terbaik karena perubahan indeks bias untuk pelarut heksana, etil asetat, dan metanol paling kecil.
Tabel 3 Selisih indeks bias pelarut (×10-4) Pelarut CL 0.1 CL 0.5 CL 1 Toluena 8 7 7 Heksana 2 1 3 Etil asetat 2 2 1 Aseton 7 11 6 Metanol 3 0 1 Etanol 10 12 15
Kromatografi Kolom
Selulosa-g-poliakrilamida hasil sintesis diaplikasikan sebagai fase diam kromatografi kolom untuk memisahkan komponen xantorizol dari ekstrak kasar temu lawak. Xantorizol merupakan salah satu senyawa aktif yang terdapat dalam temu lawak selain golongan kurkuminoid (Hwang et al. 2000). Ekstrak kasar temu lawak diperoleh dengan mengekstraksi serbuk kering temu lawak menggunakan etanol dengan nisbah 1:4. Etanol dapat mengekstraksi dengan baik seluruh komponen xantorizol dan kurkuminoid.
Kromatografi diklasifikasikan ke dalam 4 tipe berdasarkan mekanisme retensinya, yaitu partisi, adsorpsi, eksklusi, dan pertukaran ion. Kromatografi adsorpsi didasarkan pada kemampuan fase diam mengadsorpsi eluat. Modifikasi selulosa dengan cara kopolimerisasi cangkok dan taut-silang meningkatkan kepolaran karena banyak gugus
‒NH yang tercangkok pada kerangka utama selulosa. Hal tersebut sangat memengaruhi kemampuan selulosa-g-poliakrilamida sebagai fase diam kromatografi kolom. Gugus ‒NH diharapkan mampu mengadsorpsi molekul analit yang bersifat lebih polar.
Ketiga fase diam terkemas sangat baik ke dalam kolom. Namun, pengemasan perlu dilakukan dengan hati-hati agar fase diam tidak menempel pada dinding atas kolom. Fase diam yang menempel pada dinding atas kolom dapat mongering dan menggumpal karena mengabsorpsi uap air. Penyaringan fase diam juga perlu dilakukan untuk menyeragamkan ukuran partikel. Ukuran partikel yang digunakan adalah 60–80 mesh.
Elusi dilakukan dengan gradien eluen dari kepolaran rendah hingga tinggi. Gradien eluen digunakan bila pemisahan yang baik sulit dilakukan akibat sifat campuran yang sangat bervariasi (Adnan 1997). Eluen yang digunakan ada 7, yaitu heksana, campuran heksana dan etil asetat dengan nisbah (10:1), (9:1), (3:1), (1:1), (1:3), serta metanol. Heksana yang bersifat nonpolar akan membawa komponen yang bersifat nonpolar keluar lebih dulu dari kolom. Metanol digunakan untuk membersihkan fase diam dari sisa ekstrak. Hal tersebut dibuktikan dengan warna kuning ekstrak temu lawak menghilang saat kolom dielusi menggunakan metanol.
Pemisahan ekstrak kasar temu lawak dilakukan secara kromatografi fase normal, yaitu teknik kromatografi menggunakan fase diam polar dengan fase gerak nonpolar. Teknik ini paling umum digunakan karena gel silika bersifat polar dan paling banyak digunakan sebagai media pemisahan. Pemisahan terjadi dengan mengelusi komponen-komponen ekstrak temu lawak yang bersifat nonpolar terlebih dahulu baru kemudian komponen-komponen polar. Hal tersebut terjadi karena adanya interaksi antara komponen polar dengan fase diam yang membuat komponen polar tertahan lebih lama dalam kolom. Komponen nonpolar keluar lebih dahulu karena tidak terjadi interaksi dengan fase diam.
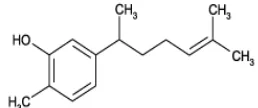
Xantorizol memiliki kepolaran yang lebih rendah daripada kurkuminoid berdasarkan strukturnya (Gambar 3). Oleh karena itu, xantorizol didapat pada fraksi pertama (eluen heksana). Hal tersebut dibuktikan oleh kromatogram KLT yang dilihat pada panjang gelombang ( ) β54 nm (Gambar 4). Xantorizol merupakan minyak atsiri temu lawak yang termasuk ke dalam golongan seskuiterpena yang tidak berwarna. Sifat tersebut membuatnya tidak dapat dideteksi pada daerah tampak, tetapi di daerah UV. Hal tersebut dibuktikan dengan perhitungan maks
xantorizol. Xantorizol memiliki maks sekitar
220 nm yang berada dalam daerah UV dekat (200–380 nm) (Creswell et al. 2005).
9
Fraksi pertama masing-masing eluen, standar xantorizol, dan ekstrak kasar temu lawak diaplikasikan pada KLT untuk mendeteksi secara kualitatif keberadaan xantorizol. Eluen yang digunakan untuk mengelusi KLT adalah heksana:etil asetat (10:1) (Asriani 2010). Gambar 4 memperlihatkan keberadaan xantorizol hanya pada fraksi 1 dengan eluen heksana. Nilai Rf
standar xantorizol, fraksi 1 eluen heksana fase diam CL 0.1, 0.5, dan 1 berturut-turut adalah 0.23, 0.24, 0.21, dan 0.21 (Lampiran 7).
Gambar 4 Foto kromatogram KLT di bawah
β54 nm. Spot standar xantorizol (a), fraksi 1 heksana fase diam CL 0.1 g (b), 0.5 g (c), 1 g (d), standar xantorizol (e), dan ekstrak kasar temu lawak (f).
Xantorizol yang terdeteksi dengan KLT kemudian dianalisis lebih lanjut dengan KCKT untuk menentukan konsentrasi xantorizol yang dipisahkan. Penentuan konsentrasi xantorizol dilakukan dengan membandingkan area kromatogram KCKT fraksi-fraksi hasil elusi dengan standar xantorizol. Konsentrasi xantorizol yang dipisahkan dengan fase diam CL 0.1, CL 0.5 dan CL 1 berturut turut adalah 3247, 2357, dan 2448 ppm (Lampiran 8). Ekstrak kasar temu lawak mengandung 3056 ppm xantorizol.
Kebaikan fase diam dalam memisahkan xantorizol dapat dilihat dari resolusi dan persen area puncaknya. Resolusi menyatakan kebaikan pemisahan melalui jarak antara 2 puncak, sedangkan persen area melalui kandungan pengotor dalam fraksi. Pemisahan dianggap baik jika nilai resolusi di atas 1.5 (Gritter et al. 1991). Semakin tinggi nilai persen area menunjukkan semakin sedikit pengotor yang ada dalam fraksi. Resolusi fraksi 1 heksana dengan fase diam CL 0.1, 0.5, dan 1 berturut-turut adalah 1.286, 1.467, dan 1.409, sedangkan persen area adalah 24.75, 34.08, dan 31.70% (Lampiran 9). Ekstrak kasar temu lawak memiliki resolusi dan persen area berturut-turut 0.790 dan
19.65%. Ketiga fase diam berhasil memisahkan xantorizol dari temu lawak. Hal tersebut dibuktikan dengan meningkatnya resolusi dan persen area xantorizol.
Berdasarkan data resolusi dan persen area, CL 0.5 adalah fase diam terbaik karena resolusi dan persen area xantorizol paling tinggi di antara fase diam lainnya. Resolusi fraksi heksana fase diam CL 0.5 yang paling mendekati 1.5 menunjukkan pemisahan telah terjadi dengan baik. Selain itu, data uji daya tahan pelarut juga mendukung pemilihan CL 0.5 sebagai fase diam terbaik karena perubahan indeks bias pelarutnya paling kecil.
SIMPULAN DAN SARAN
Simpulan
Kopolimerisasi cangkok dan taut-silang berhasil digunakan untuk memodifikasi selulosa ampas sagu menjadi fase diam kromatografi kolom. Isolasi selulosa ampas sagu melalui tahap hidrolisis pati dan delignifikasi menghasilkan selulosa yang kurang baik karena masih mengandung hemiselulosa sebanyak 36.62%. Hasil analisis kadar nitrogen Kjeldahl dan gugus fungsi dengan FTIR menunjukkan keberhasilan proses sintesis. Selulosa-g-poliakrilamida dapat diaplikasikan sebagai fase diam kromatografi kolom dan berhasil memisahkan komponen xantorizol dalam ekstrak kasar temu lawak. Pemisahan fase diam dengan penaut-silang 0.5 g paling baik dengan konsentrasi xantorizol yang diisolasi sebesar 2357 ppm serta resolusi 1.467 dan persen area 34.08%.
Saran
Tahap pulping perlu dilakukan untuk mendapatkan selulosa yang lebih baik. Pengambilan fraksi perlu dilakukan lebih kuantitatif untuk mendapatkan xantorizol yang lebih murni. Aplikasi lain juga perlu dilakukan untuk menguji kebaikan selulosa-g -poliakrilamida sebagai fase diam, dimulai dengan isolasi kelompok kurkuminoid.
DAFTAR PUSTAKA
Achmadi SS. 1990. Kimia Kayu. Bogor: IPB Pr.
10
Al-Karawi AJM, Al-Qaisi ZHJ, Abdullah HI, Al-Mokaram AMA, Al-Heetimi DTA. 2011. Synthesis, characterization of acrylamide grafted chitosan and its use in removal of copper(II) ions from water.
Carbohydr Polym 83:495-500.
Asriani D. 2010. Isolasi xantorizol dari temu lawak terpilih berdasarkan nomor harapan [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Bhattacharya A, Rawlins JW, Ray P. 2009.
Polymer Grafting and Crosslinking. New Jersey: J Wiley.
Biçak N, Sherrington DC, Senkal BF. 1999. Graft copolymer of acrylamide onto cellulose as mercury selective sorbent.
Reactive & Functional Polym 41:69-76.
Bustaman S. 2008. Potensi ulat sagu dan prospek pemanfaatannya. J Litbang Pertanian 27:50-54.
Cahyani RD. 2010. Asetilasi selulosa ampas sagu dan aplikasinya sebagai fase diam kromatografi kolom [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Creswell CJ, Runquist OA, Campbell MM. 2005. Analisis Spektrum Senyawa Organik. Padmawinata K, penerjemah. Bandung: Penerbit ITB. Terjemahan dari:
Spectrum Analysis of Organic Compound. An Introductory Programmed Text.
da Silva DA, de Paula RCM, Feitosa JPA. 2007. Graft copolymerization of acrylamide onto cashew gum. Eur Polym J
34:2620-2629.
Doner LW, Hicks KB. 1997. Isolation of hemicellulose from corn fiber by alkaline hydrogen peroxide extraction. Cereal Chem 74:176-181.
Fang JM, Sun RC, Tomkinson J. 2000. Isolation and characterization of hemicelluloses and cellulose from rye straw by alkaline peroxide extraction.
Cellulose 7:87-107.
Gritter RJ, Bobbitt JM, Schwarting AE. 1991.
Pengantar Kromatografi. Padmawinata K, penerjemah. Bandung: Penerbit ITB.
Terjemahan dari: Introduction to Chromatography.
Hwang JK, Shim JS, Pyun YR. 2000. Antibacterial activity of xanthorrhizol from Curcuma xanthorriza against oral pathogens. Fitoterapia 71:321-323.
Irfana L. 2010. Asetilasi selulosa ampas sagu dengan katalis I2 dan aplikasinya sebagai
fase diam kromatografi kolom [skripsi] Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Kiat LJ. 2006. Preparation and characterization of carboxymethyl sago
waste and it’s hydrogel [tesis]. Malaysiaμ
Master of Science, Universiti Putra Malaysia.
Kolusheva T, Marinova A. 2007. A study of the optimal conditions for starch
hydrolysis through thermostable α
-amylase. J Univ Chem Technol Mettalurgy
42:93-96.
Kowalska T, Sherma J. 2007. Thin Layer Chromatography in Chiral Separation and Analysis. Boca Raton: CRC Pr.
Kumaran S, Sastry CA, Vikineswary S. 1997. Laccase, cellulase, and xylanase activities during growth of Pleurotus sajor-caju on sago hampas. World J Microbiol Biotechnol 13:43-49.
Kurniadi T. 2010. Kopolimerisasi grafting
monomer asam akrilat pada onggok singkong dan karakterisasinya [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Lanthong P, Nuisin R, Kiatkamjornwong S. 2006. Graft copolymerization, characterization, and degradation of cassava starch-g-acrylamide/itaconic acid superabsorbents. Carbohydr Polym
66:229-245.
Liang R, Yuan H, Xi G, Zhou Q. 2009. Synthesis of wheat straw-g-poly(acrylic acid) superabsorbent composites and release of urea from it. Carbohydr Polym
77:181-187.
11
acid)/sodium humate superabsorbent.
Carbohydr Polym 70:166-173.
Nakason C, Wohmang T, Kaesaman A, Kiatkamjornwong S. 2010. Preparation of cassava-graft-polyacrylamide super-absorbents and associated composites by reactive blending. Carbohydr Polym
81:348-357.
Papilaya EC. 2009. Sagu untuk Pendidikan Anak Negeri. Bogor: IPB Pr.
Santi. 2006. Onggok sagu termodifikasi sebagai fase diam dalam kromatografi kolom [skripsi]. Bogor: Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sun JX, Xu F, Sun XF, Xiao B, Sun RC. 2005. Physico-chemical and thermal characterization of cellulose from barley straw. Polym Degradation and Stability
88:521-531.
13
Lampiran 1 Diagram alir penelitian
Ta
ha
p isol
asi s
elul
osa
Ta
ha
p si
ntesis
Ta
ha
p a
pli
ka
si kromatog
ra
fi
Uji daya tahan
pelarut
(refraktometer)
Ampas sagu
Preparasi
Fase diam
terbaik
KLT
(pelat gel silika)
Analisis dengan
KCKT
Aplikasi
kromatografi kolom
(ekstrak temu lawak)
Fraksi-fraksi dari
berbagai kolom
Pengujian kadar
nitrogen (metode
Kjeldahl) dan
absorpsi air
Pencirian
dengan FTIR
Hidrolisis pati
Kopolimerisasi
cangkok dan taut-silang
Pengujian kadar
lignin, α
-selulosa,
dan hemiselulosa
Delignifikasi
Polimer
14
Lampiran 2 Reaktor kopolimerisasi cangkok dan taut-silang
Keterangan:
a.
motor pengaduk
b.
mantel pemanas
c.
labu leher tiga
d.
corong tambah cairan
e.
termometer 100 °C
f.
selang masuk gas nitrogen.
a
b
c
d
e
15
Lampiran 3 Hipotesis mekanisme reaksi kopolimerisasi cangkok dan taut-silang
selulosa dengan akrilamida
Tahap inisiasi
O S O
O
O
O S O
O O
NH4+
NH4
+
O S O
O
O
NH4+
2
Amonium peroksidisulfat
O S O
O
O NH4+
O H OH H O CH2 H OH H O OH O OH H O CH2 H OH H O O
O S OH
O O NH4 + Selulosa
Tahap propagasi
O OH H O CH2 H OH H O O CH NH2 O H2CO OH H O CH2 H OH H O O HC NH2 O H2C
Akrilamida O OH H O CH2 H OH H O O CH NH2 O H2C
HC NH2 O CH2 CH NH2 O
H2C
O OH H O CH2 H OH H O O HC NH2 O CH2 O OH H O CH2 H OH H O O CH NH2 O H2C
HC NH2
O CH2
CH
NH2
O H2C
n O OH H O CH2 H OH H O O CH NH2 O CH2 CH NH2 O CH2 HC NH2 O
16
lanjutan Lampiran 3
Tahap terminasi
O H OH H O CH2 H OH H O O H H OH H OH CH2 H H O O H OH H CH2 H OH H H O O H H OH O H OH CH2 H O O O O O H OH H O CH2 H OH H O O H H OH H OH CH2 H H O O H OH H CH2 H OH H H O O H H OH O H OH CH2 H O O O O CH H2NO CH2
CH H2N
O CH2
CH H2N
O CH2
n
CH H2N
O CH2
CH H2N
O CH2
CH H2N
O CH2
n CH NH2 O CH2 CH NH2 O CH2 HC NH2 O CH2 n
CH NH2 O CH2 CH NH2 O CH2 HC NH2 O CH2 n
C H C N H O H2C
H2 C N H C C H O CH2 N,N'-Metilena-bis-akrilamida O H OH H OH CH2 H OH H O O H H OH H OH CH2 H H O O H OH H CH2 H OH H H O O H H OH H OH CH2 H O O O O CH H2N
O CH2
10
CH H2N
O H2C
10 CH2 CH2 CH2 CH2 O H HO H CH2 H OH H O O H H OH H OH CH2 H H O O H HO H CH2 H OH H H O O H H OH OH H OH CH2 H O O O O HC NH2 O CH2 10 CH NH2 O CH2 10
H2C
C HN O CH2 HN C H2C
O
H2C
C HN O CH2 HN C H2C
O O O H OH H CH2 H OH H H O O H H OH OH H OH CH2 H O O CH H2N
O H2C
10 CH2 CH2 O H HO H OH CH2 H OH H O O H H OH H OH CH2 H H O O O HC NH2 O CH2 10
H2C
C HN O CH2 HN C H2C
O
H H
H H
17
Lampiran 4 Hasil pengukuran kadar nitrogen dan daya absorpsi air
Komposisi sintesis fase diam
Fase
diam
Selulosa
ela (g)
Akrilamida
(g)
APS
(g)
MBA
(g)
Nitrogen
(%)
WA
(%)
CL 0.1
15.0012
15.0005
0.2503 0.1005
8.45
35.40
CL 0.5
15.0009
15.0009
0.2505 0.5008
9.75
18.83
CL 1
15.0009
15.0001
0.2508 1.0005
10.79
18.42
Keterangan: WA (absorpsi air)
Kadar nitrogen
Fase
diam
Bobot
sampel (g)
Volume (mL)
Kadar
N (%)
Awal
Akhir
Terpakai
CL 0.1
0.1014
20.00
26.00
6.00
8.45
CL 0.5
0.1004
12.00
18.85
6.85
9.75
CL 1
0.1026
20.00
27.75
7.75
10.79
Contoh perhitungan:
Absorpsi air
Sampel
W
0(g)
W
1(g)
WA
18
Lampiran 5 Spektrum FTIR isolat selulosa dan fase diam
19
Lampiran 6 Indeks bias pelarut
Pelarut
Blangko
CL 0.1
CL 0.5
CL 1
Terukur Rerata Terukur Rerata Terukur Rerata Terukur Rerata
Toluena
1.4926
1.4931
1.4938
1.4939
1.4936
1.4938
1.4939
1.4938
1.4934
1.4942
1.4939
1.4938
1.4934
1.4936
1.4939
1.4936
Heksana
1.3782
1.3781
1.3782
1.3783
1.3782
1.3782
1.3781
1.3784
1.3779
1.3783
1.3779
1.3784
1.3781
1.3784
1.3786
1.3786
Etil
Asetat
1.3706
1.3707
1.3709
1.3709
1.3706
1.3709
1.3706
1.3706
1.3709
1.3707
1.3709
1.3707
1.3706
1.3711
1.3711
1.3704
Aseton
1.3576
1.3577
1.3586
1.3584
1.3589
1.3588
1.3581
1.3583
1.3578
1.3581
1.3586
1.3584
1.3578
1.3586
1.3588
1.3584
Metanol
1.3276
1.3276
1.3279
1.3279
1.3274
1.3276
1.3276
1.3277
1.3276
1.3279
1.3278
1.3277
1.3276
1.3278
1.3276
1.3279
Etanol
1.3592
1.3594
1.3604
1.3604
1.3606
1.3606
1.3609
1.3609
1.3594
1.3603
1.3606
1.3609
20
Lampiran 7 Kromatogram KLT dan data
R
ffraksi kromatografi kolom
Data
R
f noda kromatogram KLT dengan eluen heksana:etil asetat (10:1)β54 nm
Bercak
Eluat
R
f1R
f2R
f31
Standar xantorizol
0.23
-
-
2
Fraksi heksana CL 0.1
0.18
0.24
0.38
3
Fraksi heksana:etil asetat (10:1) CL 0.1
-
-
-
4
Fraksi heksana:etil asetat (9:1) CL 0.1
-
-
-
5
Fraksi heksana:etil asetat (3:1) CL 0.1
-
-
-
6
Fraksi heksana:etil asetat (1:1) CL 0.1
-
-
-
7
Fraksi heksana:etil asetat (1:3) CL 0.1
-
-
-
8
Fraksi metanol CL 0.1
9
Fraksi heksana CL 0.5
0.15
0.21
0.31
10
Fraksi heksana:etil asetat (10:1) CL 0.5
-
-
-
11
Fraksi heksana:etil asetat (9:1) CL 0.5
-
-
-
12
Fraksi heksana:etil asetat (3:1) CL 0.5
-
-
-
13
Fraksi heksana:etil asetat (1:1) CL 0.5
-
-
-
14
Fraksi heksana:etil asetat (1:3) CL 0.5
-
-
-
15
Fraksi metanol CL 0.5
-
-
-
16
Fraksi heksana CL 1
0.15
0.21
0.32
17
Fraksi heksana:etil asetat (10:1) CL 1
-
-
-
18
Fraksi heksana:etil asetat (9:1) CL 1
-
-
-
19
Fraksi heksana:etil asetat (3:1) CL 1
-
-
-
20
Fraksi heksana:etil asetat (1:1) CL 1
-
-
-
21
Fraksi heksana:etil asetat (1:3) CL 1
-
-
-
22
Fraksi metanol CL 1
-
-
-
23
Standar xantorizol
0.23
-
-
21
Lampiran 8 Kromatogram KCKT standar xantorizol dan perhitungan konsentrasi
xantorizol hasil elusi
Puncak
Waktu retensi
(min)
Area
Puncak
awal
Puncak
akhir
Resolusi
1
2.309
3795147
2.033
2.633
2
4.141
34165238
3.842
6.067
5.762
Konsentrasi xantorizol hasil fraksionasi
Xantorizol
Area
Konsentrasi (ppm)
Standar
34165238
2900
Ekstrak kasar
36009860
3056
Fraksi CL 0,1
38254103
3247
Fraksi CL 0,5
27775357
2357
Fraksi CL 1
28842063
2448
Contoh perhitungan:
Konsentrasi standar xantorizol yang digunakan 0.29%
22
Lampiran 9 Kromatogram KCKT
Kromatogram KCKT ekstrak kasar temu lawak
Puncak
Waktu retensi
(min)
Area
Persen
area
Puncak
awal
Puncak
akhir
Resolusi
1
1.036
4171008
2.28
0.833
1.183
2
1.406
7041001
3.84
1.183
1.542
1.036
3
1.612
3167237
1.73
1.542
1.758
0.335
4
1.983
6573040
3.59
1.758
2.050
0.432
5
2.099
5908352
3.22
2.050
2.383
0.138
6
2.796
9611061
5.24
2.383
3.008
0.831
7
3.279
4352375
2.37
3.142
3.483
0.494
8
3.573
2691880
1.47
3.483
3.733
0.276
9
4.023
7100059
3.87
3.733
4.133
0.541
10
4.378
36009860
19.65
4.133
4.558
0.790
11
4.766
64962820
35.44
4.558
8.750
1.005
12
7.888
2598440
1.42
7.617
8.075
7.525
13
8.230
2160386
1.18
8.075
8.750
0.769
14
9.217
20062875
10.95
8.750
9.858
2.118
15
10.176
2026165
1.11
9.858
10.708
1.733
16
11.382
2698087
1.47
11.050
12.033
2.017
23
lanjutan Lampiran 9
Kromatogram KCKT fraksi 1 heksana fase diam CL 0.1
Puncak
Waktu retensi
(min)
Area
Persen
area
Puncak
Awal
Puncak
Akhir
Resolusi
1
1.530
2550175
1.65
1.083
1.717
2
1.950
3079510
1.99
1.717
2.067
0.878
3
2.341
2547776
1.65
2.225
2.425
1.183
4
2.463
2348142
1.52
2.425
2.683
0.209
5
2.960
14465026
9.36
2.683
3.125
0.940
6
3.820
14691773
9.50
3.658
4.017
3.640
7
4.221
38254103
24.75
4.017
5.817
1.286
8
6.096
8619559
5.58
5.817
6.692
5.294
9
9.685
37709153
24.39
8.908
10.533
8.441
10
10.922
6677575
4.32
10.533
11.950
2.271
11
13.029
6670741
4.32
12.608
13.383
3.387
24
lanjutan Lampiran 9
Kromatogram KCKT fraksi 1 heksana fase diam CL 0.5
Puncak
Waktu retensi
(min)
Area
Persen
area
Puncak
awal
Puncak
akhir
Resolusi
1
1.498
1314683
1.61
1.158
1.725
2
1.962
1550191
1.90
1.725
2.083
0.812
3
2.357
1306223
1.60
2.233
2.442
1.103
4
2.970
7129770
8.75
2.708
3.258
1.991
5
3.344
869929
1.07
3.258
3.433
1.001
6
3.828
6721290
8.25
3.675
4.033
1.277
7
4.235
27775357
34.08
4.033
5.825
1.467
8
6.102
3199261
3.93
5.825
6.675
5.825
9
9.675
21192786
26.01
8.900
10.533
8.730
10
10.917
1931501
2.37
10.533
11.483
2.322
11
13.021
2631468
3.23
12.592
13.358
3.370
25
lanjutan Lampiran 9
Kromatogram KCKT fraksi 1 heksana fase diam CL 1
Puncak
Waktu retensi
(min)
Area
Persen
area
Puncak
awal
Puncak
akhir
Resolusi
1
1.516
1301838
1.43
1.150
1.692
2
1.922
1650542
1.81
1.692
2.042
0.862
3
2.295
1404073
1.54
2.175
2.375
1.120
4
2.883
7581426
8.33
2.625
3.050
2.045
5
3.385
973057
1.07
3.342
3.550
0.504
6
3.699
7726157
8.49
3.550
3.892
0.313
7
4.086
28842063
31.70
3.892
5.600
1.409
8
5.861
4204996
4.62
5.600
6.408
5.653
9
9.269
21003143
23.08
8.533
10.025
8.738
10
10.393
2946059
3.24
10.025
10.992
2.217
11
12.430
3334611
3.67
12.025
12.733
3.433
12
13.158
9039270
9.94
12.733
13.900
1.091