DAFTAR PUSTAKA
Alfred Thomas 2002. Fats and Fatty Oils. Ullmann's Encyclopedia of Industrial Chemistry. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH.
Anastas, P.A., Warner, J.C., 1998. Green Chemistry: Theory and Practice. Oxford University Press, Oxford.
Bangun, N., Manullang, W., Panggabean, L., Sembiring, S. B., Simangunsong, R., Bali, P., Panjaitan, F., 2015. Performance of Tetraphenylsulfonato Disilane in Catalytic Transesterification of Crude Palm Oil and Esterification of Fatty Acids with Secondary Alcohols. Procedia Chemistry, 14 : 295 – 300 Berrios, M., Siles, J., Martin, M.A., 2007. A Kinetic Study of the Esterification of
Free Fatty Acids (FFA) in Sunflower Oil. Fuel, 86 : 2383 – 2388
Carey, F,A. 2000. Organic Chemistry. Edisi Keempat. United States of America. Library of Congress Cataloging Publication Data
Chen, M.L. 2004. Synthesis of the Structured Lipid 1,3-Dioleoyl-2-palmitoylglycerol from Palm Oil. JAOCS, 81 : 1-6
Chorkendroff, I dan Niemantsverdiet, J.W., 2003. Concept of Modern Catalysis and Kinetics, Weinheim : Willey – VCH GmbH & Co
Chow, C.K., 2008. Fatty Acids in Foods and Their Implications. 3rd Ed. Boca Raton. CRC Press.
Clark, J.H., 2002. Solid Acids for Green Chemistry.Accounts of Chemical Research. 35: 791-797
Corma, A., 1997. From Microporous to Mesoporous Molecular Sieve Materials and Their Use in Catalysis, Chem. Rev. 97: 2373–2419
Djikstra, A. J, Hamilton, R. J, Hamm, W., 2008. Trans Fatty Acid. New York. John Wiley & Sons.
Endalew, A. 2011. Inorganic Heterogenous Catalyst for Biodiesel Production From Vegetable Oils. Biomass And Bioenergy, 35 : 3787-3809
Ferretti, C.A, R.N. Olcese, C.R. Apesteguia, J. Isabel di Cosimo, Ind. Eng. 2009. Chem. Res.48 : 10387–10394.
Garcia, C.M. 2008. Transesterification of Soybean Oil Catalyzed by Sulfated Zirconia. Bioresour. Technol. 99 : 6608-6613
Helwani, Z., 2009. Solid Heterogenous Catalysts for Transesterification of Triglicerides With Methanol: A Review. Appl Catal A:363:1-10
Ketaren, S., 1986. Pengantar Teknologi Minyak Dan Lemak Pangan. Jakarta. UI-Press.
Kimmel T., 2004. Kinetic Investigation of The Base-Catalyzed Glycerolysis of Fatty Acid Methyl Esters. PhD Thesis, Institut fu¨ r Chemie, TU Berlin, Germany
Mufrodi, Z. 2015. 2020 Mendatang, Indonesia akan Memproduksi Gliserol. Yogyakarta. Universitas Ahmad Dahlan Press
Noureddini, H., dan Zhu, D., 1997. Kinetics of Transesterification of Soybean Oil. Journal of American Chemical Society, 74 :11.
Noureddini, H., D.W. Harkey and M.R. Gutsman., 2004. A Continuous Process for the Glycerolysis of Soybean Oil. J. Am. Oil Chem. Soc., 81: 203-207. O'Neil, M.J. 2006. The Merck Index - An Encyclopedia of Chemicals, Drugs, and
Biologicals. Whitehouse Station, NJ: Merck and Co., Inc.,, p. 1671
Ozgulsun, A., Karaosmanoglu, F., Tuter, M., 2000. Esterification Reaction of Oleic Acid with Fusel Oil Fraction for Production of Lubricating Oil. Journal of the American Oil Chemists Society, 77 : 105 -109
Pavia, D.L. 2015. Introduction of Spectroscopy. Edisi Kelima. Washington. College Bookstore.
Poedjiadi, A., (2006), Dasar-dasar Biokimia, UI Press, Jakarta
Prasetyo, E.A. 2012. Potensi Gliserol Dalam Pembuatan Turunan Gliserol Melalui Proses Esterifikasi. Jurnal Ilmu Lingkungan, 10 : 26 - 31
Roesyadi, A., Hariprajitno, D., Nurjannah, N., Savitri, S.D. 2012. HZSM-5 Catalyst For Cracking Palm Oil To Gasoline: A Comparative Study With And Without Impregnation. Semarang. Bulletin of Chemical Reaction Engineering & Catalysis UNDIP.
Restek Innovative Chromatography Products., 2003. Refrence Standards Petroleum dan Petrochem
Sheldon, R., Arends, I., Hanefeld, U., 2007. Green Chemistry And Catalysis. Germany. WILEY-VCH Verlag GmbH & Co. KgaA.
Shriver, D. & Atkins, P., 1999. Inorganic Chemistry.Third Edition. New York. Oxford University Press
Shu, Q., 2010. Synthesis of Biodiesel From Waste Vegetable Oil With Large Amounts of Free Fatty Acids Using a Carbon Based Solid Acid Catalyst. Appl Energy, 87:2589-2596
Sidabutar, A., 2011. Penggunaan Polistirena Sulfonat Sebagai Katalis Transesterifikasi Minyak Jarak Pagar (Jatropha curcas) Berkadar Asam Lemak Tinggi.[Skripsi].Medan : Universitas Sumatera Utara.
Singh, AK., Fernando SD. 2009. Preparation and Reaction Kinetics Studies of Na-based Mixed Metal Oxide for Transesterification. Energy Fuels; 23: 5160-5164
Sudarmadji S, Haryono B, Suhardi, 1996. Analisis Bahan Makanan dan Pertanian, Ed. 2. Yogyakarta: Liberty , pp 93-117.
Sutijan, Rochmadi, Budiman, A. 2012. Chemical Kinetics for Synthesis of Triacetin from Biodiesel Byproduct. International Journal of Chemistry. 4 : 101-108
Wang, Z., Wang, Z., Bai, Y., Fu, B., Liu, H., Song, A., Zhang, Z., Zhang, M., 2012. Sulfonated Polyethersulfone Directly Sinthesized Through Sulfonic Monomer As A New Stable Solid Acid Catalyst for Esterification.Catalyst Communications. 27 : 164-168.
Yasunaga K, Y Katsuragi & T Yasukawa., 2001. Nutritional Characteristics of Diacylglycerol. In: Proc Internat Palm Oil Congress Food Technology & Nutrition Conf, Malaysia 20-22 August 2001. p149-155.
Yazid, E., dan Nursanti L., 2006, Penuntun Praktikum Biokimia untuk Mahasiswa Analisis, Andi, Yogyakarta
Yoon, W. L., Park, J.W., Rhee, Y.W., Han, M.W., Jeong, J. H., Park, J. S., Jung, H., Lee, H. T. and Kim, C. S., 2003. Operating Characteristics of Integrated NG Reformer System for 5 kW Class PEM Fuel Cell, HWAHAK KONGHAK, 41 : 389
BAB 2
TINJAUAN PUSTAKA
2.1. Industri Oleokimia
Oleokimia adalah bahan kimia yang dihasilkan dari minyak dan lemak, yaitu yang diturunkan dari trigliserida menjadi bahan oleokimia. Secara industri, sebagian asam lemak diperoleh secara langsung dari hewani atau nabati menghasilkan rantai karbon panjang. Sangat memungkinkan untuk menghasilkan berbagai macam produk dari asam lemak. Diantara produk asam lemak seperti ester asam lemak memiliki aplikasi yang penting sebagai pelarut, pembungkus, resin, plastik, pelapis, parfum, kosmetik, flavor, sabun, obat-obatan, bioenergi, shortening dan pelumas (Ozgulsun et al, 2000).
Asam lemak dari minyak kelapa sawit dalam berbagai fraksi selain dapat digunakan langsung, dapat juga dihasilkan berbagai produk turunannya. Adapun produk turunan oleokimia dapat berupa asam lemak, alkohol asam lemak, amina asam lemak, amida asam lemak, ester poliglikol dan ester asam lemak. Gliserol monoester dan diester juga digunakan sebagai bahan pengemulsi dalam industri pangan.
Salah satu produk oleokimia yang dapat diperoleh dari minyak sawit adalah asam lemak. Kandungan asam lemak jenuh seperti miristat, palmitat, dan stearat serta asam lemak tidak jenuh yaitu asam oleat dan linoleat menjadi bahan baku yang diproses menjadi senyawa baru seperti metil ester asam lemak dan alkohol asam lemak (Roesyadi, dkk, 2012).
2.2. Minyak dan Lemak
Lemak dan minyak adalah salah satu kelompok yang termasuk pada golongan lipid, yaitu senyawa organik yang terdapat di alam serta tidak larut dalam air, tetapi larut dalam pelarut organik non-polar, misalnya dietil eter (C2H5OC2H5),
Kloroform (CHCl3), benzena dan hidrokarbon lainnya. Secara umum, lemak
diartikan sebagai trigliserida yang dalam kondisi ruang berada dalam keadaan padat. Sedangkan minyak adalah trigliserida yang dalam suhu ruang berbentuk cair.
Secara lebih pasti tidak ada batasan yang jelas untuk membedakan minyak dan lemak ini (Sudarmadji, 1996). Dalam proses pembentukanya, trigliserida merupakan hasil proses kondensasi satu molekul gliserol dengan tiga molekul asam-asam lemak (umumnya ketiga asam lemak berbeda-beda) yang membentuk satu molekul trigliserida dan tiga molekul air (Ketaren, 2005).
2.3. Asam Lemak
2.4. Esterifikasi
Esterifikasi adalah reaksi penting antara gliserol dengan asam lemak untuk memproduksi monogliserida, digliserida dan trigliserida. Reaksi esterifikasi akan berjalan lambat jika dilakukan tanpa menggunakan katalis. Untuk mendapatkan konversi yang tinggi dengan waktu yang relatif singkat perlu adanya bantuan katalis. Reaksi dapat dijalankan dengan adanya katalis asam seperti asam sulfat dan asam- asam sulfonat. (Kimmel, 2004).
Umumnya dalam menghasilkan trigliserida, esterifikasi dilakukan dengan mereaksikan gliserol dengan 3 mol asam oleat, dimana tiap asam lemak tersebut akan terikat membentuk trigliserida seperti tampak pada Gambar 2.1. dibawah ini :
Gambar 2.1. Reaksi Umum Esterifikasi antara Gliserol dan Asam Lemak (Kimmel, 2004)
Gliserol Asam Lemak Monogliserida Air
H2C
Digliserida Asam Lemak Trigliserida Air
H2C
Sejumlah peneliti telah mengidentifikasi beberapa variabel penting yang mempengaruhi reaksi esterifikasi untuk menghasilkan trigliserida, diantaranya adalah suhu reaksi, jenis dan jumlah katalis, perbandingan mol gliserol dan asam lemak, pengadukan dan waktu reaksi. (Noureddini et al., 2004; Ferretti et al., 2009; Singh et al., 2007).
Faktor-faktor yang mempengaruhi jalannya reaksi esterifikasi antara lain :
1. Suhu Reaksi
Kecepatan reaksi dipengaruhi oleh suhu reaksi. Kecepatan reaksi akan meningkat seiring dengan kenaikan suhu. Semakin tinggi suhu, maka semakin besar energi yang digunakan untuk mencapai energi aktivasi. Hal ini mengakibatkan tumbukan lebih sering terjadi diantara molekul-molekul reaktan untuk melakukan reaksi (Berrios, M. 2007)
2. Katalis
Katalis berfungsi untuk mempercepat laju reaksi dengan menurunkan energi aktivasi reaksi namun tidak menggeser letak kesetimbangan. Tanpa katalis, reaksi baru dapat berjalan pada suhu sekitar 250°C. Penambahan katalis bertujuan untuk mempercepat reaksi dan menurunkan kondisi operasi. Katalis yang dapat digunakan adalah katalis asam, basa, ataupun penukar ion.
Dengan katalis basa reaksi dapat berjalan pada suhu kamar, sedangkan katalis asam pada umumnya memerlukan suhu reaksi diatas 100ºC. Katalis yang digunakan dapat berupa katalis homogen maupun heterogen.
3. Rasio mol reaktan
Variabel penting dalam esterifikasi adalah rasio mol reaktan yaitu perbandingan mol gliserol dan asam lemak. Jumlah asam lemak yang berlebih (secara stoikiometri) dapat meningkatkan pembentukan trigliserida. (H.Noureddin.i et al, 1997). Semakin besar rasio gliserol/asam lemak, konversi asam lemak trigliserida akan semakin besar, sampai pada batas nilai rasio tertentu. Rasio gliserol/asam lemak yang melebihi batas nilai maksimum tidak akan meningkatkan yield (Corma. et al,1997). Reaksi pembentukan TG dapat dilihat pada Gambar 2.2 dibawah ini :
Gambar 2.2. Reaksi Umum Pembentukan Trigliserida (Corma, et al. 1997)
4. Pengadukan
Pada reaksi esterifikasi reaktan-reaktan awalnya membentuk sistem cairan dua fasa. Reaksi dikendalikan oleh difusi diantara fase-fase yang berlangsung lambat. Seiring dengan terbentuknya produk, ia bertindak sebagai pelarut tunggal yang dipakai bersama oleh reaktan-reaktan dan sistem dengan fase tunggal pun terbentuk. Dampak pengadukan ini sangat signifikan selama reaksi sebagaimana sistem tunggal terbentuk, maka pengadukan menjadi tidak lagi mempunyai pengaruh yang signifikan. Pengadukan dilakukan dengan tujuan untuk mendapatkan campuran reaksi yang bagus. Pengadukan yang tepat akan mengurangi hambatan antar massa. Untuk reaksi heterogen, ini akan menyebabkan lebih banyak reaktan mencapai tahap reaksi.
5. Waktu Reaksi
Semakin lama waktu reaksi, maka semakin banyak produk yang dihasilkan, karena akan memberikan kesempatan reaktan untuk bertumbukan satu sama lainnya. Akan tetapi, jika kesetimbangan telah tercapai, tambahan waktu reaksi tidak akan mempengaruhi reaksi
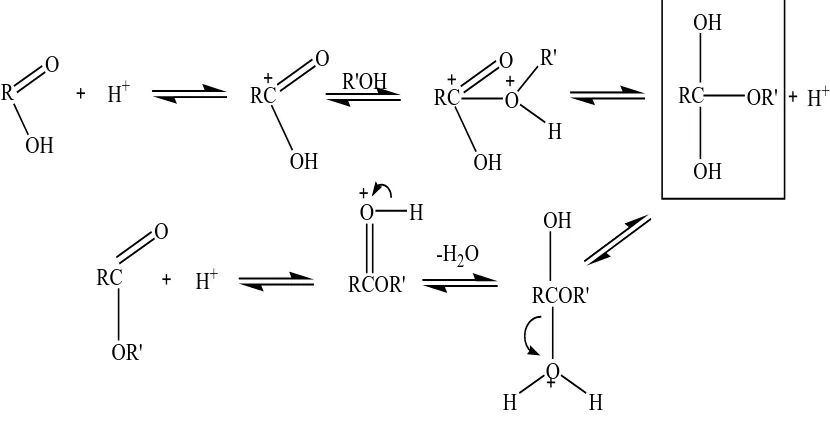
Adapun tahapan mekanisme reaksi esterifikasi asam lemak dengan katalis asam ditunjukkan pada Gambar 2.3.
Gambar 2.3. Mekanisme Reaksi Esterifikasi Asam Lemak dengan Katalis Asam (Carey, F.A 2000)
Langkah- langkah dari proses diatas yaitu protonasi asam karboksilat untuk menghasilkan ion oksonium, kemudian akan mengalami penyerangan nukleofilik oleh alkohol menghasilkan intermediet, dan selanjutnya akan melakukan deprotonasi untuk membentuk ester. Setiap langkah dalam proses tersebut bersifat reversible tetapi dengan penggunaan alkohol berlebih akan menyebabkan kesetimbangan reaksi berjalan kearah produk. Tetapi, jika terdapat air yang merupakan donor elektron dan lebih kuat dari pada alkohol alifatik akan menyebabkan terjadinya pembentukan intermediet yang tidak disukai sehingga proses esterifikasi tidak berjalan dengan sempurna (Carey, F.A., 2000).
2.5. Gliserol
Gliserol ialah suatu trihidroksi alkohol yang terdiri atas 3 atom karbon. Satu molekul gliserol dapat mengikat satu, dua, tiga molekul asam lemak dalam bentuk ester, yang disebut monogliserida, digliserida dan trigliserida. Gliserol juga digunakan sebagai penghalus pada krim cukur, sabun, dalam obat batuk dan syrup atau untuk pelembab (Hart, 1983). Gliserol larut baik dalam air dan tidak larut dalam eter (Poedjiadi, 2006). Reaksi Umum pembentukan gliserol dapat dilihat pada Gambar 2.4.
Gambar 2.4. Reaksi Umum Pembentukan Gliserol (Ketaren, 1986)
2.6. Asam Oleat
Secara kimia, asam oleat adalah salah satu asam lemak tidak jenuh. Asam oleat merupakan asam lemak berantai panjang dengan 18 atom karbon dan satu ikatan rangkap dua pada posisi-9 (18:1 cis-9). Struktur dapat dilihat pada Gambar 2.5. Asam oleat umumnya ditemukan dalam bentuk ester, seperti trigliserida.
Asam oleat merupakan asam lemak yang dapat ditemukan dari berbagai jenis minyak/lemak hewani dan nabati. Asam oleat tidak berbau, tidak berwarna, meskipun secara komersial berwarna kuning. (Young, J, A, 2002). Selain itu, asam oleat dapat juga dihasilkan dengan cara dehidrogenasi dari asam stearat. (Djikstra,A. J. 2008).
Gambar 2.5. Struktur Asam Oleat (Carey, F.A. 2000)
H2C
Trigliserida Air Gliserol Asam Lemak [H+]
CH3(CH2)6CH2 CH2(CH2)6CO2H
C C
2.7. Trioleilgliserol
Pada umumnya trigliserida berbentuk asimetris, karena merupakan turunan dari campuran beberapa asam lemak. Trioleilgliserol adalah senyawa turunan trigliserida yang simetris dan merupakan hasil ikatan kimia antara gliserol dengan 3 buah asam lemak tidak jenuh, asam oleat. Selain itu, dikenal dengan nama Triolein atau gliserida trioleat atau trigliserida oleat. Trioleilgliserol mengandung sekitar 4- 30% minyak zaitun, berfasa cairan tidak berbau dan berwarna kuning bening, tidak larut dalam air, namun larut dalam kloroform, eter, karbon tertaklorida dan sedikit larut dalam alkohol (O'Neil, M.J, 2006; Alfred, T., 2002). Struktur trioleilgliserol ditunjukkan pada Gambar 2.6.
Gambar 2.6. Struktur Molekul 1,2,3-Trioleilgliserol (Alfred, T., 2002).
Trioleigliserol banyak digunakan dalam industri pangan sebagai bahan baku pembuatan bahan pangan berlemak seperti margarin dan shortening, Dalam industri pangan, 1,2,3-trioleilgliserol digunakan sebagai pengganti dietary fat, karena dapat menyediakan energi sebesar 9 Kkal/gram, membantu pengangkutan vitamin A, D, E, K dan menyediakan asam lemak essensial bagi tubuh manusia (Yasunaga, et al.,2001, Yazid, 2006). Dalam industri farmasi, digunakan sebagai bahan pembuatan obat-obatan dan aromaterapi, dan dalam industri kosmetik digunakan sebagai moisturizer. (Yazid, 2006)
2.8. Katalis
Katalis merupakan suatu senyawa yang dapat meningkatkan laju reaksi tetapi tidak terkonsumsi oleh reaksi. Katalis meningkatkan laju reaksi dengan energi aktivasi Gibbs yang lebih rendah, ∆ᵻG (Shriver dan Atkins, 1999 ). Katalis adalah kunci utama transformasi kimia dalam industri. Kira-kira 90% produk kimia industri dibuat dengan proses katalitik (Chorkendorff, J.W dan Niemantsverdriet, 2003). Reaksi katalitik secara umum dikelompokkan menjadi dua kelompok, yaitu reaksi katalitik homogen dan reaksi katalitik heterogen.
Pada reaksi katalitik homogen, reaktan dan katalis berada dalam fasa yang sama dan reaksi terjadi di seluruh fasa sedangkan dalam katalis heterogen, reaktan dan katalis berada dalam fasa yang berbeda. (Yoon et al., 2003)
2.8.1. Katalis Homogen
Katalis homogen terdiri atas dua jenis yaitu katalis asam homogen dan katalis basa homogen. Katalis yang umum digunakan dalam reaksi gliserolisis adalah katalis alkali seperti KOH dan NaOH. Penggunaan katalis ini menimbulkan masalah yaitu sulit dipisahkan dari produk reaksi. Di samping itu, katalis basa bekerja dengan baik pada batas asam lemak bebas (ALB) < 0,5%.
Jika bahan baku mengandung ALB tinggi, akan terjadi reaksi antara katalis dengan asam lemak bebas membentuk sabun (Shu, 2010). Katalis asam homogen yang digunakan dalam reaksi gliserolisis misalnya H2SO4, HCl, dan
H3PO4.
2.8.2. Katalis Heterogen
Katalis asam berfase padat memberikan manfaat yang lebih signifikan dibanding katalis asam homogen. Penggunaan katalis tersebut dapat menyelesaikan permasalahan lingkungan, korosi, toksisitas, serta mudah dipisahkan dari campuran produk.
Pengembangan katalis padat memberikan peluang inovasi kimia hijau di masa depan (Clark, 2002). Katalis heterogen juga terdiri atas dua jenis yaitu katalis heterogen yang bersifat basa dan katalis heterogen yang bersifat asam. Beberapa katalis heterogen telah disintesis baik yang bersifat asam maupun basa. Katalis heterogen basa yang paling umum digunakan adalah senyawa-senyawa oksida logam seperti oksida logam alkali dan oksida logam alkali tanah pada reaksi transesterifikasi minyak dan lemak seperti MgO, CaO, SrO, dan BaO (Endalew, 2011).
Pada tahun 1997 Corma et al mereaksikan gliserol dengan CPO untuk menghasilkan monogliserida dan digliserida dengan menggunakan katalis MgO. Katalis MgO ini bisa memberikan konversi reaksi sampai 97 % dan mudah dipisahkan dari produk hasil reaksi karena berbentuk padat.
Tetapi proses reaksi gliserolisis dengan katalis MgO ini masih dilakukan pada suhu yang tinggi (>200oC) untuk meningkatkan kelarutan minyak dalam gliserol. Garcia (2008) telah berhasil menggunakan zirkonium sulfat sebagai katalis transesterifikasi minyak kacang kedelai dengan metanol dan etanol dengan yield masing-masing 98,6 % dan 92 %.
2.8.3. Katalis Dengan Gugus Asam Sulfonat
Penggunaan katalis padat yang memiliki gugus fungsi sulfonat telah banyak dikembangkan saat ini terutama untuk menggantikan peran asam sulfat yang memiliki banyak kelemahan. Disamping itu, gugus fungsi asam sulfonat diketahui memiliki aktivitas katalitik yang tinggi.
Wang (2012) telah membuat katalis polimer yaitu polietersulfon. Katalis ini dibuat melalui jalur sintesis langsung dengan polimerisasi monomer sulfonatnya. Dengan begitu, derajat gugus sulfonat dapat dikontrol. Katalis polietersulfon diketahui memiliki aktivitas katalitik yang baik dan stabil dalam reaksi. Disamping itu katalis ini dapat digunakan kembali lebih dari empat kali dan tidak menunjukkan penurunan aktivitas yang berarti meskipun katalis ini memiliki konsentrasi asam yang relatif sedikit.
Bangun, N dkk (2015) telah mensintesis katalis padat asam 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana berbasis sulfonat dengan gugus silikon-karbon. Katalis ini digunakan dalam reaksi transesterifikasi minyak CPO berkadar asam lemak bebas tinggi yaitu 8% pada suhu 160 oC dan didapatkan yield 96%.
Kemudian, digunakan juga dalam reaksi esterifikasi antara asam stearat dengan 2 –propanol menghasilkan propil stearat dan asam palmitat dengan 2-butanol menghasilkan butil palmitat pada suhu 150o C selama 15 jam dengan masing-masing yield yaitu 67,5 % dan 48%. Katalis ini mampu mengkatalisis esterifikasi asam lemak bebas dalam satu tahapan reaksi, relatif toleran terhadap asam lemak bebas yang terkandung di dalam bahan baku minyak dan tahan terhadap suhu tinggi.
2.8.4. Katalis Ramah Lingkungan dan Reusable
Secara luas telah diakui bahwa terdapat peningkatan kebutuhan akan proses-proses yang lebih ramah lingkungan dalam industri kimia. Tren ini selanjutnya dikenal sebagai ‘Kimia Hijau’ atau ‘Teknologi Berkelanjutan’ yang mengharuskan terjadinya pergeseran pandangan dari konsep tradisional mengenai efisiensi proses ke nilai ekonomi untuk menghilangkan limbah dan menghindari pemakaian zat-zat beracun dan/atau berbahaya (Sheldon, dkk, 2007).
BAB 3
METODE PENELITIAN
3.1. Alat
Alat-alat yang digunakan dalam penelitian ini adalah sebagai berikut :
- Spektrofotometer FT-IR Shimadzu
- Kromatografi Gas Shimadzu
- Termo Control T.E.W
- Reaktor Stainless Steel
- Hotplate Stirer Cimarec
- Magnetic Bar
- Gelas Beaker 250 mL Pyrex
- Corong Pisah 250 mL Pyrex
3.2. Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah sebagai berikut :
- Asam Oleat 93% PT. Wilmar
- Gliserol p.a. Merck
- n-heksana p.a. Merck
3.3. Prosedur Penelitian
3.4. Bagan Penelitian
Catatan : Dilakukan prosedur yang sama pada suhu 160 oC dan untuk rasio mol asam oleat : gliserol : 6 : 1 mol pada suhu 180 oC.
9,136 gram AsamOleat
dimasukkan kedalam autoclave ditambahkan 1 gram gliserol dan 0,1 gram katalis 1,2-dimetil-1,1,2,2 tetrafenilsulfonatodisilana dimasukkan magnetic bar
dipanaskan pada suhu 180oC selama 20 jam
Campuran Hasil Reaksi
fraksi n-heksan fraksi akuades
dikeringkan divakum ditimbang
hasil dianalisa dengan
Kromatografi Gas, FT-IR
dicuci dengan n-heksan dikeringkan
divakum
katalis
diekstraksi dengan n-heksana dan akuades
dicuci dengan akuades berulang-ulang
BAB 4
HASIL DAN PEMBAHASAN
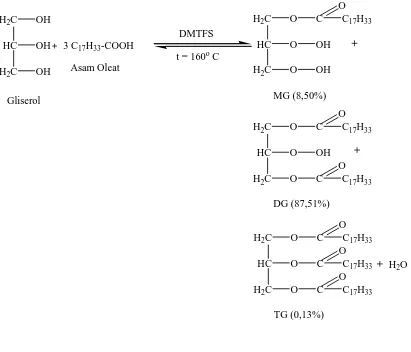
Dalam penelitian ini akan dibuat 1,2,3-trioleilgliserol dari esterifikasi asam oleat dengan gliserol dalam pelarut n-heksana menggunakan katalis 1,2-dimetil, 1,1,2,2-tetrafenilsulfonatodisilana (DMTFS) pada suhu 160 oC dan 180 oC selama 20 jam. Reaksi esterifikasi antara asam oleat dengan gliserol dengan rasio mol 3 : 1 pada suhu 160 oC ternyata hanya menghasilkan TG sebanyak 0,13% sedangkan pada suhu 180 oC menghasilkan mayoritas DG sebanyak 86,15%, dan TG sebanyak 7,58%. Untuk meningkatkan perolehan TG, dilakukan reaksi esterifikasi asam oleat dengan gliserol dengan memperbesar konsentrasi asam oleat menjadi 6 mol asam oleat/mol gliserol, ternyata didapatkan peningkatan perolehan TG menjadi 8,01%.
4.1. Esterifikasi Asam Oleat dengan Gliserol (3 : 1) pada suhu 160 oC
Reaksi Esterifikasi antara asam oleat dengan gliserol dengan rasio mol 3 : 1
dalam pelarut n-heksana dengan menggunakan katalis 1,2-dimetil, 1,1,2,2-tetrafenilsulfonatodisilana (DMTFS) pada suhu 160 oC menghasilkan
Reaksi esterifikasi asam oleat dengan gliserol dapat digambarkan menurut persamaan reaksi sebagai berikut :
Gambar 4.1. Reaksi Esterifikasi Antara Asam Oleat dengan Gliserol
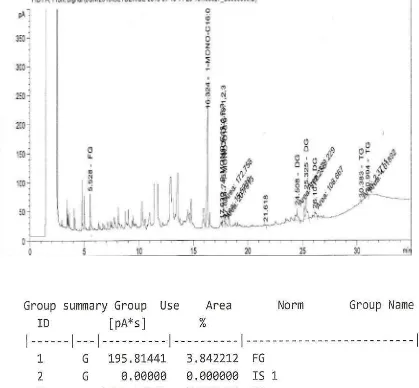
Kromatogram produk reaksi esterifikasi asam oleat dengan gliserol pada suhu 160
o
C yang di-run dengan menggunakan kolom Cool-On-Coloumn (COC) ditunjukkan pada Gambar 4.2. Dari kromatogram tersebut terlihat bahwa gliserida yang terbentuk merupakan campuran MG (8,05% ), DG (87,51%) dan TG (0,13%) dengan waktu retensi masing-masingnya adalah antara 16,32-17,88 menit, antara 24,5 – 26,1 menit, dan 30,99 menit.
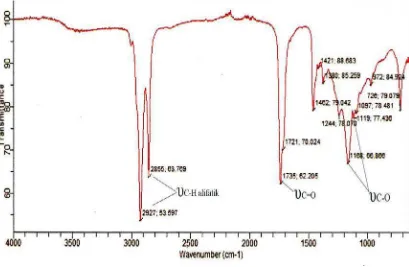
Selanjutnya, untuk melihat terbentuknya senyawa ester dari reaksi diatas, maka dilakukan uji FT-IR terhadap produk reaksi. Spektrum FT-IR produk reaksi dapat dilihat pada Gambar 4.3.
Dari spektrum FT-IR terlihat beberapa puncak absorpsi seperti
υ
C-Halifatik pada bilangan gelombang 2927 cm-1 dan 2855 cm-1 dan puncak absorpsi regangan
υ
C=O pada bilangan gelombang 1735 cm-1 yang spesifik menunjukkanpuncak absorpsi karbonil ester. Hal ini sesuai dengan data literatur yang menyatakan bahwa regangan
υ
C=O ester berkisar antara 1735 – 1750 cm-1(Silverstein, 1981). Terjadinya pergeseran pita serapan
υ
C=O ester sebesar 26 cm-1dari
υ
C=O asam oleat yaitu dari 1709 cm-1 ke 1735 cm-1 (Lampiran 1), sehinggadapat disimpulkan bahwa ester telah terbentuk pada kondisi reaksi ini.
Dari kromatogram produk reaksi esterifikasi terlihat bahwa reaksi pembentukan trioleilgliserol kurang berjalan dengan baik pada suhu 160 oC. Pada kondisi reaksi ini, senyawa yang dominan terbentuk adalah DG. Hal ini disebabkan karena esterifikasi alkohol primer yaitu posisi 1,3 pada gliserol lebih mudah terjadi, sedangkan posisi 2 yaitu alkohol sekunder lebih sukar untuk diesterifikasi. Rendahnya jumlah TG yang terbentuk kemungkinan juga disebabkan oleh suhu reaksi yang masih terlalu rendah, sehingga dicoba menaikkan suhu reaksi esterifikasi menjadi 180 oC. Oleh karena itu, dicoba untuk mereaksikan asam oleat dengan gliserol dengan rasio mol 3 : 1 dalam pelarut n-heksana dengan menggunakan katalis 1,2-dimetil, 1,1,2,2-tetrafenilsulfonatodisilana (DMTFS) pada suhu 180 oC.
4.2. Esterifikasi Asam Oleat dengan Gliserol (3 : 1) pada suhu 180 oC
Reaksi Esterifikasi antara asam oleat dengan gliserol dengan rasio mol 3 : 1
dalam pelarut n-heksana dengan menggunakan katalis 1,2-dimetil, 1,1,2,2-tetrafenilsulfonatodisilana (DMTFS) pada suhu 160 oC menghasilkan
cairan kental berwarna kuning yang merupakan campuran MG = 6,26%, DG = 86,15%, dan TG = 7,58%.
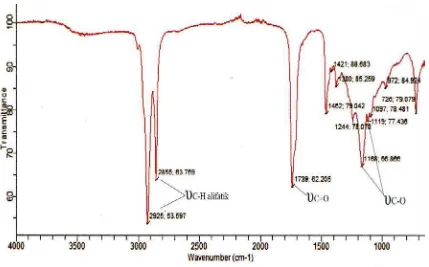
Selanjutnya, untuk melihat terbentuknya senyawa ester dari reaksi diatas, maka dilakukan uji FT-IR terhadap produk reaksi. Spektrum FT-IR produk reaksi dapat dilihat pada Gambar 4.4.
Dari spektrum FT-IR terlihat beberapa puncak absorpsi seperti
υ
C-Halifatik pada bilangan gelombang 2925 cm-1 dan 2855 cm-1 dan puncak absorpsi regangan
υ
C=O pada bilangan gelombang 1739 cm-1 yang spesifik menunjukkanpuncak absorpsi karbonil ester. Hal ini sesuai dengan data literatur yang menyatakan bahwa regangan
υ
C=O ester berkisar antara 1735 – 1750 cm-1(Silverstein, 1981). Terjadinya pergeseran pita serapan
υ
C=O ester sebesar 30 cm-1dari
υ
C=O pada asam oleat yaitu dari 1709 cm-1 – 1739 cm-1 (Lampiran 1),sehingga dapat disimpulkan bahwa ester telah terbentuk pada kondisi reaksi ini.
Terlihat bahwa dari reaksi esterifikasi asam oleat dengan gliserol dengan rasio mol 3 : 1 diperoleh trioleilgliserol (TG) masih dalam jumlah yang kecil yaitu 7,58%. Rencana untuk menaikkan suhu reaksi >180 oC tidak mungkin untuk dilaksanakan karena kondisi peralatan yang kurang memadai. Oleh karena itu, dalam meningkatkan perolehan TG dari reaksi esterifikasi ini, dicoba untuk meningkatkan konsentrasi asam oleat yang digunakan menjadi 6 mol asam oleat/mol gliserol dengan kondisi reaksi yang sama yaitu pada suhu 180 oC.
4.3. Esterifikasi Asam Oleat dengan Gliserol ( 6 : 1) pada suhu 180 oC
Reaksi Esterifikasi antara asam oleat dengan gliserol dengan rasio mol 6 : 1
dalam pelarut n-heksana dengan menggunakan katalis 1,2-dimetil, 1,1,2,2-tetrafenilsulfonatodisilana (DMTFS) pada suhu 180 oC menghasilkan
cairan kental berwarna kuning yang merupakan campuran MG = 11,21% ,DG = 68,26% dan TG = 8,01%. Kromatogram produk reaksi esterifikasi asam oleat dengan gliserol pada suhu 180 oC yang di-run dengan menggunakan kolom Cool-On-Coloumn (COC) ditunjukkan pada Gambar 4.6.
Selanjutnya, untuk melihat terbentuknya senyawa ester dari reaksi diatas, maka dilakukan uji FT-IR terhadap produk reaksi. Spektrum FT-IR produk reaksi dapat dilihat pada Gambar 4.5. Melalui FT-IR, diperoleh beberapa puncak absorpsi
υ
C-H alifatik pada bilangan gelombang 2924 cm-1 dan 2855 cm-1 danpuncak absorpsi regangan
υ
C=O pada bilangan gelombang 1737 cm-1 yang spesifikmenunjukkan puncak absorpsi karbonil ester. Hal ini sesuai dengan data literatur yang menyatakan bahwa regangan
υ
C=O ester berkisar antara 1735 – 1750 cm-1(Silverstein, 1981). Terjadinya pergeseran pita serapan
υ
C=O ester sebesar 28 cm-1dari
υ
C=O pada asam oleat yaitu dari 1709 cm-1 – 1737 cm-1 (Lampiran 1),sehingga dapat disimpulkan bahwa ester telah terbentuk pada kondisi reaksi ini.
Terlihat bahwa dari reaksi esterifikasi asam oleat dengan gliserol dengan rasio mol 6 : 1 dihasilkan campuran MG, DG dan TG kemudian terjadi peningkatan perolehan trioleilgliserol, namun masih dalam jumlah yang kecil yaitu 8,01%. Katalis DMTFS yang digunakan oleh Bangun, N, dkk telah berhasil mereaksikan asam karboksilat berantai panjang dengan alkohol sekunder seperti 2-propanol dan 2-butanol dengan yield yang memuaskan, sehingga penggunaan DMTFS sebagai katalis esterifikasi asam oleat dengan gliserol sangat memungkinkan. Namun, dalam penelitian ini hasilnya belum cukup baik. Hal ini kemungkinan disebabkan oleh gugus alkohol sekunder pada gliserol yang sukar untuk diesterifikasi dibandingkan dengan gugus alkohol primer pada posisi 1 dan 3. Selain itu juga dikarenakan rantai panjang dari asam oleat yang melindungi serangan terhadap posisi 2 yaitu alkohol sekunder, sehingga menghambat reaksi esterifikasi alkohol sekunder.
Adapun data perolehan MG, DG, dan TG pada setiap kondisi reaksi yang dilakukan ditunjukkan pada Tabel 4.1. dibawah ini :
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Reaksi esterifikasi antara asam oleat dengan gliserol dengan rasio mol 3 : 1
pada suhu 180o C selama 20 jam dalam pelarut n-heksana menggunakan katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana (DMTFS) menghasilkan campuran MG = 6,26%, DG = 86,15% dan TG sebanyak 7,58% sedangkan reaksi esterifikasi antara asam oleat dengan gliserol dengan rasio mol 6 : 1 pada suhu
180o C selama 20 jam dalam pelarut n-heksana menggunakan katalis 1,2-dimetil, 1,1,2,2-tetrafenilsulfonatodisilana (DMTFS) menghasilkan campuran MG =
11,21%, DG = 68,26% dan TG dan 8,01%. Dengan meningkatkan suhu reaksi dan memperbesar konsentrasi asam oleat dapat meningkatkan perolehan 1,2,3- trioleilgliserol menjadi 8,01%.
2. Gugus Alkohol sekunder pada gliserol sukar untuk diesterifikasi dibandingkan gugus Alkohol primer pada posisi 1 dan 3. Hal ini mungkin disebabkan karena rantai panjang asam oleat yang dapat melindungi serangan terhadap posisi 2 atau Alkohol sekunder.
5.2. Saran
BAB 2
TINJAUAN PUSTAKA
2.1. Industri Oleokimia
Oleokimia adalah bahan kimia yang dihasilkan dari minyak dan lemak, yaitu yang diturunkan dari trigliserida menjadi bahan oleokimia. Secara industri, sebagian asam lemak diperoleh secara langsung dari hewani atau nabati menghasilkan rantai karbon panjang. Sangat memungkinkan untuk menghasilkan berbagai macam produk dari asam lemak. Diantara produk asam lemak seperti ester asam lemak memiliki aplikasi yang penting sebagai pelarut, pembungkus, resin, plastik, pelapis, parfum, kosmetik, flavor, sabun, obat-obatan, bioenergi, shortening dan pelumas (Ozgulsun et al, 2000).
Asam lemak dari minyak kelapa sawit dalam berbagai fraksi selain dapat digunakan langsung, dapat juga dihasilkan berbagai produk turunannya. Adapun produk turunan oleokimia dapat berupa asam lemak, alkohol asam lemak, amina asam lemak, amida asam lemak, ester poliglikol dan ester asam lemak. Gliserol monoester dan diester juga digunakan sebagai bahan pengemulsi dalam industri pangan.
Salah satu produk oleokimia yang dapat diperoleh dari minyak sawit adalah asam lemak. Kandungan asam lemak jenuh seperti miristat, palmitat, dan stearat serta asam lemak tidak jenuh yaitu asam oleat dan linoleat menjadi bahan baku yang diproses menjadi senyawa baru seperti metil ester asam lemak dan alkohol asam lemak (Roesyadi, dkk, 2012).
2.2. Minyak dan Lemak
Lemak dan minyak adalah salah satu kelompok yang termasuk pada golongan lipid, yaitu senyawa organik yang terdapat di alam serta tidak larut dalam air, tetapi larut dalam pelarut organik non-polar, misalnya dietil eter (C2H5OC2H5),
Kloroform (CHCl3), benzena dan hidrokarbon lainnya. Secara umum, lemak
diartikan sebagai trigliserida yang dalam kondisi ruang berada dalam keadaan padat. Sedangkan minyak adalah trigliserida yang dalam suhu ruang berbentuk cair.
Secara lebih pasti tidak ada batasan yang jelas untuk membedakan minyak dan lemak ini (Sudarmadji, 1996). Dalam proses pembentukanya, trigliserida merupakan hasil proses kondensasi satu molekul gliserol dengan tiga molekul asam-asam lemak (umumnya ketiga asam lemak berbeda-beda) yang membentuk satu molekul trigliserida dan tiga molekul air (Ketaren, 2005).
2.3. Asam Lemak
2.4. Esterifikasi
Esterifikasi adalah reaksi penting antara gliserol dengan asam lemak untuk memproduksi monogliserida, digliserida dan trigliserida. Reaksi esterifikasi akan berjalan lambat jika dilakukan tanpa menggunakan katalis. Untuk mendapatkan konversi yang tinggi dengan waktu yang relatif singkat perlu adanya bantuan katalis. Reaksi dapat dijalankan dengan adanya katalis asam seperti asam sulfat dan asam- asam sulfonat. (Kimmel, 2004).
Umumnya dalam menghasilkan trigliserida, esterifikasi dilakukan dengan mereaksikan gliserol dengan 3 mol asam oleat, dimana tiap asam lemak tersebut akan terikat membentuk trigliserida seperti tampak pada Gambar 2.1. dibawah ini :
Gambar 2.1. Reaksi Umum Esterifikasi antara Gliserol dan Asam Lemak (Kimmel, 2004)
Gliserol Asam Lemak Monogliserida Air
H2C
Digliserida Asam Lemak Trigliserida Air
H2C
Sejumlah peneliti telah mengidentifikasi beberapa variabel penting yang mempengaruhi reaksi esterifikasi untuk menghasilkan trigliserida, diantaranya adalah suhu reaksi, jenis dan jumlah katalis, perbandingan mol gliserol dan asam lemak, pengadukan dan waktu reaksi. (Noureddini et al., 2004; Ferretti et al., 2009; Singh et al., 2007).
Faktor-faktor yang mempengaruhi jalannya reaksi esterifikasi antara lain :
1. Suhu Reaksi
Kecepatan reaksi dipengaruhi oleh suhu reaksi. Kecepatan reaksi akan meningkat seiring dengan kenaikan suhu. Semakin tinggi suhu, maka semakin besar energi yang digunakan untuk mencapai energi aktivasi. Hal ini mengakibatkan tumbukan lebih sering terjadi diantara molekul-molekul reaktan untuk melakukan reaksi (Berrios, M. 2007)
2. Katalis
Katalis berfungsi untuk mempercepat laju reaksi dengan menurunkan energi aktivasi reaksi namun tidak menggeser letak kesetimbangan. Tanpa katalis, reaksi baru dapat berjalan pada suhu sekitar 250°C. Penambahan katalis bertujuan untuk mempercepat reaksi dan menurunkan kondisi operasi. Katalis yang dapat digunakan adalah katalis asam, basa, ataupun penukar ion.
Dengan katalis basa reaksi dapat berjalan pada suhu kamar, sedangkan katalis asam pada umumnya memerlukan suhu reaksi diatas 100ºC. Katalis yang digunakan dapat berupa katalis homogen maupun heterogen.
3. Rasio mol reaktan
Variabel penting dalam esterifikasi adalah rasio mol reaktan yaitu perbandingan mol gliserol dan asam lemak. Jumlah asam lemak yang berlebih (secara stoikiometri) dapat meningkatkan pembentukan trigliserida. (H.Noureddin.i et al, 1997). Semakin besar rasio gliserol/asam lemak, konversi asam lemak trigliserida akan semakin besar, sampai pada batas nilai rasio tertentu. Rasio gliserol/asam lemak yang melebihi batas nilai maksimum tidak akan meningkatkan yield (Corma. et al,1997). Reaksi pembentukan TG dapat dilihat pada Gambar 2.2 dibawah ini :
Gambar 2.2. Reaksi Umum Pembentukan Trigliserida (Corma, et al. 1997)
4. Pengadukan
Pada reaksi esterifikasi reaktan-reaktan awalnya membentuk sistem cairan dua fasa. Reaksi dikendalikan oleh difusi diantara fase-fase yang berlangsung lambat. Seiring dengan terbentuknya produk, ia bertindak sebagai pelarut tunggal yang dipakai bersama oleh reaktan-reaktan dan sistem dengan fase tunggal pun terbentuk. Dampak pengadukan ini sangat signifikan selama reaksi sebagaimana sistem tunggal terbentuk, maka pengadukan menjadi tidak lagi mempunyai pengaruh yang signifikan. Pengadukan dilakukan dengan tujuan untuk mendapatkan campuran reaksi yang bagus. Pengadukan yang tepat akan mengurangi hambatan antar massa. Untuk reaksi heterogen, ini akan menyebabkan lebih banyak reaktan mencapai tahap reaksi.
5. Waktu Reaksi
Semakin lama waktu reaksi, maka semakin banyak produk yang dihasilkan, karena akan memberikan kesempatan reaktan untuk bertumbukan satu sama lainnya. Akan tetapi, jika kesetimbangan telah tercapai, tambahan waktu reaksi tidak akan mempengaruhi reaksi
Adapun tahapan mekanisme reaksi esterifikasi asam lemak dengan katalis asam ditunjukkan pada Gambar 2.3.
Gambar 2.3. Mekanisme Reaksi Esterifikasi Asam Lemak dengan Katalis Asam (Carey, F.A 2000)
Langkah- langkah dari proses diatas yaitu protonasi asam karboksilat untuk menghasilkan ion oksonium, kemudian akan mengalami penyerangan nukleofilik oleh alkohol menghasilkan intermediet, dan selanjutnya akan melakukan deprotonasi untuk membentuk ester. Setiap langkah dalam proses tersebut bersifat reversible tetapi dengan penggunaan alkohol berlebih akan menyebabkan kesetimbangan reaksi berjalan kearah produk. Tetapi, jika terdapat air yang merupakan donor elektron dan lebih kuat dari pada alkohol alifatik akan menyebabkan terjadinya pembentukan intermediet yang tidak disukai sehingga proses esterifikasi tidak berjalan dengan sempurna (Carey, F.A., 2000).
2.5. Gliserol
Gliserol ialah suatu trihidroksi alkohol yang terdiri atas 3 atom karbon. Satu molekul gliserol dapat mengikat satu, dua, tiga molekul asam lemak dalam bentuk ester, yang disebut monogliserida, digliserida dan trigliserida. Gliserol juga digunakan sebagai penghalus pada krim cukur, sabun, dalam obat batuk dan syrup atau untuk pelembab (Hart, 1983). Gliserol larut baik dalam air dan tidak larut dalam eter (Poedjiadi, 2006). Reaksi Umum pembentukan gliserol dapat dilihat pada Gambar 2.4.
Gambar 2.4. Reaksi Umum Pembentukan Gliserol (Ketaren, 1986)
2.6. Asam Oleat
Secara kimia, asam oleat adalah salah satu asam lemak tidak jenuh. Asam oleat merupakan asam lemak berantai panjang dengan 18 atom karbon dan satu ikatan rangkap dua pada posisi-9 (18:1 cis-9). Struktur dapat dilihat pada Gambar 2.5. Asam oleat umumnya ditemukan dalam bentuk ester, seperti trigliserida.
Asam oleat merupakan asam lemak yang dapat ditemukan dari berbagai jenis minyak/lemak hewani dan nabati. Asam oleat tidak berbau, tidak berwarna, meskipun secara komersial berwarna kuning. (Young, J, A, 2002). Selain itu, asam oleat dapat juga dihasilkan dengan cara dehidrogenasi dari asam stearat. (Djikstra,A. J. 2008).
Gambar 2.5. Struktur Asam Oleat (Carey, F.A. 2000)
H2C
Trigliserida Air Gliserol Asam Lemak [H+]
CH3(CH2)6CH2 CH2(CH2)6CO2H
C C
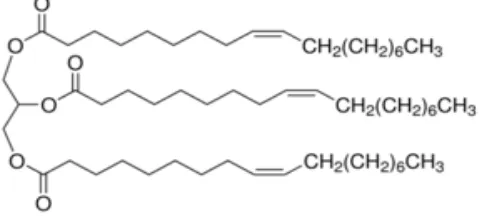
2.7. Trioleilgliserol
Pada umumnya trigliserida berbentuk asimetris, karena merupakan turunan dari campuran beberapa asam lemak. Trioleilgliserol adalah senyawa turunan trigliserida yang simetris dan merupakan hasil ikatan kimia antara gliserol dengan 3 buah asam lemak tidak jenuh, asam oleat. Selain itu, dikenal dengan nama Triolein atau gliserida trioleat atau trigliserida oleat. Trioleilgliserol mengandung sekitar 4- 30% minyak zaitun, berfasa cairan tidak berbau dan berwarna kuning bening, tidak larut dalam air, namun larut dalam kloroform, eter, karbon tertaklorida dan sedikit larut dalam alkohol (O'Neil, M.J, 2006; Alfred, T., 2002). Struktur trioleilgliserol ditunjukkan pada Gambar 2.6.
Gambar 2.6. Struktur Molekul 1,2,3-Trioleilgliserol (Alfred, T., 2002).
Trioleigliserol banyak digunakan dalam industri pangan sebagai bahan baku pembuatan bahan pangan berlemak seperti margarin dan shortening, Dalam industri pangan, 1,2,3-trioleilgliserol digunakan sebagai pengganti dietary fat, karena dapat menyediakan energi sebesar 9 Kkal/gram, membantu pengangkutan vitamin A, D, E, K dan menyediakan asam lemak essensial bagi tubuh manusia (Yasunaga, et al.,2001, Yazid, 2006). Dalam industri farmasi, digunakan sebagai bahan pembuatan obat-obatan dan aromaterapi, dan dalam industri kosmetik digunakan sebagai moisturizer. (Yazid, 2006)
2.8. Katalis
Katalis merupakan suatu senyawa yang dapat meningkatkan laju reaksi tetapi tidak terkonsumsi oleh reaksi. Katalis meningkatkan laju reaksi dengan energi aktivasi Gibbs yang lebih rendah, ∆ᵻG (Shriver dan Atkins, 1999 ). Katalis adalah kunci utama transformasi kimia dalam industri. Kira-kira 90% produk kimia industri dibuat dengan proses katalitik (Chorkendorff, J.W dan Niemantsverdriet, 2003). Reaksi katalitik secara umum dikelompokkan menjadi dua kelompok, yaitu reaksi katalitik homogen dan reaksi katalitik heterogen.
Pada reaksi katalitik homogen, reaktan dan katalis berada dalam fasa yang sama dan reaksi terjadi di seluruh fasa sedangkan dalam katalis heterogen, reaktan dan katalis berada dalam fasa yang berbeda. (Yoon et al., 2003)
2.8.1. Katalis Homogen
Katalis homogen terdiri atas dua jenis yaitu katalis asam homogen dan katalis basa homogen. Katalis yang umum digunakan dalam reaksi gliserolisis adalah katalis alkali seperti KOH dan NaOH. Penggunaan katalis ini menimbulkan masalah yaitu sulit dipisahkan dari produk reaksi. Di samping itu, katalis basa bekerja dengan baik pada batas asam lemak bebas (ALB) < 0,5%.
Jika bahan baku mengandung ALB tinggi, akan terjadi reaksi antara katalis dengan asam lemak bebas membentuk sabun (Shu, 2010). Katalis asam homogen yang digunakan dalam reaksi gliserolisis misalnya H2SO4, HCl, dan
H3PO4.
2.8.2. Katalis Heterogen
Katalis asam berfase padat memberikan manfaat yang lebih signifikan dibanding katalis asam homogen. Penggunaan katalis tersebut dapat menyelesaikan permasalahan lingkungan, korosi, toksisitas, serta mudah dipisahkan dari campuran produk.
Pengembangan katalis padat memberikan peluang inovasi kimia hijau di masa depan (Clark, 2002). Katalis heterogen juga terdiri atas dua jenis yaitu katalis heterogen yang bersifat basa dan katalis heterogen yang bersifat asam. Beberapa katalis heterogen telah disintesis baik yang bersifat asam maupun basa. Katalis heterogen basa yang paling umum digunakan adalah senyawa-senyawa oksida logam seperti oksida logam alkali dan oksida logam alkali tanah pada reaksi transesterifikasi minyak dan lemak seperti MgO, CaO, SrO, dan BaO (Endalew, 2011).
Pada tahun 1997 Corma et al mereaksikan gliserol dengan CPO untuk menghasilkan monogliserida dan digliserida dengan menggunakan katalis MgO. Katalis MgO ini bisa memberikan konversi reaksi sampai 97 % dan mudah dipisahkan dari produk hasil reaksi karena berbentuk padat.
Tetapi proses reaksi gliserolisis dengan katalis MgO ini masih dilakukan pada suhu yang tinggi (>200oC) untuk meningkatkan kelarutan minyak dalam gliserol. Garcia (2008) telah berhasil menggunakan zirkonium sulfat sebagai katalis transesterifikasi minyak kacang kedelai dengan metanol dan etanol dengan yield masing-masing 98,6 % dan 92 %.
2.8.3. Katalis Dengan Gugus Asam Sulfonat
Penggunaan katalis padat yang memiliki gugus fungsi sulfonat telah banyak dikembangkan saat ini terutama untuk menggantikan peran asam sulfat yang memiliki banyak kelemahan. Disamping itu, gugus fungsi asam sulfonat diketahui memiliki aktivitas katalitik yang tinggi.
Wang (2012) telah membuat katalis polimer yaitu polietersulfon. Katalis ini dibuat melalui jalur sintesis langsung dengan polimerisasi monomer sulfonatnya. Dengan begitu, derajat gugus sulfonat dapat dikontrol. Katalis polietersulfon diketahui memiliki aktivitas katalitik yang baik dan stabil dalam reaksi. Disamping itu katalis ini dapat digunakan kembali lebih dari empat kali dan tidak menunjukkan penurunan aktivitas yang berarti meskipun katalis ini memiliki konsentrasi asam yang relatif sedikit.
Bangun, N dkk (2015) telah mensintesis katalis padat asam 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana berbasis sulfonat dengan gugus silikon-karbon. Katalis ini digunakan dalam reaksi transesterifikasi minyak CPO berkadar asam lemak bebas tinggi yaitu 8% pada suhu 160 oC dan didapatkan yield 96%.
Kemudian, digunakan juga dalam reaksi esterifikasi antara asam stearat dengan 2 –propanol menghasilkan propil stearat dan asam palmitat dengan 2-butanol menghasilkan butil palmitat pada suhu 150o C selama 15 jam dengan masing-masing yield yaitu 67,5 % dan 48%. Katalis ini mampu mengkatalisis esterifikasi asam lemak bebas dalam satu tahapan reaksi, relatif toleran terhadap asam lemak bebas yang terkandung di dalam bahan baku minyak dan tahan terhadap suhu tinggi.
2.8.4. Katalis Ramah Lingkungan dan Reusable
Secara luas telah diakui bahwa terdapat peningkatan kebutuhan akan proses-proses yang lebih ramah lingkungan dalam industri kimia. Tren ini selanjutnya dikenal sebagai ‘Kimia Hijau’ atau ‘Teknologi Berkelanjutan’ yang mengharuskan terjadinya pergeseran pandangan dari konsep tradisional mengenai efisiensi proses ke nilai ekonomi untuk menghilangkan limbah dan menghindari pemakaian zat-zat beracun dan/atau berbahaya (Sheldon, dkk, 2007).
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Gliserol merupakan produk samping pada pembuatan biodiesel dan pada tahun 2015 diperkirakan diproduksi sekitar 0,5 juta kL gliserol yang mana hampir 50% berasal dari produksi biodiesel (Mufrodi, Z, 2015). Oleh sebab itu, mulai dilakukan penelitian tentang proses produksi turunan gliserol agar produk mempunyai nilai ekonomi yang lebih tinggi, serta dapat diaplikasikan untuk pembuatan produk yang beragam. (Prasetyo, A. 2012)
Turunan gliserol, seperti 1,2,3-trioleilgliserol dapat dimanfaatkan dalam industri pangan, farmasi dan kosmetik agar bernilai ekonomi tinggi. Dalam industri pangan, 1,2,3-trioleilgliserol digunakan sebagai pengganti dietary fat, karena dapat menyediakan energi sebesar 9 Kkal/gram, membantu pengangkutan vitamin A, D, E, K dan menyediakan asam lemak essensial bagi tubuh manusia (Yasunaga, et al.,2001). Dalam industri farmasi, digunakan sebagai bahan pembuatan obat-obatan dan aromaterapi, dan dalam industri kosmetik digunakan sebagai bahan pembuatan moisturizer atau pelembab kulit. (Yazid, 2006)
C17H33COOH +
Tahapan reaksi pembentukan 1,3-dioleil, 2-palmitoilgliserol dapat dilihat pada Gambar 1.1.
Gambar 1.1. Tahapan Reaksi Pembentukan 1,3-dioleil, 2-palmitoilgliserol
Sutijan, dkk (2012) telah melakukan esterifikasi antara gliserol dengan asam asetat menggunakan katalis asam sulfat pada suhu 115o C selama 90 menit dan didapatkan triacetin sebesar 77,84%. Namun, penggunaan asam sulfat tidak ramah lingkungan karena menyebabkan korosi pada reaktor. Wu, Y ( 2013) telah membuat trimetilolpropana trioleat dengan cara esterifikasi antara 1,1,1-trimetilolpropana dengan asam oleat menggunakan katalis asam (SO42-/MxOy, M
= Zr, Ti, Sn) pada suhu 220 oC selama 3 jam dengan yield 91,65%. Reaksi pembentukan trimetilolpropana trioleat dapat dilihat pada Gambar 1.2.
Umumnya, pembuatan trigliserida secara kimiawi berlangsung pada suhu tinggi dan menggunakan katalis yang tidak ramah lingkungan seperti asam sulfat, zeolit, CaO, MgO, dan resin penukar ion. Katalis yang digunakan tidak dapat diregenerasi. Selain itu, sulitnya dalam mengesterifikasi gugus-OH sekunder untuk menghasilkan trigliserida.
chroBangun, N dkk (2015) telah membuat suatu katalis asam sulfonat dengan mensulfonasi tetrafenildisilana menjadi 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana. Katalis ini digunakan dalam reaksi esterifikasi antara asam lemak dengan alkohol primer dan alkohol sekunder untuk menghasilkan metil ester. Katalis heterogen bergugus asam sulfonat ini memiliki aktivitas penggunaan ulang (reusable activity) yang sangat baik, stabil pada suhu tinggi, mudah dipisahkan dari produk reaksi dan rendah polusi terhadap lingkungan sehingga mendukung Green Chemistry.
Dari uraian diatas, diketahui 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana dapat mengkatalisis reaksi esterifikasi antara asam lemak berantai panjang dengan alkohol primer dan alkohol sekunder pada suhu tinggi sehingga, dalam penelitian ini akan dilakukan reaksi esterifikasi antara asam oleat dengan gliserol menggunakan 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana, dimana gliserol sebagai alkohol primer dan alkohol sekunder untuk menghasilkan 1,2,3-trioleilgliserol.
1.2. Permasalahan
1. Reaksi-reaksi esterifikasi umumnya menggunakan suhu tinggi dan katalis tidak ramah lingkungan, sehingga pada pembuatan 1,2,3-trioleilgliserol dilakukan reaksi esterifikasi menggunakan katalis yang tahan suhu tinggi, ramah lingkungan dan reusable.
1.3.Tujuan Penelitian
Untuk memperoleh 1,2,3-trioleilgliserol melalui reaksi esterifikasi antara gliserol dan asam oleat dengan menggunakan katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana dan mengetahui kondisi reaksi yang tepat.
1.4. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah terhadap industri pangan terutama produk turunan gliserol yang bernilai ekonomi tinggi seperti 1,2,3-trioleilgliserol dengan penggunaan katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana yang ramah lingkungan dan reusable.
I.5. Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Anorganik FMIPA USU. Karakterisasi produk dengan Kromatografi Gas dilakukan di PT. WBI (Wilmart Bioenergi Indonesia). Karakterisasi produk dengan spektroskopi FT-IR dilakukan di PT. Soci Mas.
1.6. Metodologi Penelitian
PEMBUATAN 1,2,3-TRIOLEILGLISEROL DARI ESTERIFIKASI ASAM OLEAT DENGAN GLISEROL MENGGUNAKAN KATALIS
1,2,-DIMETIL-1,1,2,2,-TETRAFENILSULFONATODISILANA
ABSTRAK
Reaksi esterifikasi antara asam oleat dengan gliserol dalam pelarut n-heksana menggunakan katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana telah menghasilkan 1,2,3-trioleilgliserol. Reaksi esterifikasi dilakukan dalam reaktor stainless steel dengan beberapa parameter reaksi untuk meningkatkan perolehan trioleilgliserol. Pengaruh suhu reaksi (160°C and 180°C), rasio mol gliserol : asam oleat (1:3 dan 1:6) dan jumlah katalis 1 % berat dari asam oleat pada reaksi esterifikasi asam oleat telah dilakukan. Kondisi optimum yang diperoleh pada reaksi esterifikasi adalah pada suhu 180 oC, rasio mol 6 : 1 selama 20 jam. Analisis produk reaksi esterifikasi pada kondisi tersebut menunjukkan bahwa trioleilgliserol telah terbentuk. Pengujian produk reaksi esterifikasi dilakukan dengan spektroskopi FT-IR dan Kromatografi Gas. Kromatogram yang diperoleh menunjukkan bahwa 1,2,3-trioleilgliserol telah terbentuk dengan kadar 0,133%, 7,58% dan 8,01%.
PRODUCTION OF 1,2,3-TRIOLEYLGLYCEROL FROM ESTERIFICATION OF OLEIC ACID AND GLYCEROL
USING 1,2-DIMETHYL-1,1,2,2-TETRAPHENYL SULFONATODISILANE AS CATALYST
ABSTRACT
The esterification of oleic acid with glycerol and n-hexane as solvent using 1,2-dimethyl-1,1,2,2-tetraphenylsulfonatodisilane as catalyst have given 1,2,3-trioleylglycerol. The reactions was carried in stainless steel reactor with effects of various reaction parameters were optimized to obtain high yield of trioleylglycerol. The effects of temperature (160°C and 180°C), glycerol to oleic acid molar ratio (1:3 and 1:6) and 1 wt% catalyst on esterification efficiency of oleic acid were investigated. The optimum conditions of esterification reaction were at temperature 180°C, molar ratio 6:1 for 20 hours. Analysis of yield showed that at the optimum conditions trioleylglycerol were obtained. Obtained product from those reactions were characterized by FT-IR and Gas Chromatography. The Chromatogram showed the product were 1,2,3-trioleylglycerol with amount 0,133%, 7.58 % and 8,01 %, respectively.
PEMBUATAN 1,2,3-TRIOLEILGLISEROL DARI ESTERIFIKASI ASAM OLEAT DENGAN GLISEROL MENGGUNAKAN KATALIS
1,2,-DIMETIL-1,1,2,2,-TETRAFENILSULFONATODISILANA
SKRIPSI
ANITA EKA JULYA BANJARNAHOR 110802048
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PEMBUATAN 1,2,3-TRIOLEILGLISEROL DARI ESTERIFIKASI ASAM OLEAT DENGAN GLISEROL MENGGUNAKAN KATALIS
1,2,-DIMETIL-1,1,2,2,-TETRAFENILSULFONATODISILANA
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
ANITA EKA JULYA BANJARNAHOR 110802048
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul :
Kategori : Skripsi
Nama : Anita Eka Julya Banjarnahor Nomor Induk Mahasiswa : 110802048
Program Studi : Sarjana (S1) Kimia Departemen : Kimia
Fakultas :
Disetujui di
Medan, Oktober 2015
Komisi Pembimbing :
Pembimbing 2, Pembimbing 1,
Dr. Nimpan Bangun, M.Sc Prof. Dr. Seri Bima Sembiring, M.Sc NIP: 195012221980031002 NIP: 194907181976031001
Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
Dr.Rumondang Bulan,MS NIP: 195408301985032001
Pembuatan 1,2,3-trioleilgliserol dari Esterifikasi Asam Oleat dengan Gliserol Menggunakan Katalis 1,1-dimetil- 1,1,2,2- tetrafenilsulfonatodisilana
PERNYATAAN
PEMBUATAN 1,2,3-TRIOLEILGLISEROL DARI ESTERIFIKASI ASAM OLEAT DENGAN GLISEROL MENGGUNAKAN
KATALIS 1,2, -DIMETIL-1,1,2,2,-TETRAFENIL SULFONATODISILANA
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Oktober 2015
PENGHARGAAN
Puji dan syukur penulis haturkan kepada Tuhan Yesus Kristus sebab atas berkat dan rahmatNya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini dengan baik.
Dengan rasa hormat penulis mengucapkan banyak terima kasih kepada Bapak Prof. Dr. Seri Bima Sembiring, M.Sc selaku dosen pembimbing I dan kepada Bapak Dr. Nimpan Bangun, M.Sc selaku dosen pembimbing II yang yang telah memberikan motivasi, wawasan ilmu kimia, mengajarkan keterampilan kerja maupun penulisan laporan hasil penelitian, serta dukungan dana selama penulis melakukan penelitian. Terima kasih kepada Ibu Dr. Rumondang Bulan, MS dan Bapak Dr. Albert Pasaribu, M.Sc selaku Ketua dan Sekretaris Departemen Kimia yang telah memberikan dukungan selama penyelesaian skripsi ini, kepada Ibu Cut Fatimah Zuhra, S.Si, M.Si selaku dosen pembimbing akademik, staf dosen Lab. Kimia Anorganik serta seluruh dosen dan staf pegawai yang telah memberikan bimbingan kepada penulis.
Penulis juga mengucapkan rasa terima kasih yang sebesar-besarnya kepada ayah dan ibu tercinta H. Banjarnahor dan T. Simarmata yang telah banyak berkorban selama ini hingga penulis dapat menyelesaikan masa studi serta kedua adikku tersayang Diego Jundo Oscario Banjarnahor dan Fery Afrizal Lenon Banjarnahor yang selalu mendoakan penulis.
Akhirnya dengan segala kerendahan hati penulis juga sangat berterima kasih kepada orang-orang yang telah banyak membantu terutama kepada Pak Justaman, asisten Lab. Kimia Anorganik Bang Rizal, Bang Paulus, Bang Fantoso, Bang Mars, Kak Lois, Kak Wiyanti, Kak Rahel, Kak Nabila, Kak Tionerlis, Daniel, Juwita, Suryati, Baron, Freddy, Rendi, Lince dan Claresta. Sahabat-sahabatku stambuk 2011 terutama teman seperjuangan serta teman-teman lainnya yang tidak bisa penulis sebutkan satu persatu. Kiranya Tuhan yang akan membalas semua kebaikan yang telah dilakukan untuk penulis.
Penulis menyadari karena keterbatasan penulis sehingga skripsi ini masih jauh dari kesempurnaan. Semoga skripsi ini dapat bermanfaat bagi siapa saja yang membacanya demi kemajuan ilmu pengetahuan.
PEMBUATAN 1,2,3-TRIOLEILGLISEROL DARI ESTERIFIKASI ASAM OLEAT DENGAN GLISEROL MENGGUNAKAN KATALIS
1,2,-DIMETIL-1,1,2,2,-TETRAFENILSULFONATODISILANA
ABSTRAK
Reaksi esterifikasi antara asam oleat dengan gliserol dalam pelarut n-heksana menggunakan katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana telah menghasilkan 1,2,3-trioleilgliserol. Reaksi esterifikasi dilakukan dalam reaktor stainless steel dengan beberapa parameter reaksi untuk meningkatkan perolehan trioleilgliserol. Pengaruh suhu reaksi (160°C and 180°C), rasio mol gliserol : asam oleat (1:3 dan 1:6) dan jumlah katalis 1 % berat dari asam oleat pada reaksi esterifikasi asam oleat telah dilakukan. Kondisi optimum yang diperoleh pada reaksi esterifikasi adalah pada suhu 180 oC, rasio mol 6 : 1 selama 20 jam. Analisis produk reaksi esterifikasi pada kondisi tersebut menunjukkan bahwa trioleilgliserol telah terbentuk. Pengujian produk reaksi esterifikasi dilakukan dengan spektroskopi FT-IR dan Kromatografi Gas. Kromatogram yang diperoleh menunjukkan bahwa 1,2,3-trioleilgliserol telah terbentuk dengan kadar 0,133%, 7,58% dan 8,01%.
PRODUCTION OF 1,2,3-TRIOLEYLGLYCEROL FROM ESTERIFICATION OF OLEIC ACID AND GLYCEROL
USING 1,2-DIMETHYL-1,1,2,2-TETRAPHENYL SULFONATODISILANE AS CATALYST
ABSTRACT
The esterification of oleic acid with glycerol and n-hexane as solvent using 1,2-dimethyl-1,1,2,2-tetraphenylsulfonatodisilane as catalyst have given 1,2,3-trioleylglycerol. The reactions was carried in stainless steel reactor with effects of various reaction parameters were optimized to obtain high yield of trioleylglycerol. The effects of temperature (160°C and 180°C), glycerol to oleic acid molar ratio (1:3 and 1:6) and 1 wt% catalyst on esterification efficiency of oleic acid were investigated. The optimum conditions of esterification reaction were at temperature 180°C, molar ratio 6:1 for 20 hours. Analysis of yield showed that at the optimum conditions trioleylglycerol were obtained. Obtained product from those reactions were characterized by FT-IR and Gas Chromatography. The Chromatogram showed the product were 1,2,3-trioleylglycerol with amount 0,133%, 7.58 % and 8,01 %, respectively.
DAFTAR ISI
3.3.1. Esterifikasi Asam Oleat dengan Gliserol 18
3.4. Bagan Penelitian 19
Bab 4. HASIL DAN PEMBAHASAN 20 4.1. Esterifikasi Asam Oleat dengan Gliserol ( 3 : 1 mol ) 20
pada suhu 160 oC
4.2. Esterifikasi Asam Oleat dengan Gliserol ( 3 : 1 mol ) pada 24
suhu 180 oC
4.3. Esterifikasi Asam Oleat dengan Gliserol ( 6 : 1 mol ) pada 27 suhu 180 oC
Bab 5. KESIMPULAN DAN SARAN 31
5.1.Kesimpulan 31
5.2 Saran 31
Daftar Pustaka 32
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar
1.1. Tahapan Reaksi Pembentukan 2 1,3-dioleil, 2-palmitoilgliserol
1.2. Reaksi Pembentukan Trimetilolpropana Trioleat 2 2.1. Reaksi Umum Esterifikasi Antara Gliserol dan 7
Asam Lemak
2.2. Reaksi Umum Pembentukan Trigliserida 9
2.3. Mekanisme Reaksi Esterifikasi Asam Lemak dengan 10 Katalis Asam
2.4. Reaksi Umum Pembentukan Gliserol 11
2.5. Struktur Asam Oleat 11
2.6. Struktur Molekul 1,2,3-Trioleilgliserol 12 3.4.1. Bagan Penelitian Esterifikasi Asam Oleat dengan Gliserol 18 4.1. Reaksi Esterifikasi Antara Asam Oleat dengan Gliserol
4.2. Kromatogram Hasil Reaksi Esterifikasi Asam Oleat 22 dengan Gliserol (3:1 mol) pada suhu 160 oC
4.3. Spektrum FT-IR Produk Reaksi Esterifikasi Asam Oleat 24 dengan Gliserol (3:1 mol) pada suhu 160 oC
4.4. Kromatogram Hasil Reaksi Esterifikasi Asam Oleat 25 dengan Gliserol (3:1 mol) pada suhu 180 oC
4.5. Spektrum FT-IR Produk Reaksi Esterifikasi Asam Oleat 26 Dengan Gliserol (3:1 mol) pada suhu 180 oC
4.6. Kromatogram Hasil Reaksi Esterifikasi Asam Oleat 28 dengan Gliserol (6:1 mol) pada suhu 180 oC
DAFTAR TABEL
Nomor Judul Halaman
Tabel
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lampiran
1 Spektrum FT-IR Asam Oleat 93% sebagai senyawa 30
DAFTAR SINGKATAN
COC = Cool Coloumn Chromatography
DMTFS = Dimethyl Tetraphenyl Sulfonato Disilane FFA = Free Fatty Acid
FT-IR = Fourier Transform – Infra Red GC = Gas Chromatography