ABSTRACT
TAURINE EFFECT ON SUPEROXIDE DISMUTASE ENZYME ACTIVITY, MALONDIALDEHYDE AND HEPAR HISTOLOGY OF
MICE INDUCED BY GLYPHOSATE HERBICIDE
By
Elfa Verda Puspita
Glyphosate herbicide widely used by farmers in Indonesia. As a result of exposure to herbicides, the production of free radicals or ROS exceeds the body's defense system called oxidative stress. Due to oxidative stress, the activity of antioxidant enzymes in the body decline and thus can cause tissue damage and certain organ dysfunction. ROS can be suppressed by administration of antioxidants. One source of the antioxidant is taurine. Taurine has a protective effect against oxidation and free radical capture in a variety of cells and tissues against toxic oxidant component. This study aims to determine the effect of taurine on the liver of mice induced herbicide glyphosate on the activity of the enzyme superoxide dismutase (SOD), malondialdehida (MDA), changes in morphology and structure of liver histology. The research used completely randomized design (CRD). Mice were divided into three treatment groups such as control group (K0), a group of glyphosate (K1) at a dose of 25 mg /kg BW/day orally for 25 days, and a group of taurine+glyphosate (K2) at a dose of taurine 7800 mg/kg BW/day + glyphosate dose 25 mg/kg BW/day orally for 25 days. Each treatment consisted of 8 mice as replication. Results of analysis with one ways ANOVA (P<0,05) followed by the Tukey test showed taurine dose of 7800 mg/kg BW/day can reduce liver cells of male mice that were treated by the herbicide glyphosate induction but it not be able to increase the levels of SOD and to decrease MDA levels.
ABSTRAK
PENGARUH TAURIN TERHADAP AKTIVITAS ENZIM SUPEROKSIDA DISMUTASE, MALONDIALDEHIDA, DAN HISTOLOGI PADA HATI
MENCIT (Mus musculus) JANTAN YANG DIINDUKSI HERBISIDA GLIFOSAT
Oleh
Elfa Verda Puspita
Herbisida glifosat banyak digunakan secara luas oleh para petani di Indonesia. Akibat paparan herbisida, produksi radikal bebas atau ROS melebihi sistem pertahanan tubuh yang disebut stres oksidatif. Akibat stres oksidatif, maka aktivitas enzim antioksidan di dalam tubuh mengalami penurunan sehingga dapat menyebabkan kerusakan jaringan dan disfungsi organ tertentu. ROS dapat diredam dengan pemberian antioksidan. Salah satu sumber antioksidan adalah taurin. Taurin memiliki efek perlindungan melawan oksidasi dan menangkap radikal bebas dalam berbagai sel dan jaringan melawan toksik dari komponen oksidan. Penelitian ini bertujuan untuk mengetahui pengaruh taurin pada hati mencit yang diinduksi herbisida glifosat terhadap aktivitas enzim superoksida dismutase (SOD), malondialdehida (MDA), perubahan morfologi dan struktur histologi hati mencit jantan. Penelitian menggunakan Rancangan Acak Lengkap (RAL). Mencit dibagi ke dalam tiga kelompok perlakuan, yaitu kelompok kontrol (K0), kelompok glifosat (K1) dengan dosis 25 mg/kg BB/hari secara oral selama 25 hari, dan kelompok taurin+glifosat (K2) dengan dosis taurin 7800 mg/kg BB/hari+dosis glifosat 25 mg/kg BB/hari secara oral selama 25 hari. Masing-masing perlakuan terdiri dari 8 ekor mencit sebagai ulangan. Hasil analisis dengan one ways Anova (P<0,05) dilanjutkan uji Tukey menunjukkan taurin dengan dosis 7800 mg/kg BB/hari dapat mereduksi sel-sel hati mencit jantan yang mengalami kerusakan akibat induksi herbisida glifosat tetapi belum mampu meningkatkan kadar SOD dan menurunkan kadar MDA.
PENGARUH TAURIN TERHADAP AKTIVITAS
ENZIM SUPEROKSIDA DISMUTASE, MALONDIALDEHIDA DAN HISTOLOGI PADA HATI MENCIT (Mus musculus) JANTAN YANG
DIINDUKSI HERBISIDA GLIFOSAT
Oleh
ELFA VERDA PUSPITA
Tesis
Sebagai Salah Satu Syarat Untuk Mencapai Gelar MAGISTER SAINS
Pada
Program Studi Magister Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
PROGRAM PASCASARJANA MAGISTER BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
PENGARUH TAURIN TERHADAP AKTIVITAS
ENZIM SUPEROKSIDA DISMUTASE, MALONDIALDEHIDA DAN HISTOLOGI PADA HATI MENCIT (Mus musculus) JANTAN YANG
DIINDUKSI HERBISIDA GLIFOSAT
(Tesis)
Oleh
Elfa Verda Puspita
PROGRAM PASCASARJANA MAGISTER BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
DAFTAR GAMBAR
Halaman
Gambar 1. Rumus bangun glifosat (N-phosphonomethyl-glycine)...10
Gambar 2. Mekanisme aksi glifosat pada tanaman...11
Gambar 3. Histologi hati mencit ...…... 15
Gambar 4. Sistem oksigen reaktif... 17
Gambar 5. Proses peroksidasi lipid... 19
Gambar 6. Reaksi MDA dengan TBA ... 19
Gambar 7. Prinsip dasar pengukuran SOD ... 22
Gambar 8. Rumus bangun taurin ... 23
Gambar 9. Gambaran mikroskopis hepatosit dengan pewarnaan HE ... 34
Gambar 10. Bagan rancangan penelitian... 36
Gambar 11. Struktur histologis hati mencit... ... 39
Gambar 12. Rerata (±SE) kadar enzim SOD dan MDA hati mencit percobaan... 43
Gambar 13. Pemeliharaan mencit... 67
Gambar 14. Taurin, glifosat Roundup dan kit Ransod® ... 67
Gambar 15. Pembuatan homogenat hati... 68
Gambar 16. Pembacaan aktivitas enzim menggunakan spektrofotometer... 68
DAFTAR ISI
Halaman
HALAMAN PERSETUJUAN... i
ABSTRAK.... ... ii
DAFTAR ISI... iii
DAFTAR GAMBAR... v
DAFTAR TABEL... vi
I. PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian... 4
1.3 Manfaat Penelitian... 5
1.4 Kerangka Pikir... 5
1.5 Hipotesis... .... 6
II. TINJAUAN PUSTAKA 2.1 Herbisida Glifosat... 7
2.2 Hati ... 13
2.3 Reactive Oxygen Species (ROS)... 16
2.4 Malondialdehida... 18
2.5 Antioksidan... 20
2.5.1 Superoksida Dismutase... 20
2.6 Taurin... 23
III. METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian... 26
3.2 Alat dan Bahan... 26
3.3 Rancangan Percobaan... 27
3.4 Parameter... 27
3.5 Pelaksanaan... 28
3.5.1 Aklimasi Hewan Uji... 28
3.5.2 Perlakuan Hewan Uji... 28
3.5.3 Pembuatan Homogenat Hati... 29
3.5.4 Analisis Aktivitas Enzim SOD pada Hati Mencit... 29
3.5.5 Pemeriksaan Kadar MDA... 30
3.5.6 Pembuatan Preparat Sayatan Hati... 31
3.5.7 Pengamatan Histologi……….... 33
3.5.8 Pengamatan Berat Badan Mencit... 35
4.1 Hasil Penelitian... 37
4.1.1 Berat Badan Mencit... 37
4.1.2 Berat Hati Mencit... 38
4.1.3 Histologi Hati Mencit... 39
4.1.3.1 Gambaran Histologi Hati Mencit... 39
4.1.3.2 Analisis Mikroskopoik Kerusakan Sel Hati Mencit.. 41
4.1.4 Kadar SOD dan MDA Hati Mencit... 42
4.2 Pembahasan... 43
4.2.1 Berat Badan Mencit... 43
4.2.2 Berat Hati Mencit... 45
4.2.3 Histologi Hati Mencit... 46
4.2.4 Kadar SOD dan MDA Hati Mencit... 48
V. SIMPULAN DAN SARAN 5.1 Simpulan... 51
5.2 Saran... 51
DAFTAR PUSTAKA
DAFTAR TABEL
Halaman Tabel 1. Dosis pada tiap kelompok perlakuan ... 28 Tabel 2. Kriteria penilaian derajat histopatologi sel hepar model Skoring
Histopathology Manja Roenigk...33 Tabel 3. Rerata berat badan mencit selama percobaan pada hari ke-1,
RIWAYAT HIDUP
Penulis dilahirkan di Kotabumi, pada tanggal 20 Agustus 1982 yang merupakan
putri pertama pasangan Bapak Drs. Arie Moestofa, AS dan Ibu Khalijah, A.Md.
Penulis menyelesaikan pendidikan dasar di Sekolah Dasar Negeri 1 Kotabumi
pada tahun 1994, Sekolah Lanjutan Tingkat Pertama Negeri 1 Kotabumi pada
tahun 1997, Sekolah Menengah Umum Negeri 1 Kotabumi pada tahun 2000,
Sarjana sains jurusan Biologi Fakultas Matematika dan Ilmu Penegtahuan Alam,
Universitas Lampung tahun 2006.
Pada tahun 2013 penulis terdaftar sebagai mahasiswa Program Studi Magister
Biologi Fakultas Matematika dan Ilmu Penegtahuan Alam, Universitas Lampung,
SANWACANA
Alhamdulillah puji syukur kehadirat Allah SWT karena atas rahmat dan karunia-Nya penulis dapat menyelesaikan Tesis yang berjudul “Pengaruh Taurin terhadap Aktivitas Enzim Superoksida Dismutase, Malondialdehida, dan Histologi pada Hati Mencit (Mus musculus) Jantan yang Diinduksi Herbisida Glifosat”. Ucapan terimakasih dan penghargaan sebesar-besarnya penulis tujukan kepada semua pihak yang telah membantu sejak mulai kegiatan sampai terselesaikannya tesis ini, ucapan tulus penulis sampaikan kepada:
1. Bapak Dr. G. Nugroho Susanto, M.Sc., sebagai pembimbing pertama yang telah banyak memberikan bimbingan, pengarahan, saran dan kritik selama penulisan tesis ini.
2. Bapak Dr. Sumardi, M.Si., sebagai pembimbing kedua dan Ketua Program Studi magister Biologi FMIPA Universitas Lampung yang telah banyak banyak memberikan bimbingan, pengarahan, saran dan kritik selama penulisan tesis ini.
3. Ibu Endang Linirin Widiastuti, Ph.D., sebagai pembahas atas saran, kritik, bimbingan sehingga tesis ini terselesaikan.
4. Bapak Prof. Dr. Sudjarwo, M.S., sebagai Direktur Program Pascasarjana Universitas Lampung.
6. Suami tercinta, H. Handrie Kurniawan, S.E, M.IP., yang telah memberikan banyak dukungan moril, materi, do’a dan pengertian serta anak-anakku tersayang, M. Sayyid Hilmi, M. Farhan Syakur, Afifah Syifa Azzahra, Aqilah Fatin Salsabila yang menjadi inspirasi penulis.
7. Papa dan Mama tercinta atas do’a dan dukungannya selalu.
8. Bapak dan ibu dosen, staf beserta laboran Jurusan Biologi FMIPA Unila atas ilmu dan pengalaman yang banyak diberikan kepada penulis.
9. Teman-temanku satu angkatan tersayang, Henny Marlinda, M.Si., Arini Pradita Roselin, M.Si., Annisa Agatha, M.Si., Rr. Etty Puspitaningsih, M.Si., Alia Larasati Djausal, M.Si., Erika, M.Si., dan Bapak Salman Alfarisi, M.Si, atas ukhuwah dan kebersamaan kepada penulis.
10.dr. Tiwuk Susantiningsih, M.Biomed, dr. Fitria Saftarina, M.Si., dr. Susianti, M.Si, Bu Nuriah, A.Md yang telah banyak membantu penulis. 11.Semua pihak yang telah banyak membantu penulis, yang tidak dapat
disebutkan satu persatu.
12.Almamater tercinta Universitas lampung.
Penulis berharap semoga Allah SWT membalas kebaikan yang telah mereka berikan dan semoga tesis ini bermanfaat. Jazakumullah Khoiron Katsiro.
Bandar lampung, Juli 2015 Penulis
I. PENDAHULUAN
1.1 Latar Belakang
Roundup adalah herbisida yang menggunakan bahan aktif glifosat yang banyak digunakan di dunia. Glifosat (N-phosphonomethyl-glycine) digunakan untuk mengontrol gulma dan rumput liar pada berbagai tanaman pertanian, seperti padi, jagung, dan kacang kedelai (Jasper et al, 2012). Glifosat paling banyak digunakan petani di Indonesia, terutama dalam budidaya jagung dengan sistem TOT (tanpa olah tanah) (Faqihhudin et al, 2014). Glifosat bekerja menghambat metabolisme tanaman dan beberapa hari setelah penyemprotan, tumbuhan menjadi layu, kuning, dan akhirnya mati. Herbisida glifosat mengandung bahan kimia yang membuat herbisida menempel pada daun sehingga glifosat dapat bergerak dari permukaan tumbuhan ke dalam sel tumbuhan (Djau, 2009).
2
Jasper et al (2012) menyatakan bahwa glifosat dapat memacu kerusakan hematologikal dan perubahan pada hati ketika diberi paparan hingga subakut. Kerusakan hematologikal ini berkaitan dengan adanya induksi Reactive Oxygen Species (ROS). ROS adalah senyawa pengoksidasi turunan oksigen yang
bersifat sangat reaktif yang terdiri atas kelompok radikal bebas dan kelompok non radikal. Kelompok radikal bebas antara lain superoxide anion (O2-) dan hydroxyl radical (OH-), serta non radikal misalnya hydrogen peroxide (H2O2). Senyawa oksigen reaktif ini dihasilkan dalam proses metabolisme oksidatif dalam tubuh, misalnya pada proses oksidasi katabolisme makanan menjadi energi (Harish dan Murugan, 2011).
Radikal bebas memainkan peran penting dalam toksisitas pestisida. Penelitian
Banks dan Soliman (1997) menunjukkan bahwa toksisitas yang diinduksi oleh karbamat memacu stres oksidatif dan perubahan pada sistem pertahanan
oksidatif. Pada kondisi stres oksidatif, imbangan normal antara produksi radikal bebas atau senyawa oksigen reaktif dengan kemampuan antioksidan alami tubuh untuk mengeliminasinya mengalami gangguan sehingga menggoyahkan rantai reduksi-oksidasi normal, akibatnya menyebabkan kerusakan oksidatif jaringan (Arief, 2008; Arsana, 2014).
Ozden et al (2012) mengatakan bahwa pemberian methiocarb (MC) pada tikus Wistar meningkatkan peroksidasi lipid yang diukur dengan produk akhirnya yaitu malondialdehyde (MDA) yang meningkat pada hati dan ginjal. Suarsana et al (2013) mengatakan bahwa stres oksidatif pada tikus menyebabkan kadar enzim superoksida dismutase (SOD) menurun dan malonaldehid (MDA) hati meningkat. Namun demikian, pemberian isoflavon sebagai antioksidan dapat mengatasi penurunan SOD dan mencegah naiknya kadar MDA pada jaringan hati tikus pada kondisi stres.
Taurin (2-aminoethanesulfonic acid) adalah asam amino bebas yang melimpah dan terdapat banyak pada jaringan mammalia. Taurin adalah antioksidan yang diketahui memiliki berbagai fungsi fisiologis dalam metabolisme sel, termasuk osmoregulasi, stabilisasi membran, detoksifikasi, dan pengaturan homeostatis kalsium seluler (Huxtable, 1992). Taurin memiliki efek perlindungan melawan oksidasi yang diinduksi oleh tekanan selular dan menangkap radikal bebas dalam berbagai sel dan jaringan melawan toksik dari komponen oksidan
4
antioksidan, seperti superoksida dismutase dan glutathione peroksidase, yang diberi paparan xenobiotik (Abbasoglu et al, 2001; Tabassum et al, 2007; Ozden et al, 2012; Akay et al, 2013).
Taurin memberikan efek perlindungan terhadap sel dan jaringan melawan oksidan termasuk glifosat. Pada penelitian ini dilakukan pengujian efek
senyawa taurin pada hati mencit secara in vivo yang diinduksi dengan herbisida glifosat. Sejauh ini belum pernah dilakukan penelitian tentang efek
perlindungan taurin pada hati mencit yang diinduksi herbisida glifosat dengan parameter kadar SOD, MDA, perubahan morfologi, dan histologi hati mencit. Oleh karena itu dalam penelitian ini dilakukan uji efek perlindungan dari senyawa taurin terhadap hati mencit jantan (Mus musculus). Penelitian ini dilakukan sebagai pengembangan ilmu terkait fungsi taurin secara fisiologis, juga diperolehnya informasi yang terkait penggunaan taurin sebagai antioksidan baik secara preventif ataupun kuratif bagi masyarakat yang menggunakan herbisida atau terpapar herbisida.
1.2 Tujuan Penelitian
1.3 Manfaat Penelitian
Dari penelitian ini diharapkan akan didapat hasil pengembangan ilmu terkait fungsi taurin secara fisiologis, juga pengembangan informasi yang mendukung penggunaan taurin sebagai antioksidan oleh masyarakat yang menggunakan herbisida sebagai tindakan preventif terjadinya stres oksidatif.
1.4 Kerangka Pikir
Stres oksidatif merupakan suatu kondisi ketidakseimbangan antara produksi radikal bebas dengan antioksidan, yaitu pada saat kadar radikal bebas lebih tinggi dibandingkan antioksidan. Kondisi tersebut dipengaruhi oleh faktor internal seperti genetik, umur, oksidasi fosforilasi, proses patofisiologi, dan faktor eksternal seperti asupan makanan, patogen, sinar ultra violet, dan bahan kimia termasuk herbisida.
6
Aktivitas antioksidan dapat ditingkatkan agar mencegah terjadinya stres
oksidatif sehingga diperlukan antioksidan dari luar tubuh. Antioksidan tersebut akan meredam radikal bebas dengan cara mendonorkan elektronnya baik pada tahap inisiasi, propagasi maupun tahap terminasi. Salah satu sumber antioksidan adalah taurin. Taurin adalah antioksidan yang diketahui memiliki berbagai fungsi fisiologis dalam metabolisme sel, termasuk osmoregulasi, stabilisasi membran, dan detoksifikasi. Taurin memiliki efek perlindungan melawan oksidasi yang dinduksi tekanan seluler dan menangkap radikal bebas dalam berbagai sel dan jaringan, sehingga aktivitas enzim antioksidan menurun pada saat stres oksidatif dapat meningkat dan berakibat mengurangi tingkat
kerusakan jaringan oksidatif.
1.5 Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah:
1.Pemberian taurin dapat mereduksi sel-sel hati mencit (Mus musculus) jantan yang mengalami kerusakan akibat induksi herbisida glifosat.
II. TINJAUAN PUSTAKA
2.1 Herbisida Glifosat
Herbisida merupakan suatu bahan atau senyawa kimia yang digunakan untuk menghambat pertumbuhan atau mematikan tumbuhan. Herbisida bersifat racun pada gulma atau tumbuhan pengganggu juga terhadap tanaman. Pemberantasan gulma terjadi karena herbisida mengubah pengaruh bahan kimia di dalam jaringan gulma, yang dapat mematikan jaringan itu atau merusak suatu sistem fsiologis yang dibutuhkan untuk hidup atau pertumbuhan. Bila pernafasan, fotosintesis, pembelahan sel, dan pemanjangan sel terganggu gulma akan menghabiskan cadangan energi. Tanpa fotosintesis gulma tidak akan mampu menyaingi tanaman dalam hal memperebutkan larutan hara (Riadi, 2011).
Penggunaan herbisida dengan dosis besar dan dilakukan secara terus menerus akan menimbulkan beberapa kerugian, antara lain residu herbisida akan terakumulasi pada produk-produk pertanian, pencemaran pada lingkungan pertanian, penurunan produktivitas, keracunan pada hewan, keracunan pada manusia yang berdampak buruk terhadap kesehatan. Manusia akan mengalami keracunan baik akut maupun kronis yang berdampak pada kematian (Kishi et al, 1993). Organisasi Kesehatan Dunia (WHO) memperkirakan setiap tahun
8
tingkat kematian mencapai 220.000 korban jiwa. Sekitar 80% keracunan dilaporkan terjadi di negara-negara sedang berkembang (Peduto et al, 1996).
Cara masuk herbisida ke dalam tubuh menentukan kecepatan penyerapan, sehingga berpengaruh pada intensitas dan durasi keracunan. Herbisida masuk ke dalam tubuh melalui beberapa jalur yaitu : (1) oral/mulut; (2) respirasi /
pernafasan; (3) penetrasi kulit/perkutan. Absorbsi herbisida dalam tubuh tidak hanya melalui satu jalur tapi dapat merupakan kombinasi dari beberapa jalur
(Ngatidjan dan Mustofa, 2006). Menurut O’Malley (2007) jalur utama adalah
absorbsi kulit. Cara absorbsi yang paling berbahaya secara epidemologi melalui terhirup (inhalasi) karena bahan berbentuk gas atau partikel, sehingga
memudahkan racun masuk ke dalam peredaran darah (Suwastika, 2009).
Levine (1991) menyatakan bahwa pemaparan terhadap pestisida maupun herbisida dapat berupa :
1.Blood dyscrasia dan neoplasia
Hasil toksikologi menyatakan pemaparan lama terhadap herbisida dapat menyebabkan terjadinya blood discrasia dan kanker pada organ-organ tubuh. 2.Gangguan reproduksi
Gangguan reproduksi yang dapat terjadi : (a) disfungsi seksual; (b)
3.Gangguan sistem syaraf
Apabila tubuh terpapar herbisida secara berulang dan dalam jangka waktu lama, maka mekanisme kerja enzim cholinesterase terganggu. Enzim cholinesterase berfungsi memecah acetilcholine menjadi choline dan asam asetat.
Acetilcholine berfungsi dalam menghantarkan impuls syaraf (Sutarni et al, 1996). Ketika herbisida memasuki tubuh manusia atau hewan, herbisida menempel pada enzim cholinesterase. Enzim cholinesterase tidak dapat memecah acetilcholine, sehingga impuls syaraf mengalir terus (konstan) menyebabkan suatu twiching yang cepat dari otot-otot dan akhirnya mengarah kepada kelumpuhan (Djau, 2009).
4.Sistem imunologi
Pemaparan pestisida dapat menyebabkan gangguan kemotaksis neutrofil, sehingga memudahkan terjadinya penyakit infeksi pada kelompok yang terpapar herbisida.
5.Efek pada respiratori
Pemaparan herbisida dapat terjadinya asma dan gangguan sistem pernafasan. 6.Penyakit kulit
Penyakit kulit yang sering terjadi akibat pemaparan herbisida adalah dermatitis iritan dan dermatitis alergika.
7.Hati/liver
Hati adalah organ yang berfungsi menetralkan bahan-bahan kimia beracun, maka hati itu sendiri seringkali rusak akibat herbisida. Hal ini dapat
10
Salah satu jenis herbisida yang banyak digunakan adalah herbisida glifosat, karena glifosat efektif dalam membunuh berbagai tanaman, termasuk rumput, tanaman berdaun lebar dan tanaman berkayu. Glifosat juga dikenal dengan nama dagang Roundup adalah herbisida spektrum luas. Glifosat (N-phosphonomethyl-glycine) diformulasikan sebagai garam isopropilamin. Glifosat mengganggu aktivitas enzim EPSPS (5-asam enolpyruvylshikimic-3- phosphate synthase) yang penting untuk sintesis asam amino aromatik (fenilalanin, triptofan, dan tirosin) karena berkompetisi dengan fosfoenolpiruvat (Riadi, 2011).
Nama Umum : Glifosat
Nama Kimia : [(phosphonomethyl)amino] acetic acid Rumus Empiris : C3H8NO5P
Rumus Bangun :
Mekanisme aksi glifosat pada tanaman dapat dilihat pada Gambar 2 berikut ini.
Gambar 2. Mekanisme aksi glifosat pada tanaman (Williams et al, 2000)
Zainul et al (2010) mengatakan bahwa pemberian isopropilamin glifosat terhadap tikus wistar betina berpengaruh terhadap fungsi reproduksi ovarium yaitu
12
direkomendasikan pada lahan pertanian dan efek ini meningkat dengan pemberian konsentrasi dan lama waktu pemaparan glifosat.
Jasper et al (2012) mengatakan bahwa pemaparan glifosat terhadap mencit albino Swiss jantan dan betina mengakibatkan toksik pada hati, kerusakan hematologikal dan efek oksidatif. Hal ini berkaitan dengan induksi ROS (Reactive Oxygen Species). ROS adalah senyawa pengoksidasi turunan oksigen yang bersifat sangat reaktif yang terdiri atas kelompok radikal bebas dan non radikal.
Radikal bebas adalah atom atau molekul yang mempunyai elektron yang tidak berpasangan pada orbital terluarnya dan dapat berdiri sendiri. Kebanyakan radikal bebas bereaksi secara cepat dengan atom lain untuk mengisi orbital yang tidak berpasangan, sehingga radikal bebas normalnya berdiri sendiri hanya dalam periode waktu yang singkat sebelum menyatu dengan atom lain (Surya, 2011).
Tubuh dilengkapi oleh seperangkat sistem pertahanan antioksidan untuk
menangkal serangan radikal bebas atau oksidan. Sistem pertahanan antioksidan ini antara lain adalah enzim Superoxide Dismutase (SOD) yang terdapat di
mitokondria dan sitosol, Glutathione Peroxidase (GPx), Glutathione reductase (GR) dan catalase (CAT). Selain itu, terdapat juga sistem pertahanan atau
Surya (2011) mengatakan bahwa pada saat tertentu, seperti diberi paparan herbisida atau zat kimia toksik lainnya, produksi radikal bebas meningkat atau ROS melebihi sistem pertahanan tubuh, hal inilah yang disebut stres oksidatif. Pemberian MC (methiocarb) dan TAA (thioacetamide) pada tikus meningkatkan kadar malondialdehyde (MDA) (Abbasoglu et al, 2001; Ozden et al, 2012).
2.2. Hati
Hati merupakan organ parenkim yang berukuran terbesar dan memegang peranan penting dalam proses metabolisme tubuh. Selain itu, hati / hepar memiliki banyak fungsi antara lain untuk menyimpan dan menyaring darah, mengatur kadar
glukosa dalam darah, membentuk protein plasma seperti albumin, menghasilkan cairan empedu, sebagai tempat penyimpanan vitamin A dan besi, dan mampu mendetoksifikasi berbagai obat dan toksik menjadi inaktif atau larut air (Guyton dan Hall, 1997). Diketahui hati merupakan organ pertama yang dicapai oleh obat-obatan dan zat lain yang diabsorpsi usus melalui vena porta, sehingga disebutkan bahwa hati adalah tempat utama metabolisme dan detoksifikasi obat. Penumpukan bahan-bahan toksik dalam parenkim hati dapat melukai sel hepatosit dan
menyebabkan terjadinya perubahan histopatologis yang bervariasi (Himawan, 1992).
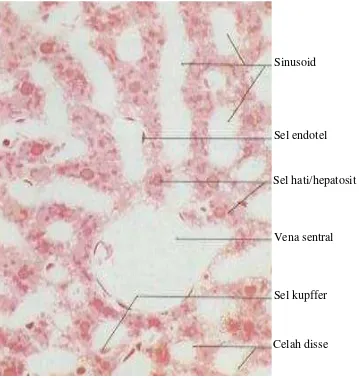
14
kontinyu sehingga memungkinkan plasma darah langsung berhubungan dengan sel-sel hepar, sehingga terjadi pertukaran metabolit antara darah dan parenkim hepar. Selain endotel, pada sinusoid juga terdapat sel Kupffer yang merupakan sel makrofag fagositik. Sel ini berfungsi memfagositosis eritrosit tua dan
membersihkan darah dari basilus kolon (Underwood, 1999; Fawcett, 2002).
Celah yang memisahkan sel-sel endotel dengan hepatosit disebut ruang
perisinusoidal (ruang Disse), yang berisi mikrovili dari hepatosit. Ruang Disse ini terdapat sel stelata atau sel penimbun lemak (sel Ito) yang mampu menyimpan vitamin A yang diberikan dari luar. Sel Ito diduga berperan dalam pembentukan fibrosis hepar dengan cara sintesis kolagen (Underwood, 1999; Fawcett, 2002).
Sel hepatosit merupakan salah satu bagian yang terdapat di dalam organ hati. Sel hepatosit adalah sel parenkimal utama yang terdapat di dalam hati yang
Sinusoid hati memiliki lapisan endothelial berpori yang dipisahkan dari hepatosit oleh ruang disse (ruang sinusoida) (Sloane, 2003).
Gambar 3. Histologi hati mencit (Nurlaili, 2010)
Sinusoid
Sel endotel
Sel hati/hepatosit
Vena sentral
Sel kupffer
16
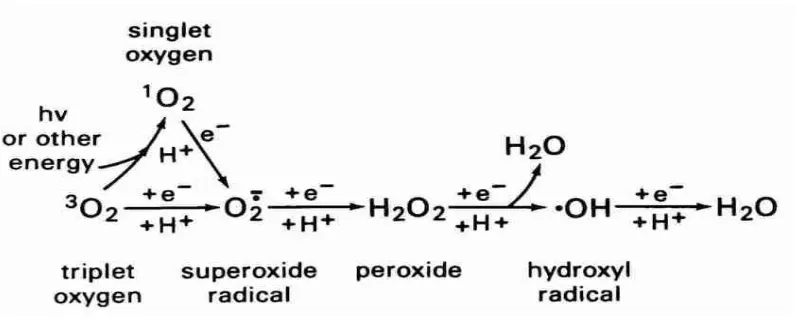
2.3 Reactive Oxygen Species (ROS)
Pengertian radikal bebas sering kali disamakan dengan oksidan karena keduanya
memiliki kemiripan sifat yakni agresivitas untuk menarik elektron di
sekelilingnya. Setiap radikal bebas adalah oksidan, tetapi tidak setiap oksidan
adalah radikal bebas. Oksidan adalah senyawa penerima elektron atau suatu
senyawa yang dapat menarik elektron (electron acceptor) seperti ion ferri yang berubah menjadi ferro (Fe 3+ + e- Fe 2+) (Winarsi, 2007).
Radikal bebas merupakan atom atau molekul yang mempunyai satu atau lebih elektron yang tidak berpasangan. Molekul ini sangat reaktif dan akan menyerang
molekul stabil di dekatnya sehingga menjadi radikal bebas (Kothari et al, 2010).
Dengan demikian maka radikal bebas akan memicu terjadinya reaksi berantai,
yang akhirnya menyebabkan kerusakan sel (Arief, 2008).
Ada dua bentuk umum dari radikal bebas yaitu ROS dan reactive nitrogen
species (RNS). Termasuk ROS di antaranya ion superoxide (O2-•), hydrogen
peroxide (H2O2), hydroxyl radical (OH•), dan peroxyl radical (OOH•).
Sementara RNS sering dianggap sebagai subklas dari ROS, di antaranya nitric
oxide (NO), nitrous oxide (N2O), peroxynitrite (NO3-), nitroxyl anion (HNO) dan
peroxynitrous acid (HNO3-) (Kothari et al, 2010).
Pembentukan ATP tersebut membutuhkan O2, tetapi tidak semua O2 berikatan dengan hidrogen untuk membentuk air, sekitar 4% - 5% berubah menjadi radikal bebas (Ngurah, 2007).
Radikal bebas diproduksi dalam sel yang secara umum melalui reaksi pemindahan elektron, menggunakan mediator enzimatik atau non enzimatik. Produksi radikal bebas dalam sel dapat terjadi secara rutin maupun sebagai reaksi terhadap
rangsangan. Secara rutin adalah superoksida yang dihasilkan melalui aktifasi fagosit dan reaksi katalisa seperti ribonukleotida reduktase. Pembentukan melalui rangsangan adalah kebocoran superoksida, hidrogen peroksida dan kelompok oksigen reaktif (ROS) lainnya pada saat bertemunya bakteri dengan fagosit teraktifasi. Pada keadaan normal sumber utama radikal bebas adalah kebocoran elektron yang terjadi dari rantai transport elektron, misalnya yang ada dalam mitokondria dan endoplasma retikulum dan molekul oksigen yang menghasilkan superoksida. Dalam kondisi yang tidak lazim seperti radiasi ion, sinar ultraviolet, dan paparan energi tinggi lainnya, dihasilkan radikal bebas yang sangat berlebihan (Arief, 2008).
[image:31.595.113.511.554.714.2]18
2.4 Malondialdehida
Peroksidasi lipid merupakan suatu marker kerusakan (oxidative injury) yang dipresentasikan sebagai malondialdehida (MDA). MDA merupakan senyawa toksik yang dapat mengganggu keutuhan membran sel, karena itu bila kadarnya tinggi, maka akan mengganggu berfungsinya sel (Winarsi et al, 2012).
Malondialdehida (MDA) dapat terbentuk apabila radikal bebas hidroksil seperti Reactive Oxygen Species (ROS) bereaksi dengan komponen asam lipid dari membran sel sehingga terjadi reaksi berantai yang dikenal dengan peroksidasi lipid. Peroksidasi lipid tersebut akan menyebabkan terputusnya rantai asam lipid menjadi berbagai senyawa toksik dan menyebabkan kerusakan pada membran sel (Yunus, 2001).
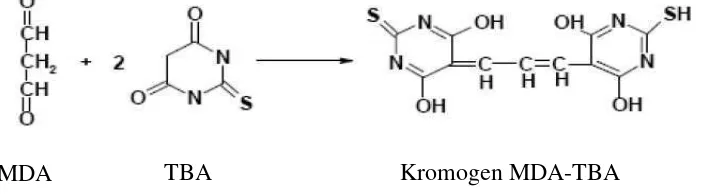
Gambar 5. Proses peroksidasi lipid (Yunus, 2001)
Gambar 6. Reaksi MDA dengan TBA (Yunus, 2001)
Peroksidasi lipid terjadi melalui beberapa tahapan reaksi yaitu inisiasi, propagasi dan terminasi :
Lipid (LH) penyusun membran sel biasanya berupa asam lemak tak jenuh ganda. Peroksidasi dimulai (inisiasi) dari abstraksi atom hidrogen pada gugus
metilen oleh ROS membentuk radikal karbon (L•). Apabila radikal karbon
bereaksi dengan oksigen maka akan terbentuk radikal peroksil (LOO•). Reaksi berikutnya adalah abstraksi atom hidrogen lipid lain oleh radikal peroksil membentuk lipid hidroperoksida yang bersifat sitotoksik (LOOH), sehingga terjadi reaksi berantai. Reaksi akan berakhir (terminasi) jika radikal karbon yang terbentuk pada tahap inisiasi ataupun radikal lain yang terbentuk pada reaksi propagasi bereaksi dengan radikal lain menjadi produk non radikal (Setiawan dan Suhartono, 2007).
20
2.5. Antioksidan
Antioksidan merupakan senyawa yang mampu menangkal atau meredam
dampak negatif oksidan dalam tubuh dengan cara mendonorkan satu elektronnya kepada senyawa yang bersifat oksidan sehingga aktivitasnya bisa dihambat (Winarsi, 2007). Antioksidan dapat digolongkan menjadi antioksidan enzimatis dan non enzimatis. Antioksidan enzimatis disebut juga antioksidan primer atau
antioksidan endogen, diantaranya GPx, catalase, dan SOD. Antioksidan non
enzimatis disebut juga antioksidan sekunder atau antioksidan eksogen,
digolongkan sebagai yang larut dalam lemak seperti tokoferol, karotenoid,
flavonoid, quinon, dan bilirubin, sementara yang larut dalam air seperti asam
askorbat, asam urat, protein pengikat logam dan protein pengikat heme (Winarsi,
2007). Di samping itu, dikenal juga antioksidan sintetik seperti Butil Hidroksi
Anisol (BHA), Butil Hidroksi Toluen (BHT), propil galat, terti-butil hidroksi quinon (TBHQ) (Prangdimurti, 2007).
2.5.1 Superoksida Dismutase (SOD)
Enzim antioksidan SOD merupakan kelompok enzim yang dapat ditemukan dalam sel (sitosol dan mitokondria) juga dalam plasma. Dalam sitoplasma, SOD
ada dalam bentuk CuZn-SOD mempunyai berat molekul 32.000 Da, dalam
mitokondria ada dalam bentuk Mn-SOD dengan berat molekul 23.000 Dalton,
Semua bentuk SOD tersebut mengkatalisis perubahan anion superoxide menjadi
hydrogen peroxide (Zelko et al, 2002), seperti reaksi: O2-• + 2H+ SOD H2O2 + O2.
Kelas enzim SOD yang lain di antaranya Fe-SOD dan NiSOD. FeSOD umumnya
ditemukan pada prokariota, alga dan beberapa tumbuhan tinggi, sedangkan
NiSOD ditemukan dalam Streptomyces (Scandalios, 2005).
Menurut Widowati et al (2005), prinsip dasar pengukuran superoksida dismutase (SOD) adalah sebagai berikut :
Reaksi antara xantin dan xantin oksidase yang digunakan menghasilkan O2*- Xantin XOD asam urat + O2*-
Radikal superoksida yang dihasilkan akan bereaksi dengan pewarna kuning nitro blue tetrazolium (NBT) sehingga menghasilkan pewarna formazan biru ungu. NBT + O2*- pewarna formazan
SOD yang terdapat dalam plasma atau serum berlomba dengan NBT untuk bereaksi dengan radikal superoksida sehingga menghambat pembentukan zat warna. 2O2* + 2 H+ SOD H2O2 + 3O2
22
Gambar 7. Prinsip dasar pengukuran SOD (Cell Biolabs, Inc. 2013)
Penelitian Mu’nisa et al (2008) mengatakan pemberian ekstrak daun cengkeh
meningkatkan aktivitas SOD dan mencegah peroksidasi lipid pada jaringan
kelinci di bawah kondisi hiperkolesterolemia. Arsana (2014) juga mengatakan
pelatihan fisik disertai pemberian ekstrak kulit buah manggis dapat menurunkan
stres oksidatif melalui penurunan MDA, serta peningkatan baik SOD maupun
2.6 Taurin
Taurin (2-aminoethanesulfonic acid) adalah asam amino bebas yang melimpah dan terdapat banyak pada jaringan mammalia. Taurin adalah antioksidan yang diketahui memiliki berbagai fungsi fisiologis dalam metabolisme sel, termasuk osmoregulasi, stabilisasi membran, detoksifikasi, dan pengaturan homeostatis kalsium seluler (Huxtable, 1992).
Gambar 8. Rumus bangun taurin (Strange dan Jackson, 1997)
Taurin memiliki efek perlindungan melawan oksidasi yang diinduksi oleh tekanan selular dan menangkap radikal bebas dalam berbagai sel dan jaringan melawan toksik dari komponen oksidan (Abbasoglu et al, 2001; Hagar, 2004; Tabassum et al, 2007; Akay et al, 2013). Ini ditunjukkan bahwa taurin mengurangi peroksidasi lipid dan meningkatkan aktivitas enzim antioksidan yang diberi paparan
24
Ning et al (2010) mengatakan bahwa pada jaringan otak mencit yang diberi paparan arsenik, histopatologi menunjukkan pembengkakan, degenerasi vakuola di sitoplasma, karyorhexis dan karyolisis, dan terdapat ekspresi intensif 8-nitroguanine pada jaringan otak mencit terutama pada nukleus, tetapi sedikit di sitoplasma. Pemberian arsenik dan taurin menunjukkan adanya perubahan patologidan ekspresi yang lemah 8-nitroguanine pada jaringan otak mencit. Pemberian arsenik dan taurin dapat mengurangi kerusakan DNA pada syaraf otak yang disebabkan arsenik melalui jalur sinyal RNS (Reactive Nitrogen Species).
Akay et al (2012) mengatakan bahwa taurin mengurangi aktivitas peroksidasi lipid, amilase dan myeloperoxidase (MPO) dan konsentrasi peradangan sitokin sekunder dan meningkatkan aktivitas Superoxide Dismutase (SOD), Glutathione Peroxidase (GPx) pada tikus pada kondisi AP (Pankreas Akut) yang diinduksi sodium taurocholate. Taurin juga menunjukkan efek perbaikan pada lesi histopatologi. Dengan efek ini, taurin melindungi sel dari kerusakan oksidatif, mengurangi peradangan dan kerusakan pankreas.
Ozden et al (2012) mengatakan bahwa pemberian vitamin E dan taurin dapat mengurangi kerusakan oksidatif pada hati dan ginjal yang disebabkan pemaparan MC (methiocarb) akut pada tikus wistar. Pemberian vitamin E dan taurin
Pemberian taurin atau glisin efektif mencegah cedera hati yang berlemak dengan melalui mekanisme dependent-sel Kupffer. Glisin dan taurin signifikan
menurunkan leukosit dan interaksi platelet-endotelium dan fagositosis latex-bead. Enzim pada hati signifikan menurun setelah pemberian glisin dan taurin (Bruns et al, 2010).
26
III. METODE PENELITIAN
3.1 Tempat dan Waktu
Penelitian dilakukan di Laboratorium Biologi Molekuler Fakultas Matematika dan Ilmu Pengetahuan Alam dan Laboratorium Biomolekuler Fakultas Kedokteran, Universitas Lampung. Pembedahan dan proses mikroteknik dilakukan di Balai Penyidikan dan Pengujian Veteriner (BPPV) Regional III Bandar Lampung. Penelitian dilaksanakan pada bulan Desember 2014 sampai bulan Februari 2015.
3.2 Alat dan Bahan
Bahan yang digunakan adalah mencit jantan (Mus musculus) yang berumur 2-3 bulan dengan berat badan 30-40 gram, mencit diperoleh dari BPPV Lampung, homogenat hati mencit, pakan pellet, larutan trikloroasetat (TCA) 20%, larutan tiobarbiturat (TBA) 0,67%, larutan tetraetoksipropan 1,5 nmol/60 uL
(pengenceran 1/80.000 kali) untuk standar MDA, reagen pemeriksaan SOD, taurin, glifosat-Roundup, larutan bouin/formalin, aquades, parafin, hematoxylin-eosin.
3.3 Rancangan Percobaan
Penelitian dilaksanakan dalam rancangan acak lengkap (RAL). Pengujian pada mencit dilakukan secara in vivo. Mencit dibagi menjadi 3 kelompok perlakuan,
yaitu : kelompok kontrol (K0), kelompok glifosat (K1), dan kelompok taurin+
glifosat (K2). Masing-masing perlakuan terdiri dari 8 ekor sebagai ulangan.
3.4 Parameter
28
3.5Pelaksanaan
3.5.1 Aklimasi Hewan Uji
Mencit diaklimasi selama dua minggu diberi makan dan minum yang sama
secara ad libitum. Pada tahap ini dilakukan pengamatan terhadap keadaan
umum dan berat badan mencit. Mencit yang sakit tidak diikutsertakan
dalam percobaan.
3.5.2 Perlakuan Hewan Uji
[image:42.595.102.512.441.758.2]Hewan uji mencit dibagi dalam tiga kelompok perlakuan, masing-masing terdiri dari 8 ekor sebagai ulangan. Pemberian pakan dilakukan pada pagi hari, antara pukul 09.00-10.00 WIB.
Tabel 1. Dosis pada tiap kelompok perlakuan
Kelompok Keterangan Jumlah
mencit K0 (Kontrol
normal)
Diberi makan dan minum ad libitum sampai akhir
masa penelitian tanpa pemberian taurin dan herbisida glifosat
8
K1 (Glifosat) Diberi makan dan minum ad libitum, lalu diinduksi herbisida glifosat dengan dosis 25 mg/kg BB mencit per hari secara oral selama 25 hari . Berdasarkan penelitian, dosis ini dapat menginduksi peroksidasi
lipid pada mencit (Ozden et al, 2012)
8
K2 (Taurin + Glifosat)
Diberi makan dan minum ad libitum, lalu diberi taurin
dengan dosis 7800 mg/kg BB mencit per hari dan glifosat 25 mg/kg BB mencit per hari selama 25 hari. Dosis taurin menurut Shao dan Hathcock (2008), yaitu 3 gram/70 kg berat badan pada manusia. Dosis taurin pada mencit dihitung dengan menggunakan tabel konversi manusia ke mencit ukuran 20 gram menurut Nugraha (2011). Nilai konversi dari manusia ke mencit adalah 0,0026. Sehingga diperoleh dosis taurin untuk mencit, yaitu 3000 mg x 0,0026 = 7,8 mg/g BB = 7800 mg/kg BB mencit.
3.5.3 Pembuatan Homogenat Hati
Pembuatan homogenat hati menggunakan jaringan hati dengan berat 100 mg yang ditempatkan pada test tube 1,5 mL, lalu ditambahkan 0,5 mL PBS 0,1 M pH 7,4. Jaringan hati lalu divorteks yang telah dipasang micropestle dan dilumatkan hingga homogen, kemudian ditambahkan 0,5 mL PBS 0,1 M pH 7,4 sehingga volume menjadi 1 mL. Homogenat kemudian disentrifugasi pada 5000 rpm selama 10 menit. Lalu supernatan dipindahkan ke test tube kosong dan disimpan pada suhu -20oC.
3.5.4 Analisis Aktivitas Enzim SOD Pada Hati Mencit
Aktivitas SOD ditentukan secara biokimia yaitu dengan menggunakan kit RanSOD®. Aktivitas SOD total ditetapkan dari derajat penghambatan
pembentukan warna formazan. Ini yang diukur dengan spektrofotometer A 505 nm. Reagen-reagen pada kit ini terdiri dari mixed substrate yang mengandung xantin dan INT (2-(4-iodophenyl)-3-(4-nitrophenol)-5-pheniltetrazolium
chloride), buffer fosfat, xantin oksidase dan larutan standar untuk membuat kurva standar. Sebanyak 15 μl sampel/standar dimasukan ke dalam kuvet, lalu
30
Perhitungan : A1 - A2 = ΔA/menit 3
Kecepatan sampel diluent/buffer fosfat (S1) = kecepatan yang tidak diinhibisi = 100%.
% inhibisi = 100 –( ΔA standar/menit x 100) ΔA S1/menit
100 –( ΔA standar/menit x 100) ΔA S1/menit
% inhibisi sampel yang diperoleh diplot pada kurva log 10/semilog standar.
3.5.5 Pemeriksaan Kadar MDA
Pengukuran MDA dilakukan dengan menggunakan modifikasi metode uji asam tiobarbiturat (TBA) secara spektrofotometri. Sebanyak 400 μl sampel direaksikan
dengan 200 μl trichloroacetic acid (TCA) 20% untuk deproteinisasi. Kemudian divorteks dan disentrifus dengan kecepatan 3500 rpm selama 10 menit.
Supernatan yang terbentuk diambil dan tambahkan 400 μl TBA 0,67%.
3.5.6 Pembuatan Preparat Sayatan Hati
Pembuatan preparat hati menggunakan metode parafin dengan pewarnaan hematoxylin-eosin. Menurut Nurlaili (2010), pembuatan sayatan hepar adalah sebagai berikut :
1. Fixation, yaitu memfiksasi spesimen yang berupa organ hati dengan larutan formalin 10% dan mencucinya dengan air mengalir.
2. Trimming, yaitu mengecilkan ± 3 mm dan memasukkan potongan organ hati ke dalam embedding cassette.
3. Infiltrasi yaitu dengan menambahkan paraffin sebanyak 3 kali selama 30 menit.
4. Dehidrasi yaitu berturut-turut melakukan perendaman organ hati ke dalam alkohol bertingkat 80% dan 95% masing-masing selama 2 jam. Selanjutnya dilakukan perendaman alkohol 95%, absolut I, II, III selama 1 jam.
5. Clearing yaitu membersihkan sisa alkohol dengan xilol I, II, III, masing-masing selama 1 jam.
6. Impregnasi dengan menggunakan paraffin I, II, III masing-masing selama 2 jam.
32
dalam suhu 4-60C beberapa saat.Memotong paraffin sesuai dengan letak
jaringan yang ada dengan menggunakan scalpel hangat. Meletakkan pada balok kayu, meratakan pinggirnya dan ujungnya dibuat sedikit meruncing.
8. Cutting, yaitu melakukan pemotongan dan blok didinginkan terlebih dahulu. Melakukan pemotongan kasar, dilanjutkan pemotongan halus dengan ketebalan 4-5 mikron. Pita hasil irisan diambil dengan menggunakan kuas dan
dimasukkan air dingin untuk membuka lipatan lalu dimasukkan air hangat dan dilakukan pemilihan irisan yang terbaik. Irisan yang terpilih diambil dengan gelas obyek kemudian dikeringkan diatas hot plate.
9. Staining, yaitu pewarnaan dengan hematoxylin-eosin. Langkah-langkahnya secara berurutan sebagai berikut. Slide direndam ke dalam xilol I, II, III masing-masing 5 menit, lalu alkohol absolut I, II, III masing-masing 5 menit, aquades selama 1 menit, lalu pewarna hematoxylin-eosin selama 20
menit,dibilas dengan aquades 5menit, direndam dalam etanol bertingkat 80%, 90%, 95% dan etanol absolut masing-masing selama 5 menit. Terakhir
memasukkan dalam larutan xylol 2 kali selama 5 menit.
3.5.7 Pengamatan Histologi
Pengamatan dilakukan dengan membandingkan preparat histologi hati antara
kelompok perlakuan dengan kelompok kontrol. Preparat histologis hati diamati di
[image:47.595.156.420.423.500.2]bawah mikroskop cahaya dalam lima lapangan pandang yang berbeda, dengan perbesaran 400 kali. Setiap lapangan pandang dihitung 20 sel secara acak sehingga dalam 1 preparat tersebut teramati 100 sel hati. Kemudian dihitung rerata bobot skor perubahan histopatologi hepar dari lima lapangan pandang dari masing-masing mencit dengan model Skoring Histopathology Manja Roenigk. Kemudian dicatat dan dihitung jumlah persentase kerusakan yang terjadi (Maulida et al, 2010).
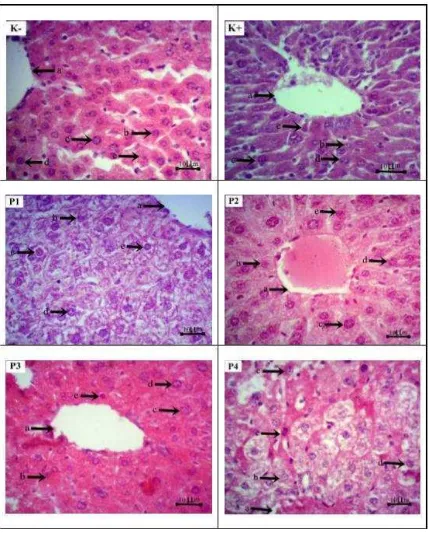
Tabel 2. Kriteria penilaian derajat histopatologi sel hepar model Skoring
Histopathology Manja Roenigk (Maulida et al, 2013).
Tingkat Perubahan Nilai
Normal 1
Degenerasi parenkimatosa 2
Degenerasi hidropik 3
Nekrosis 4
34
[image:48.595.101.529.78.611.2]Kriteria gambaran mikroskopis hepatosit menurut Maulida et al (2013):
a. Normal : tampak sel berbentuk poligonal, sitoplasma berwarna merah homogen dan membran sel berbatas tegas.
b. Degenerasi parenkimatosa : tampak sitoplasma keruh karena terdapat endapan protein.
c. Degenerasi hidropik : tampak vakuola pada sitoplasma sel maupun di sekeliling inti sel.
d. Nekrosis : tampak inti sel piknotik dan sitoplasma sel menggumpal.
3.5.8 Pengamatan Berat Badan Mencit
Selama 25 hari percobaan, diamati berat badan mencit kelompok kontrol dan kelompok perlakuan. Hasil pengamatan dicatat dan dibandingkan untuk setiap kelompok perlakuan.
3.6 Analisis Data
36
Bagan rancangan penelitian dapat dilihat pada Gambar 10 berikut.
Gambar 10. Bagan rancangan penelitian
Aklimasi mencit
Kontrol (K0) Glifosat (K1) Glifosat+taurin (K2)
Diberi makan dan minum ad
libitum sampai akhir masa penelitian tanpa pemberian taurin dan herbisida glifosat
selama 25 hari.
Diberi makan dan minum ad
libitum, lalu diinduksi herbisida glifosat dengan dosis
25 mg/kg BB mencit per hari secara oral selama 25 hari .
Diberi makan dan minum ad
libitum, lalu diberi taurin dengan dosis 7800 mg/kg BB mencit per hari dan glifosat 25 mg/kg BB mencit per hari selama 25 hari.
Pengamatan
Histologi hati Kadar SOD dan MDA
hati
Morfologi
Degenerasi dan nekrosis Berat mencit Berat hati
V. SIMPULAN DAN SARAN
5.1 Simpulan
Dari hasil penelitian dapat disimpulkan :
1. Pemberian taurin dengan dosis 7800 mg/kg BB per hari dapat
mereduksi sel-sel hati mencit (Mus musculus) jantan yang mengalami kerusakan akibat induksi herbisida glifosat sebesar 76,3%.
2. Pemberian taurin dengan dosis 7800 mg/kg BB per hari belum mampu meningkatkan kadar SOD dan menurunkan kadar MDA.
5.2 Saran
Beberapa penelitian lanjutan yang dapat dilakukan diantaranya adalah :
1. Dosis taurin yang lebih tinggi, dan waktu pengamatan yang lebih lama terhadap mencit yang diinduksi herbisida glifosat
2. Dosis glifosat yang lebih tinggi, dan waktu pengamatan yang lebih lama terhadap mencit agar terjadi stres oksidatif.
DAFTAR PUSTAKA
Abbasoglu, S. D., O. Kanbagli, J. Balkan, U. Cevikbas, G.A. Toker, dan M. Uysal. 2001. The Protective Effect of Taurine Against Thioacetamide Hepatotoxicity of Rats. Human and Experimental Toxicology. 20 : 23-27.
Akay, C., H. Yaman, M. Oztosun, E. Cakir, A.O.Yildirim, Y.E. Eyi, M. Agilli, E.O. Akgul, I. Aydin, U. Kaldirim, S.K. Tuncer, A. Eken, E. Oztas, Y. Poyrazoglu, M. Yasar, and Y. Ozkan. 2013. The Protective Effects of Taurine on Experimental Acute Pancreatitis in a Rat Model. Human and Experimental Toxicology. 32(5) : 522-529.
Arief, S. 2008. Radikal Bebas. Artikel. SMF Ilmu Kesehatan Anak FK Unair/RSU Dr. Soetomo. Surabaya.
Arsana, I.N. 2014. Ekstrak Kulit Buah Manggis (Garcinia mangostana L.) dan Pelatihan Fisik Menurunkan Stres Oksidatif pada Tikus Wistar (Rattus norvegicus) Selama Aktivitas Fisik Maksimal. Disertasi. Universitas Udayana. Denpasar.
Ayoola, S.O. 2008. Toxicity of Glyphosate Herbicide on Nile Tilapia (Oreochromis niloticus) Juvenile. African Journal of Agricultural Research. 3(12): 825-834.
Banks, D., dan M.R. Soliman. 1997. Protective Effects of Antioxidants Against Benomyl-Induced Lipid Peroxidation and Glutathion Depletion in Rats. Toxicology. 116 : 177-181.
Bruns, H., I. Watanpour, M. Gebhard, C. Flechtenmacher, U. Galli, H. Bergkamen, M. Zorn, M. Buchler, and P. Schemmer. 2010. Glycine and Taurine Equally Prevent Fatty Liver From Kupffer Cell-Dependent Injury: An in Vivo Microscopy Study.
Microcirculation.18: 205-213.
Caille, C., C. Heu, C. Guyon, dan L. Nicod. 2010. Morphological Damages of a Glyphosate-treated Human Keratinocyte Cell Line Revealed by A Micro-to Nanoscale
Miscroscopik Investigation. Cell Biol Toxicol. 26: 331-339.
Cell Biolabs, Inc. 2013. OxiSelectTM Superoxide Dismutase Activity Assay. Product Manual. USA.
Chen, X., B.M. Sebastian., H. Tang., M. McMullen., A. Axhemi., D. Jacobsen., L.Nagy. 2009. Taurine Supplementation Prevents Ethanol-Induced Decrease in Serum Adinopectin and Reduce Hepatic Steatosis in Rats. Hepatology. 49(5): 1554-1562. Chen, Y.X., S.C. Wang, G.N. Zhao. 1992. Effect of Taurine on Calcium Uptake and Release
by Isolated Rat Liver Mitochondria. Fourth Milid Med Univ. 13: 282-283.
Contardo-Jara, V., E. Klingelmann, C. Wiegand. 2009. Bioaccumulation of Glyphosate and its Formulation Roundup Ultra in Lumbriculus variegatus and its Effect on
Biotrasformation and Antixidant Enzymes. Environ. Pollut. 157: 57-63.
Dallegrave, E., F.D. Mantese, R.S. Coelho, J.D. Pereira, P.R. Dalsenter, A. Langeloh. 2003. The Teratogenic Potential of The Herbicide Glyphosate-Roundup in Wistar Rats. Toxicol Lett. 142(1-2): 45-52.
Djau, R.A. 2009. Faktor Risiko Kejadian Anemia dan Keracunan Pestisida pada pekerja Penyemprot Gulma di Kebun Kelapa Sawit PT. Agro Indomas Kab. Seruyan Kalimantan Tengah. Tesis. Universitas Diponegoro. Semarang.
Du, H., J.You., Z. Xu., J.Park., S.Kim., K.Chang. 2010. Antiobesity and Hypolipidemic Effects of Lotus Leaf Hot Water Extract with Taurine Supplementation in Rats Fed A High Fat Diet. Biomedical Science. 17(1): S42.
El-Sayed, W.M., M. Alkahtani., A.M. Abdel-Monem. 2011. Prophylactic and Therapeutic Effects of Taurine Against aluminium-Induced Acute Hepatotoxicity in Mice. Hazardous Materials. 192: 880-886.
Fajariyah, S., E.T. Utami, Y. Arisandi. 2010. Efek Pemberian Estrogen Sintetis
(Diethylstillbestrol) terhadap Struktur Hepar dan Kadar SGOT dan SGPT pada Mencit (Mus musculus) Betina Strain Balb’C. Ilmu Dasar. 11(1): 76-82.
Faqihhudin, M.D., Haryadi, P. Heni. 2014. Penggunaan Herbisida IPA-Glifosat terhadap Pertumbuhan, Hasil dan Residu pada Jagung. Ilmu Pertanian. 17(1): 1-12.
Fawcett, W. Don. 2002. Buku Ajar Histologi. 12th ed. EGC. Jakarta.
Guyton, A.C, J.E. Hall. 1997. Buku Ajar Fisiologi Kedokteran. Edisi 9. EGC. Jakarta.
Harish, R.S., dan K. Murugan. 2011. Oxidative Stress Indices in Natural Populations of
Avicennia alba Blume as Biomarker of Environmental Pollution. Environ. Res. 11(8) :
1070-1073.
Himawan, S. 1992. Patologi. Penerbit Buku Kedokteran EGC. Jakarta.
Huxtable, R.J. 1992. Physiological Actions of Taurine. Physiological Reviews. 72: 101-163. Issabeagloo, E., M. Taghhizadiyeh., P. Kermanizadeh. 2011. Hepatoprotective Effect of
Taurine Against Oxidative Stress Due to Methotrexate in Rat. Animal and Veterinary Sciences. 6(4); 187-192.
Jasper, R., G.O. Locatelli, C. Pilati, C. Locatelli. 2012. Evaluation of Biochemical, Hematological and Oxidative Parameters in Mice Exposed to The Herbicide Glyphosate-Roundup. Interdiscip Toxicol. 5(3): 133-140.
Kishi, Hirschhorn, Djajadisastra, Satterlee, Strowman, Dilts. 1993. Relationship of Pesticide Spraying to Sign and Symptoms in Indonesia Farmers. Scand J. Work Environment Health.
Kothari, S., A. Thompson, A. Agarwal, dan S. Plessis. 2010. Free Radical: Their Beneficial and Detrimental Effects on Sperm Function. Indian Journal of Experimental Biology. 48: 425-435.
Kozumbo, W.J., S. Agarwal, H.S. Koren. 1992. Breakage and Binding of DNA by Reaction Product of Hypochlorous Acid with Aniline, 1-Naphthylamine or 1-Naphthol. Toxicol Appl Pharmacol. 115: 107-115.
Levine, R. 1991. Recognized and Possible Effects of Pesticides in Human. In: Handbook of Pesticides Toxicology. Hayes, JW ed & Laws, ER ed. Pp 318-343. Academic Press Inc. California.
Marciniak, A., J. Brzeszczynska, K. Gwozdzinski, dan A. Jegier. 2009. Antioxidant Capacity and Physical Exercise. Biology of Sport. 26(3): 197-213.
Maulida, A., S. Ilyas dan S. Hutahaean. 2013. Pengaruh Pemberian Vitamin C dan E terhadap Gambaran Histologis Hepar Mencit (Mus musculus L.) yang dipajankan Monosodium Glutamat (MSG). Saintia Biologi. 1(2): 1-6.
Mu’nisa, A., T. Wresdiyati, N. Kusumorini, dan W. Manalu. 2008. Perbaikan Aktivitas Antioksidan pada Jaringan Kelinci di bawah Kondisi Hiperkolesterolimia dengan Pemberian Ekstrak Daun Cengkeh. Nitro PDF Profesional.
Yogyakarta.
Ngurah. 2007. Peranan Antioksidan pada Olahraga. Medicina. 38 (1): 3-6
Nugraha, L.S.A. 2011. Cara dan Rute Pemberian Obat Pada Hewan Percobaan Mencit. Tesis. Akademi Farmasi Theresiana. Semarang.
Nurlaili, E. 2010. Pengaruh Ekstrak Biji Klabet (Trigonella foenum-graecum Linn.) terhadap Kadar Transminase (GPT dan GOT) dan Gambaran Histologi pada Hepar Mencit (Mus
musculus) yang Terpapar Streptozotocin. Tesis. Universitas Islam Negeri (UIN) Maulana
Malik Ibrahim. Malang.
O’Mailey, M. 2007. Pesticides. In Current Occupational & Environmental Medicine. Pp 544. 4th Ed. Ladou, J. Ed Mc Graw Hill Medical. California.
Ozden, S., B. Catalgol, S.G. Oktayoglu, A. Karatug, S. Bolkent, B. Alpertunaga. 2012. Acute Effects of Methiocarb on Oxidative Damage and The Protective Effects of Vitamin E and Taurine in the Liver and Kidney of Wistar Rats. Toxicology and Industrial Health 29(1) : 60-71.
Parvez, S., H. Tabassum, B. Banerjee, S. Raisuddin. 2008. Taurine Prevents Tamoxifen-Induced Mitochondrial Oxidative Damage in Mice. Basic and Clinical Pharmacology and Toxicology. 102: 382-387.
Peduto,V.A., R. D’uva, M. Piga. 1996. Carbamate and Organic Phosphorus Poisoning. Minerva Anestesiol. 62:33-54.
Prangdimurti, E. 2007. Metode Evaluasi Antioksidan Secara In Vitro dan In Vivo. Departemen Ilmu dan Teknologi Pangan Fak. Teknologi Pertanian. IPB.
http://xa.yimg.com/kq/groups/20875559/1368419127/name/ Topik9.pdf. Di akses tanggal 20/11/2013.
Redmond, H.P., J.H. Wang, D. Bouchier-Hayes. 1996. Taurine Attenuates Nitric Oxide and Reactive Oxygen Intermediate-Dependent Hepatocyte Injury. Arch Surg. 131: 1280-1288.
Riadi. 2011. Bahan Ajar Mata Kuliah : Herbisida dan Aplikasinya. Universitas Hasanuddin. Sulawesi Selatan.
Scandalios. 2005. Oxidative Stress: Molecular Perception and Transduction of Signal Triggering Antioxidant Gene Defences. Brazilian Journal of Medicaland Biological Research. 38: 995-1014.
Schaffer, S., J. Azuma, K. Takahashi, M. Mozaffari. 2003. Why is Taurine Cytoprotective?. Adv Exp Med Biol. 526: 307-321.
Setiawan, B. dan E. Suhartono. 2007. Peroksidasi Lipid dan Penyakit Terkait Stres Oksidatif pada Bayi Prematur. Majalah Kedokteran Indonesia. 57(1): 10-14.
Shao A., J.N. Hathcock. 2008. Risk assessment for the amino acids taurine, glutamine and l-arginine. Regul Toxicol Pharmacol 50(3): 376-399.
Sloane, E. 2003. Anatomi dan Fisiologi. Penerbit Buku Kedokteran EGC. Jakarta.
Son, T.G., S. Camandola, M.P. Mattson. 2008. Hormetic Dietary Phytochemicals. Neuromol Med. 10: 236-246.
Strange, W. dan Jackson, 1997. Penaeid Shrimp Nutrition for the Comercial Feed Industry. In Proceeding of the Aquaqulture Feed.
Suarsana, I.N., T. Wresdiyati dan A. Suprayogi. 2013. Respon Stres Oksidatif dan Pemberian Isoflavon terhadap Aktivitas Enzim Superoksida Dismutase dan Peroksidasi Lipid pada Hati Tikus. JITV. Vol 18(2): 146-152.
Suarsana, I.N., I.H. Utama, I.G. Agung, dan Suartini. 2011. Pengaruh Hiperglikemia dan Vitamin E pada Kadar Malonaldehida dan Enzim Antioksidan Intrasel Jaringan PankreasTikus. Majalah Kedokteran Bandung (MKB). 43(2): 72-76.
Surya. 2011.http://repository.usu.ac.id/bitstream/123456789/23312/4/Chapter%20II.pdf. Diakses tanggal 22 Mei 2014 pukul 14.30.
Sutarni, S., A. Suwarni, T. Sudargo. 1996. Pemaparan Pestisida dan Polineuropati pada Petani di Kelurahan Tlogodadi, Kecamatan Mlati, Kabupaten Sleman, Yogyakarta.
Jurnal Manusia dan Lingkungan. 1(4): 21-30.
Suwastika, I. 2009. Faktor Lingkungan, Hyegine Perorangan, Perilaku Penggunaan Pestisida dan Tingkat Keracunan pada Petani Jeruk di Kabupaten Timor Tengah Selatan. Tesis. Program Studi Ilmu Kesehatan Kerja Pasca Sarjana Universitas Gadjah Mada.
Yogyakarta.
Tabassum, H., S. Parvez, H. Rehman, B. Banerjee, D. Siemen, dan S. Raisuddin. 2007. Nephrotoxicity and Its Prevention by Taurine in Tamoxifen Induced Oxidative Stress in Mice. Human & Experimental Toxicology. 26: 509–518.
Williams, G.M., R. Kroes, I.C. Munro. 2000. Safety Evaluation and Risk Assessment of The Herbicide Roundup and its Active Ingredient, Glyphosate for Human. Regul. Toxicol.
Pharmacol. 31(2): 117-165.
Winarsi, H. 2007. Antioksidan Alami dan Radikal Bebas. Potensi dan Aplikasinya dalam Kesehatan. Kanisius. Yogyakarta.
Winarsi, H., S. Wijayanti, dan Purwanto, A. 2012. Aktivitas Enzim Superoksida Dismutase, Katalase, dan Glutation Peroksidase Wanita Penderita Sindrom Metabolik. MKB. 44(1): 7-12.
Yeh, Y., Y. Lee, Y. Hsieh, D. Hwang. 2011. Dietary Taurine reduces Zinc-Induced Toxicity in Male Wistar Rats. Journal of Food Science. 76(4): 90-98.
Yousef, M.I., M.H. Salem, H.Z. Ibrahim, S. Helmi, M.A. Seehy, K. Bertheussen. 1995. Toxic Effects of carbofuran and Glyphosate on Semen Characteristics in Rabbits. Environ.
Sci. Health. 30: 523-534.
Yunus, M. 2001. Pengaruh Antioksidan Vitamin C Terhadap MDA Eritrosit Tikus Wistar Akibat Latihan Anaerobik. Jurnal Pendidikan Jasmani. (1): 9-16.
Zainul, Karyono, Arifin. 2010. Pengaruh Toksisitas Subkronik Grasstin (Isopropilamina Glyphosate) terhadap Ovarium Tikus Galur Wistar Betina.Tesis. Universitas Brawijaya. Malang. Jawa Timur.
Zainuri, M. dan S.I. Wanandi. 2012. Aktivitas Spesifik Manganase Superoxide Dismutase (MnSOD) dan Katalase pada Hati Tikus yang Diinduksi Hipoksia Sistemik:
Hubungannya dengan Kerusakan Oksidatif. Jurnal Media Litbang Kesehatan. 22(2): 87-92.
Zelko, I.N., T.J. Mariani, dan R.J. Foltz. 2002. Superoxide Dismutase Multigene Family : A Comparison of The CuZn-SOD (SOD1), Mn-SOD (SOD2), and EC-SOD (SOD3) Gene Structure, Evolution and Expression. Free Radical Biology and Medicine. 33(3): 337-349.