PENGUJIAN POTENSI BAKTERI PENGHASIL
INDOLE-3-ACETIC ACID
(IAA) ASAL TANAH BATUAN KAPUR PADA
PENANAMAN LAMTORO (
Leucaena leucocephala
)
RAMADHANUL FITRA YANDRA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pengujian Potensi Bakteri Penghasil Indole-3-Acetic Acid (IAA) Asal Tanah Batuan Kapur pada Penanaman Lamtoro (Leucaena leucocephala) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2015
ABSTRAK
RAMADHANUL FITRA YANDRA. Pengujian Potensi Bakteri Penghasil Indole-3-Acetic Acid (IAA) Asal Tanah Batuan Kapur pada Penanaman Lamtoro
(Leucaena leucocephala). Dibimbing oleh NISA RACHMANIA MUBARIK dan
YADI SURYADI.
Tanah bekas tambang batuan kapur merupakan tanah yang kering dengan diversitas mikrob yang rendah sehingga diperlukan usaha untuk mengembalikan keadaan tanah menjadi produktif kembali. Reklamasi dapat dilakukan dengan menambahkan pupuk, melakukan penanaman kembali, serta menginduksi bakteri tanah yang bermanfaat. Bakteri yang bermanfaat salah satunya ialah bakteri yang mampu menghasilkan zat pemacu pertumbuhan (ZPT). Penanaman kembali dapat dilakukan dengan beberapa jenis tanaman legum, misalnya lamtoro. Tanaman lamtoro (Leucaena leucocephala) merupakan tanaman leguminosa yang paling produktif dibandingkan yang lain, kualitas hijaunya tinggi, tahan kekeringan, dan tumbuh dalam variasi iklim yang luas. Penelitian ini bertujuan untuk mengetahui potensi bakteri penghasil Indole-3-Acetic Acid (IAA) terhadap pembibitan lamtoro. Isolat yang terpilih diketahui menghasilkan IAA setelah dilakukan uji kolorimetri dengan reagen Salkwoski. Hasil uji hipersensitivitas dengan menggunakan daun tembakau diperoleh dua isolat yang bersifat nonpatogen yang akan diujikan potensinya pada tanaman lamtoro. Isolat QC 7B41 menghasilkan IAA tertingi pada jam ke-30 dan isolat QC 5C32 pada jam ke-27. Pemberian bakteri berpengaruh positif terhadap pertumbuhan akar primer dan jumlah akar lateral pada tanaman bibit lamtoro hingga 83 hari setelah tanam.
Kata kunci: batu kapur,IAA (Indole-3-Acetic Acid), lamtoro, mikrob
ABSTRACT
RAMADHANUL FITRA YANDRA. The Use of Potential of Indole-3-Acetic Acid (IAA) Producing Bacteria from Limestone Quarry to Leucaena leucocephala
Seedlings. Supervised by NISA RACHMANIA MUBARIK and YADI SURYADI.
hour incubation. The bacteria had positive effect on primary root growth and lateral root number of leucaena seedling up to 83 days after planting.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
PENGUJIAN POTENSI BAKTERI PENGHASIL
INDOLE-3-ACETIC ACID
(IAA) ASAL TANAH BATUAN KAPUR PADA
PENANAMAN LAMTORO (
Leucaena leucocephala
)
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Skripsi : Pengujian Potensi Bakteri Penghasil Indole-3-Acetic Acid (IAA) Asal Tanah Batuan Kapur pada Penanaman Lamtoro (Leucaena leucocephala)
Nama : Ramadhanul Fitra Yandra NIM : G34110029
Disetujui oleh
Dr Nisa Rachmania Mubarik, MSi Pembimbing I
Ir Yadi Suryadi, MSc Pembimbing II
Diketahui oleh
Dr Ir Iman Rusmana, MSi Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari hingga Juni 2015 ini ialah Isolasi dan Pengujian Potensi Bakteri Penghasil Indole-3-Acetic-Acid
(IAA) Asal Tanah Batuan Kapur Pada Penanaman Lamtoro (Leucaena leucocephala).
Terima kasih penulis ucapkan kepada Dr Nisa Rachmania Mubarik, MSi dan Ir Yadi Suryadi, MSc sebagai pembimbing, serta Dr Ir Sulistijorini, MSi sebagai penguji ujian skripsi atas saran dan diskusi yang diberikan. Di samping itu, penghargaan penulis sampaikan kepada Ian dan Nana yang telah membantu pengumpulan data penelitian, dan teman-teman Laboratorium Mikrobiologi IPB
“microbiota” yang telah membantu selama pengumpulan data, serta teman-teman
Biologi 48 atas doa dan semangat yang diberikan. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
METODE 1
Waktu dan Tempat 1
Bahan 2
Peremajaan Isolat Uji 2
Uji Hipersensitivitas Isolat terhadap Daun Tembakau 2
Uji Kemampuan Bakteri Penghasil IAA 2
Pengujian Isolat Bakteri pada Tanaman Lamtoro 3
Perkiraan Jumlah Sel Bakteri Di dalam Tanah dengan Metode Total Plate
Count (TPC) 3
Analisis Data 3
HASIL DAN PEMBAHASAN 4
Uji Hipersensitivitas Isolat terhadap Daun Tembakau 4 Uji Kemampuan Bakteri yang Menghasilkan IAA 4 Pengujian Isolat Bakteri pada Penanaman Bibit Lamtoro 4 Perkiraan Jumlah Sel Bakteri Di dalam Tanah dengan Metode Total Plate
Count (TPC) 6
Pembahasan 7
SIMPULAN DAN SARAN 10
Simpulan 10
Saran 10
DAFTAR PUSTAKA 10
LAMPIRAN 13
DAFTAR TABEL
1 Jenis perlakuan pada pembibitan tanaman lamtoro 3 2 Pengaruh penyiraman inokulasi bakteri terhadap pertumbuhan lamtoro
yang berumur 83 hari setelah tanam 6
3 Persentasi peningkatan atau pengurangan jumlah sel bakteri pada hari ke-50 dan hari ke-80 HST dengan media nutrient agar (NA) dan NA
dengan penambahan L-triptofan 1 mM L-ttriptofan 6
DAFTAR GAMBAR
1 Uji hipersensitivitas kelima isolat bakteri uji umur 48 jam dengan
menggunakan daun tembakau 4
2 Kurva pertumbuhan isolat dan sintesis IAA dengan penambahan 1 mM
L-triptofan 5
3 Log sel hasil TPC asal tanah semua perlakuan 7
DAFTAR LAMPIRAN
1 Kurva standar pertumbuhan isolat QC 7B41 13
2 Kurva standar pertumbuhan isolat QC 5C32 13
3 Kurva standar pengukuran IAA 13
4 Hasil analilis sidik ragam (Anova) masing-masing parameter pada saat
PENDAHULUAN
Latar Belakang
Batuan kapur merupakan salah satu jenis bahan galian yang banyak digunakan dalam proses industri maupun bangunan. Penambangan batu kapur dilakukan di daerah yang memiliki lahan kapur yang merupakan daerah kering (Algunadi et al. 2013). Kawasan penambangan batuan kapur memiliki diversitas mikrob yang rendah karena bertekstur kering (Pradyudyaningsih 2014). Oleh karena itu, diperlukan adanya upaya reklamasi terhadap kondisi tanah tersebut. Reklamasi lahan ialah proses pengubahan kembali tanah yang tergangggu atau rusak ke penggunaan sebelumnya atau penggunaan-penggunaan produktif lainnya (Siswomartono 1989).
Reklamasi dapat dilakukan salah satunya dengan menginduksi bakteri ke dalam tanah untuk meningkatkan daya dukung tanah pascatambang batuan kapur. Galur bakteri yang dapat diinduksikan dan menguntungkan dalam peningkatan pertumbuhan tanaman dikelompokkan sebagai Plant Growth Promoting Rhizobacteria (PGPR) (Kloepper dan Scroth 1978). Salah satu kelompok bakteri yang dapat diaplikasikan untuk reklamasi lahan ialah bakteri penghasil auksin atau Indole-3-Acetic Acid (IAA). Frankenberger dan Arshad (1995) menyebutkan bahwa produksi IAA sangat bervariasi antar spesies bakteri yang dipengaruhi oleh kondisi lingkungan, tingkat pertumbuhan, dan ketersediaan substrat seperti asam amino. Proses selanjutnya dalam pemulihan lahan pascatambang dengan melakukan penghijauan. Tanaman yang baik untuk penghijauan di tanah pascatambang batu kapur yaitu jenis legum, salah satunya tanaman lamtoro (Leucaena leucocephala) (Suriadikarta dan Setyorini 2005). Tanaman ini merupakan tanaman leguminosa yang paling produktif dibanding yang lain, kualitas hijaunya tinggi, tahan kekeringan, tumbuh dalam variasi iklim yang luas, dan dapat digunakan sebagai pupuk hijau serta pakan ternak (Purwantari dan Sajimin 2006). Publikasi mengenai proses reklamasi dengan bakteri penghasil IAA sebagai agen mempercepat pertumbuhan tanaman belum banyak dilaporkan, sehingga pengujian potensi bakteri penghasil IAA asal tanah bekas tambang batuan kapur sangat bermanfaat untuk dilakukan.
Tujuan Penelitian
Penelitian ini bertujuan mengetahui potensi bakteri penghasil IAA terhadap penanaman bibit tanaman lamtoro di rumah kaca.
METODE
Waktu dan Tempat
2
Bahan
Lima isolat bakteri penghasil IAA digunakan dalam penelitian ini, yaitu QC 6B33, QC 5C31, QC 5C31, QC 7B41, dan QC 5C32 (Dwiana 2015). Isolat-isolat tersebut disimpan pada koleksi biakan IPB Culture Collection (IPBCC). Bakteri Xanthomonas oryzae pv. Oryzae berasal dari Balai Besar Litbang Bioteknologi dan Sumber Daya Genetik Pertanian (BB Biogen) Bogor. Bibit lamtoro diperoleh dari Balai Teknologi Perbenihan (BTP), Ciheuleut, Bogor. Tanah latosol sebagai media tanam diambil dari Kebun Percobaan Cikabayan, IPB, Dramaga, Bogor. Pupuk kompos dan pupuk kandang diperoleh dari Toko Dramaga Tani, Dramaga, Bogor.
Peremajaan Isolat Uji
Lima isolat uji diremajakan dengan metode gores kuadran pada media
nutrient agar (NA) dengan penambahan 1 mM L-triptofan. Seluruh isolat diinkubasi pada suhu kamar (± 27ºC) hingga tumbuh optimum.
Uji Hipersensitifitas Isolat terhadap Daun Tembakau
Isolat yang tumbuh optimum dimasukkan sebanyak 1 lup ke dalam 50 mL media nutrient broth (NB) dengan penambahan 1 mM L-triptofan pada suhu 30 o
C sambil dikocok dengan agitasi 120 rpm hingga kepekatan ±108 sel/mL. Isolat
Xanthomonas oryzae pv. Oryzae sebagai kontrol positif dibiakkan sebanyak 1 lup di dalam 50 mL media NB dan akuades sebagai kontrol negatif. Sebanyak 1 mL biakan dan akuades disuntikkan pada bagian abaksial daun tembakau, lalu dilakukan pengamatan dalam 48 jam.
Uji Kemampuan Bakteri Penghasil IAA
Isolat uji yang tidak menyebabkan nekrosis pada daun tembakau masing-masing dibiakkan sebanyak 1 lup di dalam 50 mL media NB dengan penambahan 1 mM L-triptofan pada suhu 30 oC dan dikocok dengan agitasi 120 rpm hingga kepekatan ±108 sel/mL. Sebanyak 1 mL kultur diambil dan dimasukkan ke dalam 50 mL media NB dengan penambahan 1 mM L-triptofan. Setiap 3 jam dilakukan pengambilan kultur untuk dilakukan pengukuran absorbansi pada panjang gelombang 520 nm yang berlangsung sampai dengan 48 jam. Analisis IAA dilakukan dengan metode kolorimetri menggunakan reagen Salkowski (150 mL H2SO4 pekat; 7,5 mL FeCl3.6H2O 0,5 M; dan 250 mL akuades steril) (Gordon dan Weber 1950).
3 kemampuan tumbuhnya dengan menggunakan kurva standar isolat QC 7B 41 (Lampiran 2) dan isolat QC 5C32 (Lampiran 3)
Pengujian Isolat Bakteri pada Bibit Tanaman Lamtoro
Biji lamtoro yang telah dikeringkan, direndam dengan air bersuhu 60ºC selama 24 jam. Biji yang tenggelam dipilih untuk ditanam pada media persemaian selama 2 minggu, lalu dipindahkan ke dalam polibag yang berukuran 12 x 20 cm berukuran 2 kg dengan media tanah seberat 1,2 kg. Tanah disterilisasi terlebih dahulu menggunakan autoklaf. Setiap perlakuan dilakukan dengan tiga kali ulangan (Tabel 1). Pengukuran tinggi tanaman dilakukan setiap minggu hingga 83 hari setelah tanam (HST). Variabel yang diukur ialah panjang batang, diameter akar, dan bobot tanaman.
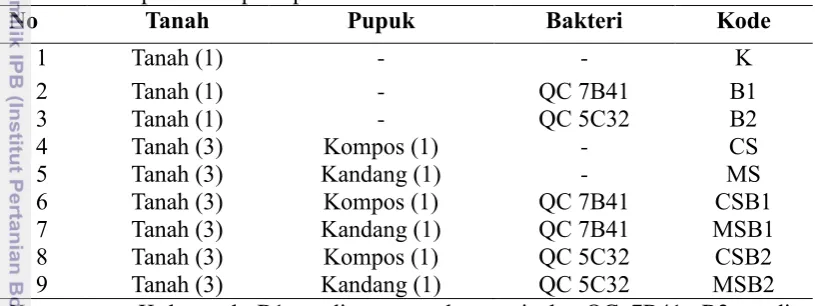
Tabel 1 Jenis perlakuan pada pembibitan tanaman lamtoro
No Tanah Pupuk Bakteri Kode
6 Tanah (3) Kompos (1) QC 7B41 CSB1
7 Tanah (3) Kandang (1) QC 7B41 MSB1
8 Tanah (3) Kompos (1) QC 5C32 CSB2
9 Tanah (3) Kandang (1) QC 5C32 MSB2
Keterangan: K=kontrol; B1=media tanam dengan isolat QC 7B41; B2=media tanah dengan isolat QC 5C32; CS=media tanam dengan pupuk kompos (compost soil); MS=media tanam dengan pupuk kandang (manure soil).
Penyiraman suspensi bakteri dilakukan sebanyak 3 kali pada hari 0, ke-14, dan ke-28 HST. Bakteri penghasil IAA yang digunakan sebanyak 7 ml suspensi dan disiram pada bagian permukaan tanah polibag yang berisi bibit lamtoro. Isolat yang akan disiram ditumbuhkan pada media NB dengan penambahan 1 mM L-Triptofan selama 24 jam, lalu dipindah pada media yang sama sebagai media produksi sesuai dengan waktu pencapaian produksi IAA tertinggi masing-masing isolat.
Perkiraan Jumlah Sel Bakteri Di dalam Tanah dengan Metode Total Plate
Count (TPC)
Sebanyak 1 gram tanah dari masing-masing perlakuan diencerkan dalam garam fisiologis 0,85% hingga pengenceran ke-6. Hasil pengenceran disebar di cawan yang berisi media nutrient agar (NA) dan NA dengan penambahan 1mM L-triptofan, lalu diinkubasi selama 24 jam. Pengukuran ini dilakukan pada hari ke-50 dan ke-80 HST.
Analisis Data
4
Statistic. Apabila terdapat perbedaan nyata dilanjutkan dengan uji lanjut Duncan (Duncan Multiple Range Test) pada taraf 5 %.
HASIL DAN PEMBAHASAN
Uji Hipersensitivitas Isolat terhadap Daun Tembakau
Lima isolat bakteri penghasil IAA yaitu QC 6B33, QC 5C31, QC 5C31, QC 7B41, dan QC 5C32 yang telah tumbuh optimum diuji hipersensitivitasnya pada daun tembakau dibandingkan dengan akuades sebagai kontrol negatif dan bakteri patogen Xanthomonas oryzae pv. oryzae sebagai kontrol positif. Berdasarkan pengamatan yang dilakukan pada jam ke-48, terdapat 3 isolat yang menyebabkan nekrosis pada tanaman seperti kontrol positif, yaitu isolat QC 5C31, QC 6B31, dan QC 5C31. Dua isolat yang besifat nonpatogen, yaitu QC 7B41 dan QC 5C32. Isolat-isolat nonpatogen tidak menyebabkan nekrosis pada tumbuhan. Isolat-isolat nonpatogen tersebut digunakan untuk pengujian produksi IAA (Gambar 1).
(a) (b) (c) (d)
(e) (f) (g)
Gambar 1 Uji hipersensitivitas kelima isolat bakteri penghasil IAA umur 48 jam dengan menggunakan daun tembakau (a) Akuades (kontrol negatif), (b) Xanthomonas oryzae pv. oryzae (kontrol positif), (c) Isolat QC 6B33, (d) Isolat QC 5C31, (e) Isolat QC 5C31, (f) Isolat QC 7B41, dan (g) Isolat QC 5C32
Uji Kemampuan Bakteri yang Menghasilkan IAA
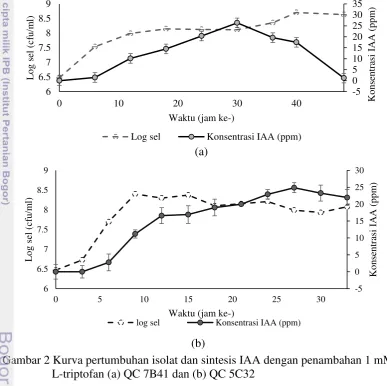
5 QC 7B41 mengalami fase lag dari jam 0 hingga 6, lalu fase log dari jam ke-6 hingga jam ke-12. Fase selanjutnya ialah fase stasioner yang dimulai dari jam ke-12 hingga seterusnnya. Isolat QC 5C32 mengalami fase lag dari jam ke-0 hingga jam ke-6, lalu fase log pada jam ke-6 hingga jam ke-12. Fase stasioner isolat QC 5C32 terjadi setelah jam ke-12 masa pertumbuhan. Kedua isolat memproduksi IAA pada fase stasioner pertumbuhan bakteri. Produksi IAA dari isolat tertinggi pada jam ke-27 untuk isolat QC5C-32 dengan konsentrasi 24.85 ppm dan jam ke-30 untuk isolat 7B 41 dengan konsentrasi 28.16 ppm. Masing-masing produksi IAA tertinggi tersebut didapatkan pada fase stasioner isolat (Gambar 2).
Gambar 2 Kurva pertumbuhan isolat dan sintesis IAA dengan penambahan 1 mM L-triptofan (a) QC 7B41 dan (b) QC 5C32
Pengujian Isolat Bakteri pada Penanaman Bibit Lamtoro
6
pertumbuhan tanaman dan isolat bakteri juga memberikan pengaruh terhadap pertumbuhan akar lateral lamtoro. Parameter lainnya yang diukur ialah bobot kering dan bobot basah akar dan tajuk. Dua parameter ini tidak memberikan hasil yang cukup baik, karena tidak adanya perbedaan antara kontrol dengan perlakuan media tanam yang disiram inokulum bakteri (Tabel 2), (Lampiran 4).
Tabel 2 Pengaruh penyiraman inokulasi bakteri penghasil IAA terhadap pertumbuhan Lamtoro yang berumur 83 hari setelah tanam
Perlakuan Panjang 5C32; CS=media tanam dengan pupuk kompos (compost soil); MS=media tanam dengan pupuk kandang (manure soil).
Perkiraan Jumlah Sel Bakteri Di dalam Tanah dengan Metode Total Plate
Count (TPC)
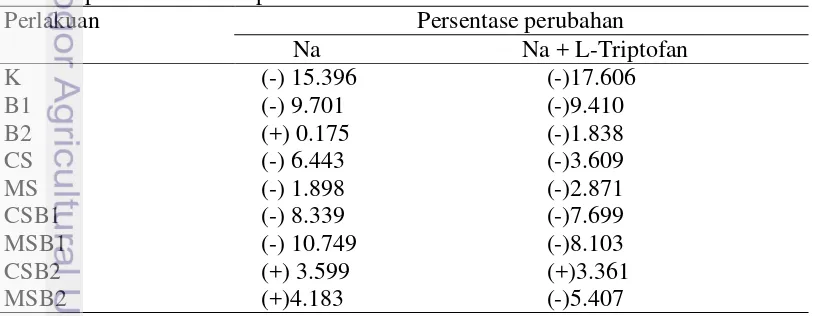
Pada hari ke-50 dan ke-80 HST dilakukan metode cawan sebar dari masing-masing tanah perlakuan media tanam lamtoro (Gambar 3). Pengurangan jumlah bakteri di tanah terjadi pada semua jenis perlakuan. Pengurangan jumlah sel bakteri paling banyak terjadi pada perlakuan kontrol (Tabel 3).
7 Keterangan: Tanda (-) menunjukkan penurunan dan (+) menunjukkan kenaikan jumlah log sel bakteri dari hari ke-50 hingga hari ke-80 HST. K=kontrol; B1=media tanam dengan isolat QC 7B41; B2=media tanah dengan isolat QC 5C32; CS=media tanam dengan pupuk kompos (compost soil); MS=media tanam dengan pupuk kandang (manure soil).
Gambar 3 Log sel hasil TPC asal tanah semua perlakuan. (a) hari ke-50 setelah hipersensitivitas menunjukkan 2 isolat bersifat nonpatogen yaitu QC 7B41 dan QC 5C32. Uji hipersensitivitas merupakan pengujian terhadap program kematian sel yang cepat dan terlokalisasi yang muncul saat pengenalan patogen. Induksi
8
reaksi hipersensitif dan patogenisitas dipengaruhi oleh gen hrp (hypersensitive reaction and pathogenicity) yang umum ditemukan pada bakteri Gram negatif patogen tanaman, termasuk kelompok Xanthomonas sp. (Zhu et al. 1992). Isolat yang bersifat nonpatogen tersebut diketahui mempunyai kemampuan menghasilkan Indole-3-Acetic-Acid (IAA).
Mikrob yang diisolasi dari bermacam jenis tanah mempunyai kemampuan untuk memproduksi IAA sebagai metabolit sekundernya dalam keadaan kaya subtrat, yaitu triptofan. IAA merupakan derivat metabolisme triptofan yang jalurnya dapat dibagi menjadi dua, yaitu: jalur yang bergantung pada triptofan dan jalur yang tidak bergantung pada triptofan. Lebih dari satu jalur dapat muncul pada mikrob (Patten dan Glick 2002), antara lain triptofan dikonversi menjadi
Indole-3-Acetamide (IAM) oleh tryptophan-2-monooxigenase dan IAM diubah menjadi IAA oleh IAM-hydrolase (Matsukawa et al. 2007).
Produksi IAA diukur dengan metode kolorimetri yang mengindikasikan adanya IAA dari tingkatan kepekatan warna merah yang terbentuk karena adanya cincin indol (Lindow et al. 1998). Cincin indol terbentuk setelah supernatan isolat direaksikan dengan reagen Salkowski. Salkowski merupakan reagen pewarna yang dapat digunakan untuk menguji senyawa indol dan turunannya. Reagen Salkowski akan mengoksidasi senyawa indol dan turunannya. Indol ialah senyawa organik golongan aromatik yang memiliki struktur bisiklik yang terdiri atas cincin benzen (Joule dan Mills 2000). IAA merupakan salah satu contoh senyawa yang memiliki gugus indol sehingga akan reaksinya dengan Salkwoski akan menghasilkan warna merah muda. Kepekatan warna merah berbanding lurus dengan peningkatan konsentrasi IAA yang diproduksi (Ehmann 1977).
Inokulasi bakteri ke dalam tanah dilakukan dengan cara penyiraman. Aplikasi menggunakan ekstrak kultur yang diencerkan atau inokulum bakteri penghasil IAA dengan kepadatan yang rendah dapat menstimulasi perpanjangan akar utama. IAA yang disekresikan oleh bakteri meningkatkan pertumbuhan akar tanaman secara langsung dengan menstimulasi pemanjangan sel atau pembelahan sel (Patten dan Glick 2002).
IAA merupakan zat pengatur pertumbuhan yang penting bagi tanaman sehingga sintesisnya oleh jenis bakteri tertentu merupakan salah satu alasan dapat menyebabkan peningkatan pertumbuhan tanaman yang diuji. Kemampuan produksi IAA dari kedua isolat bakteri yang diujikan tidak berpengaruh besar terhadap pertambahan tinggi tanaman sehingga tinggi tanaman tidak dapat menggambarkan kinerja isolat bakteri yang diinokulasikan. IAA mendorong pemanjangan batang hanya pada konsentrasi tertentu yaitu 0,9 g/l, di atas atau di bawah konsentrasi tersebut IAA akan menghambat pemanjangan sel batang (Dewi 2008). Pengaruh penghambatan ini terjadi karena tanaman menyintesis zat pengatur pertumbuhan (ZPT) lain seperti etilen yang memberikan pengaruh berlawanan dengan IAA. Selain itu alasan lain yang menyebabkan variasi tinggi tanaman ialah kadar IAA yang rendah dapat menyebabkan pemanjangan baik pada pucuk maupun pada akar. Jika konsentrasi IAA lebih tinggi, efeknya menjadi berlawanan sehingga pemanjangan pucuk dan akar menjadi terhambat (Moore 1989).
9 memberi pengaruh baik terhadap pertambahan panjang akar. Tinggi tanaman yang paling tinggi ditunjukkan oleh komposisi media tanam ditambah pupuk kompos dan isolat bakteri QC 7B41. Namun apabila isolat QC 7B41 ditambah pupuk kandang menunjukkan respon yang kurang baik, yaitu akar primernya lebih pendek daripada tanpa pupuk kandang. Menurut Salisbury dan Ross (1995) hal tersebut dikarenakan morfologi akar ditentukan oleh ditentukan oleh jumlah hara yang tersedia di dalam tanah. Apabila hara tersedia dalam jumlah yang cukup maka tanaman akan membentuk sistem akar yang dangkal.
Selain panjang akar primer, IAA juga mempengaruhi jumlah akar lateral. Respon tanaman lamtoro terhadap pemberian inokulum bakteri cenderung positif. Hal tersebut ditunjukkan oleh semua perlakuan dengan yang disiram bakteri relatif berbeda dengan kontrol. IAA membantu proses perpanjangan akar dengan memperbanyak rambut akar dan akar lateral (Datta dan Basu 2000). Parameter diameter akar primer yang diukur saat panen menunjukkan hasil yang sama besar sekitar 0,3 cm. hal tersebut menunjukkan bahwa IAA yang dihasilkan bakteri relatif tidak berpengaruh pada pembesaran diameter akar primer, hal tersebut dikarenakan pertambahan besar dipengaruhi oleh ZPT utama yaitu giberelin (Wattimena 1998).
Bobot basah dan bobot kering ditimbang setelah panen atau hari ke-83 hari setelah tanam (HST). Mekanisme kerja IAA dalam perpanjangan sel ialah mendorong elongasi sel pada koleoptil dan ruas tanaman (Salisbury dan Ross 1995). Elongasi tersebut tersebut dapat diikuti oleh pembesaran sel dan peningkatan bobot basah tanaman. Hampir sama dengan data tinggi tanaman yang dihasilkan, bobot basah dan bobot kering tajuk maupun akar tidak dapat menjelaskan positif pengaruh bakteri yang diinokulasikan. Bobot basah dan kering akar pada perlakuan kontrol sendiri lebih besar daripada semua perlakuan lainnya. Pemberian inokulum bakteri tidak mempengaruhi bobot basah maupun kering tanaman lamtoro karena pemberian inokulum bakteri ke dalam tanah hanya menunjukkan pengaruh yang dapat diamati pada pertumbuhan akar (Patten dan Glick 2002).
Jumlah sel bakteri di dalam tanah pada masing-masing perlakuan dapat diketahui dengan metode cawan sebar. Jumlah sel bakteri di dalam tanah bervariasi pada masing-masing perlakuan. Hasil perhitungan koloni menunjukkan adanya perbedaan jumlah sel bakteri pada perlakuan kontrol dan perlakuan yang disiram dengan penambahan bakteri pada hari 50 dan hari 80 HST. Hari ke-50 HST dipilih karena terakhir inokulasi bakteri pada hari ke-28. Fase awal tanaman legum berinteraksi dengan bakteri yang diinokulasikan ialah 12 hari setelah penyiraman suspensi bakteri (Kouchi et al. 2004). Pemeriksaan sel bakteri tanah dilakukan selanjutnya pada hari ke-80 HST untuk memastikan jumlah bakteri sebelum pemanenan tanaman lamtoro.
10
dan isolat QC 7B41. Hal tersebut sejalan dengan panjang akar primer yang dihasilkan, hal ini dapat dijelaskan bahwa bakteri memanfaatkan eksudat yang dikeluarkan akar tanaman lamtoro sebagai sumber nutrisinya (Lambers et al. 2009).
Berdasarkan identifikasi menggunakan KIT API 50 CH, isolat QC 7B41 dan QC 5C32 memiliki kemiripan dengan Bacillus megaterium sebesar 99,9% (Dwiana 2015). Bacillus megaterium termasuk kelompok Plamt Growth Promoting Rhizobacteria (PGPR) (Liang et al. 2011) diketahui juga mampu meningkatkan pertumbuhan tanaman, perkembangan akar, meningkatkan jumlah akar lateral, serta panjang rambut akar (Lopez-Bucio et al. 2007). Bacillus megaterium yang diisolasi dari tanah bekas tambang batuan kapur mempunyai mempunyai potensi menghasilkan IAA.
SIMPULAN DAN SARAN
Simpulan
Dua isolat dari 5 isolat terpilih yang berasal dari tanah bekas tambang batuan kapur yaitu isolat QC 7B41 dan QC 5C32 mampu menghasilkan Indole-3-Acetic Acid (IAA). IAA dihasilkan secara maksimum pada jam ke-33 untuk isolat QC 7B41 dengan konsentrasi 28.16 ppm dan jam ke-27 untuk isolat QC 5C32 dengan konsentrasi 24.85 ppm. Pemberian isolat berpengaruh terhadap jumlah akar lateral dan panjang akar primer tanaman lamtoro (Leucaena leucocephala) hingga hari ke-83 setelah tanam.
Saran
Perlu penelitian lanjutan untuk mengetahui potensi isolat penghasil Indole-3-Acetic Acid (IAA) dengan menggunakan tanah bekas tambang batuan kapur. Selain itu, identifikasi molekuler menggunakan 16s rRNA juga diperlukan agar diketahui secara pasti spesies bakteri.
DAFTAR PUSTAKA
Algunadi IG, Ida BMA, Sutarjo. 2013. Analisis dampak penambangan batu kapur terhadap lingkungan di Kecamatan Nusa Penida. J Pend Geog. 3(1):2-14. Datta C, Basu P. 2000. Indole acetic acid production by a rhizobium species from
root nodules of a leguminous shrub Cajanus cojan. Microbiology. 155(2):123-127.
11 Dwiana A. 2015. Isolasi dan karakterisasi bakteri penghasil Indole-3-Acetic Acid
dari area penambangan batu kapur [skripsi]. Bogor (ID): Departemen Biologi, FMIPA, IPB.
Ehmann A. 1977. The Van Urk-Salkwoski reagent-a sensitive and specific chromogenic reagent for silica gel thin-layer chromatographic detection and identification of indole derivates. J Chrom. 132:267-276.
Frankenberger WT, Arshad. 1995. Phytohormones in Soils, Microbial Production and Function. New York (US): Marcel Dekker.
Gordon SA, Weber RP. 1950. Colorimetric estimation of indolacetic acid. Plant Physiol. 26(1):192-195.
Joule JA, Mills K. 2000. Heterocyclic Chemistry. Oxford (GB): Blackwell Science.
Kloepper JW, Scrroth MN. 1978. Plant growth promoting rhizobacteria on radish. Di dalam: Station de Pathologie Végétale et Phytobactériologie, editor.
Proceedings of the 4th International Conference on Plant Pathogenic Bacteria; 27 Agustus – 2 September 1978. Berkeley, USA. California (US): Department of Plant Pathology, University of California. hlm 879-882.
Kouchi H et al. 2004. Large-scale analysis of gene expresiion profiles during stages of root nodule formation in a model legume, japonicas. DNA Res. 11: 263-274.
Lambers H, Mougel C, Jaillard B, Hinsinger P. 2009. Plant-microbe-soil interactions in the rhizosphere. Plant Soil. 321: 83-115.
Lay BW, Hastowo. 1992. Mikrobiologi. Jakarta (ID): Rajawali press.
Liang J, Tao R, Hao Z, Wang L, Zhang X. 2011. Induction of resistance in cucumber against seedling damping-off by Plant Growth Promoting Rhizobacteria (PGPR) Bacillus megaterium strain L8. Afr J Biotechnol. 10(36):6920-2927.
Lindow E, Desurmont C, Elkins R, G. McGourty, Clark EM, Brand MT. 1998. Occurrence of Indole-3-Acetic acid-producing bacteria on pear trees and their association with fruit russet. Phytopathology. 11(88):1149-1157.
Lopez-Bucio J, Campos-Cuevaz JC, Hernandez-Calderon E, Velasquez-Becerra C, Farias-Rodriguez R, Macias-Rodriguez LI, Valencia-Cantero E. 2007.
Bacillus megaterium rhizobacteria promote growth and alter root-system architectur through an auxin and etylene-independent signaling mechanism in
Arabidopsis thaliana. Molec Plant-Microbe Interact. 20(2):207-217.
Matsukawa E, Nakagawa Y, Iimura, Y, Hayakawa M. 2007. Stimulatory effect of indole-3-acetic acid on aerial mycelium formation and antibiotic production in
Streptomyces spp. Actinomycetologica. 21(1):32-39.
Moore TC. 1989. Biochemistry and Physiology of Plant Hormones. New York (US): Springer-Verlag.
Patten CL, Glick RJ. 2002. Role of Pseudomonas putida indo lactic acid in development of the host plant root system. Appl Environ Microbiol. 68(70):3795-3801.
12
Purwantari ND, Sajimin. 2006. Produksi hijauan beberapa jenis leguminosa pohon untuk pakan ternak. Seminar Nasional Tekonologi Peternakan dan Veteriner. 5-6 September 2006. Bogor, Indonesia. Bogor (ID): Balai Penelitian Ternak. hlm 952-957.
Salisbury FB, Ross CW. 1995. Fisiologi Tumbuhan. Bandung (ID): Institut Teknologi Bandung.
Siswomartono D. 1989. Ensiklopedi Konservasi Sumber Daya. Jakarta (ID): Erlangga.
Suriadikarta DA, Setyorini D. 2005. Baku Mutu Pupuk Organik, dalam Pupuk Organik dan Pupuk Hayati. Jawa Barat (ID): Balai Besar Penelitian dan Pengembangan Sumberdaya Lahan Pertanian, Departemen Pertanian.
Van Gestel M, Merckx R, Vlassak K. 1996. Spatial distribution of microbial biomass in microorgagregates of a silty-loam soil and the relation with the resistance of microorganisms to soil drying. Soil Biol Biochem. 28(5):503-510. Wattimena. 1998. Zat Pengatur Tumbuh Tanaman. Bogor (ID): PAU
Bioteknologi IPB.
13
LAMPIRAN
Lampiran 1 Kurva standar pengukuran IAA
Lampiran 2 Kurva standar
pertumbuhan isolat QC 7B41
14
Lampiran 4 Hasil Analysis of Variance (Anova) masing-masing parameter pada saat panen (Hari ke-83 HST)
Analysis of Variance (Anova) panjang tajuk
Sumber db JK KT F F.05 F.01 F-Prob Perlakuan 8 127,6296 15,9537 0,93 2,51 3,71 0,5132 Galat 18 307,3333 17,0741
Total 26 434,9630 16,7293
Analysis of Variance (Anova) panjang akar primer
Sumber db JK KT F F.05 F.01 F-Prob Perlakuan 8 100,6667 12,5833 5,39 2,51 3,71 0,0018 Galat 18 42,0000 2,3333
Total 26 142,6667 5,4872
Analysis of Variance (Anova) diameter akar
Sumber db JK KT F F.05 F.01 F-Prob Perlakuan 8 0,0072 0,0009 0,73 2,51 3,71 0,6637 Galat 18 0,0222 0,0012
Total 26 0,0295 0,0011
Analysis of Variance (Anova) jumlah akar lateral
Sumber db JK KT F F.05 F.01 F-Prob Perlakuan 8 1796,2963 224,5370 5,62 2,51 3,71 0,0014 Galat 18 719,3333 39,9630
Total 26 2515,6296 96,7550
Analysis of Variance (Anova) bobot basah tajuk
Sumber db JK KT F F.05 F.01 F-Prob Perlakuan 8 0,9630 0,1204 0,46 2,51 3,71 0,8654 Galat 18 4,6667 0,2593
15
Analysis of Variance (Anova) bobot basah akar
Sumber db JK KT F F.05 F.01 F-Prob
Perlakuan 8 0,1054 0,0132 0,97 2,51 3,71 0,5093 Galat 18 0,2450 0,0136
Total 26 0,3504 0,0135
Analysis of Variance (Anova) bobot kering tajuk
Sumber db JK KT F F.05 F.01 F-Prob Perlakuan 8 0,0817 0,0102 0,57 2,51 3,71 0,7884 Galat 18 0,3217 0,0179
Total 26 0,4034 0,0155
Analysis of Variance (Anova) bobot kering akar
Sumber db JK KT F F.05 F.01 F-Prob Perlakuan 8 0,0231 0,0029 1,08 2,51 3,71 0,4196 Galat 18 0,0482 0,0027
Total 26 0,0713 0,0027
Keterangan:
16
RIWAYAT HIDUP
Penulis dilahirkan di Muaro Sijunjung, 20 Maret 1993 dari Ayah M. Duya dan Ibu Rasyidah. Penulis merupakan anak pertama dari empat bersaudara. Tahun 2011 penulis lulus dari SMA Negeri 1 Sijunjung dan pada tahun yang sama penulis lulus seleksi IPB melalui jalur SNMPTN Undangan di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam. Penulis mendapatkan beasiswa Peningkatan Prestasi Akademik dari DIKTI pada tahun 2013-2014.
Penulis pernah mengikuti beberapa kepanitiaan selama kuliah di IPB baik di tingkat fakultas maupun departemen. Di tingkat departemen penulis ikut menjadi anggota logistik dan transportasi dalam acara BIONIC 2013. Di tingkat fakultas, penulis dua kali ikut divisi Leisure Officer (LO) Pesta Sains Nasional (PSN) 2013 dan 2014. Kepanitian terakhir yang diikuti penulis pada masa studi adalah LO pada International Conference of Biology (ICoBio 2015).
Selama masa perkuliahan, penulis aktif menjadi asisten praktikum Biologi Dasar (2013-2015), Genetika Dasar (2013), dan Mikrobiologi Dasar (2015). Alih semester tahun 2013, penulis melaksanakan studi lapangan dengan judul Isolasi Bakteri Mananolitik di Cagar Alam dan Taman Wisata Alam Telaga Warna, Bogor. Setelah itu, Juni 2014, penulis melaksanakan praktik lapangan dengan judul Analisis Proses Produksi Tandan Buah Sawit menjadi Crude Palm Oil