PEMANFAATAN GLISEROL DAN TURUNANNYA
SEBAGAI PLASTICIZER PADA EDIBLE FILM
GELATIN YANG DIINKORPORASI DENGAN
MINYAK ATSIRI KULIT KAYU MANIS
(Cinnamomum burmanii) SEBAGAI
ANTIMIKROBA
DISERTASI
OLEH
ADIL GINTING
078103001/KIM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PEMANFAATAN GLISEROL DAN TURUNANNYA
SEBAGAI PLASTICIZER PADA EDIBLE FILM
GELATIN YANG DIINKORPORASI DENGAN
MINYAK ATSIRI KULIT KAYU MANIS
(Cinnamomum burmanii) SEBAGAI
ANTIMIKROBA
DISERTASI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Doktor
Dalam Program Studi Kimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Sumatera Utara
OLEH
ADIL GINTING
078103001/KIM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS
SUMATERA
UTARA
Judul Disertasi : PEMANFAATAN GLISEROL DAN
TURUNANNYA SEBAGAI PLASTICIZER PADA EDIBLE FILM GELATIN YANG DIINKORPORASI DENGAN MINYAK
ATSIRI KULIT KAYU MANIS (Cinnamomum burmanii) SEBAGAI ANTIMIKROBA
Nama Mahasiswa : Adil Ginting Nomor Pokok : 078103001/KIM Program Studi : Doktor Ilmu Kimia
Menyetujui, Komisi Pembimbing
Promotor Prof. Dr. Tonel Barus
Prof. Dr. Jamaran Kaban, M.Sc.
Co.Promotor Co.Promotor
Prof. Dr. Yunazar Manjang
Ketua Program Studi Dekan
(Prof. Basuki Wiryosentono, MS., Ph.D.) (Dr. Sutarman, M.Sc.)
Telah diuji pada
Tanggal : 12 Juli 2012
PANITIA PENGUJI DISERTASI
Ketua : Prof.Dr.Tonel Barus
Anggota : 1. Prof.Dr.Jamaran Kaban,MSc. 2.Prof.Dr.Yunazar Manjang
3.Prof.Basuki Wirjosentono ,MS.,Ph.D.
4.Dr.M.Pandapotan Nasution,MPS.
PERNYATAAN ORISINALITAS
PEMANFAATAN GLISEROL DAN TURUNANNYA
SEBAGAI PLASTICIZER PADA EDIBLE FILM
GELATIN YANG DIINKORPORASI DENGAN
MINYAK ATSIRI KULITKAYU MANIS
(Cinnamomum burmanii) SEBAGAI
ANTIMIKROBA
DISERTASI
Dengan ini saya menyatakan bahwa dalam disertasi ini tidak terdapat karya Yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan Tinggi dan sepanjang sepengetahuan saya tidak terdapat karya atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain kecuali secara tertulis diacu dalam naskah dan disebut sumbernya dalam daftar pustaka.
Medan, 12 Juli 2012
PERNYATAAN PERSETUJUAN PUBLIKASI
Sebagai sivitas akademika Universitas Sumatera Utara saya yang bertanda tangan dibawah ini :
Nama : Adil Ginting Nomor Pokok : 078103001
Program Studi : Doktor Ilmu Kimia Jenis Karya Ilmiah : Disertasi
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Eksklusif (Non-Exclusive Royalty Free Right) atas Disertasi yang berjudul:
PEMANFAATAN GLISEROL DAN TURUNANNYA
SEBAGAI PLASTICIZER PADA EDIBLE FILM
GELATIN YANG DIINKORPORASI DENGAN
MINYAK ATSIRI KULIT KAYU MANIS
(Cinnamomum burmanii) SEBAGAI
ANTIMIKROBA
Beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Non-Eksklusif ini.Universitas Sumatera Utara berhak menyimpan, mengalih media, memformat, mengelola dalam bentuk data-base, merawat dan mempublikasikan Disertasi saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan pemegang dan atau sebagai pemilik hak cipta.
Demikian pernyataan ini dibuat dengan sebenarnya.
Medan, 12 Juli 2012
Judul Disertasi : PEMANFAATAN GLISEROL DAN
TURUNANNYA SEBAGAI PLASTICIZER PADA EDIBLE FILM GELATIN YANG DIINKORPORASI DENGAN MINYAK
ATSIRI KULIT KAYU MANIS (Cinnamomum burmanii) SEBAGAI ANTIMIKROBA
Nama Mahasiswa : Adil Ginting Nomor Pokok : 078103001/KIM Program Studi : Doktor Ilmu Kimia
Menyetujui, Komisi Pembimbing
Prof. Dr. Tonel Barus Promotor
Prof. Dr. Jamaran Kaban, M.Sc. Prof. Dr. Yunazar Manjang
Co.Promotor Co.Promotor
Ketua Program Studi Dekan
(Prof. Basuki Wiryosentono, MS., Ph.D.) (Dr. Sutarman, M.Sc.)
UCAPAN TERIMA KASIH
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas kasih dan anugrahNya penulis dapat menyelesaikan penelitian dan penyusunan disertasi ini. Dengan selesainya disertasi ini, perkenankanlah saya dengan hati yang tulus menyampaikan rasa hormat dan terima kasih serta penghargaan yang setinggi-tingginya kepada yang terhormat:
1.Prof.Dr.dr.Syahril Pasaribu,DTM&H,MSc. (CTM).Sp.A(K) selaku Rektor Universitas Sumatera Utara,yang telah memberi kesempatan kepada saya untuk mengikuti Program S3 Ilmu Kimia pada Departemen Kimia FMIPA- USU.
2.Dr.Sutarman selaku Dekan FMIPA Universitas Sumatera Utara atas kesempatan dan fasilitas yang diberikan kepada kami untuk mengikuti program S3 Ilmu Kimia.
3.Prof.Basuki Wiryosentono.MS,PhD. Selaku Ketua Program S3 Kimia yang Telah memberikan dorongan kepada saya untuk dapat segera menyelesaikan Program S3 Ilmu Kimia.
4.Dr.Rumondang Bulan MS selaku Ketua Departemen Kimia FMIPA Universitas Sumatera Utara atas kesempatan, kerja sama yang baik serta fasilitas sehingga saya dapat mengikuti dan menyelesaikan program S3 Ilmu
Kimia.
5.Prof.Dr.Tonel Barus selaku Promotor, Prof.Dr.Jamaran Kaban MSc. dan Prof.Dr.Yunazar Manjang, sebagai Co-promotor , yang dengan segala kesabaran dan tanpa bosan-bosannya telah banyak memberikan bimbingan sehingga saya dapat menyelesaikan disertasi ini.
6.Dr.M.Pandapotan Nasution,MPS. Dan Dr.Hamonangan Nainggolan, MSc.,selaku tim penguji, atas kesedian beliau untuk memberikan penilaian maupun saran-saran untuk perbaikan dan penyempurnaan disertasi saya. 7.Peserta program S3, stambuk 2007 Ilmu Kimia yang begitu banyak
membantu penulis sehingga disertasi ini dapat selesai.
Pada kesempatan ini tak lupa saya mengenang alm. Ayah saya beserta Ibu atas jasa-jasa mereka yang telah melahirkan, membesarkan dan mendidik saya dengan sepenuh hati serta memberikan dorongan kepada saya untuk terus belajar sehingga saya dapat mencapai tingkat pendidikan seperti sekarang ini. Kepada Isteriku tercinta Dra.Lina Tarigan Apt.MS. dan anak-anakku tersayang Maria Isabella A.Ginting.,Inda Sari Meilia A.Ginting.S.Sos.,Adli Reynaldo A.Ginting serta menantuku Rudi Astra Sinulingga MSc. serta cucuku tersayang Ibreina Elisabeth br.Sinulingga yang telah memberikan bantuan moril dan semangat sehingga saya dapat menyelesaikan disertasi ini
Akhirnya kepada semua pihak yang telah banyak membantu, baik langsung maupun tidak langsung, hanya Bapa disorgalah yang mampu memberikan balasan terbaik.Mudah-mudahan disertasi ini dapat memberikan sumbangan yang berharga bagi perkembangan Ilmu Kimia Khususnya Kimia Organik sintesa dan aplikasinya.Semoga Tuhan selalu memberikan rahmat dan kasih karuniaNya kepada kita semua.
Medan, Juli 2012 Penulis
PEMANFAATAN GLISEROL DAN TURUNANNYA SEBAGAI
PLASTICIZER
PADA
EDIBLE FILM
GELATIN YANG
DIINKORPORASI DENGAN MINYAK ATSIRI
KULIT KAYU MANIS (
Cinnamomum
burmanii
)SEBAGAI ANTIMIKROBA
ABSTRAK
Dalam penelitian ini telah dilakukan pembuatan edible film gelatin yang diinkorporasi dengan minyak atsiri kulit kayu manis dengan plasticizer gliserol dan gliseril monooleat. Produk tersebut dikarakterisasi dengan SEM,FT-IR, ketebalan film, kekuatan tarik dan kemuluran, aktivitas air(Aw), uji laju transmisi uap air,analisis termal difrensial(DTA),
analisis kalorimetri difrensial (DSC), swelling,,uji antimikrobanya serta aplikasi terhadap ikan tongkol.Secara umum perbedaan plasticizer gliserol dan gliseril monooleat menambah ketebalan, kekuatan tarik, persentase pertambahan panjang, , dan mengurangi aktivitas air(Aw), laju transmisi uap air, swelling pada 30 menit, analisis termal difrensial,
analisis kalorimetri difrensial dan aplikasi terhadap ikan tongkol. Pengujian morfologi permukaan dengan SEM menunjukkan bahwa permukaan film dengan menggunakan
plasticizer gliserol permukaanya kasar dibandingkan dengan penggunaan plasticizer
gliseril monooleat dikarenakan penambahan minyak atsiri kulit kayu manis yang bersifat non polar tidak terjadi percampuran sempurna dari gelatin-gliserol-minyak atsiri kulit kayu manis.Dari spektrum FT-IR kedua film pelapis gelatin-gliserol-minyak atsiri kulit kayu manis dan gelatin-gliseril monooleat-minyak atsiri kulit kayu manis tidak memperlihatkan terdapatnya penambahan gugus fungsi yang baru. Hal ini berarti tidak terjadi reaksi antara gelatin, gliserol dan minyak atsiri kulit kayu manis, demikian juga gelatin, gliseril monooleat dan minyak atsiri kulit kayu manis.
THE UTILIZATION OF GLYCEROL AND DERIVATIVES
AS A PLASTICIZER IN EDIBLE GELATIN FILM THAT
INCORPORATI0N WITH THE ESSENTIAL OIL
OF CINNAMON BARK(Cinnamomum
burmanii)AS AN ANTIMICROBIAL
ABSTRACT
In this reseach has been conducted by making gelatin edible films incorporation with cinnamon bark essential oil with the plasticizer glycerol and glyceryl monooleate. Products are characterized by SEM, FT-IR, film thickness, tensile strength and elongation,water activity (Aw), water vapor transmission rate (WVTR), difrensial thermal analysis (DTA), analyze difrensial scanning calorimetry (DSC), Swelling, test, and application of the antimicrobial fish tuna. In general, the difference of plasticizer glycerol and glyceryl monooleate were the increase of thickness, tensile strength, percentage elongation of the length, and were the decrease of water activity (Aw), water vapor transmission rate, swelling
at 30 min, difrensial thermal analysis, calorimetry analysis and application to fish tongkol difrensial cob. Testing of surface morphology by SEM showed that the surface of the film by using a surface glycerol plasticizer rough compared to the use of plasticizer glyceryl monooleate due to the addition of cinnamon bark essential oil is non-polar does not happen perfect mixture of gelatin-glycerol-bark essential oil.From FT-IR spectrum of both edible film gelatin-glycerol-cinnamon bark essential oil and gelatin-glyceryl monooleate-cinnamon bark essential oil did not show the presence of the addition of new functional group. This means that no reaction occurs between gelatin, glycerol and cinnamon bark essential oil, as well as gelatin, glyceryl monooleate and cinnamon bark essential oil.
DAFTAR ISI
Halaman
KATA PENGANTAR i
ABSTRAK iii
ABSTRACT iv
DAFTAR ISI v
DAFTAR TABEL ix
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xii
BAB 1. PENDAHULUAN 1
1.1.Latar Belakang 1
1.2.Perumusan Masalah 4
1.3.Hipotesa Penelitian 4
1.4.Tujuan Penelitian 4
1.5.Manfaat Penelitian 4
BAB 2 . TINJAUAN PUSTAKA 6
2.1 Edible film dan Edible coating 6
2.1.1.Edible Film 6
2.1.2.Edible coating 7
2.1.3. Edible film dari gelatin 8
2.1.4.Edible film gelatin dan antimikroba 14
2.2.Plasticizer 15
2.2.1.Plasticizer Gliserol 16
2.2.2.Plasticizer Turunan Gliserol 17
2.2.2.1.Gliseril Monooleat 17
2.3.Minyak Atsiri 19
2.4. Sifat -Sifat Edible Film 20 2.4.1.Aktivitas Air (Aw
2.4.2.Scanning Electron Microscope (SEM) 23
) 21
2.4.3.Uji Tarik dan Kemuluran 24
2.4.4.Permeabilitas Uap Air 25
2.4.5.Spektroskopi Infra Merah Fourier Transform (FT-IR) 25 2.4.6.Analisis Termal Difrensial (Difrential Thermal Analysis,DTA) 26 2.4.7.Kalorimetri Skening Difrensial (Diffrential Scanning
Calorimetry,DSC) 28
BAB 3. METODE PENELITIAN 29
3.1. Bahan-bahan 29
3.2. Alat-alat 29 3.3. Prosedur Penelitian 29
3.3.1.Penyedian sampel kulit sapi 29
3.3.1.1.Pemisahan senyawa Gelatin dari Kulit Sapi 29
3.3.2..Analisis Kadar Gelatin 30
3.3.2.1.Analisis Kadar Air 30
3.3.2.2.Analisis Kadar Abu 31
3.3.2.3.Analisis Kadar Protein 31
3.3.2.4.Analisis Spektroskopi FT-IR 32 3.3.3.Isolasi Minyak Atsiri Kulit Kayu Manis dengan
Alat Destilasi Stahl 32
3.3.4.Analisis Hasil Isolasi 33
3.3.4.1.Analisis GC-MS 33
3.3.4.2.Analisis Spektroskopi FT-IR 33 3.3.4.3.Pengujian Sifat Antibakteri 33
3.3.5.Pembuatan Edible film 34
3.3.5.3.Pembuatan edible film EF2 34 3.3.6.Karakteristik Edible film 35
3.3.6.1.Pengukuran Ketebalan 35
3.3.6.2.Uji Kekuatan Tarik dan Kemuluran 35
3.3.6.3.Uji Aktivitas Air 35
3.3.6.4.Uji Laju Transmisi Uap Air 36 3.3.6.5.Analisis Spektroskopi FT-IR 36 3.3.6.6.Analisis Scanning Electron Microscopy (SEM) 36 3.3.6.7.Analisis Termal Difrensial (DTA) 37 3.3.6.8.Analisis Kalorimetri Skenning Difrensial (DSC) 37
3.3.6.9.Analisis Swelling 37
3.3.6.10.Pengujian Sifat Antibakteri 37 3.3.7.Estimasi Kepadatan Sel Isolat Bakteri dengan Cara
Standart Plate Count (SPC) 38
BAB 4. HASIL DAN PEMBAHASAN 40 4.1.Gelatin dari Kulit Sapi 41 4.1.1.Analisis Kadar Air 42
4.1.2.Analisis Kadar Abu 42
4.1.3.Analisis Kadar Protein 43
4.1.4.Analisis Spektroskopi FT-IR dari Gelatin 44
4.2.Minyak Atsiri Kulit Kayu Manis (Cinnamomum burmanii) 45 4.2.1.Komponen Kimia Minyak Atsiri Kulit Kayu Manis 45 4.2.2.Analisis Spektroskopi FT-IR Minyak Atsiri Kulit Kayu Manis 57 4.2.3.Aktivitas Antimikroba Minyak Atsiri Kulit Kayu Manis 58 4.3.Pembuatan edible film 60 4.3.1.Pengaruh Perbandingan Volume Gelatin-Gliserol 60
4.3.2.Hasil edible film 60
4.3.2.1.Ketebalan Edible film 60
4.3.2.3.Uji Kekuatan Tarik dan Kemuluran 64 4.3.2.4.Aktivitas air (Aw
4.3.2.5.Uji Laju Transmisi Uap Air 65
) 65
4.3.2.6.Analisis Spektroskopi FT-IR 66 4.3.2.7.Hasil Uji Aktivitas Antibakteri 68 4.3.2.8.Analisis Termal Difrensial (DTA) 70 4.3.2.9.Analisis Kalorimetri Difrensial (DSC) 71
4.3.2.10.Analisis Swelling 72
4.4.Hasil Uji Aplikasi Edible film terhadap ikan tongkol 73
BAB 5 .KESIMPULAN DAN SARAN 75
5.1.Kesimpulan 75
5.2.Saran 77
DAFTAR PUSTAKA 76
LAMPIRAN 89
DAFTAR TABEL
Nomor Judul Halaman
Tabel 2.1. Komposisi Asam Amino Gelatin Beberapa Jenis Hewan 11
Tabel 2.2. Standar Mutu Gelatin 12
Tabel 4.1. Hasil Analisa GC-MS Minyak Atsiri Kulit Kayu Manis 46
Tabel 4.2. Hasil Pengukuran Zona Hambat Minyak Atsiri Kulit Kayu Manis 58
Tabel 4.3. Aktivitas Antimikroba 69
Tabel 4.4. Sifat Termal Edible film 70
Tabel 4.5. Hasil Pertumbuhan Isolat Bakteri 73
DAFTAR GAMBAR
Nomor Judul Halaman
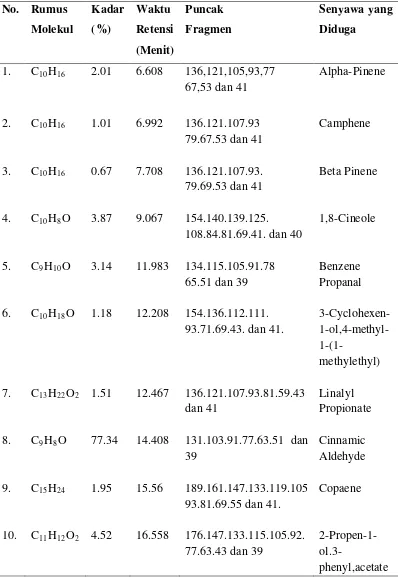
Gambar 4.1. Transisi Rantai Helik-gulungan pada kolagen 41
Gambar 4.2. Spektrum FT-IR Gelatin 44
Gambar 4.3. Kromatogram Minyak Atsiri Kulit Kayu Manis 45
Gambar 4.4. Spektrum massa Minyak Atsiri Kulit Kayu Manis dengan
RT 6.608 47
Gambar 4.5. Spektrum massa Minyak Atsiri Kulit Kayu Manis dengan
RT 6.992 48
Gambar 4.6.Spektrum massa Minyak Atsiri Kulit Kayu Manis dengan
RT 7.708 49
Gambar 4.7.Spektrum massa Minyak Atsiri Kulit Kayu Manis dengan
RT 9.067 50
Gambar 4.8. Spektrum massa Minyak Atsiri Kulit Kayu Manis dengan
RT 11.983 51
Gambar 4.9. Spektrum massa Minyak Atsiri Kulit Kayu Manis dengan
RT 12.208 52
Gambar4.10.Spektrum massa Minyak Atsiri Kulit Kayu Manis dengan
RT 12.467 53
Gambar 4.11. Spektrum massa Minyak Atsiri Kulit Kayu Manis dengan
RT 14.408 54
Gambar 4.12.Spektrum massa Minyak Atsiri Kulit Kayu Manis dengan
RT 15.560 55
Gambar 4.13. Spektrum massa Minyak Atsiri Kulit Kayu Manis dengan
Gambar 4.14. Spektrum FT-IR Minyak Atsiri Kulit Kayu Manis 57
Gambar 4.15. Bentuk Morfologi (SEM) film pelapis EF1 61
Gambar 4.16. Bentuk Morfologi (SEM) film pelapis EF2 62
Gambar 4.17. Spektrum FT-IR Edible film EF1 67
Gambar 4.18. Spektrum FT-IR Edible film EF1 67
Gambar 4.19. Analisis DTA dari EF1 71
Gambar 4.20. Analisis DTA dari EF2 71
Gambar 4.21. Analisis DSC dari Gelatin 72
Gambar 4.22. Analisis DSC dari EF1 72
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lampiran1. Fragmentasi senyawa alpha-pinene 89
Lampiran 2. Fragmentasi senyawa camphene 90
Lampiran 3. Fragmentasi senyawa beta-pinene 91
Lampiran 4. Fragmentasi senyawa 1,8-Cineole 92
Lampiran 5. Fragmentasi senyawa Benzenepropanal 93
Lampiran 6. Fragmentasi senyawa 3-Cyclohexen-1-ol,4-methyl-1-(1- methylethyl) 94
Lampiran 7. Fragmentasi senyawa Linalyl propionate 95
Lampiran 8. Fragmentasi senyawa Cinnamic aldehyde 96
Lampiran 9. Fragmentasi senyawa copaene 97
RIWAYAT HIDUP
Penulis lahir tanggal 04 Juli 1953 di Desa Tigabinanga, Kabupaten Karo anak ke tiga dari empat bersaudara.
Pendidikan yang pernah diikuti penulis adalah Sekolah Rakyat (SR) di
Medan tahun 1966, SMP di Medan tahun 1966, SMA di Medan tamat tahun 1972.
Selanjutnya penulis mengikuti pendidikan di Fakultas Matematika dan Ilmu
Pengetahuan Alam (FMIPA) Universitas Sumatera Utara pada tahun 1973 dan
lulus sebagai Sarjana Kimia pada tahun 1979.
Sebagai Staf Pengajar di Departemen Kimia FMIPA USU sejak tahun
1980 hingga saat ini.Tahun 1990 penulis mendapat kesempatan mengikuti
program Master pada Departemen Kimia Universitas Salford Inggris sampai tahun
1992. Pada tahun 2005 – 2010 diangkat sebagai Kepala Laboratorium Kimia
Organik/Proses Kimia FMIPA Universitas Sumatera Utara.
Melanjutkan studi pada Program Doktor Kimia di Fakultas Matematika
dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumatera Utara pada tahun
PEMANFAATAN GLISEROL DAN TURUNANNYA SEBAGAI
PLASTICIZER
PADA
EDIBLE FILM
GELATIN YANG
DIINKORPORASI DENGAN MINYAK ATSIRI
KULIT KAYU MANIS (
Cinnamomum
burmanii
)SEBAGAI ANTIMIKROBA
ABSTRAK
Dalam penelitian ini telah dilakukan pembuatan edible film gelatin yang diinkorporasi dengan minyak atsiri kulit kayu manis dengan plasticizer gliserol dan gliseril monooleat. Produk tersebut dikarakterisasi dengan SEM,FT-IR, ketebalan film, kekuatan tarik dan kemuluran, aktivitas air(Aw), uji laju transmisi uap air,analisis termal difrensial(DTA),
analisis kalorimetri difrensial (DSC), swelling,,uji antimikrobanya serta aplikasi terhadap ikan tongkol.Secara umum perbedaan plasticizer gliserol dan gliseril monooleat menambah ketebalan, kekuatan tarik, persentase pertambahan panjang, , dan mengurangi aktivitas air(Aw), laju transmisi uap air, swelling pada 30 menit, analisis termal difrensial,
analisis kalorimetri difrensial dan aplikasi terhadap ikan tongkol. Pengujian morfologi permukaan dengan SEM menunjukkan bahwa permukaan film dengan menggunakan
plasticizer gliserol permukaanya kasar dibandingkan dengan penggunaan plasticizer
gliseril monooleat dikarenakan penambahan minyak atsiri kulit kayu manis yang bersifat non polar tidak terjadi percampuran sempurna dari gelatin-gliserol-minyak atsiri kulit kayu manis.Dari spektrum FT-IR kedua film pelapis gelatin-gliserol-minyak atsiri kulit kayu manis dan gelatin-gliseril monooleat-minyak atsiri kulit kayu manis tidak memperlihatkan terdapatnya penambahan gugus fungsi yang baru. Hal ini berarti tidak terjadi reaksi antara gelatin, gliserol dan minyak atsiri kulit kayu manis, demikian juga gelatin, gliseril monooleat dan minyak atsiri kulit kayu manis.
THE UTILIZATION OF GLYCEROL AND DERIVATIVES
AS A PLASTICIZER IN EDIBLE GELATIN FILM THAT
INCORPORATI0N WITH THE ESSENTIAL OIL
OF CINNAMON BARK(Cinnamomum
burmanii)AS AN ANTIMICROBIAL
ABSTRACT
In this reseach has been conducted by making gelatin edible films incorporation with cinnamon bark essential oil with the plasticizer glycerol and glyceryl monooleate. Products are characterized by SEM, FT-IR, film thickness, tensile strength and elongation,water activity (Aw), water vapor transmission rate (WVTR), difrensial thermal analysis (DTA), analyze difrensial scanning calorimetry (DSC), Swelling, test, and application of the antimicrobial fish tuna. In general, the difference of plasticizer glycerol and glyceryl monooleate were the increase of thickness, tensile strength, percentage elongation of the length, and were the decrease of water activity (Aw), water vapor transmission rate, swelling
at 30 min, difrensial thermal analysis, calorimetry analysis and application to fish tongkol difrensial cob. Testing of surface morphology by SEM showed that the surface of the film by using a surface glycerol plasticizer rough compared to the use of plasticizer glyceryl monooleate due to the addition of cinnamon bark essential oil is non-polar does not happen perfect mixture of gelatin-glycerol-bark essential oil.From FT-IR spectrum of both edible film gelatin-glycerol-cinnamon bark essential oil and gelatin-glyceryl monooleate-cinnamon bark essential oil did not show the presence of the addition of new functional group. This means that no reaction occurs between gelatin, glycerol and cinnamon bark essential oil, as well as gelatin, glyceryl monooleate and cinnamon bark essential oil.
BAB 1
PENDAHULUAN
1.1.Latar Belakang
Edible film adalah lapisan tipis yang terbuat dari bahan-bahan yang dapat dimakan, dipergunakan untuk melapisi permukaan dari makanan yang mempunyai fungsi sebagai penghambat transfer massa (misalnya kelembaban, oksigen, lemak dan zat pelarut) atau sebagai carrier bahan makanan atau additive
dan untuk meningkatkan penanganan makanan (Krochta,1992).
Bahan pembentuk edible film dapat digolongkan ke dalam tiga kategori, yaitu hidrokoloid, lipid dan komposit (campuran hidrokoloid dan lipid). Hidrokoloid yang dapat digunakan untuk membuat edible film dapat berupa protein (kolagen, gelatin, kasein, protein kedelai, protein jagung, dan gluten gandum) atau karbohidrat (pati, alginat, pektin, gum arab dan modifikasi karbohidrat lainnya). Sedangkan kelompok lipid yang digunakan adalah lilin, trigliserida, monogliserida terasetilasi, asam lemak, alkohol asam lemak dan ester sukrosa asam lemak (Wahyuni,2001).
Edible film dapat memberikan penahanan yang selektif terhadap perpindahan panas, uap air dan bahan terlarut serta dapat menjadi pelindung terhadap kerusakan mekanis. Edible film yang dibuat dari protein adalah merupakan edible film yang paling atraktif (most attravtive) dibandingkan dengan lipida dan polisakarida. Edible film protein mempunyai effek penghambat gas yang paling baik demikian juga sifat fisikanya (Wahyuni,2001).
obat-obatan dan fotografi. Diperkirakan sekitar 65% gelatin yang dibuat di seluruh dunia digunakan dalam makanan, 20 % dalam industri fotografi dan sekitar 15% diaplikasikan dalam bidang lain (Arvanitoyanis,2002 dalam Muhammad Taufik,2010). Demikian juga gelatin mempunyai sifat mekanik yang baik dan membentuk film yang baik (Ju-Yeon Kim et al.,2012).
Penambahan plasticizer ke dalam gelatin dalam pembuatan edible film
diperlukan untuk mengatasi sifat rapuh film yang disebabkan oleh kekuatan intermolekuler ekstensif. Plasticizer mengurangi kekuatan ini dan meningkatkan mobilitas dari rantai polimer, dan karenanya meningkatkan fleksibilitas dan ekstensibilitas film ( Wahyuni, 2001).
Plasticizer yang sering digunakan pada film hidrokoloid adalah, poliol (mis. Gliserol). Gliserol yang merupakan senyawa propantriol, disamping dapat dihasilkan dari industri petrokimia juga dapat diperoleh melalui cara hidrolisis maupun transesterifikasi dari gliserida yang terdapat pada ikan, tumbuh-tumbuhan maupun hewan (Meffert, 1984). Gliserol banyak dihasilkan dari industri kelapa sawit di Sumatera Utara, selama ini gliserol diperoleh dari residu kelapa sawit dan merupakan salah satu bahan baku yang memiliki nilai ekonomi tinggi.
Rivero et al.(2010) telah mempelajari pembuatan edible film dari gelatin menggunakan plasticizer gliserol, dimana gliserol memberi pengaruh terhadap WVP maupun Tg dan Xray.
Edible film berbahan dasar gelatin dapat digunakan sebagai zat pembawa zat aditif seperti antioksidan, antimikroba, pewarna, flavors. Metode yang berbeda dan aplikasi langsung seperti inkorporasi bahan antimikroba kedalam edible film
atau edible coating memberikan efek fungsional pada permukaan makanan (Pranoto et al.,2005). Edible film gelatin dan antimikroba adalah pengemas yang dapat mengurangi, mencegah atau memperlambat pertumbuhan mikroorganisme patogenik didalam pembungkusan makanan dan bahan pengemas (Maizura et al
lain dapat berupa minyak atsiri, bacteriocin, enzim, alkohol dan asam lemak (Pranoto et al.,2005).
Minyak atsiri dihasilkan dari bagian jaringan tanaman tertentu seperti akar, batang, kulit, daun,bunga atau biji, diperoleh dengan cara penyulingan dengan uap (Sastrohamidjojo, 2004).
Minyak atsiri dari beberapa tanaman bersifat aktif biologis sebagai antibakteri dan antijamur. Beberapa hasil penelitian menemukan bahwa minyak atsiri dari rimpang lengkuas (Parwata dan Fanny, 2008), bawang putih (Pranoto et al.,2005), Oregano (Zinoviadou et al.,2009) memiliki aktivitas sebagai antibakteri dan anti jamur.
Kulit kayu manis dapat didestilasi atau disuling untuk diambil minyak atsirinya. Wahyu dkk.(2010), melaporkan bahwa minyak atsiri dari kulit batang kayu manis (Cinnamomum burmanii) dengan komponen utamanya trans – sinamaldehid sebagai agen anti bakteri melalui uji BSLT dan Larvasida.
Taufik (2010), telah menggunakan minyak cengkeh sebagai bahan antibakteri yang diaplikasikan pada edible film yang berbahan dasar gelatin, dalam hal ini digunakan plasticizer gliserol, hasil SEM edible film terlihat struktur morfologis permukaan yang agak kasar dan berbentuk seperti gelembung. Hal ini kemungkinan disebabkan tidak terjadinya emulsi yang sempurna antara minyak cengkeh dengan air, sehingga menyebabkan terbentuknya gelembung-gelembung pada permukaan film. Untuk mengatasi hal tersebut dicari alternativ senyawa yang dapat menyatukan antara minyak dan air.Senyawa gliseril monooleat yang merupakan turunan dari gliserol mempunyai gugus polar dan non polar .
Atas pemikiran tersebut penulis ingin melakukan penelitian tentang penggunaan turunan gliserol yaitu gliseril monooleat sebagai plasticizer pada
1.2.Perumusan masalah
1. Bagaimanakah perbedaan karakteristik edible film gelatin antara plasticizer
gliserol dan turunannya yang diinkorporasi dengan minyak atsiri kulit kayu manis sebagai antimikroba.
2. Bagaimanakah perbedaan sifat antimikroba dari edible film gelatin yang digunakan plasticizer gliserol dan turunannya yang diinkorporasi dengan minyak atsiri kulit kayu manis apabila diaplikasikan terhadap ikan tongkol,
1.3.Hipotesa Penelitian
1. Pemberian plasticizer gliserin dan turunannya dalam pembuatan edible film
gelatin yang bersifat antimikroba memberikan hasil yang berbeda terhadap sifat –sifat edible film.
2. Edible film gelatin yang sudah diberikan plasticizer gliserol dan gliseril monooleat yang diinkorporasi dengan minyak atsiri kulit kayu manis dapat bersifat sebagai antimikroba dan dapat diaplikasikan terhadap ikan tongkol dan menghambat pertumbuhan bakteri.
1.4. Tujuan Penelitian. Penelitian bertujuan:
1. Menghasilkan edible film gelatin dengan menggunakan plasticizer
gliserol, dan gliseril monooleat diinkorporasi dengan antimikroba minyak atsiri kulit kayu manis dan diuji perbedaan sifat karakteristiknya.
2. Mengaplikasikan edible film yang terbentuk yang bersifat antimikroba terhadap ikan tongkol.
1.5. Manfaat Penelitian
antimikroba. Juga memberikan informasi tentang karakteristik dari edible film
BAB 2
TINJAUAN PUSTAKA
2.1.Edible film dan Edible coating
Pengemas yang dapat dimakan (Edible packaging) berdasarkan cara pembuatannya dapat dikelompokkan menjadi dua bagian, yaitu yang berfungsi sebagai pelapis (edible coating) dan yang berbentuk lembaran (edible film).
2.1.1.Edible film
Secara umum edible film dapat didefinisikan sebagai lapis tipis yang melapisi suatu bahan pangan dan layak dimakan, digunakan pada makanan dengan cara pembungkusan. Dapat digunakan untuk memperbaiki kualitas makanan, memperpanjang masa simpan, meningkatkan efisiensi ekonomis, menghambat perpindahan uap air (Robertson,1992).
Edible film dapat dibedakan dalam tiga kategori berdasarkan bahan baku yang digunakan yaitu hidrokoloid, lemak dan campuran keduanya. Golongan hidrokoloid dapat dibuat dari polisakarida (selulosa, modifikasi selulosa, pati, agar, alginat, pektin, dekstrin), protein (kolagen, gelatin, putih telur), termasuk golongan lipid. Edible film campuran terdiri dari campuran lipid dan hidrokoloid serta mampu menutupi kelemahan masing-masing ( Guilbert,1986).
Beberapa keunggulan edible film dibandingkan dengan bahan pengemas lain (Sothornvit and Krochta, 2000 ) yaitu:
1. Meningkatkan retensi warna, asam , gula, dan komponen flavor. 2. Mengurangi kehilangan berat
3. Mempertahankan kualitas saat pengiriman dan penyimpanan. 4. Mengurangi kerusakan akibat penyimpanan
5. Memperpanjang umur simpan 6. Mengurangi pengemas sintetik.
Salah satu fungsi utama dari edible film adalah kemampuannya dalam hal berperan sebagai penghalang , baik gas, minyak atau lebih utama air. Kadar air makanan merupakan hal yang penting untuk menjaga kesegaran, mengontrol pertumbuhan mikroba, dan menyediakan mouthfeel dan tekstur yang baik. Edible film dapat mengontrol Aw (water activity) melalui pelepasan dan penerimaan air
(Sothornvit and Krochta, 2000).
2.1.2.Edible Coating
Sebuah edible film atau coating hanya dibedakan berdasarkan cara aplikasinya. Film dapat diaplikasikan sewaktu-waktu, seperti pada pengemas konvensional sedang coating harus diaplikasikan dalam bentuk cair langsung pada permukaan makanan ( Krochta,1997) . Menurut Gennadios dan Weller (1990), tidak ada perbedaan yang jelas antara edible film dan edible coating. Biasanya
edible coating langsung digunakan dan dibentuk diatas permukaan produk sedangkan edible film dibentuk secara terpisah (contoh: kantung tipis) baru bisa digunakan untuk mengemas produk.
metil selulosa), tepung dan turunannya, pektin ekstrak gangang laut (alginat, karagenan, agar), gum (gum arab, gum karaya),
Beberapa metode untuk aplikasi coating pada buah dan sayuran, antara lain metode pencelupan (dipping), pembusaan (foaming), penyemprotan (spraying), penuangan (casting), dan aplikasi penetesan terkontrol. Metode pencelupan (dipping) merupakan metode yang paling banyak digunakan terutama pada sayuran, buah, daging dan ikan, dimana produk dicelupkan ke dalam larutan yang digunakan sebagai coating.
2.1.3.Edible film dari gelatin.
Gelatin merupakan suatu senyawa protein yang diekstraksi dari jaringan kolagen kulit , tulang atau ligament (jaringan ikat) hewan. Gelatin banyak digunakan dalam industri farmasi, kosmetika, fotografi, jelly, softcandy, cake, pudding, susu yoghurt, pelapis kertas, korek api, gabus, pelapis kayu untuk interior, karet plastik dan lain-lain.
Penggunaan gelatin didalam produk murni berfungsi sebagai penjernih sari buah, beer dan wine. Didalam produk buah-buahan gelatin berfungsi sebagai pelapis (melapisi) pori-pori buah sehingga terhindar kekeringan dan kerusakan oleh mikroba, sedangkan untuk produk permen dan sejenisnya berfungsi konsistensi produk, daya gigit dan kekerasan serta tekstur, kelembapan, daya lengket dimulut. Dalam bidang farmasi digunakan sebagai cangkang kapsul dan di Indonesia beredar jenis kapsul keras yang terbuat dari gelatin yang diberi pewarna dan pelentur Dengan demikian gelatin merupakan interaksi dari jaringan kulit hewan mempunyai banyak fungsi diantaranya sebagai bahan pengemulsi, pengikat dan mempunyai gizi. Berdasarkan sifat bahan dasarnya pembuatan gelatin dapat dilakukan dengan cara 2 prinsip dasar yaitu cara alkali dan cara asam.
dan terpisah. Kemudian bahan dinetralkan dengan asam, selanjutnya dicuci dengan air dilanjutkan dengan ekstraksi melalui pemanasan.
Cara pengasaman dilakukan untuk menghasilkan gelatin tipe A (asam). Tipe A umumnya diperoleh dari kulit babi, dimana tidak memerlukan perendaman yang lama dengan asam, karena jaringan belum kuat terikat sehingga cukup dengan asam yang encer selama beberapa hari, dinetralkan dan dicuci berulang-ulang, untuk menghilangkan asam dan garamnya. Proses utama pembuatan gelatin dibagi menjadi tiga tahap. Tahap pertama adalah tahap persiapan bahan baku, yaitu penghilangan komponen non kolagen dari bahan baku dengan atau tanpa pengurangan ikatan antara komponen kolagen. Tahap kedua merupakan konversi kolagen menjadi gelatin. Tahap ketiga adalah pemurnian dan perolehan gelatin dalam bentuk kering (Ward dan Courts, 1977). Gelatin bersifat seperti kaca, padat mudah rusak/dan rapuh, berwarna kuning sampai putih transparan dan hampir tidak ada rasanya serta hampir tidak berbau, berbentuk serpihan atau serbuk, mudah larut dalam air panas gliserol dan asam asetat dan tidak mudah larut dalam pelarut organik (GMIA,2006. Budavari,1996). Kandungan protein gelatin sekitar 85 – 92%, sisanya berupa garam mineral dan air. (Schieber and Gareis,2007).
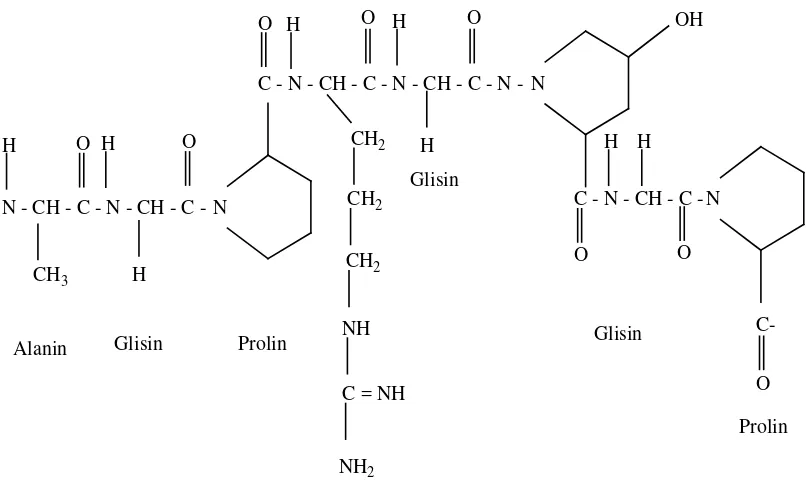
- N - CH - C - N - CH - C - N
C - N - CH - C - N - CH - C - N - N
OH
C - N - CH - C - N
C-O
O O
O O
O
O
CH3 H
H H
H H
H H
O CH2
CH2
CH2
NH
C = NH
NH2
H
Alanin Glisin Prolin
Glisin
Glisin
[image:32.595.120.523.111.352.2]Prolin
Gambar 2.1. Struktur Kimia Gelatin (Chaplin,2006)
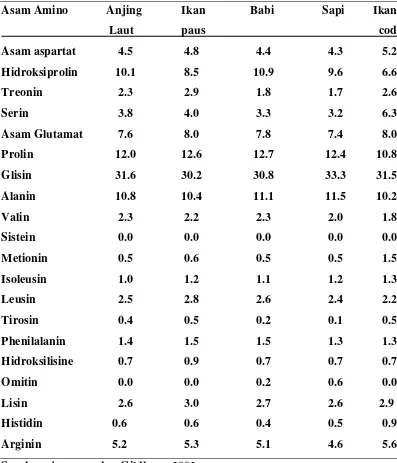
Tabel 2.1.Komposisi Asam amino Gelatin beberapa Jenis Hewan
Asam Amino Anjing Ikan Babi Sapi Ikan
Asam aspartat 4.5 4.8 4.4 4.3 5.2 Laut paus cod
Hidroksiprolin 10.1 8.5 10.9 9.6 6.6 Treonin 2.3 2.9 1.8 1.7 2.6 Serin 3.8 4.0 3.3 3.2 6.3 Asam Glutamat 7.6 8.0 7.8 7.4 8.0 Prolin 12.0 12.6 12.7 12.4 10.8 Glisin 31.6 30.2 30.8 33.3 31.5 Alanin 10.8 10.4 11.1 11.5 10.2 Valin 2.3 2.2 2.3 2.0 1.8 Sistein 0.0 0.0 0.0 0.0 0.0 Metionin 0.5 0.6 0.5 0.5 1.5
Isoleusin 1.0 1.2 1.1 1.2 1.3 Leusin 2.5 2.8 2.6 2.4 2.2 Tirosin 0.4 0.5 0.2 0.1 0.5 Phenilalanin 1.4 1.5 1.5 1.3 1.3 Hidroksilisine 0.7 0.9 0.7 0.7 0.7 Omitin 0.0 0.0 0.2 0.6 0.0 Lisin 2.6 3.0 2.7 2.6 2.9 Histidin 0.6 0.6 0.4 0.5 0.9 Arginin 5.2 5.3 5.1 4.6 5.6
Sumber: Armesen dan Gildberg, 2002.
Tabel 2.2. Standar Mutu Gelatin berdasarkan Dewan Standar Nasional Indonesia (1995) dan Gelatin Manufacturers Institute of America (GMIA,2006).
Karakteristik Syarat
Warna Tidak berwarna sampai kekuningan
Bau,rasa Normal
Kadar air Maksimum 16% Kadar abu Maksimum 3.25 % Kekuatan Gel 50 – 300 Bloom.
Viscositas 15 – 70 mps atau 1.5 – 7 cP
pH 4.5 – 6.5
Logam berat Maksimum 50 mg/kg.
Arsen Maksimum 2 mg/kg
Tembaga Maksimum 30 mg/kg Seng Maksimum 100 mg/kg Sulfit Maksimum 1000 mg/kg
Sumber: DSN (1995), GMIA (2006)
Penggunaan gelatin dalam produk pangan lebih disebabkan oleh sifat fisik yang unik dari gelatin dibanding karena nilai gizinya sebagai sumber protein. Dalam industri pangan gelatin digunakan sebagai pembentuk gel, penstabil, pengemulsi, pengental, pembentuk busa, pembentuk Kristal, pelapis, perekat, pengikat air, dan penjernih (Jones dalam Ward and Courts,1977).
Gelatin merupakan bahan hidrokoloid selain casein, protein, kedelai, protein jagung dan gluten gandum yang dapat digunakan sebagai bahan edible coating.Secara umum, edible coating dan edible film dari bahan protein mempunyai kemampuan yang lebih baik untuk melindungi produk terhadap oksigen (O2) serta memiliki sifat mekanis yang diinginkan dan meningkatkan
[image:34.595.111.520.110.447.2]Aplikasi edible coating dan edible film dari gelatin ini antara lain melindungi produk pada ikan segar, produk daging dan susu, menunda kerusakan karena mikrobia pada produk kering, memperbaiki sifat mekanik selama penanganan dan penyimpanan serta mengurangi kerusakan pada makanan misalnya cake, biskuit, pizza. Demikian juga memperbaiki penampakan pada permen , memperbaiki warna, aroma, flavor pada makanan keju dan mencegah perpindahan zat terlarut, pigmen dan aroma pada makanan tertentu, yaitu produk segar dan beku (Krochta,1997).
Film gelatin yang mempunyai kandungan triplehelix yang lebih besar kurang mengembang dalam air dan gelatin terutama digunakan sebagai geling agent yang membentuk gel thermosible elastic dan transparan, pada temperatur sekitar 35o
T.Bourtoom et al. (2006) melaporkan bahwa edible film dari protein dengan menggunakan berbagai plasticizer menunjukkan hasil yang berbeda terhadap tensile strength (TS) maupun terhadap water vapour permeability
(WVP). Penggunaan plasticizer sorbitol menghasilkan film yang kaku dengan TS, 3.14 MPa dan WVP yang rendah 30.41 g/mm/m
C yang larut menghasilkan produk yang meleleh di rongga mulut.
Edible film dari gelatin terbentuk dari 20-30% gelatin, 10-30% plasticizer dan 40-70% air dilanjutkan dengan pemanasan (Guilbert,1986).
2
/d/kPa. Sedangkan menggunakan plasticizer gliserin dan polyethylene glycol memberikan harga TS yang rendah, 2.13 dan 1.80 MPa, tetapi memberikan harga WVP yang tinggi, 125.8 dan 89.52 g/mm/m2
Melly Dianti (2008), melaporkan bahwa gelatin kulit ikan patin dapat digunakan sebagai bahan baku pembuatan edible film. Karakteristik edible film
gelatin kulit ikan patin adalah ketebalan 0.122-0.125 mm; kuat tarik 1905.66-3279.53 kgf/cm
/d/kPa.
2
2.1.4.Edible film gelatin dan antimikroba.
Kemasan antibakteri adalah salah satu bentuk kemasan makanan aktif. Kemasan aktif berinteraksi dengan produk atau ruang antara kemasan dan sistem makanan untuk memperoleh hasil yang diinginkan (Brody et al., 2001). Selanjutnya dinyatakan bahwa, kemasan makanan antibakteri bertindak menurunkan, menghambat atau memperlambat pertumbuhan mikroorganisme yang kemungkinan ada dalam makanan yang dikemas atau bahan pengemas itu sendiri.
Kemasan antibakteri dapat menghambat pertumbuhan bakteri pathogen atau organisme perusak pada permukaan makanan dan dapat memperpanjang masa simpan pada makanan yang dikemas (Lee et al., 2004). Substansi antibakteri yang disatukan dalam material kemasan dapat mengontrol kontaminasi mikroba dengan menghambat tingkat pertumbuhan dan pertumbuhan populasi maksimum dan atau memperpanjang fase lag pada bakteri target atau menonaktifkan mikroorganisme (Quintavalla and Vicini, 2002).
Edible film berbahan dasar gelatin dapat digunakan sebagai pembawa zat aditif seperti antioksidan, antimikroba, pewarna dan flavor. Metode yang berbeda dari aplikasi langsung seperti inkorporasi bahan antimikroba kedalam edible film
atau edible coating memberikan efek fungsional pada permukaan makanan (Pranoto et al.,2005).
Kemampuan minyak atsiri untuk melindungi makanan-makanan melawan mikroorganisme pathogen dan perusak telah dilaporkan oleh beberapa para peneliti. Pembuatan edible film gelatin yang bersifat antimikroba dapat dilakukan dengan beberapa cara , antara lain :
1. Penambahan sachetspads (kantong kecil) berisi bahan antimikroba volatil ke dalam kemasan.
2. Inkorporasi secara langsung bahan antimikroba volatil dan yang tidak volatil ke dalam polimer.
3. Coating atau adsorpsi antimikroba pada permukaan polimer.
4. Immobilisasi antimikroba pada polimer dengan ikatan ion atau kovalen.
5. Penggunaan polimer yang memiliki sifat sebagai antimikroba (Appendini and Hotchkiss,2002)
2.2.Plasticizer
Plasticizer didefinisikan sebagai bahan non volatil, bertitik didih tinggi jika ditambahkan pada material lain dan dapat merubah sifat material tersebut.Penambahan plasticizer dapat menurunkan kekuatan intermolekuler, meningkatkan fleksibilitas film dan menurunkan sifat barrier film. Plasticizer
ditambahkan pada pembuatan edible film untuk mengurangi kerapuhan meningkatkan fleksibilitas dan ketahanan film terutama jika disimpan pada suhu rendah (Anonim, 2005).
Mekanisme proses plastisasi polimer sebagai akibat penambahan
plastisizer berdasarkan Darby 1982 di dalam : Di Gioia and Guilbert, 1999, melalui urutan sebagai berikut:
1.Pembasahan dan adsorpsi.
2.Pemecahan dan atau penetrasi pada permukaan 3.Absorpsi, difusi.
Beberapa jenis plasticizer yang dapat digunakan dalam pembuatan edible film adalah gliserol, lebah, polivinil alkohol, sorbitol, asam laurat, asam oktanoat, asam laktat, trietilen glikol, polietilen glikol,acetylated monoglyceride (Acetem).
2.2.1.Plasticizer Gliserol
Salah satu senyawa yang penting dari alkil trihidrat adalah gliserol (propan-1,2,3-triol)dengan rumus CH2OHCHOHCH2
Pada industri oleokimia gliserol dapat ditransfomasikan melalui interesterifikasi membentuk monogliserida dan digliserida (Noureddini and Medikonduru, 1997). Gliserol kebanyakan dijumpai hampir pada semua lemak hewan, minyak nabati dan minyak ikan lainnya. Gliserol juga dapat diubah menjadi turunan alkilosa propanol amin untuk digunakan sebagai aditif bahan bakar seperti senyawa hidroksilat gliseril eter (1) dan dimernya(II) (De Caro, 1997).
OH.Senyawa ini kebanyakan ditemui hampir disemua lemak hewani dan minyak nabati sebagai ester gliseril dari asam palmitat, stearat dan oleat (Austin, 1985). Senyawa ini bermanfaat sebagai anti beku (anti freeze) dan juga merupakan senyawa yang higroskopis sehingga banyak digunakan untuk mencegah kekeringan pada tembakau, pembuatan tinta dan parfum obat-obatan, kosmetik, pada bahan makanan dan minuman serta penggunaan lainnya(Austin,1985). Gliserol banyak dihasilkan dari industri oleokimia di Sumatera Utara merupakan bahan baku yang sangat potensial untuk dikembangkan menjadi produk yang bernilai ekonomis tinggi.Gliserol dapat diperoleh dari pemecahan ester asam lemak dari minyak dan lemak dari industri oleokimia (Bhat, 1989, Nouriddini and Zoebelein, 1992).
Gliserol merupakan cairan yang memiliki kelarutan tinggi, yaitu 71 g/100 g air pada suhu 25o
Buttler et.al. dalam Bayu,2008 telah meneliti pengaruh plasticizer gliserol pada edible film dari khitosan. Penambahan gliserol dengan konsentrasi 0.25 ml/g dan 0.5 ml/g mampu menghasilkan nilai rata-rata kekuatan tarik edible film
(bioplastic) khitosan sebanding dengan film sintetis dari HDPE (High Density PolyRthylene) dan LDPE (Low Density PolyEthylene,) yaitu nilai rata-rata minimal 8.3 Newton/mm
C. Biasanya digunakan untuk mengatur kandungan air dalam makanan dan untuk mencegah kekeringan pada makanan.
2
atau 8.3 MPa dan nilai rata-rata maksimum 44.8 MPa. Sedangkan nilai rata-rata persentase elongasi (pemanjangan) keduanya sebanding dengan selofan komersil, yaitu sebesar 27% dan 46%.
2.2.2.Plasticizer Turunan Gliserol. 2.2.2.1. Gliseril Monooleat
Gliseril monooleat (monoolein) adalah bahan kimia aktif permukaan yang secara luas digunakan sebagai surfaktan nonionik dan pengemulsi (plasticizer).
Gliseril monooleat dapat dihasilkan oleh reaksi α - monoklorohidrin gliserol (Hasil klorinasi gliserol) dengan natrium oleat dengan katalis membentuk ester monogliserida (Cannont,1995),seperti reaksi berikut ini :
(CH3CH2)3N + - HC l -CH3-(CH2)7-CH=CH-(CH2)7-C-O-Na
O
+
TEA - HCl
N H
C2H5 CH3-(CH2)7-CH=CH-(CH2)7-C-O
O
+ NaCl C2H5
O-H O-H
Cl N
H C2H5 CH3-(CH2)7-CH=CH-(CH2)7-C-O
O
+
O-H O-H
CH3-(CH2)7-CH=CH-(CH2)7-C-O O
+
Gliserol Monooleat
TEA - HCl C2H5
C2H5
(CH3CH2)3N + - HC l
-. -. Gliseril monooleat tidak berbahaya bagi lingkungan . Semua bahan pembuatnya dihasilkan oleh alam. .Asam oleat diekstrak dari produk alami, sedangkan gliserol dapat dibuat dari lemak alami atau petrokimia (Anonim, 2001). Gliseril monooleat secara fisik berwujud cair berwarna jernih kekuning-kuningan atau kuning pucat (Magrabar, 1997). Gliseril monooleat (C21H40O4
) memiliki berat molekul 356.54 g/mol (Anonim,2009), tidak larut dalam air, sedikit larut dalam alkohol dingin dan larut dalam alkohol panas, kloroform, eter, petroleum eter, serta larut dalam minyak dan bersifat sebagai pengemulsi pada makanan (Pardi, 2005), gliseril monooleat larut baik dalam minyak (Chen and Dickinson, 1999). Rumus struktur gliseril monooleat adalah sebagai berikut :
Gambar 2.2. Struktur Kimia Gliseril monooleat
Indentik dengan surfaktan-surfaktan lain, sifat gliseril monooleat ini ditentukan oleh sifat reaktan pembentuknya. Gliseril monooleat dapat membentuk suatu mikro-emulsi di dalam air. Gliserol larut dalam air, sedangkan asam oleat tidak larut dalam air (Burdock, 1977). Hydrophilic-Lipophilic Balance (HLB) dari gliseril monooleat adalah 3.8 (Griffin, 1979).
Kegunaan spesifik dari gliseril monooleat ini adalah sebagai antifoam dalam pengolahan jus dan sebagai emulsifier lipofilik untuk aplikasi air dalam minyak.
2.3.Minyak Atsiri
Minyak atsiri atsiri juga dikenal dengan nama minyak mudah menguap atau minyak terbang. Pengertian atau definisi minyak atsiri yang ditulis dalam Encyclopedia of Chemical Technology menyebutkan bahwa minyak atsiri merupakan senyawa yang pada umumnya berwujud cairan,yang diperoleh dari bagian tanaman, akar kulit, batang, daun, buah, biji maupun dari bunga dengan cara penyulingan dengan uap (Sastrohamidjojo, 2004). Sifat minyak atsiri yang menonjol antara lain mudah menguap pada suhu kamar, mempunyai rasa getir, berbau wangi sesuai dengan aroma tanaman yang menghasilkannya, dan umumnya larut dalam pelarut organik. Banyak istilah yang digunakan untuk menyebut minyak atsiri. Misalnya dalam dalam bahasa Inggris disebut essential oils, ethereal oils dan volatile oils. Dalam bahasa Indonesia ada yang menyebut minyak kabur (Lutony dan Rahmayati, 2002).
Minyak atsiri dari beberapa tanaman bersifat aktif biologis sebagai anti bakteri dan antijamur. Beberapa hasil penelitian menemukan bahwa minyakatsiri dari rimpang lengkuas (Parwata & Fanny, 2008), bawang putih (Pranoto et al.,2005), Oregano (Zinoviadou et al,2009) memiliki aktivitas sebagai antibakteri dan antijamur.
2.3.1..Minyak atsiri kulit kayu manis
kulit kayu manis digunakan sebagai sumber pewangi untuk membalsem mumi raja-raja Mesir serta peningkat cita rasa masakan dan minuman. Kayu manis dapat dijadikan jamu untuk penyakit disentri dan singkir angin. Minyak kayu manis sudah ratusan tahun dikenal di belahan dunia barat dan timur sebagai penyembuh reumatik, mencret, pilek, sakit usus, jantung, pinggang dan darah tinggi (Rismunandar, 2001).
Kulit kayu manis berwarna abu-abu dengan aroma khas dan rasanya manis. Selain hanya dalam bentuk kering, kulit kayu manis tersebut dapat didestilasi atau disuling untuk diambil minyak atsirinya.
2.3.2 Kandungan Kimia Minyak Atsiri kulit Kayu Manis
Minyak Atsiri kayu manis selain mengandung Sinamaldehida juga mengandung senyawa-senyawa lain seperti, benzaldehida, limonene, 1,8-sineol,
α-copaene, bornil asetat,β-caryofilen, 1,4-terpineol,δ-cardiena, trans-cinnamaldehida, trans-cinnamil asetat, miristisin, coumarin, asam tetradecanoat (Lawless, 2002). Hasil penyulingan kulit c.burmanii, C.zeylanicum dan C.cassia
yang ditanam di Kebun percobaan Cimanggu Bogor menghasilkan minyak berturut-turut 1.75; 2,0: dan 1.50%. Selain dari kulitnya, daun kayu manis juga biasa disuling menjadi minyak daun kayu manis (Cinnamon leaf oil). Namun demikian minyak daun C.Zeylanicum mengandung eugenol sebagai komponen utamanya (80-90%), sedangkan kandungan utama minyak daun C.burmanii dan
C.cassia sama dengan minyak kulitnya, yaitu Sinamaldehida(Leung, 1980).
2.4. Sifat -Sifat Edible film.
2.4.1..Aktivitas Air (Aw
Air dalam bahan pangan berperan sebagai pelarut dari beberapa komponen disamping ikut sebagai bahan pereaksi, sedang bentuk air dapat ditemukan sebagai air bebas dan air terikat. Air bebas dapat dengan mudah hilang apabila terjadi penguapan atau pengeringan, sedangkan air terikat sulit dibebaskan dengan cara tersebut. Kandungan air dalam bahan pangan akan berubah-ubah sesuai dengan lingkungan, hal ini sangat erat hubungan dengan daya awet bahan pangan tersebut. Hal ini merupakan pertimbangan utama dalam pengolahan dan pengelolaan pasca olah bahan pangan (Purnomo,1995).
)
Menurut derajat keterikatan air, air terikat dapat dibagi atas empat tipe :
Tipe I, adalah molekul air yang terikat pada molekul-molekul lain melalui sesuatu ikatan hidrogen yang berenergi besar. Molekul air membentuk hidrat dengan molekul-molekul lain yang mengandung atom-atom O dan N seperti karbohidrat, protein, atau garam. Air tipe ini tidak dapat membeku pada proses pembekuan, tetapi sebagian air ini dapat dihilangkan dengan cara pengeringan biasa. Air tipe ini terikat kuat dan sering kali disebut air terikat.
Tipe II, yaitu molekul-molekul air membentuk ikatan hidrogen dengan molekul air yang lain, terdapat dalam mikrokapiler dan sifatnya agak berbeda dari air murni. Air jenis ini lebih sukar dihilangkan dan penghilangan air tipe II akan mengakibatkan penurunan Aw
Tipe III, adalah air yang secara fisik terikat dalam jaringan matriks bahan seperti membram, kapiler, serat, dan lain-lain. Air tipe III inilah yang sering kali disebut dengan air bebas. Air tipe ini mudah diuapkan dan dapat dimanfaatkan untuk pertumbuhan mikroba dan media bagi reaksi-reaksi kimiawi.
(water activity).
Tipe IV, adalah air yang tidak terikat dalam jaringan suatu bahan atau air murni, sifat-sifat air biasa dan keaktifan penuh(Winarno,1984). Pengawetan makanan dengan menurunkan kadar air yang dikenal dengan aktivitas air (Aw) telah
tetap sebagai suatu cara pengolahan yang sangat penting dinegara-negara yang sedang berkembang (Bucle,1985).
Aktivitas air atau “Water activity” (Aw) merupakan salah satu parameter
hidratasi yang sering diartikan sebagai air dalam bahan yang dapat digunakan untuk pertumbuhan jasad renik. Menurut hokum Roult (Secara kimia) Aw
A
berbanding lurus dengan jumlah molekul didalam pelarut (solvent) dan berbanding terbalik dengan jumlah molekul didalam larutan (solution) (Syarief,1988).
w
= n
1/n
1+ n
2Dimana n1
n
= jumlah molekul dari zat yang dilarutkan (solute)
2 = Jumlah molekul pelarut, yang dimaksud disini
adalah air
Aktivitas air berkaitan dengan Equilibrium Relative Humidity (ERH), yaitu perbandingan antara tekanan uap larutan dengan air murni dan dinyatakan dengan persentase. Kaitan antara ERH dengan Aw
dirumuskan sebagai berikut :
ERH = Aw x 100%
Akan tetapi ERH terbatas pada atmosfir serta dalam keseimbangan dengan larutan atau bahan pangan sehingga kurang sesuai untuk menggambarkan ketersedian air (air bebas). Jika larutan dipekatkan atau bahan pangan dikurangi kadar airnya, maka akan terjadi penurunan Aw. Nilai maksimum Aw = 1. Nilai ini
diperoleh pada air murni. Semakin pekat larutan atau semakin berkurang kadar air bahan pangan, nilai Aw semakin rendah. Sebagian besar mikroba (terutama
bakteri) tumbuh baik pada bahan pangan yang mempunyai Aw 0.9 – 0.97; khamir
membutuhkan Aw 0.87- 0.91 dan kapang membutuhkan Aw 0.8 – 0.91. Bakteri
halofilik adalah bakteri yang toleran terhadap kadar garam tinggi, dapat tumbuh pada bahan pangan yang mempunyai nilai Aw 0.75. Khamir osmofilik merupakan
tumbuh pada bahan pangan yang mempunyai nilai Aw 0.60. Kapang xerofilik
merupakan kapang yang mampu tumbuh pada bahan pangan yang kering (nilai Aw
Pengukuran aktivitas air terhadap suatu bahan pangan sampai saat ini masih berdasarkan pengukuran kelembaban relativ berimbang dari bahan tersebut terhadap lingkungannya. Oleh karena itu ekstrapolasi menjadi cara pengukuran yang lebih penting dari pada tekniknya.
Pengukuran relativ berimbang dapat dilakukan antara lain dengan kurva interpolasi, teknik manometrik, keseimbangan bitermal,hygrometer rambut, keseimbangan isopiestic, hygrometer listrik, metode kimia dan penurunan titik beku. Masing-masing metode memiliki kelemahannya sendiri. Yang terpenting adalah bahwa metode maupun peralatan yang dipakai harus menghasilkan pengukuran yang tepat, dapat diulang, cepat murah, mudah dibawa, mudah cara pemakaiannya(Purnomo, 1995).
0.65) (Nurwantoro dan Abbas, 1997).
2.4.2.. Scanning Electron Microscope (SEM)
Struktur permukaan suatu benda diuji dapat dipelajari dengan menggunakan scanning elektron mikroskop karena jauh lebih mudah untuk mempelajari struktur permukaan ini secara langsung. Dengan berkas sinar elektron difokuskan kesuatu titik dengan diameter sekitar 100 A dan digunakan untuk melihat permukaan dalam suatu layar. Elektron-elektron dari benda diuji difokuskan dengan suatu elektroda elektrostatik pada suatu alat pemantul yang dimiringkan. Sinar yang dihasilkan diteruskan melalui suatu pipa sinar pantulan kesuatu alat pembesar foto dan sinyal yang dapat digunakan untuk memodulasikan terangnya suatu titik osiloskop yang melalui suatu layar dengan adanya persesuaian dengan berkas sinar elektron pada permukaan benda uji.
bayangan topografi. Intensitas dari hamburan balik elektron-elektron yang cenderung tertimbun karena dengan energinya yang lebih tinggi maka tidak mudah dikumpulkan oleh sistem kolektor normal seperti yang digunakan pada elektron pancaran. Jika elektron-elektron sekunder akan terkumpul, maka kisi didepan detektor akan mengalami kemiringan sekitar 200 V (Smallman.2008).
2.4.3.Uji Tarik dan Kemuluran.
Kekuatan tarik dan kemuluran merupakan sifat mekanis yang sangat penting dari logam terutama untuk perhitungan-perhitungan konstruksi. Untuk memperoleh informasi tentang kekuatan tarik dilakukan pengujian tarik. Didalam pengujian tarik, batang percobaan atau batang uji dikenai beban aksial yang ditambah secara berangsur-angsur dan kontinu. Kekuatan tarik merupakan sifat mekanik yang banyak ditonjolkan dan dapat dianggap sebagai kekuatan bahan (Sumanto, 1994).
Dalam pengujiannya, bahan uji ditarik sampai putus. Secara sederhana, kekuatan tarik diartikan sebagai besarnya beban maksimum (Fmaks.) yang dibutuhkan untuk memutuskan spesimen bahan dibagi dengan luas penampang bahan. Karena selama dibawah pengaruh tegangan, spesimen mengalami perubahan bentuk (deformasi) maka definisi kekuatan tarik dinyatakan sebagai besarnya beban maksimum yang dibutuhkan untuk memutuskan spesimen bahan, dibagi dengan luas penampang semula (Ao).
Kekuatan tarik (kgf/mm2) = nilai beban tarik (kgf)/A(mm2)
Dimana A = Luas permukaan yang mendapat beban.
Jika didefinisikan besaran kemuluran (Є) sebagai nisbah pertambahan panjang
terhadap panjang spesimen semula adalah :
Kemuluran(€) = l-lo/lo x 100%.
2.4.4.Permeabilitas Uap air.
Permeabilitas suatu film kemasan adalah kemampuan melewatkan partikel gas dan uap air pada suatu unit luas bahan pada suatu kondisi tertentu. Nilai permeabilitas sangan dipengaruhi oleh faktor-faktor sifat kimia polimer, struktur dasar polimer. Umumnya nilai permeabilitas film kemasan berguna untuk memperkirakan daya simpan produk yang dikemas. Komponen kimia alamiah berperan penting dalam permeabilitas. Polimer dengan polaritas tinggi (polisakarida dan protein) umumnya menghasilkan nilai permeabilitas uap air yang tinggi dan permeabilitas terhadap oksigen rendah. Hal ini disebabkan polimer mempunyai ikatan hidrogen yang besar. Sebaliknya, polimer yang bersifat non polar (lipida) yang banyak mengandung gugus hidroksil mempunyai nilai permeabilitas uap air rendah dan permeabilitas oksigen yang tinggi, sehingga menjadi penahan air yang baik tetapi tidak efektif menahan gas. Permeabilitas uap air merupakan suatu bahan untuk terjadinya proses penetrasi air. Permeabilitas uap air dari suatu film kemasan adalah laju kecepatan atau transmisi uap air melalui suatu unit luasan bahan yang permukaanya rata dengan ketebalan tertentu, sebagai akibat dari suatu perbedaan unit tekanan uap antara dua permukaan pada kondisi suhu dan kelembaban tertentu (Yamada,K et al.,1995).
2.4.5. Spektroskopi Infra Merah Fourier Transform (FT-IR).
Spektroskopi infra merah (IR) suatu metoda yang digunakan untuk mengkarakterisasi bahan polimer seperti gelatin dan analisis gugus fungsinya. Dengan cara menentukan dan merekam hasil spektra residu dengan serapan energi oleh molekul organik dalam daerah sinar infra merah. Panjang gelombang 1-500 nm merupakan daerah infra merah.Gugus-gugus dalam setiap molekul umumnya mempunyai karakteristik sendiri, sehingga spektroskopi IR dapat digunakan untuk mendeteksi gugus yang spesifik pada senyawa organik maupun polimer. Intensitas pita serapan merupakan ukuran konsentrasi gugus yang khas yang dimiliki oleh polimer (Creswell,2005).
kimia.Tahap awal identifikasi bahan kimia maupun polimer harus diketahui dengan membandingkan spektrum yang telah dikenal. Pita serapan yang khas akan ditunjukkan oleh monomer penyusun material dan struktur molekulnya. Metoda analisa ini didasarkan terhadap interaksi antara radiasi infra merah dengan materi interaksi atom atau molekul dengan radiasi elektromagnetik. Interaksi ini berupa absorpsi pada frekwensi atau panjang gelombang tertentu yang berhubungan dengan energi transisi antara berbagai keadaan energi vibrasi, rotasi dan molekul.
2.4.6.Analisis Termal Difrensial (Diffrential Thermal Analysis,DTA)
Differential Thermal Analysis (DTA) adalah suatu teknik analisis termal dimana perubahan material diukur sebagai fungsi temperatur. DTA digunakan untuk mempelajari sifat thermal dan perubahan fasa akibat perubahan entalpi dari suatu material. Selain itu, kurva DTA dapat digunakan sebagai finger print
sampel lebih rendah daripada suhu pembanding maka perubahan yang terjadi disebut endotermal (West, 1984).
Umumnya, DTA digunakan pada range suhu 190 - 1600 ºC. Sampel yang digunakan sedikit, hanya beberapa miligram. Hal ini dilakukan untuk mengurangi masalah gradien termal akibat sampel terlalu banyak yang menyebabkan berkurangnya sensitivitas dan akurasi instrumen. Komponen utama instrumen DTA terdiri dari :
Tempat sampel, yang terletak dalam termokopel, dan terlindung dalam lapisan keramik atau logam. Di dalam termokopel terdapat tempat sampel dan referensi yang dikelilingi oleh lapisan keramik atau logam sebagai material pendistribusi suhu. Tempat sampel dapat berupa pyrex, alumunium, silika, nikel, atau platinum. Pemlihan jenis bahan tempat sampel bergantung pada suhu reaksi yang diinginkan. Sebagai contoh bahan alumunium sesuai untuk pemanasan sampel dibawah 600ºC karena alumunium mempunyai titik leleh 660ºC.
Furnace dan Termokopel
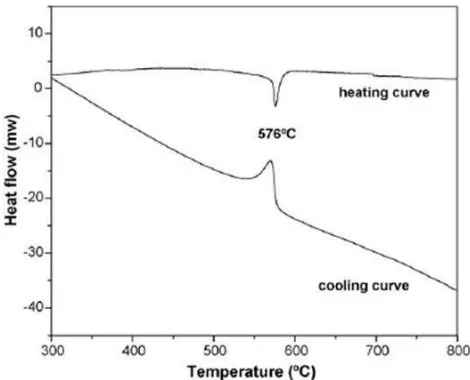
Contoh:Pembacaan Termogram pada DTA
Pembentukan MgAl
. Suhu operasional instrumen dapat diatur dengan kecepatan pemanasan atau pendinginan sesuai kebutuhan. Biasanya pengaturan kecepatan berkisar antara 1- 50 ºC/ menit.
2O4 dan MgO dari Al-Mg alloy/quartz (>99% silika kristalin)
[image:49.595.117.352.542.732.2]dapat diamati dengan teknik DTA
Puncak endotermis yang tajam pada 576oC menunjukkan terjadinya transformasi fase dari a menjadi b-quartz, a-quartz memiliki struktur trigonal dengan ikatan yang kuat antar silika tetrahedron dalam jaringan strukturnya dan menunjukkan simetri kristalografi rendah. Pada temperatur yang lebih tinggi, tetrahedron akan terpisah dan membentuk simetri tinggi dan struktur kristal heksagonal (b-quartz). Transisi fase ini tampak mulai terjadi pada temperature 550oC dan akan berjalan dengan sempurna hingga temperatur 590oC seperti yang tampak pada gambar di atas.
2.4.7.Kalorimetri Skening Difrensial (Diffrential Scanning Calorimetry,DSC)
BAB 3
METODE PENELITIAN
3.1.Bahan-bahan
Bahan kimia yang dipakai dalam penelitian ini adalah gliserol, asam oleat.natrium klorida, asam sulfat(p),asam asetat,natrium hidroksida, silika gel. Petroleum eter, , aquadest, kulit sapi,kulit kayu manis, ammonium sulfat,Mueler Hinton Agar, Plate Count Agar, Pereaksi Mc Farland, alkohol,asam borat,katalis selen,calcium klorida Demikian juga bahan untuk pengujian aktivitas air (Aw)
seperti kalium dikromat,kalium sulfat dan silika gel semuanya berasal dari bahan p.a.
3.2.Alat-alat
Peralatan yang digunakan dalam penelitian ini berupa alat gelas antara lain gelas Erlemeyer, beaker gelas,desikator,plat kaca,thermometer juga menggunakan instrument seperti magnetic stirrer, oven blower, Scanning Electron Microscope, Universal Tensile Machine,alat Kjeldhal dan Spektroskopi FT-IR. Alat untuk uji antimikroba antara lain: inkubator, kamera digital, jangka sorong, Bunsen, koloni counter, pinset, botol sprayer, vortex, autoklaf, oven, ose bengkok dan neraca analitik.
3.3.Prosedur Penelitian
3.3.1.Penyedian sampel kulit sapi.
Kulit sapi diambil dari pemotongan hewan di Berastagi,Kabupaten Karo,Propinsi Sumatera Utara.
3.3.1.1.Pemisahan senyawa gelatin dari kulit sapi.
2.Ditimbang kulit sebanyak 300 g kemudian dimasukkan kedalam erlemeyer 1 liter ditambahkan larutan kapur 15% v/v sebanyak 900 ml dan dilakukan perendaman selama 6 minggu dengan sesekali mengaduk.
3.Setelah perendaman selama 6 minggu dilakukan penyaringan, residu disebut ossein.
4.Langkah selanjutnya merendam ossein dalam 900 ml. air selama 3 jam, saring dan residu direndam dalam larutan Amm.sulfat 3% selama 3 jam, kemudian saring.
5.Dilakukan proses ekstraksi secara bertahap ( 3 tahap):
- tahap 1,residu diekstraksi dengan air lalu dipanaskan pada temperatur 55- 65o
- tahap 2 yaitu residu tahap 1 diekstraksi pada temperature 65-75
C selama 4 jam,kemudian disaring.
o
- tahap 3,residu tahap ke 2 diekstraksi dengan air pada temperature 75-85
C selama 4 jam, saring.
o
6.Setelah itu dilakukan pemekatan pada larutan gelatin untuk mengurangi kadar air. Gelatin yang telah dipekatkan kemudian disimpan di dalam ruang pendingin untuk memadatkan larutan gelatin.Gelatin yang telah berbentuk padat (gel) selanjutnya dikeringkan dengan menggunakan oven pada suhu 50-60
C selama 4 jam,saring. Seluruh filtrat hasil ekstraksi tahap 1,2 dan 3 disatukan kemudian disaring kembali.
oC selama 24
jam. Kemudian dilakukan penggilingan pada gelatin yang telah kering sehingga terbentuk bubuk gelatin. Selanjutnya ditentukan kadar air, kadar abu, kadar protein dan uji Spektroskopi FT-IR.
3.3.2.Analisis Kadar Gelatin 3.3.2.1.Analisis Kadar Air.
Kadar air(%) = (B-A) Berat contoh(g)
X 100 %.
Keterangan : A = Berat cawan + contoh kering (g). B = Berat cawan + contoh basah (g).
3.3.2.2.Analisis Kadar Abu
Contoh yang telah diuapkan airnya dimasukkan ke dalam tanur bersuhu 600o
C. Sebelumnya bobot cawan kering dan bobot contoh telah diketahui. Proses pembakaran dilakukan sampai semua bahan berubah menjadi abu(sekitar 6 jam), kemudian hasilnya ditimbang.
Kadar abu = A
B
x 100 %.
Keterangan : A = Bobot contoh akhir (g). B = Bobot contoh awal (g).
3.3.2.3.Analisis Kadar Protein
Sampel sejumlah 2 gram kemudian dimasukkan ke dalam labu Kjeldahl kemudian ditambahkan 1 gram katalis (selenium mix) dan 25 ml H2SO4 (p)lalu
dilakukan destruksi di ruang asam hingga larutan menjadi jernih Larutan dibiarkan dingin kemudian diencerkan dengan aquadest sampai volume 250 ml. Larutan hasil pengenceran kemudian dipipet 50 ml larutan dan dimasukkan ke dalam alat penyuling, ditambahkan 120 ml NaOH 30% dan 50 ml H2O, didestilasi
ungu. Untuk blanko dikerjakan dengan cara yang sama tanpa menggunakan sampel.
Kadar protein yang terkandung dalam sampel dapat dihitung dengan rumus sebagai berikut :
% Protein =
w
fpx Vtiter x N HCl x 0,014 x fk
Dimana, fp = faktor pengenceran V = volume titer
N = normalitas HCl w = bobot cuplikan
fk =faktor konversi untuk protein dari makanan secara umum = 6,25.
3.3.2.4.Analisis Spektroskopi FT-IR
Cuplikan dari gelatin hasil pemisahan dari kulit sapi dilarutkan kemudian dioleskan ke plat KBr hingga terbentuk lapisan tipis yang transparan, selanjutnya diukur spektrumnya dengan alat spektrofotometri FT-IR model IR-420.