EFEK ANTIBAKTERI EKSTRAK ETANOL UMBI
LOBAK(
Raphanus sativus L.
) TERHADAP
Fusobacterium nucleatum
ATCC 25586 SEBAGAI
BAHAN ALTERNATIF MEDIKAMEN
SALURANAKAR(SECARA
IN VITRO
)
SKRIPSI
Diajukan untuk memenuhi tugas dan melengkapi syarat memperoleh gelar Sarjana Kedokteran Gigi
Oleh:
ALVIN LEONARDI NIM: 110600097
FAKULTAS KEDOKTERAN GIGI
UNIVERSITAS SUMATERA UTARA
MEDAN2015
Departemen Ilmu Konservasi Gigi Tahun 2015
Alvin Leonardi
Efek Antibakteri Ekstrak Etanol Umbi Lobak (Raphanus sativus L.) terhadap Fusobacterium nucleatum ATCC 25586 sebagai Bahan Alternatif Medikamen Saluran Akar (Secara In Vitro)
xi + 86 halaman
Keberhasilan perawatan saluran akar dipengaruhi oleh eliminasi dari bakteri patogen di dalam saluran akar dengan pemberian bahan medikamen yang bertujuan untuk mengeliminasi bakteri. Bahan medikamen yang sering digunakan adalah kalsium hidroksida, tetapi memiliki resistensi terhadap bakteri Fusobacterium nucleatum. Pengembangan bahan medikamen alternatif dari bahan alami yang memenuhi syarat bahan medikamen diperlukan, seperti umbi lobak yang memiliki sifat biokompatibel dan antibakteri. Penelitian ini bertujuan untuk mengetahui efek antibakteri ekstrak etanol umbi lobak (Raphanus sativus L.) terhadap Fusobacterium nucleatum dengan menentukan nilai Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM).
Rancangan penelitian ini menggunakan posttest only control group design dan cara penggumpulan data dengan melakukan eksperimen. Penelitian ini dimulai dengan melakukan pengeringan umbi lobak sebanyak 5 kg dan diperoleh simplisia 300 gram yang diekstraksi dengan 5 L pelarut etanol 70%, kemudian diuapkan hingga diperoleh ekstrak 250 gram. Pengujian antibakteri menggunakan metode dilusi dengan mengencerkan ekstrak dalam Tryticase Soy Broth (TSB) dengan pengenceran berganda hingga diperoleh konsentrasi 100%, 50%, 25%, 12,5%, 6,25%, 3,125%, 1,56%, 0,78%, 0,39%. Dalam penentuan KHM, diambil 4 ml dari setiap konsentrasi dan ditambahkan 1 ml suspensi bakteri, divorteks, dan diinkubasi pada suhu 37°C selama 24 jam pada inkubator CO2. Kekeruhan tiap tabung diamati secara
jernih merupakan KHM. Setiap kelompok divorteks dan diambil 100 �l, diteteskan pada petri kemudian dituangkan media Tryticase Soy Agar (TSA) yang direplikasi 4 sampel, lalu diinkubasi pada suhu 37°C selama 24 jam pada inkubator CO2.
Penghitungan jumlah bakteri yang terbentuk dengan menggunakan metode Pour Plate untuk mendapatkan nilai KBM. Data yang didapatkan dari penelitian ini dianalisis dengan analisis non-parametrik Kruskal-Wallis dan Mann-Whitney.
Hasil penelitian ini menunjukan tabung yang mulai terlihat jernih adalah konsentrasi 12,5% dan tidak adanya bakteri pada konsentrasi 100% hingga 25%. Kesimpulan dari penelitian adalah ekstrak etanol umbi lobak memiliki efek antibakteri terhadap Fusobacterium nucleatum dengan nilai KHM pada konsentrasi 12,5% dan nilai KBM pada konsentrasi 25%.
Kata kunci : medikamen saluran akar, Fusobacterium nucleatum, umbi lobak (Raphanus sativus L.)
EFEK ANTIBAKTERI EKSTRAK ETANOL UMBI
LOBAK(
Raphanus sativus L.
) TERHADAP
Fusobacterium nucleatum
ATCC 25586
SEBAGAI BAHAN ALTERNATIF
MEDIKAMEN SALURANAKAR(SECARA
IN VITRO
)
SKRIPSI
Diajukan untuk memenuhi tugas dan melengkapi syarat memperoleh gelar Sarjana Kedokteran Gigi
Oleh:
ALVIN LEONARDI NIM: 110600097
FAKULTAS KEDOKTERAN GIGI
UNIVERSITAS SUMATERA UTARA
PERNYATAAN PERSETUJUAN
Skripsi ini telah disetujui untuk dipertahankan di hadapan tim penguji skripsi
Medan, 28 April 2015
Pembimbing: Tanda Tangan
TIM PENGUJI SKRIPSI
Skripsi ini telah dipertahankan di hadapan tim penguji Pada tanggal 28 April 2015
TIM PENGUJI
KETUA : Cut Nurliza, drg., M.Kes
iv
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Esa atas segala berkat, rahmat, dan kasih karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Gigi di Universitas Sumatera Utara.
Pada kesempatan ini, penulis ingin menyampaikan terima kasih yang sebesar – besarnya kepada ayahanda dan ibunda tercinta, Suhaimi dan Sumartini yang telah begitu banyak memberikan pengorbanan untuk membesarkan, mendidik, memberikan kasih sayang, cinta, doa, bimbingan, dan semangat yang tidak dapat terbalaskan. Tidak lupa penulis mengucapkan terima kasih kepada kakak dan adik tercinta Katherine Limita dan Irene Limita.
Dalam pelaksanaan penelitian dan penulisan skripsi ini, penulis banyak mendapatkan bantuan dan bimbingan dari berbagai pihak. Untuk itu, dengan segala kerendahan hati dan penghargaan yang tulus penulis juga menyampaikan rasa terima kasih kepada :
1. Prof. H. Nazruddin, drg., C.Ort, Sp.Ort., Ph.D selaku Dekan Fakultas Kedokteran Gigi Universitas Sumatera Utara.
2. Cut Nurliza, drg., M.Kes selaku Ketua Departemen Ilmu Konservasi Gigi Fakultas Kedokteran Gigi Universitas Sumatera Utara dan dosen pembimbing skripsi yang telah banyak meluangkan waktu, memberikan ide, dan bersedia membimbing penulis sehingga skripsi ini dapat terselesaikan.
3. Prof. Dr. Rasinta Tarigan, drg., Sp.KG(K) dan Darwis Aswal, drg. selaku dosen penguji yang telah meluangkan waktu, memberi ide dan saran kepada penulis.
4. Seluruh staf pengajar dan pegawai FKG USU terutama Departemen Ilmu Konservasi Gigi yang telah memberi bantuan, saran, dan bimbingan kepada penulis.
v
6. Drs. Awaluddin Saragih, M.Si., Apt selaku kepala Laboratorium Obat Tradisional Fakultas Faramasi USU beserta staff pengajar lainnya yang telah banyak membantu dan membimbing pelaksanan penelitian ini.
7. Ridzky Anis Advent Yuda, S.Si, Tito Aditya Sanjaya, A.Md dan staf Laboratorium Rumah Sakit Khusus Infeksi UNAIR yang telah banyak membantu dan membimbing pelaksanaan penelitian ini.
8. Prof. Dr. Dwi Suryanto, M.Sc selaku guru besar Mikrobiologi Departemen Biologi Fakultas MIPA USU yang telah membantu peneliti dalam konsultasi metode penelitian.
9.Maya Fitria, SKM, M.Kes selaku staff pengajar Departemen Kependudukan dan Biostatistika Fakultas Kesehatan Masyarakat USU yang telah membantu peneliti dalam konsultasi dan pengolahan data statistika.
10.Sahabat-sahabat terbaik penulis, Sutanto, Fredysen, Christina, Ingrid, Jennifer, Novia, Fenny, Sumery, Vandersun, Hendy, Julia, David, dan teman-teman seperjuangan di Departemen Konservasi Gigi beserta teman - teman angkatan 2011 lainnya yang telah memberi dukungan dan semangat selama pembuatan skripsi.
11. Kak Jocelyn dan Kak Jeje yang telah banyak memberi bantuan dan saran kepada penulis.
Penulis menyadari bahwa skripsi ini jauh dari sempurna, untuk itu diharapkan saran dan kritik yang membangun untuk kesempurnaan skripsi ini. Penulis juga memohon maaf apabila ada kesalahan selama melakukan penelitian dan penyusunan skripsi ini dan berharap semoga skripsi ini dapat memberikan sumbangan pikiran yang berguna bagi fakultas, pengembangan ilmu, dan masyarakat.
Medan, 28 April 2015 Penulis,
vi DAFTAR ISI
Halaman HALAMAN JUDUL ...
HALAMAN PERSETUJUAN ... HALAMAN TIM PENGUJI ...
BAB 1 PENDAHULUAN 1.1Latar Belakang ... 1
BAB 2 TINJAUAN PUSTAKA 2.1 Penggunaan Bahan Medikamen Saluran Akar ... 6
2.2 Bakteri Fusobacterium nucleatum sebagai Salah Satu Bakteri yang Berperan dalam Infeksi Saluran Akar ... 10
2.3 Lobak (Raphanus sativus L.) ... 15
2.4 Kerangka Teori... 20
BAB 3 KERANGKA KONSEP DAN HIPOTESIS PENELITIAN 3.1 Kerangka Konsep ... 21
3.2 Hipotesis Penelitian ... 21
vii
4.4 Variabel dan Definisi Operasional ... 25
4.4.1 Variabel Penelitian ... 25
4.4.2 Variabel Bebas ... 26
4.4.3 Variabel Tergantung... 26
4.4.4 Variabel Terkendali ... 26
4.4.5 Variabel Tidak Terkendali ... 27
4.4.6 Definisi Operasional... 28
4.5 Metode Penatalaksanaan Penelitian ... 29
4.5.1 Bahan Penelitian... 29
4.5.2 Alat Penelitian ... 30
4.5.3 Prosedur Penelitian... 30
4.5.3.1 Pembuatan Ekstrak Etanol Umbi Lobak (Raphanus sativus L.) ... 30
4.5.3.2 Uji Aktivitas Bakteri dengan Metode Dilusi ... 33
4.5.3.2.1 Pembuatan Suspensi Bahan Uji ... 33
BAB 5 HASIL PENELITIAN 5.1 Ekstraksi Umbi Lobak (Raphanus sativus L.) ... 37
5.2 Uji Efektivitas Antibakteri ... 38
BAB 6 PEMBAHASAN ... 49
BAB 7 KESIMPULAN DAN SARAN 7.1 Kesimpulan ... 54
7.2 Saran ... 54
DAFTAR PUSTAKA ... 55
viii
DAFTAR TABEL
Tabel Halaman
1 Bakteri yang Diisolasi Dari Saluran Akar Gigi dengan Lesi
Periapikal... 13
2 Hasil Uji Efek Antibakteri Ekstrak Etanol Umbi Lobak
(Raphanus sativus L.) terhadap Fusobacterium nucleatum pada
Konsentrasi 100%, 50%, 25%,12,5%... 38
ix
DAFTAR GAMBAR
Gambar Halaman
1 Koloni F.nucleatum dibawah Scanning Electron Microscopy
(SEM)... 10
2 F.nucleatum dibawah mikroskop elektron Outer membrane (OM), Perisplasmic space (P), dan Cell membrane(CM)... 11
3 Gambaran SEM dari pembentukan biofilm antara F.nucleatum dengan P.gingivalis... 15
4 Lobak (Raphanus sativus L.)... 16
5 Umbi lobak dikeringkan di lemari pengering... 32
6 Umbi lobak yang telah kering diblender... 32
7 Simplisia umbi lobak... 32
8 Proses maserasi... 32
9 Proses perkolasi... 33
10 Proses penguapan ekstrak etanol umbi lobak... 33
11 Ekstrak kental umbi lobak berwarna coklat... 37
12 Hasil uji KHM pada konsentrasi 100%, 50%, 25%, 12,5%, 6,25%, 3,125%, 1,56%, 0,78%, 0,38%, dan kontrol positif setelah dinkubasi 24 jam pada suhu37°C... 39
13 Hasil uji KHM yang menunjukkan tidak adanya kekeruhan pada konsentrasi (a)12,5% sebelum 24 jam, (b)12,5% setelah 24 jam... 40
x
15 Hasil uji bahan coba kontrol negatif (a) replikasi I, (b) replikasi II, (c) replikasi III, (d) replikasi IV yang menunjukkan hasil tidak
adanya pertumbuhan bakteri (steril)... 41 16 Hasil uji bahan coba kontrol positif (a) replikasi I sebesar 2,1×108
CFU/ml, (b) replikasi II sebesar 2,1×108 CFU/ml, (c) replikasi III sebesar 2,8×108 CFU/ml, (d) replikasi IV sebesar 3,2×108
CFU/ml... 42 17 Hasil uji bahan coba konsentrasi 100% (a) replikasi I, (b) replikasi
II, (c) replikasi III, (d) replikasi IV yang menunjukkan hasil tidak
adanya pertumbuhan bakteri (steril)... 43 18 Hasil uji bahan coba konsentrasi 50% (a) replikasi I, (b) replikasi
II, (c) replikasi III, (d) replikasi IV yang menunjukkan hasil tidak
adanya pertumbuhan bakteri (steril)... 44 19 Hasil uji bahan coba konsentrasi 25% a) replikasi I, (b) replikasi II,
(c) replikasi III, (d) replikasi IV yang menunjukkan hasil tidak
adanya pertumbuhan bakteri (steril)... 45 20 Hasil uji bahan coba konsentrasi 12,5% yang menunjukkan hasil
adanya pertumbuhan bakteri pada (a) replikasi I sebesar 7×106 CFU/ml, (b) replikasi II sebesar 5×106 CFU/ml, (c) replikasi III
xi
DAFTAR LAMPIRAN
Lampiran Halaman
1 Skema Alur Pikir... 62 2 Alur Penelitian... 64 3 Sertifikat Hasil Uji Bakteri... 67 4 Uji Statistik Antibakteri Umbi Lobak (Raphanus sativus L.) terhadap
BAB 1
PENDAHULUAN
1.1 Latar belakang
Keberhasilan suatu perawatan endodontik bergantung pada triad endodontik yang terdiri dari preparasi, pembentukan dan pembersihan, sertaobturasi dari saluran akar gigi.1Menghilangkan bakteri dari saluran akar dan menciptakan lingkungan agar bakteri yang tersisa tidak dapat bertahan hidup merupakan tujuan utama dari perawatan endodontik.2Penggunaan agen antimikroba seperti irigasi dan medikamen saluran akar dapat membantu untuk mengurangi jumlah dari bakteri.3,4 Medikamen saluran akar digunakan pada perawatan saluran akar yang memerlukan perawatan lebih dari satu kunjungan seperti kasus nekrosis pulpa dan lesi periapikal.5Oleh karena ituagen antimikroba pada medikamen harus mampu menembus ke dalam jaringan gigi yang terdapat mikroba untuk mencapai konsentrasi yang tinggi untuk membunuh bakteri.6
Adapun syarat bahan medikamen saluran akar yaitu biokompatibel, memiliki daya antibakteri, menetralisir sisa – sisa debris di saluran akar, mengontrol nyeri pascaperawatan, mampu mencegah reinfeksi.7Medikamen yang dapat digunakan dalam perawatan endodontik dapat dibagi atas beberapa kelompok besar yaitu golongan fenol, aldehid/formaldehid, halida/halogen, steroid, kalsium hidroksida, dan antibiotik.8 Sudah lama diketahui bahwa efek antibakteri dapat ditingkatkan dengan pemberian medikamen saluran akar yang bersifat antimikroba seperti kalsium hidroksida (Ca(OH)2).9
kelemahan dari kalsium hidroksida yaitu kelarutan dan daya difusi yang rendah membuatnya kesulitan untuk cepat mencapai pH yang diperlukan untuk membunuh bakteri di dalam tubulus dentin dan variasi anatomi yang lain.6Keefektifan dari kalsium hidroksida yang tidak sama terhadap berbagai bakteri yang ditemukan di dalam saluran akar.11Menurut penelitian dari Siqueira et al. (2007) bahwa masih ditemukan bakteri Fusobacterium nucleatum yang diisolasi dari saluran akar setelah pemberian kalsium hidroksida selama 1 minggu.12
Fusobacterium nucleatum merupakan bakteri anaerob obligat gram negatif yang terdapat dalam rongga mulut dan membran mukosa pada manusia.13Sebagai bakteri gram negatif, Fusobacterium nucleatum memiliki liposakarida (LPS) sebagai zat endotoksin yang mempunyai kemampuan dalam menstimulasi reaksi inflamasi.14Keberadaan mikroorganisme ini di dalam rongga mulutberperan dalam mengawali berlangsungnya infeksi pada pasien dengan kondisi kebersihan rongga mulut yang jelek.13Menurut penelitian dari Kipalev et al. (2014) menunjukkan bahwa
Fusobacterium nucleatum lebih sering ditemukan pada infeksi saluran akar primer dengan menggunakan metode Polymerase Chain Reaction (PCR) yaitu sebesar 52,8% dibandingkan dengan infeksi saluran akar sekunder.15Fusobacterium nucleatum dan produknya juga memperlihatkan penyebab utama pada kelainan pulpa dan perkembangan terjadinya lesi periapikal.Penelitian dari Guimaraes et al. (2011)menunjukkan bahwa dari 20 saluran akar gigi yang berasal dari 16 pasien yang mengalami nekrosis pulpa terdapat bakteri Fusobacterium nucleatum sebanyak 68,5%.16Kombinasi Fusobacterium nucleatum, Prevotella spp., Porphyromonas spp.
juga berkaitan dengan perkembangan yang menunjukkan keparahan dalam endodontik flare up, karena adanya sinergi antara bakteri tersebut sehingga meningkatkan intensitas reaksi inflamasi pada jaringan periapikal.15,17
banyak terdapat bakteri anaerob gram negatif yang membentuk kumpulan dengan matriks ekstraselular seperti polisakarida, protein, DNA ekstraseluler yang dapat menyebabkan patogen endodontik.19,20Bakteri dalam bentuk biofilm memiliki virulensi yang lebih tinggi dan cenderung mempunyai tantangan besar dalam mengeliminasinya dari dinding saluran akar.21
Akibat adanya kelemahan dari beberapa bahan medikamendalam mengeliminasi bakteri, maka digunakanlahalternatif bahan medikamen herbal dari ekstrak tumbuhan yang memenuhi syarat bahan medikamen saluran akar.22Produk herbal telah digunakan dalam praktek kedokteran gigi dan medis selama ribuan tahun dan telah menjadi semakin populer saat ini karena memiliki sifat biokompatibel, antimikroba, antiinflamasi, dan antioksidan.23Menurut World Health Organization(2003), obat herbal secara luas telah diterima diseluruh negara seperti Afrika, Asia, dan Amerika Latin sebagai pelengkap pengobatan primer. Sebanyak 80% dari populasi di Afrika menggunakan obat herbal untuk pengobatan herbal. WHO juga memberikan rekomendasi penggunaan obat tradisional termasuk herbal untuk pemeliharaan kesehatan masyarakat, pencegahan dan pengobatan penyakit seperti penyakit kronis, penyakit degeneratif, dan kanker.24 Lebih dari 50% semua obat modern mempunyai sumber yang berasal dari produk yang alami.25Penggunaan obat tradisional lebih aman karena memiliki efek samping yang relatif sedikit dibandingkan dengan obat modern serta lebih mudah tersedia dan harga yang lebih murah.24,26,27
Beberapa penelitian yang telah dilakukan di Indonesia mengenai pengembangan bahan alami sebagai alternatif bahan medikamen saluran akar, diantaranya pegagan dan daun Afrika.28,29 Penelitian yang telah dilakukan oleh Amalia (2013) mengenai ekstrak etanol siwak (Salvadora persica L.) didapatkan nilai Kadar Bunuh Minimum (KBM) untuk F.nucleatum yaitu pada konsentrasi 100%.28 Penelitian yang dilakukan oleh Vika (2014) mengenai ekstrak etanol daun Afrika terhadap F.nucleatum dengan nilai Kadar Bunuh Minimum (KBM) 12,5%.29
tanaman yang berasal dari Eropa dan Asia.Lobak dapat dikonsumsi dan telah digunakan secara tradisional sebagai obat – obatan.Lobak digunakan sebagai obat dalam pengobatan antitumor, antiinfeksi, mencegah terjadinya kanker, serta mempunyai aktivitas antimikroba.32 Umbi lobak (Raphanus sativus L.) memiliki zat – zat antimikroba seperti isothiocyanate, raphanin, tannin, saponin, coumarin,
alkaloid, anthraquinone, flavonoid, terpenoid.30,33-35Aktivitas antibakteri dari ekstrak umbi lobak (Raphanus sativus L.) lebih efektif dibandingkan dengan ekstrak batang dan daun. Penelitian dari Beevi et al. (2009) menunjukkan hasil KHM dari ekstrak aseton dengan konsentrasi 1 mg/ml umbi lobak terhadap bakteri Bacillus sublitis,
Staphylococcus aureus, Staphylococcus epidermidis, Enterococcus faecalis,
Salmonella typhimurium,Enterobacter aerogenes, Enterobacter cloacae.30 Penelitian dari Janjua et al.(2013) menunjukkan hasil KHM dari ekstrak etanol dari Raphanus sativusdengan konsentrasi 50 mg/ml dapat menghambat pertumbuhan bakteri S. aureus, B. subtilis, M. luteus, E. aerogenes, S. typhi, E. coli, K. Pneumoniae, P. aureginosa, B. bronchiseptica.35
Berdasarkan uraian diatas, diketahui bahwa umbi lobak (Raphanus sativus L.) memiliki sejumlah kandungan zat – zat yang dapat berfungsi sebagai antibakteri yang merupakan syarat medikamen saluran akar. Umbi lobak (Raphanus sativus L.) juga bersifat biokompatibel karena dapat dikonsumsi. Namun hingga saat ini belum ditemukan suatu penelitan yang menggunakan umbi lobak (Raphanus sativus L.) sebagai tanaman herbal dalam pengujian efektivitas antibakterinya terhadap bakteri
Fusobacterium nucleatum sebagai bahan alternatif medikamen saluran akar, sedangkan obat yang berasal dari sintesis akan menimbulkan efek samping yang lebih besar.
1.2 Rumusan masalah
Berdasarkan uraian yang dijelaskan di atas, maka dapat dibuat suatu rumusan masalah sebagai berikut:
Apakah ekstrak etanol umbi lobak (Raphanus sativus L.) memiliki efek antibakteri terhadap Fusobacterium nucleatum sebagai bahan alternatif medikamen saluran akar dengan mencari konsentrasi minimal ekstrak etanol umbi lobak yang dapat menghambat dan membunuh bakteri Fusobacterium nucleatum?
1.3 Tujuan penelitian
Tujuan dari penelitian ini adalah untuk mengetahui efek antibakteri dari ekstrak etanol umbi lobak (Raphanus sativus L.) sebagai bahan alternatif medikamen saluran akar terhadap Fusobacterium nucleatum dengan mencari konsentrasi minimal ekstrak etanol umbi lobak (Raphanus sativus L.) yang dapat menghambat (KHM) dan membunuh (KBM) bakteri Fusobacterium nucleatum.
1.4Manfaat penelitian 1.4.1 Manfaat Teoritis
1. Sebagai dasar penelitian lebih lanjut pengembangan ekstrak etanol umbi lobak (Raphanus sativus L.) sebagai bahan alternatif medikamen saluran akar dalam perawatan endodontik.
2. Menambah informasi dalam bidang kedokteran gigi mengenai sifat antibakteri dari ekstrak etanol umbi lobak (Raphanus sativus L.).
1.4.2 Manfaat Praktis
1.Pengembangan material kedokteran gigi yang berasal dari bahan alami dan bersifat lebih biokompatibel, mudah didapatkan dan harga yang lebih terjangkau dalam rangka meningkatkan pelayanan kesehatan gigi pada masyarakat.
BAB 2
TINJAUAN PUSTAKA
Eliminasi mikroorganisme dari infeksi saluran akar adalah faktor yang paling penting dalam perawatan saluran akar.8Untuk mengurangi aktivitas bakteri pada saluran akar digunakanlah bahan medikamen saluran akar.36 Jenis bahan medikamen yang sering digunakan dalam perawatan saluran akar adalah Ca(OH)2 karena bersifat
antibakteri.2 Namun salah satu bakteri patogen yang ada di saluran akar yang sering dijumpai berkaitan dengan bakteri lain dan mempunyai peran dalam kasus infeksi saluran akar primer seperti Fusobacterium nucleatummasih ditemukan dalam beberapa kasus setelah pemberian bahan medikamen Ca(OH)2.12 Untuk mencapai
suatu keberhasilan pada penelitian ini dalam mengetahui efek antibakteri dan mengeliminasi bakteri Fusobacterium nucleatum, diharapkan ekstrak etanol umbi lobak dapat digunakan sebagai bahan alternatif medikamen saluran akar.
2.1 Penggunaan Bahan Medikamen Saluran Akar
Bahan medimaken yang memiliki aktivitas antibakteri sering digunakan untuk mengeliminasi bakteri yang tersisa setelah preparasi chemomechanical.37Suatu medikamen saluran akar harus memiliki syarat antara lain biokompatibel, memiliki daya antibakteri, menetralisir sisa – sisa debris di saluran akar, mengontrol nyeri pascaperawatan, mampu mencegah reinfeksi.7Tujuan dari pemberian bahan medikamen saluran akar adalah untuk mengurangi jumlah bakteri dan mencegah infeksi kembali dari bakteri tersebut selama perawatan saluran akar, mengurangi rasa nyeri setelah perawatan saluran akar, menstimulasi perbaikan kembali jaringan periapikal8,38
Bahan – bahan medikamen dapat dibagi menjadi : a. Golongan fenol
membahayakan jaringan pulpa dan periapeks.8 Golongan fenol terdiri dari bahan kristalin putih yang memiliki bau yang menyegat, rasa yang tidak enak, dan akan mengalami kehilangan daya aktifnya dalam waktu 24 jam.8,39 Studi in vitro
menunjukkan fenol dan turunannya memiliki sifat sangat toksik pada sel mamalia, tetapi daya antimikrobanya tidak sebanding dengan toksisitasnya.39Contoh dari golongan fenol antara lain camphorated monoparachloropenol (CMCP),
metacresylacetate (cresatin), eugenol, parachlorophenol (PCP), camphorated parachlorophenol (CPC), cresol, creosote, thymol.8
b. Golongan aldehid seperti formokresol dan glutaraldehid8
Penggunaan golongan aldehid pada jaringan nekrotik akan membuat jaringan itu menjadi lebih toksik dan memiliki potensi mutagen serta karsinogen.8,39 Golongan fenol dan formokresol menunjukkan bahwa medikamen ini tidak berpengaruh pada pencegahan nyeri.8
c. Golongan halida sepertiIodine potassium iodide (IKI)8
Iodine potassium iodide mempunyai kemampuan berdifusi lewat tubulus dental dan membunuh bakteri in vivo. IKI juga merupakan desinfektan yang efektif pada dentin yang terinfeksi dan dapat membunuh bakteri pada dentin yang terinfeksi dalam waktu 5 menit secara in vitro.39
d. Antibiotik
Jenis antibiotik yang sering dipakai adalah pasta Ledermix dan Septomixine Forte. Keduanya sama – sama mengandung kortikosteroid sebagai agen antiinflamasi, tetapi spektrum kerja kedua jenis antibiotik tersebut kurang sehingga belum sesuai digunakan dalam perawatan saluran akar.2
e. Golongan steroid
Golongan steroid dapat menurunkan nyeri setelah perawatan, tetapi tidak akan menurunkan insiden flare up.8
f. Kalsium hidroksida
Sekarang kalsium hidroksida digunakan sebagai bahan medikamen dalam praktik endodontik.37,40
Kalsium hidroksida merupakan bahan medikamen saluran akar yang paling efektif dalam perawatan saluran akar dan sering digunakan hingga sekarang, karena memiliki sifat basa, dengan suasana basa pada saluran akar yang memiliki daya antibakteri terhadap bakteri yang tidak tahan terhadap suasana basa.6,7 Kalsium hidroksida memiliki pH yang mendekati 12 - 12,5 yang menunjukkan sebuah senyawa alkalin yang kuat jika dilarutkan dalam pelarut air.37,41 Di dalam pelarut, Ca(OH)2 akan dilarutkan menjadi kalsium dan ion hidroksil. Macam – macam sifat
biologis yang dimiliki pada Ca(OH)2, seperti aktivitas antimikroba, mencegah
resorpsi gigi, menginduksi perbaikan pada pembentukan jaringan keras. Cara kerja Ca(OH)2 melalui pelepasan ion Ca2+ yang memiliki peran dalam proses mineralisasi
jaringan dan ion OH- yang menghasilkan alkalin yang tinggi sehingga menyebabkan lingkungan yang tidak sesuai bagi mikroorganisme.2 Pelepasan ion hidroksil pada lingkungan pH alkalin dapat menghancurkan membran sel dari bakteri dan struktur proteinnya serta memodifikasi genetik dari sel bakteri tersebut.6,41 Kalsium hidroksida juga menghidrolisis lapisan lipid dari lipopolisakarida (LPS) yang biasa dimiliki oleh bakteri gram negatif, dengan menghasilkan asam lemak hidroksi dalam jumlah yang banyak dan menonaktifkan enzim dalam membran bakteri serta menggangu mekanisme transportasi yang mengakibatkan sel keracunan.42
Efek letalnya pada bakteri ditunjukkan pada mekanisme: a. Penghancuran pada membran sel dari bakteri
b. Denaturasi protein
Sifat alkalinasi yang berasal dari kalsium hidroksida menginduksi pelepasan ikatan ionik yang mempertahankan struktur tersier dari protein. Struktur dari protein juga dirusak oleh ion hidroksil.
c. Penghancuran pada DNA bakteri
Ion hidroksil bereaksi dengan DNA bakteri dan menginduksi pemisahan dari untaiannya. Hasilnya, replikasi DNA terhambat dan aktivitas selular terganggu. Radikal bebas juga menyebabkan induksi dari mutasi yang letal.6,40
Namun kalsium hidroksida (Ca(OH)2) juga memiliki beberapa kelemahan
melalui penelitian Siquiera et al (2007), membuktikan bahwa dari 11 saluran akar dengan lesi periodontitis apikalis, setelah penggunaan bahan dressing antar kunjungan dengan menggunakan Ca(OH)2 selama satu minggu, ditemukan dua kasus
bakteri postmedikamen, dengan satu takson per kasus, yaitu bakteri F.nucleatum dan
Lactococcus garvieae.12Penelitian dari Porteiner .et al (2001)melaporkan bahwa dentin dapat mempengaruhi aktivitas antibakteri dari kalsium hidroksida, dengan kemampuan buffer dentin yang menghambat kerja dari kalsium hidroksida, sehingga terjadi penurunan kondisi alkalin yang dibutuhkan untuk membunuh bakteri, serta menghambat penetrasi ion hidroksil ke jaringan pulpa.43Kalsium hidroksida juga bersifat lambat sebagai agen antibakteri dalam mencapai keefektifitasan, karena kalsium hidroksida harus berada dalam saluran akar kurang lebih satu minggu. Penelitian menunjukkan 11% dari saluran akar masih terdapat bakteri setelah dua perawatan berturut – turut dengan bahan medikamen kalsium hidroksida dan dua per tiga mengalami kegagalan.37 Hal ini kemungkinan terjadi karena anatomi pulpa yang kompleks sehingga beberapa mikroorganisme dapat berpindah ke kanal lateral,
isthmus, delta saluran akar, dan tubulus dentin setelah dilakukan preparasi
2.2 Bakteri Fusobacterium nucleatum sebagai Salah Satu Bakteri yang Berperan dalam Infeksi Saluran Akar.
Menurut taksonominya, Fusobacterium nucleatum diklasifikasikan berdasarkan:14
Kingdom : Bacteria Filum : Fusobacteria Famili : Bacteriodaceae Genus : Fusobacterium
Spesies : Fusobacterium nucleatum
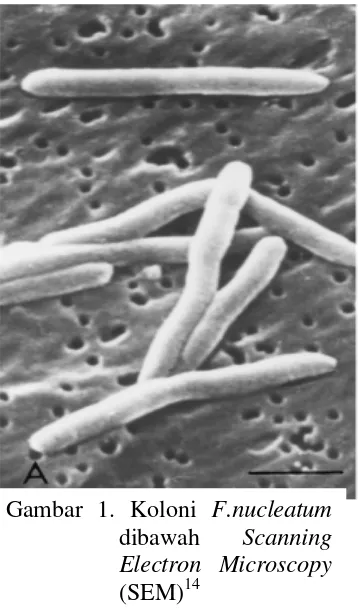
Fusobacterium nucleatum merupakan jenis bakteri anaerob obligat gram negatif dengan sel yang tipis, bentuk batang yang bergelendong dengan kedua ujung yang tajam atau filamen, panjang sel bakteri 5 – 10 �mdan termasuk kedalam famili Bacteroidaceae.14,45 (Gambar 1)
Gambar 1. Koloni F.nucleatum dibawah Scanning Electron Microscopy
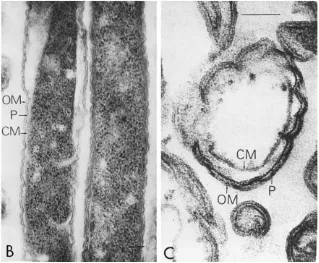
F. nucleatum sebagai bakteri gram negatif memiliki karakteristik pada membran luar bakteri tersebut. Envelope dari bakteri terdiri dari membran luar dan dalam yang terpisah dengan periplasmic space yang mengandung peptidoglikan. Secara umum membran dalam dari bakteri terdiri dari membran ganda fosfolipid yang simetris dan protein. Membran terluar berfungsi sebagai molekul selektif dan membran asimetris yang terdiri dari fosfolipid, lipopolisakarida (LPS), lipoprotein, dan protein.14(Gambar 2)
Kompleks lipopolisakaridayang berupa endotoksin dapat menyebabkan
biological effects yaitu aktivasi komplemen, sitotoksisitas, dan resorpsi tulang. Lipopolisakarida juga memegang peranan penting dalam proses perlekatan bakteri F.
nucleatum dengan hidroksiapatit dan sementum pada permukaan
gigi.14,46Lipopolisakarida dari Fusobacterium nucleatum juga menginduksi secara cepat respon imun pada jaringan pulpa.47
F.nucleatum memerlukan media yang baik untuk tumbuh sumbur yang terdapat kandungan trypticase, peptone, dan ekstrak ragi. F.nucleatum menggunakan asam amino untuk menghasilkan energi serta menggunakan glukosa untuk reaksi biosintesis molekuler interseluler.14Bakteri tersebut bersifat tidak bergerak dan tidak menghasilkan spora dengan produk utama hasil akhir metabolisme berupa asam butirat serta sejumlah kecil asetat, laktat, format, dan asam propionat.14,17Asam butirat, asam propionat, dan ion amonium dapat menghambat proliferasi sel fibroblas pada gingiva, yang memberikan jalan masuk bagi F.nucleatum untuk melakukan penetrasi ke epitel gingiva.14 Asam butirat juga berperan dalam inhibisi terbesar dari T-sel blastogenesis dan menstimulasi produksi interleukin-1 yang berkaitan dengan resorpsi tulang.46F.nucleatum juga menghasilkan protease yang dapat melakukan aktivitas proteolitik yang mendegradasi fragmen kolagen yang menyebabkan kerusakan periodontal dari host.14
Tabel 1. Bakteriyang disiloasi dari saluran akar gigi dengan lesi periapikal.46
Mikroorganisme di dalam saluran akar dapat tumbuh tidak hanya sebagai sel planktonik, tetapi juga dapat membentuk suatu biofilm yang terdiri dari jaringan kompleks dari berbagai mikroorganisme. Pembentukan biofilm yang terjadi di dalam saluran akar dimulai setelah mikroorganisme kontak dengan tanduk pulpa dan juga
didukung oleh morfologi saluran akar yang begitu kompleks.18Bakteri yang berkumpul dalam biofilm dapat berkomunikasi intraspesies maupun antarspesies. Komunikasi tersebut dilakukan untuk memperoleh sifat-sifat baru. Quorum sensing
adalah komunikasi intraspesies bakteri yang dimediasi oleh molekul rendah yang berat, yang dapat mengubah aktivitas metabolisme sel-sel tetangga dan mengkoordinasikan fungsi sel bakteri terdapat dalam biofilm. Quorum sensing juga dapat mengatur properti mikroba seperti faktor virulensi dan penggabungan DNA ekstraseluler.50,51Beberapa bakteri yang saling berhubungan dengan spesies lainnya melalui rantai makanan dengan metabolisme dari satu spesies menyediakan nutrien esensial untuk pertumbuhan populasi bakteri yang lainnya. Fusobacterium nucleatum
berperan penting dalam pembentukan biofilm karenakemampuannya dalam memecah glukosa dari strukur interseluler dan memanfaatkannya sebagai sumber energi pada saat kekurangan nutrisi, hal inilah yang mendukung bakteri lain berpindah ke sekitar permukaan sel Fusobacterium nucleatum yang selanjutnya berikatan dengan dinding selnya.14 Kombinasi Fusobacterium nucleatum, Prevotella spp., Porphyromonas spp.
juga berkaitan dengan perkembangan yang menunjukkan keparahan dalam endodontik flare up, karena adanya sinergi antara bakteri tersebut sehingga meningkatkan intensitas reaksi inflamasi pada jaringan periapikal.15,17F.nucleatum
2.3 Lobak (Raphanus sativus L.)
Raphanus sativus L. yang berasal dari famili Brassiaceae memiliki banyak manfaat dan telah digunakan sebagai tanaman obat sejak dahulu.32,35Raphanus sativus
aslinya berasal dari Eropa dan Asia. Klasifikasi nama dari tanaman lobak (Raphanus sativus L.) adalah:34
Kingdom : Plantae Divisi : Tracheophyta Kelas : Magnoliopsida Ordo : Brassicales Famili : Brassicaceae Genus : Raphanus
Spesies : Raphanus sativus L.
Tanaman tersebut dapat tumbuh pada iklim yang memiliki ketinggian antara 190 sampai 1240 m. Tanaman tersebut memiliki tinggi 30 – 90 cm dan akarnya tebal dengan banyak ukuran, bentuk, dan warna.32 Batangnya bisa bercabang maupun tidak, pada bagian dasar daunnya panjang, biasanya berbentuk lengkung dan bergerigi kasar, tapi kadang tidak bergerigi jika batangnya yang tidak bercabang dan lurus.
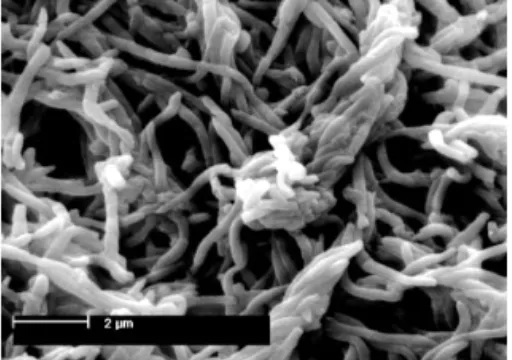
Gambar 3.Gambaran SEM dari pembentukan biofilm
antara F.nucleatum dengan
Bunganya terdapat pada ujung tandan yang panjang, biasanya berwarna putih atau ungu. Buahnya sedikit dan tidak merekah, dengan panjang 2,5 – 7,5 cm dan diameter 1,25 cm, dengan ujung yang panjang dan lonjong. Biasanya memiliki 6 – 12 biji yang bulat, dengan warna kuning sampai coklat. Umbinya dengan bentuk bervariasi dari hampir berbentuk bulat, silinder, kerucut, pada jenis orientalnya, dan berat hingga 15 kg. Dagingnya biasanya berwarna putih, meskipun ada beberapa yang berwarna merah muda hingga merah.34 (Gambar 4)
Lobak telah digunakan sebagai makanan obat – obatan untuk berbagai penyakit termasuk disfungsi hati dan pencernaan yang buruk. Beberapa penelitian telah menunjukkan bahwa ekstrak lobak memiliki aktivitas biologi seperti efek antioksidan, antimutagenik, dan anti proliferatif.34
Sifat antioksidan, antimikroba, dan sifat obat lainnya secara luas dimanfaatkan untuk kepentingan manusia tentang kesehatan. Penelitian dari Janjua et al. (2013) menunjukkan hasil KHM dari ekstrak etanol dari Raphanus sativusdengan konsentrasi 50 mg/ml dapat menghambat pertumbuhan bakteri S. aureus(20 ± 0,6 mm), B. subtilis(21 ± 1,0 mm), M. luteus(22 ± 1,5 mm), E. aerogenes(19 ± 1,0 mm),
S. typhi(3 ± 1,3 mm), E. coli(21 ± 1,1 mm), K. pneumoniae(17 ± 2,4 mm), P. aureginosa(14 ± 0,8 mm), B. bronchiseptica(22 ± 0,7 mm).35 Penelitian dari Beevi et al (2009) menunjukkan hasil KHM dari ekstrak aseton umbi lobak dengan konsentrasi 1 mg/ml terhadap bakteri Bacillus sublitis (23,43 ± 1,29 mm),
Staphylococcus aureus (23,53± 1,36 mm), Staphylococcus epidermidis (29,57± 0,81 mm), Enterococcus faecalis (25,53± 0,89 mm), Salmonella typhimurium (36,97±
0,15 mm), Enterobacter aerogenes (34,17± 0,77 mm), Enterobacter cloacae (20,50±
0,44 mm).30
Khasiat obat yang terdapat dalam Raphanus sativus L.telah dihubungkan dengan produksi dari metabolit sekunder yang mengandung tannin, saponin, coumarin, alkaloid, anthraquinone, dan flavonoid.35
a. Tannin
Tannin adalah kelompok zat fenolik primer yang bersifat astringentyang ditemukan hampir di setiap bagian tanaman yang ditandai oleh aktivitas antibakteri pada inaktivasi sifat adhesi bakteri, enzim, selubung envelope bakteri, dan protein transpor bakteri.54,55 Tannin berperan dalam stimulasi sel fagosit, aktivitas host mediated tumor, antibakteri, antijamur dan berbagai tindakan antiinfeksi.55,56
b. Saponin
Saponin adalah senyawa bioaktif yang dihasilkan terutama oleh tanaman dan beberapa organisme laut dan serangga. Saponin bersifat seperti sabun dalam air yang menghasilkan busa. Karena sifat lyobipolar, saponin dapat berinteraksi dengan membran sel dan juga mampu menurunkan tegangan permukaan larutan berair. Saponin mengerahkan beberapa aktivitas antibakteri melalui penggabungan dengan membran sel untuk menimbulkan perubahan morfologi sel yang mengakibatkan sel lisis. Kegiatan farmakologi yang telah dilaporkan dari saponin adalah antibakteri, antijamur, antivirus, hepatoprotektif antiinflamasi, anti ulkus, antitumor, antikanker, antimalaria.57-59
c. Coumarin
manusia.61 Sifat antimikroba coumarin dengan mengubah konformasi dari asam nukleat dan menghambat replikasi DNA dari bakteri, yang menyebabkan modifikasi dalam pertumbuhan sel bakteri dan inhibitor enzim. Coumarin juga membentuk kompleks ion tembaga yang bersifat antibakteri dengan sifat toksisitas terhadap bakteri.62,63
d. Flavonoid
Flavonoid adalah kelompok utama polifenol yang telah dipublikasikan untuk bertindak terhadap pengoksidasi seperti radikal hidroksil, anion superoksida, dan radikal peroksida. Salah satu peran flavonoid adalah melindungi tanaman terhadap serangan bakteri. Selain itu beberapa flavonoid telah ditemukan dan didokumentasikan menunjukkan aktivitas antibakteri terhadap strain yang berbeda dari bakteri Staphylococcusaureus, Streptococcus agalactiae, Escherichia coli and Klebsilla pneumonia.64 Setelah ditemukan untuk disintesis dari tanaman terhadap respon infeksi mikroba, flavonoid menunjukkan keefektifan secara in vitro dalam beragam zat antimikroba. Kemampuan flavonoid disebabkan oleh kemampuannya untuk bergabung dengan bagian ekstraseluler, protein yang larut, dinding sel bakteri, serta merusak membran sel bakteri. Flavonoid juga memiliki kemampuan untuk memodulasi respon imun sel mononuklear dan meningkatkan persentase darah perifer.55,65,66
e. Alkaloid
f. Anthraquinone
Quinone merupakan cincin aromatik dengan dua substitusi keton. Dengan menyediakan sumber radikal bebas yang stabil, quinone diketahui dapat melengkapi asam amino nukleofil dalam protein secara irreversibel, sehingga mengakibatkan inaktivasi dari protein dan hilangnya fungsi selular. Oleh karena itu, quinone
2.4 Kerangka Teori
Ekstrak etanol umbi lobak (Raphanus sativus L.) Infeksi primer dan sekunder saluran akar
Bakteri Fusobacterium nucleatum
Perawatan saluran akar
Medikamen saluran akar
Aktivitas antibakteri
Saponin
Tannin Coumarin Flavonoid Alkaloid Anthraquinone
BAB 3
KERANGKA KONSEP DAN HIPOTESIS PENELITIAN
3.1 Kerangka Konsep
Penelitian ini dilakukan dengan menguji daya antibakteri ekstrak etanol umbilobak (Raphanus sativus L.) sebagai bahan alternatif medikamen saluran akar terhadap bakteri Fusobacterium nucleatum dengan penentuan nilai Kadar Hambat Minimum (KHM) dan nilai Kadar Bunuh Minimum (KBM).
3.2 Hipotesis Penelitian
Ada efek antibakteri ekstrak etanol umbi lobak (Raphanus sativus L.) sebagai bahan alternatif medikamen saluran akar terhadap pertumbuhan Fusobacterium nucleatum dengan mencari konsentrasi minimal dari umbi lobak yang dapat menghambat dan membunuh bakteri Fusobacterium nucleatum.
Ekstrak etanol umbi lobak (Raphanus sativus L.)dengan konsentrasi 100%, 50%, 25%, 12,5%, 6,25%, dan 3,125%
Pertumbuhan bakteri
Fusobacterium nucleatum
pada mediaTrypticase Soy Broth (TSB) dan Trypticase Soy Agar (TSA) dengan penentuan nilai KHM dan KBM
BAB 4
METODE PENELITIAN
4.1 Rancangan dan Jenis Penelitian 4.1.1 Rancangan Penelitian
Rancangan penelitian yang digunakan dalam penelitian ini adalah posttest only control group design.
4.1.2 Jenis Penelitian
Jenis penelitian yang digunakan dalam penelitian ini adalah eksperimental laboratorium.
4.2 Lokasi dan Waktu Penelitian 4.2.1 Lokasi Penelitian
Lokasi penelitian yang digunakan pada penelitian ini adalah: 1. Laboratorium Obat Tradisional Fakultas Farmasi USU 2. Laboratorium Rumah Sakit Khusus Infeksi UNAIR
4.2.2 Waktu Penelitian
Waktu penelitian adalah 3 bulan (Januari 2014-Maret 2015)
4.3 Populasi, Sampel dan Besar Sampel 4.3.1 Populasi
Populasi dalam penelitian ini adalah bakteri Fusobacterium nucleatum.
4.3.2 Sampel
Sampel yang digunakan dalam penelitian ini adalah koloni bakteri
4.3.3 Besar Sampel Penelitian
Penentuan besar sampel berdasarkan penelitian sebelumnya, yaitu sesuai dengan SOP (Standard Operational Prosedure) yang ada di Laboratorium Rumah Sakit Khusus Infeksi, Universitas Airlangga untuk mendapatkan hasil yang representatif.
a. Penentuan nilai Kadar Hambat Minimum (KHM)
Penentuan besar sampel dilakukan berdasarkan SOP (Standard Operational Procedure) yang ada di Laboratorium Rumah Sakit Khusus Infeksi, Universitas Airlangga.Penentuan jumlah pengulangan ditentukan dengan menggunakan rumus Federer, yaitu :
Kelompok I : ekstrak dengan konsentrasi 100% = 4 sampel Kelompok II : ekstrak dengan konsentrasi 50% = 4 sampel Kelompok III : ekstrak dengan konsentrasi 25% = 4 sampel Kelompok IV : ekstrak dengan konsentrasi 12,5% = 4 sampel Kelompok V : kontrol Mc. Farland = 4 sampel Kelompok VI : kontrol negatif (ekstrak umbi lobak
tanpa suspensi F. nucleatum) = 4 sampel
Jumlah sampel = 24 sampel
b. Penentuan nilai Kadar Bunuh Minimum (KBM)
Dari masing-masing konsentrasi yang didapatkan dari prosedur penentuan nilai KHM, akan dilanjutkan dengan penghitungan jumlah koloni bakteri dengan metode Pour Plate dalam media padat Trypticase Soy Agar (TSA).
Keterangan :
Penentuan jumlah pengulangan ditentukan dengan menggunakan rumus Federer, yaitu :
( t – 1 ) ( r – 1) ≥ 15 ( 6 – 1 ) ( r – 1 ) ≥ 15
5r – 5 ≥ 15 5r ≥ 20 r ≥ 4
Jumlah perlakuan ulang (r) yang digunakan dalam penelitian ini adalah yaitu 4 kali pengulangan.
Kelompok I : ekstrak dengan konsentrasi 100% = 4 sampel Kelompok II : ekstrak dengan konsentrasi 50% = 4 sampel Kelompok III : ekstrak dengan konsentrasi 25% = 4 sampel Kelompok IV : ekstrak dengan konsentrasi 12,5% = 4 sampel Kelompok V : kontrol Mc. Farland = 4 sampel Kelompok VI : kontrol negatif (ekstrak umbi lobak
tanpa suspensi F. nucleatum) = 4 sampel
Jumlah sampel = 24 sampel
Keterangan :
4.4 Variabel dan Definisi Operasional 4.4.1 Variabel Penelitian
4.4.2 Variabel Bebas Variabel bebas
Ekstrak etanol umbi lobak (Raphanus sativus L.) dengan konsentrasi 100%, 50%, 25%, 12,5%, 6,25% dan 3,125%.
Variabel tergantung
Pertumbuhan bakteri Fusobacterium nucleatum pada media TSB dan TSA dengan penentuan nilai KHM dan KBM.
Variabel terkendali
a. Jenis dan asal umbi lobak (Raphanus sativus L.) b. Berat umbi lobak sebelum pengeringan (5 kg) dan setelah pengeringan (200 gram)
c. Lama dan suhu pengeringan umbi lobak (40oC) d. Volume etanol yang dipakai 6 liter
e. Konsentrasi etanol yang dipakai (70%) f. Waktu perendaman umbi lobak (15 menit) g. Suhu saat perendaman umbi lobak (25oC) h. Waktu perkolasi (2 minggu)
i. Nomor kertas saring yang dipakai (Whatman No.42)
j. Jumlah kertas saring saat perkolasi (3 lapis) k. Kecepatan tetes cairan dalam perkolator (20 tetes/menit)
l. Suhu penguapan rotavapor (40oC) m.Waktu penguapan rotavapor (10 jam)
n. Media pertumbuhan bakteri yaitu TSA dan
TSB
o. Sterilisasi alat, bahan coba, dan media p. Fusobacterium nucleatum ATCC 25586
q. Jumlah bahan coba yang diteteskan ke TSA dan
TSB (TSA = 100µl, TSB = 4 ml) r. Suhu inkubasi (37oC)
s. Teknik pembiakan Fusobacterium nucleatum
t. Waktu pembiakan Fusobacterium nucleatum
(24 jam)
u. Waktu pengamatan (24 jam) v. Keterampilan operator
Variabel tidak terkendali
a. Lingkungan (kondisi tanah dan iklim) tempat tumbuh umbi lobak
b. Usia umbi lobak
c. Perlakuan terhadap umbi lobak selama tumbuh
d. Lama penyimpanan umbi lobak sampai proses ekstraksi
e. Suhu penyimpanan umbi lobak sampai proses ekstraksi
f. Lama pengiriman dari bahan coba sampai ke Laboratorium Rumah Sakit Khusus Infeksi UNAIR
4.4.2 Variabel Bebas
Variabel bebas pada penelitian ini adalah ekstrak etanol umbi lobak (Raphanus sativus L.) dengan konsentrasi 100%, 50%, 25%, 12,5%, 6,25% dan 3,125%.
4.4.3 Variabel Tergantung
Variabel tergantung pada penelitian ini adalah pertumbuhan bakteri
Fusobacterium nucleatum pada media TSB dan TSA dengan pengukuran nilai KHM dan KBM.
4.4.4 Variabel Terkendali
Variabel terkendali pada penelitian ini terdiri atas: a. Jenis dan asal umbi lobak (Raphanus sativus L.)
b. Berat umbi lobak (Raphanus sativus L.) sebelum pengeringan (5 kg) dan setelah pengeringan (300 gram)
c. Lama dan suhu pengeringan umbi lobak (Raphanus sativus L.) (40oC) d. Volume etanol yang dipakai 6 liter
e. Konsentrasi etanol yang dipakai (70%)
f. Waktu perendaman umbi lobak (Raphanus sativus L.) (15 menit) g. Suhu saat perendaman umbi lobak (Raphanus sativus L.) (25oC) h. Waktu perkolasi (2 minggu)
i. Nomor kertas saring yang dipakai (Whatman No.42) j. Jumlah kertas saring saat perkolasi (3 lapis)
k. Kecepatan tetes cairan dalam perkolator (20 tetes/menit) l. Suhu penguapan rotavapor (40oC)
m. Waktu penguapan rotavapor (10 jam)
n. Media pertumbuhan bakteri yaitu Trypticase Soy Broth (TSB) dan
Trypticase Soy Agar (TSA)
q. Jumlah bahan coba yang diteteskan ke TSA dan TSB (TSA= 100µl, TSB= 4 ml)
r. Suhu inkubasi (37oC)
s. Teknik pembiakan Fusobacterium nucleatum
t. Waktu pembiakan Fusobacterium nucleatum (24 jam) u. Waktu pengamatan (24 jam)
4.4.5 Variabel Tidak Terkendali
Variabel yang tidak terkendali pada penelitian ini terdiri atas:
a. Lingkungan (kondisi tanah dan iklim) tempat tumbuh umbi lobak (Raphanus sativus L.)
b. Usia umbi lobak (Raphanus sativus L.)
c. Perlakuan terhadap umbi lobak (Raphanus sativus L.) selama tumbuh d. Lama penyimpanan umbi lobak (Raphanus sativus L.) sampai proses ekstraksi
e. Suhu penyimpanan umbi lobak (Raphanus sativus L.) sampai proses ekstraksi
f. Lama pengiriman dari bahan coba sampai ke Laboratorium Rumah Sakit Khusus Infeksi UNAIR
4.4.6 Definisi Operasional
Variabel Bebas
No Variabel Definisi Operasional Satuan
Ukur
Ekstrak yang didapat dengan
melarutkan 8grekstrak kental
umbi lobak (Raphanus
sativus L.) dalam 8mlTSB
Gram
Ekstrak yang didapat dengan
mengambil 4ml dari
konsentrasi ekstrak umbi
lobak (Raphanus sativus
L.)100% dan dilarutkan
dalam 4ml TSB
Mililiter Nominal Mikropipet
3 Ekstrak etanol
Ekstrak yang didapat dengan
mengambil 4ml dari
konsentrasi ekstrak umbi
lobak (Raphanus sativus L.)
50% dan dilarutkan dalam
4ml TSB
Mililiter Nominal Mikropipet
4 Ekstrak etanol
Ekstrak yang didapat dengan
mengambil 4ml dari
konsentrasi ekstrak umbi
lobak (Raphanus sativus L.)
25% dan dilarutkan dalam
4ml TSB
Variabel Tergantung
No Variabel Definisi Operasional Hasil Ukur Skala
Ukur
bahan coba yang mampu
menghambat
pertumbuhan bakteri
yang tampak secara
visual pada setiap tabung
dilusi setelah dinkubasi
bahan coba yang mampu
membunuh bakteri
Rasio Visual dengan
bantuan
transillumina-tor (Metode
Pour Plate)
4.5 Metode Penatalaksanaan Penelitian 4.5.1 Bahan Penelitian
Bahan penelitian yang digunakan adalah
1. Umbi lobak (Raphanus sativus L.) 5 kg yang diambil dari Desa Gajah, Kecamatan Simpang Empat, Kabupaten Tanah Karo, Provinsi Sumatera Utara, Indonesia.
2. Etanol 70% sebanyak 6 liter (Kimia Farma, Indonesia) 3. Akuades 1 liter (Kimia Farma, Indonesia)
4. Fusobaccterium nucleatum ATCC 25586 (Laboratorium Rumah Sakit Khusus Infeksi, Surabaya, Indonesia)
5. Trypticase Soy Agar dan Trypticase Soy Agar(Difco, USA)
4.5.2 Alat Penelitian
1. Timbangan (Home Line, China) 2. Timbangan analitik (Vibra, Japan) 3. Kertas perkamen 3 kajang
4. Blender (Panasonic, Japan)
5. Kapas 250gram (Bio Panca, Indonesia) 6. Kertas saring (Whatman no.42, England)
7. Aluminium foil 1 gulungan (Total Wrap, Indonesia) 8. Perkolator
9. Erlenmeyer (Pyrex, USA)
10. Vaccum rotavapor (Stuart, 2010)
11. Electronic balance (Ohyo JP2 6000, Japan dan Denver Instrument Company, USA)
12. Autoklaf (Tomy, Japan)
13. Vortex (Iwaki model TM-100, Japan) 14. Inkubator CO2 (Sanyo, Japan)
15. Pipet mikro (Gilson, France) 16. Piring petri (Pyrex, Japan) 17. Ose dan spiritus
18. Kaca pembesar (Ootsuka ENV-CL, Japan)
4.5.3 Prosedur Penelitian
4.5.3.1 Pembuatan ekstrak etanol umbi lobak (Raphanus sativus L.) Proses pembuatan ekstrak etanol umbi lobak (Raphanus sativus L.) dilakukan berdasarkan SOP (Standard Operational Prosedure) Laboratorium Obat Tradisional Fakultas Farmasi USU dengan langkah-langkah sebagai berikut:
a. Pembuatan simplisia
umbi diremas akan mudah hancur. Umbi lobak (Raphanus sativus L.) yang telah dikeringkan kemudian ditimbang kembali dan diperoleh 300 gram umbi lobak yang telah kering. Selanjutnya umbi lobak tersebut dihaluskan dengan menggunakan blender dan didapat serat-serat halus (simplisia) umbi lobak.
b. Proses maserasi
Sebanyak 300 gram serbuk simplisia diletakkan ke dalam bejana tertutup dan direndam dengan etanol 70% selama 15 menit pada suhu 25oC.
c. Proses perkolasi
Perkolator disiapkan dengan cara meletakkan kapas secukupnya yang telah dibasahi dengan etanol pada bagian dasar wadah perkolator, kemudian di atas kapas tersebut diletakkan kertas saring sebanyak 2 lembar. Kemudian massa simplisia yang telah direndam tersebut dipindahkan sedikit demi sedikit ke dalam perkolator di mulai dari bagian tengah hingga ke tepi perkolator dengan hati-hati sambil sesekali ditekan. Kemudian etanol 70% dituangkan ke dalam perkolator dan massa disaring dengan lapisan kertas saring sampai cairan tersebut mulai menetes dan diatas simplisia masih terdapat selapis cairan penyaring untuk mengetahui apakah perkolator sudah berfungsi dengan baik. Kemudian perkolator ditutup dengan aluminium foil dan dibiarkan selama 24 jam.
Setelah 24 jam, perkolator dibuka kembali dan cairan dibiarkan menetes dengan kecepatan 1 ml per menit atau 20 tetes per menit. Tambahkan berulang-ulang etanol 70% secukupnya sehingga selalu terdapat selapis cairan penyair di atas simplisia dan diperoleh ekstrak cair.
Gambar 5. Umbi lobak dikeringkan di lemari pengering
Gambar 6. Umbi lobak yang telah kering diblender
4.5.3.2 Uji Aktivitas Bakteri dengan Metode Dilusi 4.5.3.2.1 Pembuatan Suspensi Bahan Uji
Ekstrak umbi lobak dalam pelarut etanol ditimbang menggunakan electronic balance dan massanya disesuaikan dengan konsentrasi yang diinginkan dengan cara dilarutkan dengan media Trypticase Soy Broth (TSB). TSB dibuat dengan 3 gram serbuk TSB dalam 100 ml akuades.TSB kemudian disterilkan dalam autoklaf selama 15 menit dengan tekanan 2 atm dan suhu 121°C. Ekstrak umbi lobak dalam pelarut etanol dimulai dari konsentrasi 100% karena belum diketahui konsentrasi ekstrak yang mampu menghambat pertumbuhan Fusobacterium nucleatum, jadi pengujian dimulai pada konsentrasi terbesar. Sediakan 6 tabung, pada tabung 100% berisi 8 ml
TSB, sedangkan masing-masing tabung lainnya berisi 4 ml TSB. Pada tabung pertama diberi 8 gr ekstrak kental umbi lobak kemudian dicampur dengan menggunakan vorteks sehingga didapatkan ekstrak etanol umbi lobak dengan konsentrasi 100%. Gambar 9. Proses perkolasi Gambar 10. Proses penguapan ekstrak
Kemudian dilakukan pengenceran berganda dengan cara mengambil setengah dari konsentrasi ekstrak etanol umbi lobak 100% menggunakan mikropipet dan diletakkan pada tabung kedua untuk mendapatkan ekstrak etanol umbi lobak 50% (pengenceran berganda). Cara yang sama dilakukan untuk mendapatkan konsentrasi 25% dan 12,5%. Masing-masing tersebut diberi label sesuai konsentrasinya.
4.5.3.2.2 Pembuatan Media Bakteri
Sebelum spesimen dibiakkan, terlebih dahulu dibuat media Trypticase Soy Agar (TSA). Sebanyak 10 gr serbuk TSAdan 15 gr serbuk TSB dilarutkan dalam 500 ml akuades kemudian dituangkan pada tabung reaksi (20 ml/petri), lalu dipanaskan di atas tungku pemanas magnetik sampai mendidih. Setelah masak, media disterilkan dalam autoklaf selama 15 menit dengan tekanan 2 atm dan suhu 121oC, lalu disimpan dalam lemari pendingin. Jika akan digunakan, media dipanaskan kembali hingga mendidih lalu dituang ke dalam petri. Kemudian media dimasukkan ke dalam inkubator selama 24 jam untuk melihat apakah ada kontaminasi bakteri atau tidak.
4.5.3.2.3 Pembiakan Spesimen
Fusobacterium nucleatumyang digunakan adalah spesimen stem sel
Fusobacterium nucleatum ATCC 25586 yang dibiakkan secara murni pada media
TSA dalam suasana anaerob pada inkubator CO2 hingga didapatkan pertumbuhan
yang sehat, yang berarti bahwa bakteri tumbuh subur. Ambil sebanyak 1-2 ose dari biakan murni bakteri lalu disuspensikan dalam larutan 0,9% NaCl hingga diperoleh kekeruhan sesuai 0,5 Mc Farland Standard atau setara dengan jumlah 1 x 108CFU/ml (CFU: Colony Forming Unit).
4.5.3.2.4 Penentuan KHM Bahan Coba
tersebut kemudian divorteks, lalu diinkubasi pada suhu 37oC selama 24 jam pada inkubator CO2. Amati kekeruhan yang terjadi secara visual, lalu bandingkan
tabung-tabung tersebut dengan kontrol untuk menentukan nilai KHM, yaitu konsentrasi minimal bahan coba yang mampu menghambat pertumbuhan Fusobacterium nucleatum dalam media pembenihan setelah diinkubasi 24 jam.
4.5.3.2.5 Penentuan KBM Bahan Coba
Hasil pengujian penentuan nilai KHM dilanjutkan dengan perhitungan jumlah koloni bakteri dengan menggunakan metode Pour Plate. Dengan metode ini dapat dihitung jumlah bakteri hidup yang telah disuspensikan dalam bahan coba. Setelah diinkubasi pada prosedur penentuan KHM, bahan coba dari konsentrasi seperti di atas divorteks dan diambil 100 µl untuk setiap konsentrasi lalu diteteskan ke dalam petri yang kemudian diisi dengan media padat Trypticase Soy Agarsambil diaduk supaya suspensi bakteri tercampur merata dan koloni bakteri akan lebih mudah dihitung. Petri direplikasikan sebanyak 4 kali replikasi, diamkan selama 15-20 menit sampai mengering kemudian diinkubasi dalam inkubator CO2 dengan suhu 37oC selama 24
jam. Kemudian, dilakukan perhitungan jumlah koloni bakteri untuk mendapatkan nilai KBM dengan bantuan mikroskop. Jumlah koloni bakteri dihitung dengan prinsip satu sel bakteri hidup bila dibiakkan pada media padat akan tumbuh menjadi satu koloni bakteri. Apabila bentuk koloni melebar dianggap berasal dari satu koloni, bila bentuknya dua koloni bersinggungan dianggap sebagai dua koloni. Koloni
Fusobacterium nucleatum pada media padat berbentuk bulat dan berwarna putih keruh.
Contoh cara perhitungan koloni pada metode Pour Plate adalah
a. Pada media padat ditetesi sebanyak 100 µl suspensi bahan coba dengan mikropipet.
b. Kemudian dihitung jumlah koloni yang ada dengan menggunakan mikroskop dan didapatkanlah sebanyak 5 koloni.
c. Jadi jumlah bakteri pada bahan coba tersebut adalah 5 x 1 (faktor pengenceran) x 10 (faktor pengali) = 50 CFU/ml.
4.6 Pengolahan dan Analisis Data
Oleh karena data tidak terdistribusi normal, maka data dari setiap pemeriksaan dianalisis dengan memakai uji statistik yaitu:
1. Uji statistik Kruskal-Wallis dengan p-value = 0,05 , untuk melihat efek antimikroba ekstrak umbi lobak (Raphanus sativus) terhadap pertumbuhan
Fusobacterium nucleatum.
BAB 5
HASIL PENELITIAN
5.1 Ekstraksi Umbi Lobak (Raphanus sativus L.)
Umbi lobak yang akan digunakan diteliti terlebih dahulu di Lembaga Ilmu Pengetahuan Indonesia (LIPI) yang menyatakan jenis Raphanus sativus L. dengan suku Brassicaceae.Pembuatan ekstrak etanol umbi lobak (Raphanus sativus L.) diperoleh dari 5 kg umbi lobak yang kemudian dikeringkan dan dihaluskan menjadi bentuk simplisia sebanyak 300 gram. Simplisia tersebut kemudian diperkolasi dengan menggunakan pelarut etanol 70% sebanyak 5 liter. Didapatkan maserat cair sebanyak 3 liter dari proses tersebut. Kemudian maserat cair diuapkan dalam vacuum rotary evaporator sehingga dihasilkan esktrak kental umbi lobak (Gambar 11) sebanyak 250 gram. Ekstrak kental disimpan dalam botol plastik tertutup dan diletakkan dalam lemari pendingin.
5.2 Uji Efektivitas Antibakteri
Pengujian efektivitas antibakteri bahan coba dilakukan dengan penentuan KHM yang dilanjutkan dengan penentuan KBM. Pada penentuan KHM yang dilihat adalah tabung tiap konsentrasi bahan coba (100%, 50%, 25%, 12,5%, 6,125%, 3,125%, dan seterusnya) pada tabung perlakuan yang mulai tampak jernih bila dibandingkan dengan kontrol Mc Farland. Penentuan konsentrasi berdasarkan standar RSKI UNAIR dengan metode dilusi. Pada hasil pengamatan diperoleh nilai KHM pada konsentrasi 12,5% (Gambar 12), karena pada konsentrasi dibawah 12,5% mulai tampak adanya kekeruhan jika dibandingkan dengan kontrolpositif (Mc. Farland)setelah diinkubasi 24 jam(Gambar 13 dan 14). Selanjutnya dilakukan penghitungan jumlah koloni bakteri menggunakan metode Pour Plate yang bertujuan untuk membuktikan bahwa tingkat kekeruhan pada setiap konsentrasi menunjukkan kemampuan bahan coba membunuh bakteri sebesar 99,9%-100%, yang disebut KBM. Pada penelitian ini, diperoleh bahwa ekstrak umbi lobak (Raphanus sativus L.) memiliki efek antibakteri terhadap Fusobacterium nucleatum dengan nilai KBM adalah 25%.(Tabel2)
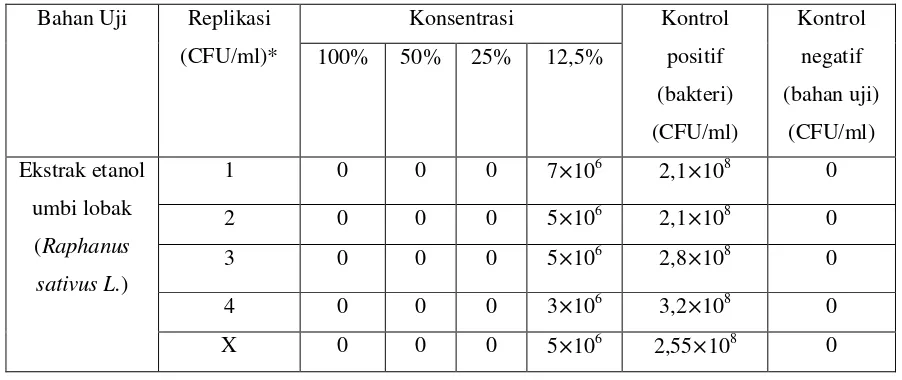
Tabel 2. Hasil uji efek antibakteri ekstrak etanol umbi lobak (Raphanus sativus L.) terhadap Fusobacterium nucleatum pada konsentrasi 100%, 50%, 25%, 12,5%.
Bahan Uji Replikasi (CFU/ml)*
Tabel 2, menunjukkan hasil pengujian efek antibakteri (penghitungan jumlah koloni yang terbentuk) terhadap Fusobacterium nucleatum pada bahan coba dengan konsentrasi 100%, 50%, 25%, 12,5%. Pada media yang diberi ekstrak etanol umbi lobak (Raphanus sativus L.) dengan konsentrasi 100%, 50%, 25%, kontrol negatif menunjukkan hasil 0 CFU/ml atau steril dan menunjukkan hasil yang sama disetiap replikasi yang berarti bahwa setelah penanaman pada media TSA dan diinkubasi selama 24 jam dalam suhu 37°C tidak dijumpai pertumbuhan bakteri Fusobacterium nucleatum atau semua bakteri mati (Gambar 15, 17, 18 dan 19). Sedangkan pada media kontrol positif dijumpai pertumbuhan bakteri dengan jumlah rata – rata dari semua replikasi adalah 2,55×108 CFU/ml dan media yang diberi ekstrak etanol umbi lobak (Raphanus sativus L.) dengan konsentrasi 12,5% dijumpai adanya pertumbuhan bakteri dengan jumlah rata – ratadari semua replikasi adalah 5×106CFU/ml.(Gambar 16 dan 20)
Gambar 12. Hasil uji KHM pada konsentrasi 100%, 50%, 25%, 12,5%, 6,25%, 3,125%, 1,56%, 0,78%, 0,39%, dan kontrol positif setelah dinkubasi 24 jam pada suhu 37°C
Gambar 14. Hasil uji KHM yang menunjukkan adanya kekeruhan pada konsentrasi (a) 6,25%, (b) 3,125%, (c) 1,56%, (d) 0,78%, (e) 0,39% yang dibandingkan dengan (f) kontrol positif
a b c d e f
Gambar 13. Hasil uji KHM yang
menunjukkan
tidak adanya kekeruhan pada konsentrasi (a)12,5% sebelum 24 jam, (b)12,5% setelah 24 jam
a b
c d
a b
c d
Gambar 17. Hasil uji bahan coba konsentrasi 100% (a) replikasi I, (b) replikasi II, (c) replikasi III, (d) replikasi IV yang menunjukkan hasil tidak adanya pertumbuhan bakteri (steril)
a b
Gambar 18. Hasil uji bahan coba konsentrasi 50% (a) replikasi I, (b) replikasi II, (c) replikasi III, (d) replikasi IV yang menunjukkan hasil tidak adanya pertumbuhan bakteri (steril)
a b
Gambar 19. Hasil uji bahan coba konsentrasi 25% a) replikasi I, (b) replikasi II, (c) replikasi III, (d) replikasi IV yang menunjukkan hasil tidak adanya pertumbuhan bakteri (steril)
a b
Data hasil penelitian ini tidak dapat dilakukan uji statistik ANOVA dan LSD karena berdasarkan uji normalitas terdapat 4 kelompok data yang nilainya tidak normal yaitu konsentrasi 100%, 50%, 25%, dan kontrol negatif. Hal ini dikarenakan hasil yang diperoleh dari jumlah bakteri adalah 0 CFU/ml (steril). Sehingga pada penelitian ini digunakan uji non-parametrik yaitu Uji Kruskal-Wallis dan Uji Mann-Whitney.
Gambar 20. Hasil uji bahan coba konsentrasi 12,5% yang menunjukkan hasil adanya pertumbuhan bakteri pada (a) replikasi I sebesar 7×106 CFU/ml, (b) replikasi II sebesar 5×106 CFU/ml, (c) replikasi III sebesar 5×106 CFU/ml, (d) replikasi IV sebesar 3×106 CFU/ml
a b
Tabel 3. Hasil uji non-parametrik Kruskal-Wallis
No. Konsentrasi n Median ±Interquartile range p value
1. 100% 4 0 0,000
Tabel 4. Hasil uji non-parametrik Mann-Whitney
No. Konsentrasi Konsentrasi p value
1. 100% 50% 1,000
BAB 6
PEMBAHASAN
Penelitian eksperimental laboratorium ini dimulai dengan melakukan identifikasi terhadap umbi lobak yang akan digunakan di Lembaga Ilmu Pengetahuan Indonesia (LIPI). Dari hasil identifikasi diperoleh bahwa umbi lobak merupakan salah satu jenis Raphanus sativus L. dengan suku Brassicaceae,setelah mendapatkan hasil identifikasi maka dilanjutkan dengan pembuatan ekstrak umbi lobak dengan menggunakan 300 gram simplisia umbi lobak yang dilarutkan dengan pelarut etanol 70% hingga diperoleh ekstrak kental 250 gram, yang diperkirakan cukup sebagai bahan coba dalam pengujian aktivitas antibakteri terhadap Fusobacterium nucleatum.
Ekstraksi umbi lobak (Raphanus sativus L.) dilakukan dengan menggunakan pelarut etanol 70%. Penggunaan etanol dapat melarutkan seluruh bahan aktif yang terkandung dalam suatu bahan alami yang bersifat polar, semipolar maupun non polar. Selain itu, pelarut etanol diketahui lebih aman (tidak bersifat toksik) dibandingkan dengan metanol.69
Umbi lobak (Raphanus sativus L.) yang dipakai adalah umbi lobak yang masih segar, bertujuan untuk menghindari rusaknya kandungan zat akibat proses enzimatis. Umbi lobak yang diperlukan sebanyak 5 kg dan diperoleh simplisia 300 gram yang disesuaikan dengan kebutuhan bahan uji ekstrak dan dilarutkan dengan etanol 70%. Umbi lobak (Raphanus sativus L.) bersifat tidak toksik dan biokompatibel karena dapat dikonsumsi, serta memiliki sifat antibakteri, antiinfeksi, antitumor. Berdasarkan hal tersebut maka peneliti memutuskan untuk menggunakan bagian umbi untuk diujicoba.32
dengan membran sel untuk menimbulkan perubahan morfologi sel yang mengakibatkan sel lisis.Sifat antimikroba coumarin dengan mengubah konformasi dari asam nukleat dan menghambat replikasi DNA dari bakteri, yang menyebabkan modifikasi dalam pertumbuhan sel bakteri dan inhibitor enzim. Kemampuan flavonoid disebabkan oleh kemampuannya untuk bergabung dengan bagian ekstraseluler, protein yang larut, dinding sel bakteri, serta merusak membran sel bakteri.Mekanisme kerja antibakteri dari alkaloid adalah kemampuan alkaloid untuk berikatan dengan DNA sel, penghambatan enzim (esterase, RNA polimerase, DNA polimerase), penghambatan respirasi sel sehingga menggangu fungsi sel.Quinonejuga memiliki potensi yang tinggi pada efek antimikroba, dengan target yang terdapat pada sel mikroba yaitu adhesin yang terdapat pada permukaan, polipeptida dinding sel, dan enzim yang berikatan dengan membran. Dengan mekanisme diatas diduga ekstrak umbi lobak(Raphanus sativus L.) mampu membuat sel bakteri lisis dan mati.56-68
Pada penelitian ini pengujian aktivitas antibakteri ekstrak umbi lobak (Raphanus sativus L.) terhadap Fusobacterium nucleatum dilakukan dengan cara metode dilusi. Dengan metode dilusi bahan coba dapat berkontak langsung dengan mikroorganisme, sertadapat diketahui nilai KHM dan KBM dari bahan coba. Metode dilusi dilakukan dengan cara pengenceran berganda dari konsentrasi awal, sehingga konsentrasi yang didapatkan adalah setengah dari konsentrasi awal. Dalam penelitian ini konsentrasi yang dipakai adalah dimulai dari 100%, kemudian dilakukan pengenceran hingga di dapatkan konsentrasi minimal yang dapat menghambat dan membunuh bakteri.70Pada metode dilusi ini menggunakan media TSB dan TSA karena media tersebut memiliki kandungan yang sesuai untuk pertumbuhan
Fusobacterium nucleatum yaitutrypticase, peptone, dan ekstrak ragi.14Penghitungan jumlah koloni bakteri dilakukan dengan metode Pour Plate karena metode ini lebih memudahkan dalam menghitung jumlah koloni yang terbentuk.Penentuan konsentrasi disesuaikan berdasarkan standard konsentrasi pengujian antibakteri yang ada di Laboratorium Rumah Sakit Khusus Infeksi, UNAIR.
coba yang diuji, diperoleh konsentrasi dibawah 12,5% mulai tampak kekeruhan yang setara jika dibandingkan dengan kontrol positif setelah diinkubasi 24 jam. Setiap konsentrasi tersebut dimulai dari 100% hingga 12,5% dilakukan penanaman pada TSA yang kemudian direplikasi sebanyak 4 sampel. Ekstrak etanol umbi lobak (Raphanus sativus L.) dari konsentrasi 100% hingga 25% tidak ditemui pertumbuhan bakteri (media steril) dengan jumlah koloni 0 CFU/ml(steril), sedangkan pada konsentrasi 12,5% terbentuk koloni dengan rata – rata 5×106CFU/ml. Berdasarkan hasil penelitian, maka hipotesis penelitian ini diterima yaitu ada efek antibakteri ekstrak etanol umbi lobak (Raphanus sativus L.) terhadap Fusobacterium nucleatum
ATCC 25586 dengan nilai KHM 12,5% dan nilai KBM 25%, dengan pengujian statistik yang menunjukkan hasil yang signifikan.
Di Indonesia telah banyak perkembangan tentang penelitian mengenai bahan alami sebagai obat herbal dan juga sebagai bahan alternatif medikamen saluran akar. Penelitian yang dilakukan oleh Amalia (2013) menunjukkan bahwa ekstrak etanol siwak (Salvadora persica L.) terhadap bakteri Fusobacterium nucleatum diperoleh nilai KBM 100% dan penelitian dari Vika (2014) mengenai ekstrak etanol daun Afrika (Vernonia amygdalina) yang dapat membunuh bakteri Fusobacterium nucleatum dengan nilai KBM 12,5%. Perbedaan efek antibakteri dari berbagai bahan alami dapat disebabkan oleh perbedaan kadar dan jenis kandungan zat aktif antibakteri dari masing – masing ekstrak bahan coba.28,29
Beberapa penelitian ekstrak umbi lobak (Raphanus sativus L.) juga telah dilakukan dengan pengujian pada bakteri lain. Penelitian dari Janjua et al. (2013) menunjukkan hasil KHM dari ekstrak etanol dari Raphanus sativusdengan konsentrasi 50 mg/ml dapat menghambat pertumbuhan bakteri S. aureus (20 ± 0,6 mm), B. subtilis (21 ± 1,0 mm), M. luteus (22 ± 1,5 mm), E. aerogenes (19 ± 1,0 mm), S. typhi (3 ± 1,3 mm), E. coli (21 ± 1,1 mm), K. pneumoniae (17 ± 2,4 mm),