KAJIAN
INDONE
N TERHADA
ESIA SEBAG
FAK
AP JAMUR
GAI SUMB
R
KULTAS T
INSTITUT
R PANGAN
BER POTEN
SKRIPSI
RICHIE RIC
F 24061494
TEKNOLOG
T PERTANI
BOGOR
2011
N PELAWAN
NSIAL PAN
I
CH
4
GI PERTAN
IAN BOGOR
N (
Boletus
s
NGAN FUN
NIAN
R
Study on Pelawan Mushroom (
Boletus
sp.) as a Potential Source of Indonesian
Functional Food
Richie Rich1, Sukarno1, Nampiah Sukarno2 1
Department of Food Science and Technology, Faculty of Agricultural Engineering and Technology, 2
Department of Biology, Faculty of Mathematics and Natural Sciences Bogor Agricultural University, IPB Darmaga Campus, PO Box 220, Bogor, West Java,
Indonesia.
ABSTRACT
Pelawan mushroom (Boletus sp.) is an edible ectomycorrhizal mushroom which associated with pelawan tree in Bangka Belitung Province. Boletus sp. is consumed by local people and exported to Malaysia and Singapore. This study aimed to provide nutritional value and bioactive compound of the mushroom in order to support a promotion and development of functional food products derived from Indonesian national resources. The mushroom analysis included the determination of moisture, protein, fat, ash, carbohydrate, amino acid and fatty acid compositions, vitamin and mineral (K, P, Ca, Na, Fe, and Zn) contents, dietary fiber, antioxidant components, and antioxidant capacity. The results revealed that Boletus sp. contained high protein (15.47%), high carbohydrate (75.81%), low fat (3.47%), and also good source of dietary fiber (11.71%). Total essential amino acid accounted for 29.86% of total amino acid, leucine was the highest amino acid and methionine was the lowest amino acid in the mushroom. Boletus sp. is a good source of mineral and has high amount of biotin and vitamin C. Data of fatty acid compotitions showed that saturated fatty acid has higher score than unsaturated fatty acid. Fatty acid compositions primarily are stearic acid, linoleic acid, palmitic acid, and oleic acid. Total phenolic content was the highest antioxidant component (4.77 mg GAE/g), followed by β-carotene (15.37 µg/g), and lycopene (6.34 µg/g). Based on IC50 value, Boletus sp. scavenged 50% DPPH radicals at 5.99 mg/ml. This
study indicated that pelawan mushroom is nutritious and can be used as a source of functional food.
Richie Rich. F24061494. Kajian terhadap Jamur Pangan Pelawan (
Boletus
sp.)
Khas Indonesia sebagai Sumber Potensial Pangan Fungsional. Di bawah
bimbingan Sukarno dan Nampiah Sukarno. 2011
RINGKASAN
Jamur pelawan (Boletus sp.) merupakan jamur pangan ektomikoriza indigenus Provinsi Kepulauan Bangka Belitung yang tumbuh bersimbiosis dengan pohon pelawan merah (Tristaniopsis sp.). Jamur pangan pelawan telah lama dikonsumsi oleh masyarakat lokal dan diharapkan dapat menjadi salah satu sektor unggulan perkebunan Provinsi Kepulauan Bangka Belitung, namun demikian penelitian mengenai budidaya jamur pangan pelawan belum dikembangkan. Hingga kini belum terdapat informasi ilmiah mengenai kandungan gizi dari jamur tersebut. Oleh karena itu, penelitian ini bertujuan untuk mendapatkan informasi kandungan zat gizi dan komponen bioaktif jamur pangan pelawan sehingga jamur tersebut dapat dilihat potensinya sebagai pangan fungsional.
Analisis yang dilakukan pada penelitian ini ialah analisis komposisi proksimat, profil asam amino, profil asam lemak, vitamin, mineral, kandungan serat pangan, komponen antioksidan, dan kapasitas antioksidan dari jamur pangan pelawan. Pengambilan sampel untuk analisis profil asam amino, profil asam lemak, analisis vitamin, dan analisis mineral dilakukan secara komposit. Sampel jamur pangan pelawan diperoleh dari Dinas Perkebunan dan Kehutanan Kabupaten Bangka Tengah, Provinsi Kepulauan Bangka Belitung. Analisis dilakukan di Laboratorium Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian IPB; Laboratorium Biorin, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB; Laboratorium Terpadu IPB; dan Laboratorium Balai Besar Pasca Panen Pertanian, Kementerian Pertanian Republik Indonesia.
Hasil analisis komposisi proksimat dari tubuh buah jamur pangan pelawan menunjukkan bahwa jamur mengandung 17.63% bb air, 15.47% bk protein, 3.47% bk lemak, 5.25% bk abu, dan 75.81% bk karbohidrat. Kandungan serat pangan tidak larut (IDF) dan serat pangan larut (SDF) jamur ialah 10.54% bk dan 1.17% bk. Profil asam lemak jamur terdiri atas total asam lemak jenuh dan total asam lemak tak jenuh yang secara berturut-turut ialah 1883.0 mg/100g dan 1605.3 mg/100g. Kandungan asam lemak jenuh tertinggi ialah stearat dan palmitat, sedangkan kandungan asam lemak tak jenuh tertinggi ialah linoleat dan oleat. Berdasarkan profil asam aminonya, jamur pangan pelawan mengandung 7 asam amino esensial, yaitu treonin (23.1 mg/100g bk), valin (66.8 mg/100g bk), metionin (20.6 mg/100g bk), isoleusin (23.1 mg/100g bk), leusin (103.2 mg/100g bk), fenilalanin (60.7 mg/100g bk), dan lisin (30.4 mg/100g bk). Kandungan biotin dan vitamin C dari jamur ialah 27.35 µg/100g, dan 12.46 mg/100g. Hasil analisis kandungan mineral menunjukkan bahwa untuk setiap 1 kg jamur pangan pelawan mengandung 31.60 g kalium (K), 5.80 g fosfor (P), 0.52 g natrium (Na), 14.88 mg kalsium (Ca), 62.52 mg zat besi (Fe), dan 67.86 mg seng (Zn). Hasil analisis komponen antioksidan menunjukkan bahwa jamur pangan pelawan mengandung komponen fenolik sebesar 4.77 mg GAE/g, sedangkan komponen pigmen dan antioksidan lain seperti β-karoten dan likopen ialah 15.37 µg/g dan 6.34 µg/g. Hasil analisis kapasitas antioksidan menunjukkan bahwa nilai IC50 dari jamur ini ialah 5.99 mg/ml dan kapasitas antioksidannya mencapai 3.48 ± 0.69 mg ekivalen vitamin C/g sampel.
KAJIAN TERHADAP JAMUR PANGAN PELAWAN (
Boletus
sp.) KHAS
INDONESIA SEBAGAI SUMBER POTENSIAL PANGAN FUNGSIONAL
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian,
Institut Pertanian Bogor
Oleh
Richie Rich
F 24061494
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Kajian terhadap Jamur Pangan Pelawan (
Boletus
sp.) Khas
Indonesia sebagai Sumber Potensial Pangan Fungsional
Nama
: Richie Rich
NIM
: F24061494
Menyetujui,
Pembimbing I
Pembimbing II
(Dr. Ir. Sukarno, M.Sc.)
(Dr. Ir. Nampiah Sukarno)
NIP 19601027 198703 1 003
NIP 19590504 198703 2 001
Mengetahui :
Plt. Ketua Departemen
(Dr. Ir. Nurheni Sri Palupi, M.Si.)
NIP 19610802 198703 2 002
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul Kajian terhadap Jamur Pangan Pelawan (Boletus sp.) Khas Indonesia sebagai Sumber Potensial Pangan Fungsional ialah hasil karya saya sendiri dengan arahan Dosen Pembimbing Akademik, dan belum diajukan dalam bentuk apapun pada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, 2 Mei 2011 Yang membuat pernyataan
BIODATA PENULIS
iii
KATA PENGANTAR
Puji syukur penulis haturkan ke hadirat Triratna yang telah melimpahkan bimbingan dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian pada Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Penyusunan skripsi yang berjudul Kajian terhadap Jamur Pangan Pelawan (Boletus sp.) Khas Indonesia sebagai Sumber Potensial Pangan Fungsional ini didasarkan pada penelitian yang dilaksanakan sejak bulan Mei 2010 sampai Februari 2011 di Laboratorium Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian IPB; Laboratorium Biorin, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB; Laboratorium Terpadu IPB; dan Laboratorium Balai Besar Pasca Panen Pertanian, Kementerian Pertanian Republik Indonesia. Penghargaan dan ucapan terima kasih yang sebesar-besarnya penulis sampaikan kepada :
1. Keluarga tercinta, papa, mama, Fanny dan Temmy yang tak pernah lelah memberikan kasih sayang, doa, nasihat dan dukungan baik moril maupun materi kepada penulis.
2. Bapak Dr. Ir. Sukarno, M.Sc. selaku dosen pembimbing utama, yang selalu menyediakan waktu di tengah-tengah kesibukannya memberikan saran, arahan dan bimbingan kepada penulis. 3. Ibu Dr. Ir. Nampiah Sukarno selaku dosen pembimbing kedua, yang selalu dengan senang hati
mendengar masalah yang dihadapi penulis dan memberi masukan yang sangat berarti.
4. Bapak Ir. Sutrisno Koswara, M.Si. atas kesediaannya menjadi dosen penguji dan masukan yang sangat bermanfaat bagi penulis.
5. Seluruh staf pengajar departemen ITP. Terima kasih atas bimbingan dan ilmu-ilmu yang telah diberikan kepada penulis.
6. Pak Rojak, Pak Wachid, Bu Rubiyah dan laboran lainnya yang telah membantu pelaksanaan penelitian.
7. Mba Pepi, Pak Ulung, Bu Dini, dan teman lainnya di Biorin yang telah membantu pelaksanaan penelitian.
8. Sahabat terbaikku, Syenny, Daisy dan Ko Leo yang selalu membantu, memberi masukan, menyemangati dan menghibur penulis.
9. Teman – teman KMB IPB (Feriana, Margaret, Fenny, Yurina, Wahyu, dan teman-teman KMB lainnya hingga angkatan 47) atas kebersamaan dan semangat yang selalu diberikan kepada penulis.
10. Teman – teman ITP 43 atas kebersamaannya selama kuliah dan penelitian berlangsung.
Akhirnya penulis berharap semoga tulisan ini bermanfaat bagi yang membaca umumnya dan bagi penulis sendiri khususnya serta memberikan kontribusi terhadap perkembangan ilmu pengetahuan di bidang ilmu dan teknologi pangan.
Bogor, Mei 2011
Daftar Isi
Halaman
KATA PENGANTAR ... iii
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
I.
PENDAHULUAN ... 1
1.1
LATAR BELAKANG ... 1
1.2
TUJUAN ... 1
1.3
MANFAAT ... 2
II.
TINJAUAN PUSTAKA ... 3
2.1
JAMUR PANGAN PELAWAN ... 3
2.2
KOMPONEN GIZI JAMUR ... 3
2.2.1
Protein ... 4
2.2.2
Asam Amino ... 4
2.2.3
Lipid ... 6
2.2.4
Asam Lemak ... 6
2.2.5
Karbohidrat dan Serat Pangan ... 7
2.2.6
Vitamin dan Mineral ... 8
2.2.7
Aktivitas Antioksidan ... 9
III.
METODOLOGI PENELITIAN ... 10
3.1
WAKTU DAN TEMPAT ... 10
3.2
BAHAN DAN ALAT ... 10
3.3
METODE PENELITIAN ... 10
3.3.1
Persiapan Sampel ... 10
3.3.2
Kadar Air (AOAC, 1995) ... 11
3.3.3
Kadar Protein (AOAC, 1995) ... 11
3.3.4
Kadar Lemak (AOAC, 1995) ... 11
3.3.5
Kadar Abu (AOAC, 1995) ... 12
3.3.7
Analisis Komposisi Asam Amino Metode
High Performance Liquid
Chromatography
(AOAC, 1995) ... 12
3.3.8
Analisis Komposisi Asam Lemak Metode
Gas Liquid Chromatograpy
(AOAC 991.39) ... 13
3.3.9
Kadar Vitamin ... 14
3.3.10
Kadar Mineral ... 15
3.3.11
Kadar Serat Pangan (Asp
et al.,
1983) ... 15
3.3.12
Analisis Total Fenolik ... 16
3.3.13
Analisis Total Antosianin (Giusti dan Worlstad, 2001) ... 16
3.3.14
Penentuan Total
β
-karoten dan Likopen (Barros
et al
., 2007 yang
dimodifikasi) ... 17
3.3.15
Analisis Kapasitas Antioksidan ... 17
IV.
HASIL DAN PEMBAHASAN ... 18
4.1
KOMPOSISI PROKSIMAT ... 18
4.2
ASAM AMINO ... 19
4.3
ASAM LEMAK ... 21
4.4
VITAMIN ... 23
4.5
MINERAL ... 24
4.6
SERAT PANGAN ... 25
4.7
KOMPONEN DAN KAPASITAS ANTIOKSIDAN ... 25
4.7.1
Komponen Antioksidan ... 25
4.7.2
Kapasitas Antioksidan ... 26
V.
SIMPULAN DAN SARAN ... 29
5.1
SIMPULAN ... 29
5.2
SARAN ... 29
DAFTAR PUSTAKA ... 30
vi
DAFTAR TABEL
Tabel 1. Komposisi proksimat dan serat pangan pada beberapa jamur pangan... 18
Tabel 2. Komposisi asam amino pada beberapa jamur pangan ... 20
Tabel 3. Komposisi jenis asam amino esensial jamur alam dari genus Boletus ... 21
Tabel 4. Komposisi asam lemak jamur pangan pelawan (Boletus sp.) ... 22
Tabel 5. Komposisi vitamin jamur pangan pelawan (Boletus sp.) ... 23
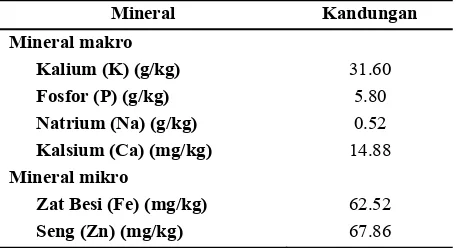
Tabel 6. Komposisi mineral jamur pangan pelawan (Boletus sp.) ... 24
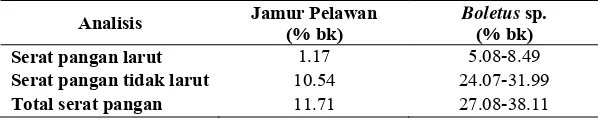
Tabel 7. Komposisi serat pangan beberapa jamur pangan ... 25
vii
DAFTAR GAMBAR
Gambar 1a. Jamur pangan pelawan segar ... 3
Gambar 1b. Jamur pangan pelawan kering ... 3
Gambar 2. Struktur umum asam amino ... 5
viii
DAFTAR LAMPIRAN
Lampiran 1. Kromatogram sampel analisis komposisi asam lemak ... 34
Lampiran 2. Kromatogram standar analisis komposisi asam lemak ... 34
Lampiran 3. Kromatogram sampel analisis komposisi asam amino ... 34
1
I.
PENDAHULUAN
1.1
LATAR BELAKANG
Banyak tubuh buah jamur atau mushroom merupakan produk pangan yang telah dikonsumsi sejak dahulu. Jamur pangan diketahui memiliki kandungan gizi yang baik serta seringkali mampu bertindak sebagai obat beberapa penyakit. Indonesia merupakan salah satu negara penghasil jamur karena memiliki kondisi lingkungan yang mendukung pertumbuhan berbagai jenis jamur. Jamur yang selama ini telah dikenal dan dikonsumsi seperti jamur merang (Volvariella volvacea), jamur tiram (Pleurotus ostreatus), jamur kuping (Auricularia auricula), dan lainnya telah banyak dibudidayakan di Indonesia.
Tubuh buah jamur merupakan organ dari fungi yang berdaging dan menyimpan spora (Chang dan Miles, 2004). Jamur merupakan makrofungus dengan tubuh buah yang menonjol secara epigeous atau hypogeous, dan berukuran cukup besar untuk dilihat dengan mata telanjang. Berdasarkan definisi tersebut, diperkirakan terdapat 14000 spesies fungi (Chang dan Miles, 2004). Berdasarkan pemanfaatannya oleh manusia, jamur dapat dikelompokkan ke dalam empat kategori, yaitu (1) jamur pangan (edible mushroom), yaitu jamur yang dapat dimakan; (2) jamur obat, yaitu jamur yang memiliki khasiat obat dan digunakan untuk pengobatan; (3) jamur beracun; dan (4) jamur yang tidak termasuk ke dalam tiga kategori sebelumnya. Jamur yang termasuk dalam kategori keempat biasanya memiliki spesies yang beragam (Chang et al., 1993).
Jamur pelawan (Boletus sp.) merupakan jamur yang tumbuh bersimbiosis membentuk ektomikoriza dengan pohon pelawan merah (Tristaniopsis sp.). Jamur ini merupakan jamur pangan yang tumbuh di Provinsi Kepulauan Bangka Belitung. Jamur pangan pelawan telah lama dikonsumsi oleh masyarakat lokal dan telah diekspor ke negara tetangga, seperti Malaysia dan Singapura. Budidaya jamur ektomikoriza berbeda dengan budidaya jamur kayu, seperti jamur tiram dan jamur kuping karena pertumbuhan jamur ektomikoriza bergantung pada tumbuhan inang. Sejak tahun 2009, penelitian mengenai budidaya jamur pangan pelawan mulai dikembangkan dengan tujuan menjadikan jamur tersebut sebagai salah satu unggulan sektor perkebunan Provinsi Kepulauan Bangka Belitung. Namun demikian, belum terdapat informasi ilmiah mengenai kandungan gizi maupun komponen bioaktif dari jamur tersebut. Oleh karena itu, penelitian mengenai hal tersebut sangat penting dilakukan untuk mempromosikan jamur tersebut baik di dalam maupun di luar negeri, dan sebagai dasar untuk pengembangan produk berbasis jamur pangan pelawan maupun penelitian lain yang terkait.
1.2
TUJUAN
Penelitian ini bertujuan untuk mempelajari kandungan gizi dan senyawa bioaktif jamur pangan pelawan yang meliputi :
1. komposisi zati gizi proksimat, vitamin, dan mineral, 2. komposisi serat pangan,
3. profil asam amino dan asam lemak,
2
1.3
MANFAAT
3
II.
TINJAUAN PUSTAKA
2.1
JAMUR PANGAN PELAWAN
Jamur pelawan merupakan jamur ektomikoriza yang bersimbiosis dengan pohon pelawan merah (Tristaniopsis sp.) (Gambar 1). Jamur ini digolongkan sebagai jamur ektomikoriza karena memerlukan pohon pelawan merah (Tristaniopsis sp.) sebagai inang untuk pertumbuhannya (Alexander dan Hogberg, 1980; Yamada et al., 2001; Yamada et al., 2007; Hidayanti, 2010). Pohon pelawan tumbuh di wilayah Malaysia, Nepal, dan Indonesia. Salah satu daerah penyebaran pohon pelawan di Indonesia ialah di Provinsi Kepulauan Bangka Belitung. Jamur pelawan merupakan jamur yang dapat dimakan serta dikenal sebagai makanan eksklusif karena memiliki nilai ekonomi yang tinggi. Harga jamur tersebut ketika panen raya dapat mencapai Rp. 400.000,-/kg dan pada bukan musim panen dapat mencapai Rp. 900.000,-/kg.
(a) Jamur pangan pelawan segar (b) Jamur pangan pelawan kering
Gambar 1. Jamur pangan pelawan
Jamur pangan pelawan termasuk dalam dunia Fungi, filum Basidiomycota, kelas Basidiomycetes, ordo Agaricales, famili Boletaceae, dan genus Boletus. Jamur pangan pelawan memiliki tubuh buah seperti payung (Gambar 1a). Dua bagian utama dari jamur pangan pelawan ialah bagian tudung dan bagian tangkai. Tudung jamur segar berwarna merah pada bagian atas dan berwarna kuning serta berpori pada bagian bawahnya. Bagian tangkainya berwarna merah dengan permukaan yang diselimuti oleh struktur jala. Jamur pangan pelawan mudah rusak pada kondisi segar, sehingga jamur dikeringkan untuk memperpanjang masa simpannya (Gambar 1b).
2.2
KOMPONEN GIZI JAMUR
Jamur sebagai pangan umumnya memiliki kandungan gizi yang baik, dan terkadang memiliki fungsi kesehatan sebagai suplemen makanan (Chang dan Miles, 2004). Oleh karena itu, jamur dapat dikategorikan sebagai pangan fungsional. Hal ini didukung penelitian yang menunjukkan kemampuan jamur dalam mencegah suatu penyakit.
4
Analisis yang dilakukan untuk menentukan kandungan zat gizi maupun bioaktivitasnya ialah analisis komposisi proksimat, profil asam amino, profil asam lemak, kandungan vitamin, kandungan mineral, kandungan serat pangan, komponen bioaktif, dan kapasitas antioksidan.2.2.1
Protein
Protein merupakan salah satu makronutrien. Protein tersusun atas asam amino yang berikatan satu sama lain melalui ikatan peptida dengan berbagai variasi dan membentuk suatu rantai panjang yang disebut polipeptida (Gaman dan Sherington, 1992). Protein berperan penting dalam penyusunan senyawa biomolekul yang dibutuhkan dalam proses biokimia tubuh (Sudarmadji et al., 2007).
Salah satu metode analisis untuk menentukan kandungan protein ialah metode Kjeldahl. Metode ini memerlukan faktor konversi yang spesifik untuk bahan tertentu. Faktor konversi yang digunakan untuk bahan jamur ialah 4.38 (Chang dan Miles, 2004; Barros et al, 2008).
Jamur merupakan pangan sumber protein yang baik. Kandungan protein jamur pangan yang dipanen dari alam lebih tinggi dibandingkan dengan jamur yang dibudidaya untuk kepentingan komersil (Barros et al., 2008). Jamur pangan ektomikoriza dari genus Boletus, Astreus, Craterellus, Heimiella, Lactarius, Phaegyroporus, dan Russula mengandung protein sebesar 14-25% bk (Sanmee et al., 2003; Manzi et al., 2004; Barros et al., 2008), dan kandungan protein pada jamur pangan non-ektomikoriza hasil budidaya seperti, Pleurotus ostreatus dan Lentinula edodes ialah 11 dan 12% bk (Reguła et al., 2007).
Protein dapat digolongkan berdasarkan kelarutannya dalam berbagai pelarut (De Man, 1997). Golongan protein ialah :
1. albumin, yaitu protein yang larut dalam air netral yang tidak mengandung garam dan terkoagulasi oleh panas,
2. globulin, yaitu protein yang larut dalam larutan garam netral dan sedikit larut dalam air seperti glisin pada kedelai, serta terkoagulasi oleh panas,
3. glutelin, yaitu protein yang larut dalam asam/basa yang sangat encer dan tidak larut dalam pelarut netral,
4. prolamin, yaitu protein yang larut dalam alkohol 50-90% dan tidak larut dalam air,
5. skleroprotein, yaitu protein yang tidak larut dalam air dan pelarut netral bahkan tahan terhadap hidrolisis memakai enzim,
6. histon, yaitu protein yang larut dalam air dan dapat diendapkan oleh ammonia, serta bersifat basa karena mengandung lisin dan arginin yang tinggi, dan
7. protamin, protein yang bersifat basa kuat dan berbobot molekul rendah.
Berdasarkan hasil penelitian Bauer-Petrovska (2001) mengenai fraksi protein pada 24 spesies jamur, diketahui komposisi albumin, globulin, glutelin-like material, glutelin, prolamin, dan prolamin-like material secara berurutan ialah 24.8, 11.5, 7.4, 11.5, 5.7, dan 5.3%.
2.2.2
Asam Amino
5
(-NH2), gugus karboksil (-COOH), sebuah atom hidrogen, dan gugus rantai cabang (-R) yang terikat pada sebuah atom C yang dikenal sebagai karbon α.Sumber : Belitz dan Grosch (1999)
Gambar 2. Struktur umum asam amino
Terdapat 20 jenis asam amino yang secara alamiah menyusun protein dengan ukuran, bentuk, muatan listrik, kapasitas ikatan hidrogen, dan reaktivitas kimia yang berbeda. Asam-asam amino dengan R polar tidak bermuatan yaitu asparagin, sistein, glutamine, glisin, serin, treonin, dan tirosin; sedangkan asam amino dengan R nonpolar tidak bermuatan yaitu alanin, isoleusin, leusin, metionin, fenilalanin, prolin, triptofan, dan valin. Asam aspartat dan asam glutamat memiliki muatan negatif, sedangkan arginin, histidin, dan lisin memiliki muatan positif (Lehninger, 1982). Menurut Boyer (2002), rantai samping asam amino dapat bersifat polar atau nonpolar sehingga dapat diklasifikasikan berdasarkan reaktivitas rantai samping dan polaritasnya pada pH 7.
Berdasarkan proses pembentukannya asam amino terbagi menjadi 2 golongan, yaitu asam amino esensial dan asam amino non-esensial. Asam amino esensial merupakan asam amino yang tidak dapat disintesis oleh tubuh dan harus diperoleh dari bahan pangan sumber protein. Jumlah asam amino esensial dalam suatu bahan pangan menentukan kualitas dari protein. Terdapat 8 jenis asam amino esensial, yaitu triptofan, lisin, fenilalanin, leusin, isoleusin, metionin, treonin, dan valin (De Man, 1997). Asam amino non-esensial merupakan asam amino yang dapat disintesis dalam tubuh (Winarno, 1997). Walaupun demikian asam amino non-esensial juga memiliki fungsi yang dibutuhkan oleh tubuh. Asam amino yang tergolong dalam asam amino non-esensial ialah arginin, histidin, asam aspartat, asam glutamat, serin, glisin, alanin, prolin, tirosin, glutamin, asparagin, dan sistein.
Profil asam amino suatu bahan pangan dapat diketahui dengan menggunakan metode kromatografi cair. Pada kromatografi cair, fase stasioner dan fase gerak yang digunakan berupa cairan, maka pelarut yang digunakan tidak boleh bercampur. Asam amino kemudian dipisahkan sesuai dengan tingkat polaritas dan interaksinya dengan fase diam. Perbedaan kelarutan asam-asam amino serta interaksinya dengan fase diam akan menyebabkan masing-masing komponen asam amino yang berada di dalam kolom keluar dengan waktu retensi yang berbeda.
6
kemoterapi, serta membantu dalam terapi untuk penderita parkinson (Kulkarni et al., 2005). Kombinasi asam glutamat, alanin, dan glisin efektif dalam pengobatan pembesaran prostat jinak (Miller, 1996).2.2.3
Lipid
Lipid merupakan penyusun jaringan makhluk hidup dan tergolong senyawa organik yang sangat heterogen (Tarigan, 1983). Lipid merupakan komponen mayor dalam pangan dan merupakan golongan senyawa organik kedua yang menjadi sumber makanan (40% dari makanan yang dimakan sehari-hari). Salah satu sifat umum lipid ialah larut dalam pelarut organik, seperti heksana, dietil eter, benzena, dan kloroform (Akoh et al., 2002). Lipid merupakan campuran dari gliserida dengan susunan asam lemak yang berbeda. Hidrolisis lipid menghasilkan asam lemak atau dapat membentuk ester dengan asam lemak yang berperan pada metabolisme makhluk hidup (Tarigan, 1983).
Lipid dapat dikelompokkan berdasarkan pada properti fisik (minyak jika berwujud cair dan lemak jika berwujud padat pada suhu kamar), polaritas (lipid polar dan netral), sifat esensial terhadap manusia (asam lemak esensial dan non-esensial), dan strukturnya (lipid sederhana dan kompleks) (Akoh et al.,2002).
Jamur merupakan bahan pangan dengan kandungan lemak yang rendah (Yilmaz et al., 2006). Kandungan lemak jamur pangan ektomikoriza dari genus Boletus, Astreus, Craterellus, Heimiella, Lactarius, Phaegyroporus, dan Russula yang dipanen dari alam berkisar antara 2.7 – 9.5% bk (Sanmee et al., 2003; Manzi et al., 2004; Barros et al., 2008), dan pada jamur non-ektomikoriza hasil budidaya, seperti Lentinula edodes dan Pleurotus ostreatus ialah 2.89 dan 2.66% bk (Regula et al., 2007).
2.2.4
Asam Lemak
7
Komposisi asam lemak dapat dianalisis menggunakan metode kromatografi gas. Prinsip analisis komposisi asam lemak dengan metode gas liquid chromatography (GLC) ialah dengan mengubah komponen asam lemak menjadi senyawa volatil metil ester asam lemak (Fatty Acid Methyl Esther atau FAME). Metil ester asam lemak tersebut akan dibawa oleh gas untuk melewati fase diam berupa cairan di dalam kolom dan dipisahkan menurut tingkat volatilitas dan interaksinya dengan fase diam. Perbedaan volatilitas asam lemak dan interaksinya dengan fase diam menyebabkan masing-masing komponen asam lemak yang berada di dalam kolom keluar dengan waktu retensi yang berbeda. Komponen yang keluar kemudian dideteksi dengan flame ionization detector (FID), yang memberikan respon berupa puncak kromatogram. Jenis dan jumlah asam lemak pada contoh dapat diidentifikasi dengan membandingkan puncak kromatogram contoh dengan standar yang telah diketahui jenis dan konsentrasinya.Penelitian yang telah dilakukan oleh Diéz and Alvarez (2001), Yilmaz et al. (2006), dan Barros et al., (2008) menunjukkan bahwa jamur pangan memiliki jumlah asam lemak tak jenuh yang lebih tinggi dibandingkan dengan jumlah asam lemak jenuh. Secara umum, jamur pangan memiliki kandungan polyunsaturated fatty acid (PUFA) lebih tinggi dibandingkan dengan kandungan monounsaturated fatty acid (MUFA) (Barros et al., 2008). Asam lemak oleat, linoleat, dan linolenat merupakan asam lemak rantai panjang yang memiliki peran penting terhadap kesehatan dan dikatakan sebagai asam lemak esensial (Yilmaz et al., 2006). Asam lemak linoleat dan oleat berperan dalam mencegah aterosklerosis melalui interaksinya dengan high density lipoprotein (HDL) dalam darah (Yilmaz et al., 2006). Berdasarkan komposisi asam lemaknya, jamur pangan merupakan sumber asam lemak tak jenuh yang baik.
2.2.5
Karbohidrat dan Serat Pangan
Karbohidrat merupakan sumber energi utama selain protein dan lemak. Berdasarkan jumlah molekul gula, karbohidrat dapat dibagi menjadi 4 kelompok, yaitu (1) monosakarida, suatu molekul yang terdiri atas 5 hingga 6 atom C, (2) disakarida yang terdiri atas 2 molekul monosakarida, (3) oligosakarida yang terdiri atas 3 hingga 10 molekul monosakarida, dan (4) polisakarida yang terdiri atas lebih dari 10 molekul monosakarida (Winarno, 1997; Food and Nutrition Board, 2005). Pengukuran kandungan karbohidrat pada bahan pangan dapat dilakukan dengan berbagai cara, salah satunya ialah melalui perhitungan by difference (AOAC, 1995).
Kandungan karbohidrat jamur pangan ektomikoriza yang berasal dari genus Boletus komersial dan dipanen dari alam berkisar antara 71.15-78.10% bk (Manzi et al., 2001; Alvarez-Parilla et al., 2007; Barros et al., 2008). Sementara jamur pangan non-ektomikoriza hasil budidaya yang juga banyak dikonsumsi seperti Pleurotus ostreatus dan Lentinula edodes mengandung 79.3 dan 71.19% bk karbohidrat (Regula et al., 2007). Sebagian besar karbohidrat yang terkandung dalam jamur pangan merupakan karbohidrat yang larut air dan dapat berfungsi sebagai antitumor atau antikanker (Chang dan Miles, 2004, Thaithatgoon et al., 2004).
8
dikatakan sebagai tinggi serat jika dapat memenuhi 20% kebutuhan serat harian. Kandungan serat pangan pada jamur dapat meningkat setelah jamur mengalami proses pemasakan (Manzi et al., 2001). Berdasarkan kelarutannya, serat pangan dapat dibagi menjadi dua kelompok, yaitu serat pangan larut dalam air hangat atau panas (soluble dietary fiber, SDF) dan serat pangan tidak larut dalam air panas atau dingin (insoluble dietary fiber, IDF) (Winarno, 1997).Serat pangan larut (SDF) berperan dalam mencegah penyakit jantung koroner dan tekanan darah tinggi karena kemampuannya mereduksi serum kolesterol plasma low density lipoprotein (LDL) yang berkaitan dengan kolesterol. Selain itu, SDF juga dapat mereduksi absorpsi glukosa dalam usus sehingga bermanfaat bagi penderita diabetes. Serat pangan tidak larut (IDF) berperan penting dalam mengatasi masalah sistem pencernaan seperti konstipasi, yaitu dengan mempercepat waktu transit makanan dalam usus dan meningkatkan volume feses (Prosky dan Devries, 1992).
2.2.6
Vitamin dan Mineral
Vitamin ialah zat organik kompleks yang dibutuhkan tubuh dalam jumlah yang sangat rendah namun memiliki peran penting dalam metabolisme tubuh (Wirakusumah, 1997). Kandungan vitamin dalam bahan pangan dapat terdegradasi akibat perlakuan terhadap bahan pangan tersebut. Menurut Wirakusumah (1997), vitamin dapat dibagi menjadi 2 kelompok, yaitu vitamin larut air dan vitamin larut lemak. Vitamin yang larut air ialah vitamin B1, B2, B3, B4, B5, B6, B12, asam folat, biotin, dan vitamin C, sedangkan vitamin yang larut lemak ialah vitamin A, D, E, dan K (Ottaway, 1993).
Beberapa vitamin berfungsi sebagai bagian dari koenzim, sehingga enzim tidak dapat berfungsi efektif sebagai biokatalis jika tidak ada vitamin. Koenzim tersebut berperan dalam metabolisme lemak, protein, dan karbohidrat. Vitamin terdapat dalam bahan pangan sebagai provitamin. Provitamin merupakan senyawa yang akan diubah menjadi vitamin di dalam tubuh. Untuk mengetahui kandungan vitamin dalam bahan pangan dapat digunakan metode high performance liquid chromatography (HPLC) (Huyghebaert et al., 2003). Vitamin yang biasanya terdapat dalam jamur pangan ialah tiamin (B1), riboflavin (B2), niasin (B3) vitamin C, dan ergosterol (Chang dan Miles, 2004).
9
2.2.7
Aktivitas Antioksidan
Proses oksidasi dalam tubuh diakibatkan adanya senyawa radikal yang dihasilkan secara alami pada proses metabolisme atau paparan eksternal. Radikal bebas memiliki kaitan yang erat terhadap timbulnya penyakit degeneratif dan proses penuaan (Soares et al., 2009). Antioksidan memiliki fungsi penting sebagai penangkal radikal bebas, membentuk kompleks dengan logam prooksidan, agen pereduksi, dan menghentikan pembentukan singlet oksigen. Radikal bebas akan menerima elektron dari antioksidan sehingga membentuk senyawa yang stabil dan tidak merusak sel.
Antioksidan dapat diklasifikasikan menjadi dua jenis berdasarkan fungsinya, yaitu antioksidan primer dan sekunder (Gordon, 1990). Antioksidan primer berfungsi menghentikan reaksi autooksidasi dengan mendonorkan atom hidrogen ke senyawa radikal lalu mengubahnya ke bentuk yang lebih stabil, sedangkan antioksidan sekunder berfungsi memperlambat laju reaksi autooksidasi. Antioksidan ini bekerja dalam berbagai mekanisme seperti mengkelat ion metal, menangkap oksigen, memecah hidrogen peroksida ke bentuk non-radikal, menyerap radiasi ultra violet, atau mendeaktifkan singlet oksigen.
Proses oksidasi yang disebabkan oleh radikal bebas terdiri atas tiga tahap, yaitu inisiasi, propagasi, dan terminasi. Reaksi yang terjadi ialah sebagai berikut:
Inisiasi : RH R• + H• (1)
Propagasi : R• + O2 ROO• (2)
: ROO• + RH ROOH + R• (3)
Terminasi : ROO• + ROO• (4)
R• + ROO•
R• + R•
Pada tahap inisiasi terjadi pembentukan senyawa radikal yang sangat reaktif akibat hilangnya satu atom hidrogen (1). Pada tahap propagasi, radikal asam lemak akan bereaksi dengan oksigen membentuk radikal peroksi (2). Radikal peroksi akan menyerang asam lemak dan membentuk hidroperoksida dan radikal asam lemak yang baru (3). Tanpa adanya antioksidan, reaksi oksidasi lemak akan mengalami terminasi dan membentuk kompleks radikal bebas (4). (Chandra, 2010)
10
III.
METODOLOGI PENELITIAN
3.1
WAKTU DAN TEMPAT
Penelitian ini dilaksanakan dari bulan Mei 2010 sampai dengan bulan Februari 2011. Tempat penelitian ialah Laboratorium Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian IPB; Laboratorium Biorin, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB; Laboratorium Terpadu IPB; dan Laboratorium Balai Besar Pasca Panen Pertanian, Kementerian Pertanian Republik Indonesia.
3.2
BAHAN DAN ALAT
Bahan yang digunakan dalam penelitian ialah jamur pelawan (Boletus sp.) kering yang diperoleh dari Dinas Perkebunan dan Kehutanan Kabupaten Bangka Tengah, Provinsi Kepulauan Bangka Belitung. Bahan yang digunakan dalam analisis kimia ialah K2SO4, HgO, H2SO4, 60% NaOH - 5% Na2S2O3, akuades, H3BO3, HCl, asam asetat 2%, indikator metilen merah-metilen biru, kertas saring Whatman, kapas bebas lemak, dietil eter, buffer fosfat 0.08 M pH 6.0, buffer fosfat 10 mM pH 3.5, klara-diastase, termamyl, enzim pepsin, pankreatin, etanol 95%, etanol 78%, aseton, metanol, pikolotiosianat, trietilamin, natrium asetat, asetonitril 60%, asam lemak margarat/C17:0, NaOH metanolik 0.5 N, N2, BF3 (boron trifluorida) metanol (14% b/v), larutan NaCl jenuh, Na2SO4 anhidrous, heksana, KCl 0.025 M pH 1, natrium asetat 0.4 M pH 0.45, 1,1-diphenyl-2-picrylhydrazyl (DPPH) 1 mM, reagen Folin Ciocalteau 50%, Na2CO3 5%, asam metafosforat 5% w/v, 2,6 dichloroindophenol (DCP) 0.2% w/v, dan Dinitrophenilhidrazine (DPNH) 2% w/v.
Alat yang digunakan dalam penelitian ialah oven, desikator, neraca analitik, tanur, penangas listrik, labu Kjeldahl, batu didih, buret, tabung ekstraksi Soxhlet, mikro pipet, Buchner, vortex, Atomic Absorption Flame Emission Spectrophotometer (AAS), High Performance Liquid Chromatography (HPLC), Gas Liquid Chromatography (GLC), dan spektrofotometer.
3.3
METODE PENELITIAN
Penelitian ini dilakukan untuk mengetahui kandungan gizi, senyawa bioaktif, dan kapasitas antioksidan dari jamur pangan pelawan (Boletus sp.). Analisis yang dilakukan ialah analisis komposisi proksimat, profil asam amino, profil asam lemak, kandungan vitamin, kandungan mineral, kandungan serat pangan, komponen antioksidan, dan kapasitas antioksidan
3.3.1
Persiapan Sampel
11
3.3.2
Kadar Air (AOAC, 1995)
Sampel seberat 1-2 g ditimbang pada sebuah wadah kering yang telah diketahui bobotnya. Sampel dikeringkan dalam oven dengan suhu 105°C selama 3 jam. Sampel didinginkan dalam desikator dan ditimbang. Pekerjaan tersebut diulangi hingga tercapai bobot yang konstan.
Kadar air x % (3.1)
Keterangan :
A = Bobot wadah + sampel sebelum dikeringkan (g) B = Bobot wadah + sampel setelah dikeringkan (g) C = Bobot sampel awal (g)
3.3.3
Kadar Protein (AOAC, 1995)
Sampel seberat 100-250 mg ditimbang dan dipindahkan ke dalam labu Kjeldahl 30 ml, kemudian ditambahkan 1.9 g K2SO4, 40 mg HgO, dan 3.8 ml H2SO4. Sampel dididihkan selama 1-1.5 jam hingga cairan jernih. Sampel didinginkan dan ditambah sejumlah kecil air secara perlahan dan didinginkan kembali. Isi labu dipindahkan ke dalam alat destilasi, dan labu dibilas 5-6 kali dengan 1-2 ml akuades. Air pembilas dipindahkan ke dalam alat destilasi dan ditambahkan 8-10 ml larutan 60% NaOH - 5% Na2S2O3.
Erlenmeyer 250 ml yang berisi 5 ml larutan H3BO3 dan 2-4 tetes indikator merah metilen – biru metilen diletakkan di bawah kondensor. Ujung tabung kondensor harus terendam dalam larutan H3BO3. Destilasi dilakukan hingga tertampung sekitar 15 ml destilat dalam erlenmeyer. Destilat dititrasi dengan HCl 0.02 N hingga terjadi perubahan warna menjadi abu-abu. Penetapan blanko juga dilakukan untuk mengurangi bias dalam pengukuran.
Kadar protein dihitung dengan rumus sebagai berikut
Kadar N . x % (3.2)
Kadar protein Kadar N x . * (3.3)
*Sumber : Chang dan Miles (2004) dan Barros et al. (2008)
3.3.4
Kadar Lemak (AOAC, 1995)
Labu lemak yang digunakan dikeringkan di dalam oven, kemudian didinginkan di dalam desikator dan ditimbang. Sebanyak 5 g sampel dibungkus dalam kertas saring dan ditutup dengan kapas bebas lemak.
Kertas saring yang berisi sampel dimasukkan ke dalam tabung ekstraksi Soxhlet, kemudian kondensor dipasang di bagian atas, dan labu lemak di bagian bawah. Pelarut heksana dituang secukupnya ke dalam labu lemak.
12
suhu 105°C hingga bobot konstan. Labu lemak selanjutnya didinginkan dalam desikator dan ditimbang beserta dengan lemak di dalamnya.Kadar lemak x % (3.4)
3.3.5
Kadar Abu (AOAC, 1995)
Sampel seberat 2-3 g ditimbang dan dimasukkan ke dalam cawan porselen yang telah dikeringkan dan diketahui bobotnya. Sampel dalam cawan diarangkan pada pemanas dan diabukan dalam tanur listrik pada suhu maksimum 550°C sampai pengabuan sempurna. Sampel didinginkan dalam desikator dan ditimbang hingga bobot konstan.
Kadar abu x % (3.5)
Keterangan :
A = Bobot cawan + sampel kering (g) B = Bobot cawan kosong kering (g) C = Bobot sampel awal (g)
3.3.6
Kadar Karbohidrat (AOAC, 1995)
Kadar karbohidrat sampel dihitung dengan cara 100% kandungan gizi sampel dikurangi dengan kadar air, kadar abu, kadar protein, dan kadar lemak. Nilainya ditentukan dengan menggunakan rumus berikut :
Kadar karbohidrat % A B C D (3.6)
Keterangan : A = Kadar air B = Kadar abu C = Kadar protein D = Kadar lemak
3.3.7
Analisis Komposisi Asam Amino Metode
High Performance Liquid
Chromatography
(AOAC, 1995)
13
Kolom HPLC yang digunakan ialah kolom pico tag 3.9 x 150 mm dengan fase gerak asetonitril 60% dan buffer natrium asetat 1 M. Detektor yang digunakan ialah UV dengan panjang gelombang 254 nm. Penentuan kadar asam amino ditentukan dengan rumus berikut:Kadar asam amino x x BM x FP x (3.7)
Keterangan :
A = Luas area sampel B = Luas area standar C = Konsentrasi standar D = Bobot sampel awal (µg)
BM = Bobot molekul masing asam amino FP = Faktor pengenceran
3.3.8
Analisis Komposisi Asam Lemak Metode
Gas Liquid Chromatograpy
(AOAC 991.39)
Sebanyak 100 mg sampel dimasukkan ke dalam tabung reaksi. Kemudian sampel ditambah dengan 1 ml larutan standar internal (SI) (asam lemak margarat/C17:0) dan 1.5 ml NaOH metanolik 0.5 N. Tabung diisi dengan N2 lalu ditutup rapat dan divorteks. Tabung dipanaskan dalam penangas bersuhu 80-100°C selama 5 menit, kemudian didinginkan. Sebanyak 2 ml BF3 metanol (14% b/v) ditambahkan ke dalam tabung, kemudian tabung diisi dengan N2 dan ditutup rapat. Tabung dipanaskan kembali pada suhu 80-100°C selama 30 menit selanjutnya didinginkan hingga mencapai suhu ruang. Heksana sebanyak 1 ml ditambahkan ke dalam tabung dan divorteks, kemudian ditambah 3 ml larutan NaCl jenuh dengan segera lalu dikocok. Lapisan heksana dipisahkan dan ditambah dengan Na2SO4 anhidrous.
Sampel disuntikkan ke dalam alat GLC dengan suhu injektor 250°C, dan suhu detektor 260°C. Suhu kolom diatur secara gradien, yaitu suhu awal kolom 120°C dipertahankan selama 6 menit, peningkatan suhu kolom 3°C/menit hingga mencapai suhu 230°C dan dipertahankan selama 25 menit. Tekanan gas helium diatur pada 1 kg/cm2, tekanan gas hidrogen dan udara masing - masing 0.5 kg/cm2. Asam lemak standar digunakan untuk identifikasi dan kuantifikasi asam lemak sampel.
Perhitungan jumlah asam lemak (g asam lemak/100 g) dapat dilakukan dengan rumus :
Kadar asam lemak x RF x S x (3.8)
Keterangan :
A = Area asam lemak A B = Area standar internal (SI)
14
RF A S S x (3.9)
3.3.9
Kadar Vitamin
1. Vitamin CSampel sebanyak 1-10 g ditambahkan dengan 50-60 ml asam metafosforat 5% w/v dan dihomogenisasi. Sampel selanjutnya dimasukkan ke dalam labu takar 100 ml dan ditera dengan asam metafosforat 5% w/v, kemudian didinginkan selama semalam. Sebanyak 5 ml sampel ditambahkan dengan 2-3 tetes 2,6 dichloroindophenol (DCP) 0.2% w/v sampai terbentuk warna yang konstan. Kemudian ke dalam sampel ditambahkan 5 ml Thiourea 2% w/v dalam asam fosforat 5% w/v, dan ditambahkan 1 ml dinitrophenilhidrazine (DPNH) 2% w/v dalam asam sulfat 9 N. Sampel diinkubasi dalam penangas air 50°C selama 90 menit. Selanjutnya sampel didinginkan dan ditambah asam asetil 5 ml dan digoyang selama 1 jam. Sampel disentrifugasi pada kecepatan 800 g selama 5 menit dan diukur dengan HPLC.
2. Vitamin B1 (Tiamin)
Sebanyak 1 g sampel ditambahkan 60 ml asam asetat 2%, kemudian dipanaskan selama 20 menit dan disonikasi selama 5 menit. Setelah dingin, ke dalam sampel ditambahkan dengan 25 ml metanol dan ditepatkan hingga 50 ml dengan asam asetat 2%. Kemudian sampel disentrifugasi pada kecepatan 1450 g selama 5 menit dan supernatan dipisahkan untuk diinjeksikan ke HPLC.
3. Vitamin B2 (Riboflavin)
Sebanyak 10 g sampel ditambahkan dengan 40 ml asam sulfat 0.2 N dan dipindahkan ke dalam labu takar 100ml. Sampel dipanaskan dalam autoklaf pada suhu 121ºC selama 15 menit. Setelah dingin, sampel ditambahkan 6-7 ml larutan natrium asetat untuk mengatur pH sampai 4.5. Selanjutnya sampel ditambahkan dengan 5 ml klara-diastase dan diinkubasi pada suhu 45ºC selama 60-90 menit. Setelah dingin, sampel ditambahkan dengan 4 ml asam sulfat 5 N dan ditepatkan dengan akuades sampai 100 ml. Kemudian sampel disaring dan filtrat diukur dengan HPLC
4. Vitamin B3 (Niasin)
Sebanyak 2 g sampel ditambahkan dengan 60 ml asam asetat 2%, dipanaskan dengan penangas air selama 20 menit. Kemudian sampel dihomogenisasi selama 5 menit dengan sonikasi dan didiamkan pada suhu ruang sampai dingin. Selanjutnya ke dalam sampel ditambahkan 25 ml metanol dan ditepatkan dengan asam asetat 2% hingga volume 50 ml. Sampel disentrifugasi pada 1450 g selama 30 menit. Selanjutnya supernatan dipisahkan untuk diukur dengan HPLC.
5. Biotin
15
3.3.10
Kadar Mineral
Mineral yang dianalisis ialah K, P, Ca, Na, Fe, dan Zn. Sebanyak 2 gram sampel diabukan kemudian didinginkan selama semalam. Abu selanjutnya ditambahkan dengan 40-50 ml HCl 1% v/v dan dipanaskan selama 60 menit. Kemudian ke dalam tabung ditambahkan 10 ml HCl dan air, dan selanjutnya dituang ke dalam labu takar 100 ml (ditera dengan air destilata). Kandungan mineral selanjutnya diukur dengan menggunakan Atomic Absorption Flame Emission Spectrophotometer (AAS).
3.3.11
Kadar Serat Pangan (Asp
et al.,
1983)
Sebanyak 1 g sampel kering bebas lemak dimasukkan ke dalam erlenmeyer, kemudian ditambah dengan 25 ml buffer fosfat 0.08 M pH 6.0 dan termamyl sebanyak 100µl. Sampel diinkubasikan dalam penangas air mendidih selama 30 menit dan diaduk setiap 5 menit. Selanjutnya sampel didinginkan lalu ditambah dengan 20 ml air destilata dan pH diatur menjadi 1.5 dengan HCl 4M. Kemudian ke dalam sampel ditambahkan 100 mg pepsin dan diagitasi selama 60 menit. Berikutnya sampel ditambahkan dengan 20 ml air destilata dan pH sampel diatur menjadi 6.8 dengan NaOH, lalu ditambahkan 100 mg pakreatin, ditutup, dan diinkubasikan pada suhu 40°C selama 60 menit sambil diagitasi, selanjutnya pH sampel diatur dengan HCl menjadi 4.5.
1. Analisis Kadar Serat Tidak Larut (IDF)
Sampel disaring dengan kertas Whatman, kemudian residu dicuci dengan 2 x 10 ml air destilata, 2 x 10 ml etanol 95%, dan 2 x 10 ml aseton. Kertas saring dikeringkan dalam oven pada suhu 105°C selama semalam, didinginkan dalam desikator dan ditimbang. Selanjutnya kertas saring diabukan dalam tanur.
Kadar IDF % S x % (3.10)
Keterangan :
D1 = Bobot kertas saring setelah analisis dan dikeringkan (g) I1 = Bobot kertas saring setelah diabukan (g)
B1 = Bobot blanko bebas serat (g)
2. Analisis Kadar Serat Larut (SDF)
Filtrat ditepatkan volumenya dengan air sampai 100 ml, lalu ditambahkan dengan 400 ml etanol 95% bersuhu 60°C, dan didiamkan selama 60 menit. Selanjutnya filtrat disaring dengan kertas Whatman dengan bantuan Buchner. Kemudian residu dicuci dengan 2 x 10 ml etanol 78%, 2 x 10 etanol 95%, dan 2 x 10 ml aseton. Kertas saring dikeringkan dalam oven pada suhu 105°C selama semalam, didinginkan dalam desikator dan ditimbang. Selanjutnya kertas saring diabukan dalam tanur.
Kadar SDF %
16
Keterangan :D2 = Bobot kertas saring setelah analisis dan dikeringkan (g) I2 = Bobot kertas saring setelah diabukan (g)
B2 = Bobot blanko bebas serat (g)
TDF IDF SDF (3.12)
Keterangan :
TDF = Kadar Total serat pangan IDF = Kadar Serat pangan tak larut SDF = Kadar Serat pangan larut
3.3.12
Analisis Total Fenolik
Sebanyak 2 g sampel kering dilarutkan dalam 20 ml etanol kemudian dimaserasi dengan pengocokan selama semalam. Campuran tersebut disaring dan kemudian disentrifugasi pada 1450 g selama 5 menit. Sebanyak 0.5 ml supernatan dimasukkan ke dalam tabung reaksi dan ditambahkan 0.5 ml etanol 95%, 2.5 ml akuades, dan 2.5 ml reagen Folin Ciocalteau 50%. Campuran didiamkan selama 5 menit, lalu ditambahkan 0.5 ml Na2CO3 5% dan divortex. Selanjutnya campuran disimpan dalam ruang gelap selama 1 jam. Pengukuran absorbansi dilakukan pada panjang gelombang 725 nm. Sebagai larutan standar digunakan asam galat dengan variasi konsentrasi 50-250 mg/L, sehingga kandungan total fenolik dinyatakan dalam mg Gallic Acid Equivalent (GAE)/g sampel.
3.3.13
Analisis Total Antosianin (Giusti dan Worlstad, 2001)
Sebanyak 1 g sampel dilarutkan dalam 20 ml campuran larutan 15% HCL 1.5 N-85% metanol. Larutan didiamkan selama 2 jam dalam ruang gelap, kemudian disaring menggunakan kertas saring. Sebanyak masing-masing 1 ml sampel dimasukkan ke dalam 2 buah tabung reaksi. Tabung reaksi pertama ditambah larutan potasium klorida 0.025 M pH 1 sebanyak 9 ml dan tabung reaksi kedua ditambahkan sodium asetat 0.4 M pH 0.45 sebanyak 9 ml. Pengaturan pH dalam pembuatan potasium klorida dan sodium asetat menggunakan HCl pekat. Absorbansi dari kedua perlakuan pH diukur dengan spektrofotometer pada panjang gelombang 510 nm dan 700 nm setelah didiamkan selama 15 menit.
Nilai absorbansi sampel ekstrak dihitung dengan menggunakan persamaan : A = [(A510-A700)pH 1 – (A510-A700)pH 4.5]. Total antosianin dihitung dengan sianidin-3-glikosida menggunakan koefisien ekstingsi molar sebesar 26900 L mol-1 cm-1 dan berat molekul 449.2 g mol-1. Total antosianin dihitung dengan menggunakan persamaan berikut :
17
Keterangan :A = Absorbansi
ε = Koefisien absortivitas (26900 L/mol cm) b = Diameter kuvet (1 cm)
BM = Berat molekul sianidin-3-glikosida (449.2 g/mol) FP = Faktor pengenceran
3.3.14
Penentuan Total
β
-karoten dan Likopen (Barros
et al
., 2007 yang
dimodifikasi)
Sebanyak 2 g sampel ditambahkan dengan 30 ml larutan aseton-heksana (4:6), kemudian digoyangkan dengan shaker selama semalam pada suhu ruang dan tempat gelap. Larutan kemudian disaring dan diukur absorbansinya pada panjang gelombang 453, 505, 663 nm. Likopen dan β-karoten kemudian dihitung dengan menggunakan persamaan sebagai berikut :
Likopen mg ml . A . A . A (3.14)
β-Karoten mg ml . A . A . A (3.15)
3.3.15
Analisis Kapasitas Antioksidan
Sebanyak 2 g sampel kering dilarutkan dalam 20 ml etanol kemudian dimaserasi dengan pengocokan selama semalam. Campuran tersebut disaring dan selanjutnya dibuat 1 seri pengenceran sampel yaitu 10, 15, dan 20 kali dengan etanol.
Sebanyak 1 ml larutan sampel dimasukkan ke dalam tabung reaksi, kemudian ditambahkan 7 ml etanol. Untuk larutan blanko digunakan 8 ml etanol. Selanjutnya, ke dalam tabung ditambahkan 2 ml larutan DPPH 1 mM dan dikocok kuat. Larutan didiamkan selama 30 menit pada suhu ruang. Larutan kemudian diukur absorbansinya pada panjang gelombang 517 nm.
Nilai IC50 merupakan konsentrasi sampel yang menghasilkan penghambatan radikal DPPH sebesar 50%.
Kapasitas antioksidan % x % (3.16)
IC50 . x A (3.17)
Keterangan :
A = Absorbansi blanko B = Absorbansi larutan sampel
18
IV.
HASIL DAN PEMBAHASAN
4.1
KOMPOSISI PROKSIMAT
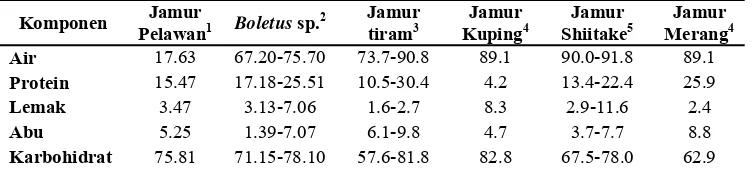
[image:31.612.140.516.338.423.2]Analisis proksimat merupakan salah satu cara untuk mengetahui kandungan gizi suatu bahan pangan. Hasil analisis terhadap komposisi proksimat dari jamur pangan pelawan dapat dilihat pada Tabel 1. Kadar air jamur pangan pelawan yang digunakan dalam penelitian ini ialah 17.63% bb. Jamur pangan pelawan tidak dipasarkan dalam kondisi segar, melainkan dalam kondisi telah dikeringkan. Kadar air yang tinggi pada suatu bahan pangan dapat menyebabkan bahan tersebut mudah mengalami kerusakan. Tujuan dari pengeringan ialah menghilangkan sebagian besar air sehingga dapat memperpanjang masa simpan dari jamur tersebut. Kadar air dari jamur yang digunakan diduga belum cukup rendah karena dapat terjadi pertumbuhan kapang selama penyimpanan pada suhu ruang, sehingga diperlukan penelitian lebih lanjut mengenai kondisi pengeringan jamur yang tepat.
Tabel 1. Komposisi proksimat dan serat pangan pada beberapa jamur pangan
Semua data disajikan dalam basis kering, kecuali kadar air disajikan dalam basis basah 1
Jamur kering, 2 Jamur kering dengan rehidrasi, 3, 4, 5 Jamur segar
Sumber : 1 Hasil penelitian, 2 Manzi et al., 2001; Manzi et al., 2004; Alvarez-Parilla et al., 2007; Barros et al., 2008, 3 Chang dan Miles, 2004; Reguła et al., 2007, 4 Chang dan Miles, 2004, 5 Chang dan Miles, 2004; Indratininingsih et al., 2004; Reguła et al., 2007
Hasil analisis menunjukkan bahwa protein merupakan makronutrien kedua tertinggi setelah karbohidrat (Tabel 1). Sebagian besar jamur pangan diketahui sebagai bahan pangan sumber protein yang baik (Liu et al., 2010). Kandungan protein jamur pangan ektomikoriza dari genus Astreus, Craterellus, Heimiella, Lactarius, Phaegyroporus, dan Russula yang dipanen dari alam berkisar antara 14.00-24.20% bk (Sanmee et al., 2003) dan pada jamur pangan ektomikoriza komersial dari genus Boletus berkisar antara 17.18-25.51% bk (Manzi et al., 2004; Barros et al., 2008), sedangkan pada jamur tiram (Pleurotus ostreatus), jamur shiitake (Lentinula edodes), jamur kuping (Auricularia auricula), dan jamur merang (Volvariella volvacea) yang merupakan jamur non-ektomikoriza hasil budidaya ialah antara 4.2-30.4% bk (Chang dan Miles, 2004; Indratininingsih et al., 2004; Reguła et al., 2007). Berdasarkan hasil penelitian, jamur pangan pelawan memiliki kandungan protein yang tidak jauh berbeda dibandingkan dengan jamur pangan lain baik yang diperoleh dari alam maupun komersial. Hasil analisis komposisi asam-asam amino dapat dilihat pada Tabel 2.
Hasil analisis menunjukkan bahwa jamur pangan pelawan memiliki kandungan lemak yang rendah (Tabel 1). Hasil ini serupa dengan hasil penelitian sebelumnya pada kandungan lemak jamur pangan komersial ataupun yang diperoleh dari alam, yaitu antara 0.92-7.89% bk (Barros et
Komponen Jamur
Pelawan1 Boletus sp.
2 Jamur
tiram3
Jamur Kuping4
Jamur Shiitake5
Jamur Merang4 Air 17.63 67.20-75.70 73.7-90.8 89.1 90.0-91.8 89.1
Protein 15.47 17.18-25.51 10.5-30.4 4.2 13.4-22.4 25.9
Lemak 3.47 3.13-7.06 1.6-2.7 8.3 2.9-11.6 2.4
Abu 5.25 1.39-7.07 6.1-9.8 4.7 3.7-7.7 8.8
19
al., 2008; Alvarez-Parilla et al., 2007). Kandungan lemak jamur pangan ektomikoriza genus Astreus, Craterellus, Heimiella, Lactarius, Phaegyroporus, dan Russula yang dipanen dari alam berkisar antara 2.70-9.5% bk (Sanmee et al., 2003), dan pada jamur pangan ektomikoriza komersial genus Boletus antara 3.13-7.06% bk (Manzi et al., 2004; Barros et al., 2008). Hasil penelitian menunjukkan bahwa kandungan lemak jamur pangan pelawan berada dalam kisaran kandungan lemak jamur pangan ektomikoriza yang dipanen dari alam dan jamur pangan komersial dari genus Boletus. Hasil analisis terhadap komposisi asam-asam lemak dapat dilihat pada Tabel 4.Kadar abu suatu bahan pangan dapat menunjukkan kandungan mineral yang ada di dalamnya. Mineral merupakan zat anorganik yang tidak terbakar selama proses pengabuan dalam tanur. Kadar abu jamur pangan ektomikoriza Boletus yang diperoleh dari alam dan komersial berkisar antara 1.39%-7.07% bk (Manzi et al., 2001; Alvarez-Parilla et al., 2007; Barros et al., 2008), dan pada jamur pangan non-ektomikoriza komersial, seperti P. ostreatus, L. edodes, V. volvacea, dan A. auricula antara 3.7-9.8% bk (Chang dan Miles, 2004; Indratininingsih et al., 2004; Reguła et al., 2007). Hasil penelitian menunjukkan bahwa kadar abu jamur pangan pelawan berada dalam kisaran kadar abu jamur ektomikoriza dan non-ektomikoriza. Hasil analisis komposisi mineral dapat dilihat pada Tabel 6.
Kandungan karbohidrat dapat diketahui melalui perhitungan secara by difference (AOAC, 1995). Karbohidrat merupakan makronutrien dengan jumlah yang paling tinggi pada jamur pangan pelawan. Kandungan karbohidrat jamur pangan ektomikoriza genus Boletus komersial dan yang dipanen dari alam berkisar antara 71.15-78.10% bk (Manzi et al., 2001; Alvarez-Parilla et al., 2007; Barros et al., 2008), sedangkan pada P. ostreatus, L. edodes, V. volvacea, dan A.z auricula yang merupakan jamur pangan komersial ialah antara 64.10-82.80% bk (Chang dan Miles, 2004; Reguła et al., 2007). Kandungan karbohidrat jamur pangan pelawan berada dalam kisaran kandungan karbohidrat jamur pangan ektomikoriza komersial, ektomikoriza yang dipanen dari alam, dan non-ektomikoriza. Hasil analisis lebih lanjut terhadap serat pangan disajikan pada sub bab 4.6 tentang serat pangan.
Kandungan zat gizi jamur yang diperoleh dari alam berbeda dengan hasil budidaya. Menurut Manzi et al. (2001), kandungan zat gizi yang berbeda pada jamur disebabkan oleh perbedaan strain, lingkungan pertumbuhan, waktu panen, kondisi perlakuan, dan persiapan substrat. Selain itu, Sistani et al. (2007) menambahkan bahwa kandungan urea pada media pertumbuhan mempengaruhi kandungan protein jamur hasil budidaya pada media tersebut.
4.2
ASAM AMINO
20
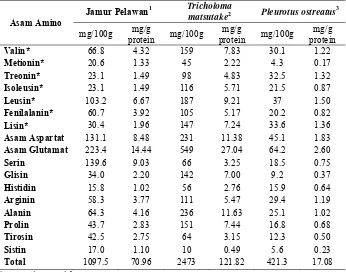
Tabel 2. Komposisi asam amino pada beberapa jamur panganAsam Amino
Jamur Pelawan1 Tricholoma
matsutake2 Pleurotus ostreatus3 mg/100g mg/g
protein mg/100g
mg/g
protein mg/100g
mg/g protein
Valin* 66.8 4.32 159 7.83 30.1 1.22
Metionin* 20.6 1.33 45 2.22 4.3 0.17
Treonin* 23.1 1.49 98 4.83 32.5 1.32
Isoleusin* 23.1 1.49 116 5.71 21.5 0.87
Leusin* 103.2 6.67 187 9.21 37 1.50
Fenilalanin* 60.7 3.92 105 5.17 20.2 0.82
Lisin* 30.4 1.96 147 7.24 33.6 1.36
Asam Aspartat 131.1 8.48 231 11.38 45.1 1.83
Asam Glutamat 223.4 14.44 549 27.04 64.2 2.60
Serin 139.6 9.03 66 3.25 18.5 0.75
Glisin 34.0 2.20 142 7.00 9.2 0.37
Histidin 15.8 1.02 56 2.76 15.9 0.64
Arginin 58.3 3.77 111 5.47 29.4 1.19
Alanin 64.3 4.16 236 11.63 25.1 1.02
Prolin 43.7 2.83 151 7.44 16.8 0.68
Tirosin 42.5 2.75 64 3.15 12.3 0.50
Sistin 17.0 1.10 10 0.49 5.6 0.23
Total 1097.5 70.96 2473 121.82 421.3 17.08
*asam amino esensial
Sumber : 1 Hasil penelitian, 2 Liu et al., (2010), 3 Patil et al., (2010)
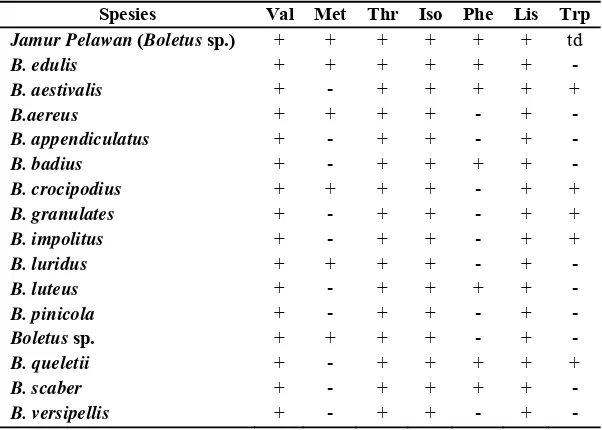
Jamur pangan pelawan memiliki komposisi asam amino esensial yang lebih lengkap dibandingkan dengan jamur pangan Boletus lainnya, kecuali pada Boletus edulis (Tabel 3). Jika dibandingkan dengan komposisi asam amino esensial kacang kedelai yang merupakan sumber protein nabati (Hermana et al., 1996), maka jamur pangan pelawan memiliki komposisi yang hampir sama. Hal ini menunjukkan bahwa jamur pangan pelawan merupakan sumber asam amino esensial yang sejajar dengan kacang kedelai dan Boletus edulis, serta lebih baik dibandingkan dengan jamur pangan dari genus Boletus lainnya yang dipanen dari alam. Serealia merupakan bahan pangan nabati yang memiliki kandungan asam amino lisin yang rendah dan metionin yang tinggi, sedangkan kacang-kacangan memiliki kandungan asam amino metionin yang rendah dan lisin yang tinggi (Muchtadi, 1989). Oleh karena itu, kombinasi kedua bahan tersebut pada diet dilakukan untuk saling melengkapi kekurangan asam amino dari kedua bahan pangan tersebut. Jamur pangan pelawan mengandung asam amino lisin dan metionin, sehingga konsumsi jamur ini dapat membantu melengkapi kekurangan asam amino pada serealia dan kacang-kacangan.
21
parkinson. Selain itu, Miller (1996) melaporkan bahwa kombinasi beberapa asam amino, seperti asam glutamat, alanin, dan glisin efektif dalam pengobatan pembesaran prostat jinak. [image:34.612.176.477.250.465.2]Total asam amino dari jamur pangan pelawan ialah 1097 mg/100g jamur (Tabel 2), nilai ini hanya sebesar 7% dari total protein jamur pangan pelawan. Kandungan total asam amino dari jamur pangan pelawan relatif rendah dibandingkan dengan total proteinnya. Demikian pula kandungan total asam amino pada jamur pangan yang lain (Liu et al., 2010; Patil et al., 2010). Hal ini diduga disebabkan oleh protein belum terhidrolisis dengan sempurna karena sampel yang dianalisis masih berupa jamur utuh yang masih banyak mengandung komponen non-protein yang dapat berikatan protein. Proses hidrolisis yang kurang sempurna menyebabkan protein tidak terurai menjadi asam amino dan tidak terukur oleh alat yang digunakan.
Tabel 3. Komposisi jenis asam amino esensial jamur alam dari genus Boletus
Spesies Val Met Thr Iso Phe Lis Trp
Jamur Pelawan (Boletus sp.) + + + + + + td
B. edulis + + + + + + -
B. aestivalis + - + + + + +
B.aereus + + + + - + -
B. appendiculatus + - + + - + -
B. badius + - + + + + -
B. crocipodius + + + + - + +
B. granulates + - + + - + +
B. impolitus + - + + - + +
B. luridus + + + + - + -
B. luteus + - + + + + -
B. pinicola + - + + - + -
Boletus sp. + + + + - + -
B. queletii + - + + + + +
B. scaber + - + + + + -
B. versipellis + - + + - + -
Semua data yang disajikan bersumber dari Dembitsky et al. (2010), kecuali jamur pelawan merupakan hasil penelitian
+ : terkandung dalam jamur - : tidak terkandung dalam jamur td : tidak diukur
4.3
ASAM LEMAK
22
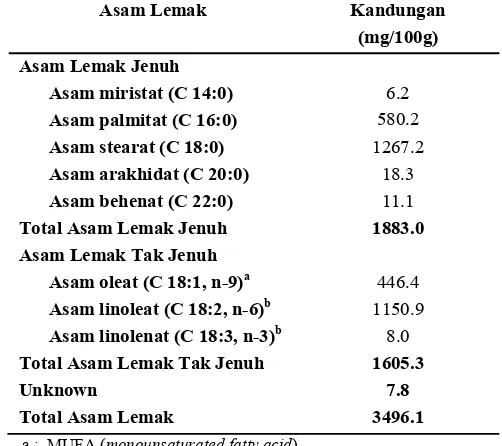
sebelumnya, yaitu antara 0.05-3.10% dari total asam lemak pada jamur yang dipanen dari alam (Yilmaz et al., 2006; Barros et al., 2008; Dembitsky et al., 2010), dan antara 0.07-0.45% dari total asam lemak pada jamur komersial (Barros et al., 2008)Tabel 4. Komposisi asam lemak jamur pangan pelawan (Boletus sp.)
Asam Lemak Kandungan
(mg/100g)
Asam Lemak Jenuh
Asam miristat (C 14:0) 6.2
Asam palmitat (C 16:0) 580.2
Asam stearat (C 18:0) 1267.2
Asam arakhidat (C 20:0) 18.3
Asam behenat (C 22:0) 11.1
Total Asam Lemak Jenuh 1883.0
Asam Lemak Tak Jenuh
Asam oleat (C 18:1, n-9)a 446.4
Asam linoleat (C 18:2, n-6)b 1150.9 Asam linolenat (C 18:3, n-3)b 8.0
Total Asam Lemak Tak Jenuh 1605.3
Unknown 7.8
Total Asam Lemak 3496.1
a : MUFA (monounsaturated fatty acid) b : PUFA (polyunsaturated fatty acid)
Asam lemak jenuh yang terkandung dalam jamur pangan pelawan ialah asam miristat, palmitat, stearat, arakhidat, dan behenat (Tabel 4). Asam stearat merupakan asam lemak yang paling banyak terdapat dalam jamur tersebut. Akan tetapi, tingginya kandungan asam stearat pada jamur tidak membuat jamur menjadi sumber asam lemak yang perlu dihindari. Grundy (1994) melaporkan bahwa berbeda dengan asam palmitat yang bersifat hiperkolesterolemik, asam stearat merupakan asam lemak jenuh rantai panjang yang tidak meningkatkan konsentrasi serum kolesterol dan low density lipoprotein (LDL).
Komposisi asam lemak jamur pangan pelawan menunjukkan bahwa kandungan asam lemak jenuh lebih tinggi dibandingkan dengan asam lemak tak jenuh (Tabel 4). Hasil ini berbeda dengan hasil penelitian Diéz dan Alvarez (2001), Yilmaz et al. (2006), dan Barros et al., (2008), yang melaporkan bahwa kandungan asam lemak tak jenuh yang lebih tinggi dibandingkan dengan asam lemak jenuh. Akan tetapi, kandungan asam lemak jenuh yang lebih tinggi pada jamur pangan pelawan diduga tidak memberikan efek negatif terhadap kesehatan. Hal ini dikarenakan asam lemak jenuh yang tertinggi pada jamur pelawan merupakan asam stearat.
23
4.4
VITAMIN
Kandungan vitamin jamur pangan pelawan diukur menggunakan metode HPLC. Vitamin B1, B2, dan B3 pada jamur pangan pelawan tidak terdeteksi oleh alat yang digunakan, hal ini disebabkan oleh kandungannya dalam jamur pangan pelawan berada di bawah limit deteksi alat (Tabel 5). Rendahnya kandungan vitamin B1, B2, B3 pada jamur pangan pelawan diduga akibat terjadinya kerusakan pada proses pengeringan jamur. Winarno (1997) juga menyatakan bahwa vitamin B1 mudah rusak akibat panas, vitamin B2 mudah rusak akibat cahaya, dan vitamin B3 juga mengalami kerusakan walaupun lebih stabil dibandingkan dengan vitamin B1 dan B2.
[image:36.612.207.446.393.477.2]Kandungan vitamin C pada jamur pangan pelawan ialah 12.46 mg/100g jamur (15.13 mg/100g bk). Kandungan vitamin C pada jamur pangan komersial ialah antara 17-25 mg/100g bk (Mattila et al., 2001), dan pada ekstrak jamur pangan yang dipanen dari alam berkisar antara 3-35 mg/100g (Barros et al., 2007; Barros et al., 2008). Dengan demikian, kandungan vitamin C pada jamur pangan pelawan tidak jauh berbeda dibandingkan pada jamur pangan komersial dan ekstrak jamur pangan yang dipanen dari alam. Kandungan vitamin C pada jamur pangan pelawan diduga lebih tinggi pada kondisi segar karena proses pengeringan dan lama penyimpanan dapat menyebabkan penurunan kandungan vitamin C. Tembo et al. (2008) melaporkan pengeringan menurunkan kandungan vitamin C. Selain itu, suhu dan lama penyimpanan juga berpengaruh terhadap penurunan vitamin C (Syafutri et al., 2006; Safaryani et al., 2007). Sampel jamur pangan pelawan yang diperoleh telah disimpan selama beberapa bulan sebelum dilakukan analisis.
Tabel 5. Komposisi vitamin jamur pangan pelawan (Boletus sp.)
Vitamin Kandungan Vitamin
Vitamin B1( mg/100g) ttd
Vitamin B2( mg/100g) ttd
Vitamin B3 (mg/100g) ttd
Biotin (µg/100g) 27.35
Vitamin C (mg/100g) 12.46
ttd : tidak terdeteksi
24
4.5
MINERAL
Komponen mineral makro yang dianalisis ialah natrium (Na), kalium (K), kalsium (Ca), dan fosfor (P), sedangkan komponen mineral mikro yang dianalisis ialah zat besi (Fe) dan seng (Zn). Mineral makro dan mineral mikro tersebut merupakan mineral yang secara umum ditemukan pada jamur pangan (Chang dan Miles, 2004).
[image:37.612.213.444.367.491.2]Mineral makro dan mineral mikro dengan kandungan tertinggi pada jamur pangan pelawan ialah K dan Zn (Tabel 6). Mattila et al. (2001) melaporkan hasil yang sama pada jamur pangan komersial. Akan tetapi, pada jamur pangan ektomikoriza yang diperoleh dari alam genus Astreus, Craterellus, Heimiella, Lactarius, Phaegyroporus, dan Russula kandungan mineral makro dan mineral mikro yang tertinggi ialah K dan Fe (Sanmee et al., 2003). Komposisi K yang jauh lebih tinggi dibandingkan dengan Na pada jamur memiliki manfaat positif terhadap kesehatan tubuh. Hal ini didukung oleh Gropper et al. (2009) yang menyatakan bahwa asupan tinggi K berhubungan dengan penurunan tekanan darah. Lebih lanjut lagi, Haddy et al. (2005) melaporkan bahwa K dapat menurunkan tekanan darah pada penderita hipertensi. Jamur pangan pelawan memiliki kandungan Ca terendah. Hasil yang sama juga ditemui pada jamur pangan ektomikoriza Astreus, Craterellus, Heimiella, Lactarius, Phaegyroporus, dan Russula yang dipanen dari alam, yaitu berkisar antara 0.1-2.4 g/kg bk (Sanmee et al., 2003), dan pada jamur pangan komersial non-ektomikoriza ialah 0.01-0.25 g/kg bk (Mattila et al., 2001).
Tabel 6. Komposisi mineral jamur pangan pelawan (Boletus sp.)
Mineral Kandungan
Mineral makro
Kalium (K) (g/kg) 31.60
Fosfor (P) (g/kg) 5.80
Natrium (Na) (g/kg) 0.52
Kalsium (Ca) (mg/kg) 14.88
Mineral mikro
Zat Besi (Fe) (mg/kg) 62.52
Seng (Zn) (mg/kg) 67.86
25
4.6
SERAT PANGAN
Tabel 7 menunjukkan total serat pangan (TDF) dari jamur pangan pelawan ialah 11.71% bk. Pada jamur pangan ektomikoriza Boletus komersial kandungan total serat pangannya ialah 27.08-38.11% bk, pada jamur pangan non-ektomikoriza Agaricus, Pleurotus dan Agrocybe komersial sebesar 25.92-32.92% bk (Manzi et al., 2001; Manzi et al., 2004). Dengan demikian, jamur pangan pelawan memiliki kadar serat pangan yang lebih rendah dibandingkan dengan jamur pangan ektomikoriza dan non-ektomikoriza. Konsumsi jamur pangan pelawan per takaran saji, yakni 28 g dapat mencukupi 8.63% dari kebutuhan serat harian pria dewasa dan 13.12% dari kebutuhan serat harian wanita dewasa.
Tabel 7. Komposisi serat pangan beberapa jamur pangan
Analisis Jamur Pelawan
(% bk)
Boletus sp. (% bk)
Serat pangan larut 1.17 5.08-8.49
Serat pangan tidak larut 10.54 24.07-31.99
Total serat pangan 11.71 27.08-38.11
Menurut Manzi et al., (2001) kadar serat pangan pada jamur dapat meningkat setelah proses pemasakan. Berdasarkan hasil penelitian, 90% dari total serat pangan jamur pangan pelawan merupakan serat pangan tidak larut (IDF) yang memiliki peranan dalam sistem pencernaan, dan 10% dari total serat pangan jamur pangan pelawan merupakan serat pangan larut (SDF). Serat pangan larut berperan dalam reduksi serum kolesterol LDL dan mengurangi absorbsi glukosa pada usus (Prosky dan Devries, 1992). Pada jamur pangan, kitin merupakan komponen utama dari serat pangan tidak larut, dan β-glukan adalah komponen serat pangan larut (Aida et al., 2009). Berdasarkan komposisi dari serat pangannya, diduga jamur pangan pelawan merupakan bahan pangan yang berperan dalam menjaga kesehatan pencernaan karena kandungan serat pangan tidak larut yang lebih tinggi daripada serat pangan larutnya.
4.7
KOMPONEN DAN KAPASITAS ANTIOKSIDAN
4.7.1
Komponen Antioksidan
Komponen fenolik merupakan komponen antioksidan utama yang terdapat pada buah dan sayur (Mau et al., 2001). Selain itu, dilihat dari warnanya pada kondisi segar, jamur pangan pelawan diperkirakan mengandung pigmen yang mempunyai sifat antioksidan seperti antosianin, β-karoten dan likopen. Oleh karena itu, komponen antioksidan yang dianalisis pada jamur pangan pelawan ialah total fenolik, antosianin, β-karoten, dan likopen.
26
tertinggi juga dilaporkan sebelumnya pada jamur pangan lain (Barros et al., 2007). Kandungan total fenolik pada jamur pangan non-ektomikoriza Agaricus bisporus, Lentinula edodes, Grifola frondosa, Pleurotus osteratus, dan Pleurotus eryngii komersial berkisar antara 4.27-10.65 mg GAE/g bk (Dubost et al., 2007), dan pada jamur panganektomikoriza genus Boletus yang dipanen dari alam berkisar antara 14.04-16.35 mg
[image:39.612.200.472.242.312.2]GAE/g bk (Gursoy et al., 2009; Vidović et al., 2010). Dengan demikian, jamur pangan pelawan memiki kandungan total fenolik yang tidak jauh berbeda dengan jamur pangan non-ektomikoriza, akan tetapi lebih rendah dibandingkan dengan jamur pangan ektomikoriza.
Tabel 8. Komponen antioksidan jamur pangan pelawan (Boletus sp.)
ttd : tidak terdeteksi
Jamur pangan pelawan mengandung β-karoten dan likopen, sedangkan antosianin tidak terdeteksi (Tabel 8). Hasil tersebut menunjukkan bahwa warna pada jamur pangan pelawan segar berasal dari β-karoten dan likopen. Kandungan β-karoten dan likopen pada ekstrak jamur non-mikoriza yang dipanen dari alam berkisar antara 1.88-5.42 µg/g ekstrak dan 0.69-2.63 µg/g ekstrak (Barros et al., 2007; Barros et al., 2008), dan pada ekstrak jamur mikoriza komersial ialah antara 2.73-13.56 µg/g ekstrak dan 1.14-5.06 µg/g ekstrak (Barros et al., 2008). Berdasarkan hasil penelitian, kandungan β-karoten dan likopen pada jamur pangan pelawan lebih tinggi dibandingkan pada jamur pangan komersial maupun yang dipanen dari alam. Kandungan β-karoten pada wortel segar (62.2 µg/g bb) (Koca dan Karadeniz, 2008). Jika dibandingkan dengan wortel, maka kandungan β-karoten jamur pangan pelawan ialah 24.71% dari kandungan β-karoten wortel. Kandungan likopen pada tomat segar (59.87 µg/g bb) (Perkins-Veazie, 2006). Jika dibandingkan dengan tomat, maka jamur pangan pelawan memiliki kandungan likopen sebesar 10.59% dari kandungan likopen tomat. Jamur pangan pelawan yang dianalisis merupakan jamur yang telah mengalami proses pengeringan. Kandungan β-karoten dan likopen pada jamur diduga mengalami kerusakan selama proses pengeringan. Hal ini sesuai dengan Bechoff (2010), yang melaporkan bahwa proses pengeringan dapat menyebabkan kerusakan terhadap karotenoid seperti β-karoten dan likopen.
4.7.2
Kapasitas Antioksidan
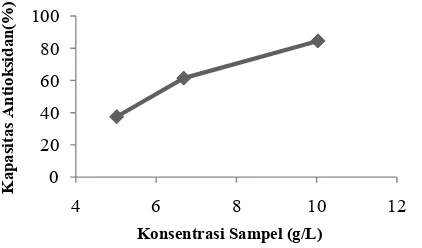
Analisis dengan metode 1,1-diphenyl-2-picrylhydrazyl (DPPH) sering digunakan untuk menentukan kapasitas antioksidan karena membutuhkan lebih sedikit waktu dibandingkan dengan metode lain. Kapasitas antioksidan pada analisis dengan metode DPPH ditunjukkan dengan terjadinya penurunan nilai absorbansi pada panjang gelombang 517 nm. Hal ini disebabkan oleh antioksidan mendonorkan atom hidrogen kepada DPPH
Komponen Antioksidan Kandungan
Total fenolik (mg GAE/g) 4.77
Antosianin (mg/100mg) ttd
β-karoten (µg/g) 15.37
27
sehingga terjadi aktivitas antioksidasi dan mengakibatkan terjadinya perubahan warna dari ungu menjadi kuning. Hasil analisis menunjukkan bahwa jamur pangan pelawan memiliki