IDENTIFIKASI KOMPONEN ANTIBAKTERI PADA
EKSTRAK BUAH TAKOKAK (
Solanum torvum
Swartz)
DENGAN KROMATOGRAFI LAPIS TIPIS
SKRIPSI
HILDA UTAMI ANWAR
F24080027
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
IDENTIFICATION OF ANTIBACTERIAL COMPOUNDS
FROM TURKEY BERRY
(Solanum torvum
Swartz) EXTRACTS
BY THIN-LAYER CHROMATOGRAPHY
Hilda Utami Anwar, Nuri Andarwulan, and Nancy Dewi Yuliana Department of Food Science and Technology, Faculty of Agricultural Technology, Bogor Agricultural University, IPB DarmagaCampus, PO BOX 220, Bogor, West Java,
Indonesia
Phone 0857 8260 5263, e-mail: hildautamianwar@ymail.com
ABSTRACT
Turkey berry (Solanum torvum Swartz) is one of medicinal plants and indigenous vegetables which grows abundantly in Indonesia. It has been known to have antibacterial activity againts some pathogen bacterias, including Bacillus cereus. The aim of this study is to determine turkey berry’s metabolites that have antibacterial activity by TLC method. The dried turkey berry was extracted by eight different combinations of methanol and water. These extracts were then divided into two parts: for antibacterial activity analysis and for TLC analysis. Extract with good antibacterial activity and showed more spots in TLC was further identified by two-dimentional TLC. The Rf score of this extract was also compared with reference compounds. F1 extract which was extracted by methanol:water (1:0) showed the highest diameter of inhibition. It also had more TLC spots than other extracts. F1 extract was then chosen to be identified by two-dimentional TLC. It showed 14 sub-spots which have maximum absorption at 200-400 nm. Some sub-spots of F1 extract also showed similar Rf score with reference compounds. Based on its TLC profile, F1 extract may contain saponin, gallic acid, quercetin, myricetin, kaempferol, and apigenin. However, since TLC has limited resolution, it is possible that F1 contains other flavonoids and phenolic acids that may also responsible for its antibacterial activity.
HILDA UTAMI ANWAR. F24080027. Identifikasi Komponen Antibakteri pada Ekstrak Buah Takokak (Solanum torvum Swartz) dengan Kromatografi Lapis Tipis. Di bawah bimbingan Nuri Andarwulan dan Nancy Dewi Yuliana. 2012.
RINGKASAN
Takokak merupakan salah satu tanaman obat indigenous Indonesia yang bagian buahnya sering dikonsumsi oleh masyarakat. Buah takokak telah diketahui memiliki aktivitas sebagai antibakteri. Aktivitas antibakteri dari suatu tanaman obat dapat bermanfaat sebagai pengawet alami, antibiotik alami, dan sebagai bahan baku obat (pharmaceutical). Penggunaan tanaman sebagai bahan baku obat dapat dilakukan dengan lebih baik apabila komponen aktif dari tanaman obat tersebut telah diketahui. Salah satu cara untuk mengidentifikasi komponen aktif dari suatu tanaman ialah dengan uji aktivitas dan pemisahan komponen dengan kromatografi lapis tipis.
Penelitian identifikasi komponen antibakteri dari buah takokak ini dilakukan melalui lima tahapan utama, yaitu persiapan sampel, ekstraksi bertingkat, uji aktivitas antibakteri, uji profil KLT, dan analisis data serta identifikasi komponen metabolit dari ekstrak terbaik. Pada penelitian ini buah takokak yang diperoleh dari Kampung Konservasi TOGA-Ciampea terlebih dahulu dikeringkan dan dibuat menjadi tepung buah takokak. Tepung buah takokak ini kemudian diekstrak secara bertingkat dengan delapan kombinasi pelarut metanol:air (1:0 (F1); 9.5:0.5 (F2); 9:1 (F3); 8.5:1.5 (F4); 8:2 (F5); 7:3 (F6); 6:4 (F7); 5:5 (F8)) sehingga dihasilkan delapan ekstrak buah takokak. Sebanyak delapan ekstrak buah takokak ini kemudian diuji aktivitas antibakteri terhadap bakteri Bacillus cereus dengan metode difusi sumur. Ekstrak F1 hingga F5 menghasilkan diameter penghambatan pada saat pengujian berdasarkan berat basah ekstrak dan pada pengujian berdasarkan berat kering ekstrak, ekstrak F1 hingga F5 menghasilkan diameter penghambatan masing-masing sebesar 7.1 mm, 5.5 mm, 5.6 mm, 5.6 mm, dan 3.4 mm. Ekstrak F1 yang menghasilkan diameter penghambatan terbesar memiliki nilai MIC sebesar 117.44 mg/ml dari hasil pengujian lanjut menggunakan metode macrodillution broth. Sebanyak delapan ekstrak buah takokak ini juga diuji profil KLT menggunakan berbagai fase gerak sehingga diketahui bahwa ekstrak F1 memiliki jumlah bercak yang lebih besar dan banyak dibanding ekstrak lainnya. Ekstrak F1 menghasilkan bercak terbanyak pada fase gerak kloroform:etil asetat (7:3) yaitu sebanyak 10 bercak. Bercak ini berwarna kehitaman pada penyinaran UV 254 nm dan berwarna merah, jingga, ungu, dan biru ketika disinari UV 366 nm. Penampakan bercak tersebut menunjukkan bahwa ekstrak buah takokak diduga mengandung komponen fenol dan flavonoid.
IDENTIFIKASI KOMPONEN ANTIBAKTERI PADA EKSTRAK BUAH TAKOKAK (Solanum torvum Swartz) DENGAN KROMATOGRAFI LAPIS TIPIS
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu dan Teknologi Pangan,
Fakultas Teknologi Pertanian, Institut Pertanian Bogor
Oleh
HILDA UTAMI ANWAR
F24080027
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Identifikasi Komponen Antibakteri pada Ekstrak Buah Takokak (Solanum torvum Swartz) dengan Kromatografi Lapis Tipis
Nama : Hilda Utami Anwar
NIM : F24080027
Menyetujui,
Tanggal ujian tugas akhir : 29 Januari 2013 Dosen Pembimbing I
Prof. Dr. Nuri Andarwulan, M.Si NIP 19630701 198811 2 001
Dosen Pembimbing II
Dr. Nancy Dewi Yuliana, S.TP, M.Sc NIP 19700127 200501 2 001
Mengetahui,
Kepala Departemen Ilmu dan Teknologi Pangan
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul Identifikasi Komponen Antibakteri pada Ekstrak Buah Takokak (Solanum torvum Swartz) dengan Kromatografi Lapis Tipis adalah hasil karya saya sendiri dengan arahan Dosen Pembimbing Akademik, dan belum diajukan dalam bentuk apapun pada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi.
Bogor, Januari 2013 Yang membuat pernyataaan,
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari
BIODATA PENULIS
Hilda Utami Anwar. Penulis lahir di Bogor, 31 Juli 1990 dan merupakan anak pertama dari empat bersaudara, dari pasangan Musahar Anwar dan Jubaedah. Pendidikan formal ditempuh penulis di RA. Assa’adah (1995-1996), SD Negeri 1 Ciawi (1996-2002), SMP Negeri 1 Ciawi (2001-2005), dan SMA Negeri 3 Bogor (2005-2008). Penulis melanjutkan pendidikan tingginya di Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB).
Sejak tahun 2008 hingga menamatkan kuliah, penulis memperoleh beasiswa Peningkatan Prestasi Akademik (2008 – 2009) dan beasiswa Tanoto Foundation (2009 – 2012). Selama mengikuti perkuliahan, penulis aktif di berbagai kegiatan termasuk menjadi asisten mata kuliah Sosiologi Umum dan asisten praktikum Pengantar Kimia dan Biokimia Pangan pada tahun 2010 – 2011. Penulis juga aktif di kegiatan organisasi yakni menjadi Reporter Koran Kampus pada tahun 2009, sebagai Sekretaris Divisi Internal Himpunan Mahasiswa Ilmu dan Teknologi Pangan tahun 2010, dan aktif di berbagai kepanitiaan acara antara lain sebagai Divisi Sponsorship HACCP VIII Himitepa (2010), Tim Soal Food Bowl Quiz (2011), dan Ketua Buku Kenangan ITP angkatan 45 (2012).
Pada tahun 2011, penulis menjadi Finalis IPB Business Competition tingkat Nasional dan Sepuluh Besar peserta DSDC-IFT tingkat Departemen. Selanjutnya pada tahun 2012, penulis mendapat peringkat 12 dalam perlombaan DSDC-IFT tingkat Internasional. Penulis juga menjadi Finalis Product Development of Natural Colorant Competitionby DD Williamson pada tahun 2012.
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan tugas akhir ini dengan baik. Shalawat serta salam semoga selalu tercurah kepada Nabi Muhammad SAW beserta keluarga, para sahabat, dan umatnya hingga akhir zaman. Penulis menyelesaikan tugas akhir dengan judul Identifikasi Komponen Antibakteri pada Ekstrak Buah Takokak (Solanum torvum Sw) dengan Kromatografi Lapis Tipis di laboratorium Kimia Pangan ITP dan laboratorium mikrobiologi Seafast Center, sejak bulan April hingga Desember 2012.
Berbagai pihak telah terlibat dalam pelaksanaan penelitian hingga tersusunnya skripsi ini. Berkaitan dengan hal tersebut penulis ingin menyampaikan penghargaan dan ucapan terima kasih yang sebesar-besarnya kepada :
1. Kedua orang tua, Hadiyansyah, Mahdaniar dan Najwa serta keluarga besar dari pihak orang tua atas do’a dan dukungan yang selalu diberikan kepada penulis.
2. Prof. Dr. Nuri Andarwulan, M.Sc sebagai dosen pembimbing utama yang dengan penuh kesabaran membimbing dan memberikan saran dalam pelaksanaan penelitian.
3. Dr. Ir. Nancy Dewi Yuliana, S.TP, M.Si sebagai dosen pembimbing yang telah memberikan dukungan kepada penulis serta masukan dan saran dalam pelaksanaan penelitian ini.
4. Dias Indrasti, S.TP, M.Sc sebagai dosen penguji yang telah meluangkan waktunya dan memberikan masukan untuk perbaikan skripsi ini.
5. Teman-teman satu bimbingan: Elva Hasna, Harum Fadhillatunnur dan Atikah Bararah.
6. Resi Sindhu Nur Zain, Raudhatussa’adah, Hafiz Fakhrurrozy, Andika BP, Citra Ayu serta teman-teman ITP 45 lainnya yang telah memberikan dukungan selama penulis melakukan studi di Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian.
7. Teman-teman satu penelitian antibakteri: Rista, Ardy, Andi Faisal serta teman-teman SNSG: Sarah, Qamariyah, Yani, dan Sam.
8. Teman sepermainan Tika Nurmalasari, M Nassa, Angga, dan Oze. 9. Teman-teman kost Harmoni 1 dan Rusunawa lantai 4.
10. Seluruh staf Laboran Departemen ITP dan Seafast Center serta PAU. 11. Semua pihak yang telah membantu dan tidak bisa disebutkan satu persatu.
Penulis tetap menyadari bahwa dalam penyusunan skripsi masih banyak kekurangannya namun penulis tetap berharap semoga tulisan ini bermanfaat dan memberikan kontribusi yang nyata terhadap perkembangan ilmu pengetahuan di bidang ilmu dan teknologi pangan.
Bogor, Januari 2013
DAFTAR ISI
KATA PENGANTAR ... iii
DAFTAR ISI ... iv
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
I. PENDAHULUAN ... 1
A. LATAR BELAKANG... 1
B. TUJUAN ... 2
C. MANFAAT ... 2
II. TINJAUAN PUSTAKA ... 3
A. TAKOKAK (Solanum torvum Swartz) ... 3
B. SENYAWA METABOLIT SEKUNDER BUAH TAKOKAK ... 4
C. KOMPONEN ANTIBAKTERI ALAMI ... 5
D. PENGUJIAN AKTIVITAS ANTIBAKTERI... 7
E. BAKTERI PATOGEN ... 8
F. EKSTRAKSI ... 9
G. KROMATOGRAFI LAPIS TIPIS ... 10
III.METODOLOGI PENELITIAN ... 12
A. BAHAN DAN ALAT ... 12
B. METODE PENELITIAN ... 12
IV.HASIL DAN PEMBAHASAN ... 22
A. KARAKTERISTIK SAMPEL BUAH TAKOKAK ... 22
B. EKSTRAKSI BERTINGKAT BUAH TAKOKAK ... 24
C. AKTIVITAS ANTIBAKTERI EKSTRAK BUAH TAKOKAK... 26
D. PROFIL KLT EKSTRAK BUAH TAKOKAK ... 36
E. IDENTIFIKASI KOMPONEN ANTIBAKTERI EKSTRAK TERPILIH ... 42
V. SIMPULAN DAN SARAN ... 50
A. SIMPULAN... 50
B. SARAN ... 50
DAFTAR PUSTAKA ... 51
DAFTAR TABEL
Tabel 1. Aktivitas antibakteri tanaman takokak ... 4
Tabel 2. Komposisi kimia buah takokak ... 4
Tabel 3. Hasil analisis kualitatif buah takokak ... 5
Tabel 4. Kelebihan dan kelemahan beberapa metode ekstraksi ... 9
Tabel 5. Kombinasi pelarut untuk ekstraksi ... 15
Tabel 6. Pembuatan larutan ekstrak untuk uji nilai MIC ... 18
Tabel 7. Hasil ekstraksi bertingkat menggunakan kombinasi pelarut terpilih ... 25
Tabel 8. Hasil uji difusi sumur ekstrak terpilih berdasarkan berak kering ekstrak ... 29
Tabel 9. Perbandingan hasil aktivitas bakteri penelitian dan referensi... 32
Tabel 10. Hasil visualisasi fraksi ekstrak F1 dan dugaan komponen metabolit berdasarkan penampakan warna yang dihasilkan ... 45
Tabel 11. Hasil uji sifat spektral dan dugaan komponen metabolit berdasarkan referensi ... 46
DAFTAR GAMBAR
Gambar 1. Tanaman takokak ... 3
Gambar 2. Struktur beberapa senyawa antibakteri dari tanaman ... 7
Gambar 3. Struktur kimia kloramfenikol ... 8
Gambar 4. Bacillus cereus ... 9
Gambar 5. Ilustrasi pemisahan senyawa dengan KLT ... 10
Gambar 6. Ilustrasi penentuan nilai Rf ... 11
Gambar 7. Diagram alir tahapan penelitian ... 12
Gambar 8. Diagram alir tahapan pengeringan dengan metode freeze dry... 13
Gambar 9. Diagram alir ekstraksi bertingkat ... 15
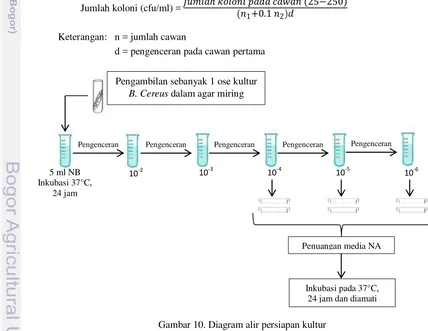
Gambar 10. Diagram alir persiapan kultur ... 16
Gambar 11. Diagram alir uji aktivitas antibakteri metode difusi sumur ... 17
Gambar 12. Diagram alir penentuan nilai MIC metode macrodilution ... 19
Gambar 13. Ilustrasi pemisahan dengan KLT dua dimensi ... 20
Gambar 14. Tepung buah takokak hasil pengeringan beku ... 23
Gambar 15. Filtrat buah takokak dan ekstrak hasil ekstraksi bertingkat ... 25
Gambar 16. Hasil pewarnaan gram bakteri Bacillus cereus ... 26
Gambar 17. Histogram hasil pengujian aktivitas antibakteri ekstrak buah takokak ... 28
Gambar 18. Struktur buah takokak dan biji buah takokak ... 33
Gambar 19. Kurva penghambatan ekstrak F1 terhadap bakteri Bacillus cereus ... 36
Gambar 20. Kromatogram dan visualisasi hasil pemisahan KLT ekstrak buah takokak pada fase gerak kloroform:metanol ... 38
Gambar 21. Kromatogram hasil pemisahan KLT ekstrak buah takokak hasil terpilih ... 39
Gambar 22. Kromatogram dan visualisasi hasil pemisahan KLT ekstrak F1 pada berbagai fase gerak ... 40
Gambar 24. Kromatogram dan visualisasi hasil pemisahan KLT dua dimensi ekstrak F1 ... 43
Gambar 25. Kromatogram hasil pemisahan KLT ekstrak F1 dan komponen metabolit standar ... 47
DAFTAR LAMPIRAN
Lampiran 1a. Kadar air buah takokak segar ... 56
Lampiran 1b. Kadar air tepung buah takokak ... 56
Lampiran 2. Total fenol tepung buah takokak ... 57
Lampiran 3. Contoh perhitungan total fenol tepung buah takokak ... 58
Lampiran 4. Rekapitualasi nilai rendemen ekstrak hasil ekstraksi bertingkat ... 59
Lampiran 5. Jumlah kultur awal Bacillus cereus ... 60
Lampiran 6. Hasil uji difusi sumur ekstrak hasil ekstraksi bertingkat... 61
Lampiran 7. Hasil uji aktivitas antibakteri metode difusi sumur pada pelarut ekstrak ... 62
Lampiran 8. Kadar air ekstrak terpilih ... 63
Lampiran 9. Lanjutan hasil kadar air ekstrak terpilih... 64
Lampiran 10. Hasil uji difusi sumur ekstrak terpilih ... 65
Lampiran 11. Hasil uji MIC ekstrak F1 ulangan pertama ... 66
Lampiran 12. Hasil uji MIC ekstrak F1 ulangan kedua ... 67
Lampiran 13. Hasil pengujian nilai MIC ekstrak F1 ... 68
Lampiran 14. Hasil ANOVA uji aktivitas antibakteri dengan metode difusi sumur ... 69
Lampiran 15. Uji Lanjut Duncan uji aktivitas antibakteri dengan metode difusi sumur ... 70
Lampiran 16. Total fenol ekstrak metanol tepung buah takokak ... 71
Lampiran 17. Referensi dugaan komponen metabolit berdasarkan penampakan bercak ... 72
Lampiran 18. Hasil uji sifat spektral fraksi ekstrak F1 fraksi 1 ... 73
Lampiran 19. Hasil uji sifat spektral fraksi ekstrak F1 fraksi 2 ... 74
Lampiran 20. Hasil uji sifat spektral fraksi ekstrak F1 fraksi 3 ... 75
Lampiran 21. Hasil uji sifat spektral fraksi ekstrak F1 fraksi 4 ... 76
Lampiran 22. Hasil uji sifat spektral fraksi ekstrak F1 fraksi 5 ... 77
Lampiran 23. Hasil uji sifat spektral fraksi ekstrak F1 fraksi 6 ... 78
Lampiran 24. Hasil uji sifat spektral fraksi ekstrak F1 fraksi 7 ... 79
Lampiran 25. Hasil uji sifat spektral fraksi ekstrak F1 fraksi 8 ... 80
Lampiran 26. Hasil uji sifat spektral fraksi ekstrak F1 fraksi 9 ... 81
Lampiran 27. Hasil uji sifat spektral fraksi ekstrak F1 fraksi 10 ... 82
Lampiran 28. Hasil uji sifat spektral fraksi ekstrak F1 fraksi 11 ... 83
Lampiran 29. Hasil uji sifat spektral fraksi ekstrak F1 fraksi 12 ... 84
Lampiran 30. Hasil uji sifat spektral fraksi ekstrak F1 fraksi 13 ... 85
Lampiran 31. Hasil uji sifat spektral fraksi ekstrak F1 fraksi 14 ... 86
I.
PENDAHULUAN
A.
LATAR BELAKANG
Indonesia memiliki keanekaragaman hayati yang melimpah termasuk di dalamnya berbagai jenis flora yang khas dari tiap daerah. Data Depkes RI (2007) menyebutkan bahwa terdapat sebanyak 30.000 jenis tanaman dan kurang lebih 7.500 jenis diantaranya termasuk tanaman berkhasiat obat yang tersebar di wilayah Indonesia. Jumlah tanaman obat yang digunakan secara rutin dalam industri obat tradisional baru sekitar 300 jenis (BPOM 2011). Salah satu tanaman obat yang juga merupakan sayuran indigenous di Indonesia adalah takokak.
Takokak merupakan tanaman obat tradisional untuk pengobatan penyakit lambung, pinggang kaku, batuk kronis, koreng, jantung, dan menurunkan tekanan darah tinggi (Sirait 2009). Buah takokak merupakan buah yang sering dikonsumsi oleh masyarakat di daerah Jawa Barat sebagai lalapan juga sering dikonsumsi sebagai sayuran dengan santan di daerah Sumatera. Selain dapat digunakan sebagai tanaman obat, takokak diketahui memiliki aktivitas antibakteri (Bari et al. 2010; Gupta dan Tripathi 2011; Sivapriya et al. 2011). Menurut Tajkarimi et al. (2010) selain berfungsi sebagai pengawet pada makanan, antibakteri dari tanaman juga dapat berfungsi untuk mencegah atau menghambat pertumbuhan mikroorganisme termasuk bakteri patogen.
Bakteri patogen merupakan bakteri yang menyebabkan kasus keracunan makanan yang masih menjadi masalah di berbagai negara, termasuk di Indonesia. Data Sentra Informasi Keracunan Nasional (2012) menunjukkan bahwa insiden keracunan akibat makanan merupakan insiden terbanyak pada tahun 2010. Salah satu bakteri yang diduga banyak ditemukan di Indonesia adalah Bacillus cereus. Bakteri ini merupakan bakteri intoksikasi yang banyak ditemukan pada nasi yang disimpan pada suhu ruang (Gibbs 2003).
Beberapa penelitian mengenai aktivitas antibakteri takokak terhadap Bacillus cereus telah dilakukan (Bari et al. 2010; Sivapriya et al. 2011). Namun dari penelitian yang telah dilakukan tersebut masih belum ada informasi mengenai komponen dari takokak yang berperan sebagai antibakteri, padahal dengan mengetahui komponen yang paling berperan terhadap aktivitas antibakteri tersebut dapat dilakukan pemurnian. Pemurnian dapat memudahkan pembuatan obat-obatan dari tanaman obat sehingga bermanfaat sebagai pharmaceutical atau suplemen kesehatan (Tajkamiri et al. 2010). Untuk mengidentifikasi komponen dari buah takokak yang berperan terhadap aktivitas antibakteri, diperlukan tahapan ekstraksi terlebih dahulu. Ekstraksi yang optimal harus menggunakan pelarut yang sesuai dengan polaritas metabolit yang terdapat pada sampel. Pemilihan pelarut ini dapat dilakukan dengan teknik kromatografi lapis tipis (KLT). KLT dapat memberikan informasi mengenai komponen dari suatu ekstrak, baik secara kualitatif maupun preparatif. Penggunaan KLT didasarkan pada sifatnya yang sederhana, cepat, dan mudah dilakukan (Cserhati dan Forgacs 1999). Selain itu, KLT lebih efisien untuk digunakan karena resiko yang ada lebih sedikit dibandingkan kromatografi cair – tekanan tinggi atau kromatografi gas. Resiko tersebut meliputi prosedur yang lebih sederhana dan mudah serta pemilihan pelarut yang lebih beragam sehingga biaya dalam penggunaan teknik KLT ini relatif lebih murah.
penentuan komponen dari ekstrak buah takokak yang berperan sebagai antibakteri. Penelitian mengenai jenis komponen ekstrak buah takokak yang berperan sebagai antibakteri masih belum banyak diteliti. Salah satu penelitian tentang komponen antibakteri pada takokak adalah hasil penelitian Sivapriya et al. (2011) yang menunjukkan bahwa jumlah komponen polifenol dan flavonoid berkorelasi erat dengan aktivitas antibakteri pada ekstrak buah takokak. Oleh karena itu, pada penelitian ini dilakukan analisis total fenol untuk mengetahui kandungan fenol yang terdapat pada ekstrak buah takokak. Walaupun demikian, komponen antibakteri lainnya yang mungkin berperan belum diketahui, oleh karena itu penelitian ini menjadi menarik untuk dilakukan. Penelitian ini juga dapat menjadi penelitian pendahuluan bagi identifikasi komponen antibakteri yang lebih komprehensif dan isolasi komponen dari ekstrak buah takokak.
B.
TUJUAN
Tujuan umum dari penelitian ini adalah untuk mengidentifikasi komponen yang berperan terhadap aktivitas antibakteri dari ekstrak buah takokak dengan menggunakan teknik KLT. Adapun tujuan khusus dari penelitian ini, yaitu:
1. Mendapatkan ekstrak buah takokak hasil ekstraksi bertingkat yang menggunakan pelarut dengan polaritas berbeda-beda,
2. Memperoleh profil aktivitas antibakteri dari semua ekstrak buah takokak yang dihasilkan dari ekstraksi bertingkat,
3. Memperoleh profil KLT semua ekstrak buah takokak yang dihasilkan dari ekstraksi bertingkat,
4. Mengidentifikasi fraksi KLT ekstrak buah takokak yang memiliki aktivitas antibakteri terbaik.
C.
MANFAAT
II. TINJAUAN PUSTAKA
A.
TAKOKAK (
Solanum torvum
Swartz)
Takokak berasal dari kepulauan Antilles, dan penyebaran tumbuhnya sampai ke negara-negara tropika termasuk Indonesia. Tanaman ini tumbuh di daerah Sumatera, Jawa, dan sampai di dataran rendah hingga 1 – 1.600 meter di atas permukaan laut. Takokak merupakan nama yang dikenal di daerah Jawa Barat, sedangkan nama umum tanaman ini adalah terong cepoka. Di daerah lain seperti Sumatera, tanaman ini dikenal dengan sebutan terong pipit atau terong rimbang (Sirait 2009). Klasifikasi tanaman takokak berdasarkan data yang diperoleh dari USDA adalah sebagai berikut:
Tanaman takokak merupakan salah satu tanaman obat tradisional untuk pengobatan penyakit lambung, pinggang kaku, batuk kronis, koreng, jantung, dan menurunkan tekanan darah tinggi (Sirait 2009). Bagian tanaman yang digunakan sebagai obat adalah akar, daun, dan buah. Tanaman ini termasuk tanaman perdu yang tumbuh tegak, tinggi tanaman sekitar 3 m. Batang bulat, berkayu, bercabang, berduri jarang, dan percabangan simpodial berwarna putih kotor. Daun tunggal, berwarna hijau, tersebar, berbentuk bulat telur, tepi rata, ujung meruncing, dan panjang sekitar 27- 30 cm dan lebar 20 – 24 cm, pertulangan menyirip dan ibu tulang berduri. Buah berbentuk buni dan bulat, apabila masih muda berwarna hijau setelah tua berwarna jingga. Buah berbiji pipih, kecil, licin, berwarna kuning pucat, berakar tunggang, dan berwarna kuning pucat. Buah pertama takokak dapat dipanen setelah tanaman berumur sekitar 3 – 4 bulan dari waktu tanam, buah yang dipetik biasanya adalah buah yang hampir tua (Sirait 2009).
Hasil beberapa penelitian menyebutkan bahwa takokak memiliki aktivitas antimikroba yang cukup baik. Sivapriya et al. (2011) menunjukkan bahwa jumlah kandungan metabolit, seperti polifenol dan flavonoid pada ekstrak kulit buah takokak, berkaitan erat dengan efektivitas penghambatan bakteri. Gupta dan Tripathi (2011) telah melakukan penelitian dan menunjukkan bahwa daun takokak memiliki aktivitas toksik terhadap kapang patogen yaitu Fusarium sacchari. Penelitian lain menunjukkan bahwa ekstrak metanolik takokak memiliki aktivitas antibakteri yang baik terhadap bakteri-bakteri patogen seperti yang ditunjukkan pada Tabel 1. Pada Tabel 1 terlihat bahwa tanaman takokak terutama bagian kulit buah dan akar memiliki aktivitas antibakteri yang baik dengan nilai diameter penghambatan >20 mm. Dari hasil beberapa penelitian tersebut juga dapat diketahui bahwa aktivitas antibakteri dari tanaman takokak lebih efektif terhadap bakteri gram positif dibandingkan bakteri gram negatif. Walaupun penelitian mengenai aktivitas antibakteri pada tanaman takokak telah banyak dilakukan, namun hingga saat
Kingdom Plantae– Plants
Subkingdom Tracheobionta– Vascular plants Superdivision Spermatophyta– Seed plants Division Magnoliophyta– Flowering plants Class Magnoliopsida– Dicotyledons Subclass Asteridae
Order Solanales
Family Solanaceae– Potato family Genus Solanum L. – nightshade
Species Solanumtorvum Sw. – turkey berry
ini penelitian yang dilakukan untuk mengetahui komponen yang berperan sebagai antibakteri dari ekstrak buah takokak belum banyak dilakukan.
Tabel 1. Aktivitas antibakteri tanaman takokak
Bagian tanaman takokak yang digunakan Pelarut ekstrak Metode pengujian
Nilai diameter penghambatan (mm)
Referensi
Gram + Gram -
B ac il lu s su bt il is B ac il lu s ce re u s S taph yl oc o cc u s au re u s E sc h er ic h ia col i S al m on el la ty ph ii P se u d om on as ae ru g in o sa
Daun Air Difusi cakram 13 - - 10 - - Gupta dan
Tripathi (2011)
Daun Metanol Difusi cakram 0 0 19 0 16 0 Bari et al.
(2010)
Batang Metanol Difusi cakram 0 19 19 0 20 0 Bari et al.
(2010)
Buah Metanol 80% Difusi cakram 16 - 22 0 0 17 Chah et al.
(2000)
Kulit buah Etanol 50% Difusi sumur 21 - 18 18 17 18 Sivapriya et al.
(2011)
Akar Metanol Difusi cakram 21 22 22 0 21 0 Bari et al.
(2010) Keterangan: 0 = tidak menunjukkan diameter penghambatan; - = tidak diujikan
B.
SENYAWA METABOLIT SEKUNDER BUAH TAKOKAK
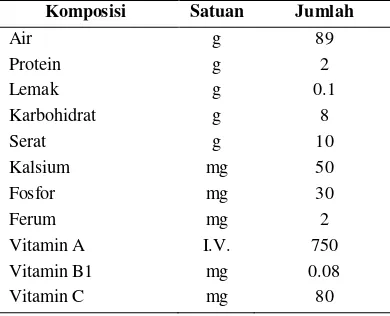
Senyawa metabolit sekunder merupakan senyawa yang dihasilkan oleh suatu organisme namun bukan komponen yang harus tersedia bagi kelangsungan hidup organisme tersebut, tidak seperti senyawa makronutrien (protein, karbohidrat, asam nukleat) yang merupakan komponen dasar bagi proses kehidupan suatu organisme (Cannell 1998). Komposisi kimia menyangkut senyawa makronutrien dan beberapa mikronutrien buah takokak telah diteliti oleh Sirait (2009) seperti yang tertera pada Tabel 2. Selain komponen dasar tersebut, buah takokak yang merupakan tanaman obat juga mengandung senyawa metabolit sekunder. Pada umumnya, senyawa metabolit sekunder ini dihasilkan sebagai respon terhadap beberapa keadaan khusus seperti krisis nutrisi atau sebagai bentuk pertahanan diri dan sebagai bentuk regulator molekul (Cannell 1998).
Tabel 2. Komposisi kimia buah takokak
Komposisi Satuan Jumlah
Air g 89
Protein g 2
Lemak g 0.1
Karbohidrat g 8
Serat g 10
Kalsium mg 50
Fosfor mg 30
Ferum mg 2
Vitamin A I.V. 750
Vitamin B1 mg 0.08
Vitamin C mg 80
Senyawa aromatik merupakan salah satu senyawa metabolit yang sering ditemukan dalam tanaman obat, termasuk takokak. Komponen fenol dan flavonoid merupakan bagian dari senyawa aromatik yang terkandung dalam buah takokak. Kandungan fenol pada takokak adalah sebanyak 92.9109 mg/100 g sampel segar dan 860.2860 mg/100 g sampel kering (Sirait 2009). Berdasarkan hasil penelitian Andarwulan et al. (2012), takokak mengandung total fenol sebesar 153.92 mg asam galat/100 g berat buah segar dan total antosianin sebesar 4.44 mg/100 g berat buah segar. Selain itu, takokak juga diketahui mengandung beberapa komponen asam fenolat yakni asam klorogenat sebesar 33.14 mg/100 g berat buah segar, 2.56 mg/100 g berat buah segar asam kafeat, dan 0.32 mg/100 g berat buah segar asam ferulat. Buah takokak juga diketahui mengandung flavonoid seperti myricetin sebesar 2.30 mg/100 g berat buah segar dan quercetin sebesar 0.66 mg/100 g berat buah segar.
Selain komponen aromatik, takokak juga mengandung senyawa metabolit lain yakni alkaloid. Takokak mengandung total alkaloid sebesar 0.12% (bk) dan mengandung beberapa komponen alkaloid seperti glikoalkaloid (0.039%), solasonin (12%), dan solamargin (7.8%). Komponen alkaloid yang terkandung dalam takokak tersebut dapat digunakan sebagai substrat dalam memproduksi steroid untuk kebutuhan farmakologi (Perez-amador et al. 2007). Selain analisis kuantitatif seperti yang telah disebutkan sebelumnya, analisis kualitatif komponen metabolit buah takokak juga telah dilakukan. Hasil analisis kualitatif komponen metabolit takokak yang diekstrak dengan berbagai pelarut dapat dilihat pada Tabel 3.
Tabel 3. Hasil analisis kualitatif buah takokak Komponen
Metabolit
Pelarut Ekstrak
Metanol Etil asetat Kloroform Air Petroleum eter Heksan
Alkaloid + - - + + +
Flavonoid + - - + + +
Tannin + + - + - -
Saponin + - - + + +
Steroid - + + - + -
Terpenoid - + - - + +
Referensi Arif dan Fareed (2011) Kannan et al.
(2012)
Kusuma (2012)
C.
KOMPONEN ANTIBAKTERI ALAMI
Sebanyak 12.000 senyawa metabolit telah berhasil ditemukan dalam tanaman, setidaknya 10% diantaranya merupakan bahan utama dari pembuatan obat. Senyawa metabolit ini diproduksi sebagai salah satu bentuk pertahanan tanaman terhadap berbagai ancaman seperti mikroorganisme, serangga, dan herbivora (Cowan 1999). Beberapa struktur komponen metabolit dari tanaman dapat dilihat pada Gambar 2. Komponen metabolit dari tanaman berpotensi sebagai bahan pengembangan obat-obatan. Salah satu pengembangan obat-obatan dari tanaman adalah sebagai antibiotik (Verpoorte 2000). Aktivitas antibiotik dari komponen metabolit tanaman tidak terlepas dari aktivitas komponen tersebut sebagai antibakteri. Beberapa komponen metabolit yang telah diketahui memiliki aktivitas sebagai antibakteri adalah sebagai berikut.
1. Senyawa Fenolik
banyak terdapat di vakuola sel dan bersifat larut air karena umumnya senyawa ini berikatan dengan gugus gula seperti glukosida. (Harborne 1973). Senyawa fenol sederhana, asam fenolat, dan flavonoid merupakan senyawa fenolik yang diketahui memiliki aktivitas antimikroba (Cowan 1999; Ncube et al. 2008).
a. Senyawa fenol sederhana dan asam fenolat
Asam fenolat dan senyawa fenol sederhana sering dianalisis secara bersamaan dalam penelitian menggunakan tanaman (Harborne 1973). Letak dan jumlah gugus hidroksil dari senyawa fenol berhubungan erat dengan toksisitasnya terhadap mikroorganisme, semakin banyak gugus hidroksil maka semakin meningkat kemampuan toksisitasnya (Geismann (1963) dalam Cowan 1999). Salah satu senyawa fenol sederhana yakni katekol diketahui memiliki aktivitas sebagai antimikroba. Mekanisme senyawa fenol sederhana sebagai antimikroba diantaranya dengan menghambat reaksi enzimatis, berikatan dengan dinding sel bakteri, dan dengan merusak membran (Cowan 1999; Tiwari et al. 2011).
b. Flavonoid
Flavonoid merupakan senyawa fenolik yang terbentuk sebagai C6-C3 yang diikatkan oleh sebuah senyawa aromatik. Senyawa flavonoid disintesis dalam tanaman sebagai respon terhadap infeksi mikroba oleh karena itu tidak mengejutkan apabila berdasarkan penelitian secara in vitro senyawa ini efektif sebagai antimikroba (Cowan 1999; Gould dan Lyster 2006). Jenis flavonoid tertentu seperti katekin, myricetin, quercetin telah diketahui memiliki aktivitas sebagai antibakteri. Salah satu mekanisme antibakteri dari senyawa flavonoid, yaitu quercetin, adalah dengan menghambat sintesis asam nukleat. Quercetin dapat menghambat aktivitas dari enzim DNA gyrase dari bakteri E. coli dengan berikatan dengan GyrB sehingga menghambat aktivitas enzim ATPase (Cushnie dan Lamb 2005).
2. Alkaloid
Alkaloid merupakan salah satu komponen metabolit yang telah digunakan sebagai bahan baku obat-obatan. Alkaloid telah diteliti memiliki efek farmakologi termasuk bersifat sitotoksik dan sebagai antiprotozoa, namun masih sedikit yang meneliti tentang aktivitas alkaloid sebagai antibakteri (Karou2et al. 2005). Alkaloid merupakan senyawa siklik yang mengandung satu atau dua atom nitrogen yang biasanya merupakan bagian dari struktur siklik tersebut. Jenis alkaloid yang umum ditemukan dalam tanaman famili Solanaceae, yang merupakan famili dari buah takokak khususnya adalah solanine, atropin, dan nikotin (Harborne 1973). Salah satu jenis alkaloid yang diketahui sebagai antimikroba adalah berberine. Berberine diduga berpotensi melawan beberapa mikroorganisme seperti plasmodia dan tripanosoma. Mekanisme dari komponen ini berhubungan erat dengan kemampuannya sebagai DNA intercalator (Cowan 1999; Karou2 et al. 2005). DNA intercalator adalah senyawa yang dapat berikatan pada struktur DNA sehingga DNA yang seharusnya berbentuk heliks berubah menjadi tidak beraturan.
3. Terpenoid
Gambar 2. Struktur beberapa senyawa antibakteri dari tanaman
C10H16 dan berada dalam bentuk diterpen (C20), triterpen (C30), tetraterpen (C40), hemiterpen (C5), dan sesquiterpen (C15). Ketika komponen tersebut mengandung oksigen maka kelompok ini didefinisikan sebagai terpenoid (Cowan 1999). Terpenoid merupakan komponen yang berperan terhadap aroma dan kandungan minyak esensial dari suatu tanaman (Brielmann et al. 2006). Salah satu triterpen glikosida yang memiliki berat molekul tinggi adalah saponin. Ekstrak saponin dari tanaman Anabasis artadulata diketahui memiliki aktivitas antibakteri yang baik terhadap bakteri Escherichia coli ATCC 25922, Staphylococcus aureus ATCC 6538, Klebsiella pneumonia, Bacillus subtilis ATCC 6633, dan Pseudomonas aeruginosa ATCC 14028. Aktivitas antibakteri dari saponin ini lebih baik dibandingkan dengan ekstrak alkaloid dari tanaman yang sama (Maatalah et al. 2012).
D.
PENGUJIAN AKTIVITAS ANTIBAKTERI
Antibakteri merupakan senyawa yang dapat menghambat pertumbuhan dan aktivitas bakteri. Aktivitas antibakteri dapat berasal baik dari tanaman maupun hewan. Aktivitas antibakteri ini dapat berperan sebagai pengawet alami bagi makanan maupun sebagai antibiotik dan obat-obatan alami (Tajkarimi et al. 2010). Untuk mengetahui nilai aktivitas dari suatu senyawa antibakteri, dapat digunakan beberapa metode, seperti metode difusi sumur, dilusi agar, dan spiral plating. Pada penelitian ini, metode yang digunakan adalah metode difusi sumur karena metode ini lebih sederhana, mudah dilakukan juga sering digunakan dalam analisis aktivitas antibakteri sehingga tidak asing lagi untuk dilakukan (Parish dan Davidson 1993).
Pada metode difusi sumur, aktivitas antimikroba ditunjukkan dengan munculnya zona bening di sekitar areal sumur. Zona bening tersebut memiliki nilai diameter yang menunjukkan aktivitas penghambatan dari senyawa yang diujikan dan dikenal sebagai nilai DIZ (diameter of inhibiton zone). Menurut Sadgic et al. (2005), sampel uji yang menghasilkan diameter penghambatan lebih besar dari 20 mm maka dapat dikategorikan sebagai senyawa antibakteri yang kuat, dikategorikan sedang jika diameter penghambatan yang dihasilkan 16 - 20 mm, dikategorikan tipis jika 10 – 15 mm, dan lemah jika diameter penghambatan yang dihasilkan 6 – 9 mm. Analisis aktivitas antibakteri dengan difusi sumur merupakan analisis secara kualitatif. Pada umumnya, analisis aktivitas antibakteri juga dilakukan dengan kuantitatif sehingga didapatkan nilai MIC(minimum inhibitory concentration). Analisis secara kuantitatif dilakukan untuk menunjukkan aktivitas antibakteri suatu sampel secara lebih lengkap (Parish dan Davidson 1993).
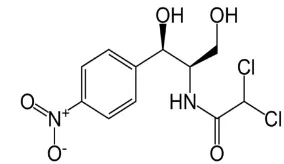
Gambar 3. Struktur kimia kloramfenikol (Anonim1 2012)
tahapan awal untuk mengevaluasi potensi sebagai antibakteri dari suatu senyawa baru (Wiegand et al. 2008). Metode agar dilution dan broth dilution adalah metode yang paling umum digunakan dalam menentukan nilai MIC. Pada metode agar dilution pengujian dilakukan dengan menginokulasikan sejumlah bakteri dengan jumlah tertentu ke permukaan agar yang telah berisi senyawa uji dengan konsentrasi tertentu. Brothdilution menggunakan media pertumbuhan dalam bentuk cairan yang telah berisi senyawa uji dengan konsentrasi tertentu yang selanjutnya diinokulasikan dengan bakteri uji. Nilai MIC ditunjukkan oleh konsentrasi senyawa uji terendah yang menurunkan jumlah bakteri secara signifikan yakni > 90% (Cosentino et al. 1999). Walaupun bersifat kuantitatif, seperti halnya difusi sumur, MIC tidak dapat menunjukkan suatu senyawa uji tersebut bersifat bakterisidal ataupun bakteriostatik.
Dalam setiap pengujian aktivitas antibakteri biasanya kontrol negatif dan kontrol positif sebagai pembanding (Gracelin et al. 2011). Kontrol negatif pada penelitian ini adalah DMSO (dimethyl sulfoxide) karena DMSO digunakan untuk melarutkan ekstrak dalam pengujian aktivitas antibakteri. Kontrol positif yang digunakan dalam penelitian ini adalah antibiotik komersial yaitu kloramfenikol. Kloramfenikol merupakan salah satu antibiotik bakterisidal yang efektif menghambat pertumbuhan bakteri Bacillus cereus (Bottone 2010). Struktur kimia kloramfenikol dapat dilihat pada Gambar 3.
E.
BAKTERI PATOGEN:
Bacillus cereus
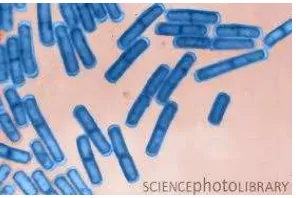
Bakteri patogen merupakan penyebab utama dari kasus keracunan pangan yang masih menjadi masalah serius di berbagai negara. Salah satu bakteri patogen yang sering ditemukan dalam nasi yang makanan pokok masyarakat Indonesia, adalah Bacillus cereus. Bacillus cereus merupakan bakteri gram positif berbentuk batang yang dapat bersifat aerob atau fakultatif anaerob, motil, dan dapat membentuk spora apabila terdapat terdapat oksigen. Bakteri ini termasuk ke dalam golongan bakteri yang berukuran besar yakni lebih dari 0.9µm. Gambar bakteri Bacillus cereus dapat dilihat pada Gambar 4. Resistensi spora Bacillus spp. dalam menghadapi perubahan lingkungan dan kemampuan memproduksi beberapa enzim pengurai makanan, membuat bakteri ini dapat dengan mudah bertahan dan tumbuh dalam berbagai kondisi (Gibbs 2003). Suhu optimum pertumbuhan bakteri ini adalah 28–35°C dengan pH optimum 7.0– 7.5 (Fardiaz 1989). Namun, spora bakteri ini dapat bergeminasi pada kondisi lembab, pangan berasam rendah, dan pada suhu 4-5°C hingga 55°C (EFSA 2005).
Antibiotik merupakan salah satu teknik pengobatan yang digunakan dalam kasus infeksi bakteri. Penelitian untuk mencari antibiotik terbaik bagi Bacillus cereus hingga saat ini masih dilakukan terutama secara in vitro. Pada umumnya, Bacillus cereus tahan terhadap antibiotik penicillin dan chepalosporins karena kemampuannya dalam memproduksi β-lactamase (Bottone 2010). Namun, bakteri ini rentan terhadap pengobatan dengan klindamisin, gentamisin, dan kloramfenikol (Drobniewski 1993).
F.
EKSTRAKSI
Ekstraksi merupakan tahapan awal untuk memisahkan sebagian komponen dari keseluruhan (Houghton dan Raman 1998). Ekstraksi didasarkan pada kenyataan bahwa jika suatu zat dapat larut dalam dua fase yang tidak tercampur, maka zat itu dapat dialihkan dari satu fase ke fase lainnya dengan mengaduknya bersama-sama (Achmadi 1992 dalam Haswirna 2006). Berdasarkan fase yang terlibat, terdapat dua jenis ekstraksi, yaitu ekstraksi cair-cair dan ekstraksi padat-cair. Ekstraksi padat-cair dapat dilakukan dengan menggunakan metode maserasi, Soxhlet, atau sonikasi yang masing-masing metode tersebut memiliki kelebihan dan kelemahan seperti yang terlihat pada Tabel 4. Pada penelitian ini, metode ekstraksi yang digunakan adalah metode sonikasi. Teknik sonikasi merupakan teknik ekstraksi yang memanfaatkan gelombang ultrasonik dengan frekuensi rendah (20 – 40 kHz). Gelombang ultrasonik yang dihasilkan ini dapat memecah sel membran dari tanaman sehingga membantu difusi dari pelarut untuk membawa komponen bioaktif yang terkandung dalam tanaman (Cseke et al. 2006). Proses ekstraksi dengan teknik sonikasi membutuhkan waktu yang relatif singkat, umumnya 20 menit untuk ekstraksi komponen bioaktif tanaman (Celeghini et al. 2001).
Tabel 4. Kelebihan dan kelemahan beberapa metode ekstraksi
Metode Ekstraksi Kelebihan Kelemahan Referensi
Maserasi Metode sederhana dan mudah, murah, dapat digunakan untuk sampel yang tidak tahan panas
Waktu yang diperlukan lama, memerlukan pelarut dalam jumlah banyak
Meloan (1999)
Soxhlet Proses ekstraksi berjalan dengan efisien karena selalu digunakan pelarut yang baru, suhu ekstraksi dapat dikontrol
Tidak dapat digunakan untuk senyawa yang tidak tahan panas, memerlukan pelarut yang banyak
Wang dan Weller (2006)
Sonikasi Prosedur sederhana dan mudah, dapat menggunakan berbagai pelarut, menghasilkan rendemen yang lebih banyak dan laju ekstraksi yang lebih cepat
Frekuensi ultrasonik yang tinggi dapat menurunkan kandungan senyawa tertentu
Wang dan Weller (2006)
Dalam melakukan proses ekstraksi diperlukan jenis pelarut yang sesuai dengan komponen yang ingin diekstrak. Hal ini sesuai dengan prinsip dari ekstraksi yakni like dissolve like, dimana pelarut polar akan melarutkan komponen polar dan sebaliknya, komponen non polar akan larut pada pelarut non polar. Pemilihan pelarut harus disesuaikan dengan komponen bioaktif yang ingin diekstrak (Ncube et al. 2008). Pelarut yang baik harus memiliki nilai toksisitas yang rendah, mudah diuapkan pada suhu rendah, bersifat mengawetkan, dan tidak menyebabkan ekstrak terurai (Hughes (2002) dalam Ncube et al. (2008)). Pelarut yang paling umum digunakan dalam penelitian aktivitas antimikroba adalah metanol, etanol, dan air.
Pada beberapa tanaman obat, komponen semipolar seperti asam fenolat, flavonoid, dan alkaloid telah berhasil diekstrak dengan pelarut metanol atau air (Moco et al. 2007). Beberapa peneliti menggunakan kombinasi pelarut dengan polaritas yang berbeda untuk menghasilkan proses ekstraksi yang terbaik (Cowan 1999). Selain penggunaan campuran pelarut, salah satu teknik ekstraksi yang juga umum digunakan adalah ekstraksi bertingkat menggunakan pelarut dengan kepolaran yang meningkat, mulai dari pelarut yang non-polar hingga pelarut polar. Hal ini dilakukan untuk mendapatkan komponen dengan kisaran yang lebih luas. Penelitian Sivapriya et al. (2011) menunjukkan bahwa aktivitas antibakteri tertinggi dari kulit buah takokak dihasilkan oleh ekstrak dengan pelarut campuran etanol dan air.
G.
KROMATOGRAFI LAPIS TIPIS (KLT)Kromatografi lapis tipis merupakan teknik kromatografi yang banyak digunakan sebagai instrumen analisis yang cepat dan mudah dilakukan. KLT dikenal sebagai metode yang cepat untuk mendeteksi suatu senyawa (Cserhati dan Forgacs 1999). KLT lebih efisien untuk digunakan karena resiko yang ada lebih sedikit dibandingkan kromatografi cair – tekanan tinggi atau kromatografi gas. Resiko tersebut meliputi prosedur yang lebih sederhana dan mudah serta pemilihan pelarut yang lebih beragam sehingga biaya dalam penggunaan teknik KLT ini relatif lebih murah.Prinsip KLT ini sangat sederhana, campuran zat terlarut dipisahkan dengan membuat spot kecil pada fase diam kemudian diinkubasi dalam chamber tertutup yang berisi fase gerak. Interaksi antara molekul zat terlarut dengan fase diam dan fase bergerak akan menghasilkan perbedaan mobilitas dan pemisahan pada KLT. Fase gerak akan membawa zat terlarut yang ada dalam campuran senyawa tersebut bergerak pada jarak tertentu (Cserhati dan Forgacs 1999). Zat terlarut ini akan membentuk bercak yang berwarna bila divisualisasi dengan UV dan reagen tertentu. Ilustrasi pemisahan senyawa dengan KLT dapat dilihat pada Gambar 5.
Salah satu teknik sederhana untuk mengidentifikasi komponen dalam pelat KLT ialah dengan penyemprotan reagen penampak bercak (Harborne 1973). Selain itu, apabila pelat KLT yang
Pelat KLT silika
Fase gerak
memisahkan senyawa menjadi fraksi dan dihasilkan bercak/spot
digunakan telah mengandung indikator fluoresensi maka dapat dilakukan penyinaran dengan sinar UV pada panjang gelombang tertentu sehingga komponen yang terdapat dalam pelat akan bersinar. Pada umumnya, panjang gelombang yang digunakan dalam penyinaran sinar UV adalah panjang gelombang pendek, yakni 254 nm dan panjang gelombang 366 nm. Senyawa yang terpisah dalam pelat KLT akan memiliki nilai Rf yang bersifat spesifik. Nilai Rf merupakan jarak yang ditempuh oleh suatu senyawa relatif terhadap jarak yang ditempuh oleh garis depan fase gerak (Gambar 6). Nilai Rf ini berada diantara nilai 0 hingga 1 (Gritter et al. 1991). Ilustrasi penentuan nilai Rf dapat dilihat pada Gambar 6.
Aplikasi KLT untuk menganalisis pemisahan senyawa antibakteri telah ditunjukkan oleh beberapa peneliti (Kumar et al. 2010; Haswirna 2006). Penggunaan teknik KLT dalam menganalisis aktivitas antibakteri dari ekstrak yang difraksinasi juga telah dilakukan oleh Nwodo et al. (2010) pada ekstrak tanaman asam jawa (Tamarindus indica). Identifikasi beberapa senyawa dalam buah takokak menggunakan pelat KLT juga telah dilakukan oleh Arif dan Fareed (2011) yang menunjukkan adanya komponen rutin dan digoxin. Hal ini menunjukkan bahwa teknik KLT dapat diaplikasikan untuk mengidentifikasi komponen antibakteri dari suatu ekstrak tanaman.
a b
� = = � � ��ℎ ℎ � � �
III. BAHAN DAN METODE
A.
BAHAN DAN ALAT
Bahan-bahan yang digunakan pada penelitian ini adalah bahan untuk tahap ekstraksi, uji aktivitas antibakteri, uji komponen dan identifikasi dengan KLT. Bahan-bahan yang digunakan untuk ekstraksi adalah metanol dan aquades. Bahan-bahan yang digunakan untuk uji aktivitas antibakteri antara lain kultur Bacillus cereus, media nutrient agar, nutrient broth, DMSO, dan kloramfenikol. Pada pengujian komponen dan identifikasi dengan KLT bahan-bahan yang digunakan berbagai jenis pelarut seperti kloroform, etil asetat, etanol, asam asetat, heksan, dietil eter, n-butanol. Alat yang digunakan untuk ekstraksi adalah loyang alumunium, timbangan kasar, freeze dryer, blender kering, saringan 30 mesh, plastik double seal serta peralatan gelas kimia seperti labu takar, gelas ukur, pipet Mohr, pipet tetes, pipet mikro, neraca analitik, spatula, dan gelas pengaduk, desikator tabung reaksi, tabung vial, gelas piala, spektrofotometer, dan rotary vacuum evaporator. Alat-alat yang digunakan untuk uji aktivitas antibakteri adalah cawan petri, inkubator, pipet Mohr, pipet mikro, tip, bunsen, korek api, kapas, tabung reaksi, plastik, dan autoklaf. Alat untuk uji komponen dan identifikasi adalah pelat untuk KLT, jar, pinset, pipet kapiler, penggaris, dan lampu UV.
B.
METODE PENELITIAN
Metode penelitian identifikasi komponen antibakteri buah takokak ini terdiri dari lima tahapan utama. Tahap pertama adalah persiapan sampel, selanjutnya tahap kedua adalah ekstraksi bertingkat yang akan menghasilkan delapan ekstrak buah takokak. Sebanyak delapan ekstrak ini kemudian diuji aktivitas antibakteri dan uji pemisahan dengan KLT. Tahap terakhir adalah analisis data dan identifikasi komponen antibakteri dari ekstrak buah takokak yang menunjukkan aktivitas antibakteri tertinggi dan pemisahan KLT yang baik. Diagram alir tahapan penelitian dapat dilihat pada Gambar 7.
Sebanyak 8 ekstrak dengan polaritas pelarut yang berbeda
Pengujian komponen dengan KLT Pengujian aktivitas antibakteri
Ekstraksi bertingkat
Analisis data dan identifikasi ekstrak terbaik Persiapan sampel
1.
Persiapan sampel
a. Pengeringan buah takokak
Buah takokak segar dibeli dari Kampung Konservasi TOGA Bina Sehat Lestari di Gunung Leutik, Desa Benteng, Ciampea – Bogor
.
Buah takokak yang masih segar disortir dan dicuci kemudian dikeringkan dengan teknik pengeringan beku. Buah takokak yang telah dicuci ditiriskan kemudian disimpan dalam freezer pada suhu -20 °C selama 24 jam hingga membeku. Setelah itu, dilakukan pengeringan dengan freeze dryer pada suhu -50°C ± 5°C dan tekanan ±20 bar selama 48 jam. Buah takokak yang dikeringkan menggunakan freeze dryer tidak semua kering oleh karena itu dilakukan sortasi dengan memilih buah takokak yang kering. Hasil sortasi ini kemudian ditepungkan dengan blender kering lalu diayak menggunakan saringan 30 mesh dan dimasukkan ke dalam plastik ber-seal dan disimpan di dalam freezer hingga nanti digunakan pada penelitian selanjutnya. Diagram alir tahap persiapan sampel dapat dilihat pada Gambar 8.Buah takokak
Penyortiran
Pencucian
Pembekuan T -20°C, 24 jam
Pengering beku
P 0.220 mBar, T -50 ± 5°C, 48 jam
Penggilingan
Pengayakan 30 mesh
Penyimpanan di freezer dengan kondisi gelap
Tepung buah takokak
b. Analisis Kadar Air (SNI 01-2891-1992)
Penetapan kadar air dilakukan dengan pengeringan menggunakan oven dengan dua kali ulangan masing-masing duplo. Analisis kadar air dilakukan terhadap dua jenis sampel, yaitu buah takokak segar dan tepung buah takokak. Tahapan pertama yang dilakukan adalah cawan yang akan digunakan dikeringkan dalam oven selama 15 menit kemudian didinginkan dalam desikator dan ditimbang. Sebanyak 1-2 gram sampel dimasukkan ke dalam cawan tersebut dan ditimbang. Selanjutnya, cawan berisi sampel dikeringkan dalam oven pada suhu 105°C selama 3 jam lalu didinginkan dalam desikator dan ditimbang. Perlakuan terakhir diulangi terus hingga diperoleh berat kering yang relatif tetap (berat dianggap tetap jika selisih berat sampel yang ditimbang ≤ 0.0005 g). Penetapan kadar air dapat dilakukan dengan menggunakan persamaan berikut.
adar air (g 100 g berat basah) ( 1 2) 100
Keterangan:
W = berat sampel sebelum dikeringkan (g)
W1 = berat sampel + cawan kosong setelah dikeringkan (g) W2 = berat cawan kosong (g)
c. Analisis Total Fenol (Shetty et al. 1995 dengan modifikasi)
Penentuan total fenol dilakukan untuk mengetahui kandungan senyawa fenolik pada sampel. Sebanyak 50.0 mg sampel kering dilarutkan dalam 2.5 ml etanol 95%, kemudian divorteks. Setelah itu dilakukan sentrifuse terhadap campuran tersebut dengan kecepatan 2000 rpm selama 10 menit. Supernatan diambil sebanyak 0.5 ml dan dimasukkan ke dalam tabung reaksi. Kemudian ke dalam tabung reaksi tersebut ditambahkan 0.5 ml etanol 95%, 2.5 ml aquadest, dan 2.5 ml reagen Folin Ciocalteau 50%. Campuran tersebut kemudian didiamkan selama 5 menit lalu ditambahkan 0.5 ml Na2CO3 5% dan divorteks. Setelah itu, sampel didiamkan di ruang gelap selama satu jam, lalu dilakukan pengukuran dengan spektrofotometer pada panjang gelombang 725 nm. Dalam penentuan total fenol ini digunakan asam galat yang dibeli dari Sigma-Aldrich sebagai standar. Standar asam galat dibuat dengan variasi konsentrasi antara 50-250 mg/ml. Penentuan total fenol dilakukan sebanyak dua ulangan masing-masing duplo.
2.
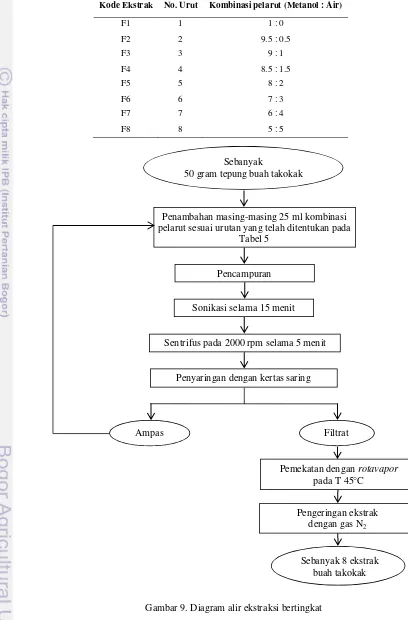
Ekstraksi Bertingkat
Diagram alir tahap ekstraksi bertingkat dapat dilihat pada Gambar 9. Ekstraksi dibuat dalam tiga kali ulangan.
Tabel 5. Kombinasi pelarut untuk ekstraksi
Kode Ekstrak No. Urut Kombinasi pelarut (Metanol : Air)
F1 1 1 : 0
F2 2 9.5 : 0.5
F3 3 9 : 1
F4 4 8.5 : 1.5
F5 5 8 : 2
F6 6 7 : 3
F7 7 6 : 4
F8 8 5 : 5
Sebanyak
50 gram tepung buah takokak
Penambahan masing-masing 25 ml kombinasi pelarut sesuai urutan yang telah ditentukan pada
Tabel 5
Pencampuran
Sonikasi selama 15 menit
Sentrifus pada 2000 rpm selama 5 menit
Ampas Filtrat
Pemekatan dengan rotavapor pada T 45°C
Pengeringan ekstrak dengan gas N2
Sebanyak 8 ekstrak buah takokak Penyaringan dengan kertas saring
3.
Analisis aktivitas antibakteri
a. Persiapan kultur Bacillus cereusPersiapan kultur dilakukan dengan terlebih dahulu menguji keseragaman kultur Bacillus cereus dengan pewarnaan Gram. Pewarnaan Gram dilakukan di atas kaca preparat. Kultur disebar di atas kaca sehingga terbentuk lapisan tipis kemudian difiksasi dan ditambahkan pewarna ungu kristal didiamkan selama 2 menit dan dibilas. Selanjutnya ditambahkan larutan lugol didiamkan selama 1 menit dan kembali dibilas dengan alkohol, terakhir ditambahkan pewarna merah safranin, dan dikeringkan. Morfologi bakteri dilihat menggunakan mikroskop hingga pembesaran 1000x. Sel bakteri dengan morfologi berwarna ungu merupakan bakteri Gram-positif, sedangkan sel bakteri dengan morfologi berwarna merah merupakan bakteri Gram-negatif (Madigan et al. 2003).
Selanjutnya dilakukan perhitungan total kultur bakteri uji menggunakan metode Aerobic Plate Count (APC) untuk mengetahui jumlah total bakteri awal sehingga dapat diketahui jumlah pengenceran yang diperlukan agar jumlah bakteri saat pengujian lebih seragam. Tahap persiapan kultur bakteri dapat dilihat pada Gambar 10. Sebanyak 1 ose bakteri Bacillus cereus diinokulasikan pada 5 ml NB steril kemudian diinkubasikan pada suhu 37°C selama 24 jam. Kultur bakteri ini yang selanjutnya digunakan dalam pengujian. Media NB yang telah berisi bakteri kemudian diencerkan pada seri pengenceran 102-106 dan ditumbuhkan pada media NA serta diinkubasi selama 24 jam suhu 37°C. Koloni yang tumbuh sebanyak 25 -250 dihitung berdasarkan metode Aerobic Plate Count (APC) (BAM 2001) dengan rumus sebagai berikut.
Jumlah koloni (cfu/ml) = ℎ ( )
Keterangan: n = jumlah cawan
d = pengenceran pada cawan pertama
10-2 5 ml NB
Inkubasi 37°C, 24 jam
Pengambilan sebanyak 1 ose kultur B. Cereus dalam agar miring
Pengenceran
10-3
Pengenceran
10-4
Pengenceran
10-5
Pengenceran
10-6
Pengenceran
Penuangan media NA cair steril
Inkubasi pada 37°C, 24 jam dan diamati
Ekstrak buah takokak
Pelarutan dalam DMSO hingga
konsentrasi 200 mg/ml
Kultur bakteri
Bacillus cereus
Pengenceran hingga ~105 cfu/ml
Inokulasi 200 µl suspensi bakteri ke 200 ml media NA bersuhu 40-42°C
Penuangan 20 ml media berisi bakteri ke dalam cawan dan pembekuan media ± 1 jam dalam refrigerator
Pembuatan sumur berdiameter 5 mm
Penuangan @ 60 µl ekstrak ke dalam sumur
[image:30.595.101.510.298.760.2]Inkubasi pada 37°C selama 24 jam
Gambar 11. Diagram alir uji aktivitas antibakteri metode difusi sumur
b. Uji difusi sumur (Shan et al. 2007 yang dimodifikasi)
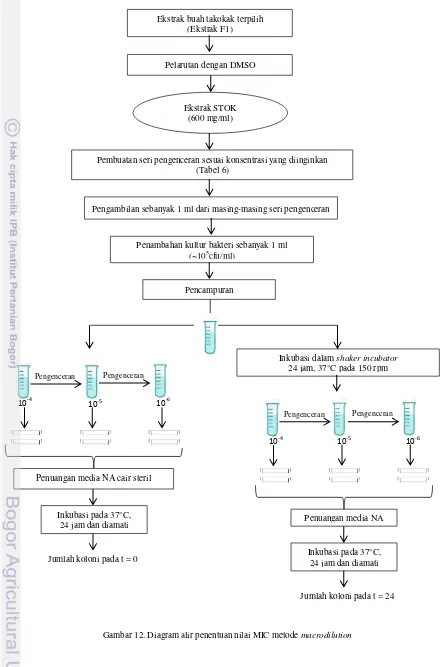
c. Uji nilai MIC dengan metode Macrodilution (Wiegand et al. 2008 yang dimodifikasi)
[image:31.595.111.526.367.506.2]Nilai Minimum Inhibitory Concentratrion (MIC) dari ekstrak metanol buah takokak dihasilkan dengan menggunakan metode pengenceran macrodilution. Ekstrak buah takokak terpilih dilarutkan dengan DMSO hingga konsentrasi 600 mg/ml sebagai larutan stok. Kemudian larutan stok ini diencerkan sesuai dengan konsentrasi yang telah ditentukan seperti yang dapat dilihat pada Tabel 6. Setelah dibuat campuran ekstrak dan NB pada berbagai konsentrasi kemudian masing-masing campuran tersebut diambil sebanyak 1 ml dan ditambahkan 1 ml kultur Bacillus cereus (~105 cfu/ml). Setelah penambahan bakteri dilakukan, secepatnya divorteks dan dihitung jumlah bakteri saat 0 jam dengan metode cawan tuang. Kemudian campuran ekstrak dan bakteri tersebut diinkubasi dalam shaker incubator suhu 37°C selama 24 jam pada kecepatan 150 rpm dan kembali dihitung jumlah bakteri setelah 24 jam dengan metode cawan tuang. Nilai MIC diperoleh dengan membuat kurva hubungan antara persentase penghambatan dan konsentrasi ekstrak yang diuji. Konsentrasi ekstrak terkecil yang menghasilkan persentase penghambatan > 90% merupakan nilai MIC (Cosentino et al. 1999). Uji nilai MIC dilakukan sebanyak dua ulangan masing-masing duplo. Diagram alir pengujian nilai MIC dapat dilihat pada Gambar 12.
Tabel 6. Pembuatan larutan ekstrak untuk uji nilai MIC
Tahapan Konsentrasi Ekstrak (mg/ml) Sumber V ekstrak yang diambil (ml) V NB steril (ml) Konsentrasi Ekstrak Hasil Pengenceran (mg/ml) Konsentrasi Ekstrak saat Pengujian (mg/ml)
1 600 Stok 1.5 1.5 300 150
2 300 Tahapan 1 0.5 0.5 150 75
3 300 Tahapan 1 1 1.5 120 60
4 120 Tahapan 3 1 1 60 30
5 120 Tahapan 3 0.5 1 40 20
6 60 Tahapan 4 0.5 1 20 10
4.
Analisis profil KLT ekstrak buah takokak (Gritter
et al
. 1991)
Jumlah koloni pada t = 0
Jumlah koloni pada t = 24 Ekstrak buah takokak terpilih
(Ekstrak F1)
Pelarutan dengan DMSO
Ekstrak STOK (600 mg/ml)
Pembuatan seri pengenceran sesuai konsentrasi yang diinginkan (Tabel 6)
Pengambilan sebanyak 1 ml dari masing-masing seri pengenceran
Penambahan kultur bakteri sebanyak 1 ml (~105cfu/ml)
Pencampuran
Inkubasi dalam shaker incubator
[image:32.595.105.546.85.752.2]24 jam, 37°C pada 150 rpm
Gambar 12. Diagram alir penentuan nilai MIC metode macrodilution
10-4 10-5
Pengenceran
10-6
Pengenceran
Penuangan media NA cair steril
Inkubasi pada 37°C, 24 jam dan diamati
10-4 10-5
Pengenceran
10-6
Pengenceran
Penuangan media NA cair steril
5.
Identifikasi komponen antibakteri dari ekstrak buah takokak terbaik
a. Analisis data hasil uji aktivitas antibakteri dan profil KLTPada tahap ini dilakukan analisis data hasil uji aktivitas antibakteri ekstrak buah takokak dan dibandingkan dengan profil pemisahan KLT ekstrak tersebut sehingga didapatkan satu ekstrak terbaik. Analisis data hasil uji aktivitas antibakteri metode difusi sumur dilakukan dengan analisis statistik ANOVA dan uji lanjut Duncan. Selanjutnya hasil analisis data statistik ini dibandingkan dengan profil KLT ekstrak dan dipilih ekstrak yang terbaik. Ekstrak terbaik adalah ekstrak yang menunjukkan aktivitas antibakteri dengan nilai diameter penghambatan terbesar serta yang memiliki profil KLT dengan bercak terbanyak dan terpisah satu sama lain. Selanjutnya ekstrak terbaik ini akan digunakan untuk identifikasi komponen metabolit buah takokak.
b. Pemisahan ekstrak terbaik dengan KLT dua dimensi (Gritter et al. 1991)
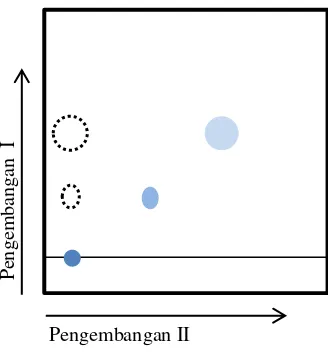
Identifikasi komponen metabolit dari ekstrak terbaik diawali dengan menentukan kandungan total fenol dari ekstrak tersebut. Kemudian dilakukan pembandingan antara profil KLT yang dihasilkan oleh ekstrak dengan profil KLT dari senyawa standar. Senyawa standar ini akan ditentukan dengan studi literatur mengenai komponen aktif tanaman yang diduga berperan terhadap aktivitas antibakteri, seperti komponen polifenol dan flavonoid dari hasil penelitian Sivapriya et al. (2011). Komponen dalam ekstrak terbaik akan dipisahkan dengan KLT dua dimensi sehingga diharapkan lebih banyak komponen yang dapat terpisah dan teridentifikasi. Pada uji KLT dua dimensi pelat dielusi dengan fase gerak yang perama kemudian diangkat dan dikeringkan dan dielusi kembali dengan fase gerak yang kedua. Ilustrasi uji KLT dua dimensi dapat dilihat pada Gambar 13. Parameter yang digunakan untuk tahap identifikasi ini adalah dengan membandingkan nilai Rf dan pola penyerapan sinar UV pada 254 dan 366 nm serta sinar tampak dari fraksi yang terpisah. Nilai Rf diperoleh dengan membandingkan antara jarak yang digerakkan oleh senyawa atau senyawa dengan jarak yang digerakkan oleh pelarut. Pemisahan ekstrak terbaik dilakukan dengan dua ulangan masing-masing duplo.
v v
P
en
ge
m
b
an
ga
n
I
[image:33.595.275.439.561.737.2]Pengembangan II
c. Uji sifat spektral fraksi hasil pemisahan KLT dua dimensi (Susanto 1995)
Pemisahan ekstrak dengan KLT dua dimensi akan menghasilkan bercak berwarna setelah divisualisasi dengan penyinaran sinar UV. Bercak ini adalah fraksi dari ekstrak yang dapat diduga sebagai komponen aktif buah takokak. Komponen aktif yang terdapat dalam fraksi ini dapat diketahui dengan uji sifat spektral. Bercak yang terlihat dikerok dan dilarutkan dengan 2 ml etanol kemudian divorteks dan disentrifus. Filtrat hasil sentrifus selanjutnya diuji sifat spektral dengan spektrofotometer pada panjang gelombang 200-400 nm. Komponen aktif dalam fraksi tersebut dapat diduga dengan membandingkan nilai panjang gelombang maksimum yang dihasilkan dengan studi literatur.
d. Uji kesesuaian nilai Rf fraksi ekstrak terbaik dengan komponen standar
IV. HASIL DAN PEMBAHASAN
A.
KARAKTERISTIK SAMPEL BUAH TAKOKAK
Pada penelitian ini buah takokak yang digunakan berasal dari Kampung Konservasi TOGA Bina Sehat Lestari di Gunung Leutik, Desa Benteng, Ciampea – Bogor sehingga diharapkan karakteristik komponen metabolit buah takokak lebih seragam bila didapatkan dari lokasi yang sama. Lokasi geografis dapat menentukan komponen metabolit yang terdapat dalam suatu tanaman, termasuk pada tanaman takokak. Pada penelitian Perez-Amador (2007) buah takokak yang ditanam di Mexico memiliki kandungan alkaloid yang berbeda dengan buah takokak yang ditanam di India. Dalam pengambilan sampel di lapangan, tanaman yang telah dikumpulkan harus segera mungkin ditangani untuk mencegah degradasi komponen metabolit yang terkandung dalam tanaman tersebut (Cseke et al. 2006). Degradasi komponen metabolit dari suatu tanaman dipengaruhi oleh kandungan air dalam tanaman tersebut. Buah takokak segar yang digunakan dalam penelitian ini memiliki kadar air sebesar 84.04% (bb) (Lampiran 1a). Kadar air buah takokak yang cukup tinggi ini dapat menyebabkan kerusakan baik biologis maupun mikrobiologis apabila disimpan dalam keadaan utuh. Kerusakan tersebut diakibatkan oleh beberapa faktor antara lain faktor lingkungan seperti suhu, RH, cahaya, waktu, dan oksigen. Kontaminasi mikroorganisme dan kandungan kimia seperti enzim juga mempengaruhi laju kerusakan yang terjadi (Muchtadi 2008). Penurunan kadar air dapat dilakukan untuk menurunkan laju kerusakan yang terjadi dalam bahan. Penurunan kadar air salah satunya dapat dilakukan dengan proses pengeringan. Pengeringan merupakan cara yang paling umum untuk mencegah degradasi komponen metabolit dari tanaman obat (Rocha et al. 2011). Oleh karena itu, untuk memperpanjang umur simpan dan mempertahankan senyawa metabolit yang terkandung dalam buah takokak segar dilakukan proses pengeringan.
Pengeringan dilakukan dengan tujuan agar bahan yang diteliti dapat digunakan setiap saat dengan kondisi yang hampir sama dengan bahan segar (Cseke et al. 2006), proses pengeringan merupakan proses yang kritikal terutama dalam penelitian menggunakan tanaman obat. Metode pengeringan akan berpengaruh terhadap kualitas minyak essensial, senyawa aromatik, dan senyawa aktif yang terdapat dalam tanaman tersebut (Rocha et al. 2011). Proses pengeringan yang dilakukan pada penelitian ini adalah dengan freeze drying. Degradasi komponen aktif dalam tanaman lebih sedikit terjadi pada proses pengeringan dengan freeze drying, bila dibandingkan dengan metode oven pada suhu 50°C dan 70°C (Mahanom et al. 1999). Metode freeze drying menggunakan prinsip sublimasi dimana air yang terkandung dalam bahan pangan terlebih dahulu dibekukan menjadi es kemudian diubah menjadi uap air. Proses sublimasi es menjadi uap air terjadi akibat tekanan yang berkurang hingga tercapai tekanan uap air antara es dalam bahan dan sekelilingnya (Muchtadi 2008).
adsorpsi dari fase solut. Tahapan ini bertujuan untuk mengurangi jumlah air yang tersisa dari pengeringan utama sehingga kandungan air dalam bahan lebih stabil (Tang dan Pikal 2004).
[image:36.595.298.382.350.473.2]Proses pengeringan dengan metode freeze drying menghasilkan buah takokak yang kering dan berwarna hijau yang lebih muda dibanding dengan warna hijau pada buah takokak segar. Menurut Muller dan Hendl (2006), perubahan warna pada tanaman obat yang telah dikeringkan menjadi coklat, menunjukkan telah terjadi proses pencoklatan. Proses pencoklatan dapat terjadi akibat degradasi klorofil, komponen metabolit lain yang terkandung dalam tanaman juga mungkin mengalami degradasi seperti halnya klorofil. Pada Gambar 14 terlihat tepung buah takokak berwarna hijau muda, hal ini menunjukkan bahwa buah takokak dengan pengeringan bekutidak mengalami proses pencoklatan sehingga diharapkan perubahan komponen metabolit yang terkandung dalam buah takokak menjadi lebih sedikit. Buah takokak kering hasil freeze drying ini kemudian dihancurkan dan disaring dengan saringan 30 mesh sehingga dihasilkan tepung buah takokak. Pembentukan tepung buah takokak ini bertujuan untuk memperkecil ukuran sampel sehingga dalam proses ekstraksi, pelarut akan lebih mudah kontak dengan sampel (Khopkar 2003). Tepung buah takokak ini memiliki kadar air sebesar 6.31% (bb) (Lampiran 1b). Menurut Winarno (1980), bahan yang mengandung kadar air 3-7% akan mencapai kestabilan optimum terutama untuk bahan yang mengandung asam lemak tak jenuh. Tepung buah takokak kemudian disimpan dalam freezer hingga nanti digunakan untuk analisis berikutnya.
Gambar 14. Tepung buah takokak hasil pengeringan beku
Selanjutnya dilakukan pengujian total fenol pada tepung buah takokak yang telah disiapkan sebelumnya. Analisis total fenol bertujuan untuk mengetahui total kandungan fenolik yang terdapat pada buah takokak. Komponen fenolik merupakan hasil metabolisme sekunder dari tanaman termasuk sayuran dan buah-buahan yang berperan menurunkan resiko penyakit degeneratif seperti diabetes, kanker, jantung, dan stroke (Crozier et al. 2009). Oleh karena itu, analisis total fenol dilakukan sebagai gambaran umum untuk mengetahui manfaat dari suatu tanaman. Dalam penelitian ini standar yang digunakan adalah asam galat sehingga nilai total fenol yang diperoleh dapat disamakan dengan jumlah kandungan asam galat. Asam galat digunakan sebagai standar dalam pengujian total fenol karena asam galat merupakan komponen fenolik yang umumnya paling banyak ditemukan dalam tanaman dan sayuran (Hedges dan Lister 2008). Selain asam galat, komponen lain yang dapat digunakan sebagai standar pengujian total fenol adalah asam tanat, namun asam tanat berada dalam konsentrasi yang kecil dalam tanaman (Crozier et al. 2009). Asam tanat atau tannin ini banyak ditemukan dalam minuman teh (Chung et al. 1998).
al. (2010) yaitu sebesar 158.92 mg GAE/100 g fresh weight, namun lebih besar dari hasil penelitian Sirait (2009) yang menyatakan kandungan fenol buah takokak sebesar 92.9109 mg/100 g fresh weight. Hal ini dapat disebabkan oleh perbedaan letak geografis dari sumber sampel diperoleh dan tingkat kematangan yang berbeda. Nilai total fenol dari buah takokak dalam penelitian ini cukup tinggi bila dibandingkan dengan beberapa sayuran indigenous Indonesia lainnya (Andarwulan et al. 2010). Beberapa penelitian menunjukkan bahwa komponen fenolik merupakan komponen metabolit sekunder yang memiliki aktivitas antibakteri (Cowan 1999; Ncube et al. 2008). Oleh karena itu, berdasarkan nilai total fenolnya dapat diduga bahwa buah takokak berpotensi sebagai antibakteri yang baik.
B.
EKSTRAKSI BERTINGKAT BUAH TAKOKAK
Ekstraksi merupakan proses utama dalam analisis komponen metabolit menggunakan tanaman obat. Faktor yang sangat penting dalam proses ekstraksi adalah metode dan jenis pelarut karena metode dan pelarut tersebut yang akan menentukan komponen metabolit yang akan ikut terekstrak (Cseke et al. 2006). Pada penelitian ini, pelarut yang akan digunakan adalah kombinasi antara metanol dan air. Pemilihan metanol dan air didasarkan pada studi literatur tentang aktivitas antibakteri ekstrak buah takokak. Kulit buah takokak yang diekstrak dengan campuran pelarut etanol dan air menunjukkan aktivitas antibakteri yang paling tinggi dibanding pelarut etanol saja atau air saja dan pelarut non polar seperti heksan atau aseton (Sivapriya et al. 2011). Selain aktivitas antibakteri yang tinggi, ekstrak kulit buah takokak dengan campuran pelarut etanol dan air