PRODUKSI ANTIBODI POLIKLONAL ANTI-
EKSKRETORI/SEKRETORI (E/S) Fasciola gigantica ISOLAT
ASAL DOMBA DAN KERBAU PADA KELINCI
RETNO SETYANINGSIH
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi Produksi Antibodi Poliklonal Anti Ekskretori/Sekretori (E/S) Fasciola gigantica Isolat Asal Domba dan Kerbau pada Kelinci adalah karya saya dengan arahan dari dosen pembimbing dan belum pernah diajukan dalam bentuk apapun kepada Perguruan Tinggi mana
pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan
maupun tidak diterbitkan dari penulis lain telah disebutkan dalan teks dan
dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juli 2011
Retno Setyaningsih
ABSTRACT
RETNO SETYANINGSIH. Production of Polyclonal Antibody Anti- Excretory/Secretory (E/S) of Fasciola gigantica Sheep and Buffalo Origins in Rabbit. Under direction FADJAR SATRIJA, SRI MURTINI.
The research was designed to study method of polyclonal antibody (Ig G) anti-Excretory/Secretory (E/S) Fasciola gigantica production in rabbit. Two antigens of E/S Fasciola gigantica (E/S Fasciola gigantica from buffalo and E/S Fasciola gigantica sheep) were immunized to rabbit, at dose level 150 µg/animal. Freund’s adjuvant added to antigen with the equal volume (1:1). The first immunization was done intravenous (i.v) without adjuvant. Second immunization were gave subcutaneous (s.c) with combination of antigen-Freund’s adjuvant complete. The third until sixth immunizations were done subcutaneous (s.c) with combination of antigen-Freund’s adjuvant incomplete. Blood samples were collecting every one week after the third immunization. To evaluated antibody anti Excretory/Secretory (E/S) Fasciola gigantica development, the sera tested using Agar Gel Precipitation Test (AGPT). The result showed that the rabbit immunized by E/S protein of Fasciola gigantica from sheep, able to develop antibody faster (4 weeks post infection) than the rabbit which immunized by E/S protein of Fasciola gigantica from buffalo (12 weeks post infection). In the same time, cross reactivity between antigens appear from the antibody that produced from each rabbit.
RINGKASAN
RETNO SETYANINGSIH. Produksi Antibodi Poliklonal Anti Ekskretori/Sekretori (E/S) Fasciola gigantica Isolat Asal Domba dan Kerbau pada Kelinci. Dibawah bimbingan FADJAR SATRIJA, SRI MURTINI.
Penelitian telah dilakukan untuk mempelajari pembentukkan antibodi poliklonal (Ig G) anti E/S Fasciola gigantica hewan coba kelinci. Dua ekor kelinci masing-masing diimunisasi dengan 150 µg antigen Ekskretori/Sekretori (E/S) Fasciola gigantica yang diisolasi dari domba dan kerbau yang disembelih di Rumah Potong Hewan (RPH) Kota Bekasi serta Tempat Pemotongan Hewan (TPH) Empang-Kota Bogor. Imunisasi pertama dilakukan dengan rute intravena (i.v) tanpa tambahan adjuvant. Imunisasi kedua dilakukan dengan rute subkutan (s.c) dengan kombinasi antigen- adjuvant lengkap Freund. Imunisasi ketiga hingga kelima dilakukan dengan rute subkutan (s.c) dengan kombinasi antigen- adjuvant tak lengkap Freund. Sampel darah dikoleksi tiap seminggu sekali setelah penyuntikkan yang ketiga. Serum darah diuji menggunakan Agar Gel Pecipitation Test (AGPT) untuk mengevaluasi antibodi anti E/S Fasciola gigantica yang terbentuk. Hasil penelitian menunjukkan bahwa kelinci yang diimunisasi dengan antigen E/S F. gigantica asal domba, mampu membentuk antibodi lebih cepat (4 minggu pasca infeksi) dibandingkan kelinci yang diimunisasi dengan antigen E/S F. gigantica asal kerbau (12 minggu pasca infeksi). Pada waktu yang sama, reaksi silang diantara antigen antigen E/S F. gigantica muncul dari antibodi yang dihasilkan oleh masing-masing kelinci.
Kata kunci: antibodi poliklonal, antigen Ekskretori/Sekretori, Fasciola gigantica
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan
atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau
tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan
yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis
PRODUKSI ANTIBODI POLIKLONAL ANTI
EKSKRETORI/SEKRETORI (ES) Fasciola gigantica PADA
KELINCI
RETNO SETYANINGSIH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
2011
Judul Skripsi : Produksi Antibodi Poliklonal Anti-Ekskretori/Sekretori (E/S) Fasciola gigantica Isolat Asal Domba dan Kerbau pada Kelinci
Nama : Retno Setyaningsih
NIM : B04070041
Disetujui
drh. H. Fadjar Satrija, M.Sc, Ph. D Pembimbing I
Dr. drh. Hj. Sri Murtini, M. Si Pembimbing II
Diketahui
Dr. Nastiti Kusumorini
Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karunia-Nya sehingga skripsi dengan judul Produksi Antibodi Poliklonal Anti Ekskretori/Sekretori (E/S) Fasciola gigantica Isolat Asal Domba dan Kerbau pada Kelinci ini berhasil diselesaikan.
Terima kasih penulis ucapkan kepada Bapak Dr. drh. H. Fadjar Satrija,
M.Sc, dan Ibu Dr. drh. Hj. Sri Murtini, M.Si, selaku dosen pembimbing yang
telah memberi kesempatan, arahan, dan masukan, hingga selesainya skripsi ini.
Ucapan terimakasih juga penulis ucapkan kepada Bapak Sulaeman dan Ibu Selin,
selaku laboran yang telah banyak membantu penulis dalam melaksanakan
penelitian. Tak lupa ucapan terimakasih penulis haturkan kepada Ibu Mayang,
Joko, Risma, dan Mega selaku rekan sepenelitian serta kepada Amalia dan Hadi
S. yang telah banyak membantu penulis dengan dorongan semangat, kasih sayang,
serta doa. Ungkapan terimakasih juga disampaikan kepada Ayah, Mama, serta
seluruh keluarga atas dukungan baik moril maupun materil. Rekan-rekan angkatan
44’ “Gianuzzi” atas seluruh kebersamaan dan semangat serta seluruh pihak baik
secara langsung maupun tidak langsung telah membantu penulis hingga
selesainya penulisan skripsi ini. Semoga skripsi ini bermanfaat.
Bogor, Juli 2011
DAFTAR ISI
Halaman
DAFTAR TABEL………... iii DAFTAR GAMBAR………... iv 1. PENDAHULUAN……….
1.1Latar Belakang………... 1.2Tujuan……….. 1.3Manfaat………
1 1 2 2
2. TINJAUAN PUSTAKA……… 2.1Kelinci………. 2.2 Cacing Fasciola gigantica……….. 2.3 Antigen Ekskretori/Sekretori……….. 2.4 Imunitas………... 2.5 Antibodi Poliklonal………. 2.6 Adjuvant……….. 2.7 Agar Gel Precipitation Test (AGPT)………...
3 3 3 5 6 7 9 9
3. BAHAN DAN METODE……….. 3.1Tempat dan Waktu Penelitian………. 3.2Metode Penelitian………
3.2.1 Persiapan dan Pemeliharaan Kelinci
sebagai Hewan Coba………... 3.2.2 Persiapan Antigen E/S Fasciola gigantica... 3.2.3 Pengukuran Konsentrasi dengan Metode Bradford……… 3.2.4 Teknik Imunisasi………. 3.2.5 Teknik Pengambilan Darah………. 3.2.6 Teknik Pengumpulan Serum………... 3.2.7 Pembuatan Antigen Terlarut……… 3.2.8 Teknik Agar Gel Pecipitation Test (AGPT)……… 3.2.9 Pemurnian Immunoglobulin G (Ig G)………. 11 11 11 11 11 12 13 14 14 14 15 15
4. HASIL DAN PEMBAHASAN………... 17 5. SIMPULAN DAN SARAN………...
5.1Simpulan……….. 5.2Saran………...
24 24 24
DAFTAR TABEL
Halaman
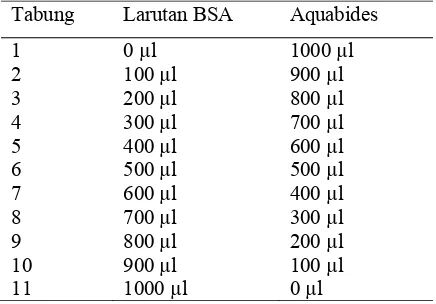
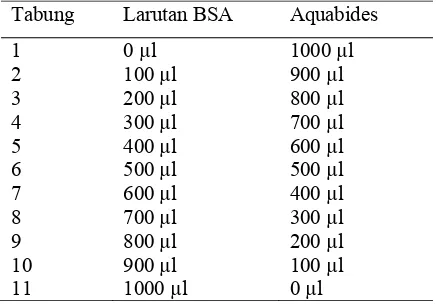
1 Tata cara pengisian larutan BSA dan Aquabides……….... 12
2 Tata cara penyuntikkan antigen... 13
DAFTAR GAMBAR
Halaman
1 Struktur Ig G pada mamalia……… 8
2 Hasil AGPT anti E/S Fasciola gigantica asal domba (KP) pada
minggu ke-4 dan ke-6………. 18
3 Hasil AGPT anti E/S Fasciola gigantica asal kerbau (KH) pada
minggu ke-12 dan ke-14……….………… 18
4 Hasil AGPT antibodi anti E/S Fasciola gigantica asal domba dengan
antigen E/S Fasciola gigantica asal kerbau………... 21
5 Penebalan presipitasi reaksi silang antibodi pada AGPT..………. 22
1.
PENDAHULUAN
1.1 Latar Belakang
Fasciolosis adalah penyakit yang disebabkan cacing dari genus Fasciola.
Fasciolosis di Indonesia secara umum disebabkan oleh Fasciola gigantica.
Berbagai studi memperlihatkan bahwa Fasciola gigantica merupakan parasit yang
paling sering ditemukan pada ruminansia terutama ruminansia besar (sapi dan
kerbau) di Indonesia. Kurang lebih 80 persen ternak ruminansia terutama kerbau
di Indonesia terserang fasciolosis, sedangkan prevalensinya di Indonesia berkisar
antara 60-90%. Prevalensi penyakit ini pada sapi di beberapa daerah di Indonesia,
seperti di Jawa Barat dapat mencapai 90%, sedangkan prevalensi penyakit ini
pada domba belum diketahui (Estuningsih et al. 2004).
Infeksi Fasciola gigantica berpotensi dalam menimbulkan masalah
ekonomi dan kesehatan ternak. Hal tersebut dikarenakan infeksi Fasciola
gigantica menyebabkan penurunan bobot hidup, penurunan performa, reproduksi,
produksi susu, pengafkiran organ tubuh terutama hati sehingga hati terbuang
percuma, bahkan dapat menyebabkan kematian (Copeman dan Copland 2008). Di
Indonesia, secara ekonomi kerugiannya dapat mencapai 439-525 juta Australian
Dollar (AUD) atau sekitar Rp. 3,512-4,200 triliun per tahun (1 AUD= Rp. 8000)
(Copeman dan Copland 2008).
Kerugian ekonomis akibat kecacingan dapat ditekan melalui program
pengendalian kecacingan yang didasarkan pada diagnosa dini infeksi cacing
sebelum menimbulkan perubahan patofisiologis dalam tubuh inang. Deteksi
antigen cacing yang dikeluarkan bersama dengan tinja (koproantigen) merupakan
salah satu metode deteksi dini infeksi cacing parasit. Beberapa penelitian
terdahulu membuktikan bahwa deteksi koproantigen akibat infeksi parasit baik
pada ternak maupun pada manusia bermanfaat untuk pengendalian dan
pencegahan dini (Charlier et al. 2008, Seres dan Cozma 2008, Guezala et al.
2009). Metode diagnosa menggunakan koproantigen memiliki keunggulan dapat
mendeteksi keberadaan antigen parasit Echinococcus pada masa prepaten yang
berkorelasi dengan derajat infeksi parasit dalam tubuh inang (Seres dan Cozma
Keberadaan koproantigen dapat dideteksi dengan antibodi anti
koproantigen yang akan direaksikan dengan feses melalui uji serologis (Satrija
2009). Antibodi anti koproantigen dapat berupa monoklonal antibodi atau
poliklonal antibodi yang diproduksi dengan memanfaatkan protein whole worm
extract (WWE) cacing parasit (Guezala et al. 2009). Selain itu, antibodi anti
koproantigen juga dapat diproduksi dengan memanfaatkan Ekskretori/Sekretori
(E/S) dari produk metabolisme cacing parasit yang diimunisasikan kedalam tubuh
hewan coba.
1.2 Tujuan
Penelitian ini bertujuan untuk membandingkan pembentukan antibodi
poliklonal (Ig G) anti E/S Fasciola gigantica dari isolat asal domba dan kerbau
2.
TINJAUAN PUSTAKA
2.1 Kelinci
Kelinci merupakan hewan yang umum digunakan untuk penelitian dan
produksi bahan biologis. Penggunaan kelinci sebagai hewan coba pada penelitian
immunodiagnostik terhadap Fasciola sp. pernah dilakukan oleh Sewell (1964),
Schalch et al. (1979), Moazeni et al. (2005), dan Mahmoud et al. (2008).
Klasifikasi kelinci menurut Orr (1976) sebagai berikut:
Filum : Cordata
Subfilum : Craniata
Kelas : Mamalia
Subkelas : Theria
Ordo : Lagomorpha
Famili : Leporidae
Subfamili : Leporinae
Genus : Oryctolagus
Spesies : Oryctolagus sp.
Penggunaan kelinci sebagai hewan coba sangat menguntungkan karena
kelinci mudah dipelihara, relatif ekonomis, dan mudah diambil darahnya (Smith
1995). Secara anatomis, telinga kelinci yang panjang dan banyak mengandung
pembuluh darah memudahkan dalam pengambilan sampel darah. Pemilihan
kelinci sebagai hewan coba untuk produksi antibodi secara eksperimental di
laboratorium karena ukuran tubuh yang lebih besar dibandingkan hewan coba
laboratorium lain seperti tikus ataupun mencit, sehingga diperoleh darah lebih
banyak (IACUC 2010).
2.2 Cacing Fasciola gigantica
Fasciola gigantica merupakan salah satu spesies cacing dari genus
Fasciola yang termasuk ke dalam trematoda digenea. Habitat cacing ini ada di
dalam pembuluh empedu. Fasciola gigantica memiliki siklus hidup yang mirip
dengan Fasciola hepatica yang membutuhkan inang antara dan inang definitif.
Siput dari genus Lymnaea merupakan inang antara Fasciola gigantica yang
gigantica yaitu domba, sapi, dan kerbau serta mamalia lain seperti babi, kuda, dan
manusia. Fasciola gigantica secara morfologi memilki ukuran yang lebih besar
dibandingkan Fasciola hepatica. Panjang tubuhnya dapat mencapai 7,5 cm
dengan lebar 1,2 cm dan tidak memiliki “bahu” yang menonjol seperti Fasciola
hepatica. Ukuran telurnya mencapai 200x105 mikron, telurnya berkulit tipis dan
memiliki operkulum (Levine 1990). Menurut Levine (1990), trematoda ini
diklasifikasikan sebagai berikut:
Filum : Platyhelminthes
Kelas : Trematoda
Subkelas : Digenea
Ordo : Echinostomorida
Subordo : Echinostomorina
Famili : Fasciolidae
Genus : Fasciola
Spesies : Fasciola gigantica
Secara umum, morfologi klasik trematoda memiliki tubuh dorsoventral,
dan tidak bersegmen seperti daun. Tubuh trematoda tidak memiliki rongga badan
dan semua organ berada di jaringan parenkim (Levine 1990). Trematoda memiliki
dua alat penghisap yang khas yaitu batil hisap mulut atau batil hisap anterior yang
mengelilingi mulut dan batil hisap posterior atau asetabulum yang terletak di
dekat pertengahan tubuh atau pada ujung posterior (Noble dan Noble 1989).
Trematoda secara seluler memiliki lapisan luar (epikutikula) yang tidak
berinti dan bersinsitial. Epikutikula dihubungkan oleh tabung-tabung sitoplasmik
sempit dengan bagian tegumen yang berinti melalui sitoplasma membrana
basalis dan lapisan otot-otot tubuh. Terdapat mikrovili dan vesikula pinositik pada
permukaan luar larva dan cacing dewasa. Struktur ini menimbulkan dugaan
adanya fungsi ekskretori dan sekretori (Noble dan Noble 1989). Kutikula atau
dinding luar (tegumen) trematoda kadang-kadang mengandung duri atau sisik
(Levine 1990).
Absorbsi glukosa berlangsung lewat tegumen yang membantu aktivasi
nutrisi secara umum pada cacing. Tegumen juga berkaitan dengan fungsi
karena asam-asam mukopolisakarida, polifenol, dan mucin (lendir). Resistensi
yang dimiliki merupakan suatu faktor utama dalam melindungi cacing terhadap
sistem pertahanan inang (Noble dan Noble 1989).
2.3 Antigen Ekskretori/Sekretori (E/S)
Antigen (antibody generations) adalah suatu senyawa atau substansi yang
dapat menggertak sistem imunitas dapatan pada inang atau individu. Antigen
dapat berupa polisakarida, protein, lemak, asam inti atau lipopolisakarida, maupun
lipoprotein (Guyton dan Hall 2007). Ciri pokok antigenisitas suatu bahan atau
senyawa ditentukan dari limitasi fisikokimiawi serta derajat keasingan (Tizard
2004). Limitasi fisikokimiawi suatu bahan atau senyawa agar dapat bersifat
imunogenik yaitu ukuran molekul harus besar, kaku dan memiliki struktur kimia
kompleks. Ciri pokok yang kedua yaitu derajat keasingan atau frekuensi paparan
suatu bahan atau senyawa di dalam tubuh. Antigenisitas suatu bahan atau senyawa
juga ditentukan oleh derajat suseptibilitas antigen di dalam tubuh (Kuby 2007).
Protein merupakan antigen yang terbaik karena ukuran dan kerumitan
strukturnya. Hampir semua protein yang berat molekulnya lebih besar dari 8000
dalton bersifat antigenik. Pembentukan sifat antigenik tergantung kepada
pengulangan kelompok molekul secara regular, yang disebut epitop (antigenik
determinan) pada permukaan molekul besar (Guyton dan Hall 2007).
Hewan, tumbuhan, serta parasit dapat menghasilkan substansi antigenik.
Substansi tersebut tidak hanya terkandung dalam jaringan tubuh, namun juga
terdapat dalam hasil metabolisme berupa Ekskretori/Sekretori (E/S) baik berasal
dari hewan, tanaman, maupun cacing parasit (Balqis 2006). Substansi antigenik
yang dihasilkan pada umumnya merupakan senyawa enzim. E/S Fasciola
hepatica telah diketahui mengandung enzim enolase, leucine aminopeptidase
(LAP), dan phosphoenolpyruvate carboxykinase (PEPCK) sebagai antigen yang
bersifat imunodominan. Selain Fasciola hepatica, PEPCK merupakan imunogen
utama yang diperoleh dari E/S telur Schistosoma mansoni (Marcilla et al. 2008).
Enzim cathepsin L1 merupakan imunogen dominan pada E/S Fasciola gigantica
yang telah dimanfaatkan sebagai kit diagnostik untuk mendeteksi antibodi (Ig G)
Transferase (GSTs) merupakan enzim yang terkandung baik dalam E/S maupun
ekstrak somatik Fasciola spp yang berperan dalam detoksifikasi anthelmentik
(Alirahmi et al. 2010). Sifat antigenik atau imunogenik E/S dari cacing golongan
nematoda dan trematoda telah diketahui berasal dari kutikula dan tegumen. E/S
yang dihasilkan oleh cacing parasitik berperan sebagai antigen yang memicu
kehadiran antibodi dalam tubuh inang (Lightowlers dan Rickard 1988).
2.4 Imunitas (Respon Kekebalan)
Imunitas berasal dari bahasa latin immunis yang berarti bebas. Imunitas
atau respon kekebalan merupakan kemampuan untuk mencegah terjadinya infeksi,
meniadakan kerja toksin dan faktor virulen lainnya yang bersifat antigenik
maupun imunogenik. Suatu bahan yang bersifat antigenik (antigen) artinya
mampu merangsang pembentukan antibodi spesifik terhadap suatu senyawa.
Selain mampu merangsang pembentukan antibodi spesifik yang bersifat protektif
terhadap senyawa penginduksinya, antigen juga mampu meningkatkan respon
kekebalan seluler (Wibawan et al. 2003).
Secara umum respon kekebalan tubuh terbagi dua yaitu kekebalan
non-spesifik dan kekebalan non-spesifik. Respon kekebalan non-non-spesifik berupa kekebalan
fisik-mekanik, kimiawi, serta seluler. Kekebalan fisik mekanik dilakukan oleh
kulit dan selaput lendir. Kekebalan kimiawi dilakukan oleh cairan tubuh yang
berupa keringat, air mata, cairan limfe, maupun lendir. Kekebalan seluler
non-spesifik dilakukan oleh makrofag dan mikrofag atau sel polimorf nuclear (PMN)
(Black 2005). Respon kekebalan spesifik berkaitan dengan sel limfosit B dan sel
limfosit T. Respon kekebalan spesifik terdiri atas respon imun berperantara
antibodi (respon humoral) dan respon imun berperantara sel (Wibawan et al.
2003).
Respon imun berperantara antibodi (respon humoral) melibatkan sel
limfosit B. Sel limfosit B berdiferensiasi menjadi sel plasma yang menghasilkan
antibodi untuk menetralkan antigen interseluler. Selain sel plasma, sel limfosit B
juga berdiferensiasi menjadi sel memori. Respon imun berperantara sel
melibatkan sel limfosit T yang terdiri dari sel limfosit T sitotoksik dan sel limfosit
intraseluler sedangkan sel limfosit T helper berperan untuk membantu sel limfosit
B (Black 2005). Penyingkiran cacing dalam sistem pencernaan memerlukan
proses rumit yang melibatkan respon kekebalan humoral dan seluler (Patterson
1995).
2.5 Antibodi Poliklonal
Antibodi hasil hiperimunisasi disebut antibodi poliklonal. Hiperimunisasi
merupakan imunisasi yang dilakukan secara sengaja terhadap hewan dengan suatu
imunogen spesifik. Antibodi poliklonal memiliki campuran kompleks antibodi
dengan spesifitas, afinitas, dan isotipe yang berbeda. Antibodi poliklonal memiliki
reaktivitas multipel yaitu bereaksi dengan sejumlah epitop (antigen determinan)
yang berbeda pada antigen. Reaktivitas multipel ini dapat mengakibatkan
terbentuknya kompleks antigen antibodi yang besar dalam bentuk presipitasi.
Selain itu, reaktivitas multipel antibodi poliklonal dapat menimbulkan reaksi
silang. Reaksi silang yang terjadi umumnya akibat adanya antibodi terhadap
antigen lain yang tidak berkaitan dan tidak relevan. Reaksi silang juga dapat
terjadi karena kesamaan epitop dari antigen yang berbeda atau karena kemiripan
struktur epitop antigen lain dengan epitop pembuat peka (priming epitop) yang
dikenali oleh antibodi (Smith 1995).
Antibodi terdiri dari unit dasar yang disebut imunoglobulin (Ig).
Imunoglobulin merupakan grup penyusun antibodi yang secara umum memiliki
dua karakteristik yaitu kimia dan biologi (Black 2005). Imunoglobulin secara
kimia memiliki struktur berupa rantai polipeptida (dua rantai ringan dan dua rantai
berat). Secara biologi, produksi imunoglobulin distimulasi oleh antigen dan
memiliki reaksi yang spesifik (Barriga 1981).
Imunoglobulin dapat dikelompokkan berdasarkan sifat-sifat dasarnya
(Guyton dan Hall 2007). Sifat dasar tersebut berupa derajat kelarutan dalam
larutan garam, muatan elektrostatik, berat molekul dan struktur antigeniknya
(Tizard 2004). Terdapat lima golongan immunoglobulin yaitu Ig M, Ig G, Ig A, Ig
E dan Ig D. Diantara lima golongan imunoglobulin tersebut, Ig G merupakan
imunoglobulin yang umum digunakan dalam produksi bahan biologis untuk
paling banyak yaitu 70-75% di dalam serum normal dibandingkan Ig M (antibodi
pertama yang muncul dalam respon primer), Ig A, Ig E dan Ig D. Ig G memiliki
struktur monomer dengan berat molekul 146.000 dalton serta merupakan antibodi
utama dari respon imun sekunder (De Buysscher dan Patterson 1995).
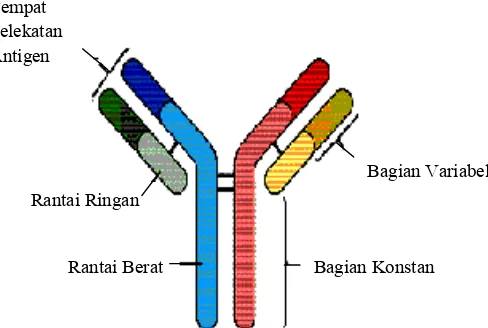
Secara struktural, Ig G memiliki empat rantai polipeptida yang terbagi atas
dua rantai berat identik serta dua rantai ringan (Gambar 1). Rantai berat dan rantai
ringan polipeptida dihubungkan oleh ikatan disulfida yang terdapat pada bagian
engsel (hinge region). Masing-masing rantai berat dan ringan dari Ig G memiliki
bagian konstan atau tetap dan bagian yang dapat berubah atau variabel (Guyton
dan Hall 2007).
Variabel (v) atau bagian yang dapat berubah pada struktur Ig G memiliki
fungsi khusus untuk melekat pada antigen, sedangkan bagian tetap atau konstan
menentukan sifat biologis Ig G dan beberapa faktor seperti penyebaran Ig G
dalam jaringan, pelekatan Ig G pada struktur spesifik jaringan, pelekatan pada
kompleks komplemen, serta kemudahan Ig G dalam melewati membran dan
beberapa sifat biologis Ig G yang lain (Guyton dan Hall 2007).
Gambar 1 Struktur Ig G pada mamalia (Mader 1997)
Bagian Konstan Bagian Variabel
Rantai Berat Rantai Ringan Tempat
Pelekatan Antigen
2.6 Adjuvant
Adjuvant merupakan senyawa yang berfungsi memperlambat pengeluaran
antigen didalam tubuh. Adjuvant dapat memodifikasi imunogen atau berkerja
pada tingkat sel dari respon kekebalan inang. Penambahan adjuvant dapat
meningkatkan imunogenisitas melalui perubahan struktural atau elektrostatik
antigen, meningkatkan agregasi molekul antigen, serta memodifikasi presentasi
antigen. Adjuvant mempengaruhi sistem kekebalan inang dengan membentuk
depot imunogen, menarik sel-sel mononuklear ke lokasi penyuntikan,
meningkatkan sirkulasi limfosit, memodifikasi membran sel (agen
aktif-dipermukaan), merangsang aktivitas sel yang terlibat dalam respon kekebalan, dan
menginduksi atau menghambat pembebasan molekul-molekul kecil yang
mengatur fungsi sel dalam system kekebalan (Smith 1995).
Emulsi air-dalam-minyak merupakan bentuk adjuvant paling awal.
Terdapat dua tipe adjuvant emulsi air-dalam-minyak. Tipe pertama yaitu adjuvant
tak lengkap Freund (Freund’s incomplete adjuvant) merupakan adjuvant tanpa
campuran mikobakteri. Tipe kedua yaitu adjuvant lengkap Freund (Freund’s
complete adjuvant) merupakan campuran minyak mineral dan pengemulsi dengan
mikobakteri (Smith 1995).
Adjuvant lengkap Freund merupakan adjuvant yang sangat kuat.
Aktivitasnya diperkuat oleh bagian aktif mikobakteri yaitu muramil dipeptida
(n-acetyl-muramyl-L-alanyl-D-isoglutamin). Muramil dipeptida merangsang fungsi
makrofag dan merangsang respon antibodi yang kuat dalam waktu lama. Rute
penyuntikkan terbaik yaitu subkutan atau intradermal. Adjuvant bertindak khusus
untuk merangsang fungsi sel T dan hanya meningkatkan reaksi antigen-tergantung
timus. Adjuvant meningkatkan produksi Ig G melebihi Ig M (Tizard 2004).
2.7 Agar Gel Precipitation Test (AGPT)
Uji presipitasi antigen-antibodi yang terlarut atau Agar gel precipitation
test (AGPT) merupakan salah satu teknik imunodiagnostik yang termasuk
kedalam jenis uji pengikatan sekunder yaitu mengukur hasil interaksi
antigen-antibodi (kompleks antigen-antigen-antibodi) secara in vitro (Tizard 2004). Uji presipitasi
digunakan untuk mendiagnosa fasciolosis pada kelompok ternak sapi ataupun
kerbau pada penelitian Linh et al. (2003). Jumlah antibodi minimal yang dapat
dideteksi pada uji AGPT yaitu 30 µg/ml antibodi. AGPT dapat digunakan untuk
mendeteksi antigen yang berbeda dengan satu jenis antibodi ataupun antibodi
yang berbeda dengan satu jenis antigen yang terdapat pada sampel serum (Black
2005).
Reaksi AGPT melibatkan keberadaan ion antigen divalent atau multivalent
dan sangat tergantung pada proporsi antigen terhadap antibodi (Barriga 1981).
Reaksi ini juga dipengaruhi oleh pH, temperatur, aviditas atau kestabilan
kompleks antigen-antibodi dan afinitas atau kekuatan ikatan kompleks
antibodi-antigen (Tizard 2004). Pembentukan presipitasi diinisiasi oleh pembentukkan
kompleks molekul antigen-antibodi yang saling bereaksi diikuti dengan proses
agregasi serta sedimentasi kompleks tersebut (Barriga 1981). Presipitasi yang
terbentuk mulai hitungan menit hingga jam terlihat sebagai suatu garis opaq
dalam suatu media agar semisolid. Garis opaque yang terbentuk disebut sebagai
3. BAHAN DAN METODE
3.1 Tempat Penelitian
Penelitian dilaksanakan di Laboratorium Terpadu Immunologi,
Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner dan
Kandang Terpadu, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Penelitian ini berlangsung dari bulan Januari hingga Juli 2010.
3.2 Metode Penelitian
3.3.1 Persiapan dan Pemeliharaan Kelinci sebagai Hewan Coba
Hewan coba yang digunakan dalam penelitian ini merupakan kelinci lokal
jantan sebanyak dua ekor, berumur 6 bulan dengan bobot badan masing-masing 1
kg, yang berasal dari Balai Penelitian Peternakan (Balitnak) Ciawi, Bogor. Lima
hari sebelum imunisasi aktif, kelinci dipastikan bebas dari koksidiosis dan scabies.
Preparat sulfa dengan dosis 30-60 mg/kgBB diberikan secara peroral yang
dilarutkan kedalam air minum disertai dengan pemeriksaan tinja selama maksimal
tiga hari untuk pencegahan koksidiosis. Ivomex® dengan dosis 0.2 µg/kgBB
diberikan melalui injeksi subkutan untuk mencegah infeksi agen parasit lain
terutama sarcoptes scabieii. Kelinci dipelihara secara individual dalam kandang
dan diberi pakan berupa pelet serta sayuran (wortel dan kangkung).
3.3.2 Persiapan Antigen E/S Fasciola gigantica
Antigen yang digunakan untuk imunisasi dalam penelitian ini merupakan
antigen E/S Fasciola gigantica asal domba dan kerbau dari hasil penelitian Satrija
(2009). Fasciola gigantica dewasa dikoleksi dari hati kerbau di Rumah Potong
Hewan (RPH) Kota Bekasi serta hati domba dari Tempat Pemotongan Hewan
(TPH) di Empang-Kota Bogor. Antigen berupa protein E/S F. gigantica
diproduksi dan diisolasi dari cacing dewasa menurut metode Satrija et al. (2007)
yang dimodifikasi.
Cacing hati (F. gigantica) dewasa yang telah dikoleksi dicuci tiga kali
dengan larutan NaCl fisiologis sebelum dicuci dengan larutan PBS steril. Untuk
menyiapkan antigen dari ES F. gigantica yang telah dicuci NaCl fisiologis, dalam
penisilin 1000 IU dan streptomisin 100 µg permililiter dalam larutan RPMI 1640
pada suhu 37oC selama 4-6 jam. Setiap tabung diisi dengan 10 ml RPMI 1640 dan
10 ekor cacing dewasa. Setelah inkubasi, protein ES dipanen dengan melakukan
sentrifugasi terhadap larutan RPMI dengan kecepatan 1500g pada suhu 4oC
selama 10 menit. Selanjutnya supernatant yang mengandung protein ES
dipisahkan dari endapanProtein E/S F. gigantica yang didapat selanjutnya
disimpan dalam tabung-tabung mikro volume 1,5 ml pada suhu -20oC sampai saat
digunakan sebagai antigen untuk imunisasi kelinci.
3.3.3 Pengukuran Konsentrasi Protein Antigen dengan Metode Bradford
Konsentrasi protein sampel antigen E/S Fasciola gigantica diukur
menggunakan metode Bradford (1976) sebelum digunakan untuk imunisasi.
Metode Bradford digunakan secara luas untuk penentuan protein secara kuantitatif
dengan menggunakan pereaksi Commasie Briliant Blue. Konsentrat Bradford
terdiri dari 100 mg Commasie Briliant Blue yang dilarutkan dalam 50 ml etanol
95% dan ditambahkan sebanyak 100 ml asam fosfat 85% (w/v) serta diencerkan
dengan aquabides hingga volume larutan mencapai 1 liter kemudian disaring
menggunakan kertas saring. Konsentrat Bradford tersebut diencerkan dengan dua
kali pengenceran menggunakan aquades dengan perbandingan 1:4 dan 1:9.
Larutan protein Bovine Serum Albumin (BSA) standar dibuat dengan
perbandingan 1:1 antara Bovine Serum Albumin (BSA) dengan aquabides (1 mg
dalam 1 ml) kemudian dihomogenkan. Kemudian sebanyak 11 tabung reaksi yang
telah disterilisasai disiapkan. Masing-masing tabung diisi dengan larutan BSA dan
aquabides (Tabel 1). Masing-masing larutan dihomogenkan dan diambil sebanyak
100 µl dari setiap tabung kemudian dimasukkan ke dalam masing-masing tabung
baru yang sebelumnya telah dimasukkan 5 ml larutan Bradford sesuai urutan
Tabel 1 Tata cara pengisian larutan BSA dan Aquabides
Tabung Larutan BSA Aquabides
1 0 µl 1000 µl
2 100 µl 900 µl
3 200 µl 800 µl
4 300 µl 700 µl
5 400 µl 600 µl
6 500 µl 500 µl
7 600 µl 400 µl
8 700 µl 300 µl
9 800 µl 200 µl
10 900 µl 100 µl
11 1000 µl 0 µl
Larutan protein Bovine Serum Albumin (BSA) digunakan untuk membuat
grafik konsentrasi protein standar pada spektrofotometer yang diukur dengan
panjang gelombang (λ) 595 nm sebelum mengukur protein sampel antigen.
Setelah itu sampel berupa ES cacing yang akan diperiksa dibuat duplo.
Masing-masing sampel diambil sebanyak 100 µl yang dimasukkan ke dalam masing-masing tabung yang kemudian ditambahkan dengan larutan Bradford sebanyak 5
ml. Larutan Bradford dan sampel dilarutkan hingga homogen kemudian dilakukan
pembacaan konsentrasi menggunakan spektrofotometer dengan panjang
gelombang (λ) 595 nm.
3.3.4 Teknik Imunisasi
Dua ekor kelinci diimunisasi dengan antigen E/S Fasciola gigantica.
Dosis antigen yang diberikan adalah 150 µg/ekor. Antigen pada imunisasi
pertama diberikan tanpa adjuvant. Rute penyuntikkan dilakukan secara intravena
(i.v). Imunisasi kedua diberikan seminggu kemudian dengan rute subkutan (s.c).
Antigen pada imunisasi kedua ditambah adjuvant Freund lengkap (Freund’s
complete adjuvant) dengan perbandingan 1:1. Imunisasi ketiga hingga imunisasi
kelima masing-masing diberikan dengan selang dua minggu. Antigen pada
imunisasi ketiga hingga kelima ditambah adjuvant Freund tak lengkap (Freund’s
incomplete adjuvant) dengan perbandingan 1:1. Imunisasi diberikan dengan rute
Tabel 2 Tata cara penyuntikkan antigen
Kelinci Antigen Penyuntikkan (Minggu ke-)
0 1 3 5 7 1 (KP)
E/S F. gigantica asal Domba
Tanpa
Adjuvant FAC FAI FAI FAI
2 (KH)
E/S F. gigantica asal Kerbau
Tanpa
Adjuvant FAC FAI FAI FAI
Keterangan: Tanpa Adjuvant (Rute i.v)
FAC = Freund’s Adjuvant Complete (Rute s.c) FAI = Freund’s Adjuvant Incomplete (Rute s.c)
KP = Kelinci yang diimunisasi E/S F. gigantica asal domba KH = Kelinci yang diimunisasi E/S F. gigantica asal kerbau
3.3.5 Teknik Pengambilan Darah
Darah kelinci diambil sebanyak 1,5-2 ml melalui vena auricularis dengan
menggunakan disposable syringe 3 ml (IACUC 2010). Pengambilan darah
pertama dilakukan sebelum kelinci diimunisasi. Pengambilan darah kedua
dilakukan seminggu setelah pengambilan darah pertama dan pengambilan darah
ketiga dilakukan empat minggu setelah pengambilan darah kedua. Pengambilan
darah berikutnya dilakukan setiap seminggu sekali hingga minggu ke-14. Sampel
darah dimasukkan dalam tabung reaksi untuk diambil serumnya.
3.3.6 Teknik Pengumpulan Serum
Darah yang diambil dari kedua kelinci, dikumpulkan dalam tabung
terpisah yang dimasukkan ke dalam inkubator dengan suhu 37oC dengan posisi
miring selama 30 menit. Kemudian disimpan dalam refrigerator semalam pada
suhu 4oC. Serum yang didapat dikumpulkan menggunakan pipet mikro. Bila
perlu, darah disentrifus dengan kecepatan 2000g selama 15 menit. Serum yang
didapat dipisahkan kemudian dimasukkan ke dalam tabung mikro dan diberi
tanggal pengambilan darah serta kode kelinci.
3.3.7 Pembuatan Antigen Terlarut
Antigen dan antibodi harus dapat berdifusi dengan baik dalam uji
presipitasi menggunakan media agar. Antibodi dalam serum memiliki ukuran
memiliki molekul protein yang besar sehingga harus dipecah salah satunya
dengan menggunakan teknik sonikasi. Teknik sonikasi digunakan dalam
penelitian ini untuk membuat antigen E/S Fasciola gigantica menjadi terlarut
(solubel) dalam agar (Parimala dan Ishaq 2005). Antigen E/S Fasciola gigantica
dimasukkan dalam tabung sonikasi. Tabung sonikasi dimasukkan dalam sonikator
yang berisi air bersuhu 4oC. Hal ini bertujuan untuk mendinginkan tabung dan
mencegah kerusakan antigen karena panas yang ditimbulkan selama proses
berlangsung. Proses sonikasi dilakukan kurang lebih selama tiga menit dengan
frekuensi 50.000 Hz.
3.3.8 Teknik Agar Gel Precipitation Test (AGPT)
Agar Gel Precipitation Test (AGPT) merupakan uji presipitasi antigen
yang terlarut. Teknik uji presipitasi dalam penelitian ini menggunakan metode
Ouchterlony (1953). Bahan untuk AGPT terdiri atas Phosphate Buffer Saline
(PBS) dengan pH 7,4, aquabides, agarose 1%, dan Na acide 0,001%. Campuran
tersebut dipanaskan dalam microwave atau dengan penangas air sampai agar larut
dan mendidih. Sebanyak 4 ml larutan agar dituang diatas gelas objek hingga
seluruh permukaan gelas objek tertutup dengan agar dan dibiarkan hingga
mengeras. Agar yang telah mengeras, dilubangi menggunakan puncher agar.
Lubang pada bagian tengah diisi dengan antigen yang telah disonikasi dan enam
lubang disekelilingnya diisi dengan serum antibodi yang akan diuji (Boulanger
1967). Agar disimpan di dalam wadah tertutup yang telah dialasi dengan kertas
atau tissue basah untuk menjaga kelembaban dan didiamkan selama 24 hingga 48
jam pada suhu ruang. Pengamatan dapat dilakukan dengan melihat garis
presipitasi yang terbentuk.
` 3.3.9 Pemurnian Immunoglobulin G (Ig G)
Serum kelinci positif mengandung antibodi dimurnikan menggunakan
metode pemurnian dari Montage® Antibody Purification Kit and Spin Columns
with PROSEP®-A Media. Media PROSEP®-A yang digunakan dipre-ekuilibrasi
menggunakan 10 ml Binding Buffer A dengan mensentrifus spin column dengan
Fasciola gigantica kerbau dan domba disaring menggunakan 0,2 µm Steriflip-GP
filter. Serum yang telah difiltrasi ditambahkan dengan Binding Buffer A dengan
volume yang sama banyak (perbandingan 1:1 v/v) kemudian disentrifus dengan
kecepatan 500g selama 30 menit pada suhu 4oC. Supernatan didasar tabung
dibuang kemudian spin column dibilas menggunakan 20 ml Binding Buffer A dan
disentrifus dengan kecepatan 500g selama 30 menit pada suhu 4oC untuk
menghilangkan kontaminan yang tidak terikat. Sepuluh ml Elution Buffer B2
ditambahkan langsung kedalam spin column dalam tabung steril baru yang telah
diisi 1,3 ml Neutralization Buffer C kemudian disentrifus dengan kecepatan 4500g
selama 40 menit pada suhu 4oC. Supernatan didasar tabung yang mengandung Ig
G diambil, kemudian difiltrasi menggunakan Amicon 30.000 dan disentrifus
dengan kecepatan 4500g selama 25 menit pada suhu 4oC. Konsentrasi Ig G
dihitung menggunakan spektrofotometer pada panjang gelombang 595 nm dengan
metode Bradford (1976). Supernatan berupa Ig G yang tertinggal didalam filter
disimpan dalam tabung-tabung mikro volume 1,5 ml, disimpan dalam suhu -20oC.
Ig G yang telah dipurifikasi diuji kembali dengan AGPT menggunakan antigen
4.
HASIL DAN PEMBAHASAN
Hasil pemeriksaan konsentrasi antigen E/S Fasciola gigantica asal domba
dan kerbau masing-masing sebesar 6755 µg /ml dan 6420 µg/ml. Dosis protein
antigen untuk dapat menginduksi antibodi pada kelinci adalah 50–1000 µg
antigen(IACUC 2010). Dengan demikian, dosis yang digunakan dalam penelitian
ini (5x 150 µg/ekor) merupakan dosis yang cukup untuk menginduksi antibodi.
Berdasarkan pemeriksaan AGPT, kelinci yang diimunisasi dengan antigen
E/S Fasciola gigantica asal domba sudah menunjukkan adanya pembentukkan
antibodi terhadap E/S Fasciola gigantica asal domba pada minggu ke-4. Berbeda
dengan kelinci yang disuntik antigen E/S Fasciola gigantica asal kerbau, antibodi
yang terbentuk terhadap E/S Fasciola gigantica asal kerbau, baru dapat dideteksi
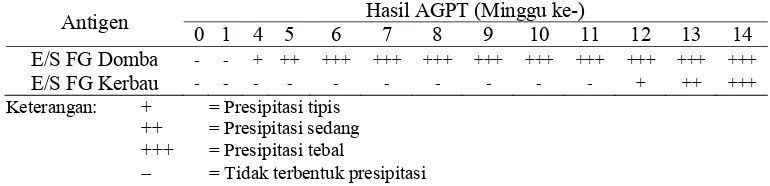
pada minggu ke-12 (Tabel 3).
Tabel 3 Data hasil AGPT dilihat dari penebalan presipitasi
Antigen Hasil AGPT (Minggu ke-)
0 1 4 5 6 7 8 9 10 11 12 13 14
E/S FG Domba - - + ++ +++ +++ +++ +++ +++ +++ +++ +++ +++
E/S FG Kerbau - - - + ++ +++
Keterangan: + = Presipitasi tipis
++ = Presipitasi sedang
+++ = Presipitasi tebal
= Tidak terbentuk presipitasi
Garis presipitasi yang tebal mulai tampak dari serum yang mengandung
antibodi anti E/S Fasciola gigantica asal domba pada minggu ke-6. Perbandingan
antara garis presipitasi awal yang terbentuk dan penebalan presipitasi antibodi anti
E/S Fasciola gigantica asal domba,dapat dilihat pada Gambar 2. Serum yang
mengandung antibodi anti E/S Fasciola gigantica asal kerbau nampak tebal pada
minggu ke-14. Perbandingan antara garis presipitasi awal yang terbentuk dan
penebalan presipitasi antibodi anti E/S Fasciola gigantica asal kerbau, dapat
dilihat pada Gambar 3. Namun, deteksi garis presipitasi antibodi anti E/S Fasciola
gigantica asal kerbau yang terbentuk tidak setebal presipitasi antibodi anti E/S
[image:30.612.103.503.54.775.2]
Gambar 2 Hasil AGPT; (a) presipitasi antibodi anti E/S Fasciola gigantica asal domba (KP) pada minggu ke-4 (dengan antigen E/S Fasciola gigantica asal domba ditengah sumur); (b) presipitasi antibodi anti E/S Fasciola gigantica asal domba (KP) pada minggu ke-6 (dengan antigen E/S Fasciola gigantica asal domba ditengah sumur).
[image:30.612.310.488.327.450.2]
Gambar 3 Hasil AGPT; (a) presipitasi antibodi anti E/S Fasciola gigantica asal kerbau (KH) pada minggu ke-12 (dengan antigen E/S Fasciola gigantica asal kerbau ditengah sumur) terbentuk samar; (b) presipitasi antibodi anti E/S Fasciola gigantica asal kerbau (KH) pada minggu ke-14 (dengan antigen E/S Fasciola gigantica asal kerbau ditengah sumur).
Pemeriksaan terhadap adanya antibodi anti E/S Fasciola gigantica pada
masing-masing kelinci setelah dua kali penyuntikkan yaitu penyuntikkan pertama
(minggu ke-0) maupun kedua (minggu ke-1) belum menunjukkan adanya
presipitasi. Hal tersebut dapat disebabkan oleh rendahnya antibodi yang terbentuk
atau antibodi belum dibentuk pada saat itu. Pengujian keberadaan antibodi dengan
uji AGPT memerlukan konsentrasi yang cukup tinggi. Antibodi minimal dalam
serum yang dapat dideteksi oleh uji AGPT yaitu 30 µg/ml (Tizzard 2004). Ag. E/S FG Domba
Ag E/S FG Kerbau Ag E/S FG Kerbau
Ag. E/S FG Domba
KP4 KP4 KP4 KH4 KH4 KP3 KP2
KP1 KH
4 KH2 KH3 KH1 (a) (b) KH5 KH5 KH5 KH5 KH5 KH5 KH6 KH6 KH6 KH6 KH6 KH6
Penelitian lain menunjukkan respon pembentukkan antibodi pada kelinci yang
diinfeksi 20 metaserkaria Fasciola gigantica muncul setelah 2 minggu pasca
infeksi. Peningkatan level antibodi terjadi setelah 8-10 minggu pasca infeksi dan
menurun hingga mencapai level yang stabil setelah 12-14 minggu pasca infeksi
(Mahmoud et al. 2008).
Antibodi yang berperan dalam presipitasi antigen merupakan
imunoglobulin G (Ig G). Ig G merupakan imunoglobulin yang memiliki fungsi
untuk netralisasi toksin, antigen virus, serta presipitasi antigen terlarut (Allan
1980). Mekanisme produksi Ig G diinisiasi oleh limfokin yang disekresikan oleh
sel T helper. Limfokin akan menggertak proliferasi sel plasma dari limfosit B
untuk memproduksi Ig G ketika terdapat paparan antigen untuk pertama kalinya.
Sel plasma akan membentuk imunoglobulin M (Ig M) sebelum membentuk Ig G.
Ig M merupakan antibodi yang pertama kali dibentuk oleh sel plasma pada respon
primer setelah paparan antigen pertama. Produksi Ig M akan menurun dan
produksi Ig G meningkat (Black 2005).
Paparan antigen baru yang sama untuk kedua kalinya (booster), akan
mengaktivasi sel memori dan menimbulkan respon antibodi kedua kali yang jauh
lebih cepat dan kuat dalam respon sekunder (Guyton dan Hall 2007). Hal ini
disebabkan sel memori berproliferasi dengan cepat membentuk sel plasma yang
menghasilkan antibodi dalam jumlah besar. Pada respon sekunder, Ig M
diproduksi dalam jumlah kecil dan dengan waktu yang singkat untuk kemudian Ig
G diproduksi dalam jumlah besar (Black 2005). Ig G merupakan antibodi
dominan yang jumlahnya mencapai 75% dari total serum darah normal (Guyton
dan Hall 2007). Ig G mencapai konsentrasi yang signifikan pada vaskular dan
ruang ekstravaskular, dan memiliki masa hidup yang cukup panjang yaitu 23 hari
(Jackson 1978). Ig G juga berkontribusi dalam aktivitas antibodi di jaringan
tubuh. Pemaparan berulang antigen dilakukan untuk mempertahankan keberadaan
antibodi spesifik berupa Ig G dalam darah (Barriga 1981).
Hasil penelitian ini menunjukkan bahwa antibodi anti E/S Fasciola
gigantica asal domba terbentuk lebih cepat dibandingkan antibodi terhadap E/S
Fasciola gigantica asal kerbau. Perbedaan waktu untuk menimbulkan respon
bervariasi dan tergantung pada imunogenisitas, bentuk dan stabilitas stimulant,
spesies hewan, rute injeksi, serta sensitivitas uji yang digunakan untuk mendeteksi
antibodi pertama yang terbentuk (Herscowitz 1978). Respon inang terhadap
imunogen yang diberikan tidak hanya ditentukan oleh sifat fisikokimia imunogen,
namun juga ditentukan oleh beberapa faktor terkait inang, termasuk kedalamnya
yaitu genetik, umur, status nutrisi, dan efek sekunder yang diturunkan dari suatu
proses penyakit (Jackson 1978). Kelinci yang digunakan pada penelitian ini
memiliki rataan umur, bobot badan, jenis kelamin, dosis injeksi, nutrisi, serta rute
injeksi yang sama, sehingga perbedaan waktu pembentukkan antibodi antara
kedua kelinci dapat disebabkan karena adanya perbedaan karakter antigen protein
E/S Fasciola gigantica.
Perbedaan antara karakter E/S Fasciola gigantica dapat memengaruhi
respon pembentukkan antibodi. Kedua jenis antigen tersebut merupakan protein
yang berasal dari spesies cacing yang sama, namun E/S Fasciola gigantica yang
dihasilkan dapat memiliki karakter protein yang berbeda. Morfologi inang asal
Fasciola yang berbeda akan memengaruhi profil protein E/S yang dihasilkan.
Perbedaan morfologi Fasciola tergantung pada inang definitifnya (Ashour et al.
1999). Berdasarkan elektroforesis menggunakan SDS-PAGE, antigen E/S
Fasciola gigantica dari isolat asal kerbau memiliki sembilan pita protein dengan
berat molekul berkisar antara 14-80 kDa (14, 25, 40, 43, 47, 56, 69, 73, dan 80
kDa) pada penelitian Satrija (2009), sedangkan E/S Fasciola gigantica dari isolat
asal sapi memiliki 6 pita protein dengan berat molekul berkisar antara 15-42 kDa
(15, 16, 20, 24, 33, dan 42 kDa) pada penelitian Meshgi et al. (2008b). Profil
protein whole worm dan produk E/S Fasciola yang dihasilkan akan berbeda antara
isolat Fasciola yang berasal dari domba dan isolat Fasciola yang berasal dari sapi
(Meshgi et al. 2008a).
Antigen somatik Fasciola gigantica dan E/S Fasciola hepatica dari isolat
asal sapi memiliki jumlah pita protein yang berbeda. Antigen somatik Fasciola
hepatica memiliki delapan pita protein dengan berat molekul berkisar antara
18-62 kDa (18, 22, 24, 33, 36, 42, 46, dan 18-62 kDa), sedangkan antigen somatik F.
gigantica memiliki 11 pita protein dengan berat molekul berkisar antara 18-68
Perbedaan karakter protein Fasciola disebabkan oleh spesies cacing yang sama
dari inang yang berbeda, spesies cacing yang berbeda dari inang yang sama,
ataupun karena variasi geografis (Ashour et al. 1999; Karimi 2008; Meshgi et al.
2008a).
Pembentukan antibodi kelinci dipengaruhi oleh antigenisitas protein E/S
Fasciola gigantica yang disuntikkan. Ciri pokok antigenisitas suatu bahan atau
senyawa ditentukan dari limitasi fisikokimiawi serta derajat keasingan (Tizard
2004). Limitasi fisikokimiawi suatu bahan atau senyawa yaitu ukuran molekul
antigen harus besar, kaku dan memiliki struktur kimia kompleks (Kuby 2007).
Struktur kimia protein E/S Fasciola gigantica yang besar dan kompleks, akan
menghasilkan antibodi yang semakin cepat. Sifat antigenik atau imunogenik E/S
dari cacing golongan nematoda dan trematoda berasal dari kutikula dan tegumen
(Lightowlers dan Rickard 1988).
Hasil AGPT menunjukkan bahwa antibodi yang terbentuk juga dapat
mendeteksi antigen lain dari jenis cacing yang sama namun berasal dari hewan
yang berbeda. Antibodi terhadap E/S Fasciola gigantica asal domba dapat
membentuk presipitasi terhadap antigen E/S Fasciola gigantica asal kerbau.
Demikian juga dengan antibodi terhadap E/S Fasciola gigantica asal kerbau yang
membentuk presipitasi terhadap antigen E/S Fasciola gigantica asal domba.
Presipitasi hasil reaksi antibodi terhadap E/S Fasciola gigantica asal
domba dengan antigen E/S Fasciola gigantica asal kerbau terbentuk pada minggu
ke-4 (Gambar 4a). Presipitasi hasil reaksi antibodi terhadap E/S Fasciola
gigantica kerbau dengan antigen E/S Fasciola gigantica asal domba terbentuk
secara samar-samar pada minggu ke-12 (Gambar 4b). Masing-masing presipitasi
Gambar 4 Hasil AGPT; (a) serum kelinci yang dinjeksi E/S Fasciola gigantica asal domba membentuk presipitasi terhadap antigen E/S Fasciola gigantica asal kerbau; (b) presipitasi terbentuk terhadap antigen E/S Fasciola gigantica asal domba terhadap serum kelinci yang diinjeksi E/S Fasciola gigantica asal kerbau .
Gambar 5 Hasil AGPT; (a) Serum kelinci yang dinjeksi E/S Fasciola gigantica asal domba membentuk penebalan presipitasi terhadap antigen E/S Fasciola gigantica asal kerbau pada minggu ke-6; (b) Presipitasi mengalami penebalan terhadap antigen E/S Fasciola gigantica asal domba terhadap serum kelinci yang diinjeksi E/S Fasciola gigantica asal kerbau pada minggu ke-14.
Antibodi poliklonal yang terdapat dalam serum kelinci menyebabkan
reaksi silang dengan pembentukan presipitasi terhadap antigen yang berbeda.
Antibodi poliklonal merupakan antibodi yang memiliki campuran kompleks
antibodi dengan spesifitas, afinitas, dan isotipe yang berbeda (Smith 1995).
Antibodi poliklonal memiliki fungsi untuk mengikat berbagai epitop pada
permukaan molekul antigen penginduksi (Frank 2002).
Antibodi poliklonal bereaksi dengan sejumlah epitop (antigen determinan)
berbeda pada antigen sehingga menimbulkan multireaktivitas yang menyebabkan
reaksi silang. Reaksi silang dapat terjadi karena epitop yang sama dimiliki oleh
(a) (b)
KP1 KH
1 Ag E/S FG Kerbau
KP2 KP3 KH2 KH3 KH5 KH5 KH5 KH5 KH5 KH5
Ag E/S FG Domba
(a) (b)
KP4 KP4 KP4 KH4 KH4 KH4
KH6 KH6 KH6 KH6 KH6
KH6
[image:34.612.382.504.302.442.2]antigen berbeda atau epitop yang secara struktur mirip atau memiliki keserupaan
dengan epitop pembuat peka (priming epitop), dikenali oleh antibodi (Smith 1995;
Kuby 2007). Prinsip tersebut juga dapat digunakan untuk menentukan derajat
hubungan diantara molekul antigen (Tizzard 2004).
Antigen somatik F. gigantica asal kerbau, sapi dan domba memiliki
karakter protein dengan berat molekul yang sama yaitu 34 dan 28 kDa (Yocananth
et al. 2005). Tiga pita protein dengan berat molekul yang sama juga ditemukan
pada E/S dan antigen somatik dari F. hepatica and F. gigantica yaitu 24, 33, dan
42 kDa (Meshgi et al. 2008b). Hal tersebut dapat menjelaskan respon
pembentukkan antibodi silang terhadap antigen yang berbeda. Reaksi silang juga
terjadi diantara protein whole worm F. gigantica, Toxocara vitulorum dan
Moneizia expansa. Reaksi silang yang terjadi disebabkan polipeptida yang berasal
dari protein whole worm F. gigantica, Toxocara vitulorum dan Moneizia expansa
memiliki kesamaan struktur (Eman dan Kadria 2000).
Antibodi poliklonal (Ig G) anti Fasciola gigantica hasil pemurnian dengan
filtrasi kolom diuji kembali dengan AGPT menggunakan antigen E/S Fasciola
gigantica. Presipitasi pada hasil AGPT menunjukkan bahwa Ig G yang dihasilkan
mampu mengikat antigen E/S Fasciola gigantica (Gambar 6). Presipitasi yang
terbentuk ada uji AGPT menunjukkan bahwa Ig G yang dihasilkan dari serum
kelinci pada penelitian ini, dapat menjadi sumber bahan diagnostik untuk menguji
antigen E/S Fasciola gigantica baik pada kerbau maupun domba.
[image:35.612.363.488.493.624.2]
Gambar 6 Hasil AGPT; (a) Presipitasi Ig G dengan antigen E/S Fasciola gigantica asal kerbau (antigen E/S terletak ditengah sumur); (b) Presipitasi Ig G dengan antigen E/S Fasciola gigantica asal domba (antigen E/S terletak ditengah sumur).
Ag E/S FG Domba
(a) (b)
Ig G
Ig G
Ig G
Ig G
Ig G
Ig G
Ig G Ig G
Ig G Ig G
Ig G
Ag E/S FG Kerbau
5.
SIMPULAN DAN SARAN
5.1Simpulan
Simpulan yang dapat diambil dari hasil penelitian ini antara lain:
1. Penyuntikkan antigen E/S Fasciola gigantica pada kelinci, dengan dosis
150 µg/ekor mampu menginduksi produksi antibodi anti E/S Fasciola
gigantica asal domba setelah tiga kali penyuntikkan, sedangkan antibodi
anti E/S Fasciola gigantica asal kerbau terbentuk setelah lima kali
penyuntikkan.
2. Karakteristik antigen E/S Fasciola gigantica yang disuntikkan pada
kelinci pada penelitian ini, mempengaruhi perbedaaan waktu
pembentukkan antibodi anti E/S Fasciola gigantica.
5.2Saran
Penelitian yang lebih dalam dapat dilakukan untuk mengetahui spesifisitas dan
sensitivitas Ig G antibodi poliklonal terhadap Fasciola gigantica dalam
DAFTAR PUSTAKA
Alirahmi H, Farahnak A, Golmohamadi T, Esharghian MR. 2010. Comparative assay of glutathione s-transferase (GSTs) activity of excretory/secretory materials and somatic extract of Fasciola spp parasites. Acta Med Iran 48 (6):367-370.
Allan D. 1980. Outlines Of Animal Immunobiology. London: Balliere Tindall.
Ashour AA, Zakiya E, Abeer AK, Elham AN. 1999. Studies on the liver fluke Fasciola in Egypt: I- morphological and morphometrical studies. J Egypt Soc Parasitol 29 (3):979-996.
Balqis U. 2006. Karakterisasi Protease dari Ekskretori/Sekretori Stadium L3 Ascaridia galli [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Barriga OO. 1981. The Immunology of Parasitic Infections. Baltimore: University Park Press. hlm 1-16.
Black JG. 2005. Microbiology: Principles and Explorations 6th Ed. Virginia: John Wiley & Sons, Inc. hlm 470-492.
Boulanger P, Bannister GL, Gray DP, Ruckerbauer GM, Willis NG. 1967. The use of the agar double-diffusion precipitation test for the detection of the virus in swine tissue. Can J Comp Med Vet Sci 30.
Bradford MM. 1976. A Rapid and Sensitive Method for The Quantitation of Microgram Quantities of Protein Utilizing The Principle of Protein Dye Binding. Anal Biochem 72: 248-254.
Charlier J, De Meulemeester L, Claerebout E, Williams D, Vercruysse J. 2008. Qualitative and quantitative evaluation of coprological and serological techniques for the diagnosis of fasciolosis in cattle. Vet Parasitol 153:44– 51.
Copeman DB, Copland RS. 2008. Importance and Potential Impact of Liver Fluke in Cattle and Buffalo. Di dalam: Gray GD, Copland RS, Copeman DB, editor. Overcoming Liver Fluke as a Constraint to Ruminant Production in South-East Asia. Canberra: Australian Centre for International Agricultural Research (ACIAR).
Eman HA, Kadria NA. 2000. Molecular identity of major cross-reactive adult antigens in Fasciola gigantica, Toxocara vitulorum, and Monieizia expansa. J Egypt Soc Parasitol 30 (2):561–571.
Estuningsih SE, Adiwinata G, Widjajanti S, Piedrafita D. 2004. Pengaruh infestasi cacing hati Fasciola gigantica terhadap gambaran Darah Sel Leukosit Eosinofil pada Domba. J ITV 9 (3):191-196.
Frank SA. 2002. Immunology and Evolution of Infectious Disease. Princeton (NJ): Princeton University Press.
Guezala MC, Rodriguez S, Zamora H, Garcia HH, Gonzalez AE, Tembo A, Allan JC, Craig PS. 2009. Development of a species-specific coproantigen ELISA for human Taenia solium taeniasis. Am J Trop Med Hyg 81(3):33– 437.
Guyton AC, Hall JE. 2007. Buku Ajar Fisiologi Kedokteran Edisi ke-11. Irawati et al., penerjemah; Rachman LY, editor. Jakarta: EGC. Terjemahan dari: Textbook of Medical Physology 11th Edition.
Herscowitz HB. 1978. Immunophysiology: Cell Function and Cellular Interactions. Di dalam: Bellanti, Joseph A, editor. Immunology II. Philadelphia: W.B. Saunders Company. hlm 151-199.
[IACUC] Institutional Animal Care and Use Committee. 2010. Guidelines for Polyclonal Antibody Production in Laboratory Animal. http://www.iacuc.ucsf.edu/Proc/awRabColl.asp [ 25 Juni 2011].
Jackson AL. 1978. Antigens and Immunogenicity. Di dalam Bellanti, Joseph A, Editor. Immunology II. Philadelphia: W.B. Saunders Company. hlm 101-150.
Karimi A. 2008. Genetic diagnosis of Fasciola species based on 18s ribosomal DNA sequences. J Biol Sci 8 (7):1166-1173.
Kuby J. 2007. Immunology 6th Ed. New York: W.H Freeman Company.
Levine ND. 1990. Buku Pelajaran Parasitologi Veteriner. Ashadi G, penerjemah; Wardiato, editor. Yogyakarta: Gadjah Mada University Press. Terjemahan dari: Textbook of Veterinary Parasitology.
Lightowlers MW, Rickard MD. 1988. Excretory/secretory products of helminth parasites: effects on host immune responses [abstrak]. J Parasitol 96; Suppl:S123-66.
Mader SS. 1997. Struktur Ig G [gambar]. [Di dalam]: Inquiry Into Life 8th Ed. [terhubung berkala]. http://www.mhhe.com/biosci/ap [20 Mei 2011].
Mahmoud MS, Abou-El-Dobal S, Soliman K. 2008. Immune response in Fasciola gigantica experimentally infected rabbits treated with either carnosine or Mirazid®. J Parasitol 3:40-49.
Marcilla A, De la Rubia JE, Sotillo J, Bernal D, Carmona C, Villavicencio Z, Acosta D,
Tort J, Bornay FJ, Esteban JG, Toledo R. 2008. Leucine aminopeptidase is an
immunodominant antigen of Fasciola hepatica excretory and secretory products in human infections. J Clin Vacc Immunol 15 (1):95-100.
Meshgi B, Eslami A, Hemmatzadeh F. 2008a. Determination of somatic and excretory/secretory antigens of Fasciola hepatica and Fasciola gigantica using SDS-PAGE. Iran J Vet Res 9 (1):22.
Meshgi B, Karimi A, Shayan P. 2008b. Genetic variation of Fasciola Hepatica from sheep, cattle, and buffalo. J Parasitol 3 (2):71-78.
Moazeni M, Gaur SN, Shahangian A. 2005. Cross reactivity between E/S and somatic antigens of Fasciola spp of enzyme linked immunosorbant assay [Short Paper]. Iran J Vet Res 6 (2):12.
Nobel RE, Nobel GA. 1989. Biologi Parasit Hewan. Edisi ke-5. Wardiato, penerjemah; Soeripto N, editor. Yogyakarta: Gadjah Mada University Press. Terjemahan dari: The Biology of Animal Parasites.
Orr RT. 1976. Vertebrate Biology. Philadelphia: W.B. Saunders Company.
Ouchterlony O. 1953. Antigen-antibody reactions in gels IV: types of reactions in co-ordinated systems of diffusion. Acta Path Microbiol Scand 32:231.
Parimala N, Ishaq M. 2005. Efficacy of sonicated and acid-extractable antigens in the serodiagnosis of H. Pylori infection in peptic ulcer patients. Indi J Med Microbiol 23 (2):117-119.
Patterson RM. 1995. Respon Imun Terhadap Parasit Cacing. Di dalam: Artama WT, penerjemah; Burgess GW, editor. Teknologi ELISA dalam Diagnosis dan Penelitian. Yogyakarta: Gadjah Mada University Press. Terjemahan dari: ELISA Technology in Diagnosis and Research.
Satrija F, Murtini S, Retnani EB, Ridwan Y. 2007. Pengembangan Uji ELISA untuk Mendeteksi Koproantigen sebagai Metode Diagnosa Infeksi Cacing Pita pada Ayam. Makalah Seminar Hasil Penelitian LPPM IPB.
Schalch W, Wright JK, Rodkey LS, Braun DG. 1979. Distinct functions of monoclonal IgG antibody depend on antigen-site specificities. J Exp Med 149:923-937.
Seres S, Cozma V. 2008. Detection of Echinococcus coproantigens by ezyme-linked immunosorbent assay in foxes from the North – West of Romania. Luc Stii Med Vet (XLI):Timisoara 388.
Sewell MMH. 1964. The immunology of fascioliasis (qualitative studies on the precipitin reaction). J Immunol 7:671.
Smith JR. 1995. Produksi Serum Hiperimun. Di dalam: Artama WT, penerjemah; Burgess GW, editor. Teknologi ELISA dalam Diagnosis dan Penelitian. Yogyakarta: Gadjah Mada University Press. Terjemahan dari: ELISA Technology in Diagnosis and Research.
Tizard IR. 2004. an Introduction to Veterinary Immunology 7th Ed. Elsevier: Philadelphia.
Wibawan IWT, Retno DS, Damayanti CS, Tauffani TB. 2003. Imunologi. Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Wongkham C, Tantrawatpan C, Intapan PM, Maleewong W, Wongkham S, Nakashima K. 2005. Evaluation of immunoglobulin G subclass antibodies against recombinant Fasciola gigantica Cathepsin L1 in an enzyme-linked immunosorbent assay for serodiagnosis of human fasciolosis. J Clin Vacc Immunol 12 (10):1152-1156.
Yocananth S, Gosh S, Gupta SC, Sures MG, Saravanan D. 2005. Characterization of spesific and cross-reacting antigens of Fasciola gigantica by immunoblotting. J Parasitol Res 97:41-48
PRODUKSI ANTIBODI POLIKLONAL ANTI-
EKSKRETORI/SEKRETORI (E/S) Fasciola gigantica ISOLAT
ASAL DOMBA DAN KERBAU PADA KELINCI
RETNO SETYANINGSIH
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi Produksi Antibodi Poliklonal Anti Ekskretori/Sekretori (E/S) Fasciola gigantica Isolat Asal Domba dan Kerbau pada Kelinci adalah karya saya dengan arahan dari dosen pembimbing dan belum pernah diajukan dalam bentuk apapun kepada Perguruan Tinggi mana
pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan
maupun tidak diterbitkan dari penulis lain telah disebutkan dalan teks dan
dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juli 2011
Retno Setyaningsih
ABSTRACT
RETNO SETYANINGSIH. Production of Polyclonal Antibody Anti- Excretory/Secretory (E/S) of Fasciola gigantica Sheep and Buffalo Origins in Rabbit. Under direction FADJAR SATRIJA, SRI MURTINI.
The research was designed to study method of polyclonal antibody (Ig G) anti-Excretory/Secretory (E/S) Fasciola gigantica production in rabbit. Two antigens of E/S Fasciola gigantica (E/S Fasciola gigantica from buffalo and E/S Fasciola gigantica sheep) were immunized to rabbit, at dose level 150 µg/animal. Freund’s adjuvant added to antigen with the equal volume (1:1). The first immunization was done intravenous (i.v) without adjuvant. Second immunization were gave subcutaneous (s.c) with combination of antigen-Freund’s adjuvant complete. The third until sixth immunizations were done subcutaneous (s.c) with combination of antigen-Freund’s adjuvant incomplete. Blood samples were collecting every one week after the third immunization. To evaluated antibody anti Excretory/Secretory (E/S) Fasciola gigantica development, the sera tested using Agar Gel Precipitation Test (AGPT). The result showed that the rabbit immunized by E/S protein of Fasciola gigantica from sheep, able to develop antibody faster (4 weeks post infection) than the rabbit which immunized by E/S protein of Fasciola gigantica from buffalo (12 weeks post infection). In the same time, cross reactivity between antigens appear from the antibody that produced from each rabbit.
RINGKASAN
RETNO SETYANINGSIH. Produksi Antibodi Poliklonal Anti Ekskretori/Sekretori (E/S) Fasciola gigantica Isolat Asal Domba dan Kerbau pada Kelinci. Dibawah bimbingan FADJAR SATRIJA, SRI MURTINI.
Penelitian telah dilakukan untuk mempelajari pembentukkan antibodi poliklonal (Ig G) anti E/S Fasciola gigantica hewan coba kelinci. Dua ekor kelinci masing-masing diimunisasi dengan 150 µg antigen Ekskretori/Sekretori (E/S) Fasciola gigantica yang diisolasi dari domba dan kerbau yang disembelih di Rumah Potong Hewan (RPH) Kota Bekasi serta Tempat Pemotongan Hewan (TPH) Empang-Kota Bogor. Imunisasi pertama dilakukan dengan rute intravena (i.v) tanpa tambahan adjuvant. Imunisasi kedua dilakukan dengan rute subkutan (s.c) dengan kombinasi antigen- adjuvant lengkap Freund. Imunisasi ketiga hingga kelima dilakukan dengan rute subkutan (s.c) dengan kombinasi antigen- adjuvant tak lengkap Freund. Sampel darah dikoleksi tiap seminggu sekali setelah penyuntikkan yang ketiga. Serum darah diuji menggunakan Agar Gel Pecipitation Test (AGPT) untuk mengevaluasi antibodi anti E/S Fasciola gigantica yang terbentuk. Hasil penelitian menunjukkan bahwa kelinci yang diimunisasi dengan antigen E/S F. gigantica asal domba, mampu membentuk antibodi lebih cepat (4 minggu pasca infeksi) dibandingkan kelinci yang diimunisasi dengan antigen E/S F. gigantica asal kerbau (12 minggu pasca infeksi). Pada waktu yang sama, reaksi silang diantara antigen antigen E/S F. gigantica muncul dari antibodi yang dihasilkan oleh masing-masing kelinci.
Kata kunci: antibodi poliklonal, antigen Ekskretori/Sekretori, Fasciola gigantica
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan
atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau
tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan
yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis
PRODUKSI ANTIBODI POLIKLONAL ANTI
EKSKRETORI/SEKRETORI (ES) Fasciola gigantica PADA
KELINCI
RETNO SETYANINGSIH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
2011
Judul Skripsi : Produksi Antibodi Poliklonal Anti-Ekskretori/Sekretori (E/S) Fasciola gigantica Isolat Asal Domba dan Kerbau pada Kelinci
Nama : Retno Setyaningsih
NIM : B04070041
Disetujui
drh. H. Fadjar Satrija, M.Sc, Ph. D Pembimbing I
Dr. drh. Hj. Sri Murtini, M. Si Pembimbing II
Diketahui
Dr. Nastiti Kusumorini
Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karunia-Nya sehingga skripsi dengan judul Produksi Antibodi Poliklonal Anti Ekskretori/Sekretori (E/S) Fasciola gigantica Isolat Asal Domba dan Kerbau pada Kelinci ini berhasil diselesaikan.
Terima kasih penulis ucapkan kepada Bapak Dr. drh. H. Fadjar Satrija,
M.Sc, dan Ibu Dr. drh. Hj. Sri Murtini, M.Si, selaku dosen pembimbing yang
telah memberi kesempatan, arahan, dan masukan, hingga selesainya skripsi ini.
Ucapan terimakasih juga penulis ucapkan kepada Bapak Sulaeman dan Ibu Selin,
selaku laboran yang telah banyak membantu penulis dalam melaksanakan
penelitian. Tak lupa ucapan terimakasih penulis haturkan kepada Ibu Mayang,
Joko, Risma, dan Mega selaku rekan sepenelitian serta kepada Amalia dan Hadi
S. yang telah banyak membantu penulis dengan dorongan semangat, kasih sayang,
serta doa. Ungkapan terimakasih juga disampaikan kepada Ayah, Mama, serta
seluruh keluarga atas dukungan baik moril maupun materil. Rekan-rekan angkatan
44’ “Gianuzzi” atas seluruh kebersamaan dan semangat serta seluruh pihak baik
secara langsung maupun tidak langsung telah membantu penulis hingga
selesainya penulisan skripsi ini. Semoga skripsi ini bermanfaat.
Bogor, Juli 2011
DAFTAR ISI
Halaman
DAFTAR TABEL………... iii DAFTAR GAMBAR………... iv 1. PENDAHULUAN……….
1.1Latar Belakang………... 1.2Tujuan……….. 1.3Manfaat………
1 1 2 2
2. TINJAUAN PUSTAKA……… 2.1Kelinci………. 2.2 Cacing Fasciola gigantica……….. 2.3 Antigen Ekskretori/Sekretori……….. 2.4 Imunitas………... 2.5 Antibodi Poliklonal………. 2.6 Adjuvant……….. 2.7 Agar Gel Precipitation Test (AGPT)………...
3 3 3 5 6 7 9 9
3. BAHAN DAN METODE……….. 3.1Tempat dan Waktu Penelitian………. 3.2Metode Penelitian………
3.2.1 Persiapan dan Pemeliharaan Kelinci
sebagai Hewan Coba………... 3.2.2 Persiapan Antigen E/S Fasciola gigantica... 3.2.3 Pengukuran Konsentrasi dengan Metode Bradford……… 3.2.4 Teknik Imunisasi………. 3.2.5 Teknik Pengambilan Darah………. 3.2.6 Teknik Pengumpulan Serum………... 3.2.7 Pembuatan Antigen Terlarut……… 3.2.8 Teknik Agar Gel Pecipitation Test (AGPT)……… 3.2.9 Pemurnian Immunoglobulin G (Ig G)………. 11 11 11 11 11 12 13 14 14 14 15 15
4. HASIL DAN PEMBAHASAN………... 17 5. SIMPULAN DAN SARAN………...
5.1Simpulan……….. 5.2Saran………...
24 24 24
DAFTAR TABEL
Halaman
1 Tata cara pengisian larutan BSA dan Aquabides……….... 12
2 Tata cara penyuntikkan antigen... 13
DAFTAR GAMBAR
Halaman
1 Struktur Ig G pada mamalia……… 8
2 Hasil AGPT anti E/S Fasciola gigantica asal domba (KP) pada
minggu ke-4 dan ke-6………. 18
3 Hasil AGPT anti E/S Fasciola gigantica asal kerbau (KH) pada
minggu ke-12 dan ke-14……….………… 18
4 Hasil AGPT antibodi anti E/S Fasciola gigantica asal domba dengan
antigen E/S Fasciola gigantica asal kerbau………... 21
5 Penebalan presipitasi reaksi silang antibodi pada AGPT..………. 22
1.
PENDAHULUAN
1.1 Latar Belakang
Fasciolosis adalah penyakit yang disebabkan cacing dari genus Fasciola.
Fasciolosis di Indonesia secara umum disebabkan oleh Fasciola gigantica.
Berbagai studi memperlihatkan bahwa Fasciola gigantica merupakan parasit yang
paling sering ditemukan pada ruminansia terutama ruminansia besar (sapi dan
kerbau) di Indonesia. Kurang lebih 80 persen ternak ruminansia terutama kerbau
di Indonesia terserang fasciolosis, sedangkan prevalensinya di Indonesia berkisar