SINTESIS BAHAN SURFAKTAN ANIONIK KALIUM
9,10-DIHIDROKSI STEARAT DAN SURFAKTAN NONIONIK
9,10-DIHIDROKSI-
N
-(2-ETANOL) STEARAMIDA
DARI ASAM OLEAT
SKRIPSI
DONALD SITUMORANG
050802017
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
SINTESIS BAHAN SURFAKTAN ANIONIK KALIUM
9,10-DIHIDROKSI STEARAT DAN SURFAKTAN NONIONIK
9,10-DIHIDROKSI-
N
-(2-ETANOL) STEARAMIDA
DARI ASAM OLEAT
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana sains
DONALD SITUMORANG
050802017
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : SINTESIS BAHAN SURFAKTAN ANIONIK
KALIUM 9,10-DIHIDROKSI STEARAT DAN SURFAKTAN NONIONIK 9,10-DIHIDROKSI-N- (2-ETANOL) STEARAMIDA DARI ASAM OLEAT
Kategori : SKRIPSI
Nama : DONALD SITUMORANG
Nomor Induk Mahasiswa : 050802017
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA
UTARA
Disetujui di Medan, Mei 2011
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1 P
Dr. Mimpin Ginting, M.S Drs. Adil Ginting, M.Sc
NIP. 195510131986011001 NIP. 195307041980031002
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
SINTESIS BAHAN SURFAKTAN ANIONIK KALIUM 9,10-DIHIDROKSI STEARAT DAN SURFAKTAN NONIONIK 9,10-DIHIDROKSI-N-(2-ETANOL)
STEARAMIDA DARI ASAM OLEAT
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Mei 2011
DONALD SITUMORANG
PENGHARGAAN
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas kasih dan
anugrahNya penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini tepat pada waktunya.
Selanjutnya penulis menyampaikan penghargaan dan cinta kasih yang tulus kepada seluruh keluarga yang senantiasa memberikan dorongan dan semangat, terutama kepada orang tua yang sangat saya sayangi M.Situmorang dan K.Ambarita yang dengan doa serta kerja kerasnya mengorbankan banyak hal untuk mendidik saya dengan penuh cinta. Terima kasih juga saya ucapkan kepada kakakku terkasih
K’Dorin dan K’Dewi serta adikku tersayang Dominggo yang banyak mendukung dalam penyelesaian perkuliahan.
Dengan segala kerendahan hati, penulis mengucapkan terimakasih yang sebesar-besarnya kepada:
1. Bapak Drs. Adil Ginting, M.Sc selaku pembimbing I dan Bapak Dr. Mimpin Ginting, M.S selaku pembimbing II yang telah banyak memberikan pengarahan dan bimbingan dalam melakukan penelitian dengan sabar hingga terselesainya skripsi ini.
2. Ibu Dr. Rumondang Bulan Nst, M.S, M.Si dan Drs. Albert Pasaribu, M.Sc selaku Ketua dan Sekretaris Departemen Kimia FMIPA USU.
3. Seluruh dosen Departemen Kimia FMIPA USU yang telah memberikan waktunya untuk memberi bimbingan selama penulis mengikuti kuliah di Departemen Kimia FMIPA USU, terkhusus kepada Ibu Dra. Nurhaida Pasaribu, M.Si selaku dosen wali saya yang telah memberikan pengarahan dalam menyelesaikan studi selama perkuliahan dan penelitian berlangsung.
4. Kakak dan sahabat-sahabatku (K’Suny, K’Riris, Jubel, Julianto, Raffles, Dewi, Reny), adik-adikku (Chata, Rara, Defi, Cristin, Sondang, Iwan, Nimrot, Sudirman), Teman-teman angkatan 2005 (Ferdy, Danny, Alexon Fitri, Ocha, Sheva, dkk) juga kepada Siska Sinabutar.
5. Seluruh asisten Laboratorium Kimia Organik/Proses Kimia FMIPA USU
6. Pihak-pihak yang tidak disebutkan namun tulus membantu penulis dalam penyelesaian skripsi ini.
ABSTRAK
Sintesis dari dua jenis bahan surfaktan yaitu surfaktan anionik kalium 9,10-dihidroksi stearat dan surfaktan nonionik 9,10-9,10-dihidroksi-N-(2-etanol)stearamida dapat dihasilkan melalui transformasi ikatan π dan gugus karboksilat dari asam oleat (C18-1) melalui reaksi epoksidasi diikuti hidrolisis yang dilanjutkan reaksi penyabunan
dengan KOH dan juga reaksi amidasi dengan etanolamin.
Surfaktan anionik kalium dihidroksi stearat dan surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida secara berturut-turut memiliki rendemen sebesar 60% dan 55%, nilai konsentrasi miesel kritis (CMC) berada pada 0,018% dan 0,015%, tegangan permukaan sebesar 45,93 dyne/cm dan 42,24 dyne/cm. Surfaktan anionik kalium 9,10-dihidroksi stearat memiliki nilai kekuatan busa lebih tinggi dari surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida tetapi lebih rendah dari sabun kalium stearat, dan kestabilan busa berada dibawah surfaktan 9,10-dihidroksi-N
SYNTHESIS ANIONIC SURFACTANT POTASSIUM 9,10-DIHYDROXY STEARATE AND NONIONIC SURFACTANT 9,10-DIHYDROXY-N-
(2-ETHANOL) STEARAMIDA FROM OLEIC ACID
ABSTRACT
Synthesis of two types of surfactant are anionic surfactant potassium 9.10 -dihydroxy stearic and nonionic surfactant 9.10--dihydroxy-N-(2-ethanol) stearamida can be produced through the transformation π bond and carboxylic group of oleic acid (C18-1) via epoxidation followed by hydrolysis, followed by KOH saponification
reaction and amidation reaction with etanolamin.
DAFTAR ISI
Halaman
Persetujuan ii
Pernyataan iii
Penghargaan iv
Abstrak v
Abstract vi
Daftar Isi vii
Daftar Tabel ix
Daftar Gambar x
Daftar Lampiran xi
Bab 1 Pendahuluan
1.1 Latar Belakang 1
1.2 Permasalahan 2
1.3 Tujuan Penelitian 3
1.4 Manfaat Penelitian 3
1.5 Lokasi Penelitian 4
1.6 Metodologi Penelitian 4
Bab 2 Tinjauan Pusataka
2.1 Oleokimia 5
2.2 Asam Lemak 6
2.4 Senyawa Amida 9
2.5 Epoksida 12
2.6 Surfaktan 14
Bab 3 Metode Penelitian
3.1 Alat-alat 20
3.2 Bahan-bahan 21
3.3 Prosedur Penelitian 22
3.3.1 Pembuatan Reagen Dan Standarisasi 22
3.3.1.1 Pembuatan Larutan HCL 0,5 N 22
3.3.1.2 Pembuatan Larutan KOH-Alkohol 0,5 N 22
3.3.1.3 Pembuatan Larutan KOH 0,1 N 22
3.3.1.4 Pembuatan Larutan KOH 0,02 N 22
3.3.1.5 Pembuatan Larutan H2C2O4 0,1 N 23
3.3.1.6 Pembuatan Larutan Indikator Fenolptalein 1% 23
3.3.1.7 Pembuatan Larutan Alkohol Netral 23
3.3.1.8 Pembuatan Larutan KI 10% 23
3.3.1.9 Pembuatan Larutan Na2S2O3 0,1 N 23
3.3.1.10 Pembuatan Larutan K2Cr2O7 0,1 N 24
3.3.1.11 Pembuatan Larutan Indikator Amilum 1% 24
3.3.1.12 Pembuatan Larutan KOH 0,5 N 24
3.3.2 Pembuatan Asam 9,10-Dihidroksi Stearat 24
3.3.3 Pembuatan Surfaktan Anionik Kalium 9,10-Dihidroksi Stearat 25
3.3.4 Pembuatan Surfaktan Nonionik 9,10-Dihidroksi-N-(2-Etanol)
Stearamida 25
3.3.5 Analisis Hasil Reaksi 26
3.3.5.2 Analisis Bilangan Penyabunan 26
3.3.5.3 Analisis Bilangan Asam 27
3.3.5.4 Penentuan Harga HLB 27
3.3.5.5 Penentuan Tegangan Permukaan (γ) 27
3.3.5.6 Uji Kekuatan dan Stabilitas Busa 28
3.4 Bagan Penelitian 29
3.4.1 Pembuatan Asam 9,10-Dihidroksi Stearat 29
3.4.2 Pembuatan Surfaktan Kalium 9,10-Dihidroksi Stearat 30
3.4.3 Pembuatan Surfaktan 9,10-Dihidroksi-N-(2-Etanol)Stearamida 31
3.4.4 Penentuan Tegangan Permukaan (γ) 32
3.4.5 Uji kekuatan dan Stabilitas Busa 32
Bab 4 Hasil dan Pembahasan
4.1 Hasil Penelitian 33
4.2 Pembahasan 38
Bab 5 Kesimpulan dan Saran
5.1 Kesimpulan 44
5.2 Saran 45
Daftar Pustaka 46
DAFTAR TABEL
Halaman
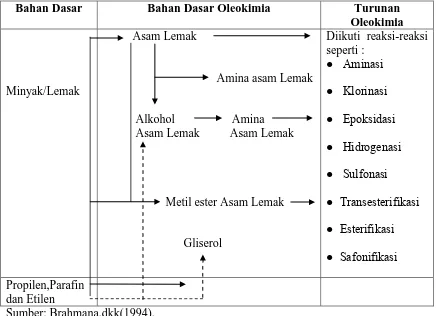
Tabel 2.1 Diagram Alur Oleokimia 6
Tabel 2.2 Harga HLB Untuk beberapa Gugus Fungsi 16
Tabel 4.1 Data Hasil Penentuan Tegangan Permukaan ( ) Larutan
Surfaktan Kalium 9, 10-Dihidroksi Stearat 36
Tabel 4.2 Data Hasil Penentuan Tegangan Permukaan ( )
Larutan Surfaktan 9,10-Dihidroksi-N-(2-Etanol)Stearamida 36
Tabel 4.3 Data Hasil Uji Kekuatan dan Stabilitas Busa Surfaktan Anionik
Kalium 9,10-Dihidroksi Stearat 37
Tabel 4.4 Data Hasil Uji Kekuatan dan Stabilitas Busa Surfaktan Nonionik
9,10-Dihidroksi-N-(2-Etanol)Stearamida 37
Tabel 4.5 Data Hasil Uji Kekuatan dan Stabilitas Busa Sabun Kalium Stearat 37
DAFTAR GAMBAR
Halaman
Gambar 2.1 Reaksai Pembentukan Amida Primer 10
Gambar 2.2 Reaksi Pembentukan Amida Sekunder 10
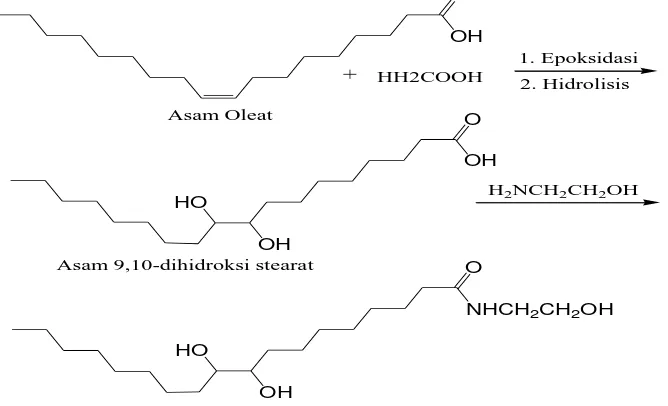
Gambar 2.3 Reaksi Pembentukan N-Etanol 9,10-Dihidroksi Stearamida
Dari Asam Oleat 11
Gambar 2.4 Skema PembentukanSenyawa Hasil Transformasi Epoksida 12
Gambar 2.5 Skala Keseimbangan Hidrofilik Lipofilik (HLB) 17
Gambar 4.1 Grafik Hasil Penentuan tegangan Permukaan 42
Gambar 4.2 Diagram Hasil Uji Kekuatan Busa 43
Gambar 4.3 Diagram Hasil Uji Stabilitas Busa 44
DAFTAR LAMPIRAN
Halaman
Lampiran A Spektrum FT–IR Asam Oleat 49
Lampiran B Penentuan Bilangan Iodin 50
Lampiran C Penentuan Bilangan Asam 51
Lampiran D Penentuan Bilangan Penyabunan 52
Lampiran E Penentuan Harga HLB Menggunakan Metode Titrasi 53
ABSTRAK
Sintesis dari dua jenis bahan surfaktan yaitu surfaktan anionik kalium 9,10-dihidroksi stearat dan surfaktan nonionik 9,10-9,10-dihidroksi-N-(2-etanol)stearamida dapat dihasilkan melalui transformasi ikatan π dan gugus karboksilat dari asam oleat (C18-1) melalui reaksi epoksidasi diikuti hidrolisis yang dilanjutkan reaksi penyabunan
dengan KOH dan juga reaksi amidasi dengan etanolamin.
Surfaktan anionik kalium dihidroksi stearat dan surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida secara berturut-turut memiliki rendemen sebesar 60% dan 55%, nilai konsentrasi miesel kritis (CMC) berada pada 0,018% dan 0,015%, tegangan permukaan sebesar 45,93 dyne/cm dan 42,24 dyne/cm. Surfaktan anionik kalium 9,10-dihidroksi stearat memiliki nilai kekuatan busa lebih tinggi dari surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida tetapi lebih rendah dari sabun kalium stearat, dan kestabilan busa berada dibawah surfaktan 9,10-dihidroksi-N
SYNTHESIS ANIONIC SURFACTANT POTASSIUM 9,10-DIHYDROXY STEARATE AND NONIONIC SURFACTANT 9,10-DIHYDROXY-N-
(2-ETHANOL) STEARAMIDA FROM OLEIC ACID
ABSTRACT
Synthesis of two types of surfactant are anionic surfactant potassium 9.10 -dihydroxy stearic and nonionic surfactant 9.10--dihydroxy-N-(2-ethanol) stearamida can be produced through the transformation π bond and carboxylic group of oleic acid (C18-1) via epoxidation followed by hydrolysis, followed by KOH saponification
reaction and amidation reaction with etanolamin.
BAB 1
PENDAHULUAN
1.1Latar Belakang
Hidroksi asam-asam lemak dan turunannya banyak digunakan secara komersial untuk pengolahan berbagai jenis produk secara luas, contohnya sebagai zat aditif pada minyak pelumas dan kosmetik, sebagai pengemulsi, sebagai poliol untuk poliuretan, dan sebagai surfaktan untuk deterjen. Kegunaannya sebagai pelengkap pada industri textil dan sebagai inhibitor korosi pada minyak pelumas telah diteliti. Asam oleat adalah bahan oleokimia yang potensial yang tersedia dari beberapa sumber alam dan merupakan bahan mentah yang penting untuk pengolahan hidroksi asam lemak (Koay, 2006).
Karena adanya ikatan rangkap, maka asam lemak tidak jenuh dapat mengalami oksidasi yang mengakibatkan putusnya ikatan C=C dan terbentuknya gugus-COOH dan gugus-OH sebagai diol (Poedjiadi, 1994).
Adanya gugus hidroksi akan meningkatkan sifat hidrofil suatu senyawa poliol dan pemakaiannya baik sebagai surfaktan maupun keperluan pereaksi terutama dalam bahan pembuatan polimer akan dapat merubah sifat dari bahan yang dihasilkan (Randal dan Lee, 2002).
Garam kalium atau natrium dari asam lemak merupakan bahan yang telah lama digunakan sebagai pembersih yang dikenal sebagai sabun. Adanya gugus hidroksi pada garam asam lemak akan menaikkan sifat hidrofilik sekaligus harga HLB (Hydrophilic Lipophilic Balance) akan meningkat sehingga kegunaan sabun poliol dari garam asam lemak dapat dimanfaatkan sebagai sabun yang baik untuk bahan pencuci dalam air sadah. (Awang,dkk, 2001).
Asam karboksilat seperti asam lemak juga dapat diubah menjadi senyawa alkanolamida melalui reaksi amidasi asam lemak maupun metilester asam lemak dengan etanolamin. Senyawa tersebut merupakan surfaktan non ionik yang banyak digunakan sebagai surfaktan untuk penstabil busa pada sampo maupun detergen, baik dalam bentuk padat maupun cairan (Maag, 1984).
Berdasarkan uraian diatas maka peneliti tertarik untuk mensintesis dua bentuk jenis surfaktan yakni yang memiliki gugus diol yakni surfaktan anionik kalium 9,10- dihidroksi stearat dan surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida yang diturunkan dari asam oleat. Selanjutnya surfaktan yang diperoleh dianalisis dengan spektrofotometer FT-IR dan dianalisis nilai konsentrasi misel kritis (CMC), tegangan permukaan, kekuatan busa dan stabilitas busa.
1.2Permasalahan
1. Apakah dari asam oleat yang memiliki ikatan rangkap dan gugus fungsi karboksilat, melalui reaksi epoksidasi diikuti dengan hidrolisis dapat menghasilkan asam 9,10-dihidroksi stearat yang selanjutnya disafonifikasi dengan KOH akan menghasilkan surfaktan anionik kalium 9,10-dihidroksi stearat dan diamidasi dengan etanolamin akan menghasilkan surfaktan nonionik 9,10-dihidroksi-N -(2-etanol)stearamida.
3. Sejauh manakah perbedaan nilai kekuatan busa dan stabilitas busa dari kedua surfaktan yang disintesis yaitu surfaktan anionik kalium 9,10-dihidroksi stearat dan surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida yang juga dibandingkan dengan sabun kalium stearat.
1.3Tujuan Penelitian
1. Untuk mensintesis surfaktan anionik kalium 9,10-dihidroksi stearat dan surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida dari asam oleat.
2. Untuk mengetahui perbedaan nilai konsentrasi miesel kritis (CMC) dan tegangan permukaan dari kedua surfaktan yang disintesis yaitu surfaktan anionik kalium 9,10-dihidroksi stearat dan surfaktan nonionik 9,10-dihidroksi-N-(2-etanol) stearamida.
3. Untuk mengetahui perbedaan nilai kekuatan busa dan stabilitas busa dari kedua surfaktan yang disintesis yaitu surfaktan anionik kalium 9,10-dihidroksi stearat dan surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida yang juga dibandingkan dengan sabun kalium stearat.
1.4Manfaat Penelitian
1.5Lokasi Penelitian
Penelitian ini akan dilakukan di laboratorium kimia organik F-MIPA USU. Analisa secara spektroskopi FT-IR di salah satu laboratorium kimia perusahaan swasta di Medan.
1.6Metodologi Penelitian
Penelitian ini dilakukan melalui eksperimen laboratorium. Pada penelitian dilakukan sintesis surfaktan anionik kalium dihidroksi stearat dan surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida dari asam oleat. Kedua jenis surfaktan tersebut dapat dihasilkan melalui transformasi ikatan π dan gugus karboksilat dari asam oleat (C18-1) melalui reaksi epoksidasi diikuti hidrolisis yang dilanjutkan reaksi penyabunan
dengan KOH dan juga reaksi amidasi dengan etanolamin. Asam oleat diepoksidasi dengan asam performat dengan menggunakan katali H2SO4(p) yang dilanjutkan
hidrolisis diikuti reaksi penyabunan dengan KOH menghasilkan surfaktan anionionik kalium 9,10-dihidroksi stearat. Selanjutnya hasil amidasi dengan etanolamin dengan menggunakan katalis NaOCH3 menghasilkan surfaktan nonionik 9,10-dihidroksi-N
-(2-etanol)stearamida. Konformasi hasil reaksi dilakukan pengujian melalui analisis spektroskopi FT-IR diikuti karakterisasi yang dibandingkan dengan surfaktan kalium stearat yaitu penentuan nilai konsentrasi miesel kritis (CMC), tegangan permukaan, kekuatan busa dan stabilitas busa.
BAB 2
TINJAUAN PUSTAKA
2.1. Oleokimia
Oleokimia pada dasarnya merupakan cabang ilmu kimia yang mempelajari trigliserida yang berasal dari minyak dan lemak menjadi asam lemak dan gliserin serta turunan asam lemak baik dalam bentuk ester, amida, sulfat, sulfonat, alkohol, alkoksi, maupun sabun. Oleokimia merupakan turunan gliserol dengan asam lemak yang berubah dalam bentuk turunannya yang digunakan baik sebagai surfaktan, deterjen, polimer, aditif, bahan bakar dan sebagainya. Bahan dasar oleokimia seperti gliserol, asam lemak, alkil asam lemak, amina asam lemak dan alkohol asam lemak dapat diperoleh dengan mengubah lipida baik yang berasal dari hewan maupun tumbuhan menjadi gliserol dan turunan asam lemak.
Sumber minyak dan lemak alami dapat berasal dari bahan nabati maupun hewani. Sumber minyak nabati diantaranya adalah minyak kelapa sawit, minyak kacang kedelai, minyak biji bunga matahari, minyak biji wijen, minyak jarak dan sebagainya. Sedangkan minyak dan lemak yang berasal dari hewan yaitu seperti minyak sapi, minyak domba, minyak babi, minyak ikan dan lain-lain. Minyak dan lemak tersebut sangat luas penggunaannya, baik sebagai bahan baku lemak dan minyak yang dapat dikonsumsi maupun sebagai bahan oleokimia (Richtler dan Knault, 1984).
berikutnya sebesar 30% untuk dijadikan sabun, deterjen, dan kosmetik. Asam lemak juga digunakan sebagai bahan dasar pembuatan resin dan cat sekitar 15%, sisanya digunakan sebagai pembantu dalam industri pembuatan ban, tekstil, kulit kertas, pelumas, lilin. Penggunaan terbesar dari gliserol adalah industri farmasi dan kosmetika serta makanan (Richtler dan Knault, 1984).
Diagram alir dari oleokimia dapat dilihat pada tabel 2.1. berikut: Tabel 2.1 Diagram Alur Oleokimia
Bahan Dasar Bahan Dasar Oleokimia Turunan
Oleokimia
Asam palmitat dan stearat berupa zat padat pada suhu kamar. Asam oleat mempunyai rantai karbon sangat panjang dengan asam stearat, tetapi suhu kamar, asam oleat berupa zat cair. Disamping itu, semakin banyak jumlah ikatan rangkap semakin rendah titik leburnya (Poedjiadi, 1994).
Asam-asam lemak mempunyai jumlah atom C genap dari C2 sampai C30 dan
dalam bentuk bebas atau ester dengan gliserol. Asam lemak jenuh yang paling banyak ditemukan dalam bahan pangan adalah asam palmitat yaitu 15 sampai 50% dari seluruh asam-asam lemak yang ada.
Sebagian besar minyak nabati berbentuk cair karena mengandung sejumlah asam lemak tidak jenuh, yaitu asam oleat, linoleat, asam linolenat dengan titik cair yang rendah. Lemak hewan pada umumnya berbentuk padat pada suhu kamar karena banyak mengandung asam lemak jenuh, misalnya asam palmitat dan stearat yang mempunyai titik cair lebih tinggi. Secara alamiah asam lemak jenuh yang mengandung atom karbon C1 sampai C8 berwujud cair, sedangkan jika lebih besar dari
C8 akan berwujud padat (Ketaren, 2008).
Walaupun lemak dalam bentuk padat dan minyak dalam bentuk cairan, keduanya mempunyai struktur dasar yang sama. Lemak dan minyak adalah triester dari gliserol, yang dinamakan dengan trigliserida. Trigliserida sederhana jarang ditemukan di alam. Pada umunya lemak atau minyak tidak terdiri dari satu macam trigliserida. Karena alasan ini, komposisi lemak atau minyak biasanya dinyatakan dalam bentuk presentase bermacam-macam yang diperoleh dari hidrolisis (Hart, 2003).
2.3. Asam Oleat
zat cair kental, hampir tidak berbau, sukar larut dalam air, tetapi larut dalam alkohol, eter, benzena dan kloroform. Asam oleat mendidih pada suhu 2330C.
H3C - (CH2)7 - CH = CH - (CH2)7 - COOH
Asam Oleat
Asam oleat mempunyai dua bentuk stereoisomer, yaitu bentuk cis dan bentuk trans. Bentuk trans asam oleat dikenal dengan nama asam elaidat.
H - C - (CH2)7 - CH3 mengalami oksidasi menjadi asam dihidroksi stearat, sedangkan pada suhu tinggi akan mengalami oksidasi lebih lanjut membentuk asam pelargonat (pelargonic acid) dan asam azelat (azelic acid).
Hidrogenasi katalitik asam oleat akan menghasilkan asam stearat, sedangkan pada brominasi akan menghasilkan asam dibromo stearat. Pada keadaan reaksi ini, hidrogen dan halogen (brom) ditangkap atau diadisi oleh ikatan rangkap asam oleat sehingga ikatan rangkap menjadi ikatan tunggal (Sumardjo, 2006).
Asam oleat komersial mempunyai kecenderungan berubah menjadi berwarna gelap selama dalam pemanasan. Perubahan warna ini disebabkan oleh kandungan minoritas yang terdapat dalam asam oleat yang mengalami oksidasi. Asam oleat komersial dihasilkan dari lemak daging sapi, lemak babi, dan kadang-kadang minyak sayuran yang merupakan pemanfaatan utama dari hasil pertanian (Lin, 1976).
Asam oleat, linoleat dan linolenat biasanya terdapat bersama dengan asam lemak lain seperti laurat, asam miristat, asam palmitat, asam stearat dan asam lemak lainnya. Asam lemak tidak jenuh tersebut dapat diubah ke berbagai bentuk turunannya antara lain dalam bentuk ester asam lemak dengan poliol seperti sorbitol, manitol dan sebagainya untuk surfaktan karena disamping memiliki gugus ester juga memiliki gugus hidroksil sehingga terjadi kesetimbangan antara gugus yang bersifat lipofil dengan gugus yang bersifat hidrofil (Daniel, 2005).
2.4. Senyawa Amida
Suatu amida ialah senyawa yang mempunyai nitrogen trivalent terikat pada satu gugus fungsi kabonil. Suatu amida diberi nama asam karboksilat induknya, dengan mengubah asam…-oat (atau –at) menjadi amida.
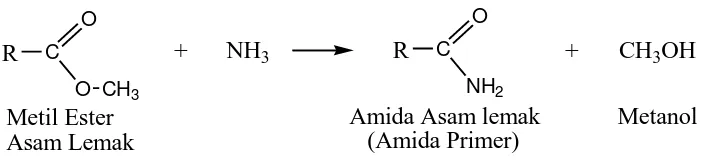
Amida asam lemak pada industri oleokimia dapat dibuat dengan mereaksikan asam lemak atau metil ester asam lemak dengan suatu amina. Amida asam lemak dibuat secara sintesis pada industri oleokimia dalam prosess batch,dimana ammonia dan asam lemak bebas bereaksi pada suhu 2000C dan tekanan345-690 kPa selama 10-12 jam. Dengan proses tersebutlah dibuat amida primer seperti lauramida, stearamida serta lainnya.
Amida primer juga dibuat dengan mereaksikan ammonia dengan metil ester asam lemak. Reaksi ini mengikuti konsep HSAB dimana H+ dari ammonia merupakan
hard-acid yang mudah bereaksi dengan hard base CH3O- untuk membentuk metanol.
Sebaliknya NH2- lebih soft-base dibandingkan dengan H3O- akan terikat dengan
Gambar 2.1. Reaksi pembentukan amida primer
Pembuatan amida sekunder dilakukan dengan mereaksikan asam lemak dengan amina primer seperti alkilamina (Gambar 2.2).
Gambar 2.2. Reaksi pembentukan amida sekunder
Senyawa amina yang digunakan untuk reaksi tersebut antara lain etanol amina dan dietanol amin, yang jika direaksikan dengan asam lemak pada suhu tinggi, 150-2000C akan membentuk suatu amida dan melepaskan air. Reaksi aminasi antara alkil klorida lebih mudah dengan gugus amina dibanding dengan terjadinya reaksi esterifikasi dengan gugus hidroksil. Adanya amina apabila direaksikan dengan ester baru terjadi pada suhu tinggi dan sangat lambat sekali apabila dilakukan pada suhu rendah dengan bantuan katalis basa Lewis NaOMe yang lebih kuat dari trietil amin. Reaksi amidasi antara amina dan ester dengan bantuan katalis NaOMe dapat terjadi pada suhu 100-1200C, sedangkan apabila tidak digunakan katalis maka reaksi baru dapat berjalan pada suhu 150-2500C (Gabriel, 1984).
Etanolamin (NH2-CH2-CH2-OH) merupakan larutan yang tidak berwarna, larut
dalam air dan biasa digunakan dalam pembuatan srubbing hidrogen sulfide (H2S) dan
CO2 yang berasal dari petroleum dan bias juga digunakan sebagai dry cleaning, dalam
pembuatan cat dan dalam bidang farmasi (obat-obatan) (Salleh,dkk, 2001).
Amida asam lemak digunakan sebagai bahan pelumas pada proses pembuatan resin, baik sebagai pelumas internal maupun eksternal, amida tersebut berperan mengurangi gaya kohesi dari polimer sehingga meningkatkan aliran polimer pada proses pengolahan (Brahmana, 1994).
Amida berperan untuk mempengaruhi polimer yang melebur agar terlepas dari permukaan wadah logam pengolahan resin. Sebagai pelumas internal, amida berperan untuk mengurangi gaya kohesi dari polimer dan meningkatkan aliran polimer pada proses pengolahannya (Reck, 1984).
Dalam industri kimia oleo, pembuatan senyawa alkanolamin dari hasil reaksi etanolamin dengan asam 9,10-dihidroksi stearat untuk bahan surfaktan dikembangkan menjadi surfaktan non ionik yakni alkanoamida dari asam dihidroksi stearat (DHSA) yang lebih mudah terurai oleh mikroorganisme dimana DHSA yang digunakan diturunkan dari asam oleat melalui reaksi epoksidasi diikuti hidrolisis (Awang, 2001).
2.5. EPOKSIDA
Epoksida (oksirana) ialah eter siklik dengan cincin beranggota tiga yang mengandung satu atom oksigen (Hart,2003). Senyawa oksida pada sintesa organik merupakan zat antara yang potensial dimanfaatkan untuk beragam bentuk senyawa dengan berbagai keperluan sehingga penelitian tentang epoksidasi baik kondisi reaksi, keberlanjutan hasil reaksi maupun manfaat hasil reaksi terus dikembangkan (Wisewan, 1983).
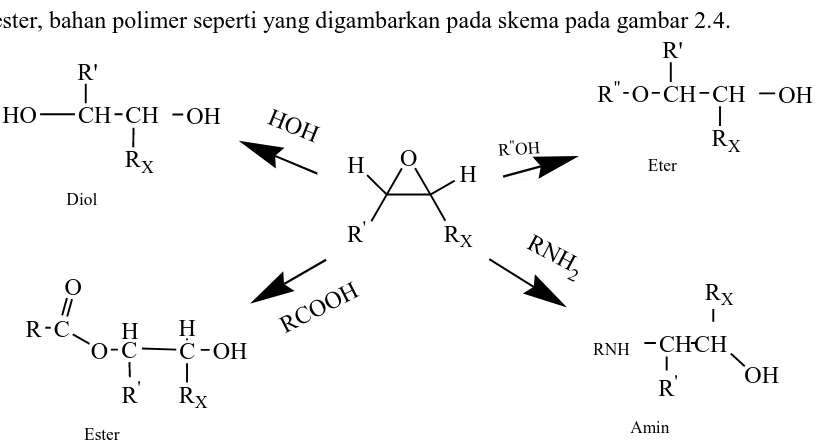
Epoksidasi terhadap ikatan rangkap adalah salah satu modifikasi kimia terhadap berbagai senyawa yang memiliki ikatan π. Berdasarkan pada kereaktifan yang tinggi dari cincin oksiran epoksida dapat dipakai sebagai zat antara untuk menghasilkan berbagai senyawa kimia yakni alkohol, alkanol amin, senyawa karbanil, ester, bahan polimer seperti yang digambarkan pada skema pada gambar 2.4.
Gambar 2.4 Skema pembentukan senyawa hasil transformasi epoksida
Minyak nabati yang memiliki kandungan asam lemak tidak jenuh merupakan sumber menarik untuk diperbaharui dalam menghasilkan produk baru yang berguna tetapi kereaktifannya perlu ditingkatkan melalui penambahan gugus fungsi kedalam molekul asam lemaknya, dengan demikian dengan berbagai reaksi kimia dan biokimia telah dilakukan berbagai cara pengubahan menjadi produk yang lebih berharga. Sejalan dengan reaksi tersebut, epoksida memegang peranan penting karena minyak maupun ester asam lemak yang terepoksidasi dapat digunakan untuk membuat senyawa-senyawa yang berbeda fungsinya dalam industri seperti plastizer, stabilizer,
resin, PVC, polyester, poliuretan, resin epoksi, dan pelapisan permukaan (Charlon dan Chang, 1985).
Anti hidroksilasi dapat dicapai melalui perlakuan dengan H2O2 dan asam
formiat. Dalam hal ini epoksidasi pertama sekali terjadi, diikuti dengan reaksi SN2.
C C + H2O2 C C
Jenis-jenis bahan pereaksi yang digunakan untuk epoksidasi tanpa pemutusan ikatan π yang umum digunakan untuk menghasilkan epoksida adalah senyawa peroksi (peracid). Dalam epoksidasi ini pereaksi dipersiapkan melalui reaksi asam karboksilat dengan peroksida (H202) dengan bantuan katalis asam (Hasibuan, 2000).
Epoksidasi dari minyak dilakukan secara lazim melalui peracid yang dibentuk secara in situ. Peracid yang lebih disukai adalah peracid alifatis yang lebih rendah, yang terutama adalah asam performat. Apabila peracid dibentuk secara in situ, penambahan zat pengompleks yaitu hidrogen peroksida sangat menguntungkan (Jourdan, 1980).
(Goud, dkk, 2006).
Dalam proses industri, hasil epoksidasi terhadap asam lemak beserta turunannya telah umum digunakan sebagai plastisizer dan stabilizer dalam pembuatan polimer (Lutz,dkk, 1980).
Gugus hidroksi pada senyawa organik dapat meningkatkan sifat hidrofil karena disamping gugus fungsi yang aktif bereaksi dengan berbagai pereaksi untuk menghasilkan senyawa baru juga dapat berinteraksi baik melalui dipol-dipol yang terbentuk maupun melalui ikatan hidrogen dan gugus hidrofil dari senyawa lain. Gugus hidroksil yang tidak terikat memberikan sifat hidrofil sedangkan gugus hidroksil yang terikat baik sebagai ester, eter dapat mengubah senyawa tersebut menjadi sifat lipofil. Adanya sifat hidrofil dan lipofil menyebabkan senyawa poliol banyak digunakan sebagai surfaktan dalam makanan, kosmetik maupun keperluan farmasi seperti obat-obatan (Jung,dkk, 1998).
2.6. SURFAKTAN
Molekul-molekul atau ion-ion yang teradsorpsi pada perbatasan (interfasa) disebut dengan bahan aktif permukaan (surface active agents) atau surfaktan. Surfaktan mempunyai peran penting untuk menurunkan tegangan permukaan bahan yang dikenai (Pavia, 1976). Aktifitas kerja suatu surfaktan disebabkan karena sifat ganda dari molekul tersebut. Molekul surfaktan memiliki bagian polar yang suka akan air dan bagian non polar yang suka lemak/minyak (Lehninger, 1988).
Pada umumnya bagian yang non polar (lipofil) adalah merupakan hidrokarbon rantai panjang, sedangkan bagian yang polar (hidrofilik) adalah suatu ion atau gugus yang kepolarannya tinggi. Berdasarkan gugus hidrofiliknya, surfaktan diklasifikasikan menjadi 4 golongan (Rosen, 1978) yaitu :
1. Surfaktan anionik, adalah surfaktan yang bagian aktifnya memiliki muatan negatif, merupakan kumpulan surfaktan terbesar. Seperti RCOONa+(sabun), danRC6H4SO3
-Na+ (alkilbenzen sulfonat).
2. Surfaktan zwiter ion, yaitu surfaktan yang memiliki muatan positif dan negatif pada bagian aktifnya atau disebut juga surfaktan ampoterik. Contohnya RN+H2CH2COO
-(asam amino rantai panjang).
3. Surfaktan kationik, adalah surfaktan yang mana bagian aktifnya mengandung muatan positif. Misalnya RNH3+Cl- (garam dari amina rantai panjang),
RN(CH3)3+Cl- (amonium klorida kuarterner).
4. Surfaktan non ionik, adalh surfaktan yang mana bagian aktifnya tidak memiliki muatan. Misalnya RCOOCH2CHOHCH2OH (monogliserida dari asam lemak rantai
panjang).
Ada tiga penggunaan surfaktan yaitu sebagai bahan pembasah (wetting agent), bahan pengemulsi (emulsing agent), dan sebagai pelarut (solubilizing agent) (Genaro, 1990).
Untuk menentukan kegunaan dari suatu surfaktan maka biasanya terlebih dahulu ditentukan harga HLBnya (Hidrofilic-Lipofilic Balance). Harga HLB dapat ditentukan secara teoritis dan praktek. Harga HLB secara praktek dilakukan dengan menggunakan tensiometer cincin du Nuoy, dimana akan diperoleh harga tegangan permukaan yang setelah diplotkan dengan logaritma konsentrasi akan diperoleh harga konsentrasi kritik misel (CMC). Melalui rumus berikut akan diperoleh harga HLB.
HLB = 7-0,36 ln (Co/Cw) Dimana : Cw = CMC
Secara teori, harga HLB suatu bahan dapat dihitung berdasarkan harga gugus hidrofil, lipofil dan derivatnya yang dapat dilihat dari tabel 2.2 :
Tabel 2.2 Harga HLB untuk Beberapa Gugus Fungsi Gugus Hidrofil Harga HLB
-SO4Na 38,7
-CO2K 21,1
-CO2Na 19,1
-N( amina tersier ) 9,4
Ester ( cicncin sorbitan ) 6,8
Ester ( bebas ) 2,4
-CO2H 2,1
-(OH) ( bebas ) 1,9
-O- 1,3
-OH ( cincin sorbitan ) 0,5
Gugus Lipofil
-CH -0,475
-CH2- -0,475
CH3 - -0,475
-CH- -0,475
Gugus turunan
-(CH2-CH2-O)- 0,33
-(CH2-CH2-CH2-O)- -0,15
Sumber : (Genaro, 1990)
Berdasarkan harga yang tertera pada tabel diatas dapat ditentukan harga HLB secara teori dengan menggunakan rumus sebagai berikut:
HLB = Σ (gugus hidrofil) - Σ (gugus lipofil) + 7
Untuk senyawa ester asam lemak polihidroksi alkohol nilai HLBnya ditentukan berdasarkan persamaan dibawah ini:
HLB = 20 (1-S/A)
Hubungan antara nilai HLB dengan penggunaaannya sebagai surfaktan dapat dilihat
Gambar 2.5 Skala Keseimbangan Hydrdofilik Lipofilik (HLB)
Surfaktan digunakan dalam volume besar pada berbagai produk kebutuhan rumah tangga, deterjen dan produk-produk pembersih lainnya. Biasanya setelah digunakan, produk yang mengandung surfaktan tersebut dibuang sebagai limbah yang mana pada akhirnya akan dibebaskan ke permukaan air. Biodegradasi dan mekanisme penguraian lain sangat diperlukan untuk mengurangi jumlah dan konsentrasi surfaktan yang mencapai lingkungan.
Salah satu alternatif untuk mengurangi kerusakan lingkungan yang berhubungan dengan penggunaan surfaktan adalah memperluas penggunaan surfaktan alami. Monogliserida, digliserida dan turunan fosfolipid seperti lesitin termasuk turunan ester asam lemak dengan poliol yang dibuat secara sintetis seperti ester sorbitol, ester glukosa dan lainnya merupakan surfaktan alami. Begitu juga dengan mereaksikan metil ester asam lemak dengan epoksida (Brahmana, 1994).
dengan surfaktan lain adalah : biodegredable, efektif pada temperatur, pH dan salinitas ekstrim, spesifitas tinggi sehingga keharusan untuk melindungi gugus fungsi multi masih berkurang. Surfaktan ini telah banyak dimanfaatkan pada industri, pertanian dan oil recovery yang berfungsi sebagai wetting agent dan industri farmasi dan kosmetika sebagai foaming dan emulsifier (Makkar dan Swaranjits, 1997).
Sabun memperlihatkan sifat-sifatnya terhadap kombinasi dari gugus karboksilat yang bersifat polar dengan rantai hidrokarbon yang nonpolar terhadap molekul yang sama. Dalam larutan berair, sejumlah besar molekul-molekul sabun berkumpul dalam bentuk bola yang dikenal sebagai misel. Ujung karboksilat yang polar dari molekul berada ditepi luar misel karena daya tarik terhadap air (hidrofilik). Ujung hidrokarbon yang nonpolar dari molekul berkumpul bersama pada pusat misel sehingga mengurangi hubungannya terhadap air (hidrofobik) (Pine, 1984).
Setiap molekul sabun memiliki gugus hidrofil dan hidrofob dimana dapat ditulis sebagai RCOONa. Ketika sabun dilarutkan ke dalam air maka akan terionisasi menjadi RCOO-Na+. Bagian yang berperan aktif dalam sifat deterjennya ialah RCOO -dan menghasilkan anion, sehingga sabun dimasukkan ke dalam jenis surfaktan anion.
Fungsi dari sabun ialah untuk menghilangkan kotoran dari permukaan seperti kulit, lantai atau pakaian. Kotoran biasanya campuran bahan berlemak dan partikel padat. Meskipun dapat berupa kotoran tanpa lemak, partikel padat dapat berupa pigmen, kabon, karat besi. Lemak yang dihasilkan dari kulit ataupun sumber lain dapat dihilangkan dari permukaan dengan menggunakan deterjen dengan cara :
a. Mereduksi atau menurunkan tegangan permukaan dari air b. Memindahkan atau mengangkat kotoran
c. Mendispersikan kotoran
BAB 3
METODE PENELITIAN
3.1. Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah :
- Labu leher dua Pyrex
- Termometer 2100C Fisons
- Kondensor bola Pyrex
- Rotarievaporator Heidolph
- Hotplate stirrer Fisons
- Oven Fisons
- Botol akuades
- Magnetik bar
- Corong Penetes
- Corong pisah
- Spektrofotometer FT-IR Shimadzu
- Tensiometer Cincin Du-Nuoy
- Kertas saring biasa
- Neraca analitis Mettler PM 480
- Alat shaker KL 2 Edmund Buhler
- Gelas ukur 100 mL Pyrex
- Gelas ukur 50 mL Pyrex
- Gelas Beaker 250 mL Pyrex
3.2 Bahan-bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah:
- 2-propanol p.a.E.Merck
- Metanol p.a.E.Merck
- n-Heksana p.a.E.Merck
- Asam sulfat 98% p.a.E.Merck
- Akuades
- Hidrogen peroksida 30% p.a.E.Merck
- Asam formiat 90% Fison
- Kalium hidroksida (pellet) p.a.E.Merck
- Natrium Sulfat Anhidrous p.a.E.Merck
- CaCl2 anhidrous p.a.E.Merck
- Dietil eter p.a.E.Merck
- Asam Oleat p.a.E.Merck
- Etanolamin p.a.E.Merck
- Sikloheksana p.a.E.Merck
- Larutan Wijs p.a.E.Merck
- Kalium Iodida p.a.E.Merck
- Natrium Tiosulfat(s) p.a.E.Merck
- Amilum p.a.E.Merck
- Fenolptalein(s) p.a.E.Merck
- Asam Klorida 37% p.a.E.Merck
- Alkohol 96% p.a.E.Merck
- n-Pentanol p.a.E.Merck
3.3 Prosedur Penelitian
3.3.1 Pembuatan Reagen dan Standarisasi
3.3.1.1 Pembuatan Larutan HCl 0,5 N
Diukur sebanyak 10,45 ml larutan HCl 37% lalu diencerkan dengan akuades dalam labu takar 250 ml sampai garis batas dan distandarisasi dengan menggunakan larutan KOH 0,1 N dan indikator BTB.
3.3.1.2 Pembuatan Larutan KOH-Alkohol 0,5 N
Ditimbang KOH sebanyak 7,0125 gram dan dilarutkan dengan alkohol 96% dalam labu takar 250 ml sampai garis batas dan distandarisasi dengan menggunakan larutan H2C2O4 0,1 N dan indikator Fenolptalein.
3.3.1.3 Pembuatan Larutan KOH 0,1 N
Ditimbang KOH sebanyak 1,4 gram dan dilarutkan dengan akuades dalam labu takar 250 ml sampai garis batas dan distandarisasi dengan menggunakan larutan H2C2O4 0,1
N dan indikator Fenolptalein.
3.3.1.4 Pembuatan Larutan KOH 0,02 N
3.3.1.5 Pembuatan Larutan H2C2O4 0,1 N
Ditimbang 1,575 gram H2C2O4.2H2O dimasukkan kedalm labu takar 250 ml dan
diencerkan dengan akuades sampai garis tanda.
3.3.1.6 Pembuatan Larutan Indikator Fenolptalein 1 %
Ditimbang 1 gram Fenolptalein dan dilarutkan dengan alkohol dalam labu takar 100 ml.
3.3.1.7 Pembuatan Alkohol Netral
Sebanyak 200 ml alkohol 96%, ditambah 4 tetes indikator Fenolptalein dan ditetesi dengan larutan KOH 0,1 N hingga menjadi larutan merah muda.
3.3.1.8 Pembuatan Larutan KI 10%
Ditimbang 10 gram Kristal KI, dilarutkan dengan akuades dalam labu takar 100 ml sampai garis tanda.
3.3.1.9 Pembuatan Larutan Na2S2O3 0,1 N
Ditimbang 6,25 gram Kristal Na2S2O3.5H2O dilarutkan dengan akuades dan
3.3.1.10 Pembuatan Larutan K2Cr2O7 0,1 N
Ditimbang 7,7 gram serbuk K2Cr2O7 dilarutkan dengan akuades dan diencerkan dalam
labu takar 250 ml.
3.3.1.11 Pembuatan Larutan Indikator Amilum 1%
Ditimbang 1 gram serbuk amilum dan dilarutkan dengan 100 ml akuades dan dipanaskan sambil diaduk di atas pemanas hingga mendidih dan disaring dalam keadaan panas.
3.3.1.12 Pembuatan Larutan KOH 0,5 N
Ditimbang KOH sebanyak 7 gram dan dilarutkan dengan akuades dalam labu takar 250 ml sampai garis batas dan distandarisasi dengan menggunakan larutan H2C2O4 0,5
N dan indikator Fenolptalein.
3.3.2 Pembuatan Asam 9,10-Dihidroksi Stearat
Kedalam labu leher dua yang dihubungkan dengan kondensor dan pengaduk magnet serta corong penetes dimasukkan asam formiat 90% sebanyak 60 ml, H2O2 30%
sebanyak 30 ml dan H2SO4(p) sebanyak 1 ml. Diaduk selama 30 menit pada suhu
40-450C dan ditambahkan asam oleat sebanyak 60 ml melalui corong penetes. Kemudian campuran diaduk pada suhu 40-450C selama 4 jam, selanjutnya campuran didiamkan selama 1(satu) malam dan dimasukkan kedalam corong pisah. Lapisan atas diambil, ditambahkan dietil eter sebanyak 100 ml dan dicuci dengan 50 ml akuades sebanyak dua kali. Hasil pencucian dikeringkan dengan CaCl2 anhidrous secukupnya
selanjutnya setelah disaring diikuti pengeringan dengan Na2SO4 anhidrous
isopropil alkohol yang diperoleh diuapkan hingga diperoleh asam 9,10-dihidroksi stearat sebagai residu. Hasil yang diperoleh ditimbang, ditentukan titik leburnya dan selanjutnya dianalisis dengan spektrofotometer FT-IR.
3.3.3 Pembuatan Surfaktan Anionik Kalium 9,10-Dihidroksi Stearat dan Kalium
Stearat
Sebanyak 18 gram (0.06 mol) asam 9,10-dihidroksi asam stearat dimasukkan kedalam labu leher dua. Ditambahkan KOH sebanyak 4 gram (0,07 mol) dan alkohol 96% sebanyak 50 ml. Kemudian direfluks sambil diaduk pada suhu 780C selama 30 menit. Hasil yang diperoleh dimasukkan kedalam gelas Beaker yang berisi KCl jenuh. Diaduk selama 15 menit dan disaring. Endapan yang diperoleh dibilas dengan alkohol 70% dan dikeringkan di dalam oven pada suhu 700C, sehingga diperoleh surfaktan kalium 9,10-dihidroksi stearat. Setelah ditimbang, hasil yang diperoleh dianalisis dengan spektrofotometer FT-IR, dilanjutkan karakterisasinya dengan menentukan tegangan permukaan, uji kekuatan dan stabilitas busa. Dengan perlakuan yang sama dilakukan juga pembuatan kalium stearat yang digunakan sebagai pembanding.
3.3.4 Pembuatan Surfaktan Nonionik 9,10-Dihidroksi-N-(2-Etanol)Stearamida
Kedalam labu leher dua dimasukkan 18 gram (0,05 mol) asam 9,10-dihidroksi stearat dan 10 ml (0,218 mol) etanolamin dan 5 gram NaOCH3 ( 25 % dalam metanol,
5 gram/20 ml metanol), kemudian dirangkai alat refluks selama 5 jam dan dipanaskan pada suhu 80-900C sambil diaduk. Kelebihan pelarut diuapkan dengan rotarievaporator. Residu yang diperoleh dilarutkan dalam 100 ml dietil eter, kemudian dicuci dengan larutan NaCL jenuh sebanyak tiga kali masing-masing 25 ml. Diambil lapisan atas dan dikeringkan dengan Na2SO4 anhidrous dan disaring. Filtrat hasil
3.3.5 Analisis Hasil reaksi
3.3.5.1 Analisis Bilangan Iodin
Analisis ini dilakukan terhadap asam oleat dan asam 9,10-dihidroksi stearat.
Ditimbang sampel sebanyak ± 0,3 gram ke dalam gelas Erlenmeyer 250 ml yang bertutup lalu ditambahkan 20 ml sikloheksana kemudian dikocok/diguncang untuk memastikan sampel telah benar-benar larut. Ditambahkan larutan Wijs kedalamnya kemudian ditutup dan dikocok agar campuran telah benar-benar bercampur dan disimpan bahan tersebut dalam ruang gelap selama ± 30 menit. Diambil bahan tersebut dari tempat penyimpanan dan ditambahkan 25 ml larutan KI 10 % dan 150 ml air suling. Dititrasi dengan larutan Na2S2O3 0,1 N sampai warna
kuning hampir hilang (kuning pucat). Ditambahkan 1-2 ml indikator amilum kedalamnya dan dititrasi kembali sampai warna biru hilang.
Dilakukan hal yang sama terhadap larutan blanko dan dihitung dengan: Bilangan Iodin =
Dimana : B = Volume Titrasi Blanko (ml) S = Volume Titrasi Sampel (ml) N = Normalitas Na2S2O3
3.3.5.2 Analisis Bilangan Penyabunan
Analisis ini dilakukan terhadap asam oleat, asam dihidroksi stearat dan 9,10-dihidroksi-N- (2-etanol)stearamida.
Ditimbang ± 1 gram sampel dan dimasukkan kedalam gelas Erlenmeyer. Kemudian ditambahkan 25 ml larutan KOH-alkohol 0,5 N dan dipanaskan hingga mendidih. Didinginkan dan ditambahkan 3 tetes indikator Fenolptalein kemudian dititrasi dengan larutan HCl 0,5 N hingga warna merah muda hilang.
Bilangan Penyabunan =
3.3.5.3 Analisis Bilangan Asam
Analisis ini dilakukan terhadap asam oleat, asam dihidroksi stearat dan 9,10-dihidroksi-N- (2-etanol)stearamida.
Sebanyak ± 0,4 gram sampel dimasukkan kedalam gelas Erlenmeyer.
Kemudian ditambahkan 10 ml larutan alkohol netral. Erlenmeyer tersebut ditutup dengan plastik dan dipanaskan sampai mendidih. Larutan tersebut didinginkan dan ditambahkan 3 tetes indikator Fenolptalein dan dititrasi dengan larutan KOH 0,02 N sampai terbentuk warna merah muda.
Dihitung volume KOH yang dipakai dan dihitung bilangan asam dengan menggunakan rumus :
Bilangan Asam =
3.3.5.4 Penentuan Harga HLB
Analisis ini dilakukan terhadap asam oleat, asam dihidroksi stearat dan 9,10-dihidroksi-N- (2-etanol)stearamida.
Harga HLB dapat diperoleh dari bilangan asam dan bilangan penyabunan dari senyawa ester dengan rumus :
HLB = 20
Dimana : S = Bilangan penyabunan senyawa ester A = Bilangan asam senyawa ester
3.3.5.5 Penentuan Tegangan Permukaan
Kedalam labu takar, dilarutkan sabun dengan akuades dengan kadar (%) 0,02; 0,04; 0,06; 0,08; 0,09; 0,1; 0,12; 0,14; 0,15; 0,18 dan 0,2. Alat tensiometer dikalibrasi pada suhu 30oC, menggunakan akuades (tegangan permukaan = 72.75 dyne/cm, suhu 30oC). Kemudian diukur tegangan permukaan dari masing-masing larutan sabun. Selanjutnya ditetapkan harga sebenarnya dengan menggunakan faktor koreksi. Kemudian dimasukkan harga-harga tegangan permukaan tersebut ke dalam kurva tegangan permukaan Vs Konsentrasi larutan sabun. Melalui kurva akan diperoleh harga CMC dari larutan sabun.
3.3.5.6 Uji Kekuatan dan Stabilitas Busa
Analisis ini dilakukan sabun kalium 9,10-dihidroksi stearat, surfaktan kalium stearat dan 9,10-dihidroksi-N-(2-etanol)stearamida.
3.4 Bagan Penelitian
3.4.1 Pembuatan Asam 9,10-Dihidroksi Stearat
60 ml HCOOH
dimasukkan kedalam labu leher dua ditambahkan 30 ml H2O2 30 % ditambahkan 1 ml H2SO4(p)
diaduk selama 30 menit pada suhu 40-450 C ditambahkan asam oleat sebanyak 60 ml melalui corong pisah setetes demi setetes
Campuran
diaduk pada suhu 40-450 C selama 4 jam didiamkan selama satu malam
dimasukkan kedalam corong pisah Lapisan Atas Lapisan Bawah
ditambahkan dietil eter sebanyak 100 ml dicuci dengan 50 ml akuades sebanyak dua kali dikeringkan dengan CaCl2 anhidrous
Filtrat
diekstraksi dengan isopropil alkohol 30 ml sebanyak 2 kali diuapkan
didinginkan Hasil
dikeringkan dengan Natrium Sulfat Anhidrous disaring
Filtrat
Ditmbang Uji Titik Lebur Analisa FT-IR Uji HLB residu
residu
3.4.2 Pembuatan Surfaktan Kalium 9,10-Dihidroksi Stearat dan Kalium Stearat
18 gram Dihidroksi asam stearat
Dimasukkan kedalam labu alas Ditambah 5 gram KOH dan 50 ml alkohol 96 %
Campuran
Direfluks sambil diaduk pada suhu 78oC
Produk
Dimasukkan kedalam larutan KCl Jenuh
Diaduk selama ± 15 menit Disaring
Residu Filtrat
Dibilas dengan alkohol 70% dan dikeringkan di dalam oven pada suhu 70oC
Hasil
Analisa FT-IR
Penentuan Tegangan Permukaan
Uji Kekuatandan Stabilitas Busa Ditimbang
3.4.3 Pembuatan Surfaktan 9,10-Dihidroksi-N- (2-Etanol)Stearamida
10 ml Etanolamin
dimasukkan kedalm labu leher dua ditambahkan H2SO4(p) sebanyak 1 ml
ditambahkan asam 9,10-dihidroksi stearat sebanyak 18 gram
ditambahkan NaOCH3 sebanyak 5 gram
Campuran
direfluks pada suhu 80-900C selama 5 jam
dirotarievaporator
Lapisan Atas Lapisan Bawah
Analisa FT-IR Uji HLB Uji TeganganPermukaan Uji Kekuatan dan Stabilitas Busa Filtrat
Residu
ditambahkan dietil eter sebanyak 100 ml
dicuci dengan larutan NaCL jenuh sebanyak 3 kali masing-masing 25 ml
dikeringkan dengan Na2SO4 anhidrous
disaring
Filtrat Residu
Residu
filtrat
diuapkan dengan rotarievaporator
3.4.4 Penentuan Tegangan Permukaan
Diencerkan sampel dengan konsentrasi %
0,002; 0,003; 0,005; 0,007; 0,008; 0,01; dan 0,013 dengan menggunakan aquades
dikalibrasi dengan alat tensiometer pada suhu 300C diukur tegangan permukaaan masing-masing
Hasil
kalium 9,10-dihidroksi stearat
● Dilakukan perlakuan yang sama terhadap surfaktan 9,10-dihidroksi-N-(2- etanol)stearamida.
3.4.5 Uji Kekuatan dan Stabilitas Busa
kalium 9,10-dihidroksi stearat
dibuat konsentrasi (%) 0,2; 0,4; 0,6; 0,8; 1 dandiencerkan dalam labu takar dengan menggunakan aquades
ditutup dengan plastik dan dikocok
dengan menggunakan alat sheaker selama 30 menit diukur volume busa yang dihasilkan
masing-masing setelah 30 detik (Vo) dan 3 menit (Vs)
Hasil
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil
Epoksida ikatan rangkap pada atom C9 dan C10 dari asam oleat dengan cara
mereaksikannya dengan asam ferformat (HCOOOH) yang diperoleh dari reaksi antara HCOOH 90% dengan H2O2 30% kemudian diikuti dengan proses hidrolisis sehingga
Gambar 4.1 Spektrum FT-IR Asam 9,10-Dihidroksi Stearat
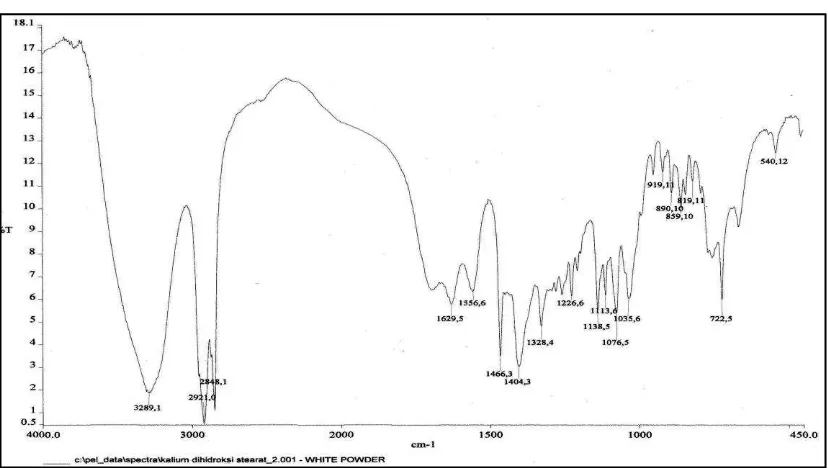
Reaksi penyabunan asam 9,10-dihidroksi stearat dengan larutan basa KOH dalam pelarut alkohol akan menghasilkan senyawa surfaktan anionik kalium 9,10-dihidroksi stearat. Dari hasil analisis dengan menggunkan spektrofotometer FT-IR diperoleh spektrum dengan puncak-puncak serapan pada daerah bilangan gelombang 3289,1 cm-1, 2921,0-2848,1 cm-1, 1629,5 cm-1 , 1404,3 cm-1, 1138,5-1035,6 cm-1, 722,5 cm-1 (Gambar 4.2).
Gambar 4.2 Spektrum FT-IR Surfaktan Anionik Kalium 9,10-Dihidroksi Stearat
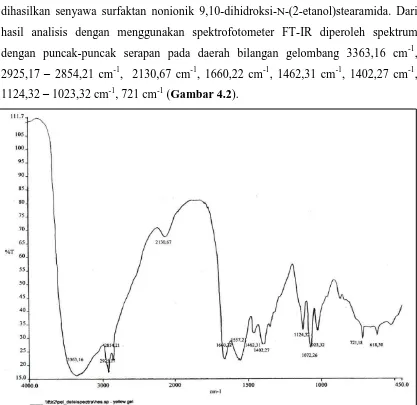
Reaksi amidasi asam 9,10-dihidroksi stearat dengan etanolamin sehingga dihasilkan senyawa surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida. Dari hasil analisis dengan menggunakan spektrofotometer FT-IR diperoleh spektrum dengan puncak-puncak serapan pada daerah bilangan gelombang 3363,16 cm-1, 2925,17 – 2854,21 cm-1, 2130,67 cm-1, 1660,22 cm-1, 1462,31 cm-1, 1402,27 cm-1, 1124,32 – 1023,32 cm-1, 721 cm-1 (Gambar 4.2).
Gambar 4.3 Spektrum FT-IR Senyawa Surfaktan Nonionik 9,10-Dihidroksi-N -(2-Etanol)Stearamida
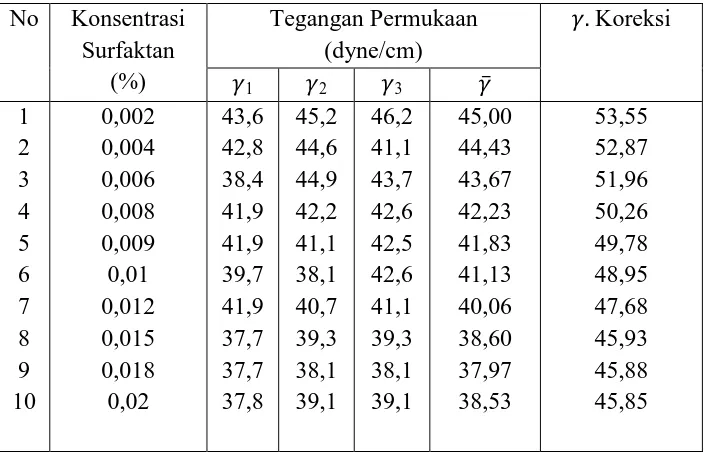
Data hasil penentuan tegangan permukaan yang diperoleh dapat dilihat pada tabel 4.1 dan 4.2 berikut:
Tabel 4.1 Data Hasil Penentuan Tegangan Permukaan ( ) Larutan Surfaktan
Anionik Kalium 9, 10-Dihidroksi Stearat
Faktor Koreksi = 1,07
Tabel 4.2 Data Hasil Penentuan Tegangan Permukaan ( ) Larutan Surfaktan
Data hasil uji kekuatan dan stabilitas busa yang diperoleh dapat dilihat pada tabel 4.3 ; 4.4 dan 4.5 berikut:
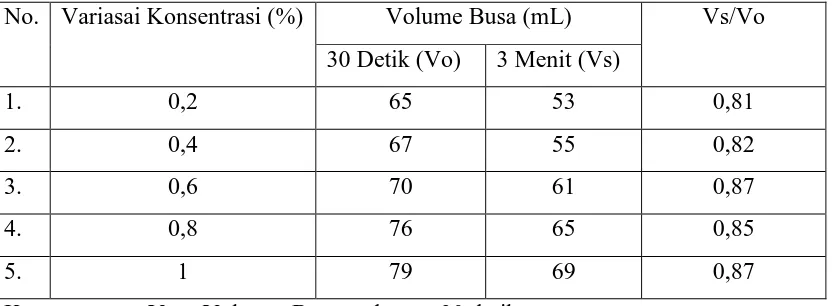
Tabel 4.3 Data Hasil Uji Kekuatan dan Stabilitas Busa Surfaktan Anionik
Kalium 9,10-Dihidroksi Stearat
No. Variasai Konsentrasi (%) Volume Busa (mL) Vs/Vo 30 Detik (Vo) 3 Menit (Vs)
1. 0,2 70 62 0,89
2. 0,4 72 65 0,90
3. 0,6 73 68 0,93
4. 0,8 75 70 0,93
5. 1 77 73 0,95
Tabel 4.4 Data Hasil Uji Kekuatan dan Stabilitas Busa Surfaktan Nonionik
9,10-Dihidroksi-N-(2-Etanol)Stearamida
No. Variasai Konsentrasi (%) Volume Busa (mL) Vs/Vo 30 Detik (Vo) 3 Menit (Vs)
1. 0,2 52 51 0,98
2. 0,4 54 53 0,98
3. 0,6 56 55 0,98
4. 0,8 58 56,5 0,97
5. 1 60 58 0,97
Tabel 4.5 Data Hasil Uji Kekuatan dan Stabilitas Busa Sabun Kalium Stearat
No. Variasai Konsentrasi (%) Volume Busa (mL) Vs/Vo 30 Detik (Vo) 3 Menit (Vs)
1. 0,2 65 53 0,81
2. 0,4 67 55 0,82
3. 0,6 70 61 0,87
4. 0,8 76 65 0,85
5. 1 79 69 0,87
4.2 Pembahsan
Asam oleat yang digunakan dalam penelitian ini adalah asam oleat komersial dengan kadar 76,5 %. Kemudian asam oleat tersebut diepoksidasi dengan campuran HCOOH 90% dan H2O2 30% dan dilanjutkan dengan reaksi hidrolisis sehingga dihasilkan
senyawa asam 9,10-dihidroksi stearat.
Asam formiat dan hidrogen peroksida direaksikan membentuk senyawa performat dengan bantuan katalis H2SO4(p) selanjutnya diikuti penambahan asam oleat
yang direfluks pada suhu 40-450C. Dalam hal ini, ikatan π dari asam oleat yang tidak jenuh pada atom C9,10 akan membentuk cincin epoksida dan selanjutnya diikuti
hidrolisis menghasilkan senyawa diol 9,10-dihidroksi stearat dengan mekanisme reaksi sebagai berikut :
gugus hidroksi (OH) sehingga puncak pada daerah 3008.74 cm-1 (C-H sp2) tidak kelihatan lagi. Hal ini juga didukung dengan adanya penurunan bilangan iodin dimana asam oleat sebesar 79,11 sedangkan hasil epoksidasi asam 9,10-dihidroksi stearat sebesar 30,84 (lampiran B). Pada daerah bilangan gelombang 2925,3-2853,6 cm-1 menunjukkan serapan khas dari vibrasi stretching C-H sp3 dan ini didukung vibrasi bending C-H sp3 pada daerah bilangan gelombang 1466,14 cm-1. Pada bilangan gelombang 1709,5 cm-1 menunjukkan serapan khas gugus karbonil (C=O) dari gugus karboksilat (COOH). Pada bilangan gelombang 723,55 cm-1 menunjukkan vibrasi rocking (CH2)ndari asam lemak dimana n≥4.
Dukungan secara visual juga memberikan informasi adanya perubahan, dalam hal ini dimana pada suhu kamar asam oleat berwujud cair sedangkan hasil reaksi berbentuk gel dengan titik lebur 65-670 C.
Senyawa 9,10-dihidroksi stearat yang diperoleh dilanjutkan dengan penyabunan menggunakan basa kuat yaitu KOH dan diendapkan dengan menggunakan garam KCl sehingga diperoleh surfaktan nonionik kalium 9,10-dihidroksi stearat dengan mekanisme reaksi sebagai berikut:
H
kalium 9,10 - dihidroksi stearat
+ H2O
gelombang 1629,5 cm-1 menunjukkan serapan khas gugus karbonil (C=O) untuk senyawa garam karboksilat.
Selanjutnya senyawa asam 9,10-dihidroksi stearat yang diperoleh juga diamidasi menggunakan etanolamin dengan katalis CH3OH dalam pelarut metanol
menghasilkan 9,10-dihidroksi-N-(2-etanol)stearamida.
Berdasarkan prinsip HSAB, amidasi senyawa 9,10-dihidroksi stearat dapat menghasilkan N-etanolamida 9,10-dihidroksi stearat dimana H+ dari NH2 merupakan
asam keras (hard acid) yang mudah bereaksi dengan-OH (hidroksil) yang merupakan basa keras (hard base) dan N- dari etanolamina yang merupakan basa lunak (soft base) yang selanjutnya akan bereaksi dengan asil R-C+=O yang merupakan asam lunak (soft acid).
Mekanisme reaksi amidasi antara senyawa asam 9,10-dihidroksi stearat dengan etanolamina untuk menghasilkan senyawa surfaktan nonionik
9,10-dihidroksi-N-(2-Etanol)stearamida dapat digambarkan sebagai berikut:
.
serapan khas dari vibrasi bending CH sp3. Pada bilangan gelombang 1660,22 cm-1 menunjukkan serapan khas gugus karbonil (C=O) dari gugus amida ( ).
Dari hasil uji HLB yang dilakukan terhadap senyawa asam oleat diperoleh sebesar 9,69; asam dihidroksi stearat sebesar 8,96; dan surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida sebesar 8,13 menunjukkan adanya penurunan nilai HLB maka senyawa asam dihidroksi stearat dan surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida bersifat semakin lipofil.
Selanjutnya surfaktan anionik kalium 9,10-dihidroksi stearat dan surfaktan nonionik 9,10-dihidroksi-N-(2-etanol) stearamida diuji nilai konsentrasi miesel kritis (CMC), uji tegangan permukaan, uji kekuatan dan stabilitas busa.
Pada hasil analisis penentuan tegangan permukaan untuk surfaktan anionik kalium 9,10-dihidroksi stearat (tabel 4.1) dan surfaktan nonionik 9,10-dihidroksi-N -(2-etanol)stearamida (tabel 4.2) maka diperoleh hasil dimana titik konsentrasi miesel kritis (CMC) untuk surfaktan anionik kalium 9,10-dihidroksi stearat berada pada konsentrasi 0,018 % dan diperoleh tegangan permukaan sebesar 35,50 dyne/cm (gambar 4.1). Dan untuk surfaktan anionik 9,10-dihidroksi-N-(2-etanol)stearamida, titik konsentrasi miesel kritis (CMC) berada pada konsentrasi 0,015 % dan diperoleh tegangan permukaan sebesar 38,60 dyne/cm (gambar 4.1). Lebih rendahnya tegangan permukaan surfaktan anionik kalium 9,10-dihidroksi stearat dibandingkan surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida, maka semakin mudah sabun tersebut untuk membasahi benda sehingga meningkatkan kemampuan untuk membersihkan kotoran.
Gambar 4.1 Grafik Hasil Penentuan Tegangan Permukaan
Pada uji kekuatan dan stabilitas busa, surfaktan tersebut dibuat menjadi 5 konsentrasi, kemudian dikocok dengan menggunkan alat shaker dan diukur volume busa yang diperoleh setelah 30 detik dan 3 menit, sehingga diperoleh hasil untuk surfaktan anionik kalium dihidroksi stearat (tabel 4.3); surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida (tabel 4.4) dan sabun kalium stearat (tabel 4.5) Selanjutnya dari masing-masing nilai kekuatan dan stabilitas busa digambarkan pada
gambar 4.2 dan 4.3. Hasil pengujian kekuatan busa untuk masing-masing surfaktan
menunjukkan bahwa surfaktan anionik kalium 9,10-dihidroksi stearat berada diatas surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida, untuk sabun kalium stearat berada pada konsentrasi 0,2; 0,4;dan 0,6 tetapi pada konsentrasi 0,8 dan 1 kekuatan busa berada diatas surfaktan anionik kalium 9,10-dihidroksi stearat. Hasil pengujian kestabilan busa menunjukkan bahwa surfaktan anionik kalium 9,10-dihidroksi stearat berada dibawah surfaktan nonionik 9,10-9,10-dihidroksi-N -(2-etanol)stearamida tetapi diatas dari sabun kalium stearat.
41
0 0.002 0.004 0.006 0.008 0.01 0.012 0.014 0.016 0.018 0.02 0.022
Gambar 4.2 Diagram Hasil Uji Kekuatan Busa
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Senyawa surfaktan anionik kalium 9,10-dihidroksi stearat dan surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida dapat dihasilkan dari asam oleat dengan rendemen berturut-turut sebesar 60% dan 55%
2. Senyawa surfaktan anionik kalium 9,10-dihidroksi stearat yang dihasilkan memiliki nilai konsentrasi miesel kritis (CMC) berada pada 0,018 % dengan tegangan permukaan 42,24 dyne/cm, sedangkan surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida mempunyai nilai CMC berada pada konsentrasi 0,015 % dengan tegangan permukaan 45,93 dyne/cm. Lebih rendahnya tegangan permukaan surfaktan anionik kalium 9,10-dihidroksi stearat dibandingkan surfaktan nonionik 9,10-dihidroksi-N -(2-etanol)stearamida, maka semakin mudah surfaktan tersebut untuk membasahi benda sehingga meningkatkan kemampuan untuk membersihkan kotoran.
6.2 Saran
DAFTAR PUSTAKA
Awang, R.,Ahmad,S.,Grazmah,G.2001. Properties of Sodium Soap Derived from Palm-Based Dihidroxystrearic Acid. Malaysia: Journal of Oil Palm Research. Vol.13.33
Brahmana, H.R.1994. Sintesa Alkil Ester dan Selulosa Turunan Asam Lemak Kelapa Sawit (CPO) dan Inti Kelapa Sawit (CPKO) dengan Natrium Selulosa pinus Merkusil. Laporan Penelitian Hibah Bersaing 1/3 Perguruan Tinggi, 1993-1994
Charlon, K.D dan Chang, S.P.,1985, Chemical Epoxy Seed Oil From Vernonia galamenesis and a look of Epoxy Oil Market, J.Am.Oil. Chem. Soc, Vol.62(5),934-935
Daniel.2005.Pembuatan Surfaktan Dari Minyak Kemiri Melalui Reaksi Interesterifikasi Diikuti Reaksi Amidasi. Jurnal Sains Kimia. Vol 9,No.1:1-7
Gabriel, R.1984.Selective Amidation of Fatty Methyl Ester With N-C2-Amimothyl
Ethanolamine Under Vase Catalys.J.Am. Oil Chem. Soc, Vol.62(2),120-125. Genaro, R.A.1990. Rhemington’s Pharmaceutical Science. 18th ed. Macle Printing
Company, Easton. Pennsilva
Goud,V.V.,Pradhan,N.C., dan Patwardhan,A.V. 2006. Epoxidation of Karanja Oil by H2O2. J.Am.Oil.Chem.Soc. Vol 83.635
Hart,H. 2003. Kimia Organik. Edisi Kesebelas. Jakarta: Erlangga
Hasibuan,M.H.E.,2000.Modifikasi Penggunaan Pemelastis Turunan Asam Oleat Dari Lemak Destilat Dari Matriks Poli Vinil Klorida.Thesis PPS-USU Medan Jourdan,E.1980.Process Of Epoxidation Of Oils.France:United States Patent
Jung,S.,Goulon,M.,Girardin dan Ghoul,1998.Structure and Surface Active Properties Determinations of Fructose Monoleates, J of Surfactans and Detergens.Vol.I(1), 53-57
Ketaren,S.2008.Pengantar Teknologi Lemak dan Minyak Pangan.Jakarta:UI-Press
Koay,G.F.L.,Abdullah,L.C.,Yunus,R.,Chong,T.S.Y.,Siwayanan,P.,Salmiah,A.2006.
Lehninger..1996. Dasar-dasar Biokimia.Jakarta:Erlangga
Lin,S.Sherman.,Hsieh,A.l.,Min,B.S.David.,Chang,S.Stephen.1976.A Study of the Color Stability of Commercial Oleic Acid.Food Science,Cook College,Rutgers,The State University of New Jersey,New Bruswick,Nj 08903
Lutz,J.T.,Jr.1980.Epoxidation in Encyclopedia of Chemical Technology.Vol.9.Edited by M.Grayson,John Wiley & Sons,New York,pp.251-266
Maag.1984.Fatty Acid Perivati Ves : Important Surfactans for Household,Cosmetic and Industrial Purpose.J.Am.OilChem.Soc
Makkar, Randhir S.,dan Swaranjit S.C.1997. Utilization of Molasses for Biosurfactant Production by Two Bacillus strains at Thermophilic Condition, J.Am. Oil Chem. Soc., 74 (7), 887-890
March,J.,1983.Advanced Organic Chemistry.4ed.New York:John Wiley & Sons Pavia,D.1976. Introduction for Organic Laboratory Techniques. Philadelphia:
Saunders Company
Pine,S.H.,Hendrickson,J.B.,Gram,D.J.,Hammond,G.S.1984. Organic Chemistry. Fourth Edition London:McGraw-Hill
Poedjiadi,A.1994.Dasar-Dasar Biokimia.Edisi Keempat.Jakarta.UI-Press
Parasuram,K.S.,1995.Soap And Detergen.London:Mc Graw Hill Book Company Randal,D.,dan Lee,S.2002,The Polyurethanes Book,John Wiley&Son,LTD,Everberg Reck,R.A.1984. Marketing and Economics of Oleochemicals to The Plastics
Indutry.J.Am.Oil Chem. Soc.,61,187-190.
Richtler,M.J.,Knaut,J. 1984. Challenges to Nature Industry, Marketing and Economics of Oleochemicals in Western Europe. USA: J.Am.Oil.Chem.Soc.Vol 61.160
Rosen,M.J.,1978.Surfactant and Interfacial Fenomena.New York:John Wiley & Sons Salleh, A.B, Basri, M., Tan, S.w., Rahman, M.B., Dzulkefly, Rahman, R.N.Z dan
Ruzah, C.N.A, (2001), Syithesis of Fatty Alkanolamides By Using Immobilized Lipases, Malaysia Jurnal of Analytical Sciences, 7(2), 281-285 Sumardjo,D. 2006. Pengantar Kimia.Jakarta: Buku Kedokteran
Lampiran B : Penentuan Bilangan Iodin dengan Metode Wijs
Sampel Massa Sampel (gram) Volume Titrasi (ml) Bilangan
Iodin
m1 m2 m3 v1 v2 v3
Blanko - - - - 47,47 47,47 47,47 47,47 -
Asam Oleat 0,235 0,235 0,298 0,256 32,85 32,79 28,89 31,51 79,11 9,10-dihidroksi stearat 0,332 0,353 0,331 0,339 39,42 38,83 39,44 39,23 30,84
Bilangan Iodin Asam Oleat =
=
= 79,11
Bilangan Iodin asam 9,10-dihidroksi stearat =
=
Lampiran C : Penentuan Bilangan Asam dengan Metode Wijs
Sampel Massa Sampel (gram) Volume Titrasi (ml) Bilangan
Asam
m1 m2 m3 v1 v2 v3
Asam Oleat 0,608 0,338 0,323 0,423 10 11 10,5 10,5 27,57
Asam 9,10-dihidroksi stearat
0,316 0,300 0,340 0,319 10 9,5 11 10,17 35,41
9,10-dihidroksi-N -(2-etanol)stearamida
0,308 0,396 0,374 0,359 7 9 8,5 8,17 25,28
Bilangan Asam Asam Oleat =
=
= 27,57
Bilangan Asam 9,10-dihidroksi stearat =
=
= 35,41
Bilangan Asam surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida =
=
Lampiran D : Penentuan Bilangan Penyabunan dengan Metode Wijs
Sampel Massa Sampel (gram) Volume Titrasi (ml) Bilangan
Penyabunan
m1 m2 m3 v1 v2 v3
Blanko - - - - 22,7 22,7 22,7 22,7 -
Asam Oleat 1,030 1,050 1,044 1,041 22,21 22,12 22,19 22,17 14,31 Asam 9,10-dihidroksi
stearat
1,035 1,028 1,174 1,079 22,00 21,95 21,89 21,95 19,54
9,10-dihidroksi-N -(2-etanol)stearamida
1,123 1,126 1,124 1,124 21,98 22,15 22,18 22,10 15,00
Bilangan Penyabunan Asam Oleat =
=
= 14,31
Bilangan Penyabunan asam 9,10-dihidroksi stearat =
=
= 19,54
Bilangan Penyabunan surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida =
=
Lampiran E : Perhitungan Harga HLB Menggunakan Metode Titrasi
HLB senyawa Asam Oleat ialah: HLB = 20 (1-S/A)
= 20 (1-14,21/27,57) = 20 – 10,31
= 9,69
HLB senyawa asam 9,10-dihidroksi stearat ialah: HLB = 20 (1-S/A)
= 20 (1-19,54/35,41) = 20 – 11,04
= 8,96
HLB senyawa surfaktan nonionik 9,10-dihidroksi-N-(2-etanol)stearamida ialah; HLB = 20 (1-S/A)
= 20 (1-15,00/25,28) = 20 – 11,87