UJI AKTIVITAS ANTIOKSIDAN LIGNIN DARI TANDAN
KOSONG KELAPA SAWIT
VANNY PRATIWI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
VANNY PRATIWI.
Uji Aktivitas Antioksidan Lignin dari Tandan Kosong
Kelapa Sawit. Dibimbing oleh GUSTINI SYAHBIRIN dan SUMINAR SETIATI
ACHMADI.
Peningkatan luas areal tanam kelapa sawit akan menyebabkan penambahan
jumlah produksi minyak kelapa sawit. Salah satu limbah padat industri kelapa
sawit adalah tandan kosong kelapa sawit (TKKS) yang mengandung
lignoselulosa. Penelitian ini memanfaatkan kandungan lignin dalam TKKS
sebagai antioksidan. Delignifikasi lignin dari TKKS dilakukan dengan metode
pulping
organosolv menggunakan etanol. Untuk mencirikan aktivitas antioksidan
lignin digunakan metode DPPH (1,1-difenil-2-pikrilhidrazil) sebagai radikal
bebas, yang diukur sebagai IC
50(konsentrasi inhibisi 50%). Rendemen lignin
9,09%; kadar lignin 76,57%; dan spektrum FTIR yang khas menunujukkan
senyawa lignin. Penentuan kadar hidroksifenolik dan bobot molekul lignin juga
dilakukan untuk mengukur aktivitas antioksidan lignin. Hasil uji menunjukkan
lignin memiliki tipe struktur fenolik 2 dan 3 masing-masing (0,4%) dan bobot
molekul lignin adalah 4005 g/mol. Butil hidroksitoluena (BHT), antioksidan
kimia komersial, digunakan sebagai kontrol positif. IC
50lignin adalah 50,2 ppm,
sedangkan IC
50BHT adalah 1883 ppm. Hasil ini menunjukkan bahwa aktivitas
ABSTRACT
VANNY PRATIWI. Antioxidant Activity Assay of Lignin From Empty Fruit
Bunch. Supervised by GUSTINI SYAHBIRIN and SUMINAR SETIATI
ACHMADI.
The increasing oil palm plantation will increase the amount of oil palm
production. One of the solid waste from oil palm industry is empty fruit bunch
(EFB) that contain lignocellulose. This research used lignin content in EFB as an
antioxidant. Lignin delignification from EFB was done by pulping organosolv
method using ethanol. Lignin antioxidant activity was characterized with DPPH
method (1,1-diphenyl-2-picrylhydrazyl) as free radical, measured as IC
50(inhibition concentration 50%). Lignin yield was 9,09%; lignin content 76,57%;
and fourier transform infrared (FTIR) spectrum indicated the lignin. Phenolic
hydroxyl and molecular weight lignin were also determine the lignin antioxidant
activity. This result pointed out that the lignin have phenolic structure of type 2
and 3 each 0,4% and the molecular weight is 4005 g/mol. Butylated
hydroxytoluene (BHT), a commercially chemical antioxidant, was used as a
positive control. The IC
50of lignin
is 50,2 ppm, while IC
50that of BHT is 1883
UJI AKTIVITAS ANTIOKSIDAN LIGNIN DARI
TANDAN KOSONG KELAPA SAWIT
VANNY PRATIWI
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Uji Aktivitas Antioksidan Lignin dari Tandan Kosong Kelapa
Sawit
Nama : Vanny Pratiwi
NIM : G44052723
Disetujui
Pembimbing I,
Pembimbing II,
Dr. Gustini Syahbirin, MS
Prof. Dr. Ir. Suminar S. Achmadi
NIP 19600819 198903 2 001 NIP 19480427 197412 2 001
Diketahui
Kepala Departemen Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor,
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Bismillahirrahmaanirrahiim...
Alhamdulillah
, p
uji syukur Penulis panjatkan kepada Allah SWT atas segala
berkah, rahmat, hidayah serta karunia yang diberikan kepada Penulis sehingga
dapat menyelesaikan karya ilmiah ini. Judul penelitian yang dilaksanakan sejak
bulan Mei hingga Agustus 2009 di Laboratorium Kimia Kayu, Departemen
Teknologi Hasil Hutan, Fakultas Kehutanan, IPB; Laboratorium Kimia Organik,
Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB; dan
Pusat Studi Biofarmaka adalah Uji Aktivitas Antioksidan Lignin dari Tandan
Kosong Kelapa Sawit.
Penulis mengucapkan terima kasih kepada Ibu Dr. Gustini Syahbirin, MS
dan Prof. Dr. Ir. Suminar S. Achmadi selaku pembimbing yang telah memberikan
bimbingan, arahan, dan waktu. Terima kasih yang tak terhingga kepada papa dan
mama tercinta, serta adik-adikku (Uci dan Kiki) atas nasihat, semangat, bantuan
materi, kesabaran, dan doa-doanya.
Ungkapan terima kasih juga penulis sampaikan kepada Bobby Alfian yang
selalu memberi dukungan dan setia menemani hari-hari Penulis; kepada Mitha,
Dian, Malia, Aulia, Ozi, Diah, Bayu, Akbar, Indah, Inka, dan Irma yang telah
memberi dukungan dan masukan yang membangun; dan kepada rekan
seperjuangan Ratih, Trisna, serta Kimia 42. Penulis juga mengucapkan terima
kasih kepada Pak Sobur, Pak Suprihatin, Mas Wawan, Mbak Siti, Mbak Tuti atas
bantuan dan masukan selama melakukan penelitian, serta pada keluarga besar
Wisma Nabila (Evi, Firda, Aulia, dan Rima) atas dukungannya.
Akhir kata, semoga karya ilmiah ini dapat bermanfaat.
Bogor, Desember 2009
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 1 Maret 1987 dari pasangan
Herry Agus Salim dan Titin Sriatin Pertiwi. Penulis merupakan putri pertama dari
tiga bersaudara.
Tahun 2005 penulis lulus dari SMA Negeri 90 Jakarta dan pada tahun
yang sama lulus seleksi masuk Insitut Pertanian Bogor (IPB) melalui jalur
Undangan Seleksi Masuk IPB (USMI).
DAFTAR ISI
Halaman
DAFTAR TABEL... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA ... 1
Tandan Kosong Kelapa Sawit... 1
Lignin dan Delignifikasi ... 2
Antioksidan ... 2
BHT... 3
Uji Aktivitas Antioksidan ... 3
BAHAN DAN METODE ... 4
Alat dan Bahan... 4
Lingkup Penelitian ... 4
HASIL DAN PEMBAHASAN... 5
Delignifikasi... 5
Isolat Lignin ... 6
Ciri-ciri Lignin ... 6
Aktivitas Antioksidan Lignin... 8
SIMPULAN DAN SARAN ... 10
Simpulan ... 10
Saran ... 10
DAFTAR PUSTAKA ... 10
DAFTAR TABEL
Halaman
1 Pencirian lindi hitam organosolv ... 6
2 Pencirian lignin dengan FTIR ... 8
DAFTAR GAMBAR
Halaman
1 Tandan kosong kelapa sawit ... 2
2 Senyawa induk lignin... 2
3 Struktur BHT... 3
4 Reaksi penangkapan H dari antioksidan oleh DPPH ... 3
5 Reaksi pengasaman gugus fenolat pada lignin... 6
6 Reaksi ionisasi gugus hidroksifenolik lignin ... 7
7 Struktur fenolik lignin tipe 2 dan 3 ... 7
8 Spektrum FTIR lignin aldrich dan organosolv TKKS ... 8
9 Stabilisasi radikal fenoksil oleh substitusi
orto
-metoksi... 9
10 Stabilisasi radikal fenoksil oleh konjugasi ikatan ganda dua... 9
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian... 13
2 Pencirian lindi hitam ... 16
3 Tipe struktur fenolik lignin ... 17
4 Data pencirian lindi hitam organosolv ... 18
5 Data ciri-ciri lignin... 19
6 Penentuan panjang gelombang maksimum DPPH... 24
7 Uji antioksidan lignin... 25
PENDAHULUAN
Pada tahun 2008, luas areal kelapa sawit mencapai 6,6 juta ha dengan produksi kelapa sawit sekitar 17,3 juta ton (Ditjen Perkebunan 2008). Peningkatan luas areal tersebut akan menyebabkan penambahan jumlah produksi minyak kelapa sawit. Hal tersebut berimplikasi pada limbah yang dihasilkan industri minyak kelapa sawit. Salah satu jenis limbah padat dari industri ini adalah tandan kosong kelapa sawit (TKKS) yang mengandung lignoselulosa. Pemanfaatan TKKS yang umum dilakukan saat ini diantaranya adalah penggunaan TKKS sebagai mulsa di kebun kelapa sawit dan dibakar untuk dijadikan pupuk. Namun, biaya transportasi yang dikeluarkan per unit nutrisi untuk mulsa cukup tinggi serta dapat menimbulkan ledakan populasi hama kumbang yang dapat mematikan tanaman kelapa sawit. Selain itu, usaha pembakaran dilarang oleh pemerintah karena dapat menyebabkan pencemaran udara (Siswanto 2006). Salah satu arah pengembangan TKKS adalah pemanfaatan lignin.
Penggunaan lignin pada saat sekarang semakin meningkat kepentingannya. Lignin merupakan komponen makromolekul kayu ketiga yang berikatan secara kovalen dengan selulosa dan hemiselulosa. Lignin dapat dimanfaatkan secara komersial sebagai bahan pengikat, perekat, pengisi, surfaktan, makanan ternak, dispersan, dan antioksidan. Lignin merupakan senyawa polimer fenolik alami.
Gugus hidroksilfenolik tersebut
memungkinkan lignin dapat bertindak sebagai antioksidan (Gregorova et al. 2007). Beberapa
penelitian telah dilakukan untuk mengetahui aktivitas penangkapan radikal oleh lignin. Barclay et al. (1997) mencirikan aktivitas penangkapan radikal dari beberapa lignin yang dihubungkan dengan struktur monomernya terhadap radikal bebas DPPH (1,1-difenil-2-pikrilhidrazil). Dizhbite et al.
(2004) mencirikan aktivitas penangkapan radikal lignin sebagai antioksidan alami. Pan
et al. (2006) menguji aktivitas antioksidan lignin organosolv etanol dari poplar hibrid sebagai penangkap radikal. Selain itu, Vinardell et al. (2008) menguji aktivitas antioksidan lignin dalam menghambat hemolisis dari berbagai sumber (bagas, lignosulfonat, steam explosion, dan curan 100)
pada sel darah manusia serta uji iritasi pada kulit dan mata kelinci.
Secara umum, efek antioksidan lignin bergantung pada aksi penangkapan dari
struktur fenolik lignin. Untuk mencirikan aktivitas antioksidan dari komponen fenolik alami digunakan DPPH sebagai radikal bebas. Metode ini memberikan berbagai keuntungan, yaitu antara lain sederhana, mudah, cepat, peka serta hanya menggunakan sedikit contoh (Apak et al. 2007). Senyawa antioksidan dalam bentuk tereduksi akan bereaksi dengan radikal bebas menjadi bentuk teroksidasinya yang stabil dan memiliki warna yang berbeda dengan bentuk tereduksinya. Perubahan warna
tersebut dapat dideteksi dengan
spektrofotometer pada panjang gelombang yang sesuai. Warna ungu pada radikal bebas DPPH dapat diamati dengan spektrofotometer UV-Vis pada panjang gelombang 515 nm. Berkurangnya intensitas warna ungu pada DPPH setara dengan kemampuan lignin dalam menangkap radikal bebas DPPH.
Tujuan penelitian ini adalah menguji aktivitas antioksidan lignin dari TKKS menggunakan metode DPPH. Pengujian ini didasarkan pada kandungan hidroksilfenolik lignin yang memugkinkan lignin memilki aktivitas antioksidan. Hal ini dapat berguna sebagai upaya memperluas pemanfaatan limbah padat industri kelapa sawit dan ligninnya.
TINJAUAN PUSTAKA
Tandan Kosong Kelapa Sawit (TKKS)
Tanaman kelapa sawit berbuah setelah berumur 2,5 tahun dan buahnya masak 5,5 bulan setelah penyerbukan. Suatu tandan dapat dipanen apabila sedikitnya terdapat 5 buah inti sawit yang jatuh dari tandan dan bobot rata-rata tandan sudah mencapai 3 kg. Jumlah buah per tandan mencapai 1600 buah. Pada tanaman normal, tandan yang dihasilkan sekitar 20 sampai dengan 22 tandan per tahun sedangkan tanaman yang tua menghasilkan 12 sampai dengan 14 tandan per tahun. Berat setiap tandan tersebut mencapai 25 sampai dengan 35 kg (Defrizal 2009).
TKKS (Gambar 1) dapat ditemukan di sekitar pabrik minyak kelapa sawit yang merupakan limbah berlignoselulosa dan pemanfaatannya belum optimum. Pada umumnya, TKKS hanya disebar di sekitar pohon kelapa sawit atau dibakar dalam insinerator yang dapat menyebabkan pencemaran udara. TKKS terdiri atas tiga
komponen utama, yaitu selulosa,
OH
OH OCH3 pembuatan pulp dan kertas, serta produksi
etanol (Siswanto 2006).
Gambar 1 Tandan kosong kelapa sawit.
Lignin dan Delignifikasi
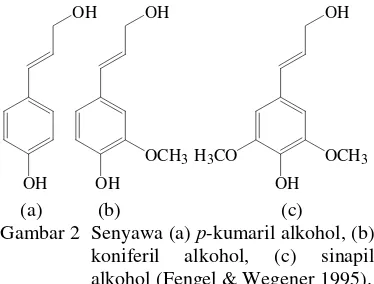
Lignin merupakan polimer dari unit-unit fenilpropana. Polimer lignin tidak linear tetapi cenderung bercabang dan membentuk struktur tiga dimensi. Sekitar dua pertiga bagian unit fenilpropana dalam lignin dihubungkan oleh ikatan eter (C-O-C), sedangkan sisanya dihubungkan oleh ikatan karbon (C-C) (Achmadi 1990). Secara fisik, lignin berwujud amorf dan berwarna cokelat. Lignin tidak larut dalam air, larutan asam dan larutan hidrokarbon. Lignin merupakan komponen makromolekul kayu yang ketiga. Struktur molekul lignin sangat berbeda bila dibandingkan dengan polisakarida karena terdiri atas sistem aromatik yang tersusun atas unit-unit fenilpropana. Lignin dapat meningkatkan sifat-sifat kekuatan mekanik sehingga tumbuhan tetap kokoh berdiri. Menurut Fengel & Wegener (1995), senyawa induk (prekursor) primer atau unit pembentuk lignin adalah p-kumaril alkohol, koniferil
alkohol dan sinapil alkohol (Gambar 2). Menurut Achmadi (1990), lignin dapat dibagi menjadi beberapa kelas menurut unsur strukturnya, yaitu lignin guaiasil dan guaiasil-siringil. Lignin guaiasil terdapat pada kayu jarum dengan prekursor koniferil alkohol, sedangkan lignin guaiasil-siringil terdapat pada kayu berdaun lebar dengan prekursor koniferil alkohol dan sinapil alkohol. Menurut Lin & Dence (1992), lignin memiliki 6 tipe struktur fenolik, yaitu struktur dengan sisi cincin jenuh, struktur ikatan ganda dua terkonjugasi, struktur α-karbonil, p,p-stilbena,
o,p-stilbena, dan struktur bifenil yang tercantum pada Lampiran 3. Beberapa penelitian telah dilakukan untuk menambah manfaat lignin dari tandan kosong kelapa sawit. Heradewi (2007) melakukan isolasi lignin dari lindi hitam proses pemasakan organosolv serat tandan kosong kelapa sawit. Anwar (2008) melakukan optimasi suhu dan
konsentrasi sodium bisulfit (NaHSO3) pada
proses pembuatan sodium lignosulfonat berbasis tandan kosong kelapa sawit. Ismiyati (2009) melakukan perancangan proses sulfonasi lignin isolat tandan kosong kelapa sawit menjadi surfaktan natrium lignosulfonat (NLS).
(a) (b) (c)
Gambar 2 Senyawa (a) p-kumaril alkohol, (b) koniferil alkohol, (c) sinapil alkohol (Fengel & Wegener 1995).
Proses delignifikasi adalah proses pelarutan lignin (pulping). Pulping secara
organosolv adalah proses delignifikasi
menggunakan pelarut organik sebagai media reaksi seperti metanol (organocell), etanol (alcell), aseton, asam asetat (acetocell), dan lain-lain. Proses organosolv tersebut
didasarkan pada perbedaan kelarutan komponen kimia bahan baku pulp dimana lignin larut dalam pelarut organik sedangkan karbohidrat dengan bobot molekul rendah larut dalam air dan selulosa tidak larut dalam kedua pelarut tersebut (Bahar 1983). Delignifikasi pada proses organosolv
disebabkan oleh terputusnya ikatan eter, yaitu
α-aril eter (α-O-4) dan β-aril eter (β-O-4)
(McDonough 1992). Proses alcell dapat mengganti semua polusi sulfit sehingga lebih ramah terhadap lingkungan. Biaya proses
alcell dibandingkan dengan biaya pulping kimia lain juga dinilai lebih ekonomis.
Antioksidan
Antioksidan didefinisikan sebagai senyawa yang dalam konsentrasi rendah dibandingkan dengan substrat yang dapat teroksidasi sehingga secara signifikan menghambat dan mencegah oksidasi substrat. Antioksidan dalam tubuh bermanfaat untuk mencegah reaksi oksidasi yang ditimbulkan oleh radikal bebas baik berasal dari metabolisme tubuh maupun faktor eksternal lainnya. Berdasarkan asalnya, antioksidan terdiri atas antioksigen yang berasal dari dalam tubuh (endogen) dan dari luar tubuh (eksogen). Adakalnya sistem antioksidan
OH
OH
OH
OCH3 OH
H3CO
endogen tidak cukup mampu mengatasi stres oksidatif yang berlebihan. Stres oksidatif merupakan keadaan saat mekanisme antioksidan tidak cukup untuk memecah spesies oksigen reaktif (ROS). Oleh karena itu, diperlukan antioksidan dari luar (eksogen) untuk mengatasinya (Percival 1998).
Komponen kimia yang berperan sebagai antioksidan dan aktivitas biologis lainnya adalah golongan polifenol. Senyawa polifenol mengandung cincin aromatik dengan satu atau lebih tersubstitusi oleh gugus –OH (Apak et al. 2007). Lignin merupakan polimer fenolik alami yang ditemukan pada dinding sel tumbuhan. Beberapa penelitian telah dilakukan untuk mempelajari aktivitas antioksidan dari lignin. Barclay et al. (1997) melaporkan bahwa substitusi orto-metoksi dapat meningkatkan efisiensi penangkapan radikal dari lignin. Dizhbite et al. (2004)
melaporkan bahwa aktivitas penangkapan radikal tidak hanya bergantung pada jumlah atom hidrogen tetapi juga stabilitas dari radikal yang dibentuk. Selain itu, bobot molekul lignin yang rendah dapat meningkatkan aktivitas antioksidan lignin. Pan et al. (2006) melaporkan bahwa kemampuan penangkapan radikal dari komponen fenolik lignin tidak hanya
bergantung pada kemampuan dalam
pembentukan radikal fenoksil tetapi juga pada stabilitas radikal fenoksil. Adanya substituen dapat menstabilkan radikal fenoksil sehingga akivitas antioksidan lignin semakin meningkat. Vinardell et al. (2008) juga melaporkan bahwa pada konsentrasi 0,1 sampai 0,5 gram, penggunaan lignin tidak menunjukkan iritasi pada mata dan kulit kelinci. Namun, diperlukan penelitian lebih lanjut untuk mengetahui formulasinya.
BHT
Butil hidroksitoluena (BHT) merupakan antioksidan yang biasa ditambahkan pada tingkat 0,01% sampai 0,02% dari kandungan
lemak pada produk makanan (Choe & Yang 1983). BHT (Gambar 3) mencegah ketengikan pada makanan yang mengandung lemak yang disebabkan oleh degradasi oksidatif lemak. Oksidasi tidak hanya menghasilkan perubahan rasa yang tidak diinginkan tetapi juga menghancurkan lemak yang larut vitamin dan asam lemak esensial serta menyebabkan produk yang beracun. BHT biasa digunakan untuk mentega, makanan sereal, dan makanan hewan.
CH3
OH
(H3C)C C(CH3)
Gambar 3 Struktur BHT.
Uji Aktivitas Antioksidan
Salah satu metode yang digunakan untuk pengujian aktivitas antioksidan adalah metode DPPH. Metode DPPH didasarkan pada kemampuan antioksidan untuk menghambat radikal bebas dengan mendonorkan atom hidrogen (Apak et al. 2007). Prinsip pengujian antioksidan ekstrak tanaman dengan DPPH (1,1-difenil-2-pikrilhidrazil) adalah reaksi penangkapan hidrogen dari antioksidan oleh radikal bebas DPPH dan diubah menjadi 1,1-difenil-2-pikrilhidrazin (Gambar 4).
Pengukuran aktivitas antioksidan
menggunakan radikal DPPH merupakan metode yang cepat, mudah, dan murah. Pada keadaan radikal, DPPH akan memberikan serapan maksimum pada panjang gelombang 515 nm yang berwarna ungu tetapi setelah tereduksi oleh senyawa antioksidan serapannya akan menghilang. Warna ungu tersebut akan berubah menjadi kuning ketika elektron bebas radikal DPPH menjadi berpasangan dengan hidrogen, yaitu DPPH-H (Brand et al. 1995).
N O2 O2N
N
N
R H
N O2
N O2 O2N
N
N H
N O2
R
.
+ +
.
Gambar 4 Reaksi penangkapan H dari antioksidan oleh DPPH.
BAHAN DAN METODE
Alat dan Bahan
Peralatan yang digunakan adalah spektrofotometer UV-VIS Hitachi U-2800 dan spektrofotometer FTIR Bruker dengan tipe tensor 37.
Bahan-bahan yang digunakan antara lain tandan kosong kelapa sawit (TKKS) dari PTP Nusantara VIII cabang kebun Sasungka, Jasinga Jawa Barat dan DPPH (1,1-difenil-2-pikrilhidrazil).
Lingkup Penelitian
Persiapan Bahan (Sun et al. 1999)
TKKS mula-mula dibersihkan dari kulit buah sawit kemudian diuraikan menjadi bentuk serat dan dikeringkan di udara terbuka (sinar matahari) selama satu minggu. Serat TKKS tersebut kemudian dipotong dengan ukuran ± 30 mm.
Delignifikasi
Delignifikasi dilakukan berdasarkan metode terbaik hasil penelitian Heradewi (2007) yang mengacu pada metode Sun et al. (1999). Sebanyak 250 gram serat kering TKKS dimasak di dalam digester untuk memperoleh lindi hitam TKKS. Pemasakan dilakukan dengan dua tahap, yaitu pemasakan dari suhu kamar sampai suhu maksimum (waktu reaksi) dan pemasakan yang dipertahankan pada suhu maksimum (waktu pada suhu maksimum). Kondisi delignifikasi dilakukan dengan komposisi larutan pemasak 1:1 (etanol teknis 95%:air) dan komposisi larutan pemasak terhadap serat kering TKKS 10:1 (v/b). Komposisi NaOH yang digunakan adalah 10% terhadap serat kering TKKS dengan suhu maksimum sebesar 170°C, dan
waktu reaksi selama 1,5 jam serta waktu pada suhu maksimum selama 1 jam.
Hasil delignifikasi terdiri atas dua bagian, yaitu lindi hitam dan serpihan (pulp) yang agak lunak. Serpihan yang dihasilkan tersebut dicuci dengan aseton teknis 95% kemudian dengan air. Sisa cairan yang diperoleh ditambahkan pada lindi hitam. Setelah itu, lindi hitam disaring dengan kain nilon 20 m untuk memisahkan bahan terlarut dalam lindi hitam (filtrat) dan tidak larut (endapan). Pencirian lindi hitam meliputi warna, bau, pH, kadar air, dan kadar padatan total yang tercantum pada Lampiran 2.
Isolasi Lignin
Isolasi lignin dilakukan berdasarkan metode terbaik hasil penelitian Heradewi (2007) yang mengacu pada metode yang dikembangkan Kim et al. (1987). Sebanyak 500 ml lindi hitam yang telah disaring (filtrat) dititrasi dengan H2SO4 20% untuk diendapkan
ligninnya. Titrasi dilakukan sampai pH 2 kemudian didiamkan selam 8 jam. Endapan lignin dipisahkan dari lindi hitam menggunakan sentrifuse dengan kecepatan 12000 rpm selama 20 menit. Setelah itu, endapan lignin dilarutkan dalam NaOH 1 N lalu diendapkan lagi dengan H2SO4 20%
(seperti tahap pertama). Endapan yang diperoleh kemudian dicuci kembali dengan H2SO4 0,01 N lalu dengan air suling dan
disaring menggunakan penyaring vakum. Endapan yang telah dicuci tersebut dikeringkan dalam oven selama 24 jam pada suhu 50°C sehingga diperoleh tepung lignin.
Pencirian Lignin
Rendemen. Rendemen lignin dihitung berdasarkan rasio bobot lignin kering terhadap bobot serpih TKKS yang digunakan. Rendemen dinyatakan dalam persen bobot per bobot serat TKKS (% b/b).
Kadar Lignin (TAPPI T 222 05-74).
Sebanyak 1 gram lignin hasil isolasi (A) dimasukkan ke dalam gelas piala 100 ml dan ditambahkan 15 ml H2SO4 72% pada suhu
10-15°C. Penambahan H2SO4 dilakukan
perlahan-lahan di dalam bak perendaman sambil diaduk dengan pengaduk kaca selama 2–3 menit kemudian gelas piala ditutup dengan kaca arloji dan dibiarkan pada suhu 20°C (dalam bak perendaman) selama 2 jam dengan sesekali diaduk.
% 100 A B lignin
Kadar = ×
Penentuan kadar hidroksilfenolik (Goldschmid 1957). Sebanyak 0,1 gram lignin dilarutkan dalam bufer pH 12 dan diencerkan sebagai larutan stok. Larutan alkali lignin dengan konsentrasi 0,15 g/l diperoleh dengan mengambil 7,5 ml larutan stok kemudian diencerkan sampai 50 ml dengan larutan bufer pH 12. Larutan netral lignin dengan konsentrasi yang sama diperoleh dengan mengambil 7,5 ml larutan stok kemudian ditambahkan 7,5 ml H2SO4 0,1 N
dan diencerkan dengan larutan bufer pH 6 sampai 50 ml. Perbedaan absorbans kedua larutan diukur pada panjang gelombang 280 sampai dengan 400 nm dengan larutan netral sebagai blanko. Kadar hidroksifenolik ditentukan dengan persamaan berikut:
% 100 4100 17 a enolik hidroksilf
Kadar =∆ max× ×
Keterangan:
∆amax = Absorptivitas maksimum
17 = Bobot molekul OH 4100 = Absorptivitas molar lignin
Penentuan bobot molekul lignin (Beckman dalam Santoso 1995). Perhitungan bobot
molekul lignin dilakukan melalui perhitungan bobot ekuivalen, yaitu sebanyak 0,5 gram lignin dimasukkan ke dalam Erlenmeyer 250 ml dan dibasahi dengan 5 ml etanol. Campuran tersebut dibubuhi dengan 1 gram NaCl kemudian ditambahkan 100 ml air suling. Larutan tersebut kemudian dititrasi dengan NaOH 0,1 N sampai pH 7,5. Bobot ekuivalen lignin ditentukan dengan persamaan berikut: NaOH N NaOH ml contoh gram 1000 BE × × =
Pencirian lignin menggunakan FTIR (Nada
et al. 2002). Sebanyak 1 mg tepung lignin dicampur dengan 150 mg KBr lalu dibuat menjadi pelet, kemudian dianalisis dengan FTIR.
Aktivitas Antioksidan Lignin (Pan et al. 2006)
Larutan lignin dibuat dengan konsentrasi 25; 50; 100; 150; 200 mg/l yang dilarutkan dalam 90% dioksana. Pelarutan lignin dilakukan sedikit demi sedikit. Sebanyak 1,12 ml larutan lignin dicampurkan dengan 4,13
ml larutan DPPH 6
×
10-5 M pada suhu 25°C selama 16 menit. BHT digunakan sebagai kontrol positif. Konsentrasi radikal DPPH pada 0 dan 16 menit diukur pada panjang gelombang 515 nm.% 100 (0) A (16) A -(0) A (%)
IP = ×
Persentasi inhibisi diplot sebagai fungsi konsentrasi lignin. Dari grafik tersebut ditentukan konsentrasi lignin yang dibutuhkan untuk mencapai 50% IP yang diukur sebagai IC50. Diagram alir penelitian tercantum pada
Lampiran 1.
HASIL DAN PEMBAHASAN
Delignifikasi
Perlakuan fisik TKKS dengan cara pemotongan dilakukan untuk memperluas permukaan bahan sehingga penetrasi larutan pemasak ke dalam serat lebih cepat. Selain itu, pengeringan dilakukan untuk menguapkan air dalam serat sehingga dapat mempercepat penetrasi larutan pemasak. Pada penelitian ini, delignifikasi dilakukan dengan proses organosolv. Proses delignifikasi atau pulping
merupakan proses pelarutan lignin. Proses tersebut dilakukan untuk memisahkan lignin dengan selulosa. Pemilihan proses ini didasarkan pada faktor lingkungan, biaya, dan daur ulang larutan pemasak. Proses organosolv lebih aman terhadap lingkungan karena tidak mengandung sulfur. Selain itu, proses organosolv lebih mudah dilakukan dan daur ulang larutan pemasak menghasilkan lignin sebagai bahan padat dan karbohidrat sebagai bahan gula sehingga proses ini dinilai lebih ekonomis. Pelarut organik yang digunakan pada proses organosolv tersebut adalah etanol atau yang disebut proses alcell.
Pemilihan pelarut tersebut didasarkan pada formulasi larutan pemasak yang tidak mengandung sulfur sehingga dapat mereduksi semua limbah sulfur akibat proses pulping
konvensional. Selain itu, proses alcell juga
dapat digunakan untuk suhu tinggi sehingga degradasi lignin-karbohidrat lebih sempurna (Schroeter 1991).
kondensasi serta polimerisasi kembali yang menyebabkan lignin tidak larut dalam larutan pemasak. Selama pemasakan terjadi reaksi cepat, yaitu terjadinya pemutusan ikatan lignin karbohidrat sehingga lignin yang lepas larut dalam larutan pemasak. Selain itu, juga terjadi reaksi lambat, yaitu reaksi kondensasi dan polimerisasi kembali yang menyebabkan lignin tidak larut dalam larutan pemasak (Bahar 1983). Pada proses delignifikasi ini digunakan katalis basa, yaitu NaOH. Penggunaan NaOH menyebabkan tingginya konsentrasi ion hidroksil dalam larutan pemasak yang dapat mempercepat pemutusan ikatan intramolekul lignin saat ekstraksi sehingga mempercepat proses delignifikasi (Rostika et al. 1995). Hasil delignifikasi terdiri atas dua bagian, yaitu lindi hitam dan serpihan (pulp) agak lunak. Serpihan yang diperoleh tersebut dicuci dengan aseton dan air. Fungsi pencucian tersebut adalah untuk melarutkan lignin yang masih menempel pada serat kayu. Pencirian lindi hitam yang diperoleh (Tabel 1).
Tabel 1 Pencirian lindi hitam organosolv.
Pencirian Pengamatan
Warna Hitam kecoklatan
Bau Bau etanol
pH 11,03
Kadar air (%) 97,56
Padatan total (%) 2,44
Lindi hitam dicirikan untuk mengetahui ciri bahan secara fisik dan kimia dari lindi hitam yang diperoleh. Warna lindi hitam diperoleh secara visual, yaitu hitam kecokelatan. Hal ini disebabkan oleh bahan organik dan anorganik yang larut ataupun yang tersuspensi dalam larutan setelah pemasakan bahan baku. Lindi hitam yang diperoleh pada penelitian ini berbau etanol. Selain itu, adanya degradasi asam lemak menjadi asam-asam lemak berantai pendek seperti asam butirat, senyawa hasil degradasi karbohidrat, dan terbentuknya asam format serta asam asetat dapat menyebabkan bau tidak sedap pada lindi hitam (Brongers & Mierzwa 2005).
Derajat keasaman (pH) lindi hitam yang diperoleh adalah 11,03. Lindi hitam cenderung bersifat basa kuat karena penggunaan soda (NaOH) sebagai katalis dalam larutan pemasak pada penelitian ini. Padatan total yang diperoleh pada penelitian
ini 2,44%. Padatan total dalam lindi hitam menunjukkan banyaknya kandungan senyawa organik dan anorganik yang terlarut dalam lindi hitam. Senyawa organik dan anorganik tersebut antara lain berupa zat ekstraktif, hemiselulosa, lignin yang terdegradasi, dan selulosa dengan bobot molekul rendah (Fengel & Wegener 1995). Data pencirian lindi hitam organosolv tercantum pada Lampiran 4.
Isolat Lignin
Lignin diisolasi dari lindi hitam dengan cara mengendapkan pada pH 2 menggunakan H2SO4 20%. Pada pH 2, gugus fenolat
menerima ion hidrogen secara maksimal menjadi fenol (Gambar 5).
HC OH
HC CH2OH
R H+ O -OCH3 HC OH HC CH2OH
R
OH
OCH3
Gambar 5 Reaksi pengasaman gugus fenolat pada lignin.
Hal tersebut menyebabkan kelarutan lignin dalam air berkurang sehingga lignin dapat dipisahkan dari senyawaan yang larut dalam air. Pengendapan dilakukan menggunakan H2SO4 20% yang didasarkan pada penelitian
Heradewi (2007). Pada kondisi tersebut diperoleh rendemen terbesar. Rendemen isolat lignin yang diperoleh pada konsentrasi dibawah 20% mengalami penurunan yang mungkin disebabkan belum maksimumnya reaksi kondensasi sedangkan pada konsentrasi diatas 20% juga terjadi penurunan rendemen yang disebabkan oleh lokalisasi pengasaman. Endapan lignin dilarutkan dalam NaOH 1 N untuk menghilangkan asam organik yang tidak larut bersama lignin ketika pH dinaikkan sehingga kemurnian lignin meningkat. Pengendapan dan pelarutan berulang menghasilkan ion natrium pada lignin yang dihasilkan. Pengotor ini dapat diminimumkan dengan pencucian menggunakan H2SO4.
Ciri-ciri Lignin
Rendemen. Rendemen lignin yang diperoleh
pada penelitian ini adalah 9,09%. Hasil ini lebih rendah dibandingkan dengan hasil
penelitian Heradewi (2007), yaitu 19,95%. Hal tersebut dapat disebabkan oleh masih banyaknya zat ekstraktif sehingga terjadi proses kondensasi dan polimerisasi kembali (Sjostrom 1995). Kondendsasi dan repolimerisasi tersebut menyebabkan lignin tidak larut dalam larutan pemasak dan menempel kembali pada permukaan serat sehingga kandungan lignin dalam lindi hitam lebih sedikit.
Kadar Lignin. Metode Klason digunakan
untuk menentukan kadar lignin. Ikatan eter antarlignin dan selulosa yang terdapat pada lignin dihidrolisis dengan H2SO4 72%.
Selulosa larut dalam H2SO4 72%, sedangkan
lignin tidak larut. Kadar lignin yang diperoleh pada penelitian ini adalah 76,57%. Hasil ini lebih rendah dibandingkan hasil penelitian Heradewi (2007) yang memperoleh kadar lignin 88,39%. Hal ini dapat disebabkan pencucian isolat lignin yang lebih banyak dibandingkan dengan yang dilakukan Heradewi (2007).
Kadar Hidroksilfenolik. Ionisasi gugus hidroksifenolik pada lignin menghasilkan perubahan batokromik dan hiperkromik dari spektrum absorpsi (Gambar 6). Perubahan spektrum tersebut dapat digunakan untuk mengukur tipe dan frekuensi unit hidroksifenolik pada lignin.
Gambar 6 Reaksi ionisasi gugus hidroksi-fenolik lignin.
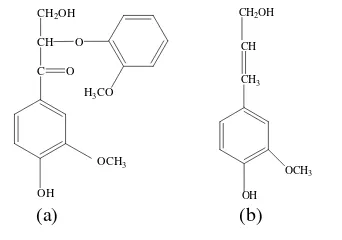
Berdasarkan penelitian, diperoleh kadar hidroksilfenolik lignin organosolv dari TKKS untuk tipe struktur 2 dan 3 (Gambar 7) masing-masing sebesar 0,4%. Hasil tersebut
lebih kecil dibandingkan kadar
hidroksilfenolik Ardiansyah (2008) untuk lignin kraft eukaliptus dengan tipe struktur 1 dan 3, berturut-turut sebesar 2,73% dan 2,50%. Hal ini mungkin disebabkan jumlah gugus kromofor pada lignin organosolv TKKS lebih sedikit dibandingkan lignin kraft eukaliptus. Perbedaan jumlah kromofor tersebut kemungkinan disebabkan oleh perbedaan asal sampel.
(a) (b)
Gambar 7 Struktur fenolik lignin tipe 2 (a) dan tipe 3 (b).
Bobot Molekul Lignin. Lignin merupakan polimer kompleks yang memiliki distribusi bobot molekul. Beckman dalam Santoso (1995) mengemukakan bahwa lignin merupakan senyawa kimia bivalen sehingga bobot molekul lignin adalah dua kali bobot eukivalennya. Berdasarkan hasil penelitian, diperoleh bobot molekul lignin organosolv sebesar 4005 g/mol. Hasil tersebut tidak berbeda secara signifikan dengan bobot molekul TKKS pada penelitian Heradewi (2007), yaitu sebesar 3943 g/mol. Rerata bobot molekul lignin tidak seragam yang disebabkan oleh beragamnya proses pembuatan pulp, proses isolasi lignin, degradasi makromolekul selama isolasi, dan efek kondensasi terutama pada kondisi asam. Selain itu, ketidakseragaman bobot molekul lignin juga disebabkan oleh degradasi acak lignin pada dinding sel secara kimia selama isolasi sehingga menghasilkan fragmen-fragmen dengan ukuran yang berbeda yang dapat larut tetapi komposisi kimianya agak seragam (Fengel & Wegener 1995).
Spektrum FTIR Lignin. Analisis spektrum
inframerah dilakukan untuk menentukan sifat-sifat khas senyawa yang strukturnya sudah diketahui pasti. Spektrum FTIR lignin organosolv yang dibandingkan dengan model lignin Aldrich memperlihatkan beberapa pita serapan khas lignin (Gambar 8). Pita serapan pada bilangan gelombang 3409,74 cm-1 pada
lignin organosolv TKKS dan 3409,74 cm-1
pada lignin Aldrich menunjukkan uluran O-H. Pita serapan pada bilangan gelombang 2919,26 cm-1 pada lignin organosolv TKKS
dan 2933,34 cm-1 pada lignin Aldrich
menunjukkan uluran C-H dari gugus metil. Dua pita serapan pada bilangan gelombang 1605,54 cm-1 dan 1507,85 cm-1 pada lignin organosolv TKKS serta 1596,20 cm-1 dan
1508,29 cm-1 pada lignin Aldrich menunjukkan ciri vibrasi cincin aromatik. Pita H3CO
OH Lignin
OH
-OCH3 H3CO
O -Lignin
OCH3 + H2O
CH2OH
CH
CH3
OCH3 OH CH2OH
CH
C O O
H3CO
OH
OCH3
serapan pada bilangan gelombang 1463,82 cm-1 pada lignin organosolv TKKS dan 1464,39 cm-1 pada lignin Aldrich
menunjukkan deformasi C-H asimetri. Pita serapan lignin yang paling khas terdapat pada sekitar 1510 cm-1 dan 1600 cm-1 yang menunjukkan vibrasi cincin aromatik serta antara 1470 cm-1 dan 1460 cm-1 menunjukkan
deformasi C-H (Fengel & Wegener 1995). Pita serapan pada bilangan gelombang 1218,25 cm-1 pada lignin organosolv TKKS
dan 1220,21 cm-1 pada lignin Aldrich
menunjukkan vibrasi cincin guaiasil. Bilangan gelombang pada 1330 cm-1 sampai dengan 1320 cm-1 pada lignin organosolv TKKS dan
Aldrich yang menunjukkan vibrasi cincin siringil tidak ada. Hal ini kemungkinan karena lignin Aldrich berasal dari kayu daun jarum, sedangkan lignin organosolv TKKS berasal dari non kayu. Cincin guaiasil merupakan struktur penyusun lignin dengan prekursor koniferil alkohol. Pita serapan pada 1116,58 cm-1 pada lignin organosolv TKKS dan
1137,57 cm-1 pada lignin Aldrich
menunjukkan uluran eter (Tabel 2). Berdasarkan spektrum FTIR lignin organosolv TKKS dan lignin aldrich yang digunakan sebagai pembanding menunjukkan bahwa secara kualitatif isolat lignin yang diperoleh adalah senyawa lignin. Pergeseran pita serapan mungkin disebabkan oleh sumber
lignin dan prosedur isolasi yang berbeda-beda. Data ciri-ciri lignin tercantum pada Lampiran 5.
Tabel 2 Pencirian lignin dengan FTIR.
Lignin Lignin Pita
aldrich organosolv serapan
3409,74* 3409,74* Ulur O-H
2933,34* 2919,26* Ulur C-H
pada metil 1596,20** 1605,54* Vibrasi
cincin aromatik 1508,29* 1507,85* Vibrasi
cincin aromatik
1464,39* 1463,82* Deformasi
C-H (asimetri)
- - Vibrasi
cincin siringil 1220,21* 1218,25* Vibrasi cincin guaisil 1137,57** 1116,58** Ulur eter
*Fengel & Wegener 1995 **Silverstein et al. 1981
Gambar 8 Spektrum FTIR lignin aldrich dan organosolv TKKS.
Aktivitas Antioksidan Lignin
Antioksidan lignin diuji menggunakan metode DPPH. Metode DPPH didasarkan
pada kemampuan antioksidan untuk menghambat radikal bebas dengan mendonorkan atom hidrogen. Metode DPPH dipilih karena dapat memberi pengukuran
yang mudah, cepat, peka, dan hanya membutuhkan sedikit contoh. BHT yang merupakan antioksidan kimia komersial digunakan sebagai kontrol positif pada penelitian ini. Pengukuran aktivitas antioksidan lignin dilakukan pada panjang gelombang 515,6 nm (Lampiran 6). Berdasarkan penelitian, diperoleh nilai IC50
lignin organosolv tepatnya 50,2 ppm, sedangkan nilai IC50 BHT tepatnya 1883
ppm. Hal tersebut menunjukkan bahwa aktivitas antioksidan lignin jauh lebih tinggi dibandingkan dengan BHT. Lignin yang merupakan polifenol memilki kandungan hidroksilfenolik lebih banyak dibandingkan BHT yang merupakan fenol sehingga aktivitas antioksidan lignin lebih tinggi. Adanya stabilisasi tambahan pada lignin kemungkinan juga dapat menyebabkan tingginya aktivitas antioksidan lignin. Atom hidrogen pada BHT lebih asam sehingga lebih mudah dilepaskan dibandingkan dengan lignin. Hal ini disebabkan karena gugus pendorong elektron pada lignin (metoksil) lebih kuat dibandingkan dengan BHT (metil) sehingga menurunkan keasaman lignin. Selain itu, lignin organosolv dari TKKS memiliki nilai IC50
yang hampir sama dengan nilai IC50 lignin
bagas pada penelitian Vinardell et al. (2008), yaitu 51,6 ppm. Lignin bagas menunjukkan aktivitas antioksidan paling besar dibandingkan dengan lignin curan 100,
steam explosion, dan lignosulfonat. Data IC50 lignin dan BHT tercantum pada
Lampiran 7 dan 8.
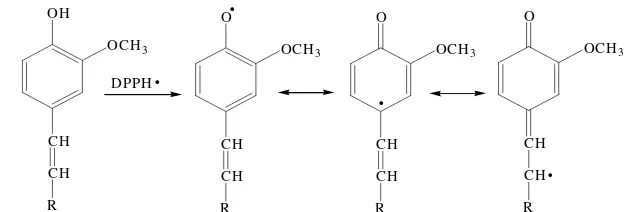
Aktivitas antioksidan lignin bergantung pada kandungan hidroksilfenolik lignin. Kecilnya kandungan hidroksilfenolik lignin pada penelitian ini, yaitu sebesar 0,4% dapat menyebabkan menurunnya aktivitas antioksidan lignin. Selain itu, aktivitas antioksidan lignin juga dipengaruhi oleh kestabilan radikal fenoksil yang terbentuk (Pan et al. 2006). Adanya substitusi orto
-metoksi menunjukkan semakin
meningkatnya aktivitas antioksidan lignin. Substitusi orto-metoksi dapat menstabilkan
radikal fenoksil dengan resonansi sehingga dapat menghalangi terjadinya tahap propagasi (Gambar 9). Selain itu, adanya konjugasi ikatan ganda dua dapat memberikan stabilisasi tambahan pada radikal fenoksil (Gambar 10), sedangkan adanya substitusi α-karbonil dapat
menurunkan aktivitas antioksidan lignin. Aktivitas antioksidan lignin juga dipengaruhi oleh besarnya bobot molekul lignin (Dizhbite et al. 2004). Rendahnya bobot molekul lignin dapat meningkatkan aktivitas antioksidan lignin. Hal ini disebabkan oleh lignin dengan bobot molekul rendah memiliki kandungan ArOH yang lebih banyak dibandingkan lignin dengan bobot molekul tinggi. Heterogenitas lignin merupakan salah satu faktor yang dapat mempengaruhi aktivitas antioksidan lignin. Adanya tambahan karbohidrat dapat menurunkan aktivitas antioksidan lignin yang kemungkinan disebabkan oleh ikatan hidrogen yang terbentuk antara gugus polar karbohidrat dengan gugus fenolik lignin (Dizhbite et al. 2004).
OH OCH3 Lignin O OCH3 Lignin O OCH3 Lignin O OCH3 Lignin
.
+.
.
.
DPPHGambar 9 Stabilisasi radikal fenoksil oleh substitusi orto-metoksi.
OH OCH3 CH CH R DPPH O OCH3 CH CH R O OCH3 CH CH R O OCH3 CH CH R
.
.
.
.
Gambar 10 Stabilisasi radikal fenoksil oleh konjugasi ikatan ganda dua.
SIMPULAN DAN SARAN
Simpulan
Lignin organosolv TKKS memilki rendemen berdasarkan bobot serat TKKS sebesar 9% (b/b). Kadar lignin TKKS yang diperoleh adalah 77% dan kadar hidroksifenolik untuk struktur 2 dan 3 masing-masing 0,4%. Bobot molekul lignin TKKS yang diperoleh adalah sekitar 4000 g/mol. Analisis spektrum FTIR lignin organosolv TKKS menunjukkan serapan yang khas untuk senyawa lignin.
Nilai IC50 lignin organosolv TKKS yang
diperoleh adalah sebesar 50 ppm sedangkan nilai IC50 BHT diperoleh sebesar 1880 ppm.
Berdasarkan nilai tersebut diketahui bahwa aktivitas antioksidan lignin organosolv TKKS jauh lebih tinggi dibandingkan BHT.
Saran
Perlu dilakukan penelitian lebih lanjut mengenai uji antioksidan lignin secara in vitro maupun in vivo dan mempelajari formulasi lignin untuk aplikasi antioksidan. Selain itu, untuk penelitian lebih lanjut perlu dilakukan pengujian penambahan hasil pencucian serpihan pulp ke dalam lindi hitam.
DAFTAR PUSTAKA
Achmadi SS. 1990. Kimia Kayu. Bogor:
Departemen Pendidikan dan
Kebudayaan, Direktorat Pendidikan Tinggi, Pusat Antaruniversitas Bioteknologi, IPB.
[ASTM] American Society for Testing and Material. 1962. Water Content of Pulp and Wood. ASTM D2016-62T.
Anwar K. 2008. Optimasi suhu dan konsentrasi sodium bisulfit (NaHSO3)
pada proses pembuatan sodium lignosulfonat berbasis tandan kosong kelapa sawit (TKKS) [Skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Apak R, Gőclő K, Özyőrek M, Çelik SE,
Karademir SE. 2007. Comparitive evaluation of various total antioxidant capacity assay applied to phenolic compounds with the CUPRAC assay.
Molecules 12:1496-1547.
Ardiansyah IP. 2008. Sintesis dan pencirian natrium hidroksimetilfenol(lignin klason) Sulfonat. [Skripsi]. Bogor: Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Bahar N. 1983. Pembuatan pulp dengan pelarut organik. Berita Selulosa 19 (3):
104-108.
Barclay LRC, Xi F, Norris JQ. 1997. Antioxidant properties of phenolic lignin model compounds. Wood Chemistry and Technology 17 (1): 73-90.
Brand W, Cuvelier ME, Reset C. 1995. Use a free radical method to evaluate antioxidant activity. Lebensm Wiss Technology. 28(1): 25-30.
Brongers MPH, Mierzwa AJ. 2005. Pulp and paper. [terhubung berkala].http://www. corosioncost.com/pdf/pulppaper.pdf. [23 Nov 2009].
Choe SY, Yang KH. 1983. Effect of butylated hydroxytoluene (BHT) and butylated hydroxyanisole (BHA) on carbon tetrachloride and TCDD hepatotoxicity. Korean Biochemistry 16 (4): 315-321.
Defrizal W. 2009. Pemanenan kelapa sawit. [terhubung berkala]. http//mamaks-16.blogspot.com/2009/03/kegiatan-maga ng-d-pt-smart-tbk.html. [20 Apr 2009]. [Ditjen Perkebunan]. 2008. Pendataan
kelapa sawit tahun 2008 secara komprehensif dan objektif. [terhubung berkala]. http://ditjenbun.deptan.go.id/se kretbun/sekret/index.php?option=com_c ontent&task=view&id=171&Itemid=26. [24 Feb 2009].
Dizhbite T, Telysheva G, Jurkjane V, Viesturs U. 2004. Characterization of the Radical Scavenging Activity of Lignins-Natural Antioxidants. Bioresource Technology 95:309-317.
Fengel D, Wegener G. 1995. Kayu: Kimia, Ultrastruktur, Reaksi-Reaksi. Sastrohamidjojo H, penerjemah; Yogyakarta: UGM Pr. Terjemahan dari:
Wood: Chemical, Ultrastructure, Reactions.
Goldschmid O. 1957. Determination of phenolic hydroxyl content of lignin
preparations by ultraviolet
spectrophotometry. Analitycal Chemistry
26: 1421-1423.
Gregorova A, Košikovà B, Staško A. 2007. Radical scavenging capacity of lignin and its effect on processing stabilization of virgin and recycled polypropylene.
Applied Polymer Science 106: 1626-1631.
Heradewi. 2007. Isolasi lignin dari lindi hitam proses pemasakan organosolv serat
tandan kosong kelapa sawit (TKKS) [Skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Ismiyati. 2009. Perancangan proses sulfonasi
lignin isolat tandan kosong kelapa sawit menjadi surfaktan natrium lignosulfonat (NLS) [Disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor. Kim H, Hill MK, Fricke AL. 1987.
Preparation of kraft lignin from black liquor. TAPPI J/ 12:112-115.
Lin SY, Dence CW. 1992. Methods in Lignin Chemistry. New York: State University of New York College of Enviromental Science and Foresty Syracuse.
McDonough TJ. 1992. The Chemistry of Organosolv Delignification. Georgia: Institute of Paper and Science Technology.
Nada AM, Sakhawi ME, Kamel SM. 1998. Infra-red spectroscopic study of lignin.
Polymer Degradation Stability 60:247-251.
Pan X, Kadla JF, Ehara K, Gilkes N, Saddler JN. 2006. Organosolv lignin from hybrid poplar as a radical scavenger: relationship between lignin structure, extraction conditions, and antioxidant activity. J Agricultural Food Chemistry
54: 5806-5813.
Percival M. 1998. Antioxidants. [terhubung berkala]. http://acudoc.com/Antioxidan ts.PDF. [29 Okt 2009].
Rostika I, Bastian T, Yuliani E, Elut D. 1995. Upaya peningkatan kualitas pulp organosolv. Berita Selulosa 31 (3):
15-18.
Santoso A. 1995. Pencirian isolat lignin dan upaya menjadikannya sebagai bahan
perekat kayu lapis [Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Schroeter MC. 1991. Possible lignin reaction in the organocell pulping process. TAPPI J/ 74 (10): 197-200.
Silverstein RM, Bassler GC, Morril TC. 1981. Penyidikan Spektrometrik Senyawa Organik. Hartomo AJ, Purba AV, penerjemah; Jakarta: Erlangga. Terjemahan dari: Spectrometric Identification of Organic Compounds.
Siswanto. 2006. Potensi dan kendala pemanfaatan limbah industri kelapa sawit untuk sumber energi hayati. Di dalam: Energi Hayati Sebagai Solusi Krisis Energi: Peluang dan Tantangannya di Indonesia. Prosiding Seminar Nasional; Surakarta, 8 Apr 2006. Surakarta: Pertamina. hlm 20-23. Sjostrom E. 1995. Kimia Kayu: Dasar-dasar
Penggunaan. Sastrohamidjojo H, penerjemah; Yogyakarta: UGM Pr. Terjemahan dari: Wood Chemistry: Fundamentals and Applications.
Sun RC, Fang JM, Tomkinson J, Bolton J. 1999. Physicochemical and structural characterization of alkali soluble lignin from oil palm trunk and empty fruit-bunch fibers. J Agricultural Food Chemistry 47: 2930-2936.
[TAPPI] Technical Association of the Pulp and Paper Industry. 1974. Lignin Content of Pulp and Paper. T 222 05-74.
Vinardell MP, Ugartondo V, Mijans M. 2008. Potential applications of antioxidant lignins from different sources. Industrial crops and products
27: 220-223.
Lampiran 1 Diagram alir penelitian
TKKS
Dibersihkan dari kulit buah sawit, diuraikan menjadi
bentuk serat
Serat TKKS
Dikeringkan 1 minggu pada sinar matahari lau dipotong menjadi
ukuran ± 30 mm
Serat TKKS kering
Pemasakan organosolv dalam digester dengan komposisi larutan
pemasak etanol teknis 95%:air (1:1), NaOH 10%, suhu maksimum
170
°C
Lindi hitam
Serpihan pulp
Penyaringan dengan kain nilon
20 m
Pencucian dengan aseton
teknis 95% lalu dengan air
Lindi hitam TKKS
Cairan sisa pencucian
Lanjutan Lampiran 1
Dititrasi dengan H
2SO
420% sampai pH 2 lalu didiamkan selama 8 jam
Filtrat (lindi hitam)
Endapan lignin
Dipisahkan dengan sentrifuse dengan
kecepatan12000 rpm selama 20 menit
Dilarutkan dalam NaOH 1
Dititrasi kembali dengan H
2SO
420% sampai
pH 2 lalu didiamkan selama 8 jam
Disaring dengan penyaring vakum
menggunakan H
2SO
40,01 N lalu dengan air
suling
Endapan lignin
Filtrat (lindi hitam)
Dikeringkan dalam oven selama 24 jam
pada suhu 50
°C
Tepung lignin
Lindi hitam TKKS
Lanjutan Lampiran 1
Tepung lignin
Pencirian lignin
Uji aktivitas antioksidan
Lignin
BHT
Konsentrasi radikal DPPH pada 0 dan 16 menit
diukur pada 515 nm
Persentase inhibisi diplot sebgai fungsi
konsentrasi lalu dihitung nilai IC50
Lampiran 2 Pencirian lindi hitam
1.
Uji warna, bau, pH
Lindi hitam dilihat warna dan dicium baunya serta ditentukan pH nya
menggunakan pH meter.
2.
Uji kadar air (ASTM D2016-62T)
Cawan porselen dikeringkan pada suhu 105 °C. Setelah didinginkan
dalam eksikator kemudian ditimbang. Sebanyak 2 gram sampel lindi hitam
dimasukkan dalam cawan, dan dikeringkan pada temperatur 105 °C. Setelah 3
jam, sampel diambil lalu didinginkan dalam eksikator, dan ditimbang. Hal
tersebut dilakukan beberapa kali hingga diperoleh bobot konstan.
%
100
a
b
-a
air
Kadar
=
×
Keterangan:
a = bobot sampel sebelum pemanasan (gram)
b = bobot sampel sesudah pemanasan (gram)
3.
Uji kadar padatan total
air
kadar
-1
tal
padatan to
Kadar
=
Lampiran 3 Tipe struktur fenolik lignin (Lin & Dence (1992))
Tipe 1 Struktur dengan sisi cincin jenuh
Tipe 2 Struktur ikatan ganda dua
terkonjugasi
Tipe 3 Struktur
α
-karbonil
Tipe 4 Struktur
p,p
-stilbena
Tipe 5 Struktur
o,p
-stilbena
Tipe 6 Struktur bifenil
CH2OH
CH
CH3
OCH3
OH CH2OH
CH2 O
CH2OH
OH
OCH3
OCH3
OH
H3CO
CH
OCH3
CH OH
OH
H3CO
CH CH
OH OCH3
CH2OH
OH
CH2OH
OH OCH3
CH3O
CH2OH
CH
C O
O
H3CO
OH
OCH3
Lampiran 4 Data pencirian lindi hitam organosolv
1.
pH
Ulangan 1 = 11.04
Ulangan 2 = 11.03
Ulangan 3 = 11.02
Rerata pH lindi hitam = 11.03
2. Kadar air
- Ulangan 1
Kadar air = a – b x 100%
a
Kadar air
=
(19.7374 gram – 17.7550 gram)-(17.8036 gram – 17.7550 gram)x 100%
(19.7374 gram – 17.7550 gram)
= 97.55%
- Ulangan 2
Kadar air
=
(20.4049 gram – 18.4221 gram)-(18.4706 gram – 18.4221 gram)x 100%
(20.4049 gram – 18.4221 gram)
= 97.55%
- Ulangan 3
Kadar air
=
(19.9087 gram – 17.8858 gram)-(17.9347 gram – 17.8858 gram)x 100%
(19.9087 gram – 17.8858 gram)
= 97.58%
▪
Rerata kadar air = 97.55% + 97.55% + 97.58%
3
= 97.56%
3. Kadar padatan total
- Kadar padatan total ulangan 1
= 100% - kadar air ulangan 1
= 100% - 97.55%
= 2.45%
- Kadar padatan total ulangan 2
= 100% - kadar air ulangan 2
= 100% - 97.55%
= 2.45%
- Kadar padatan total ulangan 3
= 100% - kadar air ulangan 3
= 100% - 97.58%
= 2.42%
▪
Rerata kadar padatan total
= 2.45%+ 2.45%+ 2.42%%
3
= 2.44%
Lampiran 5 Data ciri-ciri lignin
1.
Rendemen lignin
Rendemen
= bobot lignin x 100%
bobot serat TKKS
= 22.7314 gram x 100 %
250 gram
= 9.09 %
2.
Kadar lignin
1. Lignin Klason ulangan 1
Bobot lignin awal
= 1.0014 gram
Bobot kertas saring
= 0.7640 gram
Bobot lignin hasil klason (setelah konstan)
= 1.5265 gram
Kadar lignin = B (bobot konstan) x 100 %
A (bobot awal)
= 1.5265 gram – 0.7640 gram x 100 %
1.0014 gram
= 76.14 %
2. Lignin Klason ulangan 2
Bobot lignin awal
= 2.0005 gram
Bobot kertas saring
= 0.7932 gram
Bobot cawan petri
= 32.9104 gram
Bobot lignin hasil klason (setelah konstan)
= 35.2437 gram
Kadar lignin = B (bobot konstan) x 100 %
A (bobot awal)
= 35.2437 gram – 32.9104 gram – 0.7932 gram x 100 %
2.0005 gram
= 76.99 %
▪
Rerata kadar lignin = 76.14 % + 76.99 %
2
= 76.57 %
Lanjutan Lampiran 5
3.
Kadar hidroksifenolik
-
Ulangan 1
Spektrum lignin organosolv TKKS ulangan 1.
Penentuan absorbans maksimum lignin ulangan 1.
λ
(nm)
serapan
λ
(nm)
Serapan
λ
(nm)
serapan
307.7
0.166
341.3
0.141
359.9
0.149
309.6
0.159
342.6
0.147
361.1
0.147
312.7
0.156
343.6
0.146
362
0.148
317
0.147
345.2
0.148
362.9
0.148
321.2
0.145
347.6
0.149
366.4
0.143
322.4
0.144
351.4
0.151
369.4
0.14
329.8
0.135
352.6
0.152
372
0.135
333
0.139
354.2
0.15
373.8
0.133
335.2
0.137
355.2
0.15
374.5
0.131
336.3
0.139
357.5
0.15
339.7
0.137
359.1
0.15
Tipe 2: OH fenolik (pada 333 nm)
= a
maxx 17 x 100%
4100
a
maxL
g
cm
/
15
,
0
1
1
139
,
0
×
1×
=
−1 1
9267
,
0
− −=
Lg
cm
OH fenolik (%)
= 0,9267 L g
-1cm
-1x 1 Eq cm L
-1x 17 g x 100 %
4100
1 Eq
= 0.38 %
Lanjutan Lampiran 5
Tipe 3: OH fenolik (pada 352,6 nm)
= a
maxx 17 x 100%
4100
∆
a
maxL
g
cm
/
15
,
0
1
1
152
,
0
×
1×
=
−1 1
1013
,
1
− −=
Lg
cm
OH fenolik (%)
= 1,1013 L g
-1cm
-1x 1 Eq cm L
-1x 17 g x 100 %
4100
1 Eq
= 0.42 %
-
Ulangan 2
Spektrum lignin organosolv dari TKKS ulangan 2.
Penentuan absorbans maksimum lignin ulangan 2.
λ
(nm)
serapan
λ
(nm)
serapan
λ
(nm)
serapan
300.1
0.238
334.3
0.167
366.3
0.154
304.8
0.218
335.2
0.163
369.8
0.149
305.7
0.219
338.6
0.164
372.8
0.143
307.8
0.211
341.2
0.165
374.9
0.139
310.6
0.199
342.3
0.166
377.5
0.137
316.2
0.184
343.9
0.167
379.3
0.134
317.8
0.184
345
0.166
380.1
0.131
319.4
0.18
346.1
0.165
384.8
0.129
322.6
0.171
348.8
0.166
395.2
0.088
324
0.171
352.9
0.165
326.5
0.169
356.2
0.162
327.9
0.168
358.3
0.164
329
0.166
359.4
0.163
330.9
0.166
363.1
0.16
333
0.171
364.7
0.158
Lanjutan Lampiran 5
Tipe 2: OH fenolik (pada 333 nm)
= a
maxx 17 x 100%
4100
∆
a
maxL
g
cm
/
15
,
0
1
1
171
,
0
×
1×
=
−1 1
1400
,
1
− −=
Lg
cm
OH fenolik (%)
= 1,1400 L g
-1cm
-1x 1 Eq cm L
-1x 17 g x 100 %
4100
1 Eq
= 0.47 %
Tipe 3: OH fenolik (pada 358,3 nm)
= a
maxx 17 x 100%
4100
∆
a
maxL
g
cm
/
15
,
0
1
1
164
,
0
×
1×
=
−1 1
0933
,
1
− −=
Lg
cm
OH fenolik (%)
= 1,0933 L g
-1cm
-1x 1 Eq cm L
-1x 17 g x 100 %
4100
1 Eq
= 0.45 %
▪
Rerata kadar OH fenolik tipe 2 = 0,38 % + 0,47%
2
= 0,43 %
▪
Rerata kadar OH fenolik tipe 3 = 0,42 % + 0,45%
2
= 0,44 %
4.
Bobot molekul
Standardisasi NaOH dengan asam oksalat.
Ulangan
Volume
(ml)
Normalitas
awal
akhir
terpakai
NaOH
1
13,7
23,1
9,4
0,1064
2
23,1
32,5
9,4
0,1064
3
32,5
41,9
9,4
0,1064
Rerata
0.1064
Penentuan bobot molekul lignin.
Ulangan
Bobot
Volume
(ml)
BE
BM
contoh
(gram)
Awal
Akhir
Terpakai lignin(g/ekiv)
lignin
(g/mol)
1
0,5008
2,60
4,95
2,35
2002,88
4005
2
0,5005
4,95
7,30
2,35
2001,68
4003
3
0,5010
7,65
10,00
2,35
2003,68
4007
Rerata
4005
Lanjutan Lampiran 5
Contoh perhitungan
BE ulangan 1 = 1000 x 0,5008 gram
2,35 ml x 0,1064 N
= 2002,88 g/ekiv
BM lignin
= 2 x BE lignin
= 2 x 2002,880 g/ekiv
= 4005 g/mol
Lampiran 6 Penentuan panjang gelombang maksimum DPPH
Penentuan panjang gelombang maksimum DPPH.
Lampiran 7 Uji antioksidan lignin
Penentuan nilai IC
50lignin ulangan 1.
Konsentrasi
Absorbans
Absorbans
Absorbans
% IP
ln [lignin]
lignin (ppm)
DPPH
(lignin + DPPH)
lignin
200
0.619
0.222
0.266
74.92
5.2983
150
0.619
0.238
0.186
70.43
5.0106
100
0.619
0.279
0.122
62.35
4.6052
50
0.619
0.347
0.062
49.05
3.9120
25
0.619
0.397
0.026
38.45
3.2189
Kurva penentuan nilai IC
50lignin ulangan 1.
Perhitungan nilai IC
50y
= 17,89x – 19,87
50 %
= 17,89x – 19,87
x
= 3,9055 = ln (x)
Anti ln (x)
= 49,68 ppm
Lanjutan Lampiran 7
Penentuan nilai IC
50lignin ulangan 2.
Konsentrasi Absorbans
Absorbans
Absorbans
% IP
ln [lignin]
lignin (ppm)
DPPH
(lignin + DPPH)
lignin
200
0.619
0.202
0.224
76.04
5.2983
150
0.619
0.222
0.174
72.01
5.0106
100
0.619
0.276
0.114
62.35
4.6052
50
0.619
0.344
0.071
50.14
3.9120
25
0.619
0.410
0.023
36.14
3.2189
Kurva penentuan nilai IC
50lignin ulangan 2.
Perhitungan nilai IC
50y
= 19,35x – 25,98
50 %
= 19,35x – 25,98
x
= 3,9266 = ln (x)
Anti ln (x)
= 50,73 ppm
▪
Rerata nilai IC
50lignin = 49,68 ppm + 50,73 ppm
2
= 50,2 ppm
Lampiran 8 Uji antioksidan BHT
Penentuan nilai IC
50BHT ulangan 1.
Konsentrasi
Absorbans
Absorbans
% IP
ln [BHT]
BHT
DPPH
(BHT + DPPH)
5000
0.619
0.204
67.03
8.5172
4000
0.619
0.241
61.08
8.2940
3000
0.619
0.274
55.68
8.0064
2000
0.619
0.316
48.92
7.6009
1000
0.619
0.36
41.89
6.9078
Kurva penentuan nilai IC
50BHT ulangan 1.
Perhitungan nilai IC
50y
= 15,29x – 65,36
50 %
= 15,29x – 65,36
x
= 7,5448 = ln (x)
Anti ln (x)
= 1891 ppm
Lanjutan Lampiran 8
Penentuan nilai IC
50BHT ulangan 2.
Konsentrasi
Absorbans
Absorbans
% IP
ln [BHT]
BHT
DPPH
(BHT + DPPH)
5000
0.619
0.199
67.84
8.5172
4000
0.619
0.238
61.62
8.2940
3000
0.619
0.269
56.49
8.0064
2000
0.619
0.321
48.11
7.6009
1000
0.619
0.358
42.16
6.9078
Kurva penentuan nilai IC
50BHT ulangan 2.
Perhitungan nilai IC
50y
= 15,80x – 69,07
50 %
= 15,80x – 69,07
x
= 7,5361 = ln (x)
Anti ln (x)
= 1874 ppm
▪
Rerata nilai IC
50lignin = 1891 ppm + 1874 ppm
2
= 1883 ppm