SKRIPSI
KANDUNGAN ANTIOKSIDAN EKSTRAK TEPUNG KULIT BUAH
MANGGIS (GARCINIA MANGOSTANA L.) PADA BERBAGAI PELARUT,
SUHU, DAN WAKTU EKSTRAKSI
Oleh :
LEONARDUS ADI WIJAYA
F24051029
2010
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
KANDUNGAN ANTIOKSIDAN EKSTRAK TEPUNG KULIT BUAH
MANGGIS (GARCINIA MANGOSTANA L.) PADA BERBAGAI PELARUT,
SUHU, DAN WAKTU EKSTRAKSI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
LEONARDUS ADI WIJAYA
F24051029
2010
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Kandungan Antioksidan Ekstrak Tepung Kulit Buah
Manggis (Garcinia mangostana L.) Pada Berbagai Pelarut, Suhu, dan Waktu Ekstraksi
Nama : Leonardus Adi Wijaya NIM : F24051029
Menyetujui
Pembimbing Utama Pembimbing Anggota
Dr. Ir. Harsi D. Kusumaningrum MSc. Ir. Siti Mariana Widayanti M.Si. NIP. 19640502.199303.2.004 NIP. 19680129.199403.2.001
Mengetahui, Ketua Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian IPB
Dr. Ir. Dahrul Syah NIP. 19650814.199002.1.001
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 18 November 1987 sebagai anak kedua dari tiga bersaudara dari pasangan Yosef Iin Hindaryono dan Paulina Harum Djene. Pendidikan formal ditempuh penulis di TK Angela Bunda Jakarta, SD Katolik Abdi Siswa Jakarta, SLTP Katolik Abdi Siswa Jakarta, SLTA Katolik Sang Timur Jakarta. Penulis diterima sebagai mahasiswi Institut Pertanian Bogor pada tahun 2005 melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) pada Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Selama masa studi di IPB, penulis aktif dalam berbagai kegiatan maupun organisasi. Beberapa diantaranya, penulis sempat menjadi anggota Food Processing Club divisi fermented food tahun 2006 dan menjadi ketua divisi ice cream tahun 2007. Penulis juga aktif dalam organisasi Keluarga Mahasiswa Katolik IPB (KEMAKI) dan sempat menjadi ketua divisi pendidikan dan up-grading tahun 2006.
Leonardus Adi Wijaya. F24051029. Kandungan Antioksidan Ekstrak Tepung Kulit Buah Manggis (Garcinia mangostana L.) Pada Berbagai Pelarut, Suhu, dan Waktu Ekstraksi. Di bawah bimbingan Harsi D. Kusumaningrum dan Siti Mariana Widayanti. 2010.
RINGKASAN
Manggis (Garcinia mangostana L.) merupakan salah satu buah tropika unggulan nasional Indonesia dan menjadi primadona penghasil devisa negara. Data tahun 2006 menunjukkan bahwa hanya 5.697 ton manggis dari jumlah total produksi 72.634 ton yang dapat diekspor. Sisanya, sebagian besar dipasarkan di dalam negri dan banyak yang terbuang karena penanganan yang kurang baik. Hal ini sangat disayangkan, mengingat begitu besar manfaat yang dapat diperoleh dari buah manggis terutama kulitnya. Berdasarkan penelitian fitokimia, kulit buah manggis (KBM) mengandung senyawa antioksidan golongan fenolik. Senyawa-senyawa fenolik tersebut antara lain xanthone, antosianin, tanin, dan epikatekin.
Melihat potensi antioksidan yang begitu besar pada KBM maka diperlukan penelitian lebih lanjut untuk memanfaatkannya sebagai minuman fungsional. Penelitian ini mempelajari kandungan antioksidan ekstrak KBM (Garcinia mangostana L.) menggunakan lima jenis pelarut (air, etanol 96 %, etanol 70 %, easeton 72 %, dan aseton 90 %) dengan empat perlakuan suhu yaitu suhu ruang, 40oC, 60oC, dan 80oC serta tiga perlakuan waktu ekstraksi yaitu 2 jam, 4 jam, dan 6 jam. Metode ekstraksi yang digunakan pada penelitian kali ini adalah metode maserasi. Selain itu, untuk mencegah proses browning enzimatis pada tahap persiapan bahan dilakukan perendaman menggunakan air, larutan asam asetat 0,3 %, dan larutan metabisulfit 0,3 %.
Bahan perendam terbaik untuk mencegah proses browning enzimatis adalah air. Proses perendaman menggunakan air menunjukkan warna tepung KBM yang lebih merah dibandingkan dengan kedua bahan perendam lainnya yaitu asam asetat 0,3 % dan metabisulfit 0,3 %. Ekstrak dengan pelarut aseton 72 % diketahui memiliki kapasitas antioksidan terbesar yaitu 89,31 % diikuti oleh ekstrak dengan pelarut etanol 70 % (86,63 %) dan ekstrak dengan pelarut air (86,29 %). Secara keseluruhan, kapasitas antioksidan seluruh ekstrak dengan berbagai pelarut memiliki kapasitas antioksidan yang lebih besar dari kapasitas antioksidan vitamin C 800 ppm yang hanya sebesar 79,26 %.
Pelarut air memiliki kemampuan untuk mengekstrak total senyawa fenolik paling besar bila dibandingkan ke empat pelarut lainnya yaitu sebesar 154,57 mg katekin/g tepung KBM. Hal serupa nampak pada kemampuan pelarut air dalam mengekstrak senyawa antosianin yaitu sebesar 6,22 mg antosianin/g tepung KBM, terbesar diantara pelarut lainnya. Namun demikian, pelarut air bukanlah pelarut yang baik untuk mengekstrak komponen xanthone. Pelarut aseton 90 % merupakan pelarut terbaik untuk mengekstrak komponen xanthone (78,5β mg α mangostin/g ekstrak).
yang mudah didapat serta ekonomis menjadi salah satu alasan dipilihnya pelarut air pada tahap penelitian utama. Selain itu, ekstrak dengan pelarut air memiliki total senyawa fenolik terbesar dan kapasitas antioksidan terbesar ke tiga.
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yesus Kristus atas berkat, anugerah, dan penyertaan-Nya serta kekuatan-Nya sehingga penulis dapat menyelesaikan skripsi ini. Terima kasih atas setiap pelajaran-pelajaran berharga yang dialami penulis selama penulisan tugas akhir. Tugas akhir ini dapat terselesaikan dengan baik bukan karena karena kasih dan anugerah dari Tuhan Yesus. Selain itu, banyak pihak yang juga turut membantu penulis dalam kegiatan penelitian maupun penulisan skripsi. Oleh karena itu, dalam kesempatan ini penulis mengucapkan terima kasih yang mendalam kepada :
1. Keluargaku : Ayah (Yosef Iin Hindaryono), Ibu (Paulina), serta adikku (Putra) atas cinta kasihnya, semangatnya, doanya, bimbingannya, serta dukungannya kepada penulis sehingga penulis mampu menyelesaikan semuanya.
2. Dr. Ir. Harsi D. Kusumaningrum MSc. dan Ir. Siti Mariana Widayanti M.Si. selaku dosen pembimbing akademik dan dosen pembimbing skirpsi yang banyak memberikan dukungan, arahan, dan bimbingan selama penulis menjalani pendidikan dan melakukan tugas akhir.
3. Dr. Ir. Endang Prangdimurti sebagai dosen penguji yang telah menyempatkan waktunya untuk datang dan menguji hasil penelitian ini. 4. Bapak Asep W. Permana STP MSi. atas bimbingannya dan bantuannya
selama penulis melakukan penelitian dan pembuatan skripsi.
5. Sahabat-sahabat terbaikku : Glenn, Antony, Stefanus, Yusi, Arya, atas dukungan, dan bantuan di saat susah maupun senang.
6. Teman-teman di Lab : Marcel, Tuti, Ari, Nanda, Cece, Yuni, Ester, Caca, Dina, dan lainnya atas canda tawanya dan lemburnya di lab.
7. Teman-teman ITP 42 atas kegembiraan di saat kuliah dan praktikum. 8. Teman-teman ITP 43 dan anak-anak praktikum ENG Gol P2.
10.Seluruh staff dan laboran di Lab Departemen ITP dan Pilot Plant : Pak Rojak, Pak Wahid, Pak Gatot, Pak Sobirin, Pak Sidik, Pak Adi, Bu Antin, Pak Yahya, Mas Edi, Teh Ida, Pak Nur, dan Pak Iyas. Terimakasih atas semua bantuan yang telah diberikan.
11.Staff dan teknisi Laboratorium Balai Besar Pasca Panen : Teh Ika, Ibu Ning, Mas Tri, Mas Yudi, Pak Danu, Pak Bambang, Pak Heru, Pak Atok, Mbak Citra, Ibu Dini, Ibu Meli, Ibu Tisna, dan Mbak Dewi. Terima kasih atas bantuannya.
12.Dosen IPB dan ITP-FATETA periode 2004-2008, setiap individu dan institusi yang tidak dapat disebutkan satu persatu, atas segala pengajaran pendidikan, serta bantuan yang telah diberikan kepada penulis.
Penulis menyadari bahwa masih banyak kekurangan dalam pelaksanaan penelitian dan penyusunan skripsi ini. Oleh karena itu, kritik dan saran yang membangun sangat diharapkan. Penulis berharap agar skripsi ini dapat bermanfaat bagi berbagai pihak dengan berbagai cara.
Bogor, November 2009
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... ix
I. PENDAHULUAN ... 1
A. LATAR BELAKANG………... 1
B. TUJUAN DAN MANFAAT ... 2
II. TINJAUAN PUSTAKA………. 3
A. BUAH MANGGIS (Garcinia mangostana L.) ... 3
B. PEMANFAATAN KULIT BUAH MANGGIS (KBM) ... 5
C. METODE EKSTRAKSI DAN PENGUKURAN ANTIOKSIDAN . 6
D. REAKSI BROWNING DAN PENCEGAHANNYA ... 8
E. ANTIOKSIDAN PADA KULIT BUAH MANGGIS ... 11
a. Antosianin ... 12
b. Xanthone ... 13
c. Tannin ... 14
III.METODOLOGI PENELITIAN... 16
A. ALAT DAN BAHAN ... 16
B. METODE PENELITIAN ... 16
1. Penelitian Pendahuluan ... 17
2. Persiapan Sampel ... 18
Halaman
C. METODE ANALISIS ... 22
1. Analisis Kadar Air... 22
2. Analisis Total Padatan Terlarut ... 23
3. Analisis Kadar Abu ... 23
4. Analisis Kadar Protein ... 24
5 Analisis Kadar Lemak ... 25
6. Analisis Kadar Karbohidtat ... 25
7. Analisis Total Gula ... 26
8. Analisis Warna Menggunakan Chromameter ... 26
9. Analisis Kapasitas Antioksidan ... 28
10. Analisis Total Senyawa Fenolik... 29
11. Analisis Kadar Antosianin ... 30
12. Analisis Total Xanthone (a) ... 30
13. Analisis Total Xanthone (b) ... 31
C. RANCANGAN PERCOBAAN ... 32
IV. HASIL DAN PEMBAHASAN………....…. 34
A. PENELITIAN PENDAHULUAN ... 34
1. Karakterisrik Buah Manggis Yang Digunakan ... 34
2. Jenis Bahan Perendam Pencegah Browning ... 36
3. Pelarut Ekstraksi... 38
B. PENELITIAN UTAMA ... 44
1. Total Padatan Ekstrak... 44
2. Kapasitas Antioksidan... 46
3. Total Senyawa Fenolik ... 49
4. Total Antosianin ... 52
Halaman
V. KESIMPULAN DAN SARAN………..…….. 59
A. KESIMPULAN... 59
B. SARAN... 60
DAFTAR PUSTAKA ... 61
DAFTAR TABEL
Halaman
DAFTAR GAMBAR
Halaman
Gambar 1. Buah Manggis (Garcinia mangostana L.) ... 3
Gambar 2. Reaksi Antara dalam Pembentukan Melanin ... 10
Gambar 3. Reaksi Pembentukan Melanin dari O-Kuinon atau O-Difenol 11 Gambar 4. Struktur Jenis-Jenis Turunan Xanthone... 13
Gambar 5. Struktur Kimia Antosianidin ... 14
Gambar 6. Bagan Alir Garis Besar Penelitian Pendahuluan ... 17
Gambar 7. Proses Persiapan Sampel Tepung KBM... 18
Gambar 8. Bagan Alir Garis Besar Penelitian Utama ... 19
Gambar 9. Proses Ekstraksi Tepung KBM Tahap Ekstraksi dan Reduksi Tannin yang Berlebih ... 20
Gambar 10. Proses Ekstraksi Tepung KBM Tahap Penghilanggan Gum Dan Tahap Evaporasi ……….…. ... 21
Gambar 11. Bola Imaginer Munsell ... 27
Gambar 12. Tingkat Kematangan Buah Manggis Yang Digunakan... 34
Gambar 13. Kapasitas Antioksidan Ekstrak Tepung KBM Pada Berbagai Pelarut Dengan Metode DPPH... 39
Gambar 14. Total Senyawa Fenolik Ekstrak Tepung KBM Pada Berbagai Pelarut... 39
Gambar 15. Kurva Standar Katekin Pada Analisis Total Senyawa Fenolik 40 Gambar 16. Total Antosianin Ekstrak Tepung KBM Pada Berbagai Pelarut... 40
Gambar 17. Total Xanthone Ekstrak Tepung KBM Pada Berbagai Pelarut 40 Gambar 18. Total Padatan Ekstrak Tepung KBM Pada Berbagai Perlakuan Suhu dan Waktu Ekstraksi Menggunakan Pelarut Air... 45
Gambar 19. Kapasitas Antioksidan Ekstrak Tepung KBM Pada Berbagai Perlakuan Suhu dan Waktu Ekstraksi Menggunakan Pelarut Air (Persen)... 47
Halaman
Gambar 21. Kapasitas Antioksidan Ekstrak Tepung KBM Pada Berbagai Perlakuan Suhu dan Waktu Ekstraksi Menggunakan Pelarut Air (AEAC)... 48 Gambar 22. Kurva Standar Asam Galat ... 49 Gambar 23. Total Senyawa Fenolik Ekstrak Tepung KBM Pada Berbagai
Perlakuan Suhu dan Waktu Ekstraksi Menggunakan Pelarut Air... 50 Gambar 24. Total Antosianin Ekstrak Tepung KBM Pada Berbagai
Perlakuan Suhu danWaktu Ekstraksi Menggunakan Pelarut Air... 53 Gambar 25. Jalur Degradasi Senyawa Antosianin Cyanodin-3-Glukoside Akibat Proses Termal Pada Kondisi Asam ... 55 Gambar 26. Hasil Scanning Panjang Glombang Maksimum α mangostin.. 56 Gambar 27. Total Xanthone Ekstrak Tepung KBM Pada Berbagai Perlakuan
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Analisis Proksimat dan Gula KBM Segar... . 68
Lampiran 2. Hasil Analisis Proksimat dan Gula Tepung KBM ... 68
Lampiran 3. Hasil Analisis Warna Chromameter Terhadap Penggunaan Berbagai Jenis Bahan Perendam Pada Tepung KBM ... 68
Lampiran 4. Hasil Analisis Proksimat dan Gula KBM Segar ... 69
Lampiran 5. Hasil Analisis Proksimat dan Gula Tepung KBM ... 69
Lampiran 6. Hasil Analisis Kapasitas Antioksidan pada Percobaan Penentuan Pelarut ... 70
Lampiran 7. Hasil Analisis Total Senyawa Fenolik pada Percobaan Penentuan Pelarut ... 71
Lampiran 8. Kurva Standar Katekin Analisis Total Senyawa Fenolik pada Percobaan Penentuan Pelarut... 71
Lampiran 9. Hasil Analisis Total Antosianin pada Percobaan Penentuan Pelarut ... 72
Lampiran 10. Hasil Analisis Total Xanthone pada Percobaan Penentuan Pelarut ... 73
Lampiran 11a. Hasil Analisis Total Padatan Ekstrak ... 74
Lampiran 11b. Lanjutan Hasil Analisis Total Padatan Ekstrak ... 75
Lampiran 12a. Hasil Analisis Kapasitas Antioksidan Ekstrak I ... 76
Lampiran 12b. Lanjutan Hasil Analisis Kapasitas Antioksidan Ekstrak I .... 77
Lampiran 12c. Lanjutan Hasil Analisis Kapasitas Antioksidan Ekstrak I .... 78
Lampiran 13. Kurva Standar Asam Askorbat Analisis Kapasitas Antioksidan Ekstrak ... 79
Lampiran 14a. Hasil Analisis Kapasitas Antioksidan Ekstrak II ... 80
Lampiran 14b. Lanjutan Hasil Analisis Kapasitas Antioksidan Ekstrak II ... 81
Lampiran 14c. Lanjutan Hasil Analisis Kapasitas Antioksidan Ekstrak II ... 82
Lampiran 15a. Hasil Analisis Total Senyawa Fenolik Ekstrak ... 83
Halaman
Lampiran 15c. Lanjutan Hasil Analisis Total Senyawa Fenolik Ekstrak ... 85
Lampiran 16. Kurva Standar Asam Galat Analisis Total Senyawa Fenolik Ekstrak ... 86
Lampiran 17a. Hasil Analisis Total Antosianin Ekstrak ... 87
Lampiran 17b. Lanjutan Hasil Analisis Total Antosianin Ekstrak ... 88
Lampiran 17c. Lanjutan Hasil Analisis Total Antosianin Ekstrak ... 89
Lampiran 18a. Hasil Analisis Total Xanthone Ekstrak ... 90
Lampiran 18b. Lanjutan Hasil Analisis Total Xanthone Ekstrak ... 91
Lampiran 18c. Lanjutan Hasil Analisis Total Xanthone Ekstrak ... 92
Lampiran 19. Kurva Standar α Mangostin Analisis Total Xanthone Ekstrak... 93
Lampiran 20. Hasil Scanning Panjang Gelombang Maksimum α Mangostin... 94
Lampiran 21. Hasil Analisis Statistik ANOVA Duncan Pada Berbagai Analisis Percobaan Penentuan Pelarut ... 95
Lampiran 22. Hasil Analisis Statistik ANOVA Duncan Pada Analisis Total Padatan Ekstrak ... 99
Lampiran 23. Hasil Analisis Statistik ANOVA Duncan Pada Berbagai Analisis Kimia Percobaan Utama ... 101
I.
PENDAHULUAN
A. LATAR BELAKANG
Manggis (Garcinia mangostana L.) merupakan salah satu buah tropika unggulan nasional Indonesia dan menjadi primadona penghasil devisa negara. Produksi manggis tahun 2007 mencapai 112.722 ton. Namun, sebagian besar mutu buah manggis yang dihasilkan masih rendah sehingga hanya sebagian kecil saja yang dapat bersaing di pasar internasional. Data tahun 2006 menunjukkan bahwa hanya 5.697 ton dari jumlah total produksi 72.634 ton yang dapat diekspor (Anonima, 2008). Sisanya, sebagian besar dipasarkan di dalam negeri dan banyak yang terbuang begitu saja karena penanganan yang kurang baik.
Penelitian terbaru menunjukkan kulit buah manggis (KBM) memiliki banyak manfaat yang berguna bagi kesehatan manusia antara lain sebagai antioksidan, antikanker, antiinflamantory, maupun sebagai antimikroba (Obolskiy et al., 2009). Kulit buah manggis (KBM) diketahui memiliki kandungan senyawa polifenol yang cukup banyak. Beberapa diantaranya adalah antosianin, xanthone, tannin, maupun senyawa asam fenolat lainnya (Zadernowski et al., 2009). Xanthone dan turunannya merupakan salah satu senyawa antioksidan yang sangat efektif dalam mencegah terbentuknya penyakit kanker sedangkan senyawa antosianin merupakan salah satu senyawa aktif yang terbukti dapat berfungsi sebagai antioksidan di dalam tubuh.
sepat) yang cukup besar pada kulit buah manggis (KBM) mengakibatkan kurangnya penerimaan konsumen terhadap produk ini.
Salah satu alternatif cara yang dapat dilakukan untuk mengatasi masalah diatas adalah dengan menggunakan kulit buah manggis (KBM) yang telah dikeringkan sebagai bahan baku ekstraksi. Proses pengeringan kulit buah manggis (KBM) akan meningkatkan umur simpan dari bahan sehingga produksi dapat dilakukan secara kontinu. Tahapan perendaman maupun pencucian pada proses pengeringan akan melarutkan sebagian tannin sehingga diharapkan rasa sepat akan berkurang. Namun demikian, sebelum proses ini dapat digunakan dan diterapkan di dalam industri maka penelitian lebih lanjut perlu dilakukan untuk mendapatkan ekstrak kulit buah manggis (KBM) yang kaya kandungan antioksidan dan bersifat aplikatif secara komersial.
B. TUJUAN DAN MANFAAT
a. Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari proses ekstraksi tepung kulit buah manggis (Garcinia mangostana L.) sebagai penjajagan dalam pembuatan minuman fungsional. Secara khusus, penelitian ini bertujuan untuk mempelajari ekstraksi antioksidan tepung kulit buah manggis dengan menggunakan berbagai jenis pelarut dan perlakuan suhu serta perlakuan waktu pada jenis pelarut terpilih.
b.Manfaat Penelitian
II.
TINJAUAN PUSTAKA
A. BUAH MANGGIS (Garcinia mangostana L.)
Manggis termasuk buah eksotik yang sangat digemari oleh konsumen karena rasanya yang lezat, bentuk buah yang indah, dan tekstur daging buah yang putih halus. Manggis (Gambar 1) mendapat julukan Queen of tropical fruit (Ratunya Buah-buahan Tropik) karena rasanya yang unik dan lengkap.
Gambar 1. Buah Manggis (Garcinia mangostana L.)
Jika dilihat dari taksonominya, maka tanaman manggis dapat diklasifikasikan ke dalam :
Divisi : Spermatophyta Kelas : Angiospermae Sub-kelas : Dicotyledonae Ordo : Thalamiflora Famili : Guttiferales Genus : Guttiferae
Spesies : Garcinia manggostana L.
Pada umumnya masyarakat memanfaatkan tanaman manggis karena buahnya yang menyegarkan dan mengandung gula sakarosa, dekstrosa, dan levulosa. Komposisi bagian buah yang dimakan per 100 gram meliputi 79,2 gram air, 0,5 gram protein, 19,8 gram karbohidrat, 0,3 gram serat, 11 mg kalsium, 17 mg fosfor, 0,9 mg besi, 14 IU vitamin A, 66 mg vitamin C, vitamin B (tiamin) 0,09 mg, vitamin B2 (riboflavin) 0,06 mg, dan vitamin B5
(niasin) 0,1 mg. Kebanyakan buah manggis dikonsumsi dalam keadaan segar, karena olahan awetannya (manggis dalam kaleng) kurang digemari oleh masyarakat (Qosim, 2007).
Indonesia pada saat ini merupakan produsen manggis terbesar di dunia baik dari sisi produksi, luas panen maupun jumlah ekspornya. Negara pesaing utama untuk produksi dan ekspor manggis adalah Thailand, Philipina, Malaysia dan kini Australia. Negara tujuan ekspor manggis Indonesia pada tahun 2006 antara lain adalah China sebesar 63%, Hongkong sebesar 22%, Timur Tengah (Saudi Arabia, Uni Emirat Arab, Kuwait, Bahrain dan Qatar) sebesar 9%, Asia lainnya (Jepang, Korea, Singapura, Malaysia, India) sebesar 5% dan Eropa (Belanda, Prancis, Jerman, Italia, Spanyol) sebesar 1%. Dari data ekspor diatas dapat disimpulkan bahwa China merupakan negara importir manggis terbesar (Anonima, 2008).
B. PEMANFAATAN KULIT BUAH MANGGIS (KBM)
Berbagai penelitian manggis dan produk turunannya semakin berkembang dengan ditemukan berbagai senyawa aktif yang terkandung didalamnya. Perhatian para ilmuwan tertuju kepada kulit buah manggis (KBM) yang ternyata kaya akan kandungan antioksidan. Menurut Zadernowski et al., (2009) KBM memiliki kandungan senyawa polifenol yang cukup besar antara lain adalah antosianin, xanthone, tannin, maupun asam fenolat.
Senyawa xanthone pada KBM memiliki sifat antioksidan, antidiabetic, antikanker, anti-imflammatory, hepatoprotective, immuno-modulation, aromatase inhibitor, antibakteri dan sifat fungsional lainnya (Jung et al., 2006; Balunas et al., 2008). Sedangkan senyawa antosianin, banyak dimanfaatkan orang sebagai pewarna alami maupun sebagai antioksidan. Di beberapa negara Asia dan Afrika, ekstrak KBM digunakan sebagai obat tradisional untuk pengobatan diare, disentri dan infeksi (Matsumoto et al., 2003). Selain kandungan xanthone KBM mengandung Vitamin B1, Vitamin B2, Vitamin B6, Vitamin C, senyawa pektin, tanin, dan resin yang dimanfaatkan untuk menyamak kulit dan sebagai zat pewarna hitam untuk makanan dan industri tekstil, sedangkan getah kuning dimanfaatkan sebagai bahan baku cat dan insektisida (Qosim, 2007).
Metode yang saat ini mulai dikembangkan adalah metode kering yang ditambahkan proses pengeringan KBM segar menjadi KBM kering. Indonesia juga sudah mulai megekspor ekstrak KBM ke berbagai Negara antara lain Korea dan Malaysia sebagai bahan baku industri kosmetik, jus, maupun pewarna. Jumlahnya kini mencapai 100 Kg ekstrak KBM untuk ekspor ke negri jiran Malaysia (Cahyana, 2009).
C. METODE EKSTRAKSI DAN PENGUKURAN ANTIOKSIDAN
Menurut Nielsen (2003), Ekstraksi ialah suatu cara memisahkan komponen tertentu dari suatu bahan sehingga didapatkan zat yang terpisah secara kimiawi maupun fisik. Ekstraksi biasanya berkaitan dengan pemindahan zat terlarut diantara dua pelarut yang tidak saling bercampur. Proses ekstraksi bertujuan untuk mendapatkan bagian-bagian tertentu dari bahan yang mengandung komponen-komponen aktif. Teknik ekstraksi yang tepat berbeda untuk masing-masing bahan. Hal ini dipengaruhi oleh tekstur, kandungan bahan, dan jenis senyawa yang ingin didapat.
Secara umum proses ekstraksi melibatkan dua fasa yang tidak saling melarut. Suatu solut pada awalnya berada pada salah satu fasa, kemudian solut atau komponen tersebut ditransfer ke salah satu fase yang lain sehingga ekstraksi dapat berlangsung. Jenis jenis ekstraksi antara lain ekstrasksi cair-cair, padat-cair-cair, cair-padat, dan gas-padat (Deden, 2007).
dilakukan dan tidak memakan banyak biaya namun tetap efektif untuk mengekstrak komponen antioksidan pada KBM.
Pada umumnya, ekstraksi kulit buah dalam bentuk tepung menggunakan pelarut air akan menyebabkan terlarutnya senyawa polisakarida. Senyawa polisakarida yang ikut terlarut ini akan menimbulkan beberapa masalah dalam proses aplikasi maupun analisis sehingga perlu dilakukan perlakuan yang dapat mengurangi kadar senyawa tersebut. Salah satu proses yang mudah dan banyak digunakan adalah proses pengendapan senyawa polisakarida menggunakan etanol 95 %. Contoh proses ekstraksi yang menggunakan proses ini adalah proses ekstraksi senyawa antosianin pada rosella (Kristie, 2008).
Menurut Cuppet et al., (1997) antioksidan merupakan suatu senyawa yang ketika berada pada konsentrasi rendah dibandingkan dengan substrat yang dapat dioksidasi, secara nyata dapat memperlambat oksidasi substrat tersebut. Antioksidan terdapat secara alami dalam hampir semua bahan pangan. Antioksidan bereaksi dengan oksidan sehingga mengurangi kapasitas oksidan untuk menimbulkan kerusakan. Sistem antioksidan tubuh mampu melindungi jaringan tubuh itu sendiri dari efek negatif radikal bebas.
Jenis antioksidan sangat beragam. Berdasarkan mekanisme kerjanya, antioksidan digolongkan menjadi antioksidan primer dan antioksidan sekunder. Antioksidan primer atau antioksidan pemecah rantai (Chain– breaking Antioxidant) dapat bereaksi dengan radikal lemak dan mengubahnya menjadi produk yang stabil. Contoh antioksidan primer yaitu α-tokoferol, lesitin, dan asam askorbat.
Menurut Pratt dan Hudson (1999), senyawa-senyawa yang umumnya terkandung dalam antioksidan alami antara lain fenol, polifenol, dan yang paling umum adalah flavonoid (flavanol, isoflavon, flavon, katekin, flavonon), turunan asam sinamat, α-tokoferol, dan asam organik polifungsi.
Beberapa metode pengukuran aktivitas antioksidan yang dapat
digunakan antara lain metode -karoten atau linoleat, metode terkonjugasi, metode ransimat, metode DPPH, dan metode tiosianat. Pada metode pengukuran dengan DPPH free radikal scavenging activity, DPPH (1,1-diphenyl-2-piercrylhydrazil) digunakan sebagai model radikal bebas yang stabil (Hatano et al., 1988). Senyawa ini bila disimpan dalam keadaan kering dan kondisi penyimpanan yang baik akan tetap stabil selama bertahun-tahun (Larson, 1997). Jika senyawa ini masuk ke dalam tubuh manusia dan tidak terkendalikan maka dapat menyebabkan kerusakan fungsi sel. Dalam uji ini metanol berfungsi sebgai pelarut, sedangkan inkubasi pada suhu 37 oC dimaksudkan untuk mengoptimalkan aktivitas DPPH. Pada prinsipnya antioksidan akan bereaksi dengan DPPH dan mengubahnya menjadi 1,1-diphenyl-2-piercrylhydrazine. Perubahan serapan yang dihasilkan oleh reaksi ini menjadi ukuran kemampuan antioksidasi senyawa tersebut (Hatano et al., 1988)
D. REAKSI BROWNING DAN PENCEGAHANNYA
Kontak antara jaringan yang terluka atau terpotong dengan udara akan menyebabkan pencoklatan. Hal tersebut dikarenakan senyawa fenol teroksidasi secara enzimatis dengan bantuan enzim polifenol oksidase menjadi o-kuinon, yang secara cepat mengalami polimerisasi membentuk pigmen coklat atau melanin. Senyawa fenol bersifat sangat mudah terdekomposisi pada suhu biasa dan sangat sukar untuk diisolasi.
Reaksi tersebut membutuhkan oksigen sebagai akseptor H2 dan ion
tembaga sebagai katalisator (Eskin et al.,1971). Enzim yang berperan mengkatalisa oksidasi senyawa fenol adalah polifenol oksidase (Palmer, 1963). Enzim fenolase berfungsi mengkatalis reaksi oksidasi, logam tembaga berfungsi sebagai pentransfer elektron dan O2 berfungsi sebagai akseptor
elektron (Coleman, 1974 dan Schwimmer, 1981).
Tingkat reaksi pencoklatan enzimatis semakin tinggi jika konsentrasi phenolic (substrat PPO) pada buah dan sayuran tinggi dan konsentrasi asam askorbat yang rendah (Bauernfeind dan Pinkert 1970). Menurut Winarno (1992), banyak sekali senyawa fenolik yang dapat bertindak sebagai subtrat dalam reaksi pencoklatan enzimatis pada buah dan sayuran. Senyawa-senyawa fenolik tersebut di antaranya adalah katekin dan turunannya seperti tirosin, asam kafeat, asam klorogenat, dan leukoantosianin.
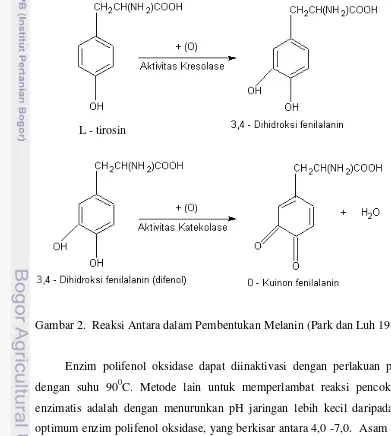
Pada umumnya reaksi oksidasi fenol dikatalisis oleh 2 enzim fenolase yaitu kresolase dan katekolase. Kresolase mengkatalisis oksidasi monofenol (tirosin dan kresol) dengan menambah gugus hidroksil pada posisi orthonya sehingga menjadi orto-difenol. Reaksi oksidasi selanjutnya, katekolase menghilangkan 2 atom hidrogen pada orto difenol membentuk orto-quinon (Park dan Luh 1985). Reaksi dalam tahap ini dapat dilihat pada Gambar 2.
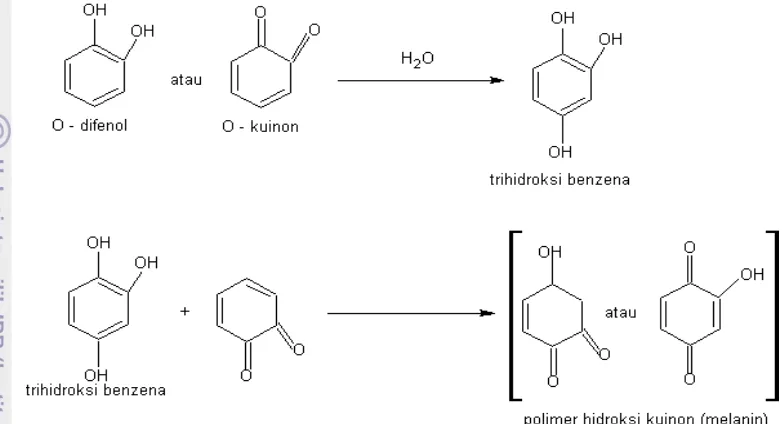
Faktor-faktor yang mempengaruhi tingkat reaksi pencoklatan enzimatis adalah kandungan komponen fenolik, aktifitas dari enzim polifenol oksidase, kehadiran oksigen, ion logam, pH, dan suhu (Lisinska and Leszczynski 1989). Reaksi pencoklatan enzimatis dapat dikontrol oleh inaktivasi enzim polifenol oksidase, pengeluaran oksigen, modifikasi komponen fenolik, penambahan agen pereduksi, interaksi dengan grup tembaga, mereduksi atau mengikat senyawa quinon, bahkan memindahkan produk akhir dari reaksi pencoklatan (Shahidi and Naczk 1995). Asam askorbat, sodium bisulfit, dan komponen thiol adalah beberapa substrat yang dapat digunakan untuk mengikat senyawa kuinon untuk mencegah terjadinya reaksi browning.
Gambar 2. Reaksi Antara dalam Pembentukan Melanin (Park dan Luh 1985)
Enzim polifenol oksidase dapat diinaktivasi dengan perlakuan panas dengan suhu 900C. Metode lain untuk memperlambat reaksi pencoklatan enzimatis adalah dengan menurunkan pH jaringan lebih kecil daripada pH optimum enzim polifenol oksidase, yang berkisar antara 4,0 -7,0. Asam yang
dapat ditambahkan untuk menurunkan pH adalah asam sitrat, malat, askorbat, dan asam fosfat (Shahidi and Naczk 1995).
Gambar 3. Reaksi Pembentukan Melanin dari O-Kuinon atau O-Difenol (Eskin et al 1971)
Menurut Elbe dan Schwartz (1996) secara enzimatis kehadiran enzim polifenol oksidase mempengaruhi kestabilan antosianin dan dapat merusak antosianin. Hal ini dipertegas oleh Kader et al., (1999) yang menyatakan bahwa, dengan kehadiran oksigen, enzim polifenol oksidase mampu mengkatalisis reaksi oksidasi asam klorogenik menjadi klorogenik quinon. Senyawa kuinon ini menyebabkan senyawa antosianin terdegradasi menjadi produk yang berwarna kecoklatan. Mengingat tingginya kandungan senyawa antosianin pada KBM maka perlu dilakukan beberapa upaya pencegahan reaksi browning enzimatik agar tidak mengurangi kandungan senyawa antioksidan maupun senyawa antosianin yang terkandung di dalam KBM.
E. ANTIOKSIDAN PADA KULIT BUAH MANGGIS
turunannya memiliki sifat cenderung larut dalam air (Suradikusumah, 1989). Senyawa fenolik merupakan senyawa yang penting karena merupakan kelas besar diantara senyawa – senyawa penyusun tanaman. Senyawa fenolik terdiri atas ribuan struktur.
Menurut Yu et al., (2007) KBM mengandung senyawa-senyawa fenolik. Senyawa fenolik yang ada dalam jumlah besar di dalam KBM adalah antosianin, xanthone, tannin, dan asam fenolat (Zadernowski et al., 2009). Selain senyawa tersebut, Yu et al., (2007) juga menyatakan bahwa KBM mengandung turunan senyawa polifenol berupa protosianidin.
a. Xanthone
Xanthone adalah senyawa organik dengan rumus molekul dasar C13H8O2. Turunan senyawa xanthone banyak terdapat di alam dan
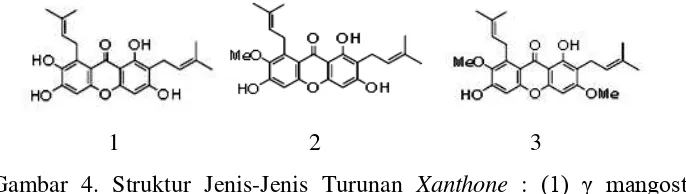
berdasarkan penelitian telah terbukti memiliki aktivitas antioksidan. Turunan senyawa xanthone yang paling banyak dikenal dan dimanfaatkan adalah yang berasal dari buah manggis. Turunan xanthone tersebut merupakan hasil metabolit sekunder dari buah manggis (Ji et al., 2007).
Penelitian terkhir menunjukkan bahwa buah manggis memiliki 14 jenis turunan senyawa xanthone. Senyawa-senyawa turunan tersebut yaitu 11-hidroksi-1-isomangostin, garcinone C, garcinone D, mangostin, 8 -deoxygartanin, gartanin, α mangostin, garcinone E, demethylcarbaxanthone, 1,6-dihidroxy-7-methoksi-8-(3-methylbut-2-enyl)-6’,6’-dimethylpyrano(β’,γ’:γ,β)xanthone, mangostin, mangostenone A, carbaxanthone, dan tovophylin B (Chaivisuthangkura et al., 2008). Beberapa struktur senyawa xanthone dapat dilihat pada Gambar 4.
2004), antioksidan (Jung et al., 2006), antiplasmodial (Mahabusarakam et al., 2006), dan aktivitas sitotoksik (Suksamarn et al., 2006).
1 2 3
Gambar 4. Struktur Jenis-Jenis Turunan Xanthone : (1) mangostin,
(β) α mangostin, dan (γ) mangostin, (Chaivisuthangkura et al., 2008)
b. Antosianin
Antosianin adalah kelompok pigmen yang berwarna merah sampai biru, yang tersebar luas pada tanaman. Pigmen ini banyak ditemukan pada buah-buahan, sayur-sayuran dan bunga contohnya pada anggur, strawbery, raspbery, cherry, apel, bunga mawar, bunga kembang sepatu dan sebagainya. Pigmen antosianin tergolong ke dalam turunan benzopiran. Struktur utama turunan benzopiran ditandai dengan adanya dua cincin aromatik benzena (C6H6) yang dihubungkan dengan tiga atom karbon yang
membentuk cincin (Moss, 2002).
Seluruh senyawa antosiain merupakan senyawa turunan dari kation flavium. Dua puluh jenis senyawa telah ditemukan, tetapi hanya enam yang memegang peranan penting di dalam bahan pangan, yaitu pelargonidin, sianidin, delfinidin, peonidin, petunidin, dan malvidin. Senyawa-senyawa bentuk lainnya sangat jarang ditemui. Pigmen antosianin terdiri dari aglikon (yaitu antosianidin) yang teresterifikasi oleh satu atau lebih gula (Francis, 1985).
Antosianin memiliki sifat mudah larut dalam air dan merupakan suatu gugusan glikosida yang terbentuk dari gugus aglikon dan glikon (Markakis, 1982). Sifat dan warna antosianin di dalam jaringan tanaman dipengaruhi oleh beberapa faktor seperti : jumlah pigmen, letak, dan jumlah gugus hidroksi dan metoksi, kopigmentasi, dsb (Markakis, 1982).
kemudian cenderung bewarna merah pada pH rendah (Deman, 1997). Kebanyakan antosianin menghasilkan warna pada pH kurang dari 4. Jumlah gugus hidroksi atau metoksi pada struktur antosianidin, akan mempengaruhi warna antosianin. Jumlah gugus hidroksil yang dominan menyebabkan warna cenderung biru dan relatif tidak stabil. Sedangkan jumlah gugus metoksil yang dominan dibandingkan gugus hidroksi pada struktur antosianidin, menyebabkan warna cenderung merah dan relatif stabil.
Laju kerusakan antosianin tergantung pada pH dan lebih tinggi lagi lajunya dengan meningkatnya pH. Secara enzimatis kehadiran enzim polifenol oksidase mempengaruhi kestabilan antosianin karena dapat merusak antosianin. Faktor- faktor lain yang mempengaruhi kestabilan antosianin secara non-enzimatis adalah pengaruh dari pH, cahaya, suhu (Elbe dan Schwartz, 1996).
Menurut Konczack dan Chang (2004) senyawa antosianin memiliki kemampuan sebagai antioksidan dan memiliki peranan yang cukup penting dalam pencegahan penyakit neuronal, penyakit cardiovascular, kanker, dan diabetes. Strukrur antosianidin dapat dilihat pada Gambar 5.
Gambar 5. Struktur Kimia Antosianidin
c. Tannin
sehingga mampu membentuk kompleks kuat dengan protein. Senyawa tannin memiliki berat molekul antara 500 – 20.000 µg.
Tannin mempunyai rasa sepat dan mempunyai kemampuan menyamak kulit. Tannin terdiri dari berbagai asam fenolat. Beberapa tannin dapat mempunyai aktivitas antioksidan, mengambat pertumbuhan tumor, dan menghambat enzim seperti reverse transkripitase dan DNA topoisomerase (Robinson, 1995). Tannin dapat membentuk kompleks dengan protein dan menyebabkan prespitasi pada molekul protein (Elbe dan Schwartz, 1996). Tannin memiliki beberapa fungsi kesehatan, diantaranya antioksidan dan relaksasi. Selain itu tannin merupakan senyawa yang secara klinis memiliki kemampuan anti-diare, hemostatik, dan anti-hemorhodial (Anonimb, 2006).
III. METODOLOGI PENELITIAN
A. ALAT DAN BAHAN
Bahan-bahan yang digunakan pada penelitian ini yaitu buah manggis segar dengan tingkat kematangan 5 dan 6, air bersih, etanol 96 %, dan gelatin.
Bahan-bahan yang digunakan untuk analisa antara lain aquades, pereaksi anthrone, larutan asam sulfat pekat, CaCO3, larutan Pb asetat pekat,
Na-oksalat, DPPH (1,1-diphenyl-2-piercrylhydrazil), metanol, asam askorbat, buffer asam asetat, reagen folinciocalteau, NaCO3, etanol teknis 95 %, etanol
pro analisis, etil asetat, K2SO4, H2SO4, HgO, NaOH – Na2S2O3, H3BO3, HCl,
n-heksan, larutan standar α mangostin, dan larutan standar glukosa.
Alat-alat yang digunakan dalam pembuatan ekstrak adalah pisau, baskom, timbangan kasar, neraca analitik, disc mill, sendok pengaduk, gelas pengaduk, talenan, tray dryer, sendok makan, kape, sentrifus, water bath, dan kain saring, kertas saring, blender, gelas ukur, penyaring vacuum, vacuum evaporator, dan erlenmeyer 500 ml.
Alat-alat yang digunakan dalam analisa adalah pipet tetes, tabung reaksi berulir, kertas saring, tabung reaksi, labu kjeldahl, soxhlet, pipet volumetrik 10, 5, 2, dan1 ml, gelas piala ukuran 100 , 300, dan 400 ml, cawan alumunium, cawan porselen, corong, gelas pengaduk, gelas ukur 100 dan 250 ml, erlenmeyer 100 dan 300 ml, neraca analitik, labu bercorong, oven, tanur, kuvet, sperktrofotometer UV-Vis Shimadzu, rotavapor, penangas air, desikator, botol kaca, alumunium foil, tip, dan mikropipet.
B. METODE PENELITIAN
1. Penelitian Pendahuluan
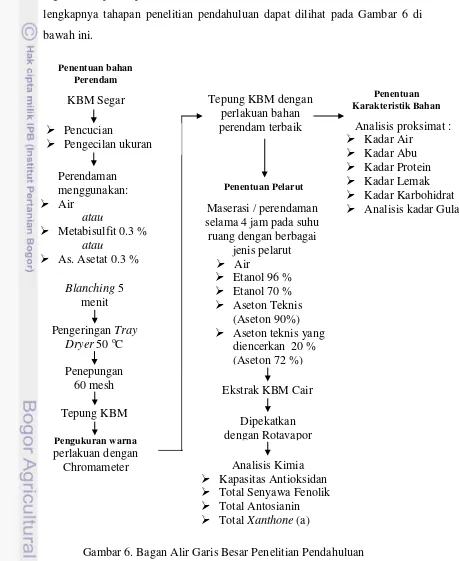
Untuk mendukung penelitian utama, pada tahap penelitian pendahuluan ini akan dilakukan penentuan karakteristik bahan yang digunakan, penentuan pelarut, penentuan bahan perendam yang akan digunakan pada proses ekstraksi serta validasi metode. Secara lebih lengkapnya tahapan penelitian pendahuluan dapat dilihat pada Gambar 6 di bawah ini.
Gambar 6. Bagan Alir Garis Besar Penelitian Pendahuluan
Penentuan Pelarut
Analisis kadar Gula Maserasi / perendaman
selama 4 jam pada suhu ruang dengan berbagai
Aseton teknis yang diencerkan 20 %
Total Senyawa Fenolik
Total Antosianin
Pengecilan ukuran
Penentuan bahan Perendam
2. Persiapan Sampel
Tahap persiapan sampel merupakan tahap awal yang penting. Pada penelitian ini dirancang proses pengeringan KBM segar menjadi tepung KBM. Mula-mula KBM yang akan digunakan terlebih dahulu dibersihkan, diperkecil dengan ukuran 1cm X 4cm, dan direndam dalam bahan perendam terbaik untuk menghilangkan getah dan mengurangi kandungan tannin. Kulit buah manggis tersebut kemudian dikeringkan dengan menggunakan tray dryer pada suhu 50 oC dan ditepungkan menggunakan pin disc mill lalu diayak hingga berukuran 60 mesh. Proses persiapan sampel secara lebih lengkap dapat dilihat pada Gambar 7 di bawah ini.
Gambar 7. Proses Persiapan Sampel Tepung KBM Kulit Buah
Manggis Segar Sortasi dan Pencucian
Pemisahan antara Kulit dengan Daging Buahnya
Perlakuan Pencegah Browning dan blaching 5 menit Pemotongan kulit buah
sebesar 1cm X 4cm
Pengeringan dengan Tray Dryer, pada suhu 50oC, selama 18 jam
Penepungan dengan Disc Mill, Diayak 60 mesh
3. Penelitian Utama
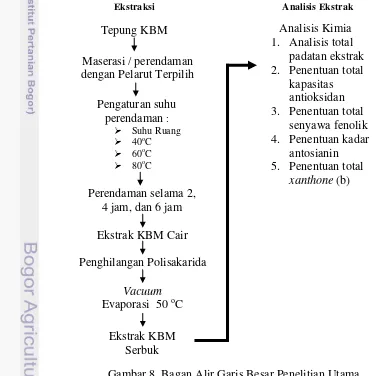
Tahap penelitian utama dibagi menjadi dua tahap yaitu, tahap ekstraksi dan tahap analisis ekstrak. Pada tahap ekstraksi, tepung KBM diekstrak dengan menggunakan pelarut terpilih pada suhu ruang, 40 oC, 60 oC, dan 80 oC masing-masing selama 2 jam, 4 jam, dan 6 jam. Ekstrak yang didapat kemudian dihilangkan kandungan polisakarida terlarutnya dengan menambahkan etanol 96 % lalu dievaporasi menggunakan vacuum evaporator hingga diperoleh ekstrak kering KBM dalam bentuk serbuk. Tahapan selanjutnya adalah analisis ekstrak, yang terdiri dari penentuan total padatan ekstrak, penentuan total kapasitas antioksidan, penentuan total fenol, penentuan kadar antosianin, dan penentuan total xanthone. Secara lengkap alur penelitian utama dapat dilihat pada Gambar 8.
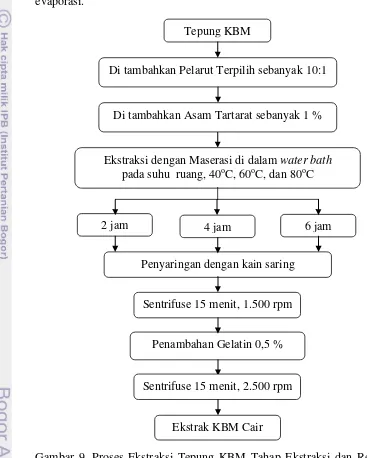
Tahapan ekstraksi yang dilakukan akan dijelaskan lebih lengkap pada Gambar 9 dan Gambar 10. Ekstraksi antioksidan dari KBM akan dilakukan dengan menggunakan metode maserasi atau perendaman. Tahap ekstraksi ini dibagi menjadi tiga tahap yaitu tahap ekstraksi dan reduksi tanin yang berlebih, tahap penghilangan polisakarida, serta tahap evaporasi.
Gambar 9. Proses Ekstraksi Tepung KBM Tahap Ekstraksi dan Reduksi Tanin yang Berlebih
Mula-mula tepung KBM yang telah dipersiapkan sebelumnya direndam dengan menggunakan pelarut terpilih yang telah ditambahkan
Tepung KBM
Di tambahkan Pelarut Terpilih sebanyak 10:1
Ekstraksi dengan Maserasi di dalam water bath pada suhu ruang, 40oC, 60oC, dan 80oC
2 jam
Penyaringan dengan kain saring
Penambahan Gelatin 0,5 %
Ekstrak KBM Cair
6 jam 4 jam
Sentrifuse 15 menit, 1.500 rpm
asam tartarat sebanyak 1 % dengan perbandingan 1:10 (bahan : pelarut). Perendaman atau maserasi dilakukan selama 2 jam, 4 jam, dan 6 jam dengan beberapa perlakuan suhu yaitu suhu ruang, 40 oC, 60 oC, dan 80 oC.
Setelah proses ekstraksi selesai dilakukan, ekstrak kemudian disaring menggunakan kain saring dan disentrifuse selama 15 menit 1.500 rpm, hingga diperoleh filtrat yang terbebas dari solut. Filtrat tersebut lalu ditambahkan gelatin sebanyak 0,5 % untuk menggendapkan tannin yang terdapat pada kulit buah manggis. Setelah 10 menit, filtrat kemudian disentrifuse kembali selama 15 menit 2.500 rpm dan disaring sehingga didapatkan ekstrak KBM Cair.
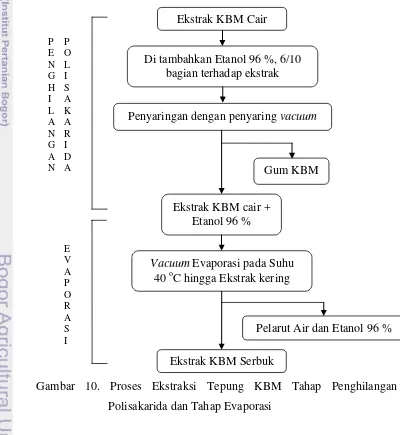
Gambar 10. Proses Ekstraksi Tepung KBM Tahap Penghilangan Polisakarida dan Tahap Evaporasi
Ekstrak KBM Cair
Di tambahkan Etanol 96 %, 6/10 bagian terhadap ekstrak
Penyaringan dengan penyaring vacuum
Ekstrak KBM cair +
Pada tahap selanjutnya, ekstrak yang diperoleh kemudian ditambahkan etanol 96 % secara perlahan sebanyak 6/10 bagian dari jumlah ekstrak yang diperoleh. Gum yang terlarut pada ekstrak akan menggumpal sehingga mudah untuk disaring dan dipisahkan. Ekstrak KBM cair + Etanol 96 % kemudian akan dikeringkan lebih lanjut menggunakan vacuum evaporator pada suhu 40 oC hingga seluruh pelarutnya menguap dan mengering. Ekstrak KBM serbuk tersebut kemudian disimpan ke dalam freezer dan dianalisis lebih lanjut.
C. METODE ANALISIS
Tahap analisis ekstrak terdiri dari dua bagian yaitu analisis yang digunakan pada percobaan pendahuluan dan analisis yang digunakan pada percobaan utama. Jenis – jenis analisis yang digunakan pada percobaan pendahuluan adalah analisis proksimat (kadar air, kadar abu, kadar protein, kadar lemak, dan kadar karbohidrat), analisis warna menggunakan cromameter, serta analisis total gula metode anthone. kimia dan analisis mikrobiologi. Sedangkan analisis pada percobaan utama yaitu analisis total padatan, analisis total kapasitas antioksidan, analisis kadar antosianin, dan analisis total xanthone.
1. Analisis Kadar Air, metode gravimetri (AOAC, 1995)
%
Dimana: W = berat bahan awal sebelum dikeringkan (g) W1 = berat contoh + berat cawan kering kosong (g)
W2 = berat cawan kosong (g)
2. Analisis Total Padatan Terlarut (AOAC, 1995)
Analisis ini mengikuti metode AOAC dengan beberapa perubahan. Sebanyak 2 gram ekstrak ditimbang dan dilarutkan ke dalam 4 ml aquades. Kemudian ekstrak cair dipipet ke dalam cawan alumunium sebanyak 2 gram lalu dimasukkan ke dalam oven suhu 100-105 °C selama satu malam. Setelah itu, cawan diangkat dan didinginkan ke dalam desikator selama 15 menit hingga beratnya menjadi konstan dan ditimbang. Tahap ini dilakukan berulang sampai didapatkan berat yang konstan dari sampel.
� % = × � 100 %
�=
� ��
Keterangan : a = Berat larutan ekstrak KBM kering (gram) b = Berat ekstrak kering yang digunakan (gram)
3. Analisis Kadar Abu, metode tanur (AOAC, 1995)
beserta sampel tersebut kemudian didinginkan dalam desikator lalu ditimbang. Penetapan kadar abu didasarkan pada perhitungan :
%
4. Analisis Kadar Protein, metode mikro-kjeldahl (AOAC,1995)
Penentuan kadar protein dilakukan dengan metode mikrokjeldahl. Sejumlah kecil sampel (0,1–0,15 g) ditempatkan dalam labu kjeldahl. Kedalamnya ditambahkan 1,9 ± 0,1 g K2SO4, 40 ± 10 mg HgO, 2,0 ± 0,1
ml H2SO4, dan beberapa batu didih. Sample dididihkan selama 1 – 1,5 jam
hingga mendidih. Cairan yang dihasilkan didinginkan untuk kemudian ditambahkan 8 – 10 ml NaOH – Na2S2O3 dan dimasukkan ke dalam alat
destilasi. Di bawah kondensor alat destilasi diletakkan erlenmeyer yang berisi 5ml larutan H3BO3 dan beberapa tetes indikator merah metil. Ujung
selang kondensor harus terendam larutan tersebut untuk menampung hasil destilasi sekitar 15 ml. Hasil destilasi kemudian dititrasi dengan larutan HCl 0.02 M hingga terbentuk warna abu-abu. Prosedur yang sama juga dilakukan terhadap blanko.
Penetapan kadar protein didasarkan pada perhitungan :
Dimana : a = ml titrasi HCl pada sampel b = ml titrasi HCl pada blanko FK = faktor konfersi
Kadar protein (bb) = Kadar protein basis basah (%) % N = Kandungan nitrogen pada sampel (%)
5. Analisis Kadar lemak, metode soxlet (AOAC, 1995)
Penentuan kadar lemak dilakukan berdasarkan metode ekstraksi soxlet. Labu takar dikeringkan dalam oven. Sampel ditimbang sebanyak 5 g dalam bentuk tepung, dibungkus dengan kertas saring dan ditutup dengan kapas bebas lemak. Kertas saring berisi sampel diletakkan ke dalam alat ekstraksi soxlet yang dirangkai dengan kondensor. Pelarut heksana dimasukkan secukupnya ke dalam labu soxlet kemudian dilakukan refluks minimal selama 5 jam. Labu takar akan berisi lemak hasil ekstraksi dan kemudian dipanaskan untuk menguapkan pelarut yang tercampur dengan lemak sampel. Penetapan kadar lemak didasarkan perhitungan :
6. Analisis Kadar karbohidrat (by difference) (Apriantono et. Al., 1989)
Dimana : P = kadar protein KA = kadar air A = kadar abu L = kadar lemak
7. Analisis Total Gula, metode anthrone (AOAC, 1995)
Penentuan total gula dengan metode Anthrone dibagi menjadi dua tahap yaitu tahap persiapan dan tahap analisis. Sebanyak 0,5 gr sampel (ekstrak) dimasukkan ke dalam gelas piala 300 ml dan ditambahkan 100 ml aquades serta 1 g CaCO3. Larutan tersebut kemudian dididihkan selama
30 menit, kemudian didinginkan dan dipindahkan ke dalam labu takar 250 ml. Sebanyak 1,5 – 2,5 ml larutan Pb asetat jenuh ditambahkan ke dalamnya hingga larutan tersebut menjadi jernih dan tepatkan hingga tanda tera dengan aquades. Kocok larutan tersebut lalu saring dengan kertas saring. Setelah proses penyaringan selesai, sebanyak 30 ml filtrat diambil ke dalam gelas piala dan ditambahkan 1,5 g Na-oksalat kering untuk mengendapkan Pb dan disaring kembali untuk analisis total gula.
Pada tahap analisis, sebanyak 5 ml larutan pada tahap persiapan dimasukkan ke dalam labu takar 100 ml dan ditepatkan hingga tanda tera dengan aquades. Setelah diencerkan, sebanyak 1 ml contoh dimasukkan ke dalam tabung reaksi bertutup dan kedalamnya dimasukan pereaksi anthrone 0,1 % (dalam asam sulfat pekat) sebanyak 5 ml. Vortex dan kocok hingga merata lalu dipanaskan pada penangas air 100 oC selama 12 menit. Setelah didinginkan, larutan dipindahkan ke dalam kuvet dan dibaca absorbansinya dengan spektofotometer pada λ 6γ0 nm. Larutan glukosa digunakan sebagai standar sedangkan untuk blanko larutan glukosa diganti menjadi aquades.
8. Analisis Warna Menggunakan Chromameter
pengukuran akan terbaca pada layar. Pada alat ini angka yang terukur berupa nilai-nilai L, a, b, dan ho (hue), dimana:
L = nilai yang menunjukkan kecerahan berkisar 0-100 a = merupakan warna campuran merah-hijau
a positif (+) antara 0 – 100 untuk warna merah a negatif (-) antara 0 – (-80) untuk warna hijau b = merupakan warna campuran biru-kuning
b positif (+) antara 0 – 70 untuk warna kuning b negatif (-) antara 0 – (-80) untuk warna biru
nilai ohue kemudian dihitung menggunanakan nilai L, a, b yang telah didapatkan sebelumnya dengan rumus di bawah ini.
Nilai hue yang didapatkan kemudian dicocokkan dengan nilai hue yang ada pada bola imajiner Munsel (Gambar 10), sehingga diperoleh data warna secara objektif. Nilai hue yang diperoleh dari metode Hunter harus berada dalam bentuk nilai derajat radian agar dapat diinterpretasikan kedalam bola imajiner Munsell.
.
Gambar 11. Bola Imaginer Munsell
2
1/2* 2 *
* a b
C
** arctan
Interpretasi warna hue pada bola imajiner Munsell juga dipengaruhi oleh nilai a dan b-nya. Jika nilai hue yang diperoleh pada metode Hunter bernilai negatif maka untuk mengintrepetasikan warnannya pada diagram Munsell, nilai negatifnya dihilangkan terlebih dahulu kemudian diukur pada kuadran yang paling tepat atau sesuai dengan nilai a dan b-nya. Pada kuadran dua nilai a bernilai negatif dan b bernlai positif. Pada kuadran ketiga a dan b sama bernilai negatif. Sedangkan pada kuadran empat, nilai a bernilai positif dan b bernilai negatif. Setelah didapatkan interpretasi warna pada diagram Munsell maka data ini dapat dibandingkan dengan data visual yang tampak.
9. Analisis Kapasitas Total Antioksidan, metode DPPH (Kubo et al.,
2002)
Penentuan kapasitas total antioksidan dilakukan dengan metode DPPH. Mula-mula sebanyak 4 ml buffer asam asetat dicampur dengan 7.5 ml metanol dan 400 µl DPPH kemudian divortex. Setelah merata, sebanyak 100 µl sampel (ekstrak) dengan konsentrasi 500 ppm kemudian ditambahkan ke dalamnya lalu divortex kembali hingga merata. Larutan campuran tersebut kemudian diinkubasi pada suhu ruang selama 20 menit
pada tempat gelap dan diukur menggunakan spektrofotometer pada λ 517
nm. Dalam penentuan kurva standar larutan sampel yang digunakan diganti dengan larutan standar antioksidan yaitu vitamin C sedangkan untuk kontrol negatif digunakan larutan metanol. Perhitungan kapasitas antioksidan dapat dinyatakan dalam % kapasitas antioksidan dan AEAC (Ascorbic Equivalen Antioksidant Capacity) dengan menggunakan kurva standar. Rumus yang digunakan dapat dilihat dibawah ini :
% Kapasitas Antioksidan = A kontrol – A sampel x 100%
A Kontrol
( � .
� ) =
Dimana: KA = Kapasitas antioksidan (%) A kontrol = Absorbansi kontrol
A sampel = Absorbansi sampel
C = Konsetrasi sampel yang didapat dari Kurva Standar (mg/L)
FP = Faktor pengenceran, ( 2 )
M = Berat Ekstrak KBM Serbuk yang digunakan (mg) 102 = Faktor Konversi Satuan
10. Penentuan Total Senyawa Fenolik (Shetty et al., 1995)
Sampel (ekstrak) diencerkan hingga memiki konsentrasi sebesar 200 ppm. Setelah diencerkan, sebanyak 1 ml sampel diambil dan ditambahkan 1 ml etanol 95 % serta 5 ml aquades. Larutan campuran tersebut kemudian divorteks dan ditambahkan 5 ml reagen folinciocalteau 50% lalu diforteks kembali. Larutan tersebut didiamkan selama 5 menit lalu tambahkan 1 ml NaCO3 5% agar kondisi menjadi basa (folin bekerja
optimum). Vortex kembali dan didiamkan (inkubasi) dalam ruang gelap selama 120 menit dan vortex kembali setiap 1 jam. Setelah inkubasi selesai, larutan tersebut diukur dengan spektrofotometer pada λ 7β5 nm. Asam galat ataupun katekin digunakan sebagai standar pada pengukuran total senyawa fenolik.
� ( � .� / �
� ) =
× �× 102
Dimana: C = Konsetrasi sampel yang didapat dari Kurva Standar (mg/L)
FP = Faktor pengenceran, ( 5 )
11. Penentuan Kadar Antosianin (Boyko et al., 2006)
Penentuan total kadar antosianin dilakukan dengan menggunakan metode yang dikemukakan oleh Boyko et al. (2006) yang dimodifikasi. Mula-mula sebanyak 500 mg ekstrak dilarutkan ke dalam 9 ml metanol kemudian disaring menggunakan kertas saring dan dipisahkan antara filtrat dengan solidnya. Filtrat yang terbentuk kemudian diencerkan sebanyak 10 kali menggunakan metanol sehingga didapatkan larutan ekstrak dengan konsentrasi 5000 ppm. Setelah dilakukan penenceran, sebanyak 9 ml ekstrak tersebut masing-masing dicampur dengan 0.25 M buffer KCL (pH 1,0, 1 ml) dan 4 M buffer asetat (pH 4,5, 1 ml). Absorbansi dari ke dua larutan tersebut kemudian diukur dengan menggunakan spektrofotometer. Perhitungan kadar antosianin dihitung dengan menggunakan hukum Lambert-Beer dengan rumus di bawah ini.
� � ( �
� ) =
∆ × × × 103 � ×
dimana :
∆ = Selisish absorbansi pH 1.0 dengan pH 4.5 pada λ 515
M = Bobot molekul sianidin 3-O-glukosida (445 g/mol) DF = Faktor pengenceran
� = Absorbsi molar sianidin 3-O-glukosida (29.600 L mol-1 cm-1)
W = Bobot kering ekstrak yang digunakan (gram)
12. Penentuan Total Xanthone (a)
panjang gelombang 320 nm. Perhitungan yang digunakan dapat dilihat di bawah ini.
=
� �
Jumlah xanthone (mg/ml sampel) = 10 �
Keterangan :
A = Absorbansi; b = Lebar kuvet (mm)
ε = emisifikas α-mangostin (3,16 x 103 liter/mol) c = konsentrasi ekstrak (mol/liter)
BM = massa molekul relatif α-mangostin (410,47 gr/mol)
13. Penentuan Total Xanthone (b) (Pothitirat, 2008)
Penentuan total xanthone ini dikukan menurut Pothitirat (2008) dengan beberapa perubahan. Penentuan total xanthone dibagi menjadi empat tahap yaitu penentuan panjang gelombang maksimun xanthone (α mangostin), pemurnian crude xanthone dari sampel (ekstrak), penentuan kurva standar, dan pengukuran konsentrasi xanthone menggunakan spektrofotometer. Sebelum pengukuran xanthone dilakukan, salah satu hal yang penting yang harus dilakukan adalah menentukan panjang gelombang maksimum. Penentuan panjang gelombang maksimum ini dilakukan dengan menggunakan spektrofotometer Shimadzu UV-160. Mula-mula larutan standar xanthone diencerkan hingga mencapai konsenrasi 10 ppm. Larutan standar yang sudah diencerkan tersebut lalu dimasukkan ke dalam spektrofotometer. Pengukuran dilakukan pada panjang gelombang 200 nm - 400 nm dengan jarak antar pengukuran sebesar 5 nm. Puncak kurva pada hasil pengukuran tersebut adalah panjang gelombang maksimum xanthone.
atau dengan perbandingan 1 : 1. Ekstraksi tersebut dilakukan berulang sebanyak 3 kali sehingga total didapatkan hasil ekstrak etilasetat sebanyak 30 ml. Hasil ekstraksi tersebut lalu dipekatkan dengan vacuum evaporator hingga kering (solid). Setelah kering, padatan hasil ekstraksi kemudian dilarutkan menggunakan metanol sebanyak 10 ml dan dipindahkan ke vial.
Dari vial, ekstrak yang sudah dimurnikan pertama-tama diencerkan sebanyak 50 hingga didapatkan konsentrasi sebesar 200 ppm, kemudian diukur absorbansinya dan dihitung konsentrasinya dengan menggunakan persamaan dari kurva standar. Pembuatan kurva standar pada prinsipnya sama dengan pengukuran xanthone namun, sampel diganti dengan larutan standar xanthone dan diukur sebanyak lima seri pengenceran dengan blanko metanol.
ℎ ( �α mangostin � ) =
× �× 10
Dimana: C = Konsetrasi sampel yang didapat dari Kurva Standar (mg/L)
FP = Faktor pengenceran, ( 50 )
M = Berat Ekstrak KBM Serbuk yang digunakan (mg) 10 = Faktor Konversi Satuan
D. RANCANGAN PERCOBAAN
Rancangan percobaan yang dilakukan terbagi menjadi dua yaitu Rancangan Acak Lengkap (RAL) untuk penelitian pendahuluan dan Rancangan Acak Kelompok Lengkap (RAKL) dengan percobaan faktorial untuk penelitian utama. Pada RAL digunakan satu jenis perlakuan (faktor) dengan pengulangan sebanyak dua kali. Percobaan penentuan bahan perendam dan percobaan penentuan jenis pelarut menggunakan RAL dengan masing-masing jenis perlakuan bahan perendam dan jenis pelarut.
a. Perlakuan ekstraksi (blok), dengan satu taraf yaitu : 1 : Tepung KBM yang diekstraksi
b. Suhu ekstraksi (A), dengan empat taraf yaitu : A1 : Suhu ruang
A2 : Suhu 40 oC
A3 : Suhu 60 oC
A4 : Suhu 80 oC
c. Lama ekstraksi (B), dengan tiga taraf yaitu : B1 : Ekstraksi selama 2 jam
B2 : Ekstraksi selama 4 jam
B3 : Ekstraksi selama 6 jam
Model matematik untuk rancangan acak kelompok lengkap faktorial (Mattjik 2002) adalah sebagai berikut :
Yijk= µ + ρi + Aj + Bk + ABjk+ єijk
dimana :
Yijk : Variabel yang diukur
µ : Pengaruh rata-rata yang sebenarnya
ρi : Pengaruh yang sebenarnya blok pada taraf ke – i Aj : Pengaruh yang sebenarnya faktor A pada taraf ke – j Bk : Pengaruh yang sebenarnya faktor B pada taraf ke – k
ABjk : Pengaruh yang sebenarnya dari interaksi faktor A taraf
ke-j dengan faktor B pada taraf ke-k
єijk : Pengaruh kesalahan percobaan
IV. HASIL DAN PEMBAHASAN
A. PENELITIAN PENDAHULUAN
1. Karakteristik Buah Manggis Yang Digunakan
Manggis merupakan salah satu buah tropika yang berkulit tebal yang memiliki banyak manfaat bagi kesehatan. Hal ini didukung adanya penelitian-penelitian terbaru yang menyebutkan bahwa KBM memiliki kandungan antioksidan yang cukup tinggi. Namun demikian, tidak semua buah manggis dapat dimanfaatkan untuk diekstrak kandungan antioksidannya. Palapol et al., (2008) menyatakan bahwa semakin tinggi tingkat kematangan buah manggis maka kandungan antosianin pada manggis juga turut meningkat. Ia membagi tingkat kematangan buah manggis dalam enam tingkat dimana tingkat kematangan lima dan enam memiliki kandungan antosianin yang paling besar. Tingkat kematangan buah manggis yang digunakan dapat dilihat pada Gambar 12.
Gambar 12. Tingkat Kematangan Buah Manggis Yang Digunakan * Dari kiri ke kanan : tigkat kematangan lima dan enam buah manggis
Buah manggis tersebut kemudian diproses menjadi tepung KBM dan diekstrak untuk dianalisis lebih lanjut. Sebelum digunakan, kedua sampel yaitu KBM segar dan tepung KBM dianalisis secara proksimat untuk mengetahui karakteristiknya. Hasil analisis proksimat yang telah dilakukan dapat dilihat pada Tabel 1.
Tabel 1. Hasil Analisis Proksimat KBM Segar dan Tepung KBM
Jenis Analisis Metode
Hasil (%) KBM segar SD Tepung
KBM SD
Kadar Air Gravimetri 62,05 0,2359 5,87 0,1097 Kadar Abu Gravimetri 1,01 0,0643 2,17 0,0404
Lemak Soxhlet 0,63 0,0551 6,45 0,0451
Protein Kjeldahl 0,71 0,1570 3,02 0,0265 Total Gula Anthrone 1,17 0,0493 2,10 0,1550 Karbohidrat By Different 35,61 - 82,50 -
Hasil uji proksimat yang diperoleh menunjukkan bahwa kadar air KBM segar cukup tinggi yaitu sekitar 62,05 % sehingga untuk menjaga kestabilan sampel perlu dilakukan proses pengeringan KBM segar menjadi tepung KBM. Secara keseluruhan setelah KBM segar ditepungkan terjadi kenaikan pada komponen-komponen lainnya, namun hal ini bukan berarti telah terjadi kenaikan yang sebenarnya. Kenaikan yang terjadi adalah akibat proses pengeringan yang mengakibatkan hilangnya air sehingga mempengaruhi perbandingan komposisi antar komponen yang masih tertinggal.
KBM segar juga banyak mengandung polisakarida. Melihat hal ini, maka perlu dilakukan proses penghilangan gum pada proses ekstraksi agar ekstrak KBM serbuk yang dihasilkan lebih stabil dan tidak bersifat terlalu higroskopis.
2. Jenis Bahan Perendam Pencegah Browning
Salah satu penelitian yang tidak kalah penting adalah perlakuan perendaman KBM segar untuk mencegah proses browning oleh enzim polifenol oksidase. Menurut Elbe dan Schwartz (1996) secara enzimatis kehadiran enzim polifenol oksidase mempengaruhi kestabilan antosianin dan dapat merusak antosianin. Hal ini dipertegas oleh Kader et al., (1999) yang menyatakan bahwa dengan kehadiran oksigen, enzim polifenol oksidase mampu mengkatalisis reaksi oksidasi asam klorogenik menjadi klorogenik quinon. Senyawa kuinon ini menyebabkan senyawa antosianin terdegradasi menjadi produk yang berwarna kecoklatan. Dengan berubahnya warna, diperkirakan aktivitas antioksidan KBM akan menurun sehingga pada penelitian akan diambil parameter perubahan warna bukan berdasarkan aktivitas antioksidan.
Melihat hal tersebut, dilakukan proses perendaman menggunakan tiga bahan perendam yang umum digunakan untuk mencegah terjadinya reaksi browning secara enzimatik yaitu air, metabisulfit 0,3 %, dan asam asetat 0,3 %. Ketiga bahan perendam tersebut mampu menghambat reaksi pencoklatan dengan mencegah molekul oksigen bertemu dengan enzim polifenol oksidase untuk membentuk kuinon.
reaksi kerusakan antosianin akibat reaksi pencoklatan oleh enzim polifenol oksidase. Hasil pengukuran warna tepung KBM menggunakan chromameter dapat dilihat pada Tabel 2.
Tabel 2. Hasil Chromameter Tepung KBM pada Berbagai Perendam
Bahan Perendam L a b hue (h o) Warna
Air 53,34 19,02 13,87 36,10o Merah Metabisulfit 0,3 % 59,13 16,29 15,39 43,37 o Kuning – Merah Asam Asetat 0,3 % 57,65 14,32 23,64 58,79 o Kuning – Merah
Dari Tabel 2 dapat diketahui bahwa senyawa metabisulfit dan asam asetat tidak mampu mempertahankan warna merah dari antosinin KBM. Perubahan warna tepung KBM menjadi kekuningan merupakan indikasi terjadinya reaksi antara metabisulfit dengan senyawa antosianin. Elbe dan Schwartz (1996) mengatakan bahwa gugus SO2 dapat berikatan dengan
flavilum pada posisi C-4 dan membentuk kompleks senyawa yang tidak berwarna. Reaksi tersebut bersifat reversibel dan warna pada senyawa antosianin dapat dimunculkan kembali dengan melakukan proses desulfuring (pencucian) sebelum dilakukan proses lebih lanjut. Namun, ada kalanya proses ini bersifat irreversibel seperti pada proses pembuatan maraschino. Diduga pada penelitian kali ini terjadi hal yang sama dimana setelah pencucian tetap terjadi discolorasi warna KBM. Diperkirakan konsentrasi metabisulfit yang terlalu tinggi menjadi penyebab reaksi tersebut tidak bersifat reversible seperti pada proses pembuatan maraschino.
terdegradasi. Hal ini diduga menjadi salah satu penyebab terjadinya penyimpangan seperti yang telah dikemukakan di atas.
Hal serupa tidak terjadi pada KBM yang direndam dengan air. Perendaman dengan bahan perendam air mampu mencegah terjadinya reaksi pencoklatan tanpa menimbulkan reaksi dengan komponen antosianin. Kandungan pH air yang netral (pH 7) diduga dapat mempertahankan senyawa antosianin dalam bentuk flavilum yang lebih stabil bila dibandingkan dengan bentuk carbinol basenya. Melihat hal ini, bahan perendam air akan digunakan kemudian sebagai bahan perendam dalam proses selanjutnya.
3. Pelarut Ekstraksi
Ekstraksi merupakan suatu proses pemisahan campuran beberapa zat menjadi komponen-komponen yang terpisah. Zat-zat yang polar hanya larut dalam pelarut polar, sedangkan zat-zat yang non-polar hanya larut di dalam pelarut non-polar (Winarno et al., 1973). Tingkat kepolaran pelarut yang digunakan sangat menentukan jumlah zat aktif karena pada proses
ekstraksi berlaku prinsip “like dissolve like” dimana zat hanya akan terlarut dengan baik dan terekstrak apabila pelarut yang digunakan memiliki tingkat kepolaran yang sama. Tingkat kepolaran berbagai jenis pelarut dapat dilihat pada Tabel 3.
Tabel 3. Tingkat Kepolaran Jenis-jenis Pelarut Jenis Pelarut Indeks Polaritas
Etil Asetat 4,4
Methanol 5,1
Aseton 5,1
Etanol 5,2
Air 9,0
Sumber : www.phenomenex.com
%). Hasil ekstraksi tepung KBM pada suhu ruang selama 4 jam dengan pelarut-pelarut tersebut kemudian akan dianalisis kimia. Hasil analisis kapasitas antioksidan, total senyawa fenol, total antosianin, dan total xanthone dapat dilihat pada Gambar 13 s/d Gambar 17.
Gambar 13. Kapasitas Antioksidan Ekstrak Tepung KBM Pada Berbagai Pelarut Dengan Metode DPPH
Huruf yang berbeda (a), (b), (c), (d) : menunjukkan perbedaan yang nyata (p<0,05).
Gambar 14. Total Senyawa Fenolik Ekstrak Tepung KBM Pada Berbagai Pelarut
Huruf yang berbeda (a), (b), (c), (d), (e) : menunjukkan perbedaan yang nyata (p<0,05).
Gambar 15. Kurva Standar Katekin Pada Analisis Total Senyawa Fenolik
Gambar 16. Total Antosianin Ekstrak Tepung KBM Pada Berbagai Pelarut Huruf yang berbeda (a), (b), (c), (d), (e) : menunjukkan perbedaan yang nyata (p<0,05).
Gambar 17. Total Xanthone Ekstrak Tepung KBM Pada Berbagai Pelarut Huruf yang berbeda (a), (b), (c), (d), (e) : menunjukkan perbedaan yang nyata (p<0,05).
Dari Gambar 13 didapatkan bahwa tepung KBM yang diekstrak menggunakan pelarut aseton 72 % memiliki kapasitas antioksidan paling besar yaitu sebesar 89,1 %, disusul pelarut etanol 70 % dan pelarut air yang masing-masing memiliki kapasitas antioksidan sebesar 86,63 % dan 86,29 %. Rata-rata kelima ekstrak dari berbagai pelarut memiliki kapasitas antioksidan yang lebih besar bila dibandingkan dengan asam askorbat 800 ppm yang hanya sebesar 79,26 %. Hal ini serupa dengan Weecharangsan et al, (2006) yang menyatakan bahwa KBM yang diekstrak menggunakan pelarut air dan etanol 50 % menunjukkan aktivitas antioksidan yang tinggi dengan nilai IC50 masing-masing sebesar 34,98 ± 2,24 µg/ml untuk ekstrak
air dan sebesar 30,76 ± 1,66 µg/ml untuk ekstrak etanol 50 %. Berdasarkan uji ANOVA perbedaan polaritas pelarut dalam hal ini menyebabkan perbedaan yang nyata pada kapasitas antioksidan ekstrak (p<0,05).
Hasil analisis total senyawa fenolik pada Gambar 14 menunjukkan kecenderungan yang berbeda dengan analisis kapasitas antioksidan dimana tepung KBM yang diekstrak dengan menggunakan pelarut air memiliki kandungan total senyawa fenolik paling tinggi, setara dengan 154,57 mg katekin/g tepung KBM disusul pelarut etanol 70 % dan aseton 72 %. Kandungan total senyawa fenolik tersebut jauh lebih rendah bila dibandingkan dengan kandungan total senyawa fenolik KBM yang diekstrak menggunakan pelarut methanol 80 % yaitu sebesar 218,1 ± 18,0 mg katekin / g KBM dry basis (Zadernowski et al., 2009).
Senyawa fenolik pada tepung KBM sebagian besar bersifat polar sehingga dapat dengan mudah terekstrak pada pelarut air. Bila hasil ini dihubungkan dengan hasil analisis kapasitas antioksidan pada Gambar 14, maka terdapat sedikit kejanggalan dimana ekstrak tepung KBM menggunakan pelarut air yang memiliki kandungan total senyawa fenolik terbesar tidak memiliki kapasitas antioksidan terbesar. Hal ini dapat disebabkan oleh adanya perbedaan struktur komponen fenolik yang terekstrak.
Diduga komponen fenolik yang terekstrak pada pelarut air memiliki gugus hidroksil (-OH) yang jauh lebih sedikit dan lebih sulit untuk mendonorkan atom hidrogen (energi aktifasinya lebih tinggi) bila dibandingkan komponen fenolik yang terekstrak menggunakan pelarut aseton 72 %. Gugus hidroksil (-OH) pada komponen antioksidan merupakan gugus yang berperan pada proses transfer elektron untuk menstabilkan radikal bebas. Semakin banyak gugus hiroksi yang dimiliki oleh komponen antioksidan maka semakin banyak elektron yang dapat didonorkan untuk menstabilkan radikal bebas. Selain itu, terdapat pula kemungkinan komponen – komponen lainnya seperti alkaloid dan beberapa vitamin antioksidan yang juga berperan terhadap terjadinya kejanggalan tersebut.