KARAKTERISTIK ANTOSIANIN DAN PROFIL SENSORI
UBI JALAR UNGU (Ipomoea batatas L) YANG DIBUDIDAYAKAN
PADA TIGA DAERAH BERBEDA
AI MAHMUDATUSSA’ADAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertasi berjudul Karakteristik Antosianin dan Profil Sensori Ubi Jalar Ungu yang dibudidayakan pada Tiga Daerah Berbeda adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tiap bab disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Ai Mahmudatussa’adah
RINGKASAN
AI MAHMUDATUSSA’ADAH. Karakteristik Antosianin dan Profil Sensori Ubi Jalar Ungu (Ipomoea batatas L) yang Dibudidayakan pada Tiga Daerah Berbeda. Dibimbing oleh DEDI FARDIAZ, NURI ANDARWULAN dan FERI KUSNANDAR.
Antosianin merupakan salah satu kelompok zat warna alami yang terdapat pada tanaman, seperti daun, bunga, umbi, buah atau sayur. Antosianin muncul dalam warna bervariasi merah, ungu, biru, dan kuning tergantung nilai pH-nya. Warna dan konsentrasi antosianin di dalam tumbuhan dapat berubah karena pengaruh panas, pH, oksigen, enzim, asam askorbat, gula, garam sulfit, ion besi, dan kopigmen. Ubi jalar ungu merupakan salah satu sumber antosianin yang mengandung lebih dari 98% antosianin terasilasi dari konsentrasi antosianin umbi. Antosianin terasilasi bersifat relatif stabil terhadap perubahan pH, suhu dan cahaya. Ubi jalar ungu banyak dikonsumsi dalam bentuk goreng, rebus, atau panggang, kadang-kadang ubi jalar ungu diolah menjadi selai atau mie. Ubi jalar biasanya disimpan terlebih dahulu sebelum dikonsumsi. Penyimpanan dapat menimbulkan profil sensori yang diinginkan ataupun profil sensori yang tidak diinginkan. Tempat budidaya ubi jalar ungu di Jawa Barat diantaranya Cilembu- Sumedang, Banjaran-Bandung, dan Pakembangan-Kuningan. Cilembu merupakan salah satu daerah yang mendapatkan indikasi geografis atau mendapatkan perlindungan wilayah penghasil perkebunan spesifik yaitu ubi jalar Cilembu. Salah satu potensi pemanfaatan ubi jalar ungu adalah diolah menjadi flakes dengan warna khas dari antosianin. Flakes merupakan sediaan kering atau serpihan yang dibuat melalui tahapan pembuatan pasta ubi jalar kukus atau rebus kemudian dikeringkan dengan pengering drum. Flakes dapat digunakan sebagai bahan baku industri pangan.
Penelitian ini dilakukan untuk mempelajari karakteristik antosianin dan profil sensori ubi jalar ungu yang dibudidayakan pada tiga lokasi berikut : Cilembu, Sumedang; Banjaran, Bandung; dan Pakembangan, Kuningan. Pengaruh lokasi budidaya terhadap jumlah antosianin monomerik; warna dan spektra ekstrak antosianin pada pH 1-14; aktivitas antioksidan dan stabilitas ekstrak antosinin pada pH 1, 4.5 dan 7, dan profil sensori ubi jalar ungu panggang telah dipelajari. Penelitian ini mengkaji juga mengenai kecenderungan model penurunan konsentrasi antosianin ubi jalar ungu segar dan flakes rehidrasi yang disebabkan oleh panas selama pemanggangan.
dan pH 7. Ekstrak antosianin ubi jalar ungu lebih stabil disimpan pada suhu rendah. Pola warna, spektra, aktivitas antioksidan dan stabilitas ekstrak antosianin dipengaruhi oleh pH, tidak dipengaruhi oleh tempat budidaya.
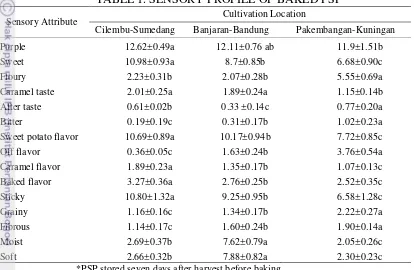
Analisis kuantitatif deskriptif dari ubi jalar ungu panggang menghasilkan lima belas deskriptor termasuk warna ungu, rasa manis, rasa tepung, rasa karamel, rasa getir, rasa pahit, cita rasa khas ubi jalar, lanas, cita rasa karamel, cita rasa panggang, tekstur pulen, berpasir, berserat, basah dan lembut. Lokasi budidaya seperti halnya waktu penyimpanan ubi jalar segar selama tujuh dan 30 hari sebelum dipanggang mempengaruhi profil sensori ubi jalar ungu panggang. Ubi jalar ungu panggang dari Cilembu, Sumedang memperlihatkan atribut sensori berkaitan dengan warna ungu, manis, cita rasa ubi jalar ungu, dan tekstur pulen. Karakteristik atribut sensori dari ubi jalar ungu panggang dari Banjaran, Bandung adalah warna ungu, manis, cita rasa ubi jalar ungu, basah dan lembut. Karakteristik atribut sensori dari ubi jalar ungu panggang dari Pakembangan, Kuningan adalah warna ungu, citarasa tepung, dan berpasir.
Untuk pengujian model kecenderungan penurunan konsentrasi antosianin karena pengaruh pengolahan panas digunakan ubi jalar ungu Ayamurasaki yang dibudidayakan di Cilembu dan sudah disimpan 7 hari setelah panen. Warna ubi jalar ungu segar adalah ungu dengan notasi warna : L*=23.38±0.71, C=9.84±0.98, dan Hue=12.25±1.61. Konsentrasi antosianin monomerik ubi jalar segar adalah 1.45±0.00 mg setara sianidin (CyE)/g basis kering (bk). Secara umum, warna dan konsentrasi antosianin ubi jalar ungu berubah selama proses pembuatan flakes. Ubi jalar ungu yang dikukus selama 7 menit berubah menjadi ungu cerah (L*=25.88±0.47, C=24.64±0.25, Hue=348.83±0.33). Konsentrasi antosianin monomerik ubi jalar ungu kukus 3.76±0.01 mgCyE/g bk, lebih tinggi dibandingkan konsentrasi antosianin monomerik ubi jalar ungu segar. Flakes ubi jalar ungu berwarna ungu sangat cerah (L*=36.12±0.11, C=9.97±0.18, Hue=359.29±0.31) dan jumlah antosianin monomerik sedikit lebih rendah dibandingkan setelah dikusus (3.19±0.12 mg CyE/g bk). Jumlah antosianin monomerik ubi jalar ungu segar dan flakes rehidrasi menurun seiring waktu pemanasan.
SUMMARY
AI MAHMUDATUSSA’ADAH. Characterization of Anthocyanin and Sensory Profile of Purple Sweet Potato (Ipomoea batatas L) Cultivated from Three Different Locations. Supervised by DEDI FARDIAZ, NURI ANDARWULAN and FERI KUSNANDAR.
Anthocyanins are groups of natural pigments found in plants, such as leaves, flowers, roots, fruits or vegetables. Anthocyanins appear in varying colors of red, purple, blue, and yellow depending on their medium pH. The color and anthocyanin content in plant may change as affected by heat, pH, oxygen, enzymes, ascorbic acid, sugar, sulfite salts, iron ions, and copigment. Purple sweet potato is one sources of anthocyanins that contain more than 98% of acylated anthocyanin in total tuber anthocyanins. Acylated anthocyanins are relatively stable to pH, temperature and light changes. Purple sweet potato is widely consumed in the form of fried, boiled or baked food, some time it used for making jam or noodle. One other potential use of purple sweet potato is for making dry flakes which retain the typical anthocyanin color. Flakes may be prepared by mashing boiled or steamed tuber followed by drying in a drum dryer.
This research was conducted to observe the characteristics of anthocyanin and sensory profile of purple sweet potato cultivated in the following locations: Cilembu, Sumedang; Banjaran, Bandung; and Pakembangan, Kuningan. The effects of cultivated locations on total monomeric anthocyanin; the color and spectra of anthocyanin extracts at pH 1-14; and antioxidant activity and stability of anthocyanin extracts at pH 1, 4.5 and 7 were studied. Other observations were also conducted on kinetic reaction model of anthocyanin in rehydration flakes and fresh tuber as affected by heat during baking; and sensory profile of baked tuber.
The results showed that total number of monomeric anthocyanins in the anthocyanin extract cultivated in Cilembu was 3.78 ± 0.08 mg (equivalent sianidin-3-glucoside / g dry weight, db) which was higher than that of Banjaran (3.18 ± 0.01mg CyE / g db) and that of Pakembangan (2.25 ± 0.01 mg CyE / g db). The different in anthocyanins content of purple sweet potato cultivated from three different locations seemed to be significant (P<0.05). The color of anthocyanin extract changes from red, purple, blue, green to yellow with increasing pH from 1 to 14. Free radical scavenging activity and reducing power of purple sweet potato anthocyanin extracts at pH 1 was higher than that at pH 4.5 and pH 7. Purple sweet potato anthocyanin extract is more stable at low temperature.
Quantitative descriptive analysis (QDA) of baked purple sweet potato generated fifteen sensory descriptors which include purple, sweet, floury, caramel taste, after taste, bitter, sweet potato flavor, off flavor, caramel flavor, baked flavor, sticky, grainy, fibrous, moist, and soft. Cultivations locations as well as storage time of seven and 30 days before baking influenced the sensory profile of baked purple sweet potato. Baked purple sweet potato from Cilembu, Sumedang
was indicated by the following specific sensory attributes purple color, sweet,
potato flavor, moist and soft. Prominent sensory attributes of baked purple sweet potato from Pakembangan - Kuningan are associated with purple color, floury, and grainy.
The color of fresh sweet potato was purple as shown in the following color notation: L * = 23.38 ± 0.71, C = 9.84 ± 0.98, Hue = 12.25 ± 1.61. Total monomeric anthocyanin in fresh purple sweet potato was 1.45 ± 0.00 mg cyanidin equivalent (CyE)/g dry basis (db). In general, the color and anthocyanin content in purple sweet potato changed during flaking. While, steaming of the tuber for 7 minutes changed its color into a bright purple (L * = 25.88 ± 0.47, C = 24.64 ± 0.25, Hue = 348.83 ± 0.33). The total monomeric anthocyanin content is 3.76 ± 0.02 CyE mg/g db after steaming. The flakes showed bright purple color (L * = 36.12 ± 0.11, C = 9.97 ± 0.18, Hue = 359.29 ± 0.31) and the total monomeric anthocyanin content was slightly lower than that of steamed sweet potato (3.19 ± 0.12 mg CyE / g db). Total monomeric anthocyanin in fresh and rehydrated flakes decrease during baking time.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu Pangan
KARAKTERISTIK ANTOSIANIN DAN PROFIL SENSORI
UBI JALAR UNGU (Ipomoea batatas L) YANG DIBUDIDAYAKAN
PADA TIGA DAERAH BERBEDA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Penguji pada Ujian Tertutup: Dr Ir Dede R Adawiyah, MSi
Staf Pengajar Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, IPB
Dr Elvira Syamsir, STP MSi Dr Ir Drajat Martianto, MS Staf Pengajar Departemen Ilmu dan Teknologi DIA
Pangan, Fakultas Teknologi Pertanian, IPB
Penguji pada Ujian Terbuka: Dr Ir Bram Kusbiantoro MS
Peneliti Pasca Panen Balai Besar Penelitian Tanaman Padi, Kementerian Pertanian
Dr Ir Didah Nur Faridah MS Prof Dr Ir Marimin,
MS Staf Pengajar Departemen Ilmu dan Teknologi
Pangan, Fakultas Teknologi Pertanian, IPB
Judul Disertasi : Karakteristik Antosianin dan Profil Sensori Ubi Jalar Ungu (Ipomoea batatas L) yang Dibudidayakan pada Tiga Daerah Berbeda
Nama : Ai Mahmudatussa’adah NIM : F261090021
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Dedi Fardiaz, MSc Ketua
Prof Dr Ir Nuri Andarwulan, MSi Dr Feri Kusnandar MSc Anggota Anggota
Diketahui oleh
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Prof Dr Ir Ratih Dewanti-Hariyadi, MSc Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur kepada Alloh Subhanahu Wata’ala Yang Maha Esa karena atas rahmat-Nya sehingga disertasi dengan judul ‖Karakteristik Antosianin dan Profil Sensori Ubi Jalar Ungu (Ipomoea batatas L) yang Dibudidayakan pada Tiga Lokasi Berbeda‖ dapat diselesaikan dengan baik. Disertasi ini merupakan salah satu syarat untuk mencapai gelar Doktor pada Program Studi Ilmu Pangan, Sekolah Pascasarjana Institut Pertanian Bogor.
Sebagian hasil penelitian dalam disertasi ini telah diajukan sebagai artikel
ilmiah pada beberapa jurnal, yaitu: 1) ―Karakteristik Warna dan Aktivitas Antioksidan Ekstrak Antosianin Ubi Jalar ungu‖ telah diajukan untuk dipublikasi pada Jurnal Teknologi dan Industri Pangan Departemen ITP IPB Bogor dan sudah sampai pada tahap hasil telaah satu; 2) “Sensory Profile of Baked Purple Sweet
Potato Cultivated from Three Different Locations‖ telah didaftarkan untuk di
publikasi pada Journal of Sensory Studies Wiley online Library dan sudah pada tahap pertimbangan dewan redaksi; dan 3)“Pengaruh Pengolahan Panas terhadap Konsentrasi Antosianin Monomerik Ubi Jalar Ungu (Ipomoea batatas L)‖ telah diajukan untuk dipublikasi pada Agritech Jurnal Teknologi Pertanian Fakultas Pertanian UGM Yogyakarta dan sudah sampai pada tahap hasil telaah dua.
Terima kasih yang tulus penulis sampaikan kepada Prof. Dr. Dedi Fardiaz, MSc., selaku ketua komisi pembimbing, Prof. Dr. Nuri Andarwulan, MSi., dan Dr. Feri Kusnandar., MSc. sebagai anggota komisi pembimbing, yang telah banyak memberikan arahan, bimbingan dan dukungan hingga terselesaikannya draf disertasi ini. Terima kasih penulis sampaikan kepada Dr. Ir. Dede R Adawiyah, M.Si dan Dr. Elvira Syamsir, STP., MSi atas masukan dan koreksinya sebagai penguji luar komisi pada ujian tertutup. Terima kasih penulis sampaikan kepada Dr. Ir. Didah Nur Faridah, M.Si dan Dr. Ir Bram Kusbiantoro, M.Si atas masukan dan penguji luar komisi pada ujian terbuka. Terima kasih kepada Kementerian Pendidikan dan Kebudayaan Republik Indonesia atas bantuan beasiswa BPPS tahun 2009-2013, dan bantuan dana penelitian melalui skim Hibah Disertasi Doktor 2014. Terima kasih kepada seluruh staf dan laboran laboratorium Departemen Ilmu dan Teknologi Pangan, IPB, dan Seafast center - IPB, yang telah mengakomodir jalannya penelitian ini. Terima kasih kepada seluruh staf dan dosen PKK, khususnya Program Studi Pendidikan Tata Boga FPTK Universitas Pendidikan Indonesia, atas izin studi dan keringanan menjalankan tugas yang telah diberikan. Terima kasih untuk teman-teman IPN 2009, 2010, 2011, atas kebersamaannya. Terima kasih untuk semua keluarga, Ema, Abah, Suami, Anak, Ibu, kakak dan kepada semua pihak yang telah membantu baik dalam pelaksanaan serangkaian penelitian ini maupun dalam penyusunan disertasi ini disampaikan terima kasih.
Penulis mengharapkan masukan dan saran untuk lebih memperbaiki Disertasi ini. Semoga hasil penelitian dalam disertasi ini bermanfaat untuk pengembangan ilmu dan pengetahuan di bidang Ilmu Pangan dan bidang terkait lainnya.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR ISI
1 PENDAHULUAN
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Hipotesis Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
Daftar Pustaka 5
2 KARAKTERISTIK WARNA, AKTIVITAS ANTIOKSIDAN DAN
STABILITAS EKSTRAK ANTOSIANINUBI JALAR UNGU
Abstrak 9
Pendahuluan 10
Bahan dan Metode 11
Hasil dan Pembahasan 13
Kesimpulan 22
Daftar Pustaka 23
3 SENSORY PROFILE OF BAKED PURPLE SWEET POTATO
CULTIVATEDFROM THREE DIFFERENT LOCATIONS
Abstract 27
Introduction 27
Materials and Method 28
Result and Discussion 29
Conclution 32
References 35
4 PENGARUH PENGOLAHAN PANAS TERHADAP KONSENTRASI
ANTOSIANIN MONOMERIK UBI JALAR UNGU(Ipomoea batatas L)
Abstrak 38
Pendahuluan 39
Metode Penelitian 40
Hasil dan Pembahasan 43
Kesimpulan 47
Daftar Pustaka 47
5 PEMBAHASAN UMUM
Antosianin Ubi Jalar Segar 50
Warna Ekstrak Antosianin 50
Spektra Ekstrak Antosianin 51
Aktivitas Antioksidan Ekstrak Antosianin 52
Stabilitas Ekstrak Antosianin 53
Profil Sensori Ubi Jalar Ungu Panggang 53
Pengaruh Pengolahan Panas Terhadap Jumlah Antosianin Monomerik 55
Simpulan dan Saran 56
Daftar Pustaka 57
1
1
PENDAHULUAN
Latar Belakang
Antosianin merupakan komponen bioaktif kelompok flavonoid dengan warna bervariasi mulai merah, ungu, biru, pada bunga, daun, umbi, buah dan sayur yang tergantung pada pH-nya (Torskangerpoll dan Andersen 2005; Burdullis et al. 2009; Jensen et al. 2011). Antosianin adalah senyawa yang terdiri dari antosianidin dan gugus gula. Antosianidin yang banyak ditemukan di dalam buah, sayur atau umbi adalah pelargonidin, sianidin, delfinidin, peonidin, petunidin dan malvidin (Kim et al. 2012). Antosianin larut dalam air dan aman untuk dikonsumsi, sehingga umumnya digunakan sebagai pewarna alami untuk produk makanan dan minuman (Chiste et al. 2010). Antosianin memiliki fungsi yang baik untuk kesehatan seperti mencegah risiko kanker usus kolon (Lim 2012), kanker hati (Choi et al. 2011). Antosianin juga diketahui sebagai antidiabetes (Sancho dan Pastore 2012) dan antioksidan (Takahata et al. 2011; Jiao et al. 2012). Sifat antosianin, termasuk perubahan warna, dan aktivitas antioksidan dipengaruhi oleh pH dan struktur dari antosianin (Marco et al. 2011). Struktur antosianin berubah pada pH 1, pH 4.5 dan pH 7 (Lee et al. 2005). Berbagai macam sayur, buah, bunga, dan umbi sudah ditemukan mengandung antosianin seperti kubis merah (Wiczkowsi et al. 2013), kulit leci (Ruenroengklin et al. 2008), beras hitam, paria, paprika, kulit bawang, kulit anggur, mulberry, buah bit, (Boo et al. 2012), rosella (Duangmall et al. 2008), buah duwet (Sari et al. 2012), bunga teleng (Marpaung 2012) dan ubi jalar ungu (Jiao et al. 2012).
Ubi jalar mudah dibudidayakan, dapat tumbuh pada berbagai macam jenis tanah, produktifitasnya tinggi, dengan masa tanam yang relatif pendek, 3-6 bulan, dan membutuhkan sedikit pupuk (George et al. 2011). Tempat budidaya ubi jalar ungu di Jawa Barat diantaranya Cilembu-Sumedang, Banjaran-Bandung, dan Pakembangan-Kuningan. Ketiga tempat ini memiliki karakteristik geografis dan iklim yang relatif berbeda. Desa Cilembu, Sumedang memiliki ketinggian wilayah 600 m di atas permukaan laut (dpl), suhu rata-rata 28 oC. Desa Banjaran, Bandung 600 m dpl, suhu udara rata-rata 29 oC. Desa Pakembangan Kuningan ketinggian 400 m dpl, suhu rata-rata 31 oC. Beberapa peneliti sebelumnya menemukan bahwa letak geografis tempat tumbuh dan suhu lingkungan tumbuh mempengaruhi kandungan total antosianin kentang (Reyes et al. 2004; Brown et al. 2008), bilberries (Burdullis et al. 2007), ceri (Pedisic et al. 2010), dan kedelai (Kim et al. 2014). Wilayah Cilembu-Sumedang sudah ditetapkan oleh pemerintah Indonesia sebagai salah satu daerah yang mendapatkan Perlindungan Wilayah Geografis Penghasil Produk Perkebunan Spesifik Lokasi PP No. 31 Tahun 2009.
2
antosianin yang diasilasi (Tsukui et al. 2002). Antosianin terasilasipada ubi jalar ungu relatif stabil terhadap perubahan pH, panas, dan cahaya (Cevallos-Casals dan Cisneros-Zevallos 2004; Jie et al. 2013).
Ubi jalar biasanya disimpan terlebih dahulu sebelum dikonsumsi atau diolah. Perubahan sifat sensori selama penyimpanan sangat penting, dan perubahan
tersebut mungkin diinginkan atau tidak diinginkan (van Oirschot et al. 2003).
Perubahan tekstur yang lembut dan lembab selama penyimpanan dianggap
diinginkan di Amerika Serikat (Hamann et al. 1980). Di Indonesia ubi jalar
biasanya disimpan terlebih dahulu untuk mendapatkan rasa ubi jalar yang lebih manis.
Ubi jalar ungu banyak dikonsumsi dalam bentuk goreng, rebus, atau panggang; kadang-kadang diolah menjadi tepung, dodol, selai atau mie instan. Di antara potensi pemanfaatan lain dari ubi jalar ungu adalah diolah menjadi bentuk flakes dengan warna khas dari antosianin. Flakes merupakan sediaan kering atau serpihan yang dibuat melalui tahapan pembuatan pasta dari ubi jalar rebus atau kukus, kemudian dikeringkan dengan pengering drum. Flakes umumnya dibuat dari kentang, dikenal dengan potato flakes. Flakes dapat diolah lebih lanjut sebagai ingredien pangan untuk pembuatan french fried potatoes atau potato chips (Lamberti et al. 2004).
Pembuatan flakes secara umum melalui tahapan proses pembuatan pasta dengan cara dikukus, direbus, digoreng atau dipanggang, kemudian pasta tersebut dikeringkan dengan pengering drum. Konsentrasi dan warna antosianin dapat berubah karena pengaruh pemanasan (Truong et al. 2010, Kim et al. 2012, Lachman et al. 2012, Burgos et al. 2013). Pengaruh panas merupakan masalah yang banyak ditemukan dapat menurunkan konsentrasi antosianin selama pengolahan.
Perumusan Masalah
Antosianin merupakan komponen bioaktif yang memiliki warna yang menarik, dapat berubah karena pH dan memiliki sifat fungsional yang baik untuk kesehatan. Konsentrasi dan warna antosianin dapat berubah diantaranya dipengaruhi oleh pH, dan panas. Salah satu sumber antosianin yang potensial adalah ubi jalar ungu. Ubi jalar ungu dibudidayakan pada berbagai lokasi. Lokasi dan kondisi tempat budidaya dapat mempengaruhi karakteristik dari tanaman yang dibudidayakan. Lokasi budidaya ubi jalar ungu di Jawa Barat diantaranya Desa Cilembu Kabupaten Sumedang, Desa Banjaran Kabupaten Bandung, dan Desa Pakembangan Kabupaten Kuningan. Ubi jalar ungu biasanya disimpan terlebih dahulu pada suhu ruang sebelum diolah dan dikonsumsi. Teknik pengolahan ubi jalar ungu diantaranya dikukus, direbus, digoreng dan dipanggang. Proses pengolahan dapat merubah jumlah dan warna antosianin. Dengan demikian dalam penelitian ini dikaji mengenai jumlah antosianin monomerik, warna, spektra, aktivitas antioksidan, dan stabilitas ekstrak antosianin, juga profil sensori ubi jalar ungu panggang yang ditanam pada berbagai daerah. Selain itu di dalam penelitian ini juga dikaji mengenai model penurunan jumlah antosianin monomerik ubi jalar ungu segar dan flakes rehidrasi dari Cilembu selama pemanggangan.
Penelitian ubi jalar ungu yang sudah dilakukan peneliti sebelumnya
3 2012), identifikasi jumlah monomer antosianin (Terahara et al. 2004, Truong et al. 2010), stabilitas antosianin (Cevallos-Casals dan Cisneros-Zevallos, 2004, Jie et al. 2013), aktivitas antioksidan (Kano et al. 2005; Takahata et al. 2011; Jiao 2012), mencegah kanker usus (Lim 2012), pengaruh pengolahan terhadap kadar antosianin (Burgos et al. 2013). Belum ditemukan penelitian mengenai
karakteristik antosianin dan profil sensori ubi jalar ungu yang dibudidayakan pada daerah berbeda. Informasi mengenai perubahan warna dan konsentrasi antosianin sebagai akibat proses pengolahan panas ubi jalar menjadi flakes ubi jalar juga belum tersedia.
Tujuan Penelitian
Tujuan penelitian secara umum adalah untuk mempelajari karakteristik antosianin dan profil sensori ubi jalar ungu yang dibudidayakan pada tiga lokasi berbeda. Penelitian ini secara khusus bertujuan untuk:
1) Mempelajari pengaruh lokasi budidaya terhadap jumlah antosianin monomerik.
2) Mempelajari pengaruh lokasi budidaya terhadap warna, spektra warna, aktivitas antioksidan, dan stabilitas ekstrak antosianin ubi jalar ungu.
3) Mempelajari profil sensori ubi jalar ungu Ayamurasaki yang dibudidayakan di Cilembu, Sumedang; Banjaran, Bandung; dan Pakembangan, Kuningan. 4) Mempelajari pengaruh pemanasan terhadap jumlah antosianin monomerik ubi
jalar ungu segar dan flakes rehidrasi.
Hipotesis Penelitian
Hipotesis dari penelitian ini adalah:
1) Ubi jalar ungu yang ditanam di lokasi yang berbeda memiliki jumlah antosianin monomerik berbeda.
2) Warna, spektra warna, aktivitas antioksidan, dan stabilitas ekstrak antosianin ubi jalar ungu dipengaruhi lokasi budidaya.
3) Ubi jalar ungu yang ditanam di lokasi yang berbeda memiliki profil sensori yang berbeda.
4) Model penurunan jumlah antosianin monomerik ubi jalar ungu segar dan flakes rehidrasi selama pemanggangan mengikuti orde satu.
Manfaat Penelitian
4
kesehatan. Sebagai negara agraris beriklim tropis setiap wilayah akan memberikan karakteristik hasil tanam yang memiliki ciri khas. Informasi dari penelitian ini dapat menjadi referensi dalam pelaksanaan Peraturan Pemerintah (PP) No. 51 Tahun 2007 tentang Indikasi Geografis, dan PP No. 31 Tahun 2009 tentang Perlindungan Wilayah Geografis Penghasil Produk Perkebunan Spesifik Lokasi (WGPPPSL).
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah kajian mengenai karakteristik antosianin dan profil sensori ubi jalar ungu varietas Ayamurasaki yang dibudidayakan pada tiga lokasi berbeda. Ubi jalar ungu varietas Ayamurasaki telah diverifikasi karakteristik taksonominya di Balai Penelitian Tanaman Aneka Kacang dan Umbi (Balitkabi), Malang. Kajian tahap pertama adalah analisis kandungan antosianin ubi jalar ungu yang dibudidayakan di Cilembu, Sumedang; Banjaran, Bandung dan Pakembangan, Kuningan. Selain itu dianalisa juga mengenai pengaruh pH terhadap warna, spektra dan aktivitas antioksidan ekstrak antosianin. Kajian kelompok kedua adalah profil sensori ubi jalar ungu panggang yang dibudidayakan di Cilembu, Sumedang; Banjaran, Bandung dan Pakembangan Kuningan. Kajian kelompok ketiga adalah pembuatan ingredient pangan berupa flakes ubi jalar ungu dan mengkaji pengaruh pemanggangan terhadap jumlah antosianin monomerik ubi jalar segar dan flakes rehidrasi (Gambar 1) Aktivitas antioksidan pH 1, 4.5, dan 7 Stabilitas ekstrak antosianin pH 1,4.5,dan 7
5 Penelitian ini dibagi menjadi tiga tahap penelitian. Tahap pertama adalah kajian mengenai jumlah antosianin monomerik; pengaruh pH terhadap warna, spektra warna; aktivitas antioksidan dan stabilitas ekstrak antosianin ubi jalar ungu Ayamurasaki yang dibudidayakan pada tiga lokasi yang berbeda. Ubi jalar ungu yang dibudidayakan di Cilembu-Sumedang, Banjaran-Bandung, dan Pakembangan-Kuningan disimpan selama 7 hari, diblansir kukus, dan diukur kadar air, jumlah antosianin monomerik; dilihat perubahan warna; diukur spektra warna ekstrak antosianin pada pH 1-14; dianalisis aktivitas antioksidan dan stabilitas ekstrak antosianin pada pH 1, 4.5 dan 7.
Tahap ke dua mengkaji mengenai profil sensori ubi jalar ungu Ayamurasaki panggang yang dibudidayakan di Cilembu-Sumedang, Banjaran-Bandung, dan Pakembangan-Kuningan. Ubi jalar ungu disimpan selama 7 hari dan 30 hari pada suhu ruang (± 30 oC), kelembaban (±80%). Ubi jalar ungu panggang kemudian diukur profil sensori dengan metode QDA (Quantitative Descriptive Analysis) oleh panelis terlatih.
Tahap ke tiga mengkaji mengenai model penurunan konsentrasi antosianin monomerik ubi jalar ungu segar dan flakes rehidrasi selama pemanggangan. Ubi jalar ungu yang digunakan sebagai sampel adalah ubi jalar ungu Ayamurasaki yang dibudidayakan di Cilembu. Ubi jalar ungu dibuat flakes dengan cara ubi jalar ungu dibersihkan, dikupas dengan pengupas abrasive, dipotong, dikukus, dan dikeringkan dengan pengering drum. Flakes ditambahkan air 65%, diaduk sampai membentuk pasta, ditimbang, dan dibentuk kubus dengan panjang sisi 4 cm, kemudian dibungkus dengan aluminium foil. Ubi jalar segar dicuci, dikeringkan, dipotong kubus dengan panjang sisi 4 cm, kemudian dibungkus dengan aluminium foil. Semua sampel dipanggang dengan oven listrik pada suhu 150 oC (120 menit), suhu 200 oC (90 menit) dan suhu 250 oC (60 menit). Dari setiap suhu pemanggangan diambil 6 titik sampel, kemudian dianalisa jumlah antosianin monomerik.
DAFTAR PUSTAKA
Boo H, Hwang S, Baec C, Park S, Heod B, Gorinsteine S. 2012. Extraction and characterization of some natural plant pigments. Ind Crop Prod 40:129 – 135. DOI:10.1016/j.indcrop.2012.02.042.
Brown CR, Durst RW, Wrolstad R, De Jong W. 2008. Variability of phytonutrient content of potato in relation to growing location and cookingmethod. Potato Research 51: 259–270. DOI 10.1007/s11540-008-9115-0
Burdulis D, Ivanauskas L, Dirs V, Kazlauskas S, Ražukas A. 2007. Study of
diversity of anthocyanin composition in bilberry (Vaccinium myrtillus L.) fruits. Medicina (Kaunas) 43(12): 971-977.
Burdulis D, Sarkinas A, Jasutiené I, Stackevicené E, Nikolajevas L, Janulis V. 2009. Comparative study of anthocyanin composition, antimicrobial and antioxidant activity in bilberry (Vaccinium myrtillus L.) and blueberry (Vaccinium corymbosum L.) fruits. Acta Pol Pharm 66: 399–408.
Burgos G, Amoros W, Munoa, Sosa P, Cayhualla E, Sanchez C, Dı´az C,
6
concentrations and antioxidant activity of purple-fleshed potatoes as affected by boiling. J Food Comp Anal 30 : 6–12. DOI: 10.1016/j.jfca.2012.12.001 Cevallos-Casals BA, Cisneros-Zevallos L. 2004. Stability of anthocyanin based
aqueous extracts of Andean purple corn and red-fleshed sweet potato compared to synthetic and natural colorants. Food Chem 86: 69–77.
Chisté RC, Lopes AS, de Faria LJG. 2010. Thermal and light degradation kinetics of anthocyanin extracts from mangosteen peel (Garcinia mangostana L.). Int J Food Sci Tech 45: 1902–1908. DOI: 10.1111/j.1365-2621.2010.02351
Choi JH, Hwang YP, Choi CY, Chung YC, Jeong HG. 2010. Anti-fibrotic effects of the anthocyanins isolated from the purple-fleshed sweet potato on hepatic fibrosis induced by dimethylnitrosamine administration in rats. Food Chem Toxicol 48: 3137–3143. DOI:10.1016/j.fct.2010.08.009.
Duangmall K, Saicheua B, Sueeprasan S.2008. Colour evaluation of freeze-dried roselle extract as a natural food colorant in a model system of a drink. LWT (41): 1437–1445. DOI:10.1016/j.lwt.2007.08.014.
George NA, Pecota KV, Bowen BD, Schultheis JR, Yencho GC. 2011. Root piece planting in sweetpotato – a synthesis of previous research and directions for the future. Hort Tech 21: 703–711.
Goda, Y., Shimizu, T., Kato, Y., Nakamura, M., Maitani, T., Yamada, T., Terahara, N., dan Yamaguchi, M. (1997). Two acylated anthocyanins from purple sweet potato. Phytochemistry 44: 183–186.
Huang CL, Liao WC, Chan CF, Lai YC. 2010. Optimization for extraction anthocyanin from purple sweet potato roots using response surface methodology. J Taiwan Agric Res 59(3) : 143-150
Jensen MB, Bergamo CA, Payet RM, Liu X, Konczak I. 2011. Influence of
copigment derived from Tasmannia pepper leaf on Davidson’s plum anthocyanins. J Food Sci 76: C447–C453.
Jiao Y, Jiang Y, Zhai W dan Yang Z. 2012. Studies on antioxidant capacity of anthocyanin extract from purple sweet potato (Ipomoea batatas L.). Afr J Biotechnol 11(27): 7046-7054. DOI: 10.5897/AJB11.3859.
Jie L, Xiao-ding L, Yun Z, Zheng-dong Z, Zhi-ya O, Meng L, Shao-hua Z, Shuo L, Meng W, Lu O. 2013. Identification and thermal stability of purple-fleshed sweet potato anthocyanins in aqueous solutions with various pH values and fruit juices. Food Chem 136: 1429–1434. DOI: 10.1016/j.foodchem.2012.09.054
Kano M, Takayanagi T, Harada K, Makino K, Ishikawa F. 2005. Antioxidative activity of anthocyanins from purple sweet potato, Ipomoea batatas cultivar Ayamurasaki. Biosci Biotechnol Biochem 69: 979-988
Kim EH, Lee OK, Kim JK, Kim SL, Lee J, Kim SH, Chung IM. 2014. Isoflavones and anthocyanins analysis in soybean (Glycine max (L.) Merill) from three different planting locations in Korea. Field Crops Res 156: 76– 83. DOI: 10.1016/j.fcr.2013.
Kim HW, Kim JB, Cho SM, Chung MN, Leen YM, Chu SM, Che JH, Kim SN, Kim SY, Cho YS, Kim JH, Park HJ, Lee DJ. 2012. Anthocyanin changes in the Korean purple-fleshed sweet potato, Shinzami, as affected by steaming and baking. Food Chem. 130: 966–972.
7 cooking and baking on the content of anthocyanins in coloured-flesh potatoes. Food Chem. 133: 1107–1116.
Lamberti M, Geiselman A, Conde-Petit B, Escher F. 2004. Starch transformation and structure development in production and reconstitution of potato flakes. Lebensm.-Wiss. u.-Technology 37: 417– 427.
Lee J, Durst W, Wrolstad RE. 2005. Determination of total monomeric anthocyanin pigment content of fruit juices, beverages, natural colorants, and wines by the pH differential method: Collaborative study. J AOAC Int 88: 1269–1278.
Lim S. 2012. Anthocyanin-enriched Purple Sweet Potato for Colon Cancer Prevention [Disertasi]. Kansas: Department of Human Nutrition, Kansas State University Manhattan.
Março PH, Poppi RJ, Scarminio IS, Tauler R. 2011. Investigation of the pH effect and UV radiation on kinetic degradation of anthocyanin mixtures extracted from Hibiscus acetosella. Food Chem 125: 1020–1027. DOI: 10.1016/j.foodchem.2010.10.005
Marpaung AM. 2012. Optimasi Proses Ekstraksi Antosianin Pada Bunga Teleng (Clitoria ternatea L.) dengan Metode Permukaan Tanggap [Tesis]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Montilla EC, Hillebrand S, Winterhalter P. 2011. Anthocyanins in Purple Sweet Potato (Ipomoea batatas L.) Varieties. Fruit, Vegetable and Cereal Science and Biotechnology 5 (Special Issue 2), 19-24.
Odake K, Terahara N, Saito N, Toki K, Honda T. 1992. Chemical structures of two anthocyanins from purple sweet potato, Ipomoea batatas. Phytochemistry 31: 2127-2130.
Pedisic S, Dragovi-Uzelac V, Levaj B, Skevin D. 2010. Effect of Maturity and Geographical Region on Anthocyanin Content of Sour Cherries (Prunus cerasus var. marasca). Food Technol Biotechnol 48 (1): 86–93.
Reyes LF, Miller JC, Cisneros-Zevallos L. 2004. Environmental conditions influence the content and yield of anthocyanins and total phenolics in purple- and red-flesh potatoes during tuber development. Am J Potato Res 81: 187–193.
Reyes LF, Cisneros-Zevallos L. 2007. Degradation kinetics and colour of anthocyanins in aqueous extracts of purple and red-flesh potatoes (Solanum
tuberosum L.). Food Chem 100: 885–894.
DOI:10.1016/j.foodchem.2005.11.002
Ruenroengklin N, Zhong J, Duan J, Yang B, Li J, Jiang Y. 2008. Effects of various temperatures and pH values on the extraction yield of phenolics from litchi fruit pericarp tissue and the antioxidant activity of the extracted anthocyanins. Int J Mol Sci 9: 1333-1341. DOI: 10.3390/ijms9071333 Sancho RAS, Pastore GM. 2012. Evaluation of the effects of anthocyanins in type
2 diabetes. Food Res Int 46: 378–386. DOI: 10.1016/j.foodres.2011.11.021. Sari P, Wijaya CH, Sajuthi D, Supratman U. 2012. Colour properties, stability,
and free radical scavenging activity of jambolan (Syzygium cumini) fruit anthocyanins in a beverage model system: Natural and copigmented
anthocyanins. Food Chem 132: 1908–1914.
8
Takahata Y, Kai Y, Tanaka M, Nakayama H, Yoshinaga M. 2011. Enlargement of the variances in amount and composition of anthocyanin pigments in sweetpotato storage roots and their effect on the differences in DPPH radical-scavenging activity. Sci Hortic-Amsterdam 127: 469–474. doi:10.1016/j.scienta.2010.10.010
Terahara N, Konczak I, Ono H, Yoshimoto M, Yamakawa O. 2004. Characterization of acylated anthocyanins in callus induced from storage root of purple-fleshed sweet potato, Ipomoea batatas L. J Biomed Biotechnol 2004: 279-286.
Torskangerpoll K, Andersen OM. 2005. Colour stability of anthocyanins in queous solutions at various pH values. Food Chem 89(3): 427–440. DOI:10.1016/j.foodchem.2004.03.002.
Truong VD, Deighton N, Thompson RT, McFeeters RF, Dean LO, Pecota KV, Yencho GC. 2010. Characterization of anthocyanins and anthocyanidins in purple-fleshed sweetpotatoes by HPLC-DAD/ESI-MS/MS. J Agr Food Chem 58: 404–410. DOI:10.1021/jf902799.
Truong VD. Hua Z, Thompson RL, Yencho GC, Pecota KV. 2012. Pressurized liquid extraction and quantification of anthocyanins in purple-fleshed sweet potato genotypes. J Food Compos Anal 26 : 96–103. DOI: 10.1016/j.jfca.2012.03.006.
Tsukui A, Murakami T, Shiina R, dan Hayashi K. 2002. Effect of alcoholic fermentation on the stability of purple sweet potato anthocyanins. Food Sci Technol Res. 8: 4-7.
Van Oirschot QEA, Ress D, Aked J. 2003. Sensory characteristics of five sweet potato cultivars and their changes during storage under tropical conditions. Food Qual Prefer. 14, 673–680.
9
2
KARAKTERISTIK WARNA, AKTIVITAS ANTIOKSIDAN
DAN STABILITAS EKSTRAK ANTOSIANIN UBI JALAR
UNGU
1ABSTRACT
Anthocyanin is a natural pigment with color varying from red, purple, blue to yellow. The stability of its anthocyanin color is affected by pH, temperature and light. Purple sweet potato is rich in anthocyanin, particularly a stable acylated anthocyanin. This research was conducted to study the effect of pH on color and antioxidative activity of anthocyanin extracted from purple sweet potatoes harvested from Cilembu-Sumedang, Banjaran-Bandung and Pakembangan-Kuningan. The results showed that the total number of monomeric anthocyanin in purple sweet potato harvested from Cilembu was higher than that of Banjaran and Pakembangan. The color of purple sweet potato anthocyanin extract was pH dependent. The color changed from red, faded red, purple, blue, green and yellow along with the increase of pH from 1 to 14. The content of anthocyanin from three locations of purple sweet potatoes differed from each other (P<0.05). Radical scavenging activity and reducing power of purple sweet potato anthocyanins extract at pH 1 was higher than that at pH 4.5 and pH 7. Stability of extract anthocyanin at pH 7 was lowest than that at pH 4.5 and pH 1.
Keywords: anthocyanin, antioxidant activity, purple sweet potato
ABSTRAK
Antosianin merupakan pewarna alami dengan warna bervariasi dari merah, ungu, biru, dan kuning tergantung nilai pH-nya. Stabilitas warna antosianin dipengaruhi pH, suhu dan cahaya. Ubi jalar ungu mengandung antosianin terasilasi yang bersifat stabil. Penelitian ini dilakukan untuk mempelajari pengaruh pH pada warna, dan aktivitas antioksidan ekstrak antosianin ubi jalar ungu yang dibudidayakan di Cilembu - Sumedang; Banjaran - Bandung; dan Pakembangan - Kuningan. Hasil penelitian menunjukkan bahwa jumlah total antosianin monomer dalam ekstrak antosianin ubi jalar ungu yang dibudidayakan di Cilembu (3.78 ± 0.08 mg setara sianidin-3-glukosida/g berat kering, bk); dan lebih tinggi dibandingkan dari Banjaran (3.18 ± 0.01mg/g bk) dan lebih tinggi dibandingkan dari Pakembangan (2.25 ± 0.01 mg/g bk). Jumlah antosianin dari ubi jalar ungu yang berasal dari tiga lokasi berbeda secara nyata (p<0.05). Warna ekstrak antosianin ubi jalar ungu berubah dari merah, merah pudar, ungu, biru, hijau dan kuning seiring dengan meningkatnya pH dari 1 sampai 14. Aktivitas penangkapan radikal bebas dan kekuatan mereduksi ekstrak antosianin ubi jalar ungu pada pH 1 lebih tinggi dibandingkan pada pH 4.5 dan pH 7. Stabilitas ekstrak antosianin pada pH 7 adalah yang paling rendah dibandingkan pada pH 4.5 dan pH 1.
Kata Kunci : aktivitas antioksidan, antosianin, ubi jalar ungu.
1
10
PENDAHULUAN
Antosianin merupakan komponen aktif kelompok flavonoid yang dapat memberikan warna merah, ungu, biru, pada bunga, daun, umbi, buah dan sayur (Torskangerpoll dan Andersen, 2005; Burdullis et al. 2009; Jensen et al. 2011). Antosianin larut dalam air dan aman untuk dikonsumsi, sehingga umumnya digunakan sebagai pewarna alami untuk produk makanan dan minuman (Chiste et al. 2010). Antosianin memiliki fungsi yang baik untuk kesehatan seperti mencegah risiko kanker usus kolon (Lim, 2012), kanker hati (Choi et al. 2011). Antosianin juga diketahui sebagai antidiabetes (Sancho dan Pastore, 2012) dan antioksidan (Takahata et al. 2011; Jiao et al. 2012). Sifat antosianin, termasuk perubahan warna, dan aktivitas antioksidan dipengaruhi oleh pH dan struktur dari antosianin (Marco et al. 2011).
Struktur antosianin berubah pada pH 1, pH 4.5 dan pH 7 (Lee et al. 2005). Aktivitas antioksidan antosianin dari bunga teleng dan ekstrak lowbush blueberry tertinggi adalah pada pH 1, diikuti oleh pH 4.5 dan 7 (Marpaung, 2012). Berbagai macam sayur, buah, bunga, dan umbi sudah ditemukan mengandung antosianin seperti kubis merah (Wiczkowsi et al. 2013), kulit leci (Ruenroengklin et al. 2008) beras hitam, paria, paprika, kulit bawang, kulit anggur, mulberry, buah bit, (Boo et al. 2012), rosella (Duangmall et al. 2008), buah duwet (Sari et al. 2012), bunga teleng (Marpaung 2012) dan ubi jalar ungu (Jiao et al. 2012).
Ubi jalar mudah dibudidayakan, dapat tumbuh pada berbagai macam jenis tanah, produktifitasnya tinggi, dengan masa tanam yang relatif pendek, 3-6 bulan, dan membutuhkan pupuk yang sedikit (George et al. 2011). Tempat budidaya ubi jalar ungu di Jawa Barat diantaranya Cilembu-Sumedang, Banjaran-Bandung, dan Pakembangan-Kuningan. Ketiga tempat ini memiliki karakteristik geografis dan iklim yang relatif berbeda. Desa Cilembu-Sumedang memiliki ketinggian wilayah 600 m di atas permukaan laut (dpl), suhu rata-rata 28 oC. Desa Banjaran Bandung 650 m dpl, suhu udara rata-rata 29 oC. Desa Pakembangan Kuningan ketinggian 400 m dpl, suhu rata-rata 31 oC. Beberapa peneliti sebelumnya menemukan bahwa letak geografis tempat tumbuh dan suhu lingkungan tumbuh mempengaruhi kandungan total antosianin kentang (Reyes et al. 2004; Brown et al. 2008), bilberries (Burdullis et al. 2007), ceri (Pedisic et al. 2010), dan kedelai (Kim et al. 2014).
Belum ditemukan penelitian yang mengkaji karakteristik warna dan aktivitas antioksidan ekstrak antosianin ubi jalar ungu pada pH 1, 4.5 dan 7. Penelitian mengenai ubi jalar ungu yang sudah dilakukan peneliti sebelumnya diantaranya adalah optimasi ekstraksi antosianin (Huang et al. 2010, Truong et al. 2012), identifikasi jumlah monomer antosianin (Terahara et al. 2004, Truong et al. 2010), stabilitas antosianin (Cevallos-Casals dan Cisneros-Zevallos, 2004, Jie et al. 2013), aktivitas antioksidan (Kano et al. 2005,Takahata et al. 2011, Jiao 2012), mencegah kanker usus (Lim, 2012), pengaruh pengolahan terhadap kadar antosianin (Burgos et al. 2013).
11
BAHAN DAN METODE
Bahan
Ubi jalar ungu varietas Ayamurasaki telah diverifikasi karakteristik taksonominya di Balai Penelitian Tanaman Aneka Kacang dan Umbi (Balitkabi), Malang, diperoleh dari Petani di Cilembu-Sumedang, Banjaran-Bandung dan Pakembangan-Kuningan dengan masa tanam 5 bulan (November 2012 – April 2013). Bahan kimia pro-analis metanol, KCl, CH3COONa, NaOH, HCl,
1.1-diphenil-2-picrylhydrazyl (DPPH), L-ascorbic acid, kuersetin dari Sigma-Aldrich. Dalam penelitian ini dilakukan dua kali ulangan dan tiga kali pengukuran.
Persiapan sampel
Ubi jalar ungu dari tiga lokasi tumbuh (Cilembu-Sumedang, Banjaran-Bandung dan Pakembangan-Kuningan.) dibersihkan, dicuci dengan air mengalir, kemudian dibuang kulitnya dengan menggunakan pengupas abrasif. Ubi jalar selanjutnya dipotong dengan pisau baja tahan karat. Ubi jalar dipotong dengan panjang ± 3 cm, kemudian masing-masing potongan dibelah empat. Terhadap sampel dilakukan blanching dengan menggunakan steam blancher selama 7 menit. Sampel selanjutnya dihancurkan dan dibekukan pada suhu -27oC.
Ekstraksi antosianin (Modifikasi Huang et al. 2010)
Sebanyak 1g sampel beku disuspensikan dalam 32 mL larutan asam-metanol 15 % HCl (HCl, 1.5 M di dalam asam-metanol). Suspensi diaduk dalam alat penangas air goyang pada suhu 50 oC selama 60 menit. Suspensi sampel disentrifusi pada kecepatan 4042.7 g selama 15 menit. Supernatan dipisahkan dan disaring dengan kertas saring Whatman no. 1. Endapan diekstrak kembali dengan larutan asam-metanol 15% sebanyak dua kali lagi, kemudian supernatan dikumpulkan dalam botol berkaca gelap. Supernatan diuapkan dengan evaporator putar pada suhu 40oC sampai diperoleh ekstrak antosianin pekat. Volume ekstrak antosianin yang diperoleh adalah 4-6.5 mL, kemudian disimpan dalam botol gelap pada suhu -27oC sampai digunakan untuk analisis.
Analisis antosianin monomerik (Lee et al. 2005)
12
Karakterisasi spektra warna antosianin pada berbagai pH (Cevallos - Casals dan Cisneros-Zevallos, 2004)
Spektra warna sampel antosianin diukur pada kisaran pH 1-14. Setiap 7.35 mg/L ekstrak antosianin ubi jalar ungu disiapkan pada pH 1-14 dengan cara 1 mL sampel dimasukkan kedalam labu takar 5 mL kemudian ditambahkan 4 mL larutan buffer kalium klorida (0.025 M) untuk pH 1-4, dan buffer natrium asetat (0.4 M) untuk pH 5-14. Pengaturan pH dilakukan dengan penambahan larutan NaOH (0.5 M, 2 M atau 16 M) atau HCl 1.5 M. Sampel disimpan di ruang tertutup pada suhu kamar selama 60 menit untuk kemudian dilakukan pengukuran spektra pada panjang gelombang 200-700 nm.
Analisis aktivitas penangkapan radikal DPPH (Jiao et al. 2012)
Sebanyak 2 µL ekstrak antosianin (7.35 mg/L) dimasukkan ke dalam tabung reaksi kemudian ditambahkan 2 mL DPPH 0.2 µM dalam etanol, kemudian divorteks. Larutan didiamkan di dalam ruang gelap selama 30 menit. Larutan segera diukur penyerapan sinarnya dengan spektrofotometer UV-Vis pada panjang gelombang 517 nm. Sebagai kontrol digunakan larutan DPPH tanpa sampel dan tanpa standar. Untuk pembuatan kurva standar digunakan asam askorbat atau kuersetin dengan konsentrasi bertingkat 6.25 ppm, 12.5 ppm, 25 ppm, 50 ppm, 75 ppm, dan 100 ppm. Aktivitas penangkapan terhadap radikal DPPH dinyatakan sebagai sebagai % penghambatan terhadap radikal DPPH. Persen penghambatan dihitung dengan rumus :
Ao = absorbans tanpa penambahan sampel/standar
As = absorbans dengan penambahan sampel/standar
Analisis kekuatan mereduksi besi (III) sianida (Jiao et al. 2012)
Sebanyak 1 mL sampel (7.35 mg/L) dicampur dengan 3.0 mL 0.5 M buffer fosfat (pH 6.6) dan 2.5 mL 1% kalium besi (III) sianida diinkubasi pada suhu 50oC selama 20 menit. Sebanyak 2.5 mL asam trikloro asetat (10% b/v) ditambahkan ke dalam campuran untuk memberhentikan reaksi, kemudian disentrifus pada kecepatan 2274 g selama 10 menit. Sebanyak 1 mL supernatan ditambah dengan 1 mL air destilasi dan 0.2 mL 0.1% (b/v) FeCl3. Campuran
larutan didiamkan 10 menit, kemudian diukur penyerapan sinarnya dengan spektrofotometer UV-Vis pada panjang gelombang 700 nm. Kekuatan mereduksi ditandai dengan meningkatnya penyerapan sinar.
Pengaruh pH terhadap Stabilitas Warna Antosianin Selama Penyimpanan
13 sinar sampel diukur setiap 2 hari selama 10 hari untuk penyimpanan suhu 4oC dan untuk penyimpanan pada suhu ruang penyerapan sinarnya diukur setiap hari selama 7 hari.
t = waktu; At = absorbans setelah perlakuan waktu t; Ao = absorbans sebelum
perlakuan (waktu 0) (Cevallos-Casals dan Cisneros-Zevallos 2004)
Analisis statistik
Data hasil pengujian dianalisis secara statistik dengan menghitung nilai rata-rata dan standar deviasi dengan Microsoft Office Excel 2010. Semua data yang diperoleh ditampilkan dalam bentuk nilai rerata ± standar deviasi. Data dianalisis sidik ragamnya (ANOVA), kemudian dihitung nilai bedanya dengan uji beda Duncan pada taraf 5% (p<0.05) dengan menggunakan aplikasi SPSS 16.
HASIL DAN PEMBAHASAN Antosianin monomerik
Kandungan total antosianin monomerik ekstrak ubi jalar ungu Cilembu, Banjaran dan Pakembangan berturut-turut adalah 3.78 ± 0.08; 3.18 ± 0.01; dan 2.25 ± 0.01 mg (CyE)/g (bk). Secara nyata total antosianin monomerik berbeda (p<0.05) diantara daerah asal tanam. Antosianidin yang dominan di dalam ubi jalar ungu adalah sianidin yang dominan memberikan warna biru, dan peonidin yang dominan memberikan warna merah. Antosianin yang dominan pada ubi jalar ungu varietas Ayamurasaki berupa peonidin-3-(6‖ caffeol) -sophorosida-5-glukosida (Suda et al. 2003).
Kandungan total antosianin monomerik ini berbeda dengan penelitian yang dilaporkan sebelumnya, yaitu berkisar 0-6.63 mg/g (bk) dari 335 genotip ubi jalar (Truong et al. 2012), 1.88 mg sianidin-3-glukosida/g tepung ubi jalar Ayamurasaki (Husnah 2010), dan 1.38 mg/g (bk) dalam ubi jalar ungu (Jiao et al. 2012). Perbedaan ini disebabkan perbedaan varietas, tempat dan lingkungan tumbuh (Burdullis et al. 2007; Pedisic et al., 2010).
Jumlah antosianin monomerik ubi jalar ungu yang dibudidayakan di Cilembu-Sumedang adalah yang paling tinggi dibandingkan dengan jumlah antosianin monomerik ubi jalar ungu yang dibudidayakan di Banjaran-Bandung dan Pakembangan-Kuningan. Rata-rata suhu lingkungan di Cilembu-Sumedang lebih rendah (28oC) dibandingkan suhu lingkungan di Banjaran-Bandung (29oC) dan Pakembangan-Kuningan (31oC). Suhu lingkungan merupakan salah satu faktor yang mempengaruhi biosintesis antosianin disamping faktor intensitas cahaya, curah hujan, dan kandungan hara tanah (Reyes et al. 2004, Pedisic et al. 2010, Kim et al. 2014).
14
Menurut Brown et al. (2008) semakin tinggi dataran tempat tumbuh semakin tinggi kandungan antosianinnya. Kumar et al. (2013) melaporkan iklim dan tempat tumbuh mempengaruhi komponen bioaktif dan aktivitas antioksidan dari tapak dara (Catharanthus roseus). Hasil yang berbeda dilaporkan oleh Jansen dan Flamme (2006) yang menunjukkan bahwa lokasi tempat tumbuh kentang tidak berpengaruh terhadap kandungan antosianin kentang, tetapi antosianin lebih dipengaruhi oleh faktor genotif
Warna ekstrak antosianin
Pola warna ekstrak antosianin ubi jalar ungu yang dibudidaya pada tiga daerah yang berbeda yaitu Cilembu-Sumedang, Banjaran-Bandung, dan Pakembangan-Kuningan, pada pH 1-14 menunjukkan pola warna yang sama. Warna ekstrak antosianin cenderung berubah seiring dengan kenaikan pH 1-14 dari warna merah, ungu, biru, hijau sampai kuning (Gambar 1).
Gambar 1. Warna ekstrak antosianin pada pH 1-14
Ekstrak antosianin ubi jalar ungu pada pH asam kuat 1-3 berwarna merah, pada asam lemah pH 4-6 berwarna ungu, pH 7 berwarna biru, pada pH basa lemah 8-9 berwarna hijau, dan pada pH 10, 11, 12, 13 dan 14 berwarna kuning. Hasil penelitian Cevallos – Casals dan Cisneros Zevallos (2004), menunjukkan warna ekstrak antosianin ubi jalar merah pada pH 0.9 sampai pH 4 berwarna merah, pada pH 5 sampai 7 berwarna ungu, pada pH 8 dan pH 9 berwarna biru, dan pada pH 10.7 dan 11.7 berwarna hijau. Warna ekstrak antosianin bunga teleng pada pH 1 dan pH 2 berwarna merah, pada pH 3 berwarna ungu, pada pH 4 sampai pH 9 berwarna biru, pada pH 10 sampai pH 12 berwarna hijau dan pada pH 13, dan pH 14 berwarna kuning (Nikijuluw 2013). Perbedaan pola warna ubi jalar ungu dan bunga teleng, dikarenakan berbeda senyawa penyusunnya. Antosianin dominan
12
1 2 3 4 5 6 7 8 9 10 11 13 14
Cilembu
1 2 3 4 5 6 7 8 9 10 11 12 13 14
Banjaran
13
1 2 3 4 5 6 7 8 9 10 11 12 14
15 pada ubi jalar ungu adalah 3-sophorosida-5-glukosida turunan peonidin dan sianidin (Montilla et al.2011) sedangkan senyawa antosianin dominan bunga teleng adalah ternatin A1 (Terahara et al. 1990).
Pada dasarnya, perubahan warna ekstrak antosianin ubi jalar ungu seiring dengan naiknya pH dikarenakan adanya perubahan struktur antosianin dari kation flavilium menjadi pseudobasa hemiketal karbinol, kuinonoidal atau kalkon (Brouillard 1982, Reyes dan Cisneros-Zevallos 2007, Marco et al. 2011). Perubahan struktur antosianin akibat perubahan pH (Marco et al. 2011) yang kemudian dijadikan rujukan untuk memperkirakan perubahan struktur antosianin ubi jalar ungu peonidin-3-(6‖-kaffeol)-sophorosida-5-glukosida (Suda et al. 2003) karena pengaruh pH ditunjukkan pada Gambar 2.
Gambar 2. Perkiraan perubahan struktur peonidin-3-(6’’ -kaffeol)-sophorosida-5-glukosida karena pH (Suda et al. 2003, Marco et al. 2011)
16
Marco et al. (2011) menyatakan bahwa pada pH 1-2 antosianin dominan dalam bentuk kation flavilium yang berwarna merah, pada pH < 6 berubah menjadi karbinol dan sebagian menjadi kuinonoidal yang berwarna biru, pada pH 6.5-9 dominan kuinonoidal yang berwarna biru, dan pada pH >9 antosianin dominan dalam struktur kalkon yang berwarna kuning (Gambar 2). Warna ekstrak antosianin pada pH 1-7 relatif memiliki warna yang berbeda yaitu merah, ungu dan biru (Gambar 1). Warna ekstrak antosianin pada berbagai pH adalah sebagai berikut: pH 1-2 (merah), pH 3 (merah memudar), pH 4 (merah keunguan), pH 5-6 (ungu), dan pH 7 (ungu biru). Menurut Brouillard (1982) antosianin berubah warna dari merah, menjadi berkurang warnanya pada asam lemah. Pada pH rendah antosianin berada dalam bentuk kation flavilium yang merupakan bentuk paling stabil (pH 1-2). Pada pH 3 kation flavilium ada yang berubah menjadi karbinol yang tidak berwarna sehingga muncul warna merah pudar. Pada pH>3 warna merah terang kation flavilium kemudian berubah bentuk menjadi basa kuinonoidal yang berwarna biru atau menjadi karbinol pseudobase yang tidak berwarna sejalan dengan naiknya pH sampai pH 7.
Spektra ekstrak antosianin
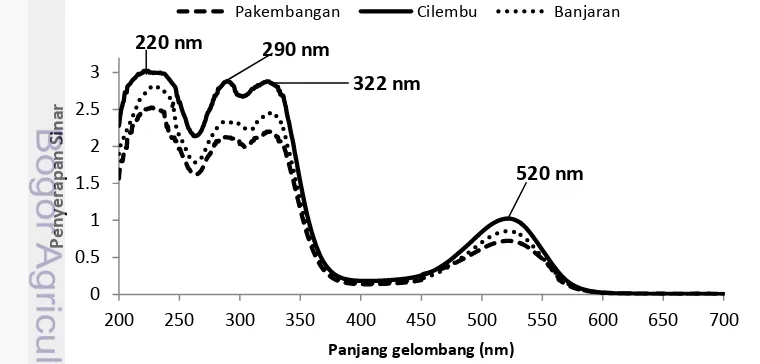
Spektrum penyerapan sinar dari ketiga esktrak antosianin menunjukkan pola spektra yang sama yaitu memiliki empat puncak penyerapan sinar maksimum pada empat panjang gelombang yang berbeda 220 nm, 290 nm, dan 322 nm pada kisaran sinar ultraviolet dan 520 nm pada kisaran sinar tampak (Gambar 3). Peneliti sebelumnya menemukan ekstrak antosianin bunga teleng memiliki 4 absorbansi maksimum yaitu pada panjang gelombang 264 nm, 287 nm, 574 nm dan 519 nm (Marpaung, 2012). Jika dihubungkan dengan struktur antosianin pada Gambar 2, penyerapan pada kisaran ultra violet 250-275 nm terkait dengan penyerapan cincin A pada struktur antosianin. Penyerapan pada kisaran sinar tampak 465-560 nm terkait dengan penyerapan cincin B dan C (Delgado-Vargas et al. 2000).
Gambar 3. Spektra ekstrak antosianin ubi jalar ungu pada pH 1 0
200 250 300 350 400 450 500 550 600 650 700
17
Penyerapan sinar ekstrak ubi jalar ungu pada panjang gelombang 322 nm adalah tiga kali lebih besar (300%) dari penyerapan sinar pada panjang gelombang maksimum sinar tampak, menunjukkan adanya antosianin terasilasi. Peneliti sebelumnya Cevallos-Casals dan Cisneros-Zevallos (2004) menemukan penyerapan sinar ekstrak ubi jalar merah pada panjang gelombang 330 nm adalah tiga kali lebih besar (391%) dari penyerapan sinar pada panjang gelombang maksimum sinar tampak, menunjukkan adanya antosianin terasilasi oleh gugus asil asam aromatik.
Sebelumnya ditemukan ubi jalar merah banyak mengandung turunan dari asilasi sianidin dan peonidin 3-glukosida (Truong et al. 2010). Jie et al. (2013) menemukan bahwa komponen utama antosianin ubi jalar ungu kultivar Jihei No. 1 adalah 3-sophorosida-5-glukosida turunan dari sianidin dan peonidin yang diasilasi dengan asam p-hidroksibenzoat, asam ferulat, atau asam kafeat.
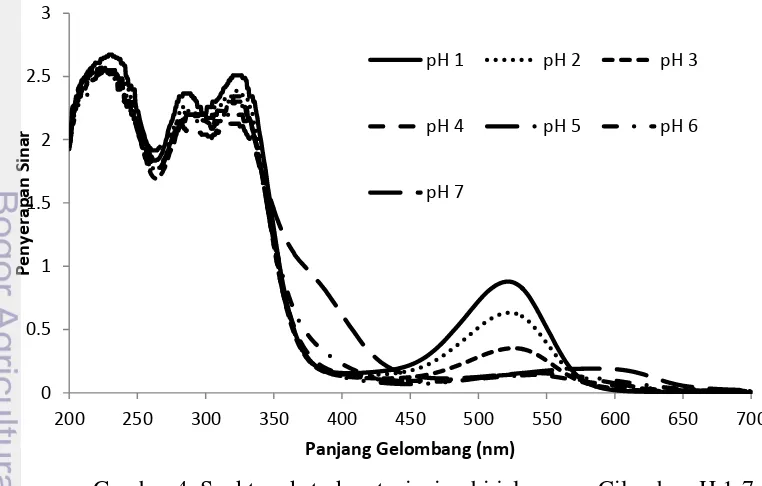
Spektra ekstrak antosianin pada pH 1-7
Spektra ekstrak antosianin mengalami pergeseran (shifting) sejalan dengan perubahan pH. Gambar 4 menunjukkan spektra ekstrak antosianin ubi jalar Cilembu pada pH 1-7. Pada pH 1-3 antosianin memiliki puncak penyerapan sinar maksimum pada kisaran panjang gelombang 520-525 nm. Dengan meningkatnya pH hingga mencapai pH 3, pergeseran hipokromik (hypochromic shift) terjadi dimana penyerapan maksimumnya menurun. Perubahan spektra ini adalah karena perubahan struktur antosianin dari bentuk kation flavilium menjadi hemiketal atau kuinonoidal (Brouillard 1982). Jika pH dinaikkan dari pH 4 ke pH 7 terjadi pergeseran batokromik (bathocromic shift) dari kisaran panjang gelombang 520 -525 (pH 3) ke panjang gelombang 535 nm (pH 4), 540 nm (pH 5), 582 nm (pH 6) dan 590 nm (pH 7).
Gambar 4. Spektra ekstrak antosianin ubi jalar ungu Cilembu pH 1-7 0
0.5 1 1.5 2 2.5 3
200 250 300 350 400 450 500 550 600 650 700
Pen
y
e
rap
an
Si
n
ar
Panjang Gelombang (nm)
pH 1 pH 2 pH 3
pH 4 pH 5 pH 6
18
Spektra ekstrak antosianin pada pH 8-14
Pola spektra ekstrak antosianin pada pH 8-14 mempunyai pola yang relatif berbeda dengan pH 1-7. Pada pH 8-9 penyerapan sinar terjadi pada panjang gelombang antara 600-630 nm (Gambar 5). Pada Gambar 5 dapat dilihat, pada pH 8-11 antosianin memiliki puncak penyerapan sinar maksimum pada kisaran panjang gelombang 350-400 nm. Semakin naik pH dari 8 sampai pH 11, terjadi pergeseran hiperkromik (hyperchromic shift), yaitu penyerapan maksimumnya meningkat. Begitu juga pada pH 12 sampai pH 14, terjadi pergeseran hipokromik (hypochromic shift), yaitu penyerapan maksimumnya menurun. Perubahan spektra terjadi karena perubahan struktur antosianin dari bentuk kuinonoidal menjadi kalkon (Brouillard 1982). Jika pH dinaikkan dari pH 11-14 terjadi pergeseran hipsokromik (hypsocromic shift) dari kisaran panjang gelombang 365 (pH 11) ke panjang gelombang 355 (pH 12), 353 nm (pH 13), dan 350 nm (pH 14).
Gambar 5. Spektrum antosianin ubi jalar ungu Cilembu pH 8-14
Aktivitas antioksidasi ekstrak antosianin
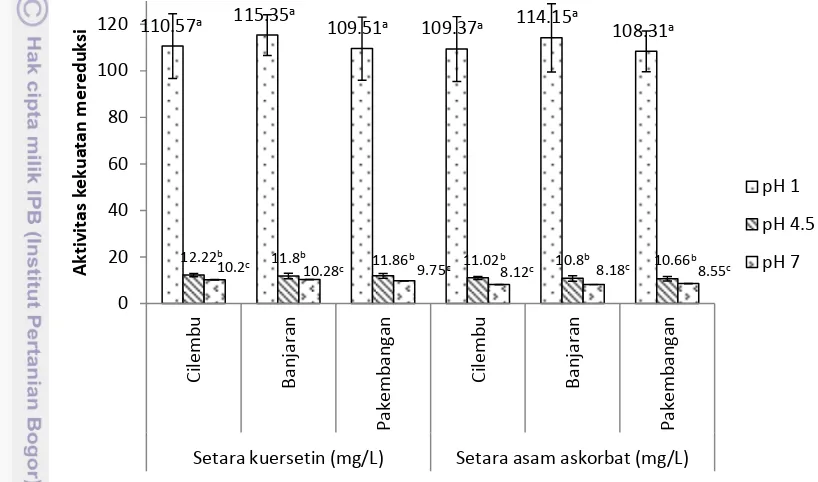
Pengujian aktivitas antioksidasi ekstrak antosianin dilakukan terhadap ekstrak ubi jalar ungu pada pH 1, 4.5 dan 7. Pengujian aktivitas antioksidasi ekstrak antosianin dilakukan dengan metode penangkapan radikal bebas DPPH dan analisa kekuatan mereduksi besi (III) sianida. Antioksidan sebagai standar digunakan kuersetin dan asam askorbat, sehingga hasil penelitian ini dinyatakan sebagai setara kuersetin dan setara asam askorbat.
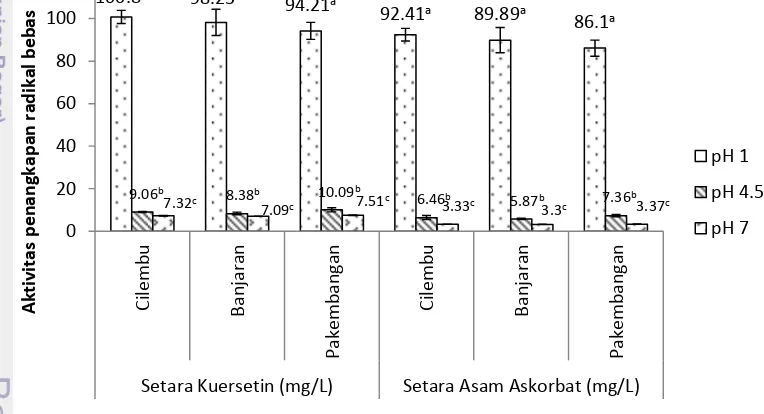
Aktivitas penangkapan radikal bebas DPPH ekstrak antosianin ubi jalar ungu dari Cilembu, Banjaran, dan Pakembangan tidak berbeda nyata (p>0.05). Gambar 6 menunjukkan bahwa aktivitas penangkapan radikal bebas DPPH ekstrak antosianin dipengaruhi oleh pH. Aktivitas penangkapan radikal bebas
0 0.5 1 1.5 2 2.5 3
200 250 300 350 400 450 500 550 600 650 700
Pen
y
e
rap
an
Si
n
ar
Panjang Gelombang (nm)
pH 8 pH 9 pH 10 pH 11
19 DPPH ekstrak antosianin ubi jalar ungu tertinggi pada pH 1, diikuti oleh aktivitas penangkapan radikal bebas DPPH pada pH 4.5 dan pH 7. Hasil ini sejalan dengan penelitian sebelumnya yang menemukan aktivitas antioksidan ekstrak lowbush blueberry (Kalt et al. 2000), ekstrak bunga teleng (Marpaung 2012) lebih tinggi pada pH 1 dan diikuti oleh pH 4.5 dan pH 7. Hasil penelitian ini berbeda dengan yang dilaporkan oleh Ruenroengklin et al. (2008) yang menunjukkan bahwa aktivitas penangkapan radikal bebas DPPH ekstrak antosianin kulit litchi pada pH 3-5 jauh lebih tinggi dibandingkan dengan pH 1 dan 7.
Antosianin dari ubi jalar ungu mempunyai aktivitas penangkapan radikal bebas DPPH mendekati kemampuan penangkapan radikal bebas dari asam askorbat (Terahara et al. 2004, Jiao et al. 2012). Hasil penelitian ini menunjukkan konsentrasi ekstrak antosianin ubi jalar ungu dari Cilembu 7.35 ppm pada pH 1, 4.5, dan 7 memiliki aktivitas penangkapan radikal bebas DPPH setara dengan kuersetin secara berurutan 100.8 mg/L, 9.06 mg/L dan 7.32 mg/L. Konsentrasi ekstrak antosianin ubi jalar ungu dari Banjaran 7.35 mg/L pada pH 1, 4.5, dan 7 memiliki aktivitas penangkapan radikal bebas DPPH setara dengan kuersetin secara berurutan 98.23 mg/L, 8.38 mg/L dan 7.09 mg/L. Konsentrasi ekstrak antosianin ubi jalar ungu dari Pakembangan 7.35 mg/L pada pH 1, 4.5, dan 7 memiliki aktivitas penangkapan radikal bebas DPPH setara dengan kuersetin secara berurutan 94.21 mg/L, 10.09 mg/L dan 7.51 mg/L.
Gambar 6. Aktivitas penangkapan radikal bebas DPPH ekstrak antosianin ubi jalar ungu (konsentrasi 7.35 mg/L). Notasi berbeda dalam kelompok
menunjukkan kedua nilai berbeda signifikan (P<0.05)
Pengujian kekuatan mereduksi dilakukan terhadap ekstrak ubi jalar ungu pada pH 1, 4.5 dan 7. Sebagai standar kekuatan mereduksi digunakan kuersetin dan asam askorbat, sehingga hasil penelitian ini dinyatakan sebagai setara kuersetin dan setara asam askorbat. Kekuatan mereduksi ekstrak antosianin ubi jalar ungu dari Cilembu, Banjaran, dan Pakembangan tidak berbeda nyata
Setara Kuersetin (mg/L) Setara Asam Askorbat (mg/L)
20
dipengaruhi oleh pH. Kekuatan mereduksi ekstrak antosianin ubi jalar ungu tertinggi pada pH 1, diikuti oleh kekuatan mereduksi pada pH 4.5 dan pH 7. Hasil ini sejalan dengan temuan peneliti sebelumnya yang menemukan kekuatan mereduksi antosianin ekstrak ubi jalar ungu (Jiao et al. 2012), dan antosianin kulit leci (Duan et al. 2007) lebih besar dibandingkan kekuatan mereduksi asam askorbat. Antosianin yang dominan pada pH 1 adalah kation flavilium, sehingga lebih mudah mendonorkan elektron dibandingkan karbinol (pH 4.5) dan kuinonoidal (pH 7).
Gambar 7. Aktivitas kekuatan mereduksi ekstrak antosianin ubi jalar ungu (konsentrasi 7.35 mg/L). Notasi berbeda pada satu kelompok menunjukkan kedua
nilai berbeda signifikan (P<0.05)
Stabilitas Ekstrak Antosianin terhadap pH
Pengujian stabilitas ekstrak antosianin ubi jalar ungu dilakukan pada pH 1, 4.5 dan 7 selama disimpan 10 hari pada suhu 4oC dan 7 hari pada suhu ruang. Pertimbangan pH 1, 4.5 dan 7 yang digunakan dalam uji stabilitas ini karena pH tersebut merupakan titik kritis terjadinya perubahan struktur antosinin dari flavilium, hemiketal/pseudobase, dan kuinonoidal (Lee et al. 2005). Konsentrasi ekstrak antosianin yang digunakan untuk pengujian stabilitas terhadap pH adalah 7.35 mg/L. Pola warna ekstrak antosianin pada pH 1, 4.5 dan 7 untuk ekstrak antosianin ubi jalar ungu dari Cilembu, Banjaran dan Pakembangan memiliki pola warna yang sama yaitu merah pada pH 1, ungu pada pH 4.5 dan biru pada pH 7 (Gambar 8). Warna ekstrak antosianin ubi jalar ungu relatif lebih stabil disimpan pada suhu rendah, dan pada pH 1 dari pada pH 4.5, dan 7 dan disimpan pada suhu ruang.
110.57a 115.35a 109.51a 109.37a 114.15a 108.31a
12.22b 11.8b 11.86b 11.02b 10.8b 10.66b
Setara kuersetin (mg/L) Setara asam askorbat (mg/L)
21
Gambar 8. Warna ekstrak antosianin ubi jalar ungu selama penyimpanan 10 hari pada suhu 4 oC dan 7 hari pada suhu ruang
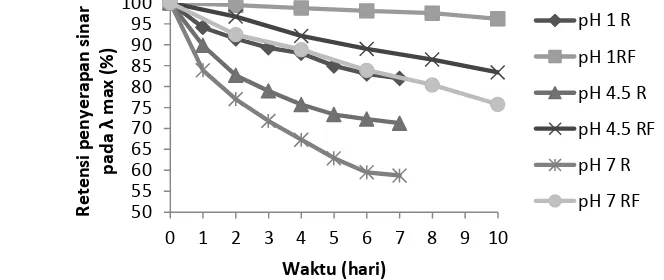
Stabilitas warna antosianin dipengaruhi oleh pH yang dapat menyebabkan reaksi protonasi atau reaksi hidrasi sehingga terjadi perubahan struktur antara kation flavilium berwarna merah, kuinonoidal berwarna biru, karbinol pseudobase yang tidak berwarna dan kalkon yang berwarna kuning (Mazza dan Brouillard 1987). Warna ekstrak antosianin ubi jalar ungu pada pH 1 tetap merah selama percobaan baik disimpan pada suhu ruang, maupun disimpan pada suhu dingin. Warna ekstrak antosianin yang terlihat berubah banyak adalah pada pH 7, diawal penelitian berwarna biru, dan diakhir penelitian berwarna hijau kekuningan baik ekstrak antosianin yang disimpan pada suhu ruang maupun yang disimpan pada suhu dingin. Karakteristik warna ini didukung oleh data kecepatan penurunan retensi penyerapan sinar selama penyimpanan pada suhu 4 oC dan suhu ruang (Gambar 9).
Gambar 9. Kecepatan penurunan retensi penyerapan sinar pada λ maksimum ektsrak antosianin ubi jalar ungu dari Cilembu selama penyimpanan, R (suhu
22
Kemiringan kurva relatif makin besar sejalan dengan naiknya pH, dan relatif kemiringannya lebih besar pada penyimpanan selama 7 hari pada suhu ruang dibandingkan dengan penyimpanan 10 hari pada suhu 4oC (Gambar 9). Stabilitas ekstrak antosianin terhadap pH selama penyimpanan pada suhu 4oC diukur berdasarkan penyerapan sinarnya setiap 2 hari sampai 10 hari dan setiap hari pada suhu ruang selama 7 hari, dinyatakan sebagai % retensi warna (Gambar 9). Retensi warna menyatakan penurunan penyerapan sinar sampel yang diukur pada panjang gelombang maksimum selama penyimpanan. Gambar 9 terlihat jelas kecepatan penurunan retensi penyerapan sinar selama penyimpanan adalah pada pH 7. Pada pH 7 yang dominan adalah kuinonoidal yang bersifat tidak stabil, sehingga retensi warna semua sampel pada pH 7 adalah yang paling rendah. Penurunan persen retensi warna antosianin pada pH 7 paling besar dibandingkan pH 4.5 dan pH 1.
Pada pH 1 struktur antosianin yang dominan adalah kation flavilium, pada pH 4.5 yang dominan hemiketal karbinol, dan kuinonoidal dan pada pH 7 yang dominan adalah kuinonoidal (Lee et al. 2005). Hasil penelitian ini sejalan dengan pendapat Cevallos-Casals dan Cisneros – Zevallos (2004) yang mengemukakan bahwa retensi warna ekstrak antosianin ubi jalar merah pada pH 3 lebih rendah dari pada pH 1. Hal ini dikarenakan rendahnya penyerapan sinar awal dari ekstrak pada pH 3 yang menunjukkan rendahnya kandungan kation flavilium dibandingkan pH 1.
Tingkatan pH dapat mempengaruhi stabilitas antosianin. Meningkatnya pH 1-6 mempercepat degradasi antosianin, terutama sianidin-3,5-diglukosida (Hou et al. 2013). pH lebih besar dari 3 menurunkan stabilitas antosianin. Antosianin paling stabil pada pH 2, meningkatnya pH menurunkan stabilitas warna (Cevallos-Casals dan Cisneros – Zevallos 2004). Torskangerpoll dan Andersen (2005) melaporkan bahwa stabilitas warna antosianin sangat tergantung pada pH dan struktur antosianin. Stabilitas antosianin meningkat dengan meningkatnya jumlah metoksil pada cincin B dan menurun seiring dengan meningkatnya hidroksil. Secara umum antosianin stabil pada pH asam (Escribano-Bailón et al. 2004). Antosianin lebih tahan terhadap panas ketika antosianin berada pada kondisi asam (Hou et al. 2013).
KESIMPULAN