Amidasi Senyawa Etil p-metoksisinamat yang Diisolasi dari
Kencur (Kaempferia galanga L.) dan Uji Aktivitas
Antiinflamasi Secara In-Vitro
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
MUHAMMAD MIRZA HARDIANSYAH
NIM: 111010200081
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
Skripsi ini adalah hasil karya sendiri, dan semua sumber baik yang dikutip maupun dirujuk telah saya nyatakan dengan benar,
Nama : Muhammad Mirza Hardiansyah
NIM : 1110102000081
Tanda Tangan :
Program Studi : Farmasi
Judul : Amidasi Senyawa Etil p-metoksisinamat yang Diisolasi dari Kencur (Kaempferia galanga L.) dan Uji Aktivitas Antiinflamasi Secara In-Vitro
Modifikasi senyawa etil p-metoksisinamat melalui reaksi amidasi telah dilakukan untuk mendapatkan senyawa baru dengan aktivitas antiinflamasi melebihi senyawa induknya.Reaksi amidasi dilakukan dengan menggunakan dietanolamin sebagai pereaksi.Reaksi ini berlangsung pada suhu tinggi dengan menghasilkan senyawa murni dietil p-metoksisinamamid (C14H19NO4) dengan produk samping berupa etanol (C2H5OH). Uji aktivitas sebagai antiinflamasi dengan Bovine Serum Albumin senyawa etil p-metoksisinamat dan senyawa dietil p-metoksisinamamid pada konsentrasi 40 ppm masing-masing menghasilkan persentase inhibisi denaturasi protein sebesar 36,61% dan 86,00%. Hasil ini menunjukkan bahwa senyawa hasil amidasi etil p-metoksisinamat (dietil p-metoksisinamamid) memiliki aktivitas sebagai antiinflamasi yang lebih tinggi dibandingkan senyawa induk etil p-metoksisinamat sehingga memungkinkan untuk dianalisis lebih lanjut sebagai kandidat antiinflamasi.
Programme study : Pharmacy
Title : Amidation of Ethyl p-methoxycinnamate Isolated from Kencur and In Vitro Test as Anti-inflammatory.
Modification of ethyl p-methoxycinnamate through amidation reaction has been carried out to obtain new compounds with higher anti-inflammatory activity of the lead compounds. Amidation reaction carried out by using diethanolamine as the reagent. This reaction takes place at high temperatures to produce a pure compounds of diethyl p-methoxycinnamamide (C14H19NO4) with byproducts such as ethanol (C2H5OH). Test as anti-inflammatory activity of Bovine Serum Albumin ethyl p-methoxycinnamate and diethyl p-methoxycinnamamide at a concentration of 40 ppm respectively produce protein denaturation percentage inhibition of 36.61% and 86.00%. These results indicate that the compounds amidation of ethyl p-methoxycinnamate (diethyl p-methoxycinnamamide) have higher anti-inflammatory activity than the lead compound ethyl p-methoxycinnamate thus allowing for further analysis as a candidate of anti-inflammatory.
Puji syukur senantiasa saya panjatkan atas kehadirat Tuhan Yang Maha Esa,
Allah SWT yang telah melimpajkan rahmat dan hidayah-Nya, sehingga saya dapat
menyelesaikan penulisan skripsi ini.Penulisan skripsi ini dilakukan dalam ragka
pemenuhan tugas akhir sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
di Fakultas Kedokteran dan Ilmu KesehatanUniversitas Negeri (UIN) Syarif
Hidayatullah Jakarta.
Saya menyadari bahwa tanpa bantuan dan bimbingan dri berbagai pihak, yang
senantiasa diberikan sejak masa perkuliah sampai saat penulisan skripsi ini, sangatlah
sulitbagi saya untuk menyelesaikan skripsi ini. Oleh karena itu, saya mengucapkan
terima kasih kepada :
1. Bapak Prof. DR. (hc) dr. M.K. Tadjudin Sp.And, selaku Dekan Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Negeri (UIN) Syarif Hidayatullah
Jakarta.
2. Bapak Drs. Umar Mansur M.Sc., Apt. selaku Ketua Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan Universitas Negeri (UIN) Syarif
Hidayatullah Jakarta.
3. Supandi, M.Si., Apt. selaku pemimbing pertama serta Ibu Ismiarni Komala,
M.Sc., Ph.D., Apt. selaku pembimbing kedua yang telah membantu,
membimbing, dan memberikan ilmu kepada saya, serta meluangkan waktu,
tenaga, dan pikiran dari awal penelitian sampai pada penyusunan skripsi ini
selesai.
4. Segenap Bapak dan Ibu Dosen yang telah memberikan ilmu dan pengetahuan
sehingga penulis dapat menyelesaikan studi di jurusan Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Negeri (UIN) Syarif Hidayatullah
Jakarta.
5. Para laboran Laboratorium Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Negeri (UIN) Syarif Hidayatullah Jakarta yang telah membantu
memberikan bantuan moril, materil, dan spiritual hingga skripsi ini dapat
diselesaikan. Semoga Allah SWT memberikan balasan yang sebaik-baiknya atas
bantuan kalian.
7. Teman-teman seperjuangan penelitian kencur, Hadi Qudsi dan Syarifatul
Mufidah, teman-teman penelitian BSA, Finti Muliati dan Maliyhatun Ni’mah
yang telah berbaik hati bekerja sama dengan saya dalam penelitiaan sampai pada
penyusunan skripsi.
8. Teman-teman seperjuangan di Laboratorium Farmasi Fakultas Kedokteran dan
Ilmu Kesehatan Universitas Negeri (UIN) Syarif Hidayatullah Jakarta yang
senantiasa memberikan masukan, semangat, dan doa bagi penulis dalam
penyelesaian skripsi ini.
9. Teman-teman Andalusia farmasi angkatan 2010 yang telah berjuang
bersama-sama selama 4 tahun untuk menyelesaikan studi ini.
10. Dan semua pihak yang tidak dapat penulis sebutka satu persatu yang turut
membantu penyelesaian skripsi ini.
Penulis menyadari bahwa skripsi ini masih belum sempurna.Oleh karena itu,
kritik dan saran yang membangun sangat penulis harapkan agar tercapainya
kesempurnaan skripsi ini.Penulis berharap semoga hasil penelitian ini dapat
bermanfaat baik badi kalangan akademis dan dunia ilmu pengetahuan, khususnya
bagi mahasiswa farmasi, serta bagi masyarakat pada umumnya.
Jakarta, September 2014
Sebagai civitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah
Jakarta, saya yang bertanda tangan di bawah ini :
Nama : Muhammad Mirza Hardiansyah
NIM : 1110102000081
Program Studi : Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan Jenis Karya : Skripsi
Demi kepentingan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya
dengan judul :
Amidasi Senyawa Etil p-metoksisinamat yang Diisolasi dari Kencur (Kaempferia galanga L.)dan Uji Aktivitas Antiinflamasi Secara In-Vitro
Untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital
LibraryPerpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
untuk kepentingan akademik sebatas sesuai dengan Undang-undang Hak Cipta.
Demikian pernyataan persetujuan publikasi karya ilmiah ini saya buat dengan
sebenarnya.
Dibuat di :
Tanggal :
Yang menyatakan :
HALAMAN JUDUL ... i
HALAMAN PERNYATAAN ORISINALITAS ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
ABSTRAK ... v
ABSTRACT ... vi
KATA PENGANTAR ... vii
HALAMAN PERSETUJUAN PUBLIKASI ILMIAH ... ix
DAFTAR ISI ... x
2.6 Kromatografi Gas-Spektrometer Massa ... 10
2.7 Spektroskopi ... 11
2.7.1 Spektrofotometer UV ... 11
2.7.2 Spektrofotometer Infra Merah... 12
2.7.3 Spektrofotometer Resonansi Magnetik ... 13
2.8 Uji In Vitro Antiinflamasi dengan Bovine Serum Albumin ... 15
BAB 4 HASIL DAN PEMBAHASAN ... 20
4.1 Isolasi Etil p-metoksisinamat dari Rimpang Kencur ... 20
4.1.1 Identifikasi Senyawa Hasil Isolasi ... 22
4.2 Modifikasi Struktur Etil p-metoksisinamat dengan Reaksi Amidasi ... 30
4.2.1 Identifikasi Senyawa Hasil Modifikasi ... 32
4.3 Pengujian Aktivitas Antiiflamasi dengan Bovine Serum Albumin ... 37
BAB 5 KESIMPULAN DAN SARAN ... 40
5.1 Kesimpulan ... 40
5.2 Saran ... 40
DAFTAR PUSTAKA ... 41
Gambar 2.1 Rimpang Kencur ... 6
Gambar 2.2 Struktur Kimia Etil p-metoksisinamat... 7
Gambar 2.3 Struktur Kimia Dietanolamin ... 8
Gambar 2.4 Skema Kromatografi Lapis Tipis ... 10
Gambar 4.1 Rimpang Kencur ... 20
Gambar 4.2 Serbuk Kering Simplisia Kencur... 21
Gambar 4.3 Hasil KLT Isolat Kencur ... 22
Gambar 4.4 Spektrum IR Isolat Kencur ... 24
Gambar 4.5 Spektrum GCMS Isolat kencur ... 26
Gambar 4.6 Pola Fragmentasi GCMS Isolat Kencur ... 27
Gambar 4.7 Spektrum 1H-NMR Isolat Kencur ... 28
Gambar 4.8 Struktur Kimia Etil p-metoksisinamat... 29
Gambar 4.9 Mekanisme Reaksi Amidasi EPMS dengan Dietanolamin ... 30
Gambar 4.10 KLT Senyawa Hasil Reaksi Amidasi ... 31
Gambar 4.11 Spektrum IR Senyawa Hasil Amidasi ... 33
Gambar 4.12 Pola Fragmentasi GCMS SEnyawa Hasil Reaksi Amidasi ... 33
Gambar 4.13 Spektrum GCMS Senyawa Hasil Amdasi ... 34
Gambar 4.14 Spektrum 1H-NMR Senyawa asil Amidasi ... 36
Gambar 4.15 Kemungkinan Struktur Senyawa Hasil Reaksi Amidasi ... 37
Tabel 2.1 Serapan Khas Beberapa Gugus Fungsi ... 12
Tabel 4.1 Daftar Daerah Spektrum IR Isolat Kencur ... 23
Tabel 4.2 Data Pergeseran Kimia Spektrum 1H NMR Senyawa EPMS ... 29
Tabel 4.3 Daftar Daerah Spektrum IR Senyawa Hasil Amidasi ... 32
Tabel 4.4 Data Pergeseran Kimia Spektrum 1H NMR Senyawa Hasil Amidasi .... 35
Lampiran 1 Alur Penelitian ... 46
Lampiran 2 Skema Isolasi Etil p-metoksisinamat ... 47
Lampiran 3 Perhitungan Bahan dan Rendemen Hasil Amidasi ... 48
Lampiran 4 Spektrum GCMS Senyawa Etil p-metoksisinamat ... 49
Lampiran 5 Spektrum IR Senyawa Etil p-metoksisinamat ... 50
Lampiran 6 Spektrum 1H-NMR Senyawa Etil p-metoksisinamat ... 51
Lampiran 7 Spektrum GCMS Senyawa Hasil Amidasi ... 52
Lampiran 8 Spektrum IR Senyawa Hasil Amidasi ... 53
Lampiran 9 Spektrum 1H-NMR Senyawa Hasil Amidasi... 54
Lampiran 10 Hasil Uji Aktivitas Antiinflamasi ... 58
Lampiran 11 Sertifikat Analisa Bahan ... 61
Lampiran 12 Hasil Determinasi Kencur ... 66
BAB 1
PENDAHULUAN
1.1Latar Belakang
Bangsa Indonesia telah lama mengenal dan menggunakan tanaman
berkhasiat obat sebagai salah satu upaya dalam menanggulangi masalah
kesehatan. Pengetahuan tentang tanaman berkhasiat obat berdasar pada
pengalaman dan ketrampilan yang secara turun-temurun telah diwariskan dari
satu generasi ke generasi berikutnya. Penggunaan bahan alam sebagai obat
tradisional di Indonesia telah dilakukan oleh nenek moyang kita sejak
berabad-abad yang lalu terbukti dari adanya naskah lama pada daun lontar Husodo
(Jawa), Usada (Bali), Lontarak Pabbura (Sulawesi Selatan), dokumen Serat
Primbon Jampi, Serat Racikan Boreh Wulang Ndalem dan relief Candi
Borobudur yang menggambarkan orang sedang meracik obat (jamu) dengan
tumbuhan sebagai bahan bakunya (Sukandar E Y., 2006).
Obat herbal telah diterima secara luas di hampir seluruh negara di dunia.
Menurut WHO, negara-negara di Afrika, Asia dan Amerika Latin menggunakan
obat herbal sebagai pelengkap pengobatan primer yang mereka terima. Bahkan
di Afrika sebanyak 80% dari populasi menggunakan obat herbal untuk
pengobatan primer. Faktor pendorong terjadinya peningkatan penggunaan obat
herbal di negara maju adalah usia harapan hidup yang lebih panjang pada saat
prevalensi penyakit kronik meningkat, adanya kegagalan penggunaan obat
modern untuk penyakit tertentu di antaranya kanker serta semakin luas akses
informasi mengenai obat herbal di seluruh dunia (Sukandar E Y., 2006).
Tanaman kencur (Kaempferia Galanga L.) telah lama digunakan oleh
nenek moyang kita dalam campuran bedak yaitu bedak dingin beras kencur yang
dapat mengurangi sengatan sinar matahari dan memberikan rasa sejuk pada
permukaan kulit. Penelitian telah membuktikan kebenaran pengalaman nenek
surya yaitu etil p-metoksisinamat. Etil p-metoksisinamat adalah salah satu
produk alam yang terdapat pada kencur (Kaempferia galanga Linn.) dalam
jumlah yang relatif besar. Etil p-metoksisinamat memiliki gugus fungsi yang
reaktif sehingga dapat ditransformasikan menjadi gugus fungsi yang lain, di
antaranya adalah ikatan rangkap terkonjugasi, cincin aromatik yang diaktifkan
oleh gugus metoksi dan gugus ester. Etil p-metoksisinamat adalah ester alam
dimana gugus esternya dapat diamidasi menjadi senyawa amida yang lebih
bermanfaat sehingga memungkinkan sebagai bahan dasar sintesa amida turunan
sinamat. (Taufikurohmah et al., 2008).
Inflamasi merupakan salah satu proses protektif dan restoratif yang dapat
mngembalikan keadaan sebelum trauma. Respon inflamasi dinyatakan dengan
adanya dilatasi pembuluh darah dan pengeluaran leukosit serta cairan. Akibat
respon ini terlihat tanda-tanda yaitu kemerahan (eritema), pembengkakan
(udem), dan kekakuan (induration). Pembengkakan yang ditimbulkan karena
masuknya leukosit dan cairan ke dalam jaringan tempat terjadinya inflamasi.
Inflamasi dapat terjadi secara akut, sub akut, dan kronik. Pada inflamasi akut
leukosit yang berperan adalah netrofil. Pada keadaan ini netrofil akan melakukan
fungsinya yaitu memfagositosis benda asing yang masuk atau yang
menimbulkan trauma (Bellanti. 1993; Stites et al., 1994).
Dalam pengobatan inflamasi, kelompok obat yang banyak diberikan
adalah obat antiinflamasi non steroid (AINS). Obat ini merupakan obat sintetik
dengan struktur kimia heterogen. Contoh obat golongan ini adalah aspirin,
karena itu sering disebut juga obat mirip aspirin (aspirin like drugs) (Wilmana
dan Gan, 2007). Efek terapi AINS berhubungan dengan mekanisme kerja
penghambatan pada enzim siklooksigenase-1 (COX-1) yang dapat menyebabkan
efek samping pada saluran cerna dan penghambatan pada enzim
siklooksigenase-2 (COX-siklooksigenase-2) yang dapat menyebabkan efek samping pada sistem kardiovaskular.
Kedua enzim tersebut dibutuhkan dalam biosintesis prostaglandin (Lelo dan
Hidayat, 2004). Non Steroidal Anti Inflammatory Drugs (NSAID) memiliki efek
peptic ulcer. Kekayaan hayati yang besar, terutama di Indonesia, dapat
menyediakan sumber bagi senyawa baru yang memiliki efek antiinflammasi
yang signifikan. Pengobatan menggunakan senyawa herbal dikenal memiliki
efek samping yang minimum dan biaya lebih murah. Pada penelitian
sebelumnya oleh Umar et al. (2012) telah dilakukan uji antiinflamasi terhadap
senyawa etil p-metoksisinamat, hasilnya adalah senyawa ini mempunyai
aktivitas antiinflamasi dengan mekanisme menghambat COX-1 dan COX-2.
Dalam penelitian ini dilakuan reaksi amidasi etil p-metoksisinamat, yaitu
pergantian gugus fungsi ester menjadi gugus fungsi amida dengan cara
mereaksikan langsung etil p-metoksisinamat dengan dietanolamin pada kondisi
tertentu. Produk hasil reaksi yang mengandung gugus amida diharapkan akan
memberikan peningkatan efek antiinflamasi etil p-metoksisinamat. Uji invitro
anti inflamasi dilakukan dengan menggunakan Bovine Serum Albumin yang
didenaturasi. Ibuprofen dan Naproxen diketahui sebagai agen antiinflamasi
turunan dari asam propionat, namun obat tersebut sering menyebabkan
kerusakan lambung seperti luka pada lambung, peptic ulcer,perdarahan, dan
perforasi. Oleh karena itu pada tahun 2013, Sadek et al. membuat turunan dari
Ibuprofen dan Naproxen melalui reaksi amidasi dengan menggunakan asam
amino, dan hasilnya senyawa turunan dari Ibuprofen dan Naproxen memiliki
aktifitas antiinflamasi yang lebih baik dibandingkan senyawa induknya, dan
tentunya dengan resiko efek samping yang lebih rendah. Inilah yang mejadi
dasar pemilihan reaksi amidasi dalam penelitian ini.
1.2Rumusan Masalah
1.2.1 Apakah dapat dilakukan modifikasi struktur etil p-metoksisinamat melalui
reaksi amidasi dengan menggunakan dietanolamin.
1.2.2 Apakah turunan etil p-metoksisinamat yang mengandung gugus amida
yang dihasilkan memiliki aktivitas antiinflamasi yang lebih tinggi dari
1.3Tujuan Penelitian
1.3.1 Melakukan modifikasi struktur senyawa etil p-metoksisinamat dengan
reaksi amidasi.
1.3.2 Mengetahui pengaruh penambahan gugus amin terhadap aktivitas
antiinflamasi senyawa hasil modifikasi.
1.4Hipotesa
Modifikasi struktur etil p-metoksisinamat melalui reaksi amidasi dengan
dietanolamin ini akan menghasilkan senyawa baru turunan etil p-metoksisinamat
yang mempunyai aktivitas antiinflamasi yang lebih besar dibandingkan senyawa
induk etil p-metoksisinamat.
1.5Manfaat Penelitian
1.5.1 Mendapatkan senyawa turunan etil p-metoksisinamat yang mengandung
gugus amida yang diharapkan memiliki aktivitas antiinflamasi yang lebih
baik dibandingkan dengan senyawa induk etil p-metoksisinamat.
1.5.2 Memberikan informasi mengenai modifikasi struktur dan uji aktivitas dari
senyawa etil p-metoksisinamat lebih lanjut, khususnya melalui reaksi
2.1 Tanaman Kencur
Kencur (Kaempferia galanga L.) merupakan salah satu dari lima jenis
tumbuhan yang dikembangkan sebagai tanaman obat asli Indonesia. Kencur
merupakan tanaman obat yang bernilai ekonomis cukup tinggi sehingga banyak
dibudidayakan. Bagian rimpangnya digunakan sebagai bahan baku industri obat
tradisional, bumbu dapur, bahan makanan, maupun minuman penyegar lainnya
(Rostiana et al., 2003).
Kencur merupakan tanaman tropis yang banyak tumbuh di berbagai daerah
di Indonesia sebagai tanaman yang dipelihara. Tanaman ini banyak digunakan
sebagai ramuan obat tradisional dan sebagai bumbu dalam masakan sehingga
para petani banyak yang membudidayakan tanaman kencur sebagai hasil
pertanian yang diperdagangkan dalam jumlah yang besar. Bagian dari tanaman
kencur yang diperdagangkan adalah buah akar yang tinggal didalam tanah yang
disebut dengan rimpang kencur atau rizoma (Soeprapto,1986).
Klasifikasi Kaempferia galanga L di dalam dunia botani adalah sebagai berikut:
Kerajaan : Plantae
Divisi : Spermatophyta
Sob Divisi : Angiospermae
Kelas : Monocotyledonae
Ordo : Zingiberales
Famili : Zingiberaceae
Subfamili : Zingiberoideae
Genus : Kaempferia
Secara empirik kencur berkhasiat sebagai obat untuk batuk, gatal-gatal
pada tenggorokan, perut kembung, mual, masuk angin, pegal-pegal, pengompres
bengkak/radang, tetanus dan penambah nafsu makan (Miranti, 2009). Sulaiman
et al. (2007), menyatakan bahwa rimpang kencur dapat digunakan sebagai untuk
hipertensi, rematik, dan asma. Kandungan minyak atsiri dari rimpang kencur
diantaranya terdiri atas miscellaneous compounds (misalnya etil
p-metoksisinamat 58,47%, isobutil β-2- furilakrilat 30,90%, dan heksil format
4,78%); derivat monoterpen teroksigenasi (misalnya borneol 0,03% dan kamfer
hidrat 0,83%); serta monoterpen hidrokarbon (misalnya kamfen 0,04% dan
terpinolen 0,02%) (Sukari et al., 2008).
Gambar 2.1 Rimpang Kencur (Koleksi Pribadi)
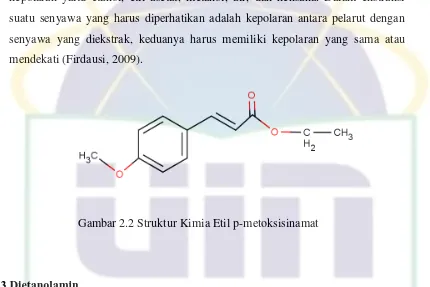
2.2 Etil p-metoksisinamat
Etil p-metoksisinamat (EPMS) adalah salah satu senyawa hasil isolasi
rimpang kencur (Kaempferia Galanga L.), termasuk dalam golongan senyawa
dan juga gugus karbonil yang mengikat etil yang bersifat sedikit polar sehingga
dalam ekstraksinya dapat menggunakan pelarut-pelarut yang mempunyai variasi
kepolaran yaitu etanol, etil asetat, metanol, air, dan heksana. Dalam ekstraksi
suatu senyawa yang harus diperhatikan adalah kepolaran antara pelarut dengan
senyawa yang diekstrak, keduanya harus memiliki kepolaran yang sama atau
mendekati (Firdausi, 2009).
Gambar 2.2 Struktur Kimia Etil p-metoksisinamat
2.3Dietanolamin
Dietanolamin merupakan cairan tidak berwarna atau sedikit berwarna,
memiliki rumus kimia (HOCH2CH2)2NH. (Departemen Kesehatan RI, 1995).
Dietanolamida pertama kali diperoleh dengan mereaksikan dua mol dietanolamin
dengan satu mol asam lemak. Senyawa ini diberi nama Kritchevsky amida sesuai
dengan nama penemunya. Bahan baku yang digunakan dalam produksi
dietanolamida dapat berupa asam lemak, trigliserida atau metil ester.
Dietanolamida biasanya diproduksi secara kimia konvensional pada temperatur
150° C selama 6-12 jam (Herawan et al., 1999). Dietanolamina adalah senyawa
yang terdiri dari gugus amina dan dialkohol. Dialkohol menunjukkan adanya dua
gugus hidroksil pada molekulnya. Dietanolamin juga dikenal dengan nama bis
(hydroxyethyl)amine, diethylolamine, hydroxtdiethylamine, diolamine dan
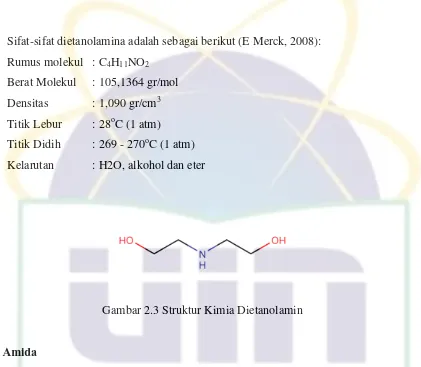
Sifat-sifat dietanolamina adalah sebagai berikut (E Merck, 2008):
Rumus molekul : C4H11NO2
Berat Molekul : 105,1364 gr/mol
Densitas : 1,090 gr/cm3
Titik Lebur : 28oC (1 atm)
Titik Didih : 269 - 270oC (1 atm)
Kelarutan : H2O, alkohol dan eter
Gambar 2.3 Struktur Kimia Dietanolamin
2.4Amida
Senyawa amida umumnya dapat diperoleh melalui amidasi turunan asam
karboksilat seperti asil halida dan metal ester (Fessenden, R. J. dan Fessenden J.
S., 1999), seperti amidasi antara steroil klorida dengan asam gluatamat untuk
menghasilkan steroil glutamida (Silvasamy et al., 2001) dan amidasi antara
1,9-nonnadiolil klorida dengan asam glutamate untuk pembuatan 1,9-nonadiolil
glutamida yang dapat digunakan sebagai bahan surfaktan (Lisma, et al., 2004).
Di samping itu, beberapa peneliti dahulu juga telah berhasil melakukan
amidasi langsung melalui pemanasan antara asam karboksilat dengan senyawa
amin seperti halnya reaksi antara asam azelat dengan urea untuk menghasilkan
senyawa amida yang berguna sebagai bahan surfaktan dan reaksi antara
dodekilamina dengan b-hidroksi nonanoat untuk menghasilkan
b-hidroksinonamida yang berguna sebagai zat anti penuaan. (Budijanto, 2002).
Senyawa amida memiliki banya kegunaan yang beragam seperti
pengobatan untuk mengobati macam-macam penyakit infeksi (Nuraini, 1988),
demikian juga amida asam lemak digunakan sebagai bahan pelumas dalam proses
pembuatan resin di samping sebagai zat antara untuk membuat senyawa amina.
(Brahmana, 1991 dan Billenstein, 1984).
2.5Kromatografi
Kromatografi merupakan teknik pemisahan yang menggunakan fase diam
(stationary phase) dn fase gerak (mobile phase). Teknik ini pertama kali
dikembangkan oleh seorang ahli botani Rusia, Michael Tswett pada tahun 1903
untuk memisahkan pigmen berwarna dalam tanaman dengan cara perkolasi
ekstrak petroleum eter dalam kolom gas yang berisi kalsium karbonat (CaCO3).
Saat ini kromatografi merupakan teknik pemisahan yang paling umum dan paling
sering digunakan dalam bidang kimia analisis dan dapat dimanfaatkan untuk
melakukan analisis kualitatif, kuantitatif, maupun preparatif. Kromatografi telah
berkembang dan telah digunakan untuk memisahkan dan menguantifikasi
berbagai macam komponen yang kompleks, baik komponen organik maupun
anorganik (Gandjar, Ibnu Gholib dan Abdul, Rohman, 2007).
Jenis-jenis kromatografi yang bermanfaat dalam analisis kualitatif dan
kuantitatif yang digunakan dalam penetapan kadar dan pengujian Farmakope
Indonesia adalah Kromatografi Kolom, Kromatografi Gas, Kromatografi Kertas,
Kromatografi Lapis Tipis, dan Kromatografi Cair Kinerja Tinggi. Kromatografi
kertas dan kromatografi lapis tipis umumnya lebih bermanfaat untuk tujuan
identifikasi, karena mudah dan sederhana. Kromatografi kolom memberikan
pilihan fase diam yang lebih luas dan berguna untuk pemisahan masing-masing
senyawa secara kuantitatif dari suatu campuran (Departemen Kesehatan, 1995).
2.5.1 Kromatografi Lapis Tipis
Kromatografi didefinisakn sebagai teknik pemisahan zat terlarut oleh
suatu proses migrasi diferensial dinamis dalam system yang terdiri dari dua
dalam arah tertentu dan di dalamnya zat-zat itu menunjukkan perbedaan
mobilitas disebabkan adanya perbedaan dalam adsorpsi, partisi, kelarutan,
tekanan uap, ukuran molekul atau kerapatan muatan ion. Dengan demikian
masing-masing zat dapat diidentifikasi atau ditetapkan dengan metode
analitik (Departemen Kesehatan RI, 1995)
Pada kromatografi lapis tipis, zat penjerap merupakan lapisan tipis
serbuk halus yang dilapiskan pada lempeng kaca, plastik atau logam secara
merata, umunya digunakan lempeng kaca. Lempeng yang dilapisi dapat
dianggap sebagai kolom kromatografi terbuka dan pemisahan yang dicapai
dapat didasarkan pada adsorpsi, partisi, atau kombinasi kedua efek,
tergntung dari jenis zat penyangga, cara pembuatan, dan jenis pelarut yang
digunakan (Departemen Kesehatan RI, 1995).
Gambar 2.4 Skema Kromatografi Lapis Tipis
2.6Gas Chromatography Mass Spectrometry (GCMS)
Instrument kromatografi gas-spektrometri massa adalah sebuah metode
yang mengombinasikan antara kromatografi gas dan spektrometri massa untuk
GC-MS dirancang dengan menggunakan dua bagian utama, yaitu kromatografi gas
dan spektrometri massa. Kromatografi gas menggunakan sebuah kolom kapiler
sebagai fase diam. Perbedaan sifat kimia antara molekul dalam sebuah pencampuran
akan memisahkan molekul pada saat sampel terebut masuk ke dalam kolom.
Molekul-molekul akan memiliki waktu retensi yang berbeda-beda untuk keluar dari
kromatografi gas, dan hal ini memungkinkan spektrometri massa mendeteksi ion-ion
molekul secara terpisah. Spektrometri massa akan mendeteksi fragmen ini dan
dihasilkan massa molekul relatifnya.
Peralatan kromatografi gas merupakan salah satu instrument analitik.
Kromatografi gas sangat efektif untuk memisahkan senyawa menjadi komponennya
yang bervariasi. Akan tetapi kromatografi gas tidak dapat mengidentifikasi senyawa
yang spesifik. Sebaliknya spektrometri massa dapat mengetahui senyawa yang
spesifik namun tidak dapat menghasilkan analisis kualitatif yang baik. Ketika sebuah
analisis menggunakan kromatografi gas untuk memisahkan komponennya sebelum
dianalisis dengan spektroskopi massa maka akan terbentuk hubungan yang
komplementer.
2.6 Spektroskopi
2.6.1 Spektrofotometer UV
Spektrofotometri UV adalah pengukuran panjang gelombang dan intensitas
sinar ultraviolet yang diabsorbsi oleh sampel.Sebagai sumber cahaya biasanya
digunakan lampu hidrogen. Panjang gelombang dari sumber cahaya akan dibagi
oleh pemisah panjang gelombang seperti prisma atau monokromator. Ketika
suatu atom atau molekul menyerap cahaya maka energi tersebut akan
menyebabkan elektron terluarnya tereksitasi ke tingkat energi yang lebih tinggi
(Dachriyanus, 2004). Energi keseluruhan dari suatu molekul adalah jumlah
energi elektroniknya, energi getar dan energi rotasi. Energi yang diserap dalam
transisi elektronik suatu molekul dihasilkan dari transisi elektron valensi dalam
molekul-molekul tersebut. Transisi ini terdiri dari eksitasi dari suatu elektron
Instrumen Spektroskopi UV, berkas cahaya yang diserap bukan
cahayatampak tapi cahaya ultraviolet dengan cara ini larutan tak berwarna dapat
diukur. Pada Spektroskopi Ultraviolet energi cahaya yang terserap digunakan
untuk transisi elektron. Karena energi cahaya UV lebih besar dari energi sinar
tampak sehingga energi UV dapat menyebabkan transisi elektron σ atau π (Mulja,
1995). Kuantitas energi yang diserap oleh suatu senyawa berbanding terbalik
dengan panjang gelombang radiasiΔE = hv = ℎ� λ = panjang gelombang, dalam cm
Panjang gelombang cahaya UV atau cahaya tampak bergantung pada
mudahnya promosi elektron. Molekul-molekul yang memerlukan lebih banyak
energi untuk promosi elektron akan menyerap pada panjang gelombang yang
lebih pendek. Molekul yang memerlukan energi lebih sedikit akan menyerap pada
panjang gelombang yang lebih panjang (Fessenden & Fessenden, 1986).
2.6.2 Spektrofotometri Infra Merah
Spektrofotometri Infra Merah merupakan alat untuk merekam spektrum di
daerah inframerah terdiri dari suatu sistem optik dengan kemampuan
menghasilkan cahaya monokromatik di daerah 4000 cm⁻¹ hingga 625 cm⁻¹ (lebih
kurang 2,5 πm hingga 16 πm) dan suatu metode untuk mengukur perbandingan
intensitas perbandingan cahaya yang ditransmisikan cahaya datang (Departemen
Kesehatan,1995).
Setiap molekul memiliki karakteristik spektrum inframerah yang
berbeda-beda baik dalam posisi maupun intensitas pita absorbsinya. Spektrum yang
diperoleh merupakan hubungan antara bilangan gelombang (cm⁻¹) dan persen
transmitan. Spektrum IR digunakan untuk mengidentifikasi gugus fungsi
Dasar Spektroskopi Infra Merah dikemukakan oleh Hooke dan didasarkan
atas senyawa yang terdiri atas dua atom atau diatom yang digambarkan dengan
dua buah bola yang saling terikat oleh pegas. Berikut adalah macam-macam
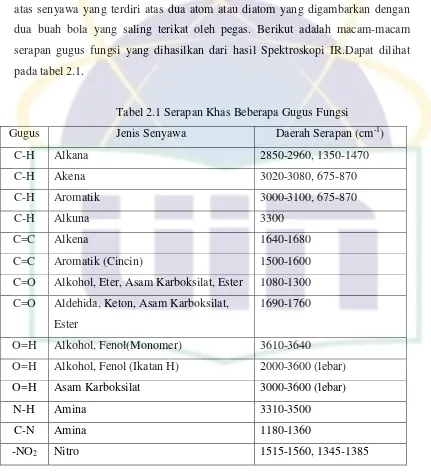
serapan gugus fungsi yang dihasilkan dari hasil Spektroskopi IR.Dapat dilihat
pada tabel 2.1.
Tabel 2.1 Serapan Khas Beberapa Gugus Fungsi
Gugus Jenis Senyawa Daerah Serapan (cm-1)
C-H Alkana 2850-2960, 1350-1470
C-H Akena 3020-3080, 675-870
C-H Aromatik 3000-3100, 675-870
C-H Alkuna 3300
C=C Alkena 1640-1680
C=C Aromatik (Cincin) 1500-1600
C=O Alkohol, Eter, Asam Karboksilat, Ester 1080-1300
C=O Aldehida, Keton, Asam Karboksilat,
Ester
1690-1760
O=H Alkohol, Fenol(Monomer) 3610-3640
O=H Alkohol, Fenol (Ikatan H) 2000-3600 (lebar)
O=H Asam Karboksilat 3000-3600 (lebar)
N-H Amina 3310-3500
C-N Amina 1180-1360
-NO2 Nitro 1515-1560, 1345-1385
2.6.3 Spektrofotometri Resonansi Magnetik
Spektrofotometri Resonansi Magnetik Inti (RMI) atau Nuclear Magnetic
Resonance (NMR) merupakan suatu metode untuk mengidentifikasi struktur
berhubungan dengan sifat magnet dari berbagai inti dan juga untuk menentukan
berbagai letak inti tersebut dalam suatu molekul. Seperti dengan menggunakan
spektroskopi resonansi magnetik proton dapat diketahui jenis lingkungan atom
hidrogen dan jumlahya pada atom karbon tetangga. Spektroskopi yang sering
digunakan adalah spektroskopi ¹H dan ¹³C-NMR karena atom hidrogen dan
karbon selalu ada dalam setiap molekul senyawa organik (Attaur Rahman, 1986,
Willard et al., 1948). Berikut merupakan komponen-komponen dari RMI:
a. Magnet
Merupakan suatu alat tambahan yang berguna untuk menstabilkan medan
magnet.
b. Probe sampel
Tempat meletakkan sampel dan tempat terjadinya resonansi.
c. Sumber dan detektor radiasi radioaktif
Merekam perubahan magnetisasi sampel dan peluruhannya yang disebabkan
oleh pengaruh waktu.
d. Rekorder data
Informasi berupa sinyal yang dikirim kesuatu komputer untuk dìproses,
diakumulasi lalu ditransformasikan secara otomatis (Attaur Rahman,1986.,
Willard et al., 1948)
2.7 Uji inVitro Antiinflamasi dengan Bovine Serum Albumin
Ada masalah etika yang muncul dengan penggunaan hewan coba pada tahap
awal penemuan dan pengembangan obat-obatan antiinflamasi maupun penyakit
degeneratif, terutama apabila ekstrak berasal dari produk alam yang biasanya
mengandung banyak senyawa yang harus diuji. Hal inilah yang mendasari
penggunaan uji in vitro efek anti-denaturasi (stabilisasi) dari Bovine Srum
Albumin yang didenaturasi (melalui pemanasan) dengan cara mengukur
absorbansinya menggunakan spektrofotometer UV sebagai metode pengujian
Bovine Serum Albumin (BSA) adalah protein globular yang berukuran
besar (66000 dalton) yang dapat rusak karena pemanasan. Albumin merupakan
kelompok protein yang larut dalam air. Albumin adalah protein yang paling
banyak terdapat dalam sirkulasi. Albumin pada sintesis senyawa pada awalnya
berbentuk preproalbumin di hati.
Uji in vitro anttiinflamasi menggunakan BSA bertujuan untuk mengurangi
penggunaan spesimen hidup dalam proses pengembangan obat. Grabt et al.
melaporkan bahwa salah satu mekanisme kerja obat-obat antiinflamasi non
steroid seperti indometasin, asam flufenamik, dan asam salisilat adalah
kemampuan untuk mengurangi denaturasi BSA yang telah dipanaskan pada pH
3.1Tempat dan Waktu
Penelitian ini dilakukan di Laboratorium Penelitian I, Laboratorium
Farmakognosi dan Fitokimia, dan Laboratorium Analisis Halal Fakultas
Kedokteran Dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta. Penelitian
ini dilakukan pada bulan Januari hingga Agustus 2014.
3.2Alat dan Bahan 3.1.1 Alat
Spektrofotometer 1H-NMR (500 MHz, JEOL), Spektrofotometer UV-vis
(HITACHI), Spektrofotometer Inframerah Transformasi Fourier, seperangkat
alat Kromatografi Lapis Tipis, timbangan analitik, Penangas air, rotary
evaporator (Eyela), gelas kimia, pipet tetes, pipet ukur, labu ukur 5 ml dan 10
ml, tabung reaksi, rak tabung, botol maserasi, magnetic stirrer (Wiggen
Hauser).
3.1.2 Bahan
Senyawa etil p-metoksi sinamat hasil ekstraksi dari kencur (Kaempferia
galanga Linn.), Natrium Hidroksida (Merck), HCl, Dietanolamin (Merck),
Etanol, Metanol, N-Heksan, Kencur, Basa Tris, Bovine Serum Albumin fraksi
V kemurnian 96% (Sigma Chemical Co).
3.3 Prosedur Kerja
3.3.1 Isolasi etil p-metoksisinamat
Kencur segar yang telah diteterminasi di Herbarium Bogoriense Pusat
Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong,
potongan kencur yang telah kering kemudian dihaluskan dengan blender
sampai terbentuk serbuk. Serbuk rimpang kencur kering dimaserasi dengan
menggunakan pelarut n-heksan yang telah didestilasi dengan waktu
perendaman 5 hari sambil sesekali dilakukan pengocokan setiap harinya.
Setelah 5 hari rendaman disaring sehingga diperoleh ampas dan filtrat.
Ampas ditambah kembali n-heksana untuk dimasersi kembali. Proses
maserasi dilaknyak tiga kali. Seluruh filtrat hasil maserasi dipekatkan dengan
vacuum evaporator. Kemudian filtrat pekat ini diendapkan pada suhu kamar
sampai terbentuk Kristal. Kristal yang terbentuk pada filtrat dipisahkan
dengan penyaringan. Kristal yang dieroleh dimurnikan dengan pencucian
menggunakan n-heksana dan rekrisalisasi dengan cara melarutkan Kristal
dalam n-heksana dan beberapa menambahkan tetes metanol dan kemudian
dibiarkan pada suhu kamar sehingga terbentuk Kristal kembali. Kristal
dipisahkan dengan penyaringan (Afrizal et al., 1999; Huang et al., 2008).
Kemudian dihitung rendemennya dengan rumus sebagai berikut:
x 100%
3.3.2 Amidasi etil p-metoksisinamat
Sebanyak 2,012 gram kristal etil p-metoksisinamat ditambahkan
6,056 gram dietanolamin dimasukkan ke dalam gelas kimia lalu
dipanaskan di atas hot plate hingga meleleh dan diaduk dengan
magnetic stirrer, suhu pada hot plate diatur menjadi 200° C. Proses
pemanasan dilakukan selama 2 jam dan dikontrol dengan pengecekkan
menggunakan plat KLT dengan eluen etil asetat dan metanol 4:1
sampai terbentuk spot tunggal pada plat KLT. Setelah pemanasan lalu
dilakukan rekristalisasi senyawa hasi amidasi dengan pelarut n-heksan.
Hasil yang didapat selanjutnya diidentifikasi lebih lanjut baik secara
1
H-NMR kemudian dilakukan uji aktivitas antiinflamasi secara
In-Vitro.
3.3.3 Uji invitro antiinflamasi (Williams et al., 2008)
Sampel kontrol positif dan sampel uji masing-masing ditimbang
sebanyak 40 mg kemudian dilarutkan dalam 10 ml aquades sebagai
larutan induk. Larutan induk ini kemudian diencerkan sehingga
didapatkan konsentrasi 4000, 2000, 1000, 500, dan 250 ppm.
a. Pembuatan Tris-Buffer Saline (TBS)
Sebanyak 4,35 gram natrium klorida dilarutkan dalam 200 ml
aquades, ditambahkan 605 mg tris base dicukupkan dengan aquades
sampai 400 ml. selanjutnya pH diatur dengan penambahan asam
asetat glasial hingga pH 6,3, kemudian dicukupkan dengan aquades
sampai 500 ml (Mohan, 2003).
b. Pembuatan Larutan 0,2% BSA dalam TBS
Sebanyak 0,5 gram Bovine Serum Albumin (BSA) dimasukkan
ke dalam labu ukur 250 ml, kemudian ditambahkan dengan larutan
TBS hingga volume 250 ml. (Williams et al., 2008).
c. Pengujian aktivitas senyawa hasil modifikasi terhadap denaturasi
BSA :
1. Pembuatan larutan blanko
Larutan kontrol blanko terdiri dari larutan tris-acetate
phosphate buffer pH 6,3.
2. Pembuatan larutan Kontrol positif
Larutan kontrol positif 1 terdiri dari larutan BSA 5 ml dan
larutan induk Na diklofenak 50 µL.
3. Pembuatan larutan uji 1
Larutan kontrol positif 1 terdiri dari larutan BSA 5 ml dan
larutan induk EPMS 50 µL.
Larutan control positif 1 terdiri dari larutan BSA 5 ml dan
larutan sampel induk 50 µL.
Pencampuran larutan induk kontrol positif dan larutan induk
sampel dengan larutan BSA dilakukan menggunakan labu ukur 5 ml
sehingga konsentrasi larutan menjadi 2,5; 5; 10; 20; dan 40 ppm.
Setiap larutan diinkubasi selama 30 menit di dalam ruang spektro
lalu dipanaskan selama 5 menit pada suhu 73° C dengan water bath,
kemudian didinginkan selama 25 menit dan diukur absorbannya
dengan spektrofotometer UV (HITACHI) pada panjang gelombang
660 nm. Persentase inhibisi dari denaturasi BSA dapat
BAB 4
HASIL DAN PEMBAHASAN
4.1 Isolasi Etil p-metoksisinamat Dari Rimpang Kencur
Senyawa etil p-metoksisinamat diisolasi dari tanaman kencur (Kaempferia
galanga L.).Kencur yang digunakan telah dideterminasi oleh Herbarium Bogoriense
Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong,
Bogor.Sebanyak 10 kg rimpang kencur dikupas, dicuci dan diris tipis-tipis ± 2 mm
kemudian dikeringkan tanpa melalui pemanasan sinar matahari langsung.Potongan
rimpang yang sudah kering diblender sampai terbentuk serbuk halus dan
menghasilkan sebanyak 858 gram serbuk simplisia kencur.Serbuk simplisia yang
dihasilkan berwarna cokelat kekuningan.Gambar serbuk simplisia dapat dilihat pada
Gambar 4.2.
Gambar 4.2.Serbuk Kering Simplisia Kencur (Koleksi Pribadi)
Isolasi senyawa etil p-metoksisinamat dilakukan dengan tiga tahap yaitu
pembuatan serbuk simplisia, maserasi simplisia dengan pelarut n-heksan, dan
rekristalisasi senyawa hasil isolasi. Setelah hasil maserasi diuapkan menggunakan
Vacuum Rotary Evaporator, senyawa etil p-metoksi sinamat yang terdapat dalam
ekstrak kental akan mengkristal pada suhu ruang sehingga memudahkan tahap isolasi
selanjutnya.
Proses rekristalisasi dilakukan dengan n-heksan dan metanol. Kristal yang
didapat berwarna kekuningan lalu dibilas menggunakan pelarut n-heksan dan metanol
sampai didapat kristal yang berwarna putih. Kristal putih yang didapat kemudian
dilakukan pengecekan dengan KLT menggunakan eluen heksan : etil asetat dengan
perbandingan 9:1, didapatkan nilai Rf= 0,5882.
Rendemen Kristal :
% rendemen = ����
Gambar 4.3 Hasil KLT Isolat Kencur eluen etil asetat :n-heksan (visualisasi UV λ 245 nm)
4.1.1 Identifikasi Senyawa Hasil Isolasi a. Pemerian
Warna : Putih kekuningan
Bau : Aromatik khas
Bentuk : Kristal
b. Pengukuran Titik Leleh
Pengukuran titik leleh dilakukan menggunakan alat DSC. Rentang
titik leleh senyawaetil p-metoksisinamat ada pada 47-52˚ C dengan nilai
entalpi (H) 78,60 J/g.
c. Analisa Senyawa Hasil Isolasi
Analisa senyawa hasil isolasi dilakukan menggunakan Kromatografi
Gas – Spektrometer Massa (GCMS) untuk mengetahui berat molekul
senyawa serta fragmentasi massa, spektrofotometri IR untuk mengetahui
gugus fungsi, dan spektrofotometer 1H-NMR untuk mengetahui letak
Table 4.1 menunjukkan spektrum IR senyawa isolat kencur dari
berbagai bilangan gelombang absorbsi gugus fungsi yang menggambarkan
bahwa ditemukan serapan pada bilangan gelombang v 1367,58 – 1321,3
cm-1 yang merupakan serapan spesifik dari ikatan C-O dan pada bilangan
gelombang v 1704,18 cm-1 yang merupakan serapan dari ikatan C=O.
Kedua serapan tersebut menunjukkan adanya suatu gugus ester.
Table 4.1 Daftar daerah spektrum IR isolat kencur (etil
p-metoksisinamat)
Gugus Fungsi Daerah Absorbansi (v, cm-1)
C-O Aril 1252,82-1210,38, 1029,07
C-H Alifatik 2979,18-2842,23
C=C Aril 1629,92-1573,02
C-H Aril 3007,15-3045,73
C-O 1367,59-1321,3
C=O 1704,18
Gambar 4.4 Spektrum IR Isolat Kencur
Adanya gugus aromatik ditunjukkan dengan terdapatnya ikatan C=C pada
bilangan gelombang v 1629,92 – 1573,02 cm-1. Pita serapan pada bilangan
gelombang v 3007,15 – 3045,73 cm-1 merupakan serapan spesifik dari ikatan antara
C-H, pada bilangan gelombang 1252,82 – 1210,38 cm-1 dan 1029,07 terdapat ikatan
C-O, kedua ikatan tersebut terletak pada gugus aromatik. Ikatan C-H alifatik
ditemukan pada bilangan gelombang 2979,18 – 2842,23 cm-1.
Analisa GCMS menunjukkan bahwa isolat kencur mempunyai waktu retensi
9,932 serta memiliki berat molekul 206,0 dengan fragmentasi massa pada 161; 134;
118; 103; 89; 77; 63 dan 51 (Lampiran 4). Menurut literatur, senyawa etil
p-metoksisinamat menunjukkan waktu retensi 9,9 dengan berat molekul 206,4 serta
Analisa terakhir yang dilakukan adalah dengan 1H-NMR dimana
interpretasinya berupa pergeseran kimia (δ) dalam satuan ppm.Nilai pergeseran kimia
adalah perbedaan resonansi frekuensi suatu inti relatif terhadap standar (Pavia et al.,
2008).Dalam penelitian ini hasil interpretasi 1H NMR senyawa isolat kencur
dibandingkan dengan hasil interpretasi 1H NMR senyawa etil p-metoksisinamat
penelitian Umar (2012). Pada penelitian ini didapatkan spectrum 1H NMR
memberikan sinyal pada pergeseran kimia 1,33 (3H) berbentuk triplet dan juga
muncul pada 4,25 ppm (2H) berbentuk kuartet yang lebih downfield karena berikatan
dengan oksigen. Spectrum 1H NMR juga memberikan sinyal pada 3,82 ppm (3H)
berbentuk singlet yang lebih downfield karena berikatan dengan oksigen –OCH (
Gambar 4.6 Pola Fragmentasi GCMS Isolat Kencur (Etil p-metoksisinamat)
Pada pergeseran kimia 6,31 ppm (1H) berbentuk doublet memilikihubungan
puncak dengan pergeseran kimia 7,65 (1H) berbentuk doublet, kedua puncak ini
memiliki nilai konstanta kopling yang dekat yaitu 15,6 dan 16,25 Hz. Hal ini
menunjukkan bahwa bentuk tersebut berupa olefin dengan proton berkonfigurasi
trans. Pada pergeseran kimia 6,9 ppm – 7,4 ppm (4H) merupakan proton-proton dari
benzen dengan dua subtitusi. Pola sinyal ini menunjukkan bahwa 2 proton yang
ekivalen terkopling secara ortho dengan 2 proton yang ekivalen lainnya, yang
Tabel 4.2 Data Pergeseran Kimia (δ ) spectrum H 1NMR senyawa etil p-metoksisinamat
Posisi
Pergeseran Kimia (δ, ppm)
Etil p-metoksisinamat (CDCL3) Etil p-metoksisinamat
(d6-DMSO) [Umar et al., 2012]
1 1,33 (t, 3H, J=7,15 1,24 (t, 3H, J=12)
2 4,25 (q, 2H, J=7,15) 4,60 (q, 2H, J=11,5)
4 6,31 (d, 1H, J=15,6) 6,45 (d, 1H, J=16,5)
5 7,65 (d, 1H, J=16,25) 7,63 (m, 1H)
7 6,90 (d, 1H, J=9,05) 6,97 (d, 1H, J=14,5)
8 7,47 (d, 1H, J=8,45) 7,63 (m, 1H)
10 7,47 (d, 1H, J=8,45) 7,63 (m, 1H)
11 6,90 (d, 1H, J=9,05) 6,97 (d, 1H, J=14,5)
12 3,82 (s, 3H) 3,83 (s, 3H)
Dari data IR, GCMS, dan 1H-NMR dapat disimpulkan bahwa senyawa hasil isolasi
dari kencur (Kaempferia galanga L.) adalah etil p-metoksisinamat.
4.2 Modifikasi Struktur Etil p-metoksisinamat dengan Reaksi Amidasi
Reaksi amidasi etil p-metoksisinamat dilakukan dengan mereaksikan langsung
dengan dietanolamin pada suhu tinggi.Adanya amina apabila direaksikan dengan
ester baru dapat terjadi pada suhu tinggi dan sangat lambat sekali apabila dilakukan
pada suhu rendah dengan bantuan katalis basa Lewis NaOMe yang lebih kuat dari
trietilamin.Reaksi amidasi antara amina dan ester dengan bantuan katalis NaOMe
baru dapat terjadi pada suhu 100°-120° C sedangkan apabila tidak digunakan katalis
maka reaksi baru dapat terjadi pada suhu 150°-250° C (Gabriel, R., 1984).
Amidasi etil p-metoksisinamat dengan dietanolamin ini didasari oleh prinsip
HSAB (Hard Soft Acid Base).Dimana H+ dari gugus NH dari dietanolamin
merupakan asam keras (Hard Acid) yang mudah bereaksi dengan –OC2H5 dari etil
p-metoksisinamat yang merupakan basa keras (Hard Base).NH- pada gugus NH dari
dietanolamin merupakan basa lunak (Soft Base) yang selanjutnya bereaksi
membentuk ikatan dengan para metoksisinamat (R-C+=O) yang merupakan asam
lunak (Soft Acid). Reaksinya sebagai berikut:
Gambar 4.9 Mekanisme Reaksi Amidasi Etil p-metoksisinamat dengan
Dietanolamin
Untuk menjalankan reaksi ini dilakukan pemanasan pada suhu tinggi (200° C)
hasil reaksi berupa cairan kental berwarna kekuningan. Ketika reaksi selesai,
dilakukan pencucian produk hasil reaksi dengan pelarut n-heksan.Setelah itu
dilakukan pengecekkan menggunakan KLT dengan eluen etil asetat dan metanol
perbandingan 4:1. Apabila belum terbentuk spot baru maka dilakukan pemanasan
kembali dengan penambahan dietanolamin.
Gambar 4.10Hasil KLT senyawa hasil amidasi dengan eluen etil asetat
: metanol perbandingan 4:1 (visualisasi UV λ 245 nm)
Keterangan : (1) Etil p-metoksisinamat (2) Senyawa Hasil Amidasi
Dari hasil KLT dapat terlihat spot baru terbentuk yang berbeda yang
merupakan senyawa hasil amidasi. Reaksi amidasi bertujuan mengganti gugus fungsi
ester dari etil p-metoksisinamat menjadi gugus fungsi amida sehingga dapat dilihat
efeknya terhadap aktivitas antiiflamasi.
% rendemen amidasi = , ����
8, gram x 100% = 20,047%
4.2.1Identifikasi Senyawa Hasil Modifikasi
Identifikasi senyawa hasil modifikasi dilakukan beberapa cara yaitu
dengan perhitungan nilai Rf, uji organoleptik, serta elusidasi struktur
menggunakan IR, GCMS, dan 1H-NMR.
Dari uji organoleptik didapatkan karakteristik senyawa amidasi adalah
sebagai berikut :
Warna : Kuning
Bau : Khas
Bentuk : Cairan kental
Elusidasi struktrur senyawa hasil amidasi menggunakan IR didapatkan
spektrum IR pada tabel 4.3 yaitu ditemukan pita serapan pada bilangan gelombang v
1365,60 cm-1 yang merupakan serapan spesifik dari ikatan C-O, adanya atom N
ditandai dengan ikatan C-N pada pita serapan di panjang gelombang 1288,45 cm-1,
ikatan C=C aromatik juga ditemukan dengan adanya serapan pada panjang
gelombang 1512,19 cm-1, ditemukan adanya ikatn C=O pada panjang gelombang
1639,49 cm-1, dan adanya OH ditandai dengan munculnya pita serapan pada panjang
gelombang 3273,20 cm-1.
Tabel 4.3 Daftar daerah spectrum IR Senyawa Hasil Amidasi
Ikatan Daerah Absorbansi (v, cm-1)
Gambar 4.11 Spektrum IR Senyawa Hasil Amidasi
Gambar 4.12 Pola Fragmentasi GCMS Senyawa Hasil Amidasi
Analisa kedua dilakukan menggunakan GCMS. Interpretasi GCMS
menunjukkan bahwa senyawa hasil amidasi muncul pada waktu retensi
14,475 dengan berat molekul 265,1 dan fragmentasi massa muncul pada
220, 161, 133, 90, dan 63.
Tabel 4.4 Data pergeseran kimia (δ) spektrum 1H NMR Senyawa Hasil Amidasi
(CD3OD, 500 MHz)
Posisi
Pergeseran Kimia (δ, ppm)
Etil p-metoksisinamat Senyawa Hasil Amidasi
1 - 2,7882 (t, 2H, J=5,2 Hz)
senyawa etil p-metoksisinamat. Pada d=6,9460 (J=1,95) dan d=7,5647 (J=1,95) yang
masing-masing mempunyai 2 proton mengindikasikan proton-proton dari benzen
dengan dua subtitusi. Pada pergeseran kimia 3,8194 yang mempunyai 3 proton,
muncul sebagai singlet menunjukkan adanya gugus OCH3 (metoksi) seperti halnya
yang ditemukan pada spektrum 1H NMR senyawa etil p-metoksisinamat. Pada d
berdekatandengan atom N. Pada pergeseran kimia 3,6 ppm – 3,8 ppm muncul peak
yang mengindikasikan adanya gugus CH2OH.
Dari data IR, GCMS, dan 1H NMR dapat disimpulkan bahwa senyawa yang
terbentuk dari reaksi antara etil p-metoksisinamat dan dietanolamin adalah senyawa
dietil p-metoksisinamamid (C14H19NO4).
Gambar 4.15Kemungkinan Struktur Senyawa Hasil Amidasi
4.3 Pengujian Aktivitas Antiinflamasi dan Hubungan Struktur Aktivitas Senyawa Hasil Modifikasi
Uji inhibisi denaturasi Bovine Serum Albumin (BSA) dengan rentang
konsentrasi uji 50-0,035 ppm yang dapat memberikan % inhibisi >20% dianggap
meliliki aktivitas antiinflamasi yang potensial (Williamset al, 2008).Uji aktivitas
antiinflamasi dengan metode ini dilakukan pada dua senyawa yang didapat yaitu etil
p-metoksisinamat dan dietil p-metoksisisinamamid dengan natrium diklofenak
sebagai kontrol positif.
Natrium diklofenak aktif memberikan efek antiinflamasi dimulai pada
konsentrasi 5 ppm dengan inhibisi sebesar 23,71% dan pada konsentrasi 40 ppm
Table 4.5 Hasil uji antiinflamasi etil p-metoksisinamat dan turunannya
No. Sampel Konsentrasi % inhibisi
1 Natrium Diklofenak
Senyawa hasil amidasi, dietil p-metoksisinamamid, merupakan hasil reaksi amidasi
dari etil p-metoksisinamat dan dietanolamin. Pada Tabel 4 dapat dilihat bahwa
senyawa hasil amidasi mulai menunjukkan aktivitas antiinflamasi pada konsentrasi 5
ppm yaitu dengan persentase inhibisi sebesar 37,32% sedangkan pada konstentrasi 40
ppm memiliki persentase inhibisi sebesar 86,00%. Data ini menunjukkan senyawa
hasil amidasi memiliki aktivitas antiinflamasi yang lebih besar dibandingkan senyawa
induknya, etil p-metoksisinamat, yang hanya memiliki persentase inhibisi 36,61%
pada konsentrasi 40 ppm. Hal ini menunjukkan bahwa modifikasi struktur yang
dilakukan pada gugus ester dari etil p-metoksisinamat menjadi turunan amida dengan
(1) (2)
Gambar 4.16 Struktur Kimia (1) Etil p-metoksisinamat; (2) Senyawa Hasil Amidasi
Gambar 4.17 Kurva Hasil Uji Antiinflamasi Senyawa Hasil Amidasi y = 1.6913x + 25.365
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Modifikasi struktur gugus fungsi ester dari etil p-metoksisinamat melalui
reaksi amidasi dengan dietanolamin menghasilkan senyawa dietil
p-metoksisinamamid (C14H19NO4) dengan berat molekul 265,1.
2. Senyawa hasil amidasi memiliki persentase inhibisi denaturasi protein sebesar
pada konsentrasi 5 ppm sebesar 37,32% dan 40 ppm sebesar 86,00% dengan
nilai IC50 pada nilai 14,565ppm. Hubungan struktur hasil modifikasi etil
p-metoksisinamat terhadap antiinflamasi menunjukkan pergantian gugus fungsi
ester menjadi amida dapat meningkatkan aktivitas antiinflamasi.
5.2 Saran
Perlu adanya penelitian lanjutan tentang aktivitas inflamasi dari senyawa
dietil p-metoksisinamamid serta optimasi reaksi dan pereaksi, kondisi reaksi
maupun waktu reaksi sehingga dapat diperoleh rendemen senyawa yang lebih
DAFTAR PUSTAKA
Bachtiar, Ujang Yuyut , 2005, Konversi Etil P-Metoksisinamat Menjadi Asam P
Metoksisinamat Dengan Iradiasi Gelombang Micro Melalui Media Kalium
Karbonat, Undergraduate Theses of Airlangga University, Surabaya.
Bangun, Robijanto. 2011. Semi Sintesis N,N-Bis(2-Hidroksietil)-3-(4-Metoksifenil)
Akrilamida Dari Etil P-Metoksisinamat Hasil Isolasi Rimpang Kencur
(Kaempferia Galanga, L) Melalui Amidasi Dengan Dietanolamin. Medan:
Universitas Sumetra Utara.
Barus, Rosbina. 2009. Amidasi Etil p-Metoksi Sinamat yang Diisolasi dari Kencur
(Kaempferia Galanga, Linn). Medan: Sekolah Pasca Sarjana Universitas
Sumatera Utara.
Bellanti, J.A,1993. Imunologi III edisi ke 3. Penerjemah Samik Wahab, Gajah Mada
University Press Yogyakarta
Chandra, Sangita. 2012. Evaluation of in vitro anti-inflammatory activity of coffee
against the denaturation of protein.Asian Pacific Journal of Tropical
Biomedicine S178-S180.
Chemical Book. Akses online via http://www.chemicalbook.com/ (Diakses pada
tanggal 26 Januari 2014)
Departemen Kesehatan RI. 1995. Farmakope Indonesia Edisi IV. Jakarta.
Farmakologi dan Terapi UI. 2007. Departemen Farmakologi dan Terapeutik Fakultas
Kedokteran Universitas Indonesia. Jakarta
Firdausi, Nur Indah., 2009, Isolasi Senyawa Etil Para Metoksi Sinamat (Epms) dari
Rimpang Kencur Sebagai Bahan Tabir Surya Pada Industri Kosmetik, Fakultas
Matematika dan Ilmu Pengetahuan Alam Jurusan Kimia Universitas Negeri
Malang, Malang.
Halen, Parmeshwari K.; Prashant R. Murumkar; Rajani Giridhar; Mange Ram Yadav.
2009. Prodrug Designing of NSAIDs. Mini-Reviews in Medicinal Chemistry, 9,
Hidayati, Nur; SM Widyastuti; Subagus Wahyuono. 2012. Isolasi Dan Identifikasi
Senyawa Antifungal Akar Acacia Mangium Dan Aktivitasnya Terhadap
Ganoderma Lucidum. Sekolah Pasca Sarjana : Universitas Gadjah Mada.
Kalgutkar, Amit S.; Brenda C.; Scott W. R.; Alan B. M.; Kevin R. K.; Rory P. R.;
Lawrence J. M.. 1999. Biochemically based design of cyclooxygenase-2
(COX-2) inhibitors: Facile conversion of nonsteroidal antiinflammatory drugs to
potent and highly selective COX-2 inhibitors. J. Med . Chem. 2000, 43 ,
2860-2870.
Khoirunni’mah, Zulfa. 2012. Modifikasi Stuktur Senyawa Metil Sinamat Melalui Proses Nitrasi Serta Uji BSLT (Brine Shrimp Lethality Test) Terhadap
Senyawa Hasil Modifikasi. Jakarta: UIN Syaif Hidayatullah.
Larson, Richard A.; Eric J. Weber. 1994. Reaction Mechanisms In Environmental
Organic Chemistry. Lewis Publisher : United States of America.
Nugroho, Ignatius Adi.. 2010. Implementasi Program Pengelolaan dan Konservasi
Suumber daya Genetik Hutan di Tingkat nasional. APFORGEN (Asia Pasific
forest genetic Resorces Programme) newsletter Edisi 2.
Nurhalimah, Neneng. 2013. Modifikasi Struktur Senyawa Metil Sinamat Melalui
Reaksi Amidasi Serta Uji Aktivitas Antikanker Terhadap Senyawa Hasil
Modifikasi. Jakarta: UIN Syarif Hidayatullah.
Nurhayati, Umi. 2010. Modifikasi Struktur Etilp-Metoksisinamat Hasil Isolasi Dari
Rimpang Kencur (Kaempferia Gatanga Linn) Menggunakan Pereaksi Pemecah
Eter.Universitas Negeri Yogyakarta.
Oyedapo, O.O.; B.A Akinpeu; K.F. Akinwunmi; M.O Adeyinka; F.O Sipeolu. 2010.
Red Blood Cell Membrane Stabilizing Potentials of Extracts of Lantana camara
and Its Fractions. International Journal of Plant Phsyiology and BioChemistry
Vol. 2(4) 46-51.
Pavia, Donald L.; Gary M.Lampman; George S.Kriz; James R. Vyvyan. 2008.
Introduction to Spectroscopy Fourth Edition. Brooks/Cole Cengage Learning.
Probowati, Astri; Giovanni, Paradigma Carlo; Ikhsan, Diyono.2012.Pembuatan
Surfaktan Dari Minyak Kelapa Murni (VCO) Melalui Proses Amidasi Dengan
Katalis NaOH.Jurnal Teknologi Kimia dan Industri. Vol. 1, No. 1, 424-432.
Rostiana, O., S. M. Rosita, H. Wawan, Supriadi, dan A. Siti, 2003, Status Pemuliaan
Tanaman Kencur. Perkembangan Teknologi TRO, 15, 2, 25-38.
Roth, H.J. et al. 1994. Analisis Farmasi, cetakan kedua diterjemahkan oleh Sardjono
Kisman dan Slamet Ibrahim. Gadjah Mada University Press. Yogyakarta.
Rukmana, Rahmat. 1994. Kencur. Yogyakarta : Penerbit Kanisius. Cetakan ke-13.
Sastroamidjojo, Hardjono. 1985. Spektroskopi Edisi I. Liberty. Yogyakarta.
Sadek, Basem; Hamruoni, Amar Mansuor; Adem, Abdu. 2013. Anti-inflammatory
agents of the carbamoylmethyl ester class: synthesis, characterization, and
pharmacological evaluation.Journal of Inflammation Research 6 35-43.
Siswandono, Soekardjo Bambang. 2000. Kimia Medisinal. Surabaya: Airlangga
University Press.
Stahl, Egon. 1985. Analisis Obat Secara Kromatografi dan Mikroskopi. Institut
Teknologi Bandung. Bandung.
Sukandar E Y, Tren dan Paradigma Dunia Farmasi, Industri-Klinik-Teknologi
Kesehatan, disampaikan dalam orasi ilmiah Dies Natalis ITB,
http://itb.ac.id/focus/focus_file/orasi-ilmiah-dies-45.pdf, diakses Januari 2014.
Sukari, M. A., N. W. M. Sharif, A. L. C. Yap, S. W. Tang, B. K. Neoh, M. Rahmani,
G. C. L. Ee, Y. H. Taufiq-Yap, and U. K. Yusof, 2008, Chemical Constituens
Variations of Essential Oils from Rhizomes of Four Zingiberaceae Species, The
Malaysian J. Anal. Sci., 12:3, 638-644.
Sulaiman, M.R.; Z.A. Zakaria; I.A.Daud; F.N.Ng ; Y.C.Ng; M.T. Hidayat. 2008.
Antinociceptive and Anti-inflammatory activities of The Aqueous extract of
Kaempferia galanga leaves in animal models. J.Nat Med 62:221-227.
Surbakti, Darwis. Isolasi dan Transformasi Etil p-metoksisinamat dari Kaempferia
Galanga, Linn. Tesis ITB via Perpustakaan Digital ITB ( http://digilib.itb.ac.id/
Takeuchi, Koji; Hideki Ukawa; Akira Konaka; Motohiro Kitamura; Yasunari
Sugawa. 1998. Effect of Nitric Oxide-Releasing Aspirin Derivative on Gastric
Functional and Ulcerogenic Responses in Rats: Comparison With Plain
Aspirin. Journal Pharmacology and Experimental Theraupetics Vol. 286 No.1
115-121
Taufikurohmah, T.; Rusmini; Nurhayati. 2008. Pemilihan Pelarut Optimasi Suhu
Pada Isolasi Senyawa Etil Para Metoksi Sinamat (EPMS) Dari Rimpang
Kencur Sebagai Bahan Tabir Surya Pada Industri Kosmetik.
Umar, Muhammad I.; Mohd Zaini Asmawi; Amirin Sadikun; Item J. Atangwho 1;
Mun Fei Yam; Rabia Altaf; Ashfaq Ahmed. 2012. Bioactivity-Guided Isolation
of Ethyl-p-methoxycinnamate, an Anti-inflammatory Constituent, from
Kaempferia galanga L. Extracts.Molecules, 17, 8720-8734.
Willard, Hobart H.; Lynne L. Merritt, Jr.; John A. Dean; Frank A. Settle, Jr. 1988.
Instrumental Methods of Analysis Seventh Edition. Wadsworth Publishing
Company. California.
Williams, LAD; A.O Connar; L. Latore; O Dennis; S. Ringer; J.A Whittaker; J
Conrad; B.Vogler; H Rosner; W Kraus. 2008. The In Vitro Anti-denaturation
Effects Induced by Natural Product and Non-steroidal Compounds in Heat
Treated (Immunogenic) Bovine Serum Albumin is Proposed as a Screening
Assay for the Detection of Anti-inflammatory compounds, without the Use of
Animals, in the Early Stages of The Drug Discovery Process. West Indian
Lampiran 1 Alur Penelitian
Isolasi Etil p-metoksisinamat dari Kencur (Kaempferia
galanga L.)
Senyawa Etil p-metoksisinamat
Identifikasi Senyawa Hasil Modifikasi
Analisa Hubungan Struktur dan Aktivitas Uji Aktivitas Antiinflamasi
Secara In-Vitro Modifikasi Struktur EPMS
dengan Reaksi Amidasi
Lampiran 2 Skema Isolasi Etil p-metoksisinamat
Rimpang Kencur
8 kg
Dipekatkan dgn Vacuum Rotary Evaporator
Dibersihkan dan
Filtrat pekat diendapkan pd suhu ruang
Rekristalisasi dgn n-heksan dan metanol Kristal yg terbentuk disaring
Lampiran 3 Perhitungan Bahan dan Rendemen Hasil Amidasi
Perhitungan bahan dan rendemen hasil amidasi
a. Etil p-metoksisinamat
Terpakai = 6 ekivalen x mol etil p-metoksisinamat
Lampiran 10 Hasil Uji Aktivitas Antiinflamasi
1. Persentase Inhibisi Denaturasi Protein Senyawa Uji
No. Sampel Konsentrasi % inhibisi
1 Natrium Diklofenak
2. Tabel Absorbansi Natrium Diklofenak
Sample Absorbansi Rata-Rata
0,304
3. Tabel Absorbansi Etil p-metoksisinamat
Sample Absorbansi Rata-Rata
4. Tabel Absorbansi Senyawa Hasil Amidasi
Sample Absorbansi Rata-Rata
Lampiran 11 Sertifikat Analisa Bahan
1. Sertifikat Analisa Metanol
2. Sertifikat Analisa Natrium Diklofenak
Lampiran 13 Dokumentasi
Serbuk Rimpang Kencur Senyawa Hasil Amidasi