SKALA LABORATORIUM
PURNAMAWATI
C151 070 021
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis dengan judul Tingkat Perombakan Bahan Organik Sedimen Waduk Cirata Pada Kondisi Anaerobik Skala Laboratorium adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau di kutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2009
PURNAMAWATI. The Organics Matter Decomposition level of Cirata Reservoir Sediment in Anaerobic on Laboratory Treatment). Under supervision of KUKUH NIRMALA and TRI HERU PRIHADI.
Sources of the pollution at Cirata Reservoir are from industrial activities, household waste, agricultural waste, and the leftover from the activities of floating net fish cages. The wastes are in the form of fat, protein and carbohydrat. In decomposition process and the rate of destruction process of organic matters in the sediment is carried our by bacteria, resulting in the oxygen dissolved in the waters will decrease. Therefore, it is necessary to carry out research the organics metter decomposition level of Cirata Reservoir sediment in anaerobicto find out dynamic pattern the organics matter decomposition of water and sediment. This lessens the oxygen at Cirata reservoir so that decomposition process takes place anaerobically at the bottom of the waters. Research was carried out in the waters of Cirata reservoir. The activity was conducted in two stages: field activity and laboratory activity. Field activity consisted of initial survey and sample analysis in the laboratory. In the meantime, the activity in the laboratory included sediment treatment from Cirata reservoir which was done for 2 months (October 2008 until December 2008), followed by laboratory analysis and data analysis. Sample analysis was performed in Waters Environment Laboratory of Agricultural Departement FPIK–IPB and in Microbiology Laboratory of Biology Departement. Analysis descriptivethe organics matter decomposition level of Cirata Reservoir sediment in anaerobic on laboratory treatment indicated that anaerobic process was reached on the 20th day. The result of laboratory analysis showed that number and types of bacteria had already belonged to the group of anaerobe bacteria. The result would be confirmed to dendogram classification hierarchy, result revealed that stations of observation were divided into 2 groups according of affecting characteristics. Group 1 covering stasion 1 and 2, group 2 which covering station 3 was characterized by high presentation nitrit. The result showed that the level of decomposition Sediment Organic Matter, water quality in Cirata reservoir based on IKA_STORET valued class III catagorized as worse. Valued sulfide, amonia, Fenol, Total Fosfat is considered not good for activities of fish culture.
PURNAMAWATI. Tingkat Perombakan Bahan Organik Sedimen
Waduk Cirata Pada Kondisi Anaerobik Skala Laboratorium.
Dibimbing oleh KUKUH NIRMALA DAN TRI HERU PRIHADI.
Semakin banyak KJA yang beroperasi akan semakin banyak limbah organik berupa buangan sisa pakan dan feses yang terakumulasi dalam Waduk Cirata. Seiring dengan meningkatnya bahan organik akan menyebabkan menurunnya konsentrasi oksigen (DO) di lapisan hipolimnion, hal ini terjadi karena oksigen dibutuhkan mikroorganisme (bakteri aerob dan bakteri anaerob) untuk merombak bahan organik menjadi senyawa yang lebih sederhana. Bila aktivitas bakteri pengurai ini berlangsung intensif, maka kualitas air waduk akan menjadi anaerob. Yang mana saat terjadi proses perombakan sisa pakan/kotoran akan membebaskanunsur hara N, P, dan K yang mengakibatkan cadangan DO di perairan menjadi berkurang. Penelitian tingkat Perombakan Bahan Organik Sedimen Waduk Cirata Pada Kondisi Anaerobik Skala Laboratorium telah dilakukan pada bulan Oktober 2008–Desember 2008. Tujuan penelitian ini adalah untuk melihat tingkat perombakan bahan organik sedimen Waduk Cirata pada kondisi anaerob. Penelitian ini menggunakan metode deskriptif, kegiatan dilakukan dalam dua tahap yaitu kegiatan lapangan dan pengamatan di Laboratorium Lingkungan Perairan Departemen Akuakultur FPIK–IPB. Kegiatan lapangan terdiri dari survai awal, analisis kualitas air dan analisis sedimen hasil survei awal dilakukan di Laboratorium Lingkungan Perairan Departemen Akuakultur FPIK–IPB. Parameter kualitas air yang diukur pada survei awal meliputi: kedalaman, suhu air, pH, dan DO, sedangkan untuk pengukuran karbondioksida (CO2), fosfat total, phospat ortho (PO4), nitrit (NO2), nitrat (NO3),
amoniak (NH3), alkalinitas, kesadahan, sulfida total (H2S), COD, BOD, Ca dan
meliputi suhu, DO, karbondioksida (CO2), total fosfat, ortho phospat (PO4), nitrit
(NO2), nitrat (NO3), amoniak (NH3), alkalinitas, kesadahan, sulfida total (H2S),
COD, BOD Ca, dan C-Organik dilakukan pada hari ke 0, 20, 40, dan 60. Sedangkan parameter yang diukur setiap hari yaitu: Redoks, suhu, DO, pH. Pengamatan jumlah dan jenis bakteri dilakukan pada awal dan akhir penelitian (hari ke 0 dan 60).Analisis kualitas air dan analisis sedimen hasil pengamatan di laboratorium dilakukan di Laboratorium Lingkungan Perairan Departemen Akuakultur FPIK–IPB dan analisa bakteri hasil pengamatan di laboratorium dilaksanakan di Laboratorium Mikrobiologi Departemen Biologi. Analisa data yang digunakan meliputi evaluasi dengan metode STORET, Analisis deskriptif dan analisis cluster (Cluster Analysis) menggunakan MINITAB versi 14.0. dan diinterpretasikan dalam bentuk Dendrogram.
Dari hasil analisis deskriptif fisika kimia air dan sedimen yang dilihat pada grafik pola dinamika tingkat perombakan menujukkan pada hari ke-20 terjadinya degradasi bahan organik dan reduksi (pengurangan oksigen), tingginya nilai sulfida, BOD, amonia, nitrit dan nitrat. Sehingga menunjukkan bahwa proses dekomposisi yang terjadi pada sedimen termasuk dalam kategori anaerobik. Sebaran karakteristik fisika kimia air dan sedimen memperlihatkan bahwa Stasiun 3 (dibagian out let) memiliki nilai nitrit yang tinggi. Skor IKA_STORET yang dihitung berdasarkan baku mutu Kelas III menunjukkan nilai sulfide, amonia, fenol dan total fosfat sudah tidak memenuhi baku mutu untuk peruntukan budidaya ikan air tawar.
©
Hak cipta milik IPB, tahun 2009
Hak cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penukisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
TINGKAT PEROMBAKAN BAHAN ORGANIK
SEDIMEN WADUK CIRATA PADA KONDISI ANAEROBIK
SKALA LABORATORIUM
PURNAMAWATI
C151 070 021
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
pada Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Tingkat Perombakan Bahan Organik Sedimen Waduk Cirata Pada Kondisi Anaerobik Skala Laboratorium.
Nama : Purnamawati
NRP : C151070021
Disetujui Komisi Pembimbing
Dr. Ir. Kukuh Nirmala, M.Sc Dr. Ir. Tri Heru Prihadi, M.Sc
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana IPB Ilmu Akuakultur Program Magister,
Prof. Dr. Ir. Enang Harris, MS Prof. Dr. Ir. Khairil A.Notodiputro, M.S.
Syukur Alhamdulillah, atas rahmat dan ridho Allah SWT penulis dapat menyelesaikan karya ilmiah ini. Tema yang dipilih dalam penelitian ini adalah perombakan bahan organik, dengan judul “Tingkat Perombakan Bahan Organik Sedimen Waduk Cirata Pada Kondisi Anaerobik Skala Laboratorium”.
Tesis ini merupakan salah satu syarat untuk memperoleh gelas Master pada Program Studi Ilmu Akuakultur, Sekolah Pascasarjana Institut Pertanian Bogor.
Seiring dengan selesainya penulisan tesis ini, penulis mengucapkan rasa terima kasih yang sebesar-besarnya kepada :
1. Bapak Dr. Ir. Kukuh Nirmala, M.Sc., selaku Ketua Komisi Pembimbing, Bapak Dr. Ir. Tri Heru Prihadi, M.Sc selaku anggota komisi pembimbing yang telah memberikan kesempatan untuk ikut dalam kegiatan penelitian, atas keikhlasan dan kesabaran memberikan bimbingan, nasehat, arahan dan dorongan dalam menyelesaikan penulisan tesis ini.
2. Ditjen DIKTI Departemen Pendidikan Nasional atas bantuan dana pendidikan BPPS.
3. Direktur Politeknik Negeri Pontianak yang telah memberikan kesempatan kepada penulis untuk melanjutkan studi S2 di Sekolah Pascasarjana Institut Pertanian Bogor.
4. Kepada Ayahnda Drs. H. Zainal Abididn, AH (Alm) dan Ibunda Tersayang Hj. Nurhana, ZA.
5. Untuk Suami tercinta (Ir. Eko Dewantoro, M.Si) dan anak-anakku (Tiara Safitri Dewanti, Nanda Nabila Dewanti dan Dita Salsabila Dewanti), adik-adikku (Edy Hasbullah Kurnija dan Sabaruddin).
6. Adang Saputra, S.Pi., Afrizal Hendri, S.Pi, dan rekan-rekan Program Studi Akuakultur serta semua pihak atas kebersamaan dan kerjasama yang baik dalam penyelesaian karya ilmiah ini.
Semoga Allah SWT membalas semua kebaikan Bapak dan Ibu dengan berlipat ganda. Penulis menyadari karya ilmiah ini masih jauh dari sempurna, oleh karenanya saran untuk perbaikan akan sangat penulis hargai. Penulis berharap semoga hasil penelitian ini dapat bermanfaat bagi pihak yang memerlukannya. Amien..
Bogor, Juli 2009
Penulis dilahirkan di Pontianak, Kalimantan Barat pada tanggal 23 juli 1973 dari pasangan Bapak Drs. H. Zainal abidin, AH (Alm) dan Ibu Hj. Nurhana, ZA sebagai anak pertama dari tiga bersaudara.
Pendidikan sekolah dasar di SDN 75 Kodya Pontianak tamat tahun 1986, melanjutkan pendidikan ke Sekolah Menengah Pertama Negeri 5 kodya Pontianak tamat tahun 1989 dan pendidikan sekolah menengah atas penulis selesaikan di SMAN 4 Kodya Pontianak tamat tahun 1992. Pendidikan sarjana di tempuh pada Program Studi Budidaya Perairan, Jurusan Budidaya Perikanan, Universitas Muhammaddiyah Pontianak dan lulus pada tahun 1998. Pada tanggal 1 Maret 1999 – 1 Desember 2001 penulis diterima sebagai staf pengajar honorer pada SMU Budi Utomo Pontianak, pada tanggal 1 Mei 1999 – 1 Desember 2003 penulis diterima sebagai tenaga honorer staf peneliti di Balai Pengkajian Teknologi Pertanian Kalimantan Barat (BPTP Kalbar). Pada tanggal 1 Desember 2003 – sekarang penulis diangkat sebagai staf pengajar pada Politeknik Negeri Pontianak Jurusan Ilmu Kelautan dan Perikanan, Program Studi Budidaya Perikanan. Pada tanggal 17 Agustus 2007 penulis mendapatkan Piagam Penghargaan sebagai Dosen Berprestasi Peringkat I dengan No. SK. 1921/K15/KP/2007.
PRAKATA... ... xi
DAFTAR TABEL ………. xv
DAFTAR GAMBAR ……… xvi
1 PENDAHULUAN ... 1
1.1 Latar Belakang ………. 1
1.2 Perumusan Masalah ………... 2
1.3 Tujuan dan Manfaat Penelitian ………. 3
1.4 Hipotesis ……… 3
2 TINJAUAN PUSTAKA ……….. 5
2.1 Tipologi Waduk Cirata ………. 5
2.2 Bahan Organik ……… 7
2.3 Dekomposisi Anaerobik ……… 10
2.4 Ketersediaan Oksigen Terlarut ……….. 12
2.4.1 Fotositensis dan respirasi fitoplankton……… 12
2.4.2 Difusi ……….. 14
2.4.3 Susupan oksigen terlarut (Interflow)……….. 15
2.5 Kualitas Air……… 16
2.5.1 BOD5……… 17
2.5.2 Nitrit, Nitrat, Amonia... 18
2.5.3 Oksigen terlarut (DO) ... 19
2.5.4 Potensial redoks ... 21
2.5.5 pH ……… 22
2.5.6 Karbondioksida (CO2) ... 23
2.5.7 Alkalinitas ... 23
2.5.8 Kesadahan ... 27
2.5.9 Kalsium (Ca) ... 29
2.5.10 Hidrogen sulfida (H2S) dan bakteri SRB ... 30
2.5.11 Fenol... 30
2.5.12 Fosfor total dan Fosfat (PO4)...……… 30
2.5.13 COD (Chemical Oxygen Demand)……… 31
2.5.14 Suhu ...……… 32
3.1 Lokasi dan Waktu Penelitian ……… 34
3.2 Alat dan Bahan ... ……….. 34
3.3 Metode Pengumpulan Data ………. ……… 34
3.3.1 Kegiatan lapangan (survei awal) ……… 34
3.3.2 Pengamatan di laboratorium ……….……… 36
3.4. Analisa Data ……….. 38
3.4.1 Analisis deskriptif………... 38
3.4.2 Sebaran karakteristik fisika-kimia dan sedimen……… 39
3.4.3 Evaluasi dengan metode STORET………. 39
4 HASIL DAN PEMBAHASAN……… 41
4.1 Analisa deskriptif kualitas air dan sedimen....……… 41
4.2 Sebaran karakteristik fisika-kimia dan sedimen …. ……… 51
4.3 Evaluasi kualitas air dengan metode STORET...……… 52
5 KESIMPULAN DAN SARAN ... 56
DAFTAR PUSTAKA ... LAMPIRAN...
1. Data kualitas perairan Waduk Cirata pada tahun 2003 ……… 6
2. Bentuk senyawa hasil oksidasi bahan-bahan organik pada kondisi aerobik dan anaerobik...
12
3. Hubungan antara kadar oksigen terlarut jenuh dan suhu pada tekanan udara 760 mm Hg ……….
20
4. Kation dan anion utama pada perairan tawar dan laut……... 24
5. Kation-kation penyusun kesadahan dan anion-anion pasangan/ asosiasinya ………
27
6. Parameter-parameter kualitas air, sedimen dan biota air yang diamati dari hasil lapangan...
35
7. Parameter-parameter kualitas air, sedimen dan biota air yang diamati skala laboratorium...
37
8. Penentuan sistem nilai untuk menentukan status mutu perairan berdasarkan metode IKA_STORET...
40
9. Kisaran nilai rerata fisika kimia air dan sedimen pada hari ke-0, 20, 40 dan 60 selama penelitian ...
42
10. Hasil analisis bakteri pada media selama penelitian ... 43
11. Nilai status mutu air Waduk Cirata berdasarkan IKA_STORET... 53
12. Nilai parameter kualitas air hasil pengukuran dan berdasarkan baku mutu air...
1. Diagram laju perombakan bahan organik pada sedimen dalam kondisi aerobik di Waduk Cirata ...
4
2. Gradien potongan melintang factor-faktor yang mempengaruhi produktivitas dan biomassa, kepentingan relative autochtonous dan allochtonous di sepanjang longitudinal waduk ………
7
3. Gabungan diagram gaya (angin, gravitasi, evaporasi dan rotasi bumi) dan resultante arus air dan gelombang. Angin memindahkan air, gravitasi membuat aliran horizontal lebih mudah daripada vertikal, evaporasi mendinginkan permukaan air yang kemudian tenggelam, dan rotasi bumi memindahkan aliran permukaan ke kiri (dibelahan bumi utara) dan ke kanan di belahan bumi selatan……...………
15
4. Inflow densitas ke waduk………. 16
5. Penampang melintang tanah yang memperlihatkan proses terlarutnya kation penyusun kesadahan perairan ………..
28
6. Denah lokasi stasiun pengambilan contoh di Waduk Cirata ………… 38
7. Kisaran nilai BOD, amonia, nitrit dan nitrat (mg/L) pada hari ke 0, 20, 40 dan 60 selama penelitian ...
43
8. Kisaran nilai C-Organik (%)) sedimen pada hari ke 0, 20, 40 dan 60 selama penelitian ...
43
9. Kisaran nilai DO (mg/L) sedimen dan air media selama penelitian .... 44
10. Kisaran nilai potensial redoks (mV) sedimen media selama penelitian 44
11. Kisaran nilai pH pada sedimen dan air media selama penelitian ... 44
12. Kisaran nilai karbondioksida (CO2), alkalinitas dan kesadahan
(mg/L) pada hari ke 0, 20, 40 dan 60 selama penelitian ... 45
13. Kisaran nilai kalsium (Ca) air (mg/L) pada hari ke 0, 20, 40 dan 60 selama penelitian ...
45
14. Kisaran nilai kalsium (Ca) sedimen (mg/Kg) pada hari ke 0, 20, 40 dan 60 selama penelitian ...
45
15. Kisaran nilai COD (mg/L) pada hari ke 0, 20, 40 dan 60 selama penelitian ...
17. Kisaran nilai suhu (oC) pada sedimen (A) dan air (B) media selama penelitian ...
46
18. Dendogram pengelompokkan antar stasiun untuk kualitas air dan sedimen...
1. Kisaran nilai suhu sedimen (oC) media penelitian selama 60 hari ... 63
2. Kisaran nilai pH sedimen media penelitian selama 60 hari ... 64
3. Kisaran nilai oksigen terlarut (DO) (mg/L) sedimen media penelitian selama 60 hari ... 65 4. Kisaran nilai potensial redoks (mV) media penelitian selama 60 hari 66 5. Kisaran nilai suhu air (oC) media penelitian selama 60 hari ... 68
6. Kisaran nilai pH air media penelitian selama 60 hari ... 69
7. Kisaran nilai oksigen terlarut (DO) (mg/L) air media penelitian selama 60 hari ... 70 8. Data peubah kualitas air dan sedimen media penelitian berdasarkan stasiun I, II dan III pada hari ke 0, 20, 40 dan 60 ... 72 9. Grafik fisika kimia sedimen berdasarkan stasiun I, II dan III pada hari ke 0, 20, 40 dan 60 selama penelitian ... 74 10. Grafik fisika kimia air berdasarkan stasiun I, II dan III pada hari ke 0, 20, 40 dan 60 selama penelitian... 76 11. Grafik peubah kualitas air berdasarkan stasiun I, II dan III pada hari ke 0, 20, 40 dan 60 selama penelitian... 78 12. Hasil analisis cluster fisika kimia air ... 81
13. Hasil analisis cluster fisika kimia sedimen... 82
14. Hasil pengukuran dan analisis kualitas air Waduk Cirata... 84
1 PENDAHULUAN
1.1 Latar Belakang
Salah satu perairan waduk yang terkenal di Jawa Barat adalah “Waduk Cirata”. Waduk ini berperan penting sebagai salah satu sumberdaya perikanan didaerah tersebut. Kegiatan perikanan di Waduk Cirata selain budidaya dengan sistem keramba jaring apung (KJA) adalah kegiatan perikanan tangkap berskala kecil (small scale fisheries). Dengan luas Waduk Cirata 6.200 ha (Ilyas et al., 1990), kapasitas maksimal KJA yang bisa ditampung sekitar 10.000 unit KJA (Prihadi, 2005). Namun hingga Tahun 2009 jumlah keramba apung yang tercatat beroperasi di Waduk Cirata berjumlah 51.838 KJA (BPWC, 2009). Karena melebihi kapasitas maksimal waduk dan pemberian pakan yang berlebihan (over feeding), maka mengakibatkan sisa pakan yang tidak termakan dan hasil ekskresi yang terbuang ke badan air memberikan sumbangan bahan organik, yang pada akhirnya mempengaruhi tingkat kesuburan (eutrofikasi) dan kelayakan kualitas air bagi kehidupan ikan budidaya (Philips et al., 1993; Boyd, 1999; Simarmata, 2007).
Beberapa hasil penelitian melaporkan bahwa sisa buangan dari kegiatan perikanan keramba jaring apung (KJA) mencapai 80% berupa limbah organik seperti lemak, protein, dan karbohidrat memberikan dampak potensial pada perubahan kualitas air (Nastiti et al., 2001; Philips et al., 1993; Boyd, 1999). Selanjutnya Mc Donald et al. (1996) menyatakan bahwa 30% dari jumlah pakan yang diberikan tertinggal sebagai pakan yang tidak dikonsumsi dan 25% dari pakan yang dikonsumsi akan diekskresikan ini berarti bahan organik yang masuk ke badan air cukup besar.
Menurut Kartamihardja (1998)secara fisik, buangan sisa pakan yang tidak termakan dan kotoran ikan hasil dari ekskresi akan meningkatkan laju sedimentasi perairan. Dalam proses selanjutnya, sisa pakan dan kotoran ikan yang menumpuk di dasar perairan tersebut akan mengalami dekomposisi dan pembusukan, yang akan menghasilkan gas-gas beracun seperti amonia dan H2S. Dalam proses
semakin tinggi, sehingga sinar matahari dan penetrasi cahaya yang masuk ke dalam perairan menjadi terbatas. Kurangnya sinar matahari akan mempengaruhi proses fotosintesis. Dengan demikian oksigen menjadi berkurang, sehingga proses dekomposisi bahan organik di dasar perairan terjadi secara anaerob. Dari proses anaerob tersebut akan melepaskan gas-gas beracun sampai kelapisan hipolimnion yang akan mengakibatkan biota yang dipelihara di dalam KJA akan kekurangan oksigen, stress, terserang penyakit, yang pada akhirnya mati.
Diduga salah satu sumber toksisitas penyebab kematian ikan yang dibudidayakan yang terjadi pada saat pembalikan air di Waduk Cirata adalah selain difisit oksigen di hipolimnion juga akibat naiknya gas-gas beracun dari dasar perairan ke permukaan (upwelling) terutama pada saat musim hujan. Meningkatnya gas-gas beracun pada dasar perairan tergantung pada kecepatan proses perombakan yang dilakukan oleh bakteri pengurai (bakteri anaerob) di dasar perairan. Oleh sebab itu, perlu dilakukan penelitian tingkat perombakan bahan organik pada sedimen Waduk Cirata dalam kondisi anaerobik, sehingga diketahui pola dinamika tingkat perombakan bahan organik pada sedimen dan pola dinamika peubah kualitas airnya.
1.2 Perumusan Masalah
Semakin banyak KJA yang beroperasi akan semakin banyak limbah organik berupa buangan sisa pakan dan feses yang terakumulasi dalam Waduk Cirata. Seiring dengan meningkatnya bahan organik akan menyebabkan menurunnya konsentrasi oksigen (DO) di lapisan hipolimnion, hal ini terjadi karena oksigen dibutuhkan mikroorganisme (bakteri aerob dan bakteri anaerob) untuk merombak bahan organik menjadi senyawa yang lebih sederhana. Bila aktivitas bakteri pengurai ini berlangsung intensif, maka perombakan bahan organik yang terjadi pada waduk akan menjadi anaerob. Yang mana saat terjadi proses perombakan sisa pakan/kotoran akan membebaskanunsur hara N, P, dan K yang mengakibatkan cadangan DO di perairan menjadi berkurang.
Akumulasi sisa pakan/kotoran ikan serta produk dekomposisi sisa pakan hasil oksidasi menghasilkan bentuk senyawa CH4, NH3 + Amin, H2S dan PO3 yang
sehingga oksigen (DO) menjadi rendah, nitrat (NO3) rendah, nitrit (NO2)
meningkat, karbondioksida (CO2) meningkat, amoniak (NH3) meningkat, H2S
meningkat, Alkalinitas meningkat, kesadahan meningkat, kalsium (Ca) air dan sedimen turun, suhu semakin dingin, pH stabil, Bakteri semakin banyak.
Dengan terjadinya difisit oksigen di hipolimnion akibat naiknya gas-gas beracun dari dasar perairan ke permukaan tersebut maka menyebabkan kematian ikan yang dibudidayakan. Secara skematis perumusan masalah disajikan pada Gambar 1.
1.3 Tujuan dan Manfaat Penelitian
Adapun tujuan dari penelitian ini adalah
1. Untuk melihat tingkat perombakan bahan organik sedimen Waduk Cirata pada kondisi anaerob.
2. Untuk mengetahui sebaran karakteristik fisika-kimia perairan dan sedimen antar stasiun pengamatan
3. Untuk mengetahui baik buruknya kualitas air bagi budidaya ikan air tawar.
Hasil penelitian ini diharapkan dapat digunakan sebagai informasi awal atau masukan awal bagi para pengguna dan pembuat kebijakan baik instansi pemerintah maupun swasta atau instansi terkait lainnya, dalam rangka menentukan pengelolaan budidaya ikan dalam Keramba Jaring Apung (KJA) Waduk Cirata.
1.4 Hipotesis
1. Menumpuknya bahan organik di dasar perairan Waduk Cirata maka tingkat perombakan yang terjadi pada waduk akan menjadi anaerob.
2. Beberapa parameter kualitas air dan analisis sedimen Waduk Cirata pada kondisi anaerob dapat dijadikan sebagai indikator sebaran karakteristik fisika kimia perairan dan sedimen.
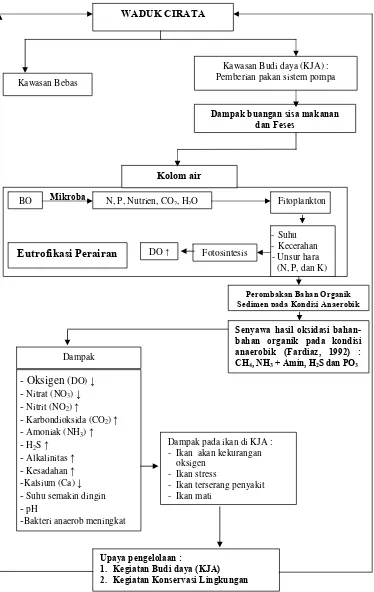
Gambar 1. Diagram tingkat perombakan bahan organik sedimen pada kondisi anaerobik di Waduk Cirata
Mikroba
-Suhu -Kecerahan - Unsur hara (N, P, dan K)
Fitoplankton
Fotosintesis
Perombakan Bahan Organik Sedimen pada Kondisi Anaerobik WADUK CIRATA
Kawasan Budi daya (KJA) : Pemberian pakan sistem pompa Kawasan Bebas
Dampak buangan sisa makanan dan Feses
Kolom air
Upaya pengelolaan :
1. Kegiatan Budi daya (KJA) 2. Kegiatan Konservasi Lingkungan
DO ↑
- Oksigen (DO) ↓ - Nitrat (NO3) ↓
- Nitrit (NO2) ↑
- Karbondioksida (CO2) ↑
- Amoniak (NH3) ↑
- H2S ↑
- Alkalinitas ↑ - Kesadahan ↑ -Kalsium (Ca) ↓ - Suhu semakin dingin - pH
-Bakteri anaerob meningkat Dampak
Dampak pada ikan di KJA : - Ikan akan kekurangan
oksigen - Ikan stress
- Ikan terserang penyakit - Ikan mati
BO N, P, Nutrien, CO2, H2O
Eutrofikasi Perairan
2 TINJAUAN PUSTAKA
2.1 Tipologi Waduk Cirata
Waduk merupakan tempat menampung air yang umumnya dibentuk dari sungai atau rawa dengan tujuan tertentu. Dan biasanya waduk memiliki drainase basin, kedalaman rata-rata, kedalaman maksimum, luas beban perairan yang lebih besar dibanding danau, tetapi dengan waktu tinggal yang lebih pendek dibanding danau (Ryding dan Rast, 1989).
Selanjutnya Ilyas et al. (1990) menegaskan, waduk merupakan badan air yang karakteristik fisika, kimia dan biologinya berbeda dari sungai yang dibendung. Dari kualitas airnya, waduk lebih stabil dibandingkan dengan sungai asalnya dan waduk dibuat dan diciptakan oleh manusia untuk tujuan tertentu.
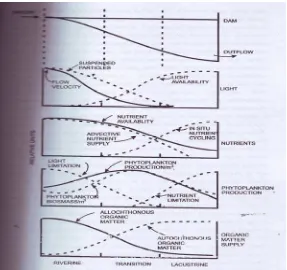
Waduk menunjukkan tingkat heterogenitas secara spasial dalam produktifitas dan biomassa fitoplankton karena adanya gradient longitudinal, kecepatan aliran, waktu tinggal, padatan tersuspensi dan ketersediaan cahaya dan nutrient. Secara longitudinal terdapat tiga zona yang berbeda di waduk (Gambar 2).
Waduk Cirata merupakan waduk yang berada ditengah-tengah DAS Citarum dan mendapatkan sumber air dari daerah aliran sungai Citarum. Berdasarkan karakteristik, Waduk Cirata berada 200 m dan waduk ini selesai dibangun pada tahun 1988. Volume air pada waktu normal sekitar 2.160.000.000 m3, dengan luas permukaan 6.200 ha, kedalaman rata-rata 34,9 m, status kesuburan mesotrophic hingga Eutrophic, pola pencampuran massa air Oligomictic (rare) (Prihadi, 2004).
mencapai 20,7 m. Hal ini disebabkan kemarau yang berkepanjangan, sehingga volume air berkurang hingga 30% dari keadaan normal sebelumnya.
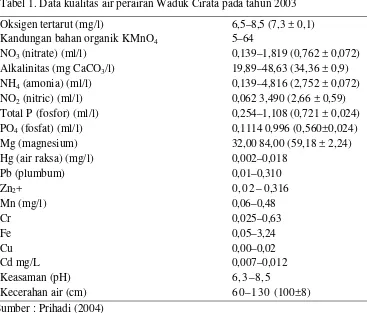
Pada tahun 2009 jumlah KJA di Waduk Cirata mencapai 51.838 unit KJA (BPWC, 2009), hal ini merupakan jumlah yang sudah melebihi kapasitas yang maksimal sekitar 10 ribuan unit. Akibat dari jumlah yang melebihi dari kapasitas asimilasi berdampak kepada data kualitas air (Tabel 1). Menurut hasil analisis, limbah pakan yang terdapat di Waduk Cirata berdasarkan kaedah Yap dalam Prihadi (2002) adalah limbah pakan yang berada di dasar perairan waduk akibat kegiatan perikanan budidaya sebanyak 279.121 ton, artinya jika luas permukaan 6.200 ha sedangkan luas permukaan kegiatan keramba jaring apung sekitar 158– 198 ha, dari perhitungan ini maka ketinggian limbah pakan sekitar 2 meter. Banyaknya pakan yang berada di dasar perairan tersebut sangat memungkinkan karena tingkat purifikasi air tidak mampu lagi bekerja untuk mensucikan dari limbah organik tersebut, sehingga usaha restorasi waduk perlu dilakukan segera.
Tabel 1. Data kualitas air perairan Waduk Cirata pada tahun 2003 Oksigen tertarut (mg/l) 6,5–8,5 (7,3 ± 0,1)
Kandungan bahan organik KMnO4 5–64
NO3(nitrate) (ml/l) 0,139–1,819 (0,762 ± 0,072)
Alkalinitas (mg CaCO3/l) 19,89–48,63 (34,36 ± 0,9)
NH4 (amonia) (ml/l) 0,139–4,816 (2,752 ± 0,072)
NO2 (nitric) (ml/l) 0,062 3,490 (2,66 ± 0,59)
Total P (fosfor) (ml/l) 0,254–1,108 (0,721 ± 0,024) PO4 (fosfat) (ml/l) 0,1114 0,996 (0,560±0,024)
Mg (magnesium) 32,00 84,00 (59,18 ± 2,24)
Hg (air raksa) (mg/l) 0,002–0,018
Pb (plumbum) 0,01–0,310
Zn2+ 0 , 0 2 – 0,316
Mn (mg/l) 0,06–0,48
Cr 0,025–0,63 Fe 0,05–3,24 Cu 0,00–0,02
Cd mg/L 0,007–0,012
Keasaman (pH) 6,3–8,5
Kecerahan air (cm) 6 0 –1 3 0 (100±8) Sumber : Prihadi (2004)
Gambar 2. Gradien potongan melintang faktor-faktor yang mempengaruhi produktifitas dan biomassa, kepentingan relative autochtonous dan allochtonous di sepanjang longitudinal waduk (Kimmel et al., dalam Thornton et al. 1990; Simarmata, 2007)
Perkembangan KJA di Waduk Cirata terbilang sangat cepat, (Garno & Adibroto, 1999 dalam Prihadi, 2005) mencatat pada tahun 1999 terdapat 27.786 KJA dengan produksi ikan 25.114 ton. KJA menutupi 136 ha atau 2,2% permukaan waduk dan sisa-sisa pakan yang tertampung di dalam waduk ada sekitar 198,376 ton (8,667 ton N dan 1,239 ton P) sedangkan pada tahun 2003 penulis mencatat sebanyak 38.276 unit KJA, sehingga sisa pakan yang berada di dasar waduk adalah sebesar 279.121 ton. Jumlah karamba ini sudah menutupi permukaan Waduk Cirata sebesar 15%–20%.
2.2 Bahan Organik
Sumber eksternal dapat berupa run off permukaan, agricultural dan forest drainage, atmosfir, buangan domestik dan buangan dari limbah industri (Vollenweider, 1986 dan Ahl, 1973 dalam Landner, 1976). Jumlah bahan organik di kolom air umumnya lebih rendah dibandingkan di tanah. Beban masukan internal merupakan bahan organik yang dihasilkan oleh sirkulasi nutrient di perairan (waduk) (Silvey dan Roach, 1964 dalam Landner, 1976).
Waduk yang didalamnya terdapat kegiatan budidaya ikan dalam KJA dengan teknik budidaya secara intensif, pakan yang tersisa banyak mengandung fosfor, sulfat dan nitrogen, sehingga dengan adanya sisa pakan ini akan mempercepat terjadinya proses eutrofikasi diperairan tersebut. Ryding dan Rast (1989) mengatakan, jumlah penambahan nutrien ke badan air dari karamba jaring apung tergantung pada densitas populasi ikan dalam karamba. Studi Swedia mengindikasikan bahwa, untuk setiap ton ikan yang dihasilkan, resultante input ke badan nutrien adalah 85–90 kg fosfor dan 12–13 kg nitrogen.
Selanjutnya Beveridge (1996) menyatakan hasil ekskresi disebarkan ke kolom air oleh arus, sedangkan padatan (pakan yang tidak termakan dan feses) jatuh ke bawah atau dasar waduk atau danau. Selama sedimentasi, sebagian pakan yang tidak dimakan dikonsumsi oleh ikan, sedangkan sebagian lagi pecah menjadi partikel halus. Jumlah nutrien terlarut yang dilepas tergantung pada komposisi faecal dan pakan yang tidak dimakan, serta sifat-sifat fisik seperti suhu, kedalaman air dan turbelensi.
Penambahan nitrogen ke badan air dari KJA yang beroperasi kira-kira 85% dalam bentuk terlarut, terutama ammonia dan urea dari ekskresi ikan. Sisanya 15% berbentuk partikulat, terutama dari pakan yang tidak termakan. Sebaliknya 15–20% input fosfor ke badan air dari KJA yang beroperasi dalam bentuk terlarut. Sisanya dalam bentuk partikulat, yang akan mengendap ke dasar sedimen. Hasil penelitian di Swedia menunjukkan kira-kira 5%–10% fosfor yang tersedimentasi diregenerasi ke kolom air karena kondisi anoksik dan proses biologis di dasar perairan (Ryding dan Rast, 1989 ; Beveridge, 1996)
ini secara kimia dan biologis sangat ditentukan oleh ukuran bahan organik tersebut. Hanya sedikit bahan organik terlarut yang secara langsung digunakan oleh organisme akuatik, sedangkan bentuk partikulat adalah sumber makanan yang utama (Wetzel dan Likens, 1991).
Menurut Simarmata (2007) dekomposisi bahan organik terlarut menghasilkan produk akhir berupa gas, bahan organik partikulat yang harus dikonversi secara enzimatik oleh mikroflora tertentu. Proses dekomposisi adalah proses yang kontinu, tetapi lajunya bervariasi tergantung jumlah substrat variabel lingkungan (Wetzel dan Likens, 1991).
Selanjutnya Simarmata (2007) mengatakan, laju relatif komposisi k, adalah jumlah detrial karbon yang dimetabolis per unit waktu. Dekomposisi bahan organik terlarut menghasilkan produk akhir berupa gas, bahan organik partikulat yang harus dikonversi secara enzimatik oleh mikroflora tertentu. Dekomposisi yang sempurna menghasilkan konversi produk organik dari fotosintesis.
Simarmata (2007) mengatakan, hipernutrifikasi (peningkatan konsentrasi nutrien terlarut) sering muncul disekitar karamba perairan tawar, dimana arus rendah dan pengenceran terbatas. Perubahan juga muncul pada oksigen terlarut, BOD, COD, kekeruhan dan kedalaman transparansi. Tingkat eutrofikasi tergantung pada karakteristik badan air, ukuran, sifat dan manajemen keramba. Pada proses eutrofikasi ini seringkali diikuti blooming algae. Algae ini seringkali menghasilkan berbagai macam bahan yang toksik yang dapat mematikan hewan-hewan yang ada diperairan tersebut (Gorham dan Carmichael, 1980).
peroleh kandungan O2 total yang ada selama sirkulasi musim semi, atau pada
saturasi 4°C. Perbedaan antara kandungan saat saturasi dan kandungan aktual musim panas dibagi luasan hipolimniondisebut hypofimnetik areal defisit.
Difisit oksigen di areal hipolimnetik sejumlah danau mengindikasikan bahwa : (1) defisit berkorelasi positif dengan produkitifitas primer fitoplankton (2) Secara proporsional defisit berkebalikan dengan transparansi epilimnion (3) danau dengan kosentrasi total fosfor yang lebih tinggi memiliki defisit oksigen yang lebih tinggi pula (4) defisit lebih besar di danau dengan suhu rata-rata hipolimnetik musim panas lebih tinggi (5) defisit oksigen lebih besar di danau-danau dengan kedalaman rata-rata hipolimnetik yang ketebalannya lebih besar. Korelasi terakhir bahwa danau dengan hipolimnion yang lebih tebal memiliki defisit oksigen yang lebih besar dari pada danau dengan hipolimnion yang dangkal (Wetzel, 2001; Simarmata, 2007).
2.3 Dekomposisi Anaerobik
Revsbech et al. (1980) dalam Killops dan Killops (1993) mengatakan, jumlah bahan organik di sedimen mempengaruhi keseimbangan antara laju konsumsi oksigen selama degradasi aerobik dan laju difusi oksigen ke dalam sedimentasi air pore dari kolom air overlaying. Oksigenasi terbatas hanya sampai beberapa mm bagian atas sedimen butiran halus, meskipun penetrasi oksigen dapat lebih jauh beberapa cm akibat bioturbasi. Jika konsentrasi oksigen turun dalam sedimen dan kondisi menjadi disaerobik, bioturasi terhenti.
Selanjutnya Gunnison et al. (1985) mengatakan, respirasi anaerobik dapat didefinisikan sebagai reaksi biologi dimana oksidasi senyawa inorganik sebagai akseptor elektron, aktivitas ini sejalan dengan energi oksidasi dari senyawa organik atau inorganik. Reduksi senyawa organik, mengikuti langkah sesuai
elektron) : manganase (IV), nitrat, besi (III), sulfat dan bikarbonat. Proses ini melepas sedikit energi ke dekomposer dibanding degradasi aerobik dari bahan organik menjadi karbondioksida dan air. Agen oksidasi degradasi anaerobik cenderung digunakan karena berkurangnya energi yang kembali. Beberapa bakteri (Clostridium, anaerob obligat, Bacillus, anaerob fakultatif) memecah komponen makromolekular detritus menjadi molekul yang lebih sederhana dengan hidrolisis dan proses fermentasi. Produk ini adalah substrat untuk bakteri anaerobik yang menyempurnakan mineralisasi bahan organik (Simarmata, 2007).
Reduksi mikrobial nitrat dibagi menjadi dua kategori asimilator dan dissimilatori. Produk asimilatori reduksi nitrat adalah NH4+ yang bergabung
dalam sel (Payne, 1973 dalam Gunnison et al. 1985; Simarmata, 2007). Dissimilatori reduksi NO3- menjadi NH4+ telah dibuktikan penting di air laut
maupun air tawar. Pada dissimilator NO3- menjadi NH4+, hasil reduksi dilepas
dan dihasilkan energi. Organisme yang membawa dissimilatori NO3- menjadi
NH4+ tidak di data, tetapi Sorensen (1978) dalam Gunnison et al. (1985) dan
Simarmata (2007) mengindikasi bahwa Clostridium perfringens dan Paracoccus denitrificans mampu dalam proses ini. Reduksi sulfat menjadi penting jika nitrat terdeplesi; hasilnya CO2, H20 dan H2S. Pereduksi sulfat (Desulfovibrio,
Desulfobacter) adalah anaerob obligat. Kedalaman zona reduksi sulfat tergantung pada jumlah bahan organik yang ada; tetapi dapat menempati beberapa meter di sedimen pelagik dengan kandungan organik yang lebih rendah. Methanogen (Methanobacillus, Methanococcus) juga anaerob obligat dan mensintesa methan dari produk fermentasi terkecil. Karbondioksida dan hydrogen adalah subtrat yang penting, tetapi beberapa species dapat menggunakan senyawa sederhana selain C, (contoh methanol dan formate) atau C1 yang telah siap (methylated amine).
Sedimen air tawar terdiri dari 70% methane hasil dari penggunaan asetat, sisanya terdiri dari CO2 dan H2 (Simarmata, 2007).
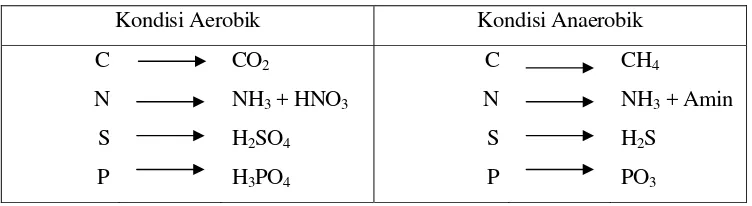
Tabel 2. Bentuk senyawa hasil oksidasi bahan-bahan organik pada kondisi aerobik dan anaerobik.
Kondisi Aerobik Kondisi Anaerobik C
N S P
CO2
NH3 + HNO3
H2SO4
H3PO4
C N S P
CH4
NH3 + Amin
H2S
PO3
Sumber : Fardiaz (1992)
Dari Tabel 2 terlihat bahwa hasil penguraian senyawa yang mengandung karbon dalam kondisi anaerob adalah gas metana, dari senyawa yang mengandung nitrogen adalah ammonia dan amin, dari senyawa yang mengandung sulfur terbentuk gas H2S yang berbau busuk, dan dari senyawa yang mengandung fosfor
akan terbentuk komponen fosfor yang mempunyai bau yang menyengat seperti bau anyir (Prihadi, 2005).
2.4 Ketersediaan Oksigen Terlarut
Kelarutan oksigen di perairan dipengaruhi oleh suhu, tekanan parsial gas dan salinitas (Boyd dan Licthkoppler, 1982). Selanjutnya dinyatakan bahwa sumber oksigen di kolam berasal dari fotosintesis dan respirasi phytoplankton, difusi dari udara, dan interflow (Simarmata, 2007).
2.4.1 Fotosintesis dan Respirasi Fitoplankton
Oksigen terlarut merupakan salah satu komponen utama dari daya dukung lingkungan yang dihasilkan dari proses fotosintesis fitoplankton dan makrofita. Banyaknya oksigen terlarut diperairan merupakan salah satu parameter kualitas air yang paling mendasar untuk kehidupan organisme akuatik (Alabaster dan Llyod, 1980 dalam Hamilton dan Schladow, 1994) dan perubahan kimia di sediment-interfase (Mortimer, 1971, Bostrim et al., dalam Hamilton dan Schladow, 1994; Simarmata, 2007).
mengatakan, fotosintesis menghasilkan oksigen, yang merupakan input utama di perairan yang subur. Thornton et al. (1990) menegaskan bahwa, fotosintesis bertanggungjawab terhadap pulse oksigen di epilimnion waduk. Umumnya konsentrasi oksigen saat permulaan fajar rendah, lalu tinggi pada siang hari kemudian secara kontinu berkurang sepanjang malam karena kebutuhan respirasi komunitas. Perubahan oksigen terlarut lebih umum dekat zona riverine dibanding lakustrin, kecuali di teluk yang besar, dimana tanaman litoral dan blooming fitoplankton sering terjadi (Simarmata, 2007).
Oksigen terlarut merupakan zat yang paling penting dalam system kehidupan di perairan, dalam hal ini berperan dalam proses metabolisme oleh makro dn mikroorganisme yang memanfaatkan bahan organik yang berasal dari hasil fotosintesis. Selain itu juga mempunyai peranan yang penting dalam penguraian bahan-bahan organik oleh berbagai jenis mikroorganisme yang bersifat aerobik (APHA, 1989), sehingga jika ketersediaan oksigen tidak mencukupi akan megakibatkan lingkungan perairan dan kehidupan dalam perairan menjadi terganggu, sekaligus akan menurunkan kualitas air (Prihadi, 2005).
Kebutuhan oksigen bagi ikan mempunyai dua aspek, yaitu kebutuhan lingkungan bagi spesies tertentu dan kebutuhan konsumtif yang bergantung kepada keadaan metabolisme ikan. Perbedaan kebutuhan okesigen dalam suatu lingkungan bagi spesies ikan tertentu disebabkan oleh adanya perbedaan struktur molekul sel darah ikan yang mempengaruhi hubungan antara tekanan parsial oksigen dalam air dan derajat kejenuhan oksigen dalam sel darah. Ikan memerlukan oksigen guna pertumbuhan, reproduksi (Zonneveld et al., 1991) dan maintenance (Beveridge, 1996). Kebutuhan oksigen bagi ikan bervariasi bergantung kepada jenis ikan, umur dan ukuran ikan. Selain faktor diatas, kebutuhan oksigen juga bergantung kepada faktor lingkungan, seperti temperatur (Beveridge, 1996). Lebih lanjut dijelaskan bahwa, bila kelarutan oksigen diperairan tidak sesuai dengan kebutuhan, maka akan mempengaruhi pertumbuhan, konversi pakan dan kesehatan ikan.
konsentrasinya dalam air jika suhu air, salinitas, dan ketinggian meningkat, dan sebaliknya. Dan untuk kegiatan budidaya ikan yang komersial memerlukan konsentrasi oksigen dalam air lebih besar atau sama dengan 5 mg/L. Menurut Cholik et al. (1986) dan Sunarti (1992), bila konsentrasi oksigen terlarut tetap sebesar 3 atau 4 mg/L untuk jangka waktu lama maka ikan akan menghentikan aktivitasnya dan pertumbuhan akan berhenti. Kadar oksigen terlarut dalam air juga bisa dijadikan indikator untuk melihat pencemaran yang terjadi pada suatu perairan yakni kandungan oksigen dalam perairan melebihi dari 5 mg/L mengandung arti bahwa perairan tersebut tercemar ringan, jika kandungannya 2–5 mg/L berarti tercemar sedang dan 0–2 mg/L berarti perairan tersebut tercemar berat.
Fotosintesis terjadi di zona fotik, tetapi respirasi terjadi dimana saja di dalam perairan (diseluruh kolom air bahkan sampai ke dasar perairan), sehingga hasil bersihnya adalah permukaan air cenderung kaya akan oksigen terlarut, dan berkurang dengan bertambahnya kedalaman (Seller dan Markland, 1990; Simarmata, 2007)
2.4.2 Difusi
Menurut Simarmata (2007) sumber oksigen terlarut di perairan yang utama adalah difusi udara. Laju transfer oksigen tergantung pada konsentrasi oksigen terlarut di lapisan permukaan, konsentrasi saturasi oksigen, dan bervariasi sesuai kecepatan angin (Seller dan Markland, 1987). Selanjutnya Welch (1952) dalam Simarmata (2007), adsorpsi oksigen dari udara ke air melalui dua cara yaitu difusi langsung ke permukaan air atau melalui berbagai bentuk agitasi air permukaan, seperti gelombang, air terjun, dan turbulensi.
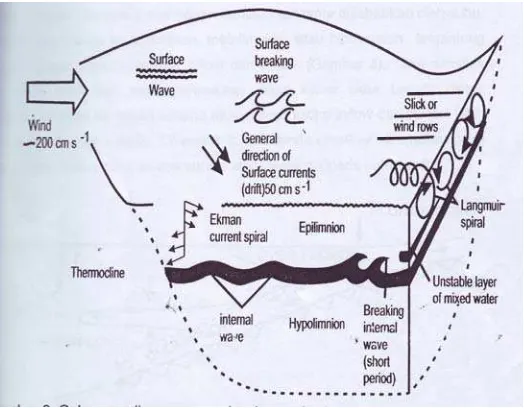
Gambar 3. Gabungan diagram gaya (angin, gravitasi, evaporasi dan rotasi bumi) dan resultante arus air dan gelombang. Angin memindahkan air, gravitasi membuat aliran horizontal lebih mudah daripada vertikal, evaporasi mendinginkan permukaan air yang kemudian tenggelam, dan rotasi bumi memindahkan aliran permukaan ke kiri (dibelahan bumi utara) dan ke kanan di belahan bumi selatan (Goldman dan Horne, 1983 dalam Simarmata, 2007).
Pengadukan vertikal seperti halnya aliran horizontal disebabkan oleh angin dipermukaan. Spiral ekman dapat dianggap sebagai bagian dari gerakan air dengan berbagai kecepatan dan arah yang berbeda. Kontak diantara bagian-bagian tersebut menyebabkan perpindahan vertikal massa air dan menghasilkan pengadukan diantara masing-masing bagian tersebut. Spiral Langmuir menyebabkan energi untuk pengadukan menjadi lebih terkendali dengan panjang gelombang kira-kira sama dengan kedalaman termoklin. Pada waktu tertentu evaporative cooling merupakan tenaga utama penyebab pengadukan vertikal. Pada Gambar 4 menunjukkan pergerakan air di danau baik vertikal maupun horizontal yang mempengaruhi konsentrasi oksigen terlarut di danau (Wetzel, 2001).
2.4.3 Susupan Oksigen Terlarut (Interflow)
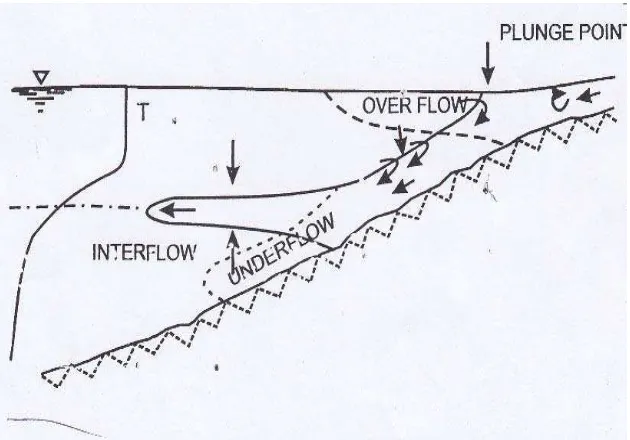
tepat mengenai pengaruh inflow pada pengadukan waduk. Jika densitas inflow berbeda dengan densitas air permukaan, maka inflow masuk dan bergerak di waduk sebagai arus densitas (Simarmata, 2007). Bell (1942) dalam Thornton et al., (1990) mendefinisikan arus densitas sebagai aliran gravitasi dari cairan atau gas, dibawah atau diatas aliran fluida yang densitasnya hampir sama.
[image:32.612.163.478.312.532.2]Selanjutnya Simarmata (2007) mengatakan, densitas dapat disebabkan oleh suhu, total dissolved solid dan suspended solid. Di waduk perbedaan densitas terutama disebabkan oleh suhu. Arus densitas masuk ke epilimnion, metalimnion atau hipolimnion tergantung pada perbedaan densitas antara inflow dan waduk (Gambar 4). Jika densitas inflow lebih kecil dari pada permukaan maka inflow akan berada diatas (overflow).
Gambar 4. Inflow densitas ke waduk (Ford and Johnson dalam Thornton et al., 1990).
2.5 Kualitas Air
2.5.1 BOD
BOD (Biological Oxygen Demand) adalah banyaknya oksigen yang diperlukan oleh mikroorganisme untuk mendekomposisi bahan organik. Pada analisis BOD, lama waktu inkubasinya bisa beraneka ragam, namun masa inkubasi yang paling umum adalah lima hari, sehingga diberi istilah BOD. Nilai BOD merupakan parameter yang menunjukkan besarnya oksigen yang dibutuhkan oleh mikroorganisme untuk menguraikan bahan organik dalam proses dekomposisi secara biokimia (Boyd, 1981), dengan demikian maka BOD merupakan ukuran banyaknya oksigen yang digunakan oleh mikroorganisme untuk menguraikan bahan-bahan organik yang terdapat dalam air dalam waktu lima hari (APHA, 1989 ; Prihadi, 2005).
2.5.2 Nitrit, Nitrat, Amonia
Amonia merupakan salah satu bentuk nitrogen anorganik yang memiliki sifat mudah larut dalam air. Sumber utama senyawa amonia berasal dari sisa pakan yang tidak terkonversi dan kotoran organisme akuatik. Amonia diperairan berada dalam dua bentuk yaitu bentuk ion yang tidak bersifat racun (NH4+) dan
bentuk gas (non ionic) yang bersifat racun (NH3) (Ciaccio, 1972). Nitrogen dalam
bentuk nitrit adalah bentuk antara nitrat dan amonia, baik dalam proses oksidasi amonia menjadi nitrat maupun dalam proses reduksi nitrat menjadi nitrit, Nitrat pada umumnya merupakan nitrogen anorganik yang terbanyak di ekosistem perairan (APHA, 1989).
Nitrogen merupakan gas yang jumlahnya paling banyak di atmosfer, yakni mencapai 78 % dari total gas yang ada di atmiosfer. Oleh karena itu maka sebagian besar nitrogen (N2) yang berada dalam suatu perairan berasal dari difusi
udara nitrogen dari udara (atmosfir). Tumbuhan jenis tertentu dapat memfiksasi secara langsung nitrogen dari udara bebas dan kilat pada waktu hujan, sehingga membentuk nitrik oksida (NO), yang akan teroksidasi lebih lanjut membentuk NO3- dan pada akhirnya akan terbawa ke perairan, dengan reaksi :
1 . N2 (g) + O2 (g) 2NO (g)
2. 2NO (g) + O2 (g) 2NO2 (g)
3. 3NO2 + H2O 2H+ + 2NO3- + NO
Jika nitrogen dalam perairan ada dalam bentuk ammonia ataupun ammonium, maka senyawa ini tetap dapat dimanfaatkan oleh tumbuhan akuatik, senyawa tersebut mengalami proses nitrifikasi membentuk nitrat yang pada akhirnya juga akan dimanfaatkan oleh jasad autotrof dalam air. Menurut Effendi (2007) proses pembentukan nitrat (nitrifikasi) terjadi dua tahap, yakni :
1. NH4+ + 1½O2 NO2- + 2H+ + H2O, dan
2. NO2- + ½O2 NO3
oksigen pada jaringan dan mengakibatkan kerusakan pada insang serta mengurangi kemampuan darah dalam mentransportasikan oksigen (Boyd, 1982).
2.5.3 Oksigen Terlarut (DO)
Kelarutan oksigen merupakan salah satu faktor kualitas air yang paling kritis dalam budi daya ikan di kolam, sehingga goncangan oksigen sedikit saja langsung dapat dirasakan oleh ikan. Kelarutan oksigen di perairan dipengaruhi oleh suhu, tekanan parsial gas dan salinitas (Boyd dan Licthkoppler, 1982). Selanjutnya dinyatakan bahwa sumber oksigen di kolam berasal dari fotosintesis phytoplankton dan difusi dari udara, sedangkan penyebab utama berkurangnya kelarutan oksigen adalah karena respirasi plankton, respirasi ikan, respirasi organisme dasar dan difusi ke udara.
Oksigen terlarut merupakan salah satu komponen utama dari daya dukung lingkungan yang dihasilkan dari proses fotosintesis fitoplankton dan makrofita. Banyaknya oksigen terlarut dalam kolam merupakan salah satu parameter kualitas air yang paling peka untuk kehidupan ikan. Menurut Cholik et al. (1986) dan Sunarti (1992), bila konsentrasi oksigen terlarut tetap sebesar 3 atau 4 mg/L untuk jangka waktu lama maka ikan akan menghentikan aktivitasnya dan pertumbuhan akan berhenti.
Selanjutnya Stickney (2000) juga menyatakan kelarutan oksigen dalam perairan dipengaruhi oleh faktor lingkungan antara lain suhu air, salinitas, dan ketinggian lokasi (altitude). Oksigen terlarut akan menurun konsentrasinya dalam air jika suhu air, salinitas, dan ketinggian meningkat, dan sebaliknya. Dan untuk kegiatan budi daya ikan yang komersial memerlukan konsentrasi oksigen dalam air lebih besar atau sama dengan 5 mg/L.
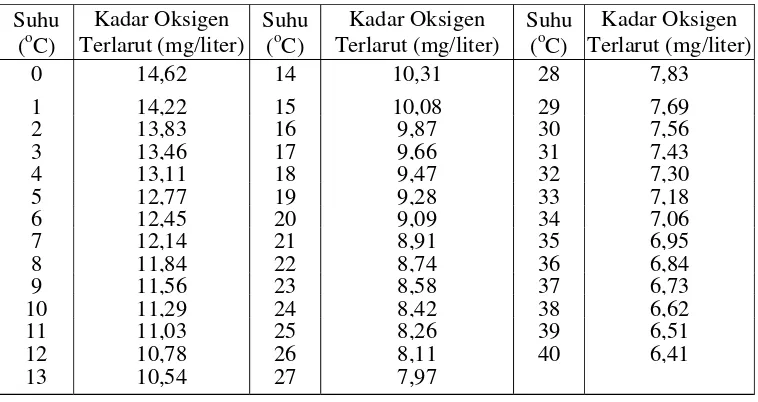
[image:36.612.131.510.349.550.2]Kadar oksigen terlarut juga berfluktuasi secara harian (diurnal) dan musiman, tergantung pada percampuran (mixing) dan pergerakan (turbulence) massa air, aktivitas fotosintesis, respirasi, dan limbah (effluent) yang masuk ke badan air. Hubungan antara kadar oksigen terlarut jenuh dan suhu ditunjukkan dalam Tabel 3, yang menggambarkan bahwa Semakin tinggi suhu, kelarutan oksigen Semakin berkurang.
Tabel 3. Hubungan antara kadar oksigen terlarut jenuh dan suhu pada tekanan udara 760 mm Hg
Suhu (oC)
Kadar Oksigen Terlarut (mg/liter)
Suhu (oC)
Kadar Oksigen Terlarut (mg/liter)
Suhu (oC)
Kadar Oksigen Terlarut (mg/liter) 0 14,62 14 10,31 28 7,83
1 14,22 15 10,08 29 7,69
2 13,83 16 9,87 30 7,56
3 13,46 17 9,66 31 7,43
4 13,11 18 9,47 32 7,30
5 12,77 19 9,28 33 7,18
6 12,45 20 9,09 34 7,06
7 12,14 21 8,91 35 6,95
8 11,84 22 8,74 36 6,84
9 11,56 23 8,58 37 6,73
10 11,29 24 8,42 38 6,62
11 11,03 25 8,26 39 6,51
12 10,78 26 8,11 40 6,41
13 10,54 27 7,97
Sumber : Cole (1988)
Boyd dan Licthkoppler (1982) menjelaskan kebutuhan oksigen pada ikan secara umum adalah sebagai berikut : DO<1 ppm adalah konsentrasi letal, 1–5
ppm hidup tapi pertumbuhan lambat, dan DO>5 ppm merupakan konsentrasi ideal bagi kehidupan ikan. Safronios et al. (1996) melaporkan bahwa ikan nila biru (Oreochromis aureus) yang dipelihara di dalam tangki dengan kadar O2 rata-rata
seiring dengan bertambahnya konsentrasi oksigen. Pertambahan total berat tubuh dan kecepatan pertumbuhan harian yang paling tinggi juga dicapai pada tangki dengan kadar oksigen tertinggi. Namun nilai konversi pakan dan efisiensi protein yang terbaik dicapai pada pemeliharaan dalam tangki dengan kadar oksigen menengah (3,75 ppm).
Kandungan oksigen terlarut pada siang hari tinggi, karena proses fotosintesis secara maksimal. Pada malam dan sore hari kandungan oksigen terlarut turun karena tidak ada sinar matahari, sementara semua organisme perairan melakukan proses respirasi yang mengkonsumsi oksigen dan mengeluarkan karbondioksida. Oleh sebab itu, konsentrasi oksigen terlarut berubah-ubah dalam siklus harian yaitu waktu fajar, konsentrasi oksigen terlarut adalah yang terendah dan semakin naik pada waktu siang hari sampai mencapai titik maksimal lewat tengah hari (Boyd, 1991).
Kelarutan oksigen dalam air juga dipengaruhi oleh suhu dan tekanan udara. Menurut Hasting dalam Jangkaru (1984), kebutuhan oksigen oleh ikan adalah 16,48 mg/100 g/jam. Kadar optimum untuk pertumbuhan harus lebih besar dari 5 mg/L (Cholik et al., 1986). Chakroff (1985) menambahkan bahwa kadar oksigen 15 mg/L merupakan kadar tertinggi kritis, dan titik terendah kritis adalah 4 mg/L.
2.5.4 Potensial Redoks
2.5.5 pH
Tingkat keasaman (pH) adalah suatu ukuran untuk menyatakan besarnya konsentrasi ion hydrogen sehingga dapat diketahui apakah suatu perairan bereaksi asam atau basa. Nilai pH suatu perairan sangat ditentukan oleh CO2 dan substansi
asam. Phytoplankton dan tanaman air lainnya mengambil CO2 selama
berlangsungnya proses fotosintesis, sehingga pH perairan meningkat di siang hari dan kembali turun pada malam hari (Boyd dan Licthkoppler, 1982 dan Zonneveld et al., 1991).
Pada pemeliharaan ikan, pH memiliki arti penting untuk diketahui karena nilai pH yang ekstrim dapat merusak permukaan insang sehingga menyebabkan kematian pada ikan. Selain alasan tadi, pH juga dapat meningkatkan efek toksid beberapa polutan seperti amonia dan sianida, dan logam berat seperti aluminium (Beveridge, 1996).
Boyd dan Licthkoppler (1982) menyatakan kisaran pH pada budidaya ikan adalah sebagai berikut : pH 4 dan 11 adalah titik mati asam dan basa, pH antara 4 dan 6, dan antara 9 dan 10, ikan dapat hidup tapi pertumbuhannya lambat, sedangkan pH 6,5 dan 9 merupakan kisaran optimum bagi kehidupan ikan. Supaya ikan dapat tumbuh maksimal, pH harus tetap ideal dengan fluktuasi yang kecil (Stickney, 1993).
Jika dalam suatu perairan terdapat kandungan bahan organik yang tinggi, maka bahan organik tersebut harus diuraikan, untuk ini diperlukan oksigen. Dalam keadaan ada oksigen akan dihasilkan karbondioksida, uap air dan nitrat. Dalam keadaan tidak ada oksigen akan dihasilkan hidrogen sulfida (H2S), amonia
(NH3) dan metana (CH4). Hampir semua senyawa yang dihasilkan tersebut
bersifat asam yang pada akhirnya akan menurunkan pH. Zat tersebut akan digunakan untuk proses fotosintesis, sehingga kandungan karbondioksida akan menurun, dan ion bikarbonat (HCO3-) akan berubah menjadi CO2 dan ion OH-.
Adanya dominasi ion hidroksil ini mengakibatkan pH air meningkat (Prihadi, 2005).
Keadaan ini juga bisa terjadi jika 1% dari karbondioksida bereaksi dengan air, sehingga membentuk asam karbonat (Cole, 1988). Pada pembentukan asam karbonat tersebut akan dihasilkan ion hidrogen yang mengakibatkan pH perairan menurun.
2.5.6 Karbon Dioksida (CO2)
Karbon dioksida sangat mudah larut dalam air. Konsentrasi CO2 di
perairan ditentukan oleh aktivitas fotosintesis phytoplankton dan respirasi organisme perairan. Bila konsentarasi O2 di perairan meningkat maka pada saat
yang bersamaan diikuti oleh penurunan kelarutan CO2, demikian pula sebaliknya.
Sehingga pada pagi hari selalu CO2 lebih tinggi dibanding pada sore hari.
Konsentrasi CO2 terendah yang masih dapat ditolerir oleh ikan adalah 5 ppm dan
konsentrasi tertinggi adalah 60 ppm dengan catatan kelarutan oksigen tinggi (Boyd dan Licthkoppler, 1982). Sebenarnya dengan kadar CO2 lebih dari 10 ppm
saja sudah dapat meracuni ikan, karena keberadaannya di darah dapat menghambat pengikatan oksigen oleh haemoglobin (Zonnveld et al., 1991). konsentrasi CO2 antara 50 dan 100 mg/l harus diwaspadai karena dapat
menyebabkan ikan stres dan jika dibiarkan akan membunuh ikan. Ikan Seraterodon macrochir di alam dapat mentolerir CO2 hingga lebih dari 75 mg/l.
2.5.7 Alkalinitas
Menurut Effendi (2007), alkalinitas adalah gambaran kapasitas air untuk menetralkan asam atau dikenal dengan sebutan acid-neutralizing capacity (ANC) atau kuantitas anion di dalam air yang dapat menetralkan kation hidrogen. Alkalinitas juga diartikan sebagai kapasitas penyangga (buffer capacity) terhadap perubahan pH perairan. Penyusun alkalinitas perairan adalah anion bikarbonat (HCO3-), karbonat (CO32-), dan hidroksida (OH-). Borst (H2BO3-), silikat (HSi03-),
fosfat (HPO42- dan H2PO4-), sulfida. (HS-), dan amonia (NH3)juga memberikan
adalah sodium dan magnesium. Anion utama pada perairan tawar adalah bikarbonat dan karbonat, sedangkan pada perairan laut adalah klorida. Selanjutnya Boyd (1981) mengatakan alkalinitas yang baik dalam penyediaan CO2 adalah 20–
150 mg/L. Menurut Cholik et al. (1986), bila total alkalinitas terlalu rendah dapat ditingkatkan melalui penambahan kapur (pengapuran), dan pada umumnya perairan yang baik (produktif) untuk budidaya ikan mengandung nilai total alkalinitas dan kesadahan yang sama besarnya. Selanjutnya Boyd (1992) mengatakan, pemberian kapur dapat meningkatkan pH lumpur dan menyebabkan tersedianya fosfor untuk jasad nabati. Disamping itu pengapuran juga dapat meningkatkan alkalinitas serta tersedianya CO2 untuk fotosintesis. Persentase
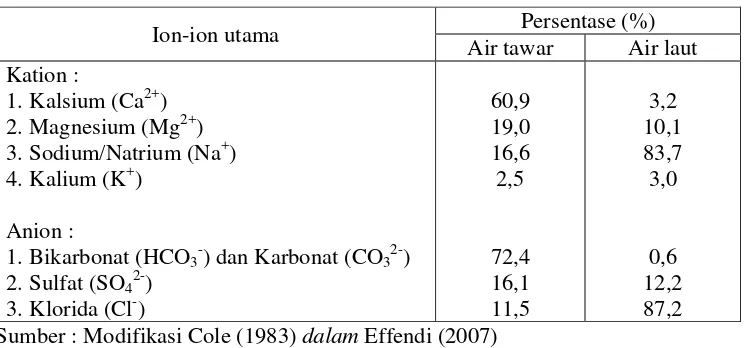
[image:40.612.135.507.316.490.2]ion-ion utama, yang terdapat dalam perairan tawar dan laut ditunjukkan dalam Tabel 4.
Tabel 4. Kation dan anion utama pada perairan tawar dan laut
Ion-ion utama Persentase (%)
Air tawar Air laut Kation :
1.Kalsium (Ca2+) 2.Magnesium (Mg2+) 3.Sodium/Natrium (Na+) 4.Kalium (K+)
Anion :
1.Bikarbonat (HCO3-) dan Karbonat (CO32-)
2.Sulfat (SO42-)
3.Klorida (Cl-)
60,9 19,0 16,6 2,5
72,4 16,1 11,5
3,2 10,1 83,7 3,0
0,6 12,2 87,2 Sumber : Modifikasi Cole (1983) dalam Effendi (2007)
Bikarbonat, karbonat, dan asam karbonat merupakan sumber utama karbon anorganik di perairan. Karbon anorganik di perairan dapat berasal dari beberapa sumber, yaitu atmosfer, batuan karbonat, siklus biologi karbon, sumber allocthonous (dari luar perairan).
Pada awalnya, alkalinitas adalah gambaran pelapukan batuan yang terdapat pada sistem drainase. Alkalinitas dihasilkan dari karbondioksida dan air yang dapat melarutkan sedimen batuan karbonat menjadi bikarbonat.
cukup tinggi. Kelarutan kalsium karbonat menurun dengan meningkatnya suhu dan meningkat dengan keberadaan karbondioksida. Kalsium karbonat bereaksi
dengan karbondioksida membentuk kalsium bikarbonat [Ca(HCO3)2] yang
memiliki daya larut lebih tinggi dibandingkan dengan kalsium karbonat (CaCO3)(Cole, 1988).
Tingginya kadar bikarbonat di perairan disebabkan oleh ionisasi asam karbonat, terutama pada perairan yang banyak mengandung karbondioksida (kadar CO2 mengalami saturasi/jenuh). Karbondioksida di perairan bereaksi
dengan basa yang terdapat pada batuan dan tanah membentuk bikarbonat (HCO3)
(Boyd, 1981).
Calcite dan dolomite sebenarnya memiliki daya larut yang rendah, namun dengan keberadaan karbondioksida kelarutan senyawa-senyawa tersebut meningkat. Reaksi pembentukan bikarbonat dari karbonat adalah reaksi setimbang dan mengharuskan keberadaan karbondioksida untuk mempertahankan bikarbonat dalam bentuk larutan. Jika kadar karbondioksida bertambah atau berkurang maka akan terjadi perubahan kadar ion bikarbonat.
Satuan alkalinitas dinyatakan dengan mg/liter kalsium karbonat (CaCO) atau mili-ekuivalen/liter. Selain bergantung pada pH, alkalinitas juga dipengaruhi oleh komposisi mineral, suhu, dan kekuatan ion. Pada air mendidih, alkalinitas hanya terdiri atas karbonat dan hidroksida. Karbondioksida tidak larut dalam air panas (mendidih), namun terbawa bersama uap air sehingp nilai pH air mendidih dapat mencapai 11.
Nilai alkalinitas perairan alami hampir tidak pernah melebihi 500 mg/liter CaCO3. Perairan dengan nilai alkalinitas yang terlalu tinggi tidak terlalu disukai
Nilai alkalinitas yang baik berkisar antara 30–500 mg/liter CaCO3. Nilai
alkalinitas di perairan berkisar antara 5 hingga ratusan mg/liter CaCO3. Alkalinitas
pada perairan alami adalah 40 mg/liter CaCO3 (Boyd, 1981). Perairan dengan
nilai alkalinitas >40 mg/liter CaCO3 disebut perairan sadah (Hard water),
sedangkan perairan dengan nilai alkalinitas <40 mg/liter disebut perairan lunak (softwater).
Alkalinitas perairan berkaitan dengan gambaran kandungan karbonat dari batuan dan tanah yang dilewati oleh air serta sedimen dasar perairan. Nilai alkalinitas tinggi biasanya juga ditemukan diwilayah kering dimana terjadi evaporasi secara intensif.
Perairan dengan nilai alkalinitas tinggi lebih produktif daripada perairan dengan alkalinitas rendah. Tingkat produktivitas perairan ini sebenarnya tidak berkaitan secara langsung dengan nilai alkalinitas, tetapi berkaitan dengan keberadaan fosfor dan elemen esensial lain yang kadarnya meningkat dengan meningkatnya nilai alkalinitas. Alkalinitas berperan dalam hal-hal sebagai berikut :
1. Sistem penyangga (buffer)
Bikarbonat yang terdapat pada perairan dengan nilai alkalinitas total tinggi berperan sebagai penyangga (buffer capacity) perairan terhadap perubahan pH yang drastis. Jika basa kuat ditambahkan ke dalam perairan maka basa tersebut akan bereaksi dengan asam karbonat manjadi garam bikarbonat dan akhimya menjadi karbonat. Jika asam ditambahkan ke dalam perairan maka asam tersebut akan digunakan untuk mengkonversi karbonat menjadi bikarbonat dan bikarbonat menjadi asam karbonat. Fenomena inilah yang menjadikan perairan dengan nilai alkalinitas total tinggi tidak mengalami perubahan pH secara drastis (Cole, 1988 dalam Effendi, 2007).
2. Koagulasi kimia
sebaiknya berada pada kisaran optimum untuk mengikat ion hidrogen yang dilepaskan pada proses koagulasi.
3. Pelunakan (water softening)
Alkalinitas adalah parameter kualitas air yang harus dipertimbangkan dalam menentukan jumlah soda abu dan kapur yang diperlukan dalam proses pelunakan (softening) dengan metode presipitasi. Pelunakan bertujuan untuk menurunkan kesadahan.
2.5.8 Kesadahan
Menurut Effendi (2007) kesadahan (hardness) adalah gambaran kation logam divalen (valensi dua). Kation-kation ini dapat bereaksi dengan sabun (soap) membentuk endapan (presipitasi) maupun dengan anion-anion yang terdapat di dalam air membentuk endapan atau karat pada peralatan logam.
Pada perairan tawar, kation divalen yang paling berlimpah adalah kalsium dan magnesium (Tabel 5), sehingga kesadahan pada dasarnya ditentukan oleh jumlah kalsium dan magnesium. Kalsium dan magnesium berikatan dengan anion penyusun alkalinitas, yaitu bikarbonat dan karbonat.
[image:43.612.131.506.578.697.2]Keberadaan kation yang lain, misalnya strontium, besi valensi dua (kation fero), dan mangan juga memberikan kontribusi bagi nilai kesadahan total, meskipun peranannya relatif kecil. Aluminium dan besi valensi tiga (Kation ferri) sebenarnya juga memberikan kontribusi terhadap nilai kesadahan. Namun demikian, mengingat sifat kelarutannya yang relatif rendah pada pH netral maka peran kedua kation ini sering kali diabaikan. Kesadahan dan alkalinitas dinyatakan dengan satuan yang sama, yaitu mg/liter CaCO3.
Tabel 5. Kation-kation penyusun kesadahan dan anion-anion pasangan/ asosiasinya
Kation Anion
Ca2+ Mg2+
Sr2+ Fe2+ Mn2+
HCO2-
SO42-
Cl- NO3-
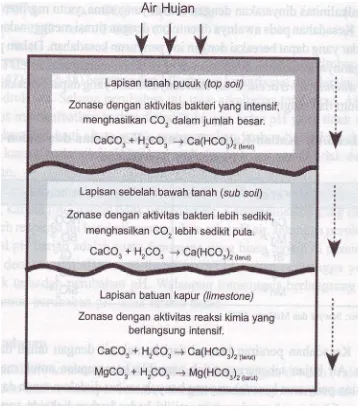
Kesadahan perairan berasal dari kontak air dengan tanah dan bebatuan. Air hujan sebenarnya tidak memiliki kemampuan untuk melarutkan ion-ion penyusun kesadahan yang banyak terikat di dalam tanah dan batuan kapur (limestone), meskipun memiliki kadar karbondioksida yang relatif. Larutnya ion-ion yang dapat meningkatkan nilai kesadahan tersebut lebih banyak disebabkan oleh aktivitas bakteri di dalam tanah, yang banyak mengeluarkan karbondioksida. Pada Gambar 5 memperlihatkan penampang melintang tanah yang memperlihatkan proses terlarutnya kation penyusun kesadahan perairan
Keberadaan karbondioksida membentuk kesetimbangan dengan asam karbonat. Pada kondisi yang relatif asam, senyawa-senyawa karbonat yang terdapat di dalam tanah dan batuan kapur yang sebelumnya tidak larut berubah menjadi senyawa bikarbonat yang bersifat larut. Batuan kapur (lime stone) pada dasarnya tidak hanya mengandung karbonat, tetapi juga mengandung sulfat, klorida, dan silikat. Ion-ion ini juga ikut terlarut dalam air. Gambar 6 menunjukkan proses pelarutan senyawa karbonat.
Perairan dengan nilai kesadahan tinggi pada umumnya merupakan perairan yang berada di wilayah yang memiliki lapisan tanah pucuk (top soil) tebal dan batuan kapur. Perairan lunak berada pada wilayah dengan lapisan tanah atas tipis dan batuan kapur relatif sedikit atau bahkan tidak ada. Air permukaan biasanya memiliki nilai kesadahan yang lebih kecil dan pada air tanah. Perairan dengan nilai kesadahan kurang dari 120 mg/liter CaCO3 dan lebih dari 500
mg/liter CaCO3 dianggap kurang baik bagi peruntukan domestik, pertanian, dan
industri. Namun, air sadah lebih disukai oleh organisme daripada air lunak (Effendi, 2007).
2.5.9 Kalsium (Ca)
Keberadaan kalsium sangat dipengaruhi oleh reaksi kimia yang melibatkan karbon dioksida, di perairan senyawa kalsium bersifat stabil dengan keberadaan karbon dioksida.
Kadar kalsium pada perairan tawar biasanya kurang dari 15 mg/L, perairan yang berada di sekitar batuan karbonat antara 30–100 mg/L, perairan laut sekitar sekitar 400 mg/L, sedangkan pada brine dapat mencapai 75.000 mg/L (McNeely et al., 1979 dalam Effendi, 2007).
Di perairan, senyawa kalsium bersifat stabil dengan keberadaan karbondioksida. Kadar kalsium menurun jika kalsium mengalami presipitasi (pengendapan) menjadi CaCO3, sebagai akibat terjadinya peningkatan suhu,
2.5.10 Hidrogen Sulfida (H2S) dan Bakteri SRB
Sulfur berada dalam bentuk organik dan anorganik. Sulfur anorganik terutama terdapat dalam bentuk sulfat (SO42-), yang merupakan bentuk sulfur
utama di perairan dan tanah (Effendi, 2007).
Sulfida berasal dari limbah industri atau dihasilkan dari proses dekomposisi bahan organik yaitu proses reduksi sulfat oleh bakteri pada kondisi anaerob. Bakteri SRB adalah bakteri obligat anaerob yang menggunakan sulfat sebagai akseptor terminal elektron (Moriaty dan Paullin, 1987), selanjutnya Simarmata (2007) mengatakan, jika deplesi oksigen semakin besar maka kondisi perairan semakin reduksif dan akhirnya mencapai anaerob, yang merupakan syarat tumbuh untuk SRB.
Di perairan, sulfur berikatan dengan ion hidrogen dan oksigen. Beberapa bentuk sulfur di perairan adalah sulfida (S2-), hidrogen sulfida (H2S), ferro sulfida
(FeS), sulfur dioksidasi (SO2), sulfit (SO3), dan sulfat (SO4). Sulfat yang berikatan
dengan hidrogen membentuk asam sulfat dan sulfat yang berikatan dengan logam alkali merupakan bentuk sulfur yang paling banyak ditemukan di danau dan sungai (Cole, 1988). Kadar sulfat pada kolom air biasanya berkisar antara 0,02– 0,1 mg/L. Menurut Effendi (2007) kadar sulfide lebih dari 0,002 mg/L mengakibatkan terjadinya gangguan pada sistem pencernaan, kadar fenol lebih dari 0,01 mg/L akan bersifat toksik bagi ikan.
2.5.11 Fenol
Fenol merupakan senyawa kimia organik yang terdiri dari suatu gugus OH yang terikat pada cincin aromatik (Fessenden dan Fessenden, 1986; Priatna et al., 1994; Haerudin, 2006). Senyawa ini mudah mengalami oksidasi, pada kadar yang lebih dari 0,01 mg/L, fenol bersifat toksik bagi ikan (Effendi, 2007).
2.5.12 Total Fosfat dan Orto Fosfat (PO43-- P)
Fosfat merupakan salah satu senyawa penting untuk sintesis protein dan berperan dalam anabolisme suatu organisme (Wardoyo, 1981). Dalam suatu perairan fosfat dapat berbentuk ortofosfat, polifosfat dan fosfat organik. Namun demikian hanya ortofosfat yang dapat dimanfaatkan secara langsung oleh jasad autotrof (APHA, 1989 ; Prihadi, 2005).
Menurut Prihadi (2005), pada umumnya fosfat yang berada di perairan banyak terdapat dalam bentuk fosfat organik dan fosfat anorganik. Sumber utama fosfat anorganik terutama berasal dari penggunaan deterjen, alat pembersih untuk keperluan rumah tangga serta berasal dari industri pupuk pertanian. Sedangkan fosfat organik barasal dari makanan dan buangan rumah tangga. Semua fosfat mengalami proses perubahan biologis menjadi fosfat anorganik yang selanjutnya digunakan oleh tanaman untuk membuat energi. Fosfat sangat berguna untuk pertumbuhan organisme dan merupakan faktor yang menentukan produktivitas badan air.
Fosfat yang terlarut dalam perairan pada keadaan normal biasanya berbentuk orto-fosfat yang ada diperairan dalam jumlah yang rendah. Kandungan fosfat terlarut di perairan alam umumnya tidak lebih dari 0,1 mg/l. Jika dalam suatu perairan terjadi masukan bahan pencemar dalam jumlah yang tinggi dan mengakibatkan kandungan fosfatnya cukup tinggi dapat mengakibatkan terjadinya proses eutrofikasi atau keadaan lewat subur yang mengakibatkan terjadinya pertumbuhan plankton yang tidak terkendali (Wetzel, 1975; Prihadi, 2005).
2.5.13 COD (Chemical Oxygen Demand)
2.5.14 Suhu
Suhu air merupakan parameter terpenting yang memberikan pengaruh proses fisiologi terhadap ikan, seperti laju pernapasan, efisiensi makanan dan pencernaan, pertumbuhan, prilaku, reproduksi dan laju metabolisme di dalam tubuh ikan. Kenaikan temperatur akan meningkat laju metabolisme dan bersamaan dengan itu juga akan meningkatkan konsumsi oksigen dan aktivitas gerak ikan (Beveridge, 1996 dan Zonneveld et al., 1991), aktivitas makan, kebutuhan energi maintenan, aktivitas enzim, difusi molekul-molekul kecil, fungsi membran dan kecepatan sintesis protein (Houlihan et al., 1993). Umumnya kecepatan reaksi kimia dan biologi akan meningkat dua kali lipat untuk setiap kenaikan suhu air 10o C (Boyd dan Licthkoppler, 1982 ; Cholik et al., 1986). Hal ini bila terjadi dari kondisi suhu dibawah titik optimal hingga mencapai titik optimal tentu dapat meningkatkan pertumbuhan ikan. Karena peningkatan laju metabolisme diikuti oleh tingginya kebutuhan O2, maka persyaratan O2 terlarut di
daerah panas lebih tinggi daripada di daerah dingin. Perubahan suhu yang mendadak dapat menyebabkan ikan mati, meskipun kondisi lingkungan lainnya optimal. Namun, peningkatan suhu ini disertai dengan penurunan kadar oksigen terlarut sehingga keberadaan oksigen sering kali tidak mampu memenuhi kebutuhan oksigen bagi organisme akuatik untuk melakukan proses metabolisme dan respirasi. Peningkatan suhu juga menyebabkan terjadinya peningkatan dekomposisi bahan organik oleh mikroba. Kisaran suhu optimum bagi pertumbuhan fitoplankton di perairan adalah 20oC–30oC.
2.5.15 Kedalaman
3 METODE PENELITIAN
3.1 Lokasi dan Waktu Penelitian
Penelitian dilakukan dalam dua tahap yaitu kegiatan lapangan (survey
awal) pada perairan Waduk Cirata dan pengamatan di Laboratorium Lingkungan
Perairan Departemen Akuakultur FPIK–IPB.
Kegiatan lapangan terdiri dari survey awal, dan analisa laboratorium.
Sedangkan kegiatan di laboratorium meliputi pengamatan sedimen dari Waduk
Cirata yang dilaksanakan selama 2 bulan (Oktober 2008 sampai Desember 2008),
analisa laboratorium dan analisa data. Analisa sampel dilakukan di Laboratorium
Lingkungan Perairan Departemen Akuakultur FPIK–IPB dan analisa bakteri di
Laboratorium Mikrobiologi Departemen Biologi.
Lokasi ini dipilih karena keberadaan kegiatan budidaya ikan dalam KJA
yang belakangan ini cukup mengkawatirkan, dimana jumlah KJA yang ada
dilapangan dapat dikategorikan melebihi kapasitas perairan tersebut.
3.2 Alat dan Bahan
Alat-alat sampling : GPS, Sechi disk, botol plastik, botol BOD, DO meter,
Cool box, pH meter, dan petersen grab. Alat-alat laboratorium : pompa vakum,
lemari pendingin, spektrofotometer, neraca analitik, hot plat, oven, turbidimeter,
alat destilasi dan labu destilasi. Bahan yang digunakan sebagai pengawet sampel :
penambahan PP indikator dan titrasi dengan Na2CO3, penambahan BCG/MR
indikator dan titrasi dengan HCl, penambahan NaOH dan Zn-Acetat. Sedangkan
untuk parameter yang lain, sampel air diawetkan dengan menggunakan H2SO4,
HNO3, HgCl.
3.3 Metode Pengumpulan Data
3.3.1 Kegiatan Lapangan (Survei Awal)
Kegiatan lapangan terdiri dari survai awal, analisis kualitas air dan analisis
sedimen hasil survei awal dilakukan di Laboratorium Lingkungan Perairan
Departemen Akuakultur FPIK–IPB. Parameter kualitas air yang diukur pada
survei awal meliputi: kedalaman, suhu air, pH, dan DO, sedangkan untuk
nitrat (NO3), amoniak (NH3), alkalinitas, kesadahan, sulfida total (H2S), COD,
BOD, Ca dan C-organik dilakukan di laboratorium dengan alat spektrofotometer
dan AAS. Pengambilan contoh sedimen dilakukan dengan menggunakan petersen
grab, kemudian sampel tersebut dimasukkan ke dalam kantong plastik hitam.
adapun parameter hasil survei awal yang diukur meliputi Redoks, Ca dan
C-organik.
Untuk menghindari terjadinya perubahan pada contoh air yang akan
dianalisis di laboratorium dilakukan preservasi. Preservasi dilakukan dengan cara
di simpan dalam Cool box. Air sampel untuk analisa karbondioksida diawetkan
dengan penambahan PP indikator dan titrasi dengan Na2CO3, untuk analisa
alkalinitas diawetkan dengan penambahan BCG/MR indikator dan titrasi dengan
HCl, analisis sulfida diawetkan dengan penambahan NaOH dan Zn-Acetat.
Sedangkan untuk parameter yang lain, sampel air diawetkan dengan
menggunakan H2SO4, HNO3, HgCl. Hal tersebut dilakukan karena contoh air
segera dianalisis pada hari berikutnya.
Untuk lebih jelasnya parameter-parameter kualitas air, sedimen dan biota
yang diamati, alat yang digunakan dan tempat dilakukan analisis pada penelitian
[image:51.612.134.511.465.710.2]ini dapat dilihat pada Tabel 6.
Tabel 6. Parameter-parameter kualitas air, sedimen dan biota air yang diamati pada survei lapangan.