PEMANFAATAN ASAM LEMAK SAWIT DISTILAT
SEBAGAI BAHAN BAKU DIETANOLAMIDA
MENGGUNAKAN LIPASE (
Rhizomucor meihei
)
T E S I S
Oleh
EKA KURNIASIH
057022001/TK
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
PEMANFAATAN ASAM LEMAK SAWIT DISTILAT
SEBAGAI BAHAN BAKU DIETANOLAMIDA
MENGGUNAKAN LIPASE (
Rhizomucor meihei
)
TESIS
Untuk Memperoleh Gelar Magister Sains dalam Program Studi Teknik Kimia
pada Sekolah Pascasarjana Universitas Sumatera Utara
Oleh
EKA KURNIASIH
057022001/TK
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
MEDAN
Judul Tesis : PEMANFAATAN ASAM LEMAK SAWIT DISTILAT SEBAGAI BAHAN BAKU DIETANOLAMIDA MENGGUNAKAN LIPASE (Rhizomucor meihei)
Nama Mahasiswa : Eka Kurniasih
Nomor Pokok : 057022001
Program Studi : Teknik Kimia
Menyetujui
Komisi Pembimbing
(Prof.Dr.Ir. Setiaty Pandia) (Dr.Ir.Tjahyono Herawan, MSc) Ketua Anggota
Ketua Program Studi Direktur
Telah diuji pada
Tanggal : 16 Juni 2008
PANITIA PENGUJI TESIS
K e t u a : Prof. Dr. Ir. Setiaty Pandia
A n g g o t a : 1. Dr.Ir. Tjahyono Herawan, MSc
2. Dr. Rumondang Bulan, MS
3. Dr. Halimatuddahliana, ST, MSc
4. Zuhrina Masyithah, ST, MSc
ABSTRAK
Dietanolamida merupakan surfaktan non ionik yang banyak digunakan dalam pembuatan beragam produk perawatan tubuh, pencuci dan pembersih serta kosmetik. Asam lemak sawit distilat (ALSD) sebagai hasil samping industri minyak goreng dicoba dimanfaatkan untuk pembuatan dietanolamida. Sintesa dietanolamida menggunakan ALSD dilakukan melalui reaksi amidasi, yaitu dengan mereaksikan substrat ALSD dengan dietanolamina pada rasio mol 4,96:1; 7:1; 10:1; 13:1; dan 15,04:1, konsentrasi Rhizomucor meihei pada 6,64%; 8%; 10%; 12%; 13,36% (b/b) dan temperatur pada 33oC; 40oC; 50oC; 60oC; 67oC. Konversi optimum reaksi sebesar 80,83 %, diperoleh pada konsentrasi Rhizomucor meihei 10% (b/b), rasio mol dietanolamina/ALSD 10:1 dan temperatur reaksi 50oC. Lipase Rhizomucor meihei memberikan aktifitas yang baik pada pelarut n-heksana pada rasio ALSD/pelarut 1:2 (b/v). Karakteristik dietanolamida yang dihasilkan adalah bilangan asam 10,57 mmol/mg, bilangan iodine 6,97 dengan titik leleh 92oC, pH 8, hidrophil liphofil balance (HLB) 18, larut pada etanol, metanol, n-heksana dan air.
UTILIZAITION PALM FATTY ACID DISTILATE AS RAW
MATERIAL OF DIETHANOLAMIDE USING LIPASE
(
Rhizomucor meihei
)
ABSTRACT
Diethanolamide is a non ionic surfactant which is mostly used in producing various kinds of body care, detergent, cleaner and also cosmetic product. Palm fatty acid distillate (PFAD) as by product of palm oil industry is tried to be used for producing diethanolamide. Diethanolamide synthesis uses PFAD which done through by amidation reaction, which is by reacting PFAD substrat with diethanolamine at mole ratio 4,96:1; 7:1; 10:1; 13:1; and 15,04:1, Rhizomucor meihei concentration at 6,64%; 8%; 10%; 12%; 13,36% (w/w) and temperature at 33oC; 40oC; 50oC; 60oC; 67oC. The optimum convertion of reaction is 80,83%, found at Rhizomucor meihei concentration 10% (w/w), mole ratio of PFAD/diethanolamine 10:1 and reaction temperature 50oC. Lipase Rhizomucor meihei has given good acivity in n-hexane as the solvent at ratio PFAD/solvent 1:2 (w/v). The Characteristic of diethanolamide are acid value of 10,57 mmole/mg, iodine value of 6,97 with melting point 92oC, pH 8, hydrofil lypofil balance (HLB) 18, dissolved in ethanol, methanol, n-hexane and H2O.
KATA PENGANTAR
Pujian hanya berhak disampaikan kepada-Nya, karena hanya Allah SWT yang sanggup menyangga segala macam pujian yang ditujukan kepada-Nya. Teriring pula ucapan Alhamdulillahi rabbil’alamin atas segala karunia-Nya sehingga penyusunan tesis ini dapat diselesaikan. Tulisan ini berjudul ”Pemanfaatan Asam Lemak Sawit Distilat Sebagai Bahan Baku Dietanolamida Menggunakan Lipase (Rhizomucor
meihei)”. Tesis ini disusun setelah melalui tahapan penelitian yang dilaksanakan di Pusat Penelitian Kelapa Sawit (PPKS) Medan, untuk itu penulis mengucapkan terima kasih sebesar-besarnya atas segala bantuan dan fasilitas yang telah diterima. Penulis mengucapkan terima kasih dan penghargaan yang tinggi kepada dosen pembimbing
Prof.Dr.Ir. Setiaty Pandia dan Dr.Ir.Tjahyono Herawan, MSc atas bantuan,
bimbingan, curahan ilmu, asih dan asuh yang telah diberikan selama penyusunan tesis dan sepanjang penyelesaian pendidikan kesarjanaan ini. Pada kesempatan ini, disampaikan pula ucapan terima kasih kepada yang terhormat :
1. Prof. dr. Chairuddin P. Lubis, DTM&H selaku Rektor Universitas Sumatera Utara atas kesempatan yang diberikan untuk mengikuti Pendidikan Program Magister.
2. Prof. Dr. Ir. T.Chairun Nisa B, M.Sc selaku Direktur Sekolah Pascasarjana
3. Prof. Dr. Ir. Setiaty Pandia, Ketua Program Studi Magister Teknik Kimia,
Universitas Sumatera Utara sekaligus sebagai komisi pembimbing.
4. Dr.Halimatuddahliana, ST, MSc selaku Sekretaris Program Studi Magister Teknik Kimia, Universitas Sumatera Utara.
5. Kedua orang tua, Zentin Suroso dan Sumiarni, adik ku Suhasmoko, ST dan Adi Noto, Ibu Suwarti dan adik Eko Madya serta keluarga besar untuk dukungan dan doa yang begitu tulus.
6. Novri Darti, SP., Rita Fitriani, Susi Andayani, dan seluruh staff beserta teknisi PPKS Medan yang telah mengikhlaskan waktu dan pemikiran selama penelitian. 7. Staf pengajar Magister Teknik Kimia dan MIFA-Kimia, Universitas Sumatera
Utara atas bimbingannya.
8. Pgawai administrasi SPS Universitas Sumatera Utara Magister Teknik Kimia. 9. Sahabat ku Meriatna, ST, MT., Farida Hanum, ST., Amina Asrah serta seluruh
rekan Magister Teknik Kimia, Universitas Sumatera Utara.
Sesudahnya saya memohon nasehat dan saran, karena tulisan ini membutuhkan banyak perbaikan untuk perkembangan selanjutnya.
Medan, Juni 2008
RIWAYAT HIDUP
Nama : Eka Kurniasih
Tempat/Tanggal Lahir : Tanjung Morawa, 02 Nopember 1981
Agama : Islam
Pendidikan : SD Negeri 105292 Bandar Klippa (1988-1994) SLTP Negeri 12 Medan (1994-1997)
SMU Al-Azhar Medan (1997-2000) Program Studi Teknik Kimia (2000-2004) Universitas Sumatera Utara
Status Keluarga : Anak pertama dari tiga bersaudara
1. Ayah : Zentin Suroso
2. Ibu : Sumiarni
3. Adik : Suhasmoko, ST
DAFTAR ISI
Halaman
ABSTRAK ... i
ABSTRACT... ii
KATA PENGANTAR ... iii
RIWAYAT HIDUP... v
DAFTAR ISI... vi
DAFTAR TABEL... ix
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN... xiii
I PENDAHULUAN 1.1 Latar Belakang ... ... 1
1.2 Perumusan Masalah ... ... 3
1.3 Tujuan Penelitian ... ... 4
1.4 Manfaat Penelitian ... ... 4
1.5 Lingkup Penelitian ... ... 4
II TINJAUAN PUSTAKA 2.1 Alkanolamida ... ... 7
2.1.1 Monoetanolamida... ... 7
2.1.2 Dietanolamida ... ... 9
2.1.3 Trietanolamida ... ... 10
2.2 Asam Lemak Sawit Distilat (ALSD) ... .. 12
2.3 Alkanolamina ... .. 15
2.3.1 Etanolamina... .. 15
2.3.2 Dietanolamina ... .. 15
2.4 Fungsi dan Cara Kerja Enzim ... 17
2.4.1 Klasifikasi Enzim ... .. 19
2.4.2 Lipase Dalam Industri Oleokimia ... .. 22
2.5 Rancangan Percobaan ... .. 23
III METODOLOGI PENELITIAN 3.1 Tempat dan Waktu ... . 27
3.2 Bahan Dan Alat ... . 27
3.3 Rancangan Percobaan ... . 29
3.4 Percobaan Pendahuluan ... . 31
3.4.1 Screening Enzim ... . 31
3.4.2 Waktu Reaksi ... . 32
3.4.3 Pelarut ... . 32
3.5 Penelitian Utama ... . 34
3.5.1 Percobaan Utama Amidasi ALSD Menjadi Dietanolamida ... 34
3.5.2 Pemurnian Produk... . 34
3.6 Analisa Sampel ... 36
3.7 Karakteristik Dietanolamida ... 37
3.8 Pengolahan Data Optimasi Reaksi ALSD menjadi Dietanolamina ... 37
3.9 Jadwal Penelitian... 38
IV HASIL DAN PEMBAHASAN 4.1 Hasil Penelitian Pendahuluan... 40
4.1.1 Screening Biokatalis ... 40
4.1.2 Penentuan Waktu Reaksi ... 43
4.1.3 Pemilihan Pelarut ... 47
4.1.4 Penentuan Rasio Pelarut... 49
4.1.5 Pengaruh pH... 50
4.1.6 Penentuan Level Rhizomucor meihei... 51
4.1.7 Penentuan Level Rasio Substrat... 53
4.1.8 Penentuan Level Temperatur ... 55
4.2 Hasil Penelitian Utama... 57
4.2.1 Analisa Pengaruh Variabel... 59
4.2.2 Analisis Variansi (ANAVA) ... 61
4.2.3 Uji Verifikasi Model Penelitian ... 64
4.3 Analisa Plot Dan Kontur Hasil Penelitian Utama ALSD Menjadi Dietanolamida Menggunakan Rhizomucor meihei... 67
4.3.3 Pengaruh Temperatur Terhadap Rasio Mol
Dietanolamina/ALSD... 73 4.4 Karakteristik Produk ... 76 V PENUTUP
DAFTAR TABEL
Nomor Judul Halaman
1. Kandungan Asam Lemak Dari Palm Kernel Olein (PKL)
dan Palm Kernel Stearin (PKS) ... 8
2. Kandungan Asam Lemak Pada Minyak Kelapa Sawit dan ALSD ... 13
3. Perlakuan Terkode Untuk Amidasi ALSD ... 29
4. Central Composite Design (CCD) Untuk 3 Variabel ... 30
5. Jadwal Kegiatan Penelitian ... 39
6. Hasil Analisa Bilangan Asam Untuk Screening Biokatalis ... 41
7. Hasil Analisa Bilangan Asam Untuk Penentuan Waktu Reaksi ... 44
8. Pengaruh Level Konsentrasi Rhizomucor meihei Terhadap Produk .... 52
9. Pengaruh Rasio Substrat Terhadap Perolehan Dietanolamida... 53
10. Pengaruh Temperatur Terhadap Perolehan Dietanolamida ... 56
11. Hasil Percobaan Optimasi ... 58
12. Hasil Statistik Minitab 14 Untuk Response Surface Methodology... 59
13. ANAVA Model Persamaan Regresi Pada Amidasi ALSD Menjadi Dietanolamida Menggunakan Minitab 14... 62
14. Karakteristik Produk Dietanolamida... 76
15. Hasil Perhitungan Untuk Matriks CCD ... 89
18. Bilangan Gelombang dari Asam Lemak Sawit Distilat... 98 19. Bilangan Gelombang dari Dietanolamida pada
Waktu Reaksi 72 Jam... 98 20. Bilangan Gelombang Dietanolamida pada Rasio
ALSD/Dietanolamina 1: 10 (Enzim) ... 100 21. Bilangan Gelombang Dietanolamida pada Rasio
ALSD/Dietanolamina 1: 10 (Non Enzim)... 100 22. Bilangan Gelombang Dietanolamida pada
Penelitian Utama (50oC) ... 102 23. Bilangan Gelombang Dietanolamida pada
Penelitian Utama (60oC) ... 102 24. Bilangan Gelombang Bilangan Gelombang Dietanolamida
DAFTAR GAMBAR
Nomor Judul Halaman
1. Bagan Proses Pengolahan Minyak Kelapa Sawit Menjadi
Minyak Goreng ... 14
2. Penguraian Substrat Oleh Enzim ... 18
3. Diagram Alir Penentuan Level Rhizomucor meihei, Temperatur, Rasio Mol Dietanolamina/ALSD (Percobaan Pendahuluan) ... 33
4. Rangkaian Peralatan Percobaan Pendahuluan ... 33
5. Diagram Alir Percobaan Utama Amidasi ALSD Menjadi Dietanolamida ... 35
6. Rangkaian Peralatan Percobaan Optimasi ... 36
7. Pengaruh Jenis Biokatalis Terhadap Produk Dietanolamida ... 41
8. Perolehan Produk Dietanolamida Pada Substrat Asam Palmitat ... 43
9. Pengaruh Waktu Reaksi Terhadap Produk Dietanolamida... 45
10. Pengaruh Jenis Pelarut Terhadap Aktifitas Rhizomucor meihei... 47
11. Pengaruh Rasio Pelarut Terhadap Produk Dietanolamida ... 49
12. Pengaruh Level Konsentrasi Biokatalis Terhadap Dietanolamida... 52
13. Pengaruh Rasio Substrat Terhadap Perolehan Dietanolamida... 54
14. Pengaruh Temperatur Terhadap Perolehan Produk ... 56
15. Plot Residual Dengan Taksiran Model ... 64
17. Plot Distribusi Normal Residual Model Regresi... 66
18. Respon Permukaan Dari Plot Konsentrasi Rhizomucor meihei Terhadap Rasio Mol Dietanolamina/ALSD... 68
19. Kontur Dari Plot Konsentrasi Rhizomucor meihei Terhadap Rasio Mol Dietanolamina/ALSD ... 69
20. Respon Permukaan Dari Plot Konsentrasi Rhizomucor meihei Terhadap Temperatur ... 71
21. Kontur Dari Plot Konsentrasi Rhizomucor meihei Terhadap Temperatur ... 72
22. Respon Permukaan Dari Plot Temperatur Terhadap Rasio Mol Dietanolamina/ALSD... 73
23. Kontur Dari Plot Temperatur Terhadap Rasio Mol Dietanolamina/ALSD... 74
24. Sketsa Plat Kromatografi Lapis Tipis ... 86
25. Kromatografi Lapis Tipis Pada Beberapa Level Temperatur ... 96
26. Hasil Analisa FT-IR (a) ALSD (b)Waktu Reaksi 72 Jam (Lipase) ... 97
27. FT-IR Pada (a) Rasio Substrat 1:10 (Enzim) ( b) Rasio Subtrat 1:10 (Non Enzim)... 99
28. FT-IR Percobaan Optimasi (a) Temperatur 50oC (b) Temperatur 60oC ... 101
DAFTAR LAMPIRAN
Nomor Judul Halaman
1. Prosedur Analisa Sampel ... 83
2. Response Surface Methodology... 88
3. Output Analisa Statistika ... 91
4. Tabel Statistika... 94
5. Hasil Analisa KLT ... 95
I. PENDAHULUAN
1.1Latar Belakang
Indonesia adalah salah satu produsen minyak sawit terbesar di dunia. Sebagian dari produksi minyak sawit tersebut diekspor dalam bentuk minyak sawit mentah dan sisanya digunakan sebagai bahan baku untuk keperluan industri dalam negeri. Konsumsi minyak sawit di dalam negeri hanya digunakan sebagai bahan baku industri minyak goreng, margarin, sabun, serta industri oleokimia yang memproduksi asam lemak sawit, metil ester dan fatty alkohol. Pada industri minyak goreng terdapat tahap refining yang bertujuan untuk meningkatkan kualitas minyak yang dihasilkan. Pada tahap ini, selain dihasilkan produk utama berupa minyak goreng, juga dihasilkan produk samping yaitu asam lemak sawit distilat (ALSD) yang memiliki kandungan asam palmitat yang tinggi, sekitar 56,55%. Sumber asam lemak sawit distilat memiliki potensi yang cukup besar untuk digunakan sebagai bahan baku pembuatan produk oleokimia. Bahan baku yang dapat diperbaharui, termasuk asam lemak dan minyak nabati akan menjadi penting sebagai pilihan bahan baku, tidak hanya karena alasan ekonomis, namun juga karena banyaknya pilihan sifat-sifat produk turunan yang dihasilkan dan pengaruhnya terhadap ekosistem.
sebagai bahan baku. Biasanya secara industrial dietanolamida diproduksi secara kimiawi menggunakan minyak atau lemak dengan alkanolamina pada temperatur tertentu. Teknik kimiawi konvensional memiliki kelemahan yang berhubungan dengan penggunaan energi dan pembentukan produk samping yang tidak dikehendaki. Sintesa alkanolamida secara kimiawi konvensional dilangsungkan dengan menggunakan katalis basa pada temperatur 120oC-150oC. Pada akhir produk akan diperoleh kandungan sabun amina yang akan menaikkan pH, sehingga dibutuhkan tahapan purifikasi lebih lanjut. Oleh sebab itu dikembangkan proses enzimatis untuk menghasilkan dietanolamida dari asam lemak dan minyak nabati dengan menggunakan biokatalisator. Biokatalisator yang digunakan dapat berupa enzim lipase. Enzim lipase yang digunakan harus memiliki sifat spesifik pada substrat yang mengandung asam palmitat. Sifat spesifik adalah kemampuan suatu enzim untuk beraktifitas pada satu jenis substrat tertentu (Poejiadi, 1994). Rhizomucor meihei adalah satu dari banyak lipase yang biasa digunakan dalam reaksi esterifikasi asam lemak untuk produksi metil ester asam lemak (FAME), kosmetik (palm oil emulsifier) yang mengandung asam palmitat yang tinggi, industri makanan (cocoa butter), industri minyak nabati seperti minyak jagung, minyak bunga matahari, minyak zaitun (Hasan dkk, 2005).
dihasilkan lebih aman dibandingkan dengan proses kimia konvensional (Elisabeth dkk, 1998). Dietanolamida adalah senyawa golongan fatty amida dan merupakan surfaktan non ionik yang banyak digunakan sebagai bahan pembuatan shampoo, busa mandi, pemantap lateks, zat penghambat karat, produk pembersih peralatan rumah tangga dan deterjen cair (Rahman dkk, 2003).
Surfaktan adalah senyawa yang memiliki dua gugus yaitu hidrofobik (lipofilik) dan hidrofilik (lipopobik) dalam satu molekul, sehingga disebut sebagai senyawa amphilic (Gautam dan Tyagi, 2005). Impor surfaktan Indonesia berjumlah 44.500 ton dan diprediksi impor tersebut setiap tahunnya terus berkembang sejalan dengan tumbuhnya industri kosmetik, makanan, farmasi, tekstil dan industri penyamakan kulit (Anah dan Mahfud, 2003).
1.2Perumusan Masalah
1.3Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui pengaruh konsentrasi lipase (Rhizomucor meihei) yang digunakan, rasio mol dietanolamina terhadap asam lemak sawit distilat (ALSD) dan temperatur reaksi terhadap konversidietanolamida.
1.4Manfaat Penelitian
Percobaan yang dilakukan ini diharapkan dapat memberikan manfaat sebagai berikut :
1. Sebagai informasi tentang pemanfaatan asam lemak sawit distilat (ALSD) sebagai bahan baku dietanolamida.
2. Sebagai informasi mengenai penggunaan lipase untuk memproduksi
dietanolamida secara batch.
3. Memberikan nilai tambah terhadap asam lemak sawit distilat, yang merupakan hasil samping industri pengolahan minyak goreng.
4. Sebagai dasar dalam perancangan proses produksi dietanolamida secara kontinu.
1.5Lingkup Penelitian
Penelitian dilakukan melalui dua tahap, yaitu :
1. Penelitian pendahuluan yang bertujuan untuk menentukan respon optimum dari masing-masing variabel yang selanjutnya akan digunakan dalam desain central composite design (CCD)
2. Penelitian utama, yang bertujuan untuk menentukan respon optimum yang dapat diperoleh melalui interaksi masing-masing variabel
Variabel penelitian pendahuluan terdiri atas : Variabel Tetap :
1. Screening enzim : Rhizomucor meihei, Candida antartica, asam palmitat dan sebagai kontrol reaksi dilakukan reaksi non enzim
2. Waktu reaksi (Jam) : 24, 48 dan 72 3. Jenis pelarut : n-Heksana dan Isopropanol 4. Rasio pelarut (b/v) yaitu : 1:1; 1:2; 1:3; 1:4 5. pH : 6, 7, 8
Variabel Berubah
1. Konsentrasi Rhizomucor meihei (b/b): (6%; 8%; 10%; 12%;14%) 2. Temperatur reaksi : (30oC; 40oC; 50oC; 60oC)
Variabel penelitian utama terdiri atas :
1. Konsentrasi Rhizomucor meihei (b/b): (6,64%; 8%; 10%; 12%;13,36%) 2. Temperatur reaksi : (33oC; 40oC; 50oC; 60oC; 67oC)
3. Rasio dietanolamina terhadap asam lemak sawit distilat : (4,96:1; 7:1; 10:1; 13:1; 15,04:1)
II. TINJAUAN PUSTAKA
2.1 Alkanolamida
Senyawa N-etanol alkil amida adalah senyawa yang termasuk dalam golongan fatty amida yang dapat dimanfaatkan sebagai surfaktan dalam produk deterjen, kosmetik, tekstil. Senyawa ini dapat dibuat dengan mereaksikan asam lemak sawit distilat (ALSD) dengan senyawa yang mengandung gugus atau atom nitrogen seperti alkanolamina (Nuryanto dkk, 2002). Pada reaksi ini akan terbentuk ikatan peptida antara gugus karbonil dari ALSD dengan atom nitrogen dari alkanolamina.
2.1.1 Monoetanolamida
sebagai sumber asam lemak. Berdasarkan penelitian yang dilakukan oleh Rahman dkk (2003) diperoleh yield 77% untuk palm kernel olein (PKO) sebagai bahan baku berfasa cair dan 39% untuk palm kernel stearin (PKS) untuk fasa padat. PKO dan PKS yang digunakan berasal dari proses fraksinasi crude palm olein (CPO). Hasil fraksinasi minyak sawit ini adalah sumber yang baik untuk asam lemak, fatty alkohol dan senyawa turunan nitrogen sebab mengandung atom karbon C12-C18. PKO biasanya digunakan dalam baked goods, hidrogenasi dan industri sabun, sedangkan PKS digunakan sebagai bahan substitusi pada pembuatan cocoa butter. Sintesa monoetanolamida ini menggunakan Candida rugosa sebagai biokatalis, disebabkan oleh kandungan asam laurat (C12) yang tinggi pada fraksinasi CPO ini. Berikut adalah kandungan asam lemak pada bahan baku.
Tabel 1. Kandungan Asam Lemak Dari Palm Kernel Olein (PKO) dan Palm Kernel Stearin (PKS)
Komposisi PKL (%) PKS (%)
Asam Laurat (C12) 44,7 56,6
Asam Miristat (C14) 14,0 22,4
Asam Palmitat (C16) 8,30 8,0
Asam Stearat (C18) 2,30 1,80
Asam Oleat (C18-1) 19,2 5,60
2.1.2 Dietanolamida
Dietanolamida pertama kali diperoleh dengan mereaksikan dua mol dietanolamina dengan satu mol asam lemak. Senyawa ini diberi nama Kritchevsky amida sesuai dengan nama penemunya. Bahan baku yang digunakan dalam produksi dietanolamida dapat berupa asam lemak, trigliserida atau metil ester. Dietanolamida biasanya diproduksi secara kimia konvensional pada temperatur 150oC selama 6-12 jam (Herawan dkk, 1999). Dari hasil reaksi akan dihasilkan produk dietanolamida dan hasil samping berupa sabun amina. Kehadiran sabun amina ini, tentu saja akan menaikkan pH produk. Pada tahap selanjutnya akan dilakukan pemurnian produk untuk memisahkan produk utama dengan sabun amina.
2.1.3 Trietanolamida
Trietanolamina banyak dimanfaatkan dalam pembuatan kationik surfaktan, misalnya esterquats. Kationik surfaktan merupakan komponen utama dalam industri deterjen sebagai bahan pelembut. Pada tahun 1977, esterquats berbahan dasar trietanolamina telah mendapatkan hak paten sebagai fabric softener. Senyawa esterquats diperoleh dengan mereaksikan satu mol trietanolamina dengan dua mol asam lemak, kemudian tahap quaternization menggunakan agen alkilasi, seperti dimetil sulfat (Tyagi dkk, 2006).
Esterifikasi :
Asam Lemak Trietanolamina Asam Lemak
R-C-OH + HOCH2CH2-N-CH2CH2OH + R-C-OH
O O
CH2CH2OH
RO-C-H2C-H2C-N-CH2CH2-C-OR O
CH2CH2OH O
Diester (I)
Quaternization
(I) + (CH3)2SO4 RO-C-H2C-H2C-N-CH2CH2-C-OR (1) O CH2CH2OH O
Beberapa keunggulan yang dimiliki esterquats adalah : 1. Dapat diformulasikan untuk dispersi tinggi
2. Memiliki kestabilan hidrolitik dan kemampuan softening dapat ditingkatkan dengan menstabilkan pH dispersi
3. Lulus uji dari Organization for Economic Cooperation and Development (OECD)
4. Esterquats mudah terbiodegradasi
Reaksi dengan melibatkan trietanolamina akan menghasilkan pembentukan senyawa ester amida. Berdasarkan penelitian yang dilakukan oleh Nuryanto dkk (2002) bahwa reaksi antara asam lemak sawit distilat dengan trietanolamina akan menghasilkan senyawa ester yang lebih tinggi dibandingkan alkanolamida. Hal ini disebabkan oleh gugus nitrogen yang terdapat di dalam trietanolamina telah mengikat tiga gugus etanol. Dengan demikian gugus karboksilat dari asam lemak sawit akan membentuk ester dengan gugus alkohol dari etanol. Banyaknya ikatan ester yang terbentuk bergantung kepada jumlah asam lemak sawit yang digunakan.
R-C-OH + HOCH2CH2-N-CH2CH2OH R-C-O-CH2CH2-N-CH2CH2OH + H2O (2) O
O
CH2CH2OH CH2CH2OH
ALSD Trietanolamina Ester amida Air
untuk perbandingan mol 2:1 dan 3:1 diperoleh hasil mono amina ester dan amida. Hasil analisa kromatografi lapis tipis (KLT) memperlihatkan terjadinya penurunan jumlah trietanolamina selama berlangsungnya reaksi. Artinya reaksi terus berlangsung dan jumlah air yang diperoleh juga terus meningkat. Kemungkinan produk amida dapat terjadi bila terdapat asam lemak sawit distilat berlebih yang akan bereaksi dengan atom nitrogen dari trietanolamina. Reaksi ini dimungkinkan terjadi karena atom nitrogen yang telah mengikat tiga buah gugus etanol masih mempunyai sepasang elektron bebas yang dapat berperan sebagai nukleofil, sedangkan gugus karboksilat dari asam lemak sawit berperan sebagai elektrofil (Nuryanto dkk, 2002).
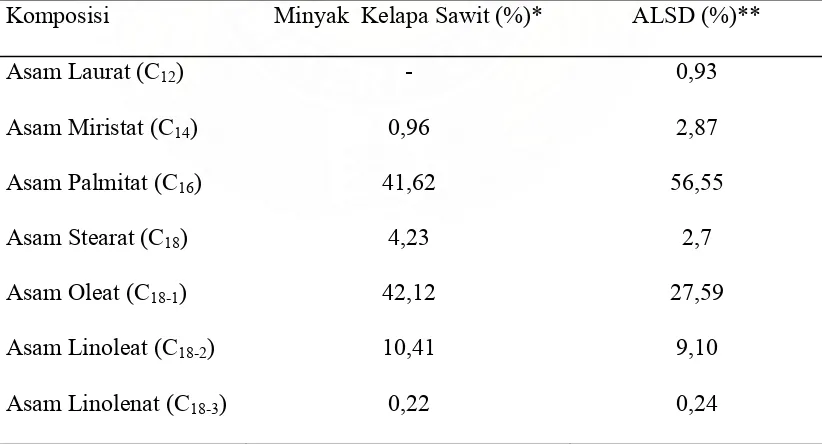
2.2 Asam Lemak Sawit Distilat (ALSD)
Perkembangan industri minyak goreng sawit pada dasawarsa terakhir mengalami peningkatan sejalan dengan beralihnya pola konsumsi masyarakat dari minyak goreng kelapa ke minyak goreng kelapa sawit. Konsumsi per kapita minyak goreng Indonesia mencapai 16,5 kg per tahun dimana konsumsi per kapita khusus untuk minyak goreng sawit sebesar 12,7 kg per tahun (Rephi’s, 2007). Kondisi ini memberikan gambaran, bahwa dengan peningkatan industri minyak goreng maka perolehan asam lemak sawit distilat turut meningkat. Hingga saat ini, pemanfaatan asam lemak sawit distilat masih terbatas pada pembuatan sabun kualitas rendah. Sehingga membutuhkan pengembangan lebih lanjut untuk meningkatkan nilai tambah dari asam lemak sawit distilat
Tabel 2. Kandungan Asam Lemak Pada Minyak Kelapa Sawit dan ALSD
Komposisi Minyak Kelapa Sawit (%)* ALSD (%)**
Asam Laurat (C12) - 0,93
Asam Miristat (C14) 0,96 2,87
Asam Palmitat (C16) 41,62 56,55
Asam Stearat (C18) 4,23 2,7
Asam Oleat (C18-1) 42,12 27,59
Asam Linoleat (C18-2) 10,41 9,10
Asam Linolenat (C18-3) 0,22 0,24
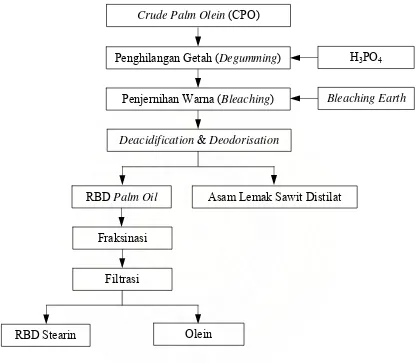
Berikut adalah bagan proses refining dalam industri pengolahan minyak kelapa sawit.
Crude Palm Olein (CPO)
Penghilangan Getah (Degumming)
Penjernihan Warna (Bleaching)
H3PO4
Deacidification & Deodorisation
RBD Palm Oil Asam Lemak Sawit Distilat
Olein RBD Stearin
Filtrasi Fraksinasi
Bleaching Earth
[image:31.612.112.529.163.526.2](Sumber :http//www.Rephi’s Weblog.2007)
2.3 Alkanolamina
2.3.1 Etanolamina
Etanolamina disebut juga 2-aminoetanol atau monoetanolamina adalah senyawa organik yang terdiri dari gugus amina primer dan alkohol primer. Etanolamina merupakan basa lemah yang memiliki aroma seperti ammonia.
Etanolamina memiliki sifat sebagai berikut (Wikipedia, 2007) : a. Rumus molekul : C2H7NO
b. Berat molekul : 61,08 gr/mol c. Densitas : 1,012 gr/cm3 d. Titik leleh : 10,3oC (1 atm) e. Titik didih : 170oC (1 atm) f. Kelarutan : H2O, alkohol
2.3.2 Dietanolamina
Dietanolamina adalah senyawa yang terdiri dari gugus amina dan dialkohol. Dialkohol menunjukkan adanya dua gugus hidroksil pada molekulnya. Dietanolamina juga dikenal dengan nama bis (hydroxyethyl)amine, diethylolamine, hydroxydiethylamine, diolamine dan 2,2-iminodiethanol. Sifat-sifat dietanolamina adalah sebagai berikut (Wikipedia, 2007) :
d. Titik leleh : 28oC (1 atm) e. Titik didih : 268,8oC (1 atm) f. Kelarutan : H2O, alkohol dan eter
Dietanolamina banyak digunakan dalam produk kosmetik dan deterjen karena mampu menciptakan tekstur yang lembut dan foaming agent (Wikipedia, 2007). Proses produksi alkanolamida dengan melibatkan dietanolamina akan menghasilkan alkanolamida yang memiliki tingkat kepolaran yang lebih baik dibandingkan alkanolamina lainnya. Hal ini disebabkan oleh adanya dua gugus hidroksil dalam molekul alkonolamida yang dihasilkan.
Berikut adalah reaksi pembentukan dietanolamida
R-C-OH + H-N-CH2CH2OH R-C-N-CH2CH2OH + H2O (3) O
CH2CH2OH
O
CH2CH2OH
ALSD Dietanolamina Dietanolamida Air
2.3.3 Trietanolamina
a. Rumus molekul : C6H15NO3 b. Berat molekul : 149,188 gr/mol c. Densitas : 1,126 gr/cm3 d. Titik leleh : 20,5oC (1 atm) e. Titik nyala : 179oC (1 atm) f. Titik didih : 335,4oC (1 atm) g. Kelarutan : H2O, alkohol dan eter
2.4 Fungsi dan Cara Kerja Enzim
atau bagian enzim yang mengadakan hubungan atau kontak dengan substrat dinamai bagian aktif (active site). Hubungan hanya mungkin terjadi apabila bagian aktif mempunyai ruang yang tepat untuk menampung substrat. Apabila substrat mempunyai bentuk atau konformasi lain, maka tidak dapat ditampung pada bagian aktif suatu enzim. Dalam hal ini enzim tidak dapat berfungsi terhadap substrat. Ini adalah penjelasan mengapa tiap enzim mempunyai kekhasan (sifat spesifik) terhadap substrat tertentu. Hubungan atau kontak antara enzim dengan substrat menyebabkan terjadinya kompleks enzim substrat. Kompleks ini merupakan kompleks yang aktif, yang bersifat sementara dan akan terurai lagi apabila reaksi yang diinginkan telah terjadi. Secara sederhana sekali penguraian suatu senyawa atau substrat oleh suatu enzim dapat digambarkan sebagai berikut :
+
Gambar 2.2 Proses Penguraian Substrat Oleh Suatu Enzim
Atau :
E + S ES E + S
E
ES
E, S, ES dan P masing-masing melambangkan enzim, substrat, kompleks enzim substrat dan produk (untuk penyusun enzim yang merupakan perkalian sub-sub unit yang identik, E menyatakan sisi aktif molekul enzim dan bukan molekul enzim). Berdasarkan model ini, bila konsentrasi substrat menjadi tinggi sehingga cukup secara keseluruhan untuk mengubah enzim ke bentuk ES, maka tahap kedua reaksi menjadi mempunyai batas kecepatan dan seluruh tingkat reaksi menjadi tidak sensitif (Simanjuntak dan Silalahi, 2003).
2.4.1 Klasifikasi Enzim
menjadi penting. Misalnya protease dan lipase digunakan dalam industri deterjen, amilase dan glukosa isomerisasi digunakan dalam industri pati atau dalam sintesa senyawa organik lainnya. Hal ini mendorong dilakukannya klasifikasi enzim yang rasional dan juga nomenklatur. Pada tahun 1961, International Union of Biochemistry menetapkan klasifikasi enzim menjadi enam kelas dasar (Manitto, 1981) yaitu : 1. Oksidoreduktase
Enzim-enzim yang termasuk dalam golongan ini dapat dibagi dalam dua bagian yaitu dehidrogenasi dan oksidase. Dehidrogenasi bekerja pada reaksi-reaksi dehidrogenase, yaitu reaksi pengambilan atom hidrogen dari suatu senyawa (donor). Hidrogen yang dilepas akan diterima oleh senyawa lain (akseptor). Oksidase juga bekerja sebagai katalis pada reaksi pengambilan hidrogen dari suatu substrat. Dalam hal ini yang bertindak sebagai akseptor hidrogen adalah oksigen.
2. Transferase
3. Hidrolase
Enzim yang termasuk dalam kelompok ini bekerja sebagai katalis pada reaksi hidrolisis. Ada tiga jenis hidrolase, yaitu yang memecah ikatan ester, memecah glikosida dan yang memecah ikatan peptida. Beberapa enzim sebagai contoh ialah esterase, lipase, fosfatase, amilase, amino peptidase, karboksi peptidase, pepsin, tripsin, kimotripsin. Lipase adalah enzim yang memecah ikatan ester pada lemak, sehingga terjadi asam lemak dan gliserol. Lipase dapat mengkatalisasi reaksi hidrolisa dari trigliserida rantai panjang. Sejak berkembangnya bioteknologi, lipase mendapatkan perhatian yang besar. Lipase merupakan kelas biokatalis yang penting dalam aplikasi bioteknologi.
4. Liase
Meningkatkan terjadinya pemisahan (secara non hidrolitik) suatu gugus atom dari substrat, sehingga terbentuk suatu ikatan rangkap atau penambahan suatu gugus atom pada suatu ikatan rangkap. Contoh enzim golongan ini antara lain dekarboksilase, aldolase, hidratase.
5. Isomerase
6. Ligase
Enzim yang termasuk golongan ini bekerja pada reaksi-reaksi penggabungan dua molekul. Oleh karenanya enzim-enzim tersebut juga dinamakan sintetase. Ikatan yang terbentuk dari penggabungan tersebut adalah ikatan C-O, C-S atau C-C. Contoh enzim golongan ini antara lain glutamine sintetase dan piruvat karboksilase.
2.4.2 Lipase Dalam Industri Oleokimia
adalah jenis lipase yang dapat digunakan dalam reaksi esterifikasi asam lemak tanpa pelarut atau menggunakan pelarut.
2.5 Rancangan Percobaan
Penelitian ini menggunakan Response Surface Methodology (RSM) untuk optimasi proses. RSM merupakan teknik matematika dan statistika yang berguna untuk pemodelan dan analisa masalah dimana responnya dipengaruhi oleh beberapa variabel. Tujuannya adalah untuk mengoptimalkan respon tersebut. Adapun metode RSM meliputi perancangan percobaan, pengembangan model matematis dan penentuan kondisi optimum untuk variabel bebas sehingga diperoleh hasil maksimum dan minimum dari percobaan ini. Langkah awal dalam desain RSM adalah dengan menentukan perkiraan yang sesuai untuk relasi fungsi yang tepat antara respon dan variabel bebas. Dengan metode RSM diperoleh persamaan kuadratik yang dapat digunakan untuk memperkirakan hasil dari fungsi variabel bebas seperti interaksinya.
Untuk menentukan level optimum pada variabel penelitian digunakan faktorial CCD dimana desain eksperimen dalam perhitungan statistika dikodekan dengan X1 dan aktual (Xi) seperti ditunjukkan dalam Persamaan 2.1 berikut ini.
Dimana :
X1 : nilai dimensi dari variabel bebas Xi : nilai aktual dari variabel bebas
−
1
x : rata-rata nilai nyata variabel bebas pada rendah (low) dan tinggi (high)
xj : selisih antar rentang
Secara umum hasil yang diperoleh dapat dianalisa dengan menggunakan multiple regression yang memenuhi persamaan berikut (Montgomery, 1997)
2) . 2 (Pers X X X X X X X X X X X Y 2 3 10 2 2 9 8 3 1 7 3 2 6 2 1 5 3 4 2 3 1 2 1 + + + + + + + + + + = Dimana :
Y : Variabel respon yang diukur yaitu % konversi dietanolamida
1- 10 : Konstanta linier, kuadratik dan hasil regresi koefisien diagonal : error term
dua level (23) yang terdiri dari 8 run pertama (1-8) dengan variabel terkode (± 1) untuk masing-masing faktor (factorial point). Selanjutnya 6 run yang disebut star point dengan level terkode (± ) sebagai significant curvature effect (9-14), sedangkan 6 run tambahan (run 15-20) memuat titik pusat (center point) sebagai perkiraan daerah lekukan kurva dengan kode 0 untuk masing-masing faktor. Jarak star point dengan center point adalah = 2n/4 (untuk 3 faktor, = 1,682). Hasil statistik 20 set run desain optimasi response surface methodology (RSM), analisa regresi dan signifikansi statistikal dianalisa dengan dengan menggunakan simulasi statsoft Minitab Release 14 untuk memberikan perkiraan pengaruh level optimum dari ketiga faktor operasi dan interaksinya masing-masing yang diperoleh dari penyelesaian persamaan regresi, analisa kontur dan plot respon permukaan (contour and surface response). Cara dalam menentukan besarnya harga perlakuan setiap komposit sebelah kiri dan kanan dari komposit pusat (kode 0) dihitung dengan cara : 1. Menetapkan terlebih dahulu perkiraan besarnya harga perlakuan tiap variabel
yang dianggap optimal (informasi tentang kondisi optimal dapat diperoleh dari literatur atau melalui penelitian awal atau orientasi). Misal : 10% untuk konsentrasi katalis pada pusat (kode 0)
2. Harga komposit berikutnya (kode 1) ditetapkan sembarang (dengan harga yang wajar). Misal ditetapkan 12, berarti sebelah kiri (kode -1) ditetapkan 8 supaya selisih sama berharga 2.
Misal : Center point : 10
Kode (1) : 12 dan kode (-1) : 8
(
)
(
)
36 , 13 2 / 8 12 2 / 12 8 682 , 1 = − + − = α αUntuk : 1, 682
(
)
(
)
64 , 6 2 / 8 12 2 / 12 8 682 , 1 1,682 : Untuk = − + − = − − α αIII. METODOLOGI PENELITIAN
3.1 Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Bioproses dan Engineering Lingkungan, Pusat Penelitian Kelapa Sawit/Indonesian Oil Palm Research Institute (IOPRI), Jl.Brigjen Katamso No.51 Kp.Baru Medan. Penelitian dilakukan selama 14 (empat belas) bulan, mulai Maret 2007 sampai April 2008
3.2 Bahan Dan Alat
Bahan yang digunakan dalam penelitian utama adalah asam lemak sawit distilat (ALSD) yang diperoleh dari pabrik refining minyak sawit lokal. Dietanolamina dengan kemurnian 99%, n-heksana (p.a) dan biokatalis Rhizomucor meihei (Lipozyme).
Peralatan yang digunakan dalam percobaan ini adalah :
1. Labu leher tiga 250 ml sebagai tempat berlangsungnya reaksi, yang dilengkapi dengan termometer, kondenser dan air sirkulasi untuk menjaga kestabilan temperatur reaksi
2. Sebagai media pemanas digunakan hot plate merek Cimarex yang dilengkapi pengaduk magnetis dengan kecepatan pengadukan 400 rpm.
3. Pada tahap prurifikasi, untuk memisahkan campuran produk dengan Rhizomucor meihei digunakan filter vakum dan kertas saring
4. Untuk menguapkan sisa pelarut digunakan rotary evaporator pada tekanan 1 atm.
5. Analisa kromatografi lapis tipis (KLT)
a. Chamber 1 : berisi eluen sebagai tempat untuk mengelusi sampel
b. Chamber 2 : berisi iodine sebagai tempat untuk mengembangkan sampel yang telah dielusi
Selanjutnya hasil analisa Kromatografi Lapis Tipis (KLT) akan ikonfirmasi dengan spektrum infra merah (FT-IR).
3.3 Rancangan Percobaan
Metode Response Surface Methodology (RSM) digunakan untuk mendesain percobaan dalam menentukan kondisi optimum proses amidasi ALSD menjadi dietanolamida dengan menggunakan tiga faktor sebagai variabel bebas, yaitu :
1. Konsentrasi biokatalis (Rhizomucor meihei)
2. Rasio mol dietanolamina terhadap asam lemak sawit distilat (ALSD) 3. Temperatur reaksi
Percobaan dirancang mengikuti bentuk Central Composite Design (CCD) (Montgomery, 1997). Titik pusat (center point) dalam rancangan percobaan CCD merupakan konversi terbaik dari masing-masing variabel yang diperoleh melalui percobaan pendahuluan. Titik pusat tersebut akan disusun sebagi level terkode percobaan yang disajikan pada Tabel 3 dan Tabel 4 berikut ini.
Tabel 3. Perlakuan Terkode Untuk Amidasi ALSD
Perlakuan Terkode Perlakuan
-1,682 -1 0 1 1,682
Konsentrasi Rhizomucor meihei(b/b) 6,64 8 10 12 13,36
Rasio Mol Dietanolamina/ALSD 4,96 7 10 13 15,04
Tabel 4. Central Composite Design (CCD) Untuk 3 Variabel
Konsentrasi R.meihei (b/b) (X1)
Rasio Mol
Dietanolamina/ALSD(X2)
Temperatur (oC) (X3)
No
Aktual Kode Aktual Kode Aktual Kode
1 8 -1 7 -1 40 -1
2 12 1 7 -1 40 -1
3 8 -1 13 1 40 -1
4 12 1 13 1 40 -1
5 8 -1 7 -1 60 1
6 12 1 7 -1 60 1
7 8 -1 13 1 60 1
8 12 1 13 1 60 1
9 6,64 -1,682 10 0 50 0
10 13,36 1,682 10 0 50 0
11 10 0 4,96 -1,682 50 0
12 10 0 15,04 1,682 50 0
13 10 0 10 0 33 -1,682
14 10 0 10 0 67 1,682
15 10 0 10 0 50 0
16 10 0 10 0 50 0
17 10 0 10 0 50 0
18 10 0 10 0 50 0
19 10 0 10 0 50 0
Percobaan untuk memperoleh data konstanta reaksi enzimatis, dilakukan dengan melangsungkan reaksi amidasi pada labu leher tiga yang dilengkapi dengan pengaduk magnetis, kondenser, termometer pada kondisi optimum yang telah diperoleh pada percobaan optimasi. Nilai center point (kode 0) diperoleh berdasarkan percobaan pendahuluan. Aturan untuk menentukan matrik Central Composite Design (CCD) terlampir pada Lampiran 2.
3.4 Percobaan Pendahuluan
3.4.1 Screening Enzim
perbandingan dilakukan percobaan dengan asam palmitat menggunakan Lipozyme. Asam palmitat adalah asam lemak terbesar dalam asam lemak sawit distilat.
3.4.2 Waktu Reaksi
Untuk penentuan waktu reaksi, diperoleh berdasarkan percobaan yang dilakukan pada temperatur 30oC, rasio mol ALSD terhadap dietanolamina 1:1 dan konsentrasi enzim lipase 10%. Reaksi berlangsung selama 72 jam. Berdasarkan analisa penentuan bilangan asam, maka ditetapkan waktu reaksi untuk amidasi asam lemak sawit distilat menjadi dietanolamida menggunakan enzim lipase adalah 24 jam.
3.4.3 Pelarut
Pelarut : n-Heksana
[image:50.612.116.526.112.424.2]ALSD Dilarutkan
Gambar 3. Diagram Alir Penentuan Level Rizhomucor meihei, Temperatur dan Rasio Mol ALSD/Dietanolamina (Percobaan Pendahuluan)
Gambar 4. Rangkaian Peralatan Percobaan Pendahuluan (Orientasi) Rasio ALSD/Dietanolamina
1:1; 1:5; 1:10; 1:20 Campuran reaksi 0%, 6%, 8%, 10%, 12%,14% Rhizomucor meihei
T : 30oC, 40oC, 50oC, 60oC Waktu reaksi : 24, 48 dan 72 Reaksi amidasi
Analisa bilangan asam Filtrasi R.meihei
Evaporasi n-Heksana
Dietanolamida Pengambilan sampel Reaksi dihentikan
n-Heksana
[image:50.612.186.432.461.673.2]3.5 Penelitian Utama
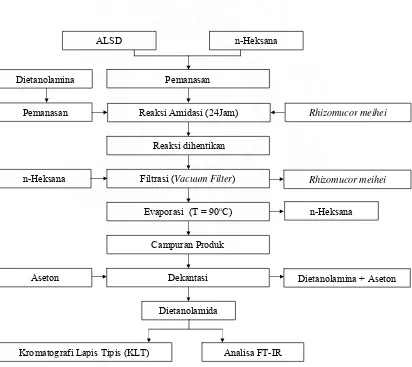
3.5.1 Percobaan Utama Amidasi ALSD Menjadi Dietanolamida
Amidasi asam lemak sawit dilakukan dalam rangkaian alat yang terdiri atas labu leher tiga dengan volume 250 ml yang dilengkapi dengan pengaduk magnetis, kondenser dan termometer. Labu leher tiga dimasukkan dalam penangas yang berisi parafin, untuk menjaga kestabilan temperatur reaksi dipergunakan air sirkulasi. Pengadukan dilakukan pada kecepatan 400 rpm selama percobaan berlangsung. Percobaan diawali dengan melarutkan sejumlah asam lemak sawit distilat (ALSD) dalam n-heksana dan dipanaskan sampai temperatur reaksi yang diinginkan tercapai. Dietanolamina yang telah dipanaskan pada temperatur tertentu serta Rhizomucor meihei dimasukkan kedalam labu leher tiga dan waktu reaksi dimulai pada saat itu. Pada saat waktu reaksi dimulai dilakukan pengambilan sampel, untuk mengetahui bilangan asam awal. Kondisi percobaan disesuaikan dengan rancangan matriks Central Composite Design (Tabel 4). Setelah reaksi amidasi berlangsung selama 24 jam, dilakukan sampling untuk menentukan kesempurnaan reaksi menggunakan analisa penentuan bilangan asam. Konversi produk diperoleh dengan menggunakan selisih antara bilangan asam awal dengan bilangan asam diakhir reaksi.
3.5.2 Pemurnian Produk
dietanolamida yang bercampur dengan heksan dipisahkan dengan menggunakan rotary evaporator pada 90oC. Penentuan suhu penguapan, didasarkan pada titik didih heksan yaitu 69oC (Perry, 1984). Produk yang masih mengandung dietanolamina berlebih, selanjutnya dicuci dengan aseton teknis. Aseton akan melarutkan dietanolamina sedangkan fraksi yang tidak terlarut adalah produk dietanolamida. Produk dietanolamida diperoleh sebagai lapisan bawah dan dietanolamina sisa akan larut bersama aseton sebagai produk atas. Berikut diagram kerja percobaan optimasi
ALSD n-Heksana
[image:52.612.116.528.298.665.2]Pemanasan
Gambar 5. Diagram Kerja Percobaan Utama Amidasi ALSD Menjadi Dietanolamida Reaksi Amidasi (24Jam)
Reaksi dihentikan
Filtrasi (Vacuum Filter)
Evaporasi (T = 90oC)
Dekantasi
Dietanolamida
Rhizomucor meihei
Rhizomucor meihei
Dietanolamina + Aseton n-Heksana
Campuran Produ Dietanolamina
Pemanasan
n-Heksana
k
Aseton
Gambar 6. Rangkaian Peralatan Percobaan Utama ALSD Menjadi Dietanolamida
3.6 Analisa Sampel
3.7 Karakteristik Dietanolamida
Karakterisasi dietanolamida dilakukan setelah dilakukan pemisahan antara enzim lipase yang digunakan dengan produk utama. Uji karakterisasi yang dilakukan terhadap dietanolamida yaitu :
a. Bilangan Asam b. Bilangan Iodine c. Titik leleh (oC) d. pH (1% larutan)
e. Hidrophil Lipophil Balance (HLB) f. Kelarutan :
1. Air 2. Methanol 3. Etanol 4. Heksana 5. Aseton
Prosedur analisa karakterisasi dietanolamida terlampir pada lampiran 1.
3.8 Pengolahan Data Optimasi Reaksi Amidasi ALSD Menjadi Dietanolamida
dianalisa menggunakan regresi multiple untuk memenuhi persamaan berikut ini (Montgomery, 1997). 3.1) (Pers X X X X X X X X X X X X Y 2 3 10 2 2 9 2 1 8 3 1 7 3 2 6 2 1 5 3 4 2 3 1 2 1 + + + + + + + + + + = Dimana :
Y : Variabel response yang diukur yaitu % konversi dietanolamida
1- 10 : Konstanta linier, kuadratik dan hasil regresi koefisien diagonal : error term
Penyelesaian persamaan regresi multiple dilakukan dengan metode Sum of Square of Error (SSE) menggunakan program Minitab Release 14 untuk mendapatkan konstanta regresi.
3.9 Jadwal Penelitian
Tabel 5. Jadwal Penelitian
Bulan (2007-2008) No.
Urut
Kegiatan
Penelitian 1 2 3 4 5 6 7 8 9 10 11 12 13 14 1 Penelusuran
Kepustakaan 2 Persiapan Alat
dan Bahan 3 Penelitian
Pendahuluan 4 Penulisan
Proposal
5 Penelitian Utama & Kinetika
6 Analisa Produk
IV. HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian Pendahuluan
4.1.1 Screening Biokatalis
Percobaan pendahuluan diawali dengan melakukan screening biokatalis yang akan digunakan dalam penelitian selanjutnya. Biokatalis yang digunakan adalah enzim lipase yang mampu bekerja pada substrat asam lemak dan minyak. Rhizomucor meihei dan Candida antartica adalah dua jenis lipase yang dijustifikasi mampu bekerja pada substrat asam lemak sawit distilat yang banyak mengandung asam palmitat. Kedua jenis enzim lipase ini dapat digunakan dalam reaksi esterifikasi lemak (Hasan dkk, 2005).
Tabel 6. Hasil Analisa Bilangan Asam untuk Screening Biokatalis
BILANGAN ASAM (mmol/mg) KONVERSI (%) Waktu
Reaksi
(Jam) RM CA NE RM CA NE
0 132,72 132,72 0,00 0,00 0,00
4 108,71 130,93 18,08 1,35 2,74
8 100,13 119,24 24,55 10,15 5,78
12 93,71 116,11 29,38 12,52 11,20
16 89,69 113,18 32,42 14,72 13,83
20 80,04 111,87 39,69 15,70 14,17
24 75,61 110,40 132,72 129,07 125,04 117,85 114,35 113,97
113,54 43,02 16,81 14,45
Keterangan : RM : Rhizomucor meihei ; CA : Candida Antartica NE : Non Enzim
0 5 10 15 20 25 30 35 40 45 50
0 4 8 12 16 20 24
Waktu Reaksi (Jam)
Ko n v e rs i ( % ) Rhizomucor Meihei Candida Antartica Non Enzim
Besarnya konversi produk, ditentukan melalui selisih penurunan bilangan asam pada awal reaksi dengan bilangan asam selama reaksi berlangsung. Dari hasil percobaan screening biokatalis, diperoleh penurunan kandungan asam lemak bebas terbesar terdapat pada lipase Rhizomucor meihei (Lipozyme). Penentuan konversi produk dilakukan menggunakan selisih bilangan asam pada awal reaksi dengan akhir reaksi dibagi bilangan asam awal reaksi. Konversi produk dietanolamida yang diperoleh berkisar 43,02%, sedangkan untuk Candida antartica (Novozyme) diperoleh 16,81%. Sedangkan reaksi tanpa melibatkan enzim lipase (non enzim) memberikan perolehan produk sebesar 14,45% dan reaksi dengan asam palmitat memberikan perolehan konversi 49,92%. Hal ini sesuai dengan studi yang dilakukan oleh Elisabeth, dkk (1998) bahwa sifat spesifik yang dimiliki Rhizomucor meihei lebih besar pada asam lemak rantai panjang, dimana asam lemak yang dominan dalam asam lemak sawit distilat (ALSD) adalah C16 (asam palmitat).
0 10 20 30 40 50 60
0 4 8 12 16 20 2
Waktu Reaksi (Jam)
K
o
n
v
er
si
(
%
)
[image:60.612.110.508.104.328.2]4
Gambar 8. Perolehan Produk Dietanolamida Pada Substrat Asam Palmitat
Hasil analisa FT-IR terhadap dietanolamida dari asam palmitat terlampir pada Lampiran 6 (Gambar 29). Berdasarkan hasil yang diperoleh ditetapkan penggunaan lipase Rhizomucor meihei sebagai biokatalisator untuk percobaan selanjutnya.
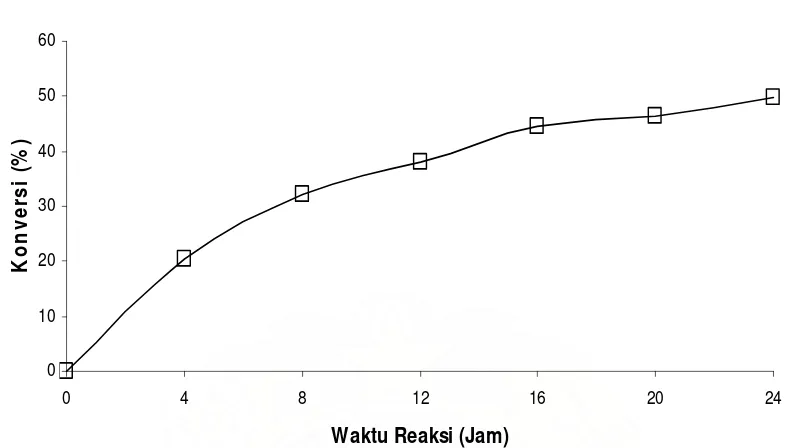
4.1.2 Penentuan Waktu Reaksi
interval waktu setiap 4 jam. Selama reaksi berlangsung dilakukan analisa bilangan asam untuk mengetahui konversi reaksi yang terjadi. Berikut adalah hasil percobaan.
Tabel 8. Hasil Analisa Bilangan Asam untuk Penentuan Waktu Reaksi
WAKTU REAKSI (JAM)
BILANGAN ASAM (mmol/g)
KONVERSI (%)
0 132,72 0,000
4 108,71 18,08
8 100,13 24,55
12 93,71 29,38
16 89,69 32,42
20 80,04 39,69
24 75,61 43,02
28 73,20 44,84
32 71,59 46,05
36 64,75 51,21
40 63,55 52,12
44 62,74 52,72
48 62,34 53,03
52 62,25 53,09
56 62,15 53,17
60 62,11 53,20
64 61,13 53,18
68 62,25 53,09
0 10 20 30 40 50 60
0 4 8 12 16 20 24 28 32 36 40 44 48 52 56 60 64 68 72
Waktu Reaksi (Jam )
K
o
(
%
)
si
n
v
er
Gambar 9. Pengaruh Waktu Reaksi Terhadap Produk Dietanolamida
1. Peningkatan waktu reaksi tidak memberikan perolehan produk yang nyata.
Bila dibandingkan dengan waktu reaksi 24 jam, maka penambahan waktu reaksi hingga 48 jam hanya memberikan peningkatan produk sebesar 10,01%. Dari Gambar 9 terlihat bahwa pada waktu reaksi 52 jam hingga 72 jam, perolehan produk telah konstan. Hal dimungkinkan oleh telah menurunnya aktifitas enzim lipase untuk mesintesa substrat asam lemak sawit distilat. 2. Pemisahan asam lemak sawit distilat (reaktan yang tidak bereaksi) dari produk
cukup mudah, sehingga peningkatan waktu reaksi tidak menjadi faktor penting sebagai bahan pertimbangan untuk meningkatkan konversi produk. 3. Penentuan waktu reaksi dilakukan pada rasio mol 1:1, dengan justifikasi
bahwa peningkatan rasio substrat mampu meningkatkan perolehan produk maka waktu reaksi tidak menjadi satu-satunya faktor penentu reaksi amidasi. Penggunaan rasio substrat yang tinggi dibutuhkan untuk memperoleh ikatan peptida yang kuat pada produk.
4. Hasil analisa spektrofotomer infra red (FT-IR) menunjukkan bahwa peningkatan waktu reaksi hingga 48 jam dan 72 jam akan menyebabkan terbentuknya amina ester pada 1737,11 cm-1 (ikatan C-O) karena adanya kehadiran H2O dalam reaksi. Hasil analisa FT-IR terlampir pada Lampiran 6, (Gambar 26).
4.1.3 Pemilihan Pelarut
Berdasarkan studi literatur, diketahui bahwa aktifitas enzim turut dipengaruhi oleh keberadaan pelarut. Jenis pelarut yang digunakan haruslah dapat meningkatkan kelarutan asam lemak sawit distilat (ALSD) dengan dietanolamina. Sebab pada kondisi temperatur reaksi yang akan digunakan, asam lemak sawit distilat belum mencapai titik lelehnya. Titik leleh asam lemak sawit distilat berkisar 60oC. Penelitian pendahuluan dilakukan percobaan terhadap dua jenis pelarut organik yaitu n-heksana dan isopropanol, sebab asam lemak sawit distilat memiliki kelarutan yang baik pada pelarut organik. Tujuan dari pemilihan pelarut adalah untuk mengetahui performa pelarut yang terbaik bagi reaksi amidasi enzimatis antara ALSD dengan dietanolamina. Reaksi amidasi dilakukan dengan rasio mol 1:1 antara ALSD terhadap dietanolamina, konsentrasi biokatalis 10% dengan rasio pelarut 1:2 (b/v) antara ALSD/pelarut pada temperatur ruang (30oC). Berikut hasil penelitian untuk pelarut n-heksan dan isopropanol.
0 5 10 15 20 25 30 35 40 45 50 Heksan Isopropanol Jenis Pelarut K o n ver si ( % ) Enzim Non Enzim
Dari hasil perbandingan kedua jenis pelarut organik tersebut, diperoleh bahwa reaksi amidasi dengan melibatkan enzim lipase memberikan hasil yang baik pada pelarut n-heksana. Kondisi ini memperlihatkan bahwa aktifitas enzim lipase lebih baik terhadap pelarut organik yang bersifat hydrophobic (Gautam dan Tyagi, 2005). Pemilihan pelarut n-heksana juga didasarkan atas studi yang dilakukan oleh Rahman, dkk (2003) yang menyatakan bahwa n-heksana, benzena dan heptana merupakan pelarut yang memberikan hasil yang baik pada sintesa alkanolamida. Berdasarkan hasil penelitian perbandingan dan studi literatur, maka ditetapkan penggunaan heksan sebagai pelarut (solvent) dalam reaksi amidasi asam lemak sawit distilat menjadi dietanolamida menggunakan enzim lipase dengan beberapa alasan, yaitu :
1. Toksisitas n-heksana lebih rendah, bila dibandingkan dengan benzena dan
heptana, diharapkan lebih aman dalam proses dan pemanfaatan produk
2. Penggunaan pelarut isopropanol, memungkinkan terjadinya reaksi esterifikasi antara asam lemak sawit distilat dengan isopropanol, sehingga kemungkinan terbentuknya senyawa amina ester semakin besar
3. n-Heksana bersifat inert, sehingga tidak mereduksi campuran produk
4. Recovery n-heksan dari campuran produk cukup mudah, sebab dalam proses purifikasi enzim lipase turut digunakan n-heksan sebagai bahan pencuci (untuk memisahkan asam lemak sisa reaksi)
4.1.4 Penentuan Rasio Pelarut
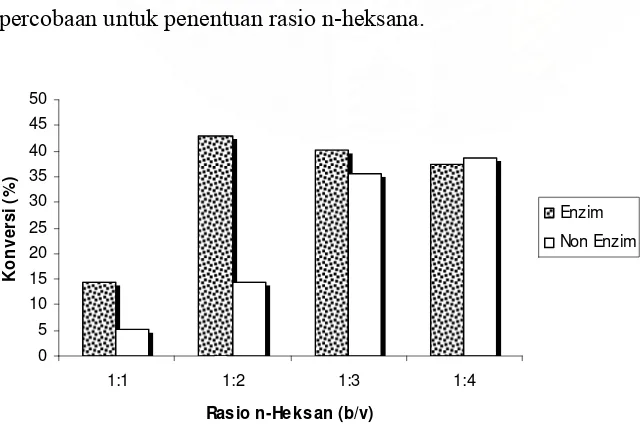
Berdasarkan percobaan untuk penentuan jenis pelarut yang memberikan pengaruh positif terhadap perolehan dietanolamida, maka ditentukan n-heksana sebagai pelarut. Pelarut n-heksan yang digunakan memiliki kadar kemurnian 99%. Digunakannya n-heksan dalam reaksi ini, bertujuan untuk membantu kelarutan dari asam lemak sawit distilat (ALSD) terhadap dietanolamina. Karenanya akan timbul suatu asumsi, bahwa peningkatan rasio pelarut dapat meningkatkan kehomogenan substrat yang akhirnya diharapkan mampu memberikan perolehan produk yang baik. Untuk itu dibutuhkan penentuan rasio pelarut yang tepat untuk meningkatkan kelarutan, tetapi juga memberikan pengaruh positif terhadap kinerja Rhizomucor meihei. Percobaan dilakukan dengan rasio ALSD/n-heksana (b/v) adalah 1:1, 1:2, 1:3 dan 1:4 dan sebagai kontrol terhadap reaksi dilakukan percobaan dengan rasio pelarut yang sama tanpa menggunakan enzim lipase (non enzim). Berikut adalah hasil percobaan untuk penentuan rasio n-heksana.
0 5 15 20 25 30 35 40 45 50
1:1 1:2 1:3 1:4
Rasio n-Heksan (b/v)
[image:66.612.114.436.470.684.2]o si ( % ) Enzim n v er Non Enzim K 10
Dari hasil percobaan diketahui bahwa rasio ALSD terhadap pelarut 1:2 (b/v) memberikan performa terbaik. Hal ini dimungkinkan oleh peningkatan rasio pelarut yang menyebabkan keracunan (toksik) pada enzim lipase. Dapat dilihat pada rasio pelarut 1:3 dan 1:4, bahwa konversi yang diberikan untuk non enzim semakin meningkat dengan bertambahnya pelarut yang disebabkan oleh homogenitas campuran yang semakin tinggi. Berbeda dengan reaksi enzimatis yang mengalami penurunan, bahkan memberikan konversi yang hampir sama dengan non enzim (pada rasio 1:4). Kondisi ini menggambarkan bahwa lipase tidak aktif pada kondisi tersebut.
4.1.5 Pengaruh pH
pH 6 – 7 maka reaksi akan di set-up pada pH tersebut untuk mengetahui aktifitas lipase terbaik. Untuk menurunkan pH awal digunakan H2SO4 dengan konsentrasi 15%. Sebagai kontrol reaksi enzimatis, dilakukan percobaan non enzim.
Berdasarkan hasil percobaan diketahui bahwa untuk pH 7 dan pH 6 aktifitas Rhizomucor meihei tidak menunjukkan aktifitas yang baik. Konversi pada reaksi enzimatis menunjukkan nilai minus, hal ini disebabkan oleh adanya reaksi esterifikasi yang bersifat reversibel oleh karena kehadiran H2SO4. Sedangkan reaksi dengan pH 8, menunjukkan aktifitas yang baik. Dari hasil percobaan pendahuluan ini, dapat disimpulkan bahwa lipase Rhizomucor meihei mampu bekerja pada reaksi amidasi dengan pH yang alkalis.
4.1.6 Penentuan Level Rhizomuor meihei
Tabel 8. Pengaruh Level Konsentrasi Rhizomucor meihei Terhadap Produk
Level Konsentrasi R. meihei (b/b)
BILANGAN ASAM (mmol/g) Bilangan Asam Awal (mmol/g) = 132,72
KONVERSI (%)
6% 105,92 20.19
8% 92,81 30,07
10% 75,61 43,02
12% 101,20 23,74
14% 102,56 22,72
0 10 20 30 40 50
6 8 10 12 14
Level Rhizom ucor m eihei (% b/b)
Ko
n
v
er
si
(
%
)
Gambar 12. Pengaruh Level Konsentrasi Biokatalis Terhadap Dietanolamida
4.1.7 Penentuan Level Rasio Substrat
Dietanolamida dikenal sebagai foaming booster (peningkat busa) karena tingkat kepolaran yang dimilikinya lebih baik dari alkanolamida lain (Takaya dkk, 2004). Reaksi antara ALSD dengan dietanolamina dilakukan dengan menggunakan dietanolamina berlebih sehingga asam lemak sawit distilat berperan sebagai reaktan pembatas yang akan diobservasi. Percobaan dilakukan pada kondisi reaksi temperatur ruang (30oC), konsentrasi Rhizomucor meihei 10% selama 24 jam. Level rasio substrat yang digunakan adalah 1:1; 1:5; 1:10, 1:15 dan 1:20. Sebagai kontrol reaksi dilakukan percobaan tanpa enzim (non enzim) dengan rasio substrat yang sama.
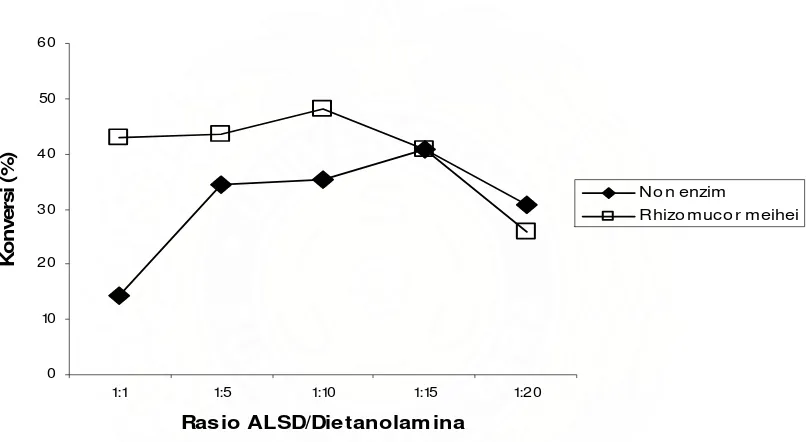
Tabel 9. Pengaruh Rasio Substrat Terhadap Perolehan Dietanolamida
BILANGAN ASAM (mmol/mg) RASIO
ALSD:Dietanolamina
Awal Akhir
KONVERSI (%)
Non Enzim R.meihei Non Enzim R.meihei
1:1 132,72 113,54 75,61 14,45 43,02
1:5 127,95 84,08 72,19 34,28 43,57
1:10 118,61 76,71 61,69 35,32 47,98
1:15 112,11 66,52 66,21 40,66 40,94
1:20 30,08 20,86 22,33 30,65 25,75
hidroksil dari dietanolamina, membentuk amina ester. Sedangkan penggunaan alkanolamina yang berlebih turut dibutuhkan untuk pembentukan ikatan peptida (amida) yang efektif. Tetapi untuk setiap pembentukan satu ikatan peptida, akan dihasilkan satu molekul air, sehingga harus ditentukan rasio ALSD/dietanolamina yang tepat untuk memperoleh dietanolamida.
0 10 20 30 40 50 60
1:1 1:5 1:10 1:15 1:20
Ras io ALSD/Dietanolam ina
K
o
(
%
)
No n enzim
si
n
[image:71.612.115.518.255.476.2]ver Rhizo muco r meihei
Gambar 13. Pengaruh Rasio Substrat Terhadap Perolehan Dietanolamida
dengan hasil yang diperoleh oleh Rahman, dkk (2003), bahwa pada rasio substrat 1:15 hingga 1:20 perolehan produk telah konstan. Analisa FT-IR menunjukkan bahwa penggunaan dietanolamina berlebih pada reaksi non enzim dapat memicu kehadiran amina ester, tetapi pada reaksi enzimatis penggunaan dietanolamina berlebih tidak menunjukkan kehadiran amina ester. Hal ini disebabkan pada non enzim terdapat air sebagai hasil samping dari reaksi esterifikasi, sehingga kemungkinan terbentuknya amina ester semakin besar. Hasil percobaan ini menunjukkan adanya kemungkinan penggunaan konsentrasi substrat yang tinggi untuk meningkatkan konversi produk. Hasil analisa terlampir pada Lampiran 6 (Gambar 27)
4.1.8 Penentuan Level Temperatur
Tabel 10. Pengaruh Temperatur Terhadap Perolehan Dietanolamida
Bilangan Asam (mmol/g) Bilangan Asam (mmol/mg) = 132,72
KONVERSI (%) Temperatur
(oC)
Non Enzim R. meihei Non Enzim R. meihei
30 113,54 75,61 14,45 43,02
40 106,29 68,29 19,91 48,54
50 95,43 61,57 28,09 53,61
60 87,74 71,03 33,89 46,48
0 10 20 30 40 50 60
30 40 50 60
Tem peratur (C)
K
o
n
versi
(
%
)
Rhizomucor meihei Non Enzim
Gambar 14. Pengaruh Temperatur Terhadap Perolehan Produk
reaksi non enzim semakin meningkat seiring dengan peningkatan temperatur. Hal ini disebabkan oleh semakin tingginya tumbukan antar partikel yang disebabkan oleh kenaikan temperatur sehingga mengaktifkan reaksi.
Dari analisa kromatografi lapis tipis (KLT), diketahui bahwa pada temperatur reaksi 60oC baik reaksi amidasi menggunakan enzim lipase atau non enzim akan menghasilkan produk samping berupa amina ester. Sedangkan pada temperatur yang lebih rendah (30oC – 50oC) tidak menunjukkan adanya pembentukan amina ester. Hal ini menunjukkan bahwa peningkatan temperatur akan berpengaruh pada pembentukan produk dietanolamida. Kenaikan temperatur mempengaruhi pemutusan ikatan hidroksil pada dietanolamina sehingga meningkatkan kuantitas H2O dan mempengaruhi aktifitas Rhizomucor meihei. Untuk reaksi amidasi ini, kehadiran H2O dalam kuantitas yang lebih besar selain akan mempengaruhi aktifitas enzim, juga akan memicu reaksi esterifikasi sehingga pada akhir produk akan diperoleh produk samping amina ester. Selain itu penuruanan konversi reaksi pada temperatur 60oC juga dimungkinkan oleh Rhizomucor meihei yang telah mengalami denaturasi pada temperatur tersebut. Hasil analisa KLT terlampir pada Lampiran 5 (Gambar 25).
4.2 Hasil Penelitian Utama
yaitu rendah (low) dan tinggi (high), sehingga diperoleh 20 run percobaan optimasi. Penelitian ini memilih CCD sebagai bentuk desain eksperimen disebabkan oleh CCD memberikan rancangan yang sistematik untuk memperoleh interaksi antar variabel. Dari rancangan CCD ini akan diperoleh interaksi dari ketiga variabel yaitu konsentrasi Rhizomucor meihei (X1), rasio mol dietanolamina terhadap asam lemak sawit distilat (X2) dan temperatur (X3) Berikut adalah hasil percobaan optimasi yang telah dilakukan.
Tabel 11. Hasil Percobaan Optimasi
Konsentrasi R.meihei (X1)
Rasio Mol
Dietanolamina/ALSD (X2)
Temperatur (X3) No
Aktual Kode Aktual Kode Aktual Kode
Konversi (%)
1 8 -1 7 -1 40 -1 70,40628
2 12 1 7 -1 40 -1 75,39498
3 8 -1 13 1 40 -1 78,18018
4 12 1 13 1 40 -1 78,24793
5 8 -1 7 -1 60 1 75,61983
6 12 1 7 -1 60 1 79,79074
7 8 -1 13 1 60 1 78,64413
8 12 1 13 1 60 1 80,12671
9 6,64 -1,682 10 0 50 0 75,15567
10 13,36 1,682 10 0 50 0 78,09618
11 10 0 4,96 -1,682 50 0 72,02944
12 10 0 15,04 1,682 50 0 79,17355
13 10 0 10 0 33 -1,682 76,02739
14 10 0 10 0 67 1,682 74,05766
15 10 0 10 0 50 0 80,67154
16 10 0 10 0 50 0 80,83069
17 10 0 10 0 50 0 80,74823
18 10 0 10 0 50 0 80,48579
4.2.1 Analisa Pengaruh Variabel
[image:76.612.119.529.334.649.2]Pengaruh signifikansi variabel-variabel yang digunakan dapat diobservasi dari hasil pengolahan data percobaan. Analisa statistika untuk signifikansi pengaruh dari ketiga variabel yaitu konsentrasi Rhizomucor meihei (X1), rasio mol asam lemak sawit distilat (ALSD) terhadap dietanolamina (X2) dan temperatur reaksi (X3) serta interaksinya masing-masing tercantum pada Tabel 12 berikut ini.
Tabel 12. Hasil Statistika Minitab 14 Untuk Response Surface Methodology (RSM)
Parameter Hasil Analisa Statistika
Koefisien Nilai p
Konstanta 80,5666 0,000
Konsentrasi Rhizomucor meihei (X1) 1,1463 0,022
Rasio mol ALSD/Dietanolamina (X2) 1,9040 0,001
Temperatur (X3) 0,6326 0,165
Konsentrasi Rizhomucor meihei (X1*X1) -1,0760 0,026 Rasio mol ALSD/Dietanolamina (X2*X2) -1,4381 0,006
Temperatur (X3*X3) -1,6358 0,003
X1*X2 -0,9512 0,115
X1*X3 0,0746 0,895
X2*X3 -0,9083 0,131
R2 0,867
Nilai p Pemodelan 0,003
Berdasarkan hasil analisa statistika diatas, dapat diketahui bahwa konsentrasi biokatalis (Rhizomucor meihei) memberikan pengruh yang positif sebesar 1,1463 dan signifikan terhadap pembentukan produk. Tetapi kuadrat variabel konsentrasi biokatalis Rhizomucor meihei dan interaksinya dengan rasio mol dietanolamina memberikan efek negatif sebesar -1,0760 dan -0,9512 meskipun tidak signifikan. Begitu pula interaksi konsentrasi Rhizomucor meihei dengan temperatur yang memberikan efek positif 0,0746 dengan nilai p 0,895. Hal ini menunjukkan adanya batasan dalam penggunaan Rhizomucor meihei, rasio mol dietanolamina dan temperatur yang dilibatkan pada reaksi. Rasio mol dietanolamina terhadap ALSD turut memberikan pengaruh yang signifikan dan positif 1,9040. Tetapi interaksinya dengan temperatur (X2.X3) memberikan efek negatif yang tidak signifikan.
Selanjutnya, model persamaan yang dapat menunjukkan hubungan variabel reaksi dan interaksinya terhadap % konversi dietanolamida dengan nilai toleransi galat sebesar p >| T | = 0,005 diperoleh sebagai berikut :
Y = 80,5666 + 1,1463X1 + 1,9040X2 + 0,6326X3 – 1,0760X12 – 1,4381X22
–1,6358X32 (Pers. 4.1)
Model orde dua yang diperoleh akan diplot sebagai respon permukaan dan kontur permukaan tiga dimensi untuk mengekspresikan respon % konversi dari percobaan.
4.2.2 Analisa Variansi (ANAVA)
Tabel 13. ANAVA Model Persamaan Regresi Pada Amidasi Asam Lemak Sawit Distilat Menjadi Dietanolamida Menggunakan Minitab 14
FAKTOR SS DK MS F P
Regresi 158,401 9 17,6001 7,24 0,002
Linier 72,918 3 24,3060 9,99 0,002
Kuadratik 71,601 3 23,8668 9,81 0,003
Interaksi 13,883 3 4,6275 1,90 0,193
Residual Error 24,325 10 2,4325 - -
Lack Of Fit(LOF) 24,206 5 4,8413 204,73 0,000
Pure Error 0,118 5 0,0236 - -
Total 182,726 19 - - -
R2 86,7% - - - -
R2(Adj) 74,7% - - - -
S 1,560 - - - -
Keterangan : SS = Sum of Square; MS = Mean of Square; DK : Derajat Kebebasan
Smirnov = 0,05), hal ini mencerminkan bahwa regresi linier merupakan model persamaan yang signifikan. Untuk regresi kuadratik ditunjukkan dengan F sebesar 9,81 dengan nilai P = 0,003. Sedangkan untuk interaksi ditunjukkan dengan F sebesar 1,90 dan nilai P = 0,193. Untuk model regresi kuadratik dan interaksi menunjukkan model yang tidak signifikan, karena nilai P pengamatan telah melampaui faktor signifikansi 5%.
Selain melalui analisa variansi, uji kenormalan model juga dapat dilihat melalui lack of fit. Hasil analisis pada Tabel 13 menunjukkan hasil uji lack of fit (LOF) yang juga dapat digunakan untuk menguji kecukupan model. Bila digunakan sebuah hipotesis
Hipotesisnya adalah :
H0 : Tidak ada lack of fit H1 : Ada lack of fit
Hipotesis awal yang mengatakan tidak ada lack of fit berarti model yang dibuat telah sesuai dengan data, sedangkan hipotesis alternatif berarti model yang telah dibuat belum mewakili data.
Daerah Penolakan
Fit t ed Value R e s id u a l 80 78 76 74 72 70 2 1 0 -1 -2 -3
[image:81.612.102.550.94.688.2]4.2.3 Uji Verifikasi Model Penelitian
Gambar 15. Plot Residual Dengan Taksiran Model
Obse r v a t ion Or de r
Untuk memeriksa kecukupan model, tidak hanya melihat data lack of fit (LOF) saja, tetapi juga harus dilakukan analisa residual. Ada tiga hal yang harus dilalakukan dalam analisa residual, yaitu :
1. Membuat plot antara residual dengan taksiran model (Gambar 15) 2. Membuat plot antara residual dengan order model (Gambar 16) 3. Memeriksa kenormalan residual (Gambar 17)
Gambar 15 menunjukkan titik-titik telah membentuk sebuah pola yang acak, hal ini dapat menyimpulkan bahwa model regresi yang dibuat telah cukup tepat dengan data. Gambar 16 digunakan untuk memeriksa residual dengan order model. Dalam analisa statistika Minitab 14, dapat dilakukan analisa terhadap unusual observation. Unusual observation adalah kondisi dimana residual antara nilai pengamatan dengan prediksi memiliki penyimpangan yang cukup besar dari pengamatan lainnya. Dengan adanya analisa terhadap besarnya nilai penyimpangan, dapat dilakukan penajaman dan peninjauan pengamatan pada penelitian selanjutnya. Berdasarkan analisa statistika (output ANAVA pada Lampiran 3) untuk peneliti