I
RES
IDENTIFI
SEPTOR
S
IN
IKASI KE
HORMON
PAD
ZUL
SEKOLAH
NSTITUT P
ERAGAM
N PERTU
DA SAPI B
LKHARN
H PASCA
PERTAN
BOGOR
2010
MAN GEN
UMBUHA
BALI
NAIM
A SARJAN
IAN BOG
R
ETIK GE
N (GHR|
A
NA
GOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Identifikasi Keragaman Genetik Gen
Reseptor Hormon Pertumbuhan (GHR|
Alu
I) pada Sapi Bali adalah karya saya dengan
arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada
perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip lain telah
disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka akhir tesis ini.
Bogor, Juni 2010
ABSTRACT
ZULKHARNAIM. Identification of Genetic Diversity Growth Hormone Receptore
(GHR|
Alu
I) Gene in Bali Cattle. Under supervised of RONNY RAHMAN NOOR and
JAKARIA.
One of factor affects in growing is Growth Hormone Receptor (GHR). GHR is
required for
GH to carry out its effects on target tissues. The objective of the study was to estimate
genetic diversity
of the GHR|AluI in Bali, Limousin, Simmental and Pesisir cattle.
Genotyping was performed on 248 animals, including 162 Bali, 21 Limousin, 17
Simmental and 48 Pesisir cattle breeds.
Single nucleotide polymorphisms (SNP) has been
found in exon 10, coding for the cytoplasmic domain of GHR, which was located at
position 81 bp (A/G) induce amino acid substitutions Ser/Gly.
Genotype frequencies of
Bali cattle AA (
0.988)
, GG (
0.006) and AG (0.006)
were evidenced for the GHR AluI
monomorphism, but largerly different from Limousin GG (
0.667),
AA (
0.238) and AG
(0.095)
, Simmental AG (
0.529), GG (0.471)
and AA (
0.000)
, Pesisir AA (
0.604), GG
(0.375)
and AG (
0.021)
were the evidenced of polymorphism. It was suggested that
homozigosity (monomorphism) in Bali cattle could be affected by adaptability in extreme
environmental conditions such as poor nutrition and improper manajement practice. It also
could be affected by natural selection and phenotype plasticity phenomena.
RINGKASAN
ZULKHARNAIM. Identifikasi Keragaman Genetik Gen Reseptor Hormon Pertumbuhan
(GHR|
Alu
I) pada Sapi Bali. Dibimbing oleh RONNY RAHMAN NOOR dan JAKARIA.
Ternak sapi memberikan kontribusi cukup besar dalam penyediaan daging nasional.
Berdasarkan produksi daging nasional 2008, kontribusi daging sapi mencapai lebih dari
352 ribu ton, yaitu sekitar 16.2 % dari total produksi daging nasional dari beberapa
komoditas ternak, dan menempati peringkat kedua setelah produksi daging unggas.
Perannya yang sedemikian penting menjadi alasan bahwa produktivitas dan populasi sapi
di Indonesia selalu menjadi perhatian besar dari pemerintah. Sapi Bali merupakan satu dari
empat bangsa sapi lokal utama (Aceh, Pesisir, Madura dan Bali) di Indonesia, yang
merupakan hasil domestikasi langsung dari Banteng (
Bos banteng
).
Pelestarian sumber daya genetik ternak lokal menjadi hal yang penting untuk
dilaksanakan selain sebagai sumber pangan, ternak lokal juga merupakan kekayaan alam
yang harus dipertahankan. Kemampuan sapi Bali beradaptasi terhadap lingkungan yang
marjinal, berpengaruh terhadap pertumbuhannya, yang ditunjukkan oleh keragaman
pertumbuhan sapi Bali pada kondisi lingkungan yang berbeda. Keragaman gen GHR|
Alu
I
pada sapi Bali menarik untuk dikaji, hal ini disebabkan informasi tersebut belum ada.
Tujuan penelitian ini adalah untuk mengetahui keragaman fragmen gen reseptor hormon
pertumbuhan (GHR|
Alu
I) pada sapi Bali.
Materi penelitian yang digunakan untuk analisis DNA adalah 162 sampel sapi Bali
dari UP3 Bali, 21 sampel sapi Limousin dari BIB Singosari Malang, 17 sampel sapi
Simmental dari BIB Singosari Malang dan 48 sampel sapi Pesisir dari Kabupaten Pesisir
Selatan. Penarikan sampel data penelitian berdasarkan kriteria bangsa yaitu bangsa sapi
Bali, Simmental, Limousin dan Pesisir. Sapi Bali merupakan bangsa
Bos javanicus
, sapi
Limousin dan Simmental termasuk
Bos taurus
, sedangkan sapi Pesisir merupakan salah
satu sapi lokal Indonesia. Pemilihan sapi Pesisir sebagai pembanding sapi Bali antar sapi
lokal Indonesia, sedangkan
Bos taurus
(Limousin dan Simmental) sebagai pembanding dari
bangsa sapi asal subtropis.
Identifikasi keragaman gen GHR|
Alu
I dilakukan menggunakan pendekatan
PCR-RFLP. Analisis yang dilakukan yakni, frekuensi alel, uji Khi-kuadrat, frekuensi
heterosigositas pengamatan, frekuensi heterosigositas harapan dan ragam heterosigositas
harapan,
Polymorphic Informative Content
dan perunutan susunan nekleotida.
Amplifikasi fragmen gen GHR|
Alu
I menggunakan primer
forward
5’-CGCTTACTTCTGCGAGGTAGACGC-3’ dan primer
reverse
5’-GTCTGGCT
CACATAGCCAC-3’. Panjang produk hasil amplifikasi sepanjang 298 bp. Genotipe yang
ditemukan adalah genotipe AA, AG dan GG. Gen GHR|
Alu
I pada sapi Bali bersifat
monomorfik dengan frekuensi alel A dan genotipe AA yang tinggi, sedangkan polimorfik
pada sapi Limousin, Simmental dan Pesisir.
Hardy-
Weinberg pada populasi sapi Bali diduga disebabkan oleh seleksi alam yang terjadi dalam
proses domestikasi sapi Bali dan seleksi negatif yakni pemotongan dan penjualan sapi-sapi
yang mempunyai pertumbuhan yang baik oleh peternak.
Nilai pendugaan heterozigositas (0.006) dan
Polymorphic Informative Content
(0.018) sapi Bali rendah jika dibandingkan dengan sapi Limousin, Simmental dan Pesisir.
Rendahnya heterozigositas atau keragaman genetik pada sapi Bali kemungkinan
disebabkan kemampuan adaptasi terhadap lingkungan marjinal yang didapatkan dari
seleksi alam dan kelenturan fenotipik. Pendugaan nilai
Polymorphic Informative Content
yang rendah pada sapi Bali mengindikasikan bahwa fragmen gen GHR
Alu
I kurang
informatif sebagai penciri genetik pada sapi Bali.
Hasil sekuen fragmen gen GHR|
Alu
I menunjukkan adanya mutasi basa adenin (A)
menjadi guanin (G) pada posisi 81 bp (3338 bp Kode Akses. EF207442
GenBank
).
Berdasarkan pohon genetik fragmen gen GHR|
Alu
I terdapat pemisahan yang jelas antara
sapi Bali, Limousin, Simmental dan Pesisir.
© Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau
menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian,
penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu
masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
IDENTIFIKASI KERAGAMAN GENETIK GEN
RESEPTOR HORMON PERTUMBUHAN (GHR|
Alu
I)
PADA SAPI BALI
ZULKHARNAIM
Tesis
Sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Mayor Ilmu Produksi dan Teknologi Peternakan
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Identifikasi Keragaman Genetik Gen Reseptor Hormon Pertumbuhan
(GHR|
Alu
I) pada Sapi Bali
Nama
: Zulkharnaim
NIM :
D151080111
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Ronny R. Noor, M. Rur. Sc
Dr. Jakaria, S. Pt, M.Si
Ketua Anggota
Diketahui
Ketua Mayor
Dekan Sekolah Pascasarjana IPB
Ilmu Produksi dan Teknologi Peternakan
Dr. Ir. Rarah R. A. Maheswari, DEA
Prof. Dr. Ir. Khairil A. Notodiputro, M. S
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia dan
petunjuk-Nya dan Nabi Muhammad SAW sebagai sauritauladan, sehingga penulis dapat
menyelesaikan studi, penelitian, dan penulisan tesis ini. Tesis ini berjudul Identifikasi
Keragaman Genetik Gen Reseptor Hormon Pertumbuhan (GHR|
Alu
I) pada Sapi Bali.
Penghargaan tertinggi penulis ucapkan kepada kedua orang tua tercinta atas
bimbingan, perhatian dan doanya yang tak pernah terbalaskan. Kepada adik dan saudara
penulis semua yang selalu memberikan semangat kepada penulis. Terimakasih juga penulis
ucapkan kepada Prof. Dr. Ir. Ronny Rahman Noor, M. Rur. Sc dan Dr. Jakaria, S. Pt, M. Si
atas bimbingan dan kesempatan yang diberikan untuk menimba ilmu pemuliaan dan
genetika ternak seluas-luasnya.
Ucapan terimakasih juga kepada juga penulis sampaikan kepada Prof. Dr. Ir.
Muladno, MSA dan Prof. Dr. Ir. Cece Sumantri, M. Agr. Sc yang telah memberikan
kesempatan melakukan penelitian di Laboratorium Genetika Molekuler Ternak. Kepada
teman-teman di Laboratorium Genetika Molekuler Ternak, teman-teman Pascasarjana S2
angkatan 2008/2009, 2009/2010 dan Pascasarjana S3 2008/2009 atas bantuannya selama
penulis melaksanakan studi. Terimakasih juga penulis ucapkan kepada semua pihak yang
tidak dapat disebutkan satu persatu atas bantuan dan dukungannya. Penulis mengharapkan
semoga karya ini bermanfaat bagi upaya pengembangan keilmuan dan pembangunan
peternakan di Indonesia.
Bogor, Juni 2010
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 22 April 1985 di Makassar. Penulis adalah anak
pertama dari dua bersaudara dari pasangan H. Baharuddin dan Hj. Ratnawati.
Pendidikan dasar diselesaikan pada tahun 1997 di SD Negeri Pa’ Baeng-baeng,
Makassar. Pendidikan lanjutan tingkat pertama diselesaikan pada tahun 2000 di SLTP
Negeri 3, Makassar. Pendidikan lanjutan menengah tingkat atas diselesaikan pada tahun
2003 di SLTA Negeri 3, Makassar. Pendidikan strata satu diselesaikan pada tahun 2008 di
Jurusan Produksi Ternak, Fakultas Peternakan, Universitas Hasanuddin, Makassar. Penulis
melanjutkan kependidikan strata dua dan diterima di Sekolah Pascasarjana, Mayor Ilmu
Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor tahun
ajaran 2008/2009.
DAFTAR ISI
Halaman
DAFTAR ISI ...
xii
DAFTAR TABEL ...
xiii
DAFTAR GAMBAR ...
xiv
DAFTAR LAMPIRAN ...
xv
PENDAHULUAN ...
1
Latar Belakang ...
1
Tujuan Penelitian ...
3
Manfaat Penelitian ...
3
TINJAUAN PUSTAKA ...
4
Asal Usul Sapi Bali dan Penyebarannya ...
4
Karakteristik Fenotipik Sapi Bali ...
6
Keragaman Genetik Sapi Bali ...
6
Gen-Gen Pengontrol Pertumbuhan ...
8
Gen Reseptor Hormon Pertumbuhan (
Growth Hormone Receptor
) ..
10
Polimorfisme pada Gen Reseptor Hormon Pertumbuhan ...
13
Penciri
Genetik
Polymerase Chain Reaction
-
Restriction Fragment Length
Polymorphism
(PCR-RLFP) ...
14
MATERI DAN METODE ...
16
Tempat dan Waktu ...
16
Materi dan Alat Penelitian ...
16
Isolasi DNA ...
16
Analisis PCR ...
16
Analisis PCR-RLFP ...
17
Analisis Elektroforesis ...
17
Metode Penelitian ...
17
Penarikan Sampel Data Penelitian ...
17
Pengambilan Sampel Darah ...
18
Isolasi DNA Total ...
18
Amplifikasi Gen GHR Menggunakan Mesin
Thermal Cycler
18
Analisis
PCR-RFLP
...
19
Elektroforesis DNA Total, Produk PCR dan Produk PCR-RLFP
19
Analisis Data ...
20
Frekuensi Alel ...
20
Frekuensi Heterozigositas Pengamatan ...
20
Frekuensi Heterozigositas Harapan ...
21
Polymorphic
Informative
Content
(PIC) ...
21
Perunutan Susunan Nukleotida ...
21
Jarak Genetik dan Pohon Genetik Gen GHR|
Alu
I ...
22
HASIL DAN PEMBAHASAN ...
23
Amplifikasi Gen Reseptor Hormon Pertumbuhan ...
23
Keragaman
Gen
Reseptor
Hormon Pertumbuhan ...
26
Frekuensi Alel dan Genotipe Fragmen Gen GHR
Alu
I ...
26
Keseimbangan Gen dalam Populasi ...
29
Pendugaan Nilai Heterozigositas ...
30
Pendugaan
Nilai
Polymorphic Informative Content
(PIC) ...
31
Sekuens Gen Reseptor Hormon Pertumbuhan (GHR) ...
32
Homologi dan Deteksi Mutasi Gen GHR|
Alu
I ...
32
Jarak Genetik dan Pohon Genetik Sekuens Gen GHR|
Alu
I ...
35
KESIMPULAN ...
37
Simpulan
...
37
Saran
...
37
DAFTAR PUSTAKA ...
38
LAMPIRAN ...
43
DAFTAR TABEL
Halaman
1
Jumlah DNA dan tahun pengambilan sampel darah
yang digunakan dalam penelitian ...
16
2
Frekuensi genotipe dan alel fragmen gen GHR|
Alu
I ...
26
3
Distribusi frekuensi alel A dan G fragmen gen GHR|
Alu
I
berdasarkan daerah pengembangan ...
29
4
Nilai heterozigositas pengamatan (H
o) dan heterozigositas
harapan (H
e) fragmen gen GHR|
Alu
I ...
30
5
Pendugaan nilai
Polymorphic Informative Content
(PIC)
DAFTAR GAMBAR
Halaman
1
Kemungkinan rute domestikasi sapi di Asia ...
5
2
Lokasi sampel dan hubungan genetik dari populasi sapi Indonesia ..
5
3
Lintasan transduksi sinyal yang diaktifkan oleh GHR ...
11
4
Rekonstruksi struktur gen GHR berdasarkan sekuens gen GHR di
GenBank
(Kode Akses. EF207442) ...
12
5
Fragmen gen GHR|
Alu
I
didasarkan pada sekuens gen GHR
di
GenBank
(Kode Akses. EF207442) ...
18
6
Posisi fragmen gen GHR|
Alu
I serta situs enzim pemotongnya ...
23
7
Produk PCR gen GHR|
Alu
I (298 bp) ...
23
8
Genotipe hasil pemotongan produk PCR fragmen gen GHR
enzim
Alu
I ...
24
9
Genotipe hasil pemotongan produk PCR fragmen gen GHR
enzim
Alu
I sapi Bali ...
25
10
Alignment
sekuens fragmen gen GHR|
Alu
I (
ekson
10)
DAFTAR LAMPIRAN
Halaman
1
Sekuens gen reseptor hormon pertumbuhan (GHR) pada sapi yang
diakses di Gen
Bank
(Kode Akses. EF207442) ...
44
2
Modifikasi metode isolasi DNA menggunakan
Genomic DNA Mini
PENDAHULUAN
Latar Belakang
Ternak sapi memberikan kontribusi cukup besar dalam penyediaan daging nasional. Berdasarkan produksi daging nasional 2008, kontribusi daging sapi mencapai lebih dari 352 ribu ton, yaitu sekitar 16.2 % dari total produksi daging nasional dari beberapa komoditas ternak, dan menempati peringkat kedua setelah produksi daging unggas (Direktorat Jenderal Peternakan 2009). Perannya yang sedemikian penting menjadi alasan bahwa produktivitas dan populasi sapi di Indonesia selalu menjadi perhatian cukup besar dari pemerintah.
Sapi Bali merupakan satu dari empat bangsa sapi lokal utama (Aceh, Pesisir, Madura dan Bali) di Indonesia, yang merupakan hasil domestikasi langsung dari Banteng (Martojo 2003). Keunggulan sapi Bali dibandingkan dengan sapi lokal lainnya yaitu memiliki daya adaptasi yang tinggi terhadap lingkungan yang marjinal (Masudana 1990). Daya adaptasi sapi Bali diantaranya adalah, dapat memanfaatkan pakan dengan kualitas rendah (Sastradipraja 1996), mempunyai fertilitas dan conception rate yang sangat baik (Oka dan Dramadja 1996), dan memiliki daging berkualitas baik dengan kadar lemak rendah (Bugiwati 2007).
Pelestarian sumber daya genetik ternak lokal menjadi hal yang penting untuk dilaksanakan. Ternak lokal selain sebagai sumber pangan juga merupakan kekayaan alam yang harus dipertahankan. Indonesia sebagai pusat domestikasi sapi Bali di dunia menjadi penting untuk melaksanakan program pelestarian sapi Bali mengingat keunggulan sapi Bali sebagai ternak lokal. Salah satu program nasional yang berhubungan dengan pelestarian sapi Bali adalah program pemurnian dan peningkatan mutu genetik sapi Bali. Program pemurnian sapi Bali dilaksanakan dengan penetapan wilayah peternakan murni sapi Bali yang meliputi Pulau Bali, Pulau Sumbawa di Propinsi Nusa Tenggara Barat (NTB), Pulau Flores di Propinsi Nusa Tengara Timur (NTT) dan Kabupaten Bone di Propinsi Sulawesi Selatan (Pane 1991).
2
pada ternak yang sebangsa, antarpopulasi maupun di dalam populasi, atau diantara individu dalam populasi (Abdullah 2008). Keragaman penampilan produksi sapi Bali dapat diukur berdasarkan bobot dewasanya, dimana terdapat keragaman bobot dewasa sapi Bali yang dipelihara pada daerah pemurnian dan pembibitan Pulau NTT, NTB, Bali dan Sulawesi Selatan yakni ; 221.5; 241.9; 303.3 dan 211 kg (Talib et al. 2003). Identifikasi tingkat keragaman genetik spesies domestik dilakukan terutama pada lokus-lokus yang mempunyai sifat bernilai penting dan mempunyai keterkaitan dengan seleksi dalam program pemuliaan (Handriawan dan Subandriyo 2004). Keragaman tersebut dapat terjadi karena kemampuan adaptasi ternak berbeda terhadap perubahan lingkungan di daerah pemeliharaannya dan kondisi sosial budaya masyarakat di daerah tersebut.
Kemampuan sapi Bali beradaptasi terhadap lingkungan yang marjinal, berpengaruh terhadap pertumbuhannya hal ini ditunjukkan dari pertumbuhan sapi Bali yang beragaman pada kondisi lingkungan yang berbeda. Salah satu faktor genetik yang mempunyai peranan dalam pertumbuhan suatu individu adalah gen reseptor hormon pertumbuhan (Growth Hormone Reseptor) (GHR). Zhou dan Jiang (2005) menyatakan bahwa pada tingkatan jaringan, aksi biologis dari hormon pertumbuhan (Growth Hormone) (GH) dimediasi oleh GHR. Pada sapi, GHR ditandai sebagai gen yang tunggal (Moody et al. 1995). Berdasarkan fungsi mediasi yang dimiliki oleh GHR maka keragaman pertumbuhan ternak sapi dapat juga diidentifikasi dari sifat keragamannya. Gen bovine Growth Hormone
Receptor (bGHR) terletak pada kromosom 20 (Moody et al. 1995).
Keragaman genetik fragmen gen GHR|AluI pada exon 10 telah diidentifikasi pada beberapa sapi pedaging/potong. Ge et al. (2000) mengidentifikasi single nucleotide polymorphism (SNP) fragmen gen GHR|AluI sapi Angus, yang berlokasi pada posisi 76 (T/C), 200 (G/A), 229 (T/C) dan 257 (A/G) bp. SNP pada posisi 200 dan 257 bp merubah susunan asam amino, secara berturut-turut Ala/Thr dan Ser/Gli, sedangkan dua mutasi lainnya merupakan
silent mutation (mutasi yang tidak mengubah susunan asam amino). Penelitian
3
Keragaman fragmen gen GHR|AluI pada sapi Bali menarik untuk dikaji, hal ini disebabkan informasi tersebut belum ada. Informasi ini penting untuk diketahui dalam rangka melengkapi kerangka kerja genetika molekuler pada tingkat regional maupun benua untuk penggunaan pada saat ini maupun masa yang akan datang.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mempelajari keragaman fragmen gen gen reseptor hormon pertumbuhan (GHR) AluI pada sapi Bali.
Manfaat
TINJAUAN PUSTAKA
Asal Usul Sapi Bali dan Penyebarannya
Sapi Bali merupakan hasil domestikasi dari Banteng (Bos banteng) (Namikawa et al. 1980), Bos javanicus, Bos sondaicus (Payne dan Hodges 1997). Banteng atau Bos banteng ditemukan hidup di Myanmar, Cambodia, Laos, Vietnam, Thailand, Malaya, Pulau Bali, Pulau Jawa, dan Pulau Kalimantan (Borneo) (Payne dan Hodges 1997). Domestikasi sapi Bali diduga terjadi di Asia Tenggara dan terpusat di Indonesia. Sapi Bali didomestikasi selama lebih kurang 3500 SM (Rollinson 1984).
Tempat dimulainya domestikasi sapi Bali belum disepakati, dimana Meijer (1962) berpendapat proses domestikasi terjadi di Pulau Jawa, namun Payne dan Rollinson (1973) menduga asal mula sapi Bali adalah dari Pulau Bali mengingat tempat ini merupakan pusat distribusi sapi Bali dari Pulau Bali yang kemudian menyebar luas ke daerah Asia Tenggara, dengan kata lain bahwa pusat gen sapi Bali adalah di Pulau Bali, di samping pusat gen sapi Zebu di India dan pusat gen
primigenius di Eropa (Gambar 1) (Handiwirawan et al. 2003).
Sapi Bali merupakan satu dari empat bangsa sapi lokal utama (Aceh, Pesisir, Madura dan Bali) di Indonesia, dimana sapi Bali merupakan hasil domestikasi langsung dari Banteng liar (Martojo 2003). Hubungan antara sapi Bali dan sapi lokal lainnya telah banyak diteliti, salah satunya dengan analisis DNA mitokondria. Menurut Kusdiantoro (2009) hubungan maternal dari sapi Bali asli dari empat tempat berbeda (Sulawesi, Bali, Sumatera Selatan, dan Sumatera Barat) berhubungan erat dengan banteng ditinjau dari analisis DNA mitokondria (mt), kromosom Y (Y) dan mikrosatelit alel autosom (µst) (Gambar 2).
I a B ( w b Indonesia (T abad ke-19 y 1993), dan s Bali ke ban (Hardjosubr wilayah Indo Gam Gam Tahu besaran yan Talib 2002). yang dibawa sampai ke Pu nyak wilaya roto dan Ast
onesia.
mbar 1. Kem Rol
mbar 2. Lok Ind un 1964 di
g menyebab
. Penyebaran a oleh raja-r ulau Timor ah di Indon tuti 1993) d
mungkinan llinson 1973
kasi sampel donesia (Kus Bali terjad bkan sapi Ba
n sapi Bali raja pada zam
antara tahun nesia kemud dan saat ini t
rute domes )
l dan hubu diantoro 200 di musibah ali tidak bole
ke Lombok man itu (Ha n 1912 dan 1 dian dilakuk telah menye stikasi sapi ngan geneti 09) penyakit je eh dikeluark mulai dilak ardjosubroto 1920. Penye kan sejak ta ebar hampir
di Asia (P
ik dari pop
embrana sec kan lagi dari
6
sebagai ternak bibit. Mulai periode inilah sumber bibit sapi Bali bagi daerah lain di Indonesia digantikan oleh NTT, Sulawesi Selatan dan NTB (Talib 2002).
Karakteristik Fenotipe Sapi Bali
Sapi Bali memiliki karakteristik fenotipe yang unik dibandingkan dengan sapi lainnya. Menurut Pane (1986) anak sapi jantan hingga sekitar umur 6 bulan berwarna sama dengan sapi betina yaitu merah bata kecoklatan, tetapi dengan semakin tua umurnya akan mulai berubah menjadi coklat kehitaman mulai dari bagian depan tubuh ke belakang. Terdapat warna putih pada bagian belakang paha (pantat), bagian bawah (perut), keempat kaki bawah (white stocking) sampai di atas kuku, bagian dalam telinga, dan pinggiran bibir atas pada sapi Bali jantan dan betina (Hardjosubroto dan Astuti 1993).
Sapi Bali merupakan ternak tipe potong atau pedaging dan sebagai ternak pekerja. Sapi Bali merupakan penghasil daging utama untuk ruminansia besar di Indonesia. Berat sapi jantan dewasa sekitar 400 kg, lingkar dada sekitar 192 cm, tinggi gumba sekitar 127 cm, dan panjang tubuh sekitar 140 cm. Berat sapi betina dewasa sekitar 260 kg dengan lingkar dada sekitar 165 cm, tinggi gumba sekitar 114 cm, dan panjang badan sekitar 260 cm (Pane 1986).
Banyak laporan yang telah mengemukakan hasil penelitian mengenai keunggulan produksi sapi Bali. Keunggulan produksi sapi Bali dapat dilihat dari beberapa indikator sifat-sifat produksi seperti bobot lahir, bobot sapih, bobot dewasa, laju pertambahan bobot badan, sifat-sifat karkas (persentase karkas dan kualitas karkas), maupun sifat reproduksi seperti dewasa kelamin, umur pubertas, jarak kelahiran (calving interval), dan persentase kelahiran. Beberapa sifat produksi dan reproduksi tersebut merupakan sifat penting/ekonomis yang dapat dipergunakan sebagai indikator seleksi (Handiwirawan dan Subandriyo 2004).
Keragaman Genetik Sapi Bali
Sapi Bali sebagai ternak domestik Indonesia yang berasal dari hasil domestikasi Banteng liar Bos banteng (Namikawa et al. 1980), Bos javanicus, Bos
sondaicus (Payne dan Hodges 1997), memiliki karakteristik genetik yang khas.
7
sehingga lingkungan mempengaruhi sifat fenotipik dan genotipiknya. Kondisi tersebut yang membuat sapi Bali berbeda dengan bangsa sapi lain di dunia.
Kemampuan sapi Bali beradaptasi pada lingkungan yang marjinal menjadi hal yang penting, disebabkan kemampuan tersebut tidak dimiliki oleh beberapa bangsa sapi lainnya. Sapi Bali dapat memanfaatkan pakan dengan kualitas rendah (Sastradipraja 1996), mempunyai fertilitas dan conception rate yang sangat baik (Oka dan Dramadja 1996), dan memiliki daging berkualitas baik dengan kadar lemak rendah (Bugiwati 2007).
Karakteristik genetik pada ternak banyak disebabkan oleh kondisi lingkungan. Rata-rata efek dari sebuah gen tergantung pada keadaan yang ekstrem akan diekspresikan oleh genetika lingkungan yang dibawa oleh gen tersebut yang dapat memberikan perubahan fenotipik sampai intra-lokus dominan, epistatis terhadap lokus yang mekanisme fungsinya berhubungan dan lingkungan fisik dimana mempunyai dampak terhadap fenotipik, hal tersebut disebabkan dasar fisiologis menyebabkan dampak pada penampilan sifat yang diobservasi pada daerah yang berbeda. Sebagai contoh, gen yang mengatur efisiensi pakan seharusnya memberikan dampak yang nyata pada keadaan nutrisi kurang, dan gen yang mengatur nafsu makan seharusnya memberikan dampak pada keadaan nutrisi yang berlimpah (Noor et al. 1993).
Kultur sel atau organisme secara keseluruhan memberikan respon dengan mensintesa sejumlah protein yang dikenal sebagai heat shock protein atau stress protein, pada saat bersamaan sebagian besar protein akan switched off (Noor 2002). Organisme memberikan respon terhadap stress dengan jalan mengatur fisiologi atau morfologi untuk meredam pengaruhnya dan mempertahankan fungsi normal, resistensi melibatkan respon fisiologis dan morfologis sehingga organisme dapat bertahan dan bereproduksi pada kondisi stress.
8
teori utama tentang aspek genetik kelenturan fenotipik, yakni ; (1) suatu sifat yang dikontrol oleh gen-gen yang terletak pada lokus yang berbeda dengan gen-gen yang mengatur rataan sifat pada lingkungan tertentu, (2) suatu fenomena seleksi untuk rataan sifat yang berbeda pada lingkungan yang berbeda, (3) perubahan fenotip pada lingkungan yang berbeda merupakan fungsi menurun dari jumlah lokus heterosigot (Noor 2002).
Secara umum, produktivitas ternak lokal di daerah tropis rendah, tetapi adaptabilitas dan ketahanan terhadap lingkungan buruk mungkin menjadi hal yang baik. Di beberapa Negara tropis, usaha untuk meningkatkan produktifitas telah dilakukan dengan mendatangkan ternak dari daerah subtropik dan menyilangkan dengan ternak lokal (Noor et al. 1993).
Kelenturan fenotipik merupakan fenomena genetik, yang disebabkan beberapa hal, yakni : (1) Kelenturan fenotipik adalah suatu sifat yang menjadi subjek seleksi alam dan perubahan secara evolusi, (2) terdapat variasi genetik pada arah dan besarnya respon terhadap perubahan lingkungan, dan (3) telah dideteksi adanya respon seleksi terhadap kelenturan fenetopik (Noor 2008).
Interaksi antara faktor genetik dengan faktor lingkungan merupakan masalah yang sangat serius di bidang peternakan pada umumnya dan impor-ekspor ternak pada khususnya. Interaksi ini dikatakan ada jika ternak-ternak yang dipelihara pada lingkungan tertentu akan berubah tingkat produksinya saat dipelihara di lingkungan berbeda. Fenomena kelenturan fenotipik akan memberikan arah baru dalam program seleksi. Program seleksi tidak saja ditujukan pada gen-gen yang mengatur daya lentur sifat poduksi, tetapi juga pada gen-gen yang mengatur daya lentur sifat produksi tersebut pada lingkungan yang berbeda (Noor 2008).
Gen-Gen Pengontrol Pertumbuhan
9
serta peningkatan ukuran dan jumlah pada tingkat dan titik berbeda dalam suatu waktu tertentu. Pertumbuhan dikarakterisasikan oleh peningkatan ukuran dari sel individu (hypertrophy) sama seperti peningkatan jumlah sel pada jaringan (hyperplasia).
Salah satu faktor genetik yang mempunyai peranan di dalam pertumbuhan suatu individu adalah gen GH. Gen GH diperlukan untuk pertumbuhan jaringan, metabolisme lemak, dan pertumbuhan tubuh normal (Burton et al. 1994). Disebabkan fungsinya yang penting, gen GH merupakan kandidat gen untuk program Marker Asissted Selection pada sapi (Beauchemin et al. 2006).
Fungsi dari gen GH pada suatu individu khususnya ternak menjadi hal yang penting dikarenakan gen GH mengatur sifat-sifat yang bernilai ekonomi yang tinggi. Menurut Sumantran et al. (1992) gen GH telah terbukti menjadi pengatur utama pada pertumbuhan pasca kelahiran, metabolisme pada mamalia, kecepatan pertumbuhan, susunan tubuh, kesehatan. Selanjutnya, gen GH merupakan kandidat gen dalam pengaturan produksi susu, karkas dan respon immun (Ge et al. 2003). Secara mendalam gen GH juga diperlukan dalam pertumbuhan jaringan, metabolisme lemak dan reproduksi (Burton et al. 1994).
Pertumbuhan juga diatur oleh gen POU1F1 (juga dinamakan Pit-1 atau
GHF-1) yang merupakan anggota dari POU-transcription factors family yang
diekspresikan terutama pada pituitary (Pan et al. 2008). Ekspresi gen Pit-1 diperlukan pada pembelahan sel secara normal, perkembangan dan pertahanan tiga tipe sel adenohypophysis (thyrotrophs, somatotrophs and lactotrophs).
Gen Pit-1 mengatur ekspresi gen GH, prolaktin (PRL) (Tuggle et al. 1993)
dan thyroid-stimulating hormone β (TSH-β) (Pan et al. 2008) pada pituitary
anterior. Menurut McCormick et al. (1990) defisiensi dari gen Pit-1 mengurangi ekspresi gen GH, disebabkan penurunan ploriferasi lapisan sel dalam memproduksi gen GH.
Gen lain yang berpengaruh terhadap pertumbuhan pada ternak adalah gen
Insulin-like growth factor I (IGF-I) yang merupakan faktor utama peningkatan
10
Gen Insulin-like growth factor I (IGF-I) merupakan kandidat gen untuk pertumbuhan pada ternak yang berpengaruh terhadap pertumbuhan dan perkembangan. Gen IGF-I memediasi rangsangan aksi pembelahan sel dan proses metabolism yang berhubungan dengan deposisi protein. Gen IGF-I menstimulasi metabolism protein dan berperan penting terhadap fungsi beberapa organ (Pereira
et al. 2005).
Gen Growth Hormone Receptore (GHR) menjadi kandidat gen untuk pertumbuhan pada ternak disebabkan gen GH membutuhkan reseptor dalam mekanisme ekspresinya ketarget jaringan. Zhou dan Jiang (2005) menyatakan bahwa pada tingkatan jaringan, aksi biologis dari gen GH dimediasi oleh gen GHR. Hubungan antara keragaman gen GHR dan sifat pertumbuhan sapi telah dilakukan pada sifat in vivo dan karakteristik daging sapi Piedmontese (Di Stasio
et al. 2005), lemak karkas pada sapi Bos taurus (Tatsuda et al. 2008), lemak intra
muscular (Han et al. 2009) dan komposisi otot (lemak intramuscular, protein dan kadar air) (Reandon et al. 2010).
Gen Reseptor Hormon Pertumbuhan (Growth Hormone Receptor)
Salah satu faktor yang juga menentukan pertumbuhan secara hormonal pada individu khususnya ternak adalah Growth Hormone Receptor (GHR). Menurut Moody et al. (1995) Growth Hormone Receptor (GHR) adalah sel permukaan reseptor untuk growth hormone (GH) dan dibutuhkan oleh GH untuk membawa pengaruhnya ketarget jaringan. GH memiliki berat molekul yang tinggi sehingga sulit sulit memasuki sel yang harus melewati membrane sel. Karenanya efek pertama dari GH adalah pada reseptor yang terdapat dalam membrane sel, agar GH dapat memberikan efeknya ke target sel tanpa merusak membrannya (Djojosoebagio 1995).
Growth Hormone Receptor merupakan anggota dari kelas I cytokine
receptor super family. Cytokine receptor tidak termasuk ke dalam suatu tyrosine
kinase tetapi tepatnya berasosiasi dengan salah satu anggota dari Janus Kinase
Family (JAK), yang mengaktifkan specific transcription factors, signal
transducer, dan aktivator transkripsi (Scanes 2003). GHR termasuk cytokine
d T a b r d b ( 2 P b m b d t dibuat men Talamantes aktivasi enz berikatan de residu tirosi sinyal, salah Transcriptio Gam Gen ditranskripsi 1996). Horm berperan da (Moody et a
25.688 bp ( Proses trans 1A, 1B dab bagian 5’-u
mRNA GHR
blot dan ana diobservasi transkripsi G
nggunakan 1998). Peng
zim tyrosine
engan GHR l. Kejadian h satunya fos
on) (Gambar
GHR
mbar 3. Linta 2003) adalah ba i ke dalam mon GHR m
lam pertumb
al. 1995). Ge (Lampiran 1 kripsi gen G 1C, secara u
ntranslated
R pada otot alisis in situ
dengan ukur GHR sapi ya
kelipatan e gikatan GH
e kinase JA
, sehingga t ini menimbu sforilasi prot r 3). asan transdu ) agian segme mRNA yan merupakan h
buhan ternak en GHR pada ) (Gambar GHR pada sa umum varias
(Jiang dan sapi selama
hybridisatio
ran sekitar 4 ang dilaporka
ekson yang dengan rese AK2 ( Janus-terjadi fosfo ulkan aktiva tein STAT (
uksi sinyal y
en DNA te ng akan ditr
hasil transla k. Gen GHR a sapi terdiri
4) (Lucy et
api diinisiasik si mRNA G
Lucy 2001 a perkemban
on. Pada oto 4,5 kb yang m
an pada hati
g tidak ter eptornya men
-family Tyro
orilasi resept asi sejumlah
(Signal Tran
yang diaktifk
ermasuk sem anslasi men si dari gen R terletak pa
i atas 10 exo
t al. 1998; J kan oleh tiga
HR 1A, 1B ). Identifika ngan fetus m
ot fetus, sebu mana hal ters sapi dewasa
rpetakan (E ngakibatkan
osine Kinas
tor dengan J h lintasan pem
nduser and A
kan oleh GH
mua nukleo njadi protein
GHR, yang ada kromoso on, dengan p
Jiang dan Lu a promotor e
dan 1C berl asi dan loka menggunakan
uah transkrip sebut konsis a (Listrat et a
11
Edens dan n terjadinya
se 2) yang JAK2 pada mbentukan Activator of HR (Scanes otida yang n (Nicholas g kemudian om 20 sapi panjang gen
ucy 2001). exon utama lainan pada alisasi dari
n
Northern-psi tunggal sten dengan
12
Sama halnya dengan gen GH, target utama dari gen GHR adalah hati. Ekspresi gen GHR bersifat autoregulation. Gen GHR 1A diekspresikan secara eksklusif pada hati (Lucy et al. 1998), sedangkan gen GHR 1B dan GHR 1C
diekspresikan pada jaringan (Jiang dan Lucy 2001). Ekspresi mRNA GHR 1A
bermacam-macam pada tahapan perkembangan, ada sedikit mRNA GHR 1A pada fetus hati tetapi setengah pada mRNA GHR dalam hati individu dewasa yang dihasilkan olah mRNA GHR 1A (Jiang dan Lucy 2001). Menurut Scanes (2003) terdapat dua mRNA GHR yang dihasilkan dari sambungan dan inisiasi pada transkripsi dari promotor 1 dan 2. Hal ini digambarkan berturut-turut sebagai gen GHR 1A dan GHR 1B pada sapi. Ekspresi gen GHR 1A dibatasi pada hati dan merupakan pengontrol perkembangannya, hal tersebut tidak terjadi pada saat setelah panyapihan. Sebaliknya, ekspresi gen GHR 1B ditemukan pada lipatan jaringan dan dalam tahapan awal dan akhir perkembangan setelah kelahiran (Liu
et al. 2000).
5’ 3’
Keterangan :
Lokus = EF207442 Panjang = 3876 pb
Gen = 10 – 35, 200 – 280, 416 -481, 675 – 804, 935 – 1095, 1321 – 1499, 1612 – 1777, 1981 – 2071, 2246 – 2315, 2609 – 3876
Sekuen depan = 9 = 9 bp
Exon 1 = 10 – 35 = 25 bp Intron 1 = 36 – 199 = 163 bp Exon 2 = 200 – 280 = 80 bp Intron 2 = 281 – 415 = 134 bp Exon 3 = 416 -481 = 65 bp Intron 3 = 482 – 674 = 192 bp Exon 4 = 675 – 804 = 129 bp Intron 4 = 805 – 934 = 29 bp Exon 5 = 935 – 1095 = 160 bp Intron 5 = 1096 – 1320 = 234 bp Exon 6 = 1321 – 1499 = 178 bp Intron 6 = 1500 – 1611 = 111 bp Exon 7 = 1612 – 1777 = 165 bp Intron 7 = 1778 – 1982 = 204 bp Exon 8 = 1981 – 2071 = 90 bp Intron 8 = 2072 – 2245 = 173 bp Exon 9 = 2246 – 2315 = 69 bp Intron 9 = 2316 – 2608 = 292 bp Exon 10 = 2609 – 3876 = 126 bp = 129 bp
Gambar 4. Rekonstruksi struktur gen GHR berdasarkan sekuens gen GHR
di GenBank (Kode Akses. EF207442)
Gen Growth Hormone Receptor sangat penting di dalam proses pertumbuhan ternak. Mutasi pada gen GHR telah diasosiasikan sebagai
Laron-type dwarfism pada manusia (Godowski et al. 1989), sex-linked dwarfism pada
Kodon awal ATG Kodon akhir TAG
Coding sequence (CDS)
13
ayam (Burnside et al. 1992), sifat pertumbuhan pada sapi pedaging (Hale et al. 2000) dan sifat produksi susu pada sapi Holstein (Aggrey et al. 1999). Dwarfism
dihubungkan dengan rendahnya peredaran konsentrasi dari gen IGF-I dan dengan ketiadaan atau rendahnya ekspresi gen GHR (Vandeerpooten et al. 1991). Gen
Growth hormone (GH), insulin-like growth factors 1 dan 2 (IGF1 dan IGF2) dan
hubungan mereka pada pengikatan protein dan reseptor transmembran (GHR,
IGF1R dan IGF2R) mengatur sebuah pengaturan penting dalam fisiologis
pertumbuhan mamalia (Curi et al. 2004).
Gen GHR bertanggung jawab pada pertumbuhan dan karkas, keragaman gen GHR berhubungan dengan keragaman produksi daging yang terjadi pada
liver-specific promoter sapi (Ohkubo et al, 2006). Gen GHR pada sapi dipetakan
sebagai sebuah gen tunggal (Moody et al. 1995) dan gen GHR memiliki ekspresi pada tubuh dengan level yang tinggi pada hati (Lucy et al. 1998).
Perbedaan observasi dalam metabolisme ternak dengan perbedaan ukuran dalam bermacam tahapan pertumbuhan, pengaturan hormon dari somatotropic axis harus menjadi penekanan (Owens et al. 1994). Somatotropic axis merupakan hal yang penting terkait pada GH, insulin-like growth factors I dan II (IGF-I dan
IGF-II) dan reseptornya yang berhubungan dengan pengikatan protein (GHR,
IGF-IR, IGF-IIR dan IGFBP) berperan dalam pengaturan metabolisme dan
fisiologis dari pertumbuhan mamalia (Curi et al. 2006).
Keragaman pada Gen Reseptor Hormon Pertumbuhan (Growth Hormone Receptor)
14
antara individu yang menampilkan perbedaan fenotipik yang diseleksi dan diinvestigasi.
Salah satu metode dalam penentuan keragaman dari gen GHR adalah menggunakan metode PCR-RFLP. Identifikasi keragaman pada gen GHR telah dilakukan pada exon 10. Menurut Ge et al. (2000) single nucleotide
polymorphism (SNP) fragmen gen GHR|AluI ditemukan pada exon 10, dengan
mengkode pada sitoplasma domain gen GHR yang berlokasi pada posisi 76 (T/C), 200 (G/A), 229 (T/C) dan 257 (A/G). SNP pada posisi 200 dan 257 pb merubah susunan asam amino, secara berturut-turut Ala/Thr dan Ser/Gli, sedangkan dua mutasi lainnya merupakan silent mutation (mutasi yang tidak mengubah susunan asam amino).
Menurut Di Stasio et al. (2005) penelitian mengenai kandidat gen untuk sifat produksi daging pada sapi diinvestigasi pada hubungan SNP posisi 257 bp pada exon 10 gen GHR (fragmen gen GHR|AluI) dengan sifat in vivo dan karakteristik daging sapi Piedmontese. Hubungan antara keragaman gen GHR|AluI dan sifat pertumbuhan sapi telah dilakukan pada sifat in vivo dan karakteristik daging sapi Piedmontese (Di Stasio et al. 2005), lemak karkas pada sapi Bos taurus (Tatsuda et al. 2008), lemak intra muscular (Han et al. 2009) dan komposisi otot (lemak intramuscular, protein dan kadar air) (Reandon et al. 2010).
Single Nucleotide Polimorphism (SNP) pada umumnya merupakan
perbedaan basa tunggal DNA antar individu (Kwok 2003). Pendeteksian perbedaan basa tunggal DNA terjadi pada penyisipan atau penghilangan satu atau beberapa basa pada DNA. Sifat keragaman pada bagian DNA yang terjadi variasi atau SNP frekuensinya tidak lebih dari 1% di dalam populasi (Kwok 2003).
Penciri Genetik Polymerase Chain Reaction-Restriction Fragment Length Polymorphism (PCR-RFLP)
Salah satu teknik penciri genetik (genetic marker) yang dikembangkan telah dipopulerkan oleh Botstein et al. (1980) dan digunakan untuk mengetahui adanya keragaman sekuens DNA, teknik ini dikenal dengan Restriction Fragment
Length Polymorphism (RFLP). Mullis et al. (1986) menyatakan bahwa setelah
15
intensif dengan mengkombinasikan teknologi PCR tersebut sehingga lahirlah teknik PCR-RFLP yang penggunaannya terus hingga sekarang ini. PCR-RFLP adalah teknik pertama yang dikembangkan untuk menvisualisasikan perbedaan pada level DNA yang didasarkan pada penggunaan enzim pemotongan
(restriction enszymes) yang dapat memotong DNA pada tempat sekuens
nukleotida spesifik (Montaldo dan Herrera 1998). Teknik ini pada prinsipnya menggunakan primer. Pengamatan keragaman dalam genom organisme digunakan juga suatu enzim pemotong tertentu (restriction enzymes). Karena sifatnya yang spesifik, maka enzim ini akan memotong situs tertentu yang dikenali oleh enzim ini. Situs enzim pemotong dari genom suatu kelompok organisme yang kemudian berubah karena mutasi atau berpindah karena genetic rearrestrictionment dapat menyebabkan situs tersebut tidak lagi dikenali oleh enzim, atau enzim restriksi akan memotong daerah lain yang berbeda. Proses ini menyebabkan terbentuknya fragmen-fragmen DNA yang berbeda ukurannya dari satu organisme ke organisme lainnya. Li dan Gaur (1991) menyatakan bahwa enzim pemotong yang dapat mengenal sekuens DNA spesifik disebut recognition sequences dan biasanya memiliki panjang empat sekuens basa atau lebih dan bersifat
palindrome.
MATERI DAN METODE
Tempat dan Waktu
Penelitian laboratorium analisis Polymerase Chain Reaction (PCR) serta analisis penciri Polymerase Chain Reaction-Restriction Fragment Length
Polymorphism (PCR-RFLP) dilaksanakan di Laboratorium Genetika Molekuler
Ternak, Bagian Pemuliaan Genetika, Fakultas Peternakan, Institut Pertanian Bogor. Analisis DNA berlangsung pada bulan Nopember 2009-Januari 2010.
Materi dan Alat Penelitian
[image:32.612.124.511.398.496.2]Materi penelitian yang digunakan untuk analisis DNA adalah sampel sapi Bali, Limousin, Simmental dan Pesisir. Sampel DNA yang digunakan merupakan koleksi sampel Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan Genetika, Fakultas Peternakan, Institut Pertanian Bogor. Jumlah setiap sampel DNA dan tahun pengambilan sampel darah disajikan pada Tabel 1.
Tabel 1. Jumlah DNA dan tahun pengambilan sampel darah yang digunakan dalam penelitian
No. Bangsa Sapi Jumlah Asal Tahun Pengambilan Sampel Darah 1.
2. 3. 4.
Bali Pesisir Limousin Simmental
162 48 21 17
UP3 Bali Pulau Bali Kab. Pesisir Selatan BIB Singosari Malang BIB Singosari Malang
2009 2004 2006 2006 Total 248
Isolasi DNA
Isolasi DNA menggunakan beberapa bahan atau pelarut seperti Tris-EDTA konsentrasi rendah (low TE), lysis buffer, digestion buffer, rinse buffer,
etanol absolut, etanol 70%, dan larutan pengencer DNA (Master mix) 1x.
Peralatan yang digunakan untuk isolasi DNA adalah pipet tip Axygen
TR222Y dan T1000B, mikro pipet 200 P, 1000 P Gilson, microtube eppendorf
ukuran 1.5 ml, mikrosentrifuge, waterbath/inkubator, dan vortex.
Analisis PCR
17
GHR|AluI, beberapa pereaksi PCR yang terdiri atas enzim Tag DNA polymerase
5 unit/µl, bufer thermophilic DNA polymerase 10x reaksi bebas MgCl2 25 mM dan campuran nukleotida 40 nM (masing-masing 10 mM dATP, dATP, dCTP, dGTP, dan dTTP).
Peralatan yang digunakan dalam analisis PCR adalah pipet tip Axygen, mikropipet 10 P, 20 P, dan 200 P Gilson, microtube, dan mesin PCR (eppendorf
5332) serta stabilizer.
Analisis PCR-RFLP
Bahan yang digunakan dalam analisis PCR-RFLP (Polymerase Chain
Reaction-Restriction Fragment Length Polymorphism) adalah produk PCR
fragmen gen reseptor hormon pertumbuhan, destilated water, dan enzim pemotong AluI 10 unit/µl dan buffernya. Peralatan yang digunakan dalam analisis PCR-RFLP adalah pipet tip Axygen, mikropipet 2.5 P, 10 P, 20 P dan 200 P Gilson, microtube eppendorf Axygen ukuran 0.2 ml, dan inkubator suhu 37° C.
Analisis Elektroforesis
Bahan yang digunakan untuk elektroforesis adalah agarose, loading dye,
ladder 100 bp, TBE 1X (1 M Tris, 0.9 M Asam Borat, 0,01 M EDTA pH 8.0), dan
ethidium bromide. Peralatan yang digunakan untuk elektroforesis adalah pipet tip
Axygen, mikro pipet 10 P Gilson, gelas ukur, electrophoresis, power supply
electrophoresis, dan alat foto UV transiluminator.
Metode Penelitian
Penarikan Sampel Data Penelitian
Penarikan sampel data penelitian berdasarkan kriteria bangsa yaitu bangsa sapi Bali, Simmental, Limousin dan Pesisir. Sapi Bali merupakan bangsa Bos
javanicus, sapi Limousin dan Simmental termasuk Bos taurus, sedangkan sapi
18
3241 taacttcatc gtggacaacg cttacttctg cgaggtagac gccaaaaagt acattgccct 3301 ggcccctcac gtcgaggctg aatcacacgt agagccaAGC Tttaaccagg aagacattta 3361 catcaccaca gaaagcctta ccactacAGC Tgggaggtcg gggacagcag aacatgttcc 3421 aagttctgag atacctgtcc cagattatac ctccattcat atagtacagt ctccacaggg 3481 cctcgtactc aatgcgactg ccctgccctt gcctgacaaa gagtttctct catcatgtgg 3541 ctatgtgagc acagaccaac tgaacaaaat catgccatag cttttctttg atttcccatg
Pengambilan Sampel Darah
Sampel darah sapi diambil melAlui vena jugularis dengan tabung venoject
vakum tanpa heparin. Setelah itu, sampel darah tersebut ditambahkan ethanol
absolute dengan perbandingan 1:1 dan disimpan pada suhu ruang.
Isolasi DNA Total
Isolasi DNA dilakukan dari sampel darah dengan menggunakan Genomic
DNA mini kit Geneaid yang dimodifikasi untuk penggunaan sampel darah yang
disimpan dalam alkohol (Lampiran 2).
Amplifikasi Gen GHR Menggunakan Mesin Thermal Cycler
Amplifikasi fragmen gen GHR|AluI dengan mesin thermal cycler metode PCR dilakukan menggunakan sepasang primer mengikuti Ge et al. (2000) yang dimodifiksi oleh Andreas (2010), dengan runutan primer forward 5’-CGCTTACTTCTGCGAGGTAGACGC-3’ dan primer reverse 5’-GTCTGTGCTCACATAGCCAC-3’. Panjang produk ampilifikasi ruas gen GHR|AluI diperkirakan sepanjang 298 bp.
Fragmen gen GHR|AluI memiliki dua situs pemotong enzim AluI dengan panjang produk PCR 298 bp pada exon 10 bovine Growth Hormone Receptor
(Gambar 5).
Keterangan : huruf tebal miring situs primer
huruf tebal besar situs pemotong enzim AluI(AGCT)
Gambar 5. Fragmen gen GHR|AluI didasarkan pada sekuens gen GHR di
GenBank (Kode Akses. EF207442)
Pereaksi yang digunakan untuk amplifikasi ruas gen GHR adalah 2 µl sampel DNA, masing-masing primer 0.5 pmol, campuran dNTP 0.2 mM, MgCl2 2
mM, Taq Polymerase (real taq) 0,1 unit dan bufernya, dan destilated water dalam
19
pada suhu 94⁰C selama 45 detik, penempelan primer pada suhu 60⁰C selama 1 menit dan pemanjangan DNA baru pada suhu 72⁰C selama 1 menit 30 detik, dan pemanjangan akhir pada suhu 72⁰C selama 5 menit.
Analisis PCR-RFLP
Produk PCR yang diperoleh dari hasil amplifikasi fragmen gen GHR|AluI dipotong menggunakan enzim pemotong AluI (AG*CT). Volume dan bahan pereaksi yang digunakan untuk setiap enzim pemotong adalah 1 µl deionized
water, 0.7 µl 1x buffer enzim pemotong, 5 µl sampel produk PCR dan 0.3 unit
enzim pemotong. Campuran sampel produk PCR fragmen gen GHR|AluI dan bahan pereaksi diinkubasi di dalam inkubator ada suhu 37°C selama lebih kurang 16 jam.
Elektroforesis DNA Total, Produk PCR dan Produk PCR-RFLP
Elektroforesis dilakukan terhadap DNA total, produk PCR dan produk pemotongan (digested) atau PCR-RFLP dengan menggunakan gel agarose dengan konsentrasi yang berbeda. Konsentrasi agarose 1.5% digunakan untuk elektroforesis DNA total (0.45 g/30 ml TBE 0.5 x) dan produk pemotongan 2% (0.6 g/30 ml TBE 0,5x). Gel agarose dibuat sesuai dengan konsentrasi yang dibutuhkan, kemudian dipanaskan di microwafe sampai mendidih (larutan terlihat bening), lAlu tambahkan ethidium bromide sebanyak 5 µl (10 mg/ml) dan dibiarkan sebentar agar dingin. Sebelum membeku tuangkan gel agarose ke cetakan yang telah disiapkan, kemudian letakkan sisir untuk 17 sampel dan biarkan sampai membeku.
20
tidaknya amplifikasi PCR atau ada tidaknya variasi atau keragaman fragmen gen GHR|AluI.
Analisis Data
Frekuensi Alel
Frekuensi alel gen GHR diperoleh dari analisis penciri PCR-RLFP AluI dihitung menggunakan rumus (Nei 1987) :
∑
Keterangan :
xi = frekuensi alel ke-i
nii = jumlah individu bergenotipe AiAi
nij = jumlah individu bergenotipe AiAj
N = jumlah total sampel
Keseimbangan Hardy-Weinberg diuji dengan Chi-Kuadrat (Hartl and Clark 1997).
Keterangan :
χ² = uji Chi-kuadrat
obs = jumlah pengamatan genotipe ke-i exp = jumlah harapan genotipe ke-i
Frekuensi Heterozigositas Pengamatan
Keragaman genetik (genetic variability) dilakukan melAlui estimasi frekuensi heterozigositas pengamatan (Ho), heterozigositas harapan (He) dan standar eror heterozigositas harapan (Weir (1996) :
Keterangan :
Ho = frekuensi heterozigositas pengamatan
N1ij = jumlah individu heterozigositas pada lokus ke-1
21
Frekuensi Heterozigositas Harapan
Keterangan :
Ho = frekuensi heterozigositas harapan
P1i = frekuensi alel ke-I pada lokus 1
n = jumlah alel pada lokus ke-1
Ragam Heterozigositas Harapan
Keterangan :
Vsl (He) = ragam heterozigositas harapan
xi = frekuensi gen ke-1
Ragam (SE) heterosigositas harapan diperoleh dari =
Polymorphic Informative Content (PIC)
Tingkat informative suatu alel dihitung menggunakan pendekatan nilai
Polymorphic Informative Content (PIC) (Botstein et al 1980) :
Keterangan :
Pi = frekuensi alel ke-i
n = jumlah alel per perinci (marker)
Perunutan Susunan Nukleotida
Hasil sekuens fragmen gen GHR|AluI sapi Bali, Limousin, Simmental dan Pesisir dianalisis kesamaannya (homology) dengan sekuens yang terdapat di
GenBank menggunakan perangkat lunak (software) komputer program Basic
Local Alignment Search Tool (BLAST) (Altschul et al. 1990).
[www.ncbi.nhl.nih.gov./BLAST] yang bertujuan untuk memastikan bahwa sekuen
yang dianalisis adalah fragmen gen GHR.
22
nukleotida spesifik yang dianalisis. Kesamaan suatu sekuen tinggi apabila score
yang didapat >200 bits.
Jarak Genetik dan Pohon Genetik Gen GHR|AluI
Berdasarkan hasil frekuensi genotipe fragmen gen GHR|AluI pada sapi Bali, Limousin dan Simmental yang diperoleh, dibuat pohon kekerabatannya
(phylogenetic trees) dengan menggunakan Software komputer program MEGA 4
(Molecular Evulotionary Genetic Analysis) dengan metode UPGMA (unweighted
HASIL DAN PEMBAHASAN
Amplifikasi Gen Reseptor Hormon Pertumbuhan
[image:39.612.64.513.142.733.2]Amplifikasi fragmen gen reseptor hormon pertumbuhan (GHR) yang dilakukan pada sapi Bali, Limousin, Simmental dan Pesisir menunjukkan posisi gen GHR pada exon 10 untuk fragmen gen GHR|AluI (Gambar 6). Amplifikasi gen GHR|AluI didapatkan menggunakan mesin thermal cycler (PCR) dengan kondisi annealing 60⁰ C selama 1 menit, dan diperoleh produk PCR dengan panjang 298 bp (Gambar 7).
…5’ GCCAAG*CTTTAAC…CTACAG*CTGGGAG ‘3…
Gambar 6. Posisi fragmen gen GHR|AluI serta situs enzim pemotongnya
Gambar 7. Produk PCR gen GHR|AluI (298 bp)
Exon 8 Exon 9 Exon 10
Intron 7 Intron 8 Intron 9
298 bp
200 bp 300 bp 400 bp 500 bp
24
Identifikasi keragaman gen bGHR khususnya fragmen gen GHR|AluI pada exon 10 yang dilakukan oleh Di Stasio et al. (2005) amplifikasi gen GHR|AluI didapatkan dengan penempelan (annealing) primer fragmen gen GHR|AluI pada suhu 53⁰ C selama 30 detik. Namun pada penelitian ini, penempelan (annealing) primer fragmen gen GHR|AluI pada suhu 60⁰ C selama 1 menit, dan berbeda dengan hasil yang didapatkan oleh Di Stasio et al. (2005). Keberhasilan amplifikasi fragmen gen GHR|AluI sangat ditentukan oleh kondisi penempelan primer pada DNA genom (gen target), bahan pereaksi PCR dan kondisi mesin
thermal cycler.
Keterangan :
M (marker) = Ladder 100 bp
AA = Individu homozigot (167 bp, 81 bp dan 50 bp) GG = Individu homozigot (167 bp dan 131 bp 1,2,12,13,14 = Sapi Limousin
[image:40.612.86.509.251.676.2]3,4,5,6 = Sapi Simmental 7,8,9,10,11 = Sapi Pesisir
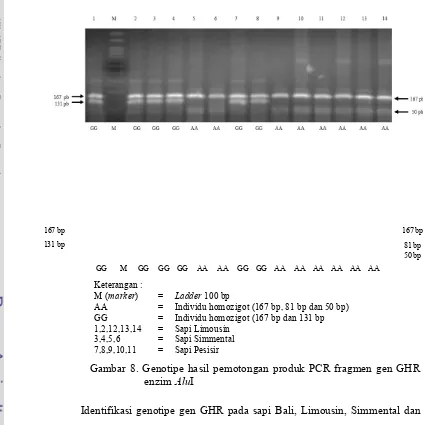
Gambar 8. Genotipe hasil pemotongan produk PCR fragmen gen GHR enzim AluI
Identifikasi genotipe gen GHR pada sapi Bali, Limousin, Simmental dan Pesisir dilakukan dengan mengidentifikasi ada tidaknya pemotongan oleh enzim
AluI, sehingga jika terdapat pemotongan hal ini mengindikasikan bahwa gen GHR 167 bp
131 bp
GG M GG GG GG AA AA GG GG AA AA AA AA AA AA
167 bp
25
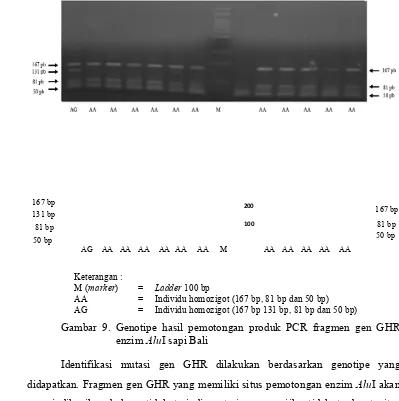
pada sapi-sapi tersebut memiliki situs pemotongan enzim AluI yaitu AG*CT. Hasil pemotongan fragmen gen GHR|AluI menggunakan enzim AluI menghasilkan tiga macam fragmen, yaitu fragmen yang terpotong menjadi tiga pita dikenal sebagai genotipe AA (Gambar 8) dan (Gambar 9), terpotong menjadi dua pita dikenal sebagai genotipe GG (Gambar 8) dan fragmen gabungan (empat pita) dikenal sebagai genotipe AG (Gambar 9).
Keterangan :
M (marker) = Ladder 100 bp
[image:41.612.106.505.206.607.2]AA = Individu homozigot (167 bp, 81 bp dan 50 bp) AG = Individu homozigot (167 bp 131 bp, 81 bp dan 50 bp)
Gambar 9. Genotipe hasil pemotongan produk PCR fragmen gen GHR enzim AluI sapi Bali
Identifikasi mutasi gen GHR dilakukan berdasarkan genotipe yang didapatkan. Fragmen gen GHR yang memiliki situs pemotongan enzim AluI akan mengindikasikan bahwa tidak terjadi mutasi, namun jika tidak terdapat situs pemotongan yang ditunjukkan dengan tidak adanya pemotongan oleh enzim AluI maka dapat dinyatakan bahwa terjadi mutasi pada situs (fragmen GHR) tersebut.
Hasil pemotongan fragmen gen GHR|AluI menghasilkan tiga Genotipe, yaitu genotipe AA yang terpotong pada 167 bp, 81 bp dan 50 bp, genotipe GG
100 200
AG AA AA AA AA AA AA M AA AA AA AA AA 81 bp
167 bp 131 bp
50 bp
167 bp
26
pada 167 bp dan 131 bp, sedangkan genotipe AG pada 167 bp, 131 bp, 81 bp dan 50 bp (Gambar 8) (Gambar 9). Hal ini berbeda dengan indentifikasi genotipe fragmen gen GHR|AluI yang dilakukan oleh Ge et al. (2000) yang mengamplifikasi fragmen gen GHR|AluI (286 bp) dengan genotipe AA terpotong pada 155 bp, 81 bp dan 50 bp, genotipe GG pada 155 bp dan 131 bp, sedangkan genotipe AG pada 155 bp, 131 bp, 81 bp dan 50 bp. Perbedaan genotipe terjadi disebabkan primer yang digunakan berbeda, sehingga panjang fragmen pun berbeda yang mengakibatkan perbedaan dalam penentuan genotipe fragmen gen GHR|AluI.
Keragaman Gen Reseptor Hormon Pertumbuhan
Frekuensi Alel dan Genotipe Fragmen Gen GHR|AluI
[image:42.612.130.511.420.507.2]Hasil analisis frekuensi alel (A dan G) dan genotipe (AA, AG dan GG) pada fragmen gen GHR|AluI pada sapi Bali, Limousin, Simmental dan Pesisir disajikan pada Tabel 2. Frekuensi alel dan genotipe gen GHR|AluI berdasarkan kriteria bangsa ternak yakni, sapi Bali, Limousin, Simmental, dan Pesisir.
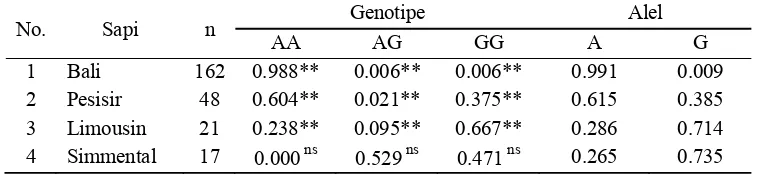
Tabel 2. Frekuensi genotipe dan alel fragmen gen GHR|AluI
No. Sapi n Genotipe Alel
AA AG GG A G
1 Bali 162 0.988** 0.006** 0.006** 0.991 0.009 2 Pesisir 48 0.604** 0.021** 0.375** 0.615 0.385 3 Limousin 21 0.238** 0.095** 0.667** 0.286 0.714 4 Simmental 17 0.000ns 0.529ns 0.471ns 0.265 0.735 Keterangan : n = jumlah individu
Frekuensi genotipe fragmen gen GHR|AluI (Tabel 2) sapi Bali memiliki genotipe AA tinggi, sedangkan genotipe GG dan AG rendah. Hal ini berbeda pada sapi Limousin frekuensi GG lebih tinggi, kemudian AA dan paling rendah AG, untuk sapi Simmental frekuensi AG lebih tinggi dibandingkan genotipe GG, sedangkan genotipe AA tidak ditemukan, sedangkan untuk sapi Pesisir genotipe GG lebih tinggi, kemudian genotipe AA, sedangkan genotipe AG lebih rendah.
27
untuk AA pada sapi Bali sebesar 0.988, genotipe GG 0.006 dan genotipe AG 0.006, sapi Bali merupakan sapi yang termasuk bangsa Bos javanicus. Sapi Limousin genotipe AA sebesar 0.238, genotipe GG sebesar 0.667 dan genotipe AG sebesar 0.095, dan sapi Simmental genotipe AA sebesar 0.000, genotipe GG sebesar 0.471 dan genotipe AG sebesar 0.529, kedua sapi ini termasuk ke dalam bangsa Bos taurus. Sapi Pesisir yang merupakan salah satu sapi lokal lain selain sapi Bali frekuensi genotipe AA sebesar 0.604, genotipe GG 0.375 dan genotipe AG sebesar 0.021.
Frekuensi alel pada fragmen GHR|AluI (Tabel 2) pada sapi Bali lebih tinggi pada alel A sebesar 0.991 dan alel G lebih rendah sebesar 0.009. Frekuensi alel sapi Limousin lebih tinggi untuk alel G sebesar 0.714 dan lebih rendah untuk alel A sebesar 0.286, dan sapi Simmental alel G lebih tinggi sebesar 0.735 dan rendah untuk alel G sebesar 0.265, sedangkan pada sapi Pesisir alel tertinggi pada alel A sebesar 0.615 dan rendah untuk alel G sebesar 0.385. Keragamann frekuensi alel fragmen GHR|AluI berdasarkan antar bangsa ternak, frekuensi alel A lebih tinggi pada bangsa Bos javanicus dan sapi Pesisir sedangkan untuk alel G sapi bangsa Bos taurus lebih tinggi.
Keragaman frekuensi alel dan genotipe fragmen gen GHR|AluI antara sapi Bali (Bos javanicus), Limousin dan Simmental (Bos taurus) terlihat pada frekuensi alel A dan genotipe AA lebih tinggi pada sapi Bali (A:0.991 dan AA:0.988), sedangkan rendah pada sapi Limousin (A:0.286 dan AA:0.238) dan pada sapi Simmental alel A (0.265) tetapi genotipe AA tidak ditemukan (0.000). Frekuensi Alel G dan genotipe GG rendah pada sapi Bali (G:0.009 dan GG:0.006) sedangkan tinggi pada sapi Limousin (G:0.714 dan GG:0.667) dan sapi Simmental (G:0.735 dan GG:0.471). Tingginya frekuensi alel G pada Bos taurus
(Limousin dan Simmental) dikemukakan juga oleh Di Stasio et al. (2005) yang mengidentifikasi frekuensi fragmen gen GHR|AluI pada sapi Piedmontese dimana frekuensi alel G lebih tinggi (0.510) dibandingkan alel A (0.490).
28
dengan Saladin (1983) sapi di Sumatera Barat menurut catatan sejarah terdiri atas sapi lokal, sapi zebu dan sapi Eropa, sejak tahun 1907 telah dimasukkan sapi-sapi zebu (onggole dan Hissar) untuk meningkatkan mutu genetik sapi lokal. Jakaria (2008) menyatakan bahwa peran sapi Bali telah memberikan proporsi yang besar terhadap pembentukan sapi pesisir, hal tersebut dilihat dari proporsi genotipe -/- atau alel (-) fragmen gen GH MspI yang tinggi dikarenakan sapi Bali hanya memiliki genotipe -/- atau alel (-).
Frekuensi alel A fragmen gen GHR|AluI sapi Bali (Bos javanicus) yang tinggi 0.988 dan frekuensi alel G yang rendah (0.012) menunjukkan bahwa fragmen gen GHR|AluI bersifat monomorfik. Falconer and Mackay (1996) menyatakan bahwa sebuah lokus polimorfik ditandai dengan salah satu frekuensi alelnya kurang dari 0.99. Frekuensi alel A fragmen GHR|AluI sapi Bali yang tinggi tersebut atau bersifat monomorfik memperjelas perbedaan sapi Bali dengan dengan sapi bangsa lainnya, sehingga menjadi informasi penting dalam pengambilan keputusan pengembangan sapi Bali sebagai ternak lokal utama penghasil daging ke depan.
Frekuensi alel dan genotipe fragmen GHR|AluI pada sapi Bali yang menunjukkan monomorfik disebabkan sapi Bali merupakan ternak domestik daerah tropis Indonesia. Sapi Bali sebagai hasil domestikasi langsung dari Banteng Bos banteng (Namikawa et al. 1980), telah beradaptasi dengan lingkungan tropis sehingga pengaruh lingkungan berperan terhadap sifat produksinya. Proses adaptasi tersebut merupakan proses evolusi dan seleksi pada spesies ternak domestik. Evolusi terhadap adaptabilitas pada lingkungan tropis memberikan semacam penyesuaian genotipe terhadap resistensi atau toleransi penyakit, stres panas (homeothermy), stres nutrisi dan toleransi obat-obatan (Newman and Coffey 1999).
29
kemampuan sapi Bali dalam mengekspresikan sifat yang dibutuhkan dalam bertahan hidup, sebuah fenomena variasi genetik pada individu berlaku. Fenomena kelenturan fenotipik sebagai hasil seleksi alam dan menyebabkan genotipe sapi Bali cenderung kurang bervariasi (monomorfik). Noor (2002) menyatakan bahwa kemampuan suatu individu / genotipe untuk menampilkan lebih dari satu bentuk morfologi, status fisiologi dan / atau tingkah laku sebagai respon terhadap perubahan lingkungan disebut sebagai kelenturan fenotipik.
Kajian distribusi fragmen gen GHR|AluI terhadap beberapa sapi di dunia yang dikelompokkan berdasarkan daerah pengembangan menunjukkan bahwa frekuensi alel G lebih tinggi pada bangsa sapi subtropis (Ge et al. 2000; Di Stasio
et al. 2005). Frekuensi alel A lebih tinggi pada bangsa sapi tropis. Tingginya
[image:45.612.138.505.383.483.2]frekuensi alel A pada sapi Bali dan sapi Pesisir memperkuat dugaan akan adanya kemungkinan yang mendukung bahwa alel A merupakan alel spesifik untuk sapi derah tropis (Tabel 3).
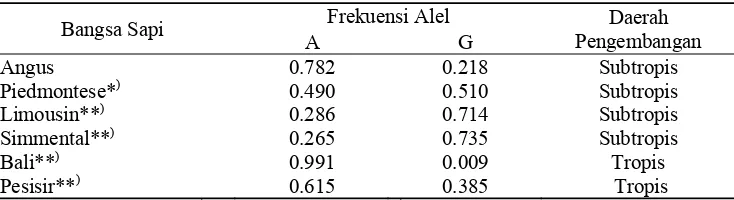
Tabel 3. Distribusi frekuensi alel A dan G fragmen gen GHR|AluI berdasarkan daerah pengembangan
Bangsa Sapi Frekuensi Alel Daerah
Pengembangan A G Angus Piedmontese*) Limousin**) Simmental**) Bali**) Pesisir**) 0.782 0.490 0.286 0.265 0.991 0.615 0.218 0.510 0.714 0.735 0.009 0.385 Subtropis Subtropis Subtropis Subtropis Tropis Tropis Sumber : Ge et al. (2000), *)Di Stasio et al. (2005), **) hasil penelitian.
Keseimbangan Gen dalam Populasi
Hasil uji Khi-kuadrat (χ²) terhadap genotipe fragmen gen GHR|AluI (Lampiran 3) menunjukkan perbedaan antara rasio pengamatan dan rasio harapan atau terjadi keadaan ketidakseimbangan Hardy- Weinberg pada populasi sapi Bali, Limousin dan Pesisir, sedangkan keseimbangan Hardy- Weinberg hanya terjadi pada populasi sapi Simmental.
30
Mackay (1996) dan Noor (2008) menyatakan ketidakseimbangan Hardy-Weinberg akan terjadi jika dalam populasi terjadi seleksi, migrasi, mutasi dan
genetic drift.
Ketidakseimbangan Hardy-Weinberg (H-W) pada populasi sapi Bali dan Pesisir diduga disebabkan oleh seleksi alam yang terjadi dalam proses domestikasi sapi Bali dan proses pembentukan sapi Pesisir. Seleksi negatif yang terjadi pada sapi Bali dan Pesisir yakni pemotongan dan penjualan sapi-sapi yang mempunyai pertumbuhan yang baik oleh peternak juga diduga menjadi penyebab ketidakseimbangan H-W. Pada sapi Limousin ketidakseimbangan H-W terjadi disebabkan ukuran populasi sampel yang kecil hal ini sesuai dengan pendapat Falconer and Mackay (1996) yang menyatakan bahwa ukuran populasi sampel juga mempengaruhi perubahan frekuensi genotipe dari generasi ke generasi.
Pendugaan Nilai Heterozigositas
[image:46.612.133.504.457.525.2]Pendugaan nilai heterozigositas pengamatan (Ho) dan nilai heterozigositas harapan (He) untuk fragmen GHR|AluI pada sapi Bali, Limousin, Simmental dan Pesisir disajikan pada Tabel 4.
Tabel 4. Nilai heterozigositas pengamatan (Ho) dan heterozigositas harapan (He) fragmen gen GHR|AluI
Bangsa Sapi n Hpengamatan Hharapan ± SE
Bali 162 0.006 0.018 ± 0.001
Pesisir 48 0.021 0.474 ± 0.007
Limousin 21 0.095 0.408 ± 0.017
Simmental 17 0.529 0.389 ± 0,021
Keterangan : n = jumlah individu
Nilai heterozigositas pengamatan (Ho) fragmen gen GHR|AluI (Tabel 4) menunjukkan bahwa sapi Simmental memiliki nilai heterozigositas yang tertinggi (0.529) dan nilai heterozigositas terendah pada sapi Bali (0.006), sedangkan nilai heterozigositas sapi Limousin dan Pesisir secara berturut-turut yakni (0.095) dan (0.021).
31
sedangkan sapi Limousin dan sapi Simmental berturut–turut (0.408±0.017) dan (0.389±0.021).
Perbedaan antara nilai heterozigositas pengamatan dan heterozigositas harapan (Tabel 4) mengindikasikan bahwa telah terjadinya ketidakseimbangan Hardy-Weinberg, yaitu perubahan frekuensi gen yang cukup besar dari satu generasi ke generasi lainnya yang mungkin disebabkan oleh adanya seleksi, migrasi, mutasi dan genetic drift (Noor 2008).
Salah satu cara mengetahui nilai variasi genetik adalah nilai heterozigositas (Nei 1987). Keragaman genetik yang kecil pada sapi Bali disebabkan oleh kemampuan adaptasi yang didapatkan dari seleksi alam daerah tropis. Kemampuan hidup dalam kondisi yang terbatas (nutrisi dan iklim) memberikan dampak sapi Bali harus mengekspresikan sifat yang sesuai dengan kebutuhannya dalam mempertahankan hidup. Kultur sel atau organisme secara keseluruhan memberikan respon dengan mensintesa sejumlah protein yang dikenal sebagai heat shock protein atau stres protein, pada saat bersamaan sebagian besar protein akan switched off (Noor 2002). Organisme memberikan respon terhadap stres dengan jalan mengatur fisiologi atau morfologi untuk meredam pengaruhnya dan mempertahankan fungsi normal, resistensi melibatkan respon fisiologis dan morfologis sehingga organisme dapat bertahan dan bereproduksi pada kondisi stres.
Pendugaan Nilai Polymorphic Informative Content (PIC)
32
[image:48.612.134.505.110.185.2]
Tabel 5. Pendugaan nilai Polymorphic Informative Content (PIC) pada sapi Bali, Pesisir, Limousin dan Simmental
No. Bangsa Sapi n PIC
1 Bali 162 0.018
2 Pesisir 48 0.362
3 Limousin 21 0.325
4 Simmental 17 0.314
Keterangan : n = jumlah individu
Tabel 5 menunjukkan bahwa sapi Bali memiliki nilai PIC yang rendah, sedangkan sapi Limousin, Simmental dan Pesisir memiliki nilai PIC yang tinggi. Pendugaan nilai PIC yang rendah pada sapi Bali (0.018) mengindikasikan bahwa fragmen gen GHR|AluI kurang informatif (tingkat keragamannya rendah) sebagai penciri genetik pada sapi Bali, sedangkan pada sapi Limousin (0.325), sapi Simmental (0.314) dan sapi Pesisir (0.362) mengindikasikan bahwa fragmen gen GHR|AluI termasuk ke dalam kategori sedang untuk dijadikan penciri genetik. Botstein et al. (1980) menyatakan bahwa kriteria nilai PIC termasuk ke dalam kelompok rendah jika nilai PIC ≥ 0.25, nilai PIC sedang 0.25 < PIC < 0.5 dan nilai PIC tinggi jika ≥ 0.5.
Pendugaan nilai PIC pada sapi Bali menunjukkan nilai yang rendah, hal ini disebabkan tingkat keragaman fragmen gen GHR|AluI pada sapi Bali rendah jika dibandingkan dengan sapi Pesisir, Limousin dan Simmental. Nilai PIC tidak hanya dapat digunakan untuk menentukan informatifnya suatu penciri, akan tetapi juga dapat digunakan untuk menentukan ada tidaknya suatu alel polimorfik, selain didasarkan nilai heterozigositas (Botstein et al. 1980). Nilai PIC selalu memiliki nilai yang lebih rendah dibandingkan dengan nilai heterozigositas, karena nilai PIC merupakan nilai heterozigositas yang dikoreksi (Hilderbrand 1992).
Sekuens Gen Reseptor Hormon Pertumbuhan (GHR)
Homologi dan Deteksi Mutasi Gen GHR|AluI
Hasil analisis homologi fragmen gen GHR|AluI menunjukkan bahwa fragmen gen GHR|AluI memiliki nilai kesamaan (similarity) yang tinggi terhadap sekuen gen bovine Growth Hormon Receptor (bGHR) yang terdapat di GenBank
33
[image:49.612.134.507.313.352.2]
penciri fragmen gen GHR|AluI sapi Bali, Limousin, Simmental dan Pesisir sebesar 98-99 % dengan sekuen gen GHR di GenBank menggunakan perangkat lunak (software) komputer program Basic Local Alig