PENGHAMBATAN PROLIFERASI SEL KANKER KOLON
HCT-116 OLEH PRODUK FERMENTASI PATI RESISTEN
TIPE 3 SAGU DAN BERAS
ENDANG YULI PURWANI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
i
Dengan ini saya menyatakan bahwa disertasi Pengambatan Proliferasi Sel Kanker Kolon HCT-116 oleh Produk Fermentasi Pati Resisten Tipe 3 Sagu dan Beras adalah karya saya dengan arahan dari komisi pembimbing. Karya tersebut belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, November 2011
Endang Yuli Purwani
ii
Cell byFermentation Product of Resistant Starch Type 3 Derived from Sago and Rice. Supervised by MAGGY T.SUHARTONO, TRESNAWATI PURWADA-RIA and DIAH ISKANDPURWADA-RIATI.
Resistant starch type 3 (RS3) is retrograded starch which is not digested by human starch degrading enzymes, and will thusundergo bacterial fermentation in the colon. The main fermentation products are the Short Chain Fatty Acid (SCFA), mostly acetate, propionate and butyrate. SCFA, especially butyrate, has been implicated in providing protection against cancer. The control of the cell proliferation and apoptosis present obvious target for preventive in cancer. The objectives of the research were: (1) to prepare RS3 derived from sago or rice starch through enzyme hydrolysis, (2) to study the SCFA profile produced in the in vitro fermentation of the RS3 by colonic butyrate producing bacteria, (3) to investigate the effect of the RS3 fermentation product on proliferation inhibition and apoptosis in HCT-116 colon cancer cell line, and explored its mechanism.
Sago or rice starch was retrograded and hydrolyzed with amylase(106
Enzyme hydrolysis of retrograded sago or rice starch was beneficial for concentrating RS. RS3 derived from sago contained higher RS (31-38%) than those derived from rice starch (21-26%). The in vitro fermentation revealed that C. butyricum BCC B2571 produced acetate, propionate and butyrate at concentration of 83.70 mM, 47.57 mM, 46.70 mM when the medium was supplemented with RS3 derived from sago treated with amylase (RSSA) at con-centration 1%. High levels of acetate (95mM), propionate (52 mM) and butyrate (59 mM) was also produced by E.rectale DSM17629 in medium supplemented withRS3 derived from sago treated with pullulanse (RSSP) at concentration 1%. The cell free supernatant, either from C.butyricum BCC B2571 grown in medium supplemented with RSSA or E.rectale 17629 grown in medium supplemented with RSSP was applied to treat HCT-116 cells. It was found that the supernatant inhibited proliferation and induced apoptosis ofHCT-116. This treatmentincreas-ed the expression ratio of Bax/Bcl-2, indicating possibility that apoptosis occurrtreatmentincreas-ed through mitochondrial pathway which simultaneously increased the caspase-3 concentration.
iii
116 oleh Produk Fermentasi Pati ResistenTipe 3 Sagu dan Beras. Dibim-bing oleh MAGGY T.SUHARTONO, TRESNAWATI PURWADARIA dan DIAH ISKANDRIATI.
Kanker kolon dan rektum (colorectal cancer, CRC), adalah pertumbuhan sel yang tak terkendali (neoplasia) pada daerah usus besar sehingga mengganggu sistem pencernaan secara lokal dan mekanisme fisiologis tubuh secara umum.Ada sekitar 1,2 juta kasus CRC pada tahun 2008 atau mencapai sekitar 9,8% di seluruh dunia.Sekitar 80% dari kasus CRC berkaitan dengan diet, 15% disebabkan oleh faktor keturunan sedangkan sisanya berasal dari faktor lain termasuk lingkungan. Keadaan tersebut menunjukkan bahwa CRC dapat dihin-dari dengan mengonsumsi bahan pangan yang sesuai. Pati resisten tipe 3 (Resis-tant starch type 3, RS3) merupakan salah satu komponen bahan pangan yang mampu memenuhi kebutuhan tersebut.
Pati tak tercerna (Resistant Starch, RS) didefinisikan sebagai fraksi pati yang tidak terserap oleh sistem pencernaan pada individu yang sehat. Ada empat kelompok RS, yaitu RS1, RS2, RS3, dan RS4. RS1 adalah pati yang secara fisik terperangkap di dalam matriks sehingga tidak dapat diakses oleh enzim. RS2 adalah granula pati mentah yang didominasi oleh struktur kristalin sehingga sulit dihidrolisis oleh enzim. RS3 adalah pati retrogradasi dan RS4 adalah pati modifikasi secara kimiawi. RS langsung memasuki usus besar (kolon) kemudian difermentasi oleh mikroflora yang ada di dalamnyamenghasilkan produk utama asam lemak rantai pendek (short chain fatty acid, SCFA,), yaitu asam asetat, propionat, dan butirat. SCFA terutama butirat merupakan sumber energi utama bagi sel-sel kolon normal dan mampu mencegah/menghambat kanker. Penghambatan proliferasi dan induksi apoptosis merupakan salah satu sasaran dalam pencegahan penyakit kanker.
Pada penelitian ini, RS3 dibuat dari pati beras dan sagu. Kedua komoditas dipilih karena tersedia dalam jumlah besar dan beragam. Dilain pihak,jenis substrat (RS3)dan jenis bakteri penghasil butirat menentukan profil SCFA yang dihasilkannya. Sejalan dengan hal di atas, penelitian dilaksanakan dengan tujuan: (a) mendapatkan RS3 dari pati beras dan pati sagu melalui kombinasi proses retrogradasi dan hidrolisis enzim, (b) mempelajari profil SCFA yang dihasilkan oleh kultur murniClostridium butyricum BCC B2571 atau Eubacterium rectale DSM 17629 pada medium fermentasi yang disuplementasi dengan RS3, (c) mempelajari hambatan proliferasi dan apoptosis pada sel lestari HCT-116 yang diberi paparan SCFA hasil fermentasi RS3.
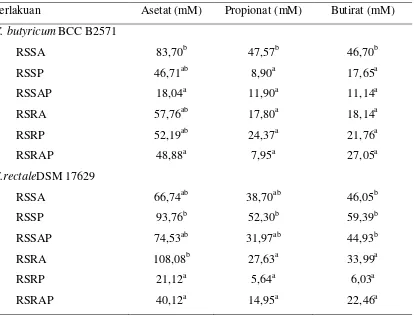
iv
Hasil penelitian menunjukkan bahwa kombinasi proses retrogradasi dan hidrolisis enzim efektif untuk mengonsentrasikan kadar RS. RS3 hasil penelitian ini dinamakan RSSA (RS3 Sagu yang dihidrolisis dengan Amilase), RSSP (RS3 Sagu yang dihidrolisis dengan Pululanase), RSSAP (RS3 Sagu yang dihidrolisis dengan Amilase & Pululanase), RSRA (RS3 beras [Rice] yang dihidrolisis dengan Amilase, RSRP (RS3 beras [Rice] yang dihidrolisis dengan Pululanase) dan RSRAP (RS3 beras yang dihidrolisis dengan Amilase & Pululanase).Kombinasi proses retrogradasi dan hidrolisis enzim mengubah kadar RS pati sagu dan beras. Kadar RS pati sagu berubah dari sekitar 11% menjadi 31-38% dan kadar RS pati beras berubah dari sekitar 13% menjadi 21-26%. Secara umum RS3 difermentasi dengan baik secara in vitro oleh bakteri penghasil butirat. C.butyricum BCC B2571 atau E.rectaleDSM 17629 menunjukkan respon yang berbeda fermentasi RS3. C. butyricum BCC B2571 menghasilkan asetat, propionat dan butirat masing-masing 83,70 mM; 47,57 mM; 46,70 mM atau pada rasio molar 1.8 : 1 : 1,dalam medium yang disuplementasi dengan RSSA 1%. Dengan suplementasi RS3 yang sama, E.rectale DSM17629 menghasilkan asetat, propionat dan butirat sebesar 66,74 mM; 38,70 mM,dan 46,05 mM atau pada rasio molar 1.7 : 1 : 1.2. Asetat, propionat, dan butirat dengan konsentrasi relatif tinggi yaitu 95 mM, 52 mM, 59 mM atau rasio molar 1.8 : 1 : 1.1juga dihasilkan oleh E.rectale DSM17629 di dalam medium yang disuplementasi RSSP 1%.
proses fermentasi. Tahap selanjutnya diarahkan untuk mempelajari pengaruh supernatan hasil fermentasi terhadap proliferasi, apoptosis, ekspresi gen Bax, Bcl-2 dan konsentrasi enzim caspase-3 pada sel HCT-116. Sel HCT-116 dikulturkan dalam medium DMEM (Dulbescco’s Modified Eagle’s Medium) yang dilengkapi dengan 10% FBS (Fetal Bovine Serum) dan antibiotik (penisilin 100 U/mL dan streptomicin 100 µg/mL). Setelah sel mencapai sekitar 50% konfluen, medium diganti dengan supernatan hasil fermentasi yang diencerkan dengan medium DMEM sehingga konsentrasi SCFA kurang dari 10 mM dan inkubasi dilanjutkan hingga 48 jam.
v
© Hak Cipta milik IPB, tahun 2011 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
vi
3SAGU DAN BERAS
ENDANG YULI PURWANI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
vii
Penguji pada Ujian Tertutup:Prof. Dr. Deddy Muchtadi
Dr. dr. Irma Herawati Suparto, MS
viii
JUDUL : PENGHAMBATAN PROLIFERASI SEL KANKER KOLON HCT-116 OLEHPRODUK FERMENTASI PATI RESISTEN TIPE 3 SAGU DAN BERAS
NAMA MAHASISWA : ENDANG YULI PURWANI NRP : F 261070091
PROGRAM STUDI : Ilmu Pangan (IPN)
Disetujui
Komisi Pembimbing
Ketua
Prof. Dr. Maggy T. Suhartono
Dr. Tresnawati Purwadaria
Anggota Anggota
Dr.Drh. Diah Iskandriati
Diketahui
Ketua Mayor Ilmu Pangan Dekan Sekolah Pascasarjana
Dr. Ir. Ratih Dewanti-Haryadi, MSc Dr. Ir. Dahrul Syah, MSc. Agr.
ix
penulis dapat menyelesaikan desertasi berjudulPenghambatan Proliferasi Sel Kanker Kolon HCT-116 oleh Produk Fermentasi Pati Resisten Tipe 3 Sagu dan Beras. Di dalamnya dilaporkan mengenai pemanfaatan sumber karbohidrat lokal (sagu dan beras) untuk dijadikan pati resisten tipe 3 dan kemampuannya untuk difermentasi menjadi asam lemak rantai pendek (short chain fatty acid=SCFA) oleh bakteri C.butyricumBCC B2571 atau E.rectale DSM 17629. Selanjutnya dilaporkan bahwa hasil fermentasi tersebut mampu menghambat proliferasi dan menginduksi apoptosis pada sel kanker kolon HCT-116 melalui jalur mitokondria.
Penulis menyampaikan terima kasih dan penghargaan kepada:
1. Kepala Balai Besar Penelitian dan Pengembangan Pasca Panen Pertanian atas usulan beasiswa petugas belajar.
2. Kepala Badan Penelitian dan Pengembangan Pertanian atas beasiswa petugas belajar dari tahun 2007 hingga 2011
3. Prof Maggy T. Suhartono sebagai Ketua Komisi Pembimbing, Dr Tresnawati Purwadaria (Anggota) dan Dr Diah Iskandriati (Anggota) atas motivasi dan bimbingan mulai menyiapkan proposal hingga melaporkannya dalam bentuk disertasi dan deseminasi ilmiah lainnya.
4. Yayasan Institut Danone Indonesia yang telah membiayai penelitian melalui Doctorate Research Grant 2008/2009 dan seluruh reviewer yang telah mem-berikan saran perbaikan penelitian.
5. Kepala Pusat Penelitian Studi Satwa Primata atas ijin penggunaan fasilitas penelitian di Laboratorium Mikrobiologi dan Imnunologi.
6. Sdr. Ahmad R. Utomo, PhD dari Stem Cell and Cancer Institute Jakarta, atas donasi sel HCT-116.
7. Prof. Dr. Deddy Muchtadi dan Dr. dr. Irma Herawati Suparto, MS yang telah menguji pada Ujian Tertutup.
8. Prof. Drh. Dondin Sajuthi, MST, PhD dan Prof. Dr Ridwan Thahir yang menguji pada Ujian Terbuka.
9. Ayah, ibu dan ibu mertua serta seluruh keluarga atas doa dan kasih sayangnya.
10. Suami (I Putu Wardana) dan anak-anak (Gde Krishna Wardana & Made Shanty Wardana) atas pengertian, kesabaran dan kasih sayangnya.
11. Teman-teman peneliti, teknisi di Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian maupun di Laboratorium Mikrobiologi & Imunologi atas bantuan teknis penelitian yang diberikan.
12. Pihak-pihak lain yang tidak bisa disebutkan satu per satu, atas bantuan langsung maupun tidak langsung yang diberikan selama penulis menjalankan tugas belajar
Semoga karya ilmiah ini bermanfaat.
Bogor, November 2011
x
Penulis lahir di Nganjuk tanggal 18 Juli 1964daripasangan Dwidjo Santosa dan Warsini. Gelar sarjana diperoleh dari Jurusan Teknologi Pangan dan Gizi, Fakultas Teknologi Pertanian IPBtahun 1987. Tahun 1999, penulis menempuh program master di program studi Bioteknologi Sekolah Pasca Sarjana IPB dan lulustahun 2002. Tahun 2007, penulis melanjutkan program doktor di Program Studi Ilmu Pangan IPB dengan beasiswa dari Pemerintah Republik Indonesiamelalui Badan Penelitian dan Pengembangan Pertanian, Kementerian Pertanian.
Penulis mengawali karir peneliti di balai Penelitian Tanaman Pangan Sukamandi pada tahun 1989. Tahun 2002 hingga sekarang, penulis menjadi penelitidi Balai Besar Penelitian dan Pengembangan Pasca Panen Pertanian, Badan Litbang Pertanian. Penulis mengikuti pelatihan di dalam maupun di luar negeri untuk meningkatkan kemampuannya meneliti. Penulis mendapatkan hibah penelitian dari Indonesia Toray Science Foundation pada tahun 1996 dan penghargaan Ketahanan Pangan 2006 dari Menteri Pertanian RI, atas penelitian yang berkualitas.
xi
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
DAFTAR SINGKATAN ... xvii
1. PENDAHULUAN 1.1.Latar Belakang ... 1
1.2.Tujuan ... 4
1.3.Keluaran yang diharapkan ... 4
1.4.Manfaat hasil penelitian ... 4
1.5.Hipotesa ... 5
2.
TINJAUAN PUSTAKA
2.1.Potensi Sagu dan Beras ... 62.2.Struktur dan Degradasi Pati ... 7
2.3.Pati Resisten (Resistant Starch/RS) ... 10
2.3.1. Klasifikasi ... 10
2.3.2. Pembuatan RS3 ... 11
2.4.Mikrofora dan Short Chain Fatty Acid(SCFA) ... 13
2.5.Kanker Kolon ... 17
2.5.1 Statistik dan Epidemiologi ... 17
2.5.2 Karsinogenesis ... 18
2.5.3. Apoptosis ... 20
2.5.4. Kultur Sel ... 23
2.5.5. Metoda Analisis Penanda Kanker Kolon ... 24
2.5.5.1. Mikroskopi ... 24
2.5.5.2. Spektrofotometri ... 25
2.5.5.3. ELISA (Enzyme Linked immunosorbant Assay)... 25
xii
3. METODOLOGI PENELITIAN
3.1. Tempat dan Waktu ... 27
3.2. Bahan ... 27
3.3. Metode Penelitian ... 27
3.3.1. Tahap I: Pembuatan RS3 dan Pemanfaatannya sebagai Substrat Fermentasi ... 29
3.3.2.2. Penghitungan Jumlah Sel ... 32
3.3.2.3. Deteksi Apoptosis ... 33
3.3.2.4. Real Time Polymerase Chain Reaction(RT-PCR) untuk Analisis Ekspresi Gen Bax dan Bcl-2 ... 33 4.1. Kadar RS pada Produk Asal Pati Sagu Lebih Tinggi dibanding Kadar RS pada Produk Asal Pati Beras ... 36
4.2. Degradasi RS3 oleh Bakteri ... 40
4.3. Produksi SCFA selama Fermentasi in vitro ... 41
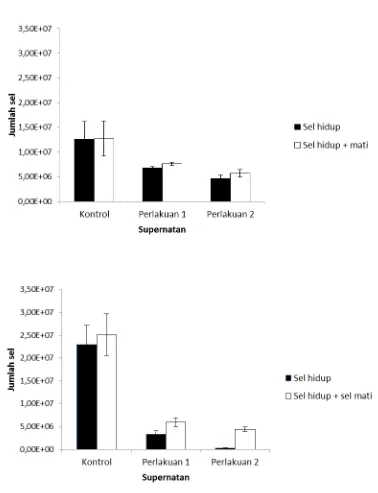
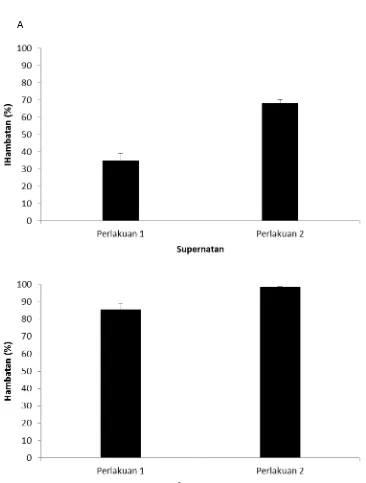
4.4. Aplikasi Supernatan Hasil Fermentasi RS3 untuk Menghambat Proliferasi dan Menginduksi Apoptosis Sel HCT-116. ... 45
4.4.1. Uji Toksisitas ... 45
xiii
Sel HCT-116. ... 47
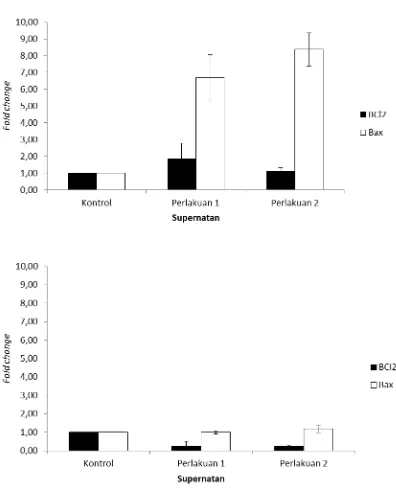
4.4.3. Apoptosis, Ekspresi mRNA Bcl-2 dan Bax ... 50
4.4.4. Konsentrasi Caspase-3 ... 55
4.4.5. Perkiraan Model Apoptosis ... 57
5. SIMPULAN DAN SARAN 5.1. Simpulan ... 60
5.2. Saran ... 60
6. DAFTAR PUSTAKA ... 62
xiv
1 Kadar amilosa pati sagu dan biji beras ... 8
2 Karakteristik amilosa dan amilopektin... 8
3 Distribusi rantai cabang amilopektin pada pati sagu dan beras ketan... 9
4 Bakteri yang sering ditemukan di dalam kolon ... 14
5 Sepuluh besar jenis kanker berdasarkan letaknya di Instalasi RadioterapiRSK” “Dharmais” Jakarta, tahun 1995-2000 ... 18
6 Karakteristik molekuler sel lestari asal organ kolon ... 24
7 Primer untuk amplifikasi gen pada analisis RT-PCR ... 34
8 Komposisi kimia dan kadar amilosa pati sagu dan pati beras ... 36
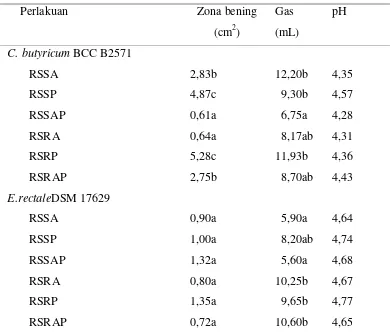
9 Zona bening, gas dan pH medium yang dihasilkan oleh C.butyricum BCC B2571 atau E.rectale DSM 17629 yang diinkubasi padamedium berisi RS3 (1%) ... 41
10 SCFA yang dihasilkan oleh C.butyricum BCC B2571 dan E.rectale DSM 17629 di dalam medium berisi RS3(1%) ... 42
11Hasil fermentasi in vitro pada subtrat RS3 ... 44
12 Pengaruh supernatan C.butyricum BCC B2571 terhadap jumlah sel hidup dan hambatan proliferasi sel VERO dan HCT-116 ... 46
13 Pengaruh supernatan E.rectale DSM 17629 terhadap jumlah sel hidup dan hambatan proliferasi sel VERO dan HCT-116 ... 47
14 Pengaruh supernatan terhadap apoptosis pada sel HCT-116 ... 51
xv
1 Ilustrasi tempat pemotongan enzim pendegradasi pati
(Mathewson 1998). ... 10
2 Jalur pembentukan asetat, propionat dan butirat. ... 16
3 Karsinogenesis pada kanker kolon (Lodish et al. 2003). ... 20
4 Perubahan morfologi sel pada proses apoptosis (O’Day 2006). ... 21
5 Jalur Apoptosis (Anonim 2010). ... 22
6 Diagram alir penelitian ... 28
7 Kadar RS di dalam produk asal pati sagu dan pati beras... 38
8 Pengaruh supernatan terhadap jumlah sel HCT-116. ... 48
9 Pengaruh supernatan terhadap inhibisi proliferasi sel HCT-116. ...49
10 Pengaruh supernatan terhadap sel HCT-116 dengan pewarna HOECHST 3258. ...51
11 Pengaruh supernatan terhadap ekspresi mRNA Bax dan Bcl-2. ...54
12 Pengaruh supernatan terhadap rasio ekspresi mRNA Bax/Bcl-2 ... . 55
13 Pengaruh supernatan terhadap sintesis caspase-3 pada sel HCT-116. .... 56
xvi
Halaman
1 Spesifikasi enzim ... 71
2 Komposisi Medium ... 71
Komposisi DMEM ... 72
4 Prosedur ekstraksi mRNA (RNeasy Kitt, Qiagen) ... 73
5 Prosedur analisa caspase-3 (Instant ELISA, Bender MedSystems) ... 74
6 Analisis sidik ragam data Fermentasi in vitro ... 75
7 SCFA di dalam medium yang berisi glukosa (1,5%) sebagai sumber karbon tunggal ... 77
8 Komposisi SCFA di dalam supernatan yang dipaparkanke sel HCT- 116 77 9 Uji Toksisitas ... 78
10 Perubahan morfologi sel HCT-116 ... 80
11 Analisis sidik ragam data jumlah sel & inhibisi proliferasi ... 81
12 Hasil pengukuran mRNA di dalam sampel ... 81
13 Contoh plot amplifikasi ... 82
14 Nilai Ct 15 Analisis sidik ragam data ekspresi gen ... 84
dan perhitungan ekspresi gen ... 83
16 Analisis sidik ragam data Caspase-3 ... 85
1.
PENDAHULUAN
1.1. Latar Belakang
Sistem pencernaan yang sehat sangat diperlukan oleh setiap orang. Pentingnya kesehatan sistem pencernaan makin disadari seiring dengan adanya perubahan pola konsumsi pangan dan gaya hidup yang penuh dengan tekanan (stres). Hal ini wajar karena saluran pencernaan merupakan organ dengan luas permukaan dan kapasitas metabolisme tertinggi bagi tubuh manusia. Organ ini terlibat langsung dalam penyerapan zat-zat gizi yang diperlukan untuk pertumbuhan maupun menjaga kesehatan, dan pembuangan zat-zat racun maupun bahan yang tidak diperlukan oleh tubuh. Sistem pencernaan yang kurang bagus dapat mengakibatkan kelainanseperti konstipasi bahkan kanker.
Kanker adalah
pertumbuhan tidak terkendali (pembelahan sel melebihi batas normal) dari sel/suatu jaringan yang menyerang jaringan di dekatnya serta dapat bermigrasi ke jaringan tubuh yang lain melalu Pertumbuhan yang tidak terkendali tersebut disebabkan oleh kerusakan DNA sehingga menyebabkan Kanker kolon dan rektum (colorectal cancer, CRC), adalah pertumbuhan sel yang tak terkendali (neoplasia) pada daerah usus besar sehingga mengganggu sistem pencernaan secara lokal dan mekanisme fisiologis tubuh secara umum.
Ada sekitar 1,2 juta kasus kanker kolon dan rektum baru pada tahun 2008 atau mencapai sekitar 9,8% di seluruh dunia(Globocan 2008). Secara global, kanker kolon menempati urutan ketiga setelah kanker paru-paru dan, payudara. CRC menempati urutan ketiga untuk laki-laki dan urutan kedua bagi perempua n. Data statistik kanker di Indonesia belum tersedia sampai saat ini. Hanya ada sekitar 600 malignan kolon di RS Dharmais Jakarta pada kurun waktu 1994-2006 (Kastomo 2007). Kemungkinan besar banyak kasus serupa terjadi di tempat lain namun belum dilaporkan secara rinci. Sekitar 80% dari kasus CRC berkaitan dengan diet (Le-Leu
bahan pangan yang mampu mencegah kanker kolon diantaranya adalah resveratrol (terdapat di dalam anggur merah), proantocyadinin (di dalam buah, sayur dan biji-bijian), kurkumin (dalam kunyit) dan pati resisten (biji-bijian, ubi-ubian, palma) (Wolter dan Stein 2002, Kim et al. 2005, Le-Leu et al. 2007,Patel et al. 2008).
Keadaan di atas mendorong dilakukannya riset tentang kontribusi ingredien pangan dalam bentuk pati resisten tipe 3 (Resistant Starch Type 3; selanjutnya disebut RS3) dalam mencegah CRC. Pati resisten (Resistant Starch = RS) didefinisikan sebagai fraksi pati yang tidak terserap oleh sistem pencernaan pada individu yang sehat (Euresta 1993). Ada empat kelompok RS, yaitu RS1, RS2, RS3 dan RS4 (Englyst et al. 1992). RS1 adalah pati yang secara fisik terperangkap di dalam matriks sehingga tidak dapat diakses oleh enzim. RS2 adalah granula pati mentah yang didominasi oleh struktur kristalin sehingga sulit dihidrolisis oleh enzim. RS3 adalah pati retrogradasi dan RS4 adalah pati modifikasi secara kimiawi.
RS lolos dari sistem pencernaan yang sehat dan langsung memasuki usus besar (kolon) selanjutnya difermentasi oleh mikroflora yang ada di dalamnya. Fermentasi dilakukan oleh sejumlah bakteri antara lain dari genusEubacterium,Peptostreptococci,Clostridia,Roseburia spp dan
Butyrofibriofibrisolvens.Bakteri tersebut mampu mendegradasi pati karena memiliki enzim pengurai pati, yaitu amilase (Wang et al. 1999).
kanker pada dasarnya merupakan target dari pencegahan maupun terapi pada penyakit kanker.
RS3 dapat dikembangkan dari beberapa sumber karbohidrat diantaranya kentang, jagung, beras, pisang dan sebagainya. Pada penelitian ini, RS3 dibuat dari pati beras dan sagu. Kedua komoditas dipilih karena tersedia dalam jumlah besar danberagam. Saat ini banyak varietas unggul beras dihasilkan oleh para pemulia padi, namun hanya sebagian saja yang populer untuk dikonsumsi langsung. Beberapa varietas memiliki keunggulan agronomi namun kurang diterima oleh konsumen karena kualitas tanaknya kurang bagus. Varietas padi yang termasuk di dalamnya antara lain adalah Cisokan dan Batang Piaman. Oleh karenanya, padi-padi tersebut sangat cocok bila dijadikan bahan ingredien pangan fungsionaldiantaranya untuk mencegah CRC.Sagu (Metroxylon sp) adalah sumber pati lain yang cukup penting di Indonesia. Luas area sagu di dunia diperkirakan mencapai 2,25 juta ha dalam bentuk hutan sagu dan 0,2 juta ha dalam bentuk semi budidaya. Indonesia memiliki luas area produksi sagu terbesar di dunia dan diikuti oleh Papua Nugini, Malaysia dan Filipina (Flach 1997). Pohon sagu mampu menghasilkan pati sekitar 2-3 ton/ha/tahun, lebih tinggi dibanding singkong maupun jagung, masing-masing 2 ton/ha/tahun dan 1 ton/ha/tahun (Stantan 1992). Selain itu, pati sagu juga dapat diperoleh dari batang pohon aren (Arenga pinata).
enzimatis dipilih dengan pertimbangan enzim bekerja sangat spesifik.Hidrolisis dilakukan oleh amilase, pululanase dan kombinasinya.
Pada penelitian ini, RS3 difermentasi oleh kultur murni Clostridium butyricum
BCC B2571 atau Eubacterium rectale DSM 17629 sebagai strain bakteri model. Keduanya merupakan bakteri pendegradasi pati dan penghasil butirat yang secara normal berada di kolon serta termasuk kelompok non patogen. Bakteri yang sering ditemukan di kolon antara lain berasal dari famili bakterioid, bifidobakteria, lactobacilli. Selanjutnya pengaruh supernatan hasil fermentasi terhadap sel kanker dipelajari secara in vitro dengan kultur sel HCT-116.
1.2.Tujuan
a. Mendapatkan RS3 daripati beras dan pati sagumelalui proses kombinasi proses retrogradasi dan hidrolisis enzim
b. Mempelajari profil SCFA yang dihasilkan oleh kultur tunggal C.butyricum BCC B2571 atau E.rectaleDSM 17629 pada media fermentasi yang disuplementasi dengan RS3 tersebut di atas.
c. Mempelajari penghambatan proliferasi dan apoptosis pada sel lestari asal kanker kolon (manusia), yaitu HCT-116yang diberi paparan SCFA hasil fermentasi RS3.
1.3. Keluaran yang diharapkan
a.RS3 dari pati beras dan pati sagu yang bersifat butirogenik, yakni RS3 yangdapatmenghasilkan asam butirat ketika difermentasi.
b.Sel kanker yang proliferasinya terhambat dan mengalami apoptosis ketika sel yang bersangkutan diberi paparan supernatan hasil fermentasi RS3.
1.4.Manfaat hasil penelitian
Hasil penelitian juga memberikan pemahaman terhadap peran bakteri kolon secara individu dalam fermentasi RS3. Pemahaman ini penting untuk menyusun strategi pengembangan dan pemanfaatan RS3 sebagai komponen bahan pangan yang memiliki fungsi unik yang mampu mencegah penyakit kanker kolon/CRC.
1.5.Hipotesis
a. RS3 asal pati sagu maupun pati beras dapat dimanfaatkanoleh C.butyricum BCC B2571 atau E.rectaleDSM 17629 dengan menghasilkan SCFA.
2. TINJAUAN PUSTAKA
2.1.Potensi Sagu dan Beras
Sagu dan beras merupakan sumber karbohidrat penting di kawasan Asia
dan khususnya di Indonesia. Tanaman sagu tumbuh secara alami terutama di
daerah dataran atau rawa dengan sumber air yang melimpah. Tanaman ini masih
tumbuh dengan baik pada ketinggian 1.250 m dpl dengan curah hujan 4.500
mm/tahun(Limbongan 2007). Tanaman sagu berkembang di beberapa wilayah di
Indonesia, yaitu sebagian Sumatera, Sulawesi dan Papua (BPS 2009). Di propinsi
Papua ditemukan lebih dari 60 jenis aksesi sagu dan Papua dianggap sebagai
sentra keragaman genetik sagu terbesar di dunia (Limbongan 2007).
Di Indonesia, terutama di Jawa Barat, istilah pati sagu juga dipakai untuk
menyatakan pati yang diekstrak dari tanaman aren (Arenga pinnata). Oleh karena
itu, di wilayah ini dikenal dua jenis pati (disebut juga aci) sagu, yakni aci kirai
dan aci kawung, masing-masing diperoleh dari batang pohon sagu dan batang
pohon aren.
Sagu dikonsumsi secara langsung sebagi makanan pokok diantaranya di
Sulawesi dalam bentuk kapurung, sagu lempeng, di Papua dalam bentuk papeda
dan sebagainya. Sagu juga diolah menjadi aneka kue kering. Sagu juga telah
menjadi mi atau bihun (Purwani et al. 2006, Herawati et al. 2010).
Berbeda dengan sagu, beras merupakan tanaman yang secara intensif
dibudidayakan oleh petani. Produksi beras meningkat dari sekitar 60 juta ton
pada tahun 2008 menjadi lebih dari 64 juta ton pada tahun 2009 (BPS 2010). Di
samping itu, lebih dari seratus varietas padi telah berhasil dirakit oleh para
pemulianya dalam satu dekade terakhir ini. Varietas-varietas tersebut memiliki
sifat agronomis maupun kualitas rasa nasi yang sangat beragam sesuai dengan
kondisi alam dan preferensi masyarakat Indonesia (Suprihatnoet al. 2010). Sifat
nasi sangat ditentukan oleh kadar amilosa beras. Berdasarkan kadar amilosa,
beras dikelompokka n menjadi: (a) beras ketan dengan kadar amilosa <10%, (b)
beras beramilosa rendah dengan kadar 10-20%, (c) beras beramilosa sedang
dengan kadar 20-25% dan (d) beras beramilosa tinggi dengan kadar
>25%(Indrasari et al. 2008). Makin tinggi kadar amilosa makin pera tekstur
Seperti halnya sagu, beras juga dikonsumsi langsung dalam bentuk nasi.
Beras beramilosa sedang umumya disukai oleh sebagian besar masyarakat
Indonesia. Sebagian etnis Melayu di Sumatera menyukai beras beramilosa tinggi.
Beras juga diolah menjadi berbagai produk seperti bihun dan berondong. Beras
yang kurang disukai untuk konsumsi langsung memiliki peluang untuk diolah
menjadi produk yang memiliki nilai ekonomi tinggi, seperti RS3.
2.2. Struktur dan Degradasi Pati
Granula pati memiliki bentuk dan ukuran spesifik tergantung pada
sumbernya. Granula pati sagu berbentuk oval dan berukuran besar yakni lebih
dari 30 µ m, sedangkan granula pati beras berbentuk poligonal berukuran kecil
yakni kurang dari 10 µ m (Ahmad et al.1999, Srichuwong et al. 2005, Yang et al.
2006). Ukuran granula pati ikut mempengaruhi tingkat kemudahannya diakses
oleh enzim-enzim pendegradasinya. Makin besar ukuran granula pati makin kecil
rasio luas permukaannya terhadap volume sehingga mengurangi ikatan dengan
enzim atau dengan kata lain menurunkan potensi hidrolisisnya (Tester et al.
2004).
Pati terdiri dari dua fraksi, yaitu amilosa dan amilopektin. Amilosa adalah
polimer rantai lurus yang tersusun atas unit monomer glukosa melalui ikatan glikosidik α-(1,4). Fraksi ini mudah larut dalam air dan mampu membentuk struktur helik ganda. Kadar amilosa pati sagu dan pati beras bervariasi antar
varietas seperti tampak dalam Tabel 1. Berat molekul amilosa sagu berkisar
antara 1,41x 106- 2,23x 106 Da (Ahmad et al. 1999).
Amilopektin adalah polimer mirip amilosa namun bercabang melalui ikatan
glikosidik α-(1,6) pada titik percabangannya. Amilopektin membentuk struktur klaster. Rantai amilopektin di dalam klaster dibedakan menjadi rantai A dan B.
Rantai A merupakan rantai yang tidak membawa rantai yang lain dan umumnya
Tabel 1 Kadar amilosa pati sagu dan biji beras
Komoditas Kadar amilosa (%, basis basah) Pustaka
Sagu
Tabel 2 menampilkan perbedaan karakteristik dasar amilosa dan
amilopektin, sedangkan Tabel 3 menampilkan distribusi panjang rantai cabang
amilopektin pati beras dan pati sagu.
Tabel 2Karakteristik amilosa dan amilopektin
Karakteristik Amilosa Amilopektin
Struktur Linear (α-1,4) Bercabang (α-1,4; α-1,6)
Warna reaksi dengan Iod Biru Merah keunguan
Stabilitas larutan (encer) Tidak stabil Stabil
Retrogradasi Cepat Lambat
Sifat gel Keras dan irreversible Lunak dan reversible
Sifat film Kuat Rapuh
Tabel 3 Distribusi rantai cabang amilopektin pada pati sagu dan beras ketan
Komoditas Distribusi panjang rantai cabang (%)
DP 6-8 DP 9-12 DP 13-24 DP 25-30
Sagu 9,0 28,1 56,2 6,7
Beras 8,0 34,5 52,1 5,4
Sumber: (Srichuwong et al. 2005a).
Variasi sifat molekuler fraksi amilosa dan amilopekin memberikan
konsekuensi terhadap perbedaan sifat fisiko kimia pati seperti kekuatan gel, sifat
pasta, tingkat kemudahannya untuk dihidrolisis oleh enzim dan sebagainya
(Ahmad et al. 1999, Patindol & Wang 2003, Srichuwong et al. 2005a,
Srichuwong et al. 2005b).
Pati dapat dihidrolisis oleh enzim α-amilase, ß-amilase, glukoamilase, dan
isoamilase atau pululanase (Mathewson 1998). Enzim α-amilase (E.C. 3.2.1.1)
merupakan enzim hidrolisis yang memotong ikatan glikosidik α-(1,4) secara acak
dari bagian dalam molekul pati. Enzim ini dikenal dengan endoamilase. Hidrolisis
rantai amilosa oleh enzim tersebut berlangsung secara terus-menerus hingga
tersisa rantai glukosa 10-20 unit. Pada rantai amilopektin, enzim amilase bekerja
dengan cara sama dan menyisakan fragmen percabangan yang mengandung ikatan
glikosidik α-(1,4). Enzim β-amilase (E.C.3.2.1.2) menghidrolisis ikatan α-(1,4)
dari ujung non pereduksi dan menghasilkan maltosa. Sistem pencernaan manusia
tidak memiliki β-amilase.Glukoamilase (EC 3.2.1.3) mengkonversi maltosa dan
fragmen besar pati (hasil hidrolisis α dan β amilase) menjadi glukosa. Isoamilase
memotong ikatan α-(1,6). Isoamilase atau pululanase (EC 3.2.1.41) memotong
ikatan α-(1,6) (Gambar 1).
Keperluan enzim dalam industri biasanya dihasilkan oleh mikroorganisme.
Tingkat kemudahan pati diakses oleh enzim lebih tergantung pada
struktur/organisasi molekul pati. Pati yang memiliki difraksi sinar x tipe A lebih
mudah dihidrolisis oleh amilase dibanding tipe B(Srichuwong et al. 2005a).
Enzim pendegradasi pati juga dihasilkan oleh beberapa bakteri penghuni usus
besar seperti Bifidobacteria, Bacteroides, Clostridium dan Eubacterium(Wang et
Gambar 1Ilustrasi tempat pemotongan enzim pendegradasi pati(Mathewson 1998).
2.3. Pati Resisten (Resistant Starch/RS)
2.3. 1. Klasifikasi
Pati resisten (resistant starch, RS) didefinisikan sebagai fraksi pati yang
tidak tercerna oleh sistem enzim pada pencernaan individu yang sehat. RS
terdapat secara alamiah di dalam bahan pangan segar maupun produk olahannya.
Ada 4 tipe RS, yaitu RS1, RS2, RS3 dan RS4 (Sajilata et al. 2006). RS1 adalah
pati yang berada dalam jaringan tanaman sehingga tidak dapat diakses oleh
enzim-enzim pencernaan. Contohnya adalah pati yang terdapat dalam buah apel
dan pisang. RS2 adalah granula pati mentah yang didominasi oleh struktur
kristalin sehingga sulit dihidrolisis oleh enzim. Contohnya adalah pati hasil
ekstraksi batang sagu, ubi jalar, jagung dan sebagainya. RS3 adalah pati
retrogradasi yang terbentuk selama proses pengolahan pangan atau yang
direkayasa. RS4 adalah pati modifikasi yang diperoleh melalui proses eterisasi,
esterifikasi maupun ikatan silang. Oleh karena itu, jenis pati ini memiliki ikatan selain ikatan glikosidik α-(1,4) atau α-(1,6), diantaranya ikatan ester.
ujung non pereduksi
ujung pereduksi
α-amilase
α-amilase
ß-amilase ß-amilase
2.3. 2. Pembuatan RS3
RS3 menjadi perhatian di kalangan industri pangan karena jenis RS ini
selain terbentuk selama proses pengolahan pangan juga dapat direkayasa
sedemikian rupa sehingga diperoleh produk yang sifatnya sesuai dengan
kebutuhan. Beberapa proses dikembangkan untuk menciptakan RS3 dari sumber
pati yang berbeda-beda. Garis besar pembuatan RS3 meliputi aplikasi proses
pemanasan, pendinginan, hidrolisis enzim maupun non-enzimatis dan
kombinasinya. Pemanasan ditujukan agar pati tergelatinisasi sehingga pati dapat
diakses oleh enzim. Pendinginan digunakan untuk memicu proses
retrogradasi,sedangkan hidrolisis berguna untuk menghilangkan bagian amorphus
pati. Hasil hidrolisis (hidrolisat) dihilangkan dan sisanya dikeringkan untuk
mendapatkan material atau produk yang dikenal sebagai RS3.
Suspensi pati yang dipanaskan mengalami gelatinisasi sehingga granula
membengkak yang mengakibatkan amilosa di dalamnya keluar (leaching) dan
ditandai oleh perubahan viskositas. Proses pendinginan menghasilkan gel. Pada
kondisi dingin, amilosa berinteraksi sesamanya dan proses ini dikenal dengan
retrogradasi. Retrogradasi dipercepat pada suhu rendah. Interaksi antar rantai
amilosa membentuk struktur yang relatif lebih tahan terhadap proses hidrolisis
enzim.
Pembuatan RS3 dengan cara memodifikasi pati garut (Marantha
arundinacea) dengan perlakuan kombinasi siklus pemanasan-pendinginan
dilaporkan oleh Sugiyono et al. (2009). Dengan cara tersebut, kadar pati resisten
meningkat dari sekitar 2% pada pati alami menjadi 10-12% tergantung pada
perlakuan yang diterapkan. Putra (2010) melaporkan bahwa pemanasan suhu
tinggi (autoclaving)meningkatkan kadar RS menjadi dua kali lipat pada tepung
atau pati pisang.
RS3 dari pati beras dilaporkan oleh (Guraya et al. 2001). Prosesnya
melibatkan hidrolisis pati beras oleh enzim pululanase dilanjutkan dengan
pemanasan pada suhu 121oC, 30 menit kemudian pendinginan pada 1oC dan
diakhiri dengan pengeringan beku. Proses tersebut menghasilkan material (RS3)
dengan kadar RS sekitar 13%. Pembuatan RS3 dari pati beras juga dilaporkan
dengan kombinasi perlakuan panas pada 121oC, 15 menit kemudian didinginkan
pada 4oC selama 24 jam. Kadar RS di dalam material sekitar 16%.
Penggunaan pati sagu dan enzim pululanase yang dikombinasikan dengan
pemanasan pada 121oC, 30 menit dan penyimpanan pada suhu bervariasi dari 4oC
sampai 80oC selama 0 sampai 7 (tujuh) hari untuk mendapatkan produk RS3 juga
dilaporkan oleh peneliti lain (Leong et al. 2007). Kadar RS tertinggi mencapai
11,6% diperoleh pada proses hidrolisis pati sagu dengan 40 PUN (Pullulanase
Unit Novozyme)/g substrat selama 8 jam yang diikuti oleh pemanasan pada
121oC, 30 menit dilanjutkan dengan penyimpanan pada suhu 80oC selama 7
(tujuh) hari. Kadar RS di dalam bahan asalnya pati sagu alami justru lebih tinggi
(sekitar 41%).
Pati singkong juga diproses menjadi RS3 (Vatanasuchart et al. 2010). Pati
digelatinisasi pada 120oC, 30 menit kemudian dihidrolisis oleh enzim pululanase
dan dilanjutkan dengan penyimpanan pada suhu 4o
Perbedaan proses pembuatan RS3 mengakibatkan perbedaan sifat
fungsionalnya dan ini sangat menentukan aplikasinya lebih lanjut. RS3 masih
memiliki kemampuan membentuk gel dan menahan air (Guraya et al. 2010),
namun ada pula yang tidak lagi memiliki kemampuan serupa (Tan 2003). RS3
mampu memperbaiki sifat produk pangan dengan bertindak sebagai texture
modifier, crisping agent(Sajilata et al. 2006). RS secara umum dianggap sebagai
bagian dari serat makanan. RS3 ditambahkan dalam suatu formula produk pangan
sebagai upaya untuk meningkatkan kadar serat makanan(Nugent 2005). RS juga
ditambahkan sebagai ingredien pangan untuk meningkatkan konsentrasi butirat di
dalam usus besar. RS ditambahkan ke dalam produk pangan olahan berbasis
serealia, susu, rerotian maupun sayuran diantaranyabreakfast cereal, yoghurt, sup C selama 24 jam atau 48 jam.
Cara ini mampu meningkatkan kadar RS dari sekitar 9% (di dalam pati mentah)
menjadi lebih dari 40%. Dari uraian di atas, tampak bahwa kadar RS di dalam
produk sangat bervariasi. Hal ini disebabkan oleh adanya perbedaan beberapa
faktor diantaranya sumber pati (bahan baku), proses pemanasan dan pendinginan,
penggunaan enzim penghidrolisis (jumlah dan jenis) dan sebagainya. Saat ini,
RS3 sudah dapat diperoleh secara komersial diantaranya adalah CrystaLean® dan
krim dan sebagainya. Jumlah RS yang ditambahkan bervariasi dari 2% hingga
20% (Brouns et al. 2002).
2.4. Mikrofora dan Short Chain Fatty Acid (SCFA)
Usus besar (kolon) merupakan habitat berbagai macam mikroorganisme.
Lebih dari 50 genus dan 400 spesies bakteri telah diidentifikasi pada feses
manusia.Bakteri fakultatif aerob seperti Escherichia coli ada di dalamnya. Bakteri
anaerob obligat seperti Clostridium dan Bacterioid berada dalam jumlah sangat
besar (Bird et al. 2000). Bakteri yang sering ditemukan didalam kolon
dicantumkan dalam Tabel 4. Populasi setiap bakteri bervariasi dari 105 hingga
1014 sel/g feses. Kemampuan memanfaatkan substrat dan produk yang
dihasilkannya juga beragam.
Pati resisten tidak dicerna di dalam sistem saluran pencernaan sehingga
material ini langsung menuju usus besar. Kelompok bakteri sakarolitik
memanfaatkan RS sebagai substrat fermentasi untuk menghasilkan produk berupa
SCFA (asetat, propionat dan butirat) dan gas (CO2, CH4 dan H2
Kadar SCFA dan distribusinya tergantung pada strain bakteri serta jumlah
dan jenis substrat yang tersedia. RS khususnya RS3 merupakan substrat potensial
bagi bakteri penghasil butirat di dalam kolon dan disebut sebagai substrat
butirogenik. Kemampuan RS3 sebagai substrat butirogenik dilaporkan oleh
beberapa peneliti. Zhao dan Lin (2009) melakukan simulasi fermentasi RS3 asal
pati jagung yang dihrolisis dengan asam sitrat. RS3 ditambahkan di dalam cairan
feses bayi atau orang dewasa sehat kemudian diinkubasi secara anaerobik pada
suhu 37
). SCFA yang
tidak diabsorpsi oleh kolon akan memasuki darah melalui sistem portal hepatik.
Di hati, asam asetat ditransfer menjadi acetil-CoA yang merupakan prekursor
untuk lipogenesis. Propionat menghambat glukoneogenesis. Butirat merupakan
sumber energi utama bagi sel-sel kolon dan dilaporkan memiliki kemampuan
menghambat sel kanker (Singhet al. 1997, Hinnebusch et al. 2002).
o
C selama 0, 12 dan 24 jam. Hasil studi menunjukkan bahwa SCFA
meningkat sejalan dengan lama fermentasi. Kadar asam butirat lebih besar
dihasilkan oleh kultur yang berasal dari cairan feses bayi. Sharp dan Macfarlane
penghasil butirat dari genus Clostridia. Reid et al. (1998) melaporkan kemampuan
kultur murni C.butyricum untuk menghasilkan SCFA dari substrat pati jagung.
Rasio amilosa/amilopektin, retrogradasi dan penambahan amilase pankreas
dilaporkan mempengaruhi SCFA dan rasio asetat terhadap butirat.
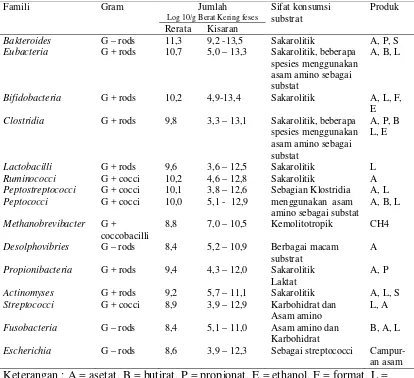
Tabel 4 Bakteri yang sering ditemukan di dalam kolon
Famili Gram Jumlah Sifat konsumsi
substrat
Produk
Log 10/g Berat Kering feses
Rerata Kisaran
Escherichia G – rods 8,6 3,9 – 12,3 Sebagai streptococci
Campur-an asam
Keterangan : A = asetat, B = butirat, P = propionat, E = ethanol, F = format, L = laktat, S = suksinat
Sumber: (Macfarlane et al. 1995).
Diperkirakan 80% dari bakteri penghasil butirat di kolon berada dalam
klaster XIVa kelompok bakteri gram positip (Barcenilla et al. 2000). Spesies
rectale, Roseburia intestinalis, Roseburia hominis dan sebagainya (Louis & Flint
2009) maupun C. butyricum(Mitsuoka 1990).
Bakteri dalam kolon bersifat sakarolitik sehingga mampu menguraikan pati
dengan bantuan enzim amilase. Sistem enzim pendegradasi pati pada bakteri
gram positip penghasil butirat dilaporkanoleh (Ramsay et al. 2006).Enzim
tersebut tertancap pada dinding sel bakteri sedemikian rupa sehingga situs
hidrolisisnya berdekatan dengan sistem transpor produk hidrolisis menuju ke
dalam sel bakteri. Produk hidrolisis kemudian dimetabolisme untuk
menghasilkan SCFA. Ada beberapa jalur pada proses pembentukan SCFA dari
glukosa yang sudah dikonfirmasi pada bakteri kolon (Miller & Wolin 1996).
Katabolisme glukosa berlangsung melalui jalur Embden Meyerhof-Parnas dengan
menghasilkan CO2 dan piruvat. Asetat berasal dari CO2 dan dibentuk melalui
jalur Wood Ljungdahl. Propionat dibentuk dengan cara fiksasi CO2
SCFA mencapai sel melalui sistem transpor pasif dan aktif dengan bantuan
senyawa pengangkut/carrier specific, yaitu MCT (Monocarboxylate Transporter)
(Hadjiagapiou et al. 2000, Lecona et al. 2008). Transpor pasif berlangsung
dengan cara difusi non ionik SCFA yang tidak terdisosiasi. SCFA juga
dimungkinkan berada dalam bentuk non ionik karena daerah apikal suasananya
asam akibat pelepasan H
. Butirat
dihasilkan melalui jalur klasik yaitu kondensasi molekul asetil-CoA. Pada tahap
akhir pembentukan butirat tersedia dua jalur yaitu pertama jalur butirat kinase dan
kedua jalur butiril-CoA:asetil-CoA transferase. Pada jalur pertama, enzim fosfo
transbutirilase dan butirat kinase mengonversi butiril-CoA menjadi butirat dengan
produk antara butiril-fosfat. Pada jalur kedua, enzim butiril-CoA:asetat
CoA-transferase mentransfer gugus CoA ke asetat eksternal sehingga dihasilkan
asetil-CoA dan butirat. Jalur ini umumnya dimiliki oleh bakteri penghasil butirat pada
kolon. Jalur butirat kinase ditemukan pada bakteri solventogenik C.
tyrobutyricum(Zhu 2003). Ilustrasi jalur pembentukan asetat, propionat dan
butirat dicantumkan dalam Gambar 2.
+
yakni Na+/H+ exchanger. Pada kondisi pH fisiologis,
SCFA berada dalam bentuk terionisasi dan transpor SCFA berlangsung secara
SCFA-/HCO3-, (ii) electroneutral H+-coupled MCT (monocarboxylate
transporter) dan (iii) electrogenic Na+
Gambar 2Jalur pembentukan asetat, propionat dan butirat. 1a: jalur butirat kinase, 1b:butiril-CoA:asetil CoA transferase, 2: jalurakrilat, 3:jalur suksinat, 4: jalur propandiol. (Louis et al. 2007). Tanda panah terputus menunjukkan adanya produk antara. DHAP: dihidroksiaseton pospat, P: Pospat, PEP: Pospoenolpiruvat.
-coupled transporter untuk MCT.
SCFA menimbulkan pengaruh fisiologis yang menguntungkan bagi
kese-hatan pencernaan inang. Asam-asam organik termasuk SCFA memberikan
kon-tribusi terhadap kesehatan kolon secara signikan. SCFA merupakan regulator
pro-ses fisiologi untuk menjaga agar kolon berfungsi normal (Bird et al. 2000).
Fung-si SCFAsecara umum didasarkan pada kenyataan SCFA termasuk kelompok asam
organik dengan nilai pKa sekitar 5 sehingga produksi SCFA akan meng-asamkan
lingkungan intrakolon. Pada kondisi tersebut terjadi: (i) pertumbuhan
mikroorganisme patogen yang sensitif terhadap perubahan pH dihambat, (ii)
Heksosa (glukosa, fruktosa), pentosa (xilosa, arabinosa) L-fukosa
senyawa alkalin yang berpotensi toksik/karsinogenik akan terdisosiasi sehingga
tidak dapat terserap lagi dan (iii) peredaran darah di kolon lebih lancar dan otot
kolon berkontraksi sehingga menstimulasi penyerapan cairan dan elektrolit (Na+,
K+ dan Ca+2). SCFA khususnya butirat merupakan sumber energi utama bagi sel
epithel kolon.Beberapa peneliti melaporkan bahwa SCFA khususnya butirat
memiliki aktifitas anti-proliferasi dan mampu mengubah ekspresi sejumlah gen
(Archer et al. 1998, Hinnebusch et al. 2002, Davie 2003). Hal ini diperkuat oleh
studi yang melibatkan hewan model. Produksi SCFA meningkat dan
perkembangan sel kanker di dalam kolon tikus/mencit berkurang setelah
tikus/mencit mengonsumsi diet kaya RS (Le-Leu et al. 2002, Le-Leu et al. 2007).
SCFA terutama butirat merupakan penghambat enzim histone deasetilase
(HDAC: Histone Deacetylase). Penghambatan enzim tersebut mengakibatkan
terjadinya hiperasetilasi pada protein histone sehingga interaksi ionik antar DNA
rusak dan hal ini mengubah ekspresi sejumlah gen. Gen-gen yang ekspresinya
dipengaruhi oleh hiperasetilasi histon antara adalah gen yang mengatur siklus sel
(Cyclin A, Cyclin E, Cyclin B1 dan sebagainya), faktor transkripsi (c-Myc, RARα
dan ß) maupun apoptosis yaitu famili gen Bcl-2(De Ruijteret al. 2003).
2.5. Kanker Kolon
2.5.1 Statistik dan Epidemiologi
Data kanker global menunjukkan bahwa ada empat jenis kanker yang sering
ditemukan yaitu kanker paru-paru (1.352.132 kasus), payudara (1.151.298 kasus),
kolon (1.023.152 kasus) dan prostat (679.023 kasus) (Parkin et al. 2005).
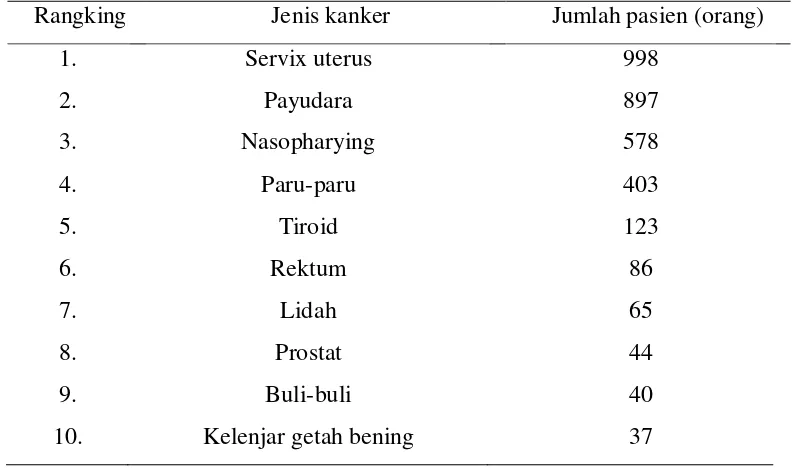
Berdasarkan data di Instalasi Radioterapi RSK ”Dharmais” Jakarta tahun
1995-2002, kanker rektum menempati urutan ke-6 dari sepuluh besar jenis kanker
(Tabel 5). Jumlah sebenarnya mestinya lebih banyak lagi.
Hasil survei penelitian mengenai kasus kanker kolon menyimpulkan bahwa
sekitar 5-10%kanker kolon dan rektum disebabkan oleh faktor genetik yang
diwariskan. Selebihnyadisebabkan oleh hal lain yang berkaitan dengan makanan,
Tabel 5Sepuluh besar jenis kanker berdasarkan letaknya di Instalasi radioterapi RSK ”Dharmais” Jakarta, tahun 1995-2000
Rangking Jenis kanker Jumlah pasien (orang)
1. Servix uterus 998
2. Payudara 897
3. Nasopharying 578
4. Paru-paru 403
5. Tiroid 123
6. Rektum 86
7. Lidah 65
8. Prostat 44
9. Buli-buli 40
10. Kelenjar getah bening 37
Sumber: (Defrizal 2007).
2.5.2. Karsinogenesis
Kanker berawal dari kerusakan/perubahan DNA atau mutasi ketika sel
ber-replikasi.Pada saat replikasi, gen yang mengontrol pembelahan sel dalam
keada-an aktif. Pada kondisi tertentu sel berdiferensiasi dkeada-an tidak lagi membelah
se-hingga gen yang mengontrolnya dalam keadaan tidak aktif. Secara normal, jika
terjadi kesalahan replikasi maka sel mampu memperbaiki karena sel memiliki
fasilitas enzim-enzim reparasi DNA (DNA repairing enzyme).
Pada kanker kolon mutasi terjadi pada gen penekan tumor (tumor supresor
gene : TSG) seperti gen APC (Adenomatous Polypopsi Coli), p53 dan lainnya
maupun pada oncogen seperti K-ras. Mutasi gen APC bersifat heriditer
(diwariskan) sehingga individu yang membawa gen APC termutasi tersebut
beresiko lebih besar untuk terkena kanker usus dibanding individu yang tidak
membawanya (Lodish et al. 2003). Namun demikian, kesalahan genetika yang
terkait dengan faktor keturunan tidak secara otomatis berubah menjadi sel kanker.
Ada faktor eksternal lainnya yang diperlukan untuk mengubahnya menjadi sel
Faktor luar (eksternal)diantaranya virus, infeksi berkelanjutan, radiasi,
polusi udara dan bahan-bahan kimia yang tidak diperlukan oleh tubuh
(xenobiotik) juga dapat menyebabkan mutasi.Mutasi gen karena faktor eksternal
terjadi padasel somatik,khususnya pada organ yang sering mengalami pergantian
sel atau atau melakukan fungsisekresi, seperti payudara dan rahim (Zakaria 2001).
Perubahan dari sel normal menjadi sel kanker berlangsung secara bertahap,
meliputi tahap inisiasi, promosi dan progresi (Barret 1993). Inisiasi merupakan
tahap terjadinya perubahan DNA/mutasi gen yang disebabkan oleh beberapa
faktor internal maupun eksternal. Mutasi ini terjadi pada kelompok
protoonco-gene dan TSG. Protooncoprotoonco-gene menyandi growth factor, growth factor receptor,
enzim maupun faktor transkripsi yang mempromosi pertumbuhan dan atau
pem-belahan sel. Protooncogene yang termutasi dinamakan oncogene. Pada tahap
ini-siasi, oncogen teraktivasi sedangkan TSG mengalami inaktivasi. Tahap
selanjut-nya adalah promosi yakni perkembangan klon sel menjadi sel
tumor/pre-maglignant. Sel kemudian memasuki tahap progresi yakni sel kanker berkembang
tanpa kendali. Sel kanker memiliki ciri yang berbeda dengan sel normal.
Mutasi di beberapa gen ditemukan pada kanker kolon (Gambar 3). Mutasi
pada gen penekan tumor APC mengakibatkan sel tumbuh membentuk polip.
Mutasi selanjutnya terjadi pada oncogen ras dan TSG DCC (deleted colorectal
cancer) serta p53. Kondisi tersebut mengakibatkan pembelahan sel tidak
terkendali. Meskipun demikian, tidak semua mutasi diperlukan agar sel normal
berubah menjadi sel kanker.
Sel kolon normal
Gambar 3 Karsinogenesis pada kanker kolon (Lodish et al. 2003).
2.5.3. Apoptosis
Apoptosis ialah suatu bentuk kematian sel terprogram yang mempunyai
ciri-ciri morfologi dan biokimia spesifik. Apoptosis merupakan mekanisme penting
untuk mencegah proliferasi sel-sel yang DNA-nya rusak dan hal ini menjadi salah
satu alat kontrol check point dalam siklus sel. Kegagalan sel melakukan
terkendali.
Pencegahan atau terapi kanker diarahkan untuk mencegah sel kanker
berproliferasi atau menginduksi agar sel kanker melakukan apoptosis. Sel mati
lewat apoptosis memiliki morfologi khusus (Gambar 4) yang berbeda dengan sel
mati secara nekrosis. Mula-mula sel mengerut, mitokondria pecah dan sitokrom
c dibebaskan. Kromatin (DNA dan protein) di dalam inti sel terurai. Sel pecah
menjadi fragmen-fragmen yang dikelilingi oleh membranfragmen tersebut
diber-sihkan oleh sel-sel fagisitosis (in vivo)(Gambar 4).
Gambar 4 Perubahan morfologi sel pada proses apoptosis (O’Day 2006).
Apoptosis diinduksi oleh beberapa senyawa. Topping dan Clifton (2001)
melaporkan bahwa sel SW620 yang diberi paparan butiratterhenti
pertum-buhannya pada fase G0-G1 dan G2-S dalam 12 jam dan 4 jam kemudian
meng-alami apoptosis. Apoptosis juga diinduksi oleh komponen bioaktif seperti
proto-antocyanidin maupun 3,3’-Diindolymethane (Kim et al. 2005, Kim et al. 2007).
Ada 2 jalur utama apoptosis yang dapat dilalui oleh sel. Pertama adalah jalur
kematian reseptor. Pada jalur ini FaSL terikat pada reseptor ekstra sel sehingga
terbentuk DISC (Death Inducing Signal Complex) yang mampu mengaktifkan
caspase 8. Pada umumnya, jalur ini dilewati oleh sel normal. Kedua adalah jalur
mitokondriayang umumnya diaktifkan oleh stres dilevel seluler.
Sinyal/per-ubahan intraseluler mengakibatkan sitokrom C lepas kedalam sitosol. Sitokrom C
berikatan dengan Apaf-1 dan procaspase-9 membentuk apoptosin dan
meng-aktifasi reaksi lain yang dikatalisis oleh sejumlah enzim caspase(Elmore 2007).
Gambar 5 menunjukkan jalur apoptosis.
Mitokondria
Gambar 5Jalur Apoptosis. Garis putus hijau adalah jalur kematian reseptor, garis putus merah adalah jalur mitokondria (Anonim 2010).
Regulasi apoptosis melibatkan ekspresi gen yang tergabung dalam famili
gen Bcl-2(Elmore, 2007). Famili Bcl-2 diklasifikasikan menjadi dua sub tipe
masing-masing bersifat anti-apoptosis dan famili Bcl-2 yang bersifat
pro-apoptosis. Famili Bcl-2 yang menyandi protein anti apoptosis antara lain terdiri
dari Bcl-2, Bcl-XL
Senyawa oligomer proantosianidin dilaporkan menginduksi apoptosis pada
sel lestari SNU-C4 melalui jalur mitokondria dengan meningkatkan ekspresi gen , Bcl-W, sedangkan famili Bcl-2 yang menyandi protein
proapoptosis beranggotakan antara lain Bax, Bad, Bak dan Bid.Keseimbangan
antara protein pro dan anti apoptosis menentukan sensitivitas sel untuk
berapoptosis.Protein anti-apoptosis berada di membran mitokondria dan berfungsi
menstabilkan integritasnya. Protein pro-apoptosis berada di sitosol dan bertindak
sebagai sensor ketika terjadi kerusakan sel. Bila ada sel rusak, protein berpindah
ke permukaan mitokondria tempat protein anti-apoptosis berada dan membentuk
pori. Interaksi tersebut mengakibatkan protein anti apoptosis kehi-langan
fungsinya sehingga sitokhrom c dapat lepas.
Fase Eksekusi
proapoptosis (Bax) dan menurunkan ekspresi gen antiapoptosis (Bcl-2) (Kim et
al. 2005).Kemampuan serupa pada senyawa lain diantaranya SCFA hasil
fermentasi RS3 masih perlu dieksplorasi.
Proses apoptosis memerlukan koordinasi beberapa jenis aktivitas protein
spesifik. Caspase (Cystein Aspartic Acid Protease) adalah salah satu protein yang
berperan penting pada proses tersebut. Caspase termasuk salah satu anggota
kelompok protease sistein dan disintesis dalam bentuk inaktif (zimogen). Enzim
ini memiliki residu sistein pada sisi aktifnya, memotong substrat pada residu
aspartat. Aktifasi caspase menyebabkan beberapa protein seluler sebagai
substratterpotong sehingga sel tidak berfungsi normal. Protein yang dimaksud
antara lain adalahprotein struktural sitoskeleton dan DNA repair enzyme. Caspase
juga mengaktivasi enzim degradatif DNAase sehingga DNA inti
terfragmentasi(Elmore 2007). Substrat sintetik yang digunakan untuk uji aktifitas
enzim caspase-3di laboratorium adalah tetra peptida
aspartat-glutamat-valin-aspartat (DVED).
2.5.4. Kultur Sel
Kultur sel ialah sel yang diperoleh dari suatu jaringan hewan dan
ditumbuhkan pada medium/lingkungan artifisial yang terkontrol agar sel tetap
hidup dan tumbuh.Ada dua jenis kultur sel yaitu sel primer dan sel lestari. Sel
yang diambil dari jaringan organisme dan dikultur untuk pertama kali dinamakan
kultur sel primer. Sel lestari adalah sel primer yang telah mengalami beberapa
kali sub kultur. Sel lestari sudah tersedia secara komersial.
Berdasarkan sifat tumbuhnya dikenal sel monolayer dan sel suspensi. Sel
monolayer tumbuh melekat pada substrat padat, sedangkan sel supensi tumbuh
mengapung di dalam medium (Ryan 2008). Sel kanker kolon termasuk sel yang
tumbuh secara monolayer. Sel lestari kanker kolon yang sering dikulturkan antara
lain adalah HCT-116, HT-29, Caco-2, RSB, LIM1215, LS174T (Whitehead et al.
1986, Avivi-Green et al. 2002,Hatayama et al. 2007,Kim et al 2007).
Karakteristik molekuler sel lestari asal kolon bervariasi (Tabel 6).
Sel lestari Sifat Pustaka
CCD-12 CoN (asal kolon normal)
tidak ditransformasi Ahn dan Schroeder (2002)
HCT-116 (sel kanker) wild type, COX2 dapat diinduksi, mutasi pada ß-catenin dan ras tetapi p53 normal dan APC normal
Campbell et al. (2006)
HT-29 (sel kanker) APC normal, type II truncation, COX2 konstitutif
Kultur sel (in vitro) sering digunakan dalam riset kanker dengan
pertimbanganfaktor fisiko-kimia dapat dikontrol dan kondisi fisiologis sel dapat
dipertahankan konstan. Sel dapat terpapar dan langsung mengakses reagen (zat)
yang diuji, sehingga kebutuhan sampel yang diuji relatif sedikit. Kultur jaringan
sel lestari juga memiliki keterbatasan diantaranya kadang-kadang kurang stabil,
dan tidak sepenuhnya mampu merepresentasikan kondisi in vivo.
2.5.5. Metoda Analisis Penanda Kanker Kolon 2.5.5.1. Mikroskopi
Mikroskop telah digunakan untuk mengamati morfologisel kolon,
menghitung jumlah sel hidup atau sel mati serta untuk mendeteksi sel apoptosis.
Sel hidup dan sel mati dibedakan dengan bantuan pewarna spesifik seperti
try-phan blue kemudian mengamatinya dibawah mikroskop. Tryphan blue hanya
menembus membran sel yang sudah mati. Jika sel dilarutkan dalam tryphan blue
maka sel mati tampak mengembang dan berwarna biru. Sebaliknya sel hidup
tampak berpendar (Doyle & Griffiths 2000).
Sel apoptosis dideteksi secara mikroskopi dengan bantuan pewarna
flouresen HOECHEST 33258(Kim et al. 2007). Sel dikulturkan pada slide
chamber. Setelah sel melekat pada slide, chamber dibuang dan sel diwarnai. Sel
apoptosis memancarkan cahaya fluoresen. Pewarna HOECHEST 33258
(benza-midin) berikatan dengan pasangan basa A-T dan menghasilkan cahaya
fluoresen.Pewarna etidium bromida-akradin oranye juga digunakan untuk
mendeteksi sel apoptosis. Etidium bromida berikatan dengan DNA terfragmentasi
sedangkan dengan sel tidak apoptosis memancarkan cahaya fluoresen hijau
(Sukardiman et al. 2005).
2.5.5.2. Spektrofotometri
Viabilitas sel dianalisis dengan metoda MTT (3-(4,5-dimetyltiazol,
2il)-2-5-difeniltetrazolium bromida)yang didasarkan pada kemampuan enzim
dehi-drogenase mitokondria mengkonversi substrat MTT (berwarna kuning) menjadi
formazan (berwarna biru, tidak larut air). Intensitas warna formazan diukur
de-ngan spektrofotometer pada panjang gelombang 570 nm (Doyle & Griffths 2000).
Keberadaan enzim caspase-3 dapat dideteksi dengan teknik kolorimetri
maupun fluorometri. Pada metoda kolorimetri, Caspase-3memotong substrat
sintetisAc-DVED-pNA(Acetyl-Asp-Glu-Val-Asp-pNA). Kromofor-p-nitro anilida
(p-NA) yang lepas diukur dengan spektrofotometer pada panjang gelom-bang
405nm. Aktifitas caspase proporsional dengan intensitas warna yang diha-silkan
oleh p-NA.Teknik kolorimetri ini dilaporkan oleh Kim et al. (2005).
Pada metoda fluorometri, enzim caspase-3 memotong substrat sintetis
DEVD yang dikonjugasi dengan molekul fluoresen 7-amino-4-trifluoromethyl
coumarin (AFC). Fluorokhrom yang lepas dideteksi pada panjang gelombang 400
nm (eksitasi) dan 505 nm (emisi).
2.5.5.3. ELISA (Enzyme Linked immunosorbant Assay).
ELISA merupakan salah satu teknik immuno assayyang dipergunakan untuk
menganalisis protein/ekpresi gen (Beck et al. 2002) dan(Kim et al. 2007).
Metoda ELISA pada prinsipnya merupakan aplikasi reaksi spesifik
antigen-antibodi. ELISA dibedakan menjadi tiga jenis yaitu langsung, tidak langsung dan
kompetisi.
Untuk mendeteksi caspase-3, Bender MedSystems mengembangkan kit
komersial ELISA yang termasuk dalam jenis ELISA langsung. Antibodi spesifik
(antibodi I) yaitu, anti humancaspase-3 diikat pada sorben. Anti bodi tersebut
digunakan untuk menangkap antigen caspase-3 yang ada di dalam sampel/standar.
Komplek antigen-antibodi I diikat oleh antibodi pendeteksi (Antibodi II) yang
tersebut direaksikan dengan substrat maka dihasilkan senyawa berwarna yang
intensitasnya diukur dengan bantuan spektrofotometer pada panjang gelombang
tertentu. Teknik ELISA memiliki sensitifitas dan spesifisitas lebih tinggi
dibanding teknik kolorimetri atau fluorometri.
2.5.5.4. Real Time Polymerase Chain Reaction (RT-PCR)
RT-PCR pada dasarnya adalah reaksi amplifikasi DNA dengan enzim
polimerase (PCR: Polymerase Chain Reaction) yang dimonitor dari waktu ke
waktu (real time) dengan bantuan kamera atau detektor. Pewarna fluoresen
(contoh SYBR Green) yang mampu berikatan dengan DNA digunakan untuk
menandai produk amplifikasi. Produk amplifikasi ini diwujudkan dalam suatu
grafik amplifikasi yang menyatakan hubungan antara siklus PCR dengan
intensitas fluoresen. Model matematika dikembangkan untuk menghitung ekpresi
gen (Pfaffl 2001). House keeping gen seperti GAPDH (Glyceraldehyde 3
-Phosphate Dehydrogenase) digunakan untuk menormalisasi gen-gen yang
menjadi target analisis. Aplikasi teknik RT-PCR untuk analisis ekspresi gen-gen
yang berkaitan dengan apoptosis dilaporkan oleh (Nohara et al. 2007; Mbazima et
3. METODOLOGIPENELITIAN 3.1. Tempat dan Waktu
Penelitian dilaksanakandiLaboratorium Balai BesarPenelitian dan Pengembangan Pascapanen di Cimanggu Bogor, Laboratorium Balai Besar Penelitian Tanaman Padi di Sukamandi Subang Jawa Barat dan Laboratorium Mikrobiologi dan Imunologi, Pusat Studi Satwa Primata IPB Lodaya Bogor. Penelitian dimulai pada bulan Januari 2009hingga Desember 2010.
3.2. Bahan
Beras varietas Cisokan diperoleh dari Balai Besar Penelitian Tanaman Padi Suka mandi. Pati sagu (dari batang sagu: aci kirai) dibeli dari unit pengolah sagu rakyat di Sukabumi Jawa Barat. Enzim amilase dan pululanase diperoleh dari distributor NOVO (PT Halim Sakti Pratama, Jakarta). Spesifikasi keduanya dicantumkan dalam Lampiran 1.
Strain bakteri C. butyricum BCC B2571 diperoleh dari Balai Besar Veteriner di Bogor sedangkan strain bakteri E. rectaleDSM 17629 dibeli dari Koleksi Kultur DSM (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH) di Jerman. Sel epitel non kanker VERO diperoleh dari Laboratorium Mikrobiologi dan Imunologi PSSP IPB. Sel ini digunakan pada uji toksisitas sebagai kontrol mewakili sel non kanker. Sel VERO ATCC CCL-81 merupakan sel epitel non kanker. Sel ini berasal dari organ ginjal monyet hijau asal Afrika. Sel lestari asal kanker kolon manusia HCT-116 ATCC CCL-247TMmerupakan donasi dari Stem Cell and Cancer Institute (SCI) Jakarta.
3.3. Metode Penelitian
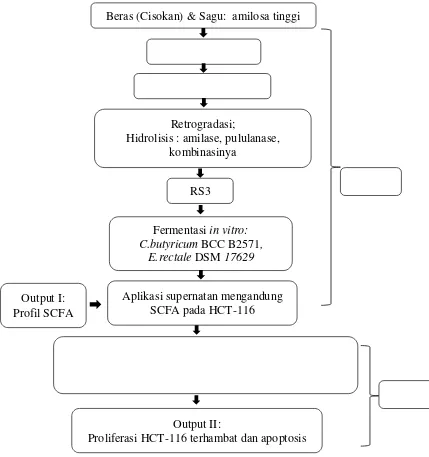
subtrat fermentasi lebih lanjut. Indikatornya adalah konsentrasi butirat >40 mM dengan rasio molar asetat : propionat : butirat sekitar 2 : 1 : 1. Fermentasi (in vitro) dengan substrat potensial dilaksanakan untuk mendapatkan produk fermentasi (supernatan) yang kemudian dipaparkan pada sel HCT-116. Keluaran dari kegiatan berupa sel HCT-116 yang dihambat proliferasinya. Garis besar tahap penelitian dicantumkan dalam Gambar 6.
Gambar 6 Diagram alir penelitian Beras (Cisokan) & Sagu: amilosa tinggi
Retrogradasi;
Hidrolisis : amilase, pululanase, kombinasinya
RS3
Fermentasi in vitro: C.butyricum BCC B2571,
E.rectale DSM 17629
Output I: Profil SCFA
Aplikasi supernatan mengandung SCFA pada HCT-116
Output II:
Proliferasi HCT-116 terhambat dan apoptosis
Ekstraksi
Pati beramilosa tinggi
Analisis:
Hambatan proliferasi, apoptosis ekspresi gen Bax dan Bcl-2 Caspase-3
Tahap I
3. 3.1.Tahap I: Pembuatan RS3 dan Pemanfaatannya sebagai Substrat Fermentasi
3.3.1.1.Produksi RS3
Pati beras diekstrak dengan larutan alkali (Wang &Wang 2004). Tata cara ekstraksi adalah sebagai berikut: tepung beras ditambah dengan larutan NaOH 0,1%, 1 L, diaduk terus-menerus selama 1 jam kemudian disaring dengan 2 lapis kain saring. Filtrat dikumpulkan, disentrifugasi 1500 g,4oC selama 7 menit. Supernatan dibuang, endapan bagian atas (protein) dipisahkan dari endapan bagian bawah (pati). Fraksi pati ditambah NaOH 0,1% 1 L kemudian diperlakukan dengan cara yang sama. Fraksi pati disuspensikan dengan akuades (250 mL) kemudian dinetralkan dengan HCl 1 M dan disentrifugasi. Endapan dibilas satu kali lagi dengan cara yang sama kemudian endapan pati dikeringkan di dalam oven 40o
Pati beras atau sagu diproses menjadi RS3 mengikuti cara yang diuraikan oleh Kim et al. (2003)dengan sedikit modifikasi. Secara ringkas prosedurnya adalah sebagai berikut: pati (50 g) disuspensikan dalam 200 mL akuades, dipanaskan (100
C selama kurang lebih 18 jam. Pati digiling halus kemudian disimpan hingga digunakan. Sedangkan pati sagu hanya dicuci ulang (tiga kali) dan dikeringkan kemudian disimpan hingga digunakan.
o
C, 10 menit), diautoklaf (121oC, 15 Psi, 1jam) dan disimpan pada suhu 4oC selama 12-14 jam untuk menginduksi retrogradasi. Pati retrogradasi disuspensikan dalam 1 L akuades dan dihidrolisis dengan enzim. Perlakuan berikut diterapkan pada pati sagu maupun pati beras: (a) 106unitamilase/g substrat, 1 jam, 85oC, (b) 4500 unit pululanase/g substrat , 3 jam, 55oC, (c) 106amilase/g substrat, 1 jam, 85oC dilan-jutkan dengan 4500 unit pululanase/g substrat, 3 jam, 55oC. Hidrolisat dipisahkan dengan bantuan sentrifugasi (1500 g), endapan dikumpulkan dan disimpan pada suhu 10oC selama 16-18 jam. Endapan disuspensikan dalam akuades dan dihomogenkan kemudian dikeringkan dengan pengering semprot yang memiliki suhu inlet 160oC.
Kadar air, abu, protein dan mineral di dalam pati sagu dan beras dianalisis dengan metode standar (AOAC 2006), sedangkan kadar amilosa pati dianalisis menggunakan metoda kolorimeteri (Juliano 1971).
3.3.1.3. Analisis Kadar RS
Kadar RS3 dianalisis menurut metoda Goni et al. (1996). Contoh (50 mg) didispersikan di dalam 5 ml larutan KCl-HCl pH 1,5 dan diinkubasi dengan 4400 unit larutan pepsin pada suhu 40o
Bufer tris maleat 0,1 MpH 6.9 (4.5 mL) ditambahkan ke dalam campuran con-toh dan diinkubasi dengan amilase (100 unit) selama 16 jam pada suhu 37
C selama 1 jam untuk menghilangkan protein.
o
C untuk menghidrolisis pati tercerna. Contoh kemudian disentrifugasi (1000 g, 15 menit) sebanyak dua kali. Supernatan dibuang sedangkan endapan dibasahi dengan 1,5 mLakuades dan dilarutkan dengan 1,5 mL KOH 4M. Larutan RS dicampur dengan 2 M HCl dan bufer sodium asetat (0,4M) pH 4,75, kemudian diinkubasi dengan 100 unitlarutan amiloglukosidase pada 55oC selama 45 menit. Contoh disentrifugasi (1000 g selama 15 menit) dan supernatannya dikumpulkan. Glukosa dalam supernatan diukur dengan metoda phenol-asam sulfat (Dubois et al. 1956). RS dihitung sebagai glukosa x 0,9 dan dinyatakan dalam persen terhadap berat contoh awal.
3.3.1.4. Fermentasi (in vitro)
Bakteri (keadaan liofilisasi) diaktifkan. SelanjutnyaC. butyricumBCC B2571 dipelihara dalam mediaReinforced Clostridia Media (RCM), dan E. rectaleDSM 17629 dalam mediaPeptone Yeast-extract Glucose (PYG) (Lampiran 2). Kultur disegarkan secara berkala.
Botol serum diisi 20 ml media RCM atau PYG dengan sumber karbon berupa 1% RS3 dan 0,5% glukosa. Botol ditutup dengan septum karet kemudian disterilkan (121oC, 15 menit). Media diinokulasi dengan kultur stok (109 koloni/mL dan berada pada fase log) dibawah aliran gas CO2, diinkubasi pada suhu 37oC selama 48 jam.
akhir fermentasi, sel bakteri dipisahkan dengan sentrifugasi dan supernatan dikumpulkan.
3.3.1.5. Pengukuran Aktivitas Amilolitik pada Media Berpati
Degradasi pati oleh C.butyricum BCC B2571 atau E.rectale DSM 17629 diketahui dengan mengukur luas zona bening pada cawan agar yang disuplementasi dengan RS3 (0,2%). C.butyricum BCC B2571 atau E.rectale DSM 17629 (30 µ L) ditransfer ke dalam “sumur” yang ada pada cawan agar. Cawan kemudian diinkubasi di dalam anaerobic jar pada 37 oC selama 48 jam. Zona bening visualisasi dengan meneteskan larutan I2-KI kemudian luasnya diukur.
3.3.1.6. Pengukuran Gas dan pH
Gas yang dihasilkan di dalam botol fermentasi diukur volumenya dengan cara mengalirkan gas ke dalam syringe. Alat pH meter digunakan untuk mengukur pH media pada akhir fermentasi.
3.3.1.7. Analisis Asetat, Propionat dan Butirat
Media fermentasi disentrifugasi (3000 g selama 10 menit). Supernatan disaring dengan membran 0,22 m. Contoh (1 l)diinjeksikan ke instrumen khromatografi gas (Agilent Technologist, 7890A GC System) yang dilengkapi dengan flame ionization detector(FID) dan kolom HP Innowax 19091-136 coloum (60 m x 0.250 mm). Gas pembawa berupa helium berkecepatan 1,8 ml/menit, dan rasio split 40:1. Oven diatur pada suhu 90oC selama 0,5 menit, kemudian dinaikkan secara bertahap menjadi 110oC dengan kecepatan 10oC/menit, meningkat ke 170oC dengan kecepatan 5oC/menit dan akhirnya menjadi 210oC dengan kecepatan 20oC/menit. Suhu injektor dan detektor adalah 275oC. Campuran SCFA terdiri dari asetat, propionat dan butirat pada konsentrasi bervariasi dari 10 mM hingga 50 mM digunakan sebagai standar.