PENYAKIT MOSAIK PADA TANAMAN NILAM DAN
IDENTIFIKASI
Telosma mosaic virus
YANG
BERASOSIASI SERTA PENGENDALIANNYA
RITA NOVERIZA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi Penyakit Mosaik pada Tanaman Nilam dan Identifikasi Telosma mosaic virus yang Berasosiasi serta Pengendaliannya adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya ini kepada Institut Pertanian Bogor.
Bogor, Januari 2013
Rita Noveriza
RITA NOVERIZA. Penyakit Mosaik pada Tanaman Nilam dan Identifikasi
Telosma mosaic virus yang Berasosiasi serta Pengendaliannya. Dibimbing oleh GEDE SUASTIKA, SRI HENDRASTUTI HIDAYAT, dan UTOMO KARTOSUWONDO.
Minyak nilam (patchouli alcohol) yang dihasilkan oleh tanaman nilam (Pogostemon cablin Benth) merupakan salah satu bahan baku parfum multifungsi yang bernilai tinggi. Namun, didalam proses budidaya dan pengembangan komoditas nilam ini terkendala oleh serangan Organisme Pengganggu Tanaman terutama penyakit. Beberapa penyakit penting nilam yang saat ini sudah tersebar di Indonesia yaitu budok, layu bakteri, penyakit yang ditimbulkan akibat nematoda, penyakit akar putih dan bercak daun dan penyakit mosaikyang disebabkan oleh virus.
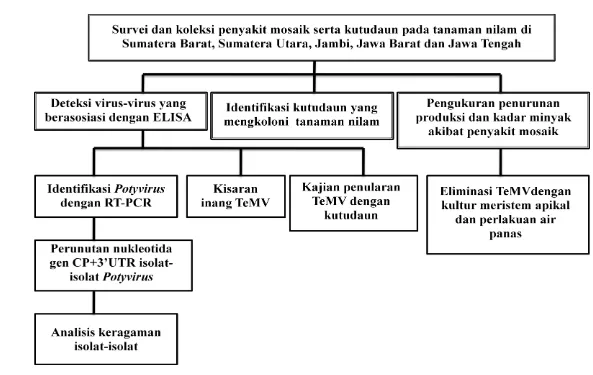
Penelitian ini bertujuan (1) untuk memetakan keberadaan penyakit mosaik pada pertanaman nilam di daerah sentra produksi nilam Indonesia, (2) untuk mengukur penurunan produksi tanaman nilam akibat penyakit mosaik, (3) untuk mengidentifikasi virus-virus yang berasosiasi dengan penyakit mosaik, (4) untuk mengidentifikasi spesies kutudaun yang mengkoloni tanaman nilam di lapangan, (5) untuk mengidentifikasi dan mengkarakterisasi secara molekuler virus yang berasosiasi dengan penyakit mosaik pada tanaman nilam, (6) untuk menganalisis keragaman genetik virus mosaik isolat nilam, (7) untuk mengetahui kisaran inang virus yang menginduksi gejala mosaik pada tanaman nilam, (8) untuk mengetahui hubungan kutudaun yang mengkoloni tanaman nilam dengan penyakit mosaik, dan (9) untuk mendapatkan bibit nilam bebas virus dengan metode kultur meristem apikal dan perendaman air panas.
Penelitian ini dilakukan melalui survei penyakit di lapangan, percobaan di rumah kaca dan laboratorium, yang terdiri atas: (1) determinasi karakter biologi virus pada tanaman nilam, meliputi: a) pengamatan kejadian penyakit dan keragaman gejala virus pada tanaman nilam di beberapa daerah sentra produksi nilam, b) deteksi virus yang berasosiasi dengan penyakit mosaik secara serologi, c) respon tanaman indikator terhadap infeksi virus, dan d) kajian penularan virus dengan serangga vektor kutudaun; (2) kajian pengaruh infeksi virus terhadap kuantitas dan kualitas beberapa varietas nilam; (3) determinasi karakter molekular
Potyvirus, meliputi: penentuan keragaman molekular Potyvirus isolat Indonesia, meliputi: ekstraksi RNA, amplifikasi DNA (RT-PCR), perunutan fragmen gen
coat protein (CP) Potyvirus, dan analisis filogenetika; dan (4) pembebasan virus dari tanaman nilam yang terinfeksi melalui kultur meristem apikal dan perendaman setek dalam air panas.
Hasil penelitian menunjukkan bahwa penyakit mosaik ditemukan terdapat di seluruh sentra produksi nilam di Jawa dan Sumatera. Penurunan produksi terna basah, terna kering, kadar minyak dan patchouli alcohol nilam akibat penyakit ini pada panen pertama berturut-turut mencapai 35%, 40%, 9% dan 5%. Dua spesies kutudaun yaitu Aphis gossypii Glover dan Brachycaudus sp. ditemukan mengkoloni tanaman nilam di seluruh lokasi survei. Berdasarkan uji serologi,
genom Potyvirus mengungkapkan bahwa spesies Potyvirus tersebut adalah
Telosma mosaic virus (TeMV). Virus ini pertama kalinya dilaporkan keberadaannya di Vietnam pada tahun 2008 dan menyebabkan penyakit mosaik pada tanaman Telosma cordata. Saat ini ditemukan menyebabkan penyakit mosaik pada tanaman nilam di Indonesia. Virus ini sangat cepat menyebar ke seluruh pertanaman nilam di Indonesia karena tanaman nilam diperbanyak melalui setek.
Teknik kultur meristem apikal berpotensi menghasilkan bibit nilam bebas virus. Eliminasi TeMV pada tiga varietas tanaman nilam (Sidikalang, Lhokseumawe, Tapak Tuan) telah berhasil dilakukan dengan menggunakan teknik kultur meristem apikal. Pada varietas Lhokseumawe, berhasil didapatkan tanaman bebas virus mencapai 90.9% dengan ukuran meristem apikal 0.5-1 mm; dan kemudian diikuti oleh varietas Sidikalang dan Tapak Tuan yang berturut-turut sebesar 66.7% dan 33.3%. Namun, perendaman setek batang nilam pada air panas yang bersuhu 50-60⁰C belum mampu mengeliminasi TeMV yang menginduksi gejala mosaik pada tanaman nilam, tetapi dapat memperlambat munculnya gejala. Suhu air panas yang terlalu tinggi mempengaruhi pertumbuhan setek nilam. Daya tumbuh setek ketiga varietas nilam yang direndam pada suhu 50⁰C mencapai kisaran 42.9–90.9%.
RITA NOVERIZA. Telosma mosaic virus associated with mosaic disease of patchouli plant: Identification and Control Approach. Under direction of GEDE
SUASTIKA, SRI HENDRASTUTI HIDAYAT, and UTOMO
KARTOSUWONDO.
Patchouli oil (patchouli alcohol) produced by patchouli plant (Pogostemon cablin Benth.) is one of the raw materials of high value multifunctional perfume. However, in the process of cultivation and development of this commodities are attacked by plant pest organisms, especially diseases. Some important diseases of patchouli, which is now spread in Indonesia, namely budok, bacterial wilt, diseases caused by nematodes and viruses.
This study aimed (1) to map the presence of mosaic disease on patchouli plantation in patchouli production centers of Indonesia, (2) to measure product reduction of patchouli plants due to mosaic disease, (3) to identify viruses associated with mosaic disease, (4) to identify aphid species found colonizing patchouli plants in the field, (5) to molecularly characterize viruses associated with mosaic disease on patchouli, (6) to analyze the genetic diversity among
Telosma mosaic virus (TeMV) isolated from patchouli, (7) to determine the host range of TeMV, (8) to determine the relationship of the aphids colonizing patchouli plants with mosaic disease, and (9) to obtain virus-free patchouli seedling by apical meristem culture method and hot water treatment.
The results show that the mosaic disease was found in all patchouli production areas of Java and Sumatra and two species of aphids, i.e. Aphis gossypii Glover and Brachycaudus sp. were found colonizing patchouli plants in all survey locations. Due to the mosaic disease, reduction of fresh herbs weight, dry herbs weight, oil content and the patchouli alcohol of patchouli in the first harvest was reached 35%, 40%, 9% and 5%, respectively. Based on the serological test, Potyvirus was found predominantly associated with the mosaic symptoms. Further identification based on nucleotide sequence of coat protein gene revealed that the species of Potyvirus is Telosma mosaic virus (TeMV). Host range and aphid transmission evaluation confirmed the association of Potyvirus
with mosaic disease. This paper is the first report of occurence of TeMV in Indonesia. This virus will be easily to spread to any areas because patchouli plants are propagated by stem cuttings. In this study, a technique was also developed to produce virus-free cutting using apical meristem culture and hot water treatment on stem cutting. The patchouli plant has been propagated from apical meristem culture of 0.5-1 mm in sizes yielded 33.3-90.9% virus-free plants. Submersion of patchouli stem cutting in hot water of 50-60⁰C for 10-30 minutes could not eliminated TeMV. Apical meristem culture technique is potential to produce virus-free cutting of patchouli.
Hak Cipta Milik Institut Pertanian Bogor, tahun 2013
Hak cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tidak merugikan kepentingan yang wajar IPB
PENYAKIT MOSAIK PADA TANAMAN NILAM DAN
IDENTIFIKASI
Telosma mosaic virus
YANG
BERASOSIASI SERTA PENGENDALIANNYA
RITA NOVERIZA
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Sub Program Studi Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi
Ujian Tertutup : Dr. Ir. Supramana, MSi
(Staf Pengajar Departemen Proteksi Tanaman, Fakultas Pertanian IPB)
: Dr. Ir. Muhamad Djazuli
(Staf Peneliti Balai Penelitian Tanaman Rempah dan Obat-Litbang Pertanian, Bogor)
Ujian Terbuka : Dr. Ir. Kikin Hamzah Mutaqin, MSi
(Staf Pengajar Departemen Proteksi Tanaman, Fakultas Pertanian IPB)
: Dr. Ir. Sedyo Hartono
Puji syukur penulis ucapkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian adalah Penyakit Mosaik pada Tanaman Nilam dan Identifikasi
Telosma mosaic virus yang Berasosiasi serta Pengendaliannya.
Pada kesempatan ini penulis menyampaikan penghargaan dan terima kasih kepada Dr. Ir. Gede Suastika, M.Sc. selaku ketua komisi pembimbing, Prof. Dr. Ir. Utomo Kartosuwondo, M.S dan Dr. Ir. Sri Hendrastuti Hidayat, M.Sc. selaku anggota komisi pembimbing atas arahan dan bimbingan selama pelaksanaan penelitian dan serta segala kesabaran, kritik, saran dan dukungan moral yang sangat besar peranannya dalam terselesaikannya disertasi ini.
Terima kasih disampaikan kepada Pimpinan Badan Litbang Pertanian beserta Jajaran atas penunjukan sebagai petugas belajar dan biaya yang diberikan. Terima kasih disampaikan kepada Pimpinan dan seluruh Staf Departemen Proteksi Tanaman, Fakultas Pertanian, IPB, Laboratorium Virologi Tumbuhan dan Laboratorium Taxonomi Serangga atas segala bantuan fasilitas dan penggunaan alat. Terima kasih dan penghargaan disampaikan kepada Prof. Keiko T. Natsuaki atas segala bantuan fasilitas dan penggunaan alat di laboratorium
Tropical Plant Protection, Department of International Agricultural Development
di Tokyo University of Agriculture, Jepang. Terima kasih juga kepada teman-teman seperjuangan di Forum Wacana Entomologi/Fitopatologi, teman-teman-teman-teman di Forum Komunikasi Petugas Belajar Badan Litbang Pertanian-IPB atas dukungannya kepada penulis. Penulis juga menyampaikan rasa terima kasih dan penghargaan kepada teman-teman di Laboratorium Virologi Tumbuhan IPB, serta adik-adik mahasiswa S1.
Terima kasih disampaikan juga kepada Pimpinan Balai Penelitian Tanaman Rempah dan Obat (Balittro) berserta jajarannya dan Ketua Kelompok Peneliti Hama dan Penyakit Balittro atas segala bantuan dan fasilitas serta penggunaan alat. Rasa terima kasih dan penghargaan, penulis sampaikan kepada Bapak dan Ibu serta teman-teman sejawat di Laboratorium Penyakit Balittro atas bantuan, dukungan moral dan semangat kepada penulis.
Ucapan terima kasih kepada suami, Mendrizal Zaini atas doa, pengorbanan, pengertian, ketabahan dan dorongan semangat yang tiada pernah putus. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Akhirnya, penulis berharap semoga karya ilmiah ini memberikan manfaat bagi kita semua.
Bogor, Januari 2013
Halaman
DAFTAR TABEL xiii
DAFTAR GAMBAR xiv
DAFTAR LAMPIRAN xvi
I. PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian 3
Hipotesis 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 4
Alur Penelitian 5
Daftar Pustaka 6
II. TINJAUAN PUSTAKA
Nilam (Pogostemon cablin Benth.) 8
Sejarah dan Perkembangan Tanaman Nilam 8
Mutu Minyak Nilam 10
Virus pada Tanaman Nilam dan Gejalanya 11
Virus-Virus yang Menginfeksi Tanaman Nilam 11
Gejala Infeksi Virus pada Tanaman Nilam 12
Karakter Biologi Potyvirus pada Tanaman Nilam 12
Bentuk Partikel dan Genom Potyvirus 12
Kisaran Inang Potyvirus pada Tanaman Nilam 12 Penyebaran dan Penularan Potyvirus pada Tanaman Nilam 12 Deteksi Molekular Potyvirus pada Tanaman Nilam 13
Akibat Infeksi Virus pada Tanaman Nilam 13
Strategi Pengendalian Virus pada Tanaman Nilam 14 Eliminasi Virus dengan Kultur Apikal Meristem 14 Eliminasi Virus dengan Perlakuan Air Panas 14 Varietas Nilam Tahan terhadap Infeksi Virus 15
Daftar Pustaka 16
III. PENYAKIT MOSAIK PADA PERTANAMAN NILAM DAN VIRUS-VIRUS YANG BERASOSIASI
Abstrak 20
Abstract 20
Pendahuluan 21
Bahan dan Metode 21
Hasil dan Pembahasan 24
Simpulan 30
Abstrak. 32
Abstract 32
Pendahuluan 33
Bahan dan Metode 34
Hasil dan Pembahasan 36
Simpulan 41
Daftar Pustaka 42
V. KISARAN INANG DAN PENULARAN TeMV ASAL NILAM
Abstrak 44
Abstract 44
Pendahuluan 45
Bahan dan Metode. 46
Hasil dan Pembahasan 47
Simpulan 51
Daftar Pustaka 51
VI. ELIMINASI TeMV PENYEBAB PENYAKIT MOSAIK PADA TANAMAN NILAM DENGAN KULTUR MERISTEM APIKAL DAN PERLAKUAN AIR PANAS
Abstrak 53
Abstract 53
Pendahuluan 54
Bahan dan Metode 55
Hasil dan Pembahasan 57
Simpulan 62
Daftar Pustaka 62
VII. PEMBAHASAN UMUM 66
VIII. SIMPULAN UMUM DAN SARAN 70
DAFTAR PUSTAKA 71
Halaman 2.1 Produksi terna kering, kadar minyak, produksi minyak, dan kadar
patchoulialcohol
9
2.2 Deskripsi 3 varietas tanaman nilam 10
2.3 Karakteristik mutu minyak 3 varietas nilam 11 3.1 Frekuensi infeksi virus pada sampel tanaman nilam dengan gejala
mosaik dari lokasi yang berbeda berdasarkan metode ELISA 25 3.2 Tingkat kejadian infeksi virus di pertanaman di daerah
pengambilan sampel di sentra produksi nilam di Indonesia 26 3.3 Penurunan bobot terna basah dan berat terna kering dari tiga
varietas nilam akibat penyakit mosaik pada pengukuran 6 bulan
setelah tanam 27
3.4 Penurunan kadar minyak (%) dan kadar patchouli alcohol (%) dari tiga varietas nilam yang terserang penyakit moaik pada
pengukuran 6 bulan setelah tanam 27
3.5 Kepadatan populasi kutudaun pada beberapa daerah sentra
budidaya tanaman nilam di Indonesia 28
4.1 Fungsi sepuluh protein yang terdapat dalam struktur genom
Potyvirus 34
4.2 Daftar virus-virus (Potyvirus) yang digunakan untuk analis sikuen
nukleotida 37
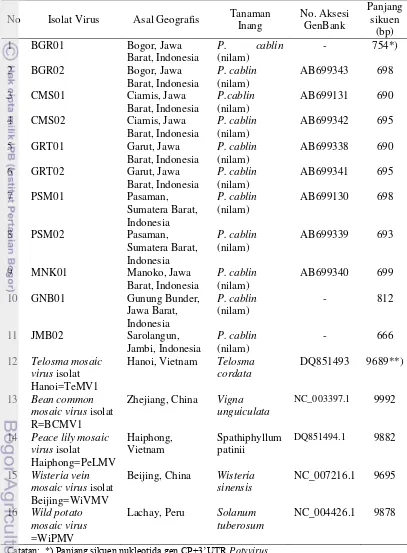
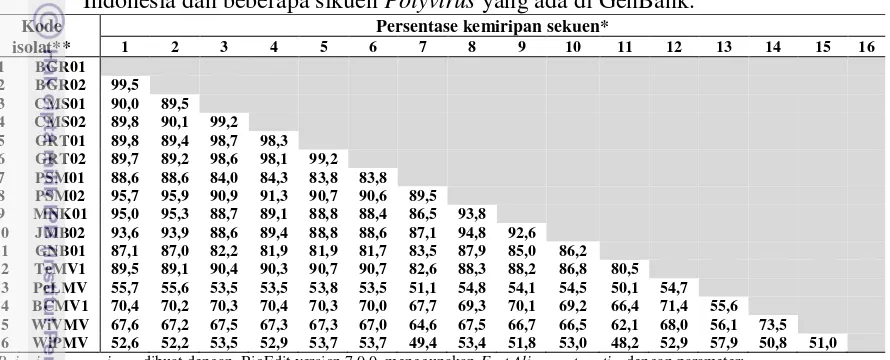
4.3 Persentase kemiripan sikuen nukleotida (623 bp) sebagian protein selubung (CP) dan 3‟UTR Potyvirus yang menginduksi gejala mosaik pada nilam dari Indonesia dan beberapa sikuen Potyvirus
ada di GenBank 38
4.4 Tingkat kesamaan 11 isolat Potyvirus asal nilam terhadap
Telosma mosaic virus (DQ851493) berdasarkan sikuen nukleotida dan asam amino gen CP serta nukleotida daerah
3‟UTR 40
5.1 Respon berbagai tanaman indikator terhadap infeksi Potyvirus
asal tanaman nilam 48
6.1 Kondisi pertumbuhan kultur jaringan nilam (varietas Sidikalang, Lhokseumawe, dan Tapak Tuan) asal meristem apikal dan batang
terminal pada media MS yang ditambah BAP 0.5 mg/l 57 6.2 Persentase tanaman nilam hasil kultur jaringan meristem apikal
Halaman 1.1 Alur penelitian penyakit mosaik pada tanaman nilam dan
identifikasi Potyvirus yang berasosiasi serta pengendaliannya 5 2.1 Nilam Jawa (Sumber: Hadipoentyanti) dan Nilam Aceh yaitu
Sidikalang, Lhokseumawe dan Tapak Tuan (Sumber: Nuryani,
2005) 9
2.2 Kalus dan tunas Nilam (Sumber: Amalia et al. 2008) 15 3.1 Karakter morfologi kutudaun tidak bersayap (aptera) yang
diamati untuk kunci identifikasi: (A) kepala, (B) kauda dan (C)
sifunkulus 24
3.2 Variasi gejala mosaik pada daun tanaman nilam yang dikoleksi dari sentra produksi tanaman nilam di Indonesia: (A) dan (B) sampel daun nilam dari Kecamatan Bogor Barat-Bogor, (C) dari Cidolog-Ciamis, (D) Pakenjeng-Garut, (E) Kinali-Pasaman Barat yang terinfeksi Potyvirus, (F) Cicurug-Sukabumi yang terinfeksi
Fabavirus (BBWV1), (G) Manoko-Bandung yang terinfeksi
Potyvirus, (H) Singkut-Sarolangun,Jambi yang terinfeksi
Potyvirus dan Fabavirus, (I) dari Kecamatan Salem-Brebes yang
terinfeksi Fabavirus (BBWV2), dan (J) tanaman nilam sehat 25 3.3 Bentuk partikel Potyvirus isolat asal Bogor yang diamati dengan
mikroskop elektron. Panjang partikel virus berkisar 350-2 400 nm
(rata-rata dari 40 partikel) dengan rata-rata 914 nm 26 3.4 Preparat mikroskopi Aphis gossypii: A. A. gossypii dewasa aptera.
B. Kepala (tanda panah). C. Kauda (tanda panah) dan
Brachycaudus sp: D. Brachycaudus sp dewasa aptera. E. Kepala
(tanda panah). F. Kauda (tanda panah) 28
4.1 Genom Potyvirus (~ 10 kb). Tanda panah no. 1 adalah posisi
primer CPUP dan tanda panah no. 2 adalah primer CP9502 35 4.2 Visualisasi fragmen DNA dari produk RT-PCR menggunakan
primer degenerate spesifik coat protein (CP) dan 3‟UTR (CPUP&CP9502) pada elektroforesis gel agarose 1%. M= DNA marker100 bp; (1) kontrol negatif; (2) kontrol positif Potyvirus
(ChiVMV); (3) sampel daun dari Pasaman; (4) Ciamis; (5) Garut; (6) Bogor; (7) Manoko; (8) Cicurug; (9) Gunung Bunder; dan
(10) Jambi 36
4.3 Pohon filogeni Potyvirus yang menginfeksi tanaman nilam di Indonesia [CMS01, CMS02, GRT01, GRT02, BGR01, BGR02, PSM01, PSM02, JMB02, GNB01 dan MNK01] dan hubungannya dengan anggota kelompok Potyvirus lainnya [Telosma mosaic virus (TeMV1), Bean common mosaic virus
isolat R (BCMV1), Peace lily mosaic virus isolat Haiphong (PeLMV), Wisteria vein mosaic virusisolat Beijing (WiVMV),
Wild potato mosaic virus (WiPMV)]. Analisa didasarkan pada metoda Neighbor Joining dengan nilai ulangan bootstrapnya
GRT02, PSM01, PSM02, JMB02, GNB01 dan MNK01] dengan beberapa gen CP Potyvirus [Telosma mosaic virus (TeMV1),
Bean common mosaic virus isolat R (BCMV1), Peace lily mosaic virus isolat Haiphong (PeLMV), Wisteria vein mosaic virus
isolat Beijing (WiVMV),Wild potato mosaic virus (WiPMV),
Turnip mosaic virus (TuMV1), Potato virus Y (PVYgp), dan
Plum pox virus (PPVgp)] dari GenBank. Area konservasi tinggi
pada gen CP Potyvirus (warna merah) 40
5.1 Persentase infeksi TeMV yang ditularkan oleh Aphis gossypii
pada beberapa tingkat periode puasa pra-akuisisi pada 50 hari
setelah inokulasi (HSI) 48
5.2 Persentase infeksi TeMV yang ditularkan oleh Aphis gossypii
pada beberapa tingkat periode waktu makan inokulasi pada 50
hari setelah inokulasi (HSI) 49
6.1 Pertumbuhan tunas meristem apikal dan batang terminal nilam (9 minggu setelah transplan) pada media MS yang ditambah BAP 0.5 mg/l: A.varietas Sidikalang, B. varietas Lhokseumawe, C. varietas Tapak Tuan. Sebagai pembanding adalah varietas
Sidikalang yang berasal dari eksplan batang terminal (D) 58 6.2 Daya tumbuh dan tinggi setek batang nilam varietas Sidikalang,
Lhokseumawe dan Tapak Tuan setelah perlakuan perendaman air panas pada tiga tingkat suhu (A= 50⁰C, B= 55⁰C, C= 60⁰C) dan tiga tingkat waktu perendaman (1= 10 menit, 2= 20 menit, 3= 30 menit). Sebagai pembanding adalah setek batang nilam tanpa perlakuan air panas (K). Pengukuran dilakukan 2 bulan setelah
Halaman 1. Susunan nukleotida (683 bp) sebagian gen protein selubung (CP)
dan 3‟UTR Potyvirus asal tanaman nilam di Indonesia [BGR01, BGR02, CMS01, CMS02, GRT01, GRT02, PSM01, PSM02, JMB02, GNB01 dan MNK01], beberapa Potyvirus [Telosma mosaic virus (TeMV1), Bean common mosaic virus isolat R (BCMV1), Peace lily mosaic virus isolat Haiphong (PeLMV),
Wisteria vein mosaic virus isolat Beijing (WiVMV), dan Wild
potato mosaic virus (WiPMV)] dari GenBank 81 2. Susunan nukleotida (249 bp) daerah 3‟UTR Potyvirus asal
tanaman nilam di Indonesia [BGR01, BGR02, CMS01, CMS02, GRT01, GRT02, PSM01, PSM02, JMB02, GNB01 dan MNK01]
I.
PENDAHULUAN
Latar Belakang
Tanaman nilam (Pogostemon cablin Benth.) merupakan salah satu tanaman penghasil minyak atsiri yang penting, menyumbang devisa lebih dari 50% total ekspor minyak atsiri Indonesia. Indonesia merupakan pemasok minyak nilam terbesar dipasaran dunia dengan kontribusi 80-90%. Ekspor Indonesia berfluktuasi dengan laju peningkatan ekspor sekitar 12% per tahun atau kisaran antara 700 dan 2 800 ton minyak nilam per tahun. Sementara itu, kebutuhan dunia berkisar 1 200-1 500 ton dengan pertumbuhan 5% per tahun (PDIP 2010).
Sebagian besar produk minyak nilam diekspor untuk dipergunakan dalam industri parfum, kosmetik, antiseptik dan insektisida (Dummond 1960, Robin 1982, Mardiningsih et al. 1995). Dengan berkembangnya pengobatan dengan aromaterapi, minyak nilam juga menjadi salah satu pilihan bahan aromaterapi, karena diketahui bermanfaat untuk penyembuhan fisik maupun mental. Selain itu, minyak nilam juga digunakan sebagai bahan fiksatif (mengikat minyak atsiri lainnya) yang sampai sekarang belum ada produk substitusinya (Ibnusantoso 2000).
Di Indonesia terdapat tiga jenis nilam (Pogostemon cablin Benth.) yang dibedakan dari karakter morfologi, kandungan dan kualitas minyak serta ketahanan terhadap cekaman lingkungan biotik dan abiotik. Jenis nilam tersebut adalah nilam Aceh, nilam Kembang dan nilam Jawa atau Sabun. Varietas unggul nilam yang dihasilkan Balai Penelitian Tanaman Rempah dan Obat yang dikembangkan dari jenis nilam Aceh adalah Tapak Tuan (unggul dalam hal produksi dan kadar patchouli alcohol), Lhokseumawe (kadar minyaknya tinggi), dan Sidikalang (agak tahan terhadap penyakit layu bakteri dan nematoda) (Nuryani, 2005).
Pertanaman nilam di Indonesia diusahakan oleh petani yang tersebar di 12 propinsi, sekitar 50% berada di Sumatera (Nanggroe Aceh Darussalam (NAD), Sumatera Utara, Sumatera Barat, Riau, Jambi, Sumatera Selatan, Bengkulu dan Lampung) dan 50% lainnya berada di Jawa (Jawa Barat, Jawa Tengah, DI Yogyakarta dan Jawa Timur). Akhir-akhir ini tanaman nilam juga dikembangkan di Kalimantan Tengah (Barani 2008). Pada tahun 1998-2008, luas areal pertanaman nilam meningkat pesat dengan rata-rata peningkatan sebesar 12.98%. Bahkan pada tahun 2002 terjadi peningkatan luas areal nilam mencapai 139.79% dibandingkan tahun sebelumnya (PDIP 2010). Namun peningkatan luas areal ini tidak sejalan dengan perkembangan produktivitas nilam.
Salah satu faktor penyebab penurunan produktivitas tanaman nilam karena adanya infeksi patogen penyebab penyakit. Beberapa penyakit penting nilam yang saat ini sudah tersebar di Indonesia yaitu budok, layu bakteri, penyakit yang ditimbulkan akibat nematoda, akar putih dan bercak daun (Nurawan 2008), dan penyakit mosaik yang disebabkan oleh virus (Sukamto et al. 2007).
Tanaman nilam di Jepang dan Taiwan, dilaporkan terinfeksi oleh
Patchouli mild mosaic virus (PaMMV) genus Fabavirus, Patchouli motle virus
(PaMoV) genus Potyvirus (Natsuaki et al. 1994) dan di Brazil diinfeksi oleh
Patchouli virus X (PatVX) genus Potexvirus (Meissner Filho et al. 2002) dan
Tobacco necrosis virus (TNV) genus Necrovirus (Gama et al. 1982); sedangkan di India diinfeksi oleh Peanut stripe virus (PStV) genus Potyvirus (Singh et al. 2009). Tanaman nilam di Indonesia (daerah Bogor dan Cianjur) dilaporkan terinfeksi oleh virus yang termasuk golongan Potyvirus dan CMV, tetapi tidak terinfeksi Potexvirus (Sukamto et al. 2007). Menurut hasil penelitian Hartono (2008), tanaman nilam di Jawa Tengah juga terinfeksi oleh Bean common mosaic virus (BCMV) strain Peanut stripe virus (PstV).
Di India, kejadian penyakit mosaik pada tanaman nilam mencapai 76% (Sastry dan Vasanthakumar 1981). Sedangkan di Indonesia dilaporkan bahwa kejadian penyakit mosaik berkisar antara 53-73%. Penyakit ini tersebar baik pada pertanaman nilam didataran rendah maupun pergunungan (Sumardiyono et al. 1995). Penyakit mosaik juga ditemukan pada pertanaman nilam Kembang (P.
heyneanus Benth.) di Jawa Tengah dengan intensitas penyakit sangat tinggi (Sumardiyono 1991). Berdasarkan hasil penelitian Sugimura et al. (1995), PaMMV (Fabavirus) dan PaMoV (Potyvirus) dapat menurunkan produksi tanaman nilam sebesar 35% dan kadar patchoulialcohol sebesar 2%.
Fabavirus dan Potyvirus adalah kelompok virus yang secara alami dapat ditularkan dan disebarkan oleh kutudaun (Hampton et al. 2005). Namun demikian, cara penyebaran utama virus tersebut yang terjadi di lapangan adalah melalui bahan tanaman yang terinfeksi. Hal ini menyebabkan tingginya kejadian penyakit mosaik pada tanaman nilam di daerah-daerah sentra produksi nilam di Indonesia (Sastry dan Vasanthakumar 1981, Hartono dan Subandiyah 2006) sehingga penggunaan bibit yang sehat menjadi sangat penting dalam pengendalian virus pada tanaman nilam. Bila menggunakan bahan tanaman yang bebas dari infeksi virus sebagai sumber bibit, diharapkan tanaman yang dibudidayakan dapat berproduksi sesuai potensi genetiknya. Untuk mendapatkan tanaman bibit yang bebas virus perlu dilakukan usaha eliminasi virus dari tanaman terinfeksi. Pada berbagai jenis tanaman dilaporkan telah berhasil dilakukan eliminasi virus melalui beberapa metode, diantaranya kultur meristem (Singh et al. 2009), perlakuan pemanasan (Damayanti et al. 2010), dan penggunaan antiviral sintetik (Budiarto
et al. 2008).
dilakukan dalam usaha untuk mengetahui virus dominan yang menginfeksi tanaman nilam dan usaha untuk mendapatkan teknik pengendaliannya.
Tujuan Penelitian
Penelitian ini mempunyai beberapa tujuan, sebagai berikut:
1. Memetakan keberadaan penyakit mosaik pada pertanaman nilam di daerah sentra produksi nilam di Indonesia (Sumatera Utara, Sumatera Barat, Jambi, Jawa Barat, dan Jawa Tengah).
2. Mengukur penurunan produksi tanaman nilam akibat penyakit mosaik. 3. Mendeteksi virus-virus yang berasosiasi dengan penyakit mosaik.
4. Mengidentifikasi dan mengkarakterisasi secara molekuler virus yang dominan berasosiasi dengan penyakit mosaik pada tanaman nilam.
5. Menganalisis keragaman genetik TeMV isolat nilam. 6. Mengetahui kisaran inang TeMV isolat nilam.
7. Mengidentifikasi spesies kutudaun yang mengkoloni tanaman nilam di lapangan.
8. Mengetahui hubungan kutudaun yang mengkoloni tanaman nilam dengan penyakit mosaik.
9. Mendapatkan bibit nilam bebas virus dengan metode kultur meristem apikal dan perendaman air panas.
Hipotesis
1. Penyakit mosaik sudah tersebar di seluruh sentra produksi nilam di Indonesia. 2. Infeksi virus penyebab penyakit mosaik menurunkan produksi dan kadar
minyak nilam.
3. Terdapat beberapa jenis virus dan kutudaun yang berasosiasi dengan penyakit mosaik pada tanaman nilam.
4. TeMV isolat nilam Indonesia mempunyai karakter yang berbeda dengan isolat virus dari belahan lain dunia.
5. Terdapat beberapa varian dalam populasi genetik TeMV pada pertanaman nilam Indonesia.
6. TeMV isolat nilam Indonesia mempunnyai kisaran inang yang berbeda dengan isolat virus dari negara lain.
7. Ada hubungan antara kutudaun yang mengkoloni tanaman nilam dengan penyakit mosaik,
8. Jaringan meristem apikal tanaman nilam sakit masih bebas dari virus yang menginfeksi jaringannya.
9. Virus mosaik dapat diinaktifkan melalui perlakuan air panas pada suhu yang setinggi-tingginya yang masih dapat ditoleransi oleh jaringan tanaman nilam.
Manfaat Penelitian
untuk mendapatkan bibit nilam sehat bebas virus, maka diharapkan dapat memberikan informasi kepada para petani nilam dalam usaha untuk mencegah penyebaran penyakit mosaik pada pertanaman nilam serta meningkatkan kesejahteran petani nilam.
Ruang Lingkup Penelitian
Penelitian ini dilakukan melalui survei lapangan, percobaan di rumah kaca dan laboratorium, yang terdiri atas:
1. Determinasi karakter biologi Potyvirus pada tanaman nilam, meliputi: a) pengamatan kejadian infeksi virus dan keragaman gejala virus pada tanaman nilam di beberapa daerah sentra produksi nilam; b) deteksi virus yang berasosiasi dengan penyakit mosaik secara serologi; c) respon tanaman indikator terhadap infeksi virus; dan d) kajian penularan virus dengan serangga vektor kutudaun.
2. Kajian pengaruh infeksi virus terhadap kuantitas dan kualitas beberapa varietas nilam.
3. Determinasi karakter molekuler TeMV, meliputi: penentuan keragaman molekuler TeMV isolat nilam Indonesia, meliputi: ekstraksi RNA, amplifikasi DNA (RT-PCR), perunutan fragmen nukleotida gen coat protein (CP) TeMV, dan analisis filogenetika.
4. Pembebasan virus dari tanaman nilam yang terinfeksi melalui kultur meristem apikal dan perendaman setek dalam air panas.
5
Gambar 1.1 Alur penelitian penyakit mosaik pada tanaman nilam dan identifikasi Telosma mosaic virus yang berasosiasi serta pengendaliannya.
Daftar Pustaka
Barani AM. 2008. Strategi pengembangan nilam di Indonesia. Prosiding Seminar Nasional Pengendalian Terpadu Organisme Pengganggu Tanaman Jahe dan Nilam. Bogor-4 Nopember 2008. Balai Penelitian Tanaman Obat dan Aromatik. Bogor. hlm 7-14.
Budiarto K, Sulyo Y, Rahardjo IB, Pramanik S. 2008. Pengaruh durasi pemanasan terhadap keberadaan Chrysanthemum Virus-B pada tiga varietas Krisan terinfeksi. J. Hort. 18(2):185-192.
Damayanti TA, Putra LK, Giyanto. 2010. Hot water treatment of cutting cane infected with Sugarcane streak mosaic virus (SCSMV). J. ISSAAS
16(2):17-25.
Dummond HM. 1960. Patchouli oil. Journal of Perfumery and Essential Oil Record. :484-492.
Gama MICS, Kitajima EW, Lin MI. 1982. Properties of a tobacco necrosis virus isolate from Pogostemon patchouli in Brazil. Phytopatology 72:529-532. Hampton RO, Jensen A, Hagel GT. 2005. Attributes of Bean yellow mosaic potyvirus transmission from clover to snap beans by four species of aphids (Homoptera: Aphididae). J. Econ. Entomol. 98(6):1816-1823. Hartono S, Subandiyah S. 2006. Pemurnian dan deteksi serologi Patchouli mottle
virus pada tanaman nilam. Jurnal Perlindungan Tanaman Indonesia
12(2):74-82.
Hartono S. 2008. Karakterisasi virus mottle pada tanaman nilam di Indonesia. Prosiding Seminar Nasional Pengendalian Terpadu Organisme Pengganggu Tanaman Jahe dan Nilam. Bogor-4 Nopember 2008. Balai Penelitian Tanaman Obat dan Aromatik. Bogor.Tidak dipublikasi.
Ibnusantosa G. 2000. Kemandegan pengembangan minyak atsiri Indonesia.
Makalah disampaikan pada seminar “Pengusahaan Minyak Atsiri
Hutan Indonesia”. Bogor, 23 Mei 2000. Fakultas Kehutanan IPB Darmaga. Bogor.
Mardiningsih TL, Triantoro SL, Tobing, Rusli S.1995. Patchouli oil product as insect repellent. Indust. Crops. Res. Journal 1(3):152-158.
Meissner Filho PE, Resende R de O, Lima MI, Kitajima EW. 2002. Patchouli virus X, a new potexvirus from Pogostemon cablin. Ann. Appl. Biol.
141:267-274.
Natsuaki KT, Tomaru K, Ushiku S, Ichikawa Y, Sugimura Y, Natsuaki T, Okuda S, Teranaka M. 1994. Characteristic of two viruses isolated from patchouli in Japan. Plant Dis. 78:1094-1097.
Nurawan A. 2008. Masalah Penyakit Nilam, Pengendalian dan Kerugian yang ditimbulkan. Prosiding Seminar Nasional Pengendalian Terpadu Organisme Pengganggu Tanaman Jahe dan Nilam. Bogor-4 Nopember 2008. Balai Penelitian Tanaman Obat dan Aromatik. Bogor. hlm 130-136.
Nuryani Y. 2005. Pelepasan Varietas Unggul Nilam. Warta Penelitian dan Pengembangan Tanaman Industri 11(1):1-3.
Robin SRJ. 1982. Selected market for the essential oils of patchouli and vetiver. Tropical Product Institute Ministry of Overseas Development. Great Britain G. 167:7-20.
Rusli S, Hobir, Hamid A, Asman A, Sufiani S, Mansyur M. 1993. Evaluasi Hasil Penelitian Minyak Atsiri. Bogor (ID): Balai Penelitian Tanaman Rempah dan Obat.
Sastry KS, Vasanthakumar T. 1981. Yellow mosaic of patchouli (Pogostemon patchouli) in India. Current Science 50(17):767-768.
Singh MK, Chandel V, Hallan V, Ram R, and Zaldi AA. 2009. Occurrence of
Peanut stripe virus on patchouli and raising of virus-free patchouli plants by meristem tip culture. Journal of Plant Diseases and Protection
116(1): 2-6.
Sugimura Y, Padayhag BF, Ceniza MS, Kamata N, Eguchi S, Natsuaki T, Okuda S. 1995. Essential oil production increased by using virus free patchouli plants derived from meristem-tip culture. Plant Pathology 44:510-515. Sukamto, Rahardjo IB, Sulyo Y. 2007. Detection of potyvirus on patchouli plant
(Pogostemon cablin Bent.) from Indonesia. Proceeding International Seminar on Essential Oil. Jakarta 7-9 November 2007. ISMECRI. Bogor. hlm 72-77.
Sumardiyono YB. 1991. Sifat fisik dan biologi virus pada tanaman nilam (Pogostemon sp.). Yogyakarta (ID): Lembaga Penelitian UGM.
II. TINJAUAN PUSTAKA Nilam (Pogostemon cablin Benth.) Sejarah dan Perkembangan Tanaman Nilam
Tanaman nilam yang umum dibudidayakan sebagai penghasil minyak atsiri yaitu nilam Aceh atau dengan nama Latin, Pogostemon cablin Benth. Tanaman ini merupakan anggota Keluarga Labiatae atau Lamiaceae. Tanaman nilam Aceh diduga berasal dari Filipina (DBPP 2004).
Budidaya nilam dilaporkan telah mulai dilakukan di Jawa pada tahun 1895 dengan bahan tanaman dari Singapura, meskipun jenisnya tidak diketahui, dan pada tahun 1909 nilam mulai ditanam di Aceh (Ahmed 2002). Sampai saat ini, Aceh Selatan dan Tenggara masih menjadi sentra nilam terluas di Indonesia, meskipun masih didominasi oleh perkebunan rakyat berskala kecil (DBPP 2004).
Di Indonesia terdapat 3 jenis nilam yaitu Kembang (P. heyneanus BTH.), Jawa atau Sabun (P. hortensis Back), dan Aceh (P. cablin Benth.) yang dibedakan berdasarkan karakter morfologi, kandungan dan kualitas minyak serta ketahanan terhadap cekaman lingkungan biotik dan abiotik. Nilam Jawa dan Kembang diduga berasal dari India dan pertama kali ditanam di Banten (Jawa Barat). Nilam Jawa dan Kembang umumnya dipakai secara tradisional, sedangkan nilam Aceh merupakan komoditi ekspor terkenal yang memiliki kualitas minyak tinggi. Nilam Aceh memiliki kadar minyak >2.5% (Sudarmono 2008).
Daerah sentra pertanaman nilam tersebar di wilayah Indonesia mencakup Nangroe Aceh Darussalam (NAD), Sumatera Barat, Sumatera Selatan, Sumatera Utara, Riau, dan berkembang di Lampung, Jambi, Bengkulu, Jawa Barat, Jawa Tengah, Jawa Timur dan Kalimantan Tengah. Di Jawa Barat, tanaman nilam telah dikembangkan di beberapa daerah seperti Kabupaten Garut, Tasikmalaya, Bandung, Kuningan dan Majalengka, baik oleh swasta maupun melalui dukungan dinas terkait (misalnya Dinas Koperasi & UKM dan Dinas Perindag) dengan pertumbuhan yang cukup memuaskan (Roni 2003).
Berdasarkan rata-rata produksi minyak nilam Indonesia lima tahun terakhir (2004-2008), sentra produksi minyak nilam Indonesia terdapat di 5 provinsi dengan kontribusi kumulatif mencapai 81.87% yaitu Sumatera Barat, Sumatera Utara, Bengkulu, Jawa Tengah dan Jawa Barat (PDIP 2010).
Gambar 2.1 Nilam Jawa (Sumber: Hadipoentyanti, tidak dipublikasikan) dan Nilam Aceh yaitu Sidikalang, Lhokseumawe dan Tapak Tuan (Sumber: Nuryani 2005).
Balittro telah berhasil mengembangkan varietas unggul nilam dari nilam Aceh yaitu Tapak Tuan, Lhokseumawe, dan Sidikalang (Nuryani 2006), yang sudah mulai dikembangkan dilapangan adalah Sidikalang.
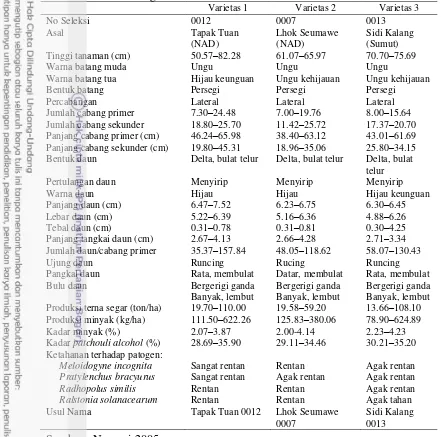
Varietas Tapak Tuan produksi terna kering, produksi minyak dan kadar
patchouli alcohol paling tinggi, tetapi kadar minyaknya paling rendah (2.83%). Lhoksemawe memiliki kandungan kadar minyak tinggi (3.21%) tetapi tidak tahan penyakit layu bakteri dan nematoda. Sedangkan Sidikalang memiliki kandungan minyak tidak terlalu tinggi (2.89%), tetapi agak tahan terhadap penyakit layu bakteri dan nematoda (Tabel 2.1 dan 2.2). Dari ketiga varietas tersebut masing-masing mempunyai keunggulan yang berbeda-beda, sehingga dalam pemilihan varietas disesuaikan dengan kondisi wilayah setempat (Nuryani 2005).
Tabel 2.1 Produksi terna kering, kadar minyak, produksi minyak, dan kadar
patchoulialcohol.
Varietas Produksi terna kering (t/ha)
Kadar minyak (%)
Produksi minyak (kg/ha)
Kadar patchouli alkohol (%)
Tapak Tuan 13.278 2.83 375.76 33.31
Lhokseumawe 11.087 3.21 355.89 32.63
Sidikalang 10.902 2.89 315.06 32.95
Sumber : Nuryani 2005
Nilam Jawa Sidika
Lhoks
Tapak Tapak Tuan
Lhokseumawe
Tabel 2.2 Deskripsi varietas unggul nilam Tapak Tuan, Lhokseumawe dan Sidikalang.
Varietas 1 Varietas 2 Varietas 3
No Seleksi 0012 0007 0013
Warna batang tua Hijau keunguan Ungu kehijauan Ungu kehijauan Bentuk batang Persegi Persegi Persegi
Percabangan Lateral Lateral Lateral Jumlah cabang primer 7.30–24.48 7.00–19.76 8.00–15.64 Jumlah cabang sekunder 18.80–25.70 11.42–25.72 17.37–20.70 Panjang cabang primer (cm) 46.24–65.98 38.40–63.12 43.01–61.69 Panjang cabang sekunder (cm) 19.80–45.31 18.96–35.06 25.80–34.15 Bentuk daun Delta, bulat telur Delta, bulat telur Delta, bulat
telur Pertulangan daun Menyirip Menyirip Menyirip Warna daun Hijau Hijau Hijau keunguan Panjang daun (cm) 6.47–7.52 6.23–6.75 6.30–6.45 Lebar daun (cm) 5.22–6.39 5.16–6.36 4.88–6.26 Tebal daun (cm) 0.31–0.78 0.31–0.81 0.30–4.25 Panjang tangkai daun (cm) 2.67–4.13 2.66–4.28 2.71–3.34 Jumlah daun/cabang primer 35.37–157.84 48.05–118.62 58.07–130.43 Ujung daun Runcing Rucing Runcing Pangkal daun Rata, membulat Datar, membulat Rata, membulat Bulu daun Bergerigi ganda Bergerigi ganda Bergerigi ganda Banyak, lembut Banyak, lembut Banyak, lembut Produksi terna segar (ton/ha) 19.70–110.00 19.58–59.20 13.66–108.10 Produksi minyak (kg/ha) 111.50–622.26 125.83–380.06 78.90–624.89 Kadar minyak (%) 2.07–3.87 2.00-4.14 2.23–4.23 Kadar patchouli alcohol (%) 28.69–35.90 29.11–34.46 30.21–35.20 Ketahanan terhadap patogen:
Meloidogyne incognita Sangat rentan Rentan Agak rentan
Pratylenchus bracyurus Sangat rentan Agak rentan Agak rentan
Radhopolus similis Rentan Rentan Agak rentan
Ralstonia solanacearum Rentan Rentan Agak tahan Usul Nama Tapak Tuan 0012 Lhok Seumawe
0007
Sidi Kalang 0013
Sumber : Nuryani 2005
Mutu Minyak Nilam
Mutu nilam ditentukan oleh sifat fisika-kimia minyaknya. Faktor yang paling menentukan mutu minyak nilam adalah kadar patchouli alcohol (PA). PA merupakan komponen terbesar (50-60%) dari minyak atsiri nilam (Walker 1969) dan memberikan bau (odour) yang khas pada minyak nilam, karena antara lain mengandung nor-patchoulene (Trifilief 1980). Pada ketiga varietas nilam unggul, kadar PAnya >30% dan merupakan syarat minimum untuk diekspor. Tapak Tuan mempunyai kadar PA yang tertinggi (33.31%) (Tabel 2.1).
Tabel 2.3 Karakteristik mutu minyak varietas unggul nilam Tapak Tuan,
Virus pada Tanaman Nilam dan Gejalanya
Virus merupakan submikroorganisme yang sangat sederhana, tersusun dari rangkaian asam nukleat (RNA atau DNA) yang bersifat infeksius dengan diselubungi oleh mantel protein (coat protein). Secara umum virus tanaman hanya dapat hidup di dalam sel-sel tanaman yang hidup, meskipun beberapa virus tertentu seperti Tobacco mosaic virus (TMV) bersifat sangat stabil dan mampu bertahan dalam keadaan inaktif pada daun tembakau sakit yang sudah kering (Agrios 2005).
Virus-Virus yang Menginfeksi Tanaman Nilam
Di Brazil, pertama kali dilaporkan adanya infeksi Tobacco Necrosis Virus
(TNV) pada tanaman nilam, yang merupakan anggota genus Necrovirus (Gama et al. 1982). Dua puluh tahun kemudian, ditemukan adanya infeksi Potato virus X
(PatVX) merupakan anggota genus Potexvirus. Virus ini ditemukan menginfeksi pertanaman nilam di Agronomic Institute of Campinas, Brazil (Meissner Filho et al. 2002).
Pada pertanaman nilam yang dikembangkan dilahan percobaan di Jepang dan Taiwan, ditemukan adanya gejala penyakit mosaik yang disebabkan oleh virus. Berdasarkan hasil identifikasi, tanaman nilam tersebut terinfeksi oleh campuran dua jenis virus yaitu Patchouli mild mosaic virus (PaMMV) merupakan anggota genus Fabavirus dan Patchouli mottle virus (PaMoV) merupakan anggota genus Potyvirus. Persentase intensitas penyakit yang disebabkan oleh kedua virus tersebut sangat tinggi (Natsuaki et al. 1994).
Pada tahun 2002, dilaporkan adanya infeksi virus Peanut stripe potyvirus
(PStV) merupakan anggota genus Potyvirus di India. Virus ini ditemukan menginfeksi tanaman nilam pada lahan Chandpur di Institute of Bioresource Technology (IHBT) kampus Palampur di India (Singh et al. 2009).
Virus yang dilaporkan menginfeksi tanaman nilam di Indonesia adalah
Cucumber mosaic virus (CMV) dan Potyvirus yang terdeteksi dari sampel tanaman nilam asal Cianjur dan Bogor (Sukamto et al. 2007). Kemudian tanaman nilam di Jawa Tengah dilaporkan terinfeksi oleh Bean common mosaic virus
(Sumardiyono 1991). Infeksi virus-virus tersebut menunjukkan gejala yang berbeda pada daun tanaman nilam.
Gejala Infeksi Virus pada Tanaman Nilam
Virus dapat menginfeksi tanaman nilam secara sendiri-sendiri (infeksi tunggal) atau secara bersama-sama dengan virus lain (infeksi ganda). Dua jenis virus (PaMoV dan PaMMV) ditemukan secara bersamaan menginfeksi tanaman nilam di Jepang. Infeksi ganda menyebabkan gejala lebih berat jika dibandingkan infeksi tunggal. PaMMV menginduksi gejala mosaik lemah (mild mosaic), sedangkan PaMoV menginduksi belang lemah (mild mottling) (Natsuaki et al.
1994). Infeksi CMV, BCMV strain PStV dan PStV dapat menginduksi gejala mosaik pada nilam di India dan Indonesia (Singh et al. 2009, Sukamto et al. 2007, Hartono 2008).
Karakter Biologi Potyvirus pada Tanaman Nilam Bentuk Partikel dan Genom Potyvirus
PaMoV dan PStV tergolong ke dalam genus Potyvirus, famili Potyviridae. Berdasarkan hasil pengamatan dengan mikroskop elektron, Potyvirus terdiri dari satu partikel berbentuk batang lentur dengan panjang antara 680–900 nm dengan diameter 12 nm (Agrios 2005). Menurut Natsuaki et al. (1994), partikel PaMoV berbentuk batang lentur dengan panjang kurang lebih 760 nm. Genom Potyvirus
adalah RNA tunggal positif, berukuran kurang lebih 10 kb dan satu subunit coat protein (Agrios 2005).
Kisaran Inang Potyvirus
Pengujian kisaran inang PaMoV telah dilakukan oleh Sumardiyono et al.
(1995). Infeksi PaMoV menyebabkan gejala bercak nekrosis pada C. amaranticolor dan Gomprena globosa, dan menyebabkan gejala mosaik pada
Nicotiana tabacum var. Samsun, N. glutinosa, dan Vigna unguiculata. Di lain pihak, infeksi PaMoV tidak menyebabkan gejala pada tanaman N. glauca, Physalis floridana, Tetragonia expansa, Phaseolus radiatus, Vicia faba dan
Datura stramonium. Hasil ini mirip dengan hasil pengujian kisaran inang strain PaMoV isolat dari Jepang.
Menurut Natsuaki et al. (1994), PaMoV secara mekanis ditularkan dari nilam ke C. quinoa, T. expansa dan Sesamum indicum L., menyebabkan gejala lesion sistemik, dan ke C. amaranticolor dan G. globosa menyebabkan gejala lesion lokal. Delapan belas spesies tanaman lain pada 7 famili termasuk Labiatae, tahan terhadap PaMoV seperti Spinacia oleracea, Phaseolus vulgaris cvs. Top Crops dan Masterpiece; Vigna sesquipedalis; Brassica campestris cv. Komatsuna;
Cucumis sativus, Perilla frutescens; Mentha spicata; Salvia splendens; Vinca rosea; Lucopersicon esculentum; Nicotiana glutinosa; N. clevelandii; N. tabacum
cvs. Burley 21, Samsun dan Xanthi-nc; Petunia X hybrida; Lactuca sativa; dan
Zinnia elegans.
Penyebaran dan Penularan Potyvirus pada Tanaman Nilam
pembuluh. Hal ini berarti bahwa virus tersebar ke seluruh jaringan tanaman dan mampu melakukan perbanyakan (multiplikasi). Multiplikasi RNA/DNA dan mantel proteinnya terjadi secara terpisah yang pada akhirnya akan bersatu membentuk partikel virus baru. Multiplikasi virus pada umumnya terjadi dalam jaringan-jaringan muda yang aktif melakukan metabolisme (Agrios 2005).
Infeksi, penyebaran dan penularan Potyvirus pada tanaman melalui berbagai cara yaitu pelukaan halus, bibit tanaman terinfeksi, dan serangga vektor.
Potyvirus adalah kelompok virus yang secara alami dapat ditularkan dan disebarkan oleh kutudaun (Hampton et al. 2005). Penularan virus melalui serangga vektor pada pertanaman nilam di India adalah 27% (Sastry dan Vasanthakumar 1981).
Namun demikian, cara penyebaran utama virus tersebut yang terjadi di lapangan adalah melalui bahan tanaman yang terinfeksi. Perbanyakan tanaman nilam dari tanaman yang terinfeksi tanpa adanya seleksi, merupakan salah satu penyebab utama tingginya kejadian penyakit pada pertanaman nilam di India (Sastry dan Vasanthakumar 1981) dan di Indonesia (Hartono dan Subandiyah 2006). Hasil penelitian menunjukkan bahwa dari 2 680 setek nilam yang ditanam di lapangan, 2 386 setek dinyatakan terinfeksi oleh virus. Persentase kejadian penyakit mencapai 89% (Sastry dan Vasanthakumar 1981).
Deteksi Molekuler Potyvirus pada Tanaman Nilam
Di India, amplifikasi cDNA dari sampel tanaman nilam yang terinfeksi PStV secara molekuler berhasil dilakukan melalui teknik reverse transcription
-polymerase chain reaction (RT-PCR) dan Immunocapture-RT-PCR (IC-RT-PCR). Teknik RT-PCR ini menggunakan satu pasang primer degenerate CP9502 (5„-GCGGATCCTTTTTTTTTTTTTTTTT-3‟) spesifik untuk bagian 3‟UTR genom Potyvirus dan CPUP (5‟- TGAGGATCCTGGTGYATHGARAAYGG-3‟, where Y = C/T, H = A/T/C, R = A/G), spesifik untuk wilayah coat protein (CP)
Potyvirus (Singh et al. 2009).
Akibat Infeksi Virus pada Tanaman Nilam
Dalam budidaya tanaman, virus merupakan salah satu penyebab penyakit tanaman yang dapat menimbulkan kerugian yang cukup berarti baik secara kualitas maupun kuantitas produksi. Infeksi virus PaMMV dapat menurunkan produksi dan kadar minyak nilam berturut-turut mencapai 35% dan 2% (Sugimura
et al. 1995).
Badan inklusi silindris dan seperti cakram juga ditemukan pada sel daun tanaman nilam yang terinfeksi PaMoV (Natsuaki et al. 1994).
Strategi Pengendalian Virus pada Tanaman Nilam
Cara yang efektif dilakukan dalam pengendalian penyakit yang disebabkan oleh virus adalah pemusnahan tanaman yang terinfeksi. Namun demikian, cara ini akan berakibat berkurangnya koleksi plasma nutfah tanaman yang dimiliki, sehingga diperlukan upaya pengendalian melalui eliminasi patogen (Barahima 2003).
Pada berbagai jenis tanaman dilaporkan telah berhasil dilakukan eliminasi virus melalui beberapa metode, diantaranya kultur meristem (Singh et al. 2009), perlakuan pemanasan (Damayanti et al. 2010), dan penggunaan antiviral sintetik (Budiarto et al 2008). Menurut Gunaeni dan Karjadi (2008), kosentrasi antiviral yang tinggi dapat mengeliminasi virus pada jaringan tanaman yang terinfeksi, tetapi konsentrasi antiviral (ribavirin) yang tinggi dapat menghambat pembentukan daun pada plantlet.
Eliminasi Virus dengan Kultur Meristem Apikal
Teknik kultur jaringan sangat membantu dalam usaha mengeliminasi patogen sistemik terutama virus. Perbanyakan tanaman dengan metode menggunakan bagian tanaman atau jaringan yang tidak mengandung patogen yaitu bagian meristem. Kemudian, jaringan tersebut ditumbuhkan pada media kultur untuk mendapatkan tanaman yang lengkap dan sehat. Pada tanaman kentang, teknik ini telah dikembangkan oleh para peneliti sebagai salah satu metode untuk mengeliminasi virus (Quak 1972).
Teknik ini juga telah dilakukan pada tanaman nilam yang terinfeksi oleh PaMMV oleh Sugimura et al. (1995). Klon nilam yang bebas virus telah diperbanyak secara kultur meristem apikal dan dikembangkan di lapangan dapat meningkatkan biomas daun dan kadar minyak nilam yang dihasilkan. Penggunaan bibit bebas Potyvirus dapat menekan sumber inokulum sehingga dapat mengurangi laju infeksi pada tanaman nilam di lapangan.
Eliminasi dengan Perlakuan Air Panas
Dalam beberapa tahun terakhir, perlakuan panas (heat treatment) menjadi metode yang umum digunakan untuk memproduksi propagasi tanaman yang bebas virus, viroid dan fitoplasma (Hadidi et al. 1998). Banyak virus yang dapat dieliminasi dari tanaman inangnya dengan cara heat treatment. Awalnya perlakuan panas diperlakukan pada keseluruhan tanaman pada suhu konstan yang berkisar dari 35-40ºC. Meskipun banyak tanaman yang mati setelah mendapatkan perlakuan ini, beberapa tanaman yang bertahan dapat menjadi tanaman yang bebas virus. Bagian tanaman dorman yang biasa digunakan adalah biji, umbi dan tunas. Secara umum bagian tanaman tersebut lebih tahan terhadap suhu tinggi dari pada jaringan tanaman lainnya. Setelah beberapa tahun, metode heat treatment
dimodifikasi, yaitu dikombinasikan dengan kultur meristem apikal untuk memperbesar peluang mendapatkan tanaman bebas virus.
waktu yang lebih singkat lebih sering digunakan daripada perlakuan udara panas. Selain menyebabkan terjadinya dehidrasi tanaman, perlakuan udara panas kurang efektif dibandingkan perlakuan air panas. Perlakuan air panas umumnya diperlakukan pada bagian tanaman dorman seperti biji, maupun tunas. Namun untuk tanaman yang sedang tumbuh lebih sering digunakan perlakuan udara panas pada suhu 35-40ºC selama beberapa hari atau beberapa minggu (Hadidi et al. 1998).
Perlakuan panas in vivo menghambat replikasi virus di dalam tanaman, translokasi virus, dan proses-proses dalam tanaman. Perlakuan panas dengan suhu diatas 37ºC mampu menghambat multiplikasi banyak virus, merusak movement protein yang sangat berperan dalam transportasi virus dalam tanaman, serta merusak coat protein virus yang juga berperan dalam translokasi sistemik virus dalam tanaman (Hadidi et al. 1998). Perlakuan panas in vivo tidak hanya berpengaruh terhadap virus di dalam tanaman, tetapi juga menghambat proses fotosintesis, meningkatkan respirasi gelap, dan mereduksi translokasi karbohidrat, mempengaruhi sintesis protein, mempengaruhi pembelahan sel, pertumbuhan sel dan hormon tumbuhan. Perubahan proses dalam tumbuhan juga dapat mempengaruhi virus dalam tumbuhan tersebut (Hadidi et al. 1998).
Selain eliminasi patogen dari jaringan tanaman terinfeksi, cara lain adalah menggunakan varietas tahan terhadap virus.
Varietas Tahan terhadap Infeksi Virus
Sampai saat ini belum ada varietas nilam yang agak tahan atau tahan terhadap infeksi virus. Keterbatasan sumber genetik merupakan faktor pembatas dalam program pemuliaan nilam untuk memilih varietas yang dikehendaki. Sempitnya keragaman genetik nilam ini disebabkan tanaman tidak berbunga/berbiji dan perbanyakannya selalu dilakukan secara vegetatif dengan cara setek (Hadipoentyanti et al. 2008).
Gambar 2.2 Kalus dan tunas Nilam (Sumber: Amalia et al. 2008).
Pengendalian Serangga Vektor
Aphis gossypii dan Myzus persicae telah dilaporkan dapat menularkan lebih dari 75 jenis virus tanaman secara non-persisten (Blackman dan Eastop 2000). Di India, kedua kutudaun ini juga menularkan Papaya ringspot virus
(PRSV) secara non-persisten (Kalleshwaraswamy et al. 2007). Menurut Takada (1995), pengendalian kutudaun sebagai vektor virus dapat dilakukan dengan beberapa cara atau taktik yaitu (1) secara kimia (senyawa penolak, senyawa pencegah makan, feromon dan insektisida), (2) secara fisik (mulsa, kawat serangga), dan (3) secara biologi (parasitoid, predator, cendawan entomopatogen).
Pengendalian secara biologi adalah sebagai salah satu komponen dalam pengendalian hama terpadu (PHT), merupakan pengendalian alternatif yang bisa dilakukan jika pengendalian kimia tidak mampu, tidak cukup atau tidak bisa diterima untuk digunakan (van Lenteren 2000). Beberapa cara pengendalian biologi yang biasa dipakai untuk mengendalikan A. gossypii adalah parasitoid, predator dan cendawan entomopatogen.
Predator yang ditemukan menyerang A. gossypii pada pertanaman nilam yaitu Syrphidae (Diptera), Coelophora maculata (Coleoptera: Coccinellidae),
Cheilomenes maculata (Coleoptera: Coccinelidae), Scymnus sp. (Coleoptera: Coccinellidae) (Mardiningsih et al. 2010; Mardiningsih et al. 2011). Sedangkan parasitoid yang ditemukan menyerang A. gossypii yaitu Aphelinus sp. (Hymenoptera: Aphelinidae). Dari hasil koleksi A. gossypii di Bogor, baik nimfa maupun imago terserang Aphelinus sp 20-76% (Mardiningsih dan Jakfar 2010).
Aplikasi Neoseiulus cucumeris (lebih kurang 20-25 individu per daun) dapat menurunkan populasi A. gossypii pada tanaman terong (Magdy et al. 2009). Menurut Vasquez et al. (2006), Aphidius colemani efektif, aman dan dapat diandalkan untuk menekan populasi A. gossypii di rumah kaca. Tingkat parasitismenya berkisar antara 48.93-83.38%. Namun demikian, aplikasi A. colemani membutuhkan biaya 4.7 kali lebih besar dibandingkan insektisida sistemik (imidakloprid). Waktu yang diperlukan oleh cendawan Beauveria bassiana dan Metarhizium anisopliae untuk membunuh A. gossypii adalah berturut-turut 2.54 hari dan 2.81 hari (Toledo et al. 2010).
Daftar Pustaka
Agrios N. 2005. Plant Pathology. Fifth Edition. New York (US): Elsevier Academic Press.
Ahmed M. 2002. Patchouli, an ideal aromatic crop of commercial importance. Guwahati (Indian): North Eastern Development Finance Corporation Ltd.
Barahima WP. 2003. Eliminasi Sweet Potato Feathery Mottle Virus (SPFMV) pada empat kultivar Ubijalar unggul local asal Papua melalui teknik kultur meristem. Bul. Agron. 31(3):81-88.
Blackman RL, Eastop VF. 2000. Aphids on the World‟s Crops: An Identification and Information Guide. New York (US): John Wiley.
Budiarto K, Sulyo Y, Rahardjo IB, Pramanik S. 2008. Pengaruh durasi pemanasan terhadap keberadaan Chrysanthemum Virus-B pada tiga varietas Krisan terinfeksi. J. Hort. 18(2):185-192.
Damayanti TA, Putra LK, Giyanto. 2010. Hot water treatment of cutting cane infected with Sugarcane streak mosaic virus (SCSMV). J. ISSAAS
16(2):17-25.
Deguerry F, Pastore L, Wu S, Clark A, Chappell J, Schalk M. 2006. The diverse sesquiterpene profile of patchouli, Pogostemon cablin, is correlated with a limited number of sesquiterpene synthases. Archives of Biochemistry and Biophysics 454:123-136.
[DBPP] Ditjen Bina Produksi Perkebunan. 2004. Nilam. Statistik Perkebunan Indonesia. 2001-2003. Jakarta (ID): Kementrian Pertanian.
Gama MICS, Kitajima EW, Lin MI. 1982. Properties of a tobacco necrosis virus isolate from Pogostemon patchouli in Brazil. Phytopatology 72:529-532. Guenter E. 1949. The Essential Oil. New York (US): Van Nostrand Company. Gunaeni N, Karjadi AK. 2008. Kultur meristem dan antiviral ribavirin pada
tanaman kentang. J. Agrivigor 7(2):105-112.
Hadidi A, Khetarpal RK, Koganezawa H. 1998. Plant Virus Diseases Control. St. Paulo (US): American Phytopatology Society.
Hadipoentyanti E; Amalia; Nursalam; Hartati SY dan Suhesti S. 2008.Perakitan varietas untuk ketahanan nilam terhadap penyakit layu bakteri.Prosiding Seminar Nasional Pengendalian Terpadu Organisme Pengganggu Tanaman Jahe dan Nilam. Bogor-4 Nopember 2008. Balai Penelitian Tanaman Obat dan Aromatik. Bogor. hlm163-176.
Hampton RO, Jensen A, Hagel GT. 2005. Attributes of Bean yellow mosaic potyvirus transmission from clover to snap beans by four species of aphids (Homoptera: Aphididae). J. Econ. Entomol.98(6):1816-1823. Hartono S, Subandiyah S. 2006. Pemurnian dan deteksi serologi Patchouli mottle
virus pada tanaman nilam. Jurnal Perlindungan Tanaman Indonesia
12(2):74-82.
Hartono S. 2008. Karakterisasi virus mottle pada tanaman nilam di Indonesia. Prosiding Seminar Nasional Pengendalian Terpadu Organisme Pengganggu Tanaman Jahe dan Nilam. Bogor-4 Nopember 2008. Balai Penelitian Tanaman Obat dan Aromatik. Bogor. Tidak dipublikasi. Kalleshwara swamy CM, Verg hese A, Ranga nath HR, Krishnak umar NK,
Dinesh MR, Venugopalan R. 2007. Role of transient aphid vectors on the temporal spread of Papaya ringspot virus in south India. Acta Hort.
740: 251-258.
Maeda E, Miyake H, Tomaru K. 1999. Ultrastructure of mesophyll glands secreting the aromatic substances in patchouli leaves. Plant Prod. Sci.
Magdy, El-Kholy Y, El-Sayed, El-Saiedy MAK. 2009. Biological control of
Thrips tabaci (Lind.) and Aphis gossypii (Glover) using different predatory Phytoseiid mites and the biocide vertimec on eggplant at Behaira Governorate. Egypt. Acad. J. Biolog. Sci. 2(2):13-22.
Mardiningsih TL, Jakfar R. 2010. Serangan parasitoid pada kutudaun nilam.
Prosiding Seminar Nasional Perlindungan Tanaman. Bogor, 5-6 Agustus 2009. Pusat Kajian Pengendalian Hama Terpadu, Departemen Proteksi Tanaman, Institut Pertanian Bogor. hlm 289-292.
Mardiningsih TL, Sukmana C, Tarigan N, Suriati S. 2010. Efektivitas insektisida nabati berbahan aktif azadirachtin dan saponin terhadap mortalitas dan intensitas serangan Aphis gossypii Glover. Bul. Littro 21:171-183. Mardiningsih TL, Sartiami D, Suriati S, Sukmana C, Tarigan N. 2011.
Serangga-serangga yang berasosiasi dengan tanaman nilam (Pogostemon cablin Benth.). Prosiding Seminar Peringatan Ulang Tahun Perhimpunan Entomologi Indonesia (PEI) ke 40. Yogyakarta, 1-2 Oktober 2010. Hlm 216-226.
Meissner Filho PE, Resende R de O, Lima MI, Kitajima EW. 2002. Patchouli virus X, a new potexvirus from Pogostemon cablin. Ann. Appl. Biol.
141:267-274.
Natsuaki KT, Tomaru K, Ushiku S, Ichikawa Y, Sugimura Y, Natsuaki T, Okuda S, Teranaka M. 1994. Characteristic of two viruses isolated from patchouli in Japan. Plant Dis. 78:1094-1097.
Nuryani Y. 2005. Pelepasan Varietas Unggul Nilam. Warta Penelitian dan Pengembangan Tanaman Industri 11(1):1-3.
Nuryani Y, Emmyzar, Wiratno. 2005. Budidaya Tanaman Nilam. Sirkuler No. 12.
Bogor (ID): Balittro.
Nuryani Y. 2006. Budidaya Tanaman Nilam (Pogostemon cablin Benth).Bogor (ID): Balai Penelitian Tanaman Rempah dan Obat.
[PDIP] Pusat Data Informasi Pertanian. 2010. Outlook Komoditas Pertanian Perkebunan. Jakarta (ID): Kementerian Pertanian.
Quak F. 1972. The treatment and substances inhibit virus multiplication in meristem culture to obtain virus free plant. Ad. Hort. Sci.:141-144. Roni K. 2003. Kajian teknis budidaya dan manajemen produksi pengolahan
minyak nilam di beberapa sentra Nilam Jawa Barat. Bandung (ID): Dinas Pertanian.
Sandes SS, Blank AF, Botanico MP, Blank MFA, Vasconcelos JNC, Mendonca SAD. 2012. Estruturas secretoras foliares em patchouli [Pogostemon cablin (Blanco) Benth.]. Scientia Plena 8(5):1-6.
Sastry KS, Vasanthakumar T. 1981. Yellow mosaic of patchouli (Pogostemon patchouli) in India.Current Science 50(17):767-768.
Sudarmono. 2008. Keanekaragaman nilam (Pogostemon spp.; Lamiaceae) perilaku bunga dan budidayanya. Prosiding Seminar Nasional Pengendalian Terpadu Organisme Pengganggu Tanaman Jahe dan Nilam. Bogor-4 Nopember 2008. Balai Penelitian Tanaman Obat dan Aromatik. Bogor. hlm216-220.
Sugimura Y, Padayhag BF, Ceniza MS, Kamata N, Eguchi S, Natsuaki T, Okuda S. 1995. Essential oil production increased by using virus free patchouli plants derived from meristem-tip culture. Plant Pathology 44:510-515. Sukamto, Rahardjo IB, Sulyo Y. 2007. Detection of potyvirus on patchouli plant
(Pogostemon cablin Bent.) from Indonesia. Proceeding International Seminar on Essential Oil. Jakarta, 7-9 November 2007. ISMECRI. Bogor. hlm72-77.
Sumardiyono YB. 1991. Sifat fisik dan biologi virus pada tanaman nilam (Pogostemon sp.). Yogyakarta (ID): Lembaga Penelitian UGM.
Sumardiyono YB, Sulandari S, Hartono S. 1995. Penyakit mosaik kuning pada nilam (Pogostemon cablin).Risalah Kongres Nasional XII dan Seminar Ilmiah PFI. Yogyakarta, 6-8 September 1993. Perhimpunan Fitopatologi Indonesia.Yogyakarta.hlm912-916.
Takada H. 1995. IPM of vector aphids. Japan (JP): Kyoto Prefectural University. Toledo AV, Remes-Lenicov AMM, Lopez-Lastra CC. 2010. Histopathology
caused by the entomopathogenic fungi, Beauveria bassiana and
Metarhizium anisopliae, in the adult planthopper, Peregrinus maidis , a maize virus vector. J Insect Sci 10:26-35.
Trifilief E. 1980. Isolation of the postulated precursor of nor patchoulenol in patchouli leaves. Phytochemistry 19:2464.
Van Lenteren JC. 2000. A greenhouse without pesticides: fact or fantasy. Crop Prot. 19: 375-384.
Vasquez GM, Orr DB, Baker JR. 2006. Efficacy assessment of Aphidius colemani
(Hymenoptera: Braconidae) for suppression of Aphis gossypii
(Homoptera: Aphididae) in greenhouse-grown Chrysanthemum. J. Econ. Entomol. 99(4):1104-1111.
*) Bagian penelitian ini telah dipublikasi di Journal of ISSAAS Vol 18 Number 1 Juni 2012. ISSN: 0859-3132.; di Buletin Penelitian Tanaman Rempah dan Obat Vol 23 Nomor 1, 2012. ISSN:0215-0824; dan di Jurnal Fitopatologi Indonesia Vol 8 Nomor 3 Juni 2012. ISSN:0215-7950.
III. PENYAKIT MOSAIK PADA PERTANAMAN NILAM DAN VIRUS-VIRUS YANG BERASOSIASI*)
(Mosaic Disease on Patchouli Plant and the Asociated Viruses) Abstrak
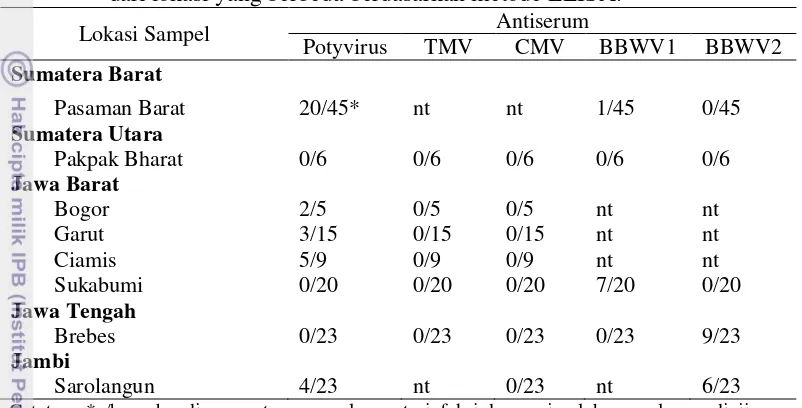
Penelitian ini dilakukan untuk memetakan keberadaan penyakit mosaik pada pertanaman nilam di daerah sentra produksi nilam di Indonesia, mengukur penurunan produksi tanaman nilam akibat penyakit mosaik, melakukan deteksi virus-virus yang berasosiasi dengan penyakit mosaik dan mengidentifikasi spesies kutudaun yang mengkoloni tanaman nilam di lapangan. Berdasarkan hasil survei, penyakit mosaik ditemukan terdapat di seluruh sentra produksi nilam di Jawa dan Sumatera (yaitu Bogor, Garut, Ciamis, Sukabumi, Pasaman Barat, Brebes, Pakpak Bharat dan Sarolangun) dengan rata-rata tingkat infeksi virus berkisar dari 0-55.5%. Infeksi virus mosaik tersebut berpotensi menyebabkan penurunan produksi tanaman dan kadar patchouli alcohol (PA) pada beberapa varietas. Kisaran penurunan produksi terna basah, terna kering, kadar minyak dan PA pada tiga varietas nilam (Tapak Tuan, Lhokseumawe, Sidikalang) karena terinfeksi virus berturut-turut adalah 7.87-34.65%, 0.62-40.42%, 2.37-9.09%, dan 0.72-5.06%. Berdasarkan hasil uji serologi dan analisis morfologi partikel, Potyvirus
ditemukan dominan berasosiasi dengan gejala mosaik tersebut. Ditemukan dua spesies kutudaun yang mengkoloni tanaman nilam di seluruh lokasi survei yaitu
Aphis gossypii Glover dan Brachycaudus sp.
Kata kunci: Nilam, Potyvirus, penyakit mosaik, Aphis gossypii, Brachycaudus
sp.
Abstract
This study was carried out to map the presence of mosaic disease on patchouli production center of Indonesia, to measure the reduction of patchouli production caused by mosaic disease, to detection viruses associated with mosaic disease, and to identify the aphids that colonized patchouli plants in the field. Based on the survey, mosaic disease was found in all patchouli production centers in Java and Sumatra (i.e. Bogor, Garut, Ciamis, Sukabumi, Pasaman Barat, Brebes, Pakpak Bharat and Sarolangun), with virus infection level ranged from 0 to 55.5%. This disease was potential to reduce the plant production and PA level of some varieties. Due to the mosaic disease, reduction of fresh herbs weight, dry herbs weight, oil content and the PA of three varieties of patchouli (Tapak Tuan, Lhokseumawe, Sidikalang) was ranging from 7.87 to 34.65%, 0.62 to 40.42%, 2.37 to 9.09%, and 0.72 to 5.06%, respectively. Based on the serological tests and analysis of particle morphologi, Potyvirus was found predominantly associated with the mosaic symptoms. Two species of aphid were found to colonize of patchouli plants in all of surveyed areas i.e. Aphis gossypii Glover and
Brachycaudus sp.