dan Ekstraselular Gen
TcPIN
yang Ditransformasikan pada
Eschericia coli
. Dibimbing
oleh TUN TEDJA IRAWADI dan TETTY CHAIDAMSARI.
PIN
merupakan gen pertahanan alamiah tanaman yang dapat dimanfaatkan untuk
pengembangan kakao transgenik. Gen
TcPIN
telah diisolasi dari kulit buah kakao pada
klon Ary dan Bal, serta dari biji kakao. Studi bioinformatika menunjukkan bahwa gen ini
mengekspresikan protein 21 kDa yang memiliki homologi tinggi dengan inhibitor tripsin.
Aktivitas protein ini diuji secara
in vitro
. Protein hasil ekspresi intraselular gen
TcPIN
dari kulit buah kakao menunjukkan aktivitasnya sebagai inhibitor tripsin. Namun, protein
hasil ekspresi gen
TcPIN
dari biji kakao tidak menunjukkan aktivitas serupa.
ABSTRACT
MUHAMAD LUTFILAH. Tripsin Inhibitor Activity of Protein Expressed Intracellularly and Extracellularly from TcPIN Gene Transformed in Eschericia coli. Supervised by TUN TEDJA IRAWADI and TETTY CHAIDAMSARI.
PIN is natural defense gene in plant which is potential to be utilized for development of transgenic cacao. TcPIN gene had been isolated from cacao’s peel (pod wall) of Ary and Bal
1
PENDAHULUAN
Indonesia merupakan produsen kakao terbesar ketiga di dunia dengan produksi rerata per tahun mencapai 456,000 ton, setelah negara Pantai Gading (1,276,000 ton) dan Ghana (586,000 ton). Luas lahan tanaman kakao Indonesia lebih kurang 992.448 Ha dengan produktivitas rata-rata 900 kg per ha (Depperin 2007). Saat ini, Indonesia mengekspor 40% kakao ke Malaysia, 30% ke Amerika Serikat, 15% ke Singapura, dan 15% ke Eropa. Produksi kakao Indonesia tahun 2008 dibandingkan dengan tahun 2007 menurun 4% dari 500,000 ton menjadi 480,000 ton. Harga rata-rata kakao selama tahun 2008 sebesar US$2,500 per ton dan pada tahun 2009 diperkirakan meningkat menjadi US$2,900 per ton (Husaini 2009). Karena itu, kakao merupakan salah satu komoditas ekspor nonmigas yang potensial dan produksinya perlu ditingkatkan.
Agribisnis kakao Indonesia masih menghadapi berbagai masalah kompleks, antara lain mutu produksi yang masih rendah, serta masih belum optimalnya pengembangan produk hilir kakao. Produktivitasnya juga masih rendah, salah satu penyebabnya ialah serangan hama penggerek buah kakao (PBK). Hal ini menjadi suatu tantangan sekaligus peluang bagi para investor untuk mengembangkan usaha dan meraih nilai tambah yang lebih besar dari agribisnis kakao (Goenadi et al. 2007).
Cara-cara yang telah diterapkan untuk mengatasi masalah hama PBK ini di antaranya pengendalian hama PBK secara nasional dan pemilihan varietas tanaman kakao yang tahan hama PBK. Cara lain yang juga potensial ialah pengembangan kakao transgenik dengan memanfaatkan gen pertahanan alami pada tanaman yang disebut gen protease inhibitor (PIN). PIN merupakan gen yang dapat menghasilkan senyawa protein antinutrisi yang dapat menghambat kerja enzim proteolitik (protease) di dalam perut serangga (Ryan 1990). Apabila termakan oleh hama PBK, protein tersebut akan berinteraksi dengan protease di dalam usus hama tersebut, terikat, dan terkunci pada tapak aktifnya (Terra et al. 1996; Walker et al. 1998) akibatnya, hama PBK kekurangan nutrisi karena terinhibisinya kerja enzim protease yang menghasilkan asam amino, sehingga pertumbuhan dan perkembangan pada hama PBK menjadi terhambat dan dapat menyebabkan kematian.
Isda et al. 2008 telah mengisolasi gen PIN
dari kulit buah 2 klon kakao, yang tahan (Ary) dan yang tidak tahan (Bal), serta dari biji kakao. Gen ini selanjutnya disebut TcPIN. Gen-gen ini diklon pada Eschericia coli. Secara bioinformatika, gen tersebut menyandikan protein 21 kDa dengan homologi yang cocok dengan inhibitor tripsin. Pada penelitian ini aktivitas inhibisi tripsin dari protein ekspresi ketiga gen itu diujikan secara in vitro. Selain itu, bobot molekul protein juga dicirikan dengan elektroforesis gel poliakrilamida-natrium dodesil sulfat (SDS-PAGE). Semua pekerjaan dalam penelitian ini dikerjakan di Labolatorium Biomolekuler, Balai Penelitian Bioteknologi Perkebunan Bogor, antara bulan Maret dan Juni 2009.
TINJAUAN PUSTAKA
Kakao (Theobroma cacao L.) Tanaman kakao berasal dari Amerika Selatan
.
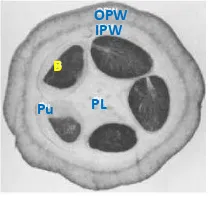
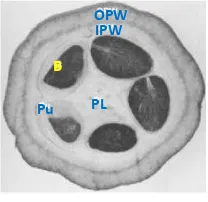
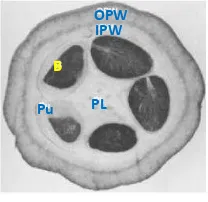
Buah kakao bila dibelah akan tampak seperti Gambar 1 dan bagiannya dapat dicirikan, yaitu OPW (outer pod wall) bagian kulit terluar dari kakao, IPW (inner pod wall), kulit lapisan kedua yang berada di dalam buah, Pu (pulp) daging buah kakao, B (beans) biji kakao, dan PL (placenta) bagian tengah dari kakao.Gambar 1 Bagian buah kakao (Chaidamsari 2005).
Pada saat ini kecenderungan perluasan areal kakao terus berlanjut, walaupun tidak setajam periode 1985 1995 yang laju reratanya di atas 20% per tahun sedangkan pada periode 1995 2002 sebesar 7.5% per tahun. Kondisi areal yang ada dan masalah serangan hama PBK yang cenderung terus meluas dapat menjadikan produksi kakao nasional menurun dalam satu dasawarsa mendatang. Hal ini disebabkan oleh peningkatan produksi dengan perluasan areal
OPW IPW
B
PENDAHULUAN
Indonesia merupakan produsen kakao terbesar ketiga di dunia dengan produksi rerata per tahun mencapai 456,000 ton, setelah negara Pantai Gading (1,276,000 ton) dan Ghana (586,000 ton). Luas lahan tanaman kakao Indonesia lebih kurang 992.448 Ha dengan produktivitas rata-rata 900 kg per ha (Depperin 2007). Saat ini, Indonesia mengekspor 40% kakao ke Malaysia, 30% ke Amerika Serikat, 15% ke Singapura, dan 15% ke Eropa. Produksi kakao Indonesia tahun 2008 dibandingkan dengan tahun 2007 menurun 4% dari 500,000 ton menjadi 480,000 ton. Harga rata-rata kakao selama tahun 2008 sebesar US$2,500 per ton dan pada tahun 2009 diperkirakan meningkat menjadi US$2,900 per ton (Husaini 2009). Karena itu, kakao merupakan salah satu komoditas ekspor nonmigas yang potensial dan produksinya perlu ditingkatkan.
Agribisnis kakao Indonesia masih menghadapi berbagai masalah kompleks, antara lain mutu produksi yang masih rendah, serta masih belum optimalnya pengembangan produk hilir kakao. Produktivitasnya juga masih rendah, salah satu penyebabnya ialah serangan hama penggerek buah kakao (PBK). Hal ini menjadi suatu tantangan sekaligus peluang bagi para investor untuk mengembangkan usaha dan meraih nilai tambah yang lebih besar dari agribisnis kakao (Goenadi et al. 2007).
Cara-cara yang telah diterapkan untuk mengatasi masalah hama PBK ini di antaranya pengendalian hama PBK secara nasional dan pemilihan varietas tanaman kakao yang tahan hama PBK. Cara lain yang juga potensial ialah pengembangan kakao transgenik dengan memanfaatkan gen pertahanan alami pada tanaman yang disebut gen protease inhibitor (PIN). PIN merupakan gen yang dapat menghasilkan senyawa protein antinutrisi yang dapat menghambat kerja enzim proteolitik (protease) di dalam perut serangga (Ryan 1990). Apabila termakan oleh hama PBK, protein tersebut akan berinteraksi dengan protease di dalam usus hama tersebut, terikat, dan terkunci pada tapak aktifnya (Terra et al. 1996; Walker et al. 1998) akibatnya, hama PBK kekurangan nutrisi karena terinhibisinya kerja enzim protease yang menghasilkan asam amino, sehingga pertumbuhan dan perkembangan pada hama PBK menjadi terhambat dan dapat menyebabkan kematian.
Isda et al. 2008 telah mengisolasi gen PIN
dari kulit buah 2 klon kakao, yang tahan (Ary) dan yang tidak tahan (Bal), serta dari biji kakao. Gen ini selanjutnya disebut TcPIN. Gen-gen ini diklon pada Eschericia coli. Secara bioinformatika, gen tersebut menyandikan protein 21 kDa dengan homologi yang cocok dengan inhibitor tripsin. Pada penelitian ini aktivitas inhibisi tripsin dari protein ekspresi ketiga gen itu diujikan secara in vitro. Selain itu, bobot molekul protein juga dicirikan dengan elektroforesis gel poliakrilamida-natrium dodesil sulfat (SDS-PAGE). Semua pekerjaan dalam penelitian ini dikerjakan di Labolatorium Biomolekuler, Balai Penelitian Bioteknologi Perkebunan Bogor, antara bulan Maret dan Juni 2009.
TINJAUAN PUSTAKA
Kakao (Theobroma cacao L.) Tanaman kakao berasal dari Amerika Selatan
.
Buah kakao bila dibelah akan tampak seperti Gambar 1 dan bagiannya dapat dicirikan, yaitu OPW (outer pod wall) bagian kulit terluar dari kakao, IPW (inner pod wall), kulit lapisan kedua yang berada di dalam buah, Pu (pulp) daging buah kakao, B (beans) biji kakao, dan PL (placenta) bagian tengah dari kakao.Gambar 1 Bagian buah kakao (Chaidamsari 2005).
Pada saat ini kecenderungan perluasan areal kakao terus berlanjut, walaupun tidak setajam periode 1985 1995 yang laju reratanya di atas 20% per tahun sedangkan pada periode 1995 2002 sebesar 7.5% per tahun. Kondisi areal yang ada dan masalah serangan hama PBK yang cenderung terus meluas dapat menjadikan produksi kakao nasional menurun dalam satu dasawarsa mendatang. Hal ini disebabkan oleh peningkatan produksi dengan perluasan areal
OPW IPW
B
2
saat ini tidak dapat mengimbangi penurunan produksi tanaman kakao yang tua, serta serangan hama PBK sudah menjadi ancaman bagi produksi kakao nasional (Goenadi et al. 2007).
Penggerek Buah Kakao
Penggerek buah kakao (PBK),
Conophomorpha cramerella Snellen, dari famili Gracillariidae merupakan salah satu hama kakao yang memakan plasenta yang merupakan saluran makanan menuju ke biji sehingga mengakibatkan penurunan hasil dan mutu biji. PBK dapat menyerang buah dengan panjang buah 3 cm, tetapi umumnya lebih menyukai yang berukuran sekitar 8 cm. Ulatnya merusak dengan cara menggerek buah serta memakan kulit buah, daging buah, dan plasenta. Buah yang terserang akan lebih awal menjadi berwarna kuning dan jika digoyang tidak berbunyi. Biasanya buah ini lebih berat daripada yang sehat. Biji-bijinya saling melekat, berwarna kehitaman, dan ukuran biji yang lebuh kecil (Goenadi et al. 2007)
Gen PIN dari Buah kakao
Gen PIN diketahui memiliki peranan yang penting dalam sistem pertahanan tanaman pada predator dan patogen (Lawrence & Koundal 2002). Pada kakao, gen ini menyandikan protein berukuran 21 kDa dan memiliki homologi yang cocok dengan inhibitor tripsin. Telah dilaporkan oleh Tai et al (1991) bahwa protein tersebut diakumulasi selama perkembangan biji dan tidak didegradasi selama perkecambahan benih pada kakao.
Keberhasilan penggunaan gen PIN dalam tanaman transgenik telah dilaporkan antara lain pada padi (Xu et al. 1996), ubi jalar (Newell et al. 1995), dan tembakau (Johnson
et al. 1989). Inhibitor protease pada kakao merupakan golongan inhibitor protease serin (inhibitor tripsin dan kemotripsin) dan telah menunjukkan keefektifannya menghambat perkembangan larva beberapa jenis
Lepidoptera.
Protease dan Inhibitor Protease Setiap metabolisme pada kehidupan sel bergantung pada proteolisis. Protease merupakan suatu kelompok enzim yang dapat memutuskan ikatan peptida, terlibat dalam berbagai proses penting pada pengatur katabolisme protein, dan mendegradasi selektif protein yang rusak. Berdasarkan
beberapa penelitian terakhir dari proteolisis, diketahui bahwa protease bukan hanya penting dalam penyediaan metabolit primer untuk pertumbuhan dan perkembangan sel. Protease juga merupakan sarana untuk berbagai proses kunci seperti pemutusan spesifik ikatan peptida pada protein yang belum sempurna atau penghancuran sinyal-sinyal target dari praprotein setelah translokasinya pada bagian-bagian sel yang cocok. Karena itu, enzim proteolitik yang sebelumnya disebut ‘katalis penghancur’ terutama dalam menghidrolisis asupan protein, sekarang dianggap sebagai pusat pengendali dari unsur-unsur dalam perkembangan banyak kehidupan organisme (Wolf 1992).
Protease dapat diklasifikasikan berdasar-kan meberdasar-kanisme katalitiknya. Empat kelas mekanisme yang diusulkan oleh The Nomenclature Committee of the International Union of Biochemistry and Molecular Biology
(NC-IUBMB) adalah protease serin, protease kristein, protease aspartat, dan metaloprotease. Klasifikasi ini lebih lanjut telah diperluas pembagiannya berdasarkan hubungan evolusioner dari proteasenya (Rawling & Barrett 1993). Data tentang klasifikasi protease ini tersedia di basis data Swissport. Protease juga dapat terinhibisi oleh adanya suatu inhibitor. Berdasarkan kelompok mekanisme dari protease maka proses inhibisinya pun bersifat selektif dan mengikuti mekanisme dari kerja enzimnya.
Menurut Ryan (1990), klasifikasi inhibitor protease pada jaringan tanaman dibagi menjadi 10 kelompok: inhibitor Kunitz (tripsin kedelai), Bowman-Birk, tripsin jewawut, kentang I, kentang II, ketela, ragi
1−2/jagung bifungsional, karboksipeptidase A dan B, protease kristein (kristatin), dan protease aspartil.
Struktur Protein
Protein (akar kata protos dari bahasa Yunani yang berarti "yang paling utama") adalah senyawa organik kompleks berbobot molekul tinggi yang merupakan polimer dari asam amino. Struktur protein (Gambar 2) dapat dilihat sebagai suatu hirarki. Struktur primer protein merupakan urutan asam-asam amino penyusun protein yang dihubungkan melalui ikatan peptida (amida). Sementara, struktur sekunder protein adalah struktur 3 dimensi lokal dari berbagai rangkaian asam amino pada protein yang distabilkan oleh ikatan hidrogen. Gabungan dari aneka ragam struktur sekunder akan menghasilkan struktur 3 dimensi yang dinamakan struktur tersier. Srtuktur inilah yang memungkinkan beberapa molekul seperti enzim untuk berinteraksi secara efisien dan spesifik menghasilkan aktivitas katalitik terhadap substratnya. Ketika struktur tersier tersebut rusak, protein akan kehilangan aktivitas fisiologisnya, proses ini dinamakan denaturasi (Steavens 2007). Kumpulan beberapa struktur tersier protein menghasilkan struktur kuaterner, yang dapat pula melibatkan molekul protein lain atau gugus-gugus nonprotein.
Struktur Struktur Struktur Struktur primer sekunder tersier kuaterner
Gambar 2 Ilustrasi struktur protein (Berg et al. 2000)
Analisis Protein
Metode analisis protein antara lain metode Lowry, Bradford, FeCl3, dan Biuret. Pemilihan metode merupakan hal yang tidak dapat diabaikan, karena pengukuran konsentrasi secara akurat menjadi sangat penting peranannya, mengingat hasil penetapan ini digunakan dalam perhitungan lainnya, seperti penentuan aktivitas enzim. Metode Bradford adalah metode analisis kadar protein total yang didasarkan pada pengikatan secara langsung zat warna biru brilian Coomassie G250 (CBBG) oleh protein yang mengandung residu asam amino dengan rantai samping aromatik (tirosina, triptopan, dan fenilalanin)
atau bersifat basa (arginin, histidin, dan leusin). Reagen CBBG bebas berwarna merah-kecokelatan (λmaks 465 nm), sedangkan dalam suasana asam, reagen CBBG akan berada dalam bentuk anion yang akan mengikat protein membentuk warna biru (λmaks 595 nm). Jumlah CBBG yang terikat pada protein proporsional dengan muatan positif yang ditemukan pada protein (Sudarmanto 2007).
Elektroforesis SDS-PAGE
SDS-PAGE adalah teknik yang lazim dilakukan pada elektroforesis protein. Teknik ini memberikan perkiraan massa dari suatu molekul polipeptida, dan memberikan hasil analisis dengan resolusi tinggi dari campuran kompeks protein. Namun teknik ini bersifat destruktif, karena membutuhkan protein terdenaturasi untuk efektivitas pemisahan. Untuk memisahkan protein ke dalam rantai-rantai polipeptida tunggal, surfaktan SDS diperlukan dalam kombinasi dengan pereduksi. Protein akan mengikat 1.4 g SDS/g protein, molekul-molekul surfaktan tersebut menempel pada molekul protein. Kompleks protein-SDS secara efektif menudungi muatan awal protein, gugus-gugus sulfat pada detergen menjadikannya secara keseluruhan kompleks protein-SDS ini bermuatan negatif. Elektroforesis dengan penambahan SDS efektif memberikan muatan protein yang seragam dan pemisahan didasarkan pada massa molekul relatif dari rantai-rantai polipeptida (Richards et al. 1998).
Medium yang digunakan pada teknik SDS-PAGE ini adalah poliakrilamida yang memiliki kekuatan tarik yang baik, konduktivitas listrik yang rendah, penyerapan sinar ultraviolet (UV) yang rendah, dan ukuran pori yang mudah diatur. Sebagai pereduksi dapat digunakan 2-merkaptoetanol untuk memutus ikatan-ikatan sulfida, dan untuk memunculkan pita-pita hasil pemisahan dapat digunakan pewarnaan biru Coomassie R250 (CBBR) atau AgNO3.
BAHAN DAN LINGKUP KERJA
Bahan dan alat
3
Struktur Protein
Protein (akar kata protos dari bahasa Yunani yang berarti "yang paling utama") adalah senyawa organik kompleks berbobot molekul tinggi yang merupakan polimer dari asam amino. Struktur protein (Gambar 2) dapat dilihat sebagai suatu hirarki. Struktur primer protein merupakan urutan asam-asam amino penyusun protein yang dihubungkan melalui ikatan peptida (amida). Sementara, struktur sekunder protein adalah struktur 3 dimensi lokal dari berbagai rangkaian asam amino pada protein yang distabilkan oleh ikatan hidrogen. Gabungan dari aneka ragam struktur sekunder akan menghasilkan struktur 3 dimensi yang dinamakan struktur tersier. Srtuktur inilah yang memungkinkan beberapa molekul seperti enzim untuk berinteraksi secara efisien dan spesifik menghasilkan aktivitas katalitik terhadap substratnya. Ketika struktur tersier tersebut rusak, protein akan kehilangan aktivitas fisiologisnya, proses ini dinamakan denaturasi (Steavens 2007). Kumpulan beberapa struktur tersier protein menghasilkan struktur kuaterner, yang dapat pula melibatkan molekul protein lain atau gugus-gugus nonprotein.
Struktur Struktur Struktur Struktur primer sekunder tersier kuaterner
Gambar 2 Ilustrasi struktur protein (Berg et al. 2000)
Analisis Protein
Metode analisis protein antara lain metode Lowry, Bradford, FeCl3, dan Biuret. Pemilihan metode merupakan hal yang tidak dapat diabaikan, karena pengukuran konsentrasi secara akurat menjadi sangat penting peranannya, mengingat hasil penetapan ini digunakan dalam perhitungan lainnya, seperti penentuan aktivitas enzim. Metode Bradford adalah metode analisis kadar protein total yang didasarkan pada pengikatan secara langsung zat warna biru brilian Coomassie G250 (CBBG) oleh protein yang mengandung residu asam amino dengan rantai samping aromatik (tirosina, triptopan, dan fenilalanin)
atau bersifat basa (arginin, histidin, dan leusin). Reagen CBBG bebas berwarna merah-kecokelatan (λmaks 465 nm), sedangkan dalam suasana asam, reagen CBBG akan berada dalam bentuk anion yang akan mengikat protein membentuk warna biru (λmaks 595 nm). Jumlah CBBG yang terikat pada protein proporsional dengan muatan positif yang ditemukan pada protein (Sudarmanto 2007).
Elektroforesis SDS-PAGE
SDS-PAGE adalah teknik yang lazim dilakukan pada elektroforesis protein. Teknik ini memberikan perkiraan massa dari suatu molekul polipeptida, dan memberikan hasil analisis dengan resolusi tinggi dari campuran kompeks protein. Namun teknik ini bersifat destruktif, karena membutuhkan protein terdenaturasi untuk efektivitas pemisahan. Untuk memisahkan protein ke dalam rantai-rantai polipeptida tunggal, surfaktan SDS diperlukan dalam kombinasi dengan pereduksi. Protein akan mengikat 1.4 g SDS/g protein, molekul-molekul surfaktan tersebut menempel pada molekul protein. Kompleks protein-SDS secara efektif menudungi muatan awal protein, gugus-gugus sulfat pada detergen menjadikannya secara keseluruhan kompleks protein-SDS ini bermuatan negatif. Elektroforesis dengan penambahan SDS efektif memberikan muatan protein yang seragam dan pemisahan didasarkan pada massa molekul relatif dari rantai-rantai polipeptida (Richards et al. 1998).
Medium yang digunakan pada teknik SDS-PAGE ini adalah poliakrilamida yang memiliki kekuatan tarik yang baik, konduktivitas listrik yang rendah, penyerapan sinar ultraviolet (UV) yang rendah, dan ukuran pori yang mudah diatur. Sebagai pereduksi dapat digunakan 2-merkaptoetanol untuk memutus ikatan-ikatan sulfida, dan untuk memunculkan pita-pita hasil pemisahan dapat digunakan pewarnaan biru Coomassie R250 (CBBR) atau AgNO3.
BAHAN DAN LINGKUP KERJA
Bahan dan alat
(EDTA), 2-merkaptoetanol, standar tirosina, asam trikloroasetat (TCA), pereaksi Folin-Ciocalteu, fenol, KH2PO4, K2HPO4, N2 cair, standar albumin serum sapi (BSA) (Sigma), pereaksi CBBG (sigma), CBBR (sigma), asam ortofosfat 85% (Sigma), akrilamida, SDS 10%, amonium persulfat (APS) 10%, dan N’,N’,N’,N’-tertrametiletilenadiamina
(TEMED).
Alat-alat yang digunakan adalah spektrofotometer UV-VIS, tabung eppendorf, pipet mikro, penangas air, lemari pendingin, peralatan elektroforesis SDS-PAGE, sentrifus, dan alat-alat kaca.
Lingkup Kerja
Penelitian ini terdiri atas 4 tahap. Tahap pertama ialah ekstraksi protein pada kulit dan biji kakao serta protein intraselular dan ekstraselular hasil E. coli yang telah diklon gen TcPIN baik dari kulit buah kakao (Ary dan Bal) maupun dari biji buah kakao (Biji). Tahap kedua ialah penentuan kadar protein hasil ekstraksi dengan metode Bradford. Tahap ketiga ialah identifikasi bobot molekul protein dengan elektroforesis SDS-PAGE dan tahap keempat ialah uji aktivitas inhibisi protease protein oleh hasil ekstraksi secara in vitro dengan metode spektrofotometri. Tahapan ini tergambar pada diagram alir penelitian (Lampiran 1) dan prosedur pembuatan pereaksi yang digunakan terdapat pada Lampiran 2.
Ekstraksi Protein
Protein diekstraksi menggunakan salah satu metode yang dikemukakan oleh Pirovani
et al. (2008), dengan sejumlah modifikasi. Contoh dalam bentuk kulit dan biji buah kakao ditambahkan N2 cair dan digerus dengan mortar. Sekitar 2 g hasil gerusan dimasukkan ke dalam tabung sentrifus yang berisi 20 ml aseton dingin dan dikocok kuat. Campuran disentrifugasi dengan laju 10,000 g dengan suhu 4 °C selama 15 menit. Endapan yang dihasilkan diberi 10 ml aseton yang mengandung TCA 10%, dikocok kuat lalu disentrifugasi pada kondisi yang sama seperti di atas. Hal ini dilakukan 3 kali. Selanjutnya endapan dicuci dengan TCA 10% dalam pelarut air kemudian aseton 80% masing-masing satu kali. Endapan yang dihasilkan disuspensikan dengan larutan SDS-dense
sebanyak 10 ml dan didiamkan selama 15 menit. Setelah itu, diberi 20 ml larutan fenol, dikocok, dan diinkubasi selama 30 menit pada suhu -20 oC sebelum disentrifugasi dengan
laju 10,000 g dengan suhu 4 oC selama 10 menit. Fase atas diambil dan diberi 40 ml aseton kemudian dinkubasi pada suhu -20 oC selama 18 jam. Endapan yang terbentuk kemudian diambil dengan cara disentrifugasi dengan laju 10,000 g pada suhu 4 oC selama 5 menit, lalu endapan yang diperoleh dilarutkan dengan bufer fosfat pH 6.5 sebanyak 2.5 ml.
Contoh berupa kultur E. coli yang membawa gen TcPIN disentifugasi dengan laju 10,000 g dengan suhu 4 oC selama 15 menit, untuk memisahkan medium kultur sebagai supernatan dan bakteri E. coli hasil biakan sebagai pelet. Supernatan yang diperoleh diambil sebagai protein ekspresi ekstraselular dan dilakukan prakonsentrasi dengan mengendapkan protein dengan aseton (supernatan-aseton 1:4), dan dilarutkan kembali dengan bufer fosfat pH 6.5. Sementara itu, pelet yang terpisah ditimbang, digerus dengan mortar dengan penambahan sedikit N2 cair sampai halus, lalu ditetesi dengan bufer fosfat pH 6.5 (dingin) 0.05 M dengan nisbah1 ml untuk 2 g pelet. Suspensi yang didapat disentrifugasi dengan kecepatan 10,000 g dengan suhu 4 oC selama 15 menit. Supernatan yang diperoleh diambil sebagai protein hasil ekspresi intraselular.
Analisis Protein
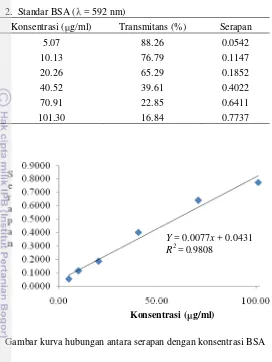
Analisis protein dilakukan dengan menggunakan metode Bradford (1976) dengan beberapa modifikasi. Ekstrak protein dianalisis dengan cara memasukkansejumlah tertentu larutan contoh dan akuades hingga mencapai volume 100 l ke dalam tabung Eppendorf, lalu ditambahkan ke dalamnya 100 mL NaOH 0.1 M dan 3 ml pereaksi Bradford. Campuran digoyang dan didiamkan selama 30 menit, lalu diukur serapannya dengan spektrofotometer pada panjang gelombangmaksimum ( maks sekitar 595 nm. Sebagai pembanding, digunakan model kalibrasi hubungan antara konsentrasi dan serapan dari sejumlah deret standar. Standar yang digunakan ialah 100 l BSA dengan beberapa konsentrasi berbeda yang dianalisis dengan cara yang sama. Sementara blangko ialah 100 l akuades yang dianalisis dengan cara yang sama.
5
dengan cara mencampur 3.35 ml akuades, 2.5 ml tris-HCl 1.5 M pH 8.8, 0.1 ml SDS 10%, 4 ml akrilamida, 0.1 ml APS 10%, dan 0.015 ml TEMED ke dalam Erlenmeyer, lalu dimasukkan ke dalam cetakan sampai batas tertentu (sesuai dengan tinggi sisir). Isopropanol ditempatkan secara perlahan ke atas gel tersebut untuk meratakannya, lalu dibiarkan membeku, dan sisa isopropanol dibersihkan dari permukaan gel dengan kertas saring. Larutan stacking gel 4.5% dituang ke atas permukaan gel tersebut, kemudian sisir dipasang dan dibiarkan membeku. Sisir lalu dibuka secara perlahan dan gel siap digunakan.
Setelah peralatan elektroforesis disiapkan, larutan bufer loading ditempatkan pada alat. Setelah itu, sampel dimasukan ke dalam sumur pada gel SDS-PAGE, dipanaskan selama 4 menit, lalu diberi arus listrik hingga pewarna mencapai ujung gel (tegangan yang dipakai 110 150 V). Setelah elektroforesis selesai, dilanjutkan dengan pewarnaan.
Perwarnaan dapat dilakukan dengan 2 cara, yaitu dengan biru Coomassie atau dengan AgNO3. Pewarnaan dengan biru Coomassie dilakukan dengan merendam gel dengan larutan pewarna CBBR selama 90 menit, kemudian dilakukan dekolorisasi (pemucatan warna sehingga muncul pita-pita hasil pemisahan) dengan merendam gel dalam air mendidih selama 10 menit. Sementara itu, pewarnaan dengan AgNO3 dilakukan dengan cara merendam gel dalam larutan fiksatif selama 1 jam, lalu dicuci selama 30 menit sebanyak 2 kali dalam campuran metanol-air 1:1. Setelah itu gel direndam dalam larutan pewarna AgNO3 selama 15 menit dan direndam dengan akuades sebanyak 5 kali. Pita-pita pada gel dimunculkan warnanya dengan cara merendam gel tersebut pada larutan revelasi selama 3 5 menit.
Aktivitas Inhibitor Tripsin
Aktivitas inhibitor tripsin ditentukan secara tidak langsung dari aktivitas tripsinnya. Aktivitas tripsin diukur dengan metode yang dikemukakan oleh Walter (1984) yaitu memasukkan berturut-turut 150 l bufer tris-HCl pH 7.8, 50 l larutan contoh, dan 350 l substrat kasein 2%, dan setelah itu divorteks. Campuran diinkubasi selama 0 dan 15 menit pada suhu 37 oC. Reaksi dihentikan dengan menambahkan 1 ml TCA 0.3 M, lalu divorteks kembali, dan didiamkan selama 10 menit pada suhu ruang. Setelah itu, campuran disentrifugasi dengan laju 10,000 g pada suhu
4 oC selama 10 menit. Supernatan yang dihasilkan dipipet sebanyak 0.4 ml ke dalam tabung Eppendorf yang bersih lalu ditambahkan ke dalamnya 0.85 ml NaOH 0.5 M dan 0.25 ml pereaksi Folin-Ciocalteu. Larutan lalu didiamkan selama 15 menit dan diukur serapannya pada 728 nm. Sebagai pembanding digunakan model kalibrasi dari sederet standar. Standar yang digunakan ialah tirosina yang dianalisis dengan cara yang sama
Aktivitas inhibitor tripsin dari masing-masing ekstrak protein diukur dengan cara mencampur 25 l ekstrak protein dan 25 l larutan stok tripsin 1 mg/ml ke dalam tabung Eppendorf, untuk selanjutnya diuji aktivitas tripsinnya. Aktivitas inhibisi diperoleh dengan membandingkan nilai yang didapat dengan aktivitas tripsin tanpa penambahan ekstrak protein.
HASIL DAN PEMBAHASAN
Ekstrak Protein
Sel dipecahkan dengan penggerusan menggunakan mortar. N2 cair ditambahkan selama penggerusan sel agar tetap stabil. Bufer ektraksi yang digunakan memiliki pH 6.5, dan pada pH ini diharapkan protein target yang berada di bagian dalam sel dapat terekstraksi dengan baik.
Pada ekstraksi protein ekstraselular dilakukan prakonsentrasi menggunakan aseton. Hal ini dikarenakan nisbah antara protein ekstraselular dan medium yang digunakan sangat kecil. Protein ini pun masih bercampur dengan sisa nutrien dalam medium. Hasil pengendapan dengan cara ini tidak seluruhnya dapat larut kembali ketika ditambahkan bufer fosfat pH 6.5. Sisa endapan yang tidak larut kemudian disaring sehingga diperoleh protein terlarut yang digunakan untuk pengujian selanjutnya.
Ekstraksi protein dari kulit buah kakao sangat sulit karena kandungan pektinnya yang membentuk gel saat dilarutkan dengan air. Pada saat pencucian dengan TCA 10% berair, terbentuk gel yang pekat. Molekul protein diduga terperangkap dalam matriks gel ini, sehingga ekstraksi menjadi tidak efektif. Pada metode yang dilakukan oleh Pirovani et al.
dengan cara mencampur 3.35 ml akuades, 2.5 ml tris-HCl 1.5 M pH 8.8, 0.1 ml SDS 10%, 4 ml akrilamida, 0.1 ml APS 10%, dan 0.015 ml TEMED ke dalam Erlenmeyer, lalu dimasukkan ke dalam cetakan sampai batas tertentu (sesuai dengan tinggi sisir). Isopropanol ditempatkan secara perlahan ke atas gel tersebut untuk meratakannya, lalu dibiarkan membeku, dan sisa isopropanol dibersihkan dari permukaan gel dengan kertas saring. Larutan stacking gel 4.5% dituang ke atas permukaan gel tersebut, kemudian sisir dipasang dan dibiarkan membeku. Sisir lalu dibuka secara perlahan dan gel siap digunakan.
Setelah peralatan elektroforesis disiapkan, larutan bufer loading ditempatkan pada alat. Setelah itu, sampel dimasukan ke dalam sumur pada gel SDS-PAGE, dipanaskan selama 4 menit, lalu diberi arus listrik hingga pewarna mencapai ujung gel (tegangan yang dipakai 110 150 V). Setelah elektroforesis selesai, dilanjutkan dengan pewarnaan.
Perwarnaan dapat dilakukan dengan 2 cara, yaitu dengan biru Coomassie atau dengan AgNO3. Pewarnaan dengan biru Coomassie dilakukan dengan merendam gel dengan larutan pewarna CBBR selama 90 menit, kemudian dilakukan dekolorisasi (pemucatan warna sehingga muncul pita-pita hasil pemisahan) dengan merendam gel dalam air mendidih selama 10 menit. Sementara itu, pewarnaan dengan AgNO3 dilakukan dengan cara merendam gel dalam larutan fiksatif selama 1 jam, lalu dicuci selama 30 menit sebanyak 2 kali dalam campuran metanol-air 1:1. Setelah itu gel direndam dalam larutan pewarna AgNO3 selama 15 menit dan direndam dengan akuades sebanyak 5 kali. Pita-pita pada gel dimunculkan warnanya dengan cara merendam gel tersebut pada larutan revelasi selama 3 5 menit.
Aktivitas Inhibitor Tripsin
Aktivitas inhibitor tripsin ditentukan secara tidak langsung dari aktivitas tripsinnya. Aktivitas tripsin diukur dengan metode yang dikemukakan oleh Walter (1984) yaitu memasukkan berturut-turut 150 l bufer tris-HCl pH 7.8, 50 l larutan contoh, dan 350 l substrat kasein 2%, dan setelah itu divorteks. Campuran diinkubasi selama 0 dan 15 menit pada suhu 37 oC. Reaksi dihentikan dengan menambahkan 1 ml TCA 0.3 M, lalu divorteks kembali, dan didiamkan selama 10 menit pada suhu ruang. Setelah itu, campuran disentrifugasi dengan laju 10,000 g pada suhu
4 oC selama 10 menit. Supernatan yang dihasilkan dipipet sebanyak 0.4 ml ke dalam tabung Eppendorf yang bersih lalu ditambahkan ke dalamnya 0.85 ml NaOH 0.5 M dan 0.25 ml pereaksi Folin-Ciocalteu. Larutan lalu didiamkan selama 15 menit dan diukur serapannya pada 728 nm. Sebagai pembanding digunakan model kalibrasi dari sederet standar. Standar yang digunakan ialah tirosina yang dianalisis dengan cara yang sama
Aktivitas inhibitor tripsin dari masing-masing ekstrak protein diukur dengan cara mencampur 25 l ekstrak protein dan 25 l larutan stok tripsin 1 mg/ml ke dalam tabung Eppendorf, untuk selanjutnya diuji aktivitas tripsinnya. Aktivitas inhibisi diperoleh dengan membandingkan nilai yang didapat dengan aktivitas tripsin tanpa penambahan ekstrak protein.
HASIL DAN PEMBAHASAN
Ekstrak Protein
Sel dipecahkan dengan penggerusan menggunakan mortar. N2 cair ditambahkan selama penggerusan sel agar tetap stabil. Bufer ektraksi yang digunakan memiliki pH 6.5, dan pada pH ini diharapkan protein target yang berada di bagian dalam sel dapat terekstraksi dengan baik.
Pada ekstraksi protein ekstraselular dilakukan prakonsentrasi menggunakan aseton. Hal ini dikarenakan nisbah antara protein ekstraselular dan medium yang digunakan sangat kecil. Protein ini pun masih bercampur dengan sisa nutrien dalam medium. Hasil pengendapan dengan cara ini tidak seluruhnya dapat larut kembali ketika ditambahkan bufer fosfat pH 6.5. Sisa endapan yang tidak larut kemudian disaring sehingga diperoleh protein terlarut yang digunakan untuk pengujian selanjutnya.
Ekstraksi protein dari kulit buah kakao sangat sulit karena kandungan pektinnya yang membentuk gel saat dilarutkan dengan air. Pada saat pencucian dengan TCA 10% berair, terbentuk gel yang pekat. Molekul protein diduga terperangkap dalam matriks gel ini, sehingga ekstraksi menjadi tidak efektif. Pada metode yang dilakukan oleh Pirovani et al.
6
21 kDa
kakao ini berupa endapan putih. Namun, endapan yang terbentuk ini tidak seluruhnya dapat larut sempurna dalam bufer fosfat pH 6.5. Penyaringan dilakukan untuk meng-hilangkan protein yang tidak terlarut.
Kadar Protein Total
Pengukuran kadar protein bertujuan untuk mengetahui nisbah awal antara volume sampel dan tripsin yang digunakan dalam pengujian aktivitas inhibisi tripsin. Namun data protein ini tidak dapat digunakan untuk menentukan sifat inhibisi dari protein inhibitor tripsin itu sendiri. Protein yang diuji masih merupakan ekstrak kasar dan perlu dilakukan fraksionasi untuk memisahkan protein target yang akan diuji dari protein lainnya.
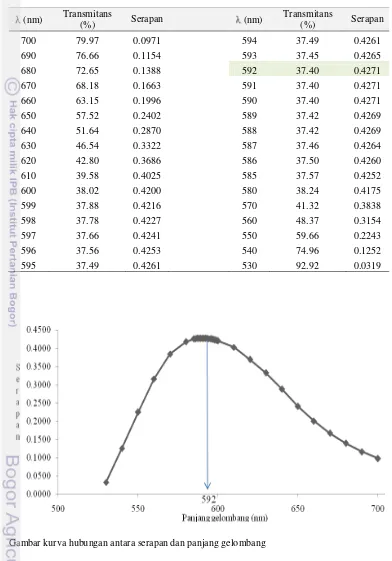
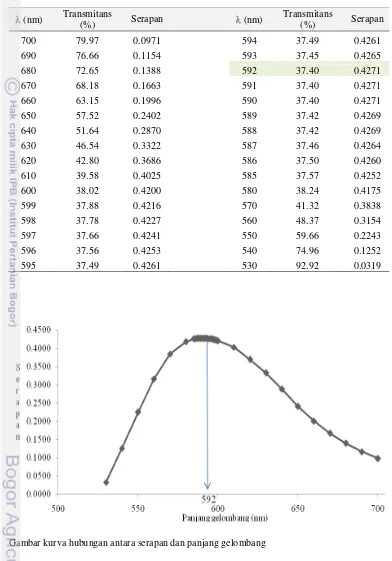
Pengukuran serapan pada penentuan kadar protein ini dilakukan pada 592 nm. Hal ini sesuai dengan nilai serapan tertinggi pada saat pemilihan maks (Lampiran 3). Nilainya berbeda dengan maks yang direkomendasikan oleh Sudarmanto (2007) dan Mikkelsen (2004), yaitu berturut-turut 595 dan 590 nm. Namun, perbedaan ini tidak menimbulkan penyimpangan yang berarti pada hasil pengukuran. Pada maksimum, serapan akan memberikan respons yang optimum sehingga nisbah antara sinyal analat dan sinyal yang akibat derau akan semakin tinggi. Perbedaan maksimum ini dapat terjadi karena perbedaan kondisi alat dan lingkungan saat pengukuran dilakukan.
Hasil pengukuran dengan metode Bradford dapat dilihat pada Lampiran 4. Berdasarkan hasil pengukuran kadar protein, aktivitas inhibitor tripsin protein intraselular dan ekstraselular, diuji pada nisbah volume ekstrak protein pada volume tripsin sebesar 1:1, dengan konsentrasi tripsin aktual yang digunakan adalah 1.03 mg/ml. Hal ini agar pada saat pengukuran aktivitas tripsin, serapan yang diperoleh berada pada daerah kurva standar tirosina. Akan tetapi, aktivitas inhibitor spesifik dari protein 21 kDa yang terekspresi sulit ditentukan, terlebih untuk membandingkan sifat inhibisinya. Hal ini karena menggunakan ekstrak protein kasar yang belum mengalami fraksionasi. Walaupun demikian, pengujian aktivitas inhibitor tripsin dengan nisbah 1:1 antara ekstrak protein dan tripsin yang digunakan, diharapkan dapat memberikan pembuktian bahwa gen TcPIN
yang diklon pada E. coli memang mengekspresikan protein 21 kDa yang aktif sebagai inhibitor tripsin. Penurunan aktivitas
tripsin dengan adanya penambahan ekstrak protein dibandingkan dengan tanpa penambahan ekstrak (kontrol) menjadi identitasnya sebagai inhibitor tripsin.
Homologi pada Bobot Molekul Protein Uji homologi dengan SDS-PAGE ni bertujuan memperkirakan jenis dan fungsi protein yang terekspresi berdasarkan bobot molekulnya. Namun, bobot molekul yang homolog tidak sepenuhnya dapat memberi kepastian akan fungsi molekul protein itu sendiri. Pengujian yang lebih spesifik diperlukan untuk menunjukkan fungsi sesungguhnya dari protein tersebut.
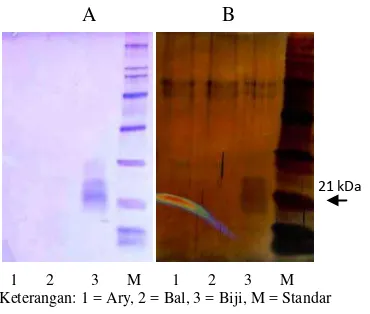
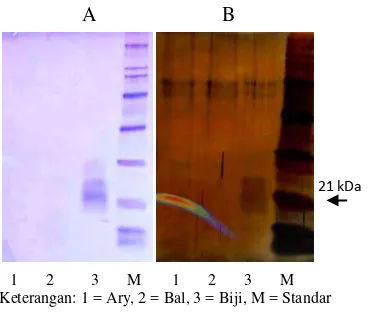
Pencirian bobot molekul pada protein hasil ekstraksi dari kulit dan biji buah kakao dengan metode SDS-PAGE diperlihatkan pada Gambar 3A. Hasilnya, terlihat pita pada ekstrak protein Biji (3) dengan bobot molekul yang sedikit lebih tinggi dari penanda standar 21 kDa (M). Pita yang terlihat pun berbayang, hal ini diduga disebabkan oleh masih adanya polisakarida yang mengganggu (Pirovani et al. 2008). Pada ekstrak protein dari kulit buah sama sekali tidak nampak pita di daerah sekitar 21 kDa, baik pada klon Ary (1) maupun Bal (2). Hal ini disebabkan metode ekstraksi pada penelitian ini tidak dapat mengekstraksi protein dari matriks contoh kulit buah dan ekstrak protein dari kulit dan buah kakao ini tidak dilanjutkan ke tahap pengujian aktivitas inhibitor tripsin. Hal serupa diperoleh pula pada pewarnaan dengan AgNO3 seperti terlihat pada Gambar 3B.
A B
1 2 3 M 1 2 3 M Keterangan: 1 = Ary, 2 = Bal, 3 = Biji, M = Standar
21 kDa
4A), tidak terlihat jelas pita pada daerah sekitar 21 kDa, baik pada kulit kakao Bal (2) maupun Ary (3). Akan tetapi, Biji (1) terlihat ekspresinya pada daerah sekitar 21 kDa. Pewarnaan yang digunakan untuk memunculkan pita pada bagian ini adalah pewarna AgNO3 yang memiliki sensitivitas 100 kali lebih tinggi daripada pewarna biru Coomassie (Merril et al. 1979). Hal ini dilakukan karena pita-pita yang terbentuk pada pewarnaan dengan biru Coomassie tidak dapat dianalisis (data tidak ditampilkan).
Pada pencirian protein intraselular (Gambar 4B). Pita di daerah sekitar 21 kDa teramati pada protein intraselular Ary (3) dan Bal (2). Kedua pita ini terlihat doublet, hal ini diduga disebabkan kadar 2-merkaptoetanol pada loading bufer kurang mencukupi atau telah mengalami kerusakan pada saat penyimpanan (Bio-rad 2009). Pita yang sejajar dengan penanda standar 21 kDa (M) terlihat sedikit berimpitan dengan pita yang memiliki bobot molekul lebih tinggi. Namun, protein 21 kDa cukup teridentifikasi dengan jelas dan dapat menunjukkan bahwa kedua bakteri E. coli yang diklon gen TcPIN yang mengekspresikan protein 21 kDa. Pada protein intraselular Biji (1), bobot molekul protein yang teramati lebih besar dari 21 kDa, dan perbedaan bobot molekul ini terlihat cukup jelas. Berdasarkan hal ini dapat dikatakan bahwa E. coli yang diklon gen
TcPIN dari biji buah kakao tidak
mengekspresiakan protein yang berukuran 21 kDa.
A B
1 2 3 M 1 2 3 M Keterangan: 1 = Biji, 2 = Ary, 3 = Bal, M = Standar
Gambar 4 Hasil elektroforesis SDS-PAGE protein ekspresi ekstraselular (A) dan intraselular (B).
Aktivitas Inhibitor Tripsin
Penurunan aktivitas tripsin dengan penambahan ekstrak protein merupakan
petunjuk adanya aktivitas sebagai inhibitor tripsin. Penurunan ini disebabkan oleh adanya interaksi protein dengan tapak aktif dari tripsin, yang akan menginhibisi aktivitasnya sebagai enzim protease. Waktu inkubasi yang dipilih pada percobaan ini ialah 15 menit. Pada waktu inkubasi ini diharapkan serapan pada saat pengukuran tetap berada pada kisaran kurva standar tirosina yang digunakan.
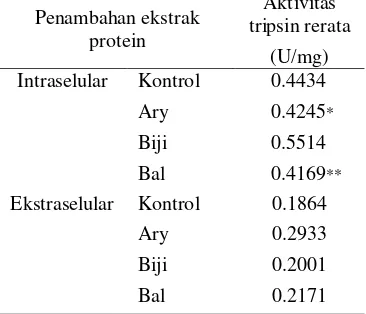
Pada Tabel 1 terlihat penurunan aktivitas tripsin untuk pengujian dengan penambahan ekstrak protein intraselular dari E. coli yang diklon gen TcPIN dari kulit buah kakao baik pada klon Ary maupun Bal. Penurunan ini terjadi dari aktivitas tripsin tanpa penambahan ekstrak protein (kontrol), yaitu sebesar 0.4434 U/mg berturut-turut menjadi 0.4245 U/mg dan 0.4169 U/mg. Penurunan ini berturut-turut nyata dan sangat nyata berdasarkan uji t-student two-tails. Adanya penurunan ini menunjukkan bahwa pita 21 pada hasil SDS-PAGE (Gambar 4B) merupakan protein yang aktif sebagai inhibitor tripsin. Selain itu juga membuktikan bahwa gen TcPIN dari kulit buah kakao klon Bal (2) dan Ary (3) yang ditransformasikan merupakan gen yang mengekspresikan protein 21 kDa yang aktif sebagai inhibitor tripsin. Hasil yang berkebalikan ditunjukkan pada penambahan ekstrak protein Biji. Aktivitas tripsinnya justru meningkat dari aktivitas kontrol menjadi 0.5514 U/mg. Data lengkap hasil pengujian protein intraselular ini terdapat pada Lampiran 5.
Tabel 1 Hasil pengukuran aktivitas tripsin Penambahan ekstrak
protein
Aktivitas tripsin rerata
(U/mg) Intraselular Kontrol 0.4434
Ary 0.4245* Biji 0.5514 Bal 0.4169** Ekstraselular Kontrol 0.1864
Ary 0.2933
Biji 0.2001
Bal 0.2171
Keterangan: penurunan aktivitas tripsin secara statistik berbeda: (*) nyata, (**) sangat nyata
8
ektraselular dan intraselular berbeda, yaitu berturut-turut 0.4434 dan 0.1864 U/mg. Hal ini karena waktu pengujian yang berbeda 5 hari dengan pengujian pada ekstrak protein intraselular. Penurunan dapat terjadi karena adanya galat pada pengaturan kondisi percobaan diantara pengujian protein ekstraselular dan intraselular. Kendatipun demikian, hal ini tidak menjadikan hasil pengujian inhibitor tripsin ini menjadi bias. Pengujian protein ekstraselular maupun intraselular, masing-masing dibandingkan dengan kontrol yang dianalisis pada waktu dan kondisi yang sama. Adanya kemungkinan terjadinya galat dari perbedaan hasil pengukuran aktivitas tripsin dengan ataupun tanpa perlakuan diharapkan dapat diminimumkan pada kondisi percobaan seperti ini.
Pada hasil SDS-PAGE (Gambar 4A), walaupun terlihat pita pada daerah sekitar 21 kDa ditunjukkan ada pada ekstrak protein ekstraselular gen TcPIN dari biji (1), tetapi uji
in vitro tidak menunjukkan penurunan aktivitas tripsin. Hal serupa juga diperoleh pada pengujian aktivitas inhibitor tripsin pada protein intraselularnya. Hal ini mempertegas bahwa gen TcPIN yang diisolasi dari biji kakao ini tidak mengekspresikan protein yang berperan sebagai inhibitor tripsin. Menurut Tai et al. (1991) protein 21 kDa yang ditemukan dalam jumlah yang besar di biji merupakan protein simpanan. Secara fisiologis biji berfungsi sebagai jaringan penyimpan (sink tissue) maka metabolit yang dikandung di dalamnya adalah cadangan makanan atau metabolit tersimpan.
Pada protein ektraselular E. coli yang diklon gen TcPIN dari kulit buah kakao, baik dari klon Ary ataupun Bal, keduanya menunjukkan hasil yang bersesuaian, yaitu antara hasil pencirian dengan SDS-PAGE tidak menunjukkan adanya pita di daerah sekitar 21 kDa. Hasil uji in vitro pun tidak menunjukkan aktivitas inhibitor tripsin. Berdasarkan hasil ini maka diketahui bahwa gen TcPIN ini tidak terekspresi secara ekstraselular.
Berdasarkan hasil penelitian Isda et al. 2008, gen yang menunjukkan fungsi sebagai gen TcPIN dari kakao akan mengekpresikan protein 21 kDa yang memiliki homologi dengan inhibitor tripsin. Pada hasil penelitian ini terbukti gen TcPIN yang diisolasi dari kulit buah kakao baik dari klon Ary maupun Bal menunjukkan aktivitas inhibitor tripsin pada protein hasil ekspresi intraselular. Sementara
gen TcPIN yang diisolasi dari biji kakao, ekspresi proteinnya tidak menunjukkan aktivitas sebagai inhibitor tripsin, baik pada protein hasil ekspresi secara ekstraselular maupun intraselular.
SIMPULAN DAN SARAN
E. coli hasil trasformasi gen TcPIN
yang diisolasi dari kulit buah kakao dari klon Ary ataupun Bal mengekspresikan secara intraselular protein yang aktif sebagai inhibitor tripsin. Di sisi lain, hasil transformasi gen TcPIN yang diisolasi dari biji kakao tidak mengekspresikan protein yang aktif sebagai inhibitor tripsin, baik secara intraselular, maupun ekstraselular.
Masih diperlukan fraksionasi pada ekstrak protein terekspresi agar dapat diketahui karakter penghambatan spesifik dari protein 21 kDa yang diekspresikan oleh gen-gen tersebut. Hal ini untuk mengetahui apakah karakter dari protein yang diekspresikan oleh gen TcPIN tanaman kakao memberikan pengaruh terhadap serangan hama PBK.
DAFTAR PUSTAKA
Berg JM, Tymaczko JL, Stryer L. 2000.
Biochemistry. Ed ke-5. New York: WH Freeman.
[Bio-rad.]. 2009. SDS-PAGE molecular weight standards, broad range.
http://www.bio-rad.com/webroot/web/ pdf/ lsr/ literature/Bulletin_9515.pdf. [17 Nov 2009].
Bradford MM. 1976. A rapid and sensitive method for quantitation of protein utilization: The principle of protein-dye binding. Anal Biochem 72:248-254. Chaidamsari T. 2005. Biotechnology for
cacao pod borer resistance in cacao, [disertasi]. Wagenigen: Plant Research International, Wagenigen University. [Depperin]. Departemen Perindustrian. 2007.
Gambaran Sekilas Industri Kakao. Jakarta: Sekertariat Jenderal Departemen Perindustrian.
ektraselular dan intraselular berbeda, yaitu berturut-turut 0.4434 dan 0.1864 U/mg. Hal ini karena waktu pengujian yang berbeda 5 hari dengan pengujian pada ekstrak protein intraselular. Penurunan dapat terjadi karena adanya galat pada pengaturan kondisi percobaan diantara pengujian protein ekstraselular dan intraselular. Kendatipun demikian, hal ini tidak menjadikan hasil pengujian inhibitor tripsin ini menjadi bias. Pengujian protein ekstraselular maupun intraselular, masing-masing dibandingkan dengan kontrol yang dianalisis pada waktu dan kondisi yang sama. Adanya kemungkinan terjadinya galat dari perbedaan hasil pengukuran aktivitas tripsin dengan ataupun tanpa perlakuan diharapkan dapat diminimumkan pada kondisi percobaan seperti ini.
Pada hasil SDS-PAGE (Gambar 4A), walaupun terlihat pita pada daerah sekitar 21 kDa ditunjukkan ada pada ekstrak protein ekstraselular gen TcPIN dari biji (1), tetapi uji
in vitro tidak menunjukkan penurunan aktivitas tripsin. Hal serupa juga diperoleh pada pengujian aktivitas inhibitor tripsin pada protein intraselularnya. Hal ini mempertegas bahwa gen TcPIN yang diisolasi dari biji kakao ini tidak mengekspresikan protein yang berperan sebagai inhibitor tripsin. Menurut Tai et al. (1991) protein 21 kDa yang ditemukan dalam jumlah yang besar di biji merupakan protein simpanan. Secara fisiologis biji berfungsi sebagai jaringan penyimpan (sink tissue) maka metabolit yang dikandung di dalamnya adalah cadangan makanan atau metabolit tersimpan.
Pada protein ektraselular E. coli yang diklon gen TcPIN dari kulit buah kakao, baik dari klon Ary ataupun Bal, keduanya menunjukkan hasil yang bersesuaian, yaitu antara hasil pencirian dengan SDS-PAGE tidak menunjukkan adanya pita di daerah sekitar 21 kDa. Hasil uji in vitro pun tidak menunjukkan aktivitas inhibitor tripsin. Berdasarkan hasil ini maka diketahui bahwa gen TcPIN ini tidak terekspresi secara ekstraselular.
Berdasarkan hasil penelitian Isda et al. 2008, gen yang menunjukkan fungsi sebagai gen TcPIN dari kakao akan mengekpresikan protein 21 kDa yang memiliki homologi dengan inhibitor tripsin. Pada hasil penelitian ini terbukti gen TcPIN yang diisolasi dari kulit buah kakao baik dari klon Ary maupun Bal menunjukkan aktivitas inhibitor tripsin pada protein hasil ekspresi intraselular. Sementara
gen TcPIN yang diisolasi dari biji kakao, ekspresi proteinnya tidak menunjukkan aktivitas sebagai inhibitor tripsin, baik pada protein hasil ekspresi secara ekstraselular maupun intraselular.
SIMPULAN DAN SARAN
E. coli hasil trasformasi gen TcPIN
yang diisolasi dari kulit buah kakao dari klon Ary ataupun Bal mengekspresikan secara intraselular protein yang aktif sebagai inhibitor tripsin. Di sisi lain, hasil transformasi gen TcPIN yang diisolasi dari biji kakao tidak mengekspresikan protein yang aktif sebagai inhibitor tripsin, baik secara intraselular, maupun ekstraselular.
Masih diperlukan fraksionasi pada ekstrak protein terekspresi agar dapat diketahui karakter penghambatan spesifik dari protein 21 kDa yang diekspresikan oleh gen-gen tersebut. Hal ini untuk mengetahui apakah karakter dari protein yang diekspresikan oleh gen TcPIN tanaman kakao memberikan pengaruh terhadap serangan hama PBK.
DAFTAR PUSTAKA
Berg JM, Tymaczko JL, Stryer L. 2000.
Biochemistry. Ed ke-5. New York: WH Freeman.
[Bio-rad.]. 2009. SDS-PAGE molecular weight standards, broad range.
http://www.bio-rad.com/webroot/web/ pdf/ lsr/ literature/Bulletin_9515.pdf. [17 Nov 2009].
Bradford MM. 1976. A rapid and sensitive method for quantitation of protein utilization: The principle of protein-dye binding. Anal Biochem 72:248-254. Chaidamsari T. 2005. Biotechnology for
cacao pod borer resistance in cacao, [disertasi]. Wagenigen: Plant Research International, Wagenigen University. [Depperin]. Departemen Perindustrian. 2007.
Gambaran Sekilas Industri Kakao. Jakarta: Sekertariat Jenderal Departemen Perindustrian.
AKTIVITAS INHIBITOR TRIPSIN DARI PROTEIN
EKSPRESI INTRASELULAR DAN EKSTRASELULAR Gen
TcPIN
YANG DITRANSFORMASIKAN PADA
Eschericia coli
MUHAMAD LUTFILAH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ektraselular dan intraselular berbeda, yaitu berturut-turut 0.4434 dan 0.1864 U/mg. Hal ini karena waktu pengujian yang berbeda 5 hari dengan pengujian pada ekstrak protein intraselular. Penurunan dapat terjadi karena adanya galat pada pengaturan kondisi percobaan diantara pengujian protein ekstraselular dan intraselular. Kendatipun demikian, hal ini tidak menjadikan hasil pengujian inhibitor tripsin ini menjadi bias. Pengujian protein ekstraselular maupun intraselular, masing-masing dibandingkan dengan kontrol yang dianalisis pada waktu dan kondisi yang sama. Adanya kemungkinan terjadinya galat dari perbedaan hasil pengukuran aktivitas tripsin dengan ataupun tanpa perlakuan diharapkan dapat diminimumkan pada kondisi percobaan seperti ini.
Pada hasil SDS-PAGE (Gambar 4A), walaupun terlihat pita pada daerah sekitar 21 kDa ditunjukkan ada pada ekstrak protein ekstraselular gen TcPIN dari biji (1), tetapi uji
in vitro tidak menunjukkan penurunan aktivitas tripsin. Hal serupa juga diperoleh pada pengujian aktivitas inhibitor tripsin pada protein intraselularnya. Hal ini mempertegas bahwa gen TcPIN yang diisolasi dari biji kakao ini tidak mengekspresikan protein yang berperan sebagai inhibitor tripsin. Menurut Tai et al. (1991) protein 21 kDa yang ditemukan dalam jumlah yang besar di biji merupakan protein simpanan. Secara fisiologis biji berfungsi sebagai jaringan penyimpan (sink tissue) maka metabolit yang dikandung di dalamnya adalah cadangan makanan atau metabolit tersimpan.
Pada protein ektraselular E. coli yang diklon gen TcPIN dari kulit buah kakao, baik dari klon Ary ataupun Bal, keduanya menunjukkan hasil yang bersesuaian, yaitu antara hasil pencirian dengan SDS-PAGE tidak menunjukkan adanya pita di daerah sekitar 21 kDa. Hasil uji in vitro pun tidak menunjukkan aktivitas inhibitor tripsin. Berdasarkan hasil ini maka diketahui bahwa gen TcPIN ini tidak terekspresi secara ekstraselular.
Berdasarkan hasil penelitian Isda et al. 2008, gen yang menunjukkan fungsi sebagai gen TcPIN dari kakao akan mengekpresikan protein 21 kDa yang memiliki homologi dengan inhibitor tripsin. Pada hasil penelitian ini terbukti gen TcPIN yang diisolasi dari kulit buah kakao baik dari klon Ary maupun Bal menunjukkan aktivitas inhibitor tripsin pada protein hasil ekspresi intraselular. Sementara
gen TcPIN yang diisolasi dari biji kakao, ekspresi proteinnya tidak menunjukkan aktivitas sebagai inhibitor tripsin, baik pada protein hasil ekspresi secara ekstraselular maupun intraselular.
SIMPULAN DAN SARAN
E. coli hasil trasformasi gen TcPIN
yang diisolasi dari kulit buah kakao dari klon Ary ataupun Bal mengekspresikan secara intraselular protein yang aktif sebagai inhibitor tripsin. Di sisi lain, hasil transformasi gen TcPIN yang diisolasi dari biji kakao tidak mengekspresikan protein yang aktif sebagai inhibitor tripsin, baik secara intraselular, maupun ekstraselular.
Masih diperlukan fraksionasi pada ekstrak protein terekspresi agar dapat diketahui karakter penghambatan spesifik dari protein 21 kDa yang diekspresikan oleh gen-gen tersebut. Hal ini untuk mengetahui apakah karakter dari protein yang diekspresikan oleh gen TcPIN tanaman kakao memberikan pengaruh terhadap serangan hama PBK.
DAFTAR PUSTAKA
Berg JM, Tymaczko JL, Stryer L. 2000.
Biochemistry. Ed ke-5. New York: WH Freeman.
[Bio-rad.]. 2009. SDS-PAGE molecular weight standards, broad range.
http://www.bio-rad.com/webroot/web/ pdf/ lsr/ literature/Bulletin_9515.pdf. [17 Nov 2009].
Bradford MM. 1976. A rapid and sensitive method for quantitation of protein utilization: The principle of protein-dye binding. Anal Biochem 72:248-254. Chaidamsari T. 2005. Biotechnology for
cacao pod borer resistance in cacao, [disertasi]. Wagenigen: Plant Research International, Wagenigen University. [Depperin]. Departemen Perindustrian. 2007.
Gambaran Sekilas Industri Kakao. Jakarta: Sekertariat Jenderal Departemen Perindustrian.
9
to herbivores and pathogens: An approach using primary gene products. Plant Mol Biol 2:223-233.
Fritz H. 2000. Foreword. Di dalam: Helm K Von der, Korant BD, Cheronis JC.
Protease as Targets for Therapy. Berlin: Springer-Verlag. hlm v-vii.
Goenadi DH et al. 2007. Arah Dan Pengembangan Agribisnis Kakao. Ed ke-2. Jakarta: Badan Penelitian dan Pengembangan Pertanian, Departemen Pertanian.
Husaini A. 2009. Pengusaha kakao minta PPN tetap 0%. Kontan Online [terhubung berkala] http://www.kontan.co.id/ pengusaha [10 Jan 2009].
Isda MN, Kasim M, Mansyurdin, Chaidamsari T, Santoso D. 2008. Kloning dan karakterisasi gen penyandi inhibitor proteinase dari kulit buah kakao. Menara Perkebunan 76:83-92.
Johnson R, Narraez J, An G, Ryan CA. 1989. Expression of proteinase inhibitors I and II in transgenic tobacco plant: Effects on natural defense against man-duga sexta larvae. Proc Natl Acad Sci USA 86:9871-9875.
Laemmli UK. 1970. Cleavage of structural protein during the assembly of head of bacteriophage T-4. Nature 227:680-685. Lawrence PK, Koundal KR. 2002. Plant
protease inhibitors in control of phytophagous insects. J Biotech 5:93-109. Merril CR et al. 1979. Trace polypeptides in
cellular extracts and human body fluids detected by two-dimensional electrophoresis and a highly sensitive silver stain. Proc Natl Acad Sci USA
76:4335-4339.
Mikkelsen SR, Corton E. 2004. Bioanalitycal Chemistry. New Jersey: J Wiley.
Newell CA. 1995. Transformation of sweet potato [Ipomoea batatas (L.) Lam.] with
Agrobacterium tumefaciens and
regeneration of plants expressing cowpea trypsin inhibitor and snowdrop lectin.
Plant Sci 107:215-227.
Pirovani CP et al. 2008. Protein extraction for proteome analysis from cacao leaves and meristems, organs infected by
Moniliophthora perniciosa, the causal
agent of the witches’ broom disease.
Weinheim: Electroforesis 29:2391-2401. Rawlings ND, Barrett AJ. 1993. Evolutionary
families of peptidases. Biochem J
290:205-218.
Richards P et al. 1998. Molecular Biomethods Handbook. Rapley R, Walker JM. Totono, editor. NewJersey: Humana Pr.
Ryan CA. 1981. Proteinase Inhibitors. Di dalam: Stumpf PK, Conn EE editor. The Biochemistry of Plants—A Comprehensive Treatis. New York: Acad Pr. hlm:351-370. Ryan CA. 1990. Proteinase inhibitors in plants: Genes for improving defenses against insect and pathogens. Annu Rev Phytopathol 28:425-449.
Steavens PM. 2007. Kimia Polimer. Sofyan L, penerjemah. Jakarta: Pradya Paramita. Terjemahan dari Polymer Chemistry: An Introductory.
Sudarmanto A. 2007. Penetapan kadar protein dengan metode Bradford. [terhubung berkala] http://ariebs.staff.ugm.ac.id/?tag= analisis-protein [18 Jan 2009].
Terra WR, Ferreira C, Jordao BP, Dillon BJ. 1996. Digestive enzymes. Di dalam:
Biology of The Insect Midgut. Lehane MJ, Billingsley PF, editor. London: Chapman & Hall. hlm:3-25.
Tai H, McHenry L, Fritz PJ, Furtek DB. 1991. Nucleid acid sequence of 21 kDa cocoa seed protein with homology to the soybean trypsin inhibitor (Kumitz) family of protease inhibitor. Plant Mol Biol 16:913-915.
Walker AJ. et al. 1998. Characterisation of the midgut digestive proteinase activity of the two-spot ladybird (Adalia bipunctata
L.) and its sensitivity to proteinase inhibitors. Insect Biochem and Mol Biol
28:173-180.
analysis. Deerfield Beach Florida Basel: Verlag Chemie.
Wolf DH. 1992. Proteases as biological regulators introductory remarks.
Experientia 48:117-118.
Xu at al. 1996. Expression of a late embryogenesis abundant protein cene,
AKTIVITAS INHIBITOR TRIPSIN DARI PROTEIN
EKSPRESI INTRASELULAR DAN EKSTRASELULAR Gen
TcPIN
YANG DITRANSFORMASIKAN PADA
Eschericia coli
MUHAMAD LUTFILAH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
dan Ekstraselular Gen
TcPIN
yang Ditransformasikan pada
Eschericia coli
. Dibimbing
oleh TUN TEDJA IRAWADI dan TETTY CHAIDAMSARI.
PIN
merupakan gen pertahanan alamiah tanaman yang dapat dimanfaatkan untuk
pengembangan kakao transgenik. Gen
TcPIN
telah diisolasi dari kulit buah kakao pada
klon Ary dan Bal, serta dari biji kakao. Studi bioinformatika menunjukkan bahwa gen ini
mengekspresikan protein 21 kDa yang memiliki homologi tinggi dengan inhibitor tripsin.
Aktivitas protein ini diuji secara
in vitro
. Protein hasil ekspresi intraselular gen
TcPIN
dari kulit buah kakao menunjukkan aktivitasnya sebagai inhibitor tripsin. Namun, protein
hasil ekspresi gen
TcPIN
dari biji kakao tidak menunjukkan aktivitas serupa.
ABSTRACT
MUHAMAD LUTFILAH. Tripsin Inhibitor Activity of Protein Expressed Intracellularly and Extracellularly from TcPIN Gene Transformed in Eschericia coli. Supervised by TUN TEDJA IRAWADI and TETTY CHAIDAMSARI.
PIN is natural defense gene in plant which is potential to be utilized for development of transgenic cacao. TcPIN gene had been isolated from cacao’s peel (pod wall) of Ary and Bal
AKTIVITAS INHIBITOR TRIPSIN DARI PROTEIN
EKSPRESI INTRASELULAR DAN EKSTRASELULAR Gen
TcPIN
YANG DITRANSFORMASIKAN PADA
Eschericia coli
MUHAMAD LUTFILAH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Nama
: Muhamad Lutfilah
NIM
: G44076025
Disetujui
Komisi Pembimbing
Pembimbing I
Pembimbing II
Prof. Dr. Ir. Tun Tedja Irawadi, MS.
Dr. Tetty Chaidamsari
NIP 19501227 197603 200 2
NIK 110400241
Diketahui
Ketua Departemen Kimia
Prof. Dr. Ir. Tun Tedja Irawadi, MS.
NIP 19501227 197603 200 2
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya
sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang
dilaksanakan sejak bulan Maret ini adalah uji
in vitro
protein ekspresi hasil transformasi
gen
PIN
, dengan judul Uji Aktivitas Protease Inhibitor Protein Intraselular dan
Ekstraselular Hasil Transformasi Pada
Eschericia coli
.
Terima kasih penulis ucapkan kepada Prof. Dr. Ir. Tun Tedja Irawadi, MS dan
Dr. Tetty Chaidamsari selaku pembimbing. Di samping itu, penulis juga mengucapkan
terima kasih kepada Prof. drh. Dr. Ir. Maria Bintang Msc; Meita Nova Isda, S.Si. M.Si.
atas sarannya dalam penelitian ini, kepada seluruh staf Balai Penelitian Bioteknologi
Perkebunan Indonesia yang telah banyak membantu selama penelitian terutama
Mas
Topani,
Mas
Herry,
Mbak
Herti,
Mbak
Nina,
Mbak
Riana, serta Budi Arifin S.Si. atas
sarannya dalam penyusunan karya ilmiah ini. Terima kasih juga penulis sampaikan untuk
ayah, ibu, dan seluruh keluarga atas doa dan kasih sayangnya. Penulis juga mengucapkan
terima kasih atas doa dan dukungan semua sahabat dan juga teman-teman ekstensi S-1
Kimia. Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2009
DAFTAR ISI
DAFTAR GAMBAR ……….………...………...………..
viii
DAFTAR LAMPIRAN ………...……..
viii
PENDAHULUAN ……….………...…..……..
1
TINJAUAN PUSTAKA
Kakao (
Theobroma cacao
L.) ...
1
Penggerek Buah Kakao ...……….………..…….
2
Gen
PIN
pada Kakao ………..……...……..……….
2
Proteinase dan Protei
nase Inhibitor ………..………..……..
2
Struktur Protein ………..………..……….
3
Analisis Protein ………..……..…….
3
Elektroforesis SDS-
PAGE ………..………..……
3
BAHAN DAN LINGKUP KERJA
Bahan dan Alat ………..…..….
3
Lingkup Kerja ...……….……….……..…….
4
HASIL DAN PEMBAHASAN
Ekstrak Protein ………...
5
Kadar Protein Total ...
6
Homologi pada Bobot
Molekul Protein ..………...…...
6
Aktivitas Inhibitor Tripsin .………..………..
7
SIMPULAN DAN SARAN ...………...………..……...
8
DAFTAR PUSTAKA ....……….…...……...…
8
LAMPIRAN ...………...…....
11
Halaman
DAFTAR GAMBAR
1
Bagian buah kakao ...
1
2
Ilustrasi struktur protein ………..……….….
3
3
Hasil SDS-PAGE ekstrak protein dari kulit dan biji buah kakao dengan pewarna
AgNO
3(A) dan pewarna biru Coomassie (B) ……….…
..
6
4
Hasil SDS-
PAGE protein ekspresi ekstraselular (A) dan intraselular (B) …....…
7
DAFTAR LAMPIRAN
1
Diagram alir penelitian ………...………..
12
2 Prosedur pembuatan pereaksi-pereaksi dan kultur
E. coli
...……….……
13
3 Penentuan
maksimum pada pengukuran kadar protein ………..……...
14
4
Hasil pengukuran kadar protein ...………...
15
1
PENDAHULUAN
Indonesia merupakan produsen kakao terbesar ketiga di dunia dengan produksi rerata per tahun mencapai 456,000 ton, setelah negara Pantai Gading (1,276,000 ton) dan Ghana (586,000 ton). Luas lahan tanaman kakao Indonesia lebih kurang 992.448 Ha dengan produktivitas rata-rata 900 kg per ha (Depperin 2007). Saat ini, Indonesia mengekspor 40% kakao ke Malaysia, 30% ke Amerika Serikat, 15% ke Singapura, dan 15% ke Eropa. Produksi kakao Indonesia tahun 2008 dibandingkan dengan tahun 2007 menurun 4% dari 500,000 ton menjadi 480,000 ton. Harga rata-rata kakao selama tahun 2008 sebesar US$2,500 per ton dan pada tahun 2009 diperkirakan meningkat menjadi US$2,900 per ton (Husaini 2009). Karena itu, kakao merupakan salah satu komoditas ekspor nonmigas yang potensial dan produksinya perlu ditingkatkan.
Agribisnis kakao Indonesia masih menghadapi berbagai masalah kompleks, antara lain mutu produksi yang masih rendah, serta masih belum optimalnya pengembangan produk hilir kakao. Produktivitasnya juga masih rendah, salah satu penyebabnya ialah serangan hama penggerek buah kakao (PBK). Hal ini menjadi suatu tantangan sekaligus peluang bagi para investor untuk mengembangkan usaha dan meraih nilai tambah yang lebih besar dari agribisnis kakao (Goenadi et al. 2007).
Cara-cara yang telah diterapkan untuk mengatasi masalah hama PBK ini di antaranya pengendalian hama PBK secara nasional dan pemilihan varietas tanaman kakao yang tahan hama PBK. Cara lain yang juga potensial ialah pengembangan kakao transgenik dengan memanfaatkan gen pertahanan alami pada tanaman yang disebut gen protease inhibitor (PIN). PIN merupakan gen yang dapat menghasilkan senyawa protein antinutrisi yang dapat menghambat kerja enzim proteolitik (protease) di dalam perut serangga (Ryan 1990). Apabila termakan oleh hama PBK, protein tersebut akan berinteraksi dengan protease di dalam usus hama tersebut, terikat, dan terkunci pada tapak aktifnya (Terra et al. 1996; Walker et al. 1998) akibatnya, hama PBK kekurangan nutrisi karena terinhibisinya kerja enzim protease yang menghasilkan asam amino, sehingga pertumbuhan dan perkembangan pada hama PBK menjadi terhambat dan dapat menyebabkan kematian.
Isda et al. 2008 telah mengisolasi gen PIN
dari kulit buah 2 klon kakao, yang tahan (Ary) dan yang tidak tahan (Bal), serta dari biji kakao. Gen ini selanjutnya disebut TcPIN. Gen-gen ini diklon pada Eschericia coli. Secara bioinformatika, gen tersebut menyandikan protein 21 kDa dengan homologi yang cocok dengan inhibitor tripsin. Pada penelitian ini aktivitas inhibisi tripsin dari protein ekspresi ketiga gen itu diujikan secara in vitro. Selain itu, bobot molekul protein juga dicirikan dengan elektroforesis gel poliakrilamida-natrium dodesil sulfat (SDS-PAGE). Semua pekerjaan dalam penelitian ini dikerjakan di Labolatorium Biomolekuler, Balai Penelitian Bioteknologi Perkebunan Bogor, antara bulan Maret dan Juni 2009.
TINJAUAN PUSTAKA
Kakao (Theobroma cacao L.) Tanaman kakao berasal dari Amerika Selatan
.
Buah kakao bila dibelah akan tampak seperti Gambar 1 dan bagiannya dapat dicirikan, yaitu OPW (outer pod wall) bagian kulit terluar dari kakao, IPW (inner pod wall), kulit lapisan kedua yang berada di dalam buah, Pu (pulp) daging buah kakao, B (beans) biji kakao, dan PL (placenta) bagian tengah dari kakao.Gambar 1 Bagian buah kakao (Chaidamsari 2005).
Pada saat ini kecenderungan perluasan areal kakao terus berlanjut, walaupun tidak setajam periode 1985 1995 yang laju reratanya di atas 20% per tahun sedangkan pada periode 1995 2002 sebesar 7.5% per tahun. Kondisi areal yang ada dan masalah serangan hama PBK yang cenderung terus meluas dapat menjadikan produksi kakao nasional menurun dalam satu dasawarsa mendatang. Hal ini disebabkan oleh peningkatan produksi dengan perluasan areal
OPW IPW
B
saat ini tidak dapat mengimbangi penurunan produksi tanaman kakao yang tua, serta serangan hama PBK sudah menjadi ancaman bagi produksi kakao nasional (Goenadi et al. 2007).
Penggerek Buah Kakao
Penggerek buah kakao (PBK),
Conophomorpha cramerella Snellen, dari famili Gracillariidae merupakan salah satu hama kakao yang memakan plasenta yang merupakan saluran makanan menuju ke biji sehingga mengakibatkan penurunan hasil dan mutu biji. PBK dapat menyerang buah dengan panjang buah 3 cm, tetapi umumnya lebih menyukai yang berukuran sekitar 8 cm. Ulatnya merusak dengan cara menggerek buah serta memakan kulit buah, daging buah, dan plasenta. Buah yang terserang akan lebih awal menjadi berwarna kuning dan jika digoyang tidak berbunyi. Biasanya buah ini lebih berat daripada yang sehat. Biji-bijinya saling melekat, berwarna kehitaman, dan ukuran biji yang lebuh kecil (Goenadi et al. 2007)
Gen PIN dari Buah kakao
Gen PIN diketahui memiliki peranan yang penting dalam sistem pertahanan tanaman pada predator dan pato