LAMPIRAN
Lampiran 1 : Alur Kerja Penelitian
Isolasi BAL dari nira aren yang terfermentasi secara spontan
Karakteristik Morfologi, Uji Biokimia dan Fewarnaan Gram
Uji Aktivitas Antimikroba BAL Terhadap Bakteri Fatogen Fangan
Uji Viabilitas BAL Sebagai Kandidat Frobiotik
Uji Ketahanan Terhadap pH 2 (lambung) dan pH 7.2 (Usus)
Uji Ketahanan Terhadap Garam Empedu 0.5%
38
39
Lampiran2 : Data Diameter Zona Hambat BAL Terhadap Bakteri Patogen
Pada Pangan
Keterangan ;S. aureus = Staphylococcus aureus S. typhi = Salmonella typhi E. coli = Eschericia coli NO
Kode Isolat
Diameter zona hambat (mm)
S. aureus S. typhi E. coli
1 MF1 6.5 8.25 8.62
2 MF2 - -
-3 MF3 - - 7.37
4 MF4 - 7.25 8.87
5 MF5 9.75 9.12 8.00
6 MF6 9.25 8.25
-7 MF7 - 8.37 10.12
8 MF8 8.75 7.75 6.50
9 MF9 8.87 7.12 6.75
10 MF10 8.5 8.25 8.75
11 MF11 9.62 8.12 9.62
12 MF12 8.75 8.12 6.25
13 MF13 11.75 11.62 8.87
14 MF14 9.75 10.25 9.25
15 MF15 11.62 8.37 8.75
40
Lampiran 8 : Foto Hasil Penelitian
Uji Fewarnaan Gram: Isolat MF14berbentuk Basil Uji Tipe Fermentasi BAL : Heterofermentatif
MF5pada media MRSA setelah diinkubasi selama 90 menit pada MRSB pH 2.0
Aktivitas antimikroba Supernatan BAL MF11 pH Netral TerhadapSalmonella typhi
Uji penempelan MF5pada permukaan padat Stainless steelsetelah inkubasi 3 hari dengan pengenceran 105
DAFTAR PUSTAKA
Abdullah, W., Usman, R., Raden, I., Sitti, A., Ilma, S.,Zulfikar, L., Rianda, B dan Abdi, L. 2015. Potency of Natural Sweetener : Brown Sugar.Transactions on Business and Economics. 12(1). 12-23.
Amezquita, A. and M.M. Brashears. 2002. Competitive Inhibition of Listeria monocytogenes in Ready to-eat Meat Products by Lactic Acid Bacteria.
Food Protection Journal.65(2): 316-325.
Argyri AA, Zoumpopoulou G, Karatzas GKA, Tsakalidou E, Nychas EGJ, Panagou EZ, assou CC. 2013. Selection of potential probiotic lactic acid bacteria from fermented lives by in vitro tests. Food Microbiol.
33:282-291
Ashraf, R and Shah, N. P. 2011. Antibiotic Resistance of Probiotic Organisms and Safety of Probiotic Dairy Product.Journal International of Food.2(1):
23-50.
Axellson, L. 1998. Lactic Acid Bacteria : Classification and Physiology In Lactic Acid Bacteria : Microbiology and Functional Aspect Salmminen S and A. Wright (ED) . 2nd. New York: Marcel Dekker Inc.
Baeumler, A., Hargis, B. M. dan Tsolis, R. M. 2000. Tracing the origin of Salmonella outbreaks. Science.
Badan Pengawas Obat dan Makanan Republik Indonesia. 2013. Berbagai Jenis Bahaya Bakteri serta Penanganannya. Direktorat Surveilan dan Penyuluhan Keamanan Pangan Deputi III.
Benech, R.O., E.E. Kheadr, R. Laridi, C. Laeroix, and I. Fills. 2002. Inhibition of
Listeria innocuain Cheddar Cheese by Addition of Nisin-Z in Liposomes or by in situ Production in Mixed Culture. Journal of Applied Environmental Microbiology.68 (8): 3683-3690.
Buckle, K.A., Edwards, R.A., Fleet, G.H & Wootton, M. 2007. Ilmu Pangan. Purnomo H. & Adiono (eds). Universitas Indonesia Press, Jakarta.
Cahyaningsih, H. E. 2006. Identifikasi Bakteri Asam Laktat Dari Nira Lontar Serta Aplikasinya Dalam Mereduksi Salmonella typhimurium dan
Aspergillus flavus Pada Biji Kakao. [Skripsi]. Fakultas Teknologi Pertanian Institut Pertanian Bogor.
Direktur Jenderal Perkebunan. 2006. Perkembangan Aren di Indonesia. Prosiding Seminar Nasional Aren. Tondano, 9 Juni 2004. Balai Penelitian Tanaman Kelapa dan Palma Lain. 1(2): 138-144.
Djide, M. N., dan Sartini, 2008, Isolasi, Identifikasi Bakteri Asam Laktat dari Kol
33
harveyiIn Vitro,Torani, Vol.18 (3) : 211-216.
Djide, M. N. dan Wahyuddin, E. 2008. Isolasi Bakteri Asam Laktat dari Air Susu Ibu dan Potensinya dalam Penurunan Kadar Kolestrol Secara In Vitro. Majalah Farmasi dan Farmakologi. 12(3): 15-30.
Effendi, D. 2010. Prospek Pengembangan Tanaman Aren (Arenga pinnata Merr) Mendukung Kebutuhan Bioetanol di Indonesia.Jurnal Prespektif. 9(1). 36-46. Fadhillah, A., Hafsan dan Fatmawati. 2015. Penurunan Kadar Kolesterol Oleh Bakteri
Asam Laktat Asal Dangke Secara In Vitro. Prosiding. Makassar: Fakultas Sains dan Teknologi. UIN.
Frazier, W. C. dan Westhoff. 1998.Food Microbiology.4thEdition. Mc Graw. Hill. New
York, Chapter 9. In Ray, B and M. Daescel. Food Biopreservatives of Microbial Origins.
Gan, S. 1987. Farmakologi dan Terapi, Edisi 3. Bagian Farmakologi, Fakultas Kedokteran, Universitas Indonesia. Jakarta.
Handayani, A. N. 2001. Mempelajari Sifat Antimikotin Lactobacillus plantarum kik Terhadap Penicillium citrinum. [Skripsi]. Fakultas Teknologi Pertanian Institut Pertanian Bogor.
Hussein, H. 2009. Influence of Gamma Rays on the Ability ofLactobacillus acidophilus
and Lactobacillus casei for Lowering Cholesterol and Aflatoxin. Journal of Radiation Research and Applied Science. 2(3): 1-7.
Jack, R., Tagg, J dan Ray, B. 1995. Bacteriocin of Gram Positive Bacteria. Journal Microbial: 171-200.
Jay, JM. 1996.Modern Food Microbiology. Edisi ke-5. New York: Chapman anda Hall. Jay, James M., Martin J. Loessner, David A. Golden. 2005.Modern Food Microbiology.
Seventh Edition. USA (US): Springer Science + Business Media, Inc.
Jayaprakash, B., P.R, Suresh., Meera, M., Balachandran, M., Balkrishnan, P. 2013. Keraamritham a Health Drink from Coconut Inflorensence Sap.Article.
Jenie, B., Suliantari, Andjaja, N. 2000. Pengembangan Produk Makanan Tradisional Rendah Garam Berbasis Ikan Melalui Aplikasi Bakteri Asam Laktat Penghasil Bakteriosin.Laporan Penelitian Hibah Bersaing tahun 1999/2000.
34
Krismurtono, M. 2012. Feed Batch Alcoholic Fermentation of Palm Juice (Arenga pinnata Mer) Influence of the Feeding Rate on Yeast, Yield and Productivity.
Journal International of Engineering and Technology. 2(5): 55-70.
Kusmiati & Amarila, M. 2002. Aktivitas Bakteriosin Dari Bakteri Leuconostoc mesenteroides Pbac1 Pada Berbagai Media. Jurnal Mareka Kesehatan. 6(1): 16-19.
Leverrier P, Dimova D, Pichereau V, Auffray Y, Boyaval P, Jan G. 2003. Susceptibility and adaptive response to bile salts in Propionibacterium freudenreichii : physiological and proteomic analysis. Journal of Application Environmental Microbiologi.69(7):3809-3818
Loessner, M. S., Guenther, and S. Scherer. 2002. A Pediocinproducing Lactobacillus plantarumstrain inhibitsListeria monocytogenesin a Multispecies Cheese Surface Microbial Ripening Consortium. Journal of Applied Environmental Microbiology
69 (3): 1854-1857.
Lin WH, Hwang CF, Chen LW, Tsen HY. 2006. Viable counts, characteristic evaluation for commercial lactic acid bacteria product [short communication]. Journal of Food Microbiol.23(1): 74-81.
Lisal, J. S. 2005. Konsep Probiotik Dan Prebiotik Untuk Modulasi Mikrobiota Usus Besar.Jurnal Medis. Nusa Tenggara Timur. 26(4): 259-262.
Melia, S dan Indri, J. 2010. Potensi Dadih Susu Sapi Mutan Lactococcus lactis Dengan Kandungan Bakteriosin Terhadap Bakteri Patogen. Jurnal Ilmu Kesehatan dan Pangan.2(1): 1-6.
Morgolles A, Gracia L, Sanchez B, Gueimonde M, Gavilan CG. 2003. Characterisation of aBifidobacteriumstrain with acquired resistance to cholate-A preliminary study.
Int ernational Journal of Food Microbiology.82:191-198.
Mourad, S dan Meriem, T. 2008. Potensi BAL Yang Diisolasi dari ASI (Air Susu Ibu) Sebagai Probiotik.Jurnal Ilmu Pangan.2(1): 3-11.
Muralidharan, K and Deepthi, N. 2013. Coconut Neera- the Hidden Unexplored Treasure.
Indian Coconut Journal. 4(8): 1-20.
Naidu, A.S. and R.A. Clemens. 2000. Probiotics. In: Natural Food Antimicrobial Systems. Naidu, A.S. (Ed). CRC Press, LLC. pp. 431-462.
Naknean, P, M. Meenune, G. Roudaut. 2010. Characterization of palm sap harvested Songkhla province, Southern Thailand. Journal of International Food Resource.
35
Ningsih, C. 2006. Identifikasi Bakteri Asam Laktat dari Nira Lontar Serta Aplikasinya Dalam MereduksiSalmonella thypimuriumdanAspergillus flavuspada Biji Kakao. [Skripsi]. Fakultas Ilmu Pangan Institut Pertanian Bogor.
Nurnaafi, A. 2016. Seleksi dan Karakterisasi Bakteri Asam Laktat Asal Bekasam Sebagai Probiotik. [Skripsi]. Sekolah PascaSarjana. Institut Pertanian Bogor.
Oscariz, J.C. and A.G. Pisabarro. 2000. Classification and Mode of Action of Membrane-Active Bacteriocins Produced by Gram-Positive Bacteria.International Journal of Microbiology4 (1): 13-19.
Rahayu, E.S., Ekasari, A., Wardhani, A.K., & Margino, S. (1999). Screening of Lactic Acid Bacteria from Meat and Meat Product as Bacteriocin Producer.Proceeding of Food National Conference. 2(1). Yogyakarta.
Rachmawati, I., Suranto & Ratna, S. 2006. Uji Anti Bakteri Asam Laktat Asal Asinan Sawi Terhadap Bakteri Patogen.Jurnal Bioteknologi2(2): 43-48.
Rusbana, T, B. 2009. Kajian Pengawetan Nira Menggunakan Asap Cairan Tempurung Kelapa. [Skripsi]. Institut Pertanian Bogor.
Salminen, S., Wright, A., Ouwehand, A. 2004.Lactic Acid Bacteria. Marcel Dekker, Inc. New York. Bassel.
Sharpe, EM. 1979.Identification of Lactic Acid Bacteria. Di dalam: FA. Skinner dan D.W. Lovelock (eds). Identification Methodes for Microbiology. 2th edition. Academic
Press, London.
Silitonga, Y, W., It, J dan Dwi, S. 2010. Pengendalian Sel Biofilm Bakteri Patogen Opportunistik Dengan Panas dan Klorin. [Skripsi]. Fakultas MIPA. Universitas Sumatera Utara.
Surono. I.S. 2003.In vitro Probiotic properties of indigenous dadih lactic bacteria Asian
Aust. Journal of Animal. Sci. 16.5. 726-731.
Sulistyo, J., Cahyaningsih, H dan jenny, B. 2014. Application of Lactic Acid Bacteria to Control Microbial Contaminants During Fermentation of Cocoa Beans.
International Journal ofResearch in Agriculture and Food Sciences.2(5): 16-20. Usmiati, S., Broto, W., Setiyanto, H. 2011. Karakteristik Dadih Susu Sapi yang
Menggunakan Starter Bakteri Probiotik. Jurnal Ilmu Ternak dan Veteriner. 16(2): 1-23.
36
Xia, Qiuyu, Rui Li, Songlin Zhao, Weljun, C., Hua, C., Minmin, T. 2011. Composition Changes of Post-harvest Coconut Inflorencense Sap During Natural Fermentation.
Journal of Biotechnology African. 10(66): 12-25
Yuliana, N. (2007). Profile of Rusip Fermentation Made From Anchovies (Stolephorus
sp).Agritechnology Journal.27(1): 12–17.
Zavaglia, A.G., G Kociubinski, P. Perez and G. De Antoni. 1998. Isolation and Characterization of Bifidobacterium Strains For Probiotic Formulation.Journal of Food Protect. 6(1): 865-873.
BAB 3
MEPODE PENELTPTAN
3.1 Waktu dan Pempat Penelitian
Penelitian ini dilakukan mulai bulan Juni hingga Oktober 2016 di Laboratorium Mikrobiologi, Fakultas Ilmu Pengetahuan Alam, Universitas Sumatera Utara.
3.2. Tsolasi Bakteri Asam Laktat
Sampel nira aren diambil dari 3 pohon aren yang berbeda di daerah Pangaribuan, Kabupaten Tapanuli Utara. Penyadapan dilakukan pada sore hari (17.00 WIB) dengan menggunakan parang dan diambil pada pagi hari (09.00 WIB). Selama proses penyadapan nira ditampung menggunakan jerigen penampungan dan dipindahkan ke dalam botol steril pada pagi hari. Botol ini kemudian dimasukkan ke dalam cool boxuntuk menjaga kesegaran nira hingga dibawa ke laboratorium. Sampel nira dibiarkan mengalami fermentasi secara spontan dengan interval waktu 0, 12, 24, 36 dan 48 jam, lalu diukur suhu dan pH dari masing-masing nira dan dihitung jumlah sel bakteri asam laktat pada tiap interval waktu fermentasi.
A. Uji Morfologi dan Pengecatan Gram
Isolat murni BAL ditumbuhkan pada media MRSA selama 24 jam. Lalu dilakukan pewarnaan gram dan karakterisasi koloni bakteri (Waluyo, 2010).
B. Uji Motilitas
Kultur BAL 24 jam diambil menggunakan ose lurus dan diinokulasikan secara vertikal pada media sufide indol motility (SIM) lalu diinkubasi selama 24 jam. Motilitas bakteri ditunjukkan dengan adanya pertumbuhan pada permukaan medium dan ada bekas pergerakan bakteri pada tusukan. Bakteri nonmotil tumbuh sepanjang tusukan (Tiwariet al., 2009).
C. Uji Biokimia (Uji Katalase dan Ui TSIA)
Uji katalase dilakukan dengan meneteskan H2O2 3% pada kultur BAL umur 24 jam. Sifat reaksi terhadap uji katalase ditentukan dengan munculnya gelembung gas yang memberikan indikasi pembentukan gas CO2. Uji TSIA dilakukan dengan menggunakan media miring Triple Sugar Iron Agar (TSIA). Kultur BAL muda (umur 24 jam) digoreskan pada permukaan media TSIA dengan menggunakan ose bengkok, kemudian tusuk bagian tengah media secara lurus diinkubasi selama 24 jam. Uji positif dilihat dengan adanya endapan hitam (Fardiaz, 1989).
D. Uji Tipe Fermentasi
3.3. Uji Aktivitas BAL Dalam Menghambat Pertumbuhan Bakteri Patogen Asal Pangan
Aktivitas antimikroba yang dihasilkan oleh BAL dalam menghambat bakteri patogen asal pangan dapat berupa asam-asam organik (laktat, asetat dan diasetil), bakteriosil, H202 dan etanol. Metode aktivitas antimikroba BAL dalam menghambat pertumbuhan bakteri patogen asal pangan (Salmonella typhii, Staphylococcus aureus dan Escherichia coli) dilakukan dengan 2 (dua) metode. Metode yang pertama menggunkan isolat BAL kultur 24 jam untuk melihat kemampuan keseluruhan senyawa antimikroba BAL dan materi yang kedua menggunakan supernatan BAL pH netral untuk melihat kemampuan senyawa antimikroba selain asam-asam organik dalam menghambat pertumbuhan bakteri patogen asal pangan.
Uji aktivitas BAL dalam menghambat pertumbuhan bakteri patogen asal pangan dilakukan dengan menggunakan metode difusi cakram. Masing-masing isolat bakteri patogen asal pangan didapatkan dari Laboratorium Mikrobiologi, Fakultas Kedokteran, Universitas Sumatera Utara. Bakteri diremajakan pada media Nutrient broth (NB) untuk persiapan uji antimikroba selama 24 jam. Kultur bakteri asam laktat (BAL) dan kultur bakteri patogen pangan umur 24 jam diukur OD (Optical density) hingga 108CFU/ml atau setara dengan 0,5 - 0,6 pada panjang gelombang 600 nm pada pengukuran menggunakan spektrofotometri. Kertas cakram direndam pada masing-masing suspensi BAL dan supernatan BAL selama 1 jam. Media Mueller Hinton Agar (MHA) dituang ke dalam cawan petri steril hingga media memadat lalu bakteri patogen digoreskan pada media menggunakan cotton bud steril. Masing-masing cakram yang telah berisi suspensi BAL di letakkan pada media MHA berisi bakteri patogen tersebut dan diinkubasi selama 24 jam. Zona bening yang terbentuk di sekitar cakram menandakan kemampuan BAL dalam menghambat pertumbuhan bakteri patogen asal pangan.
masing-masing supernatan BAL diatur menjadi pH 7 menggunakan NaOH 1 M dan tanpa perlakuan sebagai kontrol. Kertas cakram direndam pada masing-masing supernatan BAL selama 1 jam. Media MHA dituang ke dalam cawan petri steril hingga media memadat lalu bakteri patogen digoreskan pada media menggunakan cotton bud steril. Masing-masing cakram yang telah berisi suspensi BAL diletakkan pada media MHA berisi bakteri patogen tersebut dan diinkubasi selama 24 jam. Zona bening yang terbentuk di sekitar cakram menandakan kemampuan BAL dalam menghambat pertumbuhan bakteri patogen asal pangan (Kawaiet al.,1972).
3.4 Uji Viabilitas BAL Sebagai Kandidat Probiotik
3.4. 1 Pengujian Ketahanan pH 2 (Lambung) dan pH 7,2 (Usus) Manusia
Isolat BAL yang paling potensial dalam menghambat bakteri patogen pangan di uji kemampuannya sebagai kandidat probiotik. Masing-masing isolat bakteri (MF5, MF10, MF11, MF13, MF14 dan MF15 ditanam pada media MRSB selama 24 jam. Lalu disediakan media MRSB dengan pH 2 dan pH 7,2 menggunakan HCl 0,1 N dan NaOH 0,1 N. Sebanyak 1 ml dari masing-masing suspensi bakteri dengan jumlah populasi awal 108 CFU/ml diinokulasikan ke dalam media MRSB pH 2 dan pH 7,2, diinkubasi selama 90 menit pada suhu 28-32 0C. Setelah diinkubasi, dilakukan pengenceran setiap suspensi bakteri menggunakan NaCl 0,9 % hingga pengenceran 108CFU/ml. Sebanyak 1 mL dari setiap pengenceran dituang kedalam cawan petri steril, lalu ditambahkan media MRSA sebanyak 15 ml kedalam tiap-tiap cawan petri dan diinkubasi selama 24 jam pada suhu 370C. Penghitungan dilakukan terhadap koloni bakteri asam laktat yang tumbuh pada media MRSA tersebut (Linet al, 2006.).
3.4.2 Pengujian Ketahanan Perhadap Garam Empedu 0,5% ox gall
kecil). Sebanyak 1 mL kultur BAL dengan jumlah populasi awal minimal 108 CFU/ml diinokulasikan pada media MRSB yang telah ditambahkan garam empedu 0,5% steril lalu diinkubasi pada suhu 28-32 0C selama 4 jam. Setelah itu dilakukan pengenceran menggunakan NaCl 0,9% hingga 108CFU/ml. Setelah itu dihitung koloni BAL dengan menggunakan metode cawan tuang menggunakan media MRSA (Moser dan Savage, 2001).
3.5 Uji Penempelan Tsolat BAL Perpilih pada Permukaan Padat
BAB 4
HASTL DAN PEMBAHASAN
4.1 Tsolasi Bakteri Asam Laktat Asal Nira Aren
Dari hasil isolasi bakteri asam laktat (BAL) asal nira aren pada media de mann Rogosa Sharpe Agar (MRSA) + kalsium karbonat (CaCO3) 1% didapatkan 16 isolat yang diduga BAL. Isolat ini diduga BAL karena membentuk zona bening pada sekitar koloni BAL jika ditanam pada media MRSA+CaCO31%. Djide dan Sartini (2008) menjelaskan pada media MRSA + CaCO3 1% koloni BAL akan membentuk zona bening, hal ini disebabkan BAL menghasilkan asam laktat sebagai produk akhir fermentasi. Asam laktat ini akan bereaksi dengan CaCO3 yang tidak larut di dalam media sehingga membentuk kalsium laktat yang larut, ditandai dengan adanya zona bening disekitar koloni bakteri yang tumbuh. Zona bening yang terbentuk pada sekitar koloni dapat dilihat Gambar 1 di bawah ini:
Gambar 1 : Koloni BAL pada Media MRSA + CaCO31% (→ = zona bening)
Media MRSA merupakan media yang direkomendasikan menjadi media selektif bagi BAL. Namun, pada media ini berbagai jenis khamir masih tumbuh dan bersaing dengan BAL sehingga perlu ditambahkan CaCo3 1 % untuk menyeleksi BAL tersebut (Djide dan Sartini, 2008). Pada penelitian Sulistyoet al (2014), juga didapat isolat BAL dari fermentasi biji coklat yang tumbuh pada media GYPA + CaCO31%. Setiap koloni BAL yang tumbuh pada media tersebut membentuk zona bening pada sekitar koloni BAL tersebut.
Maretta,
1
-2
.5
m
19
4.2 Karakterisasi Bakteri Asam Laktat
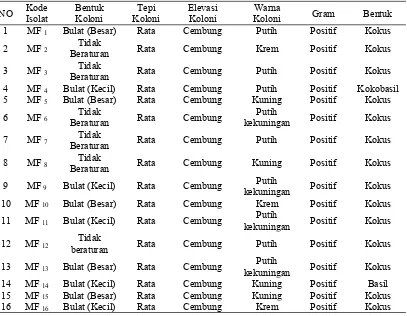
Hasil pengamatan karakterisasi morfologi BAL asal nira aren diperoleh bentuk koloni BAL beragam dari bentuk bulat kecil, besar dan tidak beraturan. Selain bentuk, warna koloni BAL juga beragam dimulai dari warna putih, putih kekuningan, kuning dan krem. Ada sebanya 10 isolat BAL yang berbentuk bulat dan 6 isolat yang berbentuk tidak beraturan. Semua koloni bakteri memiliki tepi rata dan elevasi cembung. Sedangkan, warna dari masing-masing isolat BAL terdapat 5 isolat berwarna putih, 4 isolat berwarna putih kekuningan, 3 isolat yang berwarna krem dan 4 isolat berwarna kuning (Tabel 1). Pada pengematan pewarnaan Gram semua isolat BAL termasuk ke dalam Gram positif dan sebagian besar berbentuk kokus, namun didapatkan 1 isolat yang berbentuk basil yaitu MF14 dan 1 isolat BAL yang berbentuk kokobasil yaitu MF4. Hasil uji karakterisasi secara morfologi dan biokimia secara lengkap dapat dilihat pada Tabel 1 berikut:
Tabel 1. Karakteristik Morfologi BAL Asal Nira Aren
NO IsolatKode BentukKoloni KoloniTepi ElevasiKoloni KoloniWarna Gram Bentuk
1 MF1 Bulat (Besar) Rata Cembung Putih Positif Kokus
2 MF2 BeraturanTidak Rata Cembung Krem Positif Kokus
3 MF3 BeraturanTidak Rata Cembung Putih Positif Kokus
4 MF4 Bulat (Kecil) Rata Cembung Putih Positif Kokobasil
5 MF5 Bulat (Besar) Rata Cembung Kuning Positif Kokus
6 MF6 BeraturanTidak Rata Cembung kekuninganPutih Positif Kokus
7 MF7 BeraturanTidak Rata Cembung Putih Positif Kokus
8 MF8 BeraturanTidak Rata Cembung Kuning Positif Kokus
9 MF9 Bulat (Kecil) Rata Cembung kekuninganPutih Positif Kokus
10 MF10 Bulat (Besar) Rata Cembung Krem Positif Kokus
11 MF11 Bulat (Kecil) Rata Cembung kekuninganPutih Positif Kokus
12 MF12 beraturanTidak Rata Cembung Putih Positif Kokus
13 MF13 Bulat (Besar) Rata Cembung kekuninganPutih Positif Kokus
14 MF14 Bulat (Kecil) Rata Cembung Kuning Positif Basil
15 MF15 Bulat (Besar) Rata Cembung Kuning Positif Kokus
20
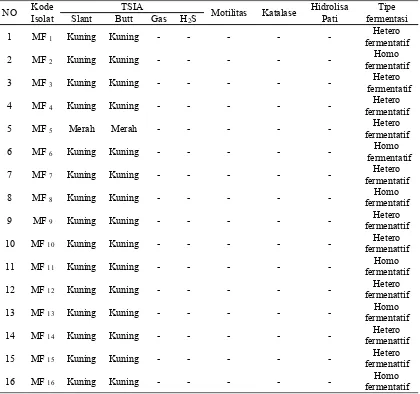
Isolat BAL yang telah dikarakterisasi berdasarkan morfologinya kemudian dikarakterisasi sifat biokimianya. Hasil uji biokimia BAL diperoleh sebagian besar isolat BAL mampu memfermentasi ketiga jenis gula (glukosa, laktosa dan sukrosa) pada media Triple Sugar Iron Agar (TSIA). Namun, isolat MF5 tidak mampu memfermentasi ketiga jenis gula ini seperti pada Tabel 2 di bawah ini:
Tabel 2. Hasil Uji Biokimia BAL Asal Nira Aren
NO IsolatKode Slant ButtTSIA Gas H Motilitas Katalase HidrolisaPati fermentasiTipe
2S
21
kuning, berbentuk kokus, basil dan kokobasil. Hasil uji tipe fermentasi BAL menunjukkan bahwa 10 isolat BAL bersifat heterofermentatif dan 6 isolat yang bersifat homofermentatif. Hal ini ditandai dengan terbentuknya gelembung gas pada tabung durham yang dimasukkan ke dalam media MRSB+BAL setelah inkubasi 24 jam. Pada penelitian Kharisma (2014), isolat BAL nira kelapa asal Sukabumi dan Purbalingga yang di isolasi pada media MRSA danGlucose Yeast Pepton Agar (GYPA) di dominasi oleh isolat heterofermentatif cocobasil. Menurut Jay (1996), BAL golongan homofermentatif mampu menghasilkan asam laktat hingga ±95% dan ATP dalam jumlah lebih banyak, sedangkan menurut Sharpe (1979) BAL golongan heterofermentatif memfermentasi glukosa menjadi asam laktat, asam asetat, etanol dan CO2.
4.3 Lama Penyimpanan Nira dan Jumlah Bakteri Asam Laktat
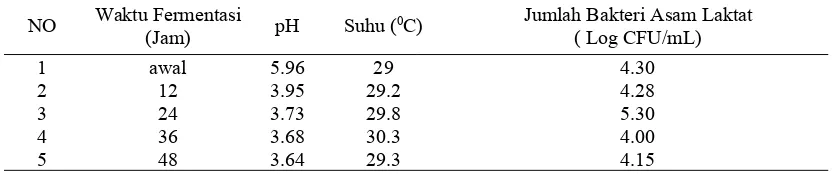
Hasil isolasi BAL dari nira aren pada waktu awal fermentasi nilai pH nira aren ialah 5.96 dan nira masih dalam kondisi segar. Jumlah BAL pada awal fermentasi ialah 4.30 log CFU/ml, hal ini terjadi karena pada saat penampungan di manggar diduga nira telah terkontaminasi oleh berbagai mikroorganisme dan salah satunya ialah BAL. Kharisma (2014) menyatakan bahwa BAL yang terdapat pada nira dapat berasal dari tempat penampungan nira, alat mengiris manggar dan dari tanaman itu sendiri sehingga dijumpai pada nira yang baru disadap. Fermentasi nira sendiri juga ditandai dengan nilai pH sampel nira segar yang mencapai pH 5.5. Battock dan Azam-Ali (1998), menegaskan bahwa kerusakan nira ditandai dengan perubahan pH nira dari 6.8 hingga menjadi 5.5, karena pH nira segar mendekati normal. Didapatkan nilai pH, suhu dan jumlah bakteri asam laktat (log CFU/ml) yang berbeda dari masing-masing interval waktu fermentasi. Data selengkapnya dijelaskan secara lengkap pada Tabel 3 di bawah ini:
Tabel 3 Nilai pH, suhu dan Jumlah Bakteri Asam Laktat Asal Nira Aren
NO Waktu Fermentasi(Jam) pH Suhu (0C) Jumlah Bakteri Asam Laktat
( Log CFU/mL)
1 awal 5.96 29 4.30
2 12 3.95 29.2 4.28
3 24 3.73 29.8 5.30
22
Jumlah BAL paling banyak ialah pada waktu fermentasi ke-24 jam dengan jumlah sel BAL sebanyak 5.30 log CFU/ml pada pH 3.73. Pada penelitian Cahyaningsih (2006), perubahan yang terjadi pada nira yang mengalami fermentasi setelah 72 jam ditandai dengan penurunan pH dari 6.5 menjadi 3.0. Hal ini disebabkan oleh komponen gula yang di uraikan sebagai bahan karbon untuk difermentasi oleh mikroorganisme tersebut sehingga terjadi penurunan pH yang signifikan dari waktu fermentasi awal hingga 72 jam waktu fermentasi.
4.4 Uji Antagonis BAL Perhadap Bakteri Patogen Asal Pangan 4.4.1 Tsolat BAL dan Bakteri Patogen Asal Pangan
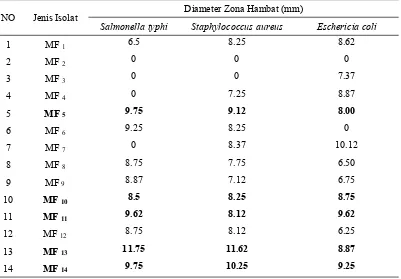
Hasil uji antagonis BAL dalam menghambat pertumbuhan bakteri patogen Salmonella typhi (S.typhi), Staphylococcus aureus (S.aureus) dan Escherichia coli (E.coli) asal pangan menunjukkan bahwa sebagian besar isolat BAL mampu menghambat ketiga jenis bakteri patogen ini. Aktivitas antimikroba tertinggi dalam menghambat pertumbuhan bakteri patogen asal pangan didapatkan pada isolat MF5, MF10, MF11, MF13, MF14 dan MF15dengan luas zona hambat yang terdapat pada Tabel 4 di bawah ini:
Tabel 4. Diameter Zona Hambat BAL Terhadap Bakteri Patogen Asal Pangan
Keterangan “0” = tidak terbentuk zona bening
NO Jenis Isolat Diameter Zona Hambat (mm)
Salmonella typhi Staphylococcus aureus Eschericia coli
23
Dari Tabel 4 diatas dapat dilihat bahwa isolat MF5, MF10, MF11, MF13,MF14 dan MF15 ini diduga potensial dalam menghambat bakteri patogen asal pangan karena mampu menghambat ke-3 jenis bakteri patogen ini dengan diameter zona hambat ≥ 8mm. Pan et al., (2009) mengkategorikan besar diameter zona hambat terhadap bakteri patogen yaitu: zona hambat 0-3 mm menunjukkan aktivitas antimikroba rendah, 3-6 mm berarti aktivitas antimikroba sedang dan diameter zona hambat >6 mm menunjukkan aktivitas antimikroba tinggi. Collado et al., (2007) menambahkan bahwa salah satu cara kerja BAL sebagai probiotik ialah melalui kemampuannya dalam menghambat bakteri patogen dalam saluran pencernaan.
Isolat MF13memiliki daya hambat yang paling besar terhadap bakteri S.typhi dan S.aureus dengan luas zona hambat berturut-turut sebagai berikut 11.75 dan 11.62 pada inkubasi 24 jam. Hal ini diduga karena isolat ini termasuk ke dalam BAL dengan tipe fermentasi homofermentatif. Menurut Jay (1996), BAL homofermentatif menghasilkan hampir 95% asam laktat sebagai produk akhir dari fermentasi yang digunakan untuk menghambat bakteri patogen. Hal yang sama juga dinyatakan oleh Sulistyoet al(2014), yang mendapatkan 4 isolat BAL dari fermentasi biji coklat yang mampu menghambat patogen pangan Salmonella typhimurium. Namun, isolat Lactobacillus plantarum NL 249 homofermentatif mampu menghambat pertumbuhan patogen Salmonella typhimurium dengan diameter zona hambat tertinggi 9.3 mm pada media MHA dengan metode difusi agar. Isolat ini juga mampu memproduksi asam laktat hingga 2.05 % setelah inkubasi 4 hari.
Zona bening pada sekitar cakram yang berisi suspensi BAL terbentuk karena adanya penghambatan senyawa antimikroba terhadap sel-sel mikroba. Alakomiet al(2000), meneliti mekanisme kerja BAL dalam menghambat bakteri patogen dengan cara menghasilkan asam-asam organik dari hasil fermentasi BAL. Asam- asam organik ini akan berdifusi secara pasif ke dalam sel bakteri dengan cara merusak ion-ion pada permukaan sel bakteri. Setelah asam-asam organik
15 MF15 11.62 8.37 8.75
24
akan menghambat transpor substrat, produksi energi, sintesis makromolekul dan keseimbangan cairan sitoplasma bakteri patogen tersebut. Oleh karena ittu, bakteri patogen tersebut akan terhambat pertumbuhannya oleh aktivitas BAL.
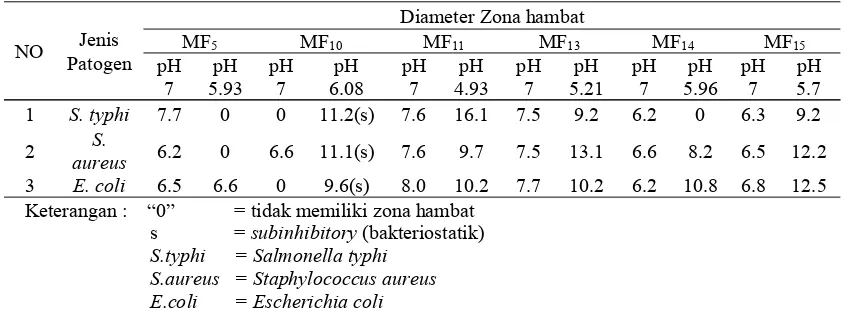
4.4.2 Filtrat Fermentasi 24 jam dan Bakteri Patogen Asal Pangan
Hampir semua isolat BAL potensial mampu menghasilkan senyawa antimikroba selain asam-asam organik dalam menghambat bakteri patogen asal pangan. Seperti pada Tabel 5 dibawah kisaran diameter zona hambat supernatan BAL pH netral yaitu 6.2 - 8.0 tetapi pada MF10 dan MF14 isolat ini tidak mampu menghambat pertumbuhan bakteriSalmonella typhi, dan MF10juga tidak mampu menghambat pertumbuhan Eschericia coli. Sedangkan, isolat MF11 memiliki diameter zona hambat tertinggi yaitu 8.0 mm terhadap bakteri Eschericia colidan jika dibandingkan dengan supernatan BAL pH kultur 24 jam (Tabel 5) luas diameter zona hambatnya lebih besar dibandingkan dengan supernatan BAL pH netral. Hasil kemampuan daya hambat supernatan BAL pada pH netral dan pH kultur 24 jam dapat dilihat pada Tabel 5 berikut:
Tabel 5. Luas Zona Hambat Supernatan BAL pH Netral dengan Supernatan BAL Fermentasi 24 jam Dalam Menghambat Bakteri Patogen Pada Pangan
Keterangan : “0” = tidak memiliki zona hambat s =subinhibitory(bakteriostatik) S.typhi = Salmonella typhi
S.aureus = Staphylococcus aureus E.coli = Escherichia coli
Aktivitas supernatan netral bakteri asam laktat tidak membentuk zona bening berarti penghambatan bakteri patogen karena aktivitas subinhibitory dari hidrogen peroksida, etanol, dan diasetil. Karena daya hambat dari senyawa antimikroba ini lebih kecil (Rachmawati et al., 2005). Supernatan BAL MF5 fermentasi 24 jam tidak mampu menghambat pertumbuhan bakteri patogen Salmonella typhi dan Staphylococcus aureus, isolat MF14 juga tidak mampu
25
menghambat pertumbuhan Salmonella typhi. Hal ini diduga karena asam-asam organik yang dihasilkan oleh BAL dalam jumlah sedikit dimana pada data Tabel 5 dapat dilihat pH dari masing-masing isolat ini masih tergolong tinggi.
4.5 Viabilitas Bakteri Sebagai Kandidat Probiotik
4.5.1 Ketahanan BAL pada pH Lambung (2.0) dan pH Usus (7.2) Manusia Hasil uji ketahanan BAL potensial setelah terpapar dengan kondisi pH lambung selama 90 menit diperoleh keenam isolat dengan kode MF5, MF10, MF11, MF13, MF14 dan MF15 mampu bertahan hidup pada suasana pH 2 (lambung) dengan kemampuan hidup diatas 50%. Dari keenam isolat BAL yang diuji hanya isolat MF13 yang mengalami penurunan jumlah sel kurang dari 1 unit log, dimana jumlah bakteri dari 10.27 log CFU/ml (kontrol) turun menjadi 9.41 log CFU/ml setelah terpapar dengan MRSB pH 2 selama 90 menit seperti pada Tabel 6 di bawah ini:
Tabel 6. Persentase Ketahanan Hidup BAL Pada pH Lambung dan Usus Manusia
Kondisi kritikal bagi BAL pertama kali terjadi pada saat sel bakteri memasuki saluran pencernaan, yaitu terpapar dengan asam lambung. Asam lambung memiliki pH yang sangat rendah, yaitu sekitar 2,0. Uji ketahanan bakteri asam laktat pada pH rendah merupakan salah satu sifat yang paling penting dalam menentukan karakteristik dari mikroorganisme probiotik (Haveenaar dan Huis, 1992). Hal ini sesuai dengan data yang didapatkan pada penelitian ini, dimana semua isolat BAL yang diuji mengalami penurunan jumlah sel bakteri seperti terlihat pada Tabel 6. Isolat MF11 memiliki kemampuan bertahan hidup terendah yaitu 65.03%, dimana jumlah sel bakteri yang bertahan hidup dari 10.24 log NO IsolatKode Log CFU/mLKontrol pH 2 (lambung)Log CFU/mL Ketahananhidup
(%)
1 MF5 10.38 7.68 73.98 9.52 91.71
2 MF10 10.28 8.50 82.68 7.21 70.13
3 MF11 10.24 6.66 65.03 8.65 84.47
4 MF13 10.26 9.41 91.71 9.45 92.10
5 MF14 10.43 8.01 76.79 8.43 80.82
26
bahwa salah satu syarat BAL sebagai probiotik ialah mampu bertahan hidup melewati lambung sampai ke usus halus. Makanan yang masuk ke dalam lambung akan terpapar dengan asam lambung hingga 90 menit pada pH yang sangat rendah yaitu sekitar 2.0 (pada kondisi lambung kosong) dan sekitar 7.2 saat memasuki usus halus.
Apabila bakteri lolos dari lambung dengan pH 2 maka akan masuk ke dalam saluran usus dengan nilai pH 7.2. Pada pH 7.2 semua isolat BAL juga mampu bertahan hidup dimana populasi BAL setelah ditumbuhkan pada kondisi tersebut memiliki jumlah sel bakteri berkisar antara 7-9 log CFU/ml. Keenam isolat ini mengalami penurunan jumlah sel bakteri tidak lebih dari 2 log CFU/ml dengan ketahanan hidup tertinggi 91.71% oleh isolat MF5. Lin et al. (2006) melaporkan bahwa ketahanan hidup BAL ≥ 50% pada suasana pH lambung dan usus dinyatakan mempunyai ketahanan hidup yang tinggi. Pada penelitian Nurnaafi (2016), kelima isolat BAL asal bekasam mampu bertahan hidup pada pH 7.2 dengan ketahanan hidup tertinggi 94.95% setelah diinkubasi pada media MRSB dengan masing-masing pengaturan pH selama 3 jam. Pada penelitian Krisnamoorthyet al., (2015), isolatLactobacillusK3mampu bertahan hidup pada pH 2 hingga 4 jam dengan jumlah sel bakteri yang bertahan 0.06 pada panjang gelombang 600nm ketika diukur menggunakan spektrofotometer.
4.5.2 Ketahanan BAL Pada Garam Empedu (0.5% ox gall)
Hasil uji isolat BAL bertahan hidup pada suasana garam empedu MRSB+ 0.5% ox gall didapatkan bahwa isolat MF5, MF10, MF11, MF14 dan MF15 mampu bertahan hidup hingga lebih dari 50%, semua isolat BAL kecuali MF13memiliki kemampuan ketahanan hidup berkisar 98-74% seperti pada Tabel 7 di bawah ini:
Tabel 7. Persentase Ketahanan Hidup BAL Pada Suasana Garam Empedu
NO Kode Isolat Kontrol (log CFU/ml) Terpapar 4 jam (logCFU/ml) Ketahanan hidup(%)
1 MF5 9.52 9.34 98.10
2 MF10 10.27 8.42 81.98
3 MF11 9.94 7.63 76.76
4 MF13 8.03 -
-5 MF14 10.04 8.85 88.14
27
Dari Tabel 7 diatas diperoleh data bahwa isolat MF13 tidak mampu bertahan hidup pada suasana media MRSB + 0.5% ox gall, pada awal terpapar dengan garam empedu jumlah awal sel bakteri 8.03 log CFU/ml dan turun menjadi 0 log CFU/ml setelah terpapar dengan garam empedu selama 4 jam. Hal ini diduga karena BAL ini memiliki sel yang sensitif terhadap konsentrasi garam yang tinggi dan isolat ini dinyatakan tidak termasuk kedalam kelompok probiotik. Nurnaafi (2016), mendapatkan isolat NS6 yang diisolasi dari bekasam tidak mampu tumbuh pada media MRSB+ 0.5%ox gall, sedangkan isolat BAL lainnya mampu bertahan hidup pada garam empedu tersebut.
Isolat MF5 memiliki daya tahan hidup yang paling besar dibandingkan dengan isolat BAL lainnya, dengan persentase ketahanan hidup 98.10% dan jumlah penurunan sel BAL dari 9.52 menjadi 9.34 log CFU/ml. Argyri et al. (2013) menguji ketahanan 12 strain BAL asal fermentasi minyak zaitun terhadap kondisi garam empedu 0.5% menghasilkan penurunan populasi tidak lebih dari 2 log. Mourad dan Meriem (2008) melaporkan bahwa galur L. plantarum SH 12 mempunyai ketahanan terhadap garam empedu sebesar 75% yang lebih tinggi dibandingkan dengan galur L. plantarumSH 21 yaitu sebesar 65%. Morgolles et al. (2003), juga meneliti ketahanan isolatBifidobacterium yang diuji pada media MRSB + 0.5% ox gall,isolat ini mengalami penurunan karena isolat BAL tidak tahan terhadap garam empedu.
Pengujian ketahanan hidup BAL menggunakan ox gall 0.5% dengan lama inkubasi 4 jam berlandaskan pada Argyri et al. (2013) yang menyatakan bahwa konsentrasi garam empedu pada lumen manusia adalah 0.5% dengan waktu penyerapan makanan di usus kecil selama 4 jam. Ketahanan beberapa strain pada garam empedu terkait dengan aktivitas hirolisis garam empedu yang dapat menghidrolisis garam empedu, mengurangi toksin dan efek samping garam empedu terhadap BAL.
4.5.3 Hasil Uji Penempelan BAL Pada Permukaan PadatStainless steel
28
menempel pada permukaan padat dan ditandai dengan jumlah sel bakteri tertinggi sebanyak 7.42 CFU/ml pada tiap cm2 lempeng permukaan padat. Hasil penempelan dapat dilihat pada Tabel 8 di bawah ini:
Tabel 8 Jumlah Sel Bakteri Asam Laktat (log CFU/ml) tiap cm2Stainless steel
Isolat MF5 memiliki nilai penempelan terendah dibandingkan dengan isolat bakteri lainnya, jumlah sel bakteri MF5 hanya 0.5 log CFU/ml tiap luas lempeng permukaan padat ini. Kusumawardhani (2002) mendapatkan isolat klinis BAL Lactobacillus brevis, Lactobacillus casei dan Lactobacillus acidophilus mampu menempel pada stainless steel dengan jumlah sel bakteri 3,85 - 4,05 log sel/cm2sedangkan isolat makanan Lactobacillus brevis mampu menempel pada stainless steeldengan jumlah sel bakteri 4,4 log sel/cm2.
Seluruh isolat BAL yang menempel pada permukaan padat lempeng stainless stell memiliki rata-rata jumlah sel bakteri 0.5-7.43 log CFU/ml pada media MRSA. Pada penelitian ini BAL yang membentuk biofilm hanya dihitung pada cawan tuang dan belum menggunakan scanning electron microscop(SEM), oleh karena itu penelitian ini hanya melihat kemampuan BAL menempel pada permukaan padat. Elida (2002), Wirawati (2002) dan Syafia (2002) menunjukkan bahwa sifat hidrofobik dan hidrofilik sel bakteri asam laktat tidak mempengaruhi sel BAL untuk dapat membentuk agregat atau menempel pada permukaan padat. Hasil penelitiannya menunjukkan bahwa BAL yang bersifat hidrofilik baik dari isolat makanan maupun isolat klinis ternyata mampu membentuk agregat dan menempel dengan baik pada permukaanstainless steel.
4.6 Rekapitulasi Hasil Seleksi Tsolat BAL Berpotensi Probiotik
Hasil isolasi isolat BAL dari nira aren didapatkan 16 isolat BAL yang mampu tumbuh pada media MRSA + CaCO3 1% dan mampu menghambat bakteri patogen asal pangan (Salmonella typhi, Staphylococcus aureus dan Escherichia
NO Nama Isolat Jumlah Sel Bakteri (log CFU/ml)/cm2
29
coli). Terdapat 6 isolat (MF5, MF10, MF11, MF13, MF14 dan MF15) BAL yang potensial dalam menghambat bakteri patogen asal pangan dengan diameter zona hambat ≥ 8mm dan mampu menghambat ketiga jenis bakteri patogen asal pangan tersebut. Rachmawati et al., (2005) menyatakan bahwa penghambatan kultur BAL terhadap bakteri patogen disebabkan aktivitas kultur didukung oleh asam dan komponen-komponen metabolit yang dihasilkannya. Supernatan netral BAL terdiri dari komponen-komponen metabolit bakteri asam laktat selain asam organik seperti hidrogen peroksida, diasetil, etanol dan bakteriosin.
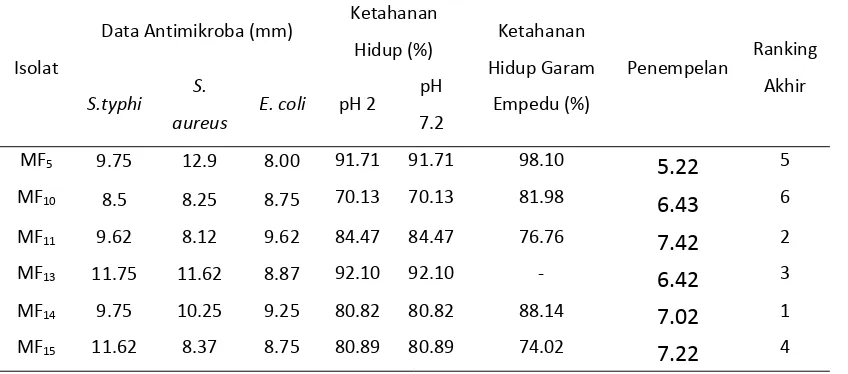
Dari hasil penelitian ini didapatkan 5 isolat (MF5, MF10, MF11,MF14 dan MF15) BAL potensial direkapitulasi nilai dari masing-masing parameter dan diperoleh 2 isolat BAL yang berpotensi untuk dikembangkan menjadi probiotik seperti pada Tabel 9 di bawah ini:
Tabel 9. Rekapitulasi Hasil Seleksi Isolat BAL Berpotensi Probiotik
Dari Tabel 9 diatas didapatkan data bahwa ada 2 isolat yaitu MF14 dan MF11 yang paling berpotensi untuk dikembangkan lebih lanjut menjadi probiotik yang baik dikonsumsi oleh masyarakat. Isolat MF13 juga berpotensi menjadi probiotik, namun karena isolat ini tidak mampu bertahan pada suasana garam empedu maka isolat ini dikeluarkan dari kandidat probiotik. Menurut Tuomola et al., (2001) Bakteri yang mampu bertahan pada kondisi keasaman lambung akan dialirkan menuju usus bagian atas, didalam usus bakteri akan
Isolat
MF5 9.75 12.9 8.00 91.71 91.71 98.10 5.22 5
MF10 8.5 8.25 8.75 70.13 70.13 81.98 6.43 6
MF11 9.62 8.12 9.62 84.47 84.47 76.76 7.42 2
MF13 11.75 11.62 8.87 92.10 92.10 - 6.42 3
MF14 9.75 10.25 9.25 80.82 80.82 88.14 7.02 1
30
BAB 5
KESTMPULAN DAN SARAN
5.1 Kesimpulan
A. Diperoleh 16 isolat BAL yang tumbuh pada media MRSA + CaCO3 1%. Namun, hanya 6 isolat yang paling potensial menghambat ke-3 jenis bakteri asal panganSalmonella typhi, Staphylococcus aureusdanEscherichia coli. B. Lima dari enam isolat potensial dengan kode MF5, MF10, MF11, MF14 dan
MF15dikategorikan sebagai kandidat probiotik, sedangkan isolat MF13keluar dari kategori probiotik karena tidak mampu bertahan pada suasana garam empedu.
C. Semua isolat BAL potensial mampu menghasilkan senyawa antimikroba selain asam-asam organik dalam menghambat ke-3 jenis bakteri patogen asal pangan dengan luas zona hambat lebih rendah.
D. Diperoleh 2 isolat paling potensial dengan kode isolat MF14dan MF11 yang memiliki nilai tertinggi dari masing-masing parameter uji yang telah dilakukan.
5.2 Saran
BAB 2
TTNJAUAN PUSTAKA
2.1 Fermentasi Pada Nira
Arenga pinnata Mer. (tanaman aren) adalah salah satu tanaman dari famili Arecaceae yang banyak ditanam di India (Muralidharan dan Deepthi, 2013). Tanaman ini menghasilkan cairan dari pangkal bunga jantan yang belum mekar dan sering disebut nira. Cairan dari pohon ini dapat difermentasi untuk menghasilkan alkohol yang bisa digunakan oleh masyarakat (Kismurtono, 2012). Nira merupakan cairan yang keluar melalui proses penyadapan bunga jantan tanaman aren yang belum terbuka. Bagian pangkal tandan bunga jantan yang belum mekar inilah yang akan dipotong lalu disadap setiap pagi dan sore.
Pada 100 ml nira terkandung gula sebanyak 10-15% dengan kondisi pH yang mendekati normal. Tingginya kandungan gula pada nira menyebabkan nira mudah terfermentasi oleh berbagai macam mikroorganisme akibat penyadapan yang kurang bersih (Kharisma, 2014). Mikroba ini berasal dari jerigen penampungan nira, kondisi manggar yang terpapar langsung dengan udara dan orang yang menyadap nira tersebut. Kondisi penyadapan yang terbuka akan mempercepat masuknya bakteri kontaminan yang berasal dari lingkungan ke dalam nira tersebut (Rusbana, 2009).
Selain gula, nira aren juga memiliki kandungan mineral dan vitamin yang tinggi. Nira adalah salah satu minuman yang baik bagi kesehatan tubuh manusia (Muralidharan dan Deepthi, 2013). Tidak hanya tanaman aren, kelapa juga menghasilkan cairan nira dari bagian tandan bunga jantan yang belum mekar. Nira kelapa dan nira aren yang terfermentasi secara spontan disebut tuak dan minuman fermentasi ini populer di negara Asia. Tuak adalah salah satu jenis minuman fermentasi yang mengandung berbagai mikroorganisme alami yang termasuk ke dalam kelompok probiotik. Mikroorganisme probiotik ini sering digunakan sebagai tambahan alami pada makanan dan berfungsi dalam meningkatkan sistem imun tubuh tanpa efek samping (Ashraf dan Shah, 2011).
6
Kandungan gula nira bisa mencapai 15% dengan pH yang mendekati netral, kandungan gula inilah yang menjadi sumber karbon utama mikroorganisme tersebut (Xiaet al, 2011).
Fase pertama fermentasi spontan yang terjadi pada nira kelapa didominasi oleh kelompok bakteri Leuconostoc, Lactobacillus, Streptococcus, Staphylococcus, Bacillus, danEnterobacter yang beberapa diantaranya diketahui ialah BAL. Aktivitas BAL dalam fermentasi akan menyebabkan penurunan pH pada nira. Selain BAL, kerusakan pada nira juga dapat disebabkan oleh khamir yang melakukan fermentasi alkohol (Vidanapathiranaet al,1983). Penurunan pH nira yang terjadi dengan cepat akan mempengaruhi ketersediaan sukrosa di dalam nira. Sukrosa terdegradasi oleh enzim hidrolase bakteri yang menghidrolisis sukrosa menjadi asam. Reaksi hidrolisis tersebut dapat terjadi secara spontan sehingga nira yang terfermentasi berubah menjadi asam (Wang, 2004).
Pada beberapa daerah seperti di India nira banyak dikonsumsi sebagai minuman yang bernama keraamritham. Keraamritham ini adalah sejenis minuman yang terbuat dari nira dan tidak mengandung alkohol pada suhu rendah. Daya simpan minuman ini pun bisa mencapai 3 bulan pada suhu rendah. Keraamritham ini merupakan minuman yang mengandung banyak nutrisi terutama kandungan vitamin dan mineral (Jayaprakashet al,2013).
2.2 Ciri Umum Bakteri Asam Laktat
Bakteri asam laktat (BAL) adalah bakteri yang telah lama dikenal dan dimanfaatkan oleh manusia dalam proses pengolahan bahan makanan, yaitu melalui proses fermentasi BAL. Bakteri yang terlibat dalam proses fermentasi ini memberikan kontribusi yang besar terhadap perbaikan rasa, tekstur dan masa simpan produk. Sifat pengawet oleh BAL adalah karena adanya produksi senyawa metabolit dan penurunan pH pada lingkungan fermentasi, hal inilah yang menghambat pertumbuhan mikroba lain selama fermentasi berlangsung (Rahayuet al, 1999).
7
yaitu homofermentatif dan heterofermentatif. Jalur homofermentatif adalah dimana lebih dari 90% substrat gula diubah menjadi asam laktat, sedangkan jalur heterofermentatif menghasilkan ± 50% asam laktat dan 50% bahan seperti asam asetat, etanol dan karbondioksida. Bakteri asam laktat pada umumnya mempunyai satu atau dua jalur ini (obligat homofermentatif atau obligat heterofermentatif), meskipun ada beberapa spesies yang mempunyai metabolisme keduanya (fakultatif homofermentatif).
BAL pada umumnya mempunyai karakteristik morfologi, fisiologi dan metabolit tertentu. Bakteri ini termasuk ke dalam Gram positif, tidak menghasilkan endospora, berbentuk bulat maupun batang, dan menghasilkan asam laktat sebagai mayoritas produk akhir selama memfermentasi karbohidrat (Axellson, 1998). Pada saat fermentasi, BAL homofermentatif akan memetabolisme gula melalui jalur Embden-Meyerhoff-Parnass menjadi asam laktat dalam jumlah yang banyak. Sedangkan, BAL heterofermentatif akan memetabolisme gula melalui jalur fosfoketolase menjadi asam laktat dan produk oranik lainnya seperti alkohol, asam asetat, asam lemak bebas, asam format, amonia, diasetil, asetonin dan CO2(Salminenet al., 2004).
2.3 Bakteri Asam Laktat Sebagai Probiotik
8
Menurut Food and Agriculture Organization/World Health
Organization (FAO/WHO) (2001) pada umumnya strain probiotik tidak hanya mampu bertahan melewati saluran pencernaan tetapi juga memiliki kemampuan untuk berkembang biak dalam saluran pencernaan yaitu mampu bertahan pada suasana cairan lambung dan cairan empedu. Selain itu probiotik juga harus mampu menempel pada sel epitel usus manusia, mampu membentuk kolonisasi pada saluran pencernaan, mampu menghasilkan zat anti mikroba (bakteriosin) dan memberikan pengaruh yang menguntungkan kesehatan manusia
Aktivitas probiotik terbagi atas 3 aspek seperti sebagai nutrisi, fisiologis dan aspek antimikroba. Aspek nutrisi yaitu adanya enzim lactase untuk membantu metabolisme komponen makanan, sintesis beberapa jenis vitamin (K, folat, piridoksin, pantotenat, biotin dan riboflavin) dan mengurangi senyawa racun yang ada pada makanan dalam usus. Aspek fisiologis meliputi kemampuan menjaga keseimbangan komposisi mikroflora usus dan menstimulasi sistem kekebalan usus. Aspek efek antimikroba meliputi kemampuan untuk meningkatkan ketahanan terhadap mikroba patogen (Naidu dan Clemens, 2000).
Karena manfaat dari BAL telah banyak diketahui oleh masyarakat, maka masyarakat mengidentifikasi BAL sebagai pengawet produk makanan. Sifat pengawet dari BAL ini terutama disebabkan oleh adanya asam laktat, hidrogen peroksida dan senyawa bakteriosin. Bakteriosin adalah protein yang terdiri dari molekul-molekul yang dihasilkan dari bermacam-macam spesies bakteri yang mempengaruhi kegiatan bakterisidal terhadap bakteri yang mudah dipengaruhi olehnya (Melia dan Indri, 2010).
9
2.4 Senyawa Antimikroba Bakteri Asam Laktat
Bakteri asam laktat (BAL) merupakan bakteri anaerob fakultatif yang cukup luas penyebarannya di alam seperti terdapat pada bagian tanaman itu sendiri, saluran pencernaan baik hewan maupun manusia, berbagai produk makanan maupun minuman fermentasi seperti yoghurt, tuak, keju, saos, kedelai dan sake. BAL dapat mengendalikan pertumbuhan bakteri patogen dengan cara memproduksi asam organik, hidrogen peroksida, diasetil dan bakteriosin (Januarsyah, 2007).
Kecap ikan adalah salah satu jenis makanan fermentasi yang banyak
ditumbuhi oleh BAL dari jenis L. plantarum yang mampu menghambat
pertumbuhan kapang dari jenis Penicillium citrinum. Antimikotik ini mampu dihasilkan oleh BAL setelah kontak dengan kapang selama 12-48 jam (Handayani, 2001). Sedangkan menurut penelitian Cahyaningsih (2006), bahwa pada nira lontar terdapat BAL dari spesies Leuconostoc mesenteroides, Leuconostoc pseudomesenteroides, Lactobacillus plantarum, dan Lactobacillius fermentum. Isolat BAL ini mampu menghambat pertumbuhan bakteri patogen Salmonella typhimuriumdanAspergilus flavusyang ada pada biji kakao (Usmiati et al,2011).
Kemampuan BAL dalam menghambat pertumbuhan bakteri patogen khususnya patogen pada pangan melalui berbagai mekanisme. Salah satu mekanisme BAL dalam mengurangi senyawa toksin dari media cair adalah dengan adanya pengikatan secara fisik antara BAL dan patogen tersebut. Salah satu contohnya adalah Lactobacillusdan strain bakteri probiotik. BAL ini mampu menurunkan senyawa aflatoksin B1 (AFB1) dari jaringan usus halus tepatnya bagian duodenum. Aktivitas antimikroba yang dimiliki oleh probiotik ini dapat digunakan sebagai detoks racun usus manusia dari bakteri patogen pada usus (Hussein, 2009).
10
menyebabkan oksidasi sel bakteri dan merusak struktur dasar molekul dari protein sel (Zalanet al., 2005).
Bakteriosin dibagi menjadi 4 kelas yaitu bakteriosin kelas 1 yang disebut lantibiotik contohnya nisin yang dihasilkan oleh Lactobacillus lactis sangat aktif melawan sebagian besar bakteri gram positif dengan merusak dinding sel dari bakteri tersebut (Benech et al., 2002). Bakteriosin kelas II berupa non lantibiotik contohnya pediosin yang dihasilkan oleh Lactobacillus plantarum yang dapat menghambat Listeria monocytogenes (Loessner et al., 2002). Bakteriosin kelas III merupakan protein yang tidak tahan terhadap panas dan berat molekul lebih dari 30 kDa. Bakteriosin kelas IV merupakan glikoprotein atau lipoprotein (Oscariz dan Pisabarro, 2000).
Penghambatan patogen oleh BAL disebabkan karena aktivitas kultur BAL yang menghasilkan asam dan senyawa metabolit. Komponen metabolit-metabolit tersebut ialah seperti hidrogen peroksida, diasetil, etanol, dan bakteriosin. BAL yang diperoleh dari fermentasi asinan sawi ini memiliki aktivitas penghambatan yang tinggi dalam menghambat peretumbuhan bakteri patogen E.coli dan Staphylococcus aureus. Hasil akhir fermentasi karbohidrat dari bakteri asam laktat berupa beberapa komponen yang memiliki sifat antimikroba (Rachmawatiet al,2006).
2.5 Bakteri Patogen Asal Pangan
11
(Badan Pengawas Obat dan Makanan, 2008).
Salmonella ialah salah satu jenis bakteri patogen yang sering mengkontaminasi bahan makanan. Salmonella merupakan bakteri Gram negatif, tidak membentuk spora, berbentuk batang, dapat memfermentasi glukosa dan biasanya disertai dengan pembentukan gas tetapi tidak memfermentasi laktosa maupun sukrosa (Frazier dan Westhoff, 1988). Salmonella spp. merupakan salah satu penyebab utama keracunan makanan di seluruh dunia. Tidak hanya makanan mentah, makanan siap saji juga tidak dibenarkan mengandung bakteri dari genus Salmonella.Salmonellaspp. dapat menyebabkan penyakit seperti gastroenteritis, bacteremia, enteric ataupunparatyphoid feverdan infeksi lokal (Lindquist, 1998; Baeumlerdkk., 2000).
Escherichia colimerupakan indikator dari kontaminan yang berasal dari fekal. Habitat alami E. coli adalah saluran pencernaan hewan dan manusia tepatnya usus besar (Badan Pengawas Obat dan Makanan, 2008). E. coli dipergunakan sebagai mikroba indikator terhadap kontaminasi feses pada air dan susu, termasuk dalam grup Enterobacteriaceae dan bersifat motil flagella peritrikus (Buckle et al., 2007). Enteropathogenic Escherichia coli (EPEC) merupakan salah satu dari keempat kelompok bakteri patogenik indikator kontaminasi fekal dan penyebab diare. Bakteri ini melekatkan diri pada sel mukosa usus kecil dan membentuk filamentous aktin pedestal sehingga menyebabkan diare cair (Arifin, 2009).
Bakteri patogen pengkontaminasi pangan lainnya adalahStaphylococcus aureus. Bakteri ini tumbuh pada permukaan kulit manusia (flora normal), mulut atau rongga hidung manusia. Keberadaan bakteri ini pada makanan dapat disebabkan oleh sanitasi dari pengolah pangan tersebut kurang memadai (Badan Pengawas Obat dan Makanan, 2008).
2.6 Mekanisme Kerja Antimikroba
12
senyawa yang mampu menghambat mikroorganisme patogen seperti hidrogen peroksida, diasetil, karbondioksida, asetaldehid, d-isomer asam-asam amino dan bakteriosin. Bakteriosin merupakan senyawa protein yang disekresikan oleh bakteri yang bersifat menghambat pertumbuhan bakteri lain terutama yang memiliki kekerabatan erat secara filogenetik. Senyawa ini mudah terdegradasi oleh enzim proteolitik dalam pencernaan hewan dan manusia. Bakteriosin yang dihasilkan BAL mudah diterima sebagai bahan tambahan dalam makanan baik oleh ahli kesehatan maupun oleh konsumen karena bakteri ini secara alami berperan dalam proses fermentasi makanan (Kusmiati & Amarila, 2002).
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Tanaman aren adalah salah satu jenis palma yang penyebarannya sangat luas di Indonesia. Di kawasan Sumatera Utara diperkirakan terdapat ± 4.357 pohon aren setiap hektar luas perkebunan dan menghasilkan nira sebanyak 26.190.000 liter setiap tahunnya (Ditjenbun, 2006). Nira merupakan cairan yang disadap dari bagian pangkal bunga jantan aren yang belum mekar. Nira aren mengandung gula yang baik bagi tubuh manusia karena memiliki kandungan kalori yang rendah. Kandungan gula tersebut diantaranya adalah K-acesulfame, saccharin, stevia, neotame dan sucrolase. Gula-gula ini jauh lebih manis dibandingkan dengan sukrosa dan baik bagi tubuh (Abdullahet al, 2015).
Muralidharan dan Deepthi (2013) menyatakan bahwa total kandungan gula yang terdapat pada tiap 100 ml nira ialah sebanyak 14,40 gr. Selain gula, dalam 100 ml nira juga mengandung protein sebanyak 0.23-0.32 gr dan berbagai vitamin seperti asam sitrik: 0,50 gr, besi: 0,15 gr, fosfor: 7,59 gr dan asam askorbat: 16-30 gr. Tingginya kandungan nutrisi pada nira menjadi penyebab mudahnya terkontaminasi oleh berbagai mikroorganisme, salah satunya ialah bakteri asam laktat (BAL). Bakteri asam laktat didefinisikan sebagai suatu kelompok bakteri gram positif, tidak menghasilkan spora, berbentuk bulat dan batang yang memproduksi asam laktat sebagai produk akhir metabolik utama selama fermentasi karbohidrat (Surono, 2003).
2
tersebut diantaranya ialah dari jenis Lactobacillus acidophilus, Lactobacillus caseidanBifidobacterium longum.
BAL juga diketahui mampu menghambat pertumbuhan beberapa bakteri patogen dengan cara memproduksi senyawa antimikroba. Komponen senyawa antimikroba tersebut diantaranya ialah: asam-asam organik (laktat, asetat dan format), senyawa bakteriosin dan antimikotik. Tidak hanya menghambat patogen, BAL juga mampu menurunkan kadar kolesterol dalam darah (Jenie et al, 2002; Salminenet al, 2004).
Salah satu syarat BAL sebagai probiotik ialah harus mampu bertahan hidup pada saluran pencernaan seperti melewati kondisi ekstrim dengan keasaman yang tinggi di lambung serta mampu bertahan pada kondisi garam empedu. Ketahanan terhadap tingkat keasaman yang tinggi merupakan sifat yang pertama yang harus dipenuhi oleh BAL sebagai probiotik (Tuomolaet al., 2001). Probiotik juga harus mampu menempel pada epitel usus, mampu membentuk kolonisasi pada saluran pencernaan, mampu menghasilkan zat antimikroba dan memberikan pengaruh yang menguntungkan bagi inangnya. Syarat probiotik lainnya ialah tidak bersifat patogen dan aman jika dikonsumsi (Prado et al., 2008).
Pada penelitian Melia dan Indri (2010) jenis BAL Lactococcus lactis yang diisolasi dari dadih susu sapi mutan mampu menghambat pertumbuhan bakteri patogen dari makanan seperti Staphylococcus aureus, Salmonella typii dan Escherichia coli. Mikroba patogen pada pangan dapat terbawa melalui air, debu, lalat, hewan peliharaan, dan orang yang menjual makanan tersebut. Bakteri patogen yang sering mengkontaminasi makanan ialahSalmonella typhii. Penyakit yang diakibatkan oleh bakteriSalmonella typhii ialah tifus dengan gejala demam dan diare, sedangkan E.coli strain Enteropatogenic dapat menyebabkan diare. Bakteri ini dapat berasal dari kontaminasi kotoran manusia. Staphylococcus aureus menyebabkan penyakit diare, mual dan kejang. Asal bakteri ini dari kulit dan saluran pernafasan manusia yang mengolah makanan tersebut (Badan Pengawas Obat dan Makanan, 2013).
3
khususnya kawasan Sumatera Utara memungkinkan pemanfaatan nira aren, tidak hanya diolah menjadi tuak dan gula aren namun dapat dikembangkan lagi seperti sebagai minuman probiotik. Untuk itu, perlu dilakukan penelitian mengenai potensi BAL pada nira yang bermanfaat sebagai probiotik dan mampu menghambat pertumbuhan bakteri patogen yang mengkontaminasi makanan dan minuman.
1.2 Permasalahan
Selama ini, pemanfaatan nira pada lingkungan masyarakat batak masih sebatas difermentasi menjadi minuman tradisional yaitu tuak dan bahan dasar membuat gula aren. Nira berpotensi sebagai media pertumbuhan bakteri asam laktat (BAL). BAL mampu menghasilkan senyawa asam organik dan senyawa bakteriosin yang mampu menghambat pertumbuhan bakteri patogen dan memiliki berbagai manfaat yang baik bagi tubuh. Oleh sebab itu, perlu dilakukan penelitian mengenai potensi BAL yang diisolasi dari nira aren dalam menghambat pertumbuhan bakteri patogen pada pangan.
1.3 Tujuan Penelitian
Tujuan penelitian ini ialah untuk :
a. mengisolasi dan mengetahui potensi BAL yang diisolasi dari nira aren asal Tapanuli Utara dalam menghambat pertumbuhan bakteri patogen pada pangan sepertiSalmonella typhii, Eschericia colidanStaphylococcus aureus. b. mendapatkan isolat BAL yang memiliki kemampuan sebagai probiotik. c. mengetahui kemampuan isolat BAL menghambat pertumbuhan bakteri
patogen pada pangan dengan menghasilkan senyawa antimikroba selain asam-asam organik.
1.4 Manfaat Penelitian
4
POPENST BAKPERT ASAM LAKPAP YANG DTTSOLAST DART NTRA AREN DALAM MENGHAMBAP PERPUMBUHAN BAKPERT
PAPOGEN ASAL PANGAN
ABSPRAK
Nira diketahui mengandung gula dan komponen nutrisi lain yang baik bagi pertumbuhan mikroorganisme, salah satunya bakteri asam laktat. Tujuan dari penelitian ini adalah untuk mendapatkan isolat bakteri asam laktat potensial dari nira aren yang mampu menghambat pertumbuhan bakteri patogen asal pangan dan memenuhi syarat lain sebagai probiotik. Pada berbagai interval waktu fermentasi (0, 12, 24, 36 dan 48 jam) nira aren, didapatkan isolat bakteri asam laktat yang tumbuh pada media de mann Rogosa agar (MRSA) + CaCO3 1%. Masing-masing isolat diuji kemampuannya menghambat bakteri patogen asal pangan (Salmonella typhi, Staphylococcus aureus dan Escherichia coli) pada media Mueller Hinton Agar (MHA) dengan metode difusi cakram. Isolat yang potensial diuji kemampuannya bertahan pada suasana saluran pencernaan seperti pada pH lambung (2.0), pH usus (7.2), garam empedu (0.5%ox gall) dan mampu membentuk biofilm pada permukaan padat stainless steel pada media MRSA. Hasil isolasi bakteri asam laktat asal nira aren didapat 16 isolat yang tumbuh pada media MRSA + CaCO31% dan didominasi oleh bakteri heterofermentatif. Hanya ada 6 isolat (MF5, MF10, MF11, MF13, MF14 dan MF15) potensial yang mampu menghambat pertumbuhan bakteri patogen asal pangan dan mampu memproduksi senyawa antimikroba selain asam-asam organik. Dari 6 isolat BAL potensial didapat 5 isolat yang mampu bertahan pada suasana saluran pencernaan dan mampu menempel pada permukaan padat stainless steel yaitu MF5, MF10, MF11, MF14 dan MF15, sedangkan isolat MF13 tidak mampu bertahan pada suasana garam empedu. Namun, ada dua isolat BAL paling potensial dari semua parameter uji yaitu MF11dan MF14.
POPENCY of LACPTC ACTD BACPERTA TSOLAPED of PALM JUTCE in TNHTBTPTNG PAPHOGENTC BACPERTA in FOOD
ABSPRACP
Nira contain sugar and other nutritional components that are good for the growth of microorganisms, one of which lactic acid bacteria. The purpose of this study was to obtain lactic acid bacteria isolates potential of palm juice that could inhibit the growth of pathogenic bacteria of food origin and included in the candidate probiotics. Fermentation at various time intervals (0, 12, 24, 36 and 48 hours) palm juice, obtained LAB isolates were grown on media de mann rogosa agar (MRSA) + 1% CaCO3. Each of LAB isolates tested for their ability to inhibit pathogenic bacteria origin of food (Salmonella typhi, Staphylococcus aureus and
Escherichia coli) on media Mueller Hinton Agar (MHA) with disc diffusion
method. Isolates potential was inhibited pathogenic bacteria origin of food tested for its ability to survive in the atmosphere of the gastrointestinal tract such as gastric pH (2.0), intestinal pH (7.2), bile salts (0.5% ox gall) and capable of forming a biofilm on the surface of solid stainless steel on media MRSA ,origin isolated palm juice obtained 16 isolates of Lactic acid bacteria are grown on
media MRSA CaCO3+ 1% and is dominated by heterofermentatif bacteria. There
were only 6 isolates (MF5, MF10, MF11, MF13, MF14 and MF15) capable potentially inhibited the growth of pathogenic bacteria of food origin and isolates were also able to produce antimicrobial compounds other than organic acids. Only 5 out of 6 isolates that were able to survive in the atmosphere of the gastrointestinal tract and is able to form a biofilm on the surface of solid stainless steel namely MF5, MF10, MF11, MF14and MF15, while isolates MF13are not able to survive in an atmosphere of bile salts that are removed from the isolates candidates probiotics From all of isolates, there were two the most potentially isolates as a probiotic candidate namely MF14and MF11.
POPENST BAKPERT ASAM LAKPAP YANG DTTSOLAST
DART NTRA AREN DALAM MENGHAMBAP
PERPUMBUHAN BAKPERT PAPOGEN ASAL PANGAN
SKRTPST
Skripsi ini diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
MAREPPA FTPRTANT 120805025
DEPARPEMEN BTOLOGT
FAKULPAS MAPEMAPTKA DAN TLMU PENGEPAHUAN ALAM UNTVERSTPAS SUMAPERA UPARA
PERSEPUJUAN
Judul : Potensi Bakteri Asam Laktat yang Diisolasi dari
Nira Aren dalam Menghambat Pertumbuhan Bakteri Patogen Asal Pangan
Kategori : Skripsi
Nama : Maretta Fitriani
Nomor Induk Mahasiswa : 120805025
Program Studi : Sarjana (S1) Biologi
Departemen : Biologi
Fakultas : Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Disetujui di
Medan, Januari 2017
Komisi Pembimbing :
Pembimbing 2, Pembimbing 1,
Dra. Nunuk Priyani, M.Sc Dr. Tt Jamilah, M.Sc
NTP. 196404281999032002 NTP. 196310121991032003
Disetujui Oleh
Departemen Biologi FMIPA USU Ketua,
KAPA PENGANPAR
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa, karena atas berkatNya telah memberikan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian yang berjudul “Potensi Bakteri Asam Laktat yang Diisolasi dari Nira Aren dalam Menghambat Pertumbuhan Bakteri Patogen Pada Pangan”dengan baik.
Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada dosen pembimbing Ibu Dr. It Jamilah dan Ibu Dra. Nunuk Priyani M. Sc yang telah membimbing penulis dengan sepenuh hati dimulai dari proposal hingga didapatkan hasil penelitian ini. Saya juga berterimakasih kepada dosen penguji saya Ibu Dr. Yurnaliza, M.Si dan Ibu Dr. Elimasni, M.Si yang telah memberikan bimbingan, arahan, waktu serta perhatian kepada penulis dalam menyelesaikan penelitian ini.
Hasil penelitian ini, penulis akui sangat jauh dari kata sempurna dan masih memiliki banyak kekurangan karena pengalaman yang dimiliki penulis sangat kurang. Oleh karena itu, penulis harapkan kepada para pembaca untuk memberikan masukan-masukan yang membangun untuk kesempurnaan penulisan hasil penelitian.
Medan, 06 Januari 2017 Penulis
POPENST BAKPERT ASAM LAKPAP YANG DTTSOLAST DART NTRA AREN DALAM MENGHAMBAP PERPUMBUHAN BAKPERT
PAPOGEN ASAL PANGAN
ABSPRAK
Nira diketahui mengandung gula dan komponen nutrisi lain yang baik bagi pertumbuhan mikroorganisme, salah satunya bakteri asam laktat. Tujuan dari penelitian ini adalah untuk mendapatkan isolat bakteri asam laktat potensial dari nira aren yang mampu menghambat pertumbuhan bakteri patogen asal pangan dan memenuhi syarat lain sebagai probiotik. Pada berbagai interval waktu fermentasi (0, 12, 24, 36 dan 48 jam) nira aren, didapatkan isolat bakteri asam
laktat yang tumbuh pada media de mann Rogosa agar (MRSA) + CaCO3 1%.
Masing-masing isolat diuji kemampuannya menghambat bakteri patogen asal
pangan (Salmonella typhi, Staphylococcus aureus dan Escherichia coli) pada
media Mueller Hinton Agar (MHA) dengan metode difusi cakram. Isolat yang
potensial diuji kemampuannya bertahan pada suasana saluran pencernaan seperti
pada pH lambung (2.0), pH usus (7.2), garam empedu (0.5%ox gall) dan mampu
membentuk biofilm pada permukaan padat stainless steel pada media MRSA.
Hasil isolasi bakteri asam laktat asal nira aren didapat 16 isolat yang tumbuh pada
media MRSA + CaCO31% dan didominasi oleh bakteri heterofermentatif. Hanya
ada 6 isolat (MF5, MF10, MF11, MF13, MF14 dan MF15) potensial yang mampu
menghambat pertumbuhan bakteri patogen asal pangan dan mampu memproduksi senyawa antimikroba selain asam-asam organik. Dari 6 isolat BAL potensial didapat 5 isolat yang mampu bertahan pada suasana saluran pencernaan dan mampu menempel pada permukaan padat stainless steel yaitu MF5, MF10, MF11,
MF14 dan MF15, sedangkan isolat MF13 tidak mampu bertahan pada suasana
garam empedu. Namun, ada dua isolat BAL paling potensial dari semua parameter uji yaitu MF11dan MF14.
POPENCY of LACPTC ACTD BACPERTA TSOLAPED of PALM JUTCE in TNHTBTPTNG PAPHOGENTC BACPERTA in FOOD
ABSPRACP
Nira contain sugar and other nutritional components that are good for the growth of microorganisms, one of which lactic acid bacteria. The purpose of this study was to obtain lactic acid bacteria isolates potential of palm juice that could inhibit the growth of pathogenic bacteria of food origin and included in the candidate probiotics. Fermentation at various time intervals (0, 12, 24, 36 and 48 hours) palm juice, obtained LAB isolates were grown on media de mann rogosa agar
(MRSA) + 1% CaCO3. Each of LAB isolates tested for their ability to inhibit
pathogenic bacteria origin of food (Salmonella typhi, Staphylococcus aureus and
Escherichia coli) on media Mueller Hinton Agar (MHA) with disc diffusion
method. Isolates potential was inhibited pathogenic bacteria origin of food tested for its ability to survive in the atmosphere of the gastrointestinal tract such as gastric pH (2.0), intestinal pH (7.2), bile salts (0.5% ox gall) and capable of forming a biofilm on the surface of solid stainless steel on media MRSA ,origin isolated palm juice obtained 16 isolates of Lactic acid bacteria are grown on
media MRSA CaCO3+ 1% and is dominated by heterofermentatif bacteria. There
were only 6 isolates (MF5, MF10, MF11, MF13, MF14 and MF15) capable
potentially inhibited the growth of pathogenic bacteria of food origin and isolates were also able to produce antimicrobial compounds other than organic acids. Only 5 out of 6 isolates that were able to survive in the atmosphere of the gastrointestinal tract and is able to form a biofilm on the surface of solid stainless
steel namely MF5, MF10, MF11, MF14and MF15, while isolates MF13are not able
to survive in an atmosphere of bile salts that are removed from the isolates candidates probiotics From all of isolates, there were two the most potentially
isolates as a probiotic candidate namely MF14and MF11.
DAFPAR TST
2.1 Fermentasi Pada Nira 5
2.2 Ciri Umum Bakteri Asam Laktat 6
2.3 Bakteri Asam Laktat Sebagai Probiotik 7
2.4 Senyawa Antimikroa Bakteri Asam Laktat 8
2.5 Bakteri Patogen Asal Pangan 11
2.6 Mekanisme Kerja Antimikroba BAL 11
BAB 3. MEPODE PENELTPTAN
3.1 Waktu dan Tempat Penelitian 13
3.2 Isolasi Bakteri Asam Laktat 13
3.3 Uji Aktivitas BAL Dalam Menghambat Pertumbuhan Bakteri
Patogen Makanan 14
3.4 Uji Viabilitas Sebagai Kandidat Probiotik
3.4.1 Uji Ketahanan Isolat BAL Terpilih Terhadap pH 15
3.4.2 Uji Ketahanan Isolat BAL Terpilih Terhadap Garam Empedu 15
3.5 Uji Aktivitas Penghambatan Supernatan BAL Terpilih dengan
pH Netral Terhadap Patogen 16
3.6 Uji Penempelan Isolat BAL Terpilih pada Permukaan Padat
4.2 Karakterisasi Bakteri Asam Laktat 18
4.3 Jumlah BAL Pada Tiap Interval Waktu Fermentasi 22
4.4 Aktivitas Antimikroba BAL Terhadap Bakteri Patogen Pangan
4.4.1 Aktivitas Antimikroba Isolat BAL 23
4.4.2 Aktivitas Antimikroba Supernatan BAL pH Netral 24
4.5 Viabilitas Bakteri Sebagai Kandidat Probiotik
4.4.1 Ketahanan BAL pada pH Lambung (2.0) dan pH Usus (7.2) 26
4.4.2 Ketahanan BAL pada Garam Empedu 0.5% 28
4.5.3 Hasil Uji Penempelan BAL pada Permukaan PadatStainless steel30
4.6 Hasil Seleksi Isolat BAL Potensial 31
BAB 5. Kesimpulan dan Saran
5.1 Kesimpulan 33
5.2 Saran 33
DAFPAR PUSPAKA 34
DAFPAR PABEL
Nomor
Pabel Judul Halaman
1 Karakteristik Morfologi BAL Asal Nira Aren 18
2 Hasil Uji Biokimia BAL Asal Nira Aren 19
3 Jumlah BAL Pada Tiap Interval Waktu Fermentasi 21
4 Diameter Zona Hambat BAL Terhadap Bakteri Patogen
Pada Pangan 23
5 Luas Zona Hambat Supernatan BAL pH Netral dengan
Supernatan BAL Fermentasi 24 jam Dalam Menghambat Bakteri Patogen Asal Pangan
29
6 Persentase Ketahanan Hidup BAL Pada pH Lambung dan
Usus Manusia 30
7 Persentase Ketahanan Hidup BAL Pada Garam Empedu 31
8 Jumlah Sel Bakteri Asam Laktat (log CFU/ml) tiap cm2
stainless steel 32
DAFPAR GAMBAR
Nomor
Gambar Judul Halaman
DAFPAR LAMPTRAN
Nomor
Lampiran Judul Halaman
1 Alur Kerja Penelitian 39