IMUNISASI PASlF TERHADAP KOKSlDlOSlS SEKUM
1
(Eimeria
tenella)
PADA AYAM DENGAN
ANTIBODI MONOKLONAL
Oleh
Sri Utami Handajani
90540lSVT
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
SUMMARY
SRI UTAMI HANDAJANI. Passive immunization against chicken's caecal
coccidiosis (Eimeria tenella) with monoclonal antibody ( under supervision of
advisory committee of GATUT ASHADI as chairman, AISJAH GIRINDRA,
FACHRIYAN H. PASARIBU, SIMON HE and A.A. MATTJIK, as members).
Coccidiosis is one of the diseases causing problem and loss to c h c k e n farms, including mortalities, decrease body weight, decrease weight gain, delay and
low egg production, increase feed conversion, increase medical and labour costs.
Coccidiostat use is the main effort in preventing coccidiosis i n Indonesia,
however, continuous use of those drugs may cause strain resistant. Cage
modification seems unpromising, because effective disinfectants against this
parasite are not available yet. Immunization, however, can be promising as a
control device against this disease.
Until recently, the stage of this parasite which is immunogenic is still
unknown, however, merozoite is considered as the antigenic source for dead vaccine against coccidia.
An experiment on the production of monoclonal antibody against caecal
coccidiosis , both in uiho and in viuo , has been carried out. The experiment was
started using a single cell isolation of local E. tenella isolates collected from
commercial farms around Bogor. From this experiment a pure local E. tenella
days and spomlation time 24 hours. Second generation merozoites were
measuring 11.5 pm, obtained from infection of two weeks old chicks with
spomlated oocysts
.
Monoclonal antibody was obtained from Balb-C mice immunized three
times intraperitoneally with two weeks interval, followed by an intravenous
immunization one week later. Fusion between spleen and myeloma (SP2)
cells was done using thymocyte cells as feeder cells. From 23 hybridoma, only
two were found to be secreting antibody which could be detected using ELISA
technique. They are monoclonaI antibodies 2 B l ( M A b 2B1) and 3E4(MAb 3E4).
In vitro study using those two antibodies revealed that sporozoite
penetration was inhibited as shown by the decrease of total sporozoite numbers
found in chicken kidney culture cells. MAb 2B1 was chosen for immunizing in
vivo, because it inhibited sporozoite penetration better than MAb 3E4 did.
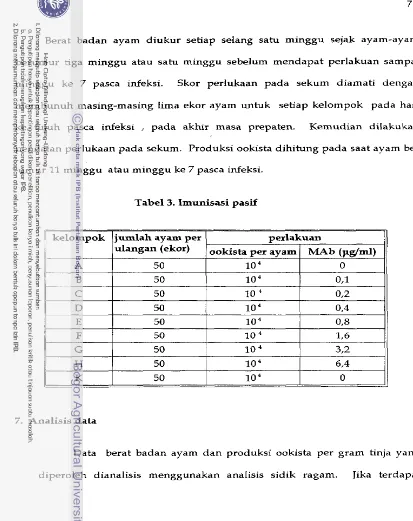
Passive immunization was performed using four hundred and f i f t y 4 weeks
old chickens, in each repetition, which were divided into nine groupsof 50 birds
each. The first group was infected with
lo4
sporulated E. tenella oocysts per bird,without monoclonal antibody (group A). Seven groups were infected with 10' sporulated oocyts per bird plus monoclonal antibody of different concentrations
(group B, C, D, E, F, G and H). The last group served as negative control (group
K) without infection and monoclonal antibody. Immunization efficacies were
totaling 70%, 4 6 % , 42% and 22% in groups A, B, C and D respectively
.
Ingroups E,F,G, H and K, mortalities did not occur. These data showed that
chicken mortalities decreased while monoclonal antibody concentrations
increased. Groups A, B and C showed less body weight gains compared to
group K. No significant differences in body weight gains in groups D, E, F, G
and H compared to group K. Lesion scores decreased while monoclonal
antibody concentration increased. Oocysts were found in the feces of all groups,
however, they were more abundant in group A, which served as positive
control
.
Therefore the immunity induced is relative.It is concluded that monoclonal antibody against merozoites is protective,
and merozoite is involved in protective immunity. It further proves that
antibody could reach the intestinal mucosae and affected sporozoite
development, w h c h in uitro study reveals a decrease in total number of
sporozoites succeded in penetrating tissue culture. Since merozoite was the primary causative agent of pathological changes, therefore the use of antibody
not only blocks the parasite transmission, but also lessens the merozoite
pathogenic effects.
Results from this study come to a conclusion that monoclonal antibody
against merozoites of E. tenella can be used for passive immunization of chicken
RINGKASAN
SRI UTAMI HANDAJANI. h u n i s a s i Pasif terhadap Koksidiosis Sekum (Eimeria
tenella) pada Ayam dengan Antibodi MonokIonal (Di bawah bimbingan GATUT
ASHADI, sebagai ketua, AISJAH GIRINDRA, FACHRIYAN H. PASARIBU, SIMON HE dan A.A. MATTJIK, sebagai anggota).
Koksidiosis merupakan penyakit yang mendatangkan banyak masalah d a n kerugian pada peternakan ayam, yang meliputi kematian, morbiditas,
penurunan berat badan, penurunan pertambahan berat badan, terlambatnya
masa bertelur disertai penurunan jumlah telur yang diproduksi, penurunan efisiensi pakan, dan peningkatan biaya pengobatan serta upah tenaga ke rja.
Pemakaian anti coccidia merupakan usaha pencegahan utama yang
dilakukan d i Indonesia, akan tetapi penggunaan obat-obatan tersebut secara terus menerus dapat menimbulkan galur coccidia yang resisten terhadap
obat-obat ini. Modifikasi kandang tampaknya juga tidak dapat diharapkan,
mengingat belum adanya desinfektan yang benar-benar efektif terhadap parasit ini. Tampaknya imunisasi merupakan satu alternatif yang memberi harapan
untuk pengendalian penyakit ini.
Hingga saat ini , belum ada kesepakatan mengenai stadium yang bersifat
imunogenik, akan tetapi tampaknya merozoit merupakan sumber antigen yang
Penelitian untuk memproduksi antibodi monoklonal terhadap koksidiosis
sekum dan pengujiannya secara in vitro d a n in vivo telah dikerjakan. Penelitian
dimulai dengan melakukan isolasi sel tunggal terhadap ookista isolat lokal, hasil pengumpulan tinja ayam dari peternakan-peternakan sekitar Bogor, sehingga
diperoleh Eimeria tenella murni, dengan ukuran ookista rata-rata 16,6 x 24,9-,
dengan masa prepaten 7 hari dan waktu sporulasi 24 jam. Merozoit generasi ke
d u a berukuran rata-rata 11,5 pm yang diperoleh dari hasil infeksi pada
ayarn-ayam berumur 2 minggu dengan ookista bersporulasi.
Pembuatan antibodi monoklonal dimulai dengan mengimunisasi mencit BaIb-C sebanyak tiga kali secara intraperitoneal, dengan selang waktu 2 minggu,
diakhiri satu kaIi imunisasi secara intravena satu minggu kemudian. Fusi
dilakukan dengan menggabungkan sel limpa dari mencit yang sudah
diimunisasi, dengan sel mieloma (SP Z), dengan bantuan sel thyrnocyte sebagai
"feeder cells". Dari 23 hibridoma yang terbentuk dilakukan uji kandungan
antibodi, menggunakan metode Enzyme Link Immunosorbent Assay (ELEA).
Ternyata hanya dua hibridoma yang memproduksi antibodi yaitu antibodi
monoklonal2Bl(MAb 2B1) dan 3E4 (MAb 3E4).
Studi secara in uitro dengan menggunakan MAb 281 d a n MAb 3E4, terlihat
adanya penghambatan invasi sporozoit, yang ditunjukkan oleh penurunan
jumlah sporozoit dalam biakan jaringan berasal dari ginjal ayam. MAb 281
dipilih sebagai bahan imunisasi pasif pada studi in uiuo, karena lebih baik dalam
Pada imunisasi pasif, digunakan ayam-ayam berumur 4 minggu sebanyak 450 ekor untuk setiap ulangan, yang dibagi menjadi 9 k e l o m ~ o k yang
masing-masing terdiri dari 50 ekor ayam
.
Kelompok pertama diinfeksi denganlo4
ookista bersporulasi per ekor ayam tanpa diberikan MAb 2B1 (kelompok A),sebagai kelompok kontrol positif. Tujuh kelompok yang lain setiap ayam
diinfeksi dengan
lo4
ookista bersporulasi d a n diberikan MAb 2B1 dengankonsentrasi yang berbeda-beda (kelorn~ok B, C, D, E, F, G, H). Kelompok
terakhir ( kelompok K) merupakan kelompok kontrol negatif, tidak diinfeksi dan
tidak diberikan MAb 281. Percobaan dilakukan dalam 3 ulangan. Efektifitas
imunisasi diukur berdasarkan mortalitas, perubahan berat badan, skor perlukaan pada sekum ayam d a n produksi ookista. Kematian ayam te rjadi pada hari ke 5, ke 6 d a n ke 7 pasca infeksi. Pada kelompok A kematian mencapai 70%, pada
kelompok B 46%, kelompok C 42% dan kelornpok D 22%. Pada kelompok E, F,
G, H d a n K tidak terdapat kematian. Dengan demikian mortalitas yang terjadi
mengalami penurunan dengan bertambahnya konsentrasi MAb yang diberikan.
Ayam-ayam pada kelompok A, B dan C menunjukkan berat badan yang lebih
kecil dibanding kelompok K, sedangkan pada kelornpok E, F, G d a n H tidak
berbeda nyata dengan kelompok kontrol. Skor perlukaan pada sekum
mengalami penurunan dengan peningkatan konsentrasi MAb. Pada
perhitungan produksi ookista, rnasih ditemukan adanya ookista daIam tinja
merupakan kontrol positip. Fenomena ini menyatakan bahwa kekebalan yang
timbul bersifat relatif.
Dalam penelitian ini terbukti bahwa penggunaan antibodi monoklonal
terhadap merozoit, menimbulkan proteksi pada ayam d a n ha1 ini menunjukkan bahwa merozoit berperan serta dalam proses kekebalan yang protektif.
Fenomena proteksi tersebut juga menunjukkan bahwa antibodi terhadap
merozoit dapat mencapai mukosa usus dan berpengaruh terhadap
perkembangan sporozoit. Studi in uitro menunjukkan penurunan total jumlah
sporozoit yang berhasil melakukan penetrasi ke dalam biakan jaringan. Lebih
jauh lagi merozoit merupakan penyebab perubahan patologi yang utama, sehingga penggunaan antibodi terhadap stadium ini bukan hanya menghambat transmisi parasit, tetapi juga dapat mengurangi efek patogeniknya.
Dari seluruh hasil penelitian yang diperoleh dapat disimpulkan, bahwa
antibodi monoklonal terhadap merozoit Eimeria tenella dapat digunakan sebagai
IMUNISASI PASIF TERHADAP KOKSIDIOSIS SEKUM
(Eimeria
tenella)
PADA AYAM DENGAN
ANTIBODI MONOKLONAL
Oleh
S r i Utami
Handajani
90540/SVT
Disertasi sebagai salah satu syarat untuk mernperoleh gelar
Doktor
pada
Program Pascasa jana, Institut Pertanian Bogor
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul : Imunisasi Pasif Terhadap Koksidiosis Sekum (Einreria tene1la)Pada Ayam Dengan Antibodi Monoklonal
Nama Mahasiswa : Sri Utami Handajani
Nomor Pokok : 90540
Program Studi : Sains Veteriner
Menyetujui
1. Komisi Pembimbing
(Prof Dr. H. Gatut Ashadi)
Ketua /
(Prof. Dr. Hj. Aisjah Girindra)
- -
(Dr. drh. Fachriyan H. Pasarilru)
Anggota Anggota
(Dr. Simon He)
-. . (Dr. Ir. H. Ahmad Anshori Mattjik)
Anggota Anggota
Pelaksana Harian Program Studi Sains Veteriner Program Pascasal
3r. drh. I Wayan Teguh Wibawan,
2
8
APR
19%
Qirektur Program
oto, - -
R I W A Y A T HIDUP
Sri Utami Handajani, merupakan anak kedua dari ayah R.Moesworo dan ibu R.Sri Rahaju. Lahir d i Jakarta, 2 September 1960. Menyelesaikan pendidikan Sekolah Dasar pada tahun 1972 di SDL Don Bosco Semarang, Sekolah Lanjutan
Tingkat Pertama pada tahun 1975 di SMPN 35 Jakarta, dan Sekolah Lanjutan
Tingkat Atas pada tahun 1979 di SMAN 4 Jakarta.
Tahun 1983 memperoleh gelar Sarjana Kedokteran Hewan dari Fakultas
Kedokteran Hewan Institut Pertanian Bogor dan gelar Dokter Hewan dari
Fakultas yang sama pada tahun 1984. Memperoleh gelar Magister Sains pada
tahun 1989 dari Fakultas Pascasa rjana Institut Pertanian Bogor. Pada tahun 1990 tercatat sebagai mahasiswa program 53 pada Program Pascasajana h s t i t u t
Pertanian Bogor dan memperoleh kesempatan belajar di University of Osaka
Prefecture, Jepang selama 18 bulan, dalam rangka penyelesaian studi 53 tersebut.
Pada tahun 1986, mulai bekeja sebagai staf pengajar pada laboratorium Protozoologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Menikah dengan Ir. Tito Pranolo, MBA, MSc. pada tahun 1985. Dikaruniai
dua orang putra, Pujangga Pandunagara dan Ario Dewabrata, serta satu orang
UCAPAN TERIMAKASIH
Puji syukur penulis panjatkan kepada Allah SWT yang telah mengijinkan penulis menyelesaikan disertasi ini.
Pada kesempatan ini, penulis menyampaikan rasa terimakasih kepada Prof.
Dr. H. Gatut Ashadi
,
yang telah bersedia menjadi ketua komisi pembimbing.Tanpa bimbingan dan pengarahan beliau, niscaya disertasi ini tidak akan pernah terwujud.
Ucapan terimakasih juga disampaikan kepada Prof. Dr. Hj. Aisjah Girindra,
Dr. Fachriyan H. Pasaribu, Dr. Simon He dan Dr. Ir. H.A.A. Mattjik, yang telah
bersedia bertindak sebagai komisi pembimbing. Saran d a n bimbingan mereka sangat membantu penulis dalam penyelesaian disertasi ini.
Kepada Tim Pengelola Manajemen Program Doktor (TMPD), Departemen
Pendidikan d a n Kebudayaan, penulis ucapkan terimakasih atas bantuan biaya yang diberikan.
Kepada Prof Dr. A. Arakawa, Dr. E. Baba, Dr. K. Sasai dan Dr. T. Fukata,
penulis ucapkan terimakasih atas bimbingannya selama panulis menimba i l m u
di University of Osaka Prefecture, Jepang.
Ucapan terimakasih juga penulis sampaikan kepada Drh. Soetiyono
Partosoedjono, selaku koordinator proyek ke rjasama IPB dengan Katholieke
selaku Ketua laboratorium Patologi Veteriner yang telah mengijinkan penulis
menggunakan fasilitas laboratorium.
Pada kesempatan i~ secara khusus disampaikan terimakasih yang
sedalam-dalamnya kepada Drh. Sri Estuningsih yang telah banyak meluangkan waktu untuk membantu penulis menyelesaikan disertasi ini. Ucapan yang sama
penulis sampaikan kepada Prof. Dr. M.P Tampubolon, MSc., Dr. Hj. Umi
Cahyaningsih dan Drh. Hj. Tutuk Astyawati, MS. Tanpa pengertian, dorongan
dan bantuan mereka, kiranya disertasi ini akan sulit terselesaikan. Kepada Dr. Hasbullah dari BPMSOH, juga diucapkan terimakasih, masukan dari beliau dan bantuan literatur sangat membantu penulis dalam penyelesaian disertasi ini.
Kepada Drh. T. Fadrial Karmil, MS terima kasih atas bantuan penyelesaian
disertasi ini. Kepada Dr. Srihadi Agung Priyono, terimakasih atas bantuan
pemotretan.
Disertasi ini tidak akan pernah terselesaikan tanpa bantuan dan dukungan
dari pegawai-pegawai d i laboratorium Protozoologi FKH-IPB, kepada Bapak
Sariyo, Bapak Komaruddin, Bapak Taufik dan Ibu Nani, penulis ucapkan terimakasih. Juga kepada Bapak Kasnadi, Bapak Soleh dan lbu Melly, dari laboratorium Patologi FKH-IPB diucapkan terimakasih atas bantuannya.
Ucapan terimakasih penulis sampaikan pula untuk seluruh staf pengajar dan pegawai di Bagian Parasitologi dan Patologi Fakultas Kedokteran Hewan
IPB dan Program Studi Sains Veteriner Program Pascasarjana IPB yang telah
kepada Program Pascasa j a n a l P B beserta seluruh staf administrasinya, penulis
ucapkan terimakasih.
Akhirnya, ucapan terimakasih penulis sampaikan kepada seluruh keluarga penulis, ayah, ibu, ayah d a n ibu mertua, kakak, adik, ipar, yang teIah
memberikan bantuan d a n dorongan yang tak ternilai. Kepada suami clan
anak-anakku tercinta, terimakasih atas pengertian, pengorbanan dan bantuan
yang sangat tak ternilai. Semoga Allah SWT senantiasa melimpahkan rahmat
Halaman
DAFTAR IS1 xiii
DAFTAR TABEL xiv
DAFTAR GAMBAR xv
DAFTAR LAMPIRAN xvi
I
.
PENDAHULUAN...
11
.
Latar Belakang Penelitian...
1 2.
Permasalahan...
2 3.
Tujuan dan Manfaat Penelitian...
54
.
Hipotesis...
I1.
TINJAUAN PUSTAKA...
1
.
Koksidiosis pada Ayam...
1.1. Koksidiosis sekum...
...
1.2. Koksidiosis usus halus...
2.
Genus Eirneria2.1. Morfologi
...
2.2. Daur Hidup
...
3
.
Patogenesis...
4.
Perubahan Patofisiologi...
5.
Patologi anatomi...
Halaman
7
.
Diagnosis
...
8
.Pengendalian
...
...
8.1. Kernoterapi
8.2. Imunisasi
...
8.2.1. Imunisasi dengan parasit mati
...
8.2.2. Imunisasi dengan parasit hidup
...
9
.
Antibodi monoklonal
...
I11
.
BAHAN
DAN METODE
...
1
.
Tempat dan waktu Penelitian
...
2
.
Penyediaan Parasit
...
2.1. Pengambilan sampel
...
2.2.
Koleksi ookista
...
2.3. Sporulasi
...
2.4. Isolasi sel tunggal
...
2.5. Penyediaan bahan infektif
...
2.6.
Perhitungan ookista
...
3
.
Peny ediaan merozoit
...
3.1. Koleksi merozoit
...
Halaman
4.2.1.
Preparasi sel mieloma
...
56
4.2.2. Preparasi sel thymus
...
57
4.2.3. Preparasi sel limpa
...
59
4.2.4. Fusi antara sel mieloma dan sel limpa
...
60
4.3.
Klon
...
62
4.4.
ELISA
...
...
4.5.
Penentuan kelas antibodi
...
4.6. Penentuan sub kelas antibodi
. .
5
.
Studi
tn
vztro
...
5.1.
Pembuatan biakan jaringan
...
5.2.
Penyediaan sporozoit
...
5.3. Inokulasi sporozoit kedalam biakan jaringan
...
...
5.4. Penghitungan sporozoit dalam biakan jaringan
6
.
Imunisasi pasif pada ayam
...
. .
7
.
A n a l ~ s ~ s
data
...
IV
.
HASIL PENELITIAN
...
1
Parasit
...
.-...
2
.
Merozoit
...
77
3.3. Sel thymosit
...
3.4.
Sel limpa (splenocyt)
...
3.5.
Fusi antara sel mielomn dnn sel limpa (sel B)
...
...
4
.
Penentuan kelas d a n s u b kelas antibodi monoklonal
. .
6
.I m u n l s a s ~
pasif pada ayam
...
...
6.1. Mortalitas ayam percobaan
6.2. Berat badan ayam
...
...
6.3. Skor Perlukaan pada sekuni ayani
6.4. Produksi ookistn
......
...
V
.
PEMBAHASAN
...
VI
.
KESIMPULAN D A N SARAN
...
DAFTAR PUSTAKA
...
LA
MPIRAN
DAFTAR TABEL
Nomor
Teks
Halaman
I.
Faktor yang berperan menentukan patogenitas
...
23
2.
Perbedaan karakteristik akibat infeksi jenis
Eimeria
penting
pada ayam
...
29
13.
Imunisasi pasif
...
74
4.
Penentuan skor perlukaan
...
75
5.
Jumlah sporozoit per 10 mm2 hamparan biakan jaringan dengan
antibodi monoklonal
...
79
6.
Rataan dari tiga ulangan mortalitas ayam pada imunisasi
pasif
... ... ... ...
.
86
7.
Rataan berat badan ayam pada imunisasi pasif (dalam gram)..
88
8.
Rataan Skor perlukaan pada sekum ayam
...
89
DAJTAR GAMBAR
Nomor
Teks
1
.
Morfologi ookista E.
tenella yang telah bersporulasi...
2
.
Morfologi ultrastruktur merozoit generasi 11 E.
tenella...
3 . Siklus hidup E
.
tenella...
4.
Patogenesis koksidiosis...
5
.
Proses pembuatan antibodi monoklonal...
6
.
Ookista E.
fenella hasil penelitian...
7 . Merozoit generasi kedua dari E
.
fenella hasil penelitian...
8 . Sel mieloma...
9.
Sel thymosit berasaI dari mencit...
1 0
.
Sel splenocyt dari Iimpa mencit yang sudah diimunisasi...
...
11
.
Hibridoma...
12.
Sporozoit E.
tenella13
.
Invasi sporozoit ke dalam biakan jaringan...
14
.
Jumlah sporozoit per10 mm' hamparan sel biakanjaringan menurut konsentrasi MAb 2B1
...
15
.
Jumlah sporozoit per 1 0 mm2 hamparan sel biakanjaringan menurut konsentrasi MAb 3E4
...
6
.
Rataan mortalitas ayam pada imunisasi pasif...
17
.
Rataan berat badan ayam menurut umur (kelompokA. B. C. D d a n K)
...
Halaman 13 14 17 22 46 76 78 78 79 80 8 1 82 83
18
.
Rataan berat badan ayam menurut umur (kelompokNomor Teks
19. Rataan skor perlukaan pada sekum a y a m
...
20. Rataan produksi ookista pada imunisasi pasif...
Halaman
90
DAFTAR LAMPIRAN
Nomor
1
.
2
.
3
.
4 . 5
.
[image:176.502.43.440.25.545.2]Teks
Tabel Perbandingan Tukey untuk data berat badan ayam ...
Tabel Analisis Ragam data berat badan ayam
...
TabeI Analisis Profil terhadap berat badan
...
Tabel Analisis Ragam data produksi ookista
...
Tabel Beda nyata terkecil dengan uji Dunnet sebagai nilai kritik
...
Tabel Hasil uji Elisa untuk mendeteksi antibodi
...
Gambar Hibridoma hasil fusi antara sel mieloma dengan sel limpa (Mikroplat 1)...
Garnbar Hibridoma hasil fusi antara sel mieloma dengan sel limpa (Mikroplat 2)...
Gambar Hibridoma hasil fusi antara sel mieloma dengan sel limpa (Mikroplat 3)
...
Gambar Hibridoma hasil fusi antara sel mieloma dengan sel limpa (Mikroplat 4)
...
Gambar Hibridoma hasil fusi antara sel mielorna dengan sel limpa (Mikroplat 5)...
Halaman 117
1-17
118
I. PENDAHULUAN
1. Latar Belakang Penelitian
Koksidiosis adalah suatu penyakit yang disebabkan oleh parasit protozoa, yang digolongkan ke dalam Filum Apicomplexa, KeIas Sporozoasida, Sub Kelas Coccidiasina, Ordo Coccidiorida, Sub Ordo Eimeriorina, Familia Eimeriidae dan
Genus Eimeria (Levine, 1980 dalam Levine, 1985)
.
Penyakit ini menimbulkanbanyak masalah dan kerugian pada peternakan ayam, berupa kematian,
morbiditas, penurunan berat badan, berkurangnya pertambahan berat badan,
terlambatnya masa bertelur disertai dengan berkurangnya jumlah telur yang diproduksi, penurunan efisiensi pakan, peningkatan biaya pengobatan serta
upah tenaga kerja (Ashadi, 1979). Penularan t e j a d i karena ookistanya dapat terbawa bersama aliran angin, debu, air, serta pakan dan air minum, alat-alat peternakan, sehingga peternakan ayam selalu terancam bahaya koksidiosis.
Pada saat ini diketahui paling sedikit 9 jenis Eimeria pada ayam yaitu
Eirneria tenella, Eimeria necatrix, Eimeria maxima, Eirneria acwvulina, Eimeria mitts,
Eimeria praecox, Eimeria brunetti, E i m m ' a hagani dan Eimeria mivati. E. fenella
merupakan jenis yang paling patogen, disusul E. necatrix, E. brunetti dan E.
maxima (Conway dan M c Kenzie, 1991).
Mortalitas yang ditimbulkan oleh jenis yang paling patogen biasanya
tidak tinggi (kurang lebih 20%), akan tetapi kadang-kadang mencapai 90%,
morbiditasnya yang tinggi, sehingga dibutuhkan sejumlah obat-obatan dan tenaga k e j a yang lebih banyak apabila penyakit ini menyerang suatu peternakan. Perhitungan kasar kerugian pada peternakan ayam di dunia akibat penyakit ini diperkirakan separuhnya untuk biaya pengobatan setiap tahunnya
(Long, 1990). Menurut Smith I1 dan Mc Gruder (1997), biaya pengobatan
penyakit koksidiosis di seluruh dunia mencapai 350 juta dolar Amerika per
tahun. Sedangkan kerugian akibat koksidiosis pada ayam termasuk blaya
pengobatan di seluruh dunia mencapai satu milyar dolar Amerika pertahun (Weber, 1997).
Dalam upaya penanggulangan penyakit koksidiosis, pencegahan utama yang dilakukan di Indonesia adalah pemakaian anti coccidia yang diberikan melalui air minum dan pakan. Namun pemakaian obat-obatan tersebut secara terus menerus dapat mengakibatkan timbulnya galur yang resisten, sehingga
pemakaiannya akan menjadi tidak efektif lagi d a n mengakibatkan keterbatasan dalam pemilihan anti coccidia (Long dan Rose, 1982; Braunius, 1996; Chapman,
1996; Edgar, 1993; Mc Dougald dan Reid, 1997; Paeffgen, Lohner dan Raether,
1995). Masalah lain yaitu adanya residu dalam daging, sehingga produk
peternakan yang bersangkutan tidak layak untuk dikonsumsi oleh manusia
(Ikeda d a n Niinuma, 1992). Kemudian muncul berbagai alternatif
baterai, yang efektifitasnya kurang dapat diharapkan, mengingat belum ada disinfektan yang benar-benar efektif terhadap coccidia (Long d a n Rose, 1982;
Janssen Pharmaceutica, 1992; Mc Dougald d a n Reid, 1997; Weber, 1997).
Imunisasi tampaknya merupakan alternatif terbaik untuk pengendalian penyakit ini (Long, 1978), meskipun masing-masing jenis mempunyai kekebalan spesifik. Kekebalan terhadap satu jenis tidak berlaku bagi jenis yang lain (Danforth dan
Augustine, 1985).
Penggunaan vaksin diharapkan dapat mengatasi keadaan ini d a n tetap menjadi bahan pemikiran. Di Indonesia, beberapa peternakan besar sudah menggunakan vaksin aktif terhadap koksidiosis yang diimpor, tetapi hasilnya
kurang memuaskan karena galur yang digunakan berbeda dengan galur lokal
(Ashadi, 1980). Vaksin impor ini mengandung 8 jenis Eirneria yang hidup
termasuk pula jenis yang patogen, sehingga apabila terjadi wabah, maka
koksidiosis yang disebabkan oleh E. tenella dan E. necatrix akan muncul. Selain
itu penggunaan vaksin hidup hanya efektif untuk pengendalian koksidiosis
pada ayam pembibit d a n pete1ur ( Braunius, 1996; Conway, 1996; Danforth, 1997;
Mc Dougald d a n Reid, 1997; Ruff, 1997; Watkins, 1997; Williams, 1997). Pada
dasarnya kebutuhan ookista untuk pembuatan vaksin melibatkan kepentingan ekonomis. Dalam ha1 ini kebutuhan akan ookista untuk diradiasi yang harus
dalam jumlah besar dipandang tidak ekonomis (Long d a n Rose, 1982). Dengan
demikian apabila dengan radiasi parasit benar-benar terlemahkan, maka metode
ini boleh menjadi pertimbangan. Dalam usaha pembuatan vaksin terhadap
coccidia juga telah dilakukan pembandingan antara penggunaan biakan jaringan d a n ayam, dilihat dari segi ekonomis (Ashadi d a n Handajani, 1995).
Sampai saat ini belum ada kesepakatan mengenai stadium mana dalam
siklus hidup E. fenella yang berperan dalam menginduksi kekebalan.
Tampaknya stadium aseksual merupakan sumber antigen yang dapat
menginduksi reaksi kekebalan yang protektif (Jeffers d a n Long, 1985; Wisher,
1986). Dengan mengetahui sumber antigen yang imunogenik
,
diharapkandapat dikembangkan pembuatan bahan imunisasi terhadap coccidia, yang dapat bekerja pada beberapa stadium secara bersamaan, mengingat stadium-stadium
tersebut memiliki susunan antigen yang berbeda. Seperti menurut Wisher
(1986), bahwa susunan protein antigen sporozoit E. feneln terdiri dari protein
dengan berat molekul 47, 26, 21 dan 18 kilodalton. Sedangkan menurut
McDonald, Wisher, Rose dan Jeffers (1988), galur WIS-F-96 memiliki susunan
71, 54, 25, 24, 22 dan 20 kilodalton dan galur WIS memiliki susunan 71 dan 20
kilodalton. Murray, Bhogal, Crane d a n McDonald (1986), menyatakan bahwa
susunan protein antigen sporozoit galur Merck terdiri dari protein dengan berat
molekul 235, 105, 94, 82, 71, 68, 45 dan 26 kilodalton. Demikian pula stadium
aseksual tainnya memiliki susunan protein yang juga berbeda
.
Menurut Xie,protein antigen 79, 114, 138, 251 kilodalton. Sedangkan menurut Hasbullah, Nakamura, Kawaguchi, Nakai dan Ogimoto (1991), merozoit galur NIAH memiliki susunan 95, 66, 29, 28, 25, 23 dan 14 kilodalton.
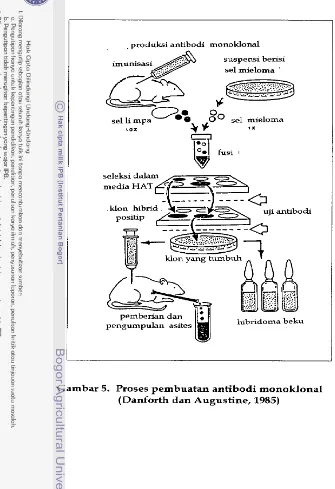
Selanjutnya teknologi antibodi monoklonal mulai dipelajari dalam
kaitannya dengan penyakit koksidiosis d a n kegunaannya sebagai bahan
imunisasi pasif terhadap penyakit ini pada ayam. Teknologi ini merupakan
penggabungan d u a macam sel, yaitu antara sel mieloma d a n sel limfosit B,
sehingga dapat dihasilkan antibodi dalam jumlah besar yang spesifik terhadap
antigen tertentu. Akan tetapi penelitian yang telah dilakukan lebih banyak
menggunakan stadium sporozoit sebagai antigen, mengingat stadium ini yang
melakukan penetrasi pada induk semang (Danforth d a n Augustine, 19851,
sehingga perIu dipelajari pembuatan antibodi monoklonal terhadap parasit
penyebab koksidiosis pada ayam yang berasal dari stadium lain selain stadium
sporozoit. Merozoit dalam ha1 ini merupakan stadium yang paling bersifat
patogenik, yang menyebabkan munculnya gejala klinis
3. Tujuan dan Manfaat Penelitian
Tujuan dari penelitian ini adalah : (1) Mempelajari kemungkinan
4. Hipotesis
Antibodi terhadap merozoit E. fenella dapat diproduksi dalam biakan sel tunggal (monoklonal) dan dapat digunakan sebagai bahan pengendalian terhadap koksidiosis sekum pada ayam secara pasif yang disebabkan oleh
11. TINJAUAN PUSTAKA
1. Koksidiosis p a d a ayam
Coccidia merupakan parasit intraseluler dengan beberapa perkecualian
merupakan parasit pada epitel usus. Parasit ini mempunyai stadium penular
yang memiliki ketahanan tinggi yaitu ookista, dan biasanya tidak membunuh induk semang (Long, 1978). Kegagalan memasuki tubuh induk semang vang
sesuai merupakan satu-satunya pembatas bagi penyebaran Eimeria (Macpherson,
1978).
Mungkin semua coccidia mempunyai potensi untuk dapat menyebabkan kerusakan epitel organ induk semangnya. Berbagai akibat oleh infeksi coccidia
tergantung pada dosis ookista bersporulasi yang tertelan d a n kecepatan
bereproduksi di dalam induk semang (Long, 1990). Meskipun 3 (tiga) genus,
Eimeria, Isospura d a n Cryptosporidia, ikut berperanan dalam menimbulkan penyakit pada hewan, tetapi tampaknya koksidiosis pada ayam berhubungan
dengan genus Eimeria (Urquhart, Armour, Duncan, Dunn d a n Jennings, 1987).
Jumlah ookista yang dibutuhkan untuk menimbulkan efek patologik
beragam untuk masing-masing jenis. Umur d a n kondisi dari induk semang juga berpengaruh, serta pada keadaan induk semang pernah terinfeksi atau belum
(Long, 1978). Menurut Gregory (1990), koksidiosis umumnya t e j a d i hanya
Daya tahan tubuh berkaitan dengan umur, status kekebalan, nufxisi d a n stres.
Masing-masing jenis yang berhasil diisolasi mempunyai karakter yang spesifik (Long, 1978).
Secara klinis koksidiosis pada ayam disebabkan oleh E. tenella, E. netmtrix,
E . bruneffi, E . maxima a f a u E . acervulina, berdasarkan diagnostik yang diambil
dari lokasi lesio (Joyner, 1978). Menurut Urquhart e f al. (1987), diagnosis yang paling baik adalah melalui pemeriksaan pasca mati, karena kesalahan dapat
terjadi bila dilakukan dengan melalui pemeriksaan keberadaan ookista saja.
Kesalahan disebabkan 1) efek patogenik muncul sebelum produksi ookista dan
2) tergantung dari jenisnya, jumlah ookista pada tinja tidak berkorelasi dengan
derajat perubahan patologi pada usus. Pemeriksaan pasca mati dapat
merupakan petunjuk yang baik yang kemudian dapat dikonfirmasikan dengan
pemeriksaan ookista pada tinja. Misalnya E. necahix merupakan jenis yang
"miskin" dalam memproduksi ookista, tetapi dibutuhkan hanya sedikit ookista
untuk d a p a t menimbulkan koksidiosis, sednngkan E. acervulina memproduksi
ookista dalam jumlah besar, tetapi untuk menimbulkan gejala klinis dibutuhkan
pula jumlah ookista yang besar (Long, 1978).
Tanda klinis dari koksidiosis secara umum adalah diare dengan ataupun
tanpa kehilangan darah tergantung jenis yang menginfeksi (Gregory, 1990).
diharapkan dapat terlihat mengapa ha1 ini dapat te j a d i , meskipun lokasi usus
yang diinfeksi secara primer berbeda.
Pada ayam, koksidiosis dapat dibedakan atas koksidiosis sekum dan
koksidiosis usus halus (Urquhart e t al., 1987).
1.1. Koksidiosis sekum
E . tenella merupakan jenis yang berperanan terhadap koksidiosis sekurn,
meskipun stadium gametogoni dari E. necatrix dapat ditemukan dalam sekum
d a n juga beberapa stadium dari E. brunetti.
Koksidiosis yang disebabkan oleh E tenella umumnya menyerang ayam
berumur tiga sampai tujuh minggu. Skizon generasi ke satu berkembang pada
mukosa kelenjar. Skizon generasi ke dua berkembang d a n meninggalkan
mukosa, bermigrasi ke lamina propria d a n s u b mukosa. Tujuh puluh d u a jam
seteIah ookista tertelan, skizon ini matang dan ruptur, kemudian timbul
perdarahan, permukaan mukosa menebal d a n tanda klinis mulai muncul. Masa
prepaten adalah tujuh hari dan ookista bersporulasi d u a sampai tiga hari dalam
kondisi normal (Urquhart et a1 ., 1987). Sedangkan menurut Levine (1985), rnasa
prepaten adalah enam hari d a n waktu sporulasi 18 jam sampai 2 hari. Gejala
klinis muncul apabila ookista tertelan dalam jumlah besar d a n dalam waktu
penurunan laju pertambahan berat badan dengan keefisienan pakan yang buruk
(Urquhart et al., 1987). Tanda-tanda pertama muncul pada saat merozoit
generasi ke d u a membesar dan menimbulkan perdarahan pada sekum (Levine, 1985).
1.2. Koksidiosis usus halus
Pada usus halus terdapat beberapa jenis Eimeria. E. necatrix merupakan
jenis yang paling patogen. Meskipun demikian prevalensi koksidiosis akibat E.
necatrix mengalami penurunan sebagai akibat penggunaan obat anti coccidia
secara intensif, sehingga jenis lain d i usus halus menunjukkan angka prevalensi yang meningkat, termasuk E. brunetti. Yang lebih umum adalah E. a c m u l i n a , E.
maxima, d a n E . mitis serta kadang-kadang E. praecox yang tidak begitu patogen.
Mass prepaten bervariasi, dari empat sampai tujuh hari. Tanda klinis muncul
tiga hari setelah ookista terteIan. Umumnya ayam-ayam yang lebih tua
terinfeksi oleh jenis-jenis yang terdapat dalam usus halus, dengan gejala klinis mirip dengan koksidiosis sekum, dengan perkecualian bahwa hanya jenis
tertentu seperti E. necatrix dan E . brunetti yang menyebabkan kerusakan dan
penyebab keluarnya darah dalam tinja. Pada pemeriksaan pascamati, tempat
d a n lesio bervariasi tergantung jenisnya (Urquhart e f al., 1987). Gejala klinis
infeksi ringan, sampai pada hemoragi dan kematian, tergantung dari jenis
Eimeria, derajat infeksi d a n status kekebalan induk semang (Long, 1990).
2. Genus Eimeria
Karakteristik yang terutama dari genus ini adaIah 1) komposisi dari
ookista bersporulasi yang selalu mengandung empat sporokista, yang
masing-masing mengandung dua sporozoit di dalamnya, 2) ditandai dengan induk semang yang spesifik, 3) adanya spesifisitas dari reaksi induk semang, dimana kekebalan terhadap satu jenis tidak melindungi terhadap jenis lain dan
4) adanya lokasi spesifik dalam menginfeksi induk semang.
2.1. Morfologi
Ookista dapat diidentifikasi berdasarkan bentuk d a n ukuran. Umumnva
berbentuk bulat, oval atau elips. Berukuran antara 15
-
50 pm (Urquhart e t al.,1987). Dindingnya terdiri dari satu atau dua lapis, dan dapat dilapisi oleh suatu
selaput (Levine, 1985). Dapat mempunyai mikropil d a n topi mikropil (Levine,
1985; Urquhart et al., 1987). Ookista yang belum bersporulasi, berisi massa inti
dari protoplasma yang dilindungi oleh dinding yang resisten (Urquhart et al.,
1987). Dalam kondisi yang sesuai, seperti keberadaan Oksigen (0,), kelembaban
dan suhu, inti membelah menjadi empat sporoblas, dimana kadang-kadang sisa
menghasilkan sporokista, dimana d i dalamnya terbentuk sporozoit (Levine,
1985; Urquhart et al., 1987). Dalam genus ini dijumpai empat sporokista dengan
masing-masing berisi d u a sporozoit. Bentuk ini disebut juga sebagai ookista
yang bersporulasi, dan merupakan bentuk yang infektif (Urquhart ef al., 1987).
Struktur ookista dari E. tenella disajikan pada Gambar 1.
Sporokista dapat memiliki benda Stieda. Sporozoit umumnya berbentuk seperti pisang, berisi bulatan-bulatan kecil yang terang d a n bersifat seperti
protein (Levine, 1985).
Struktur merozoit harnpir sama dengan sporozoit, yang membedakannya
hanya adanya badan refraktil pada sporozoit, yang biasanya satu terdapat di anterior d a n satu d i posterior. Akan tetapi ada beberapa perkecualian dimana
badan refraktil juga dapat dijumpai pada merozoit misalnya pada biakan
jaringan (Scholtyseck et al., 1981 dalam Long, 1990). Merozoit mempunvai
permukaan yang halus dengan pembukaan mikrospora tunggal dan dilapisi
oleh satu selaput luar (selaput plasma). Di bawahnya terdapat selaput dalam
yang terdiri dari unit selaput yang melengkapi garis plasmalemma, kecuali pada
mikropor dan pada cincin polar anterior d a n posterior. Kadang-kadang terdapat satu atau d u a cincin pada polar anterior. Cincin polar anterior mengelilingi
conoid silindris berisi enam atau tujuh, bahkan kadang-kadang 18-20 sub unit
d u a atau lebih rhoptri muncul dengan muara melalui conoid dan mirrotlema.
Terdapat pula butir-butir polisakarida, mitokondria, vesikula lemak, badan golgi, sisterna dari retikulo endoplasma, ribosom dan nukleus (Long, 1990).
Merozoit ini, terutama dari coccidia, sudah banyak diisolasi dan
dipurifikasi oleh beberapa peneliti ( Witlock dan Danforth, 1982; Stobsh dan
Wang, 1975; Fernando, Al-Attar, dan Bowles, 7984; Xie, Gilbert, Fuller d a n Mc
Dougald, 1990). Struktur merozoit disajikan pada Gambar 2.
1. tutup mikropil; 2. mikropil; 3. granula kutub; 4. badan stieda; 5. geIembung
refraktil kecil d i dalam sporozoit; 6. gelembung refraktil besar di dalam
sporozoit; 7. sporokista; 8. bahan sisa ookista; 9. bahan sisa sporokista; 10. inti
sporozoit; 11. sporozoit; 12. lapisan dalam dinding ookista; 13. lapisan luar
dinding ookista
G a m b a r 1. Morfologi ookista E. tenella yang telah bersporulasi
dndn M u r , anterior
Stotish dan Wang (1975), menyatakan bahwa merozoit relatif tahan
terhadap enzim hialuronidase dan dapat diperoleh dalam jumlah besar dari
jaringan sekum yang terinfeksi atau selaput chorio alantoic dari telur berembrio dengan pemberian enzim.
2.2. Daur Hidup
Perkembangan hidup Eirneria terdiri dari sporogoni, skizogoni dan
gametogoni (Lillehoj dan Trout, 1993; Watkins, 1997). Sporogoni te rjadi di luar
tubuh induk semang dan menghasilkan stadium infektif, sementara skizogoni
yang merupakan stadium aseksual dan gametogoni yang merupakan stadium seksual, terjadi di dalam sel induk semang yang spesifik.
Sporogoni dimulai dengan tertelannya ookista bersporulasi, yang merupakan stadium infektif, oleh ayarn yang peka. Sporozoit akan terekskistasi
di dalam usus karena adanya rangsangan biokimia (Reid d a n Johnson, 1970),
seperti adanya garam-garam empedu, tripsin dan CO, (Long, 1990).
Gerakan dari gizzard juga membantu dalam memecahkan dinding
ookista. Sporozoit masuk ke dalam induk semang melalui penetrasi villi atau
permukaan sel epitel dari mukosa usus (Long, 1990). Dalam waktu 12 - 48 jam,
sporozoit berubah menjadi stadium tropozoit. Tropozoit mulai membesar d a n
inti membelah yang diikuti dengan diferensiasi sitoplasma melalui proses
Kenzie, 1991; Urquhart ef al., 1987; Levine, 1985; Long, 1990) d a n stadium paraslt
saat ini disebut skizon atau rneron. Skizon pecah ketika matang dalam waktu
tiga hari, d a n melepaskan rnerozoit untuk kemudian berkembang dan
rnenginvasi sel lain, sehingga te rjadi pengulangan proses perkembangan melalui
stadium tropozoit d a n skizon.
Gametogoni atau reproduksi seksual, mengikuti daur skizon yang terakhir. Pada tahap ini berlangsung transfer sifat toleransi terhadap obat-obatan dan
patogenitas (Watkins, 1997). Merozoit, hasil dari daur skizon ke dua kembali
melakukan penetrasi sel epitel induk semang. Beberapa atau semuanya masuk ke dalam daur skizon ke tiga, tergantung dari jenisnya, sebelum membentuk gametosit jantan (mikrogametosit) atau gametosit betina (makrogametosit).
Gametosit jantan menjadi matang dan pecah, melepaskan sejumlah besar
mikrogamet, melalui suatu proses pembelahan mirip pada skizogoni, sementara rnakrogametosit tidak membelah, tetapi masing-masing menjadi makrogamet. Masing-masing makrogamet mengandung inti, mitokondria d a n dua atau tiga
flagela (Chobotar dan Scholtysek, 1982). Mikrogamet meninggalkan sel dan
mengawini makrogamet ketika makrogamet masih di dalam sel induk semang. Bagaimana mikrogamet dapat mengenal makrogamet yang matang, sampai saat
ini belum diketahui. Kemungkinan makrogamet memproduksi sendiri atau
merangsang sel induk semang untuk memproduksi molekul-molekul reseptor di
mikrogamet, dinding yang menebal terbentuk d i sekeliling zigot. Stadium ini
merupakan ookista muda atau ookista yang belum matang (Conway dan M c
Kenzie, 1991). Skema daur hidup dari genus Eimeria disajikan pada Gambar 3.
A. Ookista bersporulasi termakan unggas; B. ekskistasi;
I.
sporozoit menginvasisel epitel usus; 2. sporozoit berkembang menjadi tropozoit selanjutnya
berkembang menjadi skizon generasi 1 yang berisi merozoit; 3. skizon pecah,
merozoit generasi 1 keluar; 4. merozoit generasi I menginvasi sel epitel vang
baru; 5. merozoit I berkembang menjadi skizon generasi 2; 6. skizon generasi IJ
berkembang menjadi merozoit generasi 11; 7.merozoit generasi I1 berkem bang
menjadi mikrogamet dan 8. makrogamet ; 9. mikrogamet aktif memasuki
makrogamet; 10. fertilisasi; 11. terbentuk zigot intraseiuler dengan dinding
permeabel berkembang menjadi ookista muda; 12. ookista muda keluar dari
[image:193.507.36.452.16.533.2]tubuh unggas melalui tinja, sporulasi di luar tubuh induk semang;
3. Patogenesis
Dalam mempelajari patogenesis dari koksidiosis terlibat dua faktor yang
mengalami kerusakan yaitu parasit itu sendiri d a n induk semang yang memberi
reaksi pertahanan tubuh.
Reaksi pertahanan induk semang yang hebat menyebabkan induk semang
lebih mengalami kerusakan dibanding parasitnya sendiri, dan keduanya menyebabkan perubahan struktural yang berlanjut pada perubahan fisiologis pada induk semang.
Perubahan ultrastruktur pada sel yang bukan terinfeksi secara primer, diduga bukan disebabkan Iangsung oleh parasit, tetapi oleh beberapa produk
hasil interaksi parasit d a n induk semang. Penemuan ini memberi dugaan bahwa infeksi coccidia menyebabkan penurunan absorpsi nutrien, dan Iebih lanjut
malabsorpsi disebabkan oleh karena hilangnya permukaan mukosa yang bersifat
absorptif (Allen dan Danforth, 1984). Berbagai efek fisik, fisiologis dan
metabolik berinteraksi memproduksi efek akhir dari infeksi coccidia (Ruff dan
Allen, 1990). Sebagai contoh, kematian akibat E. tenella mayoritas akibat adanya
empat macam stres fisiologi yaitu 1) hipotermia, 2) berkurangnya cadangan karbohidrat, 3) asidosis metabolis dan 4) disfungsi tubuli ginjal (Witlock dan
Danforth, 1982). Berbagai perubahan patoIogi selama koksidiosis tidak selalu
muncul d a n pada galur penyebab koksidiosis sekum yang memproduksi lesio
terinfeksi oleh galur patogen dan karena darah tidak terbuang bersama tinja
(Ruff d a n Allen, 1990).
Koksidiosis juga menyebabkan peningkatan keasaman d i dalam alat pencernaan pada tempat yang terinfeksi. Perubahan konsentrasi ion hidrogen
dalam alat pencernaan selama fase hemoragi adalah karena destruksi dari sel-sel
usus halus yang rnenghasilkan sekretin. Hormon ini terbentuk pada dinding usus haIus d a n rnenunjukkan jumlah cairan pankreas yang tersekresi (Sturkie,
1965 dalam Stephens, Borst d a n Barnett, 1974). Konsentrasi ion hidrogen dalam
alat pencernaan tergantung dari jumlah HCl yang disekresikan ke dalam
proventrikulus, d a n cairan pankreas bereaksi untuk menetralisasi asam ini.
Oleh karena itu apabila produksi sekretin berkurang, maka cairan pankreas yang disekresi juga berkurang, sehingga situasi dalam alat pencernaan menjadi
lebih asam. Adanya perubahan p H d a n mikroflora usus akan menggangu
absorbsi zat-zat nutrisi seperti lemak, pigmen karotinoid, xantofil, vitamin, mineral d a n asam amino (Van d e r Sluis, 1993; Mc Dougald d a n Reid, 1997).
Menurut Sturkie (1965) dalam Stephens et al. (1974), penurunan konsentrasi ion
hidrogen dalam alat pencernaan akibat infeksi E. necatrix adalah karena tidak
adanya makanan d i dalamnya, degradasi jaringan dalam usus atau ketiadaan efek bufer pada makanan.
Keadaan yang cukup menarik adalah, apabila d u a jenis coccidia
akan berkompetisi, dan apabila mereka bekeqa sama, efek yang ditimbulkan
tidak lebih dari efek yang terjadi apabila mereka berdiri sendiri-sendiri.
Sedangkan apabila d u a jenis coccidia menginfeksi di lokasi yang berbeda, kerjasama mereka akan dapat memberikan efek melebihi efek dua dosis dari infeksi tiap jenis.
Telah terungkap bahwa masing-masing jenis mempunyai karakteristik sendiri-sendiri dalam menimbulkan koksidiosis beserta lokasi yang diminatinya,
yang berpengaruh pada pejalanan penyakit. Usus halus merupakan lokasi
yang populer bagi coccidia. Tampaknya coccidia yang menginfeksi usus besar
lebih patogen dari pada yang menginfeksi usus halus. Keadaan ini dikarenakan laju pergantian sel lebih rendah, d a n karena apabiln usus besar mengalami
kerusakan tidak ada lagi bagian usus yang bersifat absorptif yang terletak lebih posterior lagi, dan juga karena d i dalam usus besar cenderung Iebih banyak
organisme yang bersifat oportunis yang siap untuk merusak mukosa. Pada
beberapa jenis (E. a c m u l i n a , E. necatrix d a n E . brunetti), tempat tejadinya
parasitisme tergantung pada bagian usus mana yang terinvasi oleh sporozoit.
Sedangkan untuk E. tenella dan E. praecox untuk perkembangannya mempunyai
lokasi yang telah tertentu, yaitu sekum untuk E. tenella d a n duodenum untuk E.
praecox (Sharma d a n Reid, 1962). Long (1978), juga menyatakan bahwa
kecepatan proses ekskistasi akan menentukan bagian mana dari usus yang akan
menjadi lengkap bukan pada bagian yang seharusnya, seperti E. bvunefti yang kadang-kadang mengalami perkembangan siklus hidup d i sekum. Hal ini dapat
terjadi karena misalnya material dari kloaka kembali ke dalarn sekum akibat
adanya proses anti peristaitik (Akester, Anderson, Hill d a n Osbaldiston, 1967),
sehingga keadaan ini menyebabkan transfer merozoit yang berlanjut ke perkembangan stadium selanjutnya.
Faktor yang juga berpengaruh terhadap pe rjalanan penyakit adaIah jenis sel yang terinfeksi beserta kelainan-kelainan yang te j a d i . Kebanyakan coccidia
terutama menginfeksi sel-sel jauh ke dalam kripta. Hanya coccidia yang
memproduksi meron dalam jumlah sedikit yang d a p a t menginfeksi sel-sel yang
telah ada pada villi, misalnya E. acervulina. Jenis semacam ini menyebabkan
lesio yang dengan cepat sembuh kembali, karena sel stem pada kripta tidak
mengalami kerusakan. Rusaknya kripta akibat coccidia tertentu dapat berlanjut
dengan rusaknya sel stem. Apabila seluruh sel stem dalam suatu daerah rusak
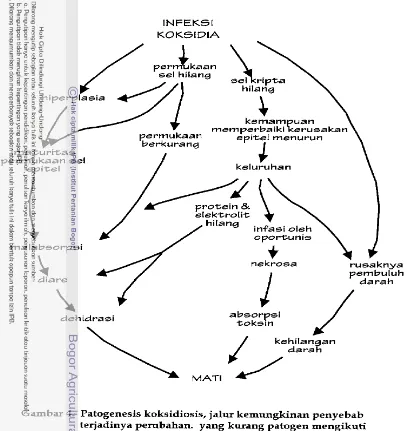
d a n mati, epitel tidak dapat digantikan kecuali melalui "pelanggaran batas" dari tempat yang rusak (Gambar 4). Kadang-kadang beberapa stadium dari coccidia menghindar dari masalah ini dengan menyebabkan berpindahnya seI induk
semang dari epitelium ke lamina propria (Fernando, Lawn, Rose d a n Al-Attar,
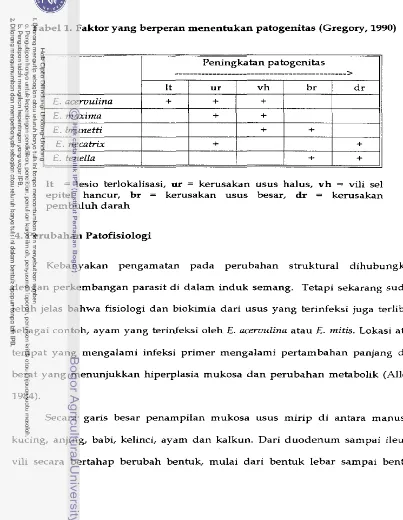
1983). Tabel I menyajikan faktor yang berperan pada patogenitas untuk
[image:197.502.38.457.11.544.2]INFEKSI KOKSIDIA
sel hilang
hiperplasia
kemam uan
memperbaiki rerusakan
berkurang imaturitas
permukaan sel
epitel keluruhan
ukaan &pice1 menurun
\
a, ,-
infasi oleh
/
oportunis\
I
ma la bsorpsi
\
//
nekrosa r ~ > ~ j a k n v a4
diare dehidrasi \ absorpsi toksrn . - - -. . . pembuGi darah-
dara h/
kehi'angan [image:198.498.40.447.47.478.2]23
Tabel 1. Faktor yang berperan menentukan patogenitas (Gregory, 1990)
It = lesio terlokalisasi, ur = kerusakan usus halus, v h = vili sel
epitel hancur, br = kerusakan usus besar, dr = kerusakan
pembuluh darah
4. Perubahan Patofisiologi
Kebanyakan pengamatan pada perubahan struktural dihubungkan
dengan perkembangan parasit di dalam induk semang. Tetapi sekarang eudah
lebih jelas bahwa fisiologi dan biokimia dari usus yang terinfeksi juga terfibat,
sebagai contoh, ayam yang terinfeksi oleh E. acervulina atau E. mifis. Lokasi atau
tempat yang mengalami infeksi primer mengalami pertambahan panjang dan
berat yang menunjukkan hiperplasia mukosa d a n perubahan metabolik (Allen,
1984).
Secara garis besar penampiIan mukosa usus mirip di antara manusia,
[image:199.502.39.442.26.546.2]d a u n d i duodenum; dari bentuk jari sampai bentuk lidah pada ileum. Vili-vili
itu juga memendek dan sempit. Umumnya ha1 ini diterima sebagai gradasi dari
proses yang berhubungan dengan laju pergantian sel, d a n berpengaruh pada
derajat infeksi terhadap kerusakan fisik d a n kimia isi lumen usus.
Peningkatan pergantian sel merupakan ha1 yang biasa pada infeksi
coccidia. Diferensiasi sel juga meningkat s e h n g g a terjadi hiperplasia sel goblet. Infeksi tidak hanya menyebabkan kehiIangan darah, tetapi populasi sel-sel absorptif pada mukosa juga berkurang.
Coccidia yang menginfeksi dan berkembang pada sel stem kripta,
umumnya pada usus kecil bagian bawah, sekum d a n kolon bersifat sangat
patogen karena cenderung menghancurkan sel stern kripta yang diinvasi.
Kerusakan ini mencegah pembaharuan epitel vili sehingga te q a d i peluruhan dari vili yang berakibat hilangnya cairan, hemoragi, kerentanan terhadap invasi
bakteri (terutama coliform), dan kemudian te rjadi lesio nekrotik. Infeksi berat kadang-kadang disertai diare yang diakhiri dengan kematian.
Efek dari coccidia yang secara primer mendiami epitel vili lebih
bervariasi. Infeksi E. rnitis misalnya, yang tidak memperlihatkan lesio, bahkan pada infeksi berat sekalipun, tetapi menyebabkan depigmentasi d a n gangguan
pertambahan berat badan (Ruff d a n Edgar, 1982). Sedangkan pada infeksi E.
necatrix secara hebat merubah sel kripta induk semang yang diinvasi.