PRODUKSI GLUKOSAMIN DENGAN METODE
HIDROLISIS BERTEKANAN SEBAGAI BAHAN
PENUNJANG KESEHATAN SENDI
EKO CAHYONO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Produksi Glukosamin dengan Metode Hidrolisis Bertekanan sebagai Bahan Penunjang Kesehatan
Sendi” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2015
Eko Cahyono
RINGKASAN
EKO CAHYONO. Produksi Glukosamin dengan Metode Hidrolisis Bertekanan sebagai Bahan Penunjang Kesehatan Sendi. Dibimbing oleh PIPIH SUPTIJAH dan IETJE WIENTARSIH.
Kitin merupakan biopolimer yang tersusun atas unit N-asetil-D-Glukosamin. Struktur kitin sangat mirip dengan selulosa yang membedakan pada gugus asetaminda diganti oleh gugus hidroksil pada atom karbonnya. Kitosan sebagai polimer yang tersusun dari 2-amino-2-deoksi-β-D-glukosa dapat diperoleh dengan cara ekstraksi kitin. Pengubahan molekul kitin menjadi kitosan diperoleh dengan cara mengubah gugus asetamida (–NHCOCH) pada kitin menjadi gugus amina (–NH3) pada kitosan. Glukosamin salah satu turunan dari kitosan yang merupakan gula amino dan prekursor penting dalam sintesis biokimia dari protein dan lipid. Glukosamin merupakan senyawa yang ditemukan secara alami dalam tubuh, terbuat dari glukosa dan asam amino glutamin. Glukosamin dibutuhkan untuk menghasilkan glikosaminoglikan, molekul yang digunakan dalam pembentukan dan perbaikan tulang rawan dan jaringan tubuh lainnya. Oleh karena itu efektivitas pemberian glukosamin secara oral perlu dilakukan untuk mengetahui peningkatan volume cairan sinovial secara in vivo
pada tikus percobaan galur sprague dawley.
Tujuan penelitian ini adalah mengkarakterisasi kitosan limbah kulit udang meliputi perhitungan rendemen, analisis proksimat dan logam berat, menentukan konsentrasi asam dan waktu pemanasan terbaik dalam pembuatan glukosamin dengan metode hidrolisis bertekanan dan menganalisis pengaruh efektivitas pemberian glukosamin terbaik dalam meningkatkan cairan sinovial hewan uji.
Penelitian dilaksanakan pada bulan Januari hingga Agustus 2014, terdiri dari tiga tahap yaitu proses pembuatan kitosan, proses pembuatan glukosamin, dan efektivitas pemberian glukosamin. Penelitian tahap satu terdiri atas proses deproteinasi, demineralisasi, dan deasetilasi. Kitosan yang dihasilkan selanjutnya dianalisis proksimat, kadar logam berat, dan derajat deasetilasi. Pada tahap kedua kitosan dihidrolisis secara kimia dengan menerapkan metode bertekanan pada pembuatan glukosamin dengan perlakuan konsentrasi asam dan waktu pemanasan. Glukosamin yang dihasilkan selanjutnya dianalisis rendemen, loss on drying, nilai pH, tingkat kelarutan, loss on ignition, derajat deasetilasi dan
kandungan logam berat. Glukosamin terbaik pada tahap kedua selanjutnya diproduksi secara masal dan diaplikasikan secara in vivo pada hewan percobaan.
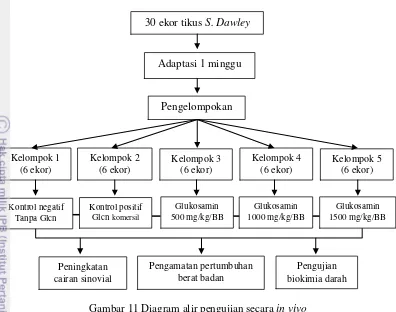
Dosis glukosamin yang diberikan 500, 1000, 1500 mg/kgBB secara pre-oral selama 28 hari. Analisis yang dilakukan meliputi pengukuran berat badan, peningkatan cairan sinovial dengan photo X-ray, dan biokimia serum darah pada
hewan percobaan.
pemanasan 60 menit, loss on drying 0,60% pada konsentrasi HCl 5% dan waktu
pemanasan 150 menit, nilai pH 5,66 pada konsentrasi HCl 5% dan waktu pemanasan 90 menit, kelarutan 9633% pada konsentrasi HCl 8% dan waktu pemanasan 60 menit, loss on ignition 0,233% pada konsentrasi HCl 5 % dan
waktu pemanasan 150 menit, derajat deasetilasi 99,44% dan kandungan logam merkuri 0,00005±1,0414 ppm, kadmium 0,00087±1,1547 ppm, tembaga 0,00109±1,1547 ppm, timbal 0,00153±1,7265 dan arsen 0,00170±1,4410 ppm. Hasil pengujian efektivitas glukosamin secara in vivo pada dosis 1.500 mg/kgBB
dapat meningkatkan cairan sinovial secara maksimal, dan tidak memberikan pengaruh yang nyata (p>0,05) terhadap kadar SGOT-SGPT dan kreatinin darah.
SUMMARY
EKO CAHYONO. Production of Glucosamine as a Subtance to Promote Joint Health Using a Controlled Pressure Method. Supervised by PIPIH SUPTIJAH and IETJE WIENTARSIH.
Chitin is a biopolymer constructed from N-Acetyl-D-Glucosamine units. The structure of chitin closely resembles that of cellulose but is distinguished by the replacement of the hydroxyl group on the carbon atom with an acetyl amine group. Chitosan is a 2-amino-2-deoxy-β-D-glucose polymer which can be produced by processing chitin. Chitin molecules can be transformed to produce chitosan by changing the Acetamide group (–NHCOCH) for an amine group (–NH3). Glucosamine is a derivative of chitosan which is both an amino sugar and an important precursor in the biochemical synthesis of proteins and lipids. Glucosamine is a substance which occurs naturally in the body, produced from glucose and the amino acid glutamine. Glucosamine is needed in order to produce glycosaminoglycans, molecules used for the formation and repair of cartilage and other body tissues. Hence the effectiveness of glucosamine administered orally
in vivo to laboratory mice of the sprague dawley strain needs to be tested in order
to know whether there is a resulting increase in synovial fluid volume.
The goals of this research were to determine the characteristics of chitosan from shrimp shelling waste through measuring yield, proximate analysis and heavy metal concentrations, to determine the optimal acid concentration and heating time for producing glucosamine with a low-pressure hydrolysis method and to analyse the effectiveness of the optimally produced glucosamine in increasing synovial fluid animal experiments.
The research was carried out from January to August 2014 and comprised three stages. These were the production of chitosan, the glucosamine production process, and the effectiveness of administering glucosamine. The first stage comprised deproteination, demineralization, and deacetylation processes. The chitosan produced was subjected to proximate analysis, analysis of heavy metal concentrations and of the degree of deacetylation. In the second stage, the chitosan was hydrolysed chemically to produce glucosamine using a low-pressure method with several acid concentration and heating time treatments. The glucosamine produced from each treatment was tested for yield, loss on drying, pH value, solubility, loss on ignition, deacetylation level and heavy metal concentrations. In the second stage the glucosamine was mass produced using the treatment which yielded the best glucosamine and was administered in vivo to
laboratory animals. Glucosamine was administered orally in doses of 500, 1000, 1500 mg/kg of body weight for 28 days. Analyses carried out on the laboratory animals comprised measurement of body weight, increases in synovial fluid volume using X-ray images, and biochemical analysis of blood serum.
glucosamine produced showed a significant (p<0.05) correlation with yield, 65.33% at HCl concentration of 5% and heating time of 60 minutes, loss on drying 0.60% at HCl concentration of 5% and heating time of 150 minutes, a pH
value of 5.66 at HCl concentration of 5% and heating time of 90 minutes, 96.33% solubility at HCl concentration of 8% and heating time of 60 minutes, loss on ignition of 0.233% at HCl concentration of 5 % and heating time of 150 minutes,
deacetylation level 99.44% and heavy metal concentrations of Mercury 0.00005±1.0414 ppm, Cadmium 0.00087±1.1547 ppm, Copper 0.00109±1.1547 ppm, Lead 0.00153±1.7265 and Arsenic 0.00170±1.4110 ppm. The test results for the effectiveness of glucosamine administered orally in vivo showed that a dose of
1500 mg/kg/BW produced a maximal increase in synovial fluid, and did not have a significant effect (p>0,05) on the concentration of SGOT-SGPT and creatinine in blood.
©
Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
PRODUKSI GLUKOSAMIN DENGAN METODE
HIDROLISIS BERTEKANAN SEBAGAI BAHAN
PENUNJANG KESEHATAN SENDI
EKO CAHYONO
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Penelitian : Produksi Glukosamin dengan Metode Hidrolisis Bertekanan sebagai Bahan Penunjang Kesehatan Sendi
Nama : Eko Cahyono
NRP : C351120201
Disetujui oleh Komisi Pembimbing
Dr Dra Pipih Suptijah, MBA
Ketua
Prof Dr Dra Ietje Wientarsih, Apt, MSc
Anggota
Tanggal ujian : 03 Desember 2014 Tanggal Pengesahan : Diketahui oleh
Ketua Program Studi
Teknologi Hasil Perairan Dekan Sokolah Pascasarjana IPB
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segenap limpahan karunia dan hidayah-Nya sehingga penulis dapat menyelesaikan penelitian ini. Penelitian ini mengangkat tema dengan judul "Produksi Glukosamin dengan Metode Hidrolisis Bertekanan sebagai Bahan Penunjang Kesehatan Sendi". Tesis ini merupakan salah satu syarat mendapatkan gelar
magister di Program Studi Teknologi Hasil Perairan, Sekolah Pascasarjana, Institut Pertanian Bogor.
Pada kesempatan ini penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam menyelesaikan tesis terutama kepada:
1. Dr Dra Pipih Suptijah, MBA selaku ketua komisi pembimbing yang telah banyak meluangkan waktu, tenaga, dan fikiran dalam membimbing penulis. 2. Prof Dr Dra Ietje Wientarsih, Apt MSc selaku anggota komisi pembimbing
yang telah memberikan arahan dan masukan selama penyusunan tesis ini. 3. Dr Tati Nurhayati, SPi MSi selaku dosen penguji luar komisi atas bimbingan,
arahan, kritik, dan saran yang sangat membantu kepada penulis.
4. Dr Ir Wini Trilaksani, MSc selaku Ketua Program Studi Teknologi Hasil Perairan yang telah memberikan saran dalam penulisan tesis.
5. Prof Dr Ir Joko Santoso, MSi selaku Ketua Departemen Teknologi Hasil Perairan.
6. Ayahanda Hadini Masyuri dan Ibu Minayah Iskandar (Alm) tercinta atas limpahan kasih sayang dan doa yang selalu mengalir tanpa henti, serta motivasi dan dukungan yang tak terhingga kepada penulis.
7. Sri Handayani, Skom dan Ariya Putra, SE adik-adiku tercinta yang telah membetikan motivasi, doa, dan dukungannya selama ini.
8. Hamburadul Gaenk La Ode Muhammad Hazairin Nadia SPi MSi; Yunialdi Hapynes Teffu, SPi MSi; Tri Dian Oktiana STp MSi; Febrina Olivia Akerina SPi MSi; dan Asti Nur Annisa SPi MSi terima kasih atas kebersamaan selama ini baik suka maupun duka.
9. Wisma Komiu Andi Achmadi, SPi MSi; Normawati K. Mboto, SPi MSi; Tri Nur Ekawati Lukman, SKm MSi; dan Mardiana STp MSi terima kasih atas kebersamaanya.
10. Teman-teman Teknologi Hasil Perairan 2011, 2012 dan 2013 terima kasih atas kebersamaannya.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna. Penulis mengharapkan masukan dari semua pihak yang sifatnya membangun demi kesempurnaan tesis ini. Semoga tulisan ini bermanfaat bagi pihak-pihak yang memerlukan. Terima kasih.
Bogor, Januari 2015
DAFTAR ISI
DAFTAR TABEL xvi
DAFTAR GAMBAR xvi
DAFTAR LAMPIRAN xvi
1.PENDAHULUAN
Latar Belakang 1
Rumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
2.KARAKTERISASI KITOSAN LIMBAH KULIT UDANG
Pendahuluan 4
Bahan dan Metode 5
Hasil dan Pembahasan 10
Simpulan 18
3.PENERAPAN METODE HIDROLISIS BERTEKANAN
PADA PRODUKSI GLUKOSAMIN
Pendahuluan 19
Bahan dan Metode 20
Hasil dan Pembahasan 25
Simpulan 35
4.EFEKTIVITAS GLUKOSAMIN SECARA IN VIVO PADA TIKUS
Sprague Dawley
Pendahuluan 36 Bahan dan Metode 37 Hasil dan Pembahasan 40 Simpulan 435.PEMBAHASAN UMUM 45
Kesimpulan 47
Saran 47
DAFTAR PUSTAKA 48
DAFTAR GAMBAR
1. Diagram alir pembuatan kitosan limbah kulit udang 6
2. Spektrum FTIR kitosan 14
3. Diagram alir pembuatan glukosamin metodehidrolisis bertekanan 21
4. Rendemen glukosamin 25
5. Loos on drying glukosamin 27
6. Nilai pH glukosamin 28
7. Kelarutan glukosamin 29
8. Loss on ignition glukosamin 30
9. Spektrum FTIR glukosamin hasil penelitian 31
10. Spektrum FTIR glukosamin komersil 32
11. Diagram alir penelitian secara in vivo 38
12. Selisih pertumbuhan berat badan hewan percobaan 40
13. Penampakan cairan sinovial melalui photox-ray 41
DAFTAR TABEL
1. Hasil karakteristik limbah kulit udang 102. Karakteristik kitosan kulit udang 11
3. Kandungan logam berat kitosan 15
4. Karakteristik glukosamin penelitian pendahuluan 25
5. Kandungan logam berat glukosamin 33
6. Kadar SGOT dan SGPT serum darah tikus 43
7. Kadar kreatinin serum darah tikus 44
DAFTAR LAMPIRAN
1. Hasil analisis statistik rendemen glukosamin 572. Hasil analisis statistik loss on drying glukosamin 58
3. Hasil analisis statistik nilai pH glukosamin 59
4. Hasil analisis statistik kelarutan glukosamin 60
5. Hasil analisis statistik loss on ignition glukosamin 61
6. Hasil analisis statistik kadar SGOT serum darah 62
7. Hasil analisis statistik kadar SGPT serum darah 62
1 PENDAHULUAN
Latar Belakang
Wilayah perairan Indonesia yang sangat luas merupakan sumber daya alam yang tidak ada habisnya, hampir semua potensi kelautan yang ada belum dimanfaatkan secara maksimal. Pemanfaatan komoditas perikanan khususnya krustasea menghasilkan limbah dalam jumlah besar. Cangkang invertebrata laut,
terutama krustasea mengandung kitin berkisar antara 20-60% (Rochima et al.
2007). Kulit udang mengandung beberapa komponen antara lain protein, pigmen, lemak, dan mineral berupa kalsium karbonat. Limbah padat krustasea (kepala, kaki, kulit, dan ekor) merupakan salah satu masalah yang harus dihadapi oleh pabrik pengolahan seafood (Abllo et al. 2002). Salah satu alternatif upaya
pemanfaatan limbah krustasea agar menjadi produk yang bernilai ekonomis tinggi dengan pengolahan menjadi kitin dan kitosan (Dutta et al. 2004; Toan 2009).
Kitin merupakan biopolimer alami terbanyak kedua setelah selulosa dan merupakan polimer aminoglukan dari N-asetil-D-glukosamin yang tidak larut dalam air (Dutta et al. 2004). Kitin memiliki biopolimer yang sangat panjang dan
tidak bercabang. Setiap rantai polimer terdiri dari 2.000-5.000 unit monomer N-asetil-D-Glukosamin yang terpaut melalui ikatan β-(1-4) glukosa. Kitosan merupakan senyawa turunan kitin adalah senyawa penyusun rangka luar hewan berkaki banyak misalnya kepiting, ketam, udang, dan serangga. Kitosan termasuk polisakarida linear yang berisi campuran dari D-glukosamin. Derajat deasetilasi kitosan berkisar antara 76,26-91,60% untuk komersil dengan berat molekul antara 100.000-1.000.000 KDa (Patria 2013). Kitosan telah banyak diaplikasikan dalam berbagai bidang misalnya sebagai pengawet hasil perikanan (Dahiya et al. 2005),
membantu proses reverse osmosis (Agusnar 2007), sebagai bahan aditif produk
agrokimia (Saputra et al. 2009), sebagai antimikroba (Mahae et al. 2011), sebagai
antibakteri (Islama et al. 2011), antitumor (Qin et al. 2004), sebagai anti
inflamasi (Oliveira et al. 2012), sebagai antikanker (Kuppusamy dan Karuppaiah
2012), aktivitas biologis (Xia et al. 2010), dan sebagai antioksidan (Rajalakshmi et al. 2013). Kitosan dapat diaplikasikan lebih lanjut dengan memanfaatkan
turunannya misalnya oligomer kitosan, karboksimetil kitosan, dan glukosamin. Glukosamin adalah salah satu turunan dari kitosan yang merupakan gula amino dan prekursor penting dalam sintesis biokimia dari protein glikosilasi dan lipid (Kelly 1998). Glukosamin secara alami terdapat pada tubuh, terutama pada jaringan penghubung dan jaringan tulang rawan serta hati dan ginjal (Camara dan Dowelss 1998). Glukosamin merupakan senyawa yang diperlukan untuk biosintesis berbagai senyawa termasuk glikolipid, glikoprotein, dan proteoglikan, yang semua senyawa terlibat dengan struktur dan fungsi sendi. Glukosamin tersusun dari glukosa dan asam amino glutamin. Produksi glukosamin akan menurun seiring dengan pertambahan usia. Glukosamin secara luas telah digunakan untuk mencegah gejala osteoatritis. Glukosamin dapat dihasilkan melalui beberapa metode ekstraksi yaitu proses hidrolisis kimiawi dengan penambahan HCl dengan rendemen 87,3% (Mojarrad 2007), proses enzimatis dengan bantuan enzim α-amilase dengan rendemen 91,1% (Pan et al. 2011),
proses fermentasi dengan bantuan (Aspergillus sp.) dengan rendemen 5,48%
mengevaluasi glukosamin dengan LD50 secara oral pada hewan percobaan dosis 2.700 mg/kg selama 12 bulan dianggap aman karena tubuh dapat memetabolisme glukosa dengan pemberian parenteral. Konsumsi glukosamin yang aman berkisar 1.500 mg/bb (BPOM 2004; EFSA 2009) dan 2.000 mg/bb (Hathcock dan Shao 2006). Bersama dengan kondroitin, glukosamin dapat membantu mengatasi masalah sendi pada penderita osteoatritis. Kondroitin sendiri adalah suplemen makanan yang biasa digunakan bersama glukosamin. Kondroitin merupakan senyawa rantai gula bercabang yang menyusun tulang rawan. Glukosamin juga merupakan komponen penting dari membran sel dan protein permukaan sel serta molekul struktural interstisial yang menyangga sel secara bersama-sama. Secara
tidak langsung, glukosamin berperan dalam pembentukan permukaan artikular, tendon, ligamen, cairan sinovial, kulit, kuku, pembuluh darah dan sekresi lendir dalam pencernaan, pernafasan, dan sistem saluran pada kemih (Martin 2004).
Osteoartritis (OA) dikenal juga sebagai artritis degeneratif, yaitu kondisi sendi terasa nyeri akibat inflamasi ringan yang timbul karena gesekan ujung-ujung tulang penyusun sendi (Martin 2004). Osteoartritis terdiri atas osteoartritis primer yang dikenal juga sebagai artritis degeneratif sendi dan osteoartritis sekunder yang disebabkan oleh trauma atau cedera (Mahajan et al. 2005). Osteoartritis dapat
menyerang semua tulang rawan dalam tubuh, termasuk tulang belakang, lutut hingga pergelangan kaki, bahu hingga pergelangan tangan, dan juga jari-jari tangan maupun kaki. Kartilago merupakan suatu jaringan tulang rawan biasanya menutupi ujung tulang penyusun sendi. Suatu lapisan cairan sinovial terletak diantara tulang tersebut yang berfungsi sebagai pelumas untuk mencegah ujung tulang tersebut bergesekan dan saling mengikis satu sama lain (Reyes et al. 2000).
Kondisi kekurangan cairan ini lapisan kartilago yang menutup ujung tulang akan bergesekan satu sama lain. Gesekan tersebut akan membuat lapisan tersebut semakin tipis dan pada akhirnya akan menimbulkan rasa nyeri. Hasil penelitian Berief et al. (2001) menunjukkan bahwa perubahan struktural dalam komposisi
molekul ini memiliki dampak negatif pada sifat biomekanik artikular kartilago dewasa normal dan cairan sinovial. Osteoatritis biasanya menyerang orang tua dan paling banyak dalam bentuk atritis, lebih dari 80% menyerang kaum lansia dengan usia di atas 50 tahun. Data statistik menunjukkan bahwa lebih dari 40 juta warga dunia khususnya di Amerika Serikat menderita osteoatritis. Penelitian ini perlu dilakukan untuk mengetahui efektivitas glukosamin dalam mencegah penyakit osteoartritis dengan jalan peningkatan cairan sinovial dan proses produksinya dengan menerapkan metode hidrolisis bertekanan.
Rumusan Masalah
Tujuan Penelitian
Tujuan penelitian ini adalah melakukan karakterisasi kitosan limbah kulit udang windu (Panaeaus monodon), menentukan konsentrasi asam dan waktu
pemanasan terbaik dalam pembuatan glukosamin dengan penerapan metode hidrolisis bertekanan, dan menganalisis pengaruh efektivitas pemberian glukosamin dalam meningkatkan cairan sinovial.
Manfaat Penelitian
Manfaat yang diharapkan dari hasil penelitian ini adalah sebagai upaya pendayagunaan limbah dan pengembangan metode pada produksi glukosamin serta sebagai bahan informasi ilmu pengetahuan dan teknologi.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah pengambilan sampel limbah kulit udang windu (Peneaus monodon) di perusahan pembekuan udang, karakterisasi
bahan baku, proses pembuatan kitosan, pengujian mutu kitosan limbah kulit udang, proses pembuatan glukosamin dengan metode hidrolisis bertekanan, pengujian mutu glukosamin, pengujian efektivitas glukosamin dalam meningkatkan cairan sinovial secara in vivo pada tikus putih, serta pengujian
2 KARAKTERISASI KITOSAN LIMBAH KULIT
UDANG WINDU (Penaeus monodon)
Latar Belakang
Teknologi polimer saat ini berkembang dengan pesat seiring dengan semakin beragamnya produk polimer. Eksplorasi terhadap polimer yang pesat mendorong keinginan untuk menemukan jenis polimer yang lebih baik sehingga mudah diperoleh untuk kepentingan aplikasi. Zulfikar dan Ratnadewi (2006) menyatakan bahwa pemanfaatan produk polimer telah berkembang keberbagai aspek kehidupan, sedangkan penghasil polimer difokuskan pada sumberdaya alam yang jauh lebih murah dan mudah didapat. Polimer tersebut merupakan biopolimer, suatu polimer yang mudah diperoleh, dan ramah lingkungan serta mudah terdegradasi.
Kitin merupakan biopolimer organik terbanyak kedua yang ditemukan di alam setelah selulosa, terdapat di berbagai spesies binatang baik darat maupun perairan (Suptijah et al. 1992). Kitosan merupakan senyawa organik turunan dari
kitin, senyawa golongan karbohidrat dari biomaterial kitin yang dihasilkan dari limbah laut, khususnya golongan udang, kepiting, rajungan, lobster, ketam, dan kerang-kerangan (Rochima et al. 2007). Kitosan adalah poliglukosamin atau biasa
disebut juga dengan ß-1,4-2 acetamido-2-dioksi-D-glukosa yang dihasilkan dari kitin dengan proses deasetilasi menggunakan suhu tinggi dan alkali berkonsentrasi tinggi (Dutta et al. 2004; Rochima et al. 2007).
Proses transformasi kitin menjadi kitosan secara umum adalah tahap deasetilasi dengan penggunaan basa kuat misalnya KOH dan NaOH. Robert (2008) menjelaskan bahwa proses deasetilasi dapat dilakukan dengan konsentrasi basa antara 33-39,5% suhu 60-80 °C selama 4-6 hari dan dianggap lebih ramah lingkungan. Hasil karakterisasi kitosan dari limbah kulit udang mengandung rendemen 15,21% (Islama et al. 2011) 15% (Hossain 2013). Kadar air 1,25% (Walke et al. 2014). Viskositas 121±52 cPs (Trung dan Thong 2012); 191,1 cPs
(Patria 2013). Derajat deasetilasi 82,3±0,5% (Trung dan Thong 2012); 81,24% (Hossain 2013); 75% (Walke et al. 2014). Karbohidrat 74,12% (Isa et al. 2012).
Kelarutan 0,9±0,8% (Trung dan Thong 2012); 1% (Walke et al. 2014).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui mutu kitosan dari limbah kulit udang windu (Peneaus monodon) dengan menghitung rendemen kitosan limbah
kulit udang, menganalisis kandungan proksimat kitosan limbah kulit udang, dan menganalisis logam berat kitosan limbah kulit udang.
Bahan dan Metode Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari sampai Maret 2014 di Laboratorium Diversifikasi dan Pengembangan Produk Hasil Perairan, Laboratoriam Biokimia Hasil Perairan Fakultas Perikanan dan Ilmu Kelautan serta Laboratorium Pengujian Pusat Studi Biofarmaka Institut Pertanian Bogor.
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah kulit udang windu (Panaeus monodon) dari pabrik pembekuan udang. Bahan pendukung
lainnya dalam proses pembuatan kitosan antara lain larutan NaOH 3 N (proses deproteinasi), HCl 1 N (proses demineralisasi), NaOH 50% (proses deasetilasi). Bahan untuk analisis proksimat antara lain Kjeldahl, selenium 0,25 g, H2SO4 pekat 3 mL, NaOH 40% 20 mL, H3BO3 2% 10 mL, indikator bromcresol
green-methyl red, dan benzena. Bahan yang digunakan untuk analisis logam berat antara
lain HNO3 pekat 15 mL, HClO4 5 mL dan akuades.
Alat yang digunakan dalam penelitian ini antara lain seperangkat alat produksi kitosan stainless steel, kompor gas (Hitachi), timbangan digital
(Quattro), dan gelas ukur (Pyrex). Alat yang digunakan untuk analisis proksimat antara lain oven listrik (Yamato DV 41), Kjeldahl sistem, tanur listrik (Yamato AAF 11/3 PID 301), desikator (Pyrex Duran), Sokhlet (Pyrex), alat titrasi (Fatex-S), cawan porselin, gegep, gelas piala 200 mL (Pyrex), labu takar (Pyrex), Kjeldahl 50 mL (Pyrex), erlenmeyer 125 mL (Pyrex), pipet tetes, tabung reaksi (Pyrex), labu takar (Pyrex), ubbelohde dilution viscometer (Type R-85
viscometer), pH meter (Hanna), seperangkat alat Fourier Transform Infrared Spectroscopy (FTIR), dan Atomic Absorption Spektrofotometer (AAS).
Tahap Penelitian
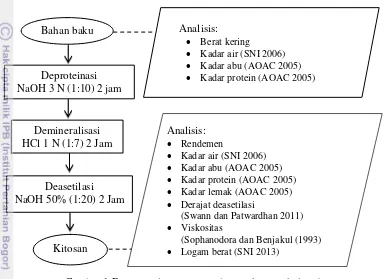
Tahap pembuatan kitosan dari limbah kulit udang meliputi proses deproteinasi, demineralisasi, dan deasetilasi (Suptijah et al. 1992).
a. Deproteinasi
Bahan baku kulit udang dicampur dengan larutan NaOH 3 N dengan perbandingan 1:10 b/v. Campuran tersebut dipanaskan pada suhu 100 °C selama 2 jam dan cuci sampai netral.
b. Demineralisasi
c. Deasetilasi
Sampel kitin direndam dalam larutan NaOH 50% dengan perbandingan 1:20 b/v. Sampel tersebut dipanaskan pada suhu 100 ºC selama 2 jam sambil diaduk dan ditiriskan selanjutnta dicuci dengan air sampai netral. Kitosan dijemur sampai kering sehingga diperoleh kitosan larut asam. Diagram alir proses pembuatan kitosan dapat dilihat pada Gambar 1.
Gambar 1 Diagram alir proses pembuatan kitosan kulit udang Sumber : Suptijah et al. (1992)
Rendemen Kitosan (AOAC 2005)
Rendemen merupakan salah satu parameter penting dalam mengetahui berat akhir suatu bahan setelah proses produksi. Persentase berat kitosan dalam cangkang udang windu (Penaeus monodon) dihitung dengan rumus:
Kadar Air(SNI 01-2354.2-2006)
Prinsip penentuan kadar air adalah penghilangan molekul air pada bahan dengan oven pada suhu 95-100 ºC selama 16-24 jam. Penentuan kadar air dengan mengeringkan cawan porselin dalam oven pada suhu 105 ºC selama 1 jam. Cawan porselin dimasukkan ke dalam desikator selama ±15 menit dan ditimbang sampai diperoleh berat konstan (A: berat cawan). Sebanyak 5 gram sampel dimasukkan ke dalam cawan porselin (B: berat cawan dan samperl sebelum dikeringkan). Sampel dimasukkan ke dalam oven pada suhu 105 ºC selama 5 jam. Sampel hasil pengeringan dimasukkan ke dalam desikator sampai dingin ditimbang kembali
sampel (C: berat cawan dan sampel setelah dikeringkan). Kadar air dapat dihitung dengan rumus sebagai berikut:
Keterangan:
A : Berat cawan (gram)
B : Berat sampel dan cawan sebelum dikeringkan (gram) C : Berat sampel dan cawan setelah dikeringkan (gram)
Kadar Abu(AOAC 2005)
Analisis kadar abu dimulai dengan mengeringkan cawan pengabuan di dalam oven selama 1 jam pada suhu 105 ºC. Cawan pengabuan dimasukkan ke dalam desikator selama 1 menit (A: berat cawan). Sebanyak 5 gram dimasukkan ke dalam cawan pengabuan selanjutnya dipijarkan di atas nyala api sampai tidak berasap lagi (B: berat cawan dan samperl sebelum dikeringkan). Sampel hasil pembakaran dimasukkan ke dalam tanur pengabuan dengan suhu 600 ºC selama 7 jam. Sampel hasil pengabuan dimasukkan ke dalam desikator selama 15 menit dan ditimbang kembali (C: berat cawan dan sampel setelah dikeringkan). Kadar abu dapat dihitung dengan rumus berikut:
Keterangan:
A : Berat cawan porselin kosong (gram)
B : Berat sampel dan cawan sebelum dikeringkan (gram) C : Berat sampel dan cawan setelah dikeringkan (gram)
Total Nitrogen(AOAC 2005)
Analisis kadar protein terdiri dari tiga tahap yaitu tahap destruksi, destilasi, dan titrasi. Analisis kadar protein dilakukan dengan menimbangsampel sebanyak 1 gram dan masukkan ke dalam labu Kjeldahl 50 mL dan 3 mL H2SO4 pekat. Sampel didestruksi hingga cairan berwarna hijau bening pada suhu 410 ºC. Campuran tersebut dibiarkan hingga dingin, kemudian dipindahkan ke alat destilasi. Labu Kjeldahl yang telah digunakan dicuci dengan akuades. Air cucian tersebut dimasukkan ke dalam alat destilasi dan ditambahkan 20 mL NaOH pekat hingga berwarna coklat kehitaman, selanjutnya didestilasi. Hasil destilasi ditampung dalam erlenmeyer 125 mL yang berisi 5 mL H3BO3 dan diberikan indikator methylene blue, selanjutnya dititrasi dengan larutan HCl 0,02 N sampai
Kadar Lemak Disability Soxhletasi (SNI 01-2354.3-2006)
Prinsip pengujian kadar lemak adalah sampel diekstraksi dengan pelarut organik dengan bantuan pemanasan. Pelarut yang mengikat lemak selanjutnya dipisahkan dengan penguapan (evaporasi), sehingga lemak tertinggal dalam labu. Pengujian kadar lemak dengan menimbang labu lemak yang telah dipanaskan pada suhu 105–110 °C selama 1 jam (A gram). Sebanyak 1 gram sampel kitosan ditimbang (X gram). Sampel dimasukkan ke dalam selongsong yang terbuat dari kertas saring ditutup dengan kapas bebas lemak. Selongsong dimasukkan ke dalam alat extractor soxhlet dengan menambahkan larutan petroleum eter sebagai
larutan pengekstrak. Suhu pada alat extractor soxhlet diatur 60 °C selama 25
menit. Proses ekstraksi dan evaporasi dilakukan sebanyak 2 kali. Pengeringan labu lemak dalam oven dengan suhu 105 °C selama 1 jam. Pendinginan labu lemak dalam desikator selama 1 jam dan menimbang kembali berat labu (B gram). Penentuan rumus kadar lemak kasar sebagai berikut:
Keterangan:
A = Berat labu lemak kosong (gram) B = Berat labu lemak dengan lemak (gram) X = Berat sampel (gram)
Viskositas Kitosan (Sophanodora dan Benjakul 1993)
Analisis viskositas kitosan diukur menggunakan ubbelohde dilution viscometer VT 04. Sampel kitosan cair dimasukkan ke dalam cup viskometer. Spindel nomer 2 dimasukkan ke dalam cup yang berisi sediaan kitosan cair. Alat viscometer VT 04 dihidupkan hingga spindel berputar untuk mengukur viskositas
pada sediaan kitosan cair selama 1 menit. Layar digital akan menunjukkan suatu angka (hasil pengukuran laju air sediaan). Angka tersebut merupakan nilai viskositas dari sediaan.
Derajat Deasetilasi (Swann dan Patwardhan 2011)
Pengujian Fourier Transform Infrared Spectroscopy (FTIR) digunakan
untuk menganalisis gugus fungsi dengan cara menentukan hasil spektrum bahan dengan serapan energi molekul organik melalui sinar Infrared. Sinar infrared
digunakan untuk menentukan setiap gugus dalam molekul bahan. Setiap molekul memiliki serapan infrared yang berbeda-beda umumnya disajikan dalam bentuk
panjang gelombang antara 450-4.000cm‾1. Tahapan analisis derajat deasetilasi sebagai berikut: Sampel uji yang disiapkan berupa garam rangkap dan garam kompleks. Sebanyak 1 mg garam rangkap CuSO4(NH3)2SO4 6H2O ditimbang dan dihaluskan bersamaan dengan 200 mg KBr menggunakan mortar hingga halus. Campuran bahan tersebut dibentuk pelet menggunakan alat press dan pre-vakum
selama 2-3 menit. Bahan pelet selanjutnya dipres kembali menggunakan pompa hidrolik dengan mengatur tekanannya menjadi 80 KN selama 5 menit. Pelet yang telah siap dimasukkan ke dalam hollder pada lintasan sinar infrared FTIR.
yang terbentuk. Data yang dihasilkan disimpan dan dilakukan pembahasan terhadap puncak-puncak yang terbentuk.
Logam Berat (SNI 7853:2013)
Penetapan kadar logam secara kuantitas dilakukan dengan Atomic Absorption Spectrophotometer (AAS). Unsur logam dilepaskan dari matriks
bahan dengan cara destruksi atau pengabuan dengan menggunakan microwave.
Hasil destruksi diatomisasi dengan graphite furnace (GF). Atom dari unsur
tersebut berinteraksi dengan sinar lampu katode (jenis logam) yang sesuai. Interaksi yang terjadi berupa serapan yang besarnya dapat dilihat dalam tampilan monitor AAS. Jumlah serapan sebanding dengan konsentrasi unsur logam. Pengujian kadar logam dilakukan dengan menimbang sampel sebanyak 5 gram. Sampel dimasukkan ke dalam beaker teflon secara merata agar mengalami proses
pengeringan sempurna. Sampel dikeringkan kembali ke dalam oven pada suhu 105 ºC selama 24 jam. Sampel yang telah mengering selanjutnya dihaluskan hingga berbentuk bubuk. Sebanyak 4 gram sampel bubuk ditimbang dengan menggunakan timbangan digital. Sampel dimasukkan ke dalam beaker teflon.
Sebanyak 5 mL larutan aqua regia (percampuran HCl dan HNO3 pekat dengan perbandingan 3:1 v/v) ditambahkan pada sampel dan dipanaskan pada suhu 130 °C hingga mengering. Sampel yang telah kering dipindahkan ke dalam sentrifus polietilen. Sebanyak 30 mL akuades ditambahkan ke dalam sampel dan dibiarkan mengendap. Fase cair dari sampel ditampung untuk diukur kadar logam dengan menggunakan Atomic Absorption Spektrofotometer (AAS) asetilen. Kadar
logam berat dihitung dengan rumus:
Keterangan:
D : kadar comtoh µg/L dari hasil pembacaan ASS
E : kadar blangko contoh µg/L dari hasil pembacaan ASS W : berat contoh (gram)
Hasil dan Pembahasan
Karakteristik Kitosan Kulit Udang Windu
Bahan baku yang digunakan pada penelitian ini adalah limbah kulit udang windu (Panaeus monodon) yang diperoleh dari pabrik pembekuan. Hasil
karakteristik limbah kulit udang dapat dilihat pada Tabel 1. Tabel 1 Hasil karakteristik limbah kulit udang
Komposisi Kimia Persentasi (%)
Kadar air 12,09±0,008
Kadar abu 24,42±0,004
Kadar protein 20,27±0,006
Kulit udang mengandung beberapa komponen seperti pigmen, mineral, protein, dan kitin. Berdasarkan hasil analisis kulit udang diperoleh kadar air (12,09±0,008%), kadar abu (24,42±0,004%), dan kadar protein (20,27±0,06%). Hasil penelitian Isa et al. (2012) kulit udang mengandung kadar protein (15,05%)
dan kitin (8,15%). Ploydee dan Chaiyana (2014) menyatakan limbah kepala udang segar mengandung kadar air (86,1±2,2%), kadar abu (22,2±0,6%), protein kasar (40,7±2,7%), lemak (13,9±1,1%), dan kitin (23,2%). Semua komponen dari kulit udang dapat diisolasi dan diekstraksi dengan menerapkan sistem zero waste
sehingga kulit udang tersebut memiliki nilai ekonomis yang tinggi.
Rendemen Kitosan
Rendemen merupakan salah satu parameter penting dalam pembuatan kitosan. Efisien dan efektifnya proses ekstraksi bahan baku untuk pembuatan kitosan dapat dilihat dari nilai rendemen yang dihasilkan. Rendemen kitosan diperoleh dari perbandingan antara berat kering kitosan yang dihasilkan dengan berat bahan baku. Semakin besar rendemen yang dihasilkan maka semakin efisien perlakuan yang diterapkan.
Rendemen kitosan hasil penelitian ini adalah 14%. Berdasarkan hasil penelitian Islama et al. (2011) berkisar 15,21-18%; Hossain (2013) 15,14%;
Mohanasrinivasan et al. (2013) 17%. Kitosan dihasilkan melalui proses deasetilasi
Karakteristik Kitosan
Karakterisasi kitosan yang dilakukan dalam penelitian ini meliputi bau, warna, bentuk, kadar air, kadar abu, kadar lemak, karbohidrat, total nitrogen, viskositas, logam berat, dan derajat deasetilasi. Hasil analisis karakteristik kitosan dari limbah udang windu (Peneaus monodon) dapat dilihat pada Tabel 2.
Tabel 2 Karakteristik kitosan kulit udang
Spesifikasi (% Basis kering)
Hasil Analisis EFSA 2010 GRAS 2012
Warna Putih Kecokelatan
Kitosan yang diperoleh dari penelitian ini berwarna putih kecokelatan dan berbentuk serpihan. Hasil penelitian Suptijah et al. (1992) kitosan berwarna putih
kekuningan dan berbentuk serpihan atau bubuk halus. Warna kitosan yang dihasilkan dari penelitian ini disebabkan selama proses demineralisasi dan deproteinasi masih terdapat bahan organik yang belum hilang secara sempurna. Hasil penelitian Ploydee dan Chaiyana (2014) menyatakan bahwa kitosan yang diproduksi dengan cara biologis memiliki warna lebih gelap dibandingkan dengan kitosan yang diproduksi secara kimia. Hal ini diduga masih terdapatnya kandungan protein yang mencapai 0,4±0,3% dan kalsium 1,6±0,6% selama proses produksi. Berdasarkan GRAS (2012) kitosan komersil berbentuk serbuk, berwarna putih, dan tidak berbau.
Kadar Air
Kadar air yang dihasilkan merupakan perbedaan antara berat bahan sebelum dan sesudah dilakukan pemanasan. Kadar air kulit udang 12,09±0,008 (Tabel 1). Hal ini dikarenakan setiap bahan bila diletakkan dalam udara terbuka maka kadar air akan mencapai keseimbangan dengan kelembaban udara disekitarnya. Kadar air kitosan penelitian ini adalah 12,29% (Tabel 2). Kadar air kitosan hasil penelitian Suptijah et al. (1992) kurang dari 10%; Isa et al. (2012)
1,40%; Abdulkarim et al. (2013) 8,70%; Walke et al. (2014) 1,8%.
Kadar air yang tinggi dari hasil penelitian ini diduga diakibatkan terjadinya penyerapan uap air ketika kitosan dalam keadaan terbuka. Hal ini dikarenakan kitosan mengandung gugus amino yang memiliki kemampuan untuk mengikat molekul air. Walke et al. (2014) menyatakan bahwa kitosan merupakan
memiliki kemampuan menyerap air selama peyimpanan. Kadar air kitosan komersil berdasarkan EFSA (2010) yaitu ≤ 10%; GRAS (2012) yaitu ≥ 10%.
Kadar Abu
Abu merupakan residu anorganik yang diperoleh dengan cara mengabukan komponen-komponen organik dalam suatu bahan. Jumlah dan komposisi abu dalam mineral tergantung pada jenis bahan. Kadar abu bisa digunakan sebagai indikasi kandungan mineral dalam sampel. Kadar abu merupakan bagian berat mineral dari bahan yang didasarkan atas berat keringnya.
Tabel 1 menyatakan bahwa bahan baku kulit udang memiliki kadar abu yang tinggi yaitu 24,42±0,004% yang disebabkan banyaknya mineral yang terdapat dalam kutikula kulit udang. Kadar abu setelah menjadi kitosan menurun hingga mencapai 0,99% (Tabel 2) yang berarti kandungan mineral yang tersisa sangat sedikit. Hal ini menunjukkan bahwa proses demineralisasi pada pembuatan kitosan telah berjalan dengan baik sehingga tidak banyak mineral tersisa. Kadar abu kitosan hasil penelitian Suptijah et al. (1992) 2,5%; Islama et al. (2011)
1,20%; Isa et al. (2012) 5,60%; Mohanasrinivasan et al. (2013) 2,28%. Kadar abu
yang rendah dari kitosan hasil penelitian dipengaruhi oleh konsentrasi asam klorida dan suhu pemanasan. Asam klorida dalam proses demineralisasi berperan melarutkan garam kalsium dengan terbentuknya gas CO2 dan H2O dipermukaan larutan. Hasil penelitian Walke et al. (2014) menyatakan bahwa proses
demineralisasi akan berjalan dengan baik pada konsentrasi HCl 1 N dengan suhu 110 ºC dan lama pemanasan 30 menit menghasilkan kadar abu 0,48%. Kandungan abu dari kitosan merupakan parameter yang penting. Kadar abu yang besar dapat mempengaruhi tingkat kelarutan dan dapat menurunkan viskositas. Penentuan kadar abu merupakan indikator keefektifan dari tahap demineralisasi untuk menghilangkan mineral pada kulit udang. Besarnya kadar abu yang terkandung pada bahan menunjukkan proses demineralisasi yang kurang sempurna. Kadar abu kitosan komersil berdasarkan EFSA (2010) yaitu ≤ 3%; GRAS (2012) yaitu ≤1%.
Kadar Lemak
Analisis kadar lemak dilakukan dengan tujuan untuk mengetahui kandungan lemak yang terdapat pada kitosan. Validitas hasil analisis tergantung sampel yang baik dan persiapan sampel sebelum dilakukan analisis. Idealnya komposisi sampel yang dianalisis harus mendekati sama dengan kondisi saat sampel diambil (Hermanto et al. 2007).
Total Nitrogen
Protein merupakan senyawa organik yang kompleks. Struktur dasar dari protein adalah rantai asam amino dan berperan sebagai cadangan energi bagi tubuh. Protein merupakan bagian terpenting dari molekul biokimia dalam kehidupan setiap makhluk hidup setelah lemak dan karbohidrat. Protein merupakan komponen dasar dari jaringan hewan (Mandel et al. 2012).
Tabel 1 menyatakan bahwa bahan baku kulit udang memiliki kadar protein yang cukup tinggi yaitu 20,27±0,06%. Hal ini dikarenakan protein merupakan komponen utama penyusun jaringan kulit udang setelah kitin dan beberapa mineral. Kadar nitrogen setelah menjadi kitosan dalam penelitian ini 2,20% (Tabel 2). Kadar nitrogen kitosan berdasarkan hasil penelitian Suptijah et al.
(1992) ≤ 1%; Trung dan Phuong (2012) 0,93±0,1%. Kadar nitrogen yang tinggi dari hasil penelitian diduga diakibatkan proses deproteinasi yang tidak sempurna sehingga menyebabkan rantai asam amino tidak dapat dirombak sehingga denaturasi protein tidak berlangsung dengan baik dan kadar protein pada kitosan masih cenderung tinggi. Abdulkarim et al. (2013) menyatakan bahwa kadar
protein kitosan yang tinggi dapat dikaitkan dengan waktu perendaman, dan metode yang digunakan selama proses pembuatan kitosan. Kadar nitrogen kitosan komersil berdasarkan EFSA (2010) yaitu ≤ 6%; GRAS (2012) yaitu
≤ 0,02 gram/100 gram.
Karbohidrat
Karbohidrat merupakan sumber energi utama yang merupakan turunan dari gula. Sumber gula utama adalah glukosa dan galaktosa walaupun beberapa bahan juga mengandung maltosa dan fruktosa. Glukosa akan dimetabolisme dalam proses glikolisis membentuk pirufat dan dapat diubah menjadi laktat dan memasuki siklus asam sitrat yang membentuk CO2.
Hasil perhitungan kadar karbohidrat pada penelitian ini dengan metode by difference menunjukkan bahwa kitosan mangandung karbohidrat 81,39%. Kadar
karbohidrat kitosan berdasarkan hasil penelitian Isa et al. (2012) 74.12%; Kamala et al. (2013) 54,31%. Metode by difference ini masih digunakan oleh FDA tetapi
metode ini dapat menghasilkan nilai yang salah karena ada kemungkinan terjadi akumulasi kesalahan dari metode-metode yang digunakan untuk mengukur komponen lain, dan kemungkinan adanya komponen non karbohidrat yang terukur sebagai karbohidrat dan menyebabkan penyimpangan yang lebih besar.
Viskositas
Viskositas merupakan salah satu sifat fisik kitosan yang cukup penting. Viskositas adalah daya aliran molekul dalam suatu larutan. Pengujian viskositas dilakukan untuk mengetahui tingkat kekentalan kitosan sebagai larutan pada konsentrasi dan suhu tertentu. Viskositas kitosan biasanya diukur pada suhu 60 ºC dengan konsentrasi 6,67% (b/b) (Leiner 2006).
Viskositas kitosan yang diperoleh dari penelitian ini adalah 1.713,04 cPs (Tabel 2). Viskositas diukur dengan viskometer ubbelohde pada kecepatan 50 rpm
menggunakan spindel nomor 2 selama 1 menit. Berdasarkan hasil penelitian
Suptijah et al. (1992) nilai viskositas kitosan 600 cPs; Trung dan Phuong (2012)
1.214±52 cPs; Walkes et al. (2014) 602 cPs. Kisaran nilai ini telah masuk standar
dari penelitian ini dipengaruhi oleh distribusi molekul kitosan dalam larutan serta berat molekut dari kitosan, sedangkan berat molekul kitosan berhubungan langsung dengan panjang rantai polimernya. Jika ukuran rantai polimernya menjadi kecil maka laju gerak translasinya menjadi cepat sehingga viskositas menjadi rendah dan sebaliknya. Berdasarkan hasil penelitian Avena et al. (2006)
menyatakan bahwa semakin tinggi berat molekul dari kitosan maka distribusi molekul kitosan dalam larutan semakin lambat sehingga menghasilkan viskositas yang tinggi, sebaliknya semakin kecil berat molekul kitosan maka distribusi molekul kitosan dalam larutan semakin cepat sehingga menghasilkan kitosan dengan viskositas yang rendah.
Derajat Deasetilasi
Derajat deasetilasi (DD) merupakan suatu parameter lepasnya gugus asetil dari kitin. Derajat deasetilasi diketahui dengan perhitungan berdasarkan ikatan amida dan adanya gugus amina dari spektrum FTIR. Derajat deasetilasi kitosan penelitian ini adalah 98,65% lebih tinggi dari standar mutu kitosan yang telah ditetapkan (GRAS 2012) yaitu 75-95%. Berdasarkan hasil penelitian Suptijah
et al. (1992) derajat deasetilasi kitosan berkisar 80-90%; Mohanasrinivasan et al.
(2013) 74,82%; Trung dan Phuong (2012) 82,3±05%; Hossain (2013) 81,24%; Walke et al. (2014) 75-85%. Derajat deasetilasi merupakan parameter penting
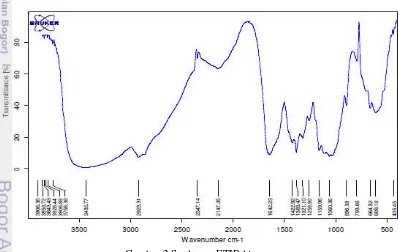
yang mempengaruhi sifat kitosan seperti kelarutan, reaktivitas kimia, dan biodegradasi. Spektrum FTIR kitosan dapat dilihat pada Gambar 2.
Gambar 2 Spektrum FTIR kitosan
Derajat deasetilasi yang tinggi diduga dipengaruhi oleh proses deasetilasi kitin menjadi kitosan meliputi jumlah larutan alkali yang digunakan, waktu, dan suhu reaksi. Pada penelitian ini menggunakan metode Suptijah et al. (1992)
menghasilkan gugus amida yang semakin banyak. Peningkatan suhu pada proses deasetilasi akan meningkatkan kecepatan reaksi dalam deasetilasi molekul kitin menjadi kitosan. Semakin lama waktu proses maka reaksi akan berlangsung semakin lama sehingga molekul NaOH yang teradisi ke molekul kitin semakin banyak dan menyebabkan gugus asetil yang terlepas semakin banyak.
Shahidi (2005) menyatakan bahwa suhu yang tinggi akan menyebabkan ikatan antar sesama molekul menjadi lemah, viskositas menjadi rendah, dan molekul bergerak lebih cepat sehingga gugus OH‾ dari larutan NaOH akan lebih cepat beradisi dengan gugus NHCOCH3 pada kitin dalam mengeliminasi gugus asetil. Rokhati (2006) menambahkan bahwa waktu reaksi juga menyebabkan terjadinya degradasi kitosan yang ditandai dengan menurunnya viskositas sehingga lamanya waktu proses tidak begitu berpengaruh terhadap derajat deasetilasi. Sedjati et al. (2007) menyatakan semakin tinggi mutu kitosan berarti
semakin tinggi pula tingkat kemurniannya. Kemurnian kitosan dapat dilihat dari kadar air dan kadar abu yang rendah dengan derajat deasetilasi yang tinggi. Semakin tinggi derajat deasetilasinya maka semakin banyak gugus amino pada rantai molekul kitosan sehingga kitosan akan semakin reaktif.
Kadar Logam Berat
Logam berat merupakan bahan pencemar berbahaya karena bersifat toksik dan mempengaruhi berbagai aspek biologi dan ekologi. Pembuangan limbah logam berat ke lingkungan sungai, muara dan pantai dapat merusak lingkungan, beracun bagi organisme dan biota di lingkungan akuatik, kebanyakan berasal dari sumber antropogenik yang terus meningkat, informasi mengenai perilaku dan biotoksisitasnya masih terbatas dan terjadi akumulasi pada organisme akuatik (Setyawan et al. 2004).
Pengujian kadar logam berat dilakukan untuk mengetahui kandungan logam berat jenis merkuri, kadmium, tembaga, timbal, dan arsen yang terdapat pada kitosan. Hasil pengujian kandungan logam berat dapat dilihat pada Tabel 3.
Tabel 3 Kandungan logam berat kitosan
Logam Hasil Analisis jenis <5 gram/cm3 (Sudarmaji et al. 2006). Beberapa jenis logam berat misalnya
Merkuri
Merkuri (Hg) adalah salah satu jenis logam berat yang sangat berbahaya, khususnya metil merkuri (MeHg). Melalui proses akumulasi secara biologi (bioakumulasi), proses perpindahan secara biologi (biotransfer), dan pembesaran secara biologi (biomagnifikasi) yang terjadi secara alamiah. Organisme laut mengakumulasi MeHg dalam konsentrasi tinggi dan selanjutnya terjadi keracunan pada manusia yang mengkonsumsinya (Lasut 2009).
Hasil analisis kandungan logam merkuri kitosan 0,00001±2,7735 ppm. Nilai ini masih di bawah standar mutu yang ditetapkan oleh BPOM (2007) 5 ppm; EFSA (2010) 0,100 ppm; GRAS (2012) 0,005 ppm. Hasil yang diperoleh menunjukkan bahwa kitosan masih aman untuk dikonsumsi sebagai bahan tambahan makanan. Barrebard et al. (1994) menyatakan bahwa efek keracunan
merkuri tergantung dari kepekaan individu dan faktor genetik. Individu yang peka terhadap keracunan merkuri adalah anak dalam kandungan (prenatal), bayi, anak-anak, dan orang tua. Gejala yang timbul akibat keracunan merkuri dapat merupakan gangguan psikologik berupa rasa cemas.
Kadmium
Kadmium (Cd) merupakan salah satu jenis logam berat yang berbahaya karena elemen ini beresiko tinggi terhadap pembuluh darah. Apabila kadmium masuk ke dalam tubuh maka sebagian besar akan terakumulasi di dalam ginjal, hati, dan sebagian yang dikeluarkan lewat saluran pencernaan. Kadmium dapat mempengaruhi otot polos pembuluh darah secara langsung maupun tidak langsung melalui ginjal akibatnya terjadi kenaikan tekanan darah. Senyawa ini bisa mengakibatkan penyakit liver dan gangguan ginjal serta tulang.
Hasil pengukuran kandungan kadmium pada kitosan 0,00079±3,4641 ppm. Nilai ini masih berada di bawah standar yang direkomendasikan BPOM (2007) <5 ppm; EFSA (2010) 0,250 ppm; GRAS (2012) 0,50 ppm. Hasil yang diperoleh menunjukkan bahwa kitosan memiliki kandungan kadmium yang sangat rendah sehingga kitosan dapat dimanfaatkan sebagai bahan tambahan pada makanan. Darmono (1999) menyatakan bahwa kadmium adalah logam non-esenssial yang
sering mencemari lingkungan dan mengakibatkan toksik pada hewan dan manusia. Sifatnya mudah terakumulasi dalam jaringan tanaman dan hewan.
Tembaga
Tembaga (Cu) merupakan salah satu logam non-ferrous yang paling
penting dan banyak dipakai mulai dari industri sederhana sampai industri berteknologi tinggi. Tembaga adalah bahan penting yang sangat diperlukan dalam berbagai aplikasi karena sifat fisik dan mekanis termasuk konduktivitas listrik dan panas yang luar biasa tinggi, ketahanan terhadap korosi yang tinggi, dan mempunyai kemampuan las yang baik. Banyak penelitian yang telah dilakukan pada tembaga baik secara mikroskopik maupun makroskopik (Arifin 2007).
Hasil pengukuran kandungan tembaga pada kitosan 0,01105±1,7320 ppm. Nilai yang diperoleh menunjukkan bahwa kitosan memiliki kandungan tembaga yang rendah hal ini dikarenakan tidak adanya aktivitas industri di sekitar perairan yang menghasilkan buangan sehingga kitosan dapat dimanfaatkan sebagai bahan tambahan pada makanan dan nutraseutika. Hendri et al. (2010) menyatakan
dalam pembentukan heamosianin sistem darah dan enzimatik hewan air. Logam tembaga dibutuhkan organisme laut untuk pertumbuhan dan perkembangan hidupnya sebagai kofaktor kerja enzim. Akan tetapi bila jumlah tembaga yang masuk ke dalam tubuh secara berlebihan maka akan berubah fungsi menjadi racun bagi tubuh organisme tersebut.
Timbal
Timbal atau dalam keseharian lebih dikenal dengan nama timah hitam, dalam bahasa ilmiahnya dinamakan Plumbum, logam ini disimbolkan dengan Pb. Timbal merupakan salah satu logam berat yang mencemari lingkungan terutama yang berasal dari gas buangan kendaraan bermotor. Timbal ditambahkan sebagai bahan adiktif bensin dalam bentuk timbal organik (Hobbelen et al. 2004).
Hasil pengukuran kandungan timbal pada kitosan 0,00316±2,3094 ppm. Nilai ini masih berada di bawah standar yang direkomendasikan BPOM (2007) <5 ppm; EFSA (2010) 0,250 ppm; GRAS (2012) 0,100 ppm. Hasil yang diperoleh menunjukkan bahwa kitosan memiliki kandungan timbal yang sangat rendah sehingga kitosan dapat dimanfaatkan sebagai bahan tambahan pada makanan. Kandungan timbal pada kitosan dapat terdeteksi dengan adanya akumulasi timbal pada pembakaran kendaraan bermotor yang menyebabkan terjadinya peningkatan gas emisi buang yang menggandung timbal. Gas emisi yang dihasilkan akan mencemari tanaman. Darmono (2001) menunjukkan toksisitas akut pada sapi yang mengalami keracunan timbal dengan pemberian pakan yang mengandung timbal yang berbeda. Akumulasi timbal terjadi pada jaringan hati, ginjal, dan otot hewan percobaan.
Arsen
Arsen (As) merupakan salah satu logam berat yang digunakan dalam kehidupan manusia. Arsen adalah suatu unsur kimia metaloid (Herman 2006). Logam arsen sebenarnya tidak beracun hanya saja bila dikonsumsi dalam jumlah yang banyak dapat menjadi beracun. Hal ini dipengaruhi oleh respirasi seluler dengan mengkombinasikan dengan beberapa sulfihidril dari enzim mitokondrial, oksidasi piruvat, dan fosfatase tertentu (Lubis dan Aman 2006).
Hasil pengukuran kandungan As pada kitosan 0,00098±1,7320 ppm. Nilai ini masih berada di bawah standar yang rekomendasikan BPOM (2007) <5 ppm; EFSA (2010) 0,250 ppm; FDA (2012) 0,100 ppm. Hasil yang diperoleh menunjukkan bahwa kitosan memiliki kandungan As yang cukup rendah sehingga kitosan dapat dimanfaatkan sebagai bahan tambahan pada makanan. Kadar logam arsen yang rendah diduga karena tidak adanya aktivitas industri pertambangan yang membuang limbah ke perairan sekitar tempat pengambilan sampel. Kitong et al. (2012) menyatakan bahwa konsentrasi alami arsen dalam sedimen
Simpulan
Berdasarkan hasil karakteristik kitosan limbah kulit udang windu maka dapat disimpulkan bahwa rendemen yang diperoleh pada penelitian ini sebesar 14%. Kitosan mengandung kadar air 12,29%; kadar abu 0,99%; kadar lemak 3,13%; kadar nitrogen 2,20%; karbohidrat 81,39%; viskositas 1.713,04 cPs; dan derajat deasetilasi 98,65%. Analisis kandungan logam berat merkuri 0,00001±2,7735 ppm; kadmium 0,00079±3,4641 ppm; tembaga 0,01105±1,7320 ppm; timbal 0,00316±2,3094 ppm; dan arsen 0,00098±1,7320 ppm masih berada di bawah standar sebagai bahan tambahan pangan dan nutraseutika.
Saran
Diperlukan pengembangan metode cut processing dalam ekstraksi kitosan
3 PENERAPAN METODE HIDROLISIS BERTEKANAN
PADA
PRODUKSI GLUKOSAMIN
Latar Belakang
Glukosamin adalah salah satu turunan dari kitosan dan merupakan gula amino dan prekursor penting dalam sintesis biokimia dari protein glikolisis dan
lipid (Kelly 1998). Glukosamin hidroklorida memiliki nama lain yakni 2-amino-2-deoksi-D-glukosa, kitosamin hidroklorida, dan D-(+)-glukosamin
hidroklorida. Secara struktural, glukosamin merupakan gula beramin dengan rumus molekul C6H13NO5HCl dengan berat molekul 215,63 kDa. Glukosamin dalam bentuk murni umumnya berbentuk serbuk kristal putih dengan titik leleh 190-194 ºC. Glukosamin memiliki tingkat kelarutan yang tinggi dalam air dengan titik larut 100 mg/mL pada suhu 20 ºC (Kralovec dan Barrow 2008).
Glukosamin dapat dihasilkan dengan beberapa metode ekstraksi yakni proses kimiawi, proses enzimatis, proses fermentasi, dan proses gabungan antara ketiganya. Ekstraksi secara kimiawi menghasilkan rendeman 87,3% (Mojarrad
et al. 2007); 45,64±1,95% (Afridina 2011); 51,04% (Rismawan 2012); 68,91%
(Sibi et al. 2013). Secara enzimatis menghasilkan rendemen 50% (Cui et al.
2006); 0,19 g/15 jam (Hsieh et al. 2007); 42% (Jamailahmadi et al. 2011); 91,1%
(Pan et al. 2011), 42% (Wu 2011). Secara fermentasi menghasilkan rendemen
5,48% (Chang et al. 2011); 7,86% (Sitanggang et al. 2012). Kombinasi ekstraksi
secara enzimatis dan kimiawi menghasilkan rendemen 11,7% (Nwe et al. 2002).
Pada ekstraksi glukosamin dengan menerapkan metode hidrolisis bertekanan dengan autoklaf menghasilkan rendemen sebesar 69,80%, loss on drying sebesar
0,92%, dan titik leleh 190-192 ºC (Ernawati 2012).
Proses ekstraksi yang umum dilakukan pada produksi glukosamin skala industri adalah proses hidrolisis kimiawi dengan kombinasi asam HCl dan basa NaOH pada konsentrasi tertentu. Kajian tentang ekstraksi glukosamin secara kimiawi dengan penerapan metode hidrolisis bertekanan perlu dilakukan untuk mengoptimalkan konsentrasi asam HCl dan waktu pemanasan. Penerapan metode ini tidak dapat mengontrol suhu dan tekanan selama proses ekstraksi. Hasil penelitian yang diharapkan adalah memperoleh metode produksi glukosamin hidroklorida yang efektif dan efisien baik dari segi kualitas dan kuantitas, waktu ekstraksi, biaya produksi, dan tingkat keamanan.Penelitian ini bermanfaat dalam pengembangan ilmu pengetahuan dan teknologi.
Tujuan Penelitian
Bahan dan Metode
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret sampai Juni 2014. Bertempat di Laboratorium Diversifikasi dan Pengembangan Produk Hasil Perairan, Laboratoriam Biokimia Hasil Perairan, Laboratorium Karakteristik Bahan Baku Hasil Perairan Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Pengujian Hasil Hutan Fakultas Kehutanan dan Laboratorium Pusat Studi Biofarmaka Institut Pertanian Bogor.
Bahan dan Alat
Bahan baku yang digunakan dalam penelitian ini adalah kitosan limbah udang windu (Panaeus monodon) dari Tahap 1, asam klorida (HCl) 5%, 8% dan
10%, isopropil alkohol (IPA). Bahan pendukung lainnya untuk analisis spesifikasi glukosamin antara lain akuades, K2SO4 pekat 1 mL.
Alat yang digunakan antara lain presto stainless steel (Vicenza), kompor
gas (Hitachi), timbangan digital (Quattro), jar, dan gelas ukur (Pyrex). Alat yang
digunakan untuk analisis spesifikasi glukosamin antara lain oven listrik (Yamato DV 41), tanur listrik (Yamato), desikator (Pyrex Duran), cawan petri (Pyrex), cawan porselin, gegep, gelas piala 200 mL (Pyrex), termometer, kertas saring, pipet tetes (Pyrex), tabung reaksi (Pyrex), labu takar (Pyrex), pH meter (Hanna), seperangkat alat Fourier Transform Infrared Spectroscopy (FTIR), dan Atomic Absorption Spektrofotometer (AAS).
Tahap Penelitian
Pada penelitian pendahuluan dalam pembuatan glukosamin dengan menggunakan presto tekanan ±0,8-1 Atm/psi pada perlakuan konsentrasi asam HCl 3%, 4%, dan 5% b/v dan waktu pemanasan selama 30 menit. Hasil yang diperoleh menunjukkan bahwa konsentrasi HCl 5% mampu menghidrolisis kitosan menjadi glukosamin sacara sempurna. Konsentrasi HCl 3% dan 4% belum mampu menghidrolisis kitosan menjadi glukosamin secara sempurna. Berdasarkan hal tersebut pada penelitian utama menggunakan konsentrasi HCl 5%, 8%, dan 10% dan waktu pemanasan hingga 150 menit diharapkan mampu menghasilkan glukosamin dengan kualitas yang baik.
Pada penelitian utama proses pembuatan glukosamin metode hidrolisis bertekanan dengan tekanan ±0,8-1 Atm/psi menggunakan presto dengan perlakuan konsentrasi HCl 5%, 8%, dan 10% b/v dan waktu pemanasan 30, 60, 90, 120, dan 150 menit. Sampel diekstraksi dalam jar dengan berbagai konsentrasi
Gambar 3 Pembuatan glukosamin dengan metode hidrolisis bertekanan
Rendemen Glukosamin (AOAC 2005)
Rendemen merupakan salah satu parameter penting dalam mengetahui berat akhir suatu bahan setelah proses produksi. Persentase (%) berat glukosamin dari kitosan dihitung dengan rumus:
Uji Kelarutan (Ernawati 2013)
Kelarutan merupakan salah satu cara yang paling mudah dilakukan untuk mengetahui sampel sebagai glukosa atau glukosamin. Uji ini dilakukan dengan cara melarutkan sampel glukosamin dalam air. Sebanyak 100 mg sampel dilarutkan dalam 1 mL air dingin bersuhu 24 ºC sehingga sampel larut sempurna.
Derajat Keasaman (SNI 06-6989.11:2004)
Salah satu parameter yang ditetapkan dalam penentuan standar mutu glukosamin adalah pH atau derajat keasamannya. Pengukuran pH adalah pengukuran banyaknya ion H+ pada suatu larutan. Cara determinasi pH glukosamin menggunakan pH meter dengan cara menimbang sebanyak 1 gram sempel selanjutnya dituangkan ke gelas piala 40 mL yang telah berisi air dan mengukur tingkat keasamannya pada suhu 25 °C menggunakan pH meter.
Kitosan
Konsentrasi HCl 5, 8, dan 10% waktu pemanasan 30, 60, 90, 120, dan 150 menit
Tekanan ±0,8-1 Atm/psi
Penetralan pH 3-5
Analisis:
Kelarutan (Ernawati 2013) pH (SNI 2004)
Loss on drying
(Ileleji et al. 2010)
Loss on Ignition (Santisteban et al. 2004)
Derajat deasetilasi
(Swann dan Patwardhan 2011) Logam berat (SNI 2013) Glukosamin
Loss on Drying (Ileleji et al. 2010)
Timbang 1 gram sampel glukosamin (W1). Cawan perti yang berisi sampel dimasukkan ke dalam oven dengan suhu 105 ºC selama 3 jam. Sampel yang telah dipanaskan ditimbang kembali (W2). Bobot yang hilang selama pemanasan (loss on drying) dihitung dengan persamaan berikut:
Keterangan:
W1: Bobot sampel awal sebelum dioven W2: Bobot sampel setelah dioven
Loss on Ignition(Santisteban et al. 2004)
Residu pengapian dilakukan untuk mengukur berat sisa dari sampel ketika asam sulfat ditambahkan ke dalam sampel dan dinyalakan. Pengukuran residu pengapian dilakukan sebagai berikut: Cawan porselin dipanaskan dalam tanur listrik suhu 600 °C selama 30 menit. Cawan porselin ditimbang secara akurat dengan menggunakan timbangan analitik (B).Sebanyak 1 gram sampel ditimbang (C). Sebanyak 1 mL asam sulfat ditambahkan ke dalam sampel selanjutnya dipanaskan dengan bunsen gas menggunakan api kecil sampai sampel hangus
terbakar secara menyeluruh. Sebanyak 1 mL asam sulfat ditambahkan pada sampel hangus sampai merata. Sampel dipanaskan kembali dengan api sedang sampai mengeluarkan asap putih. Sampel dimasukkan ke dalam tahur listrik pada suhu 600 °C selama 2 jam. Sampel ditimbang untuk mengetahui residu dari pembakaran (A). Perhitungan Loss on Ingition dengan rumus:
A: berat wadah dan residu setelah pemanasan B: berat wadah kosong
C: berat sampel
Derajat Deasetilasi (Swann dan Patwardhan 2011)
Pengujian Fourier Transform Infrared Spectroscopy (FTIR) digunakan
untuk menganalisis gugus fungsi dengan cara menentukan hasil spektrum bahan dengan serapan energi molekul organik melalui sinar Infrared. Sinar infrared
digunakan untuk menentukan setiap gugus dalam molekul bahan. Setiap molekul memiliki serapan infrared yang berbeda-beda umumnya disajikan dalam bentuk
panjang gelombang antara 450-4.000 cm‾1. Tahapan dari analisis derajat deasetilasi sebagai berikut: Sampel uji yang disiapkan berupa garam rangkap dan garam kompleks. Sebanyak 1 mg garam rangkap CuSO4(NH3)2SO4 6H2O ditimbang dan dihaluskan bersamaan dengan 200 mg KBr menggunakan mortar hingga halus. Campuran bahan tersebut dibentuk pelet menggunakan alat
press dan pre-vakum selama 2-3 menit. Bahan pelet selanjutnya dipres kembali
menggunakan pompa hidrolik dengan mengatur tekanannya menjadi 80 KN selama 5 menit. Pelet yang telah siap dimasukkan ke dalam hollder pada lintasan
grafik atau spektrum yang terbentuk. Data yang dihasilkan disimpan dan dilakukan pembahasan terhadap puncak-puncak yang terbentuk.
Logam Berat (SNI 7853:2013)
Penetapan kadar logam secara kuantitas dilakukan dengan Atomic Absorption Spectrophotometer (AAS). Unsur logam dilepaskan dari matriks
bahan dengan cara destruksi atau pengabuan menggunakan microwave. Hasil
destruksi diautomisasi dengan graphite furnace (GF). Atom dari unsur tersebut
berinteraksi dengan sinar lampu katoda (jenis logam) yang sesuai. Interaksi yang terjadi berupa serapan yang besarnya dapat dilihat dalam tampilan monitor AAS. Jumlah serapan sebanding dengan konsentrasi unsur logam. Pengujian kadar logam dilakukan dengan menimbang sampel sebanyak 5 gram. Sampel dimasukkan ke dalam beaker teflon secara merata agar mengalami proses
pengeringan sempurna. Sampel dikeringkan kembali ke dalam oven pada suhu 105 ºC selama 24 jam. Sampel yang telah mengering selanjutnya dihaluskan hingga berbentuk bubuk. Sebanyak 4 gram sampel bubuk ditimbang dengan menggunakan timbangan digital. Sampel dimasukkan ke dalam beaker teflon.
Sebanyak 5 mL larutan aqua regia (percampuran HCl dan HNO3 pekat dengan perbandingan 3:1 v/v) ditambahkan pada sampel dan dipanaskan pada suhu 130 °C hingga mengering. Sampel yang telah kering dipindahkan ke dalam sentrifus polietilen. Sebanyak 30 mL akuades ditambahkan ke dalam sampel dan dibiarkan mengendap. Fase cair dari sampel ditampung untuk diukur kadar logam dengan menggunakan Atomic Absorption Spektrofotometer (AAS) asetilen. Kadar
logam berat dihitung dengan rumus:
Keterangan:
D : Kadar contoh µg/L dari hasil pembacaan ASS
E : Kadar blangko contoh µg/L dari hasil pembacaan ASS W : Berat contoh (gram)
V : Volume akhir larutan contoh yang disiapkan (mL) P : Faktor pengencer
Analisa Data
Yijk= μ + αi+ βj+ (αβ)ij+ εijk
Keterangan:
Yij : Respon pada perlakuan k dengan kombinasi perlakuan taraf ke-i pada A dan
taraf ke-j pada B. µ : Rataan umum
i : Pengaruh perlakuan ke-i pada A i : Pengaruh perlakuan ke-j pada B
(αβ)ij : Pengaruh perlakuan taraf ke-i dari faktor A, dan taraf ke-j dari faktor B Ԑij : Galat percobaan perlakuan k dengan kombinasi rata ke-i dan ke-j
Hipotesis yang diuji adalah sebagai berikut:
H0 : Interaksi antara konsentrasi asam (Faktor A) dan waktu pemanasan (Faktor B)
tidak memberikan pengaruh terhadap mutu glukosamin.
H1 : Interaksi antara konsentrasi asam (Faktor A) dan waktu pemanasan (Faktor B)
memberikan pengaruh terhadap mutu glukosamin.
Gambar 4 Rendemenglukosamin. Waktu pemanasan 30 menit, 60 menit, 90 menit, 120 menit, dan 150 menit. Angka-angka yang diikuti huruf superskrip berbeda menunjukkan berbeda nyata (p<0,05).
Hasil dan Pembahasan
Proses pembuatan glukosamin hidroklorida (GlcN HCl) pada penelitian pendahuluan menerapkan sistem hidrolisis bertekanan dengan menggunakan presto. Proses ini memiliki prinsip yang sama dengan Ernawati (2013) dimana hidrolisis glukosamin dengan autoklaf dapat mengontrol suhu dan tekanan. Berdasarkan hasil penelitian pendahuluan sampel kitosan dihidrolisis dengan perlakuan konsentrasi HCl 3%, 4%, dan 5% dengan waktu pemanasan 30 menit. Indikator yang digunakan untuk menentukan keberhasilan hidrolisis kitosan menjadi glukosamin dapat dilihat pada Tabel 4.
Tabel 4 Karakteristik glukosamin penelitian pendahuluan
HCl (%) Penampakan Warna Kelarutan (%) Remdemen (%) 3 Butiran Kecokelatan 53,00±1,2545 62,50±1,0530 4 Butiran Cokelat jernih 58,00±0,6418 62,80±1,0431 5 Serbuk Kuning jernih 82,00±0,8107 68,60±1,2036
Berdasarkan hasil karakteristik glukosamin pada Tabel 4 perlakuan hidrolisis dengan asam HCl 5% ditetapkan sebagai perlakuan terbaik. Hasil yang diperoleh menunjukkan bahwa konsentrasi HCl 5% mampu menghidrolisis kitosan menjadi glukosamin secara sempurna. Penggunaan konsentrasi HCl 3% dan 4% belum mampu menghidrolisis kitosan menjadi glukosamin secara sempurna. Berdasarkan data tersebet maka pada penelitian utama digunakan HCl 5%, 8%, dan 10% dan waktu pemanasan 30, 60, 90, 120 dan 150 menit diharapkan mampu menghasilkan glukosamin dengan kualitas yang baik. Parameter spesifikasi glukosamin hidroklorida meliputi rendemen, loss on drying
(LoD), nilai pH, tingkat kelarutan, loss on ignition (LoI), dan uji serapan FTIR.
Rendemen Glukosamin
Rendemen merupakan persentasi bagian tertentu yang diinginkan terhadap bagian utuh dari suatu bahan. Glukosamin yang diproduksi dengan perlakuan konsentrasi asam dan lama pemanasan berbeda dapat memotong rantai polimer pada kitosan menjadi monomer glukosamin. Rendemen glukosamin pada perlakuan konsentrasi HCl dan waktu pemanasan dapat dilihat pada Gambar 4.