AKTIVITAS ANTIOKSIDAN DAN KOMPONEN BIOAKTIF
HIDROLISAT PROTEIN JEROAN IKAN KAKAP PUTIH
(
Lates calcalifer
)
ASTI LATIFAH
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
iii
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Aktivitas Antioksidan dan Komponen Bioaktif Hidrolisat Protein Jeroan Ikan Kakap Putih (Lates calcalifer) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
v
ABSTRAK
ASTI LATIFAH Aktivitas Antioksidan dan Komponen Bioaktif Hidrolisat Protein Jeroan Ikan Kakap Putih (Lates calcalifer). Dibimbing oleh NURJANAH dan TATI NURHAYATI.
Jeroan ikan kakap putih (Lates calcalifer) merupakan limbah di perusahaan perikanan yang belum dimanfaatkan secara optimal sehingga sangat berpotensi untuk dijadikan produk hidrolisat protein. Tujuan penelitian ini adalah untuk membuat hidrolisat protein dari jeroan ikan kakap putih sebagai senyawa antioksidan. Metode yang digunakan adalah optimasi konsentrasi enzim, waktu hidrolisis, dan pH; analisis proksimat, asam amino, aktivitas antioksidan, dan uji komponen bioaktif. Kondisi aktivitas antioksidan tertinggi hidrolisat protein jeroan kakap putih yaitu pada konsentrasi enzim 0,1%, waktu hidrolisis 4 jam, dan pH 7. Produk yang dihasilkan mengandung kadar air (6,83%), abu (5,18%), protein (80,88%), lemak (0,78%), dan karbohidrat (13,15%). Produk ini terdiri dari 15 macam asam amino, yaitu 8 asam amino esensial dan 7 asam amino nonesensial. Asam glutamat merupakan asam amino dengan kadar tertinggi (8,71%), sedangkan asam amino dengan kadar terendah adalah histidina (1,38%). Produk ini menunjukkan aktivitas antioksidannya dengan nilai IC50 sebesar 1.048,40 ppm, dan mengandung 5 dari 9 komponen bioaktif, yaitu flavonoid, karbohidrat, gula pereduksi, peptida, dan asam amino bebas.
Kata kunci : antioksidan, asam amino, bioaktif, hidrolisat, protein
ABSTRACT
ASTI LATIFAH. Antioxidant Activity and Bioactive Components of Protein Hydrolysate Visceral of Barramundi (Lates calcalifer). Supervised by NURJANAH and TATI NURHAYATI.
Visceral of barramundi (Lates calcalifer) is waste in the company of fisheries which has not been optimized so that making it potentially to be the product of protein hydrolysate. The purpose of this study is to make the protein hydrolysate from visceral of barramundi as antioxidant compounds. The method used was the optimization enzyme, hydrolysis time, and pH; proximate analysis, amino acids, antioxidant activity, and bioactive components. The condition of the highest antioxidant activity of visceral barramundi protein hydrolysate on the concentration of enzyme 0.1%, hydrolysis times 4 hours, and pH 7. The result of products contain water content (6.83%), ash (5.18%), protein (80.88%), fat (0.78%), and carbohydrate (13.15%). This product consists of 15 kinds of amino acids, which that 8 are essential amino acids and 7 are nonessential amino acids. Glutamic acid is an amino acid with the highest levels (8.71%), while an amino acid with the lowest levels is histidine (1.38%). This product show the antioxidant activity with IC50 value amounting to 1 048.40 ppm, and containing 5 from 9 bioactive components, among them flavonoid, carbohydrate, reducing agent of sugar, peptide, and free amino acids.
vii
AKTIVITAS ANTIOKSIDAN DAN KOMPONEN BIOAKTIF
HIDROLISAT PROTEIN JEROAN IKAN KAKAP PUTIH
(
Lates calcalifer
)
ASTI LATIFAH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
ix
Judul Skripsi : Aktivitas Antioksidan dan Komponen Bioaktif Hidrolisat Protein Jeroan Ikan Kakap Putih (Lates calcalifer)
Nama : Asti Latifah NIM : C34090043
Program Studi : Teknologi Hasil Perairan
Disetujui oleh
Prof. Dr. Ir. Nurjanah, MS. Pembimbing I
Dr. Tati Nurhayati, S.Pi., M.Si. Pembimbing II
Diketahui oleh
Dr. Ir. Joko Santoso, M.Si. Ketua Departemen
x
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT, atas berkat rahmat dan anugerah-Nya penulis dapat menyelesaikan karya ilmiah ini. Penelitian ini dilaksanakan pada bulan Februari 2013 hingga Juli 2013 dengan judul ”Aktivitas Antioksidan dan Komponen Bioaktif Hidrolisat Protein Jeroan Ikan Kakap Putih (Lates calcalifer).”
Terima kasih penulis ucapkan kepada
1. Ibu Prof. Dr. Ir. Nurjanah, MS. dan Ibu Dr. Tati Nurhayati, S.Pi., M.Si., selaku dosen pembimbing yang telah memberikan bimbingan dan arahannya.
2. Bapak Roni Nugraha, S.Si., M.Sc., selaku dosen yang telah memberikan bimbingan.
3. Bapak Dr. Ir. Agoes. M. Jacoeb, Dipl.-Biol. selaku dosen penguji yang telah banyak memberi evaluasi dan masukan.
4. Staf dosen dan administrasi Departemen Teknologi Hasil Perairan.
5. Ayahanda Asep Hadiman dan mama Pahriatini, serta adik-adikku Muhamad Farhan dan Hani Septiani, atas segala doa, dukungan, dan kasih sayangnya. 6. Staf Laboratorium Departemen Teknologi Hasil Perairan, Ibu Ema, Mas Ipul,
Mbak Lastri, dan Mbak Dini.
7. Staf Laboratorium Pusat Antar Universitas, IPB, Ibu Ika, Ibu Eni, dan Ibu Endang.
8. Staf Laboratorium Terpadu Pascasarjana IPB, Bapak Ian.
9. Teman-teman seperjuangan Casti Hasan, Cholifah. Sahabat penyemangat, Marisky Nur Adnin, Wenny Tiara, Darsasa, dan Rika Kartika, serta teman-teman THP 46, adik-adik THP 47 dan 48 atas segala bantuan dan motivasinya. 10. Kak Yayan Firmansyah (THP 43) di PT Fega Marikultura, Tangerang, atas
segala bantuannya.
11. Kak Made Suhandana, Kak Wahyu, serta kakak-kakak S2 THP atas segala bantuan dan motivasinya.
Semoga karya ilmiah ini bermanfaat.
Bogor, November 2013
xi
Penentuan konsentrasi enzim terbaik 3
Penentuan waktu hidrolisis terbaik 5
Penentuan pH terbaik 5
Produksi hidrolisat protein jeroan ikan (Bhaskar et al. 2008 yang telah
dimodifikasi) 5
Analisis asam amino (AOAC 2005 No. 982.30E) 5
Analisis aktivitas antioksidan dengan metode DPPH (Shimada et al. 1992) 6
Uji fitokimia (Harborne 1984) 7
HASIL DAN PEMBAHASAN 8
Komposisi Kimia Jeroan Kakap Putih 8
Pemilihan Proses Pembuatan Hidrolisat Protein Jeroan Kakap Putih 10 Karakteristik Hidrolisat Protein Jeroan Kakap Putih 12 Komposisi kimia hidrolisat protein jeroan kakap putih 12 Komposisi asam amino hidrolisat protein jeroan kakap putih 15 Aktivitas antioksidan hidrolisat protein jeroan kakap putih 16 Kelompok senyawa kimia hidrolisat protein jeroan kakap putih 18
SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
DAFTAR PUSTAKA 20
xii
DAFTAR TABEL
1 Komposisi kimia jeroan kakap putih sebelum dan sesudah defatting ... 9
2 Komposisi kimia hidrolisat protein jeroan kakap putih ... 14
3 Komposisi asam amino produk hidrolisat protein jeroan kakap putih ... 15
4 Hasil uji kelompok senyawa kimia hidrolisat protein jeroan kakap putih ... 18
DAFTAR GAMBAR
1 Diagram alir prosedur kerja penelitian ... 42 Aktivitas antioksidan dengan perlakuan konsentrasi enzim ... 10
3 Aktivitas antioksidan dengan perlakuan waktu hidrolisis ... 11
4 Aktivitas antioksidan dengan perlakuan pH ... 12
5 Hubungan konsentrasi BHT dengan persen inhibisinya ... 17
6 Hubungan konsentrasi sampel hidrolisat dengan persen inhibisinya ... 17
DAFTAR LAMPIRAN
1 Diagram alir proses produksi hidrolisat protein jeroan kakap putih ... 232 Contoh perhitungan kadar asam amino produk hidrolisat protein ... 24
3 Kromatogram kurva standar asam amino ... 25
4 Kromatogram kurva produk hidrolisat protein jeroan kakap putih ... 26
5 Perhitungan persen inhibisi dan penentuan IC50 ... 28
6 Dokumentasi pengujian aktivitas antioksidan hidrolisat protein jeroan kakap putih ... 29
7 Dokumentasi pengujian kelompok senyawa kimia hidrolisat protein jeroan kakap putih ... 30
8 Tahapan produksi hidrolisat protein jeroan kakap putih ... 31
9 Dokumentasi bahan baku dan produk hidrolisat protein ... 32
1
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara yang kaya akan sumberdaya hasil perikanan dengan potensi dan produktivitas yang cukup tinggi. Potensi produksi perikanan Indonesia tahun 2010 mencapai 10,83 juta ton. Produksi perikanan pada tahun 2011 sebesar 12,39 juta ton (KKP 2012). Produksi dan usaha pengolahan perikanan menghasilkan limbah, salah satunya adalah jeroan ikan. Banyaknya ikan yang dikonsumsi juga mengakibatkan banyaknya limbah jeroan ikan yang dihasilkan, salah satunya adalah ikan kakap putih (Lates calcalifer).
Upaya untuk mengatasi dan mengurangi limbah hasil perikanan adalah dengan memanfaatkannya secara optimal. Proses pengolahan limbah hasil perikanan termasuk jeroan ikan telah diteliti sebagai sumber protein termasuk enzim dan lemak (Bhaskar et al. 2007). Salah satu aplikasinya adalah usaha pembuatan hidrolisat protein. Hidrolisat protein ikan merupakan produk yang dihasilkan dari penguraian protein ikan menjadi peptida sederhana dan asam amino melalui proses hidrolisis oleh enzim, asam, atau basa. Hidrolisis protein menggunakan enzim merupakan cara yang efisien karena dapat menghasilkan hidrolisat protein yang terhindar dari kerusakan asam amino tertentu yaitu triptofan dan glutamin (Kristinsson 2007). Salah satu enzim yang digunakan dalam pembuatan hidrolisat protein adalah enzim papain.
Koesoemawardani dan Nurainy (2009) menyatakan bahwa hidrolisat protein ikan dapat dimanfaatkan sebagai bahan tambahan pangan, yaitu hidrolisat protein ikan rucah yang diaplikasikan kedalam produk biskuit. Hidrolisat protein ikan juga memiliki aktivitas antioksidan yang bermanfaat untuk mencegah ketengikan pada makanan (Venugopal 2006). Aktivitas antioksidan sangat erat kaitannya dengan ikatan peptida yang terdapat pada protein serta asam amino yang terkandung di dalamnya. Hal ini mengacu pada hasil penelitian produk hidrolisat protein jeroan ikan Catla catla (Bhaskar et al. 2008) dan produk hidrolisat protein cumi-cumi (Fang et al. 2012). Asam amino yang terkandung didalamnya antara lain asam aspartat, treonina, serina, glutamina, prolina, glisina, alanina, valina, metionina, leusina, isoleusina, tirosina, fenilalanina, histidina, dan lainnya. Penelitian mengenai aktivitas antioksidan produk hidrolisat protein ikan dan jeroannya sudah banyak dilakukan, namun informasi mengenai hidrolisat protein jeroan ikan kakap putih yang memiliki aktivitas antioksidan belum ada sehingga penelitian ini perlu dilakukan.
Perumusan Masalah
2
Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk membuat hidrolisat protein dari jeroan ikan kakap putih sebagai senyawa antioksidan, sedangkan tujuan khususnya adalah :
1) Menentukan kondisi aktivitas antioksidan tertinggi (konsentrasi enzim, waktu hidrolisis, dan pH) hidrolisat protein jeroan ikan kakap putih
2) Menentukan karakteristik produk hidrolisat yang dihasilkan, yaitu komposisi kimia, asam amino, aktivitas antioksidan, dan kelompok senyawa kimia.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai komposisi kimia, asam amino, serta aktivitas antioksidan dan kelompok senyawa kimia (bioaktif) produk hidrolisat protein jeroan ikan kakap putih (Lates calcalifer).
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah pengambilan sampel, preparasi sampel, analisis proksimat, pemilihan proses pembuatan hidrolisat protein berdasarkan aktivitas antioksidan tertinggi, produksi hidrolisat protein, analisis komposisi kimia, asam amino, dan aktivitas antioksidan, serta uji kelompok senyawa kimia hidrolisat protein, serta analisis data.
METODE
Penelitian ini dilaksanakan pada bulan Februari hingga Juli 2013. Preparasi jeroan ikan kakap putih dan uji kelompok senyawa kimia dilakukan di Laboratorium Karakteristik Bahan Baku Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis proksimat dilakukan di Laboratorium Biologi Hewan, Pusat Antar Universitas (PAU), Institut Pertanian Bogor. Produksi hidrolisat protein dilakukan di Laboratorium Mikrobiologi dan Biokimia, Pusat Antar Universitas (PAU), Institut Pertanian Bogor. Analisis aktivitas antioksidan dilakukan di Laboratorium Bioteknologi Hasil Perairan II, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis asam amino dilakukan di Laboratorium Terpadu Pascasarjana, Institut Pertanian Bogor.
Bahan
3 senyawa kimia (fitokimia). Bahan untuk analisis asam amino yaitu HCl 6 N, larutan bufer kalium borat pH 10,4; pereaksi ortoftalaldehida (OPA), Na asetat 0,025 M, Na-EDTA, metanol 95%, tetrahidrofuran (THF), larutan brij-30 30%, larutan standar asam amino 0,5 µmol/mL. Bahan untuk analisis aktivitas antioksidan yaitu pelarut etanol, kristal 1,1-diphenyl-2-pycrlhydrazil (DPPH), dan antioksidan sintetik BHT (butylated hydroxytoluena).
Alat
Alat yang digunakan pada penelitian ini meliputi alat untuk preparasi, wadah, timbangan digital, alumunium foil, blender, sentrifuge (Himac CR 21G), waterbath shaker (Certomat), freeze dryer, kertas saring, kain belacu, kertas milipore No. 45, oven (Memmert), kompor listrik, tanur pengabuan, labu Kjeldahl, tabung Soxhlet, spektrofotometer (Spectro UV Vis 2500), inkubator (Memmert), High Performance Liquid Chromatography (HPLC) merk Shimadzu, desikator, vortex, pipet, dan alat gelas lainnya misalnya tabung reaksi, beaker glass, gelas arloji, tabung ulir, botol kaca, corong kaca, labu takar, dan labu Erlenmeyer.
Prosedur Analisis Penelitian
Penelitian ini dilakukan dalam beberapa tahap yaitu pengambilan sampel di PT Fega Marikultura, Tangerang; preparasi sampel; analisis proksimat bahan baku; pemilihan proses pembuatan hidrolisat protein berdasarkan kondisi aktivitas antioksidan tertinggi; produksi hidrolisat protein; analisis proksimat hidrolisat protein; analisis kandungan asam amino hidrolisat protein; analisis aktivitas antioksidan hidrolisat protein melalui nilai IC50; pengujian kelompok senyawa kimia. Diagram alir prosedur kerja penelitian disajikan pada Gambar 1.
Preparasi sampel
Sampel jeroan ikan kakap putih ditimbang dan dipisahkan lemaknya secara manual. Bagian jeroan yang diambil meliputi usus, lambung, hati, dan empedu kemudian dicacah dan dihomogenkan. Bahan baku kemudian dihilangkan lemaknya (defatting) menurut metode Bhaskar et al. (2008) yang dimodifikasi. Analisis proksimat
Bahan baku jeroan kakap putih sebelum dan setelah proses defatting kemudian dianalisis kandungan proksimatnya. Analisis proksimat merupakan suatu analisis yang dilakukan untuk mengetahui komposisi kimia suatu bahan yang meliputi analisis kadar air, abu, lemak, dan protein.
Penentuan konsentrasi enzim terbaik
4
Gambar 1 Diagram alir prosedur kerja penelitian
5 Penentuan waktu hidrolisis terbaik
Waktu hidrolisis yang dilakukan pada penentuan waktu hidrolisis terbaik yaitu 1 jam, 2 jam, 3 jam, 4 jam, dan 5 jam. Proses hidrolisis menggunakan enzim dengan konsentrasi terbaik tahap sebelumnya, pada suhu 55oC, dan nilai pH sebesar 7. Setiap perlakuan kemudian dianalisis aktivitas antioksidannya menurut metode Shimada et al. (1992).
Penentuan pH terbaik
Nilai pH yang digunakan pada penentuan pH terbaik yaitu pH 5, 6, 7, 8, dan 9. Proses hidrolisis menggunakan enzim dan waktu hidrolisis terbaik tahap sebelumnya, dan pada suhu 55oC. Setiap perlakuan kemudian dilakukan analisis aktivitas antioksidannya menurut metode Shimada et al. (1992).
Produksi hidrolisat protein jeroan ikan (Bhaskar et al. 2008 yang telah dimodifikasi)
Bahan baku berupa jeroan ikan dan akuades (1:1) dicampur menggunakan blender hingga homogen, kemudian dipanaskan pada suhu 85oC selama 20 menit untuk menginaktivasi enzim endogenous. Sampel kemudian disentrifuse pada suhu 10oC selama 20 menit dengan kecepatan 5.800 rpm untuk menghilangkan lemak. Hasilnya berupa lapisan lemak dan residu kaya protein. Residu kaya protein selanjutnya dicampur akuades dengan perbandingan 1:2 kemudian dihomogenkan. Nilai pH campuran diatur hingga mencapai pH tertentu (5, 6, 7, 8, dan 9) dengan menambahkan NaOH 4 M atau larutan HCl 0,1 N. Campuran tersebut ditambah enzim papain dengan konsentrasi tertentu (0%; 0,05%; 0,1%; 0,15%; 0,2%). Hidrolisis dilakukan pada suhu 55oC selama waktu tertentu (1, 2, 3, 4, dan 5 jam) menggunakan waterbath shaker.
Tahap selanjutnya setelah proses hidrolisis selesai, enzim papain diinaktivasi pada suhu 85oC selama 20 menit dengan tujuan untuk menghentikan proses hidrolisis. Sampel didinginkan, diendapkan selama 24 jam pada suhu 4oC dan disentrifuse selama 30 menit pada suhu 10oC dengan kecepatan 3.500 rpm untuk memisahkan fraksi terlarut (supernatan) dan fraksi tidak terlarut (pellet). Filtrat hidrolisat dikeringkan dengan metode freeze drying. Diagram alir proses pembuatan hidrolisat protein disajikan pada Lampiran 1.
Analisis asam amino (AOAC 2005 No. 982.30E)
Analisis asam amino dilakukan untuk mengetahui karakteristik asam amino yang terdapat pada produk. Prinsip analisis asam amino menggunakan High Performance Liquid Chromatography (HPLC) adalah memanfaatkan reaksi pra kolom gugus amino, yaitu pereaksi ortoftalaldehida (OPA) yang akan bereaksi dengan asam amino primer dalam suasana basa, mengandung merkaptoetanol membentuk senyawa yang berfluorensensi sehingga dapat dideteksi dengan detektor fluoresensi. Proses analisis asam amino menggunakan HPLC adalah sebagai berikut :
a. Preparasi sampel
6
penyaring kaca masir. Sampel kemudian dipindahkan ke labu rotary evaporator untuk dikeringkan, ditambah dengan HCl 0,01 N dan ditera sampai 5 mL, dan disaring dengan kertas milipore No. 45.
b. Analisis asam amino dengan HPLC
Larutan bufer kalium borat pH 10,4 ditambahkan ke dalam sampel dengan perbandingan 1:1 sehingga diperoleh larutan sampel yang siap dianalisis. Larutan sampel sebanyak 10 µL dicampur dengan 25 µL pereaksi ortoftalaldehida (OPA). Hal yang sama dilakukan pada larutan standar asam amino. Larutan yang telah tercampur (baik sampel maupun standar) didiamkan selama 1 menit agar derivatisasi berlangsung sempurna. Larutan standar diinjeksikan ke dalam kolom HPLC sebanyak 5 µL, lalu ditunggu sampai pemisahan semua asam amino selesai. Kondisi alat HPLC pada saat dilakukan analisis :
Kolom : Ultra techspere
Fase mobil : Larutan A (Na-asetat, Na-EDTA, metanol, THF) dan larutan B (metanol 95%, akuades) (Lampiran 2)
Detektor : Fluoresensi
Konsentrasi asam amino (µmol) dalam sampel dihitung menggunakan rumus : Konsentrasi AA (µmol) = luas puncak sampel x konsentrasi standar
luas puncak standar
Persen asam amino dalam sampel dapat dihitung dengan rumus : % AA = µmol x Mr AA x 100%
µg sampel
Analisis aktivitas antioksidan dengan metode DPPH (Shimada et al. 1992) Sampel yang diuji untuk penentuan aktivitas antioksidan tertinggi yaitu filtrat hidrolisat protein yang telah diencerkan 20 kali dengan pelarut etanol p.a. Larutan sampel yang telah dibuat, pada masing-masing perlakuan diambil sebanyak 1,5 mL dan direaksikan dengan 1,5 mL larutan DPPH 0,1 mM dalam tabung reaksi. Campuran kemudian divortex dan diinkubasi pada suhu 37oC selama 30 menit dan diukur absorbansinya pada panjang gelombang 517 nm untuk mengetahui persen inhibisinya.
Produk yang diuji aktivitas antioksidannya merupakan hidrolisat protein yang telah dikeringkan. Hidrolisat protein dilarutkan dalam pelarut etanol p.a dengan konsentrasi 500, 1.000, 1.500, dan 2.000 ppm. Antioksidan BHT digunakan sebagai pembanding dan kontrol positif, dibuat dengan cara dilarutkan dalam pelarut etanol p.a dengan konsentrasi 2, 4, 6, dan 8 ppm. Larutan sampel dan larutan antioksidan pembanding yang telah dibuat masing-masing diambil sebanyak 1,5 mL dan direaksikan dengan 1,5 mL larutan DPPH 0,1 mM dalam tabung reaksi. Campuran kemudian divortex dan diinkubasi pada suhu 37oC selama 30 menit. Larutan diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 517 nm. Absorbansi larutan blanko juga diukur untuk melakukan perhitungan persen inhibisi.
7 % inhibisi = absorbansi blanko – absorbansi sampel x 100%
absorbansi blanko
Nilai konsentrasi sampel (sampel dan pembanding) dan persen inhibisinya diplot masing-masing pada sumbu x dan y pada persamaan regresi linear. Persamaan regresi linear yang diperoleh dalam bentuk y = a + bx, digunakan untuk mencari nilai IC50 (Inhibitor Concentration 50%) dari masing-masing sampel dengan menyatakan nilai y sebesar 50 dan nilai x yang akan diperoleh sebagai nilai IC50. Nilai IC50 menyatakan besarnya konsentrasi larutan sampel yang dibutuhkan untuk mereduksi radikal bebas DPPH sebesar 50%.
Uji fitokimia (Harborne 1984)
Uji fitokimia dilakukan untuk mengetahui ada tidaknya kelompok senyawa kimia (bioaktif) yang terdapat pada sampel yang memiliki aktivitas antioksidan. Uji fitokimia meliputi uji alkaloid, uji steroid/triterpenoid, flavonoid, saponin, fenol hidrokuinon, molisch, benedict, biuret, dan ninhidrin. Metode uji ini berdasarkan Harborne (1984).
a. Alkaloid
Sampel sebanyak 1 mg dilarutkan dalam beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid, yaitu pereaksi Meyer, pereaksi Wagner, dan pereaksi Dragendorff. Hasil uji dinyatakan positif bila dengan pereaksi Meyer terbentuk endapan putih kekuningan, endapan coklat dengan pereaksi Wagner, dan endapan merah jingga dengan pereaksi Dragendorff.
b. Steroid/triterpenoid
Sampel sebanyak 1 mg dilarutkan dalam 2 mL kloroform dalam tabung reaksi yang kering. Lalu ke dalamnya ditambahkan 10 tetes anhidrida asetat dan 3 tetes asam sulfat pekat. Larutan merah yang terbentuk untuk pertama kali kemudian berubah menjadi biru dan hijau menunjukkan reaksi positif.
c. Flavonoid
Sampel sebanyak 1 mg ditambah serbuk magnesium 0,1 mg dan 0,4 mL amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang sama) dan 4 mL alkohol kemudian campuran dikocok. Warna merah, kuning, atau jingga yang terbentuk pada lapisan amil alkohol menunjukkan adanya flavonoid. d. Saponin (uji busa)
Saponin dapat dideteksi dengan uji busa dalam air panas. Sampel sebanyak 1 mg dalam tabung reaksi dipanaskan dalam air mendidih. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan adanya saponin.
e. Fenol hidrokuinon
Sebanyak 1 gram sampel diekstrak dengan 20 mL etanol 70%. Larutan yang dihasilkan diambil sebanyak 1 mL kemudian ditambah 2 tetes larutan FeCl3 5%. Warna hijau atau hijau biru yang terbentuk menunjukkan adanya senyawa fenol dalam bahan.
f. Uji Molisch
8
karbohidrat ditandai dengan terbentuknya kompleks berwarna ungu diantara dua lapisan cairan.
g. Uji Benedict
Larutan sampel sebanyak 8 tetes dimasukkan ke dalam 5 mL pereaksi Benedict. Campuran dikocok dan dididihkan selama 5 menit. Terbentuknya warna hijau, kuning, atau endapan merah bata menunjukkan adanya gula pereduksi. h. Uji Biuret
Larutan sampel sebanyak 1 mL ditambah 4 mL pereaksi Biuret. Campuran dikocok dengan seksama. Larutan berwarna ungu yang terbentuk menunjukkan hasil uji positif adanya peptida.
i. Uji Ninhidrin
Larutan sampel sebanyak 2 mL ditambah beberapa tetes larutan Ninhidrin 0,1%. Campuran dipanaskan dalam penangas air selama 10 menit. Larutan berwarna biru yang terbentuk menunjukkan reaksi positif terhadap adanya asam amino.
HASIL DAN PEMBAHASAN
Komposisi Kimia Jeroan Kakap Putih
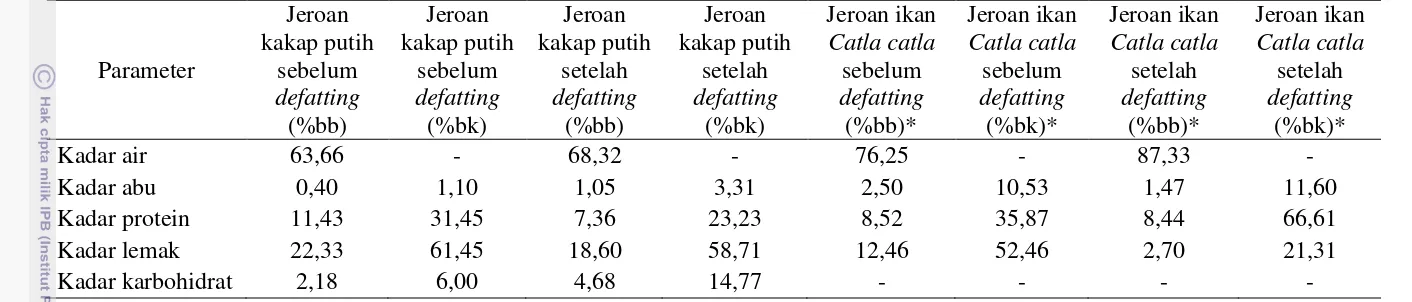
Sampel yang digunakan untuk pembuatan hidrolisat protein merupakan bahan baku yang telah melalui proses penghilangan lemak (defatting). Komposisi kimia jeroan ikan kakap putih sebelum dan sesudah proses defatting disajikan pada Tabel 1.
Tabel 1 menunjukkan komposisi kimia jeroan kakap putih sebelum dan sesudah proses penghilangan lemak (defatting). Kadar air jeroan kakap putih meningkat sebesar 4,66% setelah proses defatting (basis basah). Hasil ini juga sesuai dengan penelitian Bhaskar et al. (2008), kadar air jeroan ikan Catla catla meningkat sebesar 11,08% setelah proses defatting (basis basah), hal ini disebabkan oleh penambahan air pada proses defatting sehingga kandungan airnya meningkat.
Kadar abu jeroan kakap putih meningkat sebesar 2,21% setelah proses defatting (basis kering). Hasil ini tidak berbeda jauh dengan kadar abu jeroan ikan Catla catla yang mengalami peningkatan sebesar 1,07%. Sebagian besar bahan makanan, yaitu sebesar 96% terdiri dari bahan organik dan air, sisanya terdiri dari unsur-unsur mineral. Unsur mineral dikenal sebagai bahan anorganik atau kadar abu (Winarno 2008).
Kadar protein jeroan kakap putih menurun sebesar 8,22% setelah proses defatting (basis kering). Hasil ini bertolak belakang dengan penelitian Bhaskar et
al. (2008) yaitu kadar protein jeroan ikan Catla catla meningkat sebesar 30,74%
9
Tabel 1 Komposisi kimia jeroan kakap putih sebelum dan sesudah defatting
10
Kadar lemak jeroan kakap putih menurun sebesar 2,74% setelah proses defatting (basis kering). Hasil penelitian Bhaskar et al. (2008), kadar lemak jeroan ikan Catla catla menurun sebesar 31,15%. Hasil penelitian menunjukkan bahwa proses defatting pada jeroan ikan kakap putih ini kurang efektif. Faktor yang menyebabkan proses penghilangan lemak (defatting) kurang efektif yaitu jeroan ikan kakap putih belum tercacah menjadi ukuran yang lebih kecil dan belum terhomogenisasi; pada metode defatting, proses sentrifugasi yang dilakukan hanya satu kali sedangkan pada metode Bhaskar et al. (2008) jeroan ikan disentrifugasi sebanyak dua kali. Hasil penelitian menunjukkan bahwa persentase penurunan lemak jeroan ikan kakap putih lebih rendah dibandingkan dengan penurunan lemak jeroan ikan Catla catla.
Pemilihan Proses Pembuatan Hidrolisat Protein Jeroan Kakap Putih
Hidrolisat protein ikan merupakan produk yang dihasilkan dari penguraian protein ikan menjadi peptida sederhana dan asam amino melalui proses hidrolisis oleh enzim, asam, atau basa. Hidrolisis protein menggunakan enzim merupakan cara yang efisien karena dapat menghasilkan hidrolisat yang terhindar dari kerusakan asam amino tertentu (Kristinsson 2007).
Aktivitas antioksidan sangat erat kaitannya dengan ikatan peptida yang terdapat pada protein, serta asam amino yang terkandung didalamnya. Penelitian ini dilakukan untuk mencari aktivitas antioksidan tertinggi terhadap perlakuan konsentrasi enzim, waktu, dan pH. Aktivitas antioksidan dengan perlakuan konsentrasi enzim disajikan pada Gambar 2.
Gambar 2 Aktivitas antioksidan dengan perlakuan konsentrasi enzim Hasil analisis deskriptif menunjukkan aktivitas antioksidan tertinggi yang dihasilkan sebesar 54,85% pada perlakuan penambahan enzim sebesar 0,1%. Hasil penelitian Luo et al. (2013) menunjukkan aktivitas antioksidan optimum produk hidrolisat protein ikan hiu (Sphyrna lewini) sebesar 80,75% pada penambahan enzim papain sebesar 1,0%. Kecepatan aktivitas katalitik enzim pada hidrolisis substrat akan semakin naik dan akhirnya akan mencapai suatu batas
11 maksimum dan setelah batas ini terlampaui, kecepatan reaksi tetap meningkat tetapi dengan nilai yang semakin kecil. Pada kondisi tersebut enzim menjadi jenuh oleh substratnya dan tidak dapat berfungsi lebih cepat (Lehninger 1993). Berdasarkan hasil analisis deskriptif diduga bahwa kerja enzim yang optimum menghasilkan aktivitas antioksidan tertinggi yaitu pada konsentrasi 0,1%.
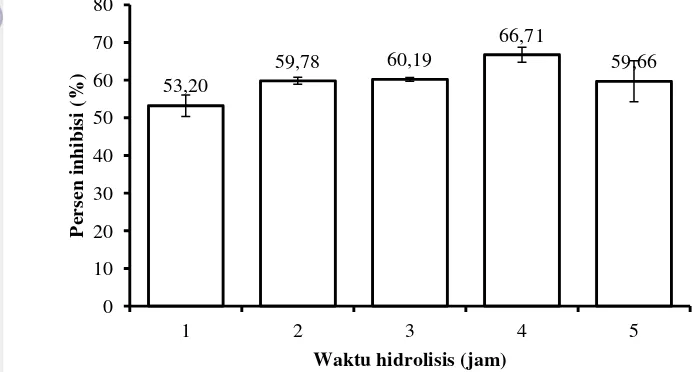
Kondisi hidrolisis umumnya dipengaruhi oleh konsentrasi substrat, konsentrasi enzim, suhu, pH, dan waktu (Muchtadi et al. 1992). Aktivitas antioksidan dengan perlakuan waktu hidrolisis disajikan pada Gambar 3.
Gambar 3 Aktivitas antioksidan dengan perlakuan waktu hidrolisis
Hasil analisis deskriptif menunjukkan aktivitas antioksidan tertinggi yang dihasilkan sebesar 66,71% pada perlakuan waktu hidrolisis selama 4 jam. Hasil penelitian Luo et al. (2013) menunjukkan aktivitas antioksidan optimum produk hidrolisat protein ikan hiu (Sphyrna lewini) sebesar 76,51% pada waktu hidrolisis selama 2 jam. Gambar 3 menunjukkan bahwa semakin lama waktu hidrolisis berlangsung semakin tinggi aktivitas antioksidan yang dihasilkan namun mulai menurun ketika waktu hidrolisis mencapai 5 jam.
Enzim papain merupakan salah satu protease. Sesuai dengan fungsinya, protease mengkatalisis proses hidrolisis protein menjadi peptida dan asam amino. Selama hidrolisis, protease menghidrolisis substrat dengan kecepatan tertentu. Nilai kecepatan hidrolisis selain dipengaruhi konsentrasi enzim, juga dipengaruhi oleh waktu hidrolisis. Semakin lama waktu yang digunakan maka proses hidrolisis berjalan lebih sempurna (Gesualdo dan Li-Chan 1999). Selain itu nilai pH juga berpengaruh dalam proses hidrolisis. Aktivitas antioksidan dengan perlakuan nilai pH disajikan pada Gambar 4.
Hasil analisis deskriptif menunjukkan aktivitas antioksidan tertinggi yang dihasilkan sebesar 78,67% pada perlakuan pH netral (7,00). Hasil penelitian Luo et al. (2013) menunjukkan aktivitas antioksidan optimum produk hidrolisat protein ikan hiu (Sphyrna lewini) yang dihasilkan sebesar 84,76% pada perlakuan pH 6. Aktivitas antioksidan mulai menurun pada pH 8. Hidrolisis protein dan peptida sederhana dengan asam atau alkali menghasilkan campuran asam amino bebas (Shahidi et al. 1995).
12
Gambar 4 Aktivitas antioksidan dengan perlakuan pH
Setiap jenis protein menghasilkan campuran atau proporsi jenis-jenis asam amino yang khas setelah hidrolisis (Lehninger 1993). Pemecahan oleh papain maksimum pada pH 7,0 untuk menghasilkan kelarutan dan aktivitas antioksidan yang baik.
Karakteristik Hidrolisat Protein Jeroan Kakap Putih
Hidrolisat protein jeroan kakap putih yang dihasilkan berbentuk serbuk yang telah dikeringkan dengan metode freeze drying dan berwarna kekuningan. Hidrolisat protein yang dihasilkan kemudian dianalisis proksimat, asam amino, aktivitas antioksidan, dan uji kelompok senyawa kimia.
Komposisi kimia hidrolisat protein jeroan kakap putih
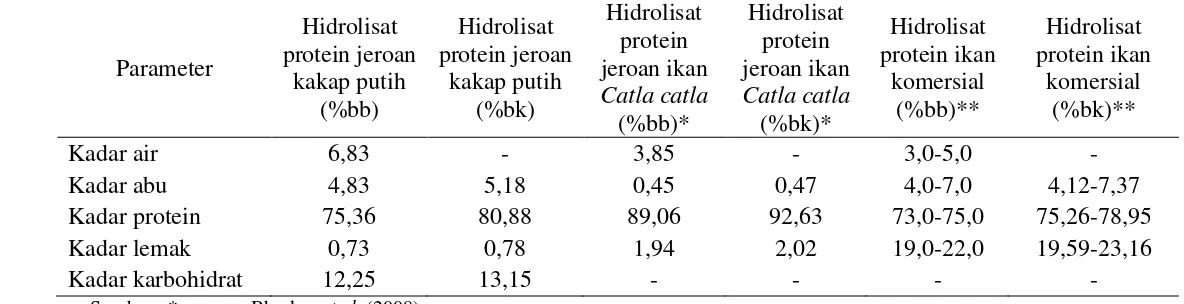
Analisis proksimat penting dilakukan untuk mengetahui karakteristik kimia produk hidrolisat protein yang dihasilkan. Komposisi kimia hidrolisat protein jeroan kakap putih disajikan pada Tabel 2.
Kadar air yang terkandung dalam hidrolisat protein jeroan kakap putih (6,83%) menunjukkan nilai yang lebih tinggi dibandingkan dengan kadar air hidrolisat protein jeroan ikan Catla catla (3,85%) dan hidrolisat protein ikan komersial (3,0-5,0%) (basis basah). Perbedaan kadar air ini disebabkan oleh perbedaan metode pengeringan. Upaya untuk memperpanjang daya tahan suatu bahan, sebagian air dalam bahan harus dihilangkan dengan beberapa cara tergantung dari jenis bahan. Pengeringan dapat dilakukan dengan penjemuran atau alat pengering buatan. Hidrolisat protein jeroan kakap putih dikeringkan menggunakan metode freeze drying. Pengeringan hidrolisat protein menggunakan metode freeze drying dapat mencapai kadar air yang sangat rendah dengan risiko kerusakan protein yang kecil karena proses pengeringan terjadi pada suhu yang sangat rendah.
Kadar abu hidrolisat protein jeroan kakap putih sebesar 5,18%, menunjukkan nilai yang lebih tinggi dibandingkan dengan kadar abu hidrolisat protein jeroan ikan Catla catla (0,47%), dan termasuk ke dalam rentang kadar abu
13 pada hidrolisat protein ikan komersial (4,12-7,37%) (basis kering). Kadar abu yang tinggi pada produk hidrolisat protein jeroan kakap putih disebabkan oleh penambahan senyawa alkali, misal NaOH, dan atau senyawa asam misal HCl dalam proses hidrolisis protein, hal ini bertujuan untuk menentukan nilai pH optimum enzim dan menjaga agar nilai pH tetap konstan. Gesualdo dan Li-Chan (1999) menyatakan bahwa pencampuran senyawa asam dan alkali dalam larutan hidrolisat protein akan menyebabkan terbentuknya senyawa garam, sehingga kandungan kadar abunya tinggi pada hidrolisat protein.
Kadar protein hidrolisat protein jeroan kakap putih sebesar 80,88%, menunjukkan nilai yang lebih rendah dibandingkan dengan kadar protein hidrolisat protein jeroan ikan Catla catla (92,63%), namun kadarnya lebih tinggi dibandingkan dengan kadar protein hidrolisat protein ikan komersial (78,95%) (basis kering). Kandungan protein pada produk hidrolisat yang dihasilkan menunjukkan nilai yang lebih tinggi daripada bahan baku awal yang digunakan (23,23%) (basis kering), hal ini disebabkan adanya penambahan enzim papain pada proses hidrolisis sehingga jumlah protein pada produk hidrolisat akan meningkat. Enzim merupakan senyawa protein yang berfungsi sebagai katalis biologis (Winarno 1983).
Protein yang terdapat pada produk merupakan protein terlarut sedangkan protein yang tidak larut sudah terbuang pada saat proses penyaringan. Peningkatan kandungan protein dalam produk hidrolisat disebabkan selama proses hidrolisis terjadi konversi protein yang bersifat tidak larut menjadi senyawa nitrogen yang larut, selanjutnya terurai menjadi senyawa-senyawa yang lebih sederhana, misalnya peptida dan asam amino sehingga mudah diserap oleh tubuh (Kirk dan Orthmer 1953). Perbedaan kandungan protein pada beberapa jenis hidrolisat protein ikan juga dapat disebabkan oleh adanya perbedaan kadar protein yang terkandung dalam ikan yang dijadikan bahan baku awal.
Kadar lemak hidrolisat protein jeroan kakap putih sebesar 0,78%, menunjukkan nilai yang lebih rendah dibandingkan dengan kadar lemak hidrolisat protein jeroan ikan Catla catla (2,02%) dan hidrolisat protein ikan komersial (19,59-23,16%) (basis kering). Kadar air umumnya berbanding terbalik dengan kadar lemak. Pernyataan hubungan tersebut dapat disimpulkan bahwa apabila kadar air yang terkandung pada bahan nilainya tinggi, maka kadar lemaknya semakin rendah.
Kandungan lemak pada produk hidrolisat protein jeroan kakap putih yang dihasilkan menunjukkan nilai yang lebih rendah (0,78%) daripada bahan baku awal yang digunakan (58,71%) (basis kering), hal ini disebabkan oleh proses penyaringan. Proses penyaringan yang dilakukan selama produksi hidrolisat protein yaitu dengan cara manual dan metode sentrifugasi. Penyaringan secara manual dilakukan dengan cara hidrolisat protein diendapkan selama 24 jam pada suhu 4oC untuk memisahkan bagian lemak pada produk.
Tabel 2 Komposisi kimia hidrolisat protein jeroan kakap putih
** = International Quality Ingredients (2011)
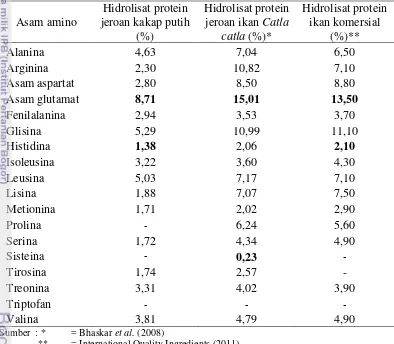
15 Komposisi asam amino hidrolisat protein jeroan kakap putih
Reaksi hidrolisis protein bertujuan untuk mengubah protein menjadi bentuk yang lebih sederhana, yaitu asam amino dan peptida melalui pemutusan ikatan peptida. Kualitas protein dapat ditentukan dengan melihat kandungan asam amino penyusunnya. Analisis asam amino bertujuan untuk mengetahui jenis dan jumlah asam amino esensial yang terkandung dalam suatu protein bahan pangan (Muchtadi 1989). Hasil analisis komposisi asam amino produk hidrolisat protein jeroan kakap putih dengan metode HPLC disajikan pada Tabel 3 dan contoh perhitungan kadar asam amino disajikan pada Lampiran 2. Kromatogram kurva standar asam amino dan produk hidrolisat disajikan pada Lampiran 3 dan 4.
Tabel 3 Komposisi asam amino produk hidrolisat protein jeroan kakap putih
Asam amino
** = International Quality Ingredients (2011)
Tabel 3 menunjukkan bahwa produk hidrolisat protein jeroan kakap putih memiliki 15 macam asam amino. Menurut Kirk dan Orthmer (1953) hidrolisis yang berjalan sempurna akan menghasilkan hidrolisat yang terdiri dari campuran 18-20 macam asam amino. Hal ini berarti proses hidrolisis yang dilakukan mendekati sempurna.
16
amino tertinggi pada asam glutamat (15,01%) dan hidrolisat protein ikan komersial (13,50%). Asam glutamat merupakan asam amino nonesensial, berperan dalam menunjang fungsi otak, mempermudah belajar dan memperkuat ingatan. Asam glutamat juga bermanfaat untuk membantu dalam meningkatkan massa otot (memperbesar otot). Asupan asam glutamat yang berlebihan (lebih dari 120 mg per kg berat badan) dapat menyebabkan kerusakan sistem syaraf sehingga dapat menimbulkan penyakit Alzheimer dan amyotrophic lateral sclerosis (The International Glutamate Information Service 2006).
Asam amino yang memiliki kandungan terendah pada hidrolisat protein jeroan kakap putih yaitu histidina sebesar 1,38%. Hasil ini juga serupa dengan hidrolisat protein ikan komersial yang memiliki kandungan asam amino terendah pada histidina (2,10%), namun pada hidrolisat protein jeroan ikan Catla catla kandungan terendah terdapat pada sisteina (0,23%). Histidina merupakan asam amino esensial yang diperlukan untuk sintesis histamin. Sisteina merupakan prekusor dari taurin (Almatsier 2006).
Asam amino yang perlu mendapat perhatian khusus bagi nutrisi protein adalah asam amino esensial. Suatu protein yang dapat menyediakan asam amino esensial dalam suatu komposisi yang hampir menyamai kebutuhan manusia pada prinsipnya mempunyai mutu yang tinggi. Produk hidrolisat protein yang dihasilkan mengandung 8 asam amino esensial yaitu histidina, treonina, metionina, valina, fenilalanina, isoleusina, leusina, dan lisina serta 7 asam amino nonesensial yaitu asam aspartat, asam glutamat, serina, glisina, arginina, alanina, dan tirosina.
Produk hidrolisat protein jeroan kakap putih ini mengandung asam-asam amino esensial yang dibutuhkan oleh tubuh, namun asam amino triptofan tidak dianalisis karena untuk menganalisis asam amino tersebut harus dengan proses hidrolisis basa, sedangkan asam amino nonesensial sisteina dan prolina tidak dianalisis karena membutuhkan metode preparasi yang berbeda. Menurut Klompong et al. (2009) asam amino dapat berpotensi sebagai antioksidan. Asam amino aromatik yaitu tirosina, histidina, dan fenilalanina, serta asam amino hidrofobik yaitu valina, alanina, prolina, dan leusina, juga metionina dilaporkan dapat menangkal senyawa radikal bebas (Rajapakse et al. 2005).
Aktivitas antioksidan hidrolisat protein jeroan kakap putih
Keberadaan senyawa antioksidan dalam suatu bahan dapat dideteksi dengan melakukan uji aktivitas antioksidan, salah satunya menggunakan metode DPPH. Metode uji DPPH merupakan salah satu metode yang paling banyak digunakan untuk memperkirakan efektivitas kinerja dari substansi yang berperan sebagai antioksidan. Metode pengujian ini berdasarkan pada kemampuan substansi antioksidan tersebut dalam menetralkan radikal bebas. Radikal bebas yang digunakan adalah 1,1-diphenyl-2-picrylhydrazyl (DPPH). Radikal bebas DPPH merupakan radikal sintetik yang stabil pada suhu kamar dan larut dalam pelarut polar yaitu metanol dan etanol (Molyneux 2004).
17 radikal bebas, yaitu menghambat aktivitas radikal bebas DPPH sebanyak 50%. Semakin kecil nilai IC50 berarti aktivitas antioksidannya semakin tinggi (Molyneux 2004). Perhitungan persen inhibisi dan penentuan IC50 disajikan pada Lampiran 5. Dokumentasi pengujian aktivitas antioksidan disajikan pada Lampiran 6. Hubungan antara konsentrasi larutan BHT yang digunakan dengan persen inhibisinya disajikan pada Gambar 5.
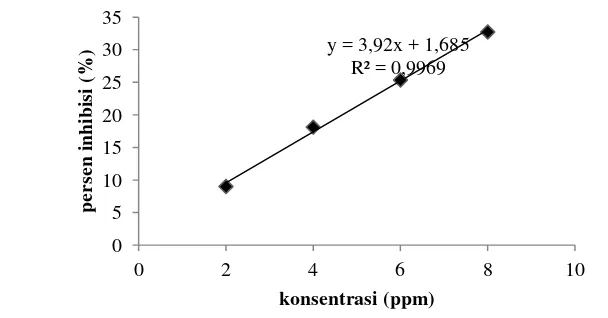
Gambar 5 Hubungan konsentrasi BHT dengan persen inhibisinya
Gambar 5 menunjukkan hubungan antara konsentrasi BHT dengan persen inhibisinya. Persen inhibisi tertinggi sebesar 32,71% dihasilkan oleh larutan BHT dengan konsentrasi tertinggi (8 ppm), sedangkan persen inhibisi terendah sebesar 8,99% dihasilkan oleh larutan BHT dengan konsentrasi terendah (2 ppm). Nilai IC50 larutan BHT (sebagai kontrol positif) yang dihasilkan sebesar 12,33 ppm. Antioksidan BHT merupakan antioksidan sintetik dan menunjukkan aktivitas penghambatannya sangat kuat (< 50 ppm) menurut klasifikasi Blois (1958) diacu dalam Molyneux (2004). Hubungan antara konsentrasi sampel hidrolisat dengan persen inhibisinya disajikan pada Gambar 6.
Gambar 6 Hubungan konsentrasi sampel hidrolisat dengan persen inhibisinya Gambar 6 menunjukkan hubungan antara konsentrasi sampel hidrolisat dengan persen inhibisinya. Persen inhibisi tertinggi sebesar 93,13% dihasilkan
18
oleh larutan sampel dengan konsentrasi tertinggi (2.000 ppm), sedangkan persen inhibisi terendah sebesar 24,09% dihasilkan oleh larutan sampel dengan konsentrasi terendah (500 ppm). Semakin tinggi konsentrasi sampel yang ditambahkan, maka semakin tinggi persen inhibisi yang dihasilkan. Hanani et al. (2005) menyatakan bahwa persentase penghambatan (persen inhibisi) terhadap aktivitas radikal bebas akan ikut meningkat seiring dengan meningkatnya konsentrasi ekstrak.
Suatu senyawa dikatakan sebagai antioksidan sangat kuat apabila nilai IC50 kurang dari 0,05 mg/mL (< 50 ppm), kuat apabila nilai IC50 sebesar 0,05-0,10 mg/mL (50-100 ppm), sedang apabila nilai IC50 sebesar 0,10-0,15 mg/mL (100-150 ppm), dan lemah apabila nilai IC50 sebesar 0,15-0,20 mg/mL (150-200 ppm) (Molyneux 2004). Nilai IC50 larutan sampel hidrolisat protein jeroan kakap putih yang dihasilkan sebesar 1.048,40 ppm. Hasil penelitian Luo et al. (2013) menunjukkan nilai IC50 hidrolisat protein ikan hiu (Sphyrna lewini) sebesar 3.060 ppm. Menurut klasifikasi, sampel hidrolisat protein jeroan kakap putih memiliki aktivitas antioksidan yang sangat lemah, karena nilainya lebih besar dari 0,20 mg/mL atau 200 ppm. Hal ini jauh berbeda dengan antioksidan BHT dan diduga karena dalam sampel hidrolisat protein masih terdapat senyawa-senyawa yang bukan sebagai antioksidan.
Kelompok senyawa kimia hidrolisat protein jeroan kakap putih
Uji komponen bioaktif dilakukan untuk mengetahui kelompok senyawa kimia yang terdapat pada produk hidrolisat protein jeroan kakap putih. Hasil pengujian disajikan pada Tabel 4. Dokumentasi hasil uji kelompok senyawa kimia disajikan pada Lampiran 7.
Tabel 4 Hasil uji kelompok senyawa kimia hidrolisat protein jeroan kakap putih
Uji Standar (warna)
Dragendorff Endapan merah sampai jingga + +
Wagner Endapan cokelat + +
Steroid Perubahan merah menjadi biru/
hijau - -
Flavonoid Lapisan amil alkohol berwarna
merah/ kuning/ hijau + -
Saponin Terbentuk busa - +
Fenol
hidrokuinon Warna hijau hingga hijau biru - - Molisch Warna ungu diantara dua
lapisan cairan ++ +
Benedict Warna hijau/ kuning, endapan
merah bata +++ -
Biuret Warna ungu ++ +++
Ninhidrin Warna ungu +++ +++
19 Senyawa metabolit sekunder pada produk hidrolisat protein jeroan kakap putih dapat diketahui dengan pengujian terhadap senyawa alkaloid, steroid, flavonoid, dan saponin. Uji alkaloid dilakukan untuk mendeteksi adanya senyawa organik siklik yang mengandung nitrogen. Kandungan alkaloid pada bahan ditandai dengan terbentuknya endapan merah oleh pereaksi Dragendorff, endapan coklat oleh pereaksi Wagner, dan endapan putih oleh pereaksi Meyer. Berdasarkan hasil uji, hidrolisat protein jeroan kakap putih menunjukkan reaksi positif terhadap pereaksi Dragendorff dan Wagner. Hasil serupa juga terdapat pada penelitian Purbasari (2008) pada produk hidrolisat protein kerang mas ngur. Menurut Purbasari (2008) asam-asam amino ornitin, lisina, fenilalanina, tirosina, dan triptofan merupakan senyawa prekusor untuk alkaloid. Berdasarkan hasil pengujian komponen bioaktif, sampel hidrolisat protein jeroan kakap putih tidak menunjukkan reaksi positif terhadap uji steroid, saponin, dan fenol hidrokuinon.
Uji Molisch positif menunjukkan bahwa dalam produk hidrolisat protein mengandung karbohidrat yang ditandai dengan terbentuknya lapisan ungu saat pengujian. Hasil uji menunjukkan bahwa pada produk hidrolisat protein jeroan kakap putih positif mengandung karbohidrat. Karbohidrat dalam produk hidrolisat dipecah oleh asam sulfat pekat menjadi gugus furfural yang akan bereaksi dengan sulfonat alfanaftol membentuk senyawa berwarna ungu.
Sifat pereduksi dari suatu molekul gula ditentukan oleh ada tidaknya gugus hidroksil (OH) bebas yang reaktif. Gugus hidroksil yang reaktif pada glukosa (aldosa) biasanya terletak pada karbon nomor dua. Sukrosa tidak mempunyai gugus OH bebas yang reaktif karena keduanya sudah saling terikat, sedangkan laktosa mempunyai OH bebas pada atom C nomor 1 pada gugus glukosanya (Winarno 2008). Tabel 4 menunjukkan bahwa hidrolisat protein jeroan kakap putih mengandung gula pereduksi. Hal ini ditunjukkan dengan adanya endapan merah bata pada larutan sampel yang telah diberikan pereaksi benedict. Gula pereduksi yang terdeteksi pada sampel menandakan bahwa pada sampel tersebut terdapat gula jenis aldosa.
Peptida merupakan ikatan kovalen antara dua atau lebih molekul asam amino melalui suatu ikatan amida substitusi. Ikatan ini dibentuk dengan menarik unsur H2O dari gugus karboksil suatu asam amino dan gugus α-amino dari molekul lain, dengan reaksi kondensasi yang kuat (Belitz et al. 2009). Berdasarkan hasil pengujian, komponen peptida terdeteksi pada sampel hidrolisat protein jeroan kakap putih.
Asam amino merupakan unit struktural dasar dari protein. Asam amino dapat diperoleh dengan menghidrolisis protein dalam asam, alkali, ataupun enzim.
Sebuah asam amino tersusun atas sebuah atom α-karbon yang berikatan secara
20
lisina (asam amino polar bermuatan), dan treonina (asam amino polar tak bermuatan).
SIMPULAN DAN SARAN
Simpulan
Produk hidrolisat protein jeroan kakap putih yang dihasilkan memiliki kadar air (6,83%) (%bb), abu (5,18%), protein (80,88%), dan lemak (0,78%) (%bk). Produk dihasilkan berdasarkan pemilihan kondisi aktivitas antioksidan tertinggi, yaitu pada konsentrasi enzim 0,1%, waktu hidrolisis 4 jam, dan nilai pH 7. Produk mengandung 15 jenis asam amino dengan kadar tertinggi yaitu asam glutamat (8,71%) dan kadar terendah histidina (1,38%). Produk hidrolisat menghasilkan aktivitas antioksidan dengan nilai IC50 sebesar 1.048,40 ppm dan mengandung senyawa flavonoid, karbohidrat, gula pereduksi, peptida, dan asam amino.
Saran
Saran yang dapat disampaikan dari hasil penelitian ini adalah pada pembuatan hidrolisat protein ikan proses penghilangan lemak (defatting) sebaiknya dilakukan satu kali saja setelah proses hidrolisis, yaitu dengan penyimpanan hidrolisat pada suhu dingin (4oC) selama 24 jam.
DAFTAR PUSTAKA
Almatsier S. 2006. Prinsip Dasar Ilmu Gizi. Jakarta: PT Gramedia Pustaka Utama. [AOAC]. Association of Official Analytical Chemist. 2005. Official Method of
Analysis of the Association of Official Analytical of Chemist. Arlington: The Association of Official Analytical Chemist, Inc.
Belitz HD, Grosch W, Schieberle P. 2009. Food Chemistry. Germany: Springer-Verlag.
Bhaskar N, Sathista AD, Sachindra NM, Sakhare PZ, Mahendrakar NS. 2007. Effect of acid ensiling on the stability of visceral waste proteases of Indian major carp Labeo rohita. Journal Aquatic Food Product Technology. 16 (1). Bhaskar N, Benila T, Radha C, Lalitha RG. 2008. Optimization of enzymatic
hydrolysis of visceral waste proteins of Catla (Catla catla) for preparing protein hydrolysate using a commercial protease. Journal of Bioresource Technology. 99 (10): 335-343.
21 Gesualdo AML, Li-Chan ECY. 1999. Functional properties of fish protein hydrolysate from herring (Clupea harengus). Journal Food Science. 64 (6): 1000-1004.
Hanani E, Mun’im A, Sekarini R. 2005. Identifikasi senyawa antioksidan dalam
spons Callyspongia sp. dari Kepulauan Seribu. Majalah Ilmu Kefarmasian. 2 (3): 127-133.
Harborne JB. 1984. Phytochemical Methods. Ed ke-2. New York: Chapman and Hall.
International Quality Ingredients. 2011. Fish Protein Hydrolysate.
http://www.eyequye.ni. [26 Agustus 2013].
Kirk RE, Orthmer JB. 1953. Encyclopedia of Chemical Technology. Volume IX. New York: The Interscience Encyclopedia Inc.
[KKP]. Kementerian Kelautan dan Perikanan. 2012. Laporan Akuntabilitas Kinerja Kementerian Kelautan dan Perikanan Tahun 2011. Jakarta: Kementerian Kelautan dan Perikanan Republik Indonesia.
Klompong V, Benjakul S, Yachai M, Vissesanguan W, Shahidi F, Hayes KD. 2009. Amino acid composition and antioxidative peptides from protein hydrolysate of yellow stripe trevally (Selaroides leptolepis). Journal Food Science. 74 (2): 126-133.
Koesoemawardani D, Nurainy F. 2009. Kajian Hidrolisat Protein Ikan Rucah sebagai Bahan Fortifikasi Makanan. Prosiding Seminar Hasil-Hasil Penelitian dan Pengabdian kepada Masyarakat Dies Universitas Lampung 19 Oktober 2009. Universitas Lampung.
Kristinsson HG. 2007. Aquatic Food Protein Hydrolysate. Di dalam: Shahidi F, editor. Maximizing the Value of Marine By-Product. Boca Raton: CRC Pr. Lehninger AL. 1993. Dasar Biokimia I. Maggy Thenawidjaja, penerjemah.
Terjemahan dari: Principles of Biochemistry. Jakarta: Penerbit Erlangga. Luo H, Wang B, Li Z, Chi CF, Zhang Q, He G. 2013. Preparation and evaluation
of antioxidant peptide from papain hydrolysate of Sphyrna lewini muscle protein. Journal Food Science Technology. 51 (1): 281-288.
Molyneux P. 2004. The use of the stable free radical diphenylpicrylhydrazil (DPPH) for estimating antioxidant activity. Journal Science and Technology. 26 (2): 211-219.
Muchtadi D. 1989. Evaluasi Nilai Gizi Pangan. Petunjuk Laboratorium. Bogor: PAU Pangan dan Gizi, Institut Pertanian Bogor.
Muchtadi D, Palupi NS. Astawan M. 1992. Enzim dalam Industri Pangan. Bogor: Pusat Antar Universitas, Institut Pertanian Bogor.
Purbasari D. 2008. Produksi dan karakterisasi hidrolisat protein dari kerang mas ngur (Atactodea striata). [Skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Rajapakse N, Mendis E, Byun HG, Kim SK. 2005. Purification and in vitro antioxidative effects of giant squid muscle peptide on free radical-mediated oxidative systems. Journal Nutrition Biochemistry. 16 (9): 562-569.
Shahidi F, Botta JR. 1994. Seafood: Chemistry, Processing Technology and Quality. Glasgow: Blackie Academic and Professional.
22
Shimada K, Fujikawa K, Yahara K, Nakamura T. 1992. Antioxidative properties of xanthan on the antioxidation of soybean oil in cyclodextrin emulsion. Journal Agricultural Food Chemistry. 40 (1): 945-948.
The International Glutamate Information Service (IGIS). 2006. Glutamat.
http://www.glutamate.org [30 Juli 2013].
Venugopal V. 2006. Seafood Processing: Adding Value Through Quick Freezing, Retortable Packaging, and Cook-Chilling. Boca Raton: CRC Pr.
Winarno FG. 1983. Enzim Pangan. Jakarta: PT Gramedia.
23
LAMPIRAN
Lampiran 1 Diagram alir proses produksi hidrolisat protein jeroan kakap putih
Jeroan kakap putih (Lates calcalifer)
Homogenisasi
Pemanasan pada suhu 85 oC selama 20 menit
Pendinginan
Sentrifuse 5.800 rpm; 20 menit; 10 oC Lapisan lemak
Residu kaya protein
Homogenisasi dengan akuades 1:2
Penambahan enzim papain
Hidrolisis dengan perlakuan konsentrasi enzim (0-0,2%), waktu hidrolisis (1-5 jam), dan pH tertentu (5-9)
Inaktivasi enzim pada suhu 85 oC selama 20 menit
Pendinginan
Pengendapan selama 24 jam ; suhu 4 oC Lapisan lemak
Filtrat hidrolisat protein
Sentrifuse 3.500 rpm; 30 menit; 10 oC
Filtrat hidrolisat protein
Pengeringan dengan metode freeze drying
Serbuk hidrolisat protein
24
Lampiran 2 Contoh perhitungan kadar asam amino produk hidrolisat protein Untuk menghitung asam amino asam aspartat pada contoh, luas area asam amino asam aspartat = 14396636 dan pada standar = 33840132, BM asam aspartat = 133,1
Konsentrasi asam amino = luas area sampel x konsentrasi standar luas area standar
Konsentrasi asam amino = 14396636 x 0,5 µmol/mL x 10 mL 33840132
= 2,1272 µmol AA % asam amino = µmol AA x Mr AA x 100
µg sampel
% asam amino = 2,1272 x 133,1 x 100
0,01 x 106
= 2,80% Laju aliran fase mobil
Waktu (menit)
Laju aliran fase mobil (mL/menit)
% Buffer B
0 1 0
1 1 0
2 1 15
5 1 15
13 1 42
15 1 42
20 1 70
22 1 100
26 1 100
28 1 0
25 Lampiran 3 Kromatogram kurva standar asam amino
Peak Table
Peak# Ret. Time Area Area % Height Name 1 3.250 33840132 7.423 7358621 Aspartat 2 7.310 25406926 5.573 2111285 Glutamat 3 11.738 858915 0.188 100564
4 12.231 29214486 6.408 3145234 Serina 5 12.912 18304472 4.015 1985089 Histidina 6 15.184 1157526 0.254 142248
7 15.423 27760659 6.089 3022358 Glysina 8 15.818 26682615 5.853 3088566 Threonina 9 16.279 31953554 7.009 3600191 Arginina 10 18.686 30384988 6.665 3037142 Alanina 11 19.131 766527 0.168 80383
12 19.466 30666536 6.727 3017740 Tyrosina 13 21.521 399530 0.088 61387
14 21.756 830500 0.182 123375 15 22.005 2704038 0.593 322055 16 22.184 1150031 0.252 194902 17 22.686 258124 0.057 34320 18 22.986 936868 0.206 141112
19 23.180 32920002 7.221 5968711 Methionina 20 23.413 36839265 8.081 6770158 Valina 21 23.704 29374453 6.443 5612349 Fenilalanina 22 24.133 346628 0.076 36773
23 24.232 530641 0.116 82882
26
25 24.617 32370595 7.100 6381595 Leusina 26 25.236 786354 0.172 156465
27 25.480 18714474 4.105 4002312 Lysina 28 25.883 635664 0.139 156673
29 25.971 583712 0.128 139031 30 26.135 217458 0.048 36536 31 27.176 296560 0.065 69818 32 27.296 270892 0.059 46955 33 27.895 1337297 0.293 257026 34 28.033 157387 0.035 36672 Total 455892596 100.000 68439703
Lampiran 4 Kromatogram kurva produk hidrolisat protein jeroan kakap putih
Peak Table
Peak#
Ret.
Time Area Area % Height Name 1 3.240 14396636 5.136 3141612 Aspartat 2 7.287 30404477 10.848 2518386 Glutamat 3 11.713 367657 0.131 42236
4 12.208 9637827 3.439 1030838 Serina 5 12.887 3287334 1.173 357850 Histidina 6 13.923 454077 0.162 53392
7 14.417 406613 0.145 27576 8 15.151 1010177 0.360 131694
28
Lampiran 5 Perhitungan persen inhibisi dan penentuan IC50 1) Persen inhibisi dan IC50 pada BHT
Sampel Konsentrasi
Nilai IC50 untuk BHT adalah 12,33 ppm
2) Persen inhibisi dan IC50 pada hidrolisat protein jeroan kakap putih Sampel Konsentrasi
29 Lampiran 6 Dokumentasi pengujian aktivitas antioksidan hidrolisat protein jeroan
kakap putih
Blanko BHT 2 ppm BHT 4 ppm
30
Lampiran 7 Dokumentasi pengujian kelompok senyawa kimia hidrolisat protein jeroan kakap putih
a. Uji alkaloid : Meyer (-); b. Steroid (-) Wagner (+); Dragendorff (+)
c. Uji flavonoid (+); fenol hidrokuinon (-); Biuret (++)
31 Lampiran 8 Tahapan produksi hidrolisat protein jeroan kakap putih
Preparasi bahan baku Homogenisasi
Pemanasan (pengovenan) Sentrifugasi
Proses hidrolisis Pengendapan/ penyimpanan
32
Lampiran 9 Dokumentasi bahan baku dan produk hidrolisat protein
Bahan baku jeroan utuh Jeroan yang telah dihomogenkan
33
RIWAYAT HIDUP
Penulis bernama lengkap Asti Latifah dilahirkan di Bogor pada tanggal 11 Oktober 1991. Penulis adalah anak pertama dari tiga bersaudara dari pasangan Bapak Asep Hadiman dan Ibu Pahriatini.
Penulis memulai jenjang pendidikan formal di TK Shandy Putera Bogor tahun 1996-1997, kemudian Sekolah Dasar Negeri Pengadilan 2 Bogor tahun 1997-2003. Penulis melanjutkan pendidikan di SMP Negeri 5 Bogor tahun 2003-2006. Pendidikan menengah atas ditempuh penulis di SMA Negeri 5 Bogor tahun 2006-2009. Penulis diterima di Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB) dengan program studi Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor tahun 2009.
Selama masa studi di Institut Pertanian Bogor penulis aktif di beberapa kegiatan mahasiswa Paduan Suara Agriaswara IPB tahun 2009, Fisheries Processing Club (FPC) tahun 2010-2012, dan Himpunan Mahasiswa Teknologi Hasil Perikanan (HIMASILKAN) tahun 2011-2012. Penulis juga aktif sebagai asisten praktikum mata kuliah Avertebrata Air tahun ajaran 2011-2012 dan 2012-2013, Penanganan Hasil Perairan (2011-2012), Fisiologi, Formasi dan Degradasi Metabolit Hasil Perairan (2012-2013), dan Teknologi Pengembangan Kitin dan Kitosan (2012-2013). Penulis telah melaksanakan praktik lapangan pada tahun 2012 di PT Tridaya Eramina Bahari, Muara Baru, Jakarta Utara dengan
judul ”Analisis Penerapan Sistem GMP Produksi Tuna Loin Beku di PT Tridaya
Eramina Bahari, Muara Baru, Jakarta” dibawah bimbingan Roni Nugraha, S.Si, M.Sc.