AKTIVITAS EKSTRAK DAUN MIANA (Coleus scutellarioides
[L] Benth) SEBAGAI ANTIFUNGI Candida tropicalis
NAZULA RAHMA SHAFRIANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Aktivitas Ekstrak Daun Miana (Coleus scutellarioides [L] Benth) Sebagai Antifungi Candida tropicalis adalah benar karya saya dengan arahan dari komisi pembimbing dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
ABSTRAK
NAZULA RAHMA SHAFRIANI. Aktivitas Ekstrak Daun Miana (Coleus scutellarioides [L] Benth) Sebagai Antifungi Candida tropicalis. Dibimbing oleh SYAEFUDIN dan MARIA BINTANG.
Keputihan merupakan infeksi yang disebabkan oleh khamir Candida tropicalis. Salah satu daun yang diduga mengandung antimikrob adalah daun miana. Penelitian ini bertujuan menguji aktivitas ekstrak daun miana (Coleus scutellarioides [L] Benth) sebagai antifungi Candida tropicalis in vitro. Metode yang digunakan adalah difusi sumur dengan penentuan konsentrasi hambat tumbuh minimum. Ekstrak yang diujikan adalah ekstrak akuades, ekstrak etanol 70%, dan ekstrak aseton daun miana. Ekstrak yang dapat menghambat pertumbuhan Candida tropicalis adalah ekstrak aseton daun miana. Konsentrasi hambat tumbuh mimimal ekstrak aseton daun miana dengan pelarut DMSO dan aseton masing-masing yaitu 25 mg/mL dengan diameter zona hambat 1.55 mm dan 1.50 mm. Hasil uji statistika dengan software SPSS 16.0 menunjukkan bahwa ekstrak aseton daun miana dapat menghambat pertumbuhan Candida tropicalis (ANOVA dengan α 0.05) meskipun diameter zona hambatnya lebih kecil dibandingkan dengan Nistatin. Ekstrak aseton daun miana dianalisis dengan GC-MS dan memilki kandungan senyawa dominan yaitu 2-hexadecen-1-ol, 3, 7, 11, 15-tetramethyl-, [R-[R*,R*-(E)]]- (CAS) phytol dan neophytadiene.
Kata kunci : antimikrob, Candida tropicalis, ekstrak daun miana
ABSTRACT
NAZULA RAHMA SHAFRIANI. Activity Extract of (Coleus scutellarioides [L] Benth) Leaves as an Antifungal Candida tropicalis. Supervised by SYAEFUDIN and MARIA BINTANG.
Candidiasis is an infection caused by yeast of Candida tropicalis. One of the leaves thought to contain anti microbial is (Coleus scutellarioides [L] Benth) leaves. The aim of this study is to test the activity of the leaf extract (Coleus scutellarioides [L] Benth) as an antifungal Candida tropicalis in vitro. This using diffusion wells and growth methods. Extracts tested are aquades extract, 70% ethanol extract and acetone extract of leaves miana. The extract can inhibit the growth of Candida tropicalis is miana leaf acetone extract. Minimum Inhibitory Concentration acetone extract solvent is DMSO and acetone, respectively at 25 mg/mL with inhibition zone diameter 1.55 mm and 1.50 mm.The results of statistical tests with SPSS 16.0 software showed that acetone extract of the (Coleus scutellarioides [L] Benth) leaves can significantly inhibit the growth of Candida tropicalis (ANOVA α 0.05) although its inhibition zone diameter is less than Nystatin. Acetone extract was analyzed by GC-MS and have the dominant content of the compound is 2-hexadecen-1-ol, 3, 7, 11, 15-tetramethyl-, [R-[R*, R*- (E)]] – (CAS) phytol and neophytadiene.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
AKTIVITAS EKSTRAK DAUN MIANA (Coleus scutellarioides
[L] Benth) SEBAGAI ANTIFUNGI Candida tropicalis
NAZULA RAHMA SHAFRIANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Aktivitas Ekstrak Daun Miana (Coleus scuttellarioides [L] Benth) Sebagai Antifungi Candida tropicalis
Nama : Nazula Rahma Shafriani NIM : G84100061
Disetujui oleh
Syaefudin, SSi MSi Pembimbing I
Prof Dr drh Maria Bintang, MS Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
Bismillahirrahmaanirrahiim
Puji dan syukur penulis ucapkan kehadirat Allah SWT atas segala rahmat, karunia, dan kemudahan yang selalu diberikan kepada hamba-Nya, sehingga penulis dapat menyelesaikan karya ilmiah dengan judul Aktivitas Ekstrak Daun Miana (Coleus scuttelarioides [L] Benth) Sebagai Antifungi Candida tropicalis. Penelitian ini dilaksanakan sejak bulan Desember 2013 sampai April 2014 di Laboratorium Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam serta di Laboratorium Mikrobiologi, Fakultas Kedokteran Hewan. Skripsi ini merupakan pelaksanaan tugas akhir untuk mendapatkan gelar sarjana Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Selama melaksanakan penelitian hingga penyusunan skripsi ini penulis mendapatkan bantuan dari berbagai pihak diantaranya pendanaan dari Yayasan Amanah IPB. Terima kasih penulis ucapkan pada Syaefudin, SSi, MSi dan Prof Dr drh Maria Bintang, MS atas bimbingan, kritik, dan sarannya dalam penulisan hasil penelitian ini. Secara khusus penulis juga berterima kasih kepada kedua orangtua penulis Bapak Suwarno, SAg dan Ibu Umiatun, SPdI atas doa dan dorongan untuk kelancaran dan kemudahan dalam menyelesaikan kuliah di IPB. Terima kasih penulis ucapkan kepada adik-adik penulis Farid Husni Rahman dan Alfi Aulia Rahma, teknisi di lab Mikrobiologi FKH IPB Bapak Agus, teman-teman dari biokimia Puji, Dwi, Ziah, Rini, Eva, Uti, Eni, Tuchin, Anes, Lia, Weni, yang telah membantu penulis selama penelitian, serta teman-teman biokimia yang tidak bisa disebutkan satu-persatu yang telah memberikan dorongan semangat kepada penulis untuk menyelesaikan penulisan hasil penelitian ini.
Penulis menyadari masih banyak kekurangan dalam penyusunan usulan penelitian ini. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun untuk perbaikan dalam penulisan selanjutnya. Penulis berharap tulisan ini dapat berguna bagi penulis maupun pembaca.
Bogor, Juli 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Metode Penelitian 2
HASIL 5
Kadar Air, Kadar Abu, dan Rendemen Daun Miana 5
Konsentrasi Hambat Tumbuh Minimum Ekstrak Kasar Daun Miana 6
Analisis Fitokimia Ekstrak Daun Miana 7
Analisis GC-MS (Gas Chromatography-Mass Spectrometer) 8
PEMBAHASAN 9
Kadar Air, Kadar Abu, dan Rendemen Daun Miana 9
Konsentrasi Hambat Tumbuh Minimum Ekstrak Kasar Daun Miana 10
Analisis Fitokimia Ekstrak Daun Miana 12
Analisis GC-MS (Gas Chromatography-Mass Spectrometer) 13
SIMPULAN DAN SARAN 14
Simpulan 14
Saran 14
DAFTAR PUSTAKA 15
LAMPIRAN 18
DAFTAR TABEL
1 Hasil analisis fitokimia ekstrak daun miana 8 2 Hasil analisis GC-MS senyawa dominan ekstrak aseton daun miana 8
DAFTAR GAMBAR
1 Rendemen ekstrak daun miana 6
2 Uji KHTM ekstrak aseton daun miana pelarut aseton 7 3 Uji KHTM ekstrak aseton daun miana pelarut DMSO 7
DAFTAR LAMPIRAN
1 Alur penelitian 18
2 Daun miana, serbuk daun miana dan ekstrak daun miana 18
3 Formula media Potatoes Dextrosa Agar (PDA) 19
4 Kadar air daun miana 19
5 Kadar abu daun miana 19
6 Rendemen ekstrak daun miana 19
7 Uji KHTM ekstrak aseton daun miana pelarut aseton 20 8 Uji KHTM ekstrak aseton daun miana pelarut DMSO 20
9 Isolat Candida tropicalis 20
10 Diameter zona hambat ekstrak aseton daun miana 20
11 Uji fitokimia 21
PENDAHULUAN
Fungi atau jamur merupakan tumbuhan yang tidak memiliki klorofil, sehingga tidak mampu melakukan fotosintesis. Fungi hanya bisa hidup sebagai parasit pada organisme hidup lain atau sebagai saprofit pada benda organisme mati. Proses perbanyakan fungi dapat membentuk sel-sel yang disebut spora yang resisten terhadap lingkungan yang kurang menguntungkan bagi kehidupannya. Ketika keadaan membaik, terutama suhu dan kelembaban tertentu, spora dapat tumbuh lagi dan membentuk mycelium (Tjay dan Rahardja 2002).
Candidiasis atau keputihan merupakan infeksi di organ kewanitaan yang disebabkan oleh jamur Candida. Genus Candida ditemukan lebih dari 200 species. Candida sp. merupakan mikroorganisme dari golongan fungi yang menyebabkan infeksi menular secara kontak seksual. Infeksi ini ditandai dengan gejala utama rasa panas dan rasa gatal pada vagina dan terjadi di dalam mulut, esofagus, saluran pencernaan, vagina, atau kulit. Tempat infeksi yang paling umum terjadi dalam mulut (ruam) atau vagina (infeksi ragi, vaginitis). Candidiasis vaginalis merupakan gejala paling umum pada wanita. Sekitar 75% candidiasis vaginalis dialami oleh wanita usia produktif (Lies 2005). Mikroorganisme penyebab utama candidiasis vaginalis adalah Candida albicans (60-95%), sedangkan spesies lainnya ditemukan dalam jumlah yang lebih sedikit seperti Candida glabrata dan Candida tropicalis 30-40% (Eraso et al. 2006).
Mikroorganisme patogen yang ada pada tubuh manusia telah berkembang menjadi semakin resisten sebagai akibat dari konsumsi antimikrob komersial secara besar-besaran. Hal ini mendorong ditemukannya sumber antimikrob baru yang efektif dan memiliki efek samping yang lebih kecil, salah satunya dari tanaman obat. Indonesia merupakan negara yang memiliki sumber tanaman obat yang sangat beragam. Lebih dari 1000 spesies tumbuhan dapat dimanfaatkan sebagai bahan baku obat. Menurut perkiraan badan kesehatan dunia (WHO), 80% penduduk dunia masih menggantungkan dirinya pada pengobatan tradisional termasuk penggunaan obat yang berasal dari tanaman (Strobel 2002). Pemanfaatan dalam bidang pengobatan perlu ditingkatkan untuk dijadikan obat alternatif. Salah satu jenis tanamannya adalah miana (Coleus scuttellarioides [L] Benth).
2
Sampai saat ini, belum ada penelitian yang menyebutkan khasiat daun miana sebagai anti Candida tropicalis, tetapi secara empiris air rebusan daun miana sudah dipakai sebagai obat keputihan. Oleh karena itu, perlu dilakukan penelitian lebih lanjut mengenai efektivitas ekstrak daun miana (Coleus scuttellarioides [L] Benth) dalam menghambat pertumbuhan candida.
Penelitian ini bertujuan menguji aktivitas ekstrak daun miana (Coleus scutellarioides [L] Benth) sebagai antifungi Candida tropicalis secara in vitro. Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah kepada masyarakat mengenai ekstrak daun miana (Coleus scutellarioides [L] Benth) sebagai obat alternatif antifungi Candida tropicalis.
METODE
Bahan dan Alat
Alat-alat yang digunakan pada penelitian ini antara lain tabung reaksi bertutup, pipet mikro, tip pipet, cawan Petri, wadah plastik, Rotary Evaporator EYELA OSB-2100, Erlenmeyer, labu takar, gelas ukur, autoklaf, desikator, penangas, neraca analitik, inkubator, shaker EYELA Multi shaker MMS, vorteks VIBROFIX VFI, lup inokulasi, kertas saring, tanur, Bunsen, aluminium foil, kain kasa, kapas, blender, saringan 100 mesh, oven EYELA NDO-700, dan GCMS-QP2010 Shimadzu.
Bahan-bahan yang digunakan pada penelitian ini antara lain daun miana tua (3-5 helai dari pucuk) yang diperoleh dari BALITRO-Bogor, kultur Candida tropicalis seri Inacc Y53 yang diperoleh dari LIPI Cibinong-Bogor, media Potatoes Dextrose Agar (PDA), NaCl, akuades, etanol 70%, aseton, DMSO, pereaksi Dragendorf, pereaksi Mayer, perekasi Wagner, H2SO4, H2SO4 pekat, dH2O, methanol, eter, asam asetat anhirida, FeCl3, Nistatin sebagai standar, dan larutan Mc Farland 3 setara dengan 109 CFU/mL.
Metode Penelitian
Preparasi Sampel
Daun miana yang digunakan dalam penelitian adalah daun miana tua yang diperoleh dari 3-5 helai dari pucuk tanaman dengan bentuk daun yang sempurna dan berwarna ungu kemerahan. Daun miana segar dicuci hingga bersih dengan air dan ditiriskan. Kemudian dikeringkan dengan oven dengan suhu 45oC selama 4-5 hari sampai benar-benar kering. Daun miana kering dihaluskan dengan blender hingga menjadi serbuk halus ukuran 100 mesh.
Penetapan Kadar Air (AOAC 2006)
3 porselin dan dikeringkan dalam oven pada suhu 105°C selama 3 jam. Cawan tersebut lalu diangkat, didinginkan di dalam desikator selama 30 menit, dan ditimbang berat akhirnya. Penentuan kadar air dilakukan sebanyak 3 kali ulangan (triplo). Penentuan kadar air dapat dihitung dengan persamaan sebagai berikut: Kadar air (%) = × 100%
Keterangan :
A = Bobot sebelum dikeringkan (gram) B = Bobot setelah dikeringkan (gram) C = Bobot sampel (gram)
Penetapan Kadar Abu (AOAC 2006)
Cawan porselin dikeringkan dalam tanur bersuhu 600°C, kemudian didinginkan dalam desikator dan ditimbang. Sebanyak 3-5 gram sampel ditimbang dan dimasukkan ke dalam cawan porselin. Sampel dipijarkan di atas nyala pembakar bunsen sampai tidak berasap lagi, kemudian dilakukan pengabuan di dalam tanur listrik pada suhu 600°C selama 4-6 jam atau sampai terbentuk abu berwarna putih. Kemudian sampel didinginkan dalam desikator dan ditimbang. Penentuan kadar abu dapat dihitung dengan rumus sebagai berikut :
Kadar Abu (%) = × 100% Keterangan:
A = Bobot setelah ditanur (gram) B = Bobot sebelum ditanur (gram)
Ektraksi Daun Miana (Modifikasi BPOM 2004)
Serbuk daun miana diekstraksi dengan metode yang mengacu pada Badan Pengawas Obat dan Makanan atau BPOM (2004) yaitu maserasi. Maserasi dilakukan dengan tiga pelarut yaitu pelarut akuades, aseton, dan etanol 70%. Maserasi dengan etanol 70% dilakukan dengan merendam sampel dalam pelarut etanol 70% dengan perbandingan 1:10. Maserasi dilakukan selama 24 jam dengan digoyang secara teratur pada 145 rpm. Maserat yang diperoleh dipisahkan menggunakan kertas saring dan proses maserasi diulang dua kali dengan menggunakan pelarut yang sama. Semua maserat yang diperoleh dikumpulkan. Maserat kemudian diuapkan dan dipekatkan menggunakan rotary evaporator dengan suhu 40oC sampai diperoleh sampel ekstrak etanol 70% daun miana. Maserasi dengan pelarut aseton dilakukan dengan metode yang sama dengan pelarut etanol 70%.
Ekstrak akuades daun miana dilakukan dengan metode modifikasi BPOM (2010) yaitu metode perebusan serbuk daun miana kering menggunakan pelarut akuades dengan perbandingan 1:10. Perebusan simplisia daun miana dilakukan selama 2 jam. Akuades rebusan didiamkan, kemudian disaring dan filtratnya dikumpulkan. Filtrat kemudian diuapkan dan dipekatkan menggunakan rotary evaporator pada suhu 40oC sampai diperoleh sampel ekstrak akuades daun miana.
4
Pembiakan Kultur C. tropicalis (Modifikasi Setiawati 2012)
Kultur C. tropicalis yang diperoleh dari LIPI Cibinong, Bogor dibiakkan dalam media Potatoes Dextrose agar (PDA). Media PDA 500 mL berisi potato 2 g, dextrosa 10 g, agar 7.5 g dan akuades 500 mL. Labu Erlenmeyer disiapkan, semua bahan yang diperlukan ke labu Erlenmeyer dimasukkan. Dikocok sampai homogen dan dipanaskan, namun tidak sampai mendidih dan diaduk supaya larut. Setelah selesai, media dikeluarkan dan ditunggu sampai agak dingin (suhu sekitar 50°-60°C), kemudian dimasukkan ke dalam cawan Petri 10 mL lalu dibiarkan menjadi dingin sampai agar-agar menjadi padat. Selanjutnya kultur dibiakan dalam media PDA padat dan diinkubasi pada suhu 37°C selama 48 jam sampai terbentuk koloni bulat putih dengan latar belakang kekuningan. Koloni tersebut disuspensikan dalam larutan natrium klorida steril 0.9 % (normal saline), yang dibandingkan dengan kepekatan tabung McFarland 3 atau setara dengan 109 CFU/mL.
Penyiapan Media Potatoes Dekstrosa Agar (PDA)
Sebanyak 3.9 gram PDA dilarutkan dalam labu erlenmeyer, kemudian ditambahkan akuades sampai volume 100 mL. Sterilisasi selama 15 menit pada suhu 121°C. Setelah suhu erlenmeyer dingin atau sudah mencapai suhu 45°C, medium PDA dituangkan ke dalam cawan petri yang sebelumnya sudah disterilisasi. Lalu digoyang-goyangkan dan biarkan hingga padat.
Uji Konsentrasi Hambat Tumbuh Minimum (KHTM) (Kusumaningjati dan Jackson et al. 2009)
Penentuan KHTM dilakukan terhadap tiga jenis ekstrak, yaitu akuades, etanol 70%, dan aseton. Kontrol positif yang digunakan adalah Nistatin 1.028 mg/mL, sedangkan kontrol negatifnya DMSO (Dimetil Sulfo Oksida) dan aseton. Sebanyak 100 µL kultur Candida tropicalis yang tersuspensi dalam larutan NaCl 0.9 % steril dengan konsentrasi 107 cfu/mL dicampurkan dengan media PDA sebanyak 200 mL. Kemudian dituangkan ke cawan Petri dan dibiarkan memadat. Lalu media PDA yang bercampur dengan suspensi C. tropicalis 106 cfu/mL dilubangi seperti sumur. Setelah itu, sebanyak 50 µL ekstrak dengan konsentrasi 200 mg/mL, 100 mg/mL, 50 mg/mL, dan 25 mg/mL, 12.5 mg/mL, 6.25 mg/mL, dan 3.125 mg/mL dimasukkan ke dalam sumur pada media PDA. Kemudian cawan Petri diinkubasi pada suhu 37oC selama 18 jam. Aktivitas anticandida ditentukan dengan pengukuran zona penghambatan di sekitar sumur secara diagonal dari tiga kali pengulangan, kemudian di rata-ratakan. Daerah bening di sekitar sumur menunjukkan uji positif. Pengujian setiap ekstrak dilakukan sebanyak tiga ulangan.
Analisis Fitokimia (Harbone 1987)
5
Uji Flavonoid. Sebanyak 0.1 gram sampel ditambahkan dengan 5 mL metanol 30 %, lalu dipanaskan selama 5 menit. Filtrat yang terbentuk ditambahkan dengan H2SO4. Perubahan warna larutan menjadi merah setelah penambahan H2SO4 menunjukkan adanya flavonoid.
Uji Saponin. Sebanyak 0.1 gram sampel ditambahkan dengan 5 mL akuades lalu dipanaskan 100°C selama 5 menit. Kemudian sampel dikocok selama 5 menit. Busa yang terbentuk setinggi tidak kurang dari 1 cm dan tetap stabil setelah didiamkan selama 15 menit menunjukkan adanya saponin.
Uji Triterpenoid dan Steroid. Sebanyak 0.1 gram sampel ditambahkan dengan 5 mL etanol 30 %, lalu dipanaskan pada suhu 50°C selama 5 menit. Selanjutnya disaring, filtrat yang diperoleh diuapkan lalu ditambahkan dengan 5 tetes eter di dalam ruang asam. Lapisan eter ditambahkan dengan pereaksi Liberman Burchard (3 tetes asam asetat anhirida dan 1 tetes H2SO4 pekat). Adanya triterpenoid ditandai dengan terbentuknya warna merah atau ungu, sedangkan adanya steroid ditunjukkan dengan warna hijau.
Uji Tanin. Sebanyak 0.1 gram sampel ditambahkn dengan 5 mL akuades, kemudian didihkan selama 5 menit. Larutan selanjutnya disaring, filtrat yang diperoleh ditambahkan dengan 5 tetes FeCl3 1% (b/v). Adanya tanin ditunjukkan dengan terbentuknya warna hijau tua atau hitam.
Analisis Gas Chromatography-Mass Spectrometer
Identifikasi jenis senyawa yang berperan sebagai anticandida dilakukan dengan GC-MS. Senyawa yang diidentifikasi dengan GC-MS adalah ekstrak daun miana yang memiliki aktivitas anticandida yang paling besar dibandingkan ekstrak lain. Jenis kolom yang digunakan kapiler tipe fase Rtx-5MS, panjang kolom sebesar 60 m, diameter kolom sebesar 0.25 mm. Gas pembawanya helium. Suhu ruang injeksi dan suhu pirolisis sebesar 280°C. Suhu kolom 50°C, laju alir sebesar 0.85 ml/menit dan volume injeksi sebanyak 2 µL, tekanan 100 kPa, dan suhu sumber ion 200°C. Jumlah senyawa yang terdapat dalam ekstrak ditunjukkan oleh jumlah puncak (peak) pada kromatogram, sedangkan nama/jenis senyawa yang ada diinterpretasikan berdasarkan data spektro dari setiap puncak tersebut dengan menggunakan metode pendekatan pustaka pada database GC-MS.
HASIL
Kadar Air, Kadar Abu, dan Rendemen Daun Miana
6
Gambar 1 Rendemen ekstrak daun miana
Konsentrasi Hambat Tumbuh Minimum Ekstrak Kasar Daun Miana
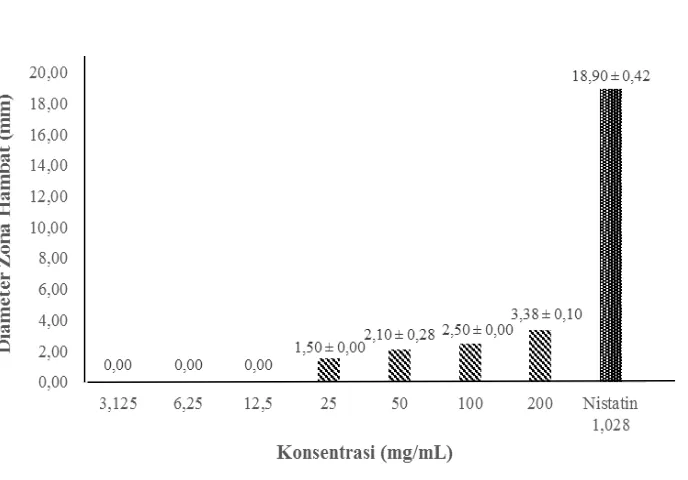
Penentuan konsentrasi hambat tumbuh minimum ekstrak daun miana dilakukan dengan tiga macam ekstrak hasil dari rendemen ekstrak dengan pelarut akuades, etanol 70%, dan aseton yang dilakukan sebelumnya. Ekstrak akuades dan ekstrak etanol 70% daun miana dengan pelarut aseton dan DMSO tidak memberikan aktivitas anticandida pada semua tingkat konsentrasi, sedangkan pada ekstrak aseton daun miana dengan pelarut aseton dan DMSO memberikan aktivitas penghambatan terhadap Candida tropicalis. Kontrol positif yang digunakan adalah Nistatin dengan konsentrasi sebesar 1.028 mg/mL dengan diameter zona hambat sebesar 18.90 mm dan 16.90 mm. Ekstrak aseton daun miana memiliki penghambatan yang lebih kecil dibandingkan dengan kontrol positif Nistatin. Hasil penghambatan ekstrak aseton dan Nistatin terhadap pertumbuhan Candida tropicalis disajikan pada Gambar 2 dan Gambar 3.
Aktivitas anticandida pada ekstrak daun miana terlihat dari terbentuknya zona bening di sekitar sumur. Konsentrasi 25 mg/mL merupakan konsentrasi ekstrak aseton daun miana dengan pelarut aseton dan DMSO paling rendah yang mampu menghambat pertumbuhan Candida tropicalis dengan diameter zona hambat masing-masing 1.50 mm dan 1.55 mm. Sedangkan pada konsentrasi 200 mg/mL merupakan konsentrasi tertinggi ekstrak aseton daun miana dengan pelarut aseton dan DMSO yang mampu menghambat pertumbuhan Candida tropicalis dengan diameter zona hambat masing-masing 3.38 mm dan 3.35 mm. Variasi konsentrasi yang digunakan menghasilkan aktivitas anticandida yang berbeda-beda. Aktivitas anticandida pada konsentrasi paling tinggi akan menghasilkan diameter zona hambat paling besar pula yang dapat dilihat pada Lampiran 11.
7
Gambar 2 Uji KHTM ekstrak aseton daun miana pelarut aseton
Gambar 3 Uji KHTM ekstrak aseton daun miana pelarut DMSO
Analisis Fitokimia Ekstrak Daun Miana
8
Tabel 1 Hasil analisis fitokimia ekstrak daun miana
Uji Akuades Etanol 70% Aseton
Keterangan : (+) menunjukkan hasil uji positif (-) menunjukkan hasil uji negatif
Analisis GC-MS (Gas Chromatography-Mass Spectrometer)
Analisis GC-MS dilakukan menggunakan GCMS-QP2010 Shimadzu. Jumlah senyawa dominan yang terdapat dalam ekstrak ditunjukkan oleh hasil analisis GC-MS pada Tabel 2. Senyawa dominan pada ekstrak aseton daun miana yaitu 2-hexadecen-1-ol, 3,7,11,15 tetramethyl-, [R-[R*,R*-(E)]]- (CAS) phytol, neophytadiene, 2,6,10,14,18,22-tetracohexaene, 2,6,10,15,19,23-hexamethyl- (CAS) squalene, dan tetratetracontane (CAS) n-tetratetracontane. Hasil analisis GC-MS lengkap senyawa ekstrak aseton daun miana disajikan pada Lampiran 12. Tabel 2 Hasil analisis GC-MS senyawa dominan ekstrak aseton daun miana
Peak R.Time Konsentrasi % Nama senyawa
6 19,571 32,45 2-Hexadecen-1-ol, 3,7,11,15tetramethyl-, [R-[R*,R*-(E)]]- (CAS) Phytol
7 19,705 10,11 NEOPHYTADIENE
8 19,857 12,80 2-Hexadecen-1-ol, 3,7,11,15tetramethyl-, [R-[R*,R*-(E)]]- (CAS) Phytol
13 21,462 0,68 2-Hexadecen-1-ol, 3,7,11,15tetramethyl-, [R-[R*,R*-(E)]]- (CAS) Phytol
15 22,133 6,18 NEOPHYTADIENE
19 29,641 9,85 2,6,10,14,18,22-Tetracohexaene,
9
PEMBAHASAN
Kadar Air, Kadar Abu, dan Rendemen Daun Miana
Kadar air merupakan kadar yang harus diuji karena berkaitan dengan mutu simplisia selama masa penyimpanan. Kadar air yang tinggi dapat mempengaruhi pertumbuhan jamur maupun kapang dan dapat menurunkan aktivitas biologi simplisia selama masa penyimpanan. Kadar air dalam suatu bahan menunjukkan kandungan air per satuan bobot bahan. Terdapat dua metode dalam menentukan kadar air suatu bahan, yaitu berdasarkan bobot kering dan bobot basah. Penentuan kadar air yang dilakukan pada penelitian ini adalah dengan mengeringkan bahan dalam oven pada suhu 105°C selama 3 jam. Selisih berat sebelum dan sesudah pengeringan adalah banyaknya air yang diuapkan. Berdasarkan penelitian dengan tiga kali ulangan diperoleh kadar air serbuk daun miana sebesar 7.21%, 7.32%, dan 7.84%, dengan nilai rata-rata sebesar 7.46% ± 0.33. Berdasarkan MMI (Materika Medika Indonesia) untuk standar acuan kadar air daun miana yaitu ≤ 10%. Hal ini bertujuan menghindari cepatnya pertumbuhan jamur dalam penyimpanan sampel (Mutiatikum et al. 2010). Hasil yang didapatkan dari penelitian ini tergolong memenuhi syarat karena kadar air daun miana ≤ 10%.
Kadar abu merupakan zat anorganik sisa hasil pembakaran suatu bahan organik yang diperoleh dengan proses pengabuan (pemanasan suhu tinggi, >450°C). Residu anorganik ini terdiri bermacam-macam mineral yang komposisi dan jumlahnya bergantung pada jenis bahan pangan dan metode analisis yang digunakan (Indrasari et al. 2008). Kadar abu berhubungan dengan mineral suatu bahan. Mineral yang terdapat dalam suatu bahan terdiri dari dua macam garam yaitu garam organik dan garam anorganik. Garam organik terdiri dari garam-garam malat, oksalat, asetat, dan pektat, sedangkan garam-garam anorganik terdiri dalam bentuk fosfat, karbonat, klorida, sulfat, dan nitrat. Analisis kadar abu yang dilakukan pada penelitian ini menggunakan metode pengeringan. Prinsipnya adalah pembakaran atau pengabuan bahan-bahan organik yang diuraikam menjadi air (H2O) dan karbondioksida (CO2) tetapi zat anorganik tidak terbakar. Zat anorganik ini disebut abu. Berdasarkan hasil penelitian, diperoleh kadar abu dengan tiga ulangan masing-masing 10.0349%, 10.3438%, dan 9.7587%, dengan nilai rataan sebesar 10.0458% ± 0.29. Kandungan kadar abu daun miana yang diperoleh lebih tinggi dibandingkan dengan standar MMI yang tidak lebih dari 8% (Mutiatikum et al. 2010). Hal ini dimungkinkan bahwa simplisia daun miana mengandung kadar anorganik atau pengotor lebih tinggi dibandingkan batas standar MMI.
10
pengerjaan dan peralatan yang digunakan sederhana dan mudah diusahakan (Sari 2000). Penelitian ini menggunakan metode ekstraksi maserasi. Maserasi dilakukan dengan merendam serbuk daun miana dalam pelarut selama 3×24 jam dengan bantuan shaker untuk mempercepat penarikan senyawa metabolit sekunder pada daun miana. Pemilihan pelarut merupakan salah satu faktor yang penting dalam proses ekstraksi, karena akan mempengaruhi jumlah rendemen ekstrak yang dihasilkan. Faktor-faktor yang harus diperhatikan dalam pemilihan pelarut diantaranya selekstivitas, sifat pelarut, kemampuan pelarut untuk mengekstraksi, vadatilitas tinggi, tidak bersifat racun, dan relatif murah (Gamse 2002). Pelarut yang digunakan pada proses ekstraksi harus dapat menembus pori-pori bahan padat sehingga bahan yang ingin diekstrak dapat tertarik.
Pelarut yang digunakan dalam proses ekstraksi maserasi pada penelitian ini ada tiga yaitu akuades, etanol 70%, dan aseton. Ketiga macam pelarut tersebut memiliki tingkat kepolaran masing-masing. Akuades merupakan pelarut paling polar, diikuti etanol 70%, dan aseton. Pelarut polar akan melarutkan senyawa polar. Pelarut yang bersifat semipolar digunakan dengan maksud untuk mendapatkan komponen yang bersifat polar sekaligus nonpolar. Sedangkan pelarut nonpolar akan melarutkan senyawa nonpolar. Ekstrak dari masing-masing pelarut akan diujikan pada Candida tropicalis untuk menentukan aktivitas anticandida yang paling besar. Berdasarkan penelitian dengan tiga kali ulangan untuk masing-masing pelarut diperoleh rata-rata rendemen ekstrak akuades, etanol 70%, dan aseton masing-masing 20.11%, 11.26%, dan 18.38%.
Hasil penelitian menunjukkan nilai rendemen yang paling besar diperoleh pada ekstrak akuades yaitu sebesar 20.11%. Hal ini menunjukkan bahwa komponen yang terdapat pada daun miana terekstrak lebih banyak menggunakan pelarut akuades diabandingkan pelarut aseton dan etanol 70%. Kuantitas rendemen ini tidak dapat digunakan untuk perkiraan banyaknya jenis bioaktif yang terdapat dalam rendemen tersebut (Kresnawaty dan Zainuddin 2009). Hasil rendemen yang didapatkan menunjukkan metabolit sekunder yang terbawa oleh pelarut dan tidak dapat menentukan jenis senyawanya (Ukieyanna 2012).
Konsentrasi Hambat Tumbuh Minimum Ekstrak Kasar Daun Miana
11 kandungan senyawa kimia yang terdapat dalam ekstrak. Kandungan kimia dari ekstrak akuades dan etanol 70% daun miana kemungkinan belum tertarik sempurna karena perbedaan berat molekul (BM), yaitu sebagian besar zat aktif ekstrak memiliki BM tinggi sedangkan sebagian zat aktif ekstrak lainnya memiliki BM yang rendah. Hal tersebut terlihat pada sifat ekstrak yang cepat mengendap apabila didiamkan.
Pelarut ekstrak yang digunakan dalam penelitian ini adalah DMSO (Dimetil Sulfo Oksida) dan aseton. Pemilihan pelarut ini dikarenakan ekstrak daun miana tidak dapat larut dalam akuades. Kontrol negatif yang digunakan adalah pelarut DMSO dan aseton, sedangkan kontrol positif yang digunakan adalah Nistatin. Penggunaan Nistatin sebagai kontrol positif karena Nistatin sering digunakan masyarakat untuk obat keputihan. Nistatin merupakan anticendawan dari golongan polien yang aman terhadap sel mamalia. Nistatin bekerja dengan mengikat sterol (terutama ergosterol) pada membran sel cendawan. Beberapa penelitian melaporkan bahwa ergosterol berkompetisi dengan kolesterol dan menjadi target Nistatin sehingga menghasilkan permeabilitas membran sel cendawan dan diikuti kebocoran komponen intraseluler yang menyebabkan kematian cendawan (Ridawati et al. 2011). Hasil penelitian menunjukkan bahwa Nistatin memberikan efek penghambatan yang besar pada Candida tropicalis jika dibandingkan dengan ekstrak aseton daun miana.
Menurut Yadav dan Bishe (2004) menyatakan bahwa daya hambat tergolong sangat kuat (>20 mm), kuat (10-20 mm), sedang (5-10 mm), dan tergolong lemah (<5 mm). Berdasarkan hasil penelitian, ekstrak aseton daun miana dengan pelarut aseton dan DMSO tergolong lemah, karena hanya memiliki zona hambat <5 mm. Hal ini dapat dikatakan bahwa ekstrak aseton memilki potensi terhadap penghambatan pertumbuhan Candida tropcalis namun tergolong lemah jika dibandingkan dengan Nistatin yang memiliki potensi penghambatan pertumbuhan Candida tropicalis yang kuat. Berdasarkan penelitian Rahmwati (2008), ekstrak aseton daun miana dengan pelarut aseton dengan konsentrasi 100 mg/mL memiliki diameter zona hambat sangat kuat yaitu sebesar 21.5 mm dan 21.0 mm terhadap bakteri S. aureus dan S. epidermidis. Perbedaan yang cukup besar dari diameter zona hambat yang dihasilkan oleh Candida tropicalis disebabkan adanya perbedaan struktur dinding sel dari bakteri dan khamir. Konsentrasi minimum yang dibutuhkan untuk menghambat pertumbuhan khamir lebih tinggi daripada konsentrasi yang digunakan untuk menghambat pertumbuhan bakteri. Daya tahan yang tinggi dari khamir terhadap senyawa antimikrob pada medium pertumbuhan diduga karena struktur selnya yang kompleks dengan dinding sel yang tebal. Khamir tergolong dalam protista tingkat tinggi (eukariotik) (Indrawati dan Wellyzar 2006).
12
Analisis Fitokimia Ekstrak Daun Miana
Analisis fitokimia merupakan cara untuk mengetahui kandungan metabolit sekunder pada suatu tanaman secara kualitatif. Analisis fitokimia dilakukan terhadap ekstrak daun miana dengan berbagai pelarut, yaitu dengan pelarut akuades, etanol 70%, dan aseton. Senyawa-senyawa yang diperiksa keberadaannya adalah saponin, tanin, alkaloid, flavonoid, triterpenoid, dan steroid. Hasil analisis fitokimia dapat dilihat pada Tabel 1. Berdasarkan hasil penelitian, ekstrak daun miana mengandung beberapa senyawa metabolit sekunder. Ekstrak akuades dan etanol 70% daun miana mengandung saponin dan tanin, sedangkan ekstrak aseton daun miana mengandung saponin, tanin, dan triterpenoid. Penelitian Rahmawati (2008) menyatakan bahwa ekstrak daun miana dengan pelarut aseton mengandung tanin dan steroid. Hasil penelitian Yuniar dkk (2013) menyatakan bahwa daun miana mengandung fenolik, flavonoid, dan triterpenoid. Berdasarkan hasil penelitian Setianingrum (2014), ekstrak daun miana dengan pelarut aseton mengandung tanin, saponin, dan steroid. Namun, dari penelitian yang dilakukan, ekstrak daun miana tidak mengandung flavonoid, steroid, dan alkaloid. Hal ini dikarenakan daun yang diambil pada rumpun berbeda menyebabkan perbedaan senyawa metabolit sekunder yang dihasilkan dari suatu tanaman, seperti perbedaan tanah, perolehan cahaya matahari, dan suhu. Hal lain yang menyebabkan perbedaan hasil karena pengaruh reagen untuk uji fitokimia yang mungkin sudah terkontaminasi dengan zat lain sehingga menyebabkan hasil yang diperoleh berbeda. Analisis fitokimia yang dilakukan pada penelitian ini yaitu secara kualitatif yang memungkinkan ketidaktelitian yang tinggi jika dibandingkan dengan analisis fitokimia secara kuantitatif.
Saponin merupakan senyawa aktif metabolit sekunder yang bersifat seperti sabun, serta dapat dideteksi berdasarkan kemampuannya membentuk busa dan menghemolisis sel darah (Harbone 1987). Mekanisme saponin dalam merusak membran adalah dengan membentuk kompleks dengan sterol dalam membran plasma fungi kemudian membentuk agregat. Agregasi ini berikutnya menyebabkan pembentukan pori-pori membran atau ekstraksi sterol dari membran dengan pembentukan kompleksi tubular di luar membran. Hal ini yang merusak cellular semipermeability sehingga mengakibatkan kematian sel. Kemampuan saponin sebagai antijamur diperkuat oleh Cowan (1999) yang menyatakan bahwa saponin berkontribusi sebagai antijamur dengan mekanisme menurunkan tegangan permukaan membran sterol dari dinding sel C. albicans, sehingga permeabilitasnya meningkat. Hasil penelitian menunjukkan ekstrak daun miana mengandung saponin yang diduga dapat menghambat pertumbuhan Candida tropicalis. Namun, ekstrak akuades dan ekstrak etanol 70% tidak memberikan penghambatan terhadap pertumbuhan Candida tropicalis.
13 hal ini menyebabkan sel tidak dapat melakukan aktivitas hidup sehingga pertumbuhannya terhambat atau bahkan mati. Tanin mempunyai daya antifungi dengan cara mengendapkan protein (Masduki 1996). Tanin yang terdapat dalam daun miana adalah senyawa polifenol yang dapat membentuk senyawa kompleks dengan protein. Tanin tidak dapat dicerna lambung dan mempunyai daya ikat dengan protein, karbohidrat, vitamin, dan mineral.
Terpenoid merupakan produk alami yang strukturnya dibagi menjadi beberapa unit isoprene, oleh karena itu senyawa ini disebut juga isoprenoid (C5H8). Unit isoprene disusun atas asetat melalui jalur asam mevalonat dan dihubungkan dengan rantai karbon yang mengandung 2 ikatan tak jenuh. Terpenoid diisolasi dari alam sekitar 20000 dari tanaman, hewan, maupun mikroorganisme. Terpenoid dapat berikatan dengan protein lipid yang terdapat pada membran sel sehingga mengganggu transport nutrisi yang dapat menyebabkan membran sel kekurangan nutrisi sehingga terjadi lisis sel (Nursa et.al 2006). Beberapa hasil penelitian menunjukkan senyawa terpenoid memiliki aktivitas sebagai antimikrob yaitu monoterpenoid linalool, diterpenoid (-) hardwicklic acid, phytol, triterpenoid saponin dan triterpenoid glikosida (Gunawan 2008). Berdasarkan penelitian, hanya ekstrak aseton daun miana yang menunjukkan adanya triterpenoid. Senyawa ini yang diduga memiliki kemampuan menghambat pertumbuhan Candida troipicalis. Ekstrak akuades dan etanol 70% yang mengandung saponin dan tanin tidak memberikan efek penghambatan terhadap pertumbuhan Candida tropicalis. Hal ini menunjukkan banhwa bukan senyawa saponin dan tanin yang dapat menghambat pertumbuhan Candida tropicalis. Ekstrak aseton daun miana kemudian dianalisis lebih lanjut menggunakan GC-MS.
Analisis GC-MS (Gas Chromatography-Mass Spectrometer)
Analisis GC-MS menggunakan gabungan dua instrumen yaitu kromatografi gas dan spektrometer massa. Kromatografi gas berfungsi untuk memisahkan berbagai senyawa dalam campuran didasarkan distribusi senyawa pada fase gerak dan fase diam. Spektrometri massa berfungsi mendeteksi molekul senyawa yang telah dipisahkan berdasarkan pada penguraian senyawa organik dan perekaman pola fragmentasi menurut massanya. Metode GC-MS untuk mengetahui struktur senyawa yang terkandung dalam fraksi paling aktif dari ekstrak terbaik daun miana. Metode ini merupakan gabungan dari metode kromatografi gas dan spektrometri massa. Kromatografi gas merupakan salah satu metode pemisahan yang berdasarkan partisi cuplikan antara fase gerak yang berupa gas pembawa dan fase diam yang menahan cuplikan secara selektif (Sastrohamidjojo dan Pranowo 1985). Metode spektrometri massa didasarkan pada pengubahan molekul netral menjadi ion-ion bermuatan positif dan memisahkannya berdasarkan perbandingan massa terhadap muatan elektron (m/e) (Hendayana 1994). Keuntungan dari metode GC-MS adalah waktu identifikasi yang cepat, sensitivitas tinggi, alat dapat dipakai dalam waktu lama dan pemisahan yang baik (Sastrohamidjojo dan Pranowo 1985).
14
Spectrometer menunjukkan terdapat beberapa senyawa dominan yang terdeteksi dari ekstrak aseton daun miana pada Tabel 2. Waktu retensi yang diperoleh dapat digunakan sebagai salah satu karakteristik untuk mengidentifikasi suatu senyawa (Kopec 2006). Senyawa 2-hexadecen-1-ol, 3, 7, 11, 15-tetramethyl-, [R-[R*,R*-(E)]]- (CAS) phytol dengan rumus molekulnya C20H40O. Senyawa 2-hexadecen-1-ol, 3, 7, 11, 15-tetramethyl-, [R-[R*,R*-(E)]]- (CAS) phytol merupakan acyclic diterpen alkohol yang berfungsi sebagai antimikrob, antiinflammatory dan antikanker (Kalaisezhiyen 2012). Senyawa terpenoid yang bersifat lipofilik dapat menyebabkan gangguan pada membran sel fungi dan dapat melarutkan lipid yang terdapat dalam membran sel (Cowan 1999; Panda 2010). Senyawa neophytadiene dengan rumus molekulnya C20H38 dan berfungsi sebagai antifungi dan antibakteri (Jualang et al. 2013). Senyawa 2, 6, 10, 14, 18, 22-tetracosahexaene, 2, 6, 10, 15, 19, 23-hexamethyl- (CAS) squalene termasuk squalene. Rumus molekulnya C30H50. Squlane termasuk golongan triterpenoid berfungsi sebagai antikanker, antimikrob, antioksidan, dan antitumor (Ramakhrisnan & Venkataraman 2011). Menurut Nakagawa et al. (1985), squalene juga memiliki aktivitas antikanker dan menurunkan kolesterol darah. Berdasarkan hasil analisis GC-MS menunjukkan bahwa senyawa yang terdeteksi sebagian besar merupakan turunan triterpenoid. Hal ini sejalan dengan analisis fitokimia yang dilakukan secara kualitatif. Senyawa triterpenoid dan turunannya diduga memberikan efek penghambatan terhadap pertumbuhan Candida tropicalis.
SIMPULAN DAN SARAN
Simpulan
Ekstrak aseton daun miana memiliki kemampuan untuk menghambat pertumbuhan Candida tropicalis. Konsentrasi 25 mg/mL merupakan konsentrasi ekstrak aseton daun miana minimum yang mampu menghambat pertumbuhan Candida tropicalis dengan diameter zona hambat 1.50 mm dan 1.55 mm. Hal ini dapat dikatakan bahwa ekstrak aseton memilki potensi terhadap penghambatan pertumbuhan Candida tropcalis, tetapi tergolong lemah jika dibandingkan dengan Nistatin. Ekstrak aseton daun miana dianalisis dengan GC-MS dan memilki kandungan senyawa dominan yaitu 2-hexadecen-1-ol, 3, 7, 11, 15-tetramethyl-, [R-[R*,R*-(E)]]- (CAS) phytol dan neophytadiene.
Saran
15
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical and Chemistry. 2006. Official Methods of Analysis. 18th ed. Marylan (US) : Association of Official Analytical Chemsists inc.
[BPOM] Badan Pengawas Obat dan Makanan. 2004. Monografi Ekstrak Tumbuhan dan Obat Indonesia. Jakarta (ID) : BPOM RI.
Cowan MM. 1999. Plant Products as Antimikrobial Agents, Clinical Microbiology Review, 12 (4) : 564 – 582, http: //www. Heart-intl.net/HEART/120104/Plant Productsas Antimicrobil.pdf.
Eraso E, Moragues MD, Villar-Vidal M, Sahand IH, Gonzalez-Gomez N, Ponton J. 2006. Evaluation of the new chromogenic medium Candida ID 2 for isolation and identification of Candida albicans and other medically important Candida species. J Clin Microbiol ; 44:3340-5.
Gamse T. 2002. Liquid-liquid Extraction and Solid-Liquid Extraction. New York (USA) : Graz Pr.
Harborne JB. 1987. Metode Fitokimia. Padmawinata K, Soediri I, penerjemah : Nikosolihin S, editor. Bandung (ID) : Institut Teknologi Bandung. Terjemahan dari : Phytochemical Mathode.
Hendayana S. 1994. Kimia Analitik Instrumen. Edisi kesatu. Semarang (ID) : IKIP Press.
Indrasari, SDP Wibowo, AA Daradjat. 2008. Kandungan mineral beras varietas unggul baru. Prosiding Seminar Nasional Padi; 2008 Jul 23-24; Sukamandi, Bogor, Indonesia. Bogor (ID) : Balai Besar Penelitian Tanaman Padi.
Indrawati G & Wellyzar S. 2006. Mikologi : Dasar dan Terapan. Jakarta (ID) : Yayasan Obor Indonesia.
Jackson, Agboke A, Nwoke V. 2009. In vitro evaluation of antimicrobial activity of combinations of nystatin and Euphorbia hirta leaf extract against Candida albicans by the checkerboard method. Journal of Medicinal Plants Research 3(9) : 666-669.
Jawetz, Melnick, Adelberg. 2005. Mikrobiologi Kedokteran. Jakarta (ID) :
Penerbit Sylvia.
Jualang et al. 2013. Antibacterial and Phytochemicals Investigations of Chromolaenaodorata (1.f) King and Robinson (asteraceae) from Sabah, Malaysia. Journal of Environmental Microbiology and Toxicology 1(1) : 18-24.
Kalaisezhiyen. 2012. GC-MS Evaluation Of Chemical Constituents From Methanolic Leaf Extract Of Kedrotis foetidissima (Jacq.) Cogn. Asian Journal of Pharmaceutical and Research 1(4) : 77-81.
Kresnawaty I, Zainuddin A. 2009. Aktivitas antioksidan dan antibakteri dari derivat metil ekstrak etanol daun gambir (Uncaria gambir). Jurnal Littri 15(4): 145-151.
16
Lies MR, Sri Werdani. 2005. Kandidiasis Kutan dan mukokutan. Dermatomikosis Superfisial. Jakarta (ID) : FKUI.
Masduki. 1996. Efek Antibakteri Ekstrak Biji Pinang (Areca catechu) terhadap S. Aureus dan E. Coli. Jakarta (ID) : Penerbit Cermin Dunia Kedokteran. Mutiatikum, Sukmayati A, Yun A. 2010. Standarisasi simplisia dari buah miana
(Plectranthus seutellaroides (L) R. Bth) yang berasal dari 3 tempat tumbuh Menado, Kupang, dan Papua. Jurnal Biomedis dan farmasi 1(1) : 1-16.
Nakagawa M, Yamaguchi T, Fukawa H, Ogata J, Komiyama S, Akiyama S, Kuwano M. 1985. Potentiation by squalene of the cytotoxicity of anticancer agents against cultured mammalian cells and murine tumor. Jpn. J. Cancer Res.76(4): 315-320.
Puspita PJ. 2010.Optimasi konsentrasi xilosa dan glukosa untuk produksi xilitol oleh Candida tropicalis. [skripsi]. Bogor (ID) : Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Rahmawati F. 2008. Isolasi dan Karakterisasi Senyawa Antibakteri Ekstrak Daun Miana (Coleus scutellariodes [L] Benth.) [skripsi]. Bogor (ID) : Institut Pertanian Bogor.
Ramakrishnan, Venkataraman. 2011. Screening of antioxidant activity, total phenolics and gas chromatography-mass spectrophotometer (GC-MS) study of ethanolic extract of Aporosa lindleyana Bail African, Journal of Biochemistry Research 5(14) : 360-364.
Ridawati, Betty SL, Ita D, Wellyzar S. 2011. Aktivitas antifungal minyak atsiri jinten putih terhadap Candida parapsilosis SS25, C. orthopsilosis NN14, C. metapsilosis MP27, dan C. etchellsii MP18, Makara Sains 15:1.
Ridwan Y, Darusman LK, Satria F, Handaryani E. 2006. Kandungan kimia berbagai ekstrak daun miana (Coleus blumei Benth) dan efek anthelmintika terhadap cacing pita pada ayam. J. II. Pert. Indon. 11(2): 1-6.
Sari PP. 2000. Potensi antimikrob ekstrak biji, daun, kulit akar, dan kulit batang kedawung (Parkia roxburghii G. Don) terhadap bakteri patogen dan perusak makanan. [Skripsi]. Bogor (ID) : Fakultas Teknologi Pertanian, IPB.
Seigler DS. 1998. Plant Secondary Metabolism. Boston : Kluwer Academic. Setiawati M. 2012. Pengaruh Pemberian Larutan Ekstrak Siwak (Salvadora
Persica) Pada Berbagai Konsentrasi Terhadap Pertumbuhan Candida Albicans [skripsi]. Semarang (ID) : Universitas Diponegoro.
Strobel GA. 2002. Microbial gifts from rain forests. Can. Jornal Plant Pathol 24: 14-20
Sundari D & Winarno MW.1996. Pemanfaatan tumbuhan sebagai obat diare di Indonesia. Jurnal Cermin dunia kedokteran 109: 25-32.
Tjay TH, Rahardja K. 2002. Obat-obat Penting : Khasiat, Penggunaan, dan Efek-Efek Sampingnya Edisi VI. Jakarta (ID) : Penerbit PT. Elex Media Komputindo. Halaman 540-541.
Tortora GJ, Funke BR and Case CL.2001. Microbiology an Introduction 7th ed, Addison Wsicy Longman, Inc USA 551-555
17 Ukieyanna E. 2012. Aktivitas antioksidan, kadar fenolik, dan flavonoid tumbuhan
suruhan (Peperomia pellucida L. Kunth) [skripsi]. Bogor (ID) : IPB
Winarto WP. 2007. Tanaman Obat Indonesia untuk Pengobatan Herba Jilid I. Jakarta (ID) : Karyasari Herba Media.
Yadav AV, Bishe SB. 2004. Chistosan : A Potential biomaterial affective against typhoid. Current Sci 9 : 1176-1178.
18
LAMPIRAN
Lampiran 1 Alur penelitian
Lampiran 2 Daun miana, serbuk daun miana dan ekstrak daun miana
Daun Miana Serbuk daun miana Ekstrak akuades, etanol 70%, dan aseton Preparasi sampel
Serbuk simplisia
- Analisis kadar air - Analisis kadar abu
Ekstraksi sampel dengan pelarut akuades, etanol 70%, dan aseton
Ekstrak sampel
Analisis fitokimia Pengujian
anticandidatropicalis
19 Lampiran 3 Formula media Potatoes Dextrosa Agar (PDA)
Setiap 1000 mL media mengandung : Potato : 4 g
Dextrose : 20 g
Agar : 15 g
Akuades : 1000 mL Lampiran 4 Kadar air daun miana
Ulangan Bobot
Lampiran 5 Kadar abu daun miana Ulangan Bobot cawan
20
Perhitungan :
Rendemen (%) = ˟ 100%
=
= 19.86%
Lampiran 7 Uji KHTM ekstrak aseton daun miana pelarut aseton Ulangan (-) aseton (+) Nistatin
Lampiran 8 Uji KHTM ekstrak aseton daun miana pelarut DMSO Ulangan (-) DMSO (+) Nistatin
Lampiran 10 Diameter zona hambat ekstrak aseton daun miana
21 Keterangan :
1 = Aseton dan DMSO 2 = Nistatin
3 = Ekstrak daun miana konsentrasi 200 mg/mL 4 = Ekstrak daun miana konsentrasi 100 mg/mL 5 = Ekstrak daun miana konsentrasi 50 mg/mL 6 = Ekstrak daun miana konsentrasi 25 mg/mL 7 = Ekstrak daun miana konsentrasi 12.5 mg/mL 8 = Ekstrak daun miana konsentrasi 6.25 mg/mL 9 = Ekstrak daun miana konsentrasi 3.125 mg/mL Lampiran 11 Uji fitokimia
Uji Ekstrak
Akuades Etanol 70% Aseton
Saponin
Tanin
Flavonoid
Terpenoid
Steroid
22
Lampiran 12 Hasil analisis GC-MS senyawa ekstrak aseton daun miana
Peak R.Time Konsentrasi % Nama senyawa
1 2,550 0,92 Carbon dioxide (CAS) Dry ice
2 14,765 1,40 2,3-DIHYDRO-BENZOFURAN
3 15,987 0,84 Napthalene, 1,2,3,4-tetrahydro-1,4,6-trimethyl- (CAS) 1,4,6 TRIMETHYL
6 19,571 32,45 2-Hexadecen-1-ol, 3,7,11,15tetramethyl-, [R-[R*,R*-(E)]]- (CAS) Phytol
7 19,705 10,11 NEOPHYTADIENE
8 19,857 12,80 2-Hexadecen-1-ol, 3,7,11,15tetramethyl-, [R-[R*,R*-(E)]]- (CAS) Phytol
9 19,970 1,45 (E)-6,6-Dimethylcyclooct-4-en-1-one 10 20,117 0,86 Hexadecanoic acid, methyl ester (CAS)
Methyl palmitate
11 20,292 1,01 Isophytol
12 20,518 0,70 9-Tricosene, (Z)- (CAS) Muscalure 13 21,462 0,68 2-Hexadecen-1-ol, 3,7,11,15tetramethyl-,
[R-[R*,R*-(E)]]- (CAS) Phytol 14 21,880 0,61 1-Docosanol (CAS) Behenic alcohol
15 22,133 6,18 NEOPHYTADIENE
16 22,133 6,18 NEOPHYTADIENE
17 23,157 0,77 9-Octadecenal, (Z)- (CAS)
CIS-OCTADEC-9-ENAL
18 25,415 1,91 1,2-Benzenedicarboxylic acid, bis (2-ethylhexyl) ester (CAS) Bis (2-ethylhexyl)
19 29,641 9,85 2,6,10,14,18,22-Tetracohexaene,
2,6,10,15,19,23-hexamethyl- (CAS)
22 38,695 1,22 STIGMAST-5-EN-3-OL, OLEAT
23 39,434 2,25
24