KERAGAMAN KOMUNITAS BAKTERI PEMFIKSASI
NITROGEN BERDASARKAN GEN
nif
H DAN 16S rRNA DI
LAHAN SAWAH
RANDI HADIANTA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Keragaman Komunitas Bakteri Pemfiksasi Nitrogen berdasarkan gen nifH dan 16S rRNA di Lahan Sawah adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
RANDI HADIANTA. Keragaman Komunitas Bakteri Pemfiksasi Nitrogen berdasarkan gen nifH dan 16S rRNA di Lahan Sawah. Dibimbing oleh IMAN RUSMANA dan NISA RACHMANIA MUBARIK.
Biological nitrogen fixation merupakan proses penting di alam yang dilakukan oleh bakteri pemfiksasi nitrogen dalam mengubah nitrogen bebas di atmosfer menjadi amonium. Amonium merupakan sumber nitrogen penting di atmosfer. Bakteri pemfiksasi nitrogen dapat hidup bebas maupun bersimbiosis dengan organisme lain seperti tanaman. Kemampuan bakteri pemfiksasi nitrogen mengubah nitrogen bebas menjadi amonium disebabkan enzim nitrogenase yang dimilikinya. Gen nifH merupakan salah satu gen yang dibutuhkan untuk mengekspresikan enzim nitrogenase tersebut. Penggunaan gen nifH sebagai marka dalam analisis keragaman bakteri pemfiksasi nitrogen secara molekuler sudah sering dilakukan. Pendekatan molekuler yang digunakan pada penelitian ini adalah DGGE. Penggunaan gen 16S rRNA sebagai marka bertujuan untuk melihat komunitas total bakteri yang terdapat pada lahan sawah tersebut.
Penggunaan pupuk hayati pada lahan sawah dapat memproduktivitas padi. Produktivitas padi dapat didukung oleh bermacam faktor, antara lain adalah unsur nitrogen. Penelitian terkait hubungan antara penggunaan pupuk hayati dengan produktivitas padi yang terkait dengan keragaman bakteri pemfiksasi nitrogen yang terdapat pada lahan sawah belum pernah dilaporkan. Penelitian ini bertujuan untuk mempelajari keragaman bakteri pemfiksasi nitrogen pada lahan sawah dengan pendekatan DGGE.
Hasil menunjukkan bahwa keragaman bakteri pemfiksasi nitrogen bervariasi pada tiap perlakuan selama masa tanam. Perlakuan kontrol terlihat paling bervariasi di antara perlakuan celup dan sebar. Analisis clustering juga menunjukkan pola keragaman bakteri pemfiksasi nitrogen cenderung mengelompok pada tiap perlakuan. Hal ini berbeda dengan keragaman total bakteri yang dianalisis dengan 16S rRNA. Pola keragaman total bakteri cenderung mengelompok pada tiap masa tanam. Hasil BLAST N menunjukkan bahwa semua sekuen yang ambil dari pita DGGE tergolong kedalam Uncultured bacteria nitrogenase. Hasil ini juga diperkuat dengan hasil BLAST X yang menunjukkan bahwa semua sekuen yang diambil tergolong kedalam protein atau enzim dinitrogenase reductase.
SUMMARY
RANDI HADIANTA. Diversity of Nitrogen Fixing Bacteria Communities based on nifH and 16S rRNA genes in Rice Fields. Supervised by IMAN RUSMANA and NISA RACHMANIA MUBARIK.
Biological nitrogen fixation is an important process in nature that performed by nitrogen-fixing bacteria to transform nitrogen in the atmosphere into ammonium. Ammonium is an important nitrogen source in environment. Nitrogen fixing bacteria can live freely or symbiosis with other organisms such as plants. The ability of nitrogen fixing bacteria to change free nitrogen into ammonium due to its nitrogenase enzyme. NifH gene is one of the genes required to express nitrogenase enzyme. The use of nifH gene as markers in diversity analysis of nitrogen fixing bacteria by molecular basis has been studied oftentimes. The molecular approach used in this study was DGGE. The use of the 16S rRNA gene as a marker aimed to see the total bacterial community found in the rice fields.
The use of bio-fertilizers in rice fields can increase rice productivity. Rice productivity can be supported by a variety of factors such as the nitrogen element. Research related to the relationship between the use of bio-fertilizer and rice productivity associated with the diversity of nitrogen fixing bacteria found in rice fields has not been reported. This research aimed to study the diversity of nitrogen fixing bacteria in rice fields with DGGE approach.
The results indicated the diversity of nitrogen fixing bacteria was various on all treatments during the growing season. Control treatment showed the most varied than soaked and spread treatment. Clustering analysis also showed diversity pattern of nitrogen-fixing bacteria tend to cluster at each treatments. This was in contrast to the total bacterial diversity on 16S rRNA gene diversity analysis. Total bacterial diversity patterns tend to cluster at each growing season. BLAST N results showed that all the sequences that sequenced from DGGE bands were classified as uncultured bacteria nitrogenase. These results were also confirmed by the results of BLAST X which showed that all the sequences were classified into protein or dinitrogenase reductase enzyme.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Mikrobiologi
KERAGAMAN KOMUNITAS BAKTERI PEMFIKSASI
NITROGEN BERDASARKAN GEN
nif
H DAN 16S rRNA DI
LAHAN SAWAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2013 hingga Mei 2014 ini ialah bakteri pemfiksasi nitrogen, dengan judul Keragaman Komunitas Bakteri Pemfiksasi Nitrogen berdasarkan gen nifH dan 16S rRNA di Lahan Sawah
Terima kasih penulis ucapkan kepada Bapak Dr Ir Iman Rusmana MSi dan Ibu Dr Nisa Rachmania Mubarik MSi selaku pembimbing, serta Bapak Dr Ir Aris Tjahjoleksono selaku penguji yang telah banyak memberi saran. Ungkapan terima kasih juga penulis sampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Terima kasih juga penulis ucapkan kepada rekan rekan Mikrobiologi 2012 dan 2013, rekan-rekan Lab Mikrobiologi, IR CREW atas dukungan, saran dan bantuan sehingga saya dapat menyelesaikan karya ilmiah ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
TINJAUAN PUSTAKA 2
Fiksasi Nitrogen 2
Diazotrof 3
Metagenomik 5
METODE 6
Bahan 6
Alat 7
Sampling Tanah 7
Pengukuran Tinggi Tajuk dan Jumlah Anakan Padi 7
Ekstraksi DNA 7
Amplifikasi DNA 8
Denaturing Gradient Gel Electrophoresis 9
Sekuensing dan Pembuatan Pohon Filogeni 10
HASIL DAN PEMBAHASAN 10
Hasil 10
Pembahasan 18
SIMPULAN DAN SARAN 24
Simpulan 24
Saran 24
DAFTAR PUSTAKA 24
LAMPIRAN 28
DAFTAR TABEL
1 Perlakuan tanah yang dilakukan 7
2 Kondisi PCR nifH 9
3 Kondisi PCR 16S rRNA 9
4 Runutan sekuen primer yang digunakan 9
5 Hasil ekstraksi DNA dengan menggunakan Power Soil DNA
Isolation Kit 12
6 Hasil BLAST-N sekuen dari gen nifH 16
7 Hasil BLAST-X sekuen dari gen nifH 17
DAFTAR GAMBAR
1 Reaksi penambatan nitrogen 3
2 Mekanisme Denaturing Gradient Gel Electrophoresis 6 3 Tinggi dan jumlah anakan padi pada perlakuan kontrol, celup, dan
sebar 11
4 Bobot basah dari rumpun, akar dan gabah padi pada perlakuan
kontrol, celup, dan sebar 11
5 Bobot kering dari rumpun, akar dan gabah padi pada perlakuan
kontrol, celup, dan sebar 12
6 Hasil amplifikasi gen nifH dengan primer PolF-GC/PolR pada gel
agarosa 1.5% 13
7 Hasil amplifikasi gen 16S rRNA dengan primer
PRBA338F/PRUN518R pada gel agarosa 1.5% 13
8 Hasil analisis DGGE gen nifH 14
9 Hasil analisis DGGE gen 16S rRNA 15
10 Hasil amplifikasi ulang pita hasil DGGE dengan primer non GC
Clamp agarosa 1.5% dengan marker 100bp 15
11 Pohon filogeni dari 8 sekuen gen nifH yang diperoleh dari analisis
DGGE 17
12 Analisis clustering dari tiap perlakuan pada DGGE gen nifH 20 13 Analisis clustering dari tiap perlakuan pada DGGE gen 16S rRNA 22
DAFTAR LAMPIRAN
1 Hasil uji Balai Penelitian Tanah 28
2 Segitiga tanah USDA 29
3 Runutan basa, BLAST N, dan BLAST X pita 1 30 4 Runutan basa, BLAST N, dan BLAST X pita 2 31 5 Runutan basa, BLAST N, dan BLAST X pita 3 32 6 Runutan basa, BLAST N, dan BLAST X pita 4 33 7 Runutan basa, BLAST N, dan BLAST X pita 5 34 8 Runutan basa, BLAST N, dan BLAST X pita 6 35 9 Runutan basa, BLAST N, dan BLAST X pita 7 36 10 Runutan basa, BLAST N, dan BLAST X pita 8 37 11 Surat pernyataan untuk penerbitan artikel di jurnal Advanced in
PENDAHULUAN
Latar Belakang
Nitrogen merupakan unsur makro yang diperlukan oleh tanaman namun komposisi nitrogen sebanyak 78% di atmosfer tersebut tidak dapat dimanfaatkan langsung oleh tanaman. Tanaman hanya mampu menyerap nitrogen yang terlarut di dalam tanah dengan menggunakan akar. Nitrogen dibutuhkan oleh tanaman dalam jumlah banyak, antara lain sebagai penyusun protein. Defisiensi nitrogen pada tanaman dapat mengganggu pertumbuhan dan produktivitas tanaman. Pemenuhan suplai nitrogen di tanah dapat dilakukan dengan cara pemupukan atau secara alamiah dengan bantuan mikroorganisme. Biological nitrogen fixation merupakan proses penting di alam yang dilakukan oleh bakteri pemfiksasi nitrogen dalam mengubah gas nitrogen bebas di atmosfer menjadi amonium. Amonium merupakan sumber nitrogen terpenting dalam ekosistem. Menurut Arshad dan Frankenberger (1993), fiksasi N2 secara biologi menyumbang sekitar 70% dari semua nitrogen yang difiksasi di bumi dan sekitar 90% kebutuhan nitrogen tanaman dapat dihasilkan oleh gabungan ini. Bakteri pemfiksasi nitrogen dapat hidup secara bebas (free living) dan dapat pula hidup bersimbiosis dengan tanaman. Biological nitrogen fixation hanya terbatas pada prokariot, karena belum dijumpai eukariot yang mampu melakukan fiksasi nitrogen (Bottomley dan Myrold 2007).
Kemampuan bakteri pemfiksasi nitrogen dalam mengubah nitrogen bebas di atmosfer menjadi amonium disebabkan oleh enzim nitrogenase yang dimilikinya. Enzim nitrogenase terdiri atas dua subunit yaitu dinitrogenase dan dinitrogenase reduktase. Enzim dinitrogenase disandikan oleh gen nifD dan nifK, sedangkan enzim dinitrogenase reduktase yang disandikan oleh gen nifH. Keragaman bakteri pemfiksasi nitrogen dapat diketahui dengan pendekatan molekuler. Salah satu teknik molekuler yang dapat digunakan ialah dengan menggunakan metode DGGE (denaturing gradient gel electrophoresis).
DGGE dapat membedakan spesies berdasarkan perbedaan komposisi GC dari sekuen DNA yang dianalisis (Muyzer et al. 1993). Hal ini dapat disebabkan oleh penggunaan gradien denaturan pada gel yang digunakan. Keragaman bakteri pemfiksasi nitrogen dipelajari berdasarkan gen nifH. Penggunaan gen nifH dalam DGGE sudah lazim digunakan dan terbukti lebih akurat untuk mendeteksi keragaman bakteri pemfiksasi nitrogen yang terdapat pada tanah (Coelho et al. 2008; Wartiainen et al. 2008; Coelho et al. 2009; Perez et al. 2014).
2
Perumusan Masalah
Keragaman bakteri pemfiksasi nitrogen pada lahan sawah dapat mempengaruhi produktivitas padi dengan aplikasi pupuk hayati di lapangan. Namun, keragaman bakteri yang begitu kompleks dan hingga sekarang tidak semua bakteri dapat ditumbuhkan pada media buatan di laboratorium maka dibutuhkan suatu pendekatan. Pendekatan molekuler dengan teknik DGGE dapat digunakan untuk menjawab dan mempelajari keragaman bakteri pemfiksasi nitrogen pada lahan sawah.
Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari keragaman komunitas bakteri pemfiksasi nitrogen berdasarkan gen fungsional nifH dan 16S rRNA di lahan sawah, desa Cicurug, Sukabumi.
Manfaat Penelitian
Penelitian ini diharapkan mendapatkan informasi mengenai keragaman komunitas bakteri pemfiksasi nitrogen di lahan sawah, desa Cicurug, Sukabumi. Selain itu, penelitian ini diharapkan menjadi referensi terkait penelitian komunitas bakteri berdasarkan gen fungsional lainnya dengan metode DGGE.
Ruang Lingkup Penelitian
Penelitian ini meliputi pengambilan sampel tanah sawah, pengukuran parameter tinggi dan jumlah anakan padi, ekstraksi DNA asal tanah sawah perbulan, amplifikasi DNA, analisis DGGE, sekuensing dan pembuatan pohon filogeni.
TINJAUAN PUSTAKA
Fiksasi Nitrogen
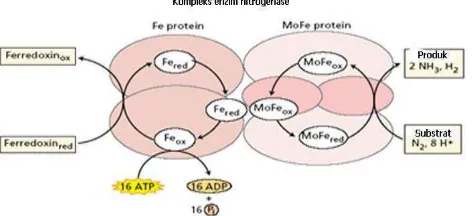
3 oleh dua komponen utama yang saling menunjang satu sama lain yaitu protein Fe (komponen I) dan protein Mo-Fe (komponen II) (Hamdi 1982; Shilov 1992).
Protein Fe berukuran lebih kecil dari protein Mo-Fe dan mempunyai dua sub-unit serupa berukuran masing-masing 30 sampai dengan 72 kDa, tergantung organismenya. Setiap subunit berisi satu kluster besi-belerang (4 Fe dan 4 S2–) yang turut ambil bagian dalam reaksi redoks yang terlibat dalam konversi N2 menjadi NH3. Protein Mo-Fe mempunyai empat sub-unit, dengan masa total satu molekul sekitar 180 sampai dengan 235 kDa, tergantung pada spesies organismenya pula. Setiap subunit mempunyai dua kluster Mo–Fe–S (Gambar 1). Enzim nitrogenase sangat sensitif terhadap oksigen (Salisbury dan Ross 1995), karena protein Fe dan protein Fe-Mo dari nitrogenase didenaturasi secara oksidatif oleh oksigen. Protein Fe akan menjadi tidak aktif apabila terpapar oksigen dengan waktu paruh kerusakan dari 30 sampai dengan 45 detik. Protein Mo-Fe juga menjadi tidak aktif oleh oksigen, dengan satu waktu paruh 10 menit (Dixon dan Wheeler 1986). Kedua molekul protein Fe akan bersenyawa dengan 1 molekul protein Mo-Fe untuk membentuk nitrogenase aktif di dalam sel sel bakteroid atau sel-sel Azotobacter (Hamdi 1982). Enzim nitrogenase sangat sensitif terhadap oksigen, sehingga masing-masing bakteri memiliki cara tersendiri untuk menjaga dan mengatasinya.
Gambaran terperinci dari pengikatan ATP, pengangkutan elektron dan pengikatan substrat di antara kompenan-kompenan nitrogenase secara sederhana (Gambar 1). Senyawa protein Fe dari nitrogenase menerima elektron-elektron berpotensial rendah dari Ferredoxin dan Flavodoxin, kemudian protein Fe bergabung dengan ATP menghasilkan suatu senyawa FeMgATP yang potensial oksidasinya rendah. Hanya satu molekul MoMgATP hasil reduksi yang dapat berlaku sebagai pereduksi protein Mo-Fe. Terbukti bahwa Mo-Fe yang berperan dalam penambatan N2 (Siegbahn et. al. 1998).
Gambar 1 Reaksi penambatan nitrogen (Taiz dan Zeiger 2002)
Diazotrof
4
mikroorganisme ini mampu mengambil sendiri dari N2 bebas dari atmosfer . Semua diazotrof memiliki enzim nitrogenase dalam bentuk subunit enzim berupa protein Fe dan protein Mo-Fe.
Diazotrof tersebar luas pada kelompok bakteri dan beberapa arkea. Akan tetapi, pada satu spesies yang mampu memfiksasi nitrogen dapat ditemukan galur dari spesies tersebut yang tidak dapat memfiksasi nitrogen (Postgate 1998). Fiksasi nitrogen akan berhenti ketika sumber nitrogen lain tersedia, hal ini menyangkut efisiensi energi. Selain itu, fiksasi nitrogen akan berhenti pada saat konsentrasi oksigen tinggi.
Secara garis besar, diazotrof terbagi menjadi 2 kelompok utama yaitu diazotrof yang hidup bebas dan diazotrof simbiotik (Moat et al. 2002). Diazotrof yang hidup bebas, dapat dikelompokkan berdasarkan kebutuhan oksigennya (aerob dan anaerob). Diazotrof dapat bersifat aerob heterotrof, seperti: Azotobacter, Derxia, Azomonas, Biejerinkia, Nocardia, Pseudomonas. Selain itu dapat bersifat aerob fototrof, seperti: Anabaena, Calothrix, Nostoc, Gleotheca, Cylindrospermum, Aphanocapsa. Diazotrof bebas juga dapat ditemukan bersifat fakultatif heterotrof, seperti: Enterobacter cloacae, Klebsiella pneumoniae, Bacillus polymyxa, Desulfovibrio desulfuricans, D. gigas, Achromobacter.
Selain bersifat aerob, diazotrof yang hidup bebas juga dapat bersifat anaerob yaitu anaerob heterotroph, seperti: Clostridium pasteurianum, C. butyricum, Propionispira arboris. Selain itu dapat juga bersifat anaerob fototrof, seperti: Chromatium vinosum, Rhodospirillum rubrum, Rhodopseudomonas sphaeroides, R. capsulata, Rhodomicrobium vernielli, Rhodocyclus, Chlorobium limocola. Kelompok terakhir diazotrof dapat bersifat non-fotosintetik heterotrof seperti: Methanobacterium, Methylococcus, Methylosinus, Methanococcus, Methanococcus, dan Methanosarcina (Moat et al. 2002).
Diazotrof simbiotik dapat ditemukan hidup bersimbiosis dengan berbagai organisme baik dari golongan tumbuhan maupun hewan. Simbiosis dengan berbagai genus tanaman legum, seperti: Azorhizobium caulindans dengan Sesbania rostrata, Allorhizobium undicola dengan lotus (Lotus albic), Bradyrhizobium japonicum dengan kedelai (Glycine max), Mesorhizobium amorphae, dengan false indigo (Amorpha fruticosa), Rhizobium trifolii, dengan clover (Trifolium, Crotolaria) dan Sinorhizobium meliloti, dengan alfalfa (Medicago sativa). Diazotrof dari golongan aktinomiset (Frankia sp.) bersimbiosis dengan angiospermae yaitu alder (Alnus), bog myrtle atau sweet gale (Myrica), oleasters (Shepherdia, Eleagnus, Hippophae) dan New Jersey tea (Ceanothus). Selain itu juga terdapat Klebsiella aerogenes yang bersimbiosis tanaman berdaun dan membentuk struktur seperti seperti nodul (Moat et al. 2002).
5
Metagenomik
Metagenomik merupakan studi tentang metagenom, yaitu bahan genetik yang secara langsung diambil dari lingkungan atau dapat juga disebut studi yang mempelajari metagenom yaitu keseluruhan DNA dari suatu ekosistem secara lengkap (bukan dari satu organisme saja). Istilah metagenomik pertama kali digunakan Handelsman et al. (1998). Namun, istilah ini kemudian diperbaiki oleh Chen dan Pachter (2005) yaitu penerapan teknik genomik modern untuk studi komunitas mikrob secara langsung di lingkungan alami mereka, tanpa melewati tahapan isolasi dan pengayaan di laboratorium. Definisi ini mengacu pada prinsip bahwa jenis mikrob yang tidak dapat dikulturkan (unculturable) lebih banyak dibandingkan yang dapat dikulturkan (culturable).
Kemampuan dari metagenomik dalam mengungkap keragaman komunitas sampel mikrob dari lingkungan yang sebelumnya tidak dapat dijangkau oleh teknik isolasi membuat teknik ini menjadi harapan baru untuk mempelajari dunia mikrob. Metagenomik menawarkan suatu potensi dan perubahan yang revolusioner dalam pemahaman terhadap dunia mikrob dan kehidupan (Marco 2011).
Metagenomik berbasis keanekaragaman mikrob di lingkungan. Untuk itu dibutuhkan teknik molekuler dalam analisisnya. Beberapa teknik berbasis molekuler yang digunakan untuk menganalisis keanekaragaman mikrob adalah Denaturing Gradient Gel Electrophoresis (DGGE), Fluorescent in-situ Hybridization (FISH), Terminal Restriction Fragment Length Polymorphism (TRFLP) dan Amplified Ribosomal DNA Restriction Analysis (ARDRA) (Marsh et al. 2000). Tujuan dari semua teknik di atas sama, yaitu memperoleh informasi cetak biru dari suatu mikrob (DNA) yang nantinya akan disekuensing sehingga diketahui runutan basanya.
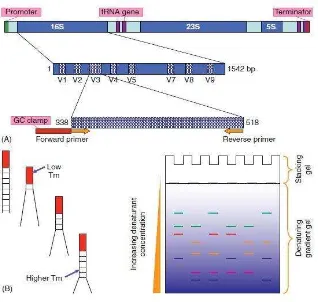
DGGE merupakan salah satu teknik molekuler dalam analisis metagenomik. Prinsip dari DGGE adalah elektroforesis dengan penggunaan gel denaturan yang bergradien (Gambar 2). Teknik DGGE dapat memisahkan DNA dari suatu mikrob berdasarkan Tm (melting temperature) dan komposisi GC dari DNA mikrob tersebut (Muyzer et al. 1993) karena pada dasarnya setiap mikrob memiliki runutan basa DNA yang berbeda beda. Keunggulan utama DGGE dibandingkan teknik molekuler lain seperti T-RFLP dalam menganalisis keragaman bakteri ialah amplikon PCR yang terpisah-pisah pada gel dapat dielusi, diamplifikasi ulang, diklon dan kemudian disekuensing sehingga dapat diketahui taksonomi dan filogeni tentang sampel yang dianalisis (Bottomley dan Myrold 2007).
6
Gambar 2 Mekanisme Denaturing Gradient Gel Electrophoresis
METODE
Penelitian ini dilaksanakan pada bulan Juni 2013 – Mei 2014. Penelitian di lapang dilakukan di persawahan desa Cidahu, Kecamatan Cicurug, Kabupaten Sukabumi, Jawa Barat. Analisis dilakukan Laboratorium Mikrobiologi dan Laboratorium Terpadu, Departemen Biologi, FMIPA, Institut Pertanian Bogor.
Bahan
7 Tabel 1 Perlakuan tanah yang dilakukan
No Perlakuan Kondisi Pemupukan
1 Kontrol 300 kg/ha NPK
2 Celup Pupuk hayati* dicelup + 200 kg/ha NPK 3 Sebar Pupuk hayati* disebar + 200 kg/ha NPK)
*: Pupuk hayati yang digunakan merupakan konsorsium dari isolat bakteri metanotrof
Alat
Peralatan khusus yang digunakan antara lain Nano Drop 2000 (Thermo Scientific, Wilmington, DE, USA), T-Gradient Thermocycler (Biometra GmbH, Goettingen, Germany), D Code Universal Mutation Detection System (Bio-Rad, Hercules, CA, USA), G:BOX (Syngene, Frederick, MD, USA).
Sampling Tanah
Tanah sawah pada perlakuan kontrol, celup dan sebar diambil dengan menggunakan syringe ukuran 10 mL sebanyak 2 kali ulangan tiap perlakuan.
Luasan petak sawah pada tiap perlakuan bervariasi. Petak kontrol memiliki luas sebesar 150 m2. Petak celup dan petak sebar memiliki luas sebesar 600 m2.
Pengambilan tanah dilakukan setiap bulan selama 3 kali selama masa tanam padi, yaitu 30 HST (Hari Setelah Tanam), 60 HST, dan 90 HST. Sebanyak ±1 kg tanah pada tiap perlakuan diambil pada awal dan akhir masa tanam dikirim dan dianalisis di Balai Penelitian Tanah, Bogor untuk mengetahui karakteristik fisik dan kimiawi dari tanah tersebut.
Pengukuran Tinggi Tajuk dan Jumlah Anakan Padi
Setiap petak sawah yang diberi perlakuan, ditandai 10 rumpun tanaman padi yang akan dijadikan patokan pengukuran setiap bulannya. Pengukuran yang dilakukan terdiri atas tinggi tajuk dan jumlah anakan setiap rumpun. Pengukuran bobot basah dan bobot kering dari rumpun, akar dan gabah juga dilakukan pada akhir masa penanaman.
Ekstraksi DNA
Ekstraksi DNA dilakukan dengan menggunakan Power Soil DNA Isolation Kit (Mobio Laboratories, Carlsbad, CA, USA). Prosedur yang digunakan seperti yang disarankan oleh produsen. Sebanyak 0.25 gram tanah dimasukkan ke dalam PowerBead Tube yang telah disediakan, kemudian dikocok dengan menggunakan vortex sekitar 5 menit.
8
g selama 30 detik pada suhu ruang. Selanjutnya, supernatan hasil sentrifuse dipindahkan ke dalam tabung mikro baru sebanyak 400 - 500 µL.
Sebanyak 250 µL larutan C2 (larutan IRT/Inhibitor Removal TechnologyTM) dimasukkan ke dalam tabung mikro kemudian dikocok selama 5 detik dengan vorteks lalu diinkubasi pada suhu 4 °C selama 5 menit. Setelah diinkubasi, tabung mikro lalu disentrifuse pada kondisi 10000 x g selama 60 detik pada suhu ruang. Setelah disentrifuse, sebanyak 500 - 600 µL supernatan dipindahkan ke tabung tabung mikro yang baru.
Sebanyak 200 µL larutan C3 (larutan IRT/Inhibitor Removal TechnologyTM) ditambahkan pada tabung mikro kemudian dikocok selama 5 detik dengan vorteks lalu diinkubasi pada suhu 4 °C selama 5 menit. Setelah inkubasi, tabung mikro disentrifuse pada kondisi 10000 x g selama 60 detik pada suhu ruang. Setelah disentrifuse, 750 µL supernatan dipindahkan ke dalam tabung mikro yang baru.
Sebanyak 1200 µL larutan C4 (larutan garam) dimasukkan ke dalam tabung mikro kemudian dikocok dengan vorteks selama 5 detik. Sebanyak 675 µL larutan yang telah dikocok tadi dimasukkan ke dalam spin filter kemudian disentrifuse pada kondisi 10000 x g selama 60 detik pada suhu ruang. Setelah itu buang cairan yang terdapat pada bawah tabung spin filter, lalu dimasukkan lagi 675 µL larutan sebelumnya kemudian disentrifuse kembali pada kondisi 10000 x g selama 60 detik pada suhu ruang. Cairan yang terdapat pada bawah tabung spin filter dibuang kemudian dimasukkan lagi sisa larutan sebelumnya, kemudian disentrifuse pada kondisi 10000 x g selama 60 detik, lalu cairan yang terdapat pada bawah tabung filter dibuang.
Sebanyak 500 µL larutan C5 (larutan pencuci) dimasukkan ke dalam tabung filter kemudian disentrifuse pada kondisi 10000 x g selama 30 detik pada suhu ruang. Setelah disentrifuse, cairan yang terdapat pada bawah tabung filter dibuang, kemudian tabung disentrifuse ulang pada kondisi 10000 xg selama 60 detik pada suhu ruang. Setelah sentrifuse, tabung filter dipindahkan ke dalam tabung mikro baru.
Sebanyak 100 µL larutan C6 (larutan elusi) dimasukkan ke dalam tabung, kemudian disentrifuse pada kondisi 10000 xg selama 30 detik. Setelah sentrifuse selesai, spin filter dibuang. DNA hasil ekstraksi tedapat pada tabung sekitar 100 µL dan siap digunakan untuk proses lanjutan seperti PCR. Hasil ekstraksi dicek kualitasnya dengan menggunakan NanoDrop 2000 (Thermo Scientific, Wilmington, DE, USA).
Amplifikasi DNA
DNA yang telah di elektroforesis kemudian di amplifikasi dengan teknik PCR. Amplifikasi gen nifH menggunakan KAPA Hot Start Readymix (KAPA Biosystems, Wilmington, MA, USA). Komposisi mix antara lain 12.5 µL KAPA Hotstart Ready Mix 2X, 1.25 µL forward primer 10 pmol (0.5 µM), 1.25 µL reverse primer 10 pmol (0.5 µM), 3 µL template DNA (~100 ng) dan 7 µL nuclease free water. Amplifikasi dilakukan selama 30 siklus (Tabel 2).
9 primer 100 pmol (0.5 µM), 3 µL template DNA (~100 ng) dan 21 µL nuclease free water. Amplifikasi dilakukan selama 30 siklus (Tabel 3) dengan menggunakan T-Gradient Thermocycler (Biometra GmbH, Goettingen, Germany). Runutan primer yang digunakan untuk amplifikasi nifH dan 16S rRNA tersaji pada Tabel 4.
Hasil amplifikasi kemudian dicek ukurannya dengan cara dimigrasi sebanyak 5 µL pada gel agarosa 1.5 %, 80 volt selama 1 jam. Hasil migrasi kemudian diwarnai dengan Ethidium bromide 0.1% selama 15 menit kemudian dilihat di bawah UV Transiluminator dan Gel Doc untuk didokumentasikan. Produk PCR yang tersisa disimpan pada suhu -20 ºC sebelum dianalisis dengan
Tabel 3 Kondisi PCR 16S rRNA (Edenborn dan Sexstone 2007)
Tahapan Kondisi PCR
Tabel 4 Runutan sekuen primer yang digunakan Nama
Primer
Sekuen Referensi
PolF* 5’-TGCGAYCCSAARGCBGACTC-3’ Poly et al. (2001) PolR 5’-ATSGCCATCATYTCRCCGGA-3’ Poly et al. (2001) PRBA338F* 5’-ACTCCTACGGGAGGCAGCAG-3’ Ovreas et al. (1997) PRUN518R 5’-ATTACCGCGGCTGCTGG-3’ Ovreas et al. (1997) * Sekuen GC Clamps (5’-CGCCCGCCGCGCCCCGCGCCCGTCCCGCCGCCCCCGCCCG-‘3) (Rosado et al. 1998) dihibridisasi pada ujung 5’ primer forward.
Denaturing Gradient Gel Electrophoresis
10
selama 6 jam. Prosedur di atas untuk gen nifH, sedangkan untuk gen 16S rRNA menggunakan gradient 30% - 70% dengan kondisi tegangan 150 volt selama 5 jam.
Setelah migrasi selesai, gel direndam dan diwarnai dengan SYBR Safe (Invitrogen-Molecular Probes, Carlsbad, CA, USA) selama 1 jam. Visualisasi gel dilakukan dengan menggunakan G:BOX (Syngene, Frederick, MD, USA). Pita yang muncul kemudian dipotong dan dimasukkan ke dalam tabung mikro yang berisi 50 µ L ddH2O lalu disimpan pada suhu 4 ºC. Hasil foto gel akrilamid dengan G:BOX dianalisis dengan menggunakan software Phoretix 1D (Total Lab) untuk mengestimasi total pita yang muncul.
Sekuensing dan Pembuatan Pohon Filogeni
Supernatan dari tiap pita yang dipotong dicek dengan Nanodrop 2000 untuk mengetahui jumlah DNA yang terdapat didalamnya. Sebanyak 10 µL (~50 ng) supernatan diamplifikasi ulang menggunakan primer tanpa GC Clamps dengan kondisi PCR yang sama seperti sebelumnya. Produk PCR kemudian dikirim ke perusahaan jasa sekuensing (1stBASE Malaysia).
Hasil sekuensing dibandingkan dengan database dari dari situs NCBI (www.ncbi.nlm.nih.gov) dengan program Basic Local Alignment Search Tool Nucleotide (BLAST-N) dan BLAST-X. Pensejajaran sekuen nukleotida dan konstruksi pohon filogeni dilakukan dengan menggunakan piranti lunak MEGA 5.2 (Tamura et al. 2011). Konstruksi pohon menggunakan metode Neighbour Joining dengan best model Tamura 3 Parameter dan nilai bootstrap 1000X.
HASIL DAN PEMBAHASAN
Hasil
Karakteristik Tanah
Tanah pada petak perlakuan kontrol tersusun dari 10% pasir, 43% debu dan 47% liat. Tanah pada petak perlakuan celup tersusun dari 16% pasir, 33% debu dan 51% liat. Tanah pada petak perlakuan sebar tersusun 18% pasir, 38% debu dan 48% liat. Petak kontrol, celup, dan sebar memiliki kisaran pH yang sama, yaitu pH 5. Kandungan karbon dari petak kontrol, celup, dan sebar secara berurutan ialah 1.97%, 1.81%, dan 1.91%. Kandungan nitrogen dari petak kontrol, celup, dan sebar secara berurutan ialah 0.17%, 0.17% dan 0.14%. Rasio C/N dari tiap petak ialah 12, 11 dan 14 (Lampiran 1).
Pengukuran Tinggi Tajuk dan Jumlah Anakan Padi
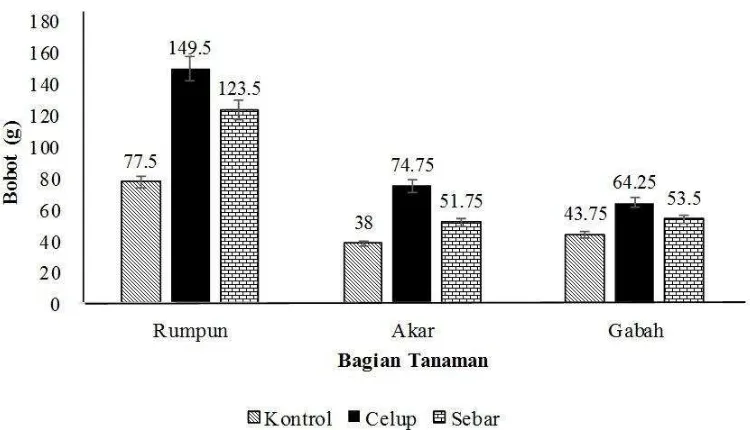
11 Jumlah rataan anakan pada perlakuan celup dan sabar yang sama, menempati tempat di atas perlakuan kontrol. Perlakuan celup dan sebar memiliki rataan jumlah anakan 26, sedangkan perlakuan kontrol hanya 16 jumlah anakan (Gambar 3).
Gambar 3 Tinggi dan jumlah anakan padi pada perlakuan kontrol, celup, dan sebar pada 90 HST
Parameter lainnya yang diukur ialah bobot basah dan bobot kering dari tiap perlakuan. Komponen yang diukur ialah akar, rumpun dan gabah. Perlakuan celup memiliki bobot basah dan bobot kering tertinggi dibandingkan dua perlakuan lain pada semua komponen yang diukur. Perlakuan sebar menempati urutan kedua sedangkan perlakuan kontrol menempati urutan ketiga (Gambar 4 dan 5).
12
Gambar 5 Bobot kering dari rumpun, akar, dan gabah padi pada perlakuan kontrol, celup, dan sebar pada 90 HST
Ekstraksi DNA
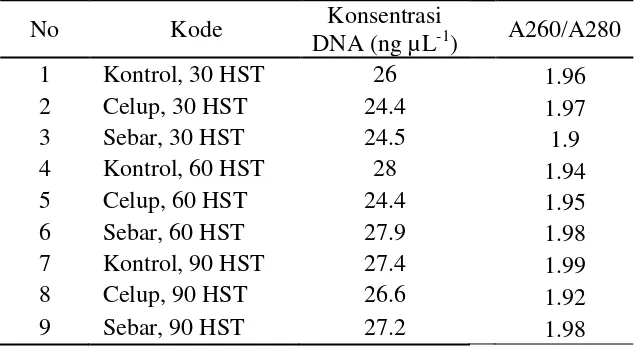
DNA yang diekstrak dari tanah dengan menggunakan Power Soil DNA Isolation Kit menunjukkan hasil yang bervariasi berkisar 24 ~ 28 ng/µ L (Tabel 5). Hasil menunjukkan pola yang hampir konsisten pada setiap perlakuan pada setiap pengambilan. Konsentrasi DNA tertinggi diperoleh pada perlakuan kontrol 60 HST, sekitar 28 ng µL-1. Konsentrasi DNA terendah diperoleh pada perlakuan celup 30 HST dan celup 60 HST, yaitu sekitar 24.4 ng µL-1.
Tabel 5 Hasil ekstraksi DNA dengan menggunakan Power Soil DNA Isolation Kit
No Kode Konsentrasi
DNA (ng µL-1) A260/A280
1 Kontrol, 30 HST 26 1.96
2 Celup, 30 HST 24.4 1.97
3 Sebar, 30 HST 24.5 1.9
4 Kontrol, 60 HST 28 1.94
5 Celup, 60 HST 24.4 1.95
6 Sebar, 60 HST 27.9 1.98
7 Kontrol, 90 HST 27.4 1.99
8 Celup, 90 HST 26.6 1.92
13
Amplifikasi DNA
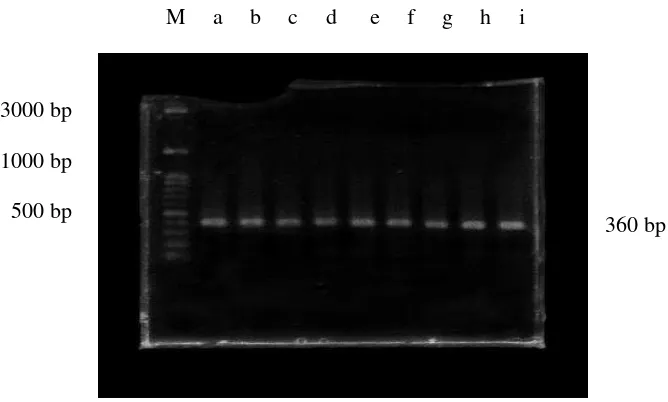
Sembilan sampel yang diamplifikasi dengan primer PolF-GC/PolR berhasil diperoleh. Ukuran fragment sesuai dengan yang diharapkan, yaitu 360 bp (Gambar 6) dan pita yang diperoleh single band. Pengecekan dilakukan pada gel agarosa 1.5%.
Gambar 6 Hasil amplifikasi gen nifH dengan primer PolF-GC/PolR pada gel agarosa 1.5%. Sumur dari kiri ke kanan: marker 100 bp, (a) kontrol 30 HST, (b) celup 30 HST, (c) sebar 30 HST, (d) kontrol 60 HST, (e) celup 60 HST, (f) sebar 60 HST, (g) kontrol 90 HST, (h) celup 90 HST, (i) sebar 90 HST
Sembilan sampel yang diamplifikasi dengan primer 16S PRBA338F/PRUN518R berhasil diperoleh. Ukuran fragment sesuai dengan yang diharapkan, yaitu 196 bp (Gambar 7) dan pita yang diperoleh single band. Pengecekan dilakukan pada gel agarosa 1.5%.
Gambar 7 Hasil amplifikasi gen 16S rRNA dengan primer PRBA338F/PRUN518R pada gel agarosa 1.5%. Sumur dari kiri ke kanan: marker 100 bp, (a) kontrol 30 HST, (b) celup 30 HST, (c) sebar 30 HST, (d) kontrol 60 HST, (e) celup 60 HST, (f) sebar 60 HST, (g) kontrol 90 HST, (h) celup 90 HST, (i) sebar 90 HST
M a b c d e f g h i
3000 bp
1000 bp
500 bp
360 bp
M a b c d e f g h i
3000 bp
1000 bp
500 bp
14
Profil DGGE
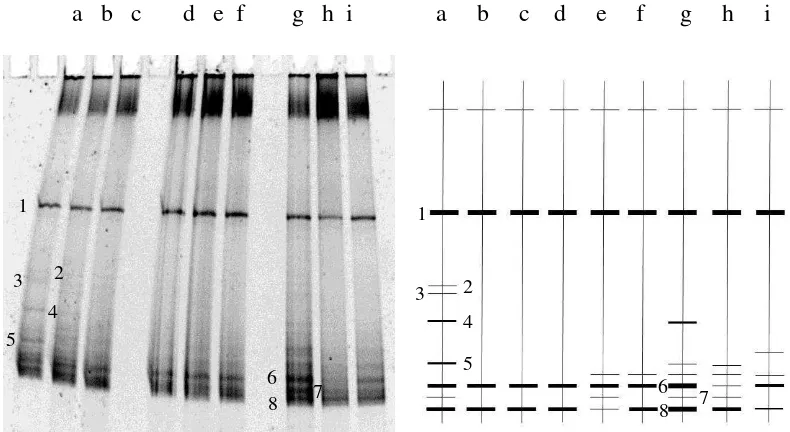
Hasil DGGE berhasil memisahkan sampel yang dianalisis menjadi beberapa pita yang terpisah. Masing-masing pita yang terpisah mewakili satu spesies tersendiri. Pada DGGE untuk analisis gen nifH, terdapat 3 pita yang selalu muncul pada tiap perlakuan tiap bulannya. Perlakuan kontrol, memiliki jumlah pita yang terbanyak dengan variasi berbeda tiap bulannya. Perlakuan celup, cenderung tetap tiap bulan dengan 2 pita. Perlakuan sebar, terjadi peningkatan pita tiap bulan dari 4 pita pada bulan pertama menjadi 6 pita pada bulan ketiga (Gambar 8).
Hasil DGGE dengan menggunakan 16S rRNA, berhasil mendapatkan variasi pita yang sangat banyak. Fenomena yang berbeda teradapat pada sumur C, yaitu perlakuan sebar HST 30, terlihat pita yang relatif paling sedikit dibandingkan pita yang dihasilkan pada sumur lain. Hal ini disebabkan hasil PCR dari gen 16S dari perlakuan tersebut tidak terlihat tebal ketika dimigrasi pada gel agarosa. Template PCR yang tidak terlalu tebal mengakibatkan pita DGGE yang muncul pada perlakuan ini menjadi sedikit (Gambar 9).
15
Gambar 9 Hasil analisis DGGE gen 16S rRNA. Kiri: Foto dari G:BOX dan Kanan: Interpretasi dari piranti lunak Phoretix 1D. Sumur dari kiri ke kanan: (a) kontrol 30 HST, (b) celup 30 HST, (c) sebar 30 HST, (d) kontrol 60 HST, (e) celup 60 HST, (f) sebar 60 HST, (g) kontrol 90 HST, (h) celup 90 HST, (i) sebar 90 HST
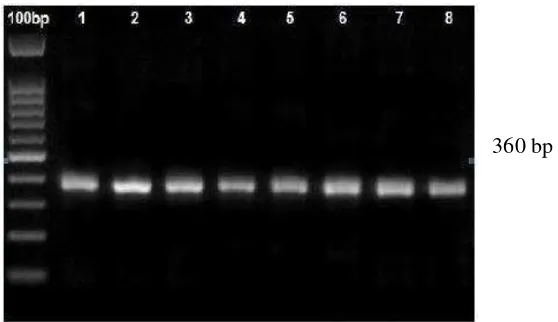
Potongan pita DGGE dari gen nifH diamplifikasi ulang dengan primer tanpa GC Clamps. Delapan pita yang dipotong berhasil diamplifikasi ulang dan menunjukkan fragmen yang diharapkan (Gambar 10). Hasil PCR tanpa GC Clamps ini kemudian disekuensing untuk mengetahui runutan basa sehingga dapat dianalisis dan dibuat pohon filogeninya.
Gambar 10 Hasil amplifikasi ulang pita hasil DGGE dengan primer non GC Clamp agarosa 1.5% dengan marker 100bp. Sumur dari kiri ke kanan: marker 100 bp, pita 1, pita 2, pita 3, pita 4, pita 5, pita 6, pita 7, pita 8
360 bp
16
BLAST dan Pohon Filogeni
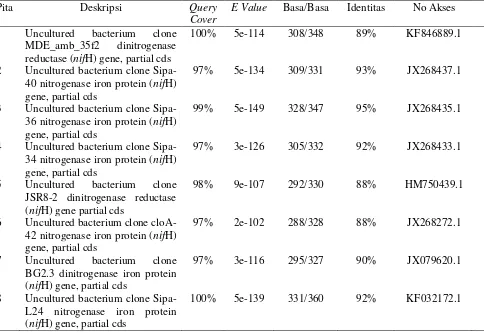
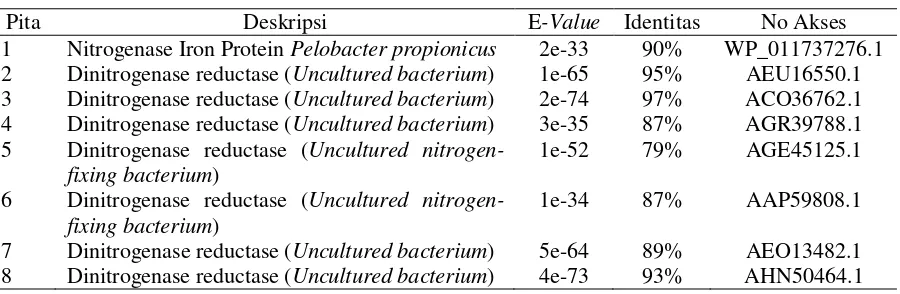
Hasil BLAST-N menunjukkan bahwa semua sekuen yang diperoleh berupa uncultured bacteria dinitrogenase (nifH) gene dari berbagai bakteri (Tabel 6). Hal ini menunjukkan bahwa sekuen bakteri yang diperoleh tergolong unculturable. Selain itu juga menunjukkan bahwa sekuen yang ditemukan tergolong baru karena persentase identitas dari hasil blast dengan sekuen database di bawah 95% dari ~360bp runutan basa.
Pita 1, 6, dan 8 merupakan pita yang terdapat pada gel DGGE pada tiap perlakuan setiap bulannya. Ketiga pita ini diduga merupakan bakteri yang dominan pada tanah sawah karena muncul pada tiap perlakuan tiap bulannya. Hasil BLAST menunjukkan pita 1 memiliki kedekatan sebesar 89% dengan Uncultured bacterium clone MDE_amb_35f2 dinitrogenase reductase (nifH) gene, partial cds. Pita 6 memiliki kedekatan sebesar 88% dengan Uncultured bacterium clone cloA-42 nitrogenase iron protein (nifH) gene, partial cds dan pita 8 memiliki kedekatan sebesar 92% dengan Uncultured bacterium clone Sipa-L24 nitrogenase iron protein (nifH) gene, partial cds.
Tabel 6 Hasil BLAST-N sekuen dari gen nifH
Pita Deskripsi Query
Cover
E Value Basa/Basa Identitas No Akses
1 Uncultured bacterium clone MDE_amb_35f2 dinitrogenase reductase (nifH) gene, partial cds
100% 5e-114 308/348 89% KF846889.1
2 Uncultured bacterium clone Sipa-40 nitrogenase iron protein (nifH) gene, partial cds
97% 5e-134 309/331 93% JX268437.1
3 Uncultured bacterium clone Sipa-36 nitrogenase iron protein (nifH) gene, partial cds
99% 5e-149 328/347 95% JX268435.1
4 Uncultured bacterium clone Sipa-34 nitrogenase iron protein (nifH) gene, partial cds
97% 3e-126 305/332 92% JX268433.1
5 Uncultured bacterium clone JSR8-2 dinitrogenase reductase (nifH) gene partial cds
98% 9e-107 292/330 88% HM750439.1
6 Uncultured bacterium clone cloA-42 nitrogenase iron protein (nifH) gene, partial cds
97% 2e-102 288/328 88% JX268272.1
7 Uncultured bacterium clone BG2.3 dinitrogenase iron protein (nifH) gene, partial cds
97% 3e-116 295/327 90% JX079620.1
8 Uncultured bacterium clone Sipa-L24 nitrogenase iron protein (nifH) gene, partial cds
100% 5e-139 331/360 92% KF032172.1
17 sesuai dengan yang diharapkan karena gen nifH memang bertugas menyandikan protein / enzim dinitrogenase reduktase.
Tabel 7 Hasil BLAST-X sekuen dari gen nifH
Pita Deskripsi E-Value Identitas No Akses 1 Nitrogenase Iron Protein Pelobacter propionicus 2e-33 90% WP_011737276.1 2 Dinitrogenase reductase (Uncultured bacterium) 1e-65 95% AEU16550.1 3 Dinitrogenase reductase (Uncultured bacterium) 2e-74 97% ACO36762.1 4 Dinitrogenase reductase (Uncultured bacterium) 3e-35 87% AGR39788.1 5 Dinitrogenase reductase (Uncultured
nitrogen-fixing bacterium)
1e-52 79% AGE45125.1
6 Dinitrogenase reductase (Uncultured nitrogen-fixing bacterium)
1e-34 87% AAP59808.1
7 Dinitrogenase reductase (Uncultured bacterium) 5e-64 89% AEO13482.1 8 Dinitrogenase reductase (Uncultured bacterium) 4e-73 93% AHN50464.1
Pembuatan pohon filogeni dilakukan dengan best method yang dianjurkan dari MEGA 5.2 yaitu Tamura 3 parameter. Pohon filogeni dibuat dengan mode Neighbour Joining dengan nilai bootstrap 1000X (Gambar 11).
Gambar 11 Pohon filogeni dari 8 sekuen gen nifH yang diperoleh dari analisis DGGE. Pohon filogeni dibuat dengan metode Neighbour Joining, model Tamura-3-Parameter dengan nilai bootstrap 1000X
band 1
Uncultured bacterium clone MDE amb 35f2 dinitrogenase reductase (nifH) gene partial cds KF846889.1 Pseudomonas stutzeri FR669138.1
Gamma Proteobacterium BAL281 AY972874.1 Pseudomonas sp. GX-127 FJ822997.1 Halorhodospira halophila EF199951.1
Uncultured bacterium clone cloA-42 nitrogenase iron protein (nifH) gene partial cds JX268272.1 band 6
Uncultured bacterium clone BG2.3 dinitrogen reductase (nifH) gene partial cds JX079620.1 Uncultured bacterium clone Sipa-L24 nitrogenase iron protein (nifH) gene partial cds KF032172.1
Anaeromyxobacter sp. CP000769.1 band 8
band 7
Uncultured bacterium clone JSR8-2 dinitrogenase reductase (nifH) gene partial cds HM750439.1 band 5
Aeromonas sp. FJ687522.1 Pseudomonas sp. FJ687518.1
Uncultured bacterium clone Sipa-40 nitrogenase iron protein (nifH) gene partial cds JX268437.1 Uncultured bacterium clone Sipa-36 nitrogenase iron protein (nifH) gene partial cds JX268435.1 Uncultured bacterium clone Sipa-34 nitrogenase iron protein (nifH) gene partial cds JX268433.1 band 3
band 2 band 4
Azonexus hydrophilus EF626686.1
18
Pembahasan
Karakteristik Tanah
Berdasarkan kriteria dari USDA (1987), tanah dari perlakuan kontrol tergolong tanah Silty Clay, perlakuan celup tergolong tanah Clay dan perlakuan sebar tergolong Clay. Berdasarkan kriteria dari BALITANAH (2005), ketiga tanah yang digunakan tergolong masam (pH 4.5 - 5.5) dengan unsur karbon dan nitrogen tergolong rendah sedangkan rasio C/N dari ketiga tanah yang digunakan tergolong sedang. Menurut AGRISNET (2014), tanaman padi tumbuh baik pada tanah clay, silty clay dan silty loam clay. Kondisi pH yang optimum yang diperlukan untuk tumbuh dengan baik berkisar 5-7. Perez et al. (2014) melaporkan bahwa, tanah dengan pH 5 dapat mempengaruhi pertumbuhan padi menjadi tidak efektif.
Selain itu, kadar C pada tanah juga memiliki peranan penting yang mempengaruhi komunitas diazotrof yang terdapat pada lingkungan tersebut, salah satunya bakteri pemfiksasi nitrogen. Perubahan kadar C di tanah dapat terjadi karena bermacam faktor, salah satunya manajemen penanaman padi. Kadar N pada tanah juga memiliki peranan. Coelho (2009) melaporkan bahwa peningkatan kadar N di tanah dapat menurunkan keragaman diazotrof yang terdapat pada daerah rizosfer. Oleh karena itu, pemupukan dengan pupuk nitrogen yang berlebih harus diperhatikan dengan seksama.
Pengukuran Tinggi Tajuk dan Jumlah Anakan Padi
Menurut Yoshida (1981), tinggi tanaman padi dapat dipengaruhi oleh unsur nitrogen. Unsur nitrogen yang sesuai dapat memacu pertumbuhan tinggi tanaman padi. Namun, penggunaan pupuk nitrogen sebagai suplai unsur N harus diperhatikan. Pemberian pupuk nitrogen pada umur-umur awal justru mengakibatkan tanaman padi menjadi rebah. Tanaman padi yang rebah dapat menyebabkan rusaknya pembuluh xilem dan floem sehingga berpotensi mengganggu aliran unsur hara dan fotosintat. Tingginya tanaman padi pada perlakuan celup dan sebar menunjukkan aktivitas bakteri pemfiksasi nitrogen dalam menyuplai nitrogen pada tanaman. Hal ini disebabkan tinggi tanaman pada perlakuan kontrol lebih rendah daripada perlakuan celup dan sebar yang mana diberi pupuk lebih sedikit dibandingkan kontrol.
19 diperlukan pemupukan. Pemupukan NPK dan pupuk hayati menghasilkan anakan yang lebih baik jika dibandingkan dengan pemberian pupuk NPK saja.
Ekstraksi dan Amplifikasi DNA
Penggunaan kit PowerSoil DNA Extraction kit dikhususkan untuk isolasi tanah dari sampel lingkungan yang sulit dengan menghasilkan DNA genom yang murni. Kemampuan kit isolasi ini disebabkan larutan IRT yang telah dipatenkan yang dimiliki oleh kit tersebut. Larutan IRT berfungsi memisahkan DNA dari pengotornya dan meningkatkan keberhasilan template DNA yang dihasilkan dalam proses PCR. Beberapa penelitian yang menggunakan PowerSoil DNA Extraction antara lain Adetutu et al. (2011), Makadia et al. (2011),dan Aleer et al. (2014).
Larutan larutan yang digunakan dalam proses ekstraksi memiliki fungsi-fungsi tersendiri. Larutan C1 berfungsi-fungsi sebagai detergen yang berperan dalam lisis membran sel, lebih tepatnya mendegradasi asam lemak yang terdapat pada membran sel. Larutan C2 dan C3 merupakan larutan IRT yang berfungsi mengendapkan materi organik selain DNA dan materi anorganik seperti asam humat, protein dan sisa-sisa sel. Proses ini penting karena dapat meningkatkan kemurnian dan hasil template DNA yang dihasilkan sehingga proses selanjutnya seperti PCR dapat berjalan optimal. Larutan C4 merupakan larutan garam dengan konsentrasi yang tinggi yang akan membantu pengikatan DNA pada membran filter yang terdiri atas silika. Larutan C5 merupakan etanol yang berfungsi membersihkan DNA yang terjerap pada membran filter. Larutan ini membersihkan DNA dari sisa-sisa kontaminan seperti garam, asam humat dan material pengganggu lainnya. Larutan C6 merupakan larutan elusi yang berfungsi melepaskan DNA yang terjerap pada membran filter yang terbuat dari silika. DNA akan terlarut pada larutan C6 yang komposisinya ialah 10 mM Tris.
Kemurnian DNA yang diperoleh dari hasil ekstraksi ini cukup baik dengan parameter A260/A280 rata-rata berkisar 1.9 (Tabel 5). Nilai A260/A280 yang baik dan dianjurkan berkisar 1.8 - 2.0 (Sambrook dan Russell 2001). Tingkat kemurnian dan kuantitas DNA yang diperoleh mempengaruhi proses aplikasi berikutnya, seperti PCR. Kuantitas template DNA yang rendah dapat mengakibatkan kegagalan pada proses PCR dengan kondisi umum. Selain itu, kemurnian DNA yang kurang baik juga dapat mengakibatkan misspriming pada primer sehingga produk PCR yang diharapkan tidak muncul (Sambrook dan Russell 2001).
Penggunaan primer PolF/PolR dalam mengamplifikasi gen nifH telah banyak dilaporkan. Primer ini dirancang khusus oleh Poly et al. (2001) untuk mengamplifikasi gen nifH yang dimiliki bakteri secara universal. Hasil risetnya melaporkan bahwa primer ini menghasilkan produk PCR yang jelas dan sesuai dengan targetnya, yaitu 360bp. Primer ini juga sudah terbukti berhasil mengamplifikasi 19 spesies bakteri pemfiksasi nitrogen penting seperti Azospirillum, Agrobacterium, Burkholderia, Pseudomonas, Rhizobium, Streptomyces, dan Xanthomonas (Poly et al. 2001).
20
Namun, teknik nested juga memiliki kelemahan, yaitu hasil PCR yang diperoleh dapat terjadi bias karena terjadi 2 kali amplifikasi. Dikhawatirkan tidak semua sekuen DNA yang teramplifikasi pada process nested. Selain itu, nested PCR juga memiliki preferensi yang khusus dalam prosesnya, sehingga tidak sesederhana dengan metode direct PCR. Gene pool nifH yang cukup stabil dapat dijadikan alasan dalam pemilihan direct PCR. Optimasi yang dilakukan menjadi lebih sederhana dan lebih mudah diperkirakan (Wartiainen et al. 2008)
Primer yang digunakan untuk mengamplifikasi gen 16S rRNA ialah PRBA338F/PRUN518R yang digunakan oleh Ovreas et al. (1997). Primer ini hanya mengamplifikasi V3 region dari sekuen DNA 16S. Seperti yang diketahui bahwa daerah 16S terdiri atas 9 region, yaitu V1, V2, V3, V4, V5, V6, V7, V8, V9. Setiap region memiliki panjang yang berbeda dan memiliki karakteristik yang unik pada setiap spesies bakteri sehingga dapat dijadikan sebagai alat identifikasi spesies (Van der Peer et al. 1996). Daerah V3 region terletak pada nukleotida ke 433 sampai 497 dengan jumlah 65 nukloetida. Menurut Charavorty (2007), analisis sekuen 16S dengan menggunakan V3 region lebih baik dibandingkan V2 region. V3 region dengan ukuran yang lebih pendek (65 bp) lebih mampu membedakan spesies dibandingkan V2 region yang lebih panjang (106 bp). Oleh karena itu penggunaan V3 region lebih lazim digunakan karena amplikon PCR yang dihasilkan dapat dianalisis lebih lanjut seperti Real Time PCR (Chakravorty 2006) dan DGGE.
Profil DGGE
Profil DGGE gen nifH menunjukkan keragaman pita yang bervariasi pada tiap perlakuan. Keragaman pita pada gel menunjukkan keragaman bakteri pemfiksasi nitrogen yang terdapat pada tanah sawah yang diambil. Keragaman bakteri juga dianalisis dengan metode clustering (Gambar 12).
Gambar 12 Analisis clustering dari tiap perlakuan pada DGGE gen nifH
Perlakuan kontrol 30 HST terlihat sebagai perlakuan dengan tingkat kedekatan paling jauh dari semua perlakuan. Hal ini disebabkan banyaknya pita yang ditemui pada perlakuan tersebut sehingga menimbulkan perbedaan dengan
21 perlakuan lain. Perlakuan celup dan sebar rata-rata memiliki kemiripan pada tiap masa pengambilan. Perlakuan sebar pada 60 HST dan 90 HST memiliki kemiripan, sama seperti halnya celup 60 HST dan 90 HST. Variasi terlihat pada node pohon atas, yaitu terdapat kemiripan antara perlakuan celup dan sebar 30 HST dengan kontrol yang telah memasuki 60 HST.
Keragaman pita yang ditemukan pada perlakuan kontrol dibandingkan dengan perlakuan celup dan sebar kemungkinan karena pada perlakuan kontrol tidak diberikan pupuk hayati sehingga tidak terjadi efek dominansi. Pupuk hayati yang berisi isolat bakteri metanotrof mampu meningkatkan pertumbuhan tanaman padi. Namun, introduksi pupuk hayati mempengaruhi komunitas mikrob yang terdapat di lahan sawah tersebut, tidak terkecuali dengan komunitas bakteri pemfiksasi nitrogen.
Namun, keragaman bakteri pemfiksasi nitrogen pada perlakuan kontrol tidak terlalu berperan mendorong pertumbuhan tanaman padi. Tanaman padi pada perlakuan kontrol memiliki tingkat pertumbuhan yang relatif kurang baik dibandingkan dengan perlakuan celup dan sebar. Banyak alasan yang dapat menyebabkan fenomena ini terjadi. Pertama, keragaman bakteri pemfiksasi nitrogen yang terdapat pada perlakuan kontrol mungkin tinggi namun belum tentu aktif. Aktif atau tidaknya gen nifH pada saat pengambilan dapat lebih akurat diketahui jika dianalisis berdasarkan RNA (Perez et al. 2014). Kedua, isolat bakteri yang digunakan sebagai pupuk hayati mampu mendorong pertumbuhan padi karena sudah teruji menurut Pingak (2013). Ketiga, beberapa isolat bakteri metanotrof yang digunakan sebagai pupuk hayati juga memiliki kemampuan fiksasi nitrogen (Bintarti 2011).
Selain itu, keragaman total bakteri pemfiksasi pada berbagai perlakuan dapat dipengaruhi dari faktor lingkungan pula. Zhan dan Sun (2012) melaporkan bahwa, komunitas diazotrof (bakteri pemfiksasi nitrogen) dapat dipengaruhi oleh eksudat rizosfer, fase pertumbuhan tanaman, dan iklim. Wartiainen et al. (2008), menemukan korelasi perubahan komunitas bakteri pemfiksasi nitrogen dengan periode pemupukan dengan pupuk kimia, eksudat akar. Coelho (2009) memperhatikan bahwa keragaman bakteri pemfiksasi nitrogen pada rizosfer dengan bulk soil juga berbeda. Selain itu, perbedaan kultivar padi, dan pemupukan juga mempengaruhi komunitas diazotrof. Perez et al. (2014) melihat keragaman bakteri pemfiksasi nitrogen dapat dipengaruhi oleh sistem penanaman yang digunakan, perubahan musim, iklim, dan pemupukan yang diberikan.
22
cenderung sedikit. Oleh sebab itu, pita yang muncul pada gel DGGE tidak terlalu banyak seperti pada perlakuan kontrol dan celup.
Gambar 13 Analisis clustering dari tiap perlakuan pada DGGE gen 16S rRNA
Dari analisis clustering dapat dilihat pula bahwa, keragaman komunitas total bakteri pada masa vegetatif memiliki kemiripan dengan masa generatif akhir (ripening) dibandingkan dengan masa generatif awal (reproduktif). Seperti yang terlihat pada gambar 14, fase vegetatif terjadi pada 0-35 HST, fase generatif awal (reproduktif) pada 35-70 HST sedangkan fase generatif akhir (pematangan) 70-100 HST (Makarim dan Suhartatik 2009; IRRI 2014). Dengan demikian, dapat diasumsikan bahwa keragaman komunitas bakteri yang menunjang fase vegetatif memiliki kemiripan dengan keragaman komunitas bakteri yang menunjang fase generatif akhir.
Gambar 14 Fase pertumbuhan padi
Celup 60 HST
Sebar 60 HST
Kontrol 60 HST
Celup 90 HST
Sebar 90 HST
Kontrol 90 HST
Kontrol 30 HST
Celup 30 HST
23
BLAST dan Pohon Filogeni
Hasil BLAST-N menunjukkan semua sekuen dari pita yang dipotong memiliki kedekatan dengan uncultured bacteria nitrogenase. Ini menunjukkan bahwa masih banyak bakteri pemfiksasi nitrogen yang belum teridentifikasi dan dikenali. Hasil ini diperkuat dengan hasil BLAST-X yang membuktikan bahwa sekuen DNA yang diperoleh merupakan sekuen yang akan menjadi enzim dinitrogenase reduktase. Persentase identitas yang rendah juga mendukung asumsi bahwa sekuen DNA yang ditemukan tergolong baru dan bisa jadi novel spesies. Namun, hal ini harus ditelaah lebih lanjut karena penggunaan sekuen yang dipakai tergolong pendek yaitu 360 bp. Dari pohon filogeni (Gambar 5) dapat dilihat bahwa pita 1, 6 dan 8 memiliki kedekatan dengan Pseudomonas stutzeri, Halorhodospira halophila dan Anaeromyxobacter sp. dengan catatan jumlah basa yang dibandingkan berkisar ~360 bp.
Pseudomonas stutzeri merupakan bakteri yang memiliki habitat yang luas dan relatif tahan terhadap perubahan kondisi lingkungan (Lalucat et al. 2006). Kemampuannya ini membuat P. stutzeri sangat toleran terhadap perubahan manajemen dan metode penanaman tanaman pada suatu tempat. Perez et al. (2014) menemukan 20 sekuen hasil DGGE yang memiliki kedekatan dengan P. stutzeri pada tanah pertanian yang diolah secara organik dan konvensional pada dua musim tanam yang berbeda. Diallo et al. (2004) juga menemukan P. stutzeri dari beberapa sekuen yang ditemukan dominan pada tanah yang diteliti.
H. halophila tergolong kedalam gamma proteobacteria, purple sulfur bacteria, Gram negatif dan fototrof. H. halophila tergolong bakteri pemfiksasi nitrogen yang potensial dan tersebar cukup luas. Beberapa riset dan penelitian membuktikan bahwa H. halophila memiliki gen nifH dan mampu memfiksasi nitrogen (Tourova et al. 2007; Coelho et al. 2008; Silva et al. 2013). Anaeromyxobacter sp. tergolong ke dalam bakteri delta proteobacteria, berbentuk batang, Gram negatif, mampu membentuk spora, dan habitat alami di tanah (Sanford et al. 2002). Anaeromyxobacter sp. mampu memfiksasi nitrogen yang ada di atmosfer dan dari beberapa penelitian telah terbukti memiliki gen nifH (Knief et al. 2012; Silva et al. 2013; Wang et al. 2013).
Delapan pita yang berhasil disekuen tidak memiliki kedekatan dengan bakteri metanotrof yang merupakan pupuk hayati yang ditambahkan ke lahan sawah. Beberapa bakteri metanotrof yang ditambahkan sebagai pupuk hayati telah diuji dan dianalisis memiliki kemampuan fiksasi nitrogen (Bintarti 2011). Namun, pada penelitian ini tidak ditemukan sekuen yang memiliki kemiripan dengan bakteri metanotrof. Hal ini disebabkan karena penggunaan primer yang berbeda sehingga tidak spesifik dalam mengenali bakteri metanotrof. Primer PolF/PolR didesain untuk mengamplifikasi bakteri pemfiksasi nitrogen dalam cakupan yang luas sedangkan primer yang digunakan oleh Bintarti (2011) merupakan primer khusus yang dirancang oleh Dedysh et al. (2004) untuk bakteri metanotrof yang memiliki kemampuan fiksasi nitrogen. Target amplikon dari kedua primer juga berbeda. Primer PolF/PolR memiliki target 360 bp sedangkan primer yang didesain Dedysh et al. (2004) memiliki target 453 bp. Berdasarkan pohon filogeni juga dapat dilihat bahwa sekuen hasil DGGE berada pada kelompok yang berbeda dengan bakteri metanotrof yang digunakan sebagai sekuen pembanding.
24
gamma-proteobacteria. Hal ini disebabkan metode pengambilan tanah dan tanaman yang ditanam. Alpha-proteobacteria itu lazim dan dominan ditemukan pada perakaran tanaman legum (Coelho 2009). Bakteri pemfiksasi nitrogen dari kelompok Alpha-proteobacteria lebih nyaman hidup pada daerah rizosfer dan berasosiasi dengan akar tanaman. Berbeda dengan bakteri pemfiksasi nitrogen dari kelompok Gamma-proteobacteria. Kelompok ini lebih fleksibel dan dapat dijumpai pada ruang lingkup tanah yang luas. Hal ini sesuai dengan penelitian ini dimana pengambilan tanah yang dilakukan itu pada bagian bulk soil, bukan daerah rizosfer. Selain itu tanaman yang ditanam pada penelitian ini adalah padi. Dari dua alasan ini kemungkinan bakteri pemfiksasi nitrogen yang berpotensi ditemukan adalah kelompok Gamma-proteobacteria. Bukan berarti pada sampel yang diambil tidak terdapat kelompok Alpha-proteobacteria, namun karena bukan tempat alaminya kemungkinan komunitasnya pada sampel itu kecil, sehingga tidak teramplifikasi dengan maksimal pada proses PCR. Template yang rendah pada DGGE kemungkinan tidak tervisualisasi dengan sempurna sehingga tidak memungkinkan untuk dipotong.
SIMPULAN DAN SARAN
Simpulan
Keragaman bakteri pemfiksasi nitrogen yang diperoleh dari lahan sawah desa Cicurug, Sukabumi cenderung bervariasi. Perlakuan kontrol memiliki keragaman paling banyak dibandingkan dengan perlakuan celup dan sebar. Keragaman perlakuan kontrol diduga karena pada perlakuan kontrol tidak diberikan perlakuan pupuk hayati sehingga tidak terjadi efek dominansi. Delapan pita berhasil dielusi dari gel DGGE dan berhasil disekuen. Hasil sekuensing menunjukkan bahwa semua pita yang dielusi tergolong kedalam uncultured bacteria dinitogenase (nifH) gene.
Saran
Validasi keragaman bakteri pemfiksasi nitrogen yang aktif dapat dilakukan dengan analisis total RNA yang terdapat pada sampel tanah.
DAFTAR PUSTAKA
[AGRISNET]. 2014. Rice Soil Requirement. [Internet]. [diunduh 18 Mei 2014]. Tersedia pada: http://sikkimagrisnet.org/General/en/Rice_Soil_Requirement. aspx
25 [BALITANAH] Balai Penelitian Tanah. 2005. Analisis Kimia Tanah, Tanaman,
Air dan Pupuk. Bogor (ID): Balai Penelitian Tanah.
Bintarti AF. 2011. Amonium serta karakterisasi gen nifH dan nifD bakteri metanotrof asal sawah [tesis]. Bogor (ID): Institut Pertanian Bogor.
Bottomley PJ, Myrold DD. 2007. Soil Microbiology, Ecology and Biochemistry. Paul EA, editor. Oxford (UK): Academic Press Inc.
Boulygina ES, Kuznetsov BB, Marusina AI, Tourova TP, Kravchenko IK, Bykova SA, Kolganova TV, Galchenko VF. 2002. A study of nucleotide sequences of nifH genes of some methanotrophic bacteria. Microbiology. 71(4): 500–508
Chakravorty S, Pathak D, Dudeja M, Haldar S, Hanif M, Tyagi JS. 2006. PCR amplification of shorter fragments from the devR (Rv3133c) gene significantly increases the sensitivity of tuberculosis diagnosis. FEMS Microbiol Lett. 257: 306–311.
Chakravorty S, Helb D, Burday M, Connell N, Alland D. 2007. A detailed analysis of 16S ribosomal RNA gene segments for the diagnosis of pathogenic bacteria. J Microbiol Methods. 69(2): 330-339.
Chen K, Pachter L. 2005. Bioinformatics for whole-genome shotgun sequencing of microbial communities. PLoS Computation Biol. 1 (2): e24. doi:10.1371/journal.pcbi.0010024.
Coelho MRR, Carneiro NP, Marriel IE, Seldin L. 2008. Molecular detection of nifH gene containing Paenibacillus in the rhizosphere of sorghum (Sorghum bicolor) shown in Cerrado soil. Lett Appl Microbiol. 48: 611-617. doi:10.1111/j.1472-765X.2009.02578.x
Coelho MRR, Marriel IEE, Jenkins SN, Lanyon CV, Seldin L, O’Donnell AG.2009. Molecular detection and quantification of nifH gene sequences in the rhizosphere of sorghum (Sorghum bicolor) shown with two levels of nitrogen fertilizer. Appl Soil Ecol. 42: 48-53.
Dedysh SN, Ricke P, Liesack W. 2004. NifH and nifD phylogenies: an evolutionary basis for understanding nitrogen fixation capabilities of methanotrophic bacteria. Microbiology. 150(5): 1301–1313.
Diallo M, Willems A, Vloemans N, Cousin S, Vandekerckhove TT, DeLajudie P, Neyra M, Vyverman W, Gillis M, Van der Gucht K. 2004. Polymerase chain reaction denaturing gradient gel electrophoresis analysis of the N2 -fixing bacterial diversity in soil under Acacia tortilis ssp. raddiana and Balanites aegyptiaca in the dryland part of Senegal. Environ Microbiol. 6: 400–415.
Dixon ROD, Wheeler CT. 1986. Nitrogen Fixation in Plants. New York (US): Chapman and Hall.
Hamdi YA. 1982. Application of nitrogen-fixing system in soil improvement and management. Roma (IT): FAO Bulletin.
Handelsman J, Rondon MR, Brady SF, Clardy J, Goodman RM. 1998. Molecular biological access to the chemistry of unknown soil microbes: A new frontier for natural products. Chem Biol. 5(10): 245–249.
26
Lalucat J, Bennasar A, Bosch R, García-Valdés E, Palleroni NJ. 2006. Biology of Pseudomonas stutzeri. Microbiol Mol Biol Rev. 70: 510–547.
[LITBANGDEPTAN] Badan Penelitian dan Pengembangan Departemen Pertanian Indonesia. 2000. Varietas Ciherang. [Internet]. [diunduh 18 Mei 2014]. Tersedia pada : http://www.litbang.deptan.go.id/varietas/one/130/ Makarim AK, Suhartatik E. 2009. Morfologi dan Fisiologi Tanaman Padi. Balai
Besar Penelitian Tanaman Padi. [Internet]. [diunduh 18 Mei 2014]. Tersedia pada:http://www.litbang.deptan.go.id/special/padi/bbpadi_2009_itkp_11.pdf Marco D. 2011. Metagenomics: Current Innovations and Future Trends. Norfolk
(GB): Caister Academic Press.
Marsh TL, Saxman P, Cole J, Tiedje J. 2000. Terminal restriction fragment length polymorphism analysis program, a web-based research tool for microbial community analysis. Appl Environ Microbiol. 66:3616-3620. Moat AG, Foster JW, Spector MP. 2002. Microbial Physiology. Ed ke-4. New
York (US): JohnWiley & Sons Inc.
Murata Y, Matsushima S. 1978. Rice. Di dalam Evans LT (editor). Crop Physiology. Cambridge (GB): Cambridge University Pr.
Muyzer G, Waal EC, Uitterlinden. 1993. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction amplified genes coding for 16s rRNA. Appl Environ Microbiol. 59(3): 695.
Ovreas L, Forney L, Daae FL, Torsvik V. 1997. Distribution of bacterioplankton in Meromictic Lake Sælenvannet, as determined by denaturing gradient gel electrophoresis of pcr-amplified gene fragments coding for 16s rRNA. Appl Environ Microbiol. 63 (9): 3367-3373.
Perez PG, Ye J, Wang S, Wang X, Huang D. 2014. Analysis of the occurrence and activity of diazotrophic communities in organic and conventional horticultural soils. Appl Soil Ecol. 79: 37-48.
Pingak GMF. 2013. Efektivitas bakteri metanotrof dan Ochrobactrum anthropi sebagai pupuk hayati dan pereduksi emisi gas CH4 serta N2O di sawah anorganik [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Poly F, Monrozier LJ, Bally R. 2001. Improvement in the RFLP procedure for studying the diversity of nifH genes in communities of nitrogen fixers in soil. Res Microbiol. 152: 95–103.
Postgate J. 1998. Nitrogen Fixation. Ed ke-3. Cambridge (GB): Cambridge University Press.
Rosado AS, Duarte GF, Seldin L, Elsas JDV. 1998. Genetic diversity of nifH gene sequences in Paenibacillus azotofixans strains and soil samples analyzed by denaturing gradient gel electrophoresis of PCR-amplified gene fragments. Appl Environ Microbiol. 64(8): 2770.
Saika SP, Jain V. 2007. Biological nitrogen fixation with non-legumes: An achievable target or dogma?. Curr Sci. 92(3): 317 – 322.
Salisbury FB, Ross CW. 1995. Fisiologi Tumbuhan. Lukman DR, Sumaryono. Penerjemah. Bandung (ID): ITB-Bandung Pr. Terjemahan dari: Plant Physiology.
27 Sanford RA, Cole JR, Tiedje JM. 2002. Characterization and description of Anaeromyxobacter dehalogenans gen. nov., sp. nov., an aryl halorespiring facultative anaerobic myxobacterium. Appl Environ Microbiol. 68: 893-900. Shilov AE. 1992. Intermediate complexes in chemical and biological nitrogen
fixation. Pure Appl Chem. 54(10): 1409-1420.
Siegbahn PEM, Westerberg J, Svenson M, Crabtree RH. 1998. Nitrogen fixation by nitrogenase : A quantum chemical study. J Phys Chem. 102: 1615-1623. Silva MCP, Hai BS, Schloter M, Elsas JD, Salles JF. 2013. Temporal dynamics of abundance and composition of nitrogen fixing communities across agricultural soils. PLoS ONE 8(9): e74500. doi:10.1371/journal.pone. 0074500.
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. 2011. MEGA5: Molecular Evolutionary Genetics Analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Mol Biol Evol. 28(10): 2731-2739.
Taiz L, Zeiger E. 2002. Plant Physiology. Ed ke-3. Massachusetts (US): Sinauer Associates Pub.
Tourova TP, Spiridonova EM, Berg IA, Slobodova NV, Bolygina ES, Sorokin DY. 2007. Phylogeny and evolution of the family Ectothiorhodospiraceae based on comparison of 16S rRNA, cbbL and nifH gene sequences. The ISME J. 57: 2387–2398. doi 10.1099/ijs.0.65041-0
28
29 Lampiran 2 Segitiga tanah USDA
Sand Silt Clay
A 10 43 47
B 16 33 51
C 18 38 44
D 18 35 47
E 16 42 42
F 20 29 51
CLAY SILTY CLAY
CLAY CRITERIA
Code Texture
30
Lampiran 3 Runutan basa, BLAST N, dan BLAST X pita 1 #band_1
31 Lampiran 4 Runutan basa, BLAST N, dan BLAST X pita 2
#band_2
32
Lampiran 5 Runutan basa, BLAST N, dan BLAST X pita 3 #band_3
33 Lampiran 6 Runutan basa, BLAST N, dan BLAST X pita 4
#band 4
34
Lampiran 7 Runutan basa, BLAST N, dan BLAST X pita 5 #band_5
35 Lampiran 8 Runutan basa, BLAST N, dan BLAST X pita 6
#band_6
36
Lampiran 9 Runutan basa, BLAST N, dan BLAST X pita 7 #band_7
37 Lampiran 10 Runutan basa, BLAST N, dan BLAST X pita 8
#band_8
38
Lampiran 11 Surat pernyataan untuk penerbitan artikel di jurnal Advanced in Environmental Bioloy
ICEBS 2014
Notification of Acceptance of the ICEBS 2014
September 26-27, 2014, Krabi, Thailand
www.ipncoference.org/icebs-2014.html
Author Name Randi Hadianta
Paper ID 012-icebs
Paper Title Diversity of Nitrogen Fixing Bacteria Based on nifH Gene in Rice Fields
Dear Author,
Congratulations !
The review processes for International Conference on Environmental and Biological Sciences (iCEBS 2014) have been completed. Based on the recommendations of the Technical Committees /reviewers and the acceptance from AEB Editorial Board, we are pleased to inform you that your paper identified above has been accepted for publication in the Advances in Environmental Biology (special issue International Conference on
Environmental and Biological Sciences (iCEBS 2014). You are cordially invited to present the paper orally at ICEBS 2014 to be held on September 26-27, 2014, Krabi, Thailand