EFEKTIVITAS XILOSA DALAM PENGENCER
TRIS KUNING TELUR DENGAN KONSENTRASI
GLISEROL YANG BERBEDA TERHADAP
KUALITAS SEMEN BEKU ANJING RETRIEVER
DWI TANIAR GRANINGGAR
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
LEMBAR PENGESAHAN
Judul Skripsi : Efektivitas Xilosa dalam Pengencer Tris Kuning Telur dengan Konsentrasi Gliserol yang Berbeda terhadap Kualitas Semen Beku Anjing Retriever
Nama : Dwi Taniar Graninggar NRP : B04104079
Disetujui, Dosen Pembimbing
Dr. Dra. R. Iis Arifiantini, M.Si NIP. 130 914 666
Mengetahui, Wakil Dekan FKH IPB
EFEKTIVITAS XILOSA DALAM PENGENCER
TRIS KUNING TELUR DENGAN KONSENTRASI
GLISEROL YANG BERBEDA TERHADAP
KUALITAS SEMEN BEKU ANJING RETRIEVER
DWI TANIAR GRANINGGAR
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 7 Mei 1986, merupakan anak kedua dari dua bersaudara, pasangan (Alm) Arsen Sihombing dan Titiek Siti Martani.
Sejak Taman Kanak-kanak (1990) hingga Sekolah Lanjutan Tingkat Pertama (2001), penulis mengambil pendidikan di Yayasan Katolik Strada Budi Luhur Bekasi. Kemudian melanjutkan ke jenjang Sekolah Lanjutan Tingkat Atas di SMU Negeri I Bekasi secara kolektif. Setelah lulus pada tahun 2004, penulis diterima di Institut Pertanian Bogor sebagai mahasiswa Fakultas Kedokteran Hewan melalui Undangan Seleksi Masuk Masuk IPB (USMI). Penulis sangat berminat dalam bidang kedokteran hewan karena kecintaannya yang besar terhadap dunia anjing.
Selama menjadi mahasiswa penulis aktif di beberapa organisasi seperti: Himpunan Minat dan Profesi Hewan Kesayangan dan Satwa Akuatik (Himpro HKSA) sebagai sekretaris periode 2005-2006 dan sebagai wakil ketua periode 2006-2007, Komunitas Seni Teater Ilmiah (Steril) dan Gita Klinika (2004-2008), Persekutuan Fakultas Kedokteran Hewan (2004-2008), serta dalam badan pengurus kelas sebagai bendahara (periode 2005-2006) dan Penanggung Jawab Mata Kuliah Mikrobiologi II dan Radiologi. Selain itu penulis sering terlibat di beberapa acara sebagai panitia dan pernah mengetuai beberapa acara seperti
KATA PENGANTAR
Puji syukur kepada Allah Bapa di surga, karena dengan berkat dan pimpinan-Nya skripsi yang berjudul “Efektivitas Xilosa dalam Pengencer Tris Kuning Telur dengan Konsentrasi Gliserol yang Berbeda terhadap Kualitas Semen Beku Anjing Retriever” ini dapat terselesaikan dengan baik. Skripsi ini disusun sebagai salah satu syarat untuk menyelesaikan Program Sarjana (S1) di Fakultas Kedokteran Hewan Institut Pertanian Bogor. Penulis juga ingin menyampaikan ucapan terima kasih yang sebesar-besarnya kepada :
1. Dr. Dra. R. Iis Arifiantini, M.Si selaku pembimbing skripsi. 2. Prof. Dr. Drh. Tuty L. Yusuf sebagai dosen penguji.
3. Drh. Soesatyoratih sebagai dosen pembimbing akademik.
4. Mama dan kakak yang baik sebagai pendukung materi serta doa. 5. Departemen Klinik, Patologi dan Reproduksi
6. Keluarga besar Laboratorium Unit Rehabilitasi Reproduksi (URR) Bagian Reproduksi dan Kebidanan Fakultas Kedokteran Hewan IPB.
7. Para pemilik anjing untuk penelitian : Keluarga Janto Tjoandra, Keluarga drh. Diah Kristono, Keluarga Irawan Liem, Joey dan Marina.
8. Para sahabat: Ririn, Retno dan Vet Angels (Dhe, Atha, Aye, Chamut, Iya, Na). 9. Sahabat-sahabat Asteroidea 41, HKSA crews, STERIL crews dan PFKH 41. 10.Teman-teman angkatan lain: 38 (Ali dkk), 39 (Isti dkk), 40 (Rian dkk), 42
(Lissa dkk) atas pinjaman buku serta dukungan moral.
11.Penghuni Perwira 12; Eko, Sarah, Mohung, Hadi, Felice, Kak Nona, Kak Meis, Miss Dordia dan banyak lagi.
12.Partner penelitian dan perjuangan : Ardilasunu Wicaksono
13.Late but not least, my beloved Daddy, Arsen Sihombing, whose words had inspiring me to be a great veterinarian.
14.And last but not least: Drh. Ign. Nuvella Sapto Yuwono, as the #1 supporter Semoga Tuhan memberikan balasan atas segala bantuan dan dorongan yang telah diberikan. Penulisan skripsi ini masih jauh dari sempurna, karena itu penulis mengharapkan saran dan kritik yang membangun di masa mendatang. Semoga skripsi ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
DAFTAR ISI
Halaman
DAFTAR ISI………. i
DAFTAR TABEL... ii
DAFTAR GAMBAR... iii
PENDAHULUAN Latar belakang... 1
Tujuan penelitian... 3
Hipotesa... 3
TINJAUAN PUSTAKA Tinjauan umum anjing Retriever………... 4
Reproduksi anjing jantan... 6
Pengolahan semen anjing... 9
Prinsip-prinsip kriopreservasi... 13
METODOLOGI PENELITIAN Waktu dan tempat penelitian... 18
Materi penelitian... 18
Metode penelitian... 18
Rancangan percobaan... 20
HASIL DAN PEMBAHASAN Karakteristik semen segar anjing Retriever... 22
Kualitas semen beku anjing Retriever... 24
KESIMPULAN DAN SARAN... 32
DAFTAR PUSTAKA... iv
DAFTAR TABEL
Halaman 1. Komposisi buffer yang digunakan dalam penelitian... 18 2. Komposisi krioprotektan yang digunakan dalam penelitian……….... 19 3. Karakteristik semen segar anjing Retriever………... 22 4. Kualitas semen beku rata-rata dari ketiga anjing Retriever dalam
pengencer Tris Kuning Telur (TKT) dengan konsentrasi gliserol
DAFTAR GAMBAR
Halaman
1. Anjing Labrador Retriever………..…………... 5
2. Anjing Golden Retriever... 6
3. Alat reproduksi anjing jantan... 7
4. Spermatozoa anjing normal... 7
5. Rumus umum gliserol………... 16
6. Rumus umum xilosa...…...………... 17
7. Prosedur kerja dalam proses pembekuan semen...…..…………... 21
8. Tiga fraksi semen anjing Retriever persentase hidup spermatozoa... 22
PENDAHULUAN Latar Belakang
Peranan anjing terutama anjing ras menjadi semakin populer dalam kehidupan manusia. Anjing berfungsi sebagai hewan kesayangan, pendamping orang cacat, penjaga, pelacak kejahatan dan narkotika. Semakin maraknya kontes-kontes anjing menyebabkan para penggemar anjing makin mengutamakan penampilan dan mutu genetik anjing mereka. Anjing Retriever merupakan ras anjing yang semakin populer di Indonesia. Hal ini disebabkan oleh temperamen kedua jenis Retriever yang sangat baik, sehingga anjing Retriever banyak digunakan sebagai assistance dog dan working dog, sebagai pelacak barang-barang terlarang seperti narkoba, bom, dll. Dengan semakin banyaknya penggemar kedua anjing trah retriever ini permintaan anakan di kalangan breeder
anjing ini semakin meningkat.
Perkembangbiakan pada anjing Retriever seperti pada hewan lainnya dapat dilakukan secara alamiah maupun dengan bantuan teknologi Inseminasi Buatan (IB). Inseminasi buatan pada anjing belakangan ini telah banyak diterima dan merupakan salah satu metode yang berhasil dilakukan dalam memproduksi keturunan yang berkualitas apabila perkawinan secara alamiah tidak mungkin dilakukan, yaitu antara lain disebabkan oleh masalah anatomi, psikologi dan fisik, selain itu keterbatasaan secara geografis juga membatasi terjadinya perkawinan secara alamiah, misalnya anjing pejantan unggul/champion yang berada di kota yang berbeda dari anjing betina (Shuttleworth 2002). Penggunaan IB juga dapat menghindari anjing pejantan unggul dari penyakit menular seksual dan selain itu IB dapat memaksimalkan manfaat dari anjing pejantan apabila anjing tersebut sudah tidak mampu mengawini atau bahkan mati.
Untuk menghasilkan semen beku yang berkualitas dibutuhkan bahan pengencer semen yang mampu mempertahankan kualitas spermatozoa selama proses pendinginan, pembekuan maupun pada saat thawing (Aboagla & Terada 2004), oleh karena itu bahan pengencer semen beku harus mengandung sumber nutrisi, buffer, bahan anti cold shock, antibiotik dan krioprotektan yang dapat melindungi spermatozoa selama proses pembekuan dan thawing. Sumber nutrisi yang paling banyak digunakan adalah karbohidrat terutama fruktosa yang paling mudah dimetabolisir oleh spermatozoa (Toelihere 1993). Buffer berfungsi sebagai pengatur tekanan osmotik dan juga berfungsi menetralisir asam laktat yang dihasilkan dari sisa metabolisme spermatozoa. Buffer yang umum digunakan adalah tris (hydroxymethyl) aminomethan yang mempunyai kemampuan sebagai penyangga yang baik dengan toksisitas yang rendah dalam konsentrasi yang tinggi (Steinbach & Foote 1967).
Karbohidrat dapat berfungsi ganda dimana karbohidrat sederhana seperti glukosa dan fruktosa dibutuhkan sebagai sumber energi, sedangkan karbohidrat molekul besar dapat berfungsi sebagai krioprotektan ekstraseluler. Penggunaan disakarida (trehalosa), trisakarida (raffinosa) dan oligosakarida lainnya pada pengenceran semen beberapa ternak diduga lebih mampu melindungi spermatozoa dalam proses pembekuan (Yildiz et al. 2000). Selanjutnya menurut peneliti tersebut penambahan xilosa 70 mM pada pembekuan semen anjing mampu meningkatkan motilitas pasca thawing semen beku anjing.
Pada umumnya kerusakan membran plasma terjadi selama proses penanganan semen, baik selama pendinginan semen (20oC – 5oC) maupun selama proses penyimpanan (Paulenz et al. 2002). Karbohidrat mampu melindungi sel selama proses dehidrasi atau pembekuan dengan jalan menstabilkan membran plasma maupun protein seluler (Eiman et al. 2003).
EFEKTIVITAS XILOSA DALAM PENGENCER
TRIS KUNING TELUR DENGAN KONSENTRASI
GLISEROL YANG BERBEDA TERHADAP
KUALITAS SEMEN BEKU ANJING RETRIEVER
DWI TANIAR GRANINGGAR
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
LEMBAR PENGESAHAN
Judul Skripsi : Efektivitas Xilosa dalam Pengencer Tris Kuning Telur dengan Konsentrasi Gliserol yang Berbeda terhadap Kualitas Semen Beku Anjing Retriever
Nama : Dwi Taniar Graninggar NRP : B04104079
Disetujui, Dosen Pembimbing
Dr. Dra. R. Iis Arifiantini, M.Si NIP. 130 914 666
Mengetahui, Wakil Dekan FKH IPB
EFEKTIVITAS XILOSA DALAM PENGENCER
TRIS KUNING TELUR DENGAN KONSENTRASI
GLISEROL YANG BERBEDA TERHADAP
KUALITAS SEMEN BEKU ANJING RETRIEVER
DWI TANIAR GRANINGGAR
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 7 Mei 1986, merupakan anak kedua dari dua bersaudara, pasangan (Alm) Arsen Sihombing dan Titiek Siti Martani.
Sejak Taman Kanak-kanak (1990) hingga Sekolah Lanjutan Tingkat Pertama (2001), penulis mengambil pendidikan di Yayasan Katolik Strada Budi Luhur Bekasi. Kemudian melanjutkan ke jenjang Sekolah Lanjutan Tingkat Atas di SMU Negeri I Bekasi secara kolektif. Setelah lulus pada tahun 2004, penulis diterima di Institut Pertanian Bogor sebagai mahasiswa Fakultas Kedokteran Hewan melalui Undangan Seleksi Masuk Masuk IPB (USMI). Penulis sangat berminat dalam bidang kedokteran hewan karena kecintaannya yang besar terhadap dunia anjing.
Selama menjadi mahasiswa penulis aktif di beberapa organisasi seperti: Himpunan Minat dan Profesi Hewan Kesayangan dan Satwa Akuatik (Himpro HKSA) sebagai sekretaris periode 2005-2006 dan sebagai wakil ketua periode 2006-2007, Komunitas Seni Teater Ilmiah (Steril) dan Gita Klinika (2004-2008), Persekutuan Fakultas Kedokteran Hewan (2004-2008), serta dalam badan pengurus kelas sebagai bendahara (periode 2005-2006) dan Penanggung Jawab Mata Kuliah Mikrobiologi II dan Radiologi. Selain itu penulis sering terlibat di beberapa acara sebagai panitia dan pernah mengetuai beberapa acara seperti
KATA PENGANTAR
Puji syukur kepada Allah Bapa di surga, karena dengan berkat dan pimpinan-Nya skripsi yang berjudul “Efektivitas Xilosa dalam Pengencer Tris Kuning Telur dengan Konsentrasi Gliserol yang Berbeda terhadap Kualitas Semen Beku Anjing Retriever” ini dapat terselesaikan dengan baik. Skripsi ini disusun sebagai salah satu syarat untuk menyelesaikan Program Sarjana (S1) di Fakultas Kedokteran Hewan Institut Pertanian Bogor. Penulis juga ingin menyampaikan ucapan terima kasih yang sebesar-besarnya kepada :
1. Dr. Dra. R. Iis Arifiantini, M.Si selaku pembimbing skripsi. 2. Prof. Dr. Drh. Tuty L. Yusuf sebagai dosen penguji.
3. Drh. Soesatyoratih sebagai dosen pembimbing akademik.
4. Mama dan kakak yang baik sebagai pendukung materi serta doa. 5. Departemen Klinik, Patologi dan Reproduksi
6. Keluarga besar Laboratorium Unit Rehabilitasi Reproduksi (URR) Bagian Reproduksi dan Kebidanan Fakultas Kedokteran Hewan IPB.
7. Para pemilik anjing untuk penelitian : Keluarga Janto Tjoandra, Keluarga drh. Diah Kristono, Keluarga Irawan Liem, Joey dan Marina.
8. Para sahabat: Ririn, Retno dan Vet Angels (Dhe, Atha, Aye, Chamut, Iya, Na). 9. Sahabat-sahabat Asteroidea 41, HKSA crews, STERIL crews dan PFKH 41. 10.Teman-teman angkatan lain: 38 (Ali dkk), 39 (Isti dkk), 40 (Rian dkk), 42
(Lissa dkk) atas pinjaman buku serta dukungan moral.
11.Penghuni Perwira 12; Eko, Sarah, Mohung, Hadi, Felice, Kak Nona, Kak Meis, Miss Dordia dan banyak lagi.
12.Partner penelitian dan perjuangan : Ardilasunu Wicaksono
13.Late but not least, my beloved Daddy, Arsen Sihombing, whose words had inspiring me to be a great veterinarian.
14.And last but not least: Drh. Ign. Nuvella Sapto Yuwono, as the #1 supporter Semoga Tuhan memberikan balasan atas segala bantuan dan dorongan yang telah diberikan. Penulisan skripsi ini masih jauh dari sempurna, karena itu penulis mengharapkan saran dan kritik yang membangun di masa mendatang. Semoga skripsi ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
DAFTAR ISI
Halaman
DAFTAR ISI………. i
DAFTAR TABEL... ii
DAFTAR GAMBAR... iii
PENDAHULUAN Latar belakang... 1
Tujuan penelitian... 3
Hipotesa... 3
TINJAUAN PUSTAKA Tinjauan umum anjing Retriever………... 4
Reproduksi anjing jantan... 6
Pengolahan semen anjing... 9
Prinsip-prinsip kriopreservasi... 13
METODOLOGI PENELITIAN Waktu dan tempat penelitian... 18
Materi penelitian... 18
Metode penelitian... 18
Rancangan percobaan... 20
HASIL DAN PEMBAHASAN Karakteristik semen segar anjing Retriever... 22
Kualitas semen beku anjing Retriever... 24
KESIMPULAN DAN SARAN... 32
DAFTAR PUSTAKA... iv
DAFTAR TABEL
Halaman 1. Komposisi buffer yang digunakan dalam penelitian... 18 2. Komposisi krioprotektan yang digunakan dalam penelitian……….... 19 3. Karakteristik semen segar anjing Retriever………... 22 4. Kualitas semen beku rata-rata dari ketiga anjing Retriever dalam
pengencer Tris Kuning Telur (TKT) dengan konsentrasi gliserol
DAFTAR GAMBAR
Halaman
1. Anjing Labrador Retriever………..…………... 5
2. Anjing Golden Retriever... 6
3. Alat reproduksi anjing jantan... 7
4. Spermatozoa anjing normal... 7
5. Rumus umum gliserol………... 16
6. Rumus umum xilosa...…...………... 17
7. Prosedur kerja dalam proses pembekuan semen...…..…………... 21
8. Tiga fraksi semen anjing Retriever persentase hidup spermatozoa... 22
PENDAHULUAN Latar Belakang
Peranan anjing terutama anjing ras menjadi semakin populer dalam kehidupan manusia. Anjing berfungsi sebagai hewan kesayangan, pendamping orang cacat, penjaga, pelacak kejahatan dan narkotika. Semakin maraknya kontes-kontes anjing menyebabkan para penggemar anjing makin mengutamakan penampilan dan mutu genetik anjing mereka. Anjing Retriever merupakan ras anjing yang semakin populer di Indonesia. Hal ini disebabkan oleh temperamen kedua jenis Retriever yang sangat baik, sehingga anjing Retriever banyak digunakan sebagai assistance dog dan working dog, sebagai pelacak barang-barang terlarang seperti narkoba, bom, dll. Dengan semakin banyaknya penggemar kedua anjing trah retriever ini permintaan anakan di kalangan breeder
anjing ini semakin meningkat.
Perkembangbiakan pada anjing Retriever seperti pada hewan lainnya dapat dilakukan secara alamiah maupun dengan bantuan teknologi Inseminasi Buatan (IB). Inseminasi buatan pada anjing belakangan ini telah banyak diterima dan merupakan salah satu metode yang berhasil dilakukan dalam memproduksi keturunan yang berkualitas apabila perkawinan secara alamiah tidak mungkin dilakukan, yaitu antara lain disebabkan oleh masalah anatomi, psikologi dan fisik, selain itu keterbatasaan secara geografis juga membatasi terjadinya perkawinan secara alamiah, misalnya anjing pejantan unggul/champion yang berada di kota yang berbeda dari anjing betina (Shuttleworth 2002). Penggunaan IB juga dapat menghindari anjing pejantan unggul dari penyakit menular seksual dan selain itu IB dapat memaksimalkan manfaat dari anjing pejantan apabila anjing tersebut sudah tidak mampu mengawini atau bahkan mati.
Untuk menghasilkan semen beku yang berkualitas dibutuhkan bahan pengencer semen yang mampu mempertahankan kualitas spermatozoa selama proses pendinginan, pembekuan maupun pada saat thawing (Aboagla & Terada 2004), oleh karena itu bahan pengencer semen beku harus mengandung sumber nutrisi, buffer, bahan anti cold shock, antibiotik dan krioprotektan yang dapat melindungi spermatozoa selama proses pembekuan dan thawing. Sumber nutrisi yang paling banyak digunakan adalah karbohidrat terutama fruktosa yang paling mudah dimetabolisir oleh spermatozoa (Toelihere 1993). Buffer berfungsi sebagai pengatur tekanan osmotik dan juga berfungsi menetralisir asam laktat yang dihasilkan dari sisa metabolisme spermatozoa. Buffer yang umum digunakan adalah tris (hydroxymethyl) aminomethan yang mempunyai kemampuan sebagai penyangga yang baik dengan toksisitas yang rendah dalam konsentrasi yang tinggi (Steinbach & Foote 1967).
Karbohidrat dapat berfungsi ganda dimana karbohidrat sederhana seperti glukosa dan fruktosa dibutuhkan sebagai sumber energi, sedangkan karbohidrat molekul besar dapat berfungsi sebagai krioprotektan ekstraseluler. Penggunaan disakarida (trehalosa), trisakarida (raffinosa) dan oligosakarida lainnya pada pengenceran semen beberapa ternak diduga lebih mampu melindungi spermatozoa dalam proses pembekuan (Yildiz et al. 2000). Selanjutnya menurut peneliti tersebut penambahan xilosa 70 mM pada pembekuan semen anjing mampu meningkatkan motilitas pasca thawing semen beku anjing.
Pada umumnya kerusakan membran plasma terjadi selama proses penanganan semen, baik selama pendinginan semen (20oC – 5oC) maupun selama proses penyimpanan (Paulenz et al. 2002). Karbohidrat mampu melindungi sel selama proses dehidrasi atau pembekuan dengan jalan menstabilkan membran plasma maupun protein seluler (Eiman et al. 2003).
8% lebih baik daripada 2, 4 dan 6% (Bateman 2001), Yildiz et al. (2000) menggunakan gliserol 8% untuk pembekuan semen anjing pada pengencer Tris, Holst et al. (2000) menggunakan 7%, Cardoso et al. (2005), Silva et al (2005) dan Kim et al. (2007) menggunakan gliserol 6%. Rota (1998) menggunakan 5% dan 3% gliserol ternyata hasil terbaik adalah 5%. Prinosilova et al. (2005) menggunakan gliserol dengan konsentrasi 4, 6 dan 8%, Sementara Olar et al.
(1989) dalam Bateman (2001) melaporkan bahwa motilitas spermatozoa post-thawing terbaik didapatkan pada pengencer Tris kuning telur dengan konsentrasi gliserol rendah yaitu 2-4%.
TUJUAN PENELITIAN
1. Mengkaji kembali konsentrasi gliserol dalam proses pembekuan semen anjing Retriever.
2. Mengetahui efektifitas suplementasi xilosa dalam berbagai konsentrasi gliserol pada pembekuan semen anjing Retriever, menggunakan pengencer Tris kuning telur dalam upaya menunjang program IB pada hewan ini.
HIPOTESA
TINJAUAN PUSTAKA Tinjauan umum anjing Retriever
Di seluruh dunia diperkirakan terdapat 700 sampai 800 ras anjing. The English Kennel Club membagi ras-ras anjing menjadi tipe Gundog grup, Hound dog grup, Pastoral grup, Terrier grup, Toy grup, Utility grup, dan Working dog
grup (Cunliffe 1999). Anjing Retriever seperti anjing lainnya termasuk kedalam subspesies Canis lupus familiaris tipe maxi dengan bobot badan 26-45 kg dan merupakan gun dogs yang bertugas mengambil hasil buruan kepada para pemburu. Anjing Retriever dibiakan terutama untuk mengambil burung atau buruan lain dan mengembalikan hasil buruan tersebut ke pemburu tanpa merusaknya. Trah Retriever memiliki mulut yang lembut dan keinginan kuat untuk menyenangkan pemiliknya, kemauan untuk belajar yang tinggi serta kepatuhan.
Terdapat dua jenis anjing Retriever, Labrador dan Golden, keduanya dapat dimiripkan dalam satu dan lain hal, namun kedua jenis ini berbeda, terlihat dari standardisasinya. Adapun kemiripan mereka adalah kedua jenis ini termasuk ke dalam jenis retriever dan sangat suka terhadap air dan juga mereka adalah anjing keluarga yang sangat handal serta mempunyai temperamen yang sangat bagus.
Salah satu alasan utama seseorang memilih anjing pendamping dari suatu jenis tertentu, adalah kesesuaian antara temperamen bawaan dari jenis tersebut dengan temperamen dan gaya hidup pecinta anjing. Anjing Retriever adalah anjing yang bersahabat, penuh kasih sayang dan sangat setia kepada pemilik dan keluarganya, cerdas, mudah dilatih dan selalu ceria, sehingga mudah berkawan dengan binatang peliharaan yang lain.
Gambar 1 Anjing Labrador Retriever (Sumber : Wikipedia 2007)
Golden Retriever menurut Cunliffe (1999) awalnya digunakan untuk mengambil dan menyerahkan buruan dalam perlombaan menembak, namun Golden Retriever ternyata juga mampu beradaptasi dalam bidang lain termasuk memandu orang cacat, mendeteksi obat-obatan terlarang dan peledak, mencari jejak dan menolong korban hilang serta kepatuhan lain. Sebagai Working Dog, Golden Retriever banyak yang difungsikan sebagai pelacak barang-barang terlarang seperti narkoba dan bom. Banyak pula yang difungsikan sebagai anjing pencari dan penolong korban dalam kegiatan Search and Rescue (SAR), seperti dalam kasus runtuhnya bangunan bertingkat akibat gempa maupun oleh bom, seperti dalam kasus 9/11 ketika gedung World Trade Center di New York runtuh akibat ditabrak pesawat oleh teroris (Anonim 2008).
Gambar 2 Anjing Golden Retriever (Sumber : Wikipedia 2008)
Selain sebagai anjing keluarga, penampilan Golden Retriever yang glamor dan selalu ceria telah menjadikannya salah satu anjing kesayangan terpopuler di dunia sebagai anjing penggembala (sheep dog), anjing penyelamat (rescue dog), anjing pelayan (service dog), keindahan bulunya juga menjanjikan kesuksesan sebagai juara di kontes (Natasaputra 2005).
Reproduksi anjing jantan
Pubertas anjing jantan diartikan sebagai pertama kali munculnya spermatozoa di dalam ejakulat, dan kemauan seksual serta kemampuan untuk kopulasi. Rata-rata umur mulainya pubertas antara 7 sampai 10 bulan, dengan kisaran 5 sampai 12 bulan. Pejantan normalnya mencapai pubertas sedikit lebih lambat daripada betina dari ras yang sama (Junaidi 2006). Spermatozoa pertama kali muncul dalam ejakulat kurang lebih umur 7 sampai 9 bulan (Johnston et al.
1982, Taha et al. 1981).
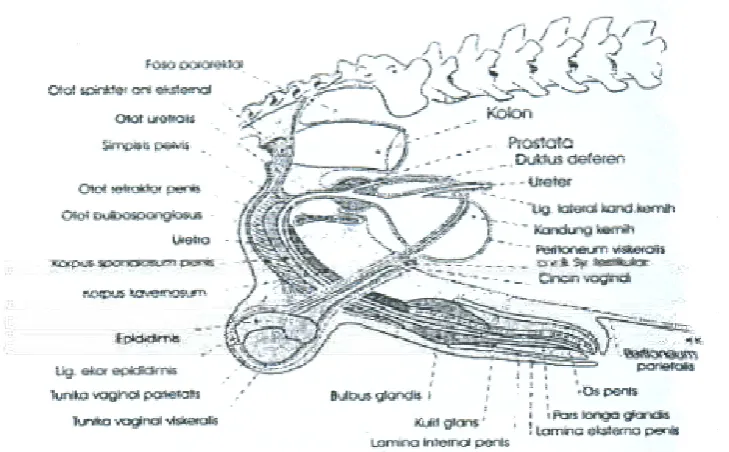
penis. Diagram anatomi dari skrotum, testis dan epididimis, prostata, penis dan preputium dapat dilihat pada Gambar 3.
Gambar 3 Alat reproduksi anjing jantan (Sumber: Junaidi 2006)
Menurut Partodihardjo (1987) semen adalah zat cair yang keluar dari tubuh melalui penis sewaktu kopulasi. Semen terdiri dari bagian yang berupa sel hidup dan bergerak yang disebut spermatozoa dan zat cair dimana sel-sel tersebut berenang yang disebut seminal plasma.
Gambar 4 Spermatozoa anjing normal (Sumber : Feldman & Nelson 1996)
utama dan bagian akhir (yang gerakan flagelanya memudahkan terjadinya gerakan spermatozoa). Spermatozoa anjing mempunyai kepala berbentuk sekop ini sama seperti spermatozoa pada manusia, sapi dan kelinci (Gambar 4).
Plasma semen adalah campuran sekresi yang dihasilkan sebagian besar oleh kelenjar-kelenjar kelamin pelengkap, yaitu kelenjar-kelenjar vesikulares dan prostat, serta sebagian oleh epididimis. Secara biokimiawi plasma semen mengandung persenyawaan-persenyawaan organik spesifik termasuk fruktosa, asam sitrat, sorbitol, inositol, glycerilphosphoril-choline (GPC), ergothionin dan
prostaglandin yang tidak ditemukan di bagian-bagian lain dari tubuh hewan. Energi untuk mempertahankan motilitas dan kemampuan spermatozoa berasal dari gula, terutama fruktosa dalam seminal plasma (Salisbury & Vandemark 1984). Fruktosa adalah gula yang siap dimetabolisme dan menyediakan sumber energi utama untuk spermatozoa dalam semen (Evans & Maxwell 1987).
Fisiologi reproduksi hewan jantan dikontrol oleh mekanisme hormonal. Mekanisme tersebut dimulai dari dilepasnya Gonadotropin Releasing Hormone (GnRH) oleh hipotalamus yang terletak di hipofise anterior. Hormon-hormon gonadotropin tersebut antara lain Luteinizing Hormone (LH) dan Follicle Stimulating Hormone (FSH) yang disekresikan oleh kelenjar pituitari anterior. Selanjutnya FSH menuju ke testis dan masuk ke dalam tubulus seminiferus kemudian bersama-sama dengan testosteron menstimulasi sel Sertoli untuk inisisasi spermatogenesis. Testosteron dalam testis diikat oleh Androgen Binding protein (ABP) yang diproduksi oleh sel-sel Sertoli.
Setelah distimulasi oleh GnRH, LH dilepaskan dan menuju ke testis untuk mengontrol sekresi testosteron dari sel Leydig. Testosteron yang dihasilkan akan berikatan dengan ABP yang diproduksi oleh sel Sertoli dan bersama-sama dengan FSH akan menginisiasi terjadinya spermatogenesis (Hafez et al. 2000). Selain mengontrol spermatogenesis, testosteron juga bertanggung jawab mengontrol semua organ kelamin assesoria dan dan karakteristik kelamin sekunder (Feldman & Nelson 1996).
Spermatogenesis adalah suatu mekanisme pembentukan spermatozoa yang berasal dari spermatogonia. Spermatogenesis terjadi dalam epithelium germinalis dari tubulus seminiferus dan terdiri dari spermatositogenesis dan spermiogenesis. Spermatositogenesis merupakan pembentukan spermatid dari spermatogonia dan menghasilkan spermatosit primer. Spermiogenesis merupakan diferensiasi bentuk spermatid menjadi spermatozoa yang dilepas ke dalam lumen tubulus seminiferus yang disebut proses spermiasi. Dari tubulus seminiferus, spermatozoa melewati rete testis dan vasa efferensia ke dalam epididimis dan mengalami stadium pendewasaan yang terakhir, spermatozoa telah memiliki kemampuan menjadi motil, terjadi perubahan membran dan droplet dalam sitoplasma hilang. Kemudian spermatozoa dewasa disimpan dalam ekor epididimis. Pada saat ejakulasi, spermatozoa lewat sepanjang vas deferen dan berbagai sekresi ditambahkan oleh kelenjar prostat (Hewitt 1997).
Pengolahan semen anjing
Koleksi dan evaluasi semen sangat diperlukan sebagai bagian dari pemeriksaan kesehatan reproduksi yang lengkap. Pemeriksaan tersebut untuk menilai apakah anjing fertil, subfertil atau infertil, juga berguna untuk koleksi spesimen untuk sitologi cairan seminal dan kultur mikrobial. Koleksi semen juga diperlukan untuk pelaksanaan IB, pengawetan semen jangka pendek (pendinginan semen yang telah diencerkan) ataupun jangka panjang (semen beku).
Koleksi semen pada anjing paling mudah dilakukan dengan masturbasi dengan ataupun tanpa sarung tangan. Persyaratan terbaik untuk memperoleh sampel adalah lingkungan yang sudah dikenal oleh anjing, di lantai atau di meja dengan permukaan yang tidak licin, dengan hadirnya betina yang estrus dan sedikit mungkin orang yang ada.
Dalam penelitian kali ini, koleksi semen dilakukan dengan metode masturbasi tanpa sarung tangan. Untuk koleksi semen dengan metode ini berbagai macam peralatan dapat digunakan. Penggunaan tabung kaca koleksi yang jernih untuk memudahkan visualisasi semen.
(fraksi yang kaya akan spermatozoa), anjing akan mencoba mengangkat salah satu kaki belakang melewati lengan operator seperti kebiasaan anjing pada perkawinan alami dimana anjing jantan mengangkat kaki dan memutar kebelakang. Koleksi kemudian harus dihentikan untuk menghindari campur dengan sekresi dari glandula prostata atau fraksi ketiga yang jernih dan transparan (Junaidi 2006).
Sesudah dilakukan koleksi semen dilanjutkan dengan evaluasi semen. Semen disimpan pada suhu 32 - 35oC sampai pemeriksaan motilitas dilakukan, sesudahnya dapat disimpan di di suhu ruang. Tabung semen harus disimpan dalam rak dan bagian yang terbuka harus ditutup dengan parafilm. Evaluasi semen dapat dilakukan setelah pemeriksaan klinik. Pemeriksaan ejakulat memberikan informasi yang dibutuhkan tentang produksi semen. Jumlah spermatozoa di dalam ejakulat berhubungan dengan frekuensi ejakulasi dan waktu istirahat kelamin pejantan.
Kualitas semen anjing bervariasi tergantung pada lingkungan dimana anjing dikoleksi, adanya penyakit pada saluran reproduksi jantan, penyakit sistemik, umur, ras, dan musim. Anjing yang sangat muda dan yang terlalu tua mempunyai kualitas semen yang jelek.
Perbedaan pada kualitas semen yang disebabkan oleh ras adalah perbedaan dalam jumlah total spermatozoa perejakulat yang tergantung pada berat jaringan testikular yang ada, sehingga pada anjing ras besar dengan testis besar akan mempunyai jumlah yang lebih banyak. Musim pada satu tahun kemungkinan juga mempunyai pengaruh pada kualitas semen.
kadang-keradangan tampak seperti normal. Warna kuning menunjukkan kontaminasi dengan urin atau eksudat keradangan, hijau mungkin menunjukkan eksudat purulen, merah menunjukkan darah, coklat menunjukkan darah lama yang biasanya berasal dari prostata, dan sampel jernih menunjukkan azoospermia.
Derajat keasaman (pH) dari fraksi ketiga (cairan prostat) dan pada total ejakulat anjing normal rata-rata 6.5 dengan kisaran 6.3 sampai 6.7. Konsentrasi bukanlah indikator kualitas semen pada anjing, kecuali pada kasus tersebut tidak ada spermatozoa dalam ejakulat. Dalam ejakulat yang mengandung spermatozoa, konsentrasi tergantung pada jumlah cairan prostata yang dikoleksi, dan dapat berkisar dari 4 sampai 400 juta per ml. Konsentrasi spermatozoa dapat dihitung dengan hemositometer, spektrofotometer atau penghitung sel otomatis. Konsentrasi harus ditentukan untuk menghitung jumlah total spermatozoa dalam ejakulat.
Abnormalitas lebih sering berlokasi di kepala dan ekor dan dibagi kedalam tipe primer dan sekunder. Abnormalitas primer aslinya berasal dari spermatogenesis, sementara abnormalitas sekunder berkembang selama melewati saluran epididimis atau selama ejakulasi. Penyebab morfologi abnormal spermatozoa pada anjing termasuk infeksi saluran reproduksi, demam, dan trauma testikuler. Sampel yang dikoleksi sesudah istirahat kelamin yang lama mengandung spermatozoa lama/tua dari epididimis mungkin mempunyai persentase morfologi spermatozoa abnormal yang tinggi. Evaluasi secara khusus tentang integritas akrosom relevan untuk mengevalusi morfologi spermatozoa dari semen beku setelah thawing.
Penilaian persentase morfologi spermatozoa normal adalah satu-satunya pengukuran yang konsisten untuk mengevaluasi spermatozoa anjing. Morfometri spermatozoa normal pada anjing dari semua ras mempunyai total panjang 6.8 μm, dengan kepala ditutupi oleh akrosom dari ketebalan yang seragam, panjang mid-piece 1.1 μm, dan ekor yang terdiri dari bagian utama dan bagian akhir panjangnya 5.0 μm. Spermatozoa yang lurus maupun yang seperti kurva dengan
tanpa abnormalitas kepala, midpiece atau ekor dikategorikan normal.
37oC selama 2 jam akan meningkatkan persentase kematian (Oettle 1993, diacu dalam Junaidi 2006).
Inseminasi buatan (IB) pada anjing belakangan ini telah banyak diterima dan merupakan salah satu metode yang berhasil dilakukan dalam memproduksi keturunan yang berkualitas apabila perkawinan secara alamiah tidak mungkin dilakukan, yaitu antara lain disebabkan oleh masalah anatomi, psikologi dan fisik, selain itu keterbatasaan jarak dan letak juga dapat membatasi terjadinya perkawinan secara alamiah (Shuttleworth 2002). Seperti pada hewan lainnya IB pada anjing dapat dilakukan dengan semen segar, semen cair ataupun semen beku.
Semen beku adalah semen yang telah diencerkan kemudian dibekukan dibawah titik beku air. Pembekuan adalah suatu fenomena pengeringan fisik. Pada pembekuan semen terbentuk kristal-kristal es, terjadi penumpukan elektrolit dan bahan terlarut lainnya di dalam larutan atau di dalam sel-sel. Pada umumnya masalah semen berkisar pada dua hal, yaitu pengaruh cold shock terhadap sel yang dibekukan dan perubahan-perubahan intra seluler akibat pengeluaran air yang bertalian dengan pembentukan kristal-kristal es. Kelemahan ini sebagian dapat diatasi dengan menggunakan zat-zat pelindung di dalam pengencer dan penurunan suhu secara gradual.
Penggunaan semen beku untuk inseminasi pada anjing tidak seluas seperti pada sapi atau kuda. Anjing jantan harus mempunyai kualitas semen yang sangat bagus, dan betina yang diinseminasi dengan semen beku harus sudah dewasa dan tidak ada gangguan infertilitas (Junaidi 2006). Kualitas semen beku antara lain ditentukan oleh bahan pengencer yang digunakan serta teknik pembekuan yang dilakukan. Pengencer semen merupakan medium spermatozoa selama proses kriopreservasi. Kandungan bahan pengencer semen akan secara langsung mempengaruhi kualitas spermatozoa yang terdapat di dalamnya.
melindungi spermatozoa selama proses pembekuan dan thawing. Held (1997) juga melaporkan pengencer ditambahkan ke semen untuk memberikan sumber energi bagi spermatozoa, mengubah buffer pH, mencegah pertumbuhan bakteri dan mencegah kerusakan spermatozoa selama pendinginan, pembekuan dan
thawing.
Buffer berfungsi sebagai pengatur tekanan osmotik dan juga berfungsi menetralisir asam laktat yang dihasilkan dari sisa metabolisme spermatozoa.
Buffer yang umum digunakan adalah tris (hydroxymethyl) aminomethan yang mempunyai kemampuan sebagai penyangga yang baik dengan toksisitas yang rendah dalam konsentrasi yang tinggi (Steinbach & Foote 1967). Selain itu,
buffer digunakan untuk menjaga keseimbangan ion dan pH di dalam larutan pengencer. Pengencer semen memiliki pH optimal dari sebesar 6.75 sampai 7.50; osmolalitas optimal adalah 300 sampai 325 mOsm (Junaidi 2006).
Sumber nutrisi yang paling banyak digunakan adalah karbohidrat terutama fruktosa yang paling mudah dimetabolisir oleh spermatozoa (Toelihere 1993). Glukosa, dekstrosa dan laktosa telah dijelaskan sebagai sumber energi pada pada pengencer semen anjing. Cairan seminal anjing mempunyai konsentrasi fruktosa yang sangat rendah dibandingkan cairan seminal pada spesies lain, kemungkinan disebabkan karena anjing jantan tidak mempunyai vesikula seminalis. Fruktosa dapat digunakan sebagai sumber energi pada spermatozoa anjing (Rota et al
1995).
Karbohidrat dapat berfungsi ganda dimana karbohidrat sederhana seperti glukosa dan fruktosa dibutuhkan sebagai sumber energi, sedangkan karbohidrat molekul besar dapat berfungsi sebagai krioprotektan ekstraseluler. Gliserol merupakan krioprotektan yang paling umum digunakan pada pembekuan semen mamalia. Konsentrasi gliserol yang tinggi akan bersifat toksik sebaliknya pada konsentrasi yang rendah maka daya protektifnya akan berkurang (Hafez 1993).
Prinsip-prinsip kriopreservasi semen
saat, (3) dapat digunakan kapan saja bila dibutuhkan, dan (4) tidak perlu mengimpor atau memelihara pejantan-pejantan unggul. Kerugiannya yaitu : (1) biaya pelaksanaan yang cukup mahal, (2) memerlukan tenaga yang terampil dan berpengalaman, dan (3) hanya semen yang berkualitas baik yang dapat dan layak dibekukan.
Prinsip utama proses kriopreservasi semen adalah pengeluaran air yang berlebihan dari sel spermatozoa dan jika tidak terjadi dehidrasi akan menyebabkan pembentukan kristal-kristal es yang dapat merusak sel spermatozoa. Menurut Toelihere (1993), ada dua fenomena utama proses pembekuan semen, yaitu adanya cold-shock terhadap sel yang dibekukan dan perubahan intraseluler akibat pengeluaran air yang bertalian dengan pembentukan kristal-kristal es.
Tiga faktor utama penyebab kerusakan selama proses kriopreservasi, yaitu (1) kerusakan mekanik akibat pembentukan kristal-kristal es yang dapat mempengaruhi struktur sel pada organel sitoplasma atau pecah karena ekspansi es, (2) adanya dehidrasi dari suspensi baik intra maupun ekstraseluler sehingga konsentrasi larutan menjadi toksik dan letal, dan (3) perubahan fisik kimiawi diantaranya presipitasi, denaturasi, koagulasi dari protein, disosiasi ion dan kehilangan sifat-sifat adsorbsi atau sifat-sifat pengikatan air (Supriatna & Pasaribu 1992).
Pada umumnya kerusakan membran plasma selama proses penanganan semen, baik selama pendinginan semen (20oC – 5oC) dan selama proses penyimpanan (Paulenz et al. 2002). Tingkat pendinginan (cooling rate) mempengaruhi kerusakan pada membran sel spermatozoa selama proses kriopreservasi semen. Prinsip utama dari cooling rate adalah kecepatan optimal yang dapat memberikan kesempatan air keluar dari sel secara kontinyu bertahap sebagai respon sel terhadap kenaikan konsentrasi larutan ekstraseluler yang semakin tinggi diantara kristal-kristal es yang terbentuk (Supriatna & Pasaribu 1992).
segar (Gwo et al. 2002). Untuk dapat melindungi spermatozoa selama pembekuan, perlu ditambahkan krioprotektan pada bahan pengencer. Krioprotektan yang sering digunakan adalah gliserol. Selain itu bahan-bahan lain seperti dimethylsulfoxide (DMSO) dan karbohidrat molekul besar dapat juga bekerja sebagai krioprotektan.
Semen mudah mengalami kerusakan selama proses pembekuan. Hammerstedt et al. (1990) menyatakan bahwa kerusakan spermatozoa anjing selama proses pembekuan dapat dihambat dengan penggunaan krioprotektan yang tepat dan pada konsentrasi yang tepat juga. Berdasarkan perpaduan antara sifat fisika-kimia (besar molekul, polaritas dan koligatif) dengan sifat biologik membran sel (semipermiabel), krioprotektan dibagi dua, yaitu krioprotektan ektraseluler dan intraseluler. Krioprotektan ekstraseluler adalah krioprotektan yang tidak dapat menembus membran dan masuk ke dalam sel dengan bobot molekul (BM) besar misalnya PVP (Polyvinilpirolidone), gula (sukrosa, glukosa, trehalosa, dan xilosa), protein dan lipoprotein (kuning telur, serum darah dan susu). Sedangkan krioprotektan intraseluler adalah krioprotektan yang mampu menembus membran sel karena memiliki BM kecil misalnya DMSO (dimethylsulfoxide), etilen glikol, 1.2 propadienol, dan gliserol.
Menurut Rohloff (1978) yang diacu dalam Rota (1998) pada awalnya laktosa banyak digunakan untuk pembekuan, namun kini gliserol merupakan bahan krioprotektan yang paling sering ditambahkan dalam pengencer untuk tujuan pembekuan semen anjing. Seperti disebutkan dalam Junaidi (2006) kuning telur dan gliserol adalah komponen yang paling sering digunakan dalam pengencer semen anjing untuk melindungi spermatozoa dari cold shock dan kerusakan selama pembekuan dan thawing.
Gliserol adalah krioprotektan intraseluler yang mengandung komponen utama lipid berupa tiga atom karbon (C) dan tiga gugus OH (Gambar 5) yang dibentuk melalui lipolisis. Gliserol merupakan agen krioprotektan yang umum digunakan dan efektif digunakan secara tunggal maupun dikombinasikan dengan krioprotektan lainnya (Maxwell & Watson 1996). Gliserol merupakan satu-satunya krioprotektan yang paling efektif dan tidak ada peningkatan pengaruh apabila ditambahkan dengan bahan lainnya (Molinia et al. 1994).
Gliserol mempunyai sifat larut dalam lemak sehingga dapat menembus membran plasma masuk ke dalam sel. Gliserol akan berdifusi memasuki spermatozoa dan digunakan untuk aktivitas metabolisme oksidatif, menggantikan sebagian air bebas dan mendesak keluar elektrolit-elektrolit, menurunkan konsentrasi elektrolit intrasel serta mengurangi daya rusaknya terhadap spermatozoa dengan jalan memodifikasi kristal-kristal es yang terbentuk (Toelihere 1985).
H OH H OH – C – C –C – OH
H
Gambar 5 Rumus umum gliserol (Sumber : Voet & Voet 1990)
Selama pembekuan, gliserol dapat memberikan efek perlindungan pada spermatozoa, tetapi dapat juga menyebabkan kerusakan pada struktur spermatozoa. Gliserol dapat bersifat toksik pada spermatozoa yang sudah mengalami pembekuan dan mengurangi kapasitas fertilitasnya (Molinia et al.
1994).
menggunakan gliserol 8% untuk pembekuan semen anjing pada pengencer Tris. Sementara Olar et al. (1989) dalam Bateman (2001) melaporkan bahwa motilitas spermatozoa post-thawing terbaik didapatkan pada pengencer yang mengandung konsentrasi gliserol 2-4%. Pada anjing motilitas post-thawing meningkat dengan penambahan gliserol diatas 2% dan dapat meningkat lagi lebih tinggi pada konsentrasi 8%. Namun pada penambahan gliserol dengan konsentrasi lebih dari 8% akan memberikan efek yang berlawanan (Bateman 2001).
Fungsi ganda karbohidrat yaitu selain sebagai sumber energi juga dapat berfungsi sebagai krioprotektan ekstraseluler. Penggunaan disakarida (trehalosa), trisakarida (raffinosa) dan oligosakarida lainnya pada pengenceran semen anjing diduga lebih mampu melindungi spermatozoa dalam proses pembekuan. Penambahan karbohidrat dalam pengencer memiliki efek meningkatkan spermatozoa hidup post-thawing spermatozoa mamalia. Selain itu, karbohidrat juga memiliki beberapa fungsi yang lain, antara lain, dapat meningkatkan penyediaan energi bagi sperma selama inkubasi, menjaga tekanan osmotik dan juga gula dapat bertindak sebagai krioprotektan (Yildiz et al. 2000).
H OH H
H2OH – C C – C – C – C – HO OH H OH
Gambar 6 Rumus umum xilosa (Sumber : Soerodikoesoemo & Hartiko 1989)
Molinia et al. (1994) menemukan bahwa monosakarida lebih baik dari disakarida dalam meningkatkan motilitas sperma beku kuda dalam pengencer Tris kuning telur. Xilosa merupakan monosakarida pentosa yang merupakan konstituen khas dari polisakarida dalam jaringan keras (Soerodikoesoemo & Hartiko 1989). Penggunaan 70 mM xilosa sebagai krioprotektan telah terbukti memiliki daya protektif tertinggi selama proses pembekuan (Yildiz et al. 2000).
METODOLOGI PENELITIAN Waktu dan Tempat Penelitian
Penelitian ini dilakukan selama bulan Februari sampai bulan April 2008. Tempat pengambilan sampel dilakukan di Taman Yasmin, Cinangneng dan Sawangan Depok dan evaluasi dilakukan di laboratorium Unit Rehabilitasi Reproduksi (URR) Bagian Reproduksi dan Kebidanan, Departemen Klinik Reproduksi dan Patologi Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Materi Penelitian
Sebagai sumber semen digunakan tiga ekor anjing jenis Retriever jantan, yang telah dewasa kelamin dalam kondisi sehat, yang terdiri atas satu ekor jenis Golden Retriever dan dua ekor jenis Labrador Retriever yang dipelihara pada tiga lokasi yang berbeda. Ketiganya diberi pakan dogfood dua kali sehari secara teratur. Bahan yang lainnya antara lain pengencer Tris kuning telur, NaCl fisiologis, antibiotik, zat pewarna eosin negrosin.
Alat-alat yang digunakan terdiri atas tabung kaca, mikroskop cahaya listrik, tabung reaksi, straw 0.25 mL, thermos, box styrofoam, kontainer nitrogen cair, object glass, pipet mikro, dan gunting.
Metode Penelitian
Buffer yang digunakan adalah Tris yang mengacu pada laporan Gunay et al. (2004) dengan komposisi pada Tabel 1.
Tabel 1 Komposisi buffer Tris
Bahan Komposisi Tris (g)
Asam sitrat (g) Fruktosa (g) Aquabides (ml) ad
0.3028 0.17 0.125
Sedangkan pengencer semen beku yang digunakan adalah Tris kuning telur (TKT) dengan mengadopsi Yildiz et al. (2000) yaitu Tris kuning telur dengan gliserol 3% dan xilosa 0 mM (G3Xo); Tris kuning telur (TKT) dengan konsentrasi gliserol 3% dan xilosa 70 mM (G3X70); Tris kuning telur (TKT) dengan konsentrasi gliserol 6% dan xilosa 0 mM (G6X0); Tris kuning telur (TKT) dengan konsentrasi gliserol 6% dan xilosa 70 mM (G6X70) (Tabel 2).
Tabel 2 Komposisi pengencer semen beku
Bahan Krioprotektan G3Xo* G3X70 G6Xo G6X70 Keterangan : *Jenis pengencer semen beku yang digunakan; G3Xo: TKT dengan gliserol 3% dan xilosa 0 mM,
G3X70: TKT dengan gliserol 3% dan xilosa 70 mM, G6Xo: TKT dengan gliserol 6% dan
xilosa 0 mM, G6X70: TKT dengan gliserol 6% dan xilosa 0 mM
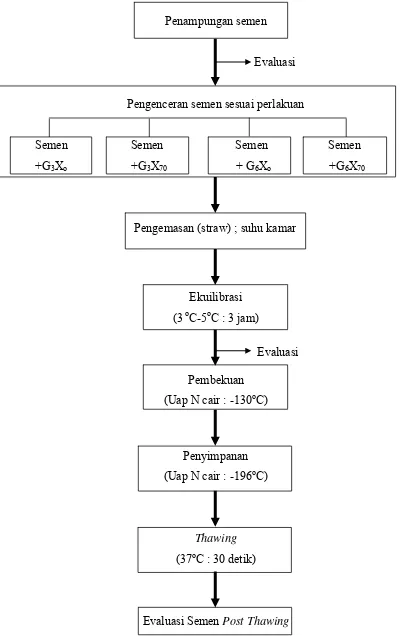
Semen anjing dikoleksi menggunakan teknik massage/masturbasi. Semen yang dikoleksi dipisahkan menjadi tiga fraksi dan hanya semen dari fraksi ke dua yang digunakan dalam penelitian. Segera setelah koleksi, semen dievaluasi secara makroskopis (volume, warna, kekentalan dan pH) serta mikroskopis (gerakan massa, persentase spermatozoa motil, persentase spermatozoa hidup, persentase spermatozoa abnormal dan konsentrasi spermatozoa). Semen yang diencerkan harus memenuhi syarat, yaitu motilitas ≥ 70% dan spermatozoa abnormal < 15%.
Semen yang memenuhi standar yang ditentukan dibagi ke dalam empat tabung dan diencerkan 1:1. Semen yang telah diencerkan dikemas dalam straw 0.25 mL. Proses ekuilibrasi selama tiga jam dilakukan dalam thermos yang diisi es batu dan dibungkus handuk dengan suhu 3oC-5oC, bersamaan dengan ditransportasi dari lokasi koleksi semen ke laboratorium. Pembekuan dilakukan diatas permukaan uap N2 cair selama 10 menit, kemudian semen beku disimpan dalam kontainer yang berisi N2 cair suhu -196oC. Pencairan kembali (thawing) dilakukan menggunakan air hangat dengan suhu 37 oC selama 30 detik.
kualitatif dengan membandingkan spermatozoa hidup yang progresif dan tidak progresif, dengan menggunakan mikroskop cahaya listrik pembesaran 400 X pada tiga lapang pandang berbeda. Penilaian yang diberikan dari angka 0% (mati semua) sampai 100% (motil semua). Persentase spermatozoa hidup ditandai dengan kepala tidak menyerap warna/transparan. Spermatozoa yang telah mati berwarna merah bila ditandai dengan zat pewarna eosin nigrosin. Persentase spermatozoa hidup dihitung dengan menggunakan mikroskop cahaya listrik dengan pembesaran 400 X, yang dihitung dengan rumus :
%
Selain itu keberhasilan pembekuan juga dinilai dari kemampuan spermatozoa yang berhasil pulih dari proses pembekuan atau disebut nilai
recovery rate (Hafez 1993),yang dihitung dengan rumus :
%
Penampungan semen
Evaluasi
Pengenceran semen sesuai perlakuan
Semen Semen Semen Semen +G3Xo +G3X70 + G6Xo +G6X70
Pengemasan (straw) ; suhu kamar
Ekuilibrasi (3 oC-5oC : 3 jam)
Evaluasi Pembekuan
(Uap N cair : -130oC)
Penyimpanan (Uap N cair : -196oC)
Thawing
(37oC : 30 detik)
Evaluasi Semen PostThawing
HASIL DAN PEMBAHASAN
Karakteristik semen segar anjing Retriever
Karakteristik semen berbeda bergantung pada breed, individu, menejemen, teknik koleksi dan frekuensi dari koleksi semen. Pada penelitian ini, semen segar anjing Retriever mempunyai karakteristik yang bagus dan memenuhi syarat pembekuan semen anjing, seperti ditunjukkan pada Tabel 3.
Table 3 Karakteristik semen segar anjing Retriever Karakteristik semen Rataan Makroskopis
Volume (ml) fraksi ke dua Warna Konsentrasi spermatozoa (106 ml-1)
Volume ejakulat fraksi ke dua yang diperoleh sebesar 2.60 ± 0.55 ml. Volume ejakulat fraksi ke dua pada anjing berkisar antara 1.0 sampai 4.0 ml (Junaidi 2006). Volume semen dipengaruhi oleh individu, bangsa dan frekuensi pengenceran (Laing 1979) namun Junaidi (2006) menyatakan bahwa volume tidak menunjukkan kualitas semen karena bergantung dari jumlah cairan prostata yang diperoleh.
Gambar 8 Tiga fraksi semen anjing Retriever
Keterangan : 1. fraksi pra-spermatozoa 2. fraksi kaya spermatozoa 3. fraksi pasca spermatozoa
ditampung, pra-spermatozoa encer (watery), kaya spermatozoa seperti susu tidak kental (milky, non viscous), dan pasca-spermatozoa sangat kental (highly viscous). Konsistensi dan warna semen berkolerasi dengan jumlah sel spermatozoa yang terdapat dalam semen tersebut. Warna fraksi kedua semen anjing yang diperoleh putih keruh seperti susu dengan konsistensi encer (Gambar 8).
Derajat keasaman (pH) memegang peranan sangat penting karena dapat mempengaruhi persentase spermatozoa hidup, apabila pH tinggi/rendah akan menyebabkan spermatozoa mati. Variasi pH semen kemungkinan dipengaruhi oleh konsentrasi asam laktat yang dihasilkan dalam proses akhir metabolisme (Toelihere 1985). Kisaran pH semen anjing 6.3 sampai 6.7 (Johnston 1991), rataan derajat keasaman semen anjing dalam penelitian 6.40 ± 0.07 relatif normal.
Kualitas semen beku anjing Retriever
Kualitas semen beku antara lain ditentukan oleh bahan pengencer yang digunakan serta teknik pembekuan yang dilakukan. Pengencer semen merupakan medium spermatozoa selama proses kriopreservasi. Kandungan bahan pengencer semen akan secara langsung mempengaruhi kualitas spermatozoa yang terdapat di dalamnya.
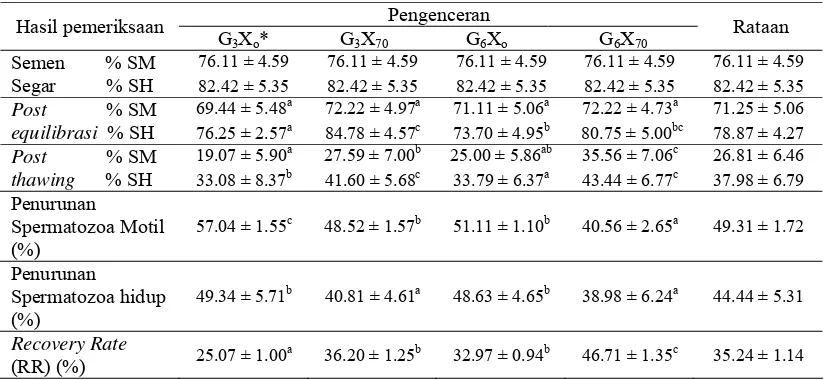
Parameter kualitas semen beku yang diamati dalam penelitian ini adalah persentase spermatozoa motil dan persentase spermatozoa hidup yang dinilai sesaat setelah koleksi, setelah ekuilibrasi dan setelah semen di-thawing. Kualitas semen beku anjing Retriever dapat dilihat pada Tabel 4.
Tabel 4 Kualitas semen beku anjing Retriever dalam pengencer Tris Kuning Telur (TKT) dengan konsentrasi gliserol 3% dan 6% dengan maupun tanpa penambahan 70 mM xilosa
Pengenceran
1. Huruf yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata (nilai P<0.05)
2. *Jenis pengencer semen beku yang digunakan; G3Xo: TKT dengan gliserol 3% dan xilosa 0 mM, G3X70:
TKT dengan gliserol 3% dan xilosa 70 mM, G6Xo: TKT dengan gliserol 6% dan xilosa 0 mM, G6X70:
TKT dengan gliserol 6% dan xilosa 0 mM
semen segar maupun semen beku (Rota 1998). Shahiduzzaman (2006) menyatakan bahwa motilitas merupakan kriteria penting dalam penilaian potensi fertilitas dari semen dan dapat menyediakan informasi yang bermanfaat mengenai reaksi spermatozoa dalam lingkungan yang tidak menguntungkan.
Berdasarkan hasil pengamatan persentase spermatozoa motil dari ketiga anjing Retriever sampai tahap post-equilibrasi, belum terdapat pengaruh perbedaan keempat pengencer semen beku sehingga memberikan hasil yang tidak berbeda nyata (nilai P>0.05), dengan masing-masing nilai pengencer Tris Kuning Telur (TKT) dengan gliserol 3% dan xilosa 0 mM sebesar 69.44%, pengencer tris kuning telur dengan gliserol 3% dan xilosa 70 mMsebesar 72.22%, pengencer tris kuning telur dengan gliserol 6% dan xilosa 0 mM sebesar 71.11% dan terakhir pengencer tris kuning telur dengan gliserol 6% dan xilosa 70 mM sebesar 72.22%. Sedangkan pada persentase spermatozoa hidup post-equilibrasi, terbesar adalah pada pengencer tris kuning telur dengan gliserol 3% dan dengan penambahan xilosa 70 mM(84.78%) lalu berturut-turut diikuti oleh pengencer tris kuning telur dengan gliserol 6% dan xilosa 70 mM (80.75%), pengencer tris kuning telur dengan gliserol 3% dan xilosa 0 mM (76.25%) dan yang terakhir dan terkecil oleh pengencer tris kuning telur dengan gliserol 6% dan xilosa 0 mM (73.70%).
Menurut Junaidi (2006) motilitas progresif adalah parameter yang paling sering dinilai untuk evaluasi kualitas spermatozoa anjing yang di-thawing setelah pembekuan. Persentase spermatozoa motil yang progresif menurun setelah
di-thawing, dengan nilai yang dilaporkan adalah kurang lebih 50-60%, dengan persentase yang dianjurkan untuk kepentingan inseminasi buatan sebesar 35-50% (Pesch & Hoffmann 2007). Dalam penelitian, berdasarkan hasil pengamatan post-thawing, persentase spermatozoa motil dan spermatozoa hidup paling tinggi ditunjukkan oleh pengencer tris kuning telur dengan konsentrasi gliserol 6% dan dengan penambahan xilosa 70 mM (G6X70) yaitu masing-masing sebesar 35.56% dan 43.44%. Lalu pada persentase spermatozoa motil post-thawing berturut-turut diikuti oleh pengencer tris kuning telur dengan gliserol 3% dan xilosa 70 mM (G3X70) sebesar 27.59% yang tidak berbeda nyata dengan pengencer tris kuning telur dengan gliserol 6% dan xilosa 0 mM (G6Xo) sebesar 25.00% dan motilitas
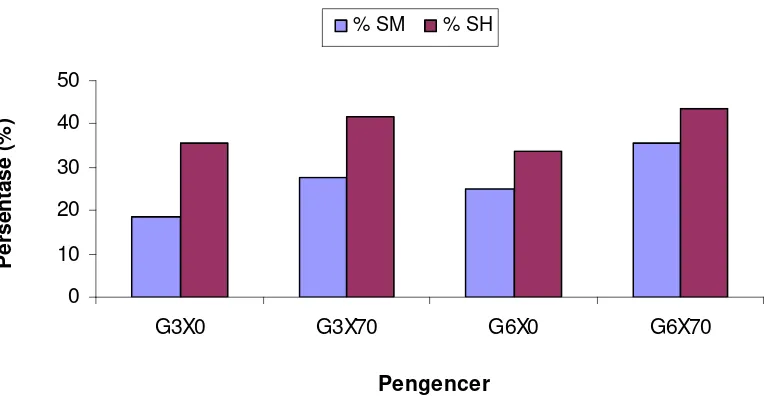
xilosa 0 mM (G3Xo) yaitu hanya sebesar 19.07%. Gambar 9 menunjukkan kualitas semen beku anjing Retriever berdasarkan persentase spermatozoa motil dan spermatozoa hidup post-thawing.
0
Gambar 9 Grafik kualitas semen beku post-thawing anjing Retriever dalam pengencer Tris kuning telur dengan konsentrasi gliserol 3% dan 6% dengan maupun tanpa penambahan 70 mM xilosa.
Gliserol mempunyai sifat larut dalam lemak sehingga dapat menembus membran plasma masuk ke dalam sel, selama proses pembekuan gliserol akan berdifusi memasuki spermatozoa dan digunakan untuk aktivitas metabolisme oksidatif, menggantikan sebagian air bebas dan mendesak keluar elektrolit-elektrolit, menurunkan konsentrasi elektrolit intrasel serta mengurangi daya rusaknya terhadap spermatozoa dengan jalan memodifikasi kristal-kristal es yang terbentuk (Toelihere 1985). Gliserol dengan konsentrasi yang lebih tinggi memiliki daya protektif yang lebih tinggi selama proses pembekuan, namun berdasarkan hasil penelitian penambahan xilosa ke dalam pengencer Tris kuning telur dengan konsentrasi gliserol 3% mampu meningkatkan persentase motilitas
post thawing melebihi persentase dari pengencer Tris kuning telur dengan konsentrasi gliserol 6%.
Selain meningkatkan persentase spermatozoa motil post thawing, xilosa juga mampu meningkatkan persentase spermatozoa hidup post thawing, terlihat pada hasil pengamatan persentase spermatozoa hidup pengencer tris kuning telur dengan penambahan xilosa 70 mM (G6X70 dan G3X70) menunjukkan persentase spermatozoa hidup masing-masing 43.44% dan 41.60% lebih tinggi dibandingkan dengan pengencer tris kuning telur dengan xilosa 0 mM (G6Xo dan G3Xo) hasilnya masing-masing hanya sebesar 33.79% dan 33.08%.
Selain persentase spermatozoa motil dan hidup, kualitas semen beku juga dapat dinilai berdasarkan jumlah spermatozoa yang kembali pulih setelah proses pembekuan. Recovery Rate (RR) merupakan nilai kemampuan spermatozoa yang berhasil pulih kembali setelah pembekuan. Hasil penelitian menunjukkan nilai RR tertinggi terdapat pada pengencer tris kuning telur dengan gliserol 6% dan dengan penambahan xilosa 70 mM (G6X70) sebesar 46.71%, hasil ini berbeda nyata (nilai P<0.05) dengan ketiga pengencer lainnya. Pengencer tris kuning telur dengan gliserol 3% dan dengan penambahan xilosa 70 mM memiliki nilai RR terbesar kedua setelah pengencer Tris kuning telur dengan konsentrasi gliserol 6% dan dengan penambahan xilosa 70 mM, yaitu sebesar 36.2%, kemudian diikuti pengencer tris kuning telur dengan gliserol 6% dan xilosa 0 mM dengan RR 32.85%. Nilai RR terkecil pada pengencer tris kuning telur dengan konsentrasi gliserol 3% dan xilosa 0 mM yaitu hanya 25.07%.
Dengan demikian dapat disimpulkan bahwa pemakaian tris kuning kuning telur dengan konsentrasi gliserol 6% dan dengan penambahan xilosa 70 mM sebagai pengencer dalam pembekuan semen anjing Retriever dapat mempertahankan persentase spermatozoa motil dan spermatozoa hidup, serta memiliki nilai recovery rate terbaik dibandingkan ketiga pengencer lainnya. Serta penambahan xilosa 70 mM ke dalam pengencer Tris dengan konsentrasi gliserol yang rendah dapat bekerja sinergis serta mampu meningkatkan kemampuan protektifnya melebihi pengencer Tris kuning telur dengan konsentrasi gliserol yang lebih tinggi apabila digunakan sebagai agen krioprotektan tunggal dalam proses pembekuan semen anjing.
ditambahkan xilosa dengan konsentrasi sebesar 70 mM sebagai agen krioprotektan ekstraseluler. Komponen ini akan melindungi spermatozoa selama proses pembekuan dengan meminimalisasi pembentukan kristal es baik intra maupun ekstra seluler (Arifiantini 2004). Berdasarkan hasil penelitian, penggunaannya gliserol dengan konsentrasi 6% lebih baik dari konsentrasi 3% dalam mencegah penurunan motilitas post thawing. Hasil ini mendukung pernyataan Rota et al (1998) yang menyatakan bahwa dalam pembekuan spermatozoa anjing, penggunaan gliserol dengan konsentrasi sebesar 5% lebih baik daripada gliserol dengan konsentrasi 3%. Gliserol merupakan krioprotektan yang paling umum digunakan pada pembekuan semen mamalia. Selain Rota (1998), penelitian mengenai berbagai konsentrasi gliserol pada pembekuan semen anjing telah banyak dilaporkan, diantaranya oleh Prinosilova et al.(2005) menggunakan gliserol dengan konsentrasi 4, 6 dan 8%, Holst et al. (2000) menggunakan 7%, Silva et al (2005) dan Kim et al. (2007) menggunakan gliserol 6%. Peneliti lain melaporkan konsentrasi gliserol 8% lebih baik daripada 2, 4 dan 6% (Bateman 2001). Yildiz et al. (2000) menggunakan gliserol 8% untuk pembekuan semen anjing pada pengencer Tris. Hasil pengujian perbedaan konsentrasi gliserol oleh Rota et al. (1998) untuk pembekuan semen anjing, memberikan hasil terbaik pada kisaran 2% sampai dengan 8%. Pada konsentrasi kurang dari 2%, gliserol tidak memberikan efek protektif terhadap spermatozoa anjing selama proses pembekuan dan sebaliknya pada konsentrasi yang lebih tinggi dari 8% gliserol akan bersifat toksik terhadap spermatozoa.
Efek gliserol adalah mencegah pengumpulan molekul H2O dan mencegah kristalisasi es pada pada daerah titik beku larutan (Mazur 1980 diacu dalam Tambing 1999). Pencegahan kristalisasi es dilakukan dengan jalan mengubah bentuk dan ukuran es sehingga mengurangi tekanan mekanik dan menurunkan titik beku medium. Selain itu gliserol akan menurunkan konsentrasi natrium di dalam medium di luar sel sehingga kematian spermatozoa akibat solution effect
dapat dihindarkan. Solution effect ini akan timbul bila terjadi perubahan yang drastis dari larutan dalam sel yang dibekukan sebagai akibat terbentuknya kristal-kristal es di luar dan di dalam spermatozoa. Akibat pembekuan akan menyebabkan penurunan volume air dalam sel, perubahan air menjadi es dan adanya peningkatan konsentrasi larutan di dalam dan di luar sel spermatozoa. Penambahan gliserol ke dalam pengencer diharapkan dapat menghindarkan peningkatan konsentrasi elektrolit di atas level yang merugikan.
Penambahan xilosa ke dalam pengencer tris kuning telur yang mengandung gliserol 3% menghasilkan persentase spermatozoa motil dan hidup yang lebih tinggi daripada pengencer tris kuning telur dengan konsentrasi gliserol 6% tanpa penambahan xilosa. Penambahan xilosa ke dalam pengencer tris kuning telur dengan konsentrasi 3% dapat meningkatkan daya protektif gliserol 3% menjadi lebih besar dari daya protektif pengencer tris kuning telur dengan gliserol 6% tanpa penambahan xilosa selama proses pembekuan.
Penggunaan karbohidrat sebagai agen utama krioprotektan belum banyak digunakan maupun diteliti. Dalam penelitian ini dilakukan penambahan xilosa yang merupakan monosakarida pentosa sebagai sumber karbohidrat yang berbeda bagi pembekuan semen anjing dan terbukti mampu bekerja sinergis bersama-sama dengan gliserol dalam meminimalisasi efek negatif proses pembekuan semen. Selain harganya yang terjangkau, pemilihan xilosa sebagai agen krioprotektan dalam pembekuan semen anjing telah terbukti mampu meningkatkan motilitas spermatozoa post-thawing, hasil ini tidak berbeda nyata (Nilai P<0.05) dengan penggunaan fruktosa dan trehalosa pada penelitian yang sama (Yildiz et al. 2000). Kemampuan gula dalam melindungi sel spermatozoa tergantung dari suhu penyimpanan, bobot molekul gula dan tipe buffer yang digunakan. Molinia et al.
disakarida dalam mempertahankan motilitas spermatozoa domba yang dibekukan dengan menggunakan pengencer Tris asam sitrat. Garcia dan Graham (1989) dalam penelitiannya menemukan bahwa penggunaan trisakarida tidak seefektif mono- dan disakarida dalam mempertahankan motilitas post-thawing spermatozoa sapi. Tiga faktor utama penyebab kerusakan selama proses kriopreservasi antara lain adanya kerusakan mekanik akibat pembentukan kristal es, adanya dehidrasi dari suspensi baik intra maupun ekstraseluler dan adanya perubahan fisik kimiawi (Supriatna & Pasaribu 1992). Pada umumnya kerusakan membran plasma terjadi selama proses penanganan semen, baik selama pendinginan semen (20oC – 5oC) maupun selama proses penyimpanan (Paulenz et al. 2002).
Mekanisme bagaimana gula bekerja, dalam hal ini xilosa, dalam melindungi sel selama proses dehidrasi atau pembekuan, berkaitan dengan pengaruh gula dalam proses pembekuan yang mampu menstabilkan membran plasma maupun protein seluler (Eiman et al. 2003). Hasil pengamatan terhadap perlindungan gula bagi spermatozoa oleh Eiman et al. (2003) mengindikasikan bahwa kehadiran gula dapat mengubah membran yang mudah terkena dampak dari perubahan fisik dan morfologi yang terjadi cepat, yang terjadi selama proses pengeluaran air secara cepat dari dalam sel selama pembekuan. Eiman juga menambahkan gula dapat meningkatkan motilitas spermatozoa post-thawing, nilai recovery rate, ketahanan terhadap perubahan suhu dan integritas akrosom. Woelder et al. (1997) menyatakan bahwa gula memiliki efek protektif terhadap kerusakan spermatozoa yang terjadi selama proses pendinginan yang berlangsung cepat. Berdasarkan hasil penelitian terbukti bahwa xilosa bekerja secara sinergis dengan krioprotektan lain dalam melindungi spermatozoa selama proses pembekuan, terlihat dari persentase spermatozoa motil dan hidup serta nilai RR yang lebih tinggi pada pengencer Tris kuning telur dengan gliserol 3% dengan penambahan xilosa 70 mM dibandingkan dengan pengencer Tris kuning telur dengan gliserol 6% tanpa penambahan xilosa 70 mM.
KESIMPULAN DAN SARAN
Dari hasil penelitian dapat disimpulkan bahwa :
1. Pengencer Tris kuning telur dengan gliserol 6% dan xilosa 70 mM menunjukkan kualitas terbaik dan recovery rate tertinggi dalam proses pembekuan semen anjing Retriever bila dibandingkan dengan pengencer Tris kuning telur dengan gliserol 3% dan xilosa 70 mM maupun dengan pengencer Tris kuning telur dengan konsentrasi gliserol 3% dan 6% tanpa penambahan xilosa 70 mM.
2. Penambahan xilosa 70 mM ke dalam pengencer Tris kuning telur dalam konsentrasi gliserol yang rendah dapat meningkatkan daya protektifnya melebihi daya protektif pengencer dengan konsentrasi gliserol yang lebih tinggi namun tanpa penambahan xilosa 70 mM.
Saran yang dapat diberikan adalah :
1. Perlu dilakukan inseminasi buatan menggunakan pengencer terbaik dalam penelitian ini agar diketahui fertilitas yang sebenarnya.
DAFTAR PUSTAKA
Anonimus, 2008a.Retriever. http://en.wikipedia.org/wiki/Retriever [24 Januari 2008] Anonimus, 2008b. Golden Retriever.
http://en.wikipedia.org/wiki/Golden_retriever [24 Januari 2008] Anonimus, 2008c. Labrador Retriever.
http://en.wikipedia.org/wiki/Labrador_retriever [24 Januari 2008]
Anonimus. 2008d. http://www.anjingkita.com/wmview.php?ArtID=285 [24 Januari 2008]
Anonimus. 2008e. http://www.anjingkita.com/wmview.php?ArtID=240 [24 Januari 2008]
Allen WE. 1992. Fertility and Obstetrics in the Dog.London: Blackwell Scientific Publications.
Aboagla EM-E, Terada T. 2004. Effects of supplementation of trehalosa extender containing egg yolk with sodium dodecyl sulfate on the freezability of goat spermatozoa. Theriogenology 62: 809-818.
Arifiantini I. 2004. Preservasi dan Kriopreservasi Semen dalam Upaya Konservasi dan Breeding Up Kuda Lokal serta Mendukung Terciptanya Kuda Pacu Indonesia. Bogor: Institut Pertanian Bogor.
Bartlett DJ. 1962. Studies on Dog Semen I. Morphological Characteristics. J. Reprod. Fertile. 3: 173.
Bateman HL. 2001. Effects of Semen Extender Composition and Cooling Methods on Canine Sperm Function and Cryo-Survival [thesis]. Guelph: University of Guelph.
Cardoso RCS, Silva AR, Silva LDM. 2005. Use of the powdered coconut water (ACP-106®) for cryopreservation of canine spermatozoa. J. Anim. Reprod.
2(4): 257-262.
Cunliffe. 2002. The Encyclopedia of Dog Breeds.Dubai: Parragon Book.
Christiansen IJ. 1980. Reproduction in the Dog and Cat. London: Bailliere Tindall.
Dhami AJ, Sahni KL. 1993. Evaluation of Different Cooling Rates, Equilibration Periods and Diluent for Effect on Deep-Freezing, Enzyme Leakage and Fertility of Taurin Bul Spermatozoa. Theriogenology. 40: 1269-1280. Eiman ME, Aboagla, T. Terada. 2003. Trehalose-Enhanced Fluidity of the Goat
Sperm Membrane and Its Protection During Freezing. Biology of Reproduction, 69: 1245–1250.
Evans G, Maxwell WMC. 1987. Salamon’s Artificial Insemination of Sheep and Goats. London: Butterworths.
Evans HE, Christensen GC. 1993. Miller’s Anatomy of the Dog: Diagnosis, Treatment, and Prevention of Reproductive Diseases in Small and Large Animals.Philadelphia: W.B. Saunders.
Fahy GM. 1986. The Relevance of Cryoprotectant Toxicity to Cryobiology. Cryobiology, 23 : 1-13.
Farstad W. 1996. Semen cryopreservation in dogs and foxes. J Anim Reprod Sci
42: 251-260.
Feldman EC, Nelson RW. 1996. Canine and Feline Endocrinology and Reproduction. USA: W.B. Saunders Company.
Garcia MA, Graham EF. 1989. Development of a Buffer System for Dyalisis of Bovine Spermatozoa before Freezing. Theriogenology, 31:1029-1037. Garner DL, Hafez ESE. 2000. Spermatozoa and Seminal Plasma. Di dalam
Balado D, Gulliver K, Smith A, Williams PC, editor. Reproduction in Farm Animals. Ed ke-7. USA: Lippincot Williams and Wilkins.
Gunay U, Zekariya N, Kemal S. 2004. Effect of Glass Wool Filtration Method on Frozen-Thawed Dog Semen. Uludag Univ.J.fac.Vet.Med.
Gwo JC, Chen CW, Cheng HY. 2002. Semen Cryopreservation of Small Abalone (Haliotis Diversicolor Supertexa). Theriogenology. 57: 823-836.
Hafez ESE. 1993. Semen Evaluation. In: Hafez ESE (Ed). Reproduction in Farm Animals. 6th Ed. Philadelphia: Lea and Febiger.
Hafez ESE, Jainudeen MR, Rosnina Y. 2000. Hormones, growth factors, and reproduction. Di dalam Balado D, Gulliver K, Smith A, Williams PC, editor. Reproduction in Farm Animals. Ed ke-7. USA: Lippincot Williams and Wilkins.
Hammerstedt R.H., Graham J.K., Nolan J.P. 1990. Cryopreservation of mammalian sperm: what we ask them to survive. J Androl (11) : 73-88 Held JP, Prater PE. 1997. Handbook of Small Animal Practice. Philadelphia:
W.B. Saunders Company.
Hewitt D. 1997. Manual of Small Animal Reproduction and Neonatology.British: British Small Animal Veterinary Association.
Holst B. S, Larsson B.,Linde-Forsberg C., Rodriguez-Martinez H. 2000. Evaluation of chilled and frozen–thawed canine spermatozoa using a zona pellucida binding assay. J. Reproduction and Fertility 119: 201–206. Johnston SD, Larsen RE, Olsen PS. 1982. Canine Theriogenology. Hasting,
Nebraska: Society for Theriogenology.
Junaidi A. 2006. Reproduksi dan Obstetri pada Anjing. Yogyakarta: UGM press. Kibble RM. 1969. Artificial Insemination in Dogs. Aust. Vet. J. 45:194.
Kim H.J, Oh H.J, Jang G, Kim M.K. 2007. Birth of puppies after intrauterine and intratubal nsemination with frozen-thawed canine semen. J. Vet. Sci. 8(1) : 75–80.
Laing JA. 1979. Fertility and Infertility in Domestic Animals. 3rd Ed. Court auld Professor of Animal Husbandry and Hygiene. London : Royal Veterinary College.
Maxwell WMC, Watson PF. 1996. Recent Progress in the Preservation of Ram Semen. J Anim Reprod Sci 42: 55-65.
Molinia FC, Evans G, Maxwell WMC. 1994. In Vitro Evaluation of Zwitterion Buffers in Diluents for Freezing Ram Spermatozoa. Reprod Nutr Dev; 34:491-500.
Natasaputra I. 2002. Golden Retriever.Jakarta: Penebar Swadaya.
Oettle EE. 1993. Sperm Morphology and Fertility in the Dog. Journals of Reproduction & Fertility Suppl. 47 : 257.
Partodihardjo S. 1987. Ilmu Reproduksi Hewan. Jakarta: Mutiara Sumber Widya. Paulenz H, Soderquist L, Perez-Pe R, Berg KA. 2002. Effect of Different
Extenders and Stage Temperatures on Sperm Viability of Liquid Ram Semen. Theriogenology. 57: 823-836.
Pena AI, Barrio F, Quintela LA. Herradon PG. 1998. Effect of different glycerol treatments on frozen thawed dog spcrm longevity and acrosomal integriy.
Theriogenology. 50: 163- 173.
Pesch S, Hoffmann B. 2007. Cryopreservation of Spermatozoa in veterinary medicine. J. Reproduktionsmed. Endokrinol 4 (2): 101-105
Prinosilova P, Veznik Z, Zajikova A, Svecova D. 2005. Using the Sperm Quality Analyzer (SQA IIc) to evaluate dog ejaculates. J. Vet. Med.-Czech 50 (5): 195-204.
Rota A. 1998. Studies on Preservation, Capacitation, and Fertility of Dog Spermatozoa [tesis]. Uppsala: Department of Obstetric and Gynecology, Swedish University of Agricultural Sciences.
Rota A, Strom B, Linde-Forsberg C. 1995. Effects of Seminal Plasma and Three Extenders on Canine Semen Stored at 40C. Theriogenology 44: 885.
Salisbury GW, Vandemark NL. 1984. Fisiologi Reproduksi dan Inseminasi Buatan pada Sapi. Penerjemah : Djanuar R. Yogyakarta: Gadjah Mada University Press.