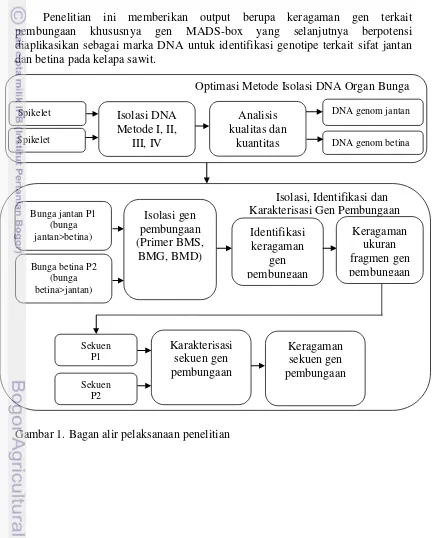
ISOLASI DAN KARAKTERISASI GEN PEMBUNGAAN PADA
KELAPA SAWIT (Elaeis guineensis Jacq.)
WINDA NAWFETRIAS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Isolasi dan Karakterisasi Gen Pembungaan Pada Kelapa Sawit (Elaeis guineensis Jaqc.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
WINDA NAWFETRIAS. Isolasi dan Karakterisasi Gen Pembungaan Pada Kelapa Sawit (Elaeis guineensis Jacq.). Dibimbing oleh SOBIR dan IRVAN FAIZAL.
Ukuran tandan yang direpresentasikan dengan jumlah buah menjadi parameter utama pada produksi kelapa sawit (Elaeis guineensis Jacq.). Jumlah buah dapat ditentukan pada fase awal perkembangan bunga yang dipengaruhi oleh berbagai faktor, termasuk properti genetik pohon. Jumlah buah yang tinggi diperoleh dari pohon yang mempunyai proporsi bunga betina lebih tinggi. Keberadaan gen MADS-box berperan penting pada penentuan identitas bunga jantan dan betina kelapa sawit. Gen SQUAMOSA (SQUA), gen GLOBOSA (GLO) dan gen DEFICIENS (DEF) termasuk dalam famili besar gen MADS-box yang berperan terhadap perkembangan sepal, petal dan stamen. Tujuan penelitian ini adalah menganalisis metode isolasi, mengidentifikasi dan mengkarakterisasi gen yang terkait dengan pembungaan dari kelapa sawit menggunakan teknik PCR. DNA genom bunga jantan dan betina yang diisolasi menggunakan metode CTAB+PVP menghasilkan kuantitas dan kualitas DNA paling baik dibandingkan metode isolasi lainnya. Isolasi DNA genom dari bunga betina lebih efesien dibandingkan dari bunga jantan.
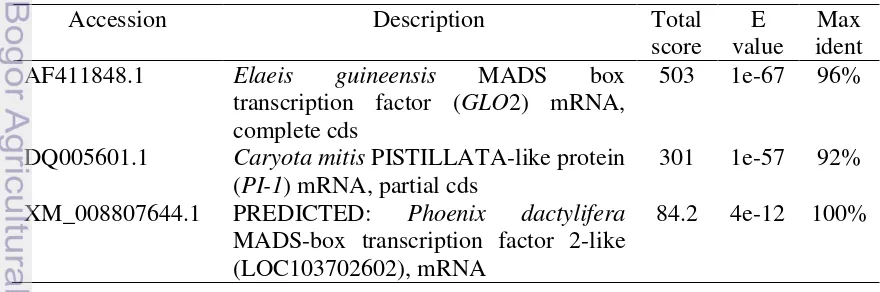
DNA genom bunga jantan dari pohon yang mempunyai bunga jantan lebih banyak (P1) dan DNA genom bunga betina dari pohon yang mempunyai bunga betina lebih banyak (P2) diidentifikasi menggunakan tiga primer; BMS, BMG dan BMD. Primer BMS, BMG dan BMD masing-masing menghasilkan produk PCR berukuran 1200 pb; 1200 pb dan 1300 pb; 1200 pb dan 1300 pb pada DNA P1 dan P2. Analisis BLASTn menunjukkan bahwa produk PCR mempunyai homologi yang tinggi dengan gen SQUA1, gen GLO2, DNA repetitive dan pentatricopeptide repeat-containing protein dari kelapa sawit.
Analisis posisi ekson dan intron menunjukkan fragmen DNA P1 dan P2 teramplifikasi primer BMS mempunyai dua ekson (ekson 1 dan 2) dan sekuen diantaranya adalah intron. Sekuen fragmen DNA P1 dan P2 teramplifikasi primer BMG mempunyai empat ekson (ekson 1, 2, 3 dan 4) dan sekuen diantaranya adalah intron. Analisis alignment menggunakan APE menunjukkan sekuen fragmen DNA P1 dan P2 yang teramplifikasi primer BMS mempunyai keragaman sekuen pada ekson 1 dan intron. Perbedaan satu nukleotida pada bagian ekson menghasilkan translasi asam amino yang berbeda. Fragmen DNA P1 dan P2 teramplifikasi primer BMG mempunyai keragaman ukuran fragmen dan keragaman sekuen intron. Fragmen DNA terkait pentatricopetide-repeat containing protein hanya terdapat pada P2.
SUMMARY
WINDA NAWFETRIAS. Isolation and Characterize of Oil Palm (Elaeis guineensis Jacq.) Flowering Genes. Supervised by SOBIR and IRVAN FAIZAL.
The bunch size that representated by fruit number is the main parameters for oil palm (Elaeis guinensis Jacq.) yield. The fruit number can be determined in the initial phase of the flower development that related to various factors, include genetic properties of the trees. Higher fruits numbers are obtained by the trees that have higher portion of female flowers. The existence of MADS-box genes were plays important role in determining the identity of females and males oil palm flowering. SQUAMOSA (SQUA) genes, GLOBOSA (GLO) genes and DEFICIENS (DEF) genes belong to large family of MADS-box gene that plays role to development of sepals, petals and stamen. The aims of this research are analyze isolated methode, identify and characterize genes associated with oil palm flowering using PCR technique.
Genomic DNA from male and female flowers that was isolated using CTAB+PVP method produce higher quantity and quality of DNA than other isolation method. The genomic DNA was isolated using CTAB+PVP in which the isolation of female flower genomic DNA was more efficient than the male flower.
The genomic DNA of male flowers of a tree which have more male flowers (P1) and genomic DNA of female flowers of a tree which have more female flowers (P2) identified using three primers; BMS, BMG and BMD. The BMS primers gave the PCR product size 1200 bp for both genomic DNA of female and male flowers. The BMG and BMD primers gave the PCR product size of 1200 bp and 1300 bp for P1 and P2 respectively. BLASTn analysis showed that the PCR product of BMS, BMG and BMD primers have homology with SQUA1 gene, GLO2 gene, repetitive DNA and pentatricopeptide repeat containing protein from oil palm. SQUA1 gene and GLO2 gene that belongs to MADS-box genes have been isolated and characterized.
Exons and introns analysis showed that P1 and P2 of DNA fragment amplified by BMS primers have two exons (exon 1 and 2) and sequences between the exons are introns. The DNA fragment of P1 and P2 amplified by primer BMG have four exons (exon 1, 2, 3 and 4) and sequences between the exons are introns. Alignment analysis by APE showed that DNA fragment sequences of P1 and P2 amplified by BMS primers variety on exons 1 and introns. The variety of one nucleotide of exons results different amino acid translation. The DNA fragment of P1 and P2 amplified by BMG primers variety on fragment size and introns sequences. DNA fragment related pentatricopeptide-repeat containing protein only presence on P2.
© Hak Cipta Milik IPB, Tahun 2015 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
ISOLASI DAN KARAKTERISASI GEN PEMBUNGAAN PADA
KELAPA SAWIT (Elaeis guineensis Jacq.)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
WINDA NAWFETRIAS
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
PRAKATA
Segala puji bagi Allah SWT atas segala rahmat dan ridho-NYA sehingga tesis ini berhasil diselesaikan. Tesis ini mengulas tentang kelapa sawit dengan judul “Isolasi dan Karakterisasi Gen Pembungaan Kelapa Sawit (Elaeis guineensis
Jacq). Penelitian yang dilaksanakan merupakan bagian dari kegiatan “Kajian Deteksi Pembungaan Kelapa Sawit Untuk Prediksi Produksi Buah” Pusat
Teknologi Produksi Pertanian (PTPP), Badan Pengkajian dan Penerapan Teknologi (BPPT).
Terima kasih penulis sampaikan kepada Bapak Prof Dr Ir Sobir, MSi dan Bapak Dr Irvan Faizal, MEng selaku komisi pembimbing, atas bimbingan, arahan, kritik dan saran serta dukungan moril kepada penulis dalam melakukan penelitian ini. Ungkapan terima kasih penulis sampaikan juga kepada Dr Awang Maharijaya, SP, MSi selaku penguji luar atas koreksi dan masukannya demi perbaikan tesis ini. Penghargaan disampaikan kepada Direktur Pusat Teknologi Produksi Pertanian BPPT beserta jajarannya, LAPTIAB BPPT Serpong dan Laboratorium PTPP, BPPT Serpong atas izin dan dukungan yang diberikan untuk menggunakan fasilitas penelitian, sampai penelitian diselesaikan dengan baik serta kepada Pusdiklat BPPT yang telah mendanai studi penulis. Terima kasih penulis sampaikan kepada rekan kerja di PTPP-TAB-BPPT Serpong dan rekan-rekan PBT 2011/2012 atas bantuan, diskusi dan kerja samanya selama penulis melaksanakan penelitian.
Segenap rasa hormat dan bangga serta terima kasih penulis sampaikan kepada keluarga tercinta Bapak Dadiek Hardadi dan ibu Titiek MA, keluarga
Bapak Samuri Mu’in dan Ibu Zaonar, dan keluarga Bapak Supendi dan Ibu Ida Mulyanah yang senantiasa memberikan dorongan dengan doa yang tulus selama penulis menjalani studi. Ungkapan terima kasih dan sayang penulis sampaikan kepada suami tercinta Bino Hermansyah dan ananda tersayang Tyaga Aisyah Winona yang selalu sabar membantu meringankan beban, memberikan dorongan semangat dan doa tulus kepada penulis.
Penulis berharap semoga hasil penelitian ini dapat bermanfaat, dapat digunakan untuk kepentingan penelitian serta kemajuan ilmu pengetahuan dan menjadi amal ibadah bagi penulis di sisi Allah SWT.
DAFTAR ISI
DAFTAR ISI VI DAFTAR TABEL VII
DAFTAR GAMBAR VII
DAFTAR LAMPIRAN IX
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 4
Kelapa Sawit 4
Gen MADS-box dan Pembungaan 6
Bioinformatika 8
Marker-assisted Selection 8
3 OPTIMASI METODE ISOLASI DNA ORGAN BUNGA KELAPA
SAWIT 10
ABSTRAK 10
ABSTRACT 10
PENDAHULUAN 11
BAHAN DAN METODE 12
Tempat dan Waktu Penelitian 12
Bahan Tanaman 12
Isolasi DNA 13
Analisis Kualitas dan Kuantitas DNA 13
HASIL DAN PEMBAHASAN 14
Fenotipe bunga jantan dan betina kelapa sawit 14
Optimasi Metode Isolasi DNA 14
KESIMPULAN 19
4 ISOLASI, IDENTIFIKASI DAN KARAKTERISASI GEN
PEMBUNGAAN PADA ORGAN BUNGA KELAPA SAWIT 20
ABSTRAK 20
ABSTRACT 20
PENDAHULUAN 21
BAHAN DAN METODE 22
Tempat dan Waktu Penelitian 22
Isolasi DNA 23
Isolasi Gen Pembungaan dari Organ Bunga Jantan dan Betina Kelapa
Sawit 24
Identifikasi Keragaman Gen Pembungaan Kelapa Sawit 27
Karakterisasi Gen Pembungaan Kelapa Sawit 29
KESIMPULAN 40
5 PEMBAHASAN UMUM 41
6 KESIMPULAN UMUM 45
DAFTAR PUSTAKA 45
DAFTAR TABEL
1. Kuantifikasi DNA bunga jantan dan betina pada kelapa sawit menggunakan
NanoDrop 18
9. Hasil BLASTp asam amino hasil translasi fragmen DNA P1 teramplifikasi primer BMS 35
10.Hasil BLASTp asam amino hasil translasi DNA fragmen P2 teramplifikasi primer BMS 36
11.Hasil BLASTp asam amino hasil translasi DNA fragmen P1 teramplifikasi primer BMG 36
12.Hasil BLASTp asam amino hasil translasi DNA fragmen P2 teramplifikasi primer BMG 37
DAFTAR GAMBAR
1. Bagan alir pelaksanaan penelitian 32. Bunga betina (A), bunga jantan (B), spikelet betina (C), spikelet jantan (D) pada kelapa sawit 5
ulangan 3 (J3) dan bunga betina kelapa sawit ulangan 1 (B1), ulangan 2 (B2), ulangan 3 (B3) dengan metode SDS, CTAB,
CTAB+PVP dan Kit. M : Marka 1 kb DNA ladder 17 5. Hasil PCR gradien primer BMS pada DNA genom P1 pada suhu annealing
59.4 oC (1), 60.2 oC (2), 61.1 oC (3), 62.1 oC (4) dan P2
pada suhu annealing 59.4 oC (5), 60.2 oC (6), 61.1 oC (7), 62.1 oC (8).
M : Marka 1 kb DNA ladder 25 6. Hasil PCR gradien primer BMG pada DNA P1 pada
suhu annealing 57.4 oC (1), 58.4 oC (2), 61 oC (3), 62.2 oC (4) dan P2 pada suhu annealing 57.4 oC (5), 58.4 oC (6), 61 oC (7),
62.2 oC (8). M : Marka 1 kb DNA ladder 26 7. Hasil PCR gradient primer BMD pada DNA P1 pada suhu annealing
55.1 oC (1), 56.4 oC (2), 58 oC (3), 59.6 oC (4), 61.8 oC (5), dan P2 pada suhu annealing 55.1 oC (6), 56.4 oC (7), 58 oC (8), 59.6 oC (9)
61.8 oC (10). M : Marka 1 kb DNA ladder 26 8. Hasil purifikasi fragmen DNA P1 (1) dan P2 (2) teramplifikasi
primer BMD 27 9. Isolasi gen pembungaan ulangan 1 pada DNA P1 ulangan 1 (P11),
ulangan 2 (P12), ulangan 3 (P13) dan P2 ulangan 1 (P21), ulangan 2 (P22), ulangan 3 (P23) menggunakan
primer BMS, BMG dan BMD. M : Marka 1 kb DNA ladder 28 10.Isolasi gen pembungaan ulangan 2 pada DNA P1 ulangan 1 (P11),
ulangan 2 (P12), ulangan 3 (P13) dan P2 ulangan 1 (P21), ulangan 2 (P22), ulangan 3 (P23) menggunakan
primer BMS, BMG dan BMD.
M : Marka 1 kb DNA ladder 28 11.Analisis homologi fragmen DNA P1 (A) dan P2 (B) teramplifikasi
primer BMS dengan database GenBank 29 12.Analisis homologi fragmen DNA P1 (A) dan P2 (B)
teramplifikasi primer BMG dengan database GenBank 31 13.Analisis homologi fragmen DNA P1 (A) dan P2 (B) teramplifikasi
primer BMD dengan database GenBank 32 14.Analisis posisi ekson dan intron pada sekuen fragmen DNA P1 (bawah)
dan P2 (atas) teramplifikasi primer BMS menggunakan Softberry 34 15.Analisis posisi ekson dan intron pada sekuen fragmen DNA P1 (bawah)
dan P2 (atas) teramplifikasi primer BMG menggunakan Softberry 34 16.Analisis posisi ekson dan intron pada sekuen fragmen DNA P2
teramplifikasi primer BMD menggunakan Softberry 35 17.Analisis BLASTp fragmen DNA P1 (A) dan P2 (B) teramplifikasi
primer BMS 35 18.Analisis BLASTp fragmen DNA P1 (A) dan P2 (B) teramplifikasi
primer BMG 36 19.Alignment sekuen fragmen DNA P1 (bawah) dan P2 (atas)
teramplifikasi primer BMS 38 20.Alignment asam amino hasil translasi fragmen DNA P1 (bawah)
dan P2 (atas) teramplifikasi primer BMS 38 21.Alignment sekuen fragmen DNA P1 (bawah) dan P2 (atas)
22.Alignment asam amino hasil translasi fragmen DNA P1 (bawah)
dan P2 (atas) teramplifikasi primer BMG 40 23.Alignment sekuen fragmen DNA P1 (bawah) dan P2 (atas)
teramplifikasi primer BMD 40
DAFTAR LAMPIRAN
1. Pembuatan buffer ekstraksi 55 2. Sekuen Fragmen DNA P1 dan P2 teramplifikasi primer BMS, BMG
1
1
PENDAHULUAN
Latar Belakang
Kelapa sawit (Elaeis guineensis Jacq) merupakan tanaman penghasil minyak nabati terbesar kedua dan menyumbangkan sekitar seperempat pasokan minyak dunia (USDA 2014), yang termasuk dalam famili Arecaceae. Kelapa sawit mengandung asam lemak jenuh dan tak jenuh lebih lengkap dibandingkan dengan minyak nabati dari jagung dan kelapa (Dauqan et al. 2011). Indonesia merupakan negara penghasil minyak kelapa sawit terbesar di dunia dengan total produksi mencapai 31 juta ton pada pertengahan tahun 2013/2014. Produksi ini meningkat dari pertengahan tahun 2012/2013 yang hanya mencapai 28.5 juta ton. Pertumbuhan ini terutama disebabkan meningkatnya area pertanaman kelapa sawit 9.538 juta hektar dengan luas areal panen 7.221 juta hektar pada tahun 2012 menjadi 9.933 juta hektar pada tahun 2013 dengan luas areal panen 7.686 juta hektar. Negara lain penghasil kelapa sawit antara lain Malaysia (20 juta ton), Thailand (2.1 juta ton), Colombia (1 juta ton) dan Nigeria (0.93 juta ton) (USDA 2014).
Berkaitan dengan isu pelestarian lingkungan, saat ini peningkatan produksi kelapa sawit diarahkan tanpa melalui perluasan area tanam. Pengembangan industri kelapa sawit memerlukan beberapa upaya untuk mencapai tujuan peningkatan produktivitas nasional, salah satunya adalah pemanfaatan benih unggul bermutu yang didukung dengan ketersediaan sumber daya genetik (plasma nutfah) yang mempunyai tingkat keragaman genetik yang tinggi (Direktorat Jenderal Perkebunan 2010). Informasi morfologi dan genetik sangat bermanfaat untuk memberi kelengkapan informasi tanaman dan mampu mencerminkan potensi setiap individu (Asmono 1998).
Kualitas dan kuantitas buah menjadi parameter utama dalam menentukan produksi tanaman kelapa sawit. Secara umum parameter ini dapat ditentukan sejak awal fase pembungaan, sehingga penelitian untuk meningkatkan kualitas dan kuantitas produksi seharusnya dilakukan juga pada bunga sebagai tahap awal pembentukan buah. Pembungaan merupakan proses yang fundamental pada perkembangan tanaman. Pembungaan tanaman merupakan kejadian fisiologis kompleks yang secara morfologi ditandai adanya perubahan dari fase vegetatif menuju terbentuknya organ-organ bunga.
Kelapa sawit merupakan tanaman monoecious yang memproduksi bunga uniseksual dengan siklus munculnya organ bunga jantan dan betina dalam suatu pola tertentu yang sampai saat ini belum dapat diprediksi. Fertilisasi antara bunga jantan dan betina akan menghasilkan buah yang mengandung minyak. Secara umum satu pokok kelapa sawit lebih diharapkan mempunyai banyak bunga betina normal karena akan menghasilkan buah sawit, namun keberadaan bunga jantan tetap diperlukan untuk menyerbuki bunga betina. Pola pembungaan yang khas ini mempengaruhi prediksi produksi kelapa sawit. Untuk mengatasi masalah pembungaan pada kelapa sawit tersebut, perlu dilakukan penelitian berbasis molekuler, studi lapang, dan mekanisme biokimia mengenai pembungaan.
2
asimilasi karbon), faktor hormon (hormon NAA, Giberelin) dan faktor genetik. Faktor abiotik, faktor metabolik dan faktor hormon sangat dipengaruhi oleh lingkungan dibandingkan faktor genetik, oleh karena itu penelitian mengenai sifat jantan dan betina berbasis molekuler diharapkan bisa menghasilkan data yang lebih tepat dan akurat. Faktor genetik yang mempengaruhi pembungaan adalah adanya gen-gen yang mengatur pembungaan termasuk adanya gen-gen yang mengatur pembentukan organ bunga jantan dan betina. Gen-gen yang berperan dalam pertumbuhan dan perkembangan bunga termasuk dalam famili besar gen MADS-box. Gen MADS-box menyandikan faktor transkripsi yang berfungsi mengontrol pertumbuhan dan perkembangan, termasuk pembentukan meristem bunga dan organ bunga pada tanaman (Adam et al. 2011).
Keragaman gen MADS-box berpotensi diaplikasikan sebagai marka untuk mengidentifikasi genotipe terkait sifat jantan dan betina. Hal ini sesuai dengan pendapat Lande dan Thompson (1990) bahwa genetika molekuler dapat diintegrasikan dengan metode seleksi konvensional dalam rangka mengidentifikasi fenotipe tertentu dengan mengaplikasikan marker-assisted selection (MAS). Efesiensi seleksi dapat meningkat dengan penggunaan MAS. MAS merupakan marka (dapat berupa keragaman morfologi, biokimia atau runutan nukleotida DNA/RNA) yang digunakan untuk seleksi tidak langsung untuk menentukan genetik suatu genotipe atau untuk menduga karakter harapan seperti produksi, ketahanan penyakit, toleransi terhadap cekaman abiotik atau kualitas hasil.
Fokus penelitian ini adalah isolasi dan karakterisasi gen yang berperan pada pembungaan, serta mengidentifikasi keragaman gen terkait pembungaan. Keragaman gen pembungaan khususnya gen MADS-box diharapkan dapat diaplikasikan sebagai MAS untuk mengidentifikasi sifat terkait jantan dan betina, yang selanjutnya dapat memprediksi produksi kelapa sawit. Penelitian mengenai gen yang berperan pada pengaturan pembungaan pada tanaman telah dilakukan pada Seline latifolia (Hardenack et al. 1994), Pinus radiata (Mouradov et al. 1998), Eucalyptus grandis(KatodanHibino 2009) dan Theobroma cacao(Samanhudi 2006). Penelitian mengenai gen-gen yang berperan dalam pembungaan kelapa sawit telah dilakukan oleh Lee at al. (2009) dan Adam et al. (2007).
Tujuan Penelitian
Penelitian ini bertujuan untuk (1) menganalisis metode isolasi DNA yang efektif dari organ bunga kelapa sawit, (2) mengidentifikasi keragaman gen terkait pembungaan pada kelapa sawit, (3) mengkarakterisasi gen terkait pembungaan pada kelapa sawit.
Manfaat Penelitian
4
2
TINJAUAN PUSTAKA
Kelapa Sawit
Kelapa sawit merupakan tanaman asli Afrika Barat yang selanjutnya menyebar ke Amerika Selatan dan sampai ke semenanjung Indo-Malaysia. Kelapa sawit pertama kali diintroduksi oleh pemerintah kolonial Belanda pada tahun 1848, tepatnya di kebun raya Bogor. Tanaman kelapa sawit mulai dikenal di Indonesia dan dibudidayakan secara komersil dalam bentuk perusahaan perkebunan pada tahun 1911. Pada mulanya hanya berkembang di Sumatera Utara dan Riau yang kemudian berkembang di seluruh Indonesia (Hartley 1977).
Kelapa sawit memiliki genom diploid dengan 16 pasang kromosom homolog (2n = 32) dan merupakan tanaman menyerbuk silang sehingga di alam akan dihasilkan keturunan yang heterozigot heterogen (Madon dan Clyde 1995). Kelapa sawit termasuk dalam Divisio : Embryophyta Siphonagama, Kelas : Angiospermae, Ordo : Monocotyledonae, Famili : Arecaceae (dahulu disebut Palmae), Sub famili : Cocoideae, Genus : Elaeis dan Spesies : Elaeis guineensis Jacq. (Pahan 2012). Untuk membedakan varietas kelapa sawit, terdapat dua kriteria yang digunakan yaitu berdasar tebal tipisnya cangkang (endocarp) dan warna buah. Berdasar tebal tipis cangkang, kelapa sawit digolongkan menjadi 3 varietas yaitu : Dura, Pisifera dan Tenera. Sedangkan berdasarkan warna buah, kelapa sawit dibagi menjadi 3 varietas yaitu : Nigrescens, Virescens dan Albescens (Lubis 1992).
Kelapa sawit termasuk tanaman berumah satu (monoecious) yang berarti bunga jantan (staminate) dan betina (pistillate) tidak berada dalam satu bunga tetapi masih dihasilkan dari satu pohon yang sama. Walaupun demikian, kadang-kadang dijumpai juga bunga jantan dan betina pada satu tandan (hermafodit). Kelapa sawit disebut sebagai dioceous temporal karena meskipun bunga jantan dan bunga betina tumbuh pada satu pohon yang sama, tetapi waktu pematangannya berbeda sehingga memungkinkan terjadinya penyerbukan silang (Adam et al 2011). Dioceous temporal diartikan sebagai urutan pembungaan yang tersinkronisasi sehingga kecil kemungkinan atau bahkan tidak terjadi fase bunga jantan dan betina matang dalam waktu bersamaan pada satu tanaman yang sama. Dioceous temporal dapat terjadi dengan penundaan kematangan salah satu carpel (pada kasus bunga protandrous) atau stamen (pada kasus bunga protogynous), kedua kondisi ini disebut sebagai dichogamy (Cruden dan Hermann-Parker 1997).
Bunga kelapa sawit merupakan bunga majemuk yang terdiri atas kumpulan spikelet dan tersusun dalam pembungaan yang berbentuk spiral. Bunga jantan dan betina mempunyai ibu tangkai bunga (peduncle/rachis) yang merupakan struktur pendukung spikelet. Bunga jantan dan betina dibedakan berdasarkan morfologi spikelet (Pahan 2012). Penampakan makroskopi bunga jantan dan betina normal terlihat seperti Gambar 2.
Gambar 2. Bunga betina (A), bunga jantan (B), spikelet betina (C), spikelet jantan (D) pada kelapa sawit
Seludang bagian dalam dan bagian luar pada tandan bunga betina menutupi pembungaan secara kuat hingga kira-kira enam minggu sebelum antesis. Dua atau tiga minggu selanjutnya seludang bagian dalam pecah, kemudian kedua seludang menjuntai dan hancur, serta bunga terdorong keluar (Hartley 1977). Tandan bunga betina kelapa sawit merupakan gabungan tongkol (spadix) pada tangkai bunga yang kuat dengan panjang 30 - 45 cm. Spikelet tersusun secara spiral mengelilingi sumbu bunga. Satu tandan bunga memiliki 100 – 200 spikelet dan tiap spikelet memiliki 15 – 20 bunga. Bunga betina tidak serentak antesis, pada satu tandan umumnya membutuhkan waktu 3 – 5 hari atau lebih (Lubis 1992).
Tandan bunga jantan juga dibungkus oleh seludang bunga, yang pecah jika antesis. Bunga jantan tidak bertangkai tersusun pada rachis dari suatu spikelet. Spikelet berbentuk silinder seperti tongkol. Ukuran spikelet antara 10 – 20 cm. spikelet terdiri atas 700 – 1200 bunga jantan. Sebelum mekar, bunga secara sempurna terbungkus dalam bract triangular yang terdiri atas enam segmen perhiasan kecil, suatu tabula androesium dengan enam atau tujuh kepala sari, serta gimnoesium rudimenter yang berhubungan dengan stigma tiga cuping (trilobe stigma). Bunga jantan mulai mekar dari dasar spikelet (Hartley 1977).
A
C
B
6
Gen MADS-box dan Pembungaan
Gen MADS-box merupakan super famili gen yang ditemukan pada fungi, tanaman dan hewan yang mengkodekan faktor transkripsi dengan domain conserve sangat tinggi yang disebut MADS-box atau domain MADS. Akronim “MADS” didapatkan dari empat anggota famili yang ditemukan pertama kali dari anggota famili ini, antara lain Minichromosome maintenance 1 (MCM1; dari yeast), AGAMOUS (AG; dari Arabidopsis thaliana), DEFICIENS (DEF; dari Antirrhinum majus), dan Serum response factor (SRF; dari manusia) (Schwarz-Sommer et al. 1990; Shore dan Sharrocks 1995). Domain MADS tersusun atas 56-58 asam amino yang terlibat dalam pengikatan DNA dan dimerisasi pada faktor transkripsi (Krizek dan Meyerowitz 1996; Davies et al. 1999).
Protein MADS-box pada tanaman mempunyai struktur sekunder yang sama dengan domain DNA-binding. Region MADS-box (M) berada di protein N-terminal. Region MADS-box diikuti dengan region Intervening (I) dan K-box (K), kedua region ini berperan pada interaksi antar protein, dan C-terminus (C), region ini menunjukkan perbedaan sekuen yang cukup tinggi antar anggota gen MADS-box (Ma et al. 1991; Theissen et al. 2000). Hal ini sesuai dengan penelitian Schwarz-Sommer et al. (1992) struktur unit transkripsi SQUAMOSA mirip dengan gen MADS-box lain yang telah diketahui. Misalnya enam ekson pertama gen SQUAMOSA mempunyai ukuran yang sama dengan enam ekson pertama gen DEFICIENS dan gen GLOBOSA.
Penentuan identitas organ pembungaan secara molekuler dapat dipelajari menggunakan model ABCDE (Coen dan Meyerowitz 1991; Colombo et al. 1995; Pelaz et al. 2000; Honma dan Goto 2001). Gen kelas A, B, C, D dan E dikelompokan berdasarkan kesamaan sekuen, yaitu gen SQUAMOSA (kelas A), DEFICIENS (kelas B), GLOBOSA (kelas B), AGAMOUS (kelas C dan D) dan AGL2-like (kelas E) (Becker dan Theissen 2003). Model ini dapat bervariasi dari skema dasar sesuai dengan kelompok tanaman yang spesifik (Theissen et al. 2000).
Berdasarkan model umum ABCDE ekspresi gen kelas A menentukan pembentukan sepal pada kaliks. Aktivitas kombinasi gen kelas A, B dan E menentukan pembentukan petal pada corolla. Ekspresi gen kelas B, C dan E menentukan pembentukan stamen pada androecium sedangkan aktivitas gen C dan E menentukan pembentukan carpel pada gynoecium. Gen kelas C, D dan E menentukan identitas ovule (Purugganan et al. 1995; Theissen et al. 1996, 2000; Alvarez-Buylla et al. 2000; Lamb dan Irish 2003). Konsep model pembungaan ABCDE telah diaplikasikan pada sebagian besar spesies dikotil (Pnueli et al. 1994; Kater et al. 1998, 2001; Berbel et al. 2001; Immink et al. 2003). Konsep model pembungaan ABCDE banyak teridentifikasi pula pada spesies monokotil (Mena et al. 1995; Ambrose et al. 2000; Jeon et al. 2000; Fornara et al. 2003; Xiao et al. 2003).
merupakan gen identitas pembungaan pada A. majus, sedangkan gen SQUA merupakan gen identitas meristem (Schwarz-Sommer et al. 1990).
Aktivitas transkripsional gen SQUA level rendah terdeteksi pada cabang dan daun tepat sebelum pembungaan. Transkripsi gen SQUA tertinggi terlihat pada meristem lateral pembungaan sesaat setelah meristem terbentuk di axil pada cabang. Aktivitas transkripsional gen SQUA terdeteksi sampai akhir morfogenesis bunga kecuali pada diferensiasi stamen. Gen SQUA menarik untuk diteliti karena gen ini berperan sebagai kontrol genetik pembungaan (Peter et al.1992). Pada Arabidopsis thaliana, terdapat tiga gen yang termasuk dalam subfamili SQUA berperan dalam penentuan pembentukan pembungaan yaitu AP1, FUL dan CAL (Ferrandiz et al. 2000). Ekspresi spesifik pada EgSQUA1 pada pembungaan dan meristem pembungaan merupakan pola yang umum terobservasi pada hampir semua anggota subfamili SQUA pada gen MADS box (Huijser et al. 1992; Mandel et al. 1992; Mena et al. 1995; Moon et al. 1999; Kyozuka et al. 2000).
Gen GLO dan DEF mempunyai fungsi yang hampir sama pada morfogenesis pembungaan (Trobner et al. 1992). Gen MADS-box kelas B terbagi menjadi dua kluster yang berhubungan yaitu gen DEF dan GLO (Egea-Cortines et al. 1999). Pada eudicotil tingkat rendah dan angiospermae, gen DEF dan GLO secara berkelanjutan terekspresi selama perkembangan stamen tetapi ekspresi gen ini bervariasi pada petal (Kramer dan Irish 1999, Kramer dan Irish 2000). Ekspresi gen kelas B (GLO) pada A. majus menunjukkan pola ekspresi yang berbeda pada tahap perkembangan akhir alat kelamin jantan dan betina. Ekspresi gen GLO berkurang dan menghilang pada tahap determinasi seksual pada bunga betina; namun ekspresi gen GLO tetap terlihat pada tahap ini pada bunga jantan. Hasil ini menunjukkan kemungkinan ekspresi gen GLO mempengaruhi degenerasi stamen pada bunga betina (Park et al. 2004).
Penelitian filogenetik menunjukkan bahwa gen AP3 pada Arabidopsis thaliana merupakan ortolog gen DEF pada A. majus dan PI pada A. thaliana merupakan ortolog GLO pada A. majus. Gen DEF dan AP3 merupakan paralog dari GLO dan PI. Gen AP3, DEF, GLO dan PI merupakan gen MADS-box dengan fungsi kritis pada spesifikasi organ bunga dan perkembangan bunga (Doyle 1994; Goto dan Meyerowits 1994; Jack et al. 1992; Purungganan et al. 1995). Gen GLO dan DEF pada A. majus diketahui bahwa gen ini mempunyai sekuen protein conserve dan pola ekspresi yang relatif sama (Jack et al. 1992).
Ekspresi EgDEF1 terekspresi pada lingkaran dalam dan stamen/staminodes pada bunga jantan atau betina, yang mengindikasikan adanya perbedaan identitas moleluker untuk organ pada lingkaran pertama dibandingkan lingkaran kedua, meskipun pada kelapa sawit fenotipnya tampak sama (Dransfield dan Uhl 1998). EgDEF1 terlibat pada deteminasi petal, insiasi stamen/staminode dan perkembangan stamen fungsional, sedangkan EgGLO2 berperan pada determinasi stamen dan petal (Adam et al. 2011).
8
Bioinformatika
Bioinformatika adalah konseptualisasi biologi molekul dan aplikasi teknik informatika (yang berasal dari berbagai ilmu seperti matematika terapan, ilmu komputer dan statistik untuk mengetahui dan mengelompokan informasi yang terkait dengan molekul yang dianalisis pada skala yang luas. Bioinformatika merupakan seni dan ilmu pengetahuan yang fokus pada penggunaan komputer untuk area penelitian biologi seperti genomik, transkriptomik, proteomik, genetik dan evolusi (Goodman 2002).
BLAST (Basic Local Alignment Search Tool) merupakan alat cepat pembanding sekuen dengan mengkonstruksi alignment untuk mengoptimasi kemiripan antara sekuen nukleotida dan protein dengan database sekuen di GenBank. Program ini dirancang untuk mengeksplorasi semua database sekuen yang diminta baik berupa nukleotida maupun protein. Program BLAST juga dapat digunakan untuk mendeteksi hubungan antar sekuen yang hanya mempunyai kesamaan pada region tertentu. BLASTn digunakan untuk menbandingkan sekuen nukleotida dengan sekuen nukleotida lain yang ada dalam database. BLASTp digunakan untuk membandingkan sekuen protein dengan protein dalam database. (Altschul et al. 1990).
Alignment sekuen merupakan salah satu cara untuk mensejajarkan sekuen DNA, RNA atau protein untuk mengidentifikasi region yang memiliki kemiripan yang diduga mempunyai kesamaan hubungan fungsi, struktur atau evolusi antar sekuen. Alignment multiple sekuen merupakan lanjutan dari alignment berpasangan untuk membandingkan lebih dari dua sekuen pada saat yang sama. Multiple alignment sering digunakan pada identifikasi region sekuen yang conserved antar kelompok sekuen (Mount, 2004).
Marker-assisted Selection
10
3
OPTIMASI METODE ISOLASI DNA ORGAN BUNGA
KELAPA SAWIT
ABSTRAK
Salah satu peningkatan produksi kelapa sawit saat ini diarahkan pada aplikasi molekuler berbasis DNA. Marka DNA dapat digunakan untuk mengidentifikasi suatu karakter pada tanaman dalam rangka mempermudah seleksi. Kemurnian DNA yang tinggi merupakan syarat utama dalam proses PCR dan analisis PCR. Organ bunga jantan dan betina pada kelapa sawit mempunyai senyawa polisakarida dan polifenolik yang tinggi sehingga dapat mendegradasi DNA. Tujuan penelitian ini adalah untuk mengetahui metode isolasi DNA genom yang optimal dari organ bunga jantan dan bunga betina kelapa sawit. Metode SDS, metode CTAB dan metode CTAB+PVP menghasilkan DNA genom dengan kualitas yang cukup baik. Metode CTAB+PVP menghasilkan kemurnian dan konsentrasi DNA genom paling tinggi dibandingkan dengan metode SDS dan CTAB. Isolasi DNA genom dari bunga betina lebih efektif dibandingkan dengan bunga jantan, hal ini disebabkan bunga jantan lebih banyak mengandung polisakarida.
Kata kunci : kelapa sawit, isolasi DNA, bunga jantan dan betina, CTAB, PVP
ABSTRACT
At this time one of the increased oil palm production directed on the application on the molecular application based on DNA. DNA markers can be used to identify a character in plants as an effort to ease selection. The high DNA purity is the main requirement in PCR process and analysis. Males and females oil palm flowers have high polyphenolic and polysaccharides compound that can be degrades DNA. The aim of this research is to know an optimal method of genomic DNA isolation from males and females oil palm flowers. SDS method, CTAB method, and CTAB+PVP method produce high quality of genomic DNA. CTAB+PVP method produce higher purity and concentration of genomic DNA than SDS method and CTAB method. The isolation of genomic DNA from females flowers more effective than male flowers, because the males flowers cointing higher polysaccharides.
PENDAHULUAN
Kelapa sawit (Elaeis guineensis Jacq.) merupakan salah satu tanaman penghasil minyak yang mempunyai nilai ekonomi tinggi dan telah banyak dibudidayakan di daerah tropis, oleh karena itu upaya peningkatan produksi kelapa sawit terus dilakukan. Saat ini pemuliaan kelapa sawit diarahkan pada aplikasi molekuler untuk meningkatkan produksi kelapa sawit. Perkembangan metode biologi molekuler berbasis DNA melibatkan isolasi DNA dan teknik Polymerase Chain Reaction (PCR).
Isolasi DNA menjadi sangat bermanfaat dan merupakan alternatif untuk penelitian mengenai karakter suatu tanaman di tingkat genomik. Pemanfaatan DNA sebagai materi genetik telah banyak diaplikasikan untuk mengetahui keragaman suatu karakter tertentu pada kelapa sawit pada tingkat genomik (Treagear et al. 2002; Hetharie 2007; Budiani 2010; Jaligot et al. 2014). Pada proses perkembangan genetika, sangat memungkinkan untuk menggunakan marka molekuler untuk menyeleksi aksesi, memilih tetua dan seleksi progeni. Berbagai analisis molekuler memerlukan kemurnian DNA yang tinggi sebagai syarat utama. Oleh karena itu, metode isolasi yang tepat sangat diperlukan untuk mendapatkan DNA yang berkualitas.
Teknik molekuler bervariasi dalam cara pelaksanaan untuk mendapatkan data, baik teknik maupun target data yang diinginkan sesuai kemudahan pelaksanaan, ketersediaan sumber daya manusia, fasilitas dan dana (Karp et al. 1997). Ekstraksi untuk mendapatkan DNA berkualitas tinggi merupakan satu kaidah dasar yang harus dipenuhi dalam studi molekuler. Metode isolasi DNA menggunakan buffer Cetyl Trimethyl Ammonium Bromide (CTAB) dan Sodium Dodecyl Sulfate (SDS) merupakan metode yang umum digunakan dalam isolasi DNA genom tanaman yang banyak mengandung polisakarida dan senyawa polifenol (Lumaret et al. 1998; Jose dan Usha 2000; Ribeiro et al. 2007). Polyvinyl pyrrolidone (PVP) sering digunakan untuk mengurangi senyawa fenol yang dapat mendegradasi DNA. PVP melalui ikatan hidrogen, membuat ikatan kompleks dengan polifenolik, dan secara efektif dapat menghilangkan polifenolik dari homogenate (John 1992; Kim et al. 1997). Beberapa protokol isolasi DNA Dellaporta et al. (1983), Jobes et al. (1995), Zheng et al. (1995) serta masih banyak metode lainnya digunakan untuk isolasi DNA organ-organ tanaman, namun tidak semua protokol tersebut cocok untuk semua jenis tanaman.
12
Sebagian besar spesies tanaman menghasilkan metabolit sekunder seperti alkaloid, flavanoid, fenol, polisakarida, terpen dan quinon yang digunakan pada industri makanan, farmasi, kosmetik dan pestisida. Keberadaan metabolit tersebut dapat menghambat prosedur isolasi dan reaksi DNA seperti restriksi DNA, amplifikasi dan kloning. Secara umum masalah utama pada isolasi dan purifikasi DNA adalah (1) degradasi DNA karena adanya endonuklease, isolasi pada sampel yang mengandung polisakarida tinggi, dan (2) adanya senyawa inhibitor seperti polifenol dan metabolit sekunder lainnya yang secara langsung dan tidak langsung berpengaruh terhadap reaksi enzimatik (Weishing et al. 1995). Keberadaan agen pengoksidasi seperti polifenol pada beberapa spesies tanaman, dapat mengurangi hasil dan kemurnian DNA yang terekstraksi (Loomis 1974; Porebski et al. 1997).
Tanaman kelapa sawit termasuk dalam famili Aracaeae. Tanaman yang termasuk dalam famili ini biasanya mempunyai polisakarida dan polifenolik yang tinggi dan mempunyai daun dengan kultikula lilin dan kandungan serat yang tinggi. Polisakarida diketahui dengan mudah bereaksi dengan DNA selama proses ekstraksi. Selanjutnya, komponen polifenolik pada sampel akan dengan cepat teroksidasi dan dapat mengikat DNA. Sampel yang terkontaminasi polisakarida dan polifenolik menyebabkan degradasi DNA dan menyebabkan masalah saat analisis sekuen DNA. Tingginya viskositas polisakarida menyebabkan sulitnya pemipetan dan menghambat aplikasi downstream dengan mengganggu aktivitas enzim seperti endonuklease, ligase dan polymerase (Fang et al. 1992). Beberapa metode ekstraksi DNA genom untuk tanaman yang mempunyai tingkat fenolik tinggi telah dipublikasikan Lodhi et al. (1994) dan Porebski et al. (1997).
Fokus penelitian ini adalah optimasi metode isolasi DNA dari organ bunga jantan dan betina pada kelapa sawit. Penelitian ini bertujuan menganalisis metode isolasi DNA dari organ bunga jantan dan bunga betina kelapa sawit dengan konsentrasi dan kemurnian yang tinggi, serta kontaminasi paling sedikit sehingga memudahkan dalam proses PCR dan analisis hasil PCR.
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di laboratorium Pemuliaan Tanaman, LAPTIAB, BPPT, Serpong. Pengambilan sampel tanaman dilaksanakan di Puspitek, Serpong. Waktu penelitian dimulai dari bulan Juni 2013 sampai Agustus 2013.
Bahan Tanaman
Isolasi DNA
DNA genom total diperoleh dengan menggerus sampel sebanyak 0.5 gram menggunakan nitrogen cair sampai halus. Mortar dan pestle yang digunakan diinkubasi semalaman pada suhu -20 oC. Pada metode I serbuk sampel dimasukan ke dalam tabung sentrifus yang berisi 5 ml buffer ekstraksi (SDS 10%; EDTA 0,5 M pH 8; Tris HCl 1 M pH 8; NaCl 5 M; ddH2O; 1% mercaptoenatol) yang telah diinkubasi sebelumnya pada suhu 65 oC. Pada metode II serbuk sampel dimasukan ke dalam tabung sentrifus yang berisi 5 ml buffer ekstraksi (CTAB 10%; EDTA 0,5 M pH 8; Tris HCl 1 M pH 8; NaCl 5 M; ddH2O; 1% mercaptoetanol) yang telah diinkubasi sebelumnya pada suhu 65 oC. Pada metode III sampel digerus dengan penambahan 0.1 gram PVP, selanjutnya serbuk dimasukan ke dalam tabung sentrifus yang berisi 5 ml buffer ekstraksi (CTAB 10%; EDTA 0,5 M pH 8; Tris HCl 1 M pH 8; NaCl 5 M; ddH2O; 1% mercaptoenatol) yang telah diinkubasi sebelumnya pada suhu 65 oC. Pembuatan buffer ekstraksi dapat dilihat pada lampiran 1. Larutan dihomogenkan dengan vortex kemudian diinkubasi pada suhu 65 oC selama 30 menit. Larutan dihomogenkan tiap 5 menit. Larutan diinkubai pada suhu kamar kemudian ditambahkan 1 volume CI (Chloroform : Isoamil alcohol = 24 : 1) dan disentrifus 14000 rpm selama 20 detik pada suhu 4 oC. Langkah ini diulang tiga kali. Supernatan diambil kemudian ditambahkan 1 volume isopropanol yang telah diinkubasi pada suhu 4 oC. Setelah diinkubasi di suhu -20 oC selama 30 menit, larutan disentrifuse pada 14000 rpm selama 10 menit 4 oC. Supernatan dibuang kemudian pelet dikeringkan. Pelet ditambahkan 500 µl TE, 1/10 volume NaCH3COO3 3 M pH 7 dingin, 2 volume ethanol absolute yang telah diinkubasi pada suhu 4 oC, kemudian disimpan pada -20 oC semalam. Larutan disentrifuse pada suhu 4 oC dengan kecepatan 14000 rpm selama 10 menit. Pelet DNA dicuci dengan 400 µl 70% ethanol yang telah diinkubasi pada suhu 4 oC, kemudian disentrifuse pada suhu 4 oC dengan kecepatan 14000 rpm selama 5 menit. Pelet dikeringkan kemudian ditambahkan 100 µl ddH2O dan 1/10 volume RNAse, kemudian diinkubasi pada suhu 37 oC selama 1 jam untuk menginaktivasikan RNAse. Pada metode IV digunakan Geneaid Genomic DNA Mini Kit (Plant) sesuai dengan prosedur yang direkomendasikan oleh produsen. Isolasi DNA pada bunga jantan dan betina dengan metode I, II, III dan IV masing-masing dilakukan pengulangan tiga kali.
Analisis Kualitas dan Kuantitas DNA
14
HASIL DAN PEMBAHASAN
Fenotipe bunga jantan dan betina kelapa sawit
Sampel bunga jantan dan betina kelapa sawit diambil dari kelapa sawit varietas Tenera. Bunga jantan dan betina pada kelapa sawit dapat dibedakan secara jelas berdasarkan fenotipenya (Gambar 3). Tandan bunga jantan dan betina yang masih tertutup seludang dapat dibedakan berdasarkan bentuknya. Tandan bunga jantan berbentuk panjang dan lonjong, ujungnya runcing dan garis tengah bunga lebih kecil. Tandan bunga betina berbentuk agak bulat, ujungnya rata dan garis tengah bunga lebih besar.
Bunga betina dan jantan tersusun dari sejumlah spikelet secara spiral pada rachis atau sumbu pembungaan. Setiap spikelet bunga betina disusun oleh 10 – 26 individu bunga. Spikelet bunga jantan memiliki bentuk silinder dan lancip pada ujungnya. Ukuran spikelet bunga jantan sekitar 10 – 20 cm. Bahan yang digunakan untuk isolasi DNA adalah individidu bunga dari spikelet bunga betina dan spikelet bunga jantan.
Gambar 3. Tandan bunga jantan (A), tandan bunga betina (B), spikelet bunga jantan (C), spikelet bunga betina (D), individu bunga betina (E) pada kelapa sawit
Optimasi Metode Isolasi DNA
Isolasi DNA pada bunga kelapa sawit cukup sulit hal ini disebabkan bunga kelapa sawit sangat mudah teroksidasi sehingga menimbulkan warna coklat
(browning) yang menyebabkan DNA terdegradasi. Untuk menghindari terjadinya browning pada sampel bunga jantan dan betina kelapa sawit, pada saat penggerusan sampel, kondisi ruangan, mortar dan pestle harus dalam keadaan dingin. Penambahan nitrogen cair saat penggerusan dapat mencegah terjadinya oksidasi dan DNA yang terdegradasi. Sampel segar bunga jantan dan betina direndam dalam nitrogen cair dan digerus dengan cepat untuk membantu memecahkan dinding sel secara mekanik, hal ini dilakukan untuk menjaga agar DNA tidak terdegradasi. Menurut Xin dan Chen (2012) penggunaan jaringan yang segar, nitrogen cair dan mortar yang dingin pada isolasi DNA dapat mengurangi terjadinya degradasi DNA.
Secara umum isolasi DNA terdiri atas empat tahap yaitu penghancuran dinding sel (lisis), pengikatan DNA (DNA binding), pencucian dan pemurnian. Tahap penghancuran dinding sel tanaman sangat mempengaruhi kemurnian DNA sehingga diperlukan teknik dan bahan pereaksi yang tepat agar DNA yang dihasilkan mempunyai kemurnian yang cukup tinggi. Pada penelitian ini dilakukan optimasi metode isolasi DNA dengan penambahan buffer ekstraksi yang berbeda (metode I, II dan III), sedangkan pada metode IV dilakukan isolasi DNA organ bunga menggunakan kit.
SDS/CTAB merupakan larutan deterjen yang berfungsi menurunkan tegangan permukaan cairan dan melarutkan lipid hal ini menyebabkan membran sel mengalami degradasi, sehingga organel-organel sel dapat keluar. Penambahan SDS dan CTAB yang bermuatan positif berfungsi untuk memisahkan polisakarida dari DNA dengan cara mengikat DNA yang bermuatan negatif. Selama tahap lisis SDS, protein dan polisakarida diikat pada suatu senyawa kompleks yang diselubungi dengan dodecyl sulfat. Senyawa ini dipresipitasi ketika ion sodium digantikan oleh ion potasium (Dellporta et al. 1983; Ish-Horowicz dan Burke 1981). Buffer ekstraksi yang digunakan pada metode I, II dan III dipanaskan terlebih dahulu pada suhu 65 oC, karena kemampuan SDS dan CTAB untuk melisis sel akan aktif pada kondisi 65 oC. Menurut Lade et al. (2014) penambahan buffer ekstraksi yang diinkubasi kurang dari 65 oC menyebabkan denaturasi yang tidak sempurna pada protein yang dapat menghasilkan kontaminasi pada tahap ekstraksi selanjutnya.
Penambahan buffer ekstraksi yang telah dipanaskan pada suhu 65 oC pada sampel yang dibekukan oleh nitrogen cair menyebabkan jaringan mengalami perubahan suhu secara cepat sehingga menghindari terjadinya kerusakan DNA. Hal ini sesuai dengan pendapat Purchooa (2004) bahwa penambahan buffer CTAB yang telah dipanaskan pada jaringan yang telah dibekukan oleh nitrogen cair menyebabkan jaringan mengalami perbedaan suhu dari -80 oC ke suhu 60 oC secara cepat sehingga menghasilkan DNA berkualitas tinggi.
16
Saat penggerusan sampel pada metode IV dilakukan penambahan PVP sebanyak 0.1 gram secara langsung. Menurut Lade et al. (2014), Murray dan Thompson (1980) kemurnian dan konsentrasi DNA akan menurun apabila konsentrasi PVP yang digunakan terlalu tinggi. Penambahan 1% PVP dan penambahan secara langsung pada buffer ekstraksi CTAB dapat menghilangkan polisakarida dan polifenol secara efesien (Romman 2011). PVP digunakan untuk menghindari pembentukan senyawa tak larut komplek antara senyawa fenolik dan DNA (Lefort dan Douglas 1999). Pemberian PVP menghasilkan DNA yang berwarna lebih bening, hal ini sesuai dengan pendapat Purchooa (2004) isolasi DNA biji sorgum yang banyak mengandung senyawa polisakarida dan polifenolik penggunaan PVP meningkatkan warna asam nukleat yang diperoleh.
Pencucian DNA dilakukan dengan ekstraksi menggunakan larutan Chloroform : I (24:1). Pada metode I, II dan III dilakukan tiga kali pencucian dengan larutan CI untuk menghilangkan kontaminan protein. Larutan CI sebagai pelarut organik dapat menghancurkan dan mengendapkan protein. Menurut Fang et al. (1992) kemurnian DNA genom tergantung pada banyaknya pencucian DNA yang dilakukan. Pencucian DNA sebanyak tiga kali yang dikombinasikan dengan sentrifugasi pada waktu yang pendek mencukupi untuk purifikasi DNA dan pengurangan nuclease endogen atau protein lainnya. Pemisahan dan pencucian protein sangat penting untuk menghindari penganggu-pengganggu pada DNA. CI digunakan untuk pemisahan protein dari DNA sehingga memungkinkan hanya DNA pada supernatant setelah tahap sentrifugasi (Purchooa 2004). Pada beberapa saat supernatant kadang berwarna kehijauan sampai kekuningan, yang dapat dieliminasi dengan mengulang tahap choloroform isoamylalcohol.
Pengikatan DNA dilakukan dengan etanol dan isopropanol karena larutan tersebut dapat mengendapkan DNA sedangkan kontaminan lainnya tetap larut. Penambahan Na-asetat berfungsi untuk membantu memekatkan dan mengendapkan DNA. Menurut Zidani et al. (2005) pencucian dengan etanol menghasilkan DNA yang lebih baik sebagai hasil dari dihilangkannya residu NaCl dan atau CTAB. Pencucian ikatan kompleks DNA-CTAB dengan ethanol berfungsi untuk mencuci kelebihan CTAB dari ikatan kompleks CTAB-DNA. Tahap ini merupakan tahap kritis untuk pengikatan DNA (Xin dan Chen 2012).
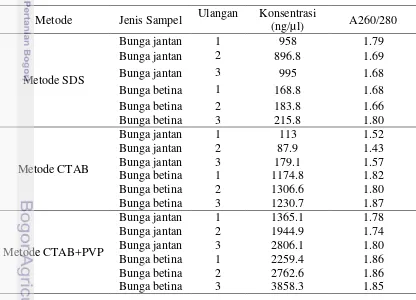
Analisis kualitas DNA bunga jantan dan betina hasil isolasi DNA metode SDS, metode CTAB dan metode CTAB+PVP pada gel agarose 0.8% menunjukkan isolasi menggunakan ketiga metode menghasilkan kualitas DNA yang cukup bagus walaupun masih tampak adanya kontaminan (Gambar 4). Menurut Rogers dan Bendich (1994) metode SDS/CTAB sering digunakan karena mudah dan kemungkinan adanya enzim pendegradasi DNA lebih kecil dibandingkan dengan metode lain. Metode isolasi DNA dengan buffer ekstraksi SDS/CTAB menghasilkan kualitas DNA yang cukup baik dari tanaman yang mengandung konsentrasi polisakarida dan polifenol yang tinggi untuk analisis downstream (Niu et al. 2008).
Isolasi menggunakan metode kit menghasilkan DNA yang tampak terdegradasi yang ditunjukan adanya smear pada DNA. Penggunaan kit untuk mengisolasi DNA organ bunga jantan dan betina tidak disarankan karena organ ini mengandung senyawa fenolik yang cukup tinggi. Reagen yang digunakan pada kit tidak dapat mengurangi senyawa fenolik yang dihasilkan organ bunga sehingga DNA terdegradasi. Kit ekstraksi DNA komersial merupakan prosedur yang ideal untuk isolasi DNA karena tidak menggunakan reagen yang berbahaya, namun pada beberapa penelitian kit komersial menghasilkan hasil DNA yang rendah dan kualitasnya bervariasi (Sharma el al. 2000; Li et al. 2001; Buldewo dan Jaufeerally-Fakim 2002; Keb-Llanes et al. 2002; Home et al. 2004).
Gambar 4. Hasil isolasi DNA bunga jantan kelapa sawit ulangan 1 (J1), ulangan 2 (J2), ulangan 3 (J3) dan bunga betina kelapa sawit ulangan 1 (B1), ulangan 2 (B2), ulangan 3 (B3) dengan metode SDS, CTAB, CTAB+PVP dan Kit. M : Marka 1 kb DNA ladder
18
rasio serapan pada λ 260/280 semua metode berkisar antara 1.43 – 1.87 (Tabel 1). Konsentrasi dan kemurnian DNA hasil isolasi kit tidak diukur karena DNA yang dihasilkan sudah mengalami degradasi. Hasil ini cukup konsisten pada tiga kali pengulangan masing-masing metode isolasi.
Kemurnian DNA dari kontaminan merupakan syarat untuk melakukan proses
PCR. Rasio absorbansi pada λ260 dengan λ280 menunjukkan kemurniannya terhadap
kontaminan protein. Sesuai dengan rekomendasi dari NanoDrop, rasio λ260/280 yang
lebih kecil dari 1.8 mengindikasikan adanya protein, fenol atau kontaminan lain yang terserap dengan kuat atau mendekati 280 nm. Meskipun pada penelitian ini terdapat
beberapa sampel yang mempunyai rasio λ260/280 lebih rendah dari 1.8, pengujian
kualitas DNA menggunakan gel elektroforesis menunjukkan bahwa DNA yang diperoleh dari isolasi metode CTAB dan metode CTAB+PVP memiliki kualitas yang cukup baik untuk digunakan sebagai template dibandingkan dengan DNA hasil isolasi metode SDS. Hal ini disebabkan masih tampak adanya kontaminan pada DNA hasil isolasi metode SDS dibandingkan dengan metode CTAB dan CTAB+PVP.
Tabel 1. Kuantifikasi DNA bunga jantan dan betina kelapa sawit menggunakan NanoDrop
Metode Jenis Sampel Ulangan Konsentrasi
(ng/µl) A260/280
dapat mendegradasi DNA dan menyebabkan teroksidasinya senyawa fenol. Oksidasi ditandai dengan terbentuknya warna coklat pada jaringan tanaman yang akan diisolasi. Hal ini sesuai dengan pendapat Utami et al. (2012) isolasi dengan CTAB sebagai buffer pengekstraksi memerlukan penambahan PVP untuk menghilangkan kontaminasi fenol. Menurut Jobes et al. (1995) variasi larutan CTAB menggunakan PVP pada tahap awal ekstraksi bertujuan untuk mengikat senyawa fenolik dan menekan oksidasi komponen fenolik (Doyle dan Doyle 1990).
Metode isolasi CTAB, dan CTAB+PVP menghasilkan kualitas dan kuantitas DNA bunga betina yang lebih baik dibandingkan dengan DNA bunga jantan. Hal ini didukung data pengukuran kemurnian DNA yang menunjukkan DNA bunga betina mempunyai kemurnian yang lebih tinggi dibandingkan dengan DNA bunga jantan. Data tersebut menunjukkan isolasi DNA dari organ bunga betina lebih efesien dibandingkan dengan isolasi DNA dari organ bunga jantan, karena diduga bunga jantan mengandung banyak kontaminan yang dapat mengurangi kemurnian DNA. Salah satu sumber kontaminan pada bunga jantan adalah adanya serbuk sari yang tersusun dari senyawa polisakarida. Tingginya polisakarida menyebabkan isolasi DNA bunga jantan lebih sulit dibandingkan dengan bunga betina.
KESIMPULAN
20
4
ISOLASI, IDENTIFIKASI DAN KARAKTERISASI GEN
PEMBUNGAAN PADA ORGAN BUNGA KELAPA SAWIT
ABSTRAK
Faktor genetik yang mempengaruhi proses pembungaan adalah adanya gen MADS-box yang menyandikan faktor transkripsi dan berperan pada pembentukan organ bunga. Tujuan penelitian ini adalah untuk mengisolasi, mengidentifikasi dan mengkarakterisasi gen yang terkait dengan pembungaan pada kelapa sawit, khususnya gen MADS-box. DNA genom diisolasi dari bunga jantan pohon yang memproduksi bunga jantan lebih banyak dibandingkan dengan bunga betina (P1) dan bunga betina pohon yang memproduksi bunga betina lebih banyak (P2). DNA genom diamplifikasi menggunakan tiga primer MADS-box (BMS, BMG dan BMD). Amplifikasi dengan primer BMS menghasilkan produk PCR berukuran masing-masing 1200 pb dari DNA P1 dan P2. Primer BMG dan BMD menghasilkan produk PCR berukuran 1200 pb dari DNA P1 dan 1300 pb dari DNA P2. Analisis BLASTn menunjukkan fragmen DNA P1 dan P2 teramplifikasi primer BMS dan BMG masing-masing mempunyai homologi yang tinggi dengan gen SQUA1 dan GLO2 pada kelapa sawit. Fragmen DNA P1 dan P2 teramplifikasi primer BMD mempunyai homologi yang tinggi masing-masing dengan DNA repetitive dan pentatricopeptide repeat-containing protein dari kelapa sawit. Analisis posisi ekson dan intron menunjukkan primer BMS dan BMG berhasil mengamplifikasi masing-masing dua ekson dan empat ekson dari DNA P1 dan P2. Sekuen diantara ekson-ekson tersebut merupakan sekuen intron. Analisis BLASTp menunjukkan fragmen DNA P1 dan P2 teramplifikasi primer BMS dan BMG ditranslasikan menjadi protein MADS-box. Analisis alignment fragmen DNA P1 dan P2 teramplifikasi primer BMS menunjukkan adanya keragaman sekuen pada ekson dan intron, sedangkan fragmen DNA P1 dan P2 teramplifikasi primer BMG menunjukkan adanya keragaman sekuen intron. Fragmen DNA terkait pentatricopeptide-repeat containing protein hanya terdapat pada P2.
Kata kunci : kelapa sawit, bunga jantan dan betina, SQUA1, GLO2, MADS-box
ABSTRACT
from tree that produce female flowers more than the male flowers (P2). The genomic DNA male and female flowers have been amplified by three different MADS-box primers; BMS, BMG and BMD. The BMS primers gave the PCR product size of 1200 bp for both genomic DNA. Meanwhile, the BMG and BMD primers gave the PCR product size of 1200 bp and 1300 bp for P1 and P2 respectively. BLASTn analysis showed that PCR products from BMS primers and BMG primers have high homology with SQUA1 gene and GLO2 from oil palm. Product PCR from BMD primers has high homology with repetitive DNA and pentatricopeptide repeat-containing protein from oil palm for P1 and P2 respectively. Exons and introns analysis showed that BMS and BMG primers successfully amplified two and four exons from P1 and P2 DNA respectively. Sequences between the exons are intron sequences. BLASTp analysis showed that P1 and P2 DNA fragment amplified by BMS and BMG primers have been translated as MADS-box proteins. Alignment analysis showed that DNA fragments amplified by BMS primers of P1 and P2 sequences have variety in the exons and introns, and varied only showed in the introns of DNA fragments amplified by BMG primers.DNA fragment related pentatricopeptide-repeat containing protein only presence on P2.
Keyword: oil palm, male and female flower, SQUA1, GLO2, MADS-box
PENDAHULUAN
Jumlah buah menjadi salah satu parameter utama produksi kelapa sawit. Secara umum produksi kelapa sawit yang berkaitan dengan jumlah buah dapat ditentukan sejak awal fase pembungaan sebagai tahap awal pembentukan buah. Kelapa sawit disebut sebagai dioecious temporal dalam memproduksi bunga jantan dan betina karena siklus munculnya bunga jantan dan betina bergantian pada tanaman yang sama, sehingga menghasilkan model reproduksi allogamus (Adam et al. 2011). Produksi bunga jantan dan betina bergantian dalam satu pohon dan dipengaruhi oleh berbagai faktor kompleks yaitu faktor abiotik misalnya cekaman air, iklim (Corley 1976); faktor metabolik misalnya siklus karbon (Adam et al. 2011), level asimilasi karbon (Sparnaaij 1960), ketidakseimbangan buffer source-sink (Legros et al. 2009 a, b, c), status hormon (Corley 1976) dan faktor genetik (Adam et al. 2011).
22
Menurut Adam et al. (2006) terdapat lima kelompok subfamili gen MADS-box yang berbeda yaitu gen SQUAMOSA (kelas A), DEFICIENS (kelas B), GLOBOSA (kelas B), AGAMOUS (kelas C dan D), AGAMOUS-like2 (kelas E) (Becker dan Theissen 2003), yang diidentifikasi dan dikarakterisasi sebagai gen yang berperan dalam penentuan struktur bunga sesuai dengan model pembungaan ABCDE (Coen dan Meyerowitz 1991; Colombo et al. 1995; Pelaz et al. 2000; Honma dan Goto 2001) dengan variasi pada skema dasar berdasarkan kelompok tanaman yang spesifik (Theissen et al. 2000). Berdasarkan model pembungaan ABCDE ekspresi gen kelas A menentukan pembentukan sepal pada calyx. Aktivitas kombinasi gen kelas A, B dan E menentukan pembentukan petal pada corolla. Ekspresi gen kelas B, C dan E menentukan pembentukan stamen pada androecium sedangkan aktivitas gen C dan E menentukan pembentukan carpel pada gynoecium. Gen kelas C, D dan E menentukan identitas ovule (Purugganan et al. 1995; Theissen et al. 1996, 2000; Alvarez-Buylla et al. 2000; Lamb dan Irish 2003).
Konsep model pembungaan ABCDE telah diaplikasikan pada sebagian besar spesies dikotil (Pnueli et al. 1994; Kater et al. 1998, 2001; Berbel et al. 2001; Immink et al. 2003). Pada beberapa tahun terakhir konsep model pembungaan ABCDE juga banyak teridentifikasi pada spesies monokotil (Mena et al. 1995; Ambrose et al. 2000; Jeon et al. 2000; Fornara et al. 2003; Xiao et al. 2003). Namun secara umum sedikit sekali pengetahuan tentang fungsi gen MADS box pada pembungaan monokotil. Tujuan dari penelitian ini adalah untuk mengisolasi, mengidentifikasi dan mengkarakterisasi gen yang terkait dengan pembungaan, khususnya gen MADS-box pada pohon dengan jumlah bunga jantan tinggi dan bunga betina tinggi.
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di laboratorium Pemuliaan Tanaman, LAPTIAB, BPPT, Serpong. Pengambilan sampel tanaman dilaksanakan di Puspitek, Serpong. Waktu penelitian dimulai dari bulan September 2013 sampai Juni 2014.
Bahan Tanaman
diambil untuk isolasi DNA adalah spikelet bunga jantan dan individu bunga dari spikelet bunga betina.
Isolasi DNA
DNA genom total diperoleh dengan menggerus sampel sebanyak 0.5 gram menggunakan nitrogen cair sampai halus. Mortar dan pestle yang digunakan diinkubasi semalaman pada suhu -20 oC. Sampel digerus dengan penambahan 0.1 gram PVP, selanjutnya serbuk dimasukan ke dalam tabung sentrifus yang berisi 5 ml buffer ekstraksi (CTAB 10%; EDTA 0,5 M pH 8; Tris HCl 1 M pH 8; NaCl 5 M; ddH2O) dan 1% mercaptoenatol yang telah diinkubasi pada suhu 65 oC sebelumnya. Pembuatan buffer ekstraksi dapat dilihat pada lampiran 1. Larutan dihomogenkan dengan vortex kemudian diinkubasi pada suhu 65 oC selama 30 menit. Larutan dihomogenkan tiap 5 menit. Larutan diinkubasi pada suhu kamar kemudian ditambahkan 1 volume CI (Chloroform : Isoamil alcohol = 24 : 1) dan disentrifus 14000 rpm selama 20 detik pada suhu 4 oC. Langkah ini diulang tiga kali. Supernatan diambil kemudian ditambahkan 1 volume isopropanol yang telah diinkubasi pada suhu 4 oC. Setelah diinkubasi di suhu – 20 oC selama 30 menit, larutan disentrifuse pada 14000 rpm selama 10 menit 4 oC. Supernatan dibuang kemudian pelet dikeringkan. Pelet ditambahkan 500 µl TE, 1/10 volume 100 µl NaCH3COO3 3 M pH 7 yang telah diinkubasi pada suhu 4 oC, 2 volume ethanol absolute yang telah diinkubasi pada suhu 4 oC, kemudian disimpan pada -20 oC semalam. Larutan disentrifuse pada suhu 4 oC dengan kecepatan 14000 rpm selama 10 menit. Pelet DNA dicuci dengan 400 µl 70% ethanol dingin kemudian disentrifuse pada suhu 4 oC dengan kecepatan 14000 rpm selama 5 menit. Pelet dikeringkan kemudian ditambahkan 100 µl ddH2O dan 1/10 volume RNAse, kemudian diinkubasi pada suhu 37 oC selama 1 jam untuk menginaktivasikan RNAse.
Amplifikasi PCR
Reaksi PCR terdiri atas template DNA genom 150 - 180 ng, 1 µl dNTP mix 2 mM, 1 µl 10 x Dream Taq buffer, 0.1 U Dream Taq DNA polymerase, 0.5 µl primer forward 0.2 µM, 0.5 µl primer reverse 0.2 µM, ddH2O nuclease-free sampai 10 µl. Kondisi PCR yang digunakan adalah inisial denaturasi 95 oC 5 menit, denaturasi 95 o
24
Tabel 2. Primer gen pembungaan
Primer Panjang primer Suhu gradient G/C content Gen Target (F/R)
BMS 20/20 65,4 ± 06 45%/55% SQUAMOSA
BMG 17/17 61.7 ± 06 58.8%/44.4% GLOBOSA
BMD 20/20 65.1 ± 10 55%/50% DEFICIENS
Purifikasi Gel Agarose
Produk PCR hasil pengujian elektroforesis dipurifikasi menggunakan Gel DNA Fragments Extraction Kit sesuai dengan prosedur yang telah direkomendasikan oleh produsen. Hasil purifikasi diuji kualitas dengan gel agarose 0.8% dan diuji kuantitasnya menggunakan NanoDrop.
Sekuensing
Fragmen DNA target disekuensing menggunakan alat dari Applied Biosystem Hitachi degan seri Genetic Analyzer 3130. Sekuensing dilakukan menggunakan primer sesuai Tabel 2.
Analisis Data
Hasil sekuensing dianalisis homologinya dengan sekuen nukleotida lain di NCBI menggunakan software online BLASTn (www.ncbi.nlm.nih.gov/BLAST). Analisis alignment sekuen fragmen DNA P1 dan P2 dilakukan menggunakan software ApE (A Plasmid Editor) v2.0.47. Sekuen fragmen DNA P1 dan P2 ditranslasi menjadi asam amino kemudian dibandingkan dengan data asam amino yang ada di NCBI menggunakan BLASTp (www.ncbi.nlm.nih.gov/BLAST). Analisis asam amino dilakukan menggunakan software Softberry (http://linux1.softberry.com). Analisis alignment asam amino dilakukan menggunakan software Bioedit v7.0.1.
HASIL DAN PEMBAHASAN
Isolasi Gen Pembungaan dari Organ Bunga Jantan dan Betina Kelapa Sawit
tergantung dari beberapa parameter, salah satunya adalah suhu annealing. Optimasi suhu annealing khususnya diperlukan ketika disintesis produk dengan ukuran yang panjang atau substrat yang digunakan sebagai template adalah DNA total genom. Suhu annealing dioptimasi untuk mengetahui suhu penempelan pasangan primer stabil dengan template.
Optimasi suhu annealing menggunakan DNA yang diisolasi dari spikelet bunga jantan yang diambil dari pohon berkarakter produksi bunga jantan lebih tinggi (P1) dan individu bunga dari spikelet bunga betina yang diambil dari pohon berkarakter produksi bunga betina lebih tinggi (P2). Reaksi PCR menggunakan DNA genom P1 dan P2 sebagai template, reaksi PCR masing-masing pohon diulang tiga kali untuk mendapatkan hasil yang konsisten. Pada penelitian ini dilakukan optimasi suhu annealing menggunakan PCR gradient. Berbagai suhu annealing yang digunakan untuk mengamplifikasi primer BMS, BMG dan BMD menunjukkan secara umum DNA P2 yang diisolasi dari organ bunga betina menghasilkan produk PCR lebih baik dibandingkan dengan DNA P1 yang diisolasi dari organ bunga jantan. Hal ini berkaitan dengan kemurnian DNA bunga betina yang lebih tinggi daripada DNA bunga jantan sebagai template pada reaksi PCR.
Hasil PCR gradient menunjukkan hasil amplifikasi DNA genom P1 dengan primer BMS menghasilkan produk PCR pada suhu annealing 59.4 oC, 60.2 oC, 61.1 o
C dan tidak dihasilkan produk PCR pada suhu annealing 62.1 oC, sedangkan pada DNA genom P2 produk PCR dihasilkan pada semua suhu annealing. Produk PCR dari DNA genom P1 dan P2 yang dihasilkan masing-masing berukuran 1200 pb (Gambar 5).
Gambar 5. Hasil PCR gradien primer BMS pada DNA genom P1 pada suhu annealing 59.4 oC (1), 60.2 oC (2), 61.1 oC (3), 62.1 oC (4) dan P2 pada suhu annealing 59.4 oC (5), 60.2 oC (6), 61.1 oC (7), 62.1 oC (8). M : Marka 1 kb DNA ladder
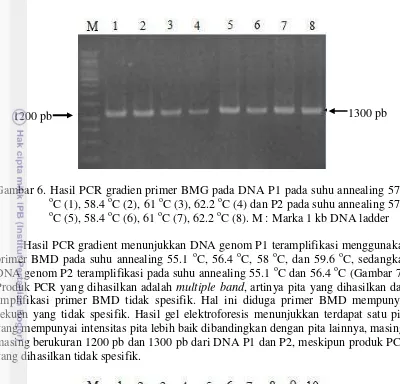
Hasil PCR gradient menunjukkan DNA genom P1 dan P2 dapat teramplifikasi menggunakan primer BMG pada suhu annealing 57.4 oC, 58.4 oC, 61 oC dan 62.2 oC. Produk PCR yang dihasilkan bervariasi antara DNA genom P1 dan P2, masing-masing 1200 pb dan 1300 pb (Gambar 6).
26
Gambar 6. Hasil PCR gradien primer BMG pada DNA P1 pada suhu annealing 57.4 o
C (1), 58.4 oC (2), 61 oC (3), 62.2 oC (4) dan P2 pada suhu annealing 57.4 o
C (5), 58.4 oC (6), 61 oC (7), 62.2 oC (8). M : Marka 1 kb DNA ladder Hasil PCR gradient menunjukkan DNA genom P1 teramplifikasi menggunakan primer BMD pada suhu annealing 55.1 oC, 56.4 oC, 58 oC, dan 59.6 oC, sedangkan DNA genom P2 teramplifikasi pada suhu annealing 55.1 oC dan 56.4 oC (Gambar 7). Produk PCR yang dihasilkan adalah multiple band, artinya pita yang dihasilkan dari amplifikasi primer BMD tidak spesifik. Hal ini diduga primer BMD mempunyai sekuen yang tidak spesifik. Hasil gel elektroforesis menunjukkan terdapat satu pita yang mempunyai intensitas pita lebih baik dibandingkan dengan pita lainnya, masing-masing berukuran 1200 pb dan 1300 pb dari DNA P1 dan P2, meskipun produk PCR yang dihasilkan tidak spesifik.
Gambar 7. Hasil PCR gradient primer BMD pada DNA P1 pada suhu annealing 55.1 o
C (1), 56.4 oC (2), 58 oC (3), 59.6 oC (4), 61.8 oC (5), P2 pada suhu annealing 55.1 oC (6), 56.4 oC (7), 58 oC (8), 59.6 oC (9), 61.8 oC (10). M : Marka 1 kb DNA ladder
1200 pb
1200 pb 1300 pb
Suhu annealing dari PCR gradient yang menghasilkan produk PCR dengan ketebalan pita terbaik selanjutnya digunakan dalam reaksi PCR selanjutnya. Produk PCR yang dihasilkan oleh primer BMD perlu dipurifikasi pada ukuran 1200 pb pada fragmen DNA P1 dan 1300 pb pada fragmen DNA P2. Purifikasi dilakukan dengan memotong gel agarose hasil elektroforesis kemudian mereaksikan dengan beberapa reagen sehingga didapatkan DNA murni. Selanjutnya DNA hasil purifikasi diuji kualitasnya menggunakan elektroforesis dan pengujian kuantitas dilakukan menggunakan NanoDrop. Hasil elektroforesis menunjukkan telah diperoleh produk PCR tunggal berukuran 1200 pb pada fragmen DNA P1 dan 1300 pb pada fragmen DNA P2 (Gambar 8). Produk PCR tunggal dari fragmen DNA teramplifikasi primer BMS, BMG dan BMD selanjutnya disekuensing untuk mendapatkan urutan basa nukleotida (sekuen).
Gambar 8. Hasil purifikasi fragmen DNA P1 (1) dan P2 (2) teramplifikasi primer BMD
Identifikasi Keragaman Gen Pembungaan Kelapa Sawit
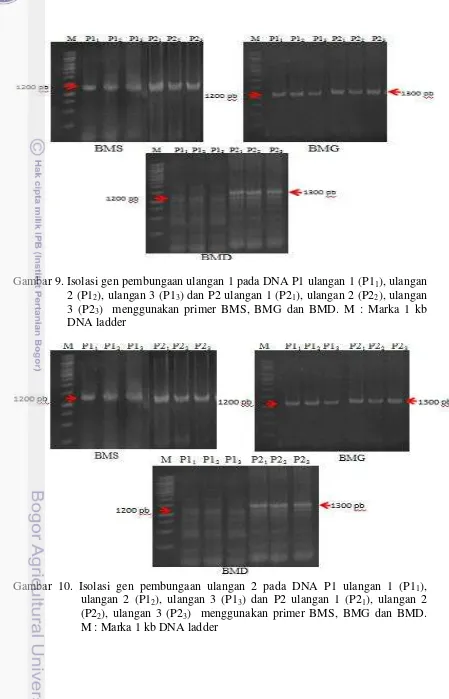
Hasil isolasi gen pembungaan pada DNA P1 dan DNA P2 menggunakan primer BMS tidak menunjukkan perbedaan ukuran fragmen DNA yang teramplifikasi, produk PCR yang dihasilkan adalah 1200 pb. Produk PCR yang dihasilkan dari DNA P1 dan P2 teraplifikasi primer BMG masing-masing 1200 pb dan 1300 pb. Produk PCR yang dihasilkan dari DNA P1 dan P2 teramplifikasi primer BMD masing-masing adalah 1200 pb dan 1300 pb. Identifikasi menggunakan primer BMG dan BMD menunjukkan terdapat perbedaan ukuran fragmen DNA yang teramplifikasi. Hasil yang konsisten ditunjukan pada tiga kali pengulangan reaksi PCR pada sampel P1 dan P2 ulangan 1 (Gambar 9) dan P1 dan P2 ulangan 2 (Gambar 10). Sampel P1 dan P2 masing-masing diulang dua kali untuk mengetahui konsistensi hasil PCR antar dua pohon P1 (pohon dengan karakter bunga jantan lebih banyak) dan dua pohon P2 (pohon dengan karakter bunga betina lebih banyak). Masing-masing P1 dan P2 diulang sampai tiga kali reaksi PCR untuk mendapatkan hasil yang konsisten pula.
28
Gambar 9. Isolasi gen pembungaan ulangan 1 pada DNA P1 ulangan 1 (P11), ulangan 2 (P12), ulangan 3 (P13) dan P2 ulangan 1 (P21), ulangan 2 (P22), ulangan 3 (P23) menggunakan primer BMS, BMG dan BMD. M : Marka 1 kb DNA ladder