LAJU PERTUMBUHAN SPESIFIK, BOBOT BIOMASSA, DAN
DOUBLING TIME
MIKROALGA (
Nannochloropsis
sp.) PADA
FOTOBIOREAKTOR DAN
OPEN RACEWAY POND
SKALA
PILOT PLANT
HARY ADITIA PUTRA
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini Saya menyatakan bahwa Skripsi yang berjudul :
LAJU PERTUMBUHAN SPESIFIK, BOBOT BIOMASSA, DAN
DOUBLING TIME
MIKROALGA (
Nannochloropsis
sp.) PADA
FOTOBIOREAKTOR DAN
OPEN RACEWAY POND
SKALA
PILOT PLANT
adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, 18 Februari 2013
RINGKASAN
HARY ADITIA PUTRA. Laju Pertumbuhan Spesifik, Bobot Biomassa, dan
Doubling Time Mikroalga (Nannochloropsis sp.) pada Fotobioreaktor dan
Open Raceway Pond Skala Pilot Plant. Dibimbing oleh MUJIZAT KAWAROE dan HENRY MUNANDAR MANIK
Mikroalga merupakan organisme yang memiliki ukuran renik yang dapat hidup pada perairan tawar maupun perairan asin (Kawaroe et al., 2010). Mikroalga merupakan organisme fotoautotrof yang mampu memproduksi zat makanannya sendiri melalui proses fotosintesis (Janssen, 2002). Saat ini, mikroalga telah banyak dikaji untuk menghasilkan energi alternatif, sepeti biofuel,
bioethanol, biohydrogen, dan biomethane (Kawaroe et al., 2010). Mikroalga disarankan sebagai sumber energi karena berbagai alasan, seperti tinggi kandungan minyak untuk beberapa strain, rendah konsumsi air, dan bahkan dapat diproduksi pada tanah yang tidak subur sekalipun (Mascarelli, 2009).Selain menjadi sumber energi alternatif, mikroalga juga dimanfaatkan sebagai sumber bahan baku pada industri farmasi, kosmetik, makanan, dan pakan hewan.
Teknologi produksi mikroalga secara umum dibagi menjadi dua, yaitu sistem tertutup dan sistem terbuka. Sistem terbuka (open raceway pond) dioperasikan di luar ruangan dan bergantung pada sinar cahaya matahari alami untuk penyinarannya. Sistem tertutup (fotobioreaktor) dapat dioperasikan di dalam atau di luar ruangan, namun biasanya diletakkan di luar ruangan, agar dapat memanfaatkan sinar cahaya matahari (Ojamae, 2011).
Produktivitas mikroalga dapat ditunjang secara optimal dengan melakukan penelitian mengenai perbandingan kultivasi yang dilakukan pada fotobioreaktor dan open raceway pond. Sehingga dapat diketahui sistem kultivasi yang paling optimal untuk pertumbuhan mikroalga.
Penelitian ini berlangsung pada bulan Juni hingga Oktober tahun 2012 yang bertempat di Pusat Penelitian Surfaktan dan Bioenergi (SBRC) LPPM, Institut Pertanian Bogor. Penelitian ini terdiri dari dua buah pengamatan kultivasi mikroalga yang dilakukan pada dua buah sistem kultivasi massal. Kedua sistem kultivasi massal yang diujicobakan ialah sebuah fotobioreaktor dan open raceway pond skala pilot plant. Sel mikroalga yang diamati pada pengamatan ini diberikan perlakuan pupuk dan waktu pengoperasian sistem yang sama.
© Hak Cipta milik Hary Aditia Putra, tahun 2013
Hak Cipta dilindungi Undang Undang
LAJU PERTUMBUHAN SPESIFIK, BOBOT BIOMASSA, DAN
DOUBLING TIME
MIKROALGA (
Nannochloropsis
sp.) PADA
FOTOBIOREAKTOR DAN
OPEN RACEWAY POND
SKALA
PILOT PLANT
HARY ADITIA PUTRA
SKRIPSI
Sebagai salah satu syarat memperoleh gelar Sarjana Ilmu Kelautan pada
Departemen Ilmu dan Teknologi Kelautan
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
vi
Judul Penelitian : LAJU PERTUMBUHAN SPESIFIK, BOBOT
BIOMASSA, DAN DOUBLING TIME MIKROALGA (Nannochloropsis sp.) PADA FOTOBIOREAKTOR DAN
OPEN RACEWAY POND SKALA PILOT PLANT
Nama Mahasiswa : Hary Aditia Putra Nomor Pokok : C54080037
Departemen : Ilmu dan Teknologi Kelautan
Menyetujui, Dosen Pembimbing
Utama Anggota
Dr. Ir. Mujizat Kawaroe, M.Si Dr. Henry M. Manik S.Pi, MT. NIP. 19651213 199403 2 002 NIP. 19701229 199703 1 008
Mengetahui,
Ketua Departemen Ilmu dan Teknologi Kelautan
Dr. Ir. I Wayan Nurjaya, M.Sc NIP. 19640801 198903 1 001
vii
Puji syukur penulis ucapkan kepada Allah SWT, karena atas rahmat, hidayah, serta umur-Nya penulis dapat menyelesaikan skripsi ini. Dalam
penulisannya, Penulis banyak mendapat bantuan dari berbagai pihak, baik berupa materi maupun moriil. Untuk itu penulis mengucapkan banyak terima kasih kepada:
1. Letkol CBA. Heri Hermantino, Dian Mardiana, S.H, Aria Dirgantara Putra dan Indah Medani Kartika Ayu Putri atas dukungannya selama penulis mengerjakan skripsi ini.
2. Dr. Ir. Mujizat Kawaroe, M.Si dan Dr. Henry M. Manik S.Pi, MT. Selaku dosen pembimbing yang telah memberikan arahan dan bimbingannya selama ini.
3. Beginer Subhan, S.Pi, M.Si selaku dosen penguji akhir skripsi. 4. Seluruh Dosen dan Staff Departemen Ilmu dan Teknologi Kelautan
terimakasih atas ilmu dan pelayanan yang diberikan selama penulis melakukan perkuliahan.
5. Pusat Penelitian Surfaktan dan Bioenergi (SBRC) LPPM IPB,
khususnya kepada Mba Dahlia, Mba Dina, Bang Ito, Mba Nely, Mba Tyas, Mba Indah, Ainun, Bang Oto, Syarif, dll yang telah membantu penulis baik dalam penelitian maupun penyusunan skripsi.
6. Tim penelitian SBRC 2012, Anma, Dea Fauzia, Aditya Hikmat, Rizky, Dodi, Misep, Yuni, Syibli, Teguh, Berlian, Raka, Van Rum, Yanuar, Wan Dodi dan Inggit atas suka dan duka yang telah diberikan selama penelitian di SBRC.
7. Laeli Nur Hasanah S.Gz atas dukungan dan semangat yang selalu terus diberikan selama penelitian maupun penyusunan skripsi hingga saat ini.
8. Keluarga besar ITK 45 atas persahabatan dan suka duka yang telah terbangun selama ini.
viii
maupun pembaca dan dapat dikembangkan melalui penelitian selanjutnya.
Bogor, 18 Februari 2013
ix
2.2.3 Fase Penurunan Pertumbuhan (Declining Growth) 5 2.2.4 Fase Stationer (Stationery Phase) 5
2.2.5 Fase Kematian (Death Phase) 6
2.3Nannochloropsis sp. 6
2.4Sistem Kultivasi Massal 8
2.4.1 Fotobioreaktor 8
2.4.2 Open Raceway Pond 10
2.5Parameter Yang Mempengaruhi Pertumbuhan Mikroalga 12
2.5.1 Nutrien 12
2.5.4 Turbulensi/Percampuran/Mixing 20
2.5.5 Salinitas 20
2.5.6 Suhu 20
3. METODE PENELITIAN 21
3.1Lokasi dan Waktu Penelitian 21
3.2Alat dan Bahan 21
3.3Metode Penelitian 22
3.3.1 Persiapan Alat Dan Bahan 23
x
3.3.4 Kultivasi 29
3.3.4.1Kultivasi Skala Laboratorium dan
Pemeliharaan Strain Murni 30
3.3.4.2Kultivasi Skala Semi Massal 30
3.3.4.3Kultivasi Skala Massal 30
3.3.5 Analisis Data 31
3.3.5.1Perhitungan Laju Pertumbuhan Spesifik 31 3.3.5.2Perhitungan Bobot Biomassa 32 3.3.5.3Perhitungan Doubling Time 33
3.3.5.4Kandungan Nutrien 34
3.3.5.4.1 Amonia 34
3.3.5.4.2 Nitrat 37
3.3.5.4.3 Nitrit 39
3.3.5.4.4 Ortofosfat 41
3.3.5.5Analisis Statistika 44
4. HASIL DAN PEMBAHASAN 45
4.1Mekanika Sistem 45
4.2Parameter Fisika dan Kimia 48
4.2.1 Suhu 48
4.3 Kepadatan dan Laju Pertumbuhan Spesifik 58
xi
1. Bahan-bahan pupuk kultivasi mikroalga skala
semi massal dan massal 13
2. Alat yang digunakan dalam penelitian 21
3. Bahan yang digunakan dalam penelitian 22
4. Spesifikasi mesin pereduksi 28
5. Komposisi larutan pengoksidasi analisis kandungan amonia ... 36
6. Nilai absorbansi larutan standar amonia 37
7. Nilai absorbansi larutan standar nitrat 39
8. Nilai absorbansi larutan standar nitrit 41
9. Nilai absorbansi larutan standar ortofosfat 43 10.Kepadatan sel mikroalga rata-rata selama kultivasi pada
fotobioreaktor dan open raceway pond 58
11. Bobot biomassa kering sel mikroalga selama kultivasi pada
fotobioreaktor dan open raceway pond 62
12.Nilai doubling time sel mikroalga kultivasi pada fotobioreaktor dan
xii
DAFTAR GAMBAR
Halaman
1. Pola pertumbuhan mikroalga ... 4
2. Nannochloropsis sp. ... 7
3. Beberapa contoh fotobioreaktor ... 10
4. Beberapa contoh open raceway pond yang umum digunakan ... 11
5. Keragaman sinar matahari harian rata-rata ... 19
6. Diagram alir metode penelitian ... 23
7. Desain fotobioreaktor ... 24
8. Desain open raceway pond tampak samping ... 25
9. Desain open raceway pond tampak atas ... 25
10.Desain pedal air ... 26
11.Open raceway pond yang telah selesai dibuat ... 27
12.Diagram alir proses kultivasi mikroalga ... 29
13.Perhitungan kepadatan pada haemocytometer ... 31
14.Diagram alir metode pengamatan bobot biomassa ... 32
15.Diagram alir metode analisis kadar amonia ... 35
16.Diagram alir metode analisis kadar nitrat ... 38
17.Diagram alir metode analisis kadar nitrit ... 40
18.Diagram alir metode analisis kadar ortofosfat ... 42
19.Tampilan sederhana arus sirkular didalam fotobioreaktor ... 46
xiii
22.Grafik nilai salinitas media kultivasi mikroalga pada fotobioreaktor dan open raceway pond ... 50 23.Grafik nilai pH media kultivasi mikroalga pada fotobioreaktor dan
open raceway pond ... 51 24.Grafik nilai kandungan kadar amonia media kultivasi mikroalga
pada fotobioreaktor dan open raceway pond 52 25.Grafik nilai kandungan kadar nitrit media kultivasi pada
fotobioreaktor dan open raceway pond 54
26.Grafik nilai kandungan kadar nitrat media kultivasi mikroalga
pada fotobioreaktor dan open raceway pond 55 27.Grafik nilai kandungan kadar ortofosfat media kultivasi mikroalga
xiv
Halaman
1. Contoh perhitungan kepadatan sel ... 74
2. Contoh perhitungan laju pertumbuhan sel ... 75
3. Contoh perhitungan bobot biomassa ... 76
4. Contoh perhitungan doubling time (K) ... 77
5. Contoh perhitungan kandungan amonia ... 78
6. Contoh perhitungan kandungan nitrit ... 79
7. Contoh perhitungan kandungan nitrat ... 80
8. Contoh perhitungan kandungan ortofosfat ... 81
9. Parameter fisika media kultivasi pada fotobioreaktor dan open raceway pond ... 82
10.Kandungan nutrien media kultivasi pada fotobioreaktor dan open raceway pond ... 83
11.Uji statistika kepadatan sel mikroalga pada fotobioreaktor dan open raceway pond ... 84
12.Uji statistika laju pertumbuhan sel mikroalga pada fotobioreaktor dan open raceway pond ... 85
13.Uji statistika dan uji lanjut bobot biomassa sel mikroalga pada fotobioreaktor dan open raceway pond ... 86
1
Mikroalga merupakan organisme yang memiliki ukuran renik yang dapat hidup pada perairan tawar maupun perairan asin (Kawaroe et al., 2010).
Mikroalga merupakan organisme fotoautotrof yang mampu memproduksi zat makanannya sendiri melalui proses fotosintesis (Janssen, 2002). Saat ini,
mikroalga telah banyak dikaji untuk menghasilkan energi alternatif, sepeti biofuel,
bioethanol, biohydrogen, dan biomethane (Kawaroe et al., 2010). Mikroalga disarankan sebagai sumber energi karena berbagai alasan, seperti tinggi
kandungan minyak untuk beberapa strain, rendah konsumsi air, dan bahkan dapat diproduksi pada tanah yang tidak subur sekalipun (Mascarelli, 2009). Selain menjadi sumber energi alternatif, mikroalga juga dimanfaatkan sebagai sumber bahan baku pada industri farmasi, kosmetik, makanan, dan pakan hewan.
Teknologi produksi mikroalga secara umum dibagi menjadi dua, yaitu sistem tertutup dan sistem terbuka. Sistem terbuka (open raceway pond) dioperasikan di luar ruangan dan bergantung pada sinar cahaya matahari alami untuk penyinarannya. Sistem tertutup (fotobioreaktor) dapat dioperasikan di dalam atau di luar ruangan, namun biasanya diletakkan di luar ruangan, agar dapat memanfaatkan sinar cahaya matahari (Ojamae, 2011).
1.2 Tujuan
Tujuan dari penelitian ini adalah untuk:
1) Mengkaji laju pertumbuhan spesifik, bobot biomassa, dan doubling time
3
2. TINJAUAN PUSTAKA
2.1 Mikroalga
Mikroalga merupakan sebuah mikroorganisme fotosintetik yang tergolong dalam prokariot atau eukariot dan dapat tumbuh secara cepat dengan struktur uniselular atau multiselularnya (Quinn, 2011). Mikroalga merupakan organisme autotrofik yang mampu membuat sendiri makanannya. Organisme ini merupakan produsen primer perairan karena mampu berfotosintesis layaknya tumbuhan tingkat tinggi. Mikroalga banyak ditemukan dari beberapa kelas seperti Bacillariophyceae (diatom), Chrysophyceae (alga coklat keemasan), dan kelas Cyanophyceae (Kawaroe et al., 2010). Berdasarkan pigmen yang dimiliki
olehnya, menurut Kawaroe et al. (2010) mikroalga dibagi menjadi 5 (lima) filum, yaitu:
Chlorophyta (alga hijau)
Chrysophyta (alga keemasan)
Pyrophyta (alga api)
Euglenophyta
Cyanophyta (alga biru hijau)
Layaknya organisme lainnya, mikroalga memiliki kisaran nilai pada
2.2 Fase Hidup Mikroalga
Fase pertumbuhan mikroalga dapat diketahui dengan melakukan pengamatan terhadap parameter pertumbuhan seperti bentuk ukuran sel,
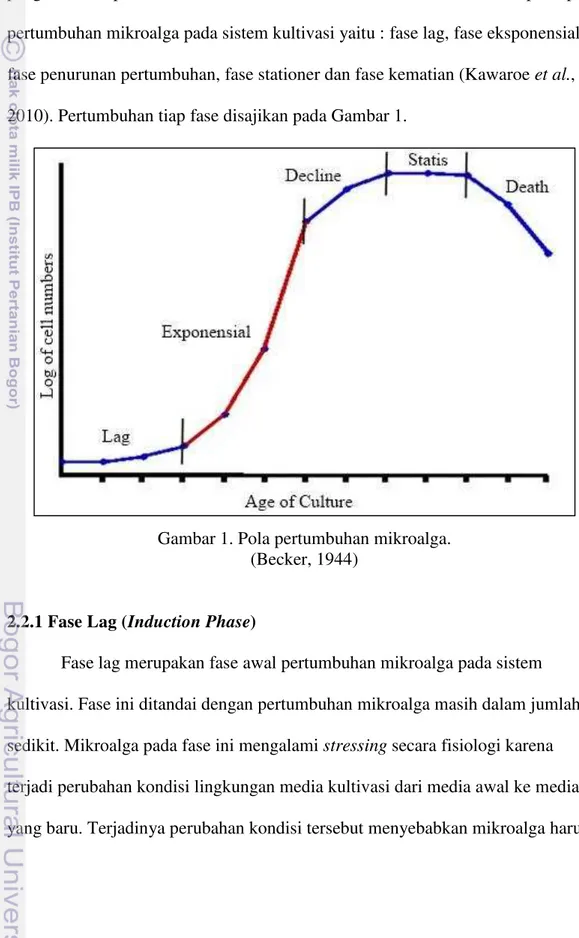
pengukuran kepadatan sel, dan biomassa sel dari waktu ke waktu. Terdapat 5 pola pertumbuhan mikroalga pada sistem kultivasi yaitu : fase lag, fase eksponensial, fase penurunan pertumbuhan, fase stationer dan fase kematian (Kawaroe et al., 2010). Pertumbuhan tiap fase disajikan pada Gambar 1.
Gambar 1. Pola pertumbuhan mikroalga. (Becker, 1944)
2.2.1 Fase Lag (Induction Phase)
mengalami proses penyesuaian terlebih dahulu sebelum mengalami pertumbuhan. Perubahan kondisi ini diakibatkan oleh penambahan nutrient dan mineral,
sehingga kelarutannya menjadi lebih banyak dari sebelumnya, dan akan memperngaruhi sintetis metabolisme dari mikroalga karena pindah dari konsentrasi rendah ke konsentrasi yang tinggi.
2.2.2 Fase Eksponensial
Fase ekponensial merupakan fase lanjutan setelah fase lag. Mikroalga yang telah dikultivasi akan mengalami pertambahan biomassa secara cepat pada fase ini. Penambahan tersebut apabila dihitung secara matematis akan membentuk sebuah fungsi logaritma. Pemanenan lebih baik dilakukan pada akhir fase ini. Karena pada akhir fase ini, struktur sel dari mikroalga berada dalam kondisi normal dan secara nutrisi terjadi keseimbangan antara kandungan nutrient dalam tubuhnya sama dengan kandungan nutrient dalam lingkungan.
2.2.3 Fase Penurunan Pertumbuhan (Declining Growth)
Fase ini ditandai dengan pengurangan laju pertumbuhan hingga sama dengan fase awal pertumbuhan, yaitu sebuah kondisi stagnan tanpa adanya penambahan sel yang terjadi. Kandungan nutrient pada fase ini mengalami pengurangan, sehingga kemampuan sel untuk melakukan pembelahan menjadi berkurang dan menjadi berkurang kuantitas selnya.
2.2.4 Fase Stationer (Stationery Phase)
Fase ini menunjukkan adanya pertumbuhan mikroalga yang terjadi secara konstan akibat dari kesetimbangan katabolisme dan anabolisme di dalam sel. Fase ini ditandai dengan rendahnya kandungan nutrien dalam sel mikroalga.
ini. Dalam kultivasi yang memiliki kepadatan mikroalga yang rendah, fase ini berlangsung pendek.
2.2.5 Fase Kematian (Death Phase)
Fase ini diindikasikan dengan kematian sel karena perubahan kualitas air ke arah yang buruk, hal ini disebabkan oleh umur mikroalga yang semakin tua. Fase ini ini ditandai dengan penurunan jumlah sel yang banyak dan cepat dan gumpalan mikroalga mengendap di dasar wadah kultivasi, warna air kultivasi yang berubah, dan buih dipermukaan media kultivasi.
2.3 Nannochloropsis sp.
Nannochloropsis spp. merupakan salah satu spesies mikroalga yang terklasifikasikan dalam filum Chlorophyta (alga hijau). Mikroalga jenis ini merupakan jenis Chlorophyta yang hidup berkoloni. Selnya mengandung klorofil A dan B yang sama identik dengan jenis klorofil yang ditemukan pada tumbuhan tingkat tinggi (Kawaroe et al., 2010), zeaxanthin, canthaxanthin dan astaxanthin (Lubia et al., 2000). Pigmen-pigmen tersebut secara cepat berubah secara dinamis bergantung bagaimana Nannochloropsis merespon terhadap perubahan
lingkungan, yaitu cahaya (Sukenik et al., 1989). Berikut ini merupakan taksonomi dari Nannochloropsis sp.
Kingdom : Chromista T. (Cavalier-Smith, 1981) Subkingdom : Chromobiota (Cavalier-Smith, 1991)
Phylum : Ochrophyta (Cavalier-Smith, 1995) Subphylum : Phaeista (Cavalier-Smith, 1995)
Superclass : Limnista (Cavalier-Smith, 1996)
Class : Eustigmatophyceae (Hibberd dan Leedale, 1970) Genus : Nannochloropsis (D.J. Hibberd, 1981)
Nannochloropsis sp. memiliki sel yang berwarna kehijauan, tidak memiliki flagel sebagai alat gerak maupun alat untuk mencari makanan, dan pergerakannya juga tidak motil. Mikroalga jenis ini memiliki ukuran yang sangat kecil yaitu 4-6 µm. Mikroalga Nannochloropsis merupakan pakan alami untuk rotifer (Kawaroe et al., 2010). Menurut Isnansetyo dan Kurniastuty (1995), rotifer merupakan salah satu pakan alami larva ikan yang digunakan para pembudidaya ikan. Gambar dari Nannochloropsis sp. disajikan pada Gambar 2.
Gambar 2. Nannochloropsis sp..
(sumber: pengamatan mikroskop perbesaran 40x1).
Nannochloropsis sp. dapat hidup pada lingkungan yang memiliki salinitas sebesar 20o/oo (Kawaroe et al., 2010). Berdasarkan hasil budidaya yang dilakukan
oleh Nyoman (2009), Nannochloropsis sp. hidup dengan baik pada salinitas 20o/oo. Menurut Kawaroe et al. (2010) ada beberapa kondisi parameter yang
optimum bagi pertumbuhan Nannochloropsis, yaitu suhu 21oC, cahaya 52 µm photons /
2.4 Sistem Kultivasi Massal
Secara umum sistem kultivasi massal biomassa mikroalga dapat dibagi menjadi dua, yaitu open pond (kolam terbuka/sistem terbuka) dan fotobioreaktor tertutup (sistem tertutup) (Janssen et al., 2003; Wen dan Johnson, 2009; Sudhakar dan Premalatha, 2012; Harun et al., 2010; Ojamae, 2011; Quinn, 2011; dan Luo, 2005). Masing-masing sistem memiliki kelebihan dan kekurangannya sendiri. Penjabaran mengenai masing-masing sistem dapat dilihat pada subbab 2.4.1 dan 2.4.2 berikut ini.
2.4.1 Fotobioreaktor
Photobioreaktor (PBR) atau Fotobioreaktor merupakan salah satu alat yang digunakan dalam kultivasi skala massal pada sistem outdoor atau luar ruangan selain sistem kolam terbuka (Kawaroe et al., 2010). Fotobioreaktor merupakan salah satu alat dimana energi cahaya dikonversikan ke dalam energi biokimia (Das, 2011). Ada beberapa faktor yang yang mempengaruhi performa dari fotobioreaktor (Das, 2011), yaitu penetrasi cahaya, perbandingan antara luas permukaan terhadap volume, kontrol temperatur, daya tembus pandang dan daya tahan dari bahan, dan pertukaran gas. Fotobioreaktor merupakan sistem kultivasi skala massal sistem tertutup, yang mana pada sistem tertutup menurut Das (2011) memberikan produksi biomassa sebanyak tiga kali lipat bila dibandingkan dengan sistem terbuka.
menangkap sinar cahaya matahari dan mendifusikannya ke dalam medium secara langsung.
Fotobioreaktor juga memiliki beberapa kekurangan, yaitu selain biaya operasionalnya tinggi (Harun et al., 2010; Li et al., 2008; Pulz, 2001; dan Richmond, 2004), fotobioreaktor juga sulit untuk dilakukan scale-up karena faktor cahaya, ketersediaan dan efisiensi. Cahaya matahari yang menyinari bagian permukaan reaktor, intensitasnya akan berkurang secara eksponensial dari daerah yang tercahayai ke daerah pusat reaktor (Luo, 2005). Intensitas cahaya biasanya menurun secara tajam akibat penyerapan selular, scattering, dan pemantulan diantara sel mikroorganisme serta elemen media kultivasi (Vincenti dan Kruger, 1965; Cassano et al., 1995).
Gambar 3. Beberapa contoh fotobioreaktor. (Ojamae, 2011)
Kunci masalah didalam kultivasi yang dilakukan dengan menggunakan fotobioreaktor menurut Gudin dan Chaumont (1991) ialah berupa semburan udara yang berlebihan dan semburan udara tersebut dapat merusak sel mikroalga. Ada tiga titik semburan udara yang dapat menyebabkan kerusakan sel menurut Tramper et al., (1986), yaitu pada titik awal penyemburan dimana gelembung udara terbentuk, pada daerah dimana gelembung udara naik, dan pada daerah dimana penyebaran gelembung udara terjadi. Ketiga titik tersebut ada pada fotobioreaktor yang digunakan dalam proses kultivasi. Daerah yang paling meyakinkan sebagai tempat kematian sel yaitu daerah dimana gelembung udara pecah (Jobses et al., 1991).
2.4.2 Open Raceway Pond
Masojidek et al., 2011 ). Hal ini digunakan untuk menjaga agar mikroalga tetap terekspos cahaya matahari dan hal tersebut juga merupakan batas kedalaman cahaya untuk masih bisa menembus air kolam (Masojidek et al., 2011). Beberapa contoh kolam arus terbuka yang umum digunakan disajikan dalam Gambar 4.
Gambar 4. Beberapa contoh open raceway pond yang umum digunakan. (sumber: Tredici, 2012)
Kolam arus terbuka memiliki kelebihan maupun kekurangan. Kelebihan yang dimiliki oleh sistem kolam terbuka ialah sistem pengoperasian dan
konstruksi bangunan yang sederhana juga mudah (Sanchez et al., 2000), dan lebih menguntungkan (Ugwu et al., 2008). Kekurangan yang dimiliki oleh kolam arus terbuka ialah terpapar secara langsung ke lingkungan terbuka, adanya penguapan, kontaminasi oleh organisme lain yang memakan alga, pemanfaatan
Kolam arus terbuka memiliki sebuah pedal air yang berfungsi untuk mengaduk dan menimbulkan sirkulasi media kultur agar mencegah terjadinya gradient konsentrasi kultur. Pengadukan ini juga menyebabkan tersedianya cahaya bagi mikroalga secara homogen ke mikroalga (Sanchez et al., 2000). Menurut Borowitzka (2005), pengadukan juga mencegah terjadinya pengendapan, menghindari stratifikasi suhu dan oksigen di dalam kolam.
2.5 Parameter Yang Mempengaruhi Pertumbuhan Mikroalga
Layaknya sebuah organisme yang hidup di perairan, mikroalga juga memiliki beberapa parameter yang berpengaruh pada kelangsungan hidupnya. Menurut (FAO, 1996), ada beberapa parameter yang mempengaruhi kelangsungan hidup dari mikroalga, yaitu kualitas dan kuantitas nutrient, cahaya, pH, turbulensi, salinitas, dan suhu.
2.5.1 Nutrien
Tabel 1. Bahan-bahan pupuk kultivasi mikroalga skala semi massal dan massal .
*Dt = Kultivasi diatom; Non-Dt = Selain diatom.
Bahan-bahan pupuk tersebut digunakan untuk mencukupi kebutuhan mikro maupun makronutrient yang dibutuhkan oleh mikroalga. Menurut Kawaroe
et al., 2010, makronutrien yang dibutuhkan oleh mikroalga antara lain C, H, N, P, K, S, Mg, dan Ca, sedangkan mikronutrien yang dibutuhkan oleh mikroalga ialah Fe, Cu, Mn, Zn, Co, Mo, Bo, Vn, dan Si. Untuk memenuhi kebutuhan unsur hara yang diperlukan mikroalga digunakan pupuk buatan seperti urea, tsp, dan za.
Urea merupakan sebuah senyawa organik yang memiliki rumusan kimia CO(NH2)2 dan memiliki istilah lain Carbamide. Urea memiliki sifat yang mudah
menyerap uap air dan memiliki kelarutan yang tinggi di dalam air. Urea akan terurai kembali menjadi komponen dasar pembentuknya seperti persamaan berikut ini.
CO(NH2)2+H2O -> 2NH3+CO2
Pupuk TSP (Triple Sugar Phosphate) yang digunakan untuk memenuhi kebutuhan fosfor, didapatkan dalam persamaan kompleks dalam persamaan berikut ini.
3Ca(PO4)2.CaF2+4H3PO4+9H2O-> 9Ca(H2PO4)2+CaF2
Reaksi tersebut akan menghasilkan pupuk TSP dengan kadar fosfor sebesar 45% dalam bentuk P2O5, sehingga pupuk TSP dikategorikan sebagai pupuk fosfor
(Havlin et al., 2005). 2.5.1.1. Amonia
Sumber amonia (NH3) di perairan merupakan pemecahan senyawa
nitrogen organik (protein dan urea) dan nitrogen anorganik yang terdapat di dalam tanah dan air, yang bersumber dari dekomposisi bahan-bahan organik (berasal dari tumbuhan dan biota yang telah mati) oleh mikroba dan jamur. Proses ini dikenal dengan sebutan amonifikasi yang ditunjukkan dalam persamaan berikut ini (Effendi, 2003).
N Organik + O2→ NH3-N + O2→ NO2-N + O2→ NO3-N
Kadar amonia di perairan dapat dapat menghilang melalui proses volatilisasi atau penguapan akibat adanya tekanan parsial amonia dalam larutan yang meningkat seiring dengan semakin meningkatnya kadar pH. Hilangnya amonia juga dapat terjadi akibat meningkatnya kecepatan angin dan suhu. Amonia yang terukur di perairan berupa amonia total (NH3 dan NH4+). Amonia bebas
tidak dapat terionisasi, sedangkan amonium (NH4) bisa terionisasi. Persentase
Sumber nitrogen yang dapat dimanfaatkan secara langsung oleh tumbuhan akuatik atau alga adalah nitrat (NO3), amonium (NH4), dan gas nitrogen (N2).
Pupuk yang mengandung amonium, misalnya urea, berfungsi untuk menambah pasokan nitrogen dalam tanah yang dapat dimanfaatkan secara langsung oleh tumbuhan. Amonia jarang ditemukan pada perairan yang mendapatkan cukup pasokan oksigen (Effendi, 2003).
Kadar amonia pada perairan alami biasanya kurang dari 0,1 mg/l
(McNeely et al., 1979). Kadar NH3 pada perairan sebaiknya tidak lebih dari 0,02 mg/l. Jika lebih dari 0,2 mg/l maka perairan tersebut bersifat toksik bagi beberapa jenis ikan (Sawyer dan McCarty, 1978). Kadar amonia yang tinggi dapat
merupakan indikasi adanya pencemaran bahan organik yang berasal dari bahan-bahan pencemar, seperti limbah domestik dan pupuk pertanian (Effendi, 2003). 2.5.1.2 Nitrat
Nitrat (NO3) merupakan bentuk utama nitrogen yang berada di perairan
dan merupakan sumber nutrient utama bagi pertumbuhan tanaman dan alga. Nitrat nitrogen sangat mudah larut dalam air dan memiliki sifat yang stabil. Senyawa ini dihasilkan oleh proses oksidasi sempurna dari senyawa nitrogen di perairan. Reaksi nitrifikasi dapat dilihat pada kedua persamaan berikut (Effendi, 2003):
2NH3 + 3O2→ 2NO2-+2H++2H20 (Nitrosomonas)
2NO2-+02→2N03- (Nitrobacter)
NO3-+CO2+tumbuhan+cahaya matahari→protein
Nitrat dan amonium adalah sumber utama nitrogen di perairan. Kadar nitrat nitrogen 0,2-5 mg/l dapat mengakibatkan terjadinya eutrofikasi (pengayaan) perairan, yang selanjutnya akan menstimulasi pertumbuhan alga dengan cepat (blooming) (Davis dan Cornwell, 1991).
2.5.1.3 Nitrit
Kadar nitrit (NO2) ditemukan dalam jumlah yang sangat sedikit, lebih
sedikit bila dibandingkan dengan kadar nitrat pada perairan alami. Hal ini karena sifatnya yang tidak stabil dengan keberadaan oksigen. Nitrit merupakan bentuk peralihan antara amonia dan nitrat (nitrifikasi), dan antara nitrat dan gas nitrogen (denitrifikasi). Proses denitrifikasi dapat dilihat pada persamaan berikut (Novotny dan Olem, 1994).
NO3-+H+→1/2(H2O+N2)+5/4O2
Gas N2 yang dapat terlepas dilepaskan dari dalam air ke udara pada proses
persamaan diatas. Ion nitrit merupakan sumber nitrogen bagi tanaman. Keberadaan nitrit dapat menggambarkan berlangsungnya proses perombakan bahan organik yang mengandung kadar oksigen terlarut yang sangat rendah (Effendi, 2003). Perairan alami mengandung nitrit sekitar 0,001 mg/l dan sebaiknya tidak melebihi 0,06 mg/l (Canadian Council of Resource and
Environment Ministers, 1987) dan jarang melibihi 1 mg/l (Sawyer dan McCarty, 1978). Apabila lebih dari 0,05 mg/l maka akan menyebabkan toksik bagi
2.5.1.4 Ortofosfat
Fosfor dalam perairan tidak ditemukan dalam bentuk bebas sebagai elemen, melainkan dalam bentuk senyawa organik terlarut (othofosfat dan polifosfat) dan senyawa organik yang berupa partikulat. Fosfor membentuk kompleks dengan ion besi dan kalsium pada kondisi aerob, bersifat tidak larut, dan mengendap pada sedimen sehingga tidak bias dimanfaatkan oleh alga (Jeffries dan Mills, 1996). Fosfat merupakan bentuk dari fosfor yang dapat dimanfaatkan oleh tumbuhan (Dugan, 1972). Fosfor merupakan unsur yang essensial bagi tumbuhan maupun alga. Unsur ini merupakan unsur yang menjadi faktor pembatas pertumbuhan bagi tumbuhan maupun alga dan sangat mempengaruhi tingkat produktivitas perairan (Effendi, 2003).
Fosfor memiliki peran dalam transfer energi yang terjadi di dalam sel, yaitu yang terdapat dalam ATP (Adenosine Triphophate) dan ADP (Adenosine Diphosphate). Ortofosfat hasil ionisasi dari asam ortofosfat merupakan bentuk fosfor yang paling sederhana di dalam perairan (Boyd, 1988). Reaksi ionisasi asam ortofosfat dapat dilihat pada ketiga persamaan berikut.
H3PO4↔H++H2PO4
-H2PO4-↔H++HPO4
2-HPO42-↔H++PO4
umumnya relatif kecil, kadarnya lebih sedikit bila dibandingkan dengan kadar nitrogen, karena sumbernya lebih sedikit dibandingkan dengan sumber nitrogen di perairan (Effendi, 2003).
Kadar fosfor pada perairan alami sekitar 0,005-0,02 mg/l P-PO4
(UNESCO/WHO/UNEP, 1992). Kadar fosfor dalam ortofosfat (P-PO4) jarang
melebihi dari 0,1 mg/l, walapun pada perairan eutrofik (Boyd, 1988). Keberadaan fosfor secara berlebih yang disertai dengan keberadaan nitrogen akan
menyebabkan blooming alga. Alga akan mengakumulasikan fosfor di dalam sel melebihi kebutuhannya (luxury consumption) pada kondisi cukup fosfor. Kelebihan fosfor akan digunakan oleh alga saat kondisi lingkungan sedang mengalami defisiensi fosfor sehingga alga dapat tumbuh beberapa waktu saat terjadinya defisiensi. Selama defisiensi fosfor, alga juga dapat menggunakan enzim alkalin fosfat untuk memecah senyawa organofosfor (Boney, 1989). 2.5.2 Cahaya
Seperti tumbuhan tingkat tinggi lainnya, mikroalga juga melakukan fotosintesis. Proses fotosintesis mengubah senyawa anorganik menjadi senyawa organik berupa glukosa dan ATP. Energi cahaya merupakan komponen utama dalam proses fotosintesis. Energi cahaya memegang peranan penting dalam keberlangsungan kultivasi mikroalga, namun besaran intensitasnya harus
Gambar 5. Keragaman sinar matahari harian rata-rata. (sumber: Schmidt, 1950 dalam Kawaroe et al., 2010).
Sinar matahari di Indonesia mencukupi untuk kebutuhan kultivasi mikroalga karena menyinari Indonesia hampir sepanjang hari (Kawaroe et al., 2010).
2.5.3 Derajat Keasaman (pH)
Proses fotosintesis yang dilakukan oleh mikroalga berakibat menurunnya kadar CO2 di dalam air. Penurunan kadar karbonsioksida tersebut menyebabkan
2.5.4 Turbulensi/Percampuran/Mixing
Mixing atau proses pengadukan sangat perlu untuk dilakukan agar pengendapan mikroalga tidak terjadi didasar media kultur, agar semua sel mikroalga dalam populasi terpapar oleh cahaya matahari dan nutrien, dan agar meningkatkan pertukaran gas antara medium kultur dengan udara (FAO, 1996). 2.5.5 Salinitas
Salinitas merupakan salah satu faktor yang berpengaruh terhadap pertahanan tekanan osmotik antara intersel dengan lingkungan air sekitar
(Kawaroe et al., 2010). Fitoplankton secara umum dapat menoleransi perubahan salintas yang sangat besar rentangnya. Namun kebanyakan spesies mikroalga tumbuh baik dengan salinitas yang sedikit lebih rendah dari kadar salinitas di lingkungan alami mereka. Rentang salinitas yang paling optimum bagi pertumbuhan mikroalga ialah 20-24 o/
oo (FAO, 1996).
2.5.7 Suhu
Suhu optimal bagi fitoplankton untuk dapat tetap tumbuh selama proses kultivasi ialah antara 20-24 oC, namun nilai ini dapat bervariasi bergantung dari
komposisi media kultur, spesies, dan strain. Spesies mikroalga yang secara umum telah ramai untuk di kultivasi mentolerir suhu antara 16o dan 27 oC. Suhu yang lebih rendah dari 16oC akan menurunkan laju pertumbuhan sedangkan suhu yang lebih besar dari 35oC akan menyebabkan kematian bagi beberapa spesies. Dalam beberapa kondisi, mikroalga dapat didinginkan dengan menggunakan
21
3. METODE PENELITIAN
3.1 Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan pada tanggal 25 Juni 2012- 10 Oktober 2012 di Pusat Penelitian Surfaktan dan Bioenergi, LPPM, Kampus IPB Baranangsiang, Kota Bogor dan Laboratorium Produktivitas Lingkungan, Departemen
Manajemen Sumberdaya Perairan, FPIK, IPB.
3.2 Alat dan Bahan
Alat dan bahan yang digunakan dalam penelitian ini disajikan pada Tabel 2 dan Tabel 3.
Tabel 2. Alat yang digunakan dalam penelitian.
Nama Unit/Ukuran/Satuan Keterangan Fotobioreaktor 1/350/l Dibuat Sebelum Penelitan Open Raceway Pond 1/260/l Dibuat Sebelum Penelitan
Labu erlenmeyer 4/500/ml Pyrex
Labu erlenmeyer 4/1.5/l Pyrex
Gelas Ukur 1/10/ml Pyrex
Gelas Ukur 1/500/ml Pyrex
Gelas Piala 3/100/ml Pyrex
Gelas Piala 6/50/ml Pyrex
Tabung Reaksi 7/- Pyrex
Aerator 1/- RESUN
Water Pump 1/- AQUILLA
Mesin Dinamo 1/- JIAYU MACHINERY
Mesin Pereduksi 1/- GUANGZHOU REDUCER
Neraca Digital 1/- Precisa
Haemacytometer 1/- Neubauer
Hand Counter 1/- -
Refraktometer 1/- ATAGO
Air Conditioner 1/- TCL
Thermometer 1/- -
Botol Sampel Air 12/300/ml -
Tabel 3. Bahan yang digunakan dalam penelitian.
Nama Unit/Ukuran/Satuan Keterangan
Bibit Mikroalga
(Nannochloropsis sp.) 2/1/l Stok Kultur
Pupuk Za, Tsp, Urea 1/1/Kg -
Seal silikon aquarium 1/buah Dextone
Akrilik 2/94 x 182/cm Tebal 3 mm
Akrilik 3 Tebal 5 mm
Bearing 2/No. 25 -
Gear Couple 1 -
3.3 Metode Penelitian
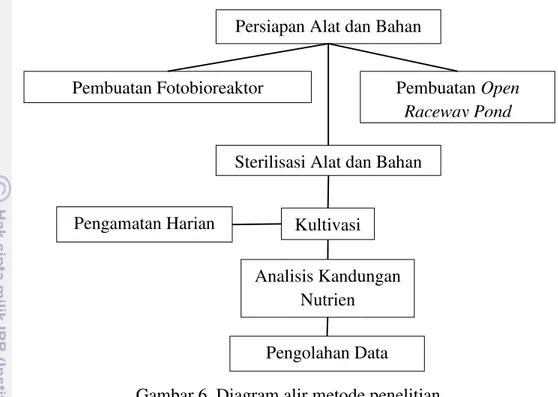
Gambar 6. Diagram alir metode penelitian.
Gambar 6 merupakan diagram alir tahapan-tahapan yang dilakukan selama penelitian berlangsung. Mesin pompa air pada fotobioreaktor maupun mesin dinamo pada kolam arus dinyalakan pada pukul 08.00-16.00. Hal ini dilakukan berdasarkan grafik penyinaran matahari harian di daerah sekitar tempat penelitian oleh Schmidt (1950) dan bertujuan untuk menghemat energi dalam menghasilkan energi (Tredici, 2012). Adapun masing-masing tahapan akan dijelaskan dalam subbab pokok bahasan.
3.3.1 Persiapan Alat Dan Bahan
Tahapan awal yang dilakukan dalam penelitian ini ialah persiapan alat dan bahan. Alat dan bahan yang digunakan serta diperlukan disiapkan secara matang agar penelitian berjalan dengan lancar.
Air laut yang akan digunakan dalam penelitian ini merupakan air laut komersil yang memiliki salinitas 35 o/oo dan terlebih dahulu harus disterilisasikan
Persiapan Alat dan Bahan
Pembuatan Fotobioreaktor Pembuatan Open Raceway Pond
Sterilisasi Alat dan Bahan
Kultivasi Analisis Kandungan
untuk memperkecil keberadaan zat kontaminan maupun mikroorganisme yang terdapat di dalamnya (Isnansetyo dan Kurniastuty, 1995).
Media kultur harus memiliki rentang pH alami air laut, yaitu 7,5-8,5 dan salinitas diupayakan memiliki kadar yang tinggi, yaitu sekitar >30 o/oo yang
diharapkan dapat menciptakan kondisi stress dan dapat menimbulkan percepatan pertumbuhan (stress accelerated growth) (Bosma dan Wijffels, 2003).
3.3.2 Pembuatan Fotobioreaktor dan Open Raceway Pond
Desain yang digunakan dalam pembuatan fotobioreaktor disajikan pada Gambar 7.
Gambar 7. Desain fotobioreaktor.
Pompa ini diletakkan di tengah-tengah dasar fotobioreaktor dengan tujuan untuk membuat arus sirkular di dalam fotobioreaktor.
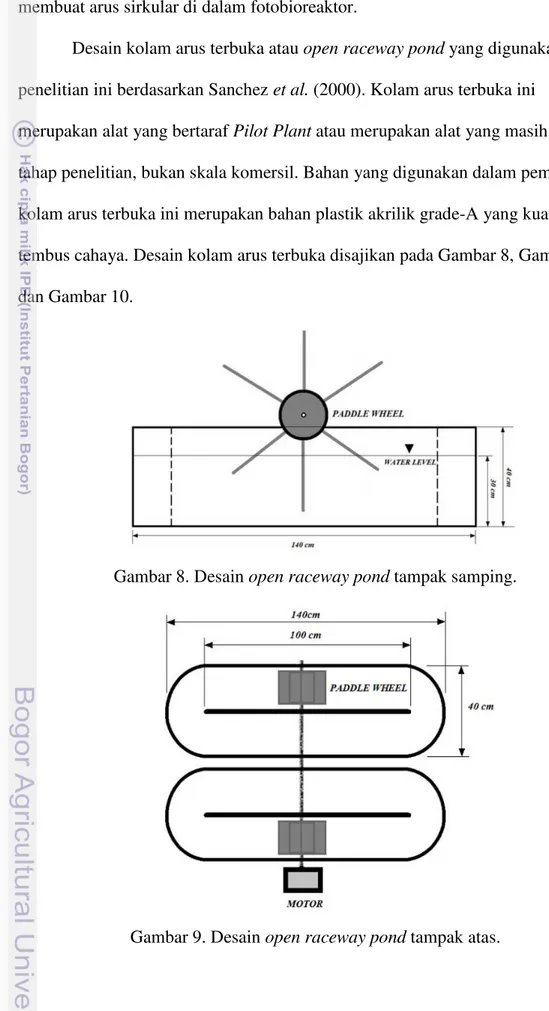
Desain kolam arus terbuka atau open raceway pond yang digunakan dalam penelitian ini berdasarkan Sanchez et al. (2000). Kolam arus terbuka ini
merupakan alat yang bertaraf Pilot Plant atau merupakan alat yang masih dalam tahap penelitian, bukan skala komersil. Bahan yang digunakan dalam pembuatan kolam arus terbuka ini merupakan bahan plastik akrilik grade-A yang kuat dan tembus cahaya. Desain kolam arus terbuka disajikan pada Gambar 8, Gambar 9, dan Gambar 10.
Gambar 8. Desain open raceway pond tampak samping.
Rangka besi (as) yang digunakan sebagai poros dan penyangga pedal air
raceway menggunakan bahan besi dengan diameter 25 mm dan disatukan dengan pelat besi bertebal 0,5 cm dan ditempelkan pelat akrilik. Desain pedal air yang digunakan pada open raceway pond disajikan dalam Gambar 10.
Gambar 10. Desain pedal air.
Gambar 11. Open raceway pond yang telah selesai dibuat.
Fotobioreaktor menggunakan sebuah mesin pompa air konvensional bermerek Aquilla P-3900 keluaran ZHENHUA. Spesifikasi pompa air tersebut disajikan pada Tabel 4.
Penggunaan pompa air tersebut bertujuan untuk menciptakan aliran arus sirkular dari dasar fotobioreaktor menuju permukaan reactor lalu kembali lagi ke dasar reactor. Untuk aerasi fotobioreaktor menggunakan sebuah mesin high blower bermerek resun. Spesifikasi mesin high blower disajikan pada Tabel 4.
Kolam arus terbuka menggunakan sebuah mesin dinamo listrik dan sebuah pereduksi untuk dapat memutar pedal. Mesin dinamo ini memiliki jenis 1-Phase Induction Motor keluaran Jiayu Electrical Machinery Co. Ltd. Spesifikasi alat tersebut disajikan pada Tabel 4.
Tabel 4. Spesifikasi mesin pereduksi.
Mesin Nama Keterangan
Pompa Air Aquilla
Tegangan AC220-240V
Frekuensi 50 Frekuensi
Watt 43
Tinggi Semburan 2.5m
Laju Air Maks. 2800L/h
Airflow 8400L/h 2220GPH
Pressure 0,042Mpa
Air Stone's Max Depth
In Water 4 m
Air Divider Outlet 33
Dinamo
Frekuensi 50 Frekuensi
Bahang 60 oC
3.3.3 Sterilisasi alat dan bahan
bertujuan untuk menghilangkan atau meminimalisir mikroorganisme ataupun zat-zat lainnya yang diduga akan mengganggu jalannya kegiatan penelitian.
Metode sterilisasi alat dan media kultur yang digunakan mengacu kepada Isnansetyo dan Kurniastuty (1995) serta Kawaroe et al. (2010). Ruangan yang akan digunakan sebagai ruangan kultur juga harus disterilisasikan. Hal ini bertujuan untuk menghilangkan zat-zat kontaminan, seperti debu ataupun spora yang dapat mengganggu jalannya penelitian. Ruangan yang akan digunakan disterilisasi dengan menyemprotkan lisol ke udara selama 10 menit agar debu atau spora yang terdapat di dalam ruangan dapat terikat oleh partikel lisol dan jatuh ke permukaan meja dan lantai. Kemudian meja dan lantai dibersihkan dengan menggunakan kain lap yang dibasahi dengan menggunakan alkohol 70% (Kawaroe et al., 2010).
Sterilisasi skala massal dilakukan dengan menggunakan zat kimia berupa kaporit ( Ca(ClO)2) sebanyak 60ppm. Kemudian air laut didiamkan selama satu
malam dan kemudian diberikan tiosulfat (S2O32−) untuk menetralisir sebanyak
20ppm (Kawaroe, 2010). 3.3.4 Kultivasi
Kultivasi mikroalga merupakan salah satu tahapan yang sangat krusial dalam penelitian mengenai bioenergi. Oleh karena itu, proses kultivasi harus dilaksanakan dengan sebaik mungkin. Tahapan dalam kultivasi mikroalga disajikan dalam Gambar 12.
Gambar 12. Diagram alir proses kultivasi mikroalga. (Sumber : Kawaroe et al., 2010)
Kultivasi Skala Laboratorium dan Pemeliharaan Strain Murni
Kultivasi Skala Semi Massal
3.3.4.1Kultivasi Skala Laboratorium dan Pemeliharaan Strain Murni Kultivasi pada skala laboratorium mutlak diperlukan untuk menyediakan bibit mikroalga yang baik untuk dilanjutkan ke dalam tahapan berikutnya. Kultivasi ini dilakukan hingga ukuran 1-5 liter per wadah. Mikroalga yang dikultivasi pada tahapan ini, diberikan pupuk dan diletakkan dibawah lampu TL (1000 lux). Pupuk yang digunakan berbeda untuk setiap spesies. Untuk spesies Nannochloropsis sp. menggunakan pupuk Guillard (f2) berdasarkan Guillard & Ryther (1962). Pupuk tersebut menggunakan konsentrasi 20 tetes/l.
3.3.4.2Kultivasi Skala Semi Massal
Kultvasi ini dilakukan dari volume 5 liter hingga 50 liter. Kultivasi ini dilakukan dengan menggunakan bathup. Kultivan pada tahapan ini juga diberikan pupuk agar menjamin mikroalga dapat tumbuh dengan baik. Kultivan mikroalga yang dilakukan pada tahapan ini mencapai 1/10 dari volume alat kultivasi pada tahapan massal. Pupuk yang digunakan pada tahapan ini, diganti menjadi pupuk teknis yang mengacu pada Balai Budidaya Lampung (BBL) dalam Kawaroe et al.
(2010).
3.3.4.3Kultivasi Skala Massal
Kultivasi massal pada penelitian ini dilakukan dengan menggunakan fotobioreaktor dan open raceway pond (ORP) yang telah dibuat sebelum proses kultivasi berlangsung. Kultivasi ini dilakukan pada volume 260 liter (ORP) dan 350 liter (fotobioreaktor). Kultivasi pada tahapan ini menggunakan pupuk teknis yang mengacu pada BBL (2007) dalam Kawaroe et al. (2010).
3.3.5 Analisis Data
3.3.5.1Perhitungan Laju Pertumbuhan Spesifik
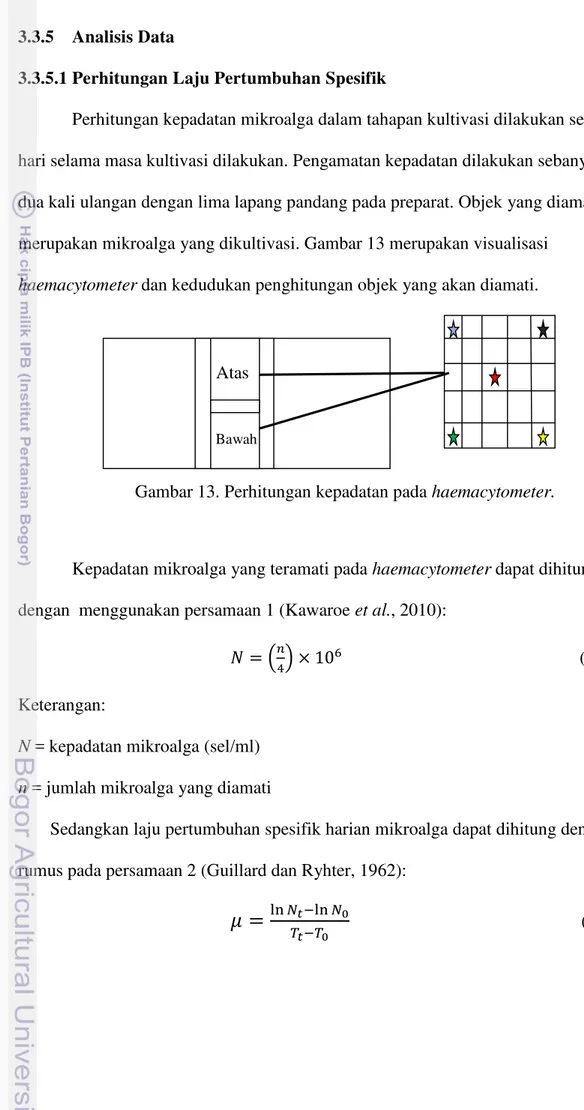
Perhitungan kepadatan mikroalga dalam tahapan kultivasi dilakukan setiap hari selama masa kultivasi dilakukan. Pengamatan kepadatan dilakukan sebanyak dua kali ulangan dengan lima lapang pandang pada preparat. Objek yang diamati merupakan mikroalga yang dikultivasi. Gambar 13 merupakan visualisasi
haemacytometer dan kedudukan penghitungan objek yang akan diamati.
Gambar 13. Perhitungan kepadatan pada haemacytometer.
Kepadatan mikroalga yang teramati pada haemacytometer dapat dihitung dengan menggunakan persamaan 1 (Kawaroe et al., 2010):
� = �4 × 6 (1)
Keterangan:
N = kepadatan mikroalga (sel/ml)
n = jumlah mikroalga yang diamati
Sedangkan laju pertumbuhan spesifik harian mikroalga dapat dihitung dengan rumus pada persamaan 2 (Guillard dan Ryhter, 1962):
� =
��− �0��−�0 (2)
Atas
Keterangan:
�
= laju pertumbuhan spesifikNt = kepadatan mikroalga pada waktu t N0 = kepadatan mikroalga awal
To = waktu awal kultivasi
Tt = waktu pengamatan/akhir kultivasi
3.3.5.2 Perhitungan Bobot Biomassa.
Perhitungan bobot biomassa dilakukan selama setiap hari selama masa pengamatan berlangsung. Metode pengamatan biomassa yang digunakan ialah metode Gravimetri yang disajikan pada Gambar 14.
Kertas saring yang digunakan pada pengamatan menggunakan kertas saring Whatman No. 41 diameter 90 mm. Kertas saring terlebih dahulu dioven pada suhu suhu 60oC ± 3 jam. Hal ini bertujuan untuk menghilangkan uap-uap air yang mungkin terkandung dalam kertas saring. Setelah dioven kemudian
didinginkan dalam desikator selama ±10 menit untuk memastikan benar-benar tidak ada uap-uap air yang terkandung dalam kertas saring benar-benar telah hilang. Lalu kertas saring ditimbang dengan menggunakan neraca analitik digital merek Precisa model XB 220A dan dicatat bobot kosongnya (b0).
Setelah kertas saring digunakan untuk menyaring biomassa mikroalga, kertas sari kembali dioven pada suhu dan waktu yang sama. Setelah dioven, kertas saring tersebut didinginkan di desikator dengan waktu yang sama. Lalu kertas saring kembali ditimbang dan dicatat bobot isinya (b1). Selisih antara b0 dan b1
merupakan bobot biomassa mikroalga (gr/l). Lalu bobot biomassa dimasukkan ke dalam persamaan 3 (Lin et al., 2012).
Biomassa (gr/l) =
−
sa pe (3) dengan:
A = Bobot kertas saring setelah dilakukan penyaringan
B = Bobot kertas saring sebelum dilakukan penyaringan 3.3.5.3 Perhitungan Doubling Time
Doubling time merupakan waktu yang dibutuhkan populasi sel untuk menggandakan dirinya (Madigan dan Martinko (2006) dalam Engström, 2012) dan di ekspresikan dalam satuan hari (Velea et.al, 2011; Devgoswami et.al, 2011).
persamaan laju pertumbuhan spesifik diekpresikan dalam hari, dari � dapat dikonversikan menjadi doubling time per-hari (Tt), dengan membagi nilai
logaritma natural 2 (0,6931) dengan nilai � seperti pada persamaan 4.
Tt = ,693 /� (4)
3.3.5.4Kandungan Nutrien
Sampel media kultivasi mikroalga yang akan dianalisis terlebih dahulu diambil dari dalam media kultivasi sebanyak 200 ml dan dimasukkan ke dalam botol sampel air. Kemudian dimasukkan ke dalam kulkas untuk didinginkan untuk kemudian dianalisis. Sampel air yang akan dianalisis terlebih dahulu disaring dengan menggunakan kertas saring Whatman No. 42 dengan metode penyaringan biasa.
Analisis kandungan nutrient dilakukan pada Laboratorium Produktivitas Lingkungan (ProLing) Departemen Manajemen Sumberdaya Perairan (MSP) FPIK IPB. Metode yang dilakukan telah terstandarisasi secara nasional oleh Lab. Produktivitas Lingkungan.
3.3.5.4.1 Amonia
Kadar amonia dalam air kultivasi mikroalga hasil penyaringan dianalisis dengan menggunakan metode 4500-NH3 F (APHA, 2005) yang disajikan pada
Gambar 15. Diagram alir metode analisis kadar amonia.
Sampel yang sudah disaring dengan menggunakan kertas saring hingga berwarna bening dimasukkan ke dalam erlenmeyer 50 ml sebanyak 25 ml. Kemudian masukkan 1 ml larutan fenol kemudian homogenkan. Setelah itu masukkan 1 ml larutan sodium nitroprusid kemudian homogenkan. Masukkan 1 ml larutan pengoksidasi kemudian homogenkan. Larutan pengoksidasi dibuat dengan mencampurkan larutan alkaline dan sodium hypoklorit 5% dengan komposisi berdasarkan Tabel 5. Larutan pengoksidasi ini harus dibuat setiap kali akan dilakukan analisis amonia.
25 ml Sampel
Erlenmeyer 50 ml 1 ml Lar. Fenol
1 ml Lar. Sodium Nitroprusid & 1 ml Lar. Oksidasi
Homogenisasi
Tutup dengan Parafin film
Biarkan Selama 1 Jam pada Ruangan Gelap Suhu 25-27 oC Masukkan sampel kedalam kuvet
Tabel 5. Komposisi larutan pengoksidasi analisis kandungan amonia.
Setelah semua larutan dimasukkan ke dalam Erlenmeyer sampel, tutup dengan menggunakan Parafin film dan diamkan dalam ruangan gelap selama ± 1 jam dengan suhu 25-27 oC untuk pembentukan warna yang stabil. Lalu kemudian ambil larutan tersebut dan analisis pada spektrofotometer dengan panjang gelombang 640 nm dan catat hasil absorbansinya.
Tabel 6. Nilai absorbansi larutan standar amonia.
Setelah nilai absorbansi dimasukkan ke dalam persamaan regresi linier yang dibuat berdasarkan kurva dari data pada Tabel 5, masukkan kadar hasil pengukuran (C) tersebut ke dalam persamaan 5 untuk mendapatkan kadar amonia (mg N/l).
Kadar amonia (mg N/l) = c x ƒp (5) dengan : c = kadar hasil pengukuran amonia (mg/l)
ƒp = faktor pengenceran 3.3.5.4.2 Nitrat
Gambar 16. Diagram alir metode analisis kadar nitrat.
Air sampel yang sudah disaring dengan hingga bening, dimasukkan ke dalam tabung reaksi sebanyak 5 ml. Siapkan juga larutan blanko yang terbuat dari 5 ml akuades dan dimasukkan ke dalam tabung reaksi. Masukkan larutan brucine sebanyak 0,5 ml ke dalam masing-masing tabung reaksi dan aduk hingga
homogen. Masukkan 5 ml. H2SO4 pekat ke dalam masing-masing tabung reaksi
dan aduk hingga homogen. Setelah masing-masing larutan dalam tabung reaksi homogen, panaskan dalam suhu 160 oC selama ± 30 menit dengan menggunakan
hot plate. Lalu dinginkan dan kemudian masukkan sampel dan blanko ke dalam kuvet untuk dianalisis dalam spektrofotometer dengan panjang gelombang 410 nm dan catat hasil absorbansinya.
Larutan brucine dibuat dengan mencampurkan 250 mg brucine sulfat dan 25 mg sulfanilic acid yang dilarutkan dalam 17,5 ml akuades panas. Lalu
5 ml Sampel
Larutan Blanko dan Sampel dan Tabung reaksi terpisah Masukkan sampel kedalam kuvet
untuk dianalisis di Spektrometer pada panjang gelombang 410nm.
tambahkan ke dalam campuran tersebut 0,75 ml HCl pekat, aduk hingga larut. Biarkan hingga dingin dan encerkan hingga 25 ml dengan menggunakan akuades.
Hasil absorbansi yang telah dicatat kemudian dimasukkan ke dalam persamaan regresi linier kurva larutan standar untuk didapatkan kadar nitrat hasil pengukuran. Tabel larutan standar beserta nilai absorbansinya disajikan pada Tabel 7.
Tabel 7. Nilai absorbansi larutan standar nitrat. Kandungan
Kadar nitrat dalam mg nitrat/l (=ppm NO3-) diukur dengan menggunakan
persamaan 6:
Kadar NO2-N = c x ƒp (6)
dengan: c = kadar hasil pengukuran nitrat (mg/l) ƒp = faktor pengenceran
3.3.5.4.3 Nitrit
Kadar nitrit dalam air kultivasi mikroalga hasil penyaringan dianalisis dengan menggunakan metode 4500 NO2-B (Colorimetric Method) (APHA, 2005)
Gambar 17. Diagram alir metode analisis kadar nitrit.
Sampel air yang tersaring oleh kertas saring hingga bening dimasukkan ke dalam tabung reaksi sebanyak 10 ml. Lalu masukkan 0,4 ml ke dalam tabung reaksi, aduk hingga homogen. Diamkan larutan selama 10 menit – 2 jam hingga pembentukan warna stabil. Setelah warna yang terbentuk stabil, masukkan larutan ke dalam kuvet untuk dianalisis absorbansinya dengan menggunakan
spektrofotometer pada panjang gelombang 543 nm.
Larutan pewarna nitrit dibuat dengan menambahkan 100 ml asam fosfat 85% dan 10 gr sulfanilamide (H2NC6H4SO2NH2) ke dalam 800 ml air suling
bebas nitrit. Setelah pelarutan sulfanilamide sempurna, tambahkan 1 gr N-(1-naphtyil)-ethyelendiamine dihydrocloride (NED Dihidroklorida). Aduk hingga homogen, kemudian encerkan sampai volume 1 liter dengan air suling bebas nitrit.
Setelah nilai absorbansi tercatat, masukkan nilai tersebut ke dalam persamaan regresi linier kurva larutan standar untuk mendapatkan kadar nitrit
10 ml sampel
Masukkan sampel kedalam kuvet dan amati absorbansi pada spektrofotometer dengan
hasil pengukuran. Tabel larutan standar beserta nilai absorbansinya disajikan pada Tabel 8.
Tabel 8. Nilai absorbansi larutan standar nitrit. Kandungan
Nilai kadar nitrit hasil pengukuran yang didapatkan dari persamaan regresi kemudian dimasukkan ke dalam persamaan 7 untuk mendapatkan kadar NO2-N.
Kadar NO2-N = c x ƒp (7)
dengan: c = kadar hasil pengukuran nitrit (mg/l) ƒp = faktor pengenceran
3.3.5.4.4 Ortofosfat
Gambar 18. Diagram alir metode analisis kadar ortofosfat.
Sampel air yang telah disaring hingga berwarna bening dimasukkan ke dalam gelas piala sebanyak 35 ml. Lalu masukkan 1 ml larutan Campuran ke dalam gelas piala dan aduk hingga homogen. Masukkan 1 ml asam askorbat ke dalam gelas piala dan aduk hingga homogen. Tunggu selama 15 menit lalu ukur absorbansinya dengan menggunakan spektrofotometer dengan panjang gelombang 880 nm.
Larutan campuran dapat dibuat dengan mencampurkan tiga buah larutan, yaitu larutan Amonium molibdate, H2SO4, dan kalium Antimonil Tartrat. Larutan
Amonium molibdate (1) dapat dibuat dengan cara campurkan 9.5 gr ammonium heptamolibdate tetrahydrate (a.g.) (NH4)6MO7O24 . 4H20 ke dalam 90 ml akuades
kemudian diencerkan hingga 100 ml. Larutan H2SO4 (9N) (2) dapat dibuat dengan
mencampurkan 250 ml H2SO4 pekat ke dalam 750 ml akuades. Larutan kalium
antimonil tartat (3) dapat dibuat dengan mencampurkan 3.25 gr kalium antimonil tartrat (a.g.) K(SbO)C6H4O6 ke dalam 100 ml akuades dan disimpan ke dalam
Masukkan sampel kedalam kuvet dan amati absorbansi pada spektrofotometer dengan
botol kaca. Larutan campuran dibuat dengan perbandingan antara larutan 1,2 dan 3 untuk 250 ml larutan campuran ialah 45 ml larutan 1 ditambah dengan 200 ml larutan 2 dan ditambah lagi dengan 5 ml larutan 3.Larutan asam askorbat yang digunakan dapat dibuat dengan mencampurkan 7 gr asam askorbat (a.g.) ke dalam 100 ml akuades dan disimpan di dalam botol gelas amber dan simpan ke dalam refrigerator.
Setelah nilai absorbansi tercatat, masukkan nilai tersebut ke dalam
persamaan regresi linier kurva larutan standar untuk mendapatkan kadar ortofosfat hasil pengukuran. Tabel larutan standar beserta nilai absorbansinya dapat dilihat pada Tabel 9 berikut ini.
Tabel 9. Nilai absorbansi larutan standar ortofosfat. Kandungan
Kadar P-PO4 = c x ƒp (8)
dengan: c = kadar hasil pengukuran ortofosfat (mg/l) ƒp = faktor pengenceran
3.3.5.5Analisis Statistika
Hasil penelitian ini diuji secara statistik untuk mengetahui pengaruh perbedaan tiap kelompok sistem dengan parameter yang diamati. Analisis sidik ragam yang digunakan yaitu metode rancangan acak kelompok (Matjik dan Sumertajaya, 2006).
Yij = a +
τ
i+β
i +є
ij (9)Keterangan
Yij = nilai pengamatan pada perlakuan ke-i, kelompok ke-j a = rataan umum populasi
τi = pengaruh perlakuan pengamatan
βj = pengaruh perlakuan sistem
Єij = galat percobaan
Hipotesis yang dapat diuji dari rancangan penelitian yang dilakukan ilah sebagai berikut.
H0: β1 = 0 = Perbedaan sistem tidak berpengaruh terhadap respons
yang diamati
H1: β1 ≠ 0 = Perbedaan sistem berpengaruh terhadap respons yang
diamati
45
Fotobioreaktor menggunakan bahan kaca transparan dengan tebal kaca 5 mm. Penggunaan bahan dasar kaca bertujuan untuk dapat menunjang proses fotosintesis. Cahaya pada fotobioreaktor berperan dominan, sebagaimana dalam Das (2011) yang menyebutkan bahwa penetrasi cahaya dan daya tembus pandang dari bahan mempengaruhi performa fotobioreaktor. Cahaya yang memasuki fotobioreaktor menurut Luo (2005) akan berkurang intensitasnya secara
ekponensial dari permukaan menuju inti reaktor, hal tersebut akan menimbulkan adanya zona gelap pada inti reaktor dan zona terang pada permukaan reaktor.
Arus sirkular bergerak dari dasar fotobioreaktor menuju permukaan lalu kembali lagi ke dasar dan seterusnya diiringi oleh butir-butir udara yang
Gambar 19. Tampilan sederhana arus sirkular di dalam fotobioreaktor.
Daerah terang seperti yang terdapat dalam Gambar 19 merupakan suatu daerah dimana daerah tersebut terpapar oleh cahaya sinar matahari, atau disebut zona fotik atau zona terang. Daerah bagian dalam yang tidak terkena cahaya matahari disebut zona gelap. Perpindahan sel mikroalga dari zona terang ke zona gelap disebut siklus terang-gelap (Janssen, 2002). Apabila siklus tersebut terjadi dalam rentang waktu yang sangat pendek 20µs sampai 1 s, maka akan tercipta sebuah kondisi yang bernama flashing effects atau efek kedip (Kok, 1953; Phillips dan Myers, 1954; dan Terry, 1986).
agar memudahkan pengamat dalam memperoleh data. Putaran yang dimiliki mesin dinamo terlalu cepat sehingga harus direduksi dengan menggunakan mesin pereduksi agar putaran yang dihasilkan oleh mesin dinamo menjadi lebih lambat. Putaran yang dihasilkan oleh mesin dinamo setelah direduksi ialah sebesar 23.5 rpm. Pedal yang digunakan dalam pengoperasian open raceway pond, berputar dengan putaran yang sama.
Kedalaman yang digunakan selama waktu kultivasi sebesar 25 cm.
Kedalaman tersebut berada dalam batas normal pengoperasian open raceway pond
yang menurut Norsker et al., (2011) dan Masojidek et al., (2011) kedalaman kolam arus terbuka tidak lebih dalam dari 20-30 cm. Saat open raceway beroperasi, aliran arusnya akan memiliki arah seperti Gambar 20.
Gambar 20. Arah aliran arus pada kolam raceway.
dari berputarnya pedal air pada sisi bagian dalam open raceway pond. Arus inilah yang menyebabkan pengadukan dalam media kultur mikroalga di dalamnya.
4. 2 Parameter Fisika dan Kimia
Parameter fisika perairan yang diamati selama proses kultivasi berlangsung ialah suhu, salinitas, dan derajat keasaman (pH), sedangkan parameter kimia yang diamati ialah ammonia, nitrit, nitrat, dan ortofosfat. 4.2.1 Suhu
Nilai suhu yang teramati selama proses kultivasi mikroalga pada fotobioreaktor dan open raceway pond tersaji pada Gambar 21.
Gambar 21. Grafik nilai suhu media kultivasi mikroalga pada fotobioreaktor dan
open raceway pond.
Berdasarkan Gambar 21, suhu selama pengamatan keseluruhan berkisar antara 24 - 30 oC. Nilai suhu yang teramati pada fotobioreaktor selama kultivasi berkisar antara 28 – 30 oC. Nilai suhu di awal kultivasi berada pada nilai 28 oC lalu meningkat dan fluktuasi hingga mencapai 30 oC pada akhir masa kultivasi.
Nilai suhu yang teramati pada open raceway pond selama kultivasi berkisar pada 24 - 25 oC. Nilai suhu di awal kultivasi berada pada nilai 25 oC lalu menurun menjadi 24 oC dan pada hari ke-5 hingga akhir berada pada nilai 25 oC.
Nilai suhu tertinggi yang teramati selama masa kultivasi pada kedua sistem ialah sebesar 30 oC yang terjadi pada hari ke-3 hingga hari ke-6, hari ke-8, dan hari ke-10 pada kultivasi di fotobioreaktor. Suhu terendah teramati pada hari ke 1-4 pada kultivadi di open raceway pond, yaitu sebesar 24 oC.
Berdasarkan hasil pengamatan yang telah didapat dari proses kultivasi pada kedua sistem, fotobioreaktor dan open raceway pond, terlihat bahwa masing-masing parameter fisika yang teramati memiliki perbedaan dari awal kultivasi hingga akhir. Secara keseluruhan, pada fotobioreaktor media kultur memiliki nilai suhu yang lebih tinggi dari nilai suhu pada media kultur yang terdapat di open raceway pond. Hal ini terjadi karena fotobioreaktor merupakan sebuah sistem kultivasi massal yang tertutup (Behrens, 2005; Ojamae, 2011; Luo, 2005) sehingga meminimalisir terjadinya pertukaran suhu di dalam fotobioreaktor dengan suhu lingkungan sekitar. Sedangkan open raceway pond merupakan suatu sistem kultivasi yang terbuka (Quinn, 2011; Luo, 2005) sehingga terjadi regulasi atau pertukaran suhu dari lingkungan dengan media kultivasi (Quinn, 2011) sehingga nilai suhu pada media kultur terlihat lebih stabil.
4.2.2 Salinitas
Gambar 22. Grafik nilai salinitas media kultivasi mikroalga pada fotobioreaktor dan open raceway pond.
Berdasarkan Gambar 22, terlihat bahwa nilai salinitas yang teramati selama kultivasi berlangsung secara keseluruhan berkisar antara 31 - 42 ‰. Nilai salinitas yang teramati selama kultivasi pada fotobioreaktor berkisa antara 31 – 32
‰. Nilai salinitas pada media fotobioreaktor di awal kultivasi sebesar 31 ‰ lalu meningkat menjadi 32 ‰ pada hari akhir kultivasi. Nilai salinitas yang teramati pada open raceway pond berkisar antara 32 – 42 ‰ . Nilai salinitas yang teramati pada awal kultivasi di open raceway pond sebesar 32‰lalu meningkat hingga pada akhir kultivasi mencapai 42‰.
Nilai salinitas tertinggi diperoleh pada pengamatan hari ke-9 dan ke-10 pada kultivasi di open raceway pond, yaitu sebesar 42‰. Nilai salinitas terendah terdapat pada pengamatan hari ke-0 dan ke-5 pada kultivasi di fotobioreaktor, yaitu sebesar 31‰.
Berdasarkan masing-masing grafik pengamatan salinitas di atas, terlihat bahwa nilai salinitas media kultivasi pada masing-masing sistem berbeda. Nilai
salinitas pada open raceway pond memiliki nilai salinitas yang lebih tinggi bila dibandingkan dengan nilai salinitas yang terdapat pada fotobioreaktor. Hal ini diduga terjadi karena open raceway pond merupakan sebuah sistem yang terbuka, terpapar langsung dengan lingkungan (Quinn, 2011; Luo,2005) sehingga terjadi penguapan yang dapat meningkatkan nilai salinitas (Quinn, 2011; Borowitzka, 2005).
4.2.3 Derajat Keasaman (pH)
Nilai derajat keasaman (pH) yang teramati selama proses kultivasi mikroalga pada fotobioreaktor tersaji pada Gambar 23.
Gambar 23. Grafik nilai pH media kultivasi mikroalga pada fotobioreaktor dan
open raceway pond.
Berdasarkan Gambar 23, nilai pH selama kultivasi secara umum berkisar antara 8,5 – 10. Nilai pH yang teramati pada kultivasi di fotobioreaktor berkisar antara 8,7 – 10. Nilai pH pada awal kultivasi di fotobioreaktor sebesar 8,7 lalu perlahan meningkat mencapai nilai 10 pada hari ke-5 dan kemudian kembali menurun dan tetap pada nilai 9,9 pada hari ke-6 hingga akhir. Nilai pH yang
teramati pada kultivasi di open raceway pond berkisar antara 8,5 – 9,7. Nilai pH pada awal kultivasi di open raceway pond sebesar 8,5 lalu meningkat secara perlahan hingga mencapai 9,7 pada akhir kultivasi. Nilai pH pada kultivasi di fotobioreaktor mencapai nilai 10 pada hari kultivasi ke-5 dan ke-6. Nilai pH tertinggi terdapat pada hari ke-5 dan ke-6 kultivasi di fotobioreaktor, yaitu sebesar 10. Nilai pH terendah terdapat pada hari ke-0 kultivasi di open raceway pond
dengan nilai sebesar 8,5.
Nilai pH meningkat dari awal kultivasi hingga akhir proses kultivasi pada fotobioreaktor dan open raceway pond. Hal ini diduga diakibatkan oleh proses fotosintesis yang dilakukan oleh mikroalga berakibat menurunnya kadar CO2 di
dalam air. Penurunan kadar karbonsioksida tersebut menyebabkan terjadinya peningkatan pH (Kawaroe et al., 2010).
4.2.4 Amonia
Nilai kadar amonia yang teramati selama selang waktu pengamatan pada fotobioreaktor dan open raceway pond tersaji pada Gambar 24.
Gambar 24. Grafik nilai kandungan kadar amonia media kultivasi mikroalga pada fotobioreaktor dan open raceway pond..
Berdasarkan Gambar 24, nilai kandungan amonia secara keseluruhan menurun dari awal kultivasi hingga akhir. Hasil pengamatan pada kultivasi di fotobioreaktor, kadar amonia menurun dari 5,66 mg/l menjadi 4,85 mg/l. Hasil pengamatan pada kultivasi di open raceway pond, kadar amonia menurun dari 5,39 mg/l menjadi 1,31 mg/l. Nilai kadar amonia tertinggi terdapat pada hari ke-0 pada kultivasi di fotobioreaktor, yatu sebesar 5,66 mg/l. Nilai kadar amonia terendah terdapat pada hari ke-10 pada kultivasi di open raceway pond, yaitu sebesar 1,31 mg/l.
Nilai kadar amonia selama kultivasi di kedua sistem telihat menurun dari hari kultivasi awal menuju akhir kultivasi. Nilai kadar amonia pada hari awal bernilai tinggi, hal ini dikarenakan pada hari tersebut terjadi pemasukan pupuk urea sebagai pemberian nutrien di awal. Nilai kadar amonia menurun dikarenakan senyawa tersebut telah mengalami proses perubahan menjadi nitrit dan nitrat melalui proses amonifikasi. Hal tersebut sesuai dengan pernyataan Effendi (2003) bahwa nilai amonia pun menurun karena terjadinya tekanan parsial dengan semakin meningkatnya nilai pH.
Nilai amonia hari ke-4 hingga hari ke-7 pada open raceway pond dan hari ke-7 hingga hari ke-10 pada fotobioreaktor mengalami peningkatan. Peningkatan nilai kadar amonia tersebut diduga karena sel mikroalga yang mati dan terurai sehingga mengingkatkan kadar N organik dalam perairan dan seiring dengan proses amonifikasi yang terjadi, kadar amonia dalam media kultur pun bertambah. Hal ini sesuai dengan penyataan Effendi (2003), bahwa salah satu sumber
Kadar amonia pada open raceway pond selama kultivasi mengalami penurunan yang lebih besar bila dibandingkan dengan fotobioreaktor. Hal ini diduga akibat pengaruh dari cara kerja sistem. Pada sistem terbuka di open raceway pond, penguapan lebih rentan terjadi bila dibandingkan dengan fotobioreaktor dengan sistem tertutupnya. Menurut (Effendi, 2003) penguapan merupakan salah satu penyebab berkurangnya kadar amonia di dalam perairan. 4.2.5 Nitrit
Nilai kadar nitrit yang teramati selama selang waktu pengamatan pada fotobioreaktor dan open raceway pond tersaji pada Gambar 25.
Gambar 25. Grafik nilai kandungan kadar nitrit media kultivasi pada fotobioreaktor dan open raceway pond.
Berdasarkan Gambar 25, nilai kandungan nitrit secara keseluruhan meningkat dari awal kultivasi hingga akhir. Hasil pengamatan pada kultivasi di fotobioreaktor, kadar nitrit meningkat dari 0,012 mg/l menjadi 0,165 mg/l. Hasil pengamatan pada kultivasi di open raceway pond, kadar nitrit meningkat dari
0,007 mg/l menjadi 0,245 mg/l. Kadar nitrit mengalami kenaikan yang cukup signifikan pada hari ke-4 menuju hari ke-7 kultivasi di open raceway pond.
Nitrit merupakan bentuk peralihan antara amonia dan nitrat dalam proses nitrifikasi (Effendi, 2003). Sehingga terlihat bahwa pada hari 0 menuju hari ke-4 merupakan saat dimana terjadinya proses amonifikasi, yaitu ditandai dengan bertambahnya kadar nitrit di media kultur pada termin kultivasi tersebut. Hari ke-7 menuju ke hari ke-10 merupakan waktu dimana terjadinya proses nitrifikasi terjadi, hal ini ditandai dengan berkurangnya kadar nitrit di media kultivasi dan berubah menjadi nitrat.
Keberadaan nitrit tidak stabil dengan adanya kadar oksigen dalam perairan (Effendi, 2003). Terlihat pada grafik bahwa nilai kadar nitrit pada media kultur bersifat tidak stabil. Hal ini menandakan bahwa baik itu fotobioreaktor maupun
open raceway pond, sama-sama mampu mengaerasi media kultur dengan baik. 4.2.6 Nitrat
Nilai kadar nitrat yang teramati selama selang waktu pengamatan pada fotobioreaktor dan open raceway pond tersaji pada Gambar 26.
Gambar 26. Grafik nilai kandungan kadar nitrat media kultivasi mikroalga pada fotobioreaktor dan open raceway pond.
Berdasarkan Gambar 26, kadar nitrat mengalami perubahan selama kultivasi berlangsung. Hasil pengamatan pada kultivasi di fotobioreaktor, kadar nitrat di media kultivasi mikroalga meningkat dari 0,010 mg/l menjadi 0,285 mg/l. Hasil pengamatan pada kultivasi di open raceway pond, kadar nitrat di media kultivasi mikroalga meningkat dari 0,061 mg/l menjadi 0,306 mg/l. Secara keseluruhan kadar nitrat meningkat selama proses kultivasi dilakukan.
Kadar nitrat yang teramati pada hari ke-0 diduga merupakan kadar nitrat yang terkandung dalam air laut dan bibit mikroalga. Kadar nitrit pada hari ke-4 mengalami peningkatan, hal ini diduga diakibatkan oleh adanya proses nitrifikasi yang terjadi pada kedua sistem. Kadar nitrat pada hari ke-4 menuju hari ke-7 mengalami penurunan, hal ini diduga terjadi karena nitrat dimanfaatkan oleh sel mikroalga sebagai nutrien untuk tumbuh. Karena nitrat merupakan bentuk utama nitrogen yang berada di perairan dan merupakan sumber nutrien utama bagi pertumbuhan tanaman dan alga (Effendi, 2003). Kadar nitrat pada hari ke-7 menuju hari ke-10 mengalami peningkatan. Hal ini diduga terjadi karena nitrit yang telah terbentuk di waktu sebelumnya kembali diubah menjadi nitrat oleh proses nitrifikasi yang terjadi. Pada saat ini, diduga nitrat tetap dimanfaatkan oleh sel mikroalga, namun mengalami penambahan dari proses nitrifikasi yang masih terjadi, sehingga kadarnya menjadi meningkat.
4.2.7 Ortofosfat
Gambar 27. Grafik nilai kandungan kadar ortofosfat media kultivasi mikroalga pada fotobioreaktor dan open raceway pond.
Berdasarkan Gambar 27, kadar ortofosfat berubah selama kultivasi berlangsung. Hasil pengamatan kadar ortofosfat pada kultivasi di fotobioreaktor, menurun dari 0,219 mg/l menjadi 0,154 mg/l. Hasil pengamatan kadar ortofosfat pada kultivasi di open raceway pond, meningkat dari 0,242 mg/l menjadi 0,723 mg/l.
Peningkatan nilai ortofosfat pada open raceway pond diduga karena pupuk TSP yang digunakan dan dimasukkan ke dalam media kultur, belum sepenuhnya terlarut, masih berupa bulatan-bulatan, sehingga pelarutan pupuk berjalan lambat. Kadar ortofosfat yang semakin menurun menurut (Effendi, 2003) diakibatkan oleh dimanfaatkannya ortofosfat oleh mikroalga sebagai unsur yang essensial bagi pertumbuhan. Ortofosfat juga menjadi unsur yang merupakan faktor pembatas bagi tumbuhan maupun alga. Menurut Boney (1989), keberadaan fosfor secara berlebih yang disertai dengan keberadaan nitrogen akan menyebabkan blooming