PENGARUH MACAM, pH, DAN PENGGOYANGAN MEDIA
TERHADAP PERTUMBUHAN CENDAWAN Rhizoctonia sp.
Oleh
RIDHO PRATOMO E01499114
PROGRAM STUDI BUDIDAYA HUTAN
FAKULTAS KEHUTANAN
Media Terhadap Pertumbuhan Cendawan Rhizoctonia sp. Dibimbing oleh ACHMAD.
Salah satu kendala yang dihadapi sebuah pesemaian adalah penyakit hawar daun (Blight). Penyakit ini menyerang beberapa jenis bibit pada pesemaian Perhutani Pongpoklandak di Cianjur, Perum Perhutani Unit III Jawa Barat. Hasil identifikasi sampai tingkat genus di laboratorium menunjukkan spesies cendawan tersebut adalah Rhizoctonia sp. yaitu patogen lodoh yang berbahaya bagi pesemaian. Upaya-upaya pengendalian penyakit banyak diteliti dan dilakukan, berupa pengendalian secara fisik, kimiawi maupun secara biologi. Bagaimana cara menekan populasi patogen secara efektif masih perlu dipelajari untuk tiap jenis patogen.
Penelitian ini bertujuan untuk mengkaji media tumbuh in vitro yang memberikan kondisi terbaik atau merugikan terhadap pertumbuhan cendawan
Rhizoctonia sp. Selain itu untuk mengetahui pengaruh faktor fisik/lingkungan (in vitro), meliputi: 1) sumber karbon (nutrisi/karbohidrat) yang memberikan pertumbuhan terbaik bagi Rhizoctonia sp., 2) mengetahui toleransi terhadap derajat kemasaman dan menentukan selang pH untuk pertumbuhan optimum
Rhizoctonia sp., serta 3) untuk mengetahui pengaruh penggoyangan media terhadap pertumbuhan cendawan Rhizoctonia sp.
Penelitian ini dilaksanakan di Laboratorium Bioteknologi Kehutanan dan Laboratorium Rekayasa Bioproses PAU Bioteknologi Institut Pertanian Bogor, dalam jangka waktu Oktober 2003-Februari 2004. Objek yang digunakan adalah biakan murni Rhizoctonia sp., spiritus, alkohol 70%, NaOH 1%, HCl 1%, aquades, media PDA (Potato Dextrose Agar), media PSA (Potato Sucrose Agar), media PDL (Potato Dextrose Liquid) dan PSL (Potato Sucrose Liquid). Peralatan yang digunakan meliputi, erlenmeyer, boks isolasi (Laminar Air Flow), bunsen, cawan petri, otoclaf, shaker, cork borer, alumunium foil, plastic wrap, jarum ose, kertas saring, oven, timbangan analitik, mikroskop, gelas preparat dan penutup, kamera focus, pH meter, alat titrasi, serta software pengolah data.
Dalam penelitian ini untuk analisis respon bobot kering koloni miselia isolat Rhizoctonia sp. terhadap pengaruh faktor medium, penggoyangan media dan pH, rancangan percobaan yang digunakan adalah Rancangan Faktorial Tiga Faktor dalam Rancangan Acak Lengkap (RAL). Penelitian dilakukan dengan melihat pengaruh beberapa larutan media (PDL dan PSL), penggoyangan media (Dishaker dan diam) dan beberapa taraf pH (2, 4, 6, 8, 10, 12), serta interaksinya. Setiap perlakuan diulang lima kali, dan setiap ulangan merupakan isolat
Rhizoctonia sp. yang dibiakkan dalam media cair pada sebuah erlenmeyer.
(PDA dan PSA) dan beberapa taraf pH (2, 4, 6, 8, 10, 12), serta interaksinya. Setiap perlakuan diulang lima kali, dan setiap ulangan merupakan isolat
Rhizoctonia sp. yang dibiakkan dalam sebuah cawan petri.Pengamatan dilakukan tiap 24 jam selama tiga hari, dengan mengukur diameter koloni (cm).
Hasil pengamatan pengukuran pertumbuhan biomassa miselia cendawan
Rhizoctonia sp. dengan bobot miselia terbesar yaitu kombinasi perlakuan media PDL diam, pH 8 sebesar 0.365 g, sedangkan biomassa terendah terdapat pada kombinasi perlakuan media pada pH 2 (sangat asam), 10 dan 12 (sangat basa/alkali) sebesar 0.004 g (≈ 0), yang menunjukkan pertumbuhan miselia yang sangat terhambat. Berdasarkan sidik ragam, faktor tunggal macam media, penggoyangan dan derajat kemasaman, berpengaruh sangat nyata terhadap pertumbuhan Rhizoctonia sp. Interaksi faktor macam media dengan faktor derajat kemasaman media, serta interaksi faktor perlakuan penggoyangan media dengan faktor derajat kemasaman media memberikan pengaruh yang sangat nyata terhadap pertumbuhan Rhizoctonia sp. Interaksi faktor macam media dengan faktor perlakuan penggoyangan media serta interaksi ketiga faktor memberikan pengaruh yang nyata terhadap pertumbuhan Rhizoctonia sp. Pada media agar pertumbuhan terbaik pada pH 8, dan mengalami hambatan pertumbuhan pada pH 2, 10 dan 12 yang merupakan pH ekstrim bagi organisme pada umumnya. Berdasarkan hasil sidik ragam, pengaruh tunggal macam media dan derajat kemasaman, serta interaksi kedua faktor sangat nyata terhadap pertumbuhan koloni Rhizoctonia sp.
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan pada Fakultas Kehutanan Institut Pertanian Bogor
Oleh:
Ridho Pratomo E01499114
PROGRAM STUDI BUDIDAYA HUTAN
FAKULTAS KEHUTANAN
Judul Penelitian : PENGARUH MACAM, pH, DAN PENGGOYANGAN MEDIA TERHADAP PERTUMBUHAN CENDAWAN Rhizoctonia sp.
Nama : Ridho Pratomo NRP : E 01499114
Menyetujui, Dosen Pembimbing
(Dr. Ir. Achmad, MS.) NIP : 131 760 842
Mengetahui, Dekan Fakultas Kehutanan
(Prof. Dr. Cecep Kusmana, MS.) NIP : 131 430 799
Penulis dilahirkan di Bogor pada tanggal 3 Maret 1981, sebagai anak pertama dari dua bersaudara pasangan Heru Pitoyo dan Teti Rosyati.
Penulis memulai pendidikan formal pada tahun 1987, ketika masuk SDN II Kedunghalang Bogor dan lulus pada tahun 1993. Kemudian melanjutkan ke SMPN V Bogor dan lulus pada tahun 1996. Pada tahun yang sama penulis melanjutkan ke SMUN III Bogor dan lulus pada tahun 1999. Pada tahun 1999 penulis diterima menjadi mahasiswa Institut Pertanian Bogor melalui Program Undangan Masuk Perguruan Tinggi Negeri (UMPTN) Departemen Manajemen Hutan, Fakultas Kehutanan. Tahun 2002, penulis memilih sub Progam Patologi Hutan sebagai spesifikasi keilmuannya.
Selama melakukan kegiatan akademik, penulis telah melakukan kegiatan Praktek Pengenalan dan Pengelolaan Hutan (P3H) pada tahun 2002 yang terdiri
dari Praktek Umum Kehutanan (PUK) yang dilaksanakan di Kesatuan Pemangkuan Hutan (KPH) Banyumas Timur dan KPH Banyumas Barat, serta Praktek Umum Pengelolaan Hutan (PUPH) yang dilaksanakan di KPH Ngawi. Selain itu, penulis juga telah melaksanakan kegiatan Praktek Kerja Lapang (PKL) di PT. Musi Hutan Persada di Propinsi Sumatra Selatan pada tahun 2003.
Selama melaksanakan pendidikan, penulis aktif mengikuti organisasi kemahasiswaan. Pada tahun 2000-2002 penulis aktif di AFSA (Asean Forestry Student’s Association). Selain itu penulis pernah menjadi asisten untuk mata kuliah Klimatologi dan Silvikultur.
i
PRAKATA
Bismillahirrahmanirrahiim,
Alhamdulillah, puji dan syukur penulis panjatkan ke hadirat Illahi Rabbi, yang telah memberikan kemudahan-kemudahan dan segala nikmat-Nya, selama dan setelah penelitian sehingga skripsi ini dapat diselesaikan.
Dalam Karya ilmiah dengan judul “Pengaruh Macam, pH, dan Penggoyangan Media terhadap Pertumbuhan Cendawan Rhizoctonia sp.”, penulis berusaha memaparkan pengaruh beberapa faktor lingkungan/fisik terhadap pertumbuhan cendawan Rhizoctonia sp. Penelitian dilakukan selama 6 bulan, sejak bulan Oktober 2003.
Atas selesainya karya ilmiah ini, penulis mengucapkan terima kasih yang sebesar-besarnya kepada pihak-pihak yang banyak membantu penulis dalam menyelesaikan skripsi ini
1. Bapak dan Ibu yang terus memberikan dukungan moril dan materiil serta doa dan kasih sayang selama ini, dan Ririn adikku tersayang.
2. Dr. Ir. Achmad, MS. yang telah membimbing penulis dalam karya ini. 3. Ir. Trisna Priadi, M.Eng.Sci. sebagai dosen penguji dari Departemen THH
dan Ir. Edhi Sandra, Msi. sebagai dosen penguji dari Departemen KSH. 4. Ibu Ir. Elis Nina Herliyana, Msi., Ibu Tutin BScF. atas segala bantuannya. 5. Mbak Pepi dan Teh Ani, laboran PAU IPB, tempat penulis penelitian. 6. Eny teman seperjuanganku selama ini, dan para rekan Fakultas Kehutanan
terutama MNH’36 atas persahabatan, bantuan dan dukungan.
7. Anak2 Prog Metal ” SEQUENCE ” Amar, Ipay, Dani, Doni Manyun.
My X-Keyboardis Anne Nelistya, U’re My Inspiration...”Keep on Rockin” 8. Serta kepada para sahabat dan semua pihak yang tak dapat disebut satu
demi satu.
Penulis menyadari bahwa karya ilmiah ini jauh dari sempurna. Akhir kata, semoga karya kecil ini dapat memberikan manfaat bagi pembaca dan bagi dunia ilmu pengetahuan.
Bogor, Februari 2006
DAFTAR ISI
Halaman
PRAKATA ... i
DAFTAR ISI ... ii
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
DAFTAR LAMPIRAN ... vi
I. PENDAHULUAN A. Latar Belakang Penelitian ... 1
B. Tujuan Penelitian ... 2
C. Hipotesis ... 2
II. TINJAUAN PUSTAKA A. Cendawan Rhizoctonia sp. ... 3
1.Klasifikasi Cendawan Rhizoctonia sp ... 3
2.Karakteristik Cendawan Rhizoctonia sp. ... 5
3.Habitat Cendawan Rhizoctonia sp. ... 6
B. Faktor-faktor yang Mempengaruhi Pertumbuhan Cendawan ... 6
C. Media Kultur ... 8
1. Media Biakan ... 8
2. Kebutuhan Cendawan ... 9
3. Susunan Media ... 10
D. Derajat Kemasaman ... 11
E. Karbohidrat ... 11
III. BAHAN DAN METODE A. Waktu dan Tempat Penelitian ... 13
B. Bahan dan Alat ... 13
C. Metode Penelitian ... 13
1. Persiapan ... 13
2. Tahap Pelaksanaan ... . 14
iii
b. Uji Respon Biomassa Miselia ... 15
c. Uji Respon Diameter Koloni Miselia ... 16
3. Dokumentasi Preparat ... 18
4. Analisis Stasistik ... 18
IV. HASIL DAN PEMBAHASAN A. Hasil ... 21
1. Pertumbuhan Miselia cendawan Rhizoctonia sp. ... 21
2. Pertumbuhan Miselia Koloni cendawan Rhizoctonia sp. ... 25
3. Struktur Miselia Cendawan Rhizoctonia sp ... 29
B. Pembahasan ... 30
1. Pengaruh Macam Media terhadap Pertumbuhan Miselia Rhizoctonia sp ... 31
2. Pengaruh pH Media terhadap Pertumbuhan Miselia Rhizoctonia sp.... 32
3. Pengaruh Penggoyangan Media terhadap Pertumbuhan Miselia Rhizoctonia sp. ... 35
4. Struktur Miselia Rhizoctonia sp. ... 37
V. KESIMPULAN DAN SARAN A. Kesimpulan ... 40
B. Saran ... 40
DAFTAR PUSTAKA ... 41
DAFTAR TABEL
Halaman
1 Kombinasi Perlakuan Percobaan Respon Pertumbuhan
Biomassa Miselia Cendawan Rhizoctonia sp. ... 15 2 Kombinasi Perlakuan Percobaan Respon Pertambahan
Diameter Koloni Rhizoctonia sp. ... 17 3 Rata-Rata Bobot Kering Miselia Rhizoctonia sp. pada Perlakuan
Kombinasi Ketiga Faktor ..………...………... 22 4 Pertumbuhan Koloni Rhizoctonia sp. pada Media PDA dan PSA ... 25
5 Pertumbuhan Koloni Rhizoctonia sp. pada beberapa
Tingkat pH Media ... 26 6. Pertumbuhan Koloni Rhizoctonia sp. pada Berbagai
v
DAFTAR GAMBAR
Halaman
1 Metode Pengukuran Diameter Koloni Miselia Rhizoctonia sp. ... 16 2 Biakan Isolat Cendawan Rhizoctonia sp. pada Kombinasi Perlakuan
Macam, Penggoyangan, dan pH Media Selama 4 Hari. ... 21 3 Bobot Kering Miselia Rhizoctonia sp. pada Beberapa Kombinasi
Macam, Penggoyangan, dan pH Media ... 23 4 Bobot Kering Miselia Rhizoctonia sp. pada Faktor Tunggal Macam,
Penggoyangan, dan pH Media. ... 24 5 Pertumbuhan koloni miselia Rhizoctonia sp. pada
Beberapa Kombinasi Macam dan pH Media. ... 27 6 Koloni Isolat Rhizoctonia sp. pada Beberapa Kombinasi
Macam dan pH Media setelah Diinkubasi Satu Hari ... 28 7 Koloni Isolat Rhizoctonia sp. pada Media PDA dan
DAFTAR LAMPIRAN
Halaman
1 Sidik Ragam Pengaruh Macam, pH dan Penggoyangan Media
terhadap pertambahan Biomassa Koloni ... 44 2 Uji Lanjut Duncan Pengaruh Macam Media
terhadap Pertambahan Biomassa Koloni ……... 45 3 Sidik Ragam Pengaruh Macam dan pH Media terhadap
Pertumbuhan Koloni Hari ke-1 ...………...……..…… 45 4 Sidik Ragam Pengaruh Macam dan pH Media terhadap
Pertumbuhan Koloni Hari ke-2 ... 45 5 Sidik Ragam Pengaruh Macam dan pH Media terhadap
I. PENDAHULUAN
A. Latar Belakang Penelitian
Pembangunan Hutan Tanaman Industri (HTI) dilakukan sejak tahun 1980-an di Indonesia. Untuk menunjang tercapainya keberhasilan hutan tanaman, diadakan pembangunan pesemaian baik permanen maupun non permanen. Pengadaan bibit melalui pesemaian ini menghadapi berbagai permasalahan seperti munculnya hama dan penyakit yang dapat menyerang sewaktu-waktu.
Pada pesemaian Perhutani Pongpoklandak di Cianjur, Perum Perhutani Unit III Jawa Barat, beberapa jenis bibit menunjukkan penyakit hawar daun (blight). Tanda yang terlihat yaitu terdapatnya miselium berwarna putih pada permukaan daun yang terserang. Hasil identifikasi sampai tingkat genus di laboratorium menunjukkan bahwa jenis cendawan tersebut adalah
Rhizoctonia sp. (Maesaroh, 2003).
Cendawan Rhizoctonia sp. merupakan salah satu penyebab penyakit lodoh yang sangat berbahaya bagi pesemaian karena dapat menyerang dan menyebabkan penyakit pada sejumlah jenis tanaman pada kondisi lingkungan yang beragam. Serangan penyakit lodoh selain merupakan salah satu penyebab utama berkurangnya jumlah bibit yang dapat disediakan untuk keperluan penanaman, juga dapat menurunkan kualitas semai.
Beberapa upaya pengendalian penyakit telah banyak diteliti dan dipraktikkan, berupa pengendalian secara fisik, kimiawi maupun secara biologi (hayati). Bagaimana cara menekan populasi patogen secara efektif perlu dipelajari untuk tiap jenis patogen. Informasi mengenai penyakit dan patogen penyebabnya masih perlu digali, diantaranya bagaimana berbagai jenis atau suatu patogen dapat bertahan hidup di lapangan, dan faktor-faktor lingkungan yang berpengaruh terhadap daya tahan hidupnya, kemampuan bereproduksi serta perkembangan penyakit.
ekologi minimum dan maksimum, dengan batas-batas kisaran toleransi tertentu (Hadi, 2001). Faktor fisik merupakan salah satu faktor pembatas dalam pertumbuhan, perkembangan dan penyebaran suatu jenis organisme.
Oleh karena itu perlu diketahui pengaruh berbagai faktor lingkungan terhadap ketahanan hidup dari patogen. Berdasarkan informasi yang diperoleh dapat diketahui kondisi yang paling tidak menguntungkan bagi kelangsungan siklus suatu penyakit. Informasi-informasi tersebut diperlukan dalam rangka pengembangan cara untuk penanggulangan penyakit tersebut.
Studi biakan secara in vitro merupakan sarana bagi pemahaman biologi, fisiologi dan ekologi cendawan. Melalui studi biakan in vitro dapat diuji dengan teliti antara lain respon pertumbuhan cendawan terhadap pH, temperatur dan kelembaban, serta fisiologi karbohidrat dan mineral, juga produksi enzim dan hormon.
B. Tujuan penelitian
1. Untuk mengkaji media tumbuh in vitro yang memberikan kondisi pertumbuhan terbaik atau sebaliknya kondisi yang merugikan terhadap pertumbuhan cendawan Rhizoctonia sp.
2. Untuk mengetahui sumber karbon (karbohidrat) yang memberikan pertumbuhan terbaik bagi Rhizoctonia sp.
3. Untuk mengetahui toleransi terhadap derajat kemasaman dan menentukan pH terbaik untuk pertumbuhan Rhizoctonia sp. secara in vitro.
4. Untuk mengetahui pengaruh penggoyangan media terhadap pertumbuhan cendawan Rhizoctonia sp.
C. Hipotesis
1. Pada kondisi media semakin asam dan semakin basa (alkali), pertumbuhan cendawan Rhizoctonia sp. akan semakin terhambat.
2. Media dengan sumber karbon monosakharida (Glukosa/dekstrosa) mengakibatkan respon pertumbuhan Rhizoctonia sp. yang berbeda dari media dengan sumber karbon disakarida/oligosakarida (sukrosa).
II. TINJAUAN PUSTAKA
A. Cendawan Rhizoctonia sp. 1. Klasifikasi
Menurut Agrios (1988), klasifikasi cendawan Rhizoctonia sp. adalah sebagai berikut :
Sub divisi : Deuteromycetes
Kelas : Agonomycetes (Mycelia Sterilia) Ordo : Agonomycetales (Myceliales) Family : Agonomycetaceae
Genus : Rhizoctonia
Species : Rhizoctonia sp.
Menurut McKane dan Kandel (1985), dari beberapa cendawan yang ada, terdapat cendawan yang tidak diketahui siklus reproduksi seksualnya (tahap sempurna), semua cendawan ini dikelompokan ke dalam Deuteromycetes. Belum diketahui reproduksi seksualnya merupakan karakteristik dari cendawan-cendawan Deuteromycetes, maka mereka biasa disebut fungi imperfek. Mereka mempunyai bentuk menyerupai bentuk salah satu dari tiga kelas cendawan yang ada. Sebagian besar Deuteromycetas menyerupai Ascomycetes, dengan hifa bersepta dan spora aseksual yang sama. Anggota dari cendawan imperfek ini langsung dikelompokkan kedalam kelompok yang lain jika reproduksi seksualnya diketahui.
Sub divisi Deuteromycetes merupakan suatu kelas dari fungi yang anggotanya sekitar 20.000 spesies. Banyak dari fungi ini merupakan saprofit, tetapi banyak juga yang merupakan parasit pada tanaman, binatang dan manusia. Menurut Alexopoulos, Mims dan Blackwell(1996), fungi imperfecti
tahap seksual, baik karena memang tidak pernah memilikinya ataupun jika punya telah hilang karena proses evolusi.
Lebih lanjut dijelaskan oleh Semangun (1996) bahwa bagian vegetatif jamur pada umumnya berupa benang-benang memanjang, bersekat (septa) atau tidak, dan disebut hifa. Kumpulan benang-benang hifa disebut miselium. Golongan fungi imperfect ini mempunyai miselium dengan dinding-dinding penyekat (septa) tapi tidak memiliki tahapan seksual. Pada umumnya jenis-jenis fungi dari kelompok ini memproduksi konidia dalam jumlah yang sangat banyak (Streets, 1972).
Fungi imperfect mempunyai hifa yang berkembang dengan baik, bersepta dan bercabang. Selnya biasanya multinukleat. Septanya memiliki perforasi atau lubang yang dapat mengalirkan sitoplasma dan perpindahan nukleus dari satu sel ke sel yang lain (Alexopoulos et al., 1996).
Deuteromycetes dibagi dalam empat forma ordo yakni: Sphaeropsidales, Melanconiales, Moniales dan Mycelia Sterilia. Semua spesies yang alat biaknya berupa konidium yang tersusun dalam piknidium dimasukkan kedalam ordo khusus Sphaeropsidales. Spesies yang konidiumnya tersusun dalam aservuli dimasukkan dalam ordo khusus Melanconiales. Spesies yang alat pembiakannya terdiri atas tunas atau hasil fragmentasi hifa berupa oidium, konidiofor, sorokodia, atau sinema dimasukkan dalam ordo khusus Moniliales. Untuk spesies yang tidak mempunyai alat-alat pembiak yang lain dimasukkan dalam ordo khusus Mycelia Sterilia (Sastrahidayat, 1990).
Spesies yang masuk dalam ordo Mycelia Sterilia belum diketahui tahapan anamorph atau telemorphnya. Mereka menghasilkan sporodocium
5
2. Karakteristik
Karakteristik yang di kemukakan oleh Barnett dan Hunter (1998), antara lain miseliumnya bening pada beberapa jenis dan gelap pada jenis lainnya, sel-sel miselium biasanya panjang, septa pada cabang terbentuk dari tubuh utama, tidak memiliki konidia dan sel reproduksi lainnya, memiliki sclerotia
yang berwarna terang atau coklat sampai hitam.
Alexopoulos et al. (1996), menambahkan bahwa Rhizoctonia memiliki susunan percabangan hifa yang tegak lurus atau hampir tegak lurus, adanya septa yang berpori (delipore septa), tidak ada sambungan apit (clamp connection), dan terjadi penyempitan hifa di dekat titik percabangan.
Ciri-ciri tersebut sesuai dengan karakteristik Rhizoctonia yang dipaparkan oleh Ogoshi, Sneh dan Burpee (1985), sebagai berikut: 1) adanya percabangan dekat septum dasar pada sel-sel dalam hifa vegetatif yang muda, 2) pembatasan hifa dan formasi dari septa pada jarak yang dekat dari pusat percabangan alami, dan 3) adanya septa yang berpori (delipore), dan tidak adanya sambungan apit, konidia, rhizomorf, serta sklerotia yang berdiferensiasi menjadi kulit dan sumsum.
Menurut Suharti (1973), Rhizoctonia sp. memiliki karakteristik sebagai berikut:
1.Bila ditumbuhkan pada media PDA mula-mula miseliumnya akan tampak berwarna putih, lama-kelamaan warna miselium berubah menjadi coklat muda sampai tua.
2.Miselium halus bercabang-cabang membentuk jala halus dan bersepta. 3.Jarak antara dua septa relatif pendek, sehingga sel-sel hifanya menjadi
pendek dan membulat, dan makin tua makin bulat. 4.Percabangan miselium khas, yaitu tegak lurus.
Rhizoctonia sp. dikenal dapat menyebabkan busuk akar, busuk batang,
damping off, dan dalam beberapa kasus menyebabkan hawar daun.
Rhizoctonia sp. merupakan soil-borne pathogen (patogen tular tanah) yang terlindungi oleh kondisi hangat dan kelembaban tanah yang cukup. Cendawan ini mampu bertahan dalam tanah sebagai sclerotia dan basidiospora
3. Habitat Cendawan
Rhizoctonia sp. dikenal sebagai salah satu patogen penyebab lodoh. Faktor lingkungan yang mempengaruhi penyakit lodoh antara lain RH tanah, pH tanah, bahan organik dan tanaman inang (Bilgrami dan Dube, 1976).
Untuk pertumbuhannya, Rhizoctonia sp. memerlukan suhu 12-32о C bagi kebanyakan strainnya, suhu optimum untuk infeksi berkisar 15-18о C, tapi beberapa strainnya aktif pada suhu tinggi hingga batas suhu 35о C. Penyakit yang ditimbulkannya lebih parah pada tanah lembab dibanding pada tanah yang tergenang atau kering (Agrios, 1988).
Kondisi yang sesuai untuk pertumbuhan Rhizoctonia sp. adalah suhu tanah yang hangat, 12-32°C (70 - 90°F). Meskipun pada kelembaban tanah yang sedang (65 % kejenuhan tanah) kecuali tanaman terluka, maka kelembaban tanah yang lebih tinggi memungkinkan untuk pertumbuhan (Moorman, 2002).
B. Faktor-Faktor Lingkungan yang Mempengaruhi Pertumbuhan Cendawan
Pada perkembangan cendawan, faktor yang mempengaruhi adalah nutrisi makanan, daya tahan hidup (survival), suhu, kelembaban, derajat kemasaman (pH), dan cahaya.
1. Nutrisi makanan
Kebutuhan cendawan akan karbohidrat lebih besar dari pada nutrisi lainnya, akan tetapi sumber nitrogen juga harus dipenuhi. Secara alami Deuteromycetes memiliki kemampuan genetik mensintesa enzim untuk dapat memakai karbon dari berbagai macam sumber, salah satu diantaranya adalah selulosa, sumber karbon yang jumlahnya melimpah (Barnett dan Hunter, 1998).
7
2. Suhu
Suhu sangat penting dalam menentukan jumlah dan tingkat pertumbuhan. Peningkatan temperatur mempunyai efek yang umum dalam meningkatkan aktifitas enzim dan aktifitas kimia (Moore-Landecker, 1972).
Dua hal yang umum berlaku mengenai pengaruh suhu, yaitu (1) kisaran suhu untuk kemungkinan terjadinya sporulasi lebih sempit dibandingkan dengan kisaran untuk pertumbuhan, dan (2) suhu optimum untuk pertumbuhan satu macam spora mungkin berlainan dari suhu optimum untuk produksi bentuk spora yang lain serta untuk pertumbuhan satu jenis cendawan (Hadi, 1989).
3. Kelembaban
Cendawan memerlukan tingkat kelembaban relatif tinggi. Walaupun banyak dari tingkatan cendawan yang lebih tinggi mampu berkembang dalam ketidakhadiran air bebas, kelembaban yang relatif tinggi juga diperlukan. Pertumbuhan maksimum untuk kebanyakan cendawan terjadi pada kelembaban relatif 95-100 % dan pertumbuhan menurun atau terhambat pada kelembaban 80-85 %. Beberapa cendawan akan tumbuh pada kelembaban relatif ≤ 65% (Moore-Landecker, 1972).
Imperfect fungi mampu tumbuh pada larutan nutrisi cair yang kurang oksigen, akan tetapi banyak juga Deuteromycetes mampu tumbuh pada kondisi tanpa cairan. Spora dari banyak cendawan Deuteromycetes membutuhkan kelembaban (Barnett dan Hunter, 1998).
4. Oksigen
Sebagian besar jenis cendawan adalah aerobik, sedang sebagian yang lain adalah anaerobik. Cendawan aerobik tidak akan dapat berkembang bila tidak tersedia cukup oksigen. Sporulasi dapat tertekan apabila kekurangan oksigen atau mungkin juga terlalu banyak CO2 (Hadi, 1989). Rhizoctonia
memerlukan pasokan oksigen dan pembuangan CO2 hasil respirasi untuk
sporulasi (Adam dan Butler, 1983b dalam Ogoshi et al.,1985). 5. Derajat kemasaman
baik pada selang yang lebih luas, dari sekitar pH 3 sampai pH 8. Spesies tertentu bahkan toleran sampai pada selang yang jauh lebih lebar seperti
Rhizoctonia solani, pada pH 2.5 – 8.5 (Barnett dan Hunter, 1998). 6. Cahaya
Cendawan dapat dipengaruhi oleh cahaya dalam beberapa cara. Cahaya dapat mempengaruhi laju pertumbuhan, kapasitas sintesa pada cendawan, mempengaruhi pembentukan struktur reproduktif, cahaya dapat pula mengontrol pergerakan phototropic dari struktur reproduksi (Moore-Landecker, 1972).
Menurut Hadi (1989), cahaya dapat berpengaruh terhadap reproduksi fungi dalam bentuk perangsangan, penghambatan atau arah pembentukan struktur reproduksi. Dengan pemberian cahaya kerap kali fungi dapat lebih cepat dan lebih banyak bereproduksi. Sporulasi Rhizoctonia solani
terbanyak terjadi pada malam hari, sedang pembentukan tubuh buah berkurang sepanjang hari (Ogoshi et al.,1985).
C. Kultur Media
1. Media biakan
Usaha pembiakan mikroorganisme di laboratorium membutuhkan tersedianya media yang tepat. Dalam hal ini yang dimaksud adalah bahan yang digunakan untuk menumbuhkan mikroorganisme.
Fardiaz (1987) menjelaskan, secara umum media yang baik untuk pertumbuhan harus memenuhi persyaratan berikut:
1.Mempunyai semua nutrisi yang mudah digunakan oleh organisme.
2.Mempunyai tekanan osmosa, tegangan permukaan dan derajat kemasaman (pH) yang sesuai.
3.Tidak mengandung zat-zat yang menghambat pertumbuhan mikroorganisme yang dikehendaki, dan
4.Steril dan terlindung dari kontaminasi.
9
Media biakan dapat digunakan untuk tujuan: (1) menumbuhkan dan memelihara suatu biakan mikroorganisme, (2) mempelajari pengaruh mikroorganisme terhadap suatu zat yang terdapat dalam media atau sebaliknya dan (3) untuk mendapatkan zat-zat yang dihasilkan oleh mikroorganisme (Fardiaz, 1987).
Cendawan dapat dibiakkan pada berbagai jenis substrat. Meskipun demikian sebenarnya tidak ada satu macam substrat pun yang sesuai untuk membiakkan semua jenis cendawan, karena keperluan nutrisi untuk tiap jenis cendawan berbeda. Beberapa cendawan dapat tumbuh dengan baik pada medium yang mengandung beberapa bahan organik, sedang cendawan yang lain memerlukan zat-zat kimia tertentu (Dharmaputra et al., 1989).
Menurut Dharmaputra et al. (1989), untuk isolasi cendawan digunakan empat macam medium, yaitu:
1.Medium umum adalah medium yang mengandung kebutuhan pokok penunjang pertumbuhan sebagian besar mikroorganisme.
2.Medium semi selektif ialah medium yang mengandung nutrsi dalam jumlah minimum yang sanggup menunjang pertumbuhan mikroorganisme tertentu.
3.Medium selektif ialah medium yang dimodifikasi dengan pangaturan pH medium atau dengan menambah zat penghambat, sehingga pertumbuhan jenis organisme tertentu yang tidak dikehendaki dihambat.
4. Media diferensial adalah media yang mengandung zat-zat kimia tertentu sehingga memungkinkan untuk membedakan berbagai spesies mikroorganisme. Media ini digunakan untuk mengisolasi dan mengidentifikasi mikroorganisme tertentu.
2. Kebutuhan Cendawan
Secara umum cendawan tumbuh baik pada media yang diformulasikan dari bahan-bahan alami yang didapat dari tempat mereka diisolasi.
Smith (1994), menjelaskan bahwa syarat-syarat untuk pertumbuhan bagi cendawan mungkin bervariasi dari satu jenis dengan jenis dari genus dan spesies lainnya, walaupun kultur diperuntukkan bagi pertumbuhan yang baik pada medium yang sama. Sumber-sumber untuk suatu isolat dapat memberikan petunjuk untuk kondisi pertumbuhan yang sesuai, sehingga pemilihan pada media khusus untuk pertumbuhan biasanya dikembangkan selama beberapa tahun dan hasil dari pengalaman. Pada sebagian besar pekerjaaan, standarisasi untuk formula media diperlukan. Media akan mempengaruhi morfologi koloni dan warna, walaupun struktur khusus terbentuk dan mempengaruhi penyimpanan isolat.
3. Susunan media
Untuk penyusunan media biakan bagi setiap mikroorganisme, tujuan utamanya adalah memberikan suatu campuran dengan syarat zat gizi yang berimbang dan pada konsentrasi yang dapat memungkinkan pertumbuhan yang baik. Medium yang seluruhnya terdiri dari zat gizi yang ditentukan secara kimiawi disebut medium sintetis. Medium yang berisi bahan-bahan kimia yang komposisinya tidak diketahui disebut medium kompleks (Stanier
et al., 1982).
Menurut susunannya, medium dapat dibagi menjadi tiga golongan yaitu medium alam, medium semi sintetik dan medium sintetik. Medium alam mempunyai komposisi nutrisi yang tidak diketahui dengan pasti tiap waktu karena dapat berubah-ubah dalam bahan yang digunakan dan bergantung bahan asalnya. Medium semi sintetik terdiri atas bahan hasil pertanian dan juga bahan kimia yang komposisinya telah diketahui dengan pasti, contohnya adalah Agar Dextrose Kentang (ADK)/PDA. Dalam medium sintetik dan medium semi sintetik dapat diulang secara tepat (Dharmaputra et al., 1989).
11
Air merupakan komponen utama protoplasma. Disamping itu merupakan wahana bagi masuknya nutrisi kedalam sel dan keluarnya sekresi maupun ekskresi dari dalam sel, serta diperlukan untuk berlangsungnya reaksi enzimatik didalam sel. Air terbaik yang digunakan dalam pembuatan media adalah air suling(Fardiaz, 1987).
Sumber karbon biasanya merupakan gula sederhana, misalnya dekstrosa. Meskipun demikian untuk tujuan tertentu dapat pula digunakan karbohidrat kompleks sebagai sumber karbon, misalnya selulosa. Meskipun dalam jumlah sedikit, unsur hara seperti natrium, kalium, kalsium, fosfor, magnesium, besi mangan, tembaga, seng, klor dan kobalt dapat dikatakan diperlukan oleh organisme. Dengan demikian media biakan pun harus tersusun dari unsur hara tersebut dalam jumlah yang kecil(Fardiaz, 1987).
Faktor tumbuh adalah komponen seluler esensial yang tidak dapat di sintesis sendiri oleh mikroorganisme dari sumber karbon dan nitrogennya. Komponen ini dapat berupa asam amino atau vitamin(Fardiaz, 1987).
D. Derajat Kemasaman
Menurut Sarles et al. (1956), reaksi dari medium diperlihatkan pada bagian konsentrasi ion hidrogen (biasanya disebut pH) sedapat mungkin digunakan untuk mengetahui pengaruhnya pada kecepatan dan tingkat pertumbuhan dari mikroorganisme. Semua mikroorganisme mempunyai pH optimum, dimana mereka dapat tumbuh baik, pH minimum dimana sebagian besar reaksinya asam, dimana mereka akan tumbuh, dan pH maksimum dimana sebagian besar reaksinya alkali atau basa yang memungkinkan mereka tumbuh.
Filamen-filamen cendawan dapat berubah-ubah pada berbagai pH. Pada umumnya sebagian besar fungi tumbuh baik antara pH 3.0 sampai pH 7.0. Walaupun ada yang dapat tumbuh pada pH 2.0 dan kurang dari pH 2.0 (Smith, 1994).
E. Karbohidrat
Monosakarida adalah karbohidrat yang tidak dapat terhidrolisis menjadi satuan karbohidrat sederhana, monosakarida adalah unit dasar karbohidrat dari metabolisme seluler. Disakarida adalah gabungan dari monosakarida baik yang sama atau berbeda ketika terhidrolisis. Disakarida sering digunakan oleh tumbuhan atau hewan untuk melakukan transport monosakarida dari satu sel ke sel lain. Oligosakarida mempunyai 2 sampai 6 monosakarida yang terjalin. Oligo berasal dari kata Yunani, oligos yang berarti kecil atau sedikit. Oligosakarida bebas jarang ditemukan di alam. Polisakarida adalah makro molekul yang pokok yang dapat terhidrolisis menjadi satuan-satuan monosakarida yang banyak. Polisakarida sangat penting bagi pedukung struktural (terutama pada tanaman) dan sebagai tempat penyimpanan monosakarida (dimana sel menggunakannya sebagai energi).
Glukosa merupakan bagian terpenting monosakarida. Glukosa adalah aldohexosa dan ditemukan pada keadaan bebas dijaringan tanaman atau hewan. Glukosa merupakan komponen dari disakarida sukrosa, maltosa dan latosa.
Disakarida merupakan Karbohidrat yang disusun dari dua unit monosakarida yang dihubungkan oleh hubungan glikosida. Dua disakarida terpenting yang ditemukan pada keadaan bebas di alam adalah sukrosa dan latosa. Sukrosa umum dikenal dengan sebutan gula meja yang terdapat di seluruh dunia tumbuhan (Hein, Best dan Pattison, 1984).
III. BAHAN DAN METODE
A. Waktu dan Tempat Penelitian
Penelitian dilakukan di Laboratorium Bioteknologi Kehutanan dan Laboratorium Rekayasa Bioproses Pusat Antar Universitas (PAU) Bioteknologi IPB, dalam jangka waktu Oktober 2003 - Februari 2004.
B. Bahan dan Alat
Bahan yang diperlukan dalam pelaksanaan penelitian adalah isolat biakan murni Rhizoctonia sp. (merupakan hasil isolasi dari bagian daun tanaman
Toona sureni), spiritus, alkohol 70%, NaOH 1%, HCl 1%, aquades, media PDA (Potato Dextrose Agar), media PSA (Potato Sucrose Agar), media PDL (Potato Dextrose Liquid) dan PSL (Potato Sucrose Liquid). Peralatan yang digunakan meliputi, erlenmeyer, boks isolasi (Laminar Air Flow), bunsen, cawan petri, otoclaf, shaker, pisau, pengaduk, kain penyaring, kapas, tisu, cork borer, alumunium foil, plastic wrap, jarum ose, korek api, kertas saring, oven, timbangan analitik, mikroskop, gelas preparat, gelas penutup, kamera focus, pH meter, alat titrasi, alat tulis, alat hitung serta software pengolah data.
C. Metode Penelitian
1. Persiapan
a. Sumber cendawan
Isolat yang dipergunakan adalah isolat murni cendawan Rhizoctonia
sp.yang diisolasi dari daun tanaman Toona sureni yang menunjukkan gejala penyakit hawar daun pada pesemaian Perhutani Pongpoklandak di Cianjur, Perum Perhutani Unit III Jawa Barat. Isolasi dilakukan dengan menanam miselium berwarna putih dari permukaan daun yang terserang, kemudian diperbanyak pada medium PDA (Potato Dextrose Agar) dalam cawan petri dan dimurnikan.
b. Pemurnian dan peremajaan
c. Sterilisai peralatan dan ruang inokulasi
Peralatan yang akan digunakan disterilkan dengan otoklaf pada tekanan 1 atm dan suhu 121о C selama 15-20 menit, sedangkan untuk sterilisasi cork borer dan jarum ose dilakukan pada saat pelaksanaan inokulasi dengan cara dibakar pada api bunsen. Strerilisasi ruang inokulasi (laminar air flow) dilakukan menggunakan larutan alkohol 70 %.
2. Tahap Pelaksanaan
a. Pembuatan Media
• PDL (Potato Dextrose Liquid) dan PSL (Potato Sucrose Liquid)
1.Satu liter PDL dan PSL dibuat dari 200 g kentang yang diiris halus dan direbus dalam aquades lalu diambil/disaring ekstraknya, kemudian ditambahkan dekstrosa/glukosa 20 g untuk membuat larutan PDL, atau 20 g sukrosa untuk membuat larutan PSL lalu ditambahkan lagi aquades, sehingga larutan menjadi 1000 ml.
2.Larutan dimasukkan ke dalam erlenmeyer yang telah dipersiapkan, masing-masing sebanyak 100 ml, kemudian masing-masing larutan dalam erlenmeyer dititrasi dengan HCl dan NaOH 1% untuk mengatur pH media menjadi 2, 4, 6, 8, 10, 12.
3.Media PDL dan PSL disterilkan menggunakan otoklaf pada tekanan 1 atm dan suhu 121оC selama 15 menit.
4.Media larutan didinginkan.
• PDA (Potato Dextrose Agar) dan PSA (Potato Sucrose Agar)
1.Satu liter PDA dan PSA dibuat dari 200 g kentang yang diiris halus dan direbus dalam aquades lalu diambil/disaring ekstraknya, kemudian ditambahkan dekstrosa/glukosa 20 g untuk membuat PDA, atau 20 g sukrosa untuk membuat PSA lalu ditambahkan lagi aquades, sehingga larutan menjadi 1000 ml.
15
3. Media disterilkan dengan menggunakan otoklaf pada tekanan 1 atm dan suhu 121оC selama 15 menit.
4. Media PDA dan PSA dituang ke dalam cawan petri, kemudian didinginkan hingga memadat.
b. Uji Respon Pertumbuhan Biomassa MiseliaRhizoctonia sp. 1. Metode Pengujian Respon Pertumbuhan
Dalam laminar air flow, 2 potong isolat Rhizoctonia sp. yang dipotong dengan bor gabus berdiameter 1 cm ditanam secara aseptik ke dalam larutan PDL dan PSL yang diberi perlakuan pHdalam erlenmeyer. Pertumbuhan isolat diamati selama diinkubasi empat hari, baik dalam keadaan digoyang menggunakan shaker pada 80 rpm maupun tanpa digoyang.
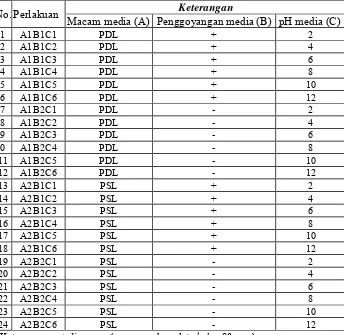
Tabel 1. Kombinasi Perlakuan Percobaan Respon Pertumbuhan Miselia Cendawan Rhizoctonia sp.
No. Perlakuan Keterangan
Macam media (A) Penggoyangan media (B) pH media (C)
1 A1B1C1 PDL + 2
Keterangan : + digoyang (menggunakan alat shaker 80 rpm)
Perlakuan percobaan dengan tiga faktor. Faktor pertama adalah macam media (A) dimana A1 adalah media PDL (Potato Dextrose Liquid) dan A2 adalah media PSL (Potato Sucrose Liquid). Faktor kedua adalah perlakuan penggoyangan media (B) dengan dua taraf, yaitu B1 adalah penggoyangan media larutan menggunakan alat shaker selama diinkubasi, dan B2 adalah cendawan yang diinkubasi dalam media dengan keadaan diam (stasioner). Faktor yang ketiga adalah faktor derajat kemasaman/pH (C) dengan 6 taraf, dimana taraf C1 adalah pH 2, taraf C2 adalah pH 4, taraf C3 adalah pH 6, taraf C4 adalah pH 8, taraf C5 adalah pH 10, dan taraf C6 adalah pH 12. Dengan demikian terdapat 24 macam kombinasi perlakuan masing-masing dengan 5 ulangan. Tiap ulangan berupa isolat
Rhizoctonia sp. yang dibiakan dalam media cair pada sebuah erlenmeyer.
2. Pengambilan Data Biomassa Miselia
1. Bobot kertas saring ditimbang terlebih dahulu sebelum digunakan untuk menyaring, kemudian miselia dipisahkan dari larutan dengan kertas saring tersebut, kemudian kertas saring beserta miselia dioven selama 24 jam dengan temperatur 47оC. Dengan timbangan analitik bobot kering kertas saring bersama-sama miselia ditimbang.
2. Bobot kering miselia adalah bobot kering kertas saring bersama-sama miselia yang telah dioven dikurangi bobot kertas saring sebelum digunakan dan dikurangi bobot kering potongan agar.
c.Uji Respon Pertumbuhan Diameter Koloni Isolat Rhizoctonia sp. 1.Metode Pengujian Respon Pertumbuhan
Biakan murni Rhizoctonia sp. dipotong menggunakan cork borer
berdiameter 1 cm. Dalam laminar air flow, memakai jarum ose sepotong isolat Rhizoctonia sp. ditanam secara aseptik tepat di tengah-tengah cawan petri berisi PDA dan PSA yang diberi perlakuan pH, kemudian diinkubasi selama 3 hari. Pengamatan dilakukan tiap 24 jam dengan mengukur diameter koloni sampai miselia menutupi seluruh permukaan cawan.
17
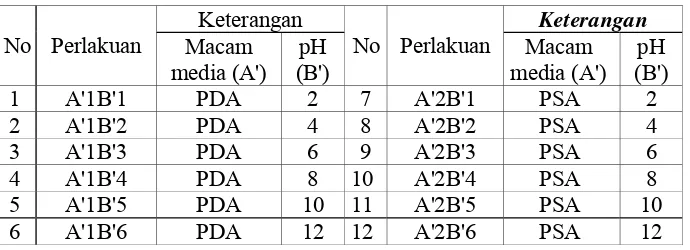
dengan 6 taraf, dimana B'1 adalah pH 2, B'2 adalah pH 4, B'3 adalah pH 6, B'4 adalah pH 8, B'5 adalah pH 10 dan B'6 adalah pH 12. Dengan demikian terdapat 12 macam kombinasi perlakuan masing-masing dengan 5 ulangan. Setiap ulangan berupa isolat Rhizoctonia sp. yang dibiakkan dalam satu cawan petri.
Tabel 2. Kombinasi Perlakuan Percobaan Respon Pertumbuhan Diameter Koloni Miselia Cendawan Rhizoctonia sp.
No Perlakuan
2. Pengambilan Data Diameter Koloni Isolat Rhizoctonia sp.
Perhitungan pertumbuhan arah radial miselia Rhizoctonia sp. dilakukan berdasarkan rumus sebagai berikut : Gambar 1. Metode Pengukuran Diameter Koloni Rhizoctonia sp. secara
in vitro pada Media PDA dan PSA
Pengukuran dilakukan dengan membuat dua garis penampang melintang pada cawan petri yang melewati tengah-tengah potongan koloni dan saling tegak lurus. Batas terluar dari koloni ditandai pada kedua garis tersebut dari hari pertama hingga seluruh permukaan cawan petri tertutup dengan miselia.
1
φ
3. Dokumentasi Preparat
a. Makroskopis
Pemotretan makroskopis dengan menggunakan kamera focus
jalinan miselia tersebut didokumentasikan, mengambil objek yang dapat mewakili ciri-ciri/ karakteristik suatu patogen yang diamati.
b. Mikroskopis
Penyiapan preparat, di awali dengan melakukan sterilisasi gelas objek/preparat berikut gelas penutupnya (cover glass) menggunakan alkohol lalu dikeringkan. Dengan menggunakan ujung jarum ose yang telah dipijarkan, kemudian miselia diambil dari cawan petri untuk tiap perlakuan dan dipindahkan ke atas gelas objek, lalu ditambahkan setetes air aquades steril, kemudian ditutup dengan gelas penutup, dan dihindari adanya gelembung udara antara gelas objek dengan gelas penutup.
Pemotretan mikroskopis dilakukan menggunakan kamera mikroskop. Preparat miselia didokumentasikan dengan mengambil obyek yang dapat mewakili ciri-ciri/karakteristik patogen yang diamati, meliputi warna, tipe percabangan hifa, ada tidaknya septa dan clamp connection, serta bentuk dan alat reproduksi fungi.
4. Analisis Statistik
a. Analisis data bobot miselia Rhizoctonia sp.
Analisis statistik untuk penelitian ini bertujuan untuk mengetahui pengaruh macam media (faktor A), pengaruh penggoyangan media larutan (faktor B), dan pengaruh tingkat pH (faktor C), serta interaksi ketiga faktor. Rancangan yang digunakan adalah rancangan faktorial tiga faktor dalam rancangan acak lengkap, dengan ulangan sebanyak lima.
Faktor A : Macam media
19
Model umum yang digunakan:
Yijkl = μ + αi + βj +
γ
k + (αβ)ij + (αγ
)ik + (βγ
)jk + (αβγ
)ijk +ε
ijkl ;i= 1, 2 j = 1, 2 k = 1, 2, 3, 4, 5 l = 1, 2, 3, 4, 5
Keterangan :
Yijkl = Nilai pengamatan pada perlakuan taraf ke-i faktor A, taraf ke-j faktor B dan taraf ke-k faktor C pada ulangan ke-l
μ = Rataan umum
αi = Pengaruh perlakuan taraf ke-i faktor A βj = Pengaruh perlakuan taraf ke-j faktor B
γ
k = Pengaruh perlakuan taraf ke-k faktor C(αβ)ij = Pengaruh interaksi perlakuan taraf ke-i faktor A dan taraf ke-j faktor B
(α
γ
)ik = Pengaruh interaksi perlakuan taraf ke-i faktor A dan taraf ke-k faktor C(β
γ
)jk = Pengaruh interaksi perlakuan taraf ke-j faktor B dan taraf ke-k faktor C(αβ
γ
)ijk = Pengaruh interaksi perlakuan taraf ke-i faktor A, taraf ke-j faktor B dan taraf ke-k faktor Cε
ijkl = Galat percobaan pada perlakuan taraf ke-i faktor A, taraf ke-j faktor B dan taraf ke-k faktor C pada ulangan ke-lb. Analisis data diameter koloni isolat Rhizoctonia sp.
Analisis statistik untuk penelitian ini bertujuan untuk mengetahui pengaruh macam media (faktor A') dan tingkat pH (faktor B') serta interaksi keduanya. Rancangan yang digunakan adalah rancangan faktorial dua faktor dalam rancangan acak lengkap, dengan lima ulangan. Pengamatan dilakukan sebanyak tiga kali setiap 24 jam.
Taraf-taraf tersebut dapat dirinci sebagai berikut : Faktor A' : Jenis media
A'1 : PDA (Potato Dextrose Agar) A'2 : PSA (Potato Sucrose Agar)
Faktor B' : Tingkat pH
Model umum yang digunakan:
Yijk = μ + αi + βj+ (αβ)ij +
ε
ijkli = 1, 2 j = 1, 2, 3, 4, 5, 6 k = 1, 2, 3, 4, 5
Keterangan :
Yijk = Nilai pengamatan pada perlakuan yang ditunjukkan oleh diameter cendawan Rhizoctonia sp. akibat pengaruh bersama taraf ke-i faktor A dan taraf ke-j faktor B yang terdapat pada ulangan ke-k
μ = Rataan umum
αi = Pengaruh perlakuan taraf ke-i faktor A βj = Pengaruh perlakuan taraf ke-j faktor B
(αβ)ij = Pengaruh interaksi perlakuan taraf ke-i faktor A dan taraf ke-j faktor B
ε
ijk = Galat percobaan pada perlakuan taraf ke-i faktor A, taraf ke-j faktor B pada ulangan ke-kUji lanjutan:
Untuk mengetahui respon yang diberikan dari masing-masing perlakuan dilakukan uji lanjutan. Uji lanjutan yang digunakan adalah uji jarak berganda Duncan. Pengolahan data menggunakan aplikasi komputer program SAS. Adapun prosedurnya dengan menggunakan prosedur
IV. HASIL DAN PEMBAHASAN
A. Hasil
1. Pertumbuhan Miselia Cendawan Rhizoctonia sp.
Berdasarkan hasil pengolahan analisis ragam (Lampiran 1), diketahui bahwa faktor macam media, perlakuan penggoyangan media, dan tingkat derajat kemasaman media memberikan pengaruh yang sangat nyata terhadap pertumbuhan Rhizoctonia sp. Interaksi faktor macam media dengan faktor derajat kemasaman media, serta interaksi faktor perlakuan penggoyangan media dengan faktor derajat kemasaman media memberikan pengaruh yang sangat nyata terhadap pertumbuhan Rhizoctonia sp. Interaksi faktor macam media dengan faktor perlakuan penggoyangan media serta interaksi ketiga faktor juga memberikan pengaruh yang nyata terhadap pertumbuhan
Rhizoctonia sp.
Hasilpengamatan secara visual pengaruh faktor-faktor lingkungan pada media in vitro yang meliputi kombinasi perlakuan macam media, faktor penggoyangan dan faktor derajat kemasaman, terhadap pertumbuhan miselia cendawan Rhizoctonia sp. menunjukkan pertumbuhan yang beragam. Kombinasi perlakuan-perlakuan tersebut memberikan pengaruh yang nyata terhadap pertumbuhan isolat cendawan Rhizoctonia sp. Gambar 2 memperlihatkan kondisi biakan cendawan pada pH 4, 6 dan 8. Pertumbuhan telah terjadi sejak hari pertama, dan berlangsung sampai hari terakhir pengamatan pada hari ke-4, yang ditunjukkan oleh adanya koloni miselia berwarna putih yang terkonsentrasi pada permukaan larutan media, di dalam larutan dan bahkan tumbuh menempel pada erlenmeyer dengan kecepatan pertumbuhan koloni yang berbeda-beda. Pada taraf lainnya dari perlakuan pH, tidak terlihat adanya pertumbuhan cendawan selama pengamatan.
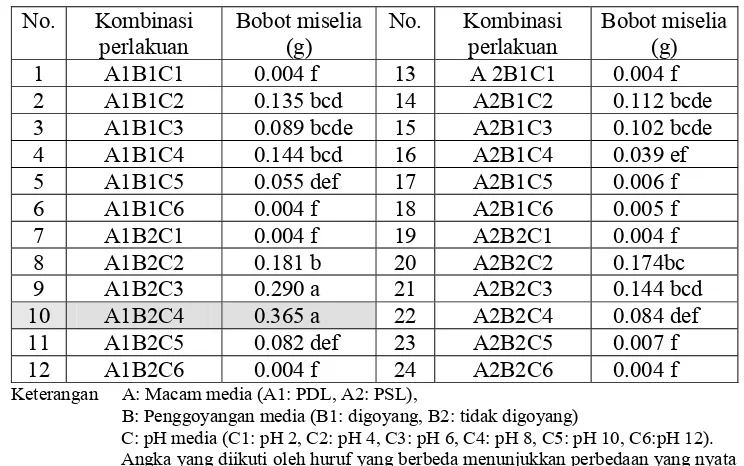
Dari 24 kombinasi perlakuan pada setiap unit percobaan, didapatkan rata-rata pertumbuhan cendawan Rhizoctonia sp. berupa bobot kering miselia sebagaimana disajikan pada Tabel 3.
Tabel 3. Rata-Rata Bobot Kering Miselia Rhizoctonia sp. pada Perlakuan Kombinasi Ketiga Faktor
B: Penggoyangan media (B1: digoyang, B2: tidak digoyang)
C: pH media (C1: pH 2, C2: pH 4, C3: pH 6, C4: pH 8, C5: pH 10, C6:pH 12). Angka yang diikuti oleh huruf yang berbeda menunjukkan perbedaan yang nyata berdasarkan uji jarak berganda Duncan taraf 5%
23
ada yang memberikan pertumbuhan baik dan sebaliknya ada pula yang mengakibatkan penghambatan terhadap pertumbuhan cendawan. Pertumbuhan terbaik diberikan oleh kombinasi perlakuan media PDL pH 8, tidak digoyang, (A1B2C4) dengan bobot kering miselia sebesar 0.365 g, sedangkan hambatan pertumbuhan diberikan oleh kombinasi perlakuan AIBICI, AIBIC6, A1B2C1, AIB2C6, A2B1C1, A2B2C1, A2B2C6 dengan nilai pertumbuhan bobot miselia yang sangat kecil (≈ 0), yaitu sebesar 0.004 g, juga pada perlakuan A2BIC5, A2BIC6, A2B2C5, berturut-turut sebesar 0.007 g, 0.006 g, 0.005 g. Kombinasi perlakuan-perlakuan tersebut mempunyai pH media 2, 10 dan 12, merupakan kondisi pH yang tergolong ekstrim bagi cendawan. Larutan media tersebut menjadi terlalu asam (pH 2) dan juga terlalu basa (pH 10 dan 12) bagi cendawan, dimana cendawan umumnya tumbuh baik pada kondisi sedikit asam. Selama 4 hari pengamatan, pada pH 2, 10 dan 12 tidak terlihat adanya pertumbuhan miselia cendawan Rhizoctonia sp. Cendawan diduga sangat terhambat dan tidak dapat tumbuh pada kondisi tersebut.
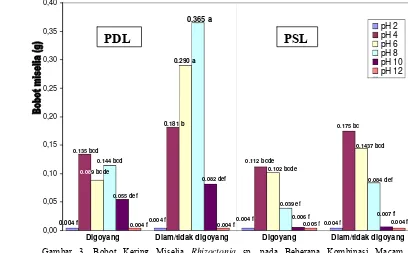
Gambaran perbedaan pertumbuhan cendawan Rhizoctonia sp. pada tiap kombinasi perlakuan ditunjukkan pada Gambar 3.
0,00
Gambar 3. Bobot Kering Miselia Rhizoctonia sp. pada Beberapa Kombinasi Macam, Penggoyangan dan pH Media
PDL
PSL
Gambar 3 memperlihatkan, media PDL memberikan pertumbuhan lebih baik dari media PSL. Pada PDL pertumbuhan terjadi pada pH 4-10 dimana pada pH 4-8 pertumbuhan meningkat dan kemudian menurun drastis pada pH 10, yang diduga karena pertumbuhannya terhambat. Pada media PSL pertumbuhan terjadi pada pH 4-8, dimana pertumbuhannya menurun seiring dengan meningkatnya pH. Perlakuan penggoyangan 4 hari menggunakan shaker dengan rpm 80, nyata menghambat pertumbuhan cendawan Rhizoctonia
sp.
Untuk mengetahui sejauh mana pengaruh dari masing-masing faktor tunggal terhadap pertumbuhan koloni Rhizoctonia sp. maka dilanjutkan dengan uji jarak berganda Duncan. Gambar 4 memperlihatkan bobot miselia pada taraf-taraf tiap faktor tunggal.
0,057
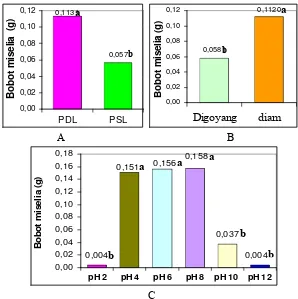
Gambar 4. Bobot Kering Miselia Rhizoctonia sp. pada Faktor Tunggal Macam, Penggoyangan, dan pH Media. (A) Histogram Pengaruh Macam media (B) Histogram Pengaruh Penggoyangan (C) Histogram Pengaruh Derajat Kemasaman.
25
Gambar 4A memperlihatkan bahwa media PDL memberikan pertumbuhan miselia yang nyata lebih baik dibanding PSL. Rata-rata bobot kering miselia yang dihasilkan pada media PDL sebesar 0.113 g dan pada media PSL sebesar 0.057 g. Data tersebut menunjukkan, pada media PDL miselia tumbuh hampir dua kali lebih baik dibandingkan pada media PSL. Untuk pengaruh tunggal penggoyangan media (Gambar 4B), larutan media yang tidak digoyang (diam) memberikan pertumbuhan miselia yang nyata lebih baik dari media yang digoyang. Pada kondisi larutan media diam, rata-rata bobot kering miselianya sebesar 0.112 g, hampir dua kali dari pertumbuhan pada media yang digoyang (0.058 g). Pengaruh tunggal derajat kemasaman (pH) media menunjukkan bahwa pada pH 4 – pH 8 tidak saling berbeda nyata, demikian pula pada pH 2, pH 10 dan pH 12, masing-masing tidak saling berbeda nyata satu dengan lainnya. Meskipun demikian pH 4-8 memberikan pengaruh yang berbeda nyata dengan pH 2, 10 dan 12, dimana pada pH 4-8 miselia cendawan tumbuh baik, sedangkan pada pH 2, 10 dan 12 pertumbuhannya terhambat (Gambar 4C).
2. Pertumbuhan Koloni Miselia Rhizoctonia sp.
Hasil analisis ragam memperlihatkan bahwa jenis media dan derajat kemasaman serta interaksi keduanya pada tiap waktu pengamatan memberikan pengaruh yang sangat nyata pada taraf 5% terhadap pertumbuhan miselia cendawan Rhizoctonia sp. (Lampiran 2, 3, 4). Untuk mengetahui sejauh mana pengaruh dari berbagai perlakuan yang diberikan terhadap pertumbuhan diameter koloni Rhizoctonia sp., maka dilanjutkan dengan uji jarak berganda Duncan.
Tabel 4. Pertumbuhan Koloni Rhizoctonia sp. pada Media PDA dan PSA
Media
Keterangan: Angka yang diikuti oleh huruf yang berbeda pada kolom yang sama menunjukkan perbedaan yang nyata berdasarkan uji jarak berganda Duncan taraf 5%
Tabel 4 menunjukkan pada media PDA respon pertumbuhan
Pada tiap waktu pengamatan, media PDA memberikan pengaruh lebih baik terhadap pertumbuhan koloni dibandingkan media PSA.
Tabel 5. Pertumbuhan Koloni Rhizoctonia sp. pada Beberapa Tingkat pH Media pH
Keterangan: Angka yang diikuti oleh huruf yang berbeda pada kolom yang sama menunjukkan perbedaan yang nyata berdasarkan uji jarak berganda Duncan taraf 5%
Tabel 6. Pertumbuhan Koloni Rhizoctonia sp. pada Berbagai Kombinasi Perlakuan Keterangan: Angka yang diikuti oleh huruf yang berbeda pada kolom yang sama menunjukkan
perbedaan yang nyata berdasarkan uji jarak berganda Duncan taraf 5%
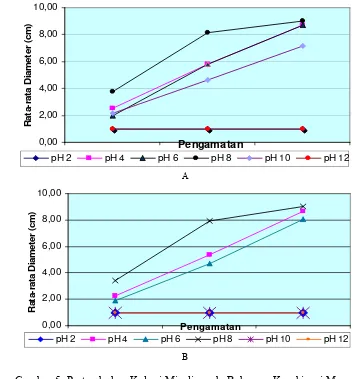
Data Tabel 5 menunjukkan pertumbuhan miselia Rhizoctonia sp. pada enam tingkat derajat kemasaman media. Pertumbuhan koloni cendawan pada pH 8 paling cepat dan berbeda nyata dengan perlakuan pH lainnya pada tiap waktu pengamatan. Pada setiap waktu pengamatan, pH 2 dan 12 sama-sama menghambat pertumbuhan miselia.
27
PDA pH 2, PDA pH 12, PSA pH 2, PSA pH 10, dan PSA pH 12 dalam masing-masing waktu pengamatan dalam tiga hari, sama-sama tidak mendukung pertumbuhan miselia.
Hasil pengamatan terhadap pertumbuhan miselia cendawan Rhizoctonia
sp. pada perlakuan faktor macam media (PDA dan PSA), dan faktor derajat kemasaman (pH 2, 4, 6, 8, 10 dan 12) selama 3 hari, menunjukkan respon pertumbuhan koloni miselia cendawan Rhizoctonia sp. yang beragam.
0,00 Gambar 5. Pertumbuhan Koloni Miselia pada Beberapa Kombinasi Macam
dan pH Media. (A) Pertumbuhan pada media PDA, (B) Pertumbuhan pada media PSA.
rata-rata dari yang tercepat sampai yang terlambat berturut-turut pH 8 (3.74 cm), pH 4 (2.54 cm), pH 10 (2.13 cm), pH 6 (1.97 cm), pH 2 dan 12 (1.00 cm). Sedangkan pada media PSA dari yang tercepat sampai yang terlambat berturut-turut pH 8 (3.39 cm), pH 4 (2.24), pH 6 (1.9 cm), pH 2, 10 dan 12 (1.00 cm). Pada hari kedua pengamatan, pada media PDA diameter pertumbuhan dari yang tercepat sampai yang terlambat berturut-turut pH 8 (8.16 cm), pH 6 (5.80 cm), pH 4 (5.79 cm), pH 10 (4.66 cm), pH 2 dan 12 (1.00 cm). Sedangkan pada media PSA dari yang tercepat sampai yang terlambat berturut-turut pH 8 (7.91 cm), pH 4 (5.39 cm), pH 6 (4.70 cm), pH 2, 10 dan 12 (1.00 cm).
A B
Gambar 6. Koloni Isolat Rhizoctonia sp. pada Beberapa Kombinasi Macam dan pH Media setelah Diinkubasi Satu Hari (A) miselia tumbuh pada pH 4, 6 dan 8, (B) pada pH 2 dan 12 miselia tidak tumbuh.
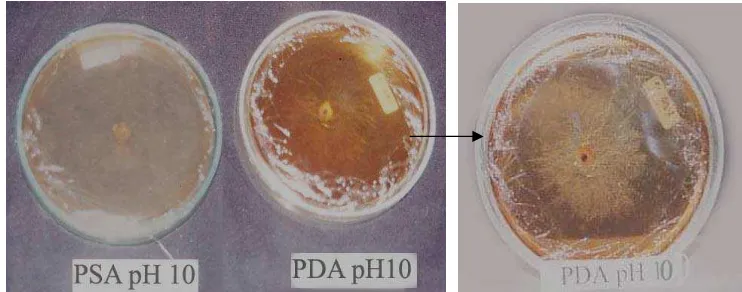
Gambar 7. Koloni Isolat Rhizoctonia sp. pada Media PDA dan PSA pH 10 setelah Diinkubasi Tiga Hari.
pH 12
pH 2
P
S
A
pH 4
pH 6
pH 8
29
Pada hari terakhir pengamatan hanya koloni pada media dengan pH 8 yang sudah mencapai ukuran maksimal cawan Petri. Pada media PDA diameter koloni dari yang terbesar sampai yang terkecil berturut-turut pH 8 (9.00 cm), pH 4 (8.69 cm), pH 6 (8.68 cm), pH 10 (7.14 cm), pH 2 dan 12 (1.00 cm). Pada media PSA diameter koloni dari yang terbesar sampai yang terkecil berturut-turut pH 8 (9.00 cm), pH 4 (8.68 cm), pH 6 (8.04 cm), pH 2, 10 dan 12 (1.00 cm). Dari hasil penelitian ini terlihat isolat cendawan pertumbuhannya terhambat pada pH 2 dan pH 12, dengan ukuran diameter selama pengamatan tetap yaitu 1.00 cm (Gambar 6B). Pada pH 10, miselia tidak tumbuh pada media PSA sedangkan pada media PDA miselia tumbuh walau terhambat (Gambar 7).
3. Struktur Miselia
Gambar mikroskopis miselia memperlihatkan struktur dari miselia cendawan, menggambarkan kondisi miselia yang tumbuh. Dalam kondisi lingkungan atau media tumbuh yang sesuai, pertumbuhan miselianya akan baik. Gambar 8 memperlihatkan struktur miselia yang dibiakan pada media PDA pH 6, dimana miselianya tumbuh dengan baik.
a b
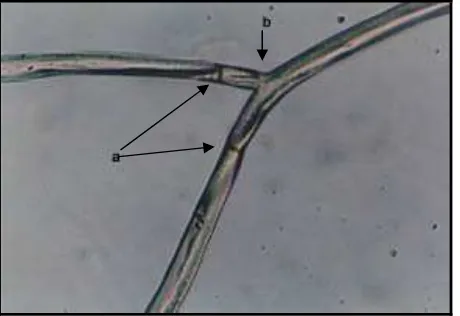
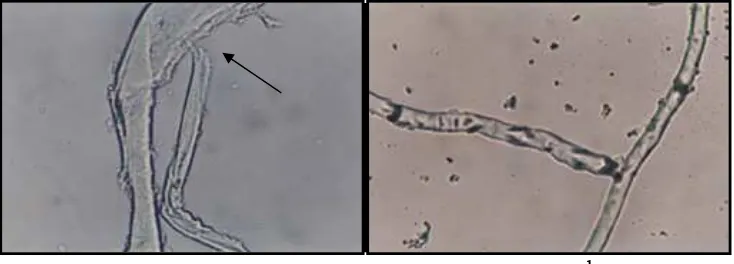
Gambar 9. Struktur Miselia Cendawan Rhizoctonia sp. pada Kondisi pH Ekstrim (a) miselia pada pH 2, tanda panah menunjukkan struktur miselia yang lisis (b) miselia pada pH 12.
Sebaliknya pada lingkungan media tumbuh yang tidak sesuai dan kurang mendukung pertumbuhan, pertumbuhan miselia akan terhambat atau bahkan menyebabkan kematian cendawan. Gambar 9 memperlihatkan struktur miselia cendawan yang mengalami kerusakan dikarenakan cekaman lingkungan.
B. Pembahasan
Hasil pengamatan, baik berdasarkan pertambahan biomassa maupun pertambahan diameter koloni, menunjukkan adanya keragaman pertumbuhan. Pertumbuhan pada individu dapat berbeda karena adanya pengaruh interaksi antara cendawan dengan faktor-faktor lingkungan.
Usaha pembiakan mikroorganisme di laboratorium membutuhkan tersedianya media yang tepat. Dalam hal ini yang dimaksud adalah bahan yang digunakan untuk menumbuhkan mikroorganisme. Dari pengamatan, media tumbuh yang terbaik dengan bobot kering miselia terbesar terdapat pada kombinasi perlakuan media larutan PDL diam, pH 8 sebesar 0.365 g, sedangkan bobot kering miselia terendah (≈ 0), terdapat pada kombinasi perlakuan dengan pH media 2, 10 dan 12 (ekstrim).
31
Secara umum media yang baik untuk pertumbuhan harus memenuhi persyaratan berikut: mempunyai semua nutrisi yang mudah digunakan oleh organisme, mempunyai tekanan osmosa, tegangan permukaan dan derajat kemasaman (pH) yang sesuai, tidak mengandung zat-zat yang menghambat pertumbuhan mikroorganisme yang dikehendaki, steril dan terlindung dari kontaminasi (Fardiaz, 1987).
1. Pengaruh Macam Media terhadap PertumbuhanRhizoctonia sp.
Moore (1972) menjelaskan akan pentingnya unsur karbon bagi cendawan, karena cendawan membutuhkan unsur karbon dalam jumlah yang besar daripada unsur-unsur esensial yang lain dan karbon merupakan nutrisi yang pokok dan terpenting pada cendawan. Hal ini terlihat dari sekitar 50% dari berat cendawan selnya terdiri atas karbon. Senyawa organik ini dipergunakan sebagai struktur utama dalam penyediaan energi untuk sel pada proses oksidasi dan beberapa senyawa organik yang digunakan oleh cendawan sebagai sumber karbon adalah karbohidrat (monosakarida, gula alkohol, polisakarida dan oligosakarida), asam organik dan karbondioksida. Dari semua itu, yang terpenting adalah karbohidrat. Cendawan mempunyai kemampuan yamg tinggi dalam menggunakan sumber karbon yang berbeda.
Macam media, yaitu PDL dan PSL, berpengaruh nyata. Pada media PDL miselia tumbuh hampir dua kali dibandingkan pada media PSL. Hal tersebut terjadi juga pada media agar PDA dengan memberikan pertumbuhan miselia dua kali lebih tinggi dari media PSA. Bahan dasar media PDL dan PDA menggunakan sumber karbon dekstrosa/glukosa, sedangkan media PSL dan PSA menggunakan sumber karbon sukrosa dalam susunan medianya.
Glukosa merupakan komponen dari disakarida sukrosa, maltosa dan laktosa. Disakarida merupakan karbohidrat yang disusun dari dua unit monosakarida yang dihubungkan oleh ikatan glikosida. Dua disakarida terpenting yang ditemukan pada keadaan bebas di alam adalah sukrosa dan laktosa. Sukrosa dikenal dengan sebutan gula meja yang terdapat di seluruh dunia tumbuhan (Hein et al., 1984).
molekul kecil seperti gula, alkohol dan asam organik sampai polimer besar seperti protein, lipid, polisakarida dan lignin. Sumber karbon memberikan dua fungsi essensial di dalam fisiologi jamur dan organisme heterotrofik lain, yaitu: (1) mensuplai kebutuhan karbon untuk sintesis komponen kritis seperti karbohidrat, protein, lipid, dan asam nukleat, dan (2) oksidasinya menyediakan sumber energi untuk menjalankan fungsi yang sesuai menyangkut proses penting bagi kehidupan jamur (Garraway dan Evans, 1984).
Sebagian besar jenis cendawan menggunakan monosakarida, tetapi tidak dapat menggunakan molekul yang lebih besar yang terdiri atas subunit monosakarida yang sama. Sebagai contoh, Rhizopus nigricans, tumbuh kurang baik pada sukrosa tetapi subur pada glukosa atau fruktosa. Hal ini berkaitan dengan ketidakmampuan dari jamur ini menghidrolisis disakarida. Suatu jenis fungi mungkin mempunyai kemampuan untuk menggunakan sumber karbon tertentu untuk pertumbuhan vegetatif, tetapi tidak mampu menggunakannya untuk produksi struktur khusus (Garraway dan Evans, 1984).
Pada umumnya fungi mampu untuk merombak karbohidrat dan bahan-bahan organik lainnya dengan reaksi enzimatik sehingga membuatnya lebih mudah untuk asimilasi (Butler dan Jones, 1955). Kebutuhan cendawan akan karbohidrat lebih besar dari pada nutrisi lainnya, akan tetapi sumber nitrogen juga harus dipenuhi. Secara alami Deuteromycetes memiliki kemampuan genetik mensintesis enzim untuk dapat memakai karbon dari berbagai macam sumber, salah satu diantaranya adalah selulosa, sumber karbon yang jumlahnya melimpah (Barnett dan Hunter, 1998).
2. Pengaruh pH Media terhadap PertumbuhanRhizoctonia sp.
Pertumbuhan dan perkembangan tidak hanya dipengaruhi oleh faktor nutrisi tetapi juga oleh faktor fisik. Nilai pH memiliki peran penting dalam proses metabolisme nutrisi. Kondisi optimal bagi cendawan bervariasi tergantung spesies dan strainnya. Sebagian besar cendawan, sel vegetatifnya tumbuh baik pada kondisi asam mendekati netral (Chang dan Miles, 1997).
33
pada pH 8. Perbedaan nilai pH medium optimal tersebut menurut Garraway dan Evans (1984), karena pH untuk pertumbuhan jamur bervariasi antar galur ataupun antara spesies.
Menurut Sarles et al. (1956), reaksi dari medium diperlihatkan pada bagian konsentrasi ion hidrogen (biasanya disebut pH) sedapat mungkin digunakan untuk mengetahui pengaruhnya pada kecepatan dan tingkat pertumbuhan dari mikroorganisme. Semua mikroorganisme mempunyai pH optimum, dimana mereka dapat tumbuh baik, pH minimum dimana sebagian besar reaksinya asam, dimana mereka akan tumbuh, dan pH maksimum dimana sebagian besar reaksinya alkali atau basa yang memungkinkan mereka tumbuh.
Wolpert (1924) dalam Lilly dan Barnett (1951), menemukan bahwa selang pH dari banyak jamur bervariasi pada media yang berbeda dan menyimpulkan bahwa selang pH yang paling luas diperoleh pada media yang baik, dalam hal ini media PDL dan PDA yang memiliki sumber karbon dekstrosa/glukosa.
Kebanyakan fungi tumbuh baik bila substrat sedikit asam antara pH 5 dan pH 6. Akan tetapi fungi masih mampu tumbuh dengan baik pada selang yang lebih luas, dari sekitar pH 3 sampai pH 8. Spesies tertentu bahkan toleransinya sampai pada selang yang jauh lebih lebar seperti Rhizoctonia solani, pH 2.5 – 8.5 (Barnett dan Hunter, 1998).
Cendawan Rhizoctonia sp. memiliki toleransi hidup pada selang pH yang lebar, dan harus diwaspadai. Selain itu Rhizoctonia sp. juga memiliki kemampuan untuk menyebabkan penyakit pada kisaran suhu tanah, pH tanah, tipe tanah, tingkat kesuburan, dan kelembaban tanah yang luas. Kemampuan alami Rhizoctonia sp. ini akibat dari luasnya potensi genetik yang dimiliki. Isolat Rhizoctonia sp. dapat menyebabkan penyakit pada sejumlah spesies tanaman dengan kondisi lingkungan yang beragam (Kucharek, 1994).
Rhizoctonia sp. masih dapat hidup pada tanah dengan pH 2.4 dan 9, tetapi tumbuh baik pada tanah dengan pH 3.5 dan 7.5 (Agrios, 1988).
melalui efek pada tersedianya nutrisi, atau secara langsung melalui aktivitas pada permukaan sel. Perkembangan morfologi juga dipengaruhi oleh derajat kemasaman (pH). Selain itu pH juga mempunyai efek terhadap proses metabolik, sehingga jamur mampu menggunakan zat tertentu untuk mendapatkan kebutuhan nutrisinya. Derajat kemasaman juga mempengaruhi aktivitas enzim, dan pemecahan molekul kedalam ion-ion pada membran permeabel. Derajat kemasaman optimal dapat membuat zat tertentu melewati membran kemudian dimanfaatkan oleh jamur yang sebelumnya tidak dapat memanfaatkan zat tersebut (Chang dan Miles, 1997).
Karena pengangkut molekul adalah protein, aktivitas mereka dipengaruhi oleh temperatur, pH dan penghambat lain yang juga mempengaruhi enzimnya. Derajat kemasaman penting karena keterlibatan H+ dalam hal symport/pengangkutan dari banyak molekul. Pengangkutan aktif dapat dipengaruhi oleh bahan kimia atau faktor fisik yang mempengaruhi pernapasan/respirasi dan begitu pula produksi energi di dalam sel itu (Garraway dan Evans, 1984).
Aktivitas enzim dipengaruhi oleh pH. Secara umum, ada suatu korelasi langsung antara selang pH optimum untuk sebagian besar enzim dan selang pH optimum untuk pertumbuhan. Haldane (1930) dalam Lilly dan Barnett (1951) menemukan dari 105 enzim yang diteliti kecuali 9 diantaranya, berfungsi optimal antara pH 4 dan 8. Kebanyakan jamur juga mempunyai pH optimal untuk pertumbuhan antara batas tersebut, kemungkinan pH mempengaruhi tingkat pertumbuhan jamur, setidaknya pada sebagian proses, dengan memodifikasi tingkat reaksi enzimatik tertentu (Lilly dan Barnett, 1951).
konsentrasi ion hidrogen eksternal juga mempengaruhi pH di dalam sel, yang pada gilirannya mempengaruhi aktivitas enzim. Enzim gagal fungsinya pada pH yang ekstrem, tetapi enzim memiliki pH optimum yang berbeda-beda untuk aktifitasnya. Kebanyakan optimal antara pH 4 dan pH 8 . (Moore-Landecker, 1972).
35
Pada sistem kehidupan ada tiga jenis larutan penyangga yang amat berperan yaitu larutan protein, bikarbonat dan fosfat yang memiliki sistem sendiri. Walaupun suatu jenis mikroorganisme mampu hidup pada pH lingkungan atau pH eksternal berselang luas, akan tetapi enzim yang bekerja di dalam sel akan tetap bekerja pada pH internal sel. Hal ini dapat terjadi karena enzim pada sitoplasma memiliki suatu sistem mekanisme sendiri sehingga organisme tersebut dapat beradaptasi terhadap lingkungan yang eksternal pH-nya luas. Dengan mekanisme tersebut suatu bentuk kehidupan akan dapat bertahan hidup pada pH eksternal atau lingkungan yang berselang luas, akan tetapi pH internalnya dimana enzim bekerja tidak harus berselang luas (Hawab, Bintang, Kustaman, 1989).
Moore-Landecker (1972) menjelaskan bahwa pengaruh pH terhadap pertumbuhan ada dua. Pengaruh yang pertama adalah terdapatnya ion logam. Ion logam ini dapat membentuk ikatan kompleks dan pada tingkat pH tertentu sulit dipecahkan/diuraikan. Pengaruh kedua adalah pada permeabilitas sel yang dapat berubah pada tingkat kemasaman atau kebasaan yang berbeda. Akibatnya yang terutama dapat terlihat pada senyawa-senyawa yang mengalami ionisasi. Penjelasan yang mungkin adalah pada pH rendah membran protoplasma dipenuhi dengan ion hidrogen, sehingga aliran kation-kation yang essensial terhambat/terbatas. Sebaliknya pada pH tinggi membran protoplasma dipenuhi dengan ion hidroksil yang akan menghambat aliran anion-anion yang essensial. Pada pH rendah asam p-Aminobenzoic berada sebagai asam bebas, selain itu pH rendah merupakan kondisi yang baik untuk pengambilan vitamin. Pada pH 6 dibutuhkan delapan kali lebih banyak asam asam p-aminobenzoic dibanding pada pH 4 untuk mendukung pertumbuhan cendawan.
3. Pengaruh Penggoyangan Media terhadap PertumbuhanRhizoctonia sp. Penggoyangan ditujukan untuk meningkatkan kadar oksigen dalam larutan, dengan mekanisme seperti dalam ruang yang terisolasi, larutan yang dikocok molekul H2O nya akan lebih banyak mengikat oksigen dari udara
Hasil penelitian ini menunjukkan bahwa penggoyangan media nyata menghambat pertumbuhan miselia cendawan dibanding media yang diam. Pada kondisi larutan media diam, rata-rata bobot kering miselianya sebesar 0.112 g, hampir dua kali dari pertumbuhan pada media yang digoyang (0.058 g).
Pada proses penggoyangan, gaya sentrifugal menyebabkan miseliumnya tenggelam. Pada kondisi diam miselium cendawan berada dipermukaan larutan dan dapat memanfaatkan oksigen atmosfer di atas larutan yang kadarnya jauh lebih besar dan merupakan oksigen bebas. Pertumbuhan
Rhizoctonia sp. akan lebih terhambat dalam kondisi tenggelam, hal ini berkaitan dengan proses respirasi cendawan yang membutuhkan oksigen dalam kadar tertentu untuk berlangsungnya metabolisme. Apabila kadar oksigen kurang dari batas kritis maka metabolisme terganggu, dan pertumbuhan terhambat (Lilly dan Barnett, 1951).
Hal tersebut dapat terjadi disebabkan cendawan Rhizoctonia sp. merupakan cendawan aerobik, yang membutuhkan oksigen untuk respirasi, merombak makanan, menghasilkan energi dan CO2. Selain itu cendawan
Rhizoctonia sp. bukanlah cendawan yang habitat hidupnya pada kondisi jenuh air (RH ≥100%) dan merupakan soil borne pathogen dimana kondisi lingkungannya memiliki kelembaban udara kurang lebih 65% sampai jenuh. Penyakit yang ditimbulkannya akan lebih parah pada tanah lembab, dibanding pada tanah yang tergenang atau kering (Agrios, 1988).
37
oksigen yang tersedia di di atmosfer; sebagai contoh, Mucor rouxii bisa menggunakan variasi sumber karbon yang berlimpah dan asam amino untuk pertumbuhan pada atmosfer aerobik, tetapi dalam kondisi anaerobik hanya dapat menggunakan heksosa sebagai suatu sumber karbon dan asam amino sebagai sumber nitrogen. Kurangnya oksigen yang mencukupi juga meningkatkan kebutuhan nutrisi pada M. rouxii dan menurunkan laju pertumbuhan (Bartnicki-Garcia dan Nickerson, 1962 dalam Moore-Landecker,1972).
Bagaimanapun, oksigen adalah hal vital bagi respirasi selular di mana suatu sumber energi dioksidasi menjadi karbondioksida dan air, serta energi yang dihasilkan tersedia bagi sel (Moore-Landecker, 1972). Oksigen juga digunakan cendawan sebagai bahan untuk melakukan reaksi enzimatik seperti pada enzim oksidase dan respirasi (Deacon, 1984).
4.Struktur Miselia Rhizoctonia sp.
Alexopoulus et al. (1996), menyatakan bahwa Rhizoctonia memiliki susunan percabangan hifa yang tegak lurus atau hampir tegak lurus, adanya septa yang berpori (delipore septa), tidak ada sambungan apit (clamp connection), dan terjadi penyempitan hifa di dekat titik percabangan.
Adanya penghambatan pertumbuhan Rhizoctonia sp. karena pengaruh pH, diduga karena miselia telah mengalami kerusakan. Semakin asam atau semakin basa pH medium, maka diduga kerusakan yang diakibatkan akan semakin parah, terutama pada struktur hifanya.
Derajat kemasaman media memberikan pengaruh terhadap struktur hifa
dimana enzim-enzim tersebut pada cendawan umumnya terdapat pada dinding sel (Lilly dan Barnett, 1951).
Miselia cendawan dikelilingi oleh suatu selaput rangkap yang semipermeabel. Selaput ini membatasi kecepatan gerak zat-zat yang dicerna dan zat-zat beracun ke dalam dan ke luar sel hidup. Pada pH 2 dan 12 terlihat bahwa hifa telah mengalami deformasi. Rapuhnya hifa yang mengalami lisis akibat pengaruh pH eksternal mempengaruhi penyerapan dari berbagai materi, terutama yang bermuatan (H+). Dalam kondisi yang ekstrim pH eksternal yang bersentuhan dengan dinding miselia, yang tidak hanya merusak enzim, tetapi juga menurunkan permeabilitas dinding sel sehingga mengganggu proses pencernaan intraseluler, karena penyerapan zat cair/larutan diluar dinding sel cendawan terganggu (Lilly dan Barnett, 1951).
Mekanisme senyawa anti mikroba dalam menghambat pertumbuhan mikroba (Pelczar dan Chan, 1986), antara lain sebagai berikut: merusak dinding sel sehingga menyebabkan lisis atau menghambat proses pembentukan dinding sel pada sel yang sedang tumbuh; mengubah permeabilitas membran sitoplasma yang menyebabkan kebocoran nutrien dari dalam sel; mendenaturasi protein sel; merusak sistem metabolisme di dalam sel dengan cara menghambat kerja enzim intraseluler. Diduga penghambatan oleh pH lingkungan memiliki mekanisme yang hampir serupa.
Pada media padat, pertumbuhan miselia dibatasi oleh ukuran cawan petri yang hanya berdiameter 9 cm. Pertumbuhan Rhizoctonia sp. akan berhenti sampai persediaan nutrisi di dalam media habis terpakai. Sampai selesai pengamatan, pada hari ke tiga dan hari-hari selanjutnya, semua cendawan
Rhizoctonia sp. yang bertahan hidup masih terus tumbuh. Setelah penuh menutupi permukaan cawan, laju pertumbuhannya terhambat dan ada kecenderungan membentuk sklerotium sebagai alat pertahanan dan penyimpanan cadangan makanan (Agrios, 1988), yang akan digunakan apabila nutrisi dalam media sudah habis, sehingga dalam keadaan kekurangan nutrisi
Rhizoctonia sp. masih mampu bertahan hidup.