I
ABSTRAK
SYARIFIN FIRDAUS. Isolasi dan Karakterisasi Fragmen cDNA dari Gel? Penyandi Glutathione S-Conjugate Transporter dari M a@ne D. Don. Dibimbing
oleh SUHARSONO, UTUT WIDYASTUTI SUHARSONO.
M nfine memiliki inekanisme detoksifikasi cekaman A1 d m pH rendah diperlihatkan oIeh pemmbuhannya yang baik pada tanah asam dengan kelarutan
A1 yang tinggi. Salah satu protein yang penting dalain detoksifikasi cekanan
xenobiotik adalah protein mzrlfi-drug resistance associated protein
(MW)
yang disandi oleh gen mrp. MRP juga disebut dengan ~ f ~ ~ p - d e ~ e n d e n t ghtafhione s-conjugate lmnsporter. (po~npa GS-X). Pompa GS-X didiuga merniliki peran penting dalam ketahanan M nfJine terhadap cekaman A1 d m asam. Penelitian ini bertujuan mengisolasi d m mengkarakterisasi fragmen cDNA yang inenyandi poinpa GS-X dari Ad afine D. Don. Isolasi fragmen cDNA mrp M affine
{MclMp) diawali dengan isolasi RNA total. Dengan transkripsi balik, cDNA total berhasi1 disintesis dari RNA total sebagai cetakan. Fraginen cDNA MaMrp (640
pb) telah berhasil diisolasi dengan PCR menggunakan cDNA total sebagai
cetakan dm primer generate rnrp yang dirancang dari AtMrpl dan AtM1y2 dari
Arabidopsis thaliana, ScYcJ1 dari sel ragi dan HmMrpl dari inanusia. Fragmen
MuMrp berhasil disisipkan ke dalam pGEM-T Easy dan plasinid rekombinan ini diintroduksikan ke dalam Escherichia coli DH5a. Keberhasilan pengklonan E.
coli d i k ~ ~ n n a s i dengan PCR, plasmid rekornbinan dikonfrrmasi dengan pelnotongan oleh enzim restriksi endonuklease EcoRl dan PCR. Fragmen MaMrp
disekuen menggunakan ABI Prism 310 automated DNA sequencer. Fragmen
MaMrp berukuran 633 pb yang menyandi 208 asam amino. Fragmen MaMrp
tid& meiniliki tempat pernotongan EcoRl
.
Analisis penyejaj aran urutannukleotida dengan fraginen mrp lain menunjukkan bahwa fragmen MuMrp
inemliki kesanaan 70% dengan bagian WOO216655 (Acc: AX506697), 69%
dengan inRNA AMrpl(AF008 124) dan 63% dengan mRNA AtMrp2 (AF008 124)
dari A. thaliaana. Berdasarkan urutan deduksi asamnya, MaMRP memiliki
kesamaan 81% dengan bagian AtMICP13 (EC
Q9C8HO),
77% dengan AtMRPl{Q9C8G9), 75% dengan AtMRP2 {Q42093), dan 73% dengan AtMW12 (Q9C8H1) masing-masing dari A. thaliana. Penyejajaran dengan AtMRPl
ISOLASI DAN KARAKTERTSASI FRAGMEN cDNA DARI GEN
PE NYANDI
GLUTA THIONE S-CONJUGA TE TRANSPORTER
DART
Melastoma affiizc D.Don.
SYAR;'F:N FPRDAUS
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
SYARIFIN FIRDAUS. Isolasi dan Karakterisasi Fragmen cDNA dari Gen Penyandi Glutathione S-Conjugate Transporter dari M a z n e D. Don. Dibimbing oleh SUHARSONO, UTUT WIDYASTUTI SUHARSONO.
M a z n e memiliki inekanisme detoksifikasi cekaman A1 dan pH rendah diperlihatkan oleh pertu~nbuhannya yang baik pada tanah asam dengan kelarutan A1 yang tinggi. Salah satu protein yang penting dalam detoksifikasi cekaman xenobiotik adalah protein mzrlti-drug resistance associated protein (MRP) yang disandi oleh gen mrp. MRP juga disebut dengan ~ F ~ ~ P - d e ~ e n d e n t glutathione s- conjugale imnsporter (pompa GS-X). Pompa GS-X didiuga memiliki peran pentiug dalan ketahanan M a z n e terhadap cekaman A1 dan asan. Penelitian ini bertujuan mengisolasi dan mengkarakterisasi fragmen cDNA yang inenyandi polnpa GS-X dari M a 8 n e D. Don. Isolasi fragmen cDNA mrp M af/ine (MuMrp) diawali dengan isolasi RNA total. Dengan transkripsi balik, cDNA total berhasil disintesis dari RNA total sebagai cetakan. Fragmen cDNA MaMrp (640 pb) telah berhasil diisolasi dengan PCR menggunakan cDNA total sebagai cetakan dan primer generate lnrp yang dirancang dari AtMrpl dan AtMrp2 dari Arabidopsis thaliana, ScYcJl dari sel ragi dan HmMrpl dari manusia. Fragmen MaMrp berhasil disisipkan ke dalam pGEM-T Easy dan plasmid rekombinan ini diintroduksikan ke dalam Escherichia coli DH5a. Keberhasilan pengklonan E. coli dikonfirmasi dengan PCR, plasmid rekombinan dikonfirmasi dengan pemotongan oleh enzim restriksi endonuklease EcoRl dan PCR. Fragrnen MaMrp
disekuen menggunakan ABI Prism 310 automated DNA sequencer. Fragmen
MaMvg berukuran 633 pb yang menyandi 208 asam amino. Fragmen MaMrp
tidak meiniliki tempat pemotongan EcoRl. Analisis penyejajaran umtan
nukleotida dengan fragmen mrp lain menunjukkan bahwa fragmen MaMrp
memliki kesamaan 70% dengan bagian WOO216655 (Acc: AX506697), 69%
dengan mRNA AlMrpl(AF008124) dan 63% dengan mRNA AtMrp2 (AF008124)
dari A. thaliana. Berdasarkan urutan deduksi asamnya, MaMRP memiliki
kesanaan 81% dengan bagian AtMRP13 (EC Q9C8HO), 77% dengan AtMRPl (Q9CSG9), 75% dengan AtMRP2 (Q42093), dan 73% dengan AtMRP12
(Q9C8H1) masing-masing dari A. thaliana. Penyejajaran dengan AtMRPl
menunjukkan bahwa fragmen MaMRP terletak antara domain TM1 szunpai NBF1.
ABSTRACT
SYAIUFIN FIRDAUS. Isolation and Characterization of cDNA Fragment of Gene Encoding Gltdathione S-Conjugate Transporter from
M
afine D. Don. Under the direction of SUI-IARSONO, UTUT WIDYASTUTI SUHARSONOIt is reasonable that M aflne has a mechanism to detoxify A1 and acid stress since it grows well in acid soil with high level of soluble aluminum. One of the important proteins in the detoxifying xenobiotic stress is a multi-drug resistance associated protein (MRP) encoded by mrp gene. MRP is also called M~'+ATP-
dependent glutathione s-conjugate transporter (GS-X pump). We suppose that GS- X pump has an important role in the resistance of M afJine to A1 and acid condition. The objective of this research is to isolate and characterize the fragment of cDNA cncoding GS-X pump from M affine L. To isolate the cDNA fragment of mrp fron: M aflne (MaMrp), we started by total RNA isolation. We had successfully isolated total RNA. By reverse transcription, total cDNA had been synthesized from the total RNA as template. The fragment of cDNA MaMrp (640 bp) had been successfully isolatetl by PCR by using total cDNA as template and mrp generate primer designcd liom AtMrpI and AtMrp2 from Arabidopsis thaliana, ScYcjl from yeast, and HmMrpl from human. The MaMrp fragment was inserted into pGEM-T Easy and the recombinant plasmid was successfully introduced into Escherichia coli DHSa. The success of the MaMrp fragment cloning in the
E.
coli was confirmed by colony-PCR, recombinant plasmid digestion by EcoRI and PCR by using recombinant plasmid as template. The MaMrp fragment was sequenced by using ABI Prism 310 automated DNA sequencer. The MaMrp fiagment is 633 bp encoding 208 amino acids. This fragment does not contain EcoRI restriction site. Nucleotide alignment analysis with other M W show that MaMrp fragment is 70% identical to part ofWOO216655 (Acc: AX506697), 69% to AlMrpl 1riRN.4 (AF008124) and 63% to
AtMrp2 (AF008124) from A. thaliana. Based on deduced amino acid sequence, MaMW is 81% identical to part of AtMRP13 (EC Q9C8HO), 77% to AtMRPl
(Q9C8G9), 75% to AtMRP2 (Q42093), and 73% to AtMW12 (Q9C8H1) from A.
thaliana respectively. Alignment with AtMRPl show that MaMRP fragment is located in TMl and NBFl domains.
BAB I
PENDAHULUAN
1.1. Latar Belakang
Ekstensifikasi pertanian di lahan asam sangat potensial untuk meningkatkan 11asil pertziiian di Indonesia. Terdapat sekitar 48.3 juta ha lahan asam jenis podsolik merall-kuning di !ndonesia (Sudjadi 1984), dan sekitar 1600 juta ha di permukaan bumi (Granados et al. 1993). Produktivitas 'tanaman di lahan asam podsolik merah-kuning sangat rendah akibat keracunan .41.
Menurut Sudjadi (1984), tanah asam podsolik merah-kuning memiliki pH di bawah 5, sehingga kerac~nan logam berat terutama A1 merupakan masalah serius pertanian di lahan asam. Pada pH di bawah 5.5, A1 menjadi terionisasi yang sangat beracun bagi tanaman (Konislu & Niyamoto 1983). Pada pH di atas 5.5, A: dalam bentuk tidak larut dan tidak beracun baa' 01 tanaman.
Ion Al ini memiliki a f d t a s yang tinggi dan inangat menganggu terhadap biomolekul anionik seperti asam lemak, karbohidrat, protein dan asam nuklent (Aniol 1984; de Lima & Copeland 1994; Kochian 1995; Sivaguru et ul. 1999). Ai juga dapat menimbuikan cekaman oksidatif dengan terbentulaya oksigen radikal
(ROS) (Panda et al. 2003).
Merakit varietas tanaman toleran di lahan asam ~neiupakan langkah yang tepat dan lestari dibandingkan dengan mereklamasi lahan yang sifatnya temporer dan tidak efisien. Persilangan secara konvensional untuk :nerakit tanaman toleran di lahan asarn juga dihadapkan pada terbatasnya su~r.berdaya genetika untuk toleransi di lahan asam. Oleh karena itu, merakit tanaman transgenik toleran di lahan asam yang didasarkan pada mekanisme ketahanan tanarnan indikator tanah asam diharapkan lebih efektif. Tanaman indikator ini juga dnpat digunakan sebagai sumber gen-gen toleransi tanaman di lahan asam.
of. 1997; 1998, Sanchez-Fernandez 1998). AiMrp juga terbukti berperan dalatn pengaturan hormon auksin dan asam absisat (ABA) serta ketahanan terhadap cekaman garam NaCl dan LiCl (Gaedeke et al.2001).
Jenis reduktan sebagai pengikat konjugat yang melewati pompa GS-X dapat berupa GSH (Ishikawa et al. 1992), fitokelatin (Ortiz et al. 1995), metallotionein (Dey et al. 1996), Glukosida dan glukoronida (Hortensteinei et al. 1993; Klein et 01. 1996; Gaedeke et al. 2001) dan sulfat (Jedlitkschky et al. 1996).
Peran mrp masih belum diketahui dengan jelas terlibat di dalam sisteln keta- hanan Al. Akan tetapi, terdapat petunjuk yang mengarah keterlibatan ~21.p dalam ketahanan Al. Pompa ATPase (ABC transporter) dilaporkan berperan dalam ketahanan tanaman terhadap A1 pada kedelai (Ermolayev 2001) dan pada barley (Sasaki et al. 2002). GSH, metallotionein dan fitokelatin yang merupakan reduk- tan dalam transport melalui pompa GS-X juga dilaporkan terlibat dalam resistensi tanaman terhadap A1 (Snowden & Gardner 1993; Cobbet 2000). MRP dari Leismltnia tarentolae terlibat dalam penimbunan senyawa trivalen kationik seperti arsenat [As(III)] dan antimoni [Sb(II!)] [sebagaimana ion AI(1II)I dengan reduktan bempa GSH, fitokelatin, dan metallotionein (Dey et al. 1996). MRP juga berperan dalam menjaga sel dari kerusakal oksidatif melalui reduksi GSH menjadi GSSG (Leier et al. 1996; Renes et al. 2000), enzim glutathione s-transferase yang mengkatalis reduksi GSSG dan berperan dalan cekaman oksidatif juga diinduksi oleh cekaman A1 (Ulmasov, 1995; Ezaki et al. 1995; Richards et al. 1998; Ezaki et al. 2004). F?.kta-fakta tersebut meyakinkan dugaan bahwa detoksifikasi dan kompartementasi A1 pada Melastoma melibatkan pompa GS-X.
Pompa GS-X melastoma diduga juga berperan dalaln mobilisasi hormon pertumbuha sebagaimana potnpa GS-X terlibat dalam regulasi hormon auksin dan ABA pada Arabidopsis (Gaedeke et oi. 2001). Sidler et 01. (1998) menm- jukkan bahwa ekspresi ponlpa GS-X di ujung akar dan pucuk batang mampu
meningkatkan pemanjxqgan hipokotil Arabidopsis. Melil~at peran mrp yang sangat penting dalam ketahanan terhadap berbagai senyawa sitotoksik, isolasi
fragmen cDNA mrp Melastoma (MaMrp) sangat penting dilakukan untuk menge-
1.2. l'o,ju:~n l'eneiiti:~n
I'enelitian ini bertl!juan iintuk rnen~isolas~ dan ~uenykarakterisasi fragmen cDNA dari gen penyandi glufrrfliior?e .s-cor?jugcrfe tror?sl,orrer dari Melasto~na (Mcihlrp).
1.3. Eipotesis Pei~elitian
Hipolesis penelitian ialah fragnlen cDNA dari nirp dapat diisolasi dari Melasto~na nlenggunakan PCR dengan primer yany didesain Serdasarkan spesies lain.
1.4. Kegunaan Penelitian
Melastorna merupakrtn genus yang ~nemiliki anggota jenis (spesies) cukup besar. Salah sailt je~iisnya yang hidup dominan di tanah a s a n ialah Melcrstotncr (!fine D. Don. Jenis ini lebih dikenal dengan nama Melastoma. Melastoma
memiliki nama daerah setiggcrnen atau lirrrendong (Jawa), sikudoekdoek
(Sumatera), c~17gkoc/ok (Kalimantan) dan rhododendron (Inggris). Kedudukan Melastoma dalam taksonolni adalah sebagai berikut (Meyer 1999).
Kingdom : Plantae
Subkingdom : Tracheobionta
Superdivisi : Spermatophyta
Divisi : Magnoliopllyta
Kelas : Magnoliopsida
Subkeias : Kosidae
Ordo : Myrtales
Famili : Melasromaceae
Genus : Melastoma
Spesies : 12.1elcrsro~~ia ulfine D. Don.
Sinonim : M rnulahuthricum L. ssp. rnalabathriczrm L.,
M n~crlahuthricum Auct. Non L., M polyanthutn Blume. Melastonla inerupakan tumbuhan perdu.yang tegak dengan tinggi antzra 0.5
111 sampai 4 in. Uaun melastoma merupakan daun tunggal, bertangkai, letak berha-
Mclasto~na banyak ditemukan di daerah lropis terutama di lahan asam. sehingga sering disebut tanaman indikator tanah asam (Osaki e/ (11. 1997; Baker ef
al. 2000). Melastoma mengakun~ulasi A1 di daun teruta~na pada daun tua (Watanabe el 01. 1998). Menurut Watalrabe el 01. (2001), Melastonla tidak hanya toleran ter!:adap cekan~an Al, tetapi pertumbuhamlya juga dipacu oleh Al.
Melastolna mainpu ~ilenginaktivasi A1 yang telah masuk ke dalain sel, padahai. AI" melniliki atinitas 10.7 kali lebih h a t daripada k e ~ n a m p ~ ~ a n ~ g " terhadap domain pengikatan kofaktor pada enzim. Alurni~liu~n cenderung terikat kuat pacla konlponen sel yang ~ne~niliki gugus hidroksil, karboksil, pospzt dan sulfida. Reaktifitas A1 juga nienyebabkan terbentuknya oksida radikal (ROS, reucth~e oxigen species) yang beracun bagi sel. Melihat ketnhanan bielastoma terhadap cekainan A1 di lahan asam. teniunya tanaman ini menliliki ~nekanislne molekuler spesifik untuk menghindari pengaruh k l .
Wata~labe et 01. (2003) menyatakan bahwa A1 nlalnpu rnenelnbus jaringan endodermis dan masuk ke peinbuluh xiieln yang ketnudian ditimbun tli daun. Bukti ini menunjukkan balnva Melastoma memiliki keinal~puac Inenyerap Al, lneaobilisasi dan menimbunllya di daun tanpa meni~nbulkan nasala ah kelainan fisiologis.
Cekaman A1 dala~n kultur air dapat menlacu pertumbuhan Melaston~n (Osaki et al. 1997: Watanabe er al. 1998). Mekanislne iqduksi p e r t u ~ n b ~ ~ h a n Melastoma oleh A1 masih belum jelas. Pertumbuhan tanaman diatur oleh hormon pertumbuhan seperti auksin. sitokinin dan ABA (Wareing & Philips 1981). C e k m a n A1 pada tanalnan tcleran akan menginduksi sejulnlah gen untuk meng!lindari pengaruh ion Al. Pada Melastoma, produk gen-gen ini tidak hanya sebagai pendetoksi Al, akan tetapi juga berperan dalam ~nenggiaika~~ hor~non pertumbuhan. Detoksifikasi .41 dan peningkatan mohilitas hormon pertu:?~S.d~an ini dapat diiskukan oleh dua enzim berbeda yang ekspresinya sama-sama diinduksi 01th A1 atau ole11 satu enziln saja.
2.2. Fitotoksisitas Tanah Asam clan Aluminium
pI-I tanah di atas 5.5. Tetapi pada pI-1 di bawah 5.5, produktivitas tanaman menurun drastis dan bahkan menyebabkan kematian tanaman.
Aluminum tidak dike~lal sebagai unsur hara tanaman. Pada pH yang tinggi (basa). A1 dala~n bel~tuk Al(0Hk-, seda~lgkan pada pH netral A1 dalaln bentuk AI(0H): yang keduanya tidak larut di air dan tidak ineni~nbulkan nasala ah bagi tanaman. Alurniniu~n akan terio~~isasi ine~nbentuk AI(OH)'+ atau A]+, dan A I ( o H ) ~ ' ~ atau AI" pada pH di. bawah 5.5 dan akan terionisasi sempurna lnelnbentuk oktahedral heksahidrat AI(H~o)~'+ atau A13+ pada pH di bawah 5 (Konishi & Niyanoto 1983).
Bentuk A13+ merupakan bentuk yang paling beracun bagi kslnbuhan. A13+ ~ne~npengaruhi proses absorbsi nutrisi dan merusak struktur dan fungsi komponen sel, sehingga dapat menghentikan aktivitas rnetabolislne secara sistemik. Menurut Kinraide (1997), AI(oI-I)~~+ dan AI(OH)'+ juga menyebabkan keracunan bagi tanaman. Aluminium juga dapat berasosisasi ~nembentuk Al-silikat, .41S04+, A1(SO4)Y, AIP04, A I F ~ + dan AIF~' serta asam organik yang tidak hciacun bagi
Keracunan A1 mempakan hambatan yang paling nyata terhadap produksi pertanian di tanall asam, keracunan A1 ini lnampu menurunkan produksi tanaman 25% sampai 85%. Rendahnya produktivitas menyebabkan tanah asam yang cukup luas ini masih belutn dilnanfaatkan secara optimal sebagai lahai pertanian. Terdapat dua cara lneinanfaatkan lahan asam sebagai lahan pertanian, yaitu (1) inereklamasi lahan dengan lnenaikkan pH tanah sa~npai bat.?:, yang tidak berpengaruh pada tanaman, tetapi cara ini tidak tahan lama dan tidak efisien biaya; (2) merakit kultivar tanaman toleran di lahan asam lnelalui persilangan dan seleksi secara konvensionai atau rnelalui perakitan tanaman transgenik.
Akar merupakan organ tanalnan yakkg paling sensitif terlladap keracunan Al. A1 akan me~natikan titik tulnbuh ujung akar dan lnenghambat pemanjacgan. sel di ujung akar (Marschner 1995). Ryan er al. (1993) dan Sasaki et al. (i994) menunjukkan bahwa tanaman yang terceka~n A1 lnelniliki akar yang pendek.
pada protein ~iiembran juga menyebabkan tcrgangganyu sirkkulasi ~ a " dan berbagai senyawa hara pcnting (I-Iuang el 01. 1992; Kochiun 1995). Ion Al juga reaklif dengan asam lenlak dan menyebabkan peningkatan peroksidasi asarn lemak membran sel (Ono et 01. 1995).
A1 dapat terikat kuat pada asani nukleat dan mengganggu replikasi DNA ilalaln pembelahan sei serla transhipsi dalam ekspresi gen (Aniol 1984). Reakti- fitas A1 berpengaruh terlladap mitokonaria (de Lima & Copeland 1994), sitoske- leton (Kochian 1995; Sivaguru ei al. 1999) dan aktin kerangka sel (Grabski &
Schindler 1995). Silva et 01. (2000) memperlihatkan terhambztnya pembelahan sel di daerah meristimatis ujung akar kedelai disebabkan oleh akumulasi aluminium pada inti sel. Adanya ikatan A1 terhadap senyawa-senyawa penyusun kolnponzn sel itulah yang menyebabkan perubahaii struktur dan fisiologi sel tanaman.
Kelainan akar karena cekarnan Al akan mengganggu proses penyerapan sejumlah unsur esensial seperti fosfor, kalsium dan hara lnikro oleh buluh akar (Marschner 1995). Kelninaii akar menyebabkan terh~nbatnya penyerapan NH4 dan No3 serta terganggunya aktivitas enzirn nitrat redilktase (Cumming & Taylor 1990).
Al juga menlpengaruhi metabolislne tanaman selain oryan akar, lnisalnya terhmbztnya asimilasi CGz karena kerosekan struktur tilakoid (Pereira er rrl. 2000). Al juga menyebabkan penurunan kandungan g!ukosa, sorbitol dan karbohidrat pada daun tanaman persik (Prunuspersicrr) (Chen et al. 2005).
2.3. Mekanisme Toleransi Tanaman terhadap Cekamart Aluminium
mg.kg-' BK sepal (Ma el a/. 1997). Tanaman-tanaman keloinpok tiga ini ole11 Baker ef NI. (2000) disebut dengan tanaman hypevrrccumz//~rlor.
Taylor (1991) membagi mekanisine toleransi tanaman terhadap cekaman aluminium menjadi dua bagian. Mekanis~ne pertama ialah eksklusi, yaitu mengeluarkan A1 atau senyawa organik dari ujung akar, sehingga ion A1 tidak mencapai daerah metabolik. hlekanis~ne ini jug2 dikenal dengan nlekanisme eksternal atau eksudasi. Mekanisnie kedua adalah inklusi, yaitu detoksifikasi atau inaktivasi A1 yang telah mencapai sel dan kemudian ditimbun. Mekanisme ini juga dikenal dengan mekanisme internal.
Mekanisme eksklusi dilakukan dengan tiga cara. Pertama dengan meningkatkan selektifitas membran. Selektifitas mernbran terutama terhadap ion logan berat dapat dilakukan dengan mengatur per~neabilitas membran yaitu melalui perubahan tingkat kejenuhan asam lemak dan fosfolipid penyusun ~ne~nbran (Cumming & Taylor 1990).
Cara kedua adaiah dengan mengatur effluks ion logam. Gandum baik yang toleran maupun yang peka apabila diberi perlakuen sik!oheksamida maka akan kehilangan toleransinya, toleransi ini diduga terkait dengan produksi protein rnembrm (effluks Q A T P ~ S ~ ) (Zhang and Taylor 1989). Ryan et al. (1997) mengamati juga bahwa A1 menginduksi pembentul.an kana1 ion pada protoplas yang diisolasi dari akar gandwn.
Cara ketiga adalah dengan memodifikasi rhizosfer aka. Modifikasi dilakukan dengan melepaskan a s m organik ke perrnukaan akar. Menurut Li ef al.
(2000) asam organik yang dikeluarkan melalui akar akan mengikat untuk
menglundari pengaruh A1 terhadap siste~n yang ada di dalam daii ruang antar sel. Asam organik tersebut di antaranya adalah asan oksalat (Ma et al. 1997; Watauabe et 01. 1998), asam sitrat pada jagung (Pellet et a!. 1995; Yang et 01.
Mekanisme inaktivasi, translokasi dan kompartemenlasi A1 pada tanaman pengakumulasi Al masih belum dapat dijelaskan. Menurut Shen & Ma (2001), arah translokasi A1 dipengaruhi oleh laju transpirasi melalui xilem dan oleh pergerakan asimilat melaiui floem. Kandungan asan sitrat pada pembuluh xilem
M rnalabathricurn L. mengalami peningkatar. dengan adanya perlakuan Al, sedangkan asam inalat, asam suksinat, dan a-ketoglutarat menurun (Watanabe &
Osaki 2002a). Asan1 oksalat yang merupakan pengikat
Al
pada daun, tidak terde- teksi keberadaannya pada jaringan pembuluh xilem melastoma baik yang diberi perlakuan maupun yang tidak (Watanabe & Osaki 2002b). Dari hasil ini, Wata- nabe & Osaki (2002b) belum dapat memastikan keterlibatan asanl organik dalam translokasi Al. Pada Fagopyrum esculenlum asam sitrat diproduksi cukup tinggi baik yang diperlakukan A1 maupun yang tidak, sedangkan asam sitrat dan asan rnalat tidak mengalami perubahan dan tetap diproduksi dalam jumlah sedikit.Detoksifikasi A1 dapat dilakukan dengan cara diikatkan dengan protein kaya sisrein seperti GSH, metallotionein, fitokelatin (Pilon-Smith & Filon 2002). Menurut Larsen et al. (1996) dan Gunse er al. (1997), fitokelatin tidak efektif sebagai pengikat Al, sebab
Al
cenderung mengikat gugus karboksil atau fosfat daripada mengikat gugus sulfida yang merupakan gugus fungsional gluthatione (GSH), metallotionein dan fitokelatin. Hasil penelitian Snowden & Gardner (1993); Snowden et al. (1995) dan Wu er al. (2000) menunjukkan bahwa protein seperti metallotionein dan fitokelatin berperan dalam toleransi tanaman terhadap Al, sebab telah terdapat gen yang horr,olog dengan penyandi nletallotionein dan ekspresinya diinduksi oleh cekaman 1.1. Cobbet (2000) juga menyatakan bahwa fitokelatin efektif dalam mengikat (mengkelat) Al. Menurut Benavides (2005), gugus sulfida pada peptida kaya sistein berpotensi merniliki afinitas yang tinggi terhadap berbagai jenis ion logam. Ekspresi berlebih (over expression) enzimglutathione s-transferase (GST) mampu menlngkatkan !:etahanan tembakau
terhadap cekaman Al dan tembaga (Cu) (Ezaki et al. 2000). GST merupakan enzim yang mengkatalisis konjugasi glutathion (GSH) atau turunannya dengan berbagai senyawa elektrofilik dan hidrofobik.
~netabolit sekunder dilakukan melalui 3 tahapan yaitu (1) aktivasi senyawa toksik dengan cara oksidasi. reduksi. hidrolisis atau hidrasi; (2) konjugasi senyawa xenobiotik dengan reduktm seperti GSI-I dan turunalmya, g!ukoronida, glukosida, atau su!fat me!alui tio!asi, glikosilasi atau sulfasi; dan (3) sekresi atau penimbutlan ko~nplek GS-konjugat atau gl~kosida-konjugat di vakuola dengan meqeinbus membran melalui g/!!tnthione s-conjtrgule frcmsporter (j~ompa GS-X). I<onjugasi dikatalisis oleh enzini glutathione s-transferase atau glukosil-transferase. Konjugasi berfungsi tlnenginaktifkan dan ~neningkatkan kelarutan konjugat di dalam sitoplasma sehingga mudah untuk dimobilisasi dan ditranslokasi.
Logan1 berat seperti arsenat [As(III)] dan antimoni [Sb(III)] yang rne~niliki kesa~naan valensi dengan Al: didetoksifikasi dengan cara diikatkan dengan GSI-I tnembentuk tris(g1utathion)arsenat [As(GS)j] dan [Sb(GS)3] yang selanjutnya disekresikan ~nelalui polnpa GS-X (Muller el ul 1994; Zaman er al. 1995; Dey et
01. 1996). Mekanis~ne yang sama ditunjukkan pada detoksifikasi dan lokalisasi ion kadmilun (Cd) pada sel ragi (Li et al. 1996; Tommasini et 31. ! 996) d m tanaman (Marrs & Walbot 1997). Kadtniu~n diinaktivasi dalanl bentuk kompleh Cd(GS)l
yang ke~nudian ditimbun dalam vakuola melalui pompa GS-X.
semakin ~nelnperkuat dugaan keterlibatan polnpa GS-X dalam ketahanan melastoma terhadap cekanan Al.
2.4. Glutlzatiotz S-Corzjugute Transporter
G!zrtrr/hione s-conjz:gute transporter (pomnpa GS-X) merupakan
glikoprotein ~nembran plasma atau tonoplas yang berperan dalam transportasi berbagai s~bstrat yang telah dikonjugasikan dengan glutathione, glukoronida, glukosida atau sulfat. Pompa GS-X pada membran plasma berperan dalam ekskresi atau sekresi sel dari sitoplasma, sedangkan pompa GS-X pada tonoplas berperan dalam lokalisasi dan penimbunan senyawa yang telah diinaktivasi.
Pompa GS-X merupakan kelompok ABC transporter (ATP binding cassette
transporter). ABC transporter berperan dalam transport berbagai macam substrat yang meliputi gula, asan amino, ion logam, peptida, protein dan sejumlah besar senyawa hidrofob dan metabolit. Karakter spesifk ABC transporter ialah adanya domain pengikatan ATP (NBF, nucleotide binding fold) yang berada di sisi bagian dalam membran plasma. Pada NBF terdapat daerah terkonservasi yang disebut Walker A, B dan C (Walker et ul. 1982). ABC transporter sedikitnya memiliki dua domain NBF dan dua domain transmembran (TM). Berdasarkan pada shvktur dan kespesifikan substratnya, ABC transporter dikelompokkan menjadi tujuh
kelas yaitu ABCA, ABCB, ABCC, ABCD, ABCE, ABCF dan ABCG (Dean et al.
2001). Pompa GS-X dikelompokkan dalam kelas ABCC.
Inhibitor aklivitas pampa GS-X secara spesilik belum ada. Selama ini digunakan inhibitor vanadate yang digunakan L I I I ~ L I ~ mengidentiiikasi polnpa GS-
X. Vanadate (Vi) menyebabkan terbentuknya transisi ko~npiek MIU''MgADP'Vi pada domaia~l NBF d m mengakibatkan aktivitas pampa GS-X terhambat (Taguchi et crl. 1997).
Po~npa GS-X disandi oleh gen nzrp (rn~~liid:l~g resistin7ce ussociuted protc-
in) (Cole el al. 1992). Nama gen ini diambil dari nama ger, sebelumnya yang peranannya sama yaitu tndr (nzultidrug resistc~nce). MDli ~nerupakan protein membran yang berperan dalarn resistensi sel kanker terhadap berbagai senyawa anti kanker seperti doksorubisin, daunorubisin, vinkristin. vinblastin, VP 16, dan obai lain yang sejenis (Juliana & Ling 1976). Terdapat perbedaan aktivitas dan jenis substrat antara MDR dan M W . Aktivitas MDR tidak bergantung pada GSH seluler dan jenis substratnya hanya senyawa anion; sedangkan MPU' bergantung pada GSH seluler dan jenis substratnya senyawa anion dan non anion (Zaman ei al. 1995).
Sejak ditemukan M W l (ABCC1) pada sel kanker (Co!e et rrl. 1992), pengetahuan tentang MRP s e c a a fisiologi dan genetik berkembang sangat pesat. CM3A'T (cunalicular multispecific organic anion ircmsporter) dari pustaka cDNA jantung tikus teridentifikasi sebagai MRP2 (ABCC2) (Paulusma et al. 1997; Evers et al. 1998; Konig et al. 1999). MRP3 (ABCC?), MRP4 (ABCC4) dan MRP5 (ABCCS) selanjutnya dite~nukan oleh Kool et 01. (1997), MRP 6 (ABCC6) (Kool et al. 1999a), 2an MRP7 (ABCCIO) (Eopper et al. 2001).
bentuk GS-Fe-NO (Watts el a/. 2006) dan estron 3-sulfat (Qian et al. 2001). MRPl yang diekspresikan secara heterolog pada sel ragi dapat berperan dalam ekskresi dan penimbunan kadmium (Li et a/. 1996).
Peran polnpa GS-X dalam sekresi GSSG dan 4HNE-GS (4-hydroxynonenal- GS) diyakini berhubungan dengan ketahanan tcrhadap cekaman oksidatif, sebab GSSG dan 4HNE-GS merupakan hasil reaksi redok dengan oksida radikal (Leier et al. 1996; Renes et al. 2000). Hirrlinger et al. (2001) juga mengamati terbentuknya GSSG pada eritrosit yang diberi cekaman oksidatif. Pembentukan GSSG ini untuk menghidari kerusakan sel dari senyawa oksigen radikal.
MRP2 merupakan CMOAT (canalicztlar multispes~$city organic anion transporter) yang ada di me~nbran kanalikuli sel hepatosit (Konig et al. 1999). Mutasi MRP2 menyebabkan hiperbilimbinemia karena ketidakmampuan melokalisasi dan mengkatabolisme bilirubin. Bilirubin ditransportasikan dalam bentuk glukuronosil bilirubin (monoglukoronosil atau bisglukoronosil konjugat) (Jedlitschky et al. 1997; Paulusma et al. 1997). MRF'2 memil2 kesamaan aktivitas dan struktur dengan MRPl (Jedlitkschky et al. 1997). MRF'2 memiliki kemampuan mentransportasi konjugat dengan reduktan GSH, glukoronida dan sulfat serta senyawa yang tidak terkonjugasi seperti vinblastin dan sulfinpirazon (Evers et al. 1998). MRP2 memiliki aktivitas yang lebih efektif dan lebih luas dibandingkan dengan MRPl (Bakos et al. 2000a).
MRP3 diisolasi dari sel ginjal tikus dan memiliki kesamaan asam amino sebesar 58% dengan MRPl dan 49% dengan MRP2 (Konig et al. 1999). MRP3 berperan dalam transportasi bilirubin-GS dan metabolit asam (Ogawa et al. 2000; Hirohashi 2000). MRP1, M W 2 dan MRP3 memiliki kemampuan yang salna dalam mentransportasikan berbagai obat antikanker seperti cisplatin-GS, etspsida- GS, vincristin-GS, dan mctotreksat (Koike et al. 1997; Cui et al. 1999; Kool et al. 1999b; Zeng et al. 1999). MRP3 memiliki kemampuan mentransportasikan GSH, sedangkan MRP 1 dan MRP2 tidak memiliki kemampuan mentransportasikan GSH. Oleh karena itu, GSH diduga sebagai senyawa kotranspor dengan senyawa utanla pada MRP3 (Kool et al. 1999b).
analog nukleosida yang inerupakan obat anti ka~lker dan HIV yaitu PMEG [9-(2-
~.'hosp/ioi7,~/11?el/7o.~yel/1~~/)glli7ii7e] dan PMEA [ 9 - ( ~ - ~ ~ h o . ~ ~ ~ h o i i ~ ~ l r r r e ~ I 7 o x ~ 1 e ~ I 1 ~ / )
rrder?ine](Schuetzs el (11. 1999). MRPS juga berperan dalain transportasi tiopurin, 6-merkaptopuri!?. tioguanin. dan 6-merkaptoguanin (Wijilholds e l nl. 2000).
MRP6 dan MIW7 masih belum banyak diidei~titikasi. MRP6 tidak meiniliki kemampuan resistensi terha2::p anti kanker seperti etopsida, ieniposida. dosorubisin dan daunnrabisin (Belinsky et al. 200'2). MRP6 dilaporkan memiliki kemampuan mentranspoi~asikan epirubisin (Kuss er al. 1998).
Polnpa GS-X juga ditemukan pada L. turentolae yang merupakan protozoa penyebab penyakit leismaniasis pada manusia. Potnpa GS-X lnenyebabkan L. farcnrolcrc? resisten terhadap obat leismai~ia dan As(II1) (Dey et 01. 1996). Lebih lanjut dijelaskdn bahwa AsiIII) pada L. larenfolae diti~nbun dalatn bentuk As(GS);.
Sel ragi lnemiliki ABC transporter berukuran 1515 asan1 amino yang disebut YCFl (yeri?t cndmiu:~ .f~cto:.l) (Szczypka et al. 1994). YCFi memiliki kesamaa~l aktivitas dengan MRPI. Ragi mutan SYCFl inenyebabkan hipersensitif terhadap cekalnan kadmium. St Pierre et al. (1994) juga menganati dua gen sekretori pada sel ragi yaitu secl dan sec6, keduanya meiniliki keinarnpuan menimbun ilNP-.GS dan taurokolat. Proses transportasiilya dikategorikan sebagai ponlpa GS-X.
Li et rrl. (1996) lnengan~ati ketidakmampuan ragi strain DTY167 (mutan
6ycfl) dalaln inelokalisasi kad~nil~m. Sedangkan ragi strain DTY 165 (ragi tipe liar) inelniliki kema~npuan rnengi~kumnulasi kadmiu~n dalam bentuk Cd(GS)z di
vakuola. Sel ragi strain DTY 168 (ragi mutan Sycfl) yang ditransfonnasi oleh n n p l inanusia, ~nerniliki kerna~npuan resisten terhadap kadlnium seperti halnya strain D'TY iG5 (ragi tipe liar) (Tc.zxlasini 21 21. 1996). IvIRPl rnenyebabkan ke~namp;tsn sel ragi n!eniintw dan ~etlgekskresikan kad~niuril bersaula GSH. Fenoinena ini menunjukkan bahwa MRPl berada di ineinbran sel dan tonoplas, sedangkan ScYCF1 hanya berada di tonoplas.
menunjukkan bahwa produk gen ao-3P berada di membran sel dan YCF berada di tonoplas.
Eksplorasi MRP pada tumbuhan tidak sepesat pada hewan. Pompa GS-X telah diketahui pada sel rnesofil barley yang berperan dalam penjmbunan metabolit glikolat dan taurokolat (Hortensteiner et al. 1993). Klein et al. (1996)
juga lnengalnati mekanisme perlimbunan giukosil-hidroksipri~nisulfuron
(h~rbisida) melalui pompa GS-X, sedangkan flavonoid C-glukosida melalui
H'ATP~S~. Hinder et al. (1996) juga mengindikasikan keberadaan pompa GS-X
dalam penimbunan katabolit klorofil (tetrapyrrolic) di vakuola sel mesofil.
Gen mrp tumbuhan pertama kali diisolasi dari arabidopsis (AtMrp) (Lu et al. 1997). AtMrpl bemkuran 5.2 kb yang menyandikan 1622 asam amino. AtMRP merniliki kemiripan 55.3% dengan ScYCF dan 63.3% dengan HmMRPl. AtMRP mempakan pompa GS-X dengan substrat DNP-GS, GSSG, metholachlor-C;S
(MOC-GS), S-(2,4-dinitrophenyl)glutathione (DNP-GS) dan cyanidin 3-
glucoside-GS (C3G-GS). Ekspresi AtMRPl diinduksi oleh benoxacor, cloquintocet, fencJ~lorczo1 dan jluorazo!. Transport GS-konjugat melalui pomps GS-X telah berhasil didemonstrasikan menggunakan molekul flourescen senyawa biman (Brn) (Sidler et al. 1998).
AtMRP2 dari arabidopsis juga memiliki kemampuan yang sama dengan AtMP31 (Lu et al. 1998). Lebih lanjut dijelaskan bahwa AtMRP2 mampu
mentransportasikan konjugat glukoronida seperti 17-0-estradiol-17-(0-D-
glukoronida) [E(2)17betaG]. AtMRP3.rnemiliki substrat (DNB-GS), katabolit klorofil, dan kadmium (Tornmasini et al. 1998). Aktivitas AtMRP3 diinduksi oleh
I-chloro-2,4-ainitrobeazene (CDNB), prilnisulfuron (PS), a~~zinotriazole, benoxacor, oxabetrinil dan IRL 1803. AtMRP4 juga dipastikan sebagai pompa GS-X berdasarkan pada kelniripan arutan nuk!eotida dan deduksi proteinnya dengan AtMrp sebelumnya (Sazcliez-Femandez et al. 1998). Aktivitas AtMRP4
, diinduksi oleh asam salisila; (SA) dan menadiorie. AtMRP5 berperan dalam
AtMlll' 1 5 ditluya me~ni liki peran sebagai porn pa GS-X bertlasarkan pada kesalnaan ~tl-~ltan nuhleotida dan deduksi asam aminonya denyan /ll~\.I,.p yang telah diketahui sebelumnya.
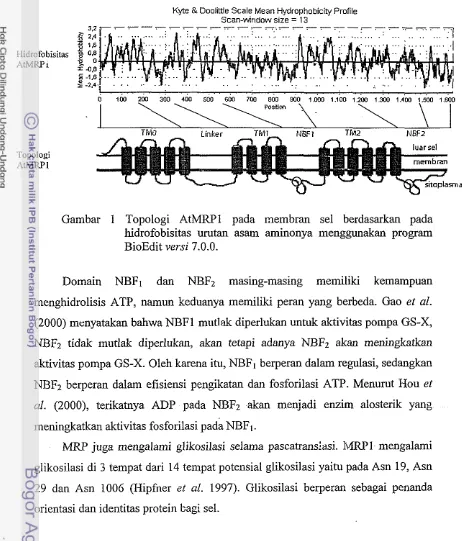
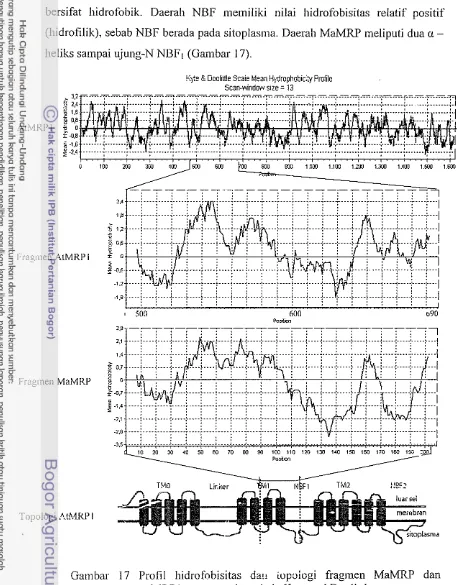
MlW terdiri atas dua atau tiga donain trans~nelnbran (TMo, TMI dan TM2) dan dua domain pengikatan ncMeotida (NBFI dan NBF2). Topologi domain pada me~nbran diprediksi berdasarkan pada pelnotongan dengan enzim proteolitik dan pola hidrofobisitas asatn aminonya (Bakos el al. 1996; Kast & Gost i997).
MRPI, MRP7. MRP3 dan MRP5 memiliki domain TMo dengan lima a- heliks transmembran. TMI dan TM2 masing-masing inemiliki enam a-heliks transmernbran, sedangkan MRP4 dan M W 5 memiliki TMI dan TM2. Deskripsi AtMRP1 (Q9CSG9) dari arabidopsis memiliki lima domain transmetnbran yaitu TMo (asam amino ke 37 sa~npai dengan 194) dengan lima a-heliks transmembran (37 - 57,73 - 93, 110 - 130, 145 - 165, dan 174 - 194). TMI (asam amino ke 302 sanil~ai dengan 2853 dengan empat a-heliks transmembran (336 - 356, 440 - 460, 527 - 547, dan 557 - 577) dan TM2 (asam amino ke 909 sampai denga? 1200) dengan enam a-heliks trailslnembran (909 - 929, 951 - 971, 1027 - 1049, 1053 -
1072, 1138 - 1 158. dan 1172 -1 192). NBFl terletak pada asam amino ke 614 sa~npai dengall 838 dengan tempat fosforilasi pada asam amino ke 649 salnpai 656. NBF2 terletak pada asam amino ke 1237 sampai dengan 1471 dengan :eii:pat fosforilasi pada asam anlino ke 1271 sampai dengan 1278. Visualisasi topologi AtMRPl yang dasarkan pada nilai hidrofobisitas asam aminonya ditunjukkan pada Gambar 1. A r M W 1 juga memiliki tempat interaksi dengan kalmodulin dan FKP421TWD1 (/wi.sred h+~ar;fil) pada asam amino ke 1231 sampai dengan 1256, interaksi dengan kalnlodulin berhubungan dengan transduksi sinyal yang secara spesifik masih belum diketahui (Geisler et 01. 2004).
Bakos et a / . (1998) menunjukkan bahwa MRPl taupa TMs ietap
Kyte & Doolime Scale Mean Hydrophobicity Profile Scan-window size = 13
. . .
Hidrofobisitas AtMW I
a t w 2 m sdo 4 w s& e w r& 40 900 rdoo 1 . h 1% r.& 1 . i ~ r.& l.&o
I
\ \ I
Topologi AtMRP 1
Gambar 1 Topologi AtMRPl pada membran sel berdasarkan pada hidrofobisitas urutan asam aminonya lnenggunakan program BioEdit versi 7.0.0.
Domain NBFl dan NBF2 masing-masing memiliki kemampuan
menghidrolisis ATP, namun keduanya memiliki peran yang berbeda. Gao et al. (2000) menyatakan bahwa NBFl mutlak diperlukan untuk aktivitas pompa GS-X, NBF2 tidak mutlak diperlukan, akan tetapi adanya NBFz akan meningkatkan aktivitas pompa GS-X. Oleh karena itu, NBFl berperan dalam regulasi, sedangkan NBF2 berperan dalam efisiensi pengikatan dan fosforilasi ATP. Menurut Hou et al. (2000), terikatnya ADP pada N B S akan menjadi enzim alosterik yang lneningkatkan aktivitas fosforilasi pada NBFI.
[image:94.567.57.519.79.620.2]BAB I11
BAHAN DAN METODE PENELITIAN
3.1. Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan September 2005 sampai dengan April 2006 di Laboratorium BIOFUN (Biotechnology Research Indonesian-The Netherlands) dan Laboratorium Genetika Molekuler dan Seluler Tanaman, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB.
3.2. Bahan Penelitian
Bahan yang digunakan dalam penelitian adalah tumbuhan melastoma (Ad
affine D. Don.) (Gambar 2) yang diambil dari lahan asam di Jasinga, Bogor. Plasmid p ~ ~ M @ - ~ Easy (Promega) (Gambar 3) digunakan sebagai vektor
pengklonan. Escherichia coli galur DH5a digunakan sebagai inang plasmid rekombinan. Primer aktin ActF (atggcagatgccgaggatat) dan ActR (cagttgtgcgacca cttgca) yang mengapit eksonl-ekson2 digunakan untuk verifkasi kualitas RNA total dan keberhasilan sintesis cDNA. Primer spesifik mrpF (gagaatcggcaattggt catcc) dan mrpR (gtagaggaatggcaggaatcaa) yang didesain berdasarkan pada cDNA AtMrpl and AtMrp2 dari A. thaliana, ScYcfl dari ragi dan HmMrpl dari manusia
[image:95.564.151.401.491.690.2]digunakan untuk mengisolasi fragmen cDNA mrp dari melastoma (MaMrp).
1 start 1 4 20 2G 31 37 43 43 49 52
Galnbar 3 Peta fisik plasnlid p ~ ~ ~ w - ~ - E u s y
3.3. Metodologi Penelitian
Penelitian ini merupakan penelitian eksploratif untuk mengisoiasi, lnengklonkan dan lnen~karakterisasi fragmen cDNA dari gen yang me~~yandi glzituthione s-conjugate trunsporter menggunakan pri~ner spesifik mrpF d m
mrpR. Tahapan penelitian dilakukan seperti disajikan pada Ga~nbar 4.
I
Isolasi RNA totalI
IDesain primer mrp
-
7
Siiltesis cDNA total.
I
Isolasi fraglnen cDNA MrpI
v
Pengklonan fraglnen cDNA MaMrp
I
I
.
(
Seleksi transforman rekombinan]
[image:96.559.79.462.90.700.2]I
3.3.1. isolasi RNA total
Isolasi RNA ~nengikuti metode LiCl (Chang E / a/. 1993) yang dimodifikasi.
Sebanyak 1 g bahan tumbuhan digerus sampai halus di dalam mortar bersa~na 0.3 g pasir kuarsa dan 10 ml bu& ekstraksi (2% CTAB, 2% PVP 25000, 100 mM Tris-HC1 pH 8, 25 mM EDTA. 2
ivf
NaCl d m 200 I ~ M P-merkapto etanolIl3ME) suhu 65 "C, ckstrak diinkubasi pada sufiu 65 "C selama 10 menit, didinginitan dan ditarnbahkan 10 ml klorofo~m:isoarnil dkohol (CI) (24:1), divorteks dan disentrifugasi dengan kecepatan 10000 rpm (setara dengan 42000xg) (Sorvall Ultra Pro 80) pada suhu 4 "C selarna 10 menit. Cairan bagian atas dipinda!kan ke tabung 20 ml baru, ditarnbahkan 2.5 M LiCl dan diinkubasi pada suhu -32 OC selama 2.5 jam, selanjutnya disentrifugasi dengan kecepatan 10000 rpm (Somall Ultra Pro 80) pada suhu 4 "C selarna 10 menit. Endapan diresuspensi dengan 500 pl TE (10 rnM Tris pH 8, 1 mM EDTA) di dalam tabung 1.5 ml, diekstraksi dengan 1 kali volume fen01 pH 9, divorteks dan disentrifugasi 14000 rpm (Jouan BR4i) pada suhu 20 "C selama 10 menit. Cairan bagian atas diambi! &andiekstraksi kembali dengan 1 volume fenol:kloroform:isoamil-alkohol (PCI) (25:24:1), divorteks dan disentrifugasi 14000 rpm pada suhu 20 "C selama 10 menit. Cairan bagian atas dipindahkan ke tabung 1.5 ml dan ditambahi dengan 2.5 M LiCl serta diinkubasi pada suhu -32 OC selama 2.5 jam. Setelah itu, tabung disentrifugasi pada 14000 rpln suhu 4 "C selama 15 menit. Endapan Zitambah 500 p1 alkol~ol 70%, disentrifugasi pada 14000 rpm pada suhu 4 "C seiama 10 menit. Endapan (RNA) dikeringkan dan diresuspensi dengan air DEPC (ddHrO yang diperlakukan dengan 0.1% (vlv) DEPC (DiethyZpyrocarbo,?ate) dan diautoklaf 121 "C selama 20 menit).
3.3.2. Kuantifikasi dan kualifikasi RNA total
K~alitas dan kuantitas RNA total hasii isolasi diteutukan dengm
spektrofotometer UV-VIS (Cecil CE 2020) paia panjang geiombang 260 prn aai
kuantitas liasil isolasi RNA j ~ g a diienlukan dengan elektrolbresis pada gel agarose 1% (FMC. USA) terde~?oturasi forrnaldehid dengan larutan penyangga MOPS [4.2 gll MOPS (3-(N-n7orpholino)i~1-opu1~e.su&)nic crcid), 0.41 dl Na- asetat, 0.37 gll Na2EDTA.HrOI. Untuk itu, 1 pl IWA dicarnpur dengan 12 111 lanrtan premiks [MOPS, 50% fvlv) formamida, 17.5% (vlv) for~naldehid dan 27.5% jvlvj air DEPC] dipanaskan G5 OC selama 10 menit, d i d i ~ g i n k a ~ ~ di es selama 5 menit da~: dibcri 116 kali volume londing dye (0.25% brornopl?enol hhrc, 0.25% xylene cyrrnol FF. 30% gliserol) dan dieleklroforesis pada tegangan 100 volt selalna 30 menit. Visualisasi dilakukar. di atas UV rrnn.slzrnzinaror GelDoc (Labquip) serela11 diwarnai dengan EtBr (0.5 pglml) selaina 30 menit d m difoto mengguna!can kamera digital (Olyrnpus). Adanya dua pita subunit RNA ribosom menunjukkan bahwa RNA total rnelniliki integritas yang baik.
3.3.3. Sintesis cDNA total
cDNA total disintesis menggunakan Szperscripi 111 Reverse T,.nnscriptas~ (Invitrogen). Komposisi siiltesis cDNA total adaid1 5 pg RNA total, lx K2'bu~Jel; 20 pn~ol primer oligo(dT). 4 mM dNTP, 10 mM DTT, 40 U enzim SuperScripl
T A " ~ ~ ~ RTase dan air DEPC dengan volume reaksi 20 pi. Sintesis cDNA dil&ckan pada suhu 52 "C selama 50 inenit. Keberl~asilan terbentuknya cDNA da11 kemumian RNA total dari DNA genom diperiksa ~nenggunakan PCR dengan primer spesifik aktin (Suharsono el 01. 2002). Komposisi reaksi PCR adalah 0.75 pI cDNA total, l x hz~J,%r taq, 30 mnM MgClz, 3 mM dNTP mix, 15 pmol primer ActF, 15 pmol primer AcrR, 4% DMSO, 0.75 U enzim taq DNA polymerase (Fermentas Inc.) dan ddH20 dengan volulne redcsi 15 p1. PCR dilakukan deagan kondisi pra-PCR 95 "C selama 5 menit, denahtrasi 94 OC sela~na 30 detik, penempelan primer 57 OC selama 30 detik, dan pemanjangan 72 OC selama 1.5 menit, dengan 35 siklus, da11 pasca-PCP, 72 "C selatna 5 menii.
3.3.4. Isolasi fragmen cDNA iuin,W.r:?
"C selama 30 detik, penempelan primer 57 O C selatna 30 detik dan pemanjangan
72 OC selatna 1.5 tnenit, siklus 35 kali, pasca-PCR 72 OC selanla 7 menit. Isolasi Sragmen Mc~Mrp dilakukan dari cDNA total daun, pucuk batang, dan ujung akar.
3.3.5. Pengklonan frag~nen cDNA Mnk1r1.1,.
Pengklonan flagmen cDNA MaMrl? dilakukan dengan cara ~nenyisipkan
fraglueti cDNA iMaMrp pada p ~ ~Ea.~y-dan ~ @mecgintroduksikan ke dalall - ~ blzteri E. coli galur DH5a.
3.3.5.1. Penyisipan fragmen cDNA MrrMrp pada vektor pGMT-E~sy
Iiasil PCR diligasikan dengan p ~ ~ ~ " - T Easy mengikuti petunjuk Promega yaitu dengan mencsunpurkan 3 pl hasil PCR, 1 p1 (10 ng) p ~ ~ Ea.sji, 1 ~ " l ~ i - ~ (40Uj T4 DNA ligase dan 5 111
2x
rapid buffer ligation, yang selanjutiiya diinlcubasi pada suhu 4 "C semalam.3.3.5.2. lntroduksi p ~ ~ ~ @ ~ - ~ n s y rekombinan ke dalam E. coli DHSu Hasil ligasi diintroduksikan ke dalam E. coli galur DH5u mengikuti tnetoae yarig dipublikasikan Suharsono (2002) yang meliputi dua tahap yaihl pembuatan
sel ko~npeten dan transformasi genetik bakteri.
(1) Pembuatan bakteri kompeten. Koloni tunggal E. coli DH5a dibiakkan dalam 2 ml media LB [1% bakto-tryptoria, 0;5% bakto-ekstrak khanir, 1% (blv) NaCl] pada suliu 37 OC semalam di inkubator bergoyang (250 rp~n). Sebanyak 100 1.11 E. coli DH5u dibiakkan keinbali dalatn 10 1111 LB pada suhu 37 "C di
inkubator bergoyang sanpai densitas bakteri 4 . 1 0 ~ - 7 . 1 0 ~ sellin1 (ODsoo,,, sama dengan 0.4 sanpai 0.5). Sebanyak 1.5 tnl kultur bakteri disentrifugasi 3000 rpm pada suhu 4 OC selana 10 menit, endapan bakteri disuspensikan dengan 495 p1 larutan penyangga transformasi (TB) (10 mM PIPES, 15 mM CaC12.2H20, 250 mM KCI, 55 rnM MnC12.4F120, pH 6.7) dan diinkubasi di es selana 10 menit. Se!siijutnya disentrifugasi dengan kecepatan 3000 rpm pada suhu 4 "C selatna 10
endapan bakteri diresuspensi dengan 5 1.25 p1 TB, ditambah 3.3 p1 CMSC dan diinkubasi di es selama 10 menit.
S L I ~ U 37 OC sela~iia 20 menit. Bakteri disebar pada media Luria Bertani A ~ a r (LA)
yang mengandung 50 p g m l ampisi!in, 10 ~ L I 100 mM isopropiltio-[3-galaklosida (IPTG) (Promega) dan 50 p1 2%(b/v) X-gal (j-bro1no-4-choloro-3-i17dolyI-/j-D- gc~lciciosiclc) (Promega) dan diinkubasi pada suhu 37 OC sernalam.
3.3.5. Seleksi transformar: rekoinhinan
E. coli DH5u yang rneliganduag vektor reko~nbinan diseleksi rnenggunakan seleksi resistensi terhadap a~iipisilin dan seleksi biru-putih. Kolorii yans tumbuh berarti bakteri transforman; sebab E. coli DH5u bar11 memiliki gel1 c~np" (ketdianan terhadap ampisilin) setelah ditransformasi oleh ~GEM'"-T Ec~sy.
Ada dua jenis \\.arna koloni yang tulnbuh yaitu koloni bir~i dan koloni putih. Koloni biru berarti bakteri transforman yang lnengandung p ~ ~ ? v i " - ~ E:I::G lion rekonibinan. sehingga gen lac2 masih ntuli d a i ~nenghasilkan enzilii
P-
galaktosidase untuk melnotong substrat X-gal yang tidak berwarnz zenjadi belwarna biru. Koloni putih berarti bakteri transforlnan yang :nengandung p ~ ~ Easy reko~nbinan, gen lac2 meliadi rusak kalcna cclsisipi oleh ~ " - ~ fragrnen DNA (it?serrional inucrivntion) d a ~ tidak akan menghasilkan enzimP-
galakkosidase.3.3.7. Analisis cDNA sisipan
Analisis cDNA sisipan dilakukan melalui PCR terhadzp koloni yang ke~nudian dari koloni yang menghasilkai aalnplifikasi sesuai cDNA sisipali diisolasi plasmidnya. Plasmid ini ke~nudian dipctong dengan enziln restriksi EcoRl untuk mengeluarkai DNA sisipan.
Koloni putih digunakan sebagai bahan cetakan de!sm PCR untuk lnendeteksi keberadaan 177,p. Untuk itu, koloni ditusuk dengall tmuk gigi
kemudian diresuspensika:i di dalan ddHzO dali dipanaskan 95 OC selalna 10 menit dan didinginkan 15 "C selaliia 5 menit. Suspensi ini dicalnpur dengall 1.5 pi bufer tirq 1 Ox, 30 mM MgCl2, 3 mM dNTP mix, 15 p1nc4 primer rnrpi., 15 pmol pritiler r~irpR, 4% DMSO, 0.75 U enzim tuq DNA polymerase (Fennentas). PCR dilakukan deng4n kondisi yang salna dengan PCR isolasi fragnien MaMrp.
Iransl'onnan rekombinan iiienggunakan prosedur Suharsono (2002). E. coii ditu~nbuhkan dalam 2 1111 media LB dan diinkubasi tli ink~~bator bergoyang (250 rpm) pada suhu 37 "C semalam. Kultur bakteri disentrifugasi dengan kecepatan 12000 rpm pad3 sullu 4 "C sela~na 10 menit. Pelet disuspensikan dengan 100 pI coltlTEG brrfj'?r . . (50 mM glukosa, 25 mM Tris pH 8, 10 mM EDTA). ditambahkan 200 111 NeC)Ii/SDS bz!ffir (1 N NaOH, 1% SDS), diboiak balik perlahan dan diinkubasi di es selama 5 menit. Selanjutnya ditambahkan 150 111 icecalsrrl bzrfir
.
.(3 M NaOAc, 11.5% a s a n asetat glasial, dHzO), dihomoge~lka~~ dan disimpan di es 3 menit. Larutan disentrifugasi 12000 rpm pada suhu 4 OC selama 5 menit. Supernatan diambil dan ditambah satu kali volume PCI, divorteks dan disentrifugasi 12000 rpm pada suhu 4 "C selan~a 5 menit. Supernatan dita~nbah dua lcali v o l ~ ~ m e etanol absolut, diinkubasi selama 5 inenit pada suhu ruang dan selanjutnya disentrifugasi 14000 rpm selama 10 menit. Pelet dikeringkan dan
setelah kering ditambahkan 100 pI TE (10 mM Tris pH 8; 1 mM EDTA). RNA
didegradasi dengan menanbahkan 100 ppin RNAse dzn dii~kubasi pada suhu 37
OC selama 30 menit. Plasmid dielektroforesis di agarose 1% pada tegangan 100 volt selama 30 menit.
3.3.8. Pengurutan DNA dan analisis fragmen MnMrp
Pengun~tan fragmen MaiLfip menggunakan DNA sequencer ABI Prism
Model 3100 Versi 3.7. 'Trutan basa nukleotida dan deduksi a s a n amino fragmen McrMrp dianalisis homologinya dengan database gen di GenBank menggunakan
program BLAST2 (Basic Local Alignment Search Tool) (http://www.ebi.ac. uWblast2). Analisis ternpat penlotongan (restriction sile) fiagmen cDNA hIrrMr~~
menggunakan program NEBCtrrrer (l~ttp:Nwww.first1naI-ket.co1ll/cutter/cut2.html).
Deduksi asam amino fragmen M u M p menggu~lakan program transicrtior?
(http://ww\~!.expasy.c!;Aools/dna.ht~nl)). Analisis kesanlaan dan filogenetik urutan nukleotida dan deduksi asam aminonya dengan nirp-mrp lain menggunakan '
prograrn MAFFT (Multiple Alignment Fast Fourier Transfornl) ver.5.8 (Katoh el rrl. 2005). Profil multiple alignme~zt ditunjukkan dala~n bentuk jal view dari program ivlSA (multiple sequence alignment) untuk mengetahui daerah terkonservasi dan daerah beragatn (http://tininani.genorne.ad.jp/-mafft/server/).
i3AB i V
NASlL DAN I'EMBAHASAN
4.1. Isolasi RNA Total
RNA total berhasil diisolasi dari daun, pucuk batang, dan ujung a!<sr tulil- bu!lan melastolna. Kuantifikasi RNA total dengan spektrofotoineter pad21 panjang gelombang 350 nm menunjukkan bahwa rendelnen isolasi RNA adalah 192.36 yg tiap g akar segar. ! 70.52 pg tiap g daun segar dan 216.96 ktg tiap g pucuk barang segar (Tabel 1). Jumlah ini ~nenunjukkan rendemen isolasi RNA yang cukup tinggi dan opfmal. Niiai rasio OD~60/ODz80 dari RNA total pada penelitian ini adalah sebesar 1.87 pada ujung akar, 1.86 pada daun dan 1.9 pada pucuk batang (Tabel 1). Manchester (1996) dan Wilfinger (1997) menyatakan bahwa rasio OD260/ODzso sebesar 1.8 salnpai 2.0 menunjukkan bahwa P\NA total yang diisolasi mempunyai keniurnian yang tinggi. Integritas RNA total dianalisis dcngan inelakukan ilei;;roforesis di gel agarose terdenaturasi ole11 for~nalde!lid (Gambar 5). Hasil ele!:troforesis RNA total menunjukkan adanya 2 pita RNA yang do~ninan pada FWA total yang diisolasi dari ujung akar, daun, dan pucuk batang pang kelnungkinan adaiah RNA riboso~nal (rRNA) 28s dan !ZS. Selain pita 2 8 s dan 18s: RNA total dari daun dewasa dan pucuk batang jug1 tnengandung pita RNA yang kenlungkinan adalah rRNA yang terdapat pada kloroplas. rRNA kloroplas berukuran 23S, 16S, dan 5s.
[image:103.559.74.460.508.671.2]G a m b a r 5 RNA total dari uju!ig a k a r (!), d a u n (2), pucuk b s t a n g (3).
Tabel 1 Hasil isolasi RNA total
-:Total RNA (&g bahan til~ubul~an segar)
192.36
w
246.96 Rasio h260lh280 1.87 1.86 I .90No
1. 2. 3.
Ballan
Ujittlg a k ~ r Daun P ~ I C U ~ batang
Absorban p a d a A260
0.22') -
4.2. Siritesis ei)N;i 'l'ut;sl
iiNA total yang telal~ diisnlasi digunakan sebagai cetakan untuk sinteds cDNA melalui proses transkripsi balik (rei~ccse ~run.scriptio~i). Transkripsi balik menggunakan primer oligo(dT), sellingga hanya inRNA yang dapat disintesis ~nenjadi cDNA karena hanya nlrCNA yang ~nengandung poly(A) pada u j u ~ y 3', sedangkan rRNA dnn ~LXNA tidah: mempunyainya. PCR dengan plirner spesifik untuk cDNA dari gen aktin digunakan sebagai kontrol untuk ~nelihnt !ceberhasilan sintesis cDNA dan kemnrnianRNA total dari DNA.
PCR dengan menggunakan primer untuk eksonl-ekson2 dari gen aktin (ActF dan ActR) dan dengan cetakan cDNA. menghasilkan pita DNA yang berukuran sekitar 450 pb (Gambar 6). Hasil ini ~nenunjukkan bahwa &aerah yang dianplifikasi adalah cDNA eksonl-ekson2 dan bnkan DNA eltsoi?!-ekson2 dari gen aktin. Anplifikasi DNA eksonl-ekson2 akan menghasilkan fragmen berukuran lebih besar daripada 450 pb karena terdapat intron antara eksonl d a l ekson2. DNA antara ekso!~! d m ekson2 berukuran sekitar 640 pb.
Teramp1ifikabinj:a cDNA dengan primer ActF dan ActR dengall uluran 450 pb menunjukkan bahwa sintesis cDNA total n~eialui proses transkripsi balik telah berlangsung dengan baik. Selain itu, ha1 ini juga lnelnbuktikan ballwa RNA total yang te!-h diisolasi ~nempunyai kualitas yang sangat bagus, kaiena selain dapat digunakan untuk mensiztesis cDNA juga terbebas dari DNA.
Garnbar 6 cCNA aktin i~asil PCR menggunakan cDNA total dari daun (I), pucuk batang (2) dan ujung akar (3) sebagai cetakan.
4.3. Isolasi Fragmen cDNA MnMrp
kandidat frag~nen gen penyandi gl:ltr/u/hio/7e s-cot?j~~gtrte /ruri.vpor/er dari ~nelastoma. Adanya DNA yang berukuran sama yaitu sekitar 640 pt. yang dihasilkan dari PCR dengan cetakan cDNA dari daun, pucuk batang, dan ujung akai. menunjukkan bahwa rnip diekspresikan pada ketiga bagian ILL c!fj';t?e (Gambar 7). Lokasi ekspresi mrp yang sama juga terjadi pada A ihrrliunrl (Geisler ei crl. 20C4). Perbedaan intensitas pita fragmen ibfc1A4i.p dari pucuk batang, daun dan ~ljung akar pada penelitian ini kemungkinana karena perbedaar: tingkat ekspresi A4crA4ip pada ketiga bagian tanamal tersebut. Perbedaan ekspresi MuAhp pada ketiga bagian h~mbuhan ini memerlukan penelitian lebih lznjut karena pada penelitian ini tidak nlenggunakan kontrol internal seperti aktin.
Galnbar 7 Fragmen MuMrp hasil PCR ~nenggunakan cDNA total dari ujung akar (I), pucuk batang (2) dan daun (3) sebagai cetakan.
4.4. Pengklonan Fragmen MnMrp
Fragmen MaMip dari daun telah diligasikan dengan plasmid p ~ ~ ~ J 4 - ~
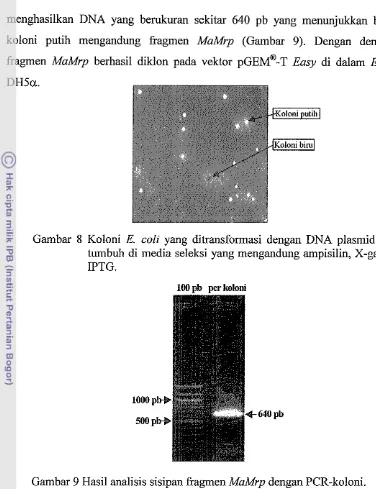
Eclsy di tengah gen lacZ. Basil ligasi kemudian diintroduksikan ke dala~n E. coli galur DriSa, yang kemudian diseleksi di media seleksi yang mengandung antibiotik ampisilin, X-gal dan IPTG. E. coli yang dapat bertahan hidup di media seleksi berarti mengandung plasmid (transforman). Koloni E. coli yang berwarna putih adalah E. coli yang lnengandung plaslnid rekombinan, dan yang berwarna biru adalah E. coli yang mengandung plaslnid non-rekornbinan (Ga~nbzr 8). Gen lac2 ~nenyandi p-gaiactosidase ((3-gal) yang ~nengubah substrat X-gal yang tidak berwarna menjadi berwarna biru. Bila fragmen MaMrp menyisip pada gen IrrcZ, Inaka gen lacZ tidak dapat diekspresikan sehingga koloni E. coli berwarna putih. Bila tidak ada penyisipan pada lncZ, ~ n a k a koloni yang terbentuk berwarna biru.
menghasilkan DNA yang berukuran sekitar 640 pb yang menunjukkan bahwa
koloni putih mengandung fragmen MaMrp (Gambar 9). Dengan demikian
fragmen MaMrp berhasil diklon pada vektor p ~ ~Easy ~ di dalam @ - E. coli ~
Gambar 8 Koloni E. coli yang ditransformasi dengan DNA plasmid yang tumbuh di media seleksi yang mengandung ampisilin, X-gal dan IPTG.
100 pb pcr koloni
Gambar 9 Hasil analisis sisipan fragmen MaMrp dengan PCR-koloni.
4.5. Anatisis Sisipan dengan Enzim EcoRl
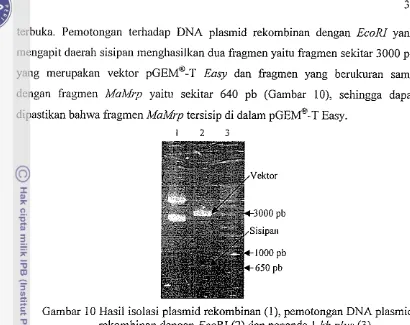
Untuk memastikan fragmen MaMrp tersisip di dalam p ~ ~Easy, ~ DNA @ - ~
[image:106.559.79.455.39.528.2]terbuka. Penlotongan terhadap
DNA
plasmid rekombinan dengan EcoRI yang mengapit daerah sisipan tnenghasilkan dua fiagmen yaitu fragmen sekitar 3000 pbyang merupakan vektor
GEM@-T
Easy dan fragmen yang berukuran samadengan fragmen Makfr,~ yaitu sekitar 640 pb (Gambar lo), sehingga dapat
dipastikan baltwa frag~nen MuMrp tersisip di dalam p ~ ~Easy. ~ @ - ~
1 2 3
Gambar 10 Hasil isolasi plaslnid rekombinan (I), pernotongan
DNA
plasmid rekgmbinan dengan EcoRI (2) dz. peiimda 1 kbplus (3).4.6. Pengurutan Fragmen MnMrp dan Deduksi Asam Aminonya
Pengurutail fragmen MuMrp pada plasmid p ~ ~Easy menggunakan ~ @ - ~ primer sp6 diperoleh sisipan sebesar 633 pb yang tneilyandi 209 asam amino. Urutan
DNA
dan asam amino yang dideduksi dari urutan3NA
tersebut disajikanpada Gallbar 11. Urutan nukleotida lengkap dari hasil penga~natan
DNA
menggunakan primer Sp6 disajikan pada lampiran 1..
g a g a a t t g g y c a a t a a y g t c a t c g t a a a a t g t t a t g c c t g c t g g g g g a g c c t t c g t g g t g t g c a a t a c g a a t 80
E L G N K V I V K C Y A W E K S L Q S R V H A I R N 2 6
g a a g a g c t t t c t t g g t t c c y t c g a y c a c a g c t c c t a t c c g t t t c c t t t t g c c t t t g t t t 152
E E L S W F R R A Q L L S A F N N F I L N S I P V V 5 2
c t c t t c g c a a t c t t a c g y t t t c c f f t g a a c c t g ~ t ~ ~ ~ ~ a t t c t g g t t g t g g - t g t t a 314
L F A 1 L R L P L N L L P N I A T Q V T I I A I . i V S L 104
c a a c g c t L g g a a g a a c t a c t g t c a a c c g a a c a g t q c a a a g c t g t t c a g t g g a a y g g a g a a c a t a g t g a g g 392
Q R L E E L L S T E Q C K A Q L Q N M E E E N I V R 130
I
agyacyagggacgatcatgaccctcagaggagtcctggyggygtgccgacgacgaacatcgatcggacgctggaacc C 7 1R T R D D H D P Q R S P G G V H D D E H R S D A G T 156
I
t g t a c g a a g t y c c t c y a g g c g c t g g t g y t c g g c t c t t t a c a g t c g t t g g g g t t g a g g t t g a c 5 4 8
C T K C L E A L V V G S L Q D G P R S G G D E Q V D 182
g a a q c a a g a g a t g a c a t g t c a y a a a c a c a a a g a g c t t c y g g g a c t t c t g t g g g t c c a t t g a t t c c t g c a t t 626
E G R D D M S E T Q R A S G T L L T G D P L I P A I 208
I t c t t a a t 633 I
[image:107.559.65.475.25.350.2]4.7.1. Analisis Icese,jajaran f r a g n ~ e n MnMrp dengan data gen tli Ger~Brrrzk
Analisis kese.jajaran urutan nukleotida fraginen MuMrp dengan clrr~crbnse DNA di Ge17Bm7k menggunakan program BLAST (Bu.ric LocrilA!:~;1nrer7/ Searcll Tool). BLAST inerupakan program penyejhjaran bagian tirutan basa nukleo:ida atau asam a~nino (local rrlign~i~eni) yang i~ie~niliki niiai (skor) paling tinggi. Locrrl nligi7ment sangat tisrarti dan bergilna dalain analisis kesejajaran antar gel,, sebab lnencakup daerah terkonserx-asi yang merupakan domain utalna suatu gen. Oleh karena itu, BLAST dapat digunakan sebagai alat untuk rnenentukan identitas suatu frag~nen DNA yang be!~lm diketaliui berdasar tingkat ho~nologi dengan gen atau fragmen DNA yang telah dikerallui di GenBunk (Mount 200 1).
Iiasil penyejajaran fragmen X.iuiMr~> inenggunakan BLAST inenunjukkan bahwa fragmen MaMrp memput~yai kesamaan 70% dengaii bagian paten WOO216655 (AX506697), peten WOO3000898 (AX65 15 19); bagiaii AthIrpl
(AF008124), dan 69?6 dci+x bagian AtMrp2 (AF020288) yang semuanya
~nerupakan rnlp dari A. tl~uliri~~u. Hasil selengkapnya disajikan pada 1,ampiren 2. Dengan demikian, fragmen IvlcrMr~~ dipastikan sebagai fraginen gen yang inenyandi glzrtcrtl7ione s-conjz~gate rrtrnsporter.
4.7.2. Analisis situs pemol'ocgan fragmen MnMrp
@5 ..,,.-.,- Linear Sequence: Klon 2.1
rnLabs,"
lEmiEa C I r m ca* Emgw n m s&
- NEB single cutter restriction enzymes 1 I blmt md W a l l a b l e C w lm
im O t l r i Su,!PIleP
.Main non.ov&apping, 1M) aa Oms
-:
1 5' ~ ~ i C m C l d l l Y M W I I I a b I C-
1 3, cxtlmim f: c l wafrected tyGC=49%, AT=Sl%
-
I Cvif I rtraxl U: teor.nane>: cleavnee a ( ~ e c t ~ M %M,"h.*I- site
Gambar 12 Peta restriksi pada fiagmen MaMrp menggunakan program
NEBCutter.
4.7.3. Analisis kesamaan dan filogenetik fragmen MaMrp dengan fragmen
mrp lain
Analisis kesamaan urutan nukleotida fiagmen MaMrp dan fiagmen mrp lain dari berbagai organisme yang ada di GenBank disajikan dalam matriks kesamaan pada Tabel 2. Fragmen MaMrp memiliki kesamaan tertinggi dengan AtMrpl3 sebesar 55.9%, berikutnya 54.8% dengan AtMrpl2, 54.7% dengan AtMrpl, 53.6%
dengan AtMp2 yang masing-masing dari arabidopsis dan 52% dengan OsMrp
dari padi. Fragrnen MaMrp memiliki kesamaan 39.9% dengan HmMrp dari
manusia dan 3 1.8% dengan ScYcfl dari sel ragi. Kesamaan antar mrp merupakan hasil dari penyejajaran seluruh fragmen mrp yang meliputi daerah terkonservasi dan daerah variasi. Dengan dernikian nilai kesamaannya lebih rendah dibandingkan dengan hasil BLAST yang hanya menyejajarkan daerah yang terkonservasi. Kesamaan antar mrp pada matrik kesamaan jauh lebih rendah dibandingkan dengan h a i l BLAST. Hal ini disebabkan oleh besarnya daerah
variasi yang terdapat antara domain TM1 (transmembranl) sampai NBFl
[image:109.559.84.485.56.290.2]