ABSTRAK
MUCHAMMAD ZAINAL ARIEF. Aktivitas Selulolitik beberapa Kapang. Dibimbing oleh GAYUH RAHAYU dan ANJA MERYANDINI.
Selulosa adalah komponen utama penyusun dinding sel tumbuhan dan merupakan biopolimer yang jumlahnya paling melimpah di alam. Selulosa di alam didegradasi oleh mikroorganisme dengan memproduksi enzim selulase yang terdiri atas endoglukanase, eksoglukanase, dan selobiase. Penelitian ini bertujuan untuk mengetahui kemampuan selulolitik beberapa isolat kapang. Sebanyak 42 isolat kapang diuji aktivitas selulolitiknya pada media agar-agar CMC. T. reesei QM6a digunakan sebagai isolat pembanding. Aspergillus niger, Aspergillus ornatus, dan Paecilomyces sp. memiliki indeks selulolitik pada media agar-agar CMC yang relatif lebih tinggi daripada isolat yang lain. Aktivitas CMC-ase A. niger dan A. ornatus optimum pada hari ke-3, CMC-ase Paecilomyces sp. optimum pada hari ke-5, sedangkan T. reesei QM6a optimum pada hari ke-2. Aktivitas CMC-ase, avisel-ase dan FP-ase tertinggi dimiliki oleh A. ornatus dengan nilai masing-masing yaitu 0.550 nkat/ml, 0.077 nkat/ml, dan 0.255 nkat/ml. Aktivitas CMC-ase A. ornatus mencapai optimum pada suhu 30 0C, sedangkan tingkat kemasaman optimumnya adalah pH 7.
ABSTRACT
MUCHAMMAD ZAINAL ARIEF. Cellulolytic Activity of Some Molds. Under supervisor GAYUH RAHAYU and ANJA MERYANDINI.
PENDAHULUAN
Latar Belakang
Selulosa adalah komponen utama penyusun dinding sel tumbuhan dan merupakan biopolimer yang jumlahnya paling melimpah di alam. Selulosa merupakan polimer glukosa tak bercabang yang terdiri atas unit-unit D-glukosa yang dihubungkan oleh ikatan β-1,4-glikosidik membentuk molekul selobiosa. Molekul ini membentuk selulosa dalam rantai panjang. Tiap rantai dihubungkan oleh ikatan hidrogen dan van der waals (Perez et al. 2002).
Selulosa di alam biasa didegradasi oleh serangga, cacing tanah, cendawan dan bakteri. Akan tetapi, cendawan merupakan dekomposer selulosa yang umum ditemukan. Cendawan yang mampu menguraikan selulosa berasal dari kelompok Ascomycota, Basidiomycota, Zigomycota, dan Deuteromycota (Moore-Landecker 1996).
Mikroorganisme mendegradasi selulosa menjadi monomernya dengan memproduksi enzim ekstraselular yaitu selulase. Enzim selulase terdiri atas endoglukanase atau endo-β-1,4-glukanase (EC 3.2.1.4), eksoglukanase atau ekso-β-1,4-glukanase (EC 3.2.1.74), dan selobiase atau -β -1,4-glukosidase (EC 3.2.1.91) (Saczi et al. 1986; Lynd et al. 2002; Perez et al. 2002). Sistem enzim tersebut bekerja pada substrat yang spesifik. Enzim endoglukanase memotong secara acak ikatan internal selulosa amorf sedangkan enzim eksoglukanase bekerja pada ujung tereduksi dan tak tereduksi dari rantai selulosa sehingga menghasilkan molekul selobiosa yang akan dihidrolisis oleh enzim selobiase menjadi monomernya yaitu glukosa.
Selulosa dapat dikelompokkan berdasarkan sifat ikatan glukosa penyusunnya. Carboxymetilcellulose (CMC) dan Avisel merupakan selulosa semisintetik komersial yang mampu menginduksi selulase. CMC merupakan selulosa amorf sehingga dapat larut dalam air sedangkan avisel merupakan tepung selulosa mikrokristalin. Kertas saring Whattman merupakan substrat majemuk yang memiliki bagian amorf dan kristalin dari struktur selulosa (Maheshwari 2005).
Limbah lignoselulosa tumbuhan dengan komponen utamanya selulosa jumlahnya sangat melimpah. Limbah tersebut dapat
dimanfaatkan sebagai kompos dan sumber energi terbarukan yang ramah lingkungan. Di Indonesia, selulosa sebagai sumber energi terbarukan baru sampai tahap penelitian. Potensinya yang besar mendorong pemanfaatan selulosa sebagai sumber energi masa depan menggantikan sumber bahan bakar fosil. Langkah awal dari pemanfaatan itu membutuhkan enzim perombak selulosa. Oleh karena itu, penelitian tentang mikroorganisme yang mampu mendegradasi selulosa perlu dilakukan.
Tujuan
Penelitian ini bertujuan untuk mengetahui kemampuan selulolitik beberapa isolat kapang.
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret hingga Desember 2008, bertempat di Laboratorium Mikologi Departemen Biologi, FMIPA, IPB.
BAHAN DAN METODE
Bahan dan Alat
Alat yang digunakan adalah penangas air, erlenmeyer, autoklaf, cawan petri, inkubator, dan peralatan umum laboratorium Mikologi. Bahan yang digunakan adalah 42 isolat kapang koleksi IPBCC, dan isolat Trichoderma reesei QM6a (IPBCC 93.260) sebagai isolat pembanding (Lampiran 1), media agar-agar dekstrosa kentang (ADK), media carboxymetilcellulose (CMC), avisel, kertas saring atau filter paper (FP) Whatman no. 1, pereaksi 3,5-asam dinitro salisilat (DNS), glukosa, dan Bovin Serum Albumin (BSA).
Metode
Persiapan inokulum. Inokulum diperoleh dari peremajaan biakan kapang. Biakan ditumbuhkan dalam media CMC dan digunakan sebagai sumber inokulan.
PENDAHULUAN
Latar Belakang
Selulosa adalah komponen utama penyusun dinding sel tumbuhan dan merupakan biopolimer yang jumlahnya paling melimpah di alam. Selulosa merupakan polimer glukosa tak bercabang yang terdiri atas unit-unit D-glukosa yang dihubungkan oleh ikatan β-1,4-glikosidik membentuk molekul selobiosa. Molekul ini membentuk selulosa dalam rantai panjang. Tiap rantai dihubungkan oleh ikatan hidrogen dan van der waals (Perez et al. 2002).
Selulosa di alam biasa didegradasi oleh serangga, cacing tanah, cendawan dan bakteri. Akan tetapi, cendawan merupakan dekomposer selulosa yang umum ditemukan. Cendawan yang mampu menguraikan selulosa berasal dari kelompok Ascomycota, Basidiomycota, Zigomycota, dan Deuteromycota (Moore-Landecker 1996).
Mikroorganisme mendegradasi selulosa menjadi monomernya dengan memproduksi enzim ekstraselular yaitu selulase. Enzim selulase terdiri atas endoglukanase atau endo-β-1,4-glukanase (EC 3.2.1.4), eksoglukanase atau ekso-β-1,4-glukanase (EC 3.2.1.74), dan selobiase atau -β -1,4-glukosidase (EC 3.2.1.91) (Saczi et al. 1986; Lynd et al. 2002; Perez et al. 2002). Sistem enzim tersebut bekerja pada substrat yang spesifik. Enzim endoglukanase memotong secara acak ikatan internal selulosa amorf sedangkan enzim eksoglukanase bekerja pada ujung tereduksi dan tak tereduksi dari rantai selulosa sehingga menghasilkan molekul selobiosa yang akan dihidrolisis oleh enzim selobiase menjadi monomernya yaitu glukosa.
Selulosa dapat dikelompokkan berdasarkan sifat ikatan glukosa penyusunnya. Carboxymetilcellulose (CMC) dan Avisel merupakan selulosa semisintetik komersial yang mampu menginduksi selulase. CMC merupakan selulosa amorf sehingga dapat larut dalam air sedangkan avisel merupakan tepung selulosa mikrokristalin. Kertas saring Whattman merupakan substrat majemuk yang memiliki bagian amorf dan kristalin dari struktur selulosa (Maheshwari 2005).
Limbah lignoselulosa tumbuhan dengan komponen utamanya selulosa jumlahnya sangat melimpah. Limbah tersebut dapat
dimanfaatkan sebagai kompos dan sumber energi terbarukan yang ramah lingkungan. Di Indonesia, selulosa sebagai sumber energi terbarukan baru sampai tahap penelitian. Potensinya yang besar mendorong pemanfaatan selulosa sebagai sumber energi masa depan menggantikan sumber bahan bakar fosil. Langkah awal dari pemanfaatan itu membutuhkan enzim perombak selulosa. Oleh karena itu, penelitian tentang mikroorganisme yang mampu mendegradasi selulosa perlu dilakukan.
Tujuan
Penelitian ini bertujuan untuk mengetahui kemampuan selulolitik beberapa isolat kapang.
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret hingga Desember 2008, bertempat di Laboratorium Mikologi Departemen Biologi, FMIPA, IPB.
BAHAN DAN METODE
Bahan dan Alat
Alat yang digunakan adalah penangas air, erlenmeyer, autoklaf, cawan petri, inkubator, dan peralatan umum laboratorium Mikologi. Bahan yang digunakan adalah 42 isolat kapang koleksi IPBCC, dan isolat Trichoderma reesei QM6a (IPBCC 93.260) sebagai isolat pembanding (Lampiran 1), media agar-agar dekstrosa kentang (ADK), media carboxymetilcellulose (CMC), avisel, kertas saring atau filter paper (FP) Whatman no. 1, pereaksi 3,5-asam dinitro salisilat (DNS), glukosa, dan Bovin Serum Albumin (BSA).
Metode
Persiapan inokulum. Inokulum diperoleh dari peremajaan biakan kapang. Biakan ditumbuhkan dalam media CMC dan digunakan sebagai sumber inokulan.
hasilnya dibagi dengan diameter koloni. Tiga isolat yang memiliki aktivitas selulolitik tertinggi diuji aktivitas selulolitiknya secara kuantitatif.
Aktivitas selulase secara kuantitatif. Sebelum aktivitas selulase kuantitatif pada berbagai sumber selulosa (CMC, avisel, dan FP Whatman no. 1) dari isolat-isolat terpilih ditetapkan, masa inkubasi optimum untuk produksi enzim ditetapkan terlebih dahulu pada medium cair CMC dengan mengamati aktivitas selulase harian. Sebanyak lima potong inokulum (diameter 5 mm) berumur empat hari yang berasal dari isolat terpilih dimasukkan ke dalam 100 ml media cair CMC 1 % dan diinkubasi pada mesin penggoyang. Kemudian sebanyak 4 ml filtrat diambil setiap hari untuk diambil ekstrak kasar enzimnya. Ekstrak kasar enzim diperoleh dengan mensentrifugasi filtrat hasil kultur pada kecepatan 4000 g selama 10 menit pada suhu 4 0C. Aktivitas selulase harian ditetapkan berdasarkan metode Miller (1959) dengan cara mencampurkan 1 ml ekstrak kasar enzim dalam 1 ml CMC cair pada bufer fosfat 0.2 M pH 7 dan diinkubasi pada suhu ruang selama 60 menit. Kemudian ke dalam campuran tersebut ditambahkan 2 ml DNS, diinkubasi pada suhu 100 0C selama 15 menit, dan diukur absorbansinya pada panjang gelombang 540 nm. Produksi optimum enzim ditetapkan berdasarkan aktivitas selulase tertinggi pada periode inkubasi. Masa produksi optimum akan digunakan untuk penetapan aktivitas enzim pada berbagai sumber selulosa. Aktivitas enzim dinyatakan dalam nkat/ml. Perhitungan aktivitas enzim selulase dinyatakan dalam nkat/ml. Satu unit aktivitas selulase didefinisikan sebagai jumlah enzim yang dibutuhkan untuk menghasilkan 1 μ mol glukosa dalam satu menit dan satu unit aktivitas enzim setara dengan 16.67 nkat/ml (Dybkaer 2001).
Uji aktivitas selulase pada substrat avisel dilakukan dengan menambahkan sebanyak 2 ml ekstrak kasar enzim ditambahkan 2 ml avisel kemudian disentrifugasi pada 3500 g selama 15 menit pada kondisi uji. Sebanyak 2 ml supernatan diambil dan ditambahkan 2 ml DNS kemudian absorbansinya diukur pada panjang gelombang 540 nm. Untuk substrat FP, 2.5 potong substrat FP berukuran 1 x 6 cm2 dimasukkan kedalam 2.5 ml bufer dan 5 ml enzim ekstrak kasar. Campuran enzim ekstrak kasar dan substrat FP diinkubasi pada kondisi uji.
Suhu dan pH optimum aktivitas enzim. Suhu optimum aktivitas selulase diukur dengan cara menginkubasi ekstrak kasar enzim pada substrat CMC 1 % pada suhu 30 0C, 40 0C, 50 0C, 60 0C, dan 70 0C, sedangkan pH optimum ditetapkan dengan cara menginkubasi ekstrak kasar enzim pada substrat CMC 1 % pada pH 3, 4, 5, 6, dan 7.
Kadar protein dan aktivitas spesifik enzim. Kadar protein diukur berdasarkan metode Bradford (1976). Sebanyak 400 μ l enzim ekstrak kasar dengan 4 ml reagen Bradford, dikocok dengan vorteks, diukur pada panjang gelombang 595 nm. Standar protein yang digunakan ialah bovin serum albumin (BSA). Aktivitas spesifik enzim dinyatakan dalam nkat per mg protein (nkat/mg).
HASIL
Aktivitas selulase kualitatif beberapa isolat kapang
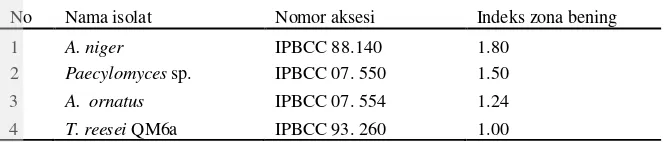
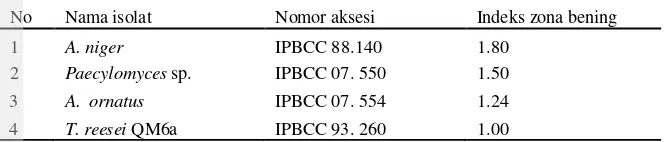
Semua isolat yang ditumbuhkan pada media agar-agar CMC 1 % membentuk zona bening setelah diwarnai dengan pewarna merah kongo 0.1 % (Lampiran 1). Sebanyak 39 isolat dari 42 isolat yang diuji memiliki nilai indeks selulolitik yang lebih tinggi dari daripada isolat pembanding. Dari 39 isolat ini dipilih tiga isolat dengan nilai indeks selulolitik tertinggi dengan tingkat kecerahan agar yang lebih baik. Tiga isolat tersebut yaitu Aspergillus niger IPBCC 88.140, A. ornatus IPBCC 07.554 dan Paecilomyces sp. IPBCC 07. 550.
Nilai indeks selulolitik ketiga isolat tersebut yaitu 1.80, 1.24, dan 1.50, sedangkan indeks selulolitik isolat T. reesei QM6a yaitu 1.00 (Tabel 1). Ketiga isolat tersebut dipilih untuk uji kuantitatif.
Periode inkubasi optimum produksi Periode inkubasi optimum bagi produksi selulase bervariasi tergantung pada jenis kapangnya. Aktivitas selulolitik isolat T. reesei QM6a mencapai optimum pada hari ke-2 dengan nilai aktivitas 0.121 nkat/ml kemudian terus turun sampai hari ke-6 (Gambar 1). Aktivitas selulolitik isolat A. niger dan A, ornatus berturut-turut mencapai optimum pada hari ke-3 dengan nilai aktivitas berturut-turut 0.342 nkat/ml dan
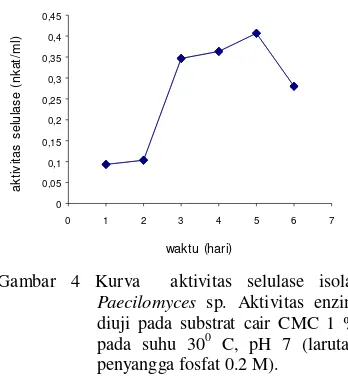
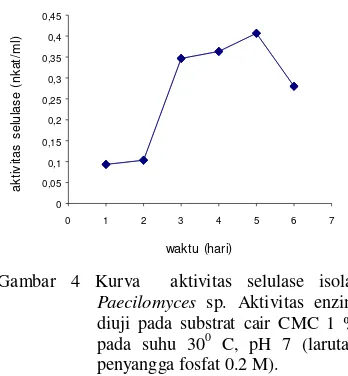
0.550 nkat/ml (Gambar 2 & Gambar 3). Aktivitas selulase isolat Paecilomyces sp. mencapai optimum pada hari ke-5 dengan nilai aktivitas 0.406 nkat/ml (Gambar 4).
hasilnya dibagi dengan diameter koloni. Tiga isolat yang memiliki aktivitas selulolitik tertinggi diuji aktivitas selulolitiknya secara kuantitatif.
Aktivitas selulase secara kuantitatif. Sebelum aktivitas selulase kuantitatif pada berbagai sumber selulosa (CMC, avisel, dan FP Whatman no. 1) dari isolat-isolat terpilih ditetapkan, masa inkubasi optimum untuk produksi enzim ditetapkan terlebih dahulu pada medium cair CMC dengan mengamati aktivitas selulase harian. Sebanyak lima potong inokulum (diameter 5 mm) berumur empat hari yang berasal dari isolat terpilih dimasukkan ke dalam 100 ml media cair CMC 1 % dan diinkubasi pada mesin penggoyang. Kemudian sebanyak 4 ml filtrat diambil setiap hari untuk diambil ekstrak kasar enzimnya. Ekstrak kasar enzim diperoleh dengan mensentrifugasi filtrat hasil kultur pada kecepatan 4000 g selama 10 menit pada suhu 4 0C. Aktivitas selulase harian ditetapkan berdasarkan metode Miller (1959) dengan cara mencampurkan 1 ml ekstrak kasar enzim dalam 1 ml CMC cair pada bufer fosfat 0.2 M pH 7 dan diinkubasi pada suhu ruang selama 60 menit. Kemudian ke dalam campuran tersebut ditambahkan 2 ml DNS, diinkubasi pada suhu 100 0C selama 15 menit, dan diukur absorbansinya pada panjang gelombang 540 nm. Produksi optimum enzim ditetapkan berdasarkan aktivitas selulase tertinggi pada periode inkubasi. Masa produksi optimum akan digunakan untuk penetapan aktivitas enzim pada berbagai sumber selulosa. Aktivitas enzim dinyatakan dalam nkat/ml. Perhitungan aktivitas enzim selulase dinyatakan dalam nkat/ml. Satu unit aktivitas selulase didefinisikan sebagai jumlah enzim yang dibutuhkan untuk menghasilkan 1 μ mol glukosa dalam satu menit dan satu unit aktivitas enzim setara dengan 16.67 nkat/ml (Dybkaer 2001).
Uji aktivitas selulase pada substrat avisel dilakukan dengan menambahkan sebanyak 2 ml ekstrak kasar enzim ditambahkan 2 ml avisel kemudian disentrifugasi pada 3500 g selama 15 menit pada kondisi uji. Sebanyak 2 ml supernatan diambil dan ditambahkan 2 ml DNS kemudian absorbansinya diukur pada panjang gelombang 540 nm. Untuk substrat FP, 2.5 potong substrat FP berukuran 1 x 6 cm2 dimasukkan kedalam 2.5 ml bufer dan 5 ml enzim ekstrak kasar. Campuran enzim ekstrak kasar dan substrat FP diinkubasi pada kondisi uji.
Suhu dan pH optimum aktivitas enzim. Suhu optimum aktivitas selulase diukur dengan cara menginkubasi ekstrak kasar enzim pada substrat CMC 1 % pada suhu 30 0C, 40 0C, 50 0C, 60 0C, dan 70 0C, sedangkan pH optimum ditetapkan dengan cara menginkubasi ekstrak kasar enzim pada substrat CMC 1 % pada pH 3, 4, 5, 6, dan 7.
Kadar protein dan aktivitas spesifik enzim. Kadar protein diukur berdasarkan metode Bradford (1976). Sebanyak 400 μ l enzim ekstrak kasar dengan 4 ml reagen Bradford, dikocok dengan vorteks, diukur pada panjang gelombang 595 nm. Standar protein yang digunakan ialah bovin serum albumin (BSA). Aktivitas spesifik enzim dinyatakan dalam nkat per mg protein (nkat/mg).
HASIL
Aktivitas selulase kualitatif beberapa isolat kapang
Semua isolat yang ditumbuhkan pada media agar-agar CMC 1 % membentuk zona bening setelah diwarnai dengan pewarna merah kongo 0.1 % (Lampiran 1). Sebanyak 39 isolat dari 42 isolat yang diuji memiliki nilai indeks selulolitik yang lebih tinggi dari daripada isolat pembanding. Dari 39 isolat ini dipilih tiga isolat dengan nilai indeks selulolitik tertinggi dengan tingkat kecerahan agar yang lebih baik. Tiga isolat tersebut yaitu Aspergillus niger IPBCC 88.140, A. ornatus IPBCC 07.554 dan Paecilomyces sp. IPBCC 07. 550.
Nilai indeks selulolitik ketiga isolat tersebut yaitu 1.80, 1.24, dan 1.50, sedangkan indeks selulolitik isolat T. reesei QM6a yaitu 1.00 (Tabel 1). Ketiga isolat tersebut dipilih untuk uji kuantitatif.
Periode inkubasi optimum produksi Periode inkubasi optimum bagi produksi selulase bervariasi tergantung pada jenis kapangnya. Aktivitas selulolitik isolat T. reesei QM6a mencapai optimum pada hari ke-2 dengan nilai aktivitas 0.121 nkat/ml kemudian terus turun sampai hari ke-6 (Gambar 1). Aktivitas selulolitik isolat A. niger dan A, ornatus berturut-turut mencapai optimum pada hari ke-3 dengan nilai aktivitas berturut-turut 0.342 nkat/ml dan
0.550 nkat/ml (Gambar 2 & Gambar 3). Aktivitas selulase isolat Paecilomyces sp. mencapai optimum pada hari ke-5 dengan nilai aktivitas 0.406 nkat/ml (Gambar 4).
0 0,02 0,04 0,06 0,08 0,1 0,12 0,14
0 2 4 6 8
Waktu (hari) a k ti v it a s s e lu las e (n k a t/ m l)
Gambar 1 Kurva aktivitas selulase isolat T. reesei QM6a. Aktivitas enzim diuji pada substrat cair CMC 1 % pada suhu 300 C, pH 7 (larutan penyangga fosfat 0.2 M)
0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4
0 1 2 3 4 5 6 7
waktu (hari) a k ti v it a s s el u la s e (nk a t/ m l)
Gambar 2 Kurva aktivitas selulase isolat
A. niger. Aktivitas enzim diuji pada substrat cair CMC 1 % pada suhu 300 C, pH 7 (larutan penyangga fosfat 0.2 M).
0 0,1 0,2 0,3 0,4 0,5 0,6
0 1 2 3 4 5 6 7
waktu (hari) a k ti v it a s s el u la s e (nk a t/ m l)
Gambar 3 Kurva aktivitas selulase isolat
A. ornatus. Aktivitas enzim diuji pada substrat cair CMC 1 % pada suhu 300 C, pH 7 (larutan penyangga fosfat 0.2 M).
0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4 0,45
0 1 2 3 4 5 6 7
waktu (hari) a k ti v it as s e lu las e (nk a t/ m l)
Gambar 4 Kurva aktivitas selulase isolat
Paecilomyces sp. Aktivitas enzim diuji pada substrat cair CMC 1 % pada suhu 300 C, pH 7 (larutan penyangga fosfat 0.2 M).
Aktivitas CMC-ase , Avisel-ase, dan FP-ase.
Aktivitas selulase (CMC-ase, avisel-ase, dan FP-ase) dari tiga isolat terpilih bervariasi tetapi relatif lebih tinggi dari isolat pembanding. Diantara ketiga isolat terpilih, A. ornatus memiliki aktivitas selulase tertinggi. Aktivitas CMC-ase, avisel-ase, dan FP-ase A. ornatus berturut-turut sebesar 0.550 nkat/ml, 0.077 nkat/ml, dan 0.255 nkat/ml (Tabel 2). Dua isolat dengan aktivitas selulase yang relatif tinggi yaitu A. ornatus dan Paecilomyces sp. dipilih untuk karakterisasi suhu dan pH.
Suhu dan pH optimum aktivitas selulase A. ornatus dan Paecilomyces sp.
Aktivitas selulase Paecilomyces sp. dan A. ornatus optimum pada suhu 30 0C dengan nilai aktivitas masing-masing yaitu 0.406 nkat/ml dan 0.550 nkat/ml (Tabel 3) kemudian aktivitasnya menurun seiring dengan kenaikan suhu. Aktivitas selulase Paecilomyces sp. optimum pada pH 4 sedangkan A. ornatus optimum pada pH 7 (Tabel 4).
Kadar protein dan aktivitas spesifik enzim.
Kadar protein keempat isolat yang diuji relatif sama, namun aktivitas spesifik tertinggi dimiliki oleh isolat A. ornatus yaitu 5.612 (nkat/mg) sedangkan aktivitas spesifik terendah dimiliki oleh isolat T. reesei QM6a yaitu 1.287 (nkat/mg) (Tabel 5)
Tabel 1Nilai indeks zona bening isolat A. niger, Paecilomyces sp, A. ornatus, dan T. reesei
QM6a yang diinkubasi pada media agar-agar CMC 1% selama tiga hari
No Nama isolat Nomor aksesi Indeks zona bening
1 A. niger IPBCC 88.140 1.80
2 Paecylomyces sp. IPBCC 07. 550 1.50
3 A. ornatus IPBCC 07. 554 1.24
4 T. reesei QM6a IPBCC 93. 260 1.00
Tabel 2 Aktivitas CMC-ase, avisel-ase, dan FP-ase. Aktivitas enzim diuji pada media cair CMC 1 % pada suhu 300 C, pH 7 (bufer fosfat 0.2 M).
Nama isolat Nomor aksesi
CMC-ase (nkat/ml)
Avisel-ase (nkat/ml)
FP-ase (nkat/ml)
A. niger IPBCC 88. 140 0.342 0.009 0.074
Paecylomyces sp. IPBCC 07. 550 0.406 0.034 0.020
A. ornatus IPBCC 07. 554 0.550 0.077 0.255
T. reesei QM6a IPBCC 93. 260 0.121 0.032 0.068
Tabel 3 Pengaruh suhu pada aktivitas CMC-ase isolat Paecilomyces sp. dan A. ornatus yang ditumbuhkan di media cair CMC 1 %, pH 7
suhu (0C)
Isolat 30 40 50 60 70
Paecilomyces sp. (nkat/ml) 0.406 0.285 0.134 0.099 0.000
A. ornatus (nkat/ml) 0.550 0.113 0.188 0.191 0.000
Tabel 4 Pengaruh pH pada aktivitas CMC-ase isolat Paecilomyces sp. dan Aspergillus ornatus yang ditumbuhkan pada media cair CMC 1 % pada suhu 300
pH
Isolat 3 4 5 6 7
Paecilomyces sp. (nkat/ml) 0.125 0.457 0.307 0.206 0.406
A. ornatus (nkat/ml) 0.034 0.198 0.431 0.398 0.550
Tabel 5 Aktivitas spesifik CMC-ase pada periode optimum produksi
Nama isolat Nomor aksesi
Kadar protein (mg/ml)
Aktivitas spesifik (nkat/mg)
A. niger IPB CC 88.140 0.101 3.386
Paecylomyces sp. IPBCC 07. 550 0.099 4.101
A. ornatus IPBCC 07. 554 0.098 5.612
T. reesei QM6a IPBCC 93. 260 0.094 1.287
PEMBAHASAN
Semua isolat kapang yang diuji secara kualitatif memiliki kemampuan untuk menguraikan substrat CMC. Hal ini dapat dilihat dari terbentuknya zona bening setelah koloni cendawan ditetesi pewarna merah kongo 0.1 %. Pewarna merah kongo memiliki interaksi yang kuat dengan polisakarida-polisakarida yang mengandung ikatan β-1,4-glikosidik dan β-1,3-glikosidik (Teather & Wood 1982). Zona bening yang
terbentuk disekitar koloni cendawan menunjukkan bahwa selulosa di zona tersebut sudah terurai menjadi unit-unit yang lebih sederhana.
selulosa sehingga menghasilkan lebih sedikit residu polisakarida yang mengandung ikatan β-1,4-glikosidik.
Produksi selulase isolat T. reesei QM6a pada media CMC optimum pada hari ke-2. Shanti (1993) melaporkan bahwa, T. reesei QM6a optimum pada hari ke-7 dengan aktivitas CMC-ase sebesar 0.178 U/ ml yang setara dengan 2.967 nkat/ml. Penurunan aktivitas ini mungkin disebabkan oleh penyimpanan isolat dalam waktu yang lama pada media ADK. Produksi CMC-ase isolat A. niger dan A. ornatus mencapai optimum pada hari ke-3, sedangkan isolat Paecilomyces sp. mencapai optimum pada hari ke-5. Ketiga isolat tersebut mengalami penurunan produksi selulase setelah waktu optimum produksi tercapai. Hal ini mungkin disebabkan oleh keberadaan glukosa dalam jumlah tertentu sebagai produk akhir pemecahan selulosa yang dapat menjadi inhibitor alosterik bagi enzim (Lehninger 1994). Selain itu, ketersediaan substrat yang semakin berkurang ikut berperan dalam menurunkan produksi selulase.
Ketiga isolat terpilih dan satu isolat pembanding yaitu T. reesei QM6a menunjukkan nilai aktivitas selulase yang berbeda ketika diuji pada substrat CMC, avisel, dan FP. Keempat isolat tersebut memiliki nilai aktivitas selulase optimum pada substrat CMC. CMC diketahui merupakan substrat yang efektif untuk produksi enzim endoglukanase (Lynd et al. 2002). Nilai aktivitas CMC-ase tertinggi ditunjukkan oleh isolat A. ornatus. Nilai tersebut relatif sama dengan aktivitas CMC-ase isolat bakteri KBM-4 pada kondisi uji yang sama yaitu sebesar 0.566 nkat/ml (Maranatha 2008). Nilai aktivitas avisel-ase keempat isolat relatif lebih rendah daripada ketika diuji pada substrat CMC. Hal ini menunjukkan bahwa CMC-ase merupakan enzim selulase yang paling banyak diproduksi oleh keempat isolat tersebut. Produksi avisel-ase tertinggi ditunjukkan oleh isolat A. ornatus, namun produksi avisel-ase tersebut masih lebih rendah dari aktivitas avisel-ase isolat bakteri KBM 2-6 sebesar 0.167 nkat/ml (Sari 2008). Produksi avisel-ase terendah ditunjukkan oleh isolat A. niger. Avisel merupakan selulosa murni kristalin yang menjadi daerah pemotongan enzim eksoglukanase sehingga aktivitas enzim pada substrat avicel merupakan kerja dari enzim eksoglukanase (Perez et al. 2001). Endoglukanase juga dapat menghidrolisis bagian kristalin dari rantai
selulosa tetapi tidak begitu aktif dan cenderung memilih bagian amorf. Pada substrat FP, produksi selulase tertinggi ditunjukkan oleh isolat A. ornatus dengan nilai aktivitas sebesar 0.255 nkat/ml. Pada kondisi uji yang sama nilai FP-ase isolat A. ornatus lebih rendah dari isolat bakteri KBM 2-6 yaitu sebesar 0.505 nkat/ml (Sari 2008). Aktivitas enzim pada substrat FP menunjukkan sinergi antara enzim endoglukanase dan eksoglukanase karena FP tersusun dari selulosa kristalin dan amorf (Perez et al. 2001). Sinergi ini penting karena selulosa di alam tidak hanya dihidrolisis oleh satu macam enzim melainkan dihidrolisis oleh sistem enzim selulase termasuk eksoglukanase dan endoglukanase.
Aktivitas CMC-ase semakin rendah seiring dengan kenaikan suhu dan aktivitas CMC-ase tidak terdeteksi pada suhu 70 0C (Tabel 3). Isolat A. ornatus dan Paecilomyces sp. tidak memiliki suhu optimum diatas 30 0C. Suhu optimum untuk produksi CMC-ase Aspergillus sp. adalah 28-30 0C (Mendels & Reese 1957; Devanathan et al. 1992), suhu yang semakin tinggi dapat menghambat aktivitas CMC-ase melalui proses denaturasi protein enzim. Selain suhu, aktivitas enzim juga sangat dipengaruhi oleh pH. Bagian dari enzim yang mudah terpengaruh oleh perubahan pH atau pH yang tidak sesuai adalah gugus karboksil dan gugus amino (Girindra 1993). Isolat A. ornatus mencapai optimum pada pH 7 Menurut Devanathan et al, (2007), CMC-ase Aspergillus sp. optimum pada pH 6.5. pH yang terlalu tinggi atau terlalu rendah dapat menghambat kerja enzim selulase. Aktivitas CMC-ase isolat Paecilomyces sp. mencapai optimum pada pH 4 dan pH 7. Hal ini menunjukkan bahwa terdapat dua macam enzim selulase yang aktivitasnya optimum pada pH 4 atau pH 7. Perolehan ini menunjukkan bahwa Paecilomyces sp. mensekresikan enzim yang aktif pada substrat CMC dan avisel.
Trichoderma yang diteliti oleh Lelana (2009) dan dari bakteri C11-1 (12.241 nkat/mg) dengan kadar protein sebesar 0.042 mg/ml (Lema 2008). Aktivitas spesifik suatu enzim menunjukkan jumlah substrat yang diubah atau jumlah gula yang diproduksi oleh 1 mg protein enzim. Kadar protein A. ornatus relatif tinggi jika dibandingkan dengan kadar protein isolat bakteri C11-1 namun memiliki nilai aktivitas spesifik yang lebih rendah. Hal ini menunjukkan bahwa protein enzim A. ornatus kurang efektif dalam menguraikan substrat selulosa jika dibandingkan dengan isolat bakteri C11-1.
SIMPULAN
Semua isolat yang diujikan mampu mendegradasi substrat selulosa sintetik. Tiga isolat kapang yaitu A. niger IPBCC 88.140, A. ornatus IPBCC 07.554 dan Paecylomyces sp. IPBCC 07.550 memiliki indeks selulolitik lebih tinggi dari pembanding T. reesei QM6a IPBCC 93.260. Periode optimum untuk produksi selulase pada media CMC isolat A. ornatus dan A. niger adalah tiga hari. Periode inkubasi optimum bagi Paecilomyces sp. adalah lima hari dan T. reesei QM6a dua hari. Di antara ketiga isolat terpilih, A. ornatus memiliki nilai aktivitas selulase (CMC-ase, avisel-ase dan FP-ase) tertinggi diikuti dengan Paecylomyces sp. Aktivitas CMC-ase A. ornatus dan Paecilomyces sp. mencapai optimum pada suhu 30 0C. pH optimum yaitu pH 7 untuk A. ornatus dan pH 4 untuk Paecilomyces sp.
SARAN
Tiga isolat yang diuji aktivitas selulase secara kuantitatif memiliki nilai aktivitas CMC-ase yang dominan, sehingga penelitian selanjutnya lebih baik difokuskan pada aktivitas enzim CMC-ase. Selain itu, Perlu dilakukan penelitian lebih lanjut tentang kemampuan selulolitik isolat terpilih pada substrat selulosa yang alami seperti jerami, tongkol jagung, dan sabut kelapa.
DAFTAR PUSTAKA
Bradford MM. 1976. A rapid and sensitif methode for the quantition of
microorganism quantities of protein utilizing the principle of protein binding. Anal. Biochem. 72: 248-254.
Devanathan G, Shanmugam A, Balasubramanian T, Manivannan S. 2007. Cellulase production by Aspergillus sp. isolated from coastal mangrove debris. Trends. in Appl. Sci. Res. 2: 23-27.
Dybkaer R. 2001. Unit katal for catalytic activity. Pure. Appl. Chem. 73: 927-931.
Girindra A.1993. Biokimia I. Jakarta: PT. Gramedia Pustaka.
Lehninger A. L, 1994. Dasar-dasar Biokimia Jilid 1. Maggy Thenawijdaya, penerjemah. Jakarta: Erlangga. Terjemahan dari Principle of Biochemistry.
Lelana NE, 2009. Seleksi cendawan potensial penghasil enzim endoglukanase (karboksimetil selulase) dan isolasi gen penyandinya [Tesis] Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lema ATH, 2008. Viabilitas isolat-isolat bakteri selulolitik pada bahan pembawa gambut [Skripsi] Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lynd LR., Paul JW., Willem H. van Zyl, Isak S. P. 2002. Microbial cellulose utillization: Fundamental and biotechnology. Microbiol. and Mol. Biol. Rev. 66: 506-577.
Maheshwari R, 2005. Fungi Experimental Methods in Biology. New York : Taylor and Friancis.
Maranatha B. 2008. Aktivitas enzim selulase isolat asal Indonesia pada berbagai substrat limbah pertanian [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Mendels M dan Reese ET. 1957. Induction of cellulose in T. viride as influenced by carbon source and metals. J. Bacteriol. 73: 269. Miller GL.1959. Use of dinitrosalicyclyc
Trichoderma yang diteliti oleh Lelana (2009) dan dari bakteri C11-1 (12.241 nkat/mg) dengan kadar protein sebesar 0.042 mg/ml (Lema 2008). Aktivitas spesifik suatu enzim menunjukkan jumlah substrat yang diubah atau jumlah gula yang diproduksi oleh 1 mg protein enzim. Kadar protein A. ornatus relatif tinggi jika dibandingkan dengan kadar protein isolat bakteri C11-1 namun memiliki nilai aktivitas spesifik yang lebih rendah. Hal ini menunjukkan bahwa protein enzim A. ornatus kurang efektif dalam menguraikan substrat selulosa jika dibandingkan dengan isolat bakteri C11-1.
SIMPULAN
Semua isolat yang diujikan mampu mendegradasi substrat selulosa sintetik. Tiga isolat kapang yaitu A. niger IPBCC 88.140, A. ornatus IPBCC 07.554 dan Paecylomyces sp. IPBCC 07.550 memiliki indeks selulolitik lebih tinggi dari pembanding T. reesei QM6a IPBCC 93.260. Periode optimum untuk produksi selulase pada media CMC isolat A. ornatus dan A. niger adalah tiga hari. Periode inkubasi optimum bagi Paecilomyces sp. adalah lima hari dan T. reesei QM6a dua hari. Di antara ketiga isolat terpilih, A. ornatus memiliki nilai aktivitas selulase (CMC-ase, avisel-ase dan FP-ase) tertinggi diikuti dengan Paecylomyces sp. Aktivitas CMC-ase A. ornatus dan Paecilomyces sp. mencapai optimum pada suhu 30 0C. pH optimum yaitu pH 7 untuk A. ornatus dan pH 4 untuk Paecilomyces sp.
SARAN
Tiga isolat yang diuji aktivitas selulase secara kuantitatif memiliki nilai aktivitas CMC-ase yang dominan, sehingga penelitian selanjutnya lebih baik difokuskan pada aktivitas enzim CMC-ase. Selain itu, Perlu dilakukan penelitian lebih lanjut tentang kemampuan selulolitik isolat terpilih pada substrat selulosa yang alami seperti jerami, tongkol jagung, dan sabut kelapa.
DAFTAR PUSTAKA
Bradford MM. 1976. A rapid and sensitif methode for the quantition of
microorganism quantities of protein utilizing the principle of protein binding. Anal. Biochem. 72: 248-254.
Devanathan G, Shanmugam A, Balasubramanian T, Manivannan S. 2007. Cellulase production by Aspergillus sp. isolated from coastal mangrove debris. Trends. in Appl. Sci. Res. 2: 23-27.
Dybkaer R. 2001. Unit katal for catalytic activity. Pure. Appl. Chem. 73: 927-931.
Girindra A.1993. Biokimia I. Jakarta: PT. Gramedia Pustaka.
Lehninger A. L, 1994. Dasar-dasar Biokimia Jilid 1. Maggy Thenawijdaya, penerjemah. Jakarta: Erlangga. Terjemahan dari Principle of Biochemistry.
Lelana NE, 2009. Seleksi cendawan potensial penghasil enzim endoglukanase (karboksimetil selulase) dan isolasi gen penyandinya [Tesis] Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lema ATH, 2008. Viabilitas isolat-isolat bakteri selulolitik pada bahan pembawa gambut [Skripsi] Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lynd LR., Paul JW., Willem H. van Zyl, Isak S. P. 2002. Microbial cellulose utillization: Fundamental and biotechnology. Microbiol. and Mol. Biol. Rev. 66: 506-577.
Maheshwari R, 2005. Fungi Experimental Methods in Biology. New York : Taylor and Friancis.
Maranatha B. 2008. Aktivitas enzim selulase isolat asal Indonesia pada berbagai substrat limbah pertanian [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Mendels M dan Reese ET. 1957. Induction of cellulose in T. viride as influenced by carbon source and metals. J. Bacteriol. 73: 269. Miller GL.1959. Use of dinitrosalicyclyc
AKTIVITAS SELULOLITIK
BEBERAPA KAPANG
MUCHAMMAD ZAINAL ARIEF
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Trichoderma yang diteliti oleh Lelana (2009) dan dari bakteri C11-1 (12.241 nkat/mg) dengan kadar protein sebesar 0.042 mg/ml (Lema 2008). Aktivitas spesifik suatu enzim menunjukkan jumlah substrat yang diubah atau jumlah gula yang diproduksi oleh 1 mg protein enzim. Kadar protein A. ornatus relatif tinggi jika dibandingkan dengan kadar protein isolat bakteri C11-1 namun memiliki nilai aktivitas spesifik yang lebih rendah. Hal ini menunjukkan bahwa protein enzim A. ornatus kurang efektif dalam menguraikan substrat selulosa jika dibandingkan dengan isolat bakteri C11-1.
SIMPULAN
Semua isolat yang diujikan mampu mendegradasi substrat selulosa sintetik. Tiga isolat kapang yaitu A. niger IPBCC 88.140, A. ornatus IPBCC 07.554 dan Paecylomyces sp. IPBCC 07.550 memiliki indeks selulolitik lebih tinggi dari pembanding T. reesei QM6a IPBCC 93.260. Periode optimum untuk produksi selulase pada media CMC isolat A. ornatus dan A. niger adalah tiga hari. Periode inkubasi optimum bagi Paecilomyces sp. adalah lima hari dan T. reesei QM6a dua hari. Di antara ketiga isolat terpilih, A. ornatus memiliki nilai aktivitas selulase (CMC-ase, avisel-ase dan FP-ase) tertinggi diikuti dengan Paecylomyces sp. Aktivitas CMC-ase A. ornatus dan Paecilomyces sp. mencapai optimum pada suhu 30 0C. pH optimum yaitu pH 7 untuk A. ornatus dan pH 4 untuk Paecilomyces sp.
SARAN
Tiga isolat yang diuji aktivitas selulase secara kuantitatif memiliki nilai aktivitas CMC-ase yang dominan, sehingga penelitian selanjutnya lebih baik difokuskan pada aktivitas enzim CMC-ase. Selain itu, Perlu dilakukan penelitian lebih lanjut tentang kemampuan selulolitik isolat terpilih pada substrat selulosa yang alami seperti jerami, tongkol jagung, dan sabut kelapa.
DAFTAR PUSTAKA
Bradford MM. 1976. A rapid and sensitif methode for the quantition of
microorganism quantities of protein utilizing the principle of protein binding. Anal. Biochem. 72: 248-254.
Devanathan G, Shanmugam A, Balasubramanian T, Manivannan S. 2007. Cellulase production by Aspergillus sp. isolated from coastal mangrove debris. Trends. in Appl. Sci. Res. 2: 23-27.
Dybkaer R. 2001. Unit katal for catalytic activity. Pure. Appl. Chem. 73: 927-931.
Girindra A.1993. Biokimia I. Jakarta: PT. Gramedia Pustaka.
Lehninger A. L, 1994. Dasar-dasar Biokimia Jilid 1. Maggy Thenawijdaya, penerjemah. Jakarta: Erlangga. Terjemahan dari Principle of Biochemistry.
Lelana NE, 2009. Seleksi cendawan potensial penghasil enzim endoglukanase (karboksimetil selulase) dan isolasi gen penyandinya [Tesis] Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lema ATH, 2008. Viabilitas isolat-isolat bakteri selulolitik pada bahan pembawa gambut [Skripsi] Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lynd LR., Paul JW., Willem H. van Zyl, Isak S. P. 2002. Microbial cellulose utillization: Fundamental and biotechnology. Microbiol. and Mol. Biol. Rev. 66: 506-577.
Maheshwari R, 2005. Fungi Experimental Methods in Biology. New York : Taylor and Friancis.
Maranatha B. 2008. Aktivitas enzim selulase isolat asal Indonesia pada berbagai substrat limbah pertanian [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Mendels M dan Reese ET. 1957. Induction of cellulose in T. viride as influenced by carbon source and metals. J. Bacteriol. 73: 269. Miller GL.1959. Use of dinitrosalicyclyc
Moore-Landecker E .1996. Fundamentals of Fungi. Ed. Ke-4. New Jersey: Prentice-Hall.
Perez J, Munoz-Dorado J, Rubia T, Martinez J. 2002. Biodegradation and biological treatments of cellulose, hemicellulose, and lignin. J. Int. Microbiol. 5:53-63.
Saczi A, Radford A, Erenler K. 1986. Detection of cellulolytic fungi by using Congo red as an indicator: a comparative study with the dinitrosalicyclic acid. Appl. Bacteriol. 61:559-562
Sari W. 2008. Karakterisasi bakteri asal tanah pertanian Jawa Tengah dan
Jawa Barat [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Shanti LP. 1993. Aktivitas selulase sejumlah isolat kapang [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Teather RM, Wood PJ. 1982. Use of congo red-polysaccharide interactions in enumeration and characterization of celluloiytic bacteria from the bovine rumen. Appl. Environ. Microbiol. 43: 777-780.
Pengetahuan Alam, Institut Pertanian Bogor. Teather RM, Wood PJ
AKTIVITAS SELULOLITIK
BEBERAPA KAPANG
MUCHAMMAD ZAINAL ARIEF
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
MUCHAMMAD ZAINAL ARIEF. Aktivitas Selulolitik beberapa Kapang. Dibimbing oleh GAYUH RAHAYU dan ANJA MERYANDINI.
Selulosa adalah komponen utama penyusun dinding sel tumbuhan dan merupakan biopolimer yang jumlahnya paling melimpah di alam. Selulosa di alam didegradasi oleh mikroorganisme dengan memproduksi enzim selulase yang terdiri atas endoglukanase, eksoglukanase, dan selobiase. Penelitian ini bertujuan untuk mengetahui kemampuan selulolitik beberapa isolat kapang. Sebanyak 42 isolat kapang diuji aktivitas selulolitiknya pada media agar-agar CMC. T. reesei QM6a digunakan sebagai isolat pembanding. Aspergillus niger, Aspergillus ornatus, dan Paecilomyces sp. memiliki indeks selulolitik pada media agar-agar CMC yang relatif lebih tinggi daripada isolat yang lain. Aktivitas CMC-ase A. niger dan A. ornatus optimum pada hari ke-3, CMC-ase Paecilomyces sp. optimum pada hari ke-5, sedangkan T. reesei QM6a optimum pada hari ke-2. Aktivitas CMC-ase, avisel-ase dan FP-ase tertinggi dimiliki oleh A. ornatus dengan nilai masing-masing yaitu 0.550 nkat/ml, 0.077 nkat/ml, dan 0.255 nkat/ml. Aktivitas CMC-ase A. ornatus mencapai optimum pada suhu 30 0C, sedangkan tingkat kemasaman optimumnya adalah pH 7.
ABSTRACT
MUCHAMMAD ZAINAL ARIEF. Cellulolytic Activity of Some Molds. Under supervisor GAYUH RAHAYU and ANJA MERYANDINI.
AKTIVITAS SELULOLITIK
BEBERAPA KAPANG
MUCHAMMAD ZAINAL ARIEF
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Aktivitas Selulolitik beberapa Kapang Nama : Muchammad Zainal Arief
NIM : G34104047
Menyetujui:
Pembimbing I, Pembimbing II,
Dr. Ir. Gayuh Rahayu Dr. Anja Meryandini, MS
NIP. 19580105 198303 2002 NIP. 19620327 198703 2001
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. Drh. Hasim, DEA NIP. 19610328 198601 1002
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penulis dapat menyeleseikan karya ilmiah yang berjudul Aktivitas Selulolitik beberapa Kapang. Karya ilmiah ini dilaksanakan sejak bulan Maret hingga Desember 2008, bertempat di Laboratorium Mikologi Departemen Biologi, FMIPA, IPB.
Terima kasih penulis ucapkan kepada Ibu Dr. Ir. Gayuh Rahayu dan Ibu Dr. Anja Meryandini MS yang telah membantu memberikan bimbingan, saran, motivasi, dan fasilitas selama penelitian dan penyusunan karya ilmiah ini. Ucapan terima kasih kepada Bapak Dr. Ir. Achmad Farajallah M.Si selaku dosen penguji yang telah memberikan saran dan kritik untuk perbaikan skripsi ini. Penulis juga mengucapkan terima kasih kepada staf Laboratorium Mikologi FMIPA IPB yang telah membantu penulis dalam melaksanakan penelitian ini.
Ungkapan terima kasih juga penulis ucapkan kepada keluarga tercinta, Ibu, Bapak, Mas Mamat, Hepi, dan Imam atas segala doa, kasih sayang, dan motivasi yang diberikan. Terima kasih juga penulis ucapkan kepada Arif Pambudi, Syamsul Bahri, Andik Wijayanto, Kusnandar, Rina Puspitasari, Tahira, Ibu Asti, Nurul Hidayati, teman-teman seperjuangan di Laboratorium Mikologi, dan Wisma Delapan atas kerjasama, kebersamaan, kekompakan, dan kekeluargaannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2009
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 14 Januari 1986 di Wonosobo, Jawa Tengah, putra dari Bapak Robikun dan Ibu Rodhiyah. Penulis merupakan anak kedua dari empat bersaudara.
Tahun 1998 penulis lulus dari SDN Sambek 1, tahun 2001 lulus dari SMPN 2 Wonosobo, kemudian melanjutkan ke SMAN 1 Wonosobo. Tahun 2004 lulus dari SMAN 1 Wonosobo dan di tahun yang sama penulis diterima sebagai mahasiswa Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
DAFTAR ISI
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 1
Waktu dan Tempat ... 1
BAHAN DAN METODE ... 1
Bahan dan Alat... 1
Metode... 1
HASIL ... 2
Aktivitas selulase kualitatif beberapa isolat kapang ... 2
Periode inkubasi optimum produksi ... 2
Aktivitas CMC-ase , Avisel-ase, dan FP-ase. ... 3
Suhu dan pH optimum aktivitas selulase Aspergillus ornatus dan Paecilomyces sp. ... 3
Kadar protein dan aktivitas spesifik enzim ... 3
PEMBAHASAN... 5
SIMPULAN ... 6
SARAN ... 6
DAFTAR PUSTAKA ... 6
DAFTAR TABEL
Halaman 1 Nilai indeks zona bening isolat Aspergillus niger, Paecilomyces sp., Aspergillus ornatus
dan T. reesei QM6a yang diikubasi pada media agar-agar CMC 1 % selama tiga hari ... 4
2 Aktivitas CMC-ase, avisel-ase, dan FP-ase. Aktivitas enzim diuji pada substrat cair CMC 1 % pada suhu 300 C, pH 7 (bufer fosfat 0.2 M). ... 4
3 Pengaruh suhu pada aktivitas CMC-ase isolat Paecilomyces sp. dan Aspergillus ornatus yang ditumbuhkan di media cair CMC 1 %, pH 7 ... 4
4 Pengaruh pH pada aktivitas CMC-ase isolat Paecilomyces sp. dan Aspergillus ornatus yang ditumbuhkan pada media cair CMC 1 % pada suhu 300 ... 4
5 Aktivitas spesifik CMC-ase pada periode optimum produksi... 4
DAFTAR GAMBAR
Halaman 1 Kurva aktivitas selulase isolat T. reesei QM6a. Aktivitas enzim diuji pada substrat cair CMC 1 % pada suhu 300 C, pH 7 (bufer fosfat 0.2 M) ... 32 Kurva aktivitas selulase isolat Aspergillus niger. Aktivitas enzim diuji pada substrat cair CMC 1 % pada suhu 300 C, pH 7 (bufer fosfat 0.2 M). ... 3
3 Kurva aktivitas selulase isolat Aspergillus ornatus. Aktivitas enzim diuji pada substrat cair CMC 1 % pada suhu 300 C, pH 7 (bufer fosfat 0.2 M). ... 3
4 Kurva aktivitas selulase isolat Paecilomyces sp. Aktivitas enzim diuji pada substrat cair CMC 1 % pada suhu 300 C, pH 7 (bufer fosfat 0.2 M). ... 3
DAFTAR LAMPIRAN
Halaman 1 Tabel nilai indeks selulolitik 43 isolat kapang ... 92 Kurva standar protein pada panjang gelombang 595 nm. ... 10
3 Kurva standar glukosa pada panjang gelombang 540 nm...10
4 Komposisi media CMC 1% dan ADK dalam 1 liter akuades………...………10
5 Komposisi DNS.………11
6 Komposisi bufer sitrat pH 3, 4, dan 5; 0.2M……….11
PENDAHULUAN
Latar Belakang
Selulosa adalah komponen utama penyusun dinding sel tumbuhan dan merupakan biopolimer yang jumlahnya paling melimpah di alam. Selulosa merupakan polimer glukosa tak bercabang yang terdiri atas unit-unit D-glukosa yang dihubungkan oleh ikatan β-1,4-glikosidik membentuk molekul selobiosa. Molekul ini membentuk selulosa dalam rantai panjang. Tiap rantai dihubungkan oleh ikatan hidrogen dan van der waals (Perez et al. 2002).
Selulosa di alam biasa didegradasi oleh serangga, cacing tanah, cendawan dan bakteri. Akan tetapi, cendawan merupakan dekomposer selulosa yang umum ditemukan. Cendawan yang mampu menguraikan selulosa berasal dari kelompok Ascomycota, Basidiomycota, Zigomycota, dan Deuteromycota (Moore-Landecker 1996).
Mikroorganisme mendegradasi selulosa menjadi monomernya dengan memproduksi enzim ekstraselular yaitu selulase. Enzim selulase terdiri atas endoglukanase atau endo-β-1,4-glukanase (EC 3.2.1.4), eksoglukanase atau ekso-β-1,4-glukanase (EC 3.2.1.74), dan selobiase atau -β -1,4-glukosidase (EC 3.2.1.91) (Saczi et al. 1986; Lynd et al. 2002; Perez et al. 2002). Sistem enzim tersebut bekerja pada substrat yang spesifik. Enzim endoglukanase memotong secara acak ikatan internal selulosa amorf sedangkan enzim eksoglukanase bekerja pada ujung tereduksi dan tak tereduksi dari rantai selulosa sehingga menghasilkan molekul selobiosa yang akan dihidrolisis oleh enzim selobiase menjadi monomernya yaitu glukosa.
Selulosa dapat dikelompokkan berdasarkan sifat ikatan glukosa penyusunnya. Carboxymetilcellulose (CMC) dan Avisel merupakan selulosa semisintetik komersial yang mampu menginduksi selulase. CMC merupakan selulosa amorf sehingga dapat larut dalam air sedangkan avisel merupakan tepung selulosa mikrokristalin. Kertas saring Whattman merupakan substrat majemuk yang memiliki bagian amorf dan kristalin dari struktur selulosa (Maheshwari 2005).
Limbah lignoselulosa tumbuhan dengan komponen utamanya selulosa jumlahnya sangat melimpah. Limbah tersebut dapat
dimanfaatkan sebagai kompos dan sumber energi terbarukan yang ramah lingkungan. Di Indonesia, selulosa sebagai sumber energi terbarukan baru sampai tahap penelitian. Potensinya yang besar mendorong pemanfaatan selulosa sebagai sumber energi masa depan menggantikan sumber bahan bakar fosil. Langkah awal dari pemanfaatan itu membutuhkan enzim perombak selulosa. Oleh karena itu, penelitian tentang mikroorganisme yang mampu mendegradasi selulosa perlu dilakukan.
Tujuan
Penelitian ini bertujuan untuk mengetahui kemampuan selulolitik beberapa isolat kapang.
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret hingga Desember 2008, bertempat di Laboratorium Mikologi Departemen Biologi, FMIPA, IPB.
BAHAN DAN METODE
Bahan dan Alat
Alat yang digunakan adalah penangas air, erlenmeyer, autoklaf, cawan petri, inkubator, dan peralatan umum laboratorium Mikologi. Bahan yang digunakan adalah 42 isolat kapang koleksi IPBCC, dan isolat Trichoderma reesei QM6a (IPBCC 93.260) sebagai isolat pembanding (Lampiran 1), media agar-agar dekstrosa kentang (ADK), media carboxymetilcellulose (CMC), avisel, kertas saring atau filter paper (FP) Whatman no. 1, pereaksi 3,5-asam dinitro salisilat (DNS), glukosa, dan Bovin Serum Albumin (BSA).
Metode
Persiapan inokulum. Inokulum diperoleh dari peremajaan biakan kapang. Biakan ditumbuhkan dalam media CMC dan digunakan sebagai sumber inokulan.
hasilnya dibagi dengan diameter koloni. Tiga isolat yang memiliki aktivitas selulolitik tertinggi diuji aktivitas selulolitiknya secara kuantitatif.
Aktivitas selulase secara kuantitatif. Sebelum aktivitas selulase kuantitatif pada berbagai sumber selulosa (CMC, avisel, dan FP Whatman no. 1) dari isolat-isolat terpilih ditetapkan, masa inkubasi optimum untuk produksi enzim ditetapkan terlebih dahulu pada medium cair CMC dengan mengamati aktivitas selulase harian. Sebanyak lima potong inokulum (diameter 5 mm) berumur empat hari yang berasal dari isolat terpilih dimasukkan ke dalam 100 ml media cair CMC 1 % dan diinkubasi pada mesin penggoyang. Kemudian sebanyak 4 ml filtrat diambil setiap hari untuk diambil ekstrak kasar enzimnya. Ekstrak kasar enzim diperoleh dengan mensentrifugasi filtrat hasil kultur pada kecepatan 4000 g selama 10 menit pada suhu 4 0C. Aktivitas selulase harian ditetapkan berdasarkan metode Miller (1959) dengan cara mencampurkan 1 ml ekstrak kasar enzim dalam 1 ml CMC cair pada bufer fosfat 0.2 M pH 7 dan diinkubasi pada suhu ruang selama 60 menit. Kemudian ke dalam campuran tersebut ditambahkan 2 ml DNS, diinkubasi pada suhu 100 0C selama 15 menit, dan diukur absorbansinya pada panjang gelombang 540 nm. Produksi optimum enzim ditetapkan berdasarkan aktivitas selulase tertinggi pada periode inkubasi. Masa produksi optimum akan digunakan untuk penetapan aktivitas enzim pada berbagai sumber selulosa. Aktivitas enzim dinyatakan dalam nkat/ml. Perhitungan aktivitas enzim selulase dinyatakan dalam nkat/ml. Satu unit aktivitas selulase didefinisikan sebagai jumlah enzim yang dibutuhkan untuk menghasilkan 1 μ mol glukosa dalam satu menit dan satu unit aktivitas enzim setara dengan 16.67 nkat/ml (Dybkaer 2001).
Uji aktivitas selulase pada substrat avisel dilakukan dengan menambahkan sebanyak 2 ml ekstrak kasar enzim ditambahkan 2 ml avisel kemudian disentrifugasi pada 3500 g selama 15 menit pada kondisi uji. Sebanyak 2 ml supernatan diambil dan ditambahkan 2 ml DNS kemudian absorbansinya diukur pada panjang gelombang 540 nm. Untuk substrat FP, 2.5 potong substrat FP berukuran 1 x 6 cm2 dimasukkan kedalam 2.5 ml bufer dan 5 ml enzim ekstrak kasar. Campuran enzim ekstrak kasar dan substrat FP diinkubasi pada kondisi uji.
Suhu dan pH optimum aktivitas enzim. Suhu optimum aktivitas selulase diukur dengan cara menginkubasi ekstrak kasar enzim pada substrat CMC 1 % pada suhu 30 0C, 40 0C, 50 0C, 60 0C, dan 70 0C, sedangkan pH optimum ditetapkan dengan cara menginkubasi ekstrak kasar enzim pada substrat CMC 1 % pada pH 3, 4, 5, 6, dan 7.
Kadar protein dan aktivitas spesifik enzim. Kadar protein diukur berdasarkan metode Bradford (1976). Sebanyak 400 μ l enzim ekstrak kasar dengan 4 ml reagen Bradford, dikocok dengan vorteks, diukur pada panjang gelombang 595 nm. Standar protein yang digunakan ialah bovin serum albumin (BSA). Aktivitas spesifik enzim dinyatakan dalam nkat per mg protein (nkat/mg).
HASIL
Aktivitas selulase kualitatif beberapa isolat kapang
Semua isolat yang ditumbuhkan pada media agar-agar CMC 1 % membentuk zona bening setelah diwarnai dengan pewarna merah kongo 0.1 % (Lampiran 1). Sebanyak 39 isolat dari 42 isolat yang diuji memiliki nilai indeks selulolitik yang lebih tinggi dari daripada isolat pembanding. Dari 39 isolat ini dipilih tiga isolat dengan nilai indeks selulolitik tertinggi dengan tingkat kecerahan agar yang lebih baik. Tiga isolat tersebut yaitu Aspergillus niger IPBCC 88.140, A. ornatus IPBCC 07.554 dan Paecilomyces sp. IPBCC 07. 550.
Nilai indeks selulolitik ketiga isolat tersebut yaitu 1.80, 1.24, dan 1.50, sedangkan indeks selulolitik isolat T. reesei QM6a yaitu 1.00 (Tabel 1). Ketiga isolat tersebut dipilih untuk uji kuantitatif.
Periode inkubasi optimum produksi Periode inkubasi optimum bagi produksi selulase bervariasi tergantung pada jenis kapangnya. Aktivitas selulolitik isolat T. reesei QM6a mencapai optimum pada hari ke-2 dengan nilai aktivitas 0.121 nkat/ml kemudian terus turun sampai hari ke-6 (Gambar 1). Aktivitas selulolitik isolat A. niger dan A, ornatus berturut-turut mencapai optimum pada hari ke-3 dengan nilai aktivitas berturut-turut 0.342 nkat/ml dan
0.550 nkat/ml (Gambar 2 & Gambar 3). Aktivitas selulase isolat Paecilomyces sp. mencapai optimum pada hari ke-5 dengan nilai aktivitas 0.406 nkat/ml (Gambar 4).
0 0,02 0,04 0,06 0,08 0,1 0,12 0,14
0 2 4 6 8
Waktu (hari) a k ti v it a s s e lu las e (n k a t/ m l)
Gambar 1 Kurva aktivitas selulase isolat T. reesei QM6a. Aktivitas enzim diuji pada substrat cair CMC 1 % pada suhu 300 C, pH 7 (larutan penyangga fosfat 0.2 M)
0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4
0 1 2 3 4 5 6 7
waktu (hari) a k ti v it a s s el u la s e (nk a t/ m l)
Gambar 2 Kurva aktivitas selulase isolat
A. niger. Aktivitas enzim diuji pada substrat cair CMC 1 % pada suhu 300 C, pH 7 (larutan penyangga fosfat 0.2 M).
0 0,1 0,2 0,3 0,4 0,5 0,6
0 1 2 3 4 5 6 7
waktu (hari) a k ti v it a s s el u la s e (nk a t/ m l)
Gambar 3 Kurva aktivitas selulase isolat
A. ornatus. Aktivitas enzim diuji pada substrat cair CMC 1 % pada suhu 300 C, pH 7 (larutan penyangga fosfat 0.2 M).
0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4 0,45
0 1 2 3 4 5 6 7
waktu (hari) a k ti v it as s e lu las e (nk a t/ m l)
Gambar 4 Kurva aktivitas selulase isolat
Paecilomyces sp. Aktivitas enzim diuji pada substrat cair CMC 1 % pada suhu 300 C, pH 7 (larutan penyangga fosfat 0.2 M).
Aktivitas CMC-ase , Avisel-ase, dan FP-ase.
Aktivitas selulase (CMC-ase, avisel-ase, dan FP-ase) dari tiga isolat terpilih bervariasi tetapi relatif lebih tinggi dari isolat pembanding. Diantara ketiga isolat terpilih, A. ornatus memiliki aktivitas selulase tertinggi. Aktivitas CMC-ase, avisel-ase, dan FP-ase A. ornatus berturut-turut sebesar 0.550 nkat/ml, 0.077 nkat/ml, dan 0.255 nkat/ml (Tabel 2). Dua isolat dengan aktivitas selulase yang relatif tinggi yaitu A. ornatus dan Paecilomyces sp. dipilih untuk karakterisasi suhu dan pH.
Suhu dan pH optimum aktivitas selulase A. ornatus dan Paecilomyces sp.
Aktivitas selulase Paecilomyces sp. dan A. ornatus optimum pada suhu 30 0C dengan nilai aktivitas masing-masing yaitu 0.406 nkat/ml dan 0.550 nkat/ml (Tabel 3) kemudian aktivitasnya menurun seiring dengan kenaikan suhu. Aktivitas selulase Paecilomyces sp. optimum pada pH 4 sedangkan A. ornatus optimum pada pH 7 (Tabel 4).
Kadar protein dan aktivitas spesifik enzim.
Kadar protein keempat isolat yang diuji relatif sama, namun aktivitas spesifik tertinggi dimiliki oleh isolat A. ornatus yaitu 5.612 (nkat/mg) sedangkan aktivitas spesifik terendah dimiliki oleh isolat T. reesei QM6a yaitu 1.287 (nkat/mg) (Tabel 5)
Tabel 1Nilai indeks zona bening isolat A. niger, Paecilomyces sp, A. ornatus, dan T. reesei
QM6a yang diinkubasi pada media agar-agar CMC 1% selama tiga hari
No Nama isolat Nomor aksesi Indeks zona bening
1 A. niger IPBCC 88.140 1.80
2 Paecylomyces sp. IPBCC 07. 550 1.50
3 A. ornatus IPBCC 07. 554 1.24
4 T. reesei QM6a IPBCC 93. 260 1.00
Tabel 2 Aktivitas CMC-ase, avisel-ase, dan FP-ase. Aktivitas enzim diuji pada media cair CMC 1 % pada suhu 300 C, pH 7 (bufer fosfat 0.2 M).
Nama isolat Nomor aksesi
CMC-ase (nkat/ml)
Avisel-ase (nkat/ml)
FP-ase (nkat/ml)
A. niger IPBCC 88. 140 0.342 0.009 0.074
Paecylomyces sp. IPBCC 07. 550 0.406 0.034 0.020
A. ornatus IPBCC 07. 554 0.550 0.077 0.255
T. reesei QM6a IPBCC 93. 260 0.121 0.032 0.068
Tabel 3 Pengaruh suhu pada aktivitas CMC-ase isolat Paecilomyces sp. dan A. ornatus yang ditumbuhkan di media cair CMC 1 %, pH 7
suhu (0C)
Isolat 30 40 50 60 70
Paecilomyces sp. (nkat/ml) 0.406 0.285 0.134 0.099 0.000
A. ornatus (nkat/ml) 0.550 0.113 0.188 0.191 0.000
Tabel 4 Pengaruh pH pada aktivitas CMC-ase isolat Paecilomyces sp. dan Aspergillus ornatus yang ditumbuhkan pada media cair CMC 1 % pada suhu 300
pH
Isolat 3 4 5 6 7
Paecilomyces sp. (nkat/ml) 0.125 0.457 0.307 0.206 0.406
A. ornatus (nkat/ml) 0.034 0.198 0.431 0.398 0.550
Tabel 5 Aktivitas spesifik CMC-ase pada periode optimum produksi
Nama isolat Nomor aksesi
Kadar protein (mg/ml)
Aktivitas spesifik (nkat/mg)
A. niger IPB CC 88.140 0.101 3.386
Paecylomyces sp. IPBCC 07. 550 0.099 4.101
A. ornatus IPBCC 07. 554 0.098 5.612
T. reesei QM6a IPBCC 93. 260 0.094 1.287
PEMBAHASAN
Semua isolat kapang yang diuji secara kualitatif memiliki kemampuan untuk menguraikan substrat CMC. Hal ini dapat dilihat dari terbentuknya zona bening setelah koloni cendawan ditetesi pewarna merah kongo 0.1 %. Pewarna merah kongo memiliki interaksi yang kuat dengan polisakarida-polisakarida yang mengandung ikatan β-1,4-glikosidik dan β-1,3-glikosidik (Teather & Wood 1982). Zona bening yang
terbentuk disekitar koloni cendawan menunjukkan bahwa selulosa di zona tersebut sudah terurai menjadi unit-unit yang lebih sederhana.
selulosa sehingga menghasilkan lebih sedikit residu polisakarida yang mengandung ikatan β-1,4-glikosidik.
Produksi selulase isolat T. reesei QM6a pada media CMC optimum pada hari ke-2. Shanti (1993) melaporkan bahwa, T. reesei QM6a optimum pada hari ke-7 dengan aktivitas CMC-ase sebesar 0.178 U/ ml yang setara dengan 2.967 nkat/ml. Penurunan aktivitas ini mungkin disebabkan oleh penyimpanan isolat dalam waktu yang lama pada media ADK. Produksi CMC-ase isolat A. niger dan A. ornatus mencapai optimum pada hari ke-3, sedangkan isolat Paecilomyces sp. mencapai optimum pada hari ke-5. Ketiga isolat tersebut mengalami penurunan produksi selulase setelah waktu optimum produksi tercapai. Hal ini mungkin disebabkan oleh keberadaan glukosa dalam jumlah tertentu sebagai produk akhir pemecahan selulosa yang dapat menjadi inhibitor alosterik bagi enzim (Lehninger 1994). Selain itu, ketersediaan substrat yang semakin berkurang ikut berperan dalam menurunkan produksi selulase.
Ketiga isolat terpilih dan satu isolat pembanding yaitu T. reesei QM6a menunjukkan nilai aktivitas selulase yang berbeda ketika diuji pada substrat CMC, avisel, dan FP. Keempat isolat tersebut memiliki nilai aktivitas selulase optimum pada substrat CMC. CMC diketahui merupakan substrat yang efektif untuk produksi enzim endoglukanase (Lynd et al. 2002). Nilai aktivitas CMC-ase tertinggi ditunjukkan oleh isolat A. ornatus. Nilai tersebut relatif sama dengan aktivitas CMC-ase isolat bakteri KBM-4 pada kondisi uji yang sama yaitu sebesar 0.566 nkat/ml (Maranatha 2008). Nilai aktivitas avisel-ase keempat isolat relatif lebih rendah daripada ketika diuji pada substrat CMC. Hal ini menunjukkan bahwa CMC-ase merupakan enzim selulase yang paling banyak diproduksi oleh keempat isolat tersebut. Produksi avisel-ase tertinggi ditunjukkan oleh isolat A. ornatus, namun produksi avisel-ase tersebut masih lebih rendah dari aktivitas avisel-ase isolat bakteri KBM 2-6 sebesar 0.167 nkat/ml (Sari 2008). Produksi avisel-ase terendah ditunjukkan oleh isolat A. niger. Avisel merupakan selulosa murni kristalin yang menjadi daerah pemotongan enzim eksoglukanase sehingga aktivitas enzim pada substrat avicel merupakan kerja dari enzim eksoglukanase (Perez et al. 2001). Endoglukanase juga dapat menghidrolisis bagian kristalin dari rantai
selulosa tetapi tidak begitu aktif dan cenderung memilih bagian amorf. Pada substrat FP, produksi selulase tertinggi ditunjukkan oleh isolat A. ornatus dengan nilai aktivitas sebesar 0.255 nkat/ml. Pada kondisi uji yang sama nilai FP-ase isolat A. ornatus lebih rendah dari isolat bakteri KBM 2-6 yaitu sebesar 0.505 nkat/ml (Sari 2008). Aktivitas enzim pada substrat FP menunjukkan sinergi antara enzim endoglukanase dan eksoglukanase karena FP tersusun dari selulosa kristalin dan amorf (Perez et al. 2001). Sinergi ini penting karena selulosa di alam tidak hanya dihidrolisis oleh satu macam enzim melainkan dihidrolisis oleh sistem enzim selulase termasuk eksoglukanase dan endoglukanase.
Aktivitas CMC-ase semakin rendah seiring dengan kenaikan suhu dan aktivitas CMC-ase tidak terdeteksi pada suhu 70 0C (Tabel 3). Isolat A. ornatus dan Paecilomyces sp. tidak memiliki suhu optimum diatas 30 0C. Suhu optimum untuk produksi CMC-ase Aspergillus sp. adalah 28-30 0C (Mendels & Reese 1957; Devanathan et al. 1992), suhu yang semakin tinggi dapat menghambat aktivitas CMC-ase melalui proses denaturasi protein enzim. Selain suhu, aktivitas enzim juga sangat dipengaruhi oleh pH. Bagian dari enzim yang mudah terpengaruh oleh perubahan pH atau pH yang tidak sesuai adalah gugus karboksil dan gugus amino (Girindra 1993). Isolat A. ornatus mencapai optimum pada pH 7 Menurut Devanathan et al, (2007), CMC-ase Aspergillus sp. optimum pada pH 6.5. pH yang terlalu tinggi atau terlalu rendah dapat menghambat kerja enzim selulase. Aktivitas CMC-ase isolat Paecilomyces sp. mencapai optimum pada pH 4 dan pH 7. Hal ini menunjukkan bahwa terdapat dua macam enzim selulase yang aktivitasnya optimum pada pH 4 atau pH 7. Perolehan ini menunjukkan bahwa Paecilomyces sp. mensekresikan enzim yang aktif pada substrat CMC dan avisel.
Trichoderma yang diteliti oleh Lelana (2009) dan dari bakteri C11-1 (12.241 nkat/mg) dengan kadar protein sebesar 0.042 mg/ml (Lema 2008). Aktivitas spesifik suatu enzim menunjukkan jumlah substrat yang diubah atau jumlah gula yang diproduksi oleh 1 mg protein enzim. Kadar protein A. ornatus relatif tinggi jika dibandingkan dengan kadar protein isolat bakteri C11-1 namun memiliki nilai aktivitas spesifik yang lebih rendah. Hal ini menunjukkan bahwa protein enzim A. ornatus kurang efektif dalam menguraikan substrat selulosa jika dibandingkan dengan isolat bakteri C11-1.
SIMPULAN
Semua isolat yang diujikan mampu mendegradasi substrat selulosa sintetik. Tiga isolat kapang yaitu A. niger IPBCC 88.140, A. ornatus IPBCC 07.554 dan Paecylomyces sp. IPBCC 07.550 memiliki indeks selulolitik lebih tinggi dari pembanding T. reesei QM6a IPBCC 93.260. Periode optimum untuk produksi selulase pada media CMC isolat A. ornatus dan A. niger adalah tiga hari. Periode inkubasi optimum bagi Paecilomyces sp. adalah lima hari dan T. reesei QM6a dua hari. Di antara ketiga isolat terpilih, A. ornatus memiliki nilai aktivitas selulase (CMC-ase, avisel-ase dan FP-ase) tertinggi diikuti dengan Paecylomyces sp. Aktivitas CMC-ase A. ornatus dan Paecilomyces sp. mencapai optimum pada suhu 30 0C. pH optimum yaitu pH 7 untuk A. ornatus dan pH 4 untuk Paecilomyces sp.
SARAN
Tiga isolat yang diuji aktivitas selulase secara kuantitatif memiliki nilai aktivitas CMC-ase yang dominan, sehingga penelitian selanjutnya lebih baik difokuskan pada aktivitas enzim CMC-ase. Selain itu, Perlu dilakukan penelitian lebih lanjut tentang kemampuan selulolitik isolat terpilih pada substrat selulosa yang alami seperti jerami, tongkol jagung, dan sabut kelapa.
DAFTAR PUSTAKA
Bradford MM. 1976. A rapid and sensitif methode for the quantition of
microorganism quantities of protein utilizing the principle of protein binding. Anal. Biochem. 72: 248-254.
Devanathan G, Shanmugam A, Balasubramanian T, Manivannan S. 2007. Cellulase production by Aspergillus sp. isolated from coastal mangrove debris. Trends. in Appl. Sci. Res. 2: 23-27.
Dybkaer R. 2001. Unit katal for catalytic activity. Pure. Appl. Chem. 73: 927-931.
Girindra A.1993. Biokimia I. Jakarta: PT. Gramedia Pustaka.
Lehninger A. L, 1994. Dasar-dasar Biokimia Jilid 1. Maggy Thenawijdaya, penerjemah. Jakarta: Erlangga. Terjemahan dari Principle of Biochemistry.
Lelana NE, 2009. Seleksi cendawan potensial penghasil enzim endoglukanase (karboksimetil selulase) dan isolasi gen penyandinya [Tesis] Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lema ATH, 2008. Viabilitas isolat-isolat bakteri selulolitik pada bahan pembawa gambut [Skripsi] Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lynd LR., Paul JW., Willem H. van Zyl, Isak S. P. 2002. Microbial cellulose utillization: Fundamental and biotechnology. Microbiol. and Mol. Biol. Rev. 66: 506-577.
Maheshwari R, 2005. Fungi Experimental Methods in Biology. New York : Taylor and Friancis.
Maranatha B. 2008. Aktivitas enzim selulase isolat asal Indonesia pada berbagai substrat limbah pertanian [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Mendels M dan Reese ET. 1957. Induction of cellulose in T. viride as influenced by carbon source and metals. J. Bacteriol. 73: 269. Miller GL.1959. Use of dinitrosalicyclyc
Moore-Landecker E .1996. Fundamentals of Fungi. Ed. Ke-4. New Jersey: Prentice-Hall.
Perez J, Munoz-Dorado J, Rubia T, Martinez J. 2002. Biodegradation and biological treatments of cellulose, hemicellulose, and lignin. J. Int. Microbiol. 5:53-63.
Saczi A, Radford A, Erenler K. 1986. Detection of cellulolytic fungi by using Congo red as an indicator: a comparative study with the dinitrosalicyclic acid. Appl. Bacteriol. 61:559-562
Sari W. 2008. Karakterisasi bakteri asal tanah pertanian Jawa Tengah dan
Jawa Barat [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Shanti LP. 1993. Aktivitas selulase sejumlah isolat kapang [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Teather RM, Wood PJ. 1982. Use of congo red-polysaccharide interactions in enumeration and characterization of celluloiytic bacteria from the bovine rumen. Appl. Environ. Microbiol. 43: 777-780.