ISOLASI DAN KARAKTERISASI BAKTERI PENGHASIL
INDOLE-3-ACETIC ACID
(IAA) YANG BERASAL DARI AREA
PENAMBANGAN BATU KAPUR
ANNISA DWIANA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Isolasi dan Karakterisasi Bakteri Penghasil Indole-3-Acetic Acid (IAA) yang berasal dari Area Penambangan Batu Kapur adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
ANNISA DWIANA. Isolasi dan Karakterisasi Bakteri Penghasil Indole-3-Acetic Acid (IAA) yang Berasal dari Area Penambangan Batu Kapur. Dibimbing oleh NISA RACHMANIA MUBARIK dan RATIH DEWI HASTUTI.
Kerusakan tanah akibat aktivitas penambangan batu dapat diatasi melalui penanaman tanaman reklamasi. Tanaman reklamasi perlu dipicu pertumbuhannya agar dapat tumbuh dengan baik pada lahan yang miskin hara dan bersifat alkali dengan bakteri indigenus tanah penambangan, salah satunya bakteri penghasil Indole-3-acetic acid (IAA). Penelitian ini bertujuan untuk mengisolasi dan melakukan karakterisasi bakteri penghasil indole-3-acetic acid (IAA) yang berasal dari area penambangan batu kapur. Isolasi dilakukan pada 13 sampel tanah area penambangan batu kapur dan diperoleh 25 isolat. Hasil seleksi berdasarkan uji hipersensitif hanya dua isolat yang terpilih sebagai isolat uji, yaitu isolat QC 5C32 dan QC 7B41. Hasil identifikasi dengan menggunakan serangkaian reaksi biokimia KIT API 50 CH menunjukkan bahwa kedua isolat memiliki kemiripan sebesar 99.9% dengan Bacillus megaterium dengan bentuk sel batang, Gram positif, dan menghasilkan endospora. Produksi IAA tertinggi saat penambahan 1.5 mM L-triptofan. Hasil menunjukkan isolat memiliki konsentrasi IAA sebesar 10.435 ppm (QC 5C32) dan 18.723 ppm (QC 7B41). Aplikasi kedua isolat terhadap kecambah siratro (Macroptilium atropurpureum) cenderung berpengaruh terhadap pertumbuhan akar primer, jumlah akar lateral, dan bobot basah akar. Kata kunci: Bacillus megaterium, Plant growth promoting rhizobacteria (PGPR), reklamasi.
ABSTRACT
ANNISA DWIANA. Isolation and Characterization of Indole-3-Acetic Acid (IAA) Producing Bacteria from Limestone Quarry. Supervised by NISA RACHMANIA MUBARIK and RATIH DEWI HASTUTI.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
ISOLASI DAN KARAKTERISASI BAKTERI PENGHASIL
INDOLE-3-ACETIC ACID
(IAA) YANG BERASAL DARI AREA
PENAMBANGAN BATU KAPUR
ANNISA DWIANA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2015 ini ialah isolasi bakteri, dengan judul Isolasi dan Karakterisasi Bakteri Penghasil Indole-3-Acetic Acid (IAA) yang Berasal dari Area Penambangan Batu Kapur.
Terima kasih penulis ucapkan kepada Ibu Dr Nisa Rachmania Mubarik, MSi dan Ibu Dr Ir Ratih Dewi Hastuti, MSc selaku pembimbing yang telah memberi masukan saran, materi penelitian, dan penulisan skripsi. Ucapan terimakasih disampaikan kepada Dr Ir RR Dyah Perwitasari, MSc atas saran dan diskusi yang diberikan. Di samping itu, penghargaan penulis sampaikan kepada Pa Jaka, Bu Heni yang selalu membantu berjalannya penelitian, Ryan yang telah bersama-sama mengumpulkan data awal penelitian, Nana, dan Mashudi yang telah berjuang bersama, serta teman-teman Lab Mikrobiologi yang tidak dapat disebutkan satu persatu. Ungkapan terima kasih juga disampaikan kepada Bapa, Mama, Aa, Ade, Gofur serta seluruh keluarga yang selalu mengingatkan, memberi doa, dukungan, dan kasih sayangnya serta teman-teman Biologi 48, teman-teman Microbiota atas segala doa, kebersamaan, dan semangatnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODE 2
Waktu dan Tempat 2
Bahan 2
Isolasi Bakteri Penghasil IAA 2
Penapisan dan Pemilihan Isolat Potensial 2
Karakterisasi dan Identifikasi Bakteri Penghasil IAA 3
Kurva Pertumbuhan dan Sintesis IAA 3
Uji Perkecambahan Siratro (Macroptilium atropurpureum) 3
HASIL DAN PEMBAHASAN 4
Isolasi Bakteri Penghasil IAA 4
Penapisan dan Pemilihan Isolat Potensial 4
Karakterisasi dan Identifikasi Bakteri Penghasil IAA 5
Kurva Pertumbuhan dan Sintesis IAA 6
Uji Perkecambahan Siratro (Macroptilium atropurpureum) 7
Pembahasan 8
SIMPULAN DAN SARAN 10
Simpulan 10
Saran 11
DAFTAR PUSTAKA 11
LAMPIRAN 14
DAFTAR TABEL
1 Konsentrasi IAA yang dihasilkan isolat terpilih 4
2 Profil biokimia isolat QC 5C32 dan QC 7B41 6
3 Pengaruh inokulasi isolat bakteri penghasil IAA terhadap perkecambahan siratro 21 hari setelah tanam 8
DAFTAR GAMBAR
1 Penyimpanan media tabung uji perkecambahan siratro (Macroptilium atropurpureum) pada bak berisi tanah 42 Hasil pewarnaan Gram dan endospora yang ditunjukkan dengan tanda panah isolat QC 5C32 dan QC 7B41 pada perbesaran 1000x 5
3 Kurva pertumbuhan isolat bakteri QC 5C32 dan produksi IAA pada media nutrient broth (NB) dengan berbagai konsentrasi L-triptofan 7
4 Kurva pertumbuhan isolat bakteri QC 7B41 dan produksi IAA pada media nutrient broth (NB) dengan berbagai konsentrasi L-triptofan 7
DAFTAR LAMPIRAN
1 Kurva standar pengukuran IAA 142 Kurva standar pertumbuhan isolat QC 5C32 14
3 Kurva standar pertumbuhan isolat QC 7B41 14
4 Komposisi hara bebas nitrogen Ahmed Evans 15
5 Karakteristik bakteri yang berhasil diisolasi dari 13 sampel tanah area penambangan batu kapur Palimanan Cirebon 16
6 Konsentrasi IAA yang dihasilkan 25 isolat 18
7 Hasil identifikasi fisiologi isolat QC 5C32 dan QC 7B41 dengan menggunakan KIT API 50 CH 18
PENDAHULUAN
Latar Belakang
Batu kapur merupakan mineral yang digunakan dalam sektor industri dan pertanian. Penggunaan batu kapur antara lain sebagai bahan pembuatan semen, keramik, dan pengapuran untuk pertanian. Pemenuhan kebutuhan batu kapur dilakukan dengan penambangan batu kapur. Proses penambangan batu kapur menyebabkan hilangnya vegetasi, kerusakan horizon tanah, dan sisa bahan galian tertimbun. Dampak lain aktivitas penambangan, yaitu hilangnya lapisan top soil tanah, kandungan bahan organik dan unsur hara tersedia rendah, pemadatan tanah, pH tinggi, suhu tanah tinggi, dan diversitas mikrob rendah (Prayudyaningsih 2014). Masalah lain yang timbul akibat proses penambangan yaitu penurunan vegetasi dan perubahan tanah penutup, morfologi, dan topografi yang selanjutnya akan mengubah struktur tanah (Subardja et al. 2011).
Kerusakan tanah penambangan batu kapur dapat diatasi dengan cara reklamasi lahan melalui penanaman tanaman reklamasi pada lahan bekas tambang. Tanaman reklamasi harus mampu hidup pada lahan bekas tambang yang miskin hara dan bersifat alkalin. Tanaman tersebut antara lain Alstonia scholaris, Acacia auriculiformis, dan Muntingia calabura (Prayudyaningsih 2014). Selain ketiga tanaman yang telah disebutkan, tanaman legum juga berpotensi sebagai tanaman reklamasi, salah satunya siratro (Macroptilium atropurpureum). Siratro merupakan tanaman legum merambat yang berasal dari Amerika tropis, memiliki daun berwarna hijau terang, setiap tangkai daun terdiri atas tiga daun, dan penyebaran dapat secara vegetatif atau melalui biji (DAFF 2014).
Tanaman reklamasi membutuhkan suatu zat pemacu pertumbuhan agar dapat hidup dengan baik pada tanah bekas tambang. Rizobakter sebagai agensia pemacu pertumbuhan tanaman (Plant Growth-Promoting Rhizobacteria/ PGPR) dapat digunakan untuk meningkatkan pertumbuhan tanaman reklamasi batu kapur. PGPR indigenus tanah tambang batu kapur lebih mudah beradaptasi bila diaplikasikan ke lingkungan aslinya, seperti aplikasi bakteri pelarut fosfat asal tambang batuan kapur Cirebon pada bibit tanaman akasia (Mubarik et al. 2014). Mekanisme PGPR dalam memacu pertumbuhan tanaman salah satunya dengan mensekresikan zat pemacu tumbuh tanaman seperti Indole-3-acetic acid (IAA).
2
bakteri memicu pertumbuhan tanaman secara langsung dengan menstimulasi perpanjangan sel atau jaringan (Patten dan Glick 2002).
Tujuan Penelitian
Penelitian ini bertujuan mengisolasi dan melakukan karakterisasi bakteri penghasil Indole-3-acetic acid (IAA) yang berasal dari area penambangan batu kapur.
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari-April 2015 bertempat di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB.
Bahan
Bahan yang digunakan ialah 13 kantung sampel tanah penambangan batu kapur dari Palimanan Cirebon koleksi Laboratorium Mikrobiologi, Biologi, FMIPA IPB dan biji Siratro (Macroptilium atropurpureum) yang diperoleh dari Sukabumi.
Isolasi Bakteri Penghasil IAA
Sampel tanah masing-masing diambil 1 gram dan diencerkan dari 10-1 hingga 10-4 menggunakan larutan garam fisiologis 0.85%. Sebanyak 0.1 mL suspensi tanah tersebut disebar menggunakan metode total plate count (TPC) pada media nutrient agar (NA) dengan penambahan 1 mM L-triptofan dan diinkubasi selama 24 jam. Koloni bakteri yang tumbuh dihitung jumlahnya, kemudian koloni dengan morfologi yang berbeda dimurnikan menggunakan metode kuadran pada media NA dengan penambahan 1 mM L-triptofan.
Penapisan dan Pemilihan Isolat Potensial
3 Konsentrasi IAA yang terdapat dalam kultur ditentukan berdasarkan kurva standar IAA dengan kisaran 0-40 ppm (Lampiran 1). Selanjutnya, Pemilihan isolat dilakukan berdasarkan uji hipersensitif pada daun tembakau (Yandra 2015).
Karakterisasi dan Identifikasi Bakteri Penghasil IAA
Karakterisasi bakteri dilakukan berdasarkan sifat morfologi koloni bakteri, bentuk sel, dan hasil pewarnaan bakteri menggunakan pewarnaan Gram serta pewarnaan endospora. Pewarnaan endospora hanya dilakukan pada dua isolat bakteri terpilih. Bakteri yang digunakan dalam pewarnaan berumur 24 jam. Ciri fisiologi dua isolat terpilih diamati menggunakan KIT API 50 CH bioMérieux®sa yang merupakan sistem yang terstandarisasi untuk pengujian metabolisme karbohidrat dari bakteri. Hasil positif menunjukkan profil biokimia yang digunakan untuk mengidentifikasi spesies bakteri. Identifikasi diperoleh dengan mengacu pada Indeks Analytical Profile pada perangkat lunak APIWEB.
Kurva Pertumbuhan dan Sintesis IAA
Sebanyak 2 isolat terpilih digunakan sebagai model untuk mengetahui produksi IAA. Satu lup bakteri diinokulasikan ke dalam 50 mL media NB kemudian dikocok dengan kecepatan agitasi 100 rpm hingga kepekatan ±108 sel/mL. Sebanyak 2 mL kultur diambil dan dimasukkan ke dalam 100 mL media NB dengan penambahan berbagai konsentrasi L-triptofan (0 mM, 0.5 mM, 1 mM, 1.5 mM). Kerapatan bakteri diukur menggunakan spektrofotometer dengan panjang gelombang 600 nm. Selanjutnya kultur dikocok kembali menggunakan kecepatan yang sama selama 6 jam. Setiap 6 jam dihitung kerapatan dari kultur dan produksi IAA. Kurva standar pertumbuhan isolat digunakan untuk mengetahui jumlah sel bakteri dengan menggunakan metode turbidimetri dan hitungan cawan (Lampiran 2 dan 3).
Uji Perkecambahan Siratro (Macroptilium atropurpureum)
Sebanyak kurang lebih 36 biji siratro dipilih yang tidak terapung dalam air. Biji tersebut direndam dalam H2SO4 pekat selama 30 menit, dibilas dengan akuades steril hingga tidak ada H2SO4 yang tersisa, selanjutnya biji direndam di dalam akuades steril selama satu malam. Setelah perendaman, biji dikecambahkan di dalam cawan petri berisi water agar selama 2 hari dalam suhu ruang dan keadaan gelap. Kecambah siratro ditanam di dalam tabung berukuran 30x200 mm yang telah berisi media agar-agar miring mengandung larutan hara bebas nitrogen dan dengan penambahan nitrogen menurut komposisi Ahmed Evans (Lampiran 4) (Somasegaran dan Hoben 1985).
4
Penentuan pertumbuhan tanaman siratro (Macroptilium atropurpureum) dilakukan menggunakan rancangan acak kelompok faktorial dengan 3 faktor perlakuan. Faktor pertama, yaitu inokulasi isolat QC 5C32, QC 7B41, dan kontrol. Faktor kedua, yaitu media tanpa dan dengan penambahan KNO3 0.05%. Faktor ketiga, yaitu tanpa dan dengan penambahan 1 mM L-triptofan. Hasil pengukuran dianalisis secara statistik menggunakan one-way Analysis of Variance (ANOVA) program SPSS.
Gambar 1 Penyimpanan media tabung uji perkecambahan siratro (Macroptilium atropurpureum) pada bak berisi tanah
HASIL DAN PEMBAHASAN
Isolasi Bakteri Penghasil IAA
Isolasi 13 sampel tanah area penambangan batu kapur dilakukan dengan mengggunakan media nutrient agar (NA) dengan penambahan 1 mM L-triptofan. Sampel tanah yang digunakan diambil pada tiga area penambangan, yaitu area tambang, area bekas tambang, dan area reklamasi. Sebanyak 25 isolat berhasil didapatkan dari ketiga area pengambilan sampel tanah, namun sebanyak 14 isolat didapatkan dari area reklamasi (Lampiran 5).
Penapisan dan Pemilihan Isolat Potensial
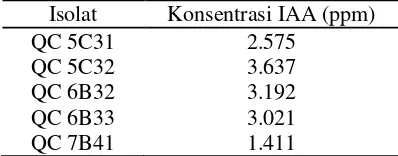
Seluruh isolat yang diperoleh diuji kemampuannya menghasilkan IAA dengan metode kolorimetri menggunakan reagen Salkowski (Lampiran 6), kemudian dipilih 5 Isolat yang menghasilkan konsentrasi IAA tertinggi (Tabel 1).
Tabel 1 Konsentrasi IAA yang dihasilkan isolat terpilih
Isolat Konsentrasi IAA (ppm)
QC 5C31 2.575
QC 5C32 3.637
QC 6B32 3.192
QC 6B33 3.021
5 Dari kelima isolat tersebut, hasil uji hipersensitif menggunakan daun tembakau didapatkan 3 isolat patogen dan 2 isolat lainnya nonpatogen (Yandra 2015). Dua isolat nonpatogen, yaitu QC 5C32 dan QC 7B41 digunakan sebagai isolat terpilih untuk pengujian tahap penelitian selanjutnya.
Karakterisasi dan Identifikasi Bakteri Penghasil IAA
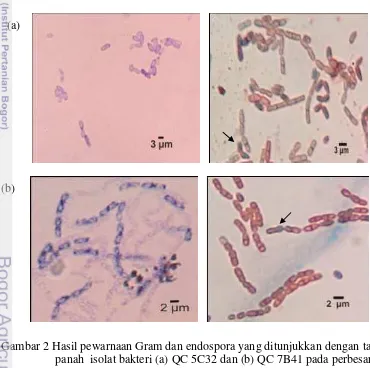
Penampakan koloni isolat sebagian besar berwarna putih dan sebagian lainnya berwarna krem, bentuk koloni bermacam-macam, tepian licin dan tidak beraturan, serta elevasi cembung dan timbul. Hasil pewarnaan Gram menunjukkan 16 isolat bersifat Gram negatif dan 9 isolat lainnya bersifat Gram positif dengan bentuk sel batang kecuali isolat QC 5C43 bentuk sel kokus (Lampiran 5). Dua isolat terpilih masing-masing termasuk ke dalam Gram positif yang ditandai dengan warna sel biru atau biru keunguan setelah diberi pewarnaan Gram dan memiliki bentuk batang. Kedua isolat menghasilkan endospora yang ditandai dengan adanya endospora berwarna hijau dan sel vegetatif berwarna merah (Gambar 2).
Gambar 2 Hasil pewarnaan Gram dan endospora yang ditunjukkan dengan tanda panah isolat bakteri (a) QC 5C32 dan (b) QC 7B41 pada perbesaran 1000x
Identifikasi secara fisiologi dilakukan menggunakan KIT API 50 CH bioMérieux®sa yang terdiri atas 50 mikrotube untuk pengujian fermentasi gula dan turunannya. Hasil positif ditandai dengan perubahan warna reagen dari merah
(a)
6
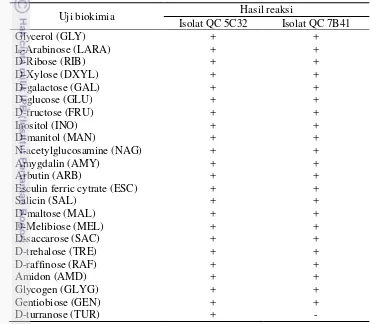
menjadi kuning pada masa inkubasi 24 dan 48 jam (Lampiran 7). Hasil tersebut dibaca sesuai perubahan warna yang terjadi dan identifikasi diperoleh dengan mengacu pada Indeks Analytical Profile pada perangkat lunak APIWEB. Berdasarkan hasil identifikasi menggunakan KIT API 50 CH bioMérieux®sa didapatkan kedua isolat, yaitu QC 5C32 dan QC 7B41 memiliki kemiripan dengan Bacillus megaterium sebesar 99.9% (Tabel 2).
Tabel 2 Profil biokimia isolat QC 5C32 dan QC 7B41
Uji biokimia Hasil reaksi
Isolat QC 5C32 Isolat QC 7B41
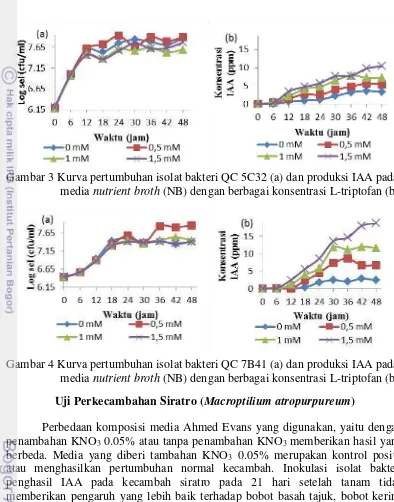
Glycerol (GLY) + + cenderung tidak dipengaruhi oleh konsentrasi L-triptofan yang diberikan pada media tumbuh isolat. Pola produksi IAA sama pada media dengan pemberian L-triptofan atau tanpa pemberian L-L-triptofan. Isolat QC 5C32 mulai menghasilkan IAA pada jam ke-12 (Gambar 3), sedangkan isolat QC 7B41 menghasilkan IAA pada jam ke-18 (Gambar 4).
7 yaitu sebesar 10.435 ppm dengan log sel 7.766 cfu/ml (Gambar 3). Isolat QC 7B41 menghasilkan IAA tertinggi pada jam ke-48, yaitu sebesar 18.723 ppm dengan log sel 7.406 cfu/ml (Gambar 4).
Gambar 3 Kurva pertumbuhan isolat bakteri QC 5C32 (a) dan produksi IAA pada media nutrient broth (NB) dengan berbagai konsentrasi L-triptofan (b)
Gambar 4 Kurva pertumbuhan isolat bakteri QC 7B41 (a) dan produksi IAA pada media nutrient broth (NB) dengan berbagai konsentrasi L-triptofan (b)
Uji Perkecambahan Siratro (Macroptilium atropurpureum)
Perbedaan komposisi media Ahmed Evans yang digunakan, yaitu dengan penambahan KNO3 0.05% atau tanpa penambahan KNO3 memberikan hasil yang berbeda. Media yang diberi tambahan KNO3 0.05% merupakan kontrol positif atau menghasilkan pertumbuhan normal kecambah. Inokulasi isolat bakteri penghasil IAA pada kecambah siratro pada 21 hari setelah tanam tidak memberikan pengaruh yang lebih baik terhadap bobot basah tajuk, bobot kering tajuk, jumlah daun, dan tidak menghasilkan bintil akar, tetapi cenderung memberikan pengaruh terhadap panjang akar primer, jumlah akar lateral, dan bobot basah akar (Lampiran 8).
8
KNO3 ditambah 1 mM L-triptofan. Bobot basah akar lebih tinggi dibandingkan kontrol pada pemberian isolat QC 5C32 yang tumbuh pada media dengan penambahan KNO3 0.05% (Tabel 3).
Tabel 3 Pengaruh inokulasi isolat bakteri penghasil IAA terhadap perkecambahan siratro 21 hari setelah tanam Angka yang diikuti huruf yang sama dalam satu kolom tidak berbeda nyata pada taraf 5%
(DMRT). N0= tanpa KNO3, N1= KNO3 0.05%, P0= tanpa L-triptofan, P1= L-triptofan 1
mM , A= isolat 5C 5C32, B= isolat QC 7B41, C= kontrol.
Pembahasan
Sebanyak 25 isolat bakteri penghasil IAA berhasil diperoleh dari 13 sampel tanah dari area penambangan batu kapur. Isolasi dilakukan dengan menggunakan media NA yang mengandung 1 mM L-triptofan dengan tujuan untuk mendapatkan sebanyak mungkin isolat bakteri potensial penghasil IAA. Aktivitas IAA diinduksi saat isolat bakteri tumbuh pada media dengan penambahan L-triptofan sebagai prekursor auksin (Kafrawi et al. 2014). Sebagian besar isolat didapatkan dari sampel tanah area reklamasi karena pada area reklamasi telah ditanami dengan berbagai macam tanaman reklamasi yang menghasilkan eksudat akar. Eksudat akar seperti asam amino dan gula digunakan sebagai sumber energi dan nutrisi bagi bakteri (Haas dan Defago 2005).
Pemilihan isolat uji dilakukan berdasarkan uji hipersensitif pada tanaman tembakau. Isolat yang menyebabkan reaksi hipersensitif pada permukaan daun tembakau merupakan bakteri patogen tanaman. Reaksi hipersensitif merupakan program kematian sel yang cepat dan terlokalisasi. Daun tembakau yang diinokulasi dengan bakteri menjadi kecoklatan pada area masuknya bakteri. Induksi reaksi hipersensitif dan patogenisitas dipengaruhi oleh gen hrp (hypersensitive reaction and patoghenicity) yang umum ditemukan pada bakteri Gram negatif patogen tanaman, seperti Xanthomonas oryzae pv oryzae (Zhu et al. 2000).
9 5C32 dan QC 7B41 berupa batang dengan sifat Gram positif dan menghasilkan endospora. Bacillus mampu menghasilkan struktur khusus endospora sebagai pertahanan diri yang mengaktifkan organisme untuk bertahan pada kondisi yang tidak menguntungkan, yaitu suhu ekstrem, kekeringan, dan kekurangan nutrisi (Madigan et al. 2012). Beberapa spesies dari genus Bacillus berperan sebagai pestisida, fungisida, biofertilizer, dan memiliki kemampuan memacu pertumbuhan tanaman (Peres-Garcia et al. 2011).
Isolat B. megaterium memiliki karakteristik sebagai Plant growth promoting rhizobacteria (PGPR) yaitu mampu menginduksi pertahanan biji terhadap ancaman cendawan Phytium aphanirdetum (Liang et al. 2011). Bacillus megaterium mampu meningkatkan pertumbuhan tanaman dan perkembangan akar, selain itu, auksin yang dihasilkan B. megaterium dapat menghambat pertumbuhan akar primer dengan meningkatkan pertumbuhan dan jumlah akar lateral, serta panjang rambut akar (Lopez-Bucio et al. 2007). Bacillus megaterium juga memiliki kemampuan melarutkan fosfat, memproduksi IAA, dan sebagai biokontrol (Trivedi dan Pandey 2008).
Pertumbuhan isolat QC 5C32 cukup cepat, pada jam ke-12 pertumbuhan bakteri sudah mencapai akhir fase logaritmik (Gambar 3). Isolat QC 7B41 mengalami akhir fase lag yang terjadi pada jam ke-6 diikuti fase logaritmik berakhir pada jam ke-18 (Gambar 4). Kedua isolat bakteri pada pemberian berbagai konsentrasi L-triptofan mengalami penurunan log sel pada jam ke-30.
Pola produksi IAA sejalan dengan pertumbuhan isolat. IAA dari kedua isolat mulai disintesis pada akhir fase logaritmik dan mencapai konsentrasi tertinggi pada fase stasioner. Penelitian sebelumnya menyatakan bahwa isolat Bacillus yang berasal dari tanah rizosfer padi mulai mensintesis IAA pada awal fase logaritmik dan IAA diproduksi secara signifikan pada akhir fase logaritmik (Widayanti 2007). Pernyataan tersebut menunjukkan bahwa produksi IAA isolat Bacillus yang berasal dari tanah penambangan batu kapur lebih lambat dibandingkan Bacillus yang berasal dari tanah rizosfer padi. Aktivitas mikroorganisme dipengaruhi oleh keberadaan nutrisi yang menunjang kehidupan mikroorganisme tersebut (Madigan et al. 2012).
Produksi IAA dapat dihasilkan oleh kedua isolat tanpa penambahan L-triptofan dalam media uji meskipun dalam jumlah yang lebih sedikit. Produksi IAA tertinggi dihasilkan saat media diberi tambahan 1.5 mM L- triptofan dengan konsentrasi IAA yang dihasilkan sebesar 10.435 ppm (QC 5C32) dan 18.723 ppm (QC 7B41). Konsentrasi IAA yang dihasilkan oleh bakteri meningkat seiring peningkatan konsentrasi L-triptofan dalam media uji (Patten dan Glick 2002).
10
IAA yang dihasilkan bakteri mendorong pembentukan sel epidermis dalam rambut akar dan meningkatkan jumlah lokasi yang potensial untuk diinfeksi untuk pembentukan bintil akar (Yahalom 1990). IAA yang disekresikan oleh kedua isolat cenderung meningkatkan panjang akar primer, jumlah akar lateral, dan bobot basah akar tanaman, namun pemberian inokulum bakteri tidak memberikan pengaruh yang lebih baik terhadap pemanjangan tajuk, jumlah daun, bobot basah tajuk, bobot kering tajuk, dan bobot kering akar. Hal ini sesuai dengan pernyataan bahwa IAA eksogen atau IAA bakteri pada konsentrasi rendah, yaitu 0.5-26.5 ppm dapat memacu secara langsung pemanjangan akar primer dan pertumbuhan akar lateral saat bakteri berasosiasi dengan tanaman (Patten dan Glick 2002).
Akar primer siratro yang diberi perlakuan bakteri cenderung lebih panjang dibandingkan kontrol, terutama pada pemberian isolat QC 7B41 yang ditumbuhkan pada media dengan penambahan KNO3 0.05% dan tanpa 1 mM L-triptofan. Akar primer juga lebih panjang bila dibandingkan dengan kecambah yang ditumbuhkan pada media tanpa KNO3, hal ini menunjukkan bahwa pemberian KNO3 sebagai sumber nitrogen penting bagi pertumbuhan kecambah dan sintesis IAA bakteri. Ketika media tumbuh bakteri diberikan sumber nitrogen eksogen, maka cadangan triptofan endogen bakteri akan digunakan untuk menghasilkan metabolit sekunder seperti IAA, dibandingkan untuk mensintesis protein (Duca et al. 2014)
Jumlah akar lateral yang tumbuh juga cenderung lebih banyak dibandingkan kontrol, terutama pada pemberian isolat QC 5C32 yang tumbuh pada media tanpa KNO3 dengan penambahan 1 mM L-triptofan. IAA dihasilkan saat penambahan L-triptofan dalam media tumbuh bakteri. Hal ini menunjukan bahwa jalur pembentukan IAA oleh bakteri melalui jalur triptofan. Triptofan telah teridentifikasi sebagai prekursor utama jalur biosintesis IAA pada bakteri. Terdapat lima jalur pembentukan IAA yang menggunakan triptofan sebagai prekursor utama. yaitu indole-3-acetamyde, indole-3-pyruvate, tryptamine, Tryptophan side-chain oxidase, dan Indole-3-acetonitrile (Spaepen et al. 2007).
Bobot basah akar dengan pemberian bakteri cenderung lebih tinggi dibandingkan kontrol, terutama pada pemberian isolat QC 5C32. Hal ini sesuai dengan laporan Ali et al. (2009) bahwa pemberian B. megaterium dapat menghasilkan auksin yang dapat meningkatkan pemanjangan akar primer dibandingkan kontrol. Peningkatan panjang akar primer diikuti dengan peningkatan bobot basah akar. Dua parameter pertumbuhan jumlah akar lateral dan bobot basah akar lebih tinggi dibandingkan kontrol saat pemberian isolat QC 5C32. Hal ini menunjukkan IAA yang dihasilkan isolat QC 5C32 lebih mendukung pertumbuhan tanaman dibandingkan IAA yang dihasilkan isolat QC 7B41.
SIMPULAN DAN SARAN
Simpulan
L-11 triptofan. Konsentrasi IAA yang dihasilkan oleh QC 5C32 dan QC 7B41 masing-masing sebesar 10.435 ppm dan 18.723 ppm. IAA yang disekresikan bakteri tersebut cenderung dapat meningkatkan panjang akar primer, jumlah akar lateral, dan bobot basah akar kecambah siratro (Macroptilium atropurpureum) yang ditanam di rumah kaca.
Saran
Identifikasi bakteri secara molekular 16S rRNA perlu dilakukan untuk memberikan hasil yang pasti spesies bakteri tersebut.
DAFTAR PUSTAKA
Ali B, Sabri AN, Ljung K, Hasnain S. 2009. Quantification of indole-3-acetic acid from plant associated Bacillus spp. and their phytostimulatory effect on Vigna radiata (L.). World J Microbiol Biotechnol. 25: 519-526.
Angus AA, Lee A, Lum MR, Shehayeb M, Hessabi R, Fujishige NA, Yerrapragada S, Kano S, Song N, Yang P et al. 2013. Nodulation and effective nitrogen fixation of Macroptilium atropurpureum (siratro) by Burkholderia tuberum, a nodulating and plant growth promoting beta-proteobacterium are influenced by environmental factors. Plant Soil. 369 (1-2): 543-562.
Benjamins R, Scheres B. 2008. Auxin: the looping star in plant development. Ann Rev Plant Biol.59: 443-465.
[DAFF] Department of Agriculture, Fisheries and Forestry. 2014. Not declared pest plant; siratro (Macroptilium atropurpureum) [internet]. [waktu dan tempat pertemuan tidak diketahui]. Queensland (AU). [diunduh 2015 juli 2]. Tersedia pada: https://www.daf.qld.gov.au/plants/weeds-pest-animals-ants/weeds/a-z-listing-of-weeds/photo-guide-to-weeds/siratro/?a=65289.
Ding Y, Wang J, Liu Y, Chen S. 2005. Isolation and identification of nitrogen-fixing Bacilli from plant rhizospheres in Beijing region. J Appl Microbiol. 99: 1271–128.
Duca D, Lorv J, Patten CL, Rose D, Glick BR. 2014. Indole-3-acetic acid in plant microbe interactions. A. Van. Leeuw. J. Microbiol. 106: 85–125.
Haas D, Defago G. 2005. Biological control of soil-borne pathogens by fluorescent pseudomonads. Nat Rev Microbiol. 3: 307–319.
Kafrawi, Baharuddin, Sengin EL, Rosmana A. 2014. Screening of free-living indole acetic acid producing rhizobacteria from shallot rhizospheres in the island of Sulawesi. Int J Scie Technol Res. 3(2):118-121.
Liang J, Tao R, Hao Z, Wang L, Zhang X. 2011. Induction of resistance in cucumber againts seedling damping-off by plant growth promoting rhizobacteria (PGPR) Bacillus megaterium strain L8. Afr J Biotechnol. 10(36): 6920-6927.
12
architectur through an auxin and etylene-independent signaling mechanism in Arabidopsis thaliana. Molec Plant-Microb Interact. 20(2):207-217.
Madigan MT, Martinko JM, Stahl DA, Clark DP. 2012. Brock Biology of Microorganisms Thirteen Edition. Netherland (NL): Wageningen Agricultural University.
Mubarik NR, Wibowo RH, Angraini E, Mursyida E, Wahdi E. 2014. Exploration of bacterial diversity at Cirebon quarry [final report]. Bogor (ID):
www.quarrylifeaward.ae/system/files/winners-files/qla_project_nisa_r_mubarik_et_al_indonesia.2014.pdf.
Patten CL, Glick BR. 2002. Role of Pseudomonas putida indoleacetic acid in development of the root plant system. Appl Environ Microbiol. 68(8):3795-3801.
Peres-Garcia A, Romero D, de Vicente A. 2011. Plant protection and growth stimulation by microorganism: biotechnological application of Bacilli in agriculture. Food Biotechnol. 22:187-193.
Prayudyaningsih R. 2014. Pertumbuhan semai Alstonia scholaris. Acacia auriculiformis. dan Muntingia calabura yang diinokulasi fungi mikoriza arbuskula pada media tanah bekas tambang kapur. J Penel Kehut Wallacea. 3(1):13-23.
Somasegaran P, Hoben HJ. 1985. Methods in Legume-Rhizobium Technology. Paia (US): University of Hawaii.
Spaepen S, Varderleyden J, Remans R. 2007. Indole-3-acetic acid in microbial and microorganism-plant signaling. FEMS Microbiol Rev. 1-24.
Subardja A, Sumawijaya N, Noviardi R, Iqbal R. 2011. Rehabilitasi lahan pasca tambang di kuari batu gamping Citeureup. kabupaten Bogor. Jawa Barat. Prosiding Pemaparan Hasil Penelitian Puslit Geoteknologi [Internet]. [Waktu dan tempat pertemuan tidak diketahui]. Bandung (ID): Pusat Penelitian Geoteknologi LIPI. 185-192; [diunduh 2015 Mei 7]. Tersedia pada:http://www.researchgate.net/profile/Prahara_Iqbal/publication/273451294 _REHABILITASI_LAHAN_PASCATAMBANG_DI_KUARI_BATUGAMPI NG_CITEUREUP_KABUPATEN_BOGOR_JAWA_BARAT/links/550255cb 0cf231de076e20ba.pdf
Torres-Rubio MG, Valencia-Plata SA, Bernall-Castilo J, Martinez-Nieto P. 2000. Isolation of Enterobacteria. Azotobacter sp. dan Pseudomonas sp., producers of indole-3-acetic acid and siderosphores. from Colombian rice rhizosphere. Rev Lat Microbiol. 42:171-176.
Trivedi P, Pandey A. 2008. Plant growth promotion abilities and formulation of
Bacillus megaterium strain B 388 (MTCC6521) isolated from a temperate
Himalayan location. Indi J Microbiol. 48: 342-347.
Widayanti T. 2007. Isolasi dan karakterisasi Bacillus sp. indigenus penghasil
asam indol asetat asal tanah rizosfer [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Yahalom E , Okon Y, Dovrat A. 1990. Possible mode of action of Azospirillum
brasilense strain Cd on the root morphology and nodule formation in burr medic (Medicago polymorpha). Can J Microbiol. 36: 10- 14.
13
Zhu W, Magbanua MM, White FF. 2000. Identification of two novel
hrp-associated genes in the hrp gene cluster of Xanthomonas oryzae pv oryzae. J
14
LAMPIRAN
Lampiran 1 Kurva standar pengukuran IAA
Lampiran 2 Kurva standar pertumbuhan isolat QC 5C32
15 Lampiran 4 Komposisi hara bebas nitrogen Ahmed Evans (Somasegaran dan
Lampiran 5 Karakteristik bakteri yang berhasil diisolasi dari 13 sampel tanah area penambangan batu kapur Palimanan Cirebon
Isolat Lokasi area
dengan GPS Lokasi
Karakteristik koloni Karakteristik sel
Bentuk Tepian Elevasi Warna Bentuk Penataan Gram
MIK 11
S 06035’24, 11”
E 106048’21,2” Bekas tambang
Konsentris Licin Seperti
tetesan Krem Batang Tunggal Negatif
MIK 12 Bundar Licin Cembung Krem Batang Tunggal Negatif
MIK 13 Bundar Licin Cembung Putih Batang Tunggal Negatif
QC 1B22 Keriput Berombak Timbul Putih Batang Tunggal Negatif
QC 1B23 Bundar Licin Timbul Putih Batang Berpasangan Positif
QC 1B41 Bundar dengan
tepian menyebar Berombak Timbul Putih Batang Tunggal Positif
QC 4B31 S 06
043’08,2”
E 108023’08,38” Penambangan Bundar Berombak Timbul Putih Batang Tunggal Negatif
QC 5B31
S 06043’09,5”
E 108024’01,5” Reklamasi
Keriput Licin Cembung Putih Batang Tunggal Negatif
QC 5B32 Keriput Berombak Timbul Putih Batang Berpasangan Negatif
QC 5B41 Kompleks Tidak
beraturan
Berbukit-bukit Agak krem Batang Tunggal Negatif
QC 5B42 Bundar Licin Seperti
tetesan Putih Batang Berpasangan Negatif
QC 5C31 Bundar dengan
tepian timbul Licin Timbul Krem Batang Berpasangan Negatif
QC 5C32 Bentuk L Licin Cembung Putih Batang Tunggal Positif
QC 5C33 Bundar Licin Timbul Putih
kecoklatan Batang Tunggal Negatif
QC 5C34 Bentuk L Licin Cembung Putih Batang Tunggal Positif
QC 5C41 Bentuk L Bercabang Cembung Krem Batang Tunggal Negatif
QC 5C42 Konsentris Seperti wol Cembung Putih Batang Berpasangan Negatif
QC 5C43 Konsentris Seperti wol Cembung Putih Kokus Gerombol Positif
QC 6B31 S 06043’19,5”
E 108024’04,6” Penambangan
Tidak beraturan
dan menyebar Bercabang Timbul Putih Batang Tunggal Negatif
QC 6B32 Tidak beraturan Seperti Timbul Putih Batang Tunggal Positif
2
dan menyebar Benang
QC 6B33 Bentuk L Siliat Timbul Putih Batang Berpasangan Negatif
QC 6B41 Bundar Licin Timbul Putih Batang Tunggal Positif
QC 7B31 S 06043’18,6”
E 108024’06,2” Reklamasi
Bentuk L Licin Timbul Putih Batang Tunggal Positif
QC 7B41 Bentuk L Licin Cembung Putih Batang Tunggal Positif
18
Lampiran 6 Konsentrasi IAA yang dihasilkan 25 isolat
Isolat Konsentrasi IAA
(ppm) Isolat Konsentrasi IAA (ppm)
QC 5C32 4.562 QC 5C41 0.000
QC 5B31 3.260 QC 5B41 0.000
QC 5C42 0.000 QC 5C44 1.719
QC 5B32 0.000 QC 4B31 0.000
MIK 11 0.000 MIK 12 0.000
QC 5C31 2.884 QC 6B31 0.555
QC 1B41 1.651 QC 1B23 0.000
QC 1B22 1.411 QC 6B32 2.096
QC 5B41 0.000 QC 5B42 0.000
QC 7B41 2.130 QC 5C43 0.000
MIK 13 0.000 QC 5C34 0.486
QC 6B33 1.925 QC 6B11 0.000
QC 5C33 0.349
Lampiran 7 Hasil identifikasi fisiologi isolat (a) QC 5C32 (b) QC 7B41 dengan menggunakan KIT API 50 CH
19 Lampiran 8 Hasil uji kecambah siratro (Macroptilium atropurpureum)
N0P0A (a) N0P1A (b) N1POA (c) N1P1A (d) N0P0B (e) N0P1B (f) N1P0B (g) N1P1B (h) N0P0C (i) N0P1C (j) N1P0C (k) N1P1C (l). N0= tanpa KNO3. N1= KNO3 0.05%. P0= tanpa L-triptofan. P1= L-triptofan 1 mM . A= isolat 5C 5C32. B= isolat QC 7B41. C= kontrol.
a b c d
e
20
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta, 20 September 1993 dari Ayah Mama dan Ibu Junaeti. Penulis merupakan anak kedua dari tiga bersaudara. Tahun 2011 penulis lulus dari SMA Negeri 9 Bekasi dan pada tahun yang sama penulis lulus seleksi IPB melalui jalur SNMPTN Undangan di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam. Penulis mendapatkan Beasiswa BRI 100 pada tahun 2013 dan beasiswa Peningkatan Prestasi Akademik (PPA) dari
DIKTI pada tahun 2014.