UJI TOKSISITAS SUBKRONIK EKSTRAK ETANOL
PECUT KUDA (
Stachytharpheta jamaicensis L.Vahl
)
PADA MENCIT
SKRIPSI
OLEH:
HELMI EVELINDA NAIBAHO
NIM 121524147
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
UJI TOKSISITAS SUBKRONIK EKSTRAK ETANOL
PECUT KUDA (
Stachytharpheta jamaicensis L.Vahl
)
PADA MENCIT
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
HELMI EVELINDA NAIBAHO
NIM 121524147
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah melimpahkan
rahmat dan karunia kepada penulis sehingga dapat menyelesaikan penyusunan
skripsi yang berjudul Uji Toksisitas Subkronik Ekstrak Etanol Pecut Kuda
(Stachytharpheta jamaicensis L.Vahl) Pada Mencit. Skripsi ini diajukan untuk
melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas
Farmasi Universitas Sumatera Utara.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan
terima kasih kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan
Fakultas Farmasi dan Ibu Prof. Dr. Julia Reveny, M.Si., Apt., selaku Wakil Dekan
I Fakultas Farmasi yang telah menyediakan fasilitas kepada penulis selama
perkuliahan di Fakultas Farmasi. Penulis juga mengucapkan terima kasih kepada
Ibu Aminah Dalimunthe, S.Si., M.Si., Apt., dan Ibu Marianne, M.Si, Apt., yang
telah membimbing penulis dengan penuh kesabaran, memberikan petunjuk dan
saran-saran selama penelitian hingga selesainya skripsi ini. Bapak Prof. Dr.
Karsono., Apt., selaku penasehat akademis yang memberikan bimbingan kepada
penulis selama ini. Bapak dan Ibu staff pengajar Fakultas Farmasi Universitas
Sumatera Utara yang telah mendidik penulis selama masa perkuliahan. Ibu
Marianne, S.Si., M.Si., Apt., selaku Kepala Laboratorium Farmakologi yang telah
memberikan fasilitas, petunjuk dan membantu selama penelitian. Ucapan terima
kasih juga penulis sampaikan kepada Ibu Prof. Dr. Rosidah, M.Si., Apt., selaku
Anjelisa Z. Hsb, M.Si., Apt., selaku anggota penguji yang telah memberikan
evaluasi dan masukan kepada penulis dalam penyusunan skripsi ini .
Penulis mengucapkan terima kasih yang tak terhingga dan penghargaan
yang tulus kepada Ayahanda Marolo P. Naibaho dan Ibunda Sabenna Sinaga,
serta kepada kakanda tercinta Meristan Naibaho dan Dahlia Naibaho, abangda
tercinta Alfonsin Naibaho, Jesse Naibaho dan Josden Naibaho, yang senantiasa
memberikan doa, dukungan, semangat dan kasih sayang yang tak ternilai dengan
apapun. Penulis juga mengucapkan terima kasih kepada teman-teman Farmasi
Ekstensi 2012 atas doa dan dukungan dalam penyelesaian skripsi ini.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih belum
sempurna. Oleh karena itu, penulis mengharapkan saran dan kritik yang
membangun demi kesempurnaan skripsi ini. Semoga Allah membalas segala budi
baik dan penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan
khususnya di bidang farmasi.
Medan, Juli 2015 Penulis,
UJI TOKSISITAS SUBKRONIK EKSTRAK ETANOL PECUT KUDA (Stachytharpheta jamaicensis L.Vahl ) PADA MENCIT
ABSTRAK
Uji toksisitas subkronik merupakan suatu pengujian untuk mendeteksi efek toksik yang muncul setelah pemberian sediaan uji dengan dosis berulang yang diberikan secara oral pada hewan uji selama 28 hari atau 90 hari.
Secara tradisional pecut kuda digunakan untuk pengobatan infeksi dan batu saluran kencing, sakit tenggorokan karena radang (faring), batuk, rematik dan haid tidak teratur. Tujuan penelitian ini adalah mengetahui efek toksik dan mengetahui batas keamanan dosis ekstrak etanol pecut kuda.
Penelitian ini dilakukan secara in vivo menggunakan mencit jantan dan betina berjumlah 32 ekor, yang dibagi dalam 4 kelompok dosis. Dosis yang digunakan pada uji toksisitas subkronik ekstrak etanol pecut kuda ini adalah 200 mg/kg bb, 400 mg/kg bb, 800 mg/kg bb dan satu kelompok kontrol (CMCNa 0,5%), dan diberikan per oral setiap hari selama 28 hari. Pengamatan dilakukan setiap hari meliputi gejala toksik, berat badan, konsumsi makanan, kematian, pengukuran kadar ureum, kreatinin, SGPT (Serum Glutamic Pyruvic Transaminase), SGOT (Serum Glutamic Oxaloacetic Transaminase), makropatologi dan histopatologi organ hati, kemudian dianalisis statistik dengan ANOVA menggunakan Statistical Program Service Solution (SPSS).
Berdasarkan hasil pengamatan, tidak ditemukan gejala toksik pada kelompok dosis 200 mg/kg bb namun pada dosis 400 dan 800 mg/kg bb ditemukan gejala toksik. Berdasarkan uji statistik, tidak terdapat perbedaan signifikan pada berat badan dan konsumsi makanan antara kelompok kontrol dan perlakuan. Tidak terdapat kematian pada dosis 200 mg/kg bb, namun terdapat kematian pada dosis 400 dan 800 mg/kg bb sebanyak 12,5 % dan 25 %. Hasil rata-rata kadar SGPT pada dosis 200 mg/kg bb tidak menunjukkan perbedaan signifikan dengan kontrol, namun pada dosis 400 dan 800 mg/kg bb terdapat perbedaan yang signifikan (p < 0,05) yaitu 78,71 IU/L dan 80,83 IU/L. Hasil rata-rata kadar SGOT pada dosis 200 mg/kg bb tidak menunjukkan perbedaan signifikan dengan kontrol, pada dosis 400 mg/kg bb terdapat perbedaan yang signifikan (p < 0,05) yaitu 250,43 IU/L, sedangkan pada dosis 800 mg/kg bb terdapat perbedaan signifikan yaitu 312,83 I/L. Hasil rata-rata kadar ureum pada kelompok kontrol dan perlakuan, tidak terdapat perbedaan signifikan. Hasil rata -rata kadar kreatini pada kelompok kontrol dan perlakuan, tidak terdapat perbedaan signifikan. Hasil makropatologi dan histopatologi organ hati pada kelompok kontrol, EEPK dosis 200 mg/kg bb tidak dijumpai perubahan organ, sedang dosis 400 mg/kg bb dan dosis 800 mg/kg bb dijumpai perubahan organ.
Berdasarkan data kadar Serum Glutamic Pyruvic Transaminase dan Serum Glutamic Oxaloacetic Transaminase serta data gambaran histopatologi dan makroskopik hati mencit, pemberian ekstrak etanol pecut kuda dosis 200 mg/kg bb tidak menyebabkan efek toksik pada hati, sedangkan dosis 400 dan 800 mg/kg menunjukkan efek toksik pada hati.
SUBCHRONIC TOXICITY TEST ETHANOL EXTRACT HORSE WHIP (Stachytharpheta jamaicensis L.Vahl) IN MICE
ABSTRACT
Subkronik toxicity test is a test for the detection of toxic effects appear after administration of the test preparation with repeated doses were administered orally to test animals for 28 or 90 days.
Traditionally horse whip is used for the treatment of urinary tract infections and stones, because of strep sore throat (pharynx), cough, rheumatism and menstrual irregularity. The purpose of this study was to determine the toxic effects and determine the safety limit dose of ethanol extract horse whip.
This study was conducted in vivousing male and female mice are 32 tails, which were divided into 4 groups of dose. Doses used in toxicity tests subkronik ethanol extract of horse whip is 200 mg/kg bw, 400 mg/kg bw, 800 mg/kg bw and the control group (CMCNa 0.5%), and given orally every day for 28 days. Observations were made every day include toxic symptoms, body weight, food consumption, death, Serum Glutamic Pyruvic Transaminase and Serum Glutamic Oxaloacetic Transaminase serta levels of measurement, makropatologi and liver histopathology, then statistically analyzed by ANOVA using the Statistical Program Service Solution (SPSS).
Based on observations, found no toxic symptoms in the group a dose of 200 mg/kg bw but at doses of 400 and 800 mg/kg bw found toxic symptoms. Based on statistical test, there were no significant differences in body weight and food consumption between control and treatment groups. There were no deaths at doses of 200 mg/kg bw, but there is death at doses of 400 and 800 mg/kg bw as much as 12.5% and 25%. Average yield SGPT levels at a dose of 200 mg/kg bw did not show significant differences with the controls, but at doses of 400 and 800 mg/kg bw there are significant differences (p < 0.05) is 78.71 IU/L and 80 , 83 IU/L. Average yield SGOT at a dose of 200 mg/kg bw did not show significant differences with the controls, at a dose of 400 mg/kg bw there are significant differences (p < 0.05), ie 250.43 IU/L, whereas at doses of 800 mg/kg bw there are significant differences, namely 312.83 I/L. The average yield of the urea in the control and treatment groups, there were no significant differences. Average yield kreatini levels in the control group and the treatment, there were no significant differences. Results makropatologi and histopathology of liver in the control group, EEPK dose of 200 mg/kg bw not found changes in organs, moderate doses of 400 mg/kg bw and 800 mg/kg bw common organ changes.
Based Serum Glutamic Pyruvic Transaminase and Serum Glutamic Oxaloacetic Transaminase serta levels of data as well as data and macroscopic liver histopathology of mice, administration of ethanol extract of horse whip dose of 200 mg/kg bw did not cause toxic effects on the liver, whereas a dose of 400 and 800 mg/kg caused toxic effects on the liver.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Tumbuhan ... 6
2.1.1 Sistematika Tumbuhan ... 6
2.1.2 Nama Lokal ... 7
2.1.3 Nama Asing ... 7
2.1.5 Khasiat Tumbuhan ... 7
2.2 Metode Ekstraksi ... 7
2.3 Toksisitas ... 9
2.3.1 Uji Toksisitas Akut ... 10
2.3.2 Uji Toksisitas Subkronik ... 11
2.3.3 Uji Toksisitas Kronik ... 11
2.4 Hati ... 12
2.4.1 Anatomi Hati ... 12
2.4.2 Fisiologi Hati ... 14
2.4.3 Histologi Hati ... 14
2.4.4 Jenis kErusakan Hati ... 15
2.5 SGPT (Serum Glutamic Pyruvic Transaminase) ... 16
2.6 SGOT (Serum Glutamic Oxaloacetic Transaminase) ... 17
BAB III METODE PENELITIAN ... 18
3.1 Alat dan Bahan ... 18
3.1.1 Alat ... 18
3.1.2 Bahan ... 18
3.2 Hewan Penelitian ... 18
3.3 Pembuatan Suspensi CMCNa 0,5 % ... 19
3.4 Pembuatan Ekstrak Etanol Pecut Kuda ... 19
3.5 Pengamatan Toksisitas Subkronik ... 20
3.5.1 Berat Badan ... 21
3.5.2 Kematian Hewan ... 21
3.5.4 Makroskopik Organ Hati ... 22
3.5.5 Histopatologi Organ Hati ... 22
3.6 Analisis Data ... 23
BAB IV HASIL DAN PEMBAHASAN ... 24
4.1 Identifikasi Bahan Tumbuhan ... 24
4.2 Uji Toksisitas Subkronik Ekstrak Etanol Pecut Kuda (EEPK) .. 24
4.2.1 Hasil Pengamatan Gejala Toksik ... 24
4.2.2 Hasil Pengamatan Kematian ... 26
4.2.3 Hasil Pengamatan Konsumsi Makanan ... 26
4.2.4 Hasil Pengamatan Berat Badan Mencit ... 27
4.2.5 Hasil Pemeriksaan Kadar SGPT dan SGOT ... 28
4.2.6 Hasil Pengamatan Makroskopik Hati ... 32
4.2.7 Hasil Pengamatan Histopatologi Organ Hati ... 33
4.2.8 Hasil Pemeriksan Kadar Ureum dan Kreatinin ... 35
BAB V KESIMPULAN DAN SARAN ... 38
5.1 Kesimpulan ... 38
5.2 Saran ... 38
DAFTAR PUSTAKA ... 39
DAFTAR TABEL
Tabel Halaman
4.1 Hasil pengamatan gejala toksik terhadap perilaku fisik hewan ... 25
4.2 Hasil pengamatan kematian ... 26
4.3 Rata-rata konsumsi makanan hewan uji setelah diberi ekstrak etanol pecut kuda ... 27
4.4 Hasil rata-rata berat badan mencit setelah diberikan ekstrak etanol pecut kuda ... 28
4.5 Hasil pengukuran rata-rata kadar SGPT mencit setelah pemberian ekstrak etanol pecut kuda ... 28
4.6 Hasil pengukuran rata-rata kadar SGOT mencit setelah diberikan ekstrak etanol pecut kuda ... 30
4.7 Hasil pengamatan makroskopik organ hati ... 32
4.8 Hasil pengukuran rata-rata kadar Ureum mencit ... 36
DAFTAR GAMBAR
Gambar Halaman
1.1 Kerangka pikir penelitian ... 5
4.1 Grafik kadar SGPT mencit uji toksisitas subkronik ekstrak etanol
pecut kuda ... 29
4.2 Grafik kadar SGOT mencit uji toksisitas subkronik ekstrak etanol
pecut kuda ... 31
4.3 Makroskopik organ hati mencit setelah diberi CMC-Na 0,5 % dan
ekstrak etanol pecut kuda ... 33
4.4 Gambaran histopatologi hati mencit kelompok kontrol dan
kelompok perlakuan dosis 200,400 dan 800 mg/kg bb ... 34
4.5 Grafik kadar Ureum mencit uji toksisitas subkronik ekstrak etanol
pecut kuda ... 36
4.6 Grafik kadar Kreatinin mencit uji toksisitas subkronik ekstrak
DAFTAR LAMPIRAN
Lampiran Halaman
1. Hasil identifikasi tumbuhan ... 43
2. Komite etik penelitian hewan ... 44
3. Gambar tumbuhan pecut kuda ... 45
4. Bagan alurpenelitian uji toksisitas subkronik ... 46
5. Perhitungan volume pemberian ekstrak etanol pecut kuda dosis 200, 400 dan 800 mg/kg bb ... 47
6. Hasil uji pendahuluan ... 48
7. Hasil pengukuran kadar SGPT dan SGOT ... 50
8. Hasil rata-rata kadar SGPT dan SGOT ... 52
9. Gambar hewan percobaan ... 53
10. Hasil analisis spss berat badan ... 54
11. Hasil analisis spss berat makanan ... 58
12. Hasil analisis spss kadar SGPT ... 60
13. Hasil analisis spss kadar SGOT ... 63
14. Hasil analisis spss kadar Kreatinin ... 66
UJI TOKSISITAS SUBKRONIK EKSTRAK ETANOL PECUT KUDA (Stachytharpheta jamaicensis L.Vahl ) PADA MENCIT
ABSTRAK
Uji toksisitas subkronik merupakan suatu pengujian untuk mendeteksi efek toksik yang muncul setelah pemberian sediaan uji dengan dosis berulang yang diberikan secara oral pada hewan uji selama 28 hari atau 90 hari.
Secara tradisional pecut kuda digunakan untuk pengobatan infeksi dan batu saluran kencing, sakit tenggorokan karena radang (faring), batuk, rematik dan haid tidak teratur. Tujuan penelitian ini adalah mengetahui efek toksik dan mengetahui batas keamanan dosis ekstrak etanol pecut kuda.
Penelitian ini dilakukan secara in vivo menggunakan mencit jantan dan betina berjumlah 32 ekor, yang dibagi dalam 4 kelompok dosis. Dosis yang digunakan pada uji toksisitas subkronik ekstrak etanol pecut kuda ini adalah 200 mg/kg bb, 400 mg/kg bb, 800 mg/kg bb dan satu kelompok kontrol (CMCNa 0,5%), dan diberikan per oral setiap hari selama 28 hari. Pengamatan dilakukan setiap hari meliputi gejala toksik, berat badan, konsumsi makanan, kematian, pengukuran kadar ureum, kreatinin, SGPT (Serum Glutamic Pyruvic Transaminase), SGOT (Serum Glutamic Oxaloacetic Transaminase), makropatologi dan histopatologi organ hati, kemudian dianalisis statistik dengan ANOVA menggunakan Statistical Program Service Solution (SPSS).
Berdasarkan hasil pengamatan, tidak ditemukan gejala toksik pada kelompok dosis 200 mg/kg bb namun pada dosis 400 dan 800 mg/kg bb ditemukan gejala toksik. Berdasarkan uji statistik, tidak terdapat perbedaan signifikan pada berat badan dan konsumsi makanan antara kelompok kontrol dan perlakuan. Tidak terdapat kematian pada dosis 200 mg/kg bb, namun terdapat kematian pada dosis 400 dan 800 mg/kg bb sebanyak 12,5 % dan 25 %. Hasil rata-rata kadar SGPT pada dosis 200 mg/kg bb tidak menunjukkan perbedaan signifikan dengan kontrol, namun pada dosis 400 dan 800 mg/kg bb terdapat perbedaan yang signifikan (p < 0,05) yaitu 78,71 IU/L dan 80,83 IU/L. Hasil rata-rata kadar SGOT pada dosis 200 mg/kg bb tidak menunjukkan perbedaan signifikan dengan kontrol, pada dosis 400 mg/kg bb terdapat perbedaan yang signifikan (p < 0,05) yaitu 250,43 IU/L, sedangkan pada dosis 800 mg/kg bb terdapat perbedaan signifikan yaitu 312,83 I/L. Hasil rata-rata kadar ureum pada kelompok kontrol dan perlakuan, tidak terdapat perbedaan signifikan. Hasil rata -rata kadar kreatini pada kelompok kontrol dan perlakuan, tidak terdapat perbedaan signifikan. Hasil makropatologi dan histopatologi organ hati pada kelompok kontrol, EEPK dosis 200 mg/kg bb tidak dijumpai perubahan organ, sedang dosis 400 mg/kg bb dan dosis 800 mg/kg bb dijumpai perubahan organ.
Berdasarkan data kadar Serum Glutamic Pyruvic Transaminase dan Serum Glutamic Oxaloacetic Transaminase serta data gambaran histopatologi dan makroskopik hati mencit, pemberian ekstrak etanol pecut kuda dosis 200 mg/kg bb tidak menyebabkan efek toksik pada hati, sedangkan dosis 400 dan 800 mg/kg menunjukkan efek toksik pada hati.
SUBCHRONIC TOXICITY TEST ETHANOL EXTRACT HORSE WHIP (Stachytharpheta jamaicensis L.Vahl) IN MICE
ABSTRACT
Subkronik toxicity test is a test for the detection of toxic effects appear after administration of the test preparation with repeated doses were administered orally to test animals for 28 or 90 days.
Traditionally horse whip is used for the treatment of urinary tract infections and stones, because of strep sore throat (pharynx), cough, rheumatism and menstrual irregularity. The purpose of this study was to determine the toxic effects and determine the safety limit dose of ethanol extract horse whip.
This study was conducted in vivousing male and female mice are 32 tails, which were divided into 4 groups of dose. Doses used in toxicity tests subkronik ethanol extract of horse whip is 200 mg/kg bw, 400 mg/kg bw, 800 mg/kg bw and the control group (CMCNa 0.5%), and given orally every day for 28 days. Observations were made every day include toxic symptoms, body weight, food consumption, death, Serum Glutamic Pyruvic Transaminase and Serum Glutamic Oxaloacetic Transaminase serta levels of measurement, makropatologi and liver histopathology, then statistically analyzed by ANOVA using the Statistical Program Service Solution (SPSS).
Based on observations, found no toxic symptoms in the group a dose of 200 mg/kg bw but at doses of 400 and 800 mg/kg bw found toxic symptoms. Based on statistical test, there were no significant differences in body weight and food consumption between control and treatment groups. There were no deaths at doses of 200 mg/kg bw, but there is death at doses of 400 and 800 mg/kg bw as much as 12.5% and 25%. Average yield SGPT levels at a dose of 200 mg/kg bw did not show significant differences with the controls, but at doses of 400 and 800 mg/kg bw there are significant differences (p < 0.05) is 78.71 IU/L and 80 , 83 IU/L. Average yield SGOT at a dose of 200 mg/kg bw did not show significant differences with the controls, at a dose of 400 mg/kg bw there are significant differences (p < 0.05), ie 250.43 IU/L, whereas at doses of 800 mg/kg bw there are significant differences, namely 312.83 I/L. The average yield of the urea in the control and treatment groups, there were no significant differences. Average yield kreatini levels in the control group and the treatment, there were no significant differences. Results makropatologi and histopathology of liver in the control group, EEPK dose of 200 mg/kg bw not found changes in organs, moderate doses of 400 mg/kg bw and 800 mg/kg bw common organ changes.
Based Serum Glutamic Pyruvic Transaminase and Serum Glutamic Oxaloacetic Transaminase serta levels of data as well as data and macroscopic liver histopathology of mice, administration of ethanol extract of horse whip dose of 200 mg/kg bw did not cause toxic effects on the liver, whereas a dose of 400 and 800 mg/kg caused toxic effects on the liver.
BAB I PENDAHULUAN
1.1 Latar Belakang
Indonesia merupakan Negara yang mempunyai aneka ragam jenis
tanaman. Sejak zaman dahulu masyarakat Indonesia telah mengenal, meramu, dan
menggunakan tanaman yang berkhasiat sebagai salah satu upaya dalam
penanggulangan masalah kesehatannya. Berbagai upaya dalam meningkatkan
kesehatan masyarakat dilakukan oleh pemerintah maupun masyarakat.
Pengobatan menggunakan obat tradisional merupakan salah satu alternatif untuk
memenuhi kebutuhan dasar masyarakat dibidang kesehatan (Manggung, 2008).
Masyarakat selama ini beranggapan bahwa obat tradisional tidak bisa
menyebabkan keracunan tetapi karena mengandung zat kimia dan digunakan
dalam waktu yang panjang maka efek toksik bisa saja terjadi. Oleh karena itu
perlu terlebih dahulu dilakukan uji keamanan sebagai dasar untuk menjadikan
tanaman sebagai obat fitofarmaka (Arifin, dkk., 2006).
Obat tradisional agar dapat diterima oleh masyarakat maupun pelayanan
kesehatan, harus didukung secara ilmiah tentang khasiat dan keamanan
penggunaannya pada manusia. Tahapan pengembangan obat tradisional menjadi
fitofarmaka adalah sebagai berikut: seleksi, uji preklinik (uji toksisitas dan
farmakodinamika), pembuatan sediaan terstandar dan uji klinik (Dewoto, 2007).
Salah satu tanaman yang dapat digunakan sebagai bahan obat alami adalah
pecut kuda. Tanaman ini mengandung senyawa glikosida, alkaloid dan flavonoid.
kencing, sakit tenggorokan karena radang (faring), batuk, rematik dan haid tidak
teratur. Bunga dan tangkainya untuk pengobatan radang hati sedangkan akarnya
untuk pengobatan keputihan (Dalimartha, 2002). Penelitian sebelumnya telah
melaporkan bahwa senyawa dari tumbuhan pecut kuda memiliki aktivitas biologis
antara lain antifungi (Winarsih, 2005), antibakteri (Ningrum, 2003), antikanker
(Calista, 2013).
Tanaman ini belum populer digunakan sebagai tanaman obat bagi
masyarakat di Indonesia, bahkan pecut kuda lebih dikenal sebagai tumbuhan liar
yang sering dijumpai di ladang ladang yang tidak terawat. Dalam rangka mencari
sumber senyawa hayati baru sekaligus mencoba mengangkat tumbuhan yang
belum memiliki nilai ekonomi maka pecut kuda dipilih sebagai bahan penelitian
(Indrayani, 2006). Sampai saat ini penggunaan tanaman pecut kuda sebagai
tanaman berkhasiat obat masih berdasarkan pengalaman empiris. Dosis
penggunaan secara ilmiah belum dilakukan pengkajian secara pasti.
Pengembangan pecut kuda sebagai bahan sediaan obat alami harus didukung oleh
penelitian. Salah satu penelitian yang dilakukan adalah pengujian toksisitas.
Peneliti sebelumnya telah melakukan uji toksisitas akut dengan nilai LD50 sebesar
1000 mg/kg BB mencit, termasuk dalam kategori toksik ringan (Citra, 2014).
Toksisitas adalah kemampuan suatu zat kimia dalam menimbulkan
kerusakan pada organisme baik saat digunakan atau saat berada dalam
lingkungan. Secara umum toksisitas dibedakan menjadi toksisitas akut, sub kronik
dan kronik (Priyanto, 2009). Uji toksisitas subkronik merupakan suatu pengujian
dosis berulang yang diberikan secara oral pada hewan uji selama 28 atau 90 hari
(OECD, 2008).
Hati merupakan organ dalam tubuh yang terlibat dalam metabolisme zat
makanan serta sebagian besar obat dan toksikan (Lu, 1995). Hati sering menjadi
organ sasaran karena zat makanan, sebagian besar obat-obatan serta toksikan yang
memasuki tubuh, setelah diserap toksikan dibawa oleh vena porta ke hati. Oleh
sebab itu, hati menjadi organ yang sangat potensial menderita keracunan lebih
dahulu sebelum organ lain (Santoso dan Nurlaini, 2006). Pemeriksaan enzim
seringkali menjadi satu-satunya petunjuk adanya kerusakan pada sel hati.
Gangguan hati ditandai dengan peningkatan aktivitas serum transaminase berupa
SGPT (Serum Glutamic Piruvic Transaminase) (Widmann, 1995).
Berdasarkan uraian di atas peneliti tertarik untuk melakukan pengujian
toksisitas subkronik ekstrak etanol pecut kuda (Stachytarpheta jamaicensis (L.)
Vahl) pada mencit, mengingat pemanfaatannya yang beragam dan belum
ditemukan informasi mengenai batas keamanannya.
1.2 Perumusan Masalah
Berdasarkan uraian dalam latar belakang masalah di atas, dapat
dirumuskan permasalahan dalam penelitian adalah: apakah ekstrak etanol pecut
kuda (Stachytarpheta jamaicensis (L.) Vahl) berpengaruh terhadap gejala toksik
1.3Hipotesis
Berdasarkan perumusan di atas, maka hipotesis penelitian ini diduga
ekstrak etanol pecut kuda (Stachytarpheta jamaicensis (L.) Vahl) berpengaruh
terhadap gejala toksik mencit selama pemberian 28 hari.
1.4 Tujuan Penelitian
Adapun tujuan penelitian ini adalah: untuk mengetahui pengaruh ekstrak
etanol pecut kuda (Stachytarpheta jamaicensis (L.) Vahl) terhadap gejala toksik
mencit selama pemberian 28 hari.
1.5 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat dijadikan bahan informasi tentang
potensi toksisitas subkronik pada ekstrak etanol pecut kuda (Stachytarpheta
jamaicensis (L.) Vahl) sebagai salah satu tanaman yang akan digunakan secara
1.6 Kerangka Pikir penelitian
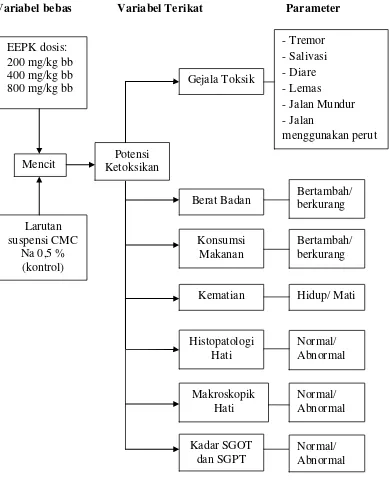
Adapun kerangka pikir penelitian ini dapat dilihat pada Gambar 1.1.
Variabel bebas Variabel Terikat Parameter
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Pecut kuda tumbuh liar di tepi jalan, tanah lapang dan tempat- tempat
terlantar lainnya. Tanaman yang berasal dari Amerika ini dapat ditemukan di
daerah cerah, sedang, terlindung dari sinar matahari dan pada ketinggian 1- 1500
m dpl. Pecut kuda merupakan terna tahunan, tumbuh tegak, tinggi ± 50 cm,
tumbuh liar disisi jalan daerah pinggir kota, tanah kosong yang tidak terawat.
Daun letak berhadapan, bentuk bulat telur, tepi bergerigi, tidak berambut. Bunga
duduk tanpa tangkai pada bulir - bulir yang berbentuk pecut, panjang 4 - 20 cm.
bunga mekar tidak berbarengan, kecil - kecil warna ungu, putih (Dalimartha,
2000).
2.1.1 Sistematika tumbuhan
Kedudukan kategori taksa untuk jenis pecut kuda di dalam sistematika
tumbuhan adalah sebagai berikut :
Divisi : Spermatophyta
Sub divisi : Angiospermae
Class : Dicotyledoneae
Ordo : Lamiales
Famili : Verbenaceae
Genus : Stachytarpheta
2.1.2 Nama lokal
Jawa : jarong (Sunda), biron, karomenal, sekar laru, ngadirenggo (jawa)
(Dalimartha, 2000).
2.1.3 Nama asing
Yu long Bian (Cina), Snakeweed (Inggris) (Dalimartha, 2000).
2.1.4 Kandungan kimia
Pecut kuda mengandung glikosida, flavonoid dan alkaloid (Dalimartha,
2000).
2.1.5 Khasiat tumbuhan
Herba pecut kuda (Stachytarpheta jamaicensis (L.) Vahl) digunakan
sebagai obat infeksi dan batu saluran kencing, rematik, sakit tenggorokan,
pembersih darah, haid tidak teratur, keputihan, hepatitis A. Bunga dan tangkainya
untuk pengobatan radang hati sedangkan akarnya untuk pengobatan keputihan
(Dalimartha, 2000).
2.2 Metode Ekstraksi
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat
aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai,
kemudian semua atau hampir semua pelarut diuapkan (Depkes, 2000). Ekstrak
adalah sediaan kering, kental atau cair dibuat dengan menyari simplisia nabati
atau hewani menurut cara yang cocok, diluar pengaruh cahaya matahari langsung
(BPOM, 2012).
Ekstraksi (dalam istilah farmasi) yaitu proses pemisahan bagian senyawa
aktif yang berkhasiat sebagai obat dari jaringan tanaman atau hewan dengan
ekstrak (Depkes, 1979). Zat aktif yang terdapat dalam simplisia dapat
digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid dan lain-lain
(Ditjen POM, 2000). Tujuan utama ekstraksi adalah untuk mendapatkan atau
memisahkan sebanyak mungkin zat-zat yang memiliki khasiat pengobatan
(Syamsuni, 2006).
Metode ekstraksi yang umum digunakan antara lain yaitu:
a. Maserasi
Maserasi adalah proses penyarian simplisia menggunakan pelarut dengan
beberapa kali pengocokan atau pengadukan pada temperatur ruangan, sedangkan
remaserasi merupakan pengulangan penambahan pelarut setelah dilakukan
penyaringan maserat pertama, dan seterusnya (Ditjen POM, 2000).
b. Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu
baru sampai sempurna yang umumnya dilakukan pada temperatur ruangan.
Serbuk simplisia yang akan diperkolasi tidak langsung dimasukkan kedalam
bejana perkolator, tetapi dibasahi atau dimaserasi terlebih dahulu dengan cairan
penyari sekurang-kurangnya selama 3 jam (Ditjen POM, 2000).
c. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan alat pada
temperatur titik didihnya dalam waktu tertentu dimana pelarut akan terkondensasi
menuju pendingin dan kembali ke labu (Ditjen POM, 2000).
d. Sokletasi
Sokletasi adalah proses penyarian dengan menggunakan pelarut yang
terkondensasi dari labu menuju pendingin, kemudian jatuh membasahi sampel
(Ditjen POM, 2000).
e. Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pada
temperatur lebih tinggi dari temperatur kamar, yaitu secara umum dilakukan pada
temperatur 40-50°C (Ditjen POM, 2000).
f. Infundasi
Infundasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90°C selama 15 menit (Ditjen POM, 2000).
g. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90°C selama 30 menit (Ditjen POM, 2000).
2.3 Toksisitas
Toksisitas adalah potensi bahan kimia untuk meracuni tubuh orang yang
terpapar. Toksisitas adalah kemampuan suatu zat asing dalam menimbulkan
kerusakan pada organisme baik saat digunakan atau saat berada dalam lingkungan
(Priyanto, 2009).
Uji toksisitas adalah suatu uji untuk mendeteksi efek toksik suatu senyawa
pada sistem biologi dan untuk memperoleh data dosis-respon dari sediaan uji.
Data yang diperoleh dapat digunakan untuk memberi informasi mengenai derajat
bahaya sediaan uji tersebut bila terjadi pemaparan pada manusia sehingga dapat
ditentukan dosis penggunaan dan keamanannya (OECD, 2001). Melakukan uji
toksisitas untuk memperoleh informasi yang dapat digunakan untuk mengevaluasi
Penelitian toksisitas konvensional pada hewan coba sering
mengungkapkan serangkaian efek akibat pajanan toksikan dalam berbagai dosis
untuk berbagai masa pajanan. Penelitian toksikologi biasanya dibagi menjadi tiga
kategori (Lu, 1995):
a. Uji toksisitas akut dilakukan dengan memberikan bahan kimia yang sedang
diuji sebanyak satu kali dalam jangka waktu 24 jam.
b. Uji toksisitas jangka pendek (dikenal dengan subkronik) dilakukan dengan
memberikan bahan kimia berulang-ulang, biasanya setiap hari, selama jangka
waktu kurang lebih tiga bulan untuk tikus dan satu atau dua tahun untuk
anjing.
c. Uji toksisitas jangka panjang dilakukan dengan memberikan bahan kimia
berulang-ulang selama masa hidup hewan coba atau sekurang-kurangnya
sebagian besar dari masa hidupnya, misalnya 18 bulan untuk mencit, 24 bulan
untuk tikus, dan 7-10 tahun untuk anjing dan monyet.
2.3.1 Uji toksisitas akut
Uji toksisitas akut adalah suatu pengujian untuk mendeteksi efek toksik
yang muncul dalam waktu singkat setelah pemberian sediaan uji secara oral dalam
dosis tunggal yang diberikan dalam waktu 24 jam sebanyak satu kali pemberian
(Lu, 1995). Tujuan dilakukannya uji toksisitas akut adalah untuk menentukan
LD50 (potensi ketoksikan) akut dari suatu senyawa (Priyanto, 2009). Semakin
kecil harga LD50 maka semakin besar potensi ketoksikannya (OECD, 2001).
Prinsip uji toksisitas akut oral yaitu, sediaan uji dalam beberapa tingkat
kelompok, kemudian dilakukan pengamatan terhadap adanya efek toksik dan
kematian (OECD, 2001).
2.3.2 Uji Toksisitas Subkronik
Uji toksisitas subkronik merupakan suatu pengujian untuk mendeteksi efek
toksik yang muncul setelah pemberian sediaan uji dengan dosis berulang yang
diberikan secara oral pada hewan uji (OECD, 2008).
Tujuan toksisitas subkronik oral adalah untuk memperoleh informasi
adanya efek toksik zat yang tidak terdeteksi pada uji toksisitas akut, informasi
kemungkinan adanya efek toksik setelah pemaparan sediaan uji secara berulang
dalam jangka waktu tertentu, informasi dosis yang tidak menimbulkan efek toksik
dan mempelajari adanya efek kumulatif dan efek reversibilitas zat tersebut
(OECD, 2008). Serta bertujuan untuk menentukan organ sasaran (organ yang
rentan) (Priyanto, 2009).
Prinsip uji toksisitas subkronik oral adalah sediaan uji dalam beberapa
tingkat dosis diberikan setiap hari pada beberapa kelompok hewan uji dengan satu
dosis per kelompok selama 28 atau 90 hari. Selama pemberian sediaan uji, hewan
harus diamati setiap hari untuk menentukan adanya toksisitas. Selama waktu dan
pada akhir periode pemberian sediaan uji, hewan yang mati dan masih hidup
diotopsi selanjutnya dilakukan pengamatan secara makropatologi pada setiap
organ dan jaringan. Selain itu juga dilakukan pemeriksaan hematologi, biokimia
klinis dan histopatologi (OECD, 2008).
2.3.3 Uji Toksisitas Kronik
Uji toksisitas kronis dilakukan dengan memberikan senyawa uji
2009). Prinsip toksisitas kronik oral pada umumnya sama dengan uji toksisitas
subkronik, hanya sediaan uji yang diberikan lebih lama tidak kurang dari 12
bulan. Pengamatan juga dilakukan secara lengkap seperti gejala toksik,
monitoring berat badan dan konsumsi makanan, pemeriksaan hematologi,
biokimia klinis, makropatologi, penimbangan organ dan histopatologi (OECD,
2008).
2.4 Hati
Salah satu organ yang sering menderita karena adanya zat-zat toksik adalah
hati. Bahan kimia kebanyakan mengalami metabolisme dalam hati dan oleh
karenanya banyak bahan kimia yang berpotensi merusak sel-sel hati. Bahan kimia
yang dapat mempengaruhi hati disebut hepatotoksik (Wisaksono, 2002).
2.4.1 Anatomi Hati
Hati merupakan organ tubuh terbesar kedua di dalam tubuh, dengan berat
rata-rata sekitar 1,5 kg. Organ ini terletak dalam rongga perut sebelah kanan di
bawah diafragma (Junqueira and Carneiro, 2007). Hati terbagi dalam dua belahan
utama kanan dan kiri yang dipisahkan oleh fisura longitudinal (Irianto, 2004).
Warnanya dalam keadaan segar merah kecoklatan, warna tersebut terutama
disebabkan oleh adanya darah yang amat banyak (Lee, et al., 1997).
Hati tersusun oleh beberapa tipe sel, yaitu:
a. Hepatosit
Sel-sel ini merupakan 70% dari di hati dan 90% dari berat hati total.
Hepatosit tersusun dalam unit-unit fungsional yang disebut asinus atau
lobulus. Setiap lobulus memiliki sebuah vena sentral (vena terminalis) dan
b. Sel duktus biliaris
Sel-sel duktus biliaris membentuk duktus dalam traktus portal lobulus hepar.
Duktus dari lobulus-lobulus yang berdekatan menyatu berjalan menuju hilus
hepar, dengan ukuran dan garis tengahnya secara bertahap membesar.
c. Sel Vaskular
Hati memiliki pendarahan ganda. Organ ini menerima darah melalui arteri
hepatika dan vena porta. Arteri hepatika dan vena porta masuk ke hepar di
porta hepatis lalu bercabang menjadi pembuluh yang lebih halus berjalan
sejajar sampai mencapai vena sentralis.
d. Sinusoid
Sinusoid hepar adalah saluran darah yang melebar dan berliku-liku, sinusoid
hepar dipisahkan dari hepatosit di bawahnya oleh spatium perisinusoideum
(disse) subendoteial. Akibatnya, zat makanan yang mengalir di dalam
sinusoid memiliki akses langsung melalui dinding endoteial yang tidak utuh
dengan hepatosit. Struktur dan jalur sinusoid yang berliku di hepar
memungkinkan pertukaran zat yang efisien antara hepatosit dan darah. Selain
endotel, sinusoid hepar juga mengandung makrofag, yang disebut sel
kuppffer (macrophagocytus stellatus), terletak di sepanjang sinusoid.
e. Kandung empedu
Kandung empedu adalah organ kecil berongga yang melekat pada permukaan
bawah hepar. Empedu diproduksi oleh hepatosit dan kemudian mengalir
melalui kanalikuli dan disimpan di dalam kandung empedu (Eroschenko,
2.4.2 Fisiologi Hati
Organ hati terlibat dalam metabolisme zat makanan serta sebagian besar
obat dan toksikan (Lu, 1994).
Fungsi hati adalah sebagai berikut (Setiadi, 2007):
1. Mengubah zat makanan yang diabsorpsi dan yang di simpan di suatu tempat
dalam tubuh, dikeluarkan sesuai dengan pemakaiannya dalam jaringan.
2. Mengubah zat buangan dan bahan racun untuk diekskresi dalam empedu dan
urin.
3. Menghasilkan enzim glikogenik glukosa menjadi glikogen.
4. Sekresi empedu, garam empedu di buat di hati, dibentuk dalam sistem
retikuloendotelium, dialirkan ke empedu.
5. Pembentukan ureum, hati menerima asam amino diubah menjadi ureum,
dikeluarkan dari darah oleh ginjal dalam bentuk urin.
6. Menyiapkan lemak untuk pemecahan terakhir asam karbonat dan air.
Semua darah yang didistribusikan ke saluran pencernaan kembali ke
jantung melalu sistem portal hati untuk menjalani beberapa proses. Dengan
demikian semua zat yang ada dalam darah akan melewati hati dan beberapa zat
dapat menyebabkan kerusakan (Priyanto, 2009).
2.4.3 Histologi Hati
Hati terdiri atas unit-unit heksagonal yaitu lobulus hati. Di bagian tengah
setiap lobulus hati terdapat sebuah vena sentralis yang dikelilingi secara radial
oleh sel-sel hati (hepatosit) (Junqueira dan Corneiro, 2007).
Hepatosit (sel parenkim hati) merupakan sebagian besar organ hati.
– sel ini terletak diantara sinusoid yang terisi darah dan saluran empedu. Sel
Kupffer melapisi sinusoid hati dan merupakan bagian penting dari sistem
retikuloendotelial tubuh (Lu, 1994).
Darah dipasok melalui vena porta dan arteri hati dan disalurkan melalui
vena sentral dan kemudian vena hati ke vena kava (Lu, 1994). Sebanyak 80% dari
aliran darahnya berasal dari vena porta yang mengangkut darah rendah oksigen.
Sisanya (20%) berasal dari arteri hepatika yang memasok darah kaya oksigen.
Darah meninggalkan hati melalui vena hepatika yang mengalir menuju vena kava
inferior (Underwood, 1994).
2.4.4 Jenis kerusakan hati
Toksikan dapat menyebabkan berbagai jenis efek toksik pada berbagai
organel dalam sel hati, mengakibatkan berbagai jenis kerusakan hati, seperti
berikut (Lu, 1994):
1. Perlemakan Hati (Steatosis)
Perlemakan hati adalah hati yang mengandung berat lipid lebih dari 5%.
2. Nekrosis Hati
Nekrosis hati adalah kematian hepatosit. Inti sel yang mati dapat terlihat lebih
kecil dan menjadi lebih padat (kariopiknosis), hancur bersegmen-segmen
(karioreksis) dan kemudian inti sel menghilang (kariolisis). Nekrosis dapat
bersifat fokal (sentral, pertengahan, perifer) atau masif.
3. Kolestatis
Jenis kerusakan hati ini bisanya bersifat akut dan jarang ditemukan
4. Sirosis
Sirosis ditandai oleh adanya septa kolagen yang tersebar di sebagian besar
hati.
5. Hepatitis yang Mirip Hepatitis Virus
Berbagai macam obat mengakibatkan suatu sindroma klinis yang tidak dapat
dibedakan dari hepatitis virus. Pada umumnya, obat itu mempunyai ciri-ciri
berikut:
a. Kerusakan hati semacam itu tidak dapat diperlihatkan pada hewan.
b. Tampaknya beberapa efek pada manusia tidak berkaitan dengan dosis.
c. Masa laten sangat beragam.
d. Toksisitas hanya muncul pada beberapa individu yang rentan.
e. Gambaran histologi lebih beragam.
f. Biasanya pasien memperlihatkan tanda-tanda hipersensivitas lain dan
kadang-kadang bereaksi terhadap suatu dosis tantangan.
g. Demam, ruam dan eosinofilia sering ditemukan.
6. Karsinogenesis
Karsinoma hepatoseluler dan kolangiokarsinoma adalah jenis neoplasma
ganas yang paling umum pada hati. Jenis karsinoma lainnya antara lain
angiosarkoma, karsinoma kelenjar, karsinoma trabekular dan karsinoma sel
hati yang tidak berdiferensiasi.
2.5 SGPT (Serum Glutamic Pyruvic Transaminase)
Tes fungsi hati yang umum untuk mengetahui adanya gangguan dalam
organ hati adalah SGPT (Serum Glutamic Pyruvic Transaminase) atau ALT
SGPT merupakan enzim transminase yang dibuat dalam sel hati
(hepatosit), jadi lebih spesifik untuk penyakit hati dibandingkan dengan enzim
lain. SGPT sering dijumpai dalam hati, sedangkan SGOT terdapat lebih banyak di
jantung, otot rangka, otak dan ginjal dibandingkan di hati (Sagita, dkk., 2012).
SGPT memberikan hasil yang lebih spesifik dari pada SGOT (Sherlock, 1981;
Bauer, 1982; Murray, et al., 1995). Kadarnya dalam serum meningkat terutama
pada kerusakan dalam hati dibandingkan dengan SGOT (Hadi, 1995).
Kerusakan pada sel hati yang sedang berlangsung dapat diketahui dengan
mengukur parameter fungsi hati berupa zat dalam peredaran darah yang dibentuk
oleh sel hati yang rusak atau mengalami nekrosis. Pemeriksaan enzim seringkali
menjadi satu-satunya petunjuk adanya penyakit hati yang dini atau setempat
(Widman, 1995).
Hepatosit apabila mengalami cedera enzim yang secara normal tersebut
berada di dalam sel yaitu sitoplasma akan masuk ke dalam aliran darah (Sacher
dan Richard, 2004). SGPT darah mencit normal adalah 17–77 IU/L (Research
Animal Resources, 2009).
2.6 SGOT (Serum Glutamic Oxaloacetic Transaminase)
SGOT (Serum Glutamic Oxaloacetic Transaminase) atau Aspartate
aminotransferase (AST) merupakan sebuah enzim yang biasanya terletak di
dalam sel-sel hati. SGOT dilepaskan ke dalam darah ketika hati atau jantung
rusak. Tingkat SGOT dalam darah signifikan dengan tingginya kerusakan hati
atau dengan kerusakan jantung (misalnya serangan jantung). Beberapa obat juga
dapat meningkatkan kadar SGOT. Enzim ini dalam jumlah yang kecil dijumpai
BAB III
METODE PENELITIAN
Penelitian ini menggunakan metode eksperimental dengan tahapan
penelitian yaitu pengujian efek toksisitas subkronik secara oral terhadap mencit
jantan dan betina, pengamatan meliputi gejala toksik, berat badan, konsumsi
makanan, kematian, pengukuran kadar ureum, kreatinin, SGPT dan SGOT,
kemudian dilakukan pemeriksaan secara makroskopik dan mikroskopik organ hati
mencit.
3.1 Alat dan Bahan 3.1.1 Alat – alat
Alat-alat yang digunakan pada penelitian ini adalah alat – alat gelas,
neraca listrik, aluminium foil, oral sonde, seperangkat alat bedah, neraca hewan,
spuit, mikroskop.
3.1.2 Bahan – bahan
Bahan-bahan yang digunakan adalah ekstrak etanol pecut kuda, akuades,
formalin 10%, natrium CMC, etanol 96 %, hematoksilin, eosin.
3.2 Hewan Penelitian
Hewan percobaan yang digunakan dalam penelitian adalah mencit jantan
dan betina sebanyak 32 ekor yang dibagi menjadi 4 kelompok. Sebelum
pengujian, mencit diaklimatisasi terlebih dahulu selama 7-14 hari. Hewan
penelitian telah diperoleh surat rekomendasi persetujuan etik penelitian kesehatan
dari Komite Etik Penelitian Hewan FMIPA USU (Lampiran 2, halaman 23).
3.3 Pembuatan Suspensi CMCNa 0,5 % b/v
Sebanyak 0,5 g CMC Na dimasukkan ke dalam lumpang yang berisi air
panas sebanyak 10 ml, dibiarkan selama 15 menit sehingga menggembang digerus
hingga diperoleh massa yang transparan, lalu diencerkan dengan akuades.
Kemudian dimasukan ke dalam wadah, cukupkan dengan akuades hingga 100 ml.
3.4 Pengelompokan Hewan Uji dan Pemberian Sediaan Uji
Hewan uji yang digunakan yaitu mencit (Mus musculus) yang sehat
sebanyak 32 ekor yang dibagi ke dalam 4 kelompok perlakuan, tiap kelompok
terdiri dari 8 ekor mencit, yaitu 4 ekor mencit jantan dan 4 ekor mencit betina.
elompok 1 sebagai kontrol, kelompok 2,3 dan 4 sebagai kelompok perlakuan.
Pembagian kelompok hewan uji sebagai berikut :
kelompok 1 : Kontrol, diberi larutan suspensi CMC-Na 0,5 % b/v
kelompok 2 : Perlakuan, diberikan EEPK dengan dosis 200 mg/kg bb
kelompok 3 : Perlakuan, diberikan EEPK dengan dosis 400 mg/kg bb
kelompok 4 : Perlakuan, diberikan EEPK dengan dosis 800 mg/kg bb
Sediaan uji diberikan secara oral menggunakan oral sonde setiap hari
3.5 Pengamatan Toksisitas Subkronik
Sediaan uji diberikan secara oral setiap hari selama 28 hari. Setelah
diberikan sediaan uji, 1 jam kemudian dilakukan pengamatan selama 2 jam.
Pengamatan yang terjadi berupa gejala-gejala toksik dan gejala klinis seperti
perilaku fisik (tremor, salivasi, diare, lemas, gerak-gerik hewan seperti berjalan
mundur dan menggunakan perut) (Rasyid, 2012).
Adapun cara pengamatannya, yaitu:
1. Salivasi
Pengeluaran salivasi mencit yang telah diberi ekstrak etanol pecut kuda
dibandingkan dengan kontrol, menggunakan kertas saring.
2. Diare
Pengeluaran tinja mencit yang telah diberi ekstrak etanol pecut kuda
dibandingkan dengan kontrol, menggunakan kertas saring.
3. Tremor
Hewan yang telah diberi ekstrak etanol pecut kuda, diamati tremor atau
tubuh hewan bergetar.
4. Lemas
Hewan yang telah diberi ekstrak etanol pecut kuda diamati aktivitasnya
secara umum.
5. Gerak-gerik hewan
Hewan yang telah diberi ekstrak etanol pecut kuda diamati gerak
3.5.1 Berat Badan
Mencit ditimbang setiap hari selama 28 hari untuk menentukan volume
sediaan uji yang akan diberikan. Sedangkan jumlah makanan yang dikonsumsi
ditimbang setiap seminggu sekali. Perubahan berat badan dianalisis seminggu
sekali. Pada akhir penelitian, hewan yang masih hidup diotopsi (BPOM RI.,
2011).
3.5.2 Kematian Hewan
Kematian mencit diamati dari hari pertama sampai hari ke 28 dan mencit
yang mati selama waktu pemberian sediaan uji segera diotopsi (BPOM RI., 2011).
3.5.3 Pengukuran kadar SGPT dan SGOT
Pada akhir periode pemberian sediaan uji semua mencit yang masih hidup
diotopsi. Hewan didislokasi lehernya kemudian darah diambil melalui jantung
(intra cardiac) secara perlahan-lahan menggunakan alat suntik steril sebanyak 1-3
ml. Sebanyak 1 ml darah dimasukkan ke dalam tabung mikrosentrifuge dan
didiamkan pada suhu kamar selama 10 menit, kemudian dipindahkan ke dalam
tangas es dan segera disentrifus selama 10 menit dengan kecepatan 3000 rpm
hingga dihasilkan serum yang bening. Serum dipisahkan, kemudian diperiksa
kadar SGPT dan SGOT dengan menggunakan alat sprektrofotometer.
Penetapan kadar SGPT dan SGOT dengan cara sejumlah 100 µl serum uji
direaksikan dengan 1000 µl pereaksi uji untuk pemeriksaan SGPT dan SGOT
dalam tabung reaksi 5 ml, dihomogenkan dengan bantuan vortex. Absorbansi
diukur dengan spektrofotometer pada suhu 37°C tepat setelah menit ke 1, 2, dan 3
(preaksi+akuades). Kadar SGPT dan SGOT dapat ditentukan dengan menghitung
rata-rata selisih absorbansi sampel permenit dikalikan faktor 1745.
3.5.4 Makroskopik Organ Hati
Mencit yang mati segera diotopsi dan dilakukan pengamatan terhadap
organ hati. Pengamatan meliputi warna, permukaan dan konsistensi organ hati
secara visual.
3.5.5 Histopatologi Organ Hati
Organ yang diperiksa secara histopatologi adalah hati. Organ yang sudah
dipisahkan segera dimasukkan dalam larutan dapar formalin 10% dan dibuat
preparat histopatologi dengan pewarnaan hematoksilin & eosin kemudian
diperiksa di bawah mikroskop.
Prosedur pembuatan preparat histopatologi:
a. Organ yang akan diperiksa direndam didalam larutan dapar formalin 10%
pada suhu kamar.
b. Organ dipotong, pemotongan dilakukan pada lobus terbesar hati.
c. Untuk menghilangkan sisa formalin dilakukan pencucian dengan air
mengalir.
d. Dilakukan proses dehidrasi dengan etanol 70%, 80%, 90%, etanol absolut.
Kemudian dilanjutkan dengan penjernihan menggunakan xilen sebanyak tiga
kali selama 1 jam.
e. Proses penanaman. Caranya: sampel direndam dengan parafin cair pada suhu
60 – 70o C selama 2 jam.
f. Dilakukan pencetakan dan dibiarkan membeku, kemudian blok parafin
µm. Setelah memperoleh potongan yang bagus, potongan tersebut
ditempelkan pada kaca obyek. Sayatan organ yang telah menempel pada kaca
obyek segera diletakkan pada permukaan pemanas dengan suhu 56 - 58° C
selama kurang lebih 10 detik, sehingga organ meregang dan menempel pada
kaca obyek sambil diatur jangan sampai organ berkerut atau melipat.
Selanjutnya preparat disimpan dalam suhu kamar untuk dilakukan
pewarnaan.
g. Pewarnaan dilakukan dengan menggunakan hematoksilin-eosin. Pertama
sediaan direndam dengan larutan xilen untuk proses deparafinasi
masing-masing selama 12 menit. Kemudian dilakukan proses dehidrasi dengan
merendam preparat dalam etanol 70%, 80%, 90%, etanol absolut selama 5
menit, dicuci dengan air mengalir. Selanjutnya direndam dengan larutan
hematoksilin selama 5 menit, dicuci dengan air mengalir, dilakukan
pewarnaan dengan eosin. Kemudian, dicelupkan ke dalam etanol 70%, 80%,
90%, dan etanol absolut masing-masing selama 10 menit. Terakhir
dimasukkan kedalam xilen selama 12 menit. Preparat diamati dibawah
mikroskop.
3.6 Analisis Data
Data jumlah hewan uji yang mati dianalisa secara statistik menggunakan
SPSS dengan metode One Way Analysis of Variance (ANOVA) dilanjutkan
dengan uji post hoc Tukey untuk mengetahui perbedaan signifikan berat badan,
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Bahan Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Lembaga Ilmu Pengetahuan
Indonesia (LIPI) Pusat Penelitian dan Pengembangan Biologi Bogor menyebutkan
bahwa tumbuhan yang digunakan adalah tumbuhan pecut kuda (Stachytarpheta
jamaicensis (L.) Vahl) (Lampiran 1, halaman 23). Ekstrak etanol pecut kuda
diperoleh dari penguji sebelumnya yang telah melakukan uji toksisitas akut (Citra,
2014).
4.2 Uji Toksisitas Subkronik Ekstrak Etanol Pecut Kuda (EEPK)
Pengamatan terhadap uji toksisitas subkronik EEPK dilakukan setiap hari
selama 28 hari meliputi perilaku fisik, jumlah kematian hewan, jumlah makanan,
berat badan, kadar ureum, kreatinin, SGPT, SGOT, makropatologi dan gambaran
histopatologi organ hati.
4.2.1 Hasil pengamatan gejala toksik
Hasil pengamatan terhadap perilaku fisik hewan uji dapat dilihat pada
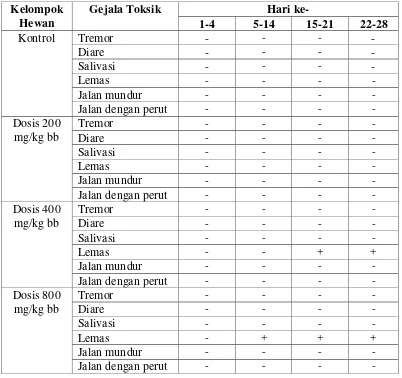
Tabel 4.1 Hasil pengamatan gejala toksik terhadap perilaku fisik hewan Kelompok
Hewan
Gejala Toksik Hari ke-
1-4 5-14 15-21 22-28
Berdasarkan tabel di atas diketahui bahwa pada pemberian ekstrak etanol
pecut kuda pada dosis 200, 400 dan dosis 800 mg/kg BB tidak menunjukkan
gejala toksik pada pengamatan tremor, diare, salivasi, lemas, jalan mundur dan
jalan dengan perut. Namun pada dosis 400 dan 800 mg/kg BB ditemukan gejala
toksik pada perilaku fisik hewan berupa penurunan aktivitas gerak hewan ditandai
dengan lemas. Hal tersebut menunjukkan adanya hubungan antara dosis dan efek
toksik, dimana makin besar dosis yang diberikan makin besar efek toksik yang
dengan dosis yang diberikan yaitu efek samping, efek merugikan dan efek toksik
(Priyanto, 2009).
4.2.2 Hasil pengamatan kematian
Hasil pengamatan kematian hewan selama waktu pemberian sediaan uji
dapat dilihat pada Tabel 4.2.
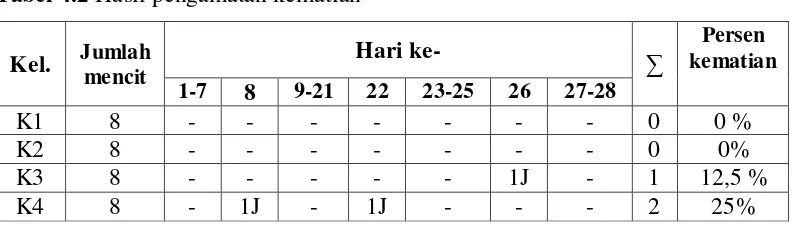
Tabel 4.2 Hasil pengamatan kematian
Kel. Jumlah
Berdasarkan tabel di atas menunjukkan bahwa pemberian EEPK pada
kelompok dosis 200 mg/kg bb tidak terdapat mencit yang mati, dosis 400 mg/kg
bb terdapat 1 ekor mencit yang mati pada hari ke 26 dengan persen kematian
12,5% dan pada dosis 800 mg/kg bb terdapat 2 ekor mencit yang mati pada hari
ke 8 dan 22 dengan persen kematian 25%. Hal tersebut dikarenakan besarnya
dosis EEPK yang menyebabkan kematian pada mencit. Efek toksik bertambah
dengan naiknya dosis (Koeman, 1987).
4.2.3 Hasil pengamatan konsumsi makanan
Hasil pengamatan konsumsi makanan yang diberikan pada hewan uji
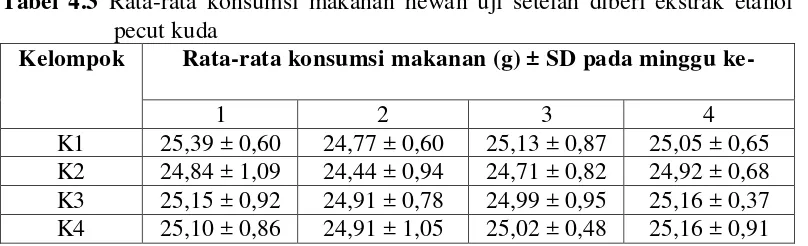
Tabel 4.3 Rata-rata konsumsi makanan hewan uji setelah diberi ekstrak etanol pecut kuda
Kelompok Rata-rata konsumsi makanan (g) ± SD pada minggu ke-
1 2 3 4
K1 25,39 ± 0,60 24,77 ± 0,60 25,13 ± 0,87 25,05 ± 0,65 K2 24,84 ± 1,09 24,44 ± 0,94 24,71 ± 0,82 24,92 ± 0,68 K3 25,15 ± 0,92 24,91 ± 0,78 24,99 ± 0,95 25,16 ± 0,37 K4 25,10 ± 0,86 24,91 ± 1,05 25,02 ± 0,48 25,16 ± 0,91
Keterangan: K1 = normal; K2 = dosis 200 mg/kg BB; K3 = dosis 400 mg/kg BB; K4 = dosis 800 mg/kg BB
Berdasarkan hasil statistik jumlah konsumsi makanan pada Tabel 4.3
terlihat bahwa tidak terdapat perbedaan yang signifikan antar kelompok normal
dan kelompok perlakuan dimana p > 0,05. Hal ini berarti bahwa pemberian
ekstrak etanol pecut kuda tidak memberikan pengaruh yang signifikan terhadap
konsumsi makanan mencit.
4.2.4 Hasil pengamatan berat badan mencit
Untuk mengetahui efek toksik dari suatu zat, ada beberapa parameter yang
merupakan indikator, yaitu perilaku fisik, berat badan, konsumsi makanan dan
minuman (Gupta et al, 2012). Hasil pengamatan berat badan mencit setelah
Tabel 4.4 Hasil rata-rata berat badan mencit setelah diberikan ekstrak etanol pecut kuda
Kelompok Rata-rata berat badan (g) ± SD pada hari ke-
1 7 14 21 28
Berdasarkan hasil statistik berat badan mencit setelah diberikan ekstrak
etanol pecut kuda yang ditunjukkan pada Tabel 4.4 tidak terdapat perbedaan yang
signifikan antara kelompok kontrol dan kelompok perlakuan dimana p > 0,05. Hal
ini berarti tidak ada pengaruh ekstrak etanol pecut kuda dengan berat badan
mencit.
4.2.5 Hasil pemeriksaan kadar SGPT dan SGOT
Kelainan hati dapat diketahui dengan pemeriksaan kadar enzim, salah
satunya adalah dengan mengukur kadar enzim transminase yaitu Serum Glutamat
Piruvat Transminase (SGPT). Hasil analisa kimia darah mencit untuk pengujian
kandungan SGPT dilakukan pada akhir perlakuan yaitu hari ke-29,dapat dilihat
pada Tabel 4.5.
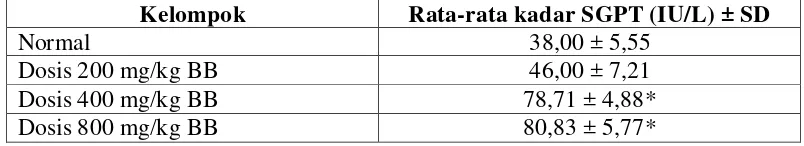
Tabel 4.5 Hasil pengukuran rata-rata kadar SGPT mencit setelah diberikan ekstrak etanol pecut kuda
Kelompok Rata-rata kadar SGPT (IU/L) ± SD
Normal 38,00 ± 5,55
Dosis 200 mg/kg BB 46,00 ± 7,21
Dosis 400 mg/kg BB 78,71 ± 4,88*
Gambar 4.1 Grafik kadar SGPT mencit uji toksisitas subkronik ekstrak etanol pecut kuda
*= berbeda signifikan dengan kontrol
Berdasarkan hasil pengukuran kadar SGPT mencit pada Tabel 4.5 terdapat
perbedaan yang signifikan antara kelompok kontrol dengan dosis 400 mg/kg bb
dan dosis 800 mg/kg bb. Pada kelompok kontrol rata-rata kadar SGPT (38,00
IU/L), dosis 200 mg/kg bb (46,00 IU/L), terlihat hasil rata-rata kadar SGPT masih
dalam batas normal. Pada dosis 400 mg/kg bb rata-rata kadar SGPT (78,71 IU/L)
dan dosis 800 mg/kg bb (80,83 IU/L), rata-rata kadar SGPT kelompok tersebut di
atas batas normal. Kadar SGPT darah mencit normal adalah 17-77 IU/L (Research
Animal Resources, 2009).
Tes fungsi hati yang umum untuk mengetahui adanya gangguan organ hati
adalah besarnya kandungan SGPT (Serum Glutamic Pyruvic Transaminase)
(Wibowo, dkk., 2005). SGPT merupakan enzim transminase yang dibuat dalam
sel hati (hepatosit), jadi lebih spesifik untuk penyakit hati dibandingkan dengan
enzim lain. SGPT sering dijumpai dalam hati, sedangkan SGOT terdapat lebih
kontrol 200 mg/kg BB 400 mg/kg BB 800 mg/kg BB
banyak di jantung, otot rangka, otak dan ginjal dibandingkan di hati (Sagita, dkk.,
2012). SGPT memberikan hasil yang lebih spesifik dari pada SGOT (Sherlock,
1981; Bauer, 1982; Murray, et al., 1995). Kadarnya dalam serum meningkat
terutama pada kerusakan dalam hati dibandingkan dengan SGOT (Hadi, 1995).
Apabila terjadi kerusakan pada membran sel hepatosit, permeabilitas sel
hepar akan meningkat kemudian enzim yang secara normal berada di dalam sel
yaitu sitoplasma, akan keluar ke sirkulasi darah (Sacher dan Richard, 2004).
Hasil analisa kimia darah mencit untuk pengujian kandungan SGOT
dilakukan pada akhir perlakuan, hari ke-29 untuk kelompok uji disajikan pada
Tabel 4.6.
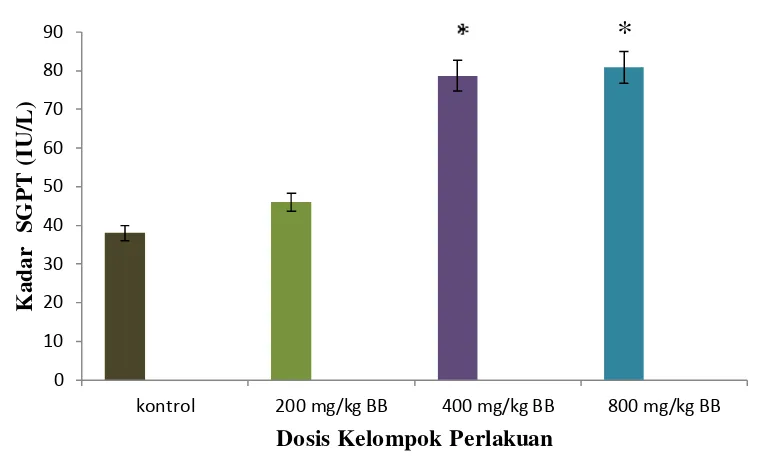
Tabel 4.6 Hasil pengukuran rata-rata kadar SGOT mencit setelah diberikan ekstrak etanol pecut kuda
Kelompok Rata-rata kadar SGOT (IU/L) ± SD
Normal 84,75 ± 14,22
Dosis 200 mg/kg BB 116,12 ± 68,02
Dosis 400 mg/kg BB 250,43 ± 36,63*
Dosis 800 mg/kg BB 312,83 ± 67,24*
Gambar 4.2 Grafik kadar SGOT mencit uji toksisitas subkronik ekstrak etanol pecut kuda
*= berbeda signifikan dengan kontrol
Berdasarkan hasil pengukuran kadar SGOT mencit pada Tabel 4.6 terdapat
perbedaan yang signifikan antara kelompok kontrol dengan dosis 400 mg/kg bb
dan dosis 800 mg/kg bb. Pada kelompok kontrol rata-rata kadar SGOT (84,75
IU/L), dosis 200 mg/kg bb (116,12 IU/L) dan dosis 400 mg/kg bb (250,43 IU/L),
terlihat hasil rata-rata kadar SGOT masih dalam batas normal. Pada kelompok
perlakuan rata-rata kadar SGOT dosis 800 mg/kg bb (312,83), rata-rata kadar
SGOT kelompok tersebut berada di atas batas normal. Kadar SGOT normal
54-298 IU/L (Research Animal Resources, 2009).
SGOT (Serum Glutamic Oxaloacetic Transaminase) atau Aspartate
aminotransferase (AST) merupakan sebuah enzim yang biasanya terletak di
dalam sel-sel hati. SGOT dilepaskan ke dalam darah ketika hati atau jantung
rusak. Tingkat SGOT dalam darah signifikan dengan tingginya kerusakan hati
atau dengan kerusakan jantung (misalnya serangan jantung). Beberapa obat juga 0
Kontrol 200 mg/kg bb 400 mg/kg bb Dosis 800 mg/kg
dapat meningkatkan kadar SGOT. Enzim ini dalam jumlah yang kecil dijumpai
pada otot jantung, ginjal dan otot rangka (Krysanti, 2014).
Kerusakan pada sel hati yang sedang berlangsung dapat diketahui dengan
mengukur parameter fungsi hati berupa zat dalam peredaran darah yang dibentuk
oleh sel hati yang rusak atau mengalami nekrosis. Pemeriksaan enzim seringkali
menjadi satu-satunya petunjuk adanya penyakit hati yang dini atau setempat
(Widman, 1995).
4.2.6 Hasil pengamatan makroskopik hati
Sebelum dilakukan pemeriksaan histopatologi, organ hati terlebih dahulu
diamati makroskopiknya. Hasil pengamatan makroskopik organ hati setelah
diberikan ekstrak etanol pecut kuda ditunjukkan pada Tabel 4.7.
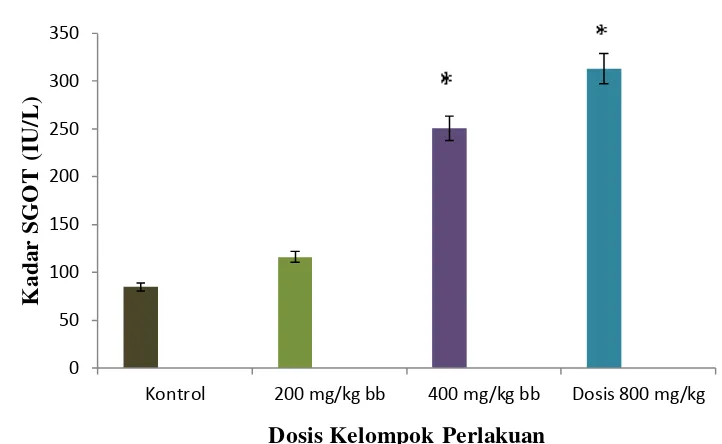
Tabel 4.7 Hasil pengamatan makroskopik organ hati
Kelompok Pengamatan
Warna konsistensi Permukaan
Normal Merah kecoklatan Kenyal Licin
Dosis 200 mg/kg BB Merah kecoklatan Kenyal Licin Dosis 400 mg/kg BB Merah kehitaman Kenyal Licin Dosis 800 mg/kg BB Pucat Tidak kenyal Licin
Pada Tabel 4.7 terlihat pada kelompok kontrol dan dosis 200 mg/kg bb
organ hati masih dalam keadaan normal yang berwarna merah kecoklatan,
permukaannya licin dan konsistensinya kenyal. Kriteria normal pada organ hati
bila tidak ditemukan perubahan warna, perubahan struktur permukaan dan
perubahan konsistensi (Anggraini, 2008). Pada dosis 400 mg/kg bb dan 800
mg/kg bb sudah terjadi perubahan warna pada organ hati yaitu merah kehitaman
(400 mg/kg bb) dan warna pucat, tidak kenyal (800 mg/kg bb).
Perubahan warna menjadi salah satu parameter terjadinya efek toksik yang
dengan organ sasaran dan efek terhadap organ tersebut (Lu, 1995). Hasil
pengamatan makroskopik organ hati dapat dilihat pada Gambar 4.3.
a. Kontrol b. Dosis 200 mg/kg bb
c. Dosis 400 mg/kg bb d. Dosis 800 mg/kg bb
Gambar 4.3 Makroskopik organ hati mencit yang diberi CMC-Na 0,5% dan ekstrak etanol pecut kuda
4.2.7 Hasil pengamatan histopatologi organ hati
Organ hati pada mencit yang mati segera diambil pada akhir periode
pemberian sediaan uji, semua mencit yang masih hidup diotopsi. Organ hati
diambil kemudian dibuat menjadi preparat histopatologi selanjutnya dilihat
kerusakan jaringan di bawah mikroskop.
Hati terlibat dalam metabolisme zat makanan serta sebagian besar obat dan
toksikan (Ariens, dkk., 1986). Zat makanan, sebagian besar obat-obatan serta
dibawa oleh vena porta ke hati. Oleh sebab itu, hati menjadi organ yang sangat
potensial menderita keracunan lebih dahulu sebelum organ lain (Santoso dan
Nurlaili, 2006). Terjadinya kerusakan pada hati dapat menjadi petunjuk apakah
suatu zat yang diberikan bersifat toksik atau tidak (Elya, dkk., 2010). Hasil
kerusakan dapat dilihat pada Gambar 4.4.
a. Kontrol b. Dosis 200 mg/kg bb
c. Dosis 400 mg/kg bb d. Dosis 800 mg/kg bb
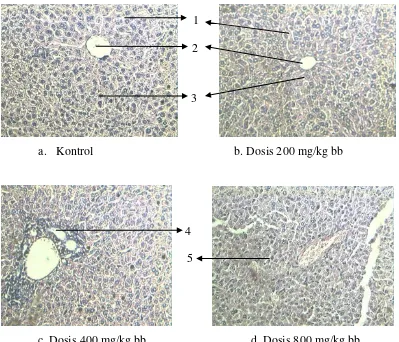
Gambar 4.4 Hasil gambaran histopatologi hati mencit kelompok kontrol dan kelompok pelakuan dosis 200, 400 dan 800 mg/kg bb (perbesaran 10x10), (1) = sinusoid, (2) = vena sentral, (3) = hepatosit, (4) = pelebaran vena sentral, (5) = sel nekrosis
Berdasarkan gambar di atas, terlihat bahwa kelompok kontrol dan
kelompok perlakuan yang diberi ekstrak etanol dosis 200 mg/kg bb tidak
mengalami kerusakan hati, sedangkan pada dosis 400 mg/kg BB terjadi pelebaran 1
2
3
4
pada vena sentral disebabkan karena rusaknya sel endotel yang peka terhadap zat
toksik, hal ini merupakan awal dari kerusakan hati yang dapat mengakibatkan sel
hati mengalami degenerasi hingga nekrosis (Rusmiati, 2004).
Pada gambar di atas dapat dilihat pada dosis 800 mg/kg BB terjadi
kerusakan pada hati berupa nekrosis. Nekrosis hati adalah kematian hepatosit. Inti
sel yang mati terlihat lebih kecil dan lebih padat (Kasno, 2003). Nekrosis
merupakan suatu manifestasi toksik yang berbahaya tetapi tidak selalu kritis
karena hati mempunyai kapasitas pertumbuhan kembali yang luar biasa (Lu,
1994).
Kerusakan sel secara terus-menerus akan mencapai suatu titik sehingga
terjadi kematian sel (Lu, 1995). Paparan zat toksik pada sel apabila cukup hebat
atau berlangsung cukup lama, maka sel tidak dapat lagi mengkompensasi dan
tidak dapat melanjutkan metabolisme (Juhryyah, 2008). Inti sel yang mati dapat
terlihat lebih kecil dan menjadi lebih padat (kariopiknosis), hancur
bersegmen-segmen (karioreksis) dan kemudian inti sel menghilang (kariolisis) (Underwood,
1994). Kerusakan pada hati dapat terjadi oleh beberapa faktor yaitu onset
pemaparan yang terlalu lama, durasi pemaparan, dosis dan sel inang yang rentan
(Jubb, dkk., 1993).
4.2.8 Hasil Pemeriksaan Kadar Ureum dan Kreatinin
Untuk mengetahui fungsi ginjal, biasanya dinilai dari kadar kreatinin dan
ureum. Hasil analisa kimia darah mencit untuk pengujian kadar ureum dilakukan
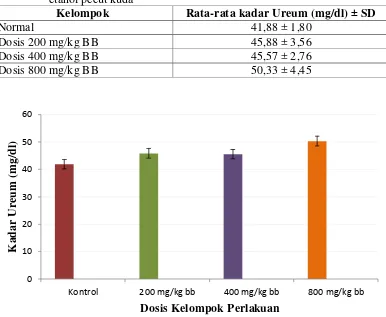
Tabel 4.8 Hasil pemeriksaan kadar ureum mencit setelah diberikan ekstrak etanol pecut kuda
Kelompok Rata-rata kadar Ureum (mg/dl) ± SD
Normal 41,88 ± 1,80
Dosis 200 mg/kg BB 45,88 ± 3,56
Dosis 400 mg/kg BB 45,57 ± 2,76
Dosis 800 mg/kg BB 50,33 ± 4,45
Gambar 4.5 Grafik kadar Ureum mencit uji toksisitas subkronik ekstrak etanol pecut kuda
Berdasarkan hasil pengukuran kadar ureum mencit pada Tabel 4.8 tidak
terdapat perbedaan yang signifikan antar kelompok. Pada dasarnya ureum
merupakan hasil metabolisme protein yang dibuat oleh hati. Hati berfungsi
menetralkan racun dengan mengeluarkan suatu senyawa asam amino ornitin yang
akan bergabung dengan senyawa lain untuk membentuk ureum. Setelah ureum
terbentuk, ureum berdifusi dari sel hati masuk ke dalam cairan tubuh dan
disekresikan oleh ginjal (Guyton, 1997). 0
Kontrol 200 mg/kg bb 400 mg/kg bb 800 mg/kg bb