Lampiran 2. Gambar Sampel
Gambar 1. sirsak biasa Gambar 2. sirsak ratu
Lampiran 3. Gambar Uji Kualitatif Sampel
Gambar 4. sampel + ammonium molibdat
Lampiran 4. Bagan Alir Proses Persiapan Sampel
Ditimbang ± 1/2 kg
Dibersihkan dari kotoran dengan menggunakan air mengalir Dipotong buah menjadi 2 bagian, diambil daging buah dan dipisahkan dari bijinya
Dihaluskan menggunakan blender Buah sirsak
Lampiran 5. Bagan Alir Proses Destruksi Basah
Ditimbang sebanyak ± 5 g, dimasukan kedalam erlenmeyer 250 ml
Ditambahkan 5 ml asam nitrat 65% b/v Didiamkan selama 24 jam
Dipanaskan diatas hotplate
Ditambahkan asam nitrat 65% b/v secara perlahan-lahan sebanyak 15 ml, dipanaskan sampai larutan menjadi bening.
Buah sirsak
Lampiran 6. Perhitungan Konsentrasi Larutan Induk Baku KH2PO4
BM KH2PO4 = 136,09
BM P = 30,9738
BM P x Berat KH2PO4
Berat P dalam 0,1118 gram KH2PO4 =
BM KH2PO4
30,9738 x 0,1118 g
=
136,09
= 0,0254 g = 25,4 mg
25,4 mg
Kadar fosfor dalam Larutan KH2PO4 =
100 ml 25,4 x 1000 µg =
100 ml
Lampiran 7. Data Penentuan Kerja pada Panjang Gelombang 717 nm
Keterangan:
Serapan kompleks stabil pada menit ke-80 sampai menit ke-83
No Menit
ke- Absorbansi
1. 31 0,389
2. 32 0,389
3. 33 0,391
4. 34 0,392
5. 35 0,393
6. 36 0,394
7. 37 0,395
8. 38 0,396
9. 39 0,397
10. 40 0,398
11. 41 0,400
12. 42 0,401
13. 43 0,402
14. 44 0,403
15. 45 0,404
16. 46 0,405
17. 47 0,406
18. 48 0,406
19. 49 0,407
20. 50 0,408
21. 51 0,409
22. 52 0,410
23. 53 0,410
24. 54 0,411
25. 55 0,412
26. 56 0,413
27. 57 0,413
28, 58 0,414
29. 59 0,415
30. 60 0,415
31. 61 0,416
32. 62 0,417
32. 63 0,417
33. 64 0,418
34. 65 0,419
35. 66 0,420
36. 67 0,420
No Menit
ke- Absorbansi
37. 68 0,421
38. 69 0,421
39. 70 0,423
40. 71 0,423
41. 72 0,424
42. 73 0,424
43. 74 0,425
44. 75 0,425
45. 76 0,426
46 77 0,426
47. 78 0,426
48. 79 0,427
49. 80 0,428
50. 81 0,428
51. 82 0,428
52, 83 0,428
53 84 0,429
54. 85 0,439
55. 86 0,430
56. 87 0,430
57. 88 0,431
58. 89 0,431
59. 90 0,432
Lampiran 8. Data Kalibrasi Fosfor dengan Menggunakan Spektrofotometer Sinar Tampak, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r)
No. Konsentrasi µg/ml (X)
Absorbansi (Y)
1. 0 0
2. 0,381 0,208
3. 0,572 0,346
4. 0,762 0,481
5. 0,953 0,532
6. 1,079 0,639
a = X
(
X)
n n Y X XY / / 2 2∑
∑
∑
∑ ∑
− − =(
)
(
3,747)
/6 1262 , 3 6 / ) 206 , 2 ( 747 , 3 8399 , 1 2 − − = 0,5813Y = a X+ b b = Y− aX
= 0,3676 – (0,5813)(0,6245) = 0,0046
No. Konsentrasi µg/ml (X)
Absorbansi
(Y) XY X
2
Y2
1 0 0 0 0 0
2 0,381 0,208 0,0792 0,1451 0,0432
3 0,572 0,346 0,1979 0,3371 0,1157
4 0,762 0,481 0,3665 0,5806 0,2313
5 0,953 0,532 0,5069 0,9082 0,2820
6 1,079 0,639 0,6894 1,1642 0,4083
∑X = 3,747 ∑Y = 2,206
∑XY =
1,8399 ∑X2 = 3,1352 ∑Y2 = 1,0805 X = 0,6245 Y = 0,3676
XY =
Lampiran 8. (Lanjutan) Persamaan Regresi Y = ax + b
Y = 0,5813 x + 0,0046
=
(
)
(
)
{
3,1352 3,747 /6}
{
1,0805(
2,206)
/6}
6/ 206 , 2 ) 747 , 3 ( 8399 , 1
2
2 −
−
−
=
4629 , 0
4623 , 0
Lampiran 9. Hasil Analisis Fosfor pada Sampel 1. Buah Sirsak Biasa (Annona muricata L.)
No Berat Sampel
(g) Serapan
Konsentrasi (µg/ml)
Kadar mg/100g
1 5,174 0,436 0,7421 7,1714
2 5,163 0,434 0,7386 7,1528
3 5,158 0,434 0,7386 7,1597
4 5,143 0,430 0,7318 7,1145
5 5,160 0,432 0,7352 7,1240
6 5,137 0,429 0,7300 7,1053
Contoh perhitungan Kadar Fosfor pada Buah Sirsak Biasa (Annona muricata L.) Berat sampel yang ditimbang = 5,174 g
Serapan = 0,436
Persaman regresi Y = 0,5813
x
+ 0,0046Konsentrasi sampel X =
5813 , 0 0046 , 0 − y
X =
5813 , 0 0046 , 0 436 , 0 −
= 0,7421 µg/ml
(g) Sampel Berat n pengencera Faktor x (ml) Volume x (µg/ml) i Konsentras
Kadar =
Keterangan: C = Konsentrasi Larutan Sampel (µg/ml) Fp = Faktor Pengenceran
W = Berat Sampel (g) Kadar fosfor dalam sampel =
g 174 , 5 10 x ml 50 µg/ml 0,7421 x
= 71,7143 µg/g
Lampiran 9. (Lanjutan)
2. Buah Sirsak Ratu (Annona muricata L.)
No Berat Sampel (g) Serapan Konsentrasi
(µg/ml) Kadar mg/100g
1 5,184 0,419 0,7128 6,8750
2 5,179 0,417 0,7094 6,8488
3 5,182 0,419 0,7128 6,8776
4 5,148 0,416 0,7077 6,8735
5 5,131 0,415 0,7060 6,8797
6 5,124 0,413 0,7052 6,8813
Contoh perhitungan Kadar Fosfor pada Buah Sirsak ratu (Annona muricata L.) Berat sampel yang ditimbang = 5,184 g
Serapan = 0,2417
Persamaan regresi Y = 0,5813x + 0,0046 Konsentrasi sampel X =
5813 , 0 0046 , 0 − y
X =
5813 , 0 0046 , 0 419 , 0 −
= 0,7128 µg/ml
(g) Sampel Berat n pengencera Faktor x (ml) Volume x (µg/ml) i Konsentras Kadar =
Keterangan: C = Konsentrasi Larutan Sampel (µg/ml) Fp = Faktor Pengenceran
W = Berat Sampel (g)
Kadar fosfor dalam sampel =
g 184 , 5 10 x ml 50 µg/ml 0,7128 x
= 68,7500 µg/g
= 0,06875 mg/g x 100/100
Lampiran 9. (Lanjutan)
3. Buah Sirsak Mandalika (Annona muricata L.)
No Berat Sampel (g) Serapan Konsentrasi (µg/ml)
Kadar mg/100g
1 5,163 0,456 0,7765 7,5198
2 5,121 0,448 0,7627 7,4467
3 5,158 0,453 0,7713 7,4767
4 5,147 0,452 0,7696 7,4761
5 5,131 0,449 0,7644 7,4488
6 5,141 0,452 0,7696 7,4849
Contoh perhitungan Kadar Fosfor pada Buah Sirsak Biasa (Annona muricata L.) Berat sampel yang ditimbang = 5,163 g
Serapan = 0,458
Persamaan regresi Y = 0,5813 x + 0,0046
Konsentrasi sampel X =
5813 , 0 0046 , 0 − y
X =
5813 , 0 0046 , 0 456 , 0 −
= 0,7765 µg/ml
(g) Sampel Berat n pengencera Faktor x (ml) Volume x (µg/ml) i Konsentras Kadar =
Keterangan: C = Konsentrasi Larutan Sampel (µg/ml) Fp = Faktor Pengenceran
W = Berat Sampel (g)
Kadar fosfor dalam sampel =
g 163 , 5 10 x ml 50 µg/ml 0,7765 x
= 75,1985 µg/g
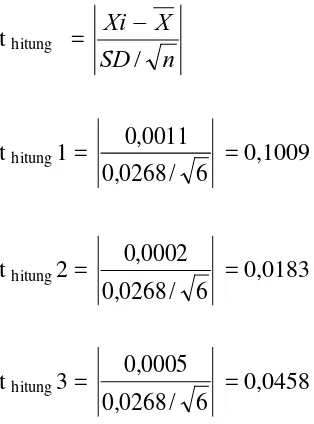
Lampiran 10. Perhitungan Statistik Kadar Fosfor dalam Sampel 1. Buah Sirsak Biasa (Annona Muricata L.).
NO. Kadar mg/100g X -X (X-X )2 X
1 7,1714 0,0335 0,0011
2 7,1528 0,0149 0,0002
3 7,1597 0,0218 0,0005
4 7,1145 -0,0234 0,0006
5 7,1240 -0,0139 0,0002
6 7,1053 -0,0326 0,0010
∑ X = 42,8277 ∑(X-X )2 = 0,0036
X = 7,1379
SD =
(
)
1 -n X -Xi 2
∑
= 1 6 0,0036 − = 0,0268Pada interval kepercayaan 95% dengan nilai α = 0,05 , dk (derajat kebebasan) = 5 maka t tabel= α/2, dk = 2,5706.
Data diterima jika t hitung < t tabel.
t hitung =
n SD X Xi / −
t hitung 1 =
6 / 0268 , 0 0,0011 = 0,1009
t hitung 2 =
6 / 0268 , 0 0,0002 = 0,0183
t hitung 3 =
Lampiran 10. (Lanjutan)
t hitung 4 =
6 / 0268 , 0
0,0006
= 0,0550
t hitung 5 =
6 / 0268 , 0
0,0002
= 0,0183
t hitung 6 =
6 / 0268 , 0
0,0010
= 0,0917
Dari hasil perhitungan diatas diperoleh semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar fosfor pada buah sirsak biasa (Annona muricata L.) adalah: μ = X ± (t (α/2, dk) x SD / √n )
Lampiran 10. (Lanjutan)
2. Buah Sirsak Ratu (Annona muricata L.).
NO. Kadar mg/100g X -X (X-X )2 X
1 6,8750 0,0024 0,00006
2 6,8488 -0,0023 0,00005
3 6,8776 0,005 0,00003
4 6,8735 0,0009 0,00007
5 6,8797 0,0071 0,00005
6 6,8813 0,0087 0,00007
∑X = 41,2359 ∑(X-X )2 = 0,00016
X = 6,8726
SD =
(
)
1 -n X -Xi 2
∑
= 1 6 0,00016 − = 0,0056Pada interval kepercayaan 95% dengan nilai α = 0,05, dk (derajat kebebasan) = 5 maka t
tabel = α/2, dk = 2,5706.
Data diterima jika t hitung < t tabel.
t hitung =
n SD X Xi / −
t hitung 1 =
6 / 0056 , 0 0,00006 = 0,0026
t hitung 2 =
6 / 0056 , 0 0,00005 -= 0,0022
t hitung 3 =
Lampiran 10. (Lanjutan)
t hitung 4 =
6 / 0056 , 0
0,00007
= 0,0003
t hitung 5 =
6 / 0056 , 0
0,00005
= 0,0217
t hitung 6 =
6 / 0056 , 0
0,00007
= 0,0304
Dari hasil perhitungan diatas diperoleh semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar fosfor pada buah sirsak ratu (Annona muricata L.) adalah: μ = X ± (t (α/2, dk) x SD / √n )
Lampiran 10. (Lanjutan)
1. Buah Sirsak Mandalika (Annona muricata L.).
NO. Kadar mg/100g X -X (X-X )2
X
1 7,5198 0,0443 0,00196
2 7,4467 -0,0288 0,00083
3 7,4767 0,0012 0,00001
4 7,4761 0,0006 0,00003
5 7,4488 -0,0267 0,00071
6 7,4849 0,0094 0,00008
∑X = 44,853 ∑(X-X )2 = 0,00358
X = 7,4755
SD =
(
)
1 -n X -Xi 2
∑
= 1 6 0,00358 − = 0,0268Pada interval kepercayaan 95% dengan nilai α = 0,05, dk (derajat kebebasan) = 5 maka t
tabel = α/2, dk = 2,5706. Data diterima jika t hitung < t tabel.
t hitung =
n SD X Xi / −
t hitung 1 =
6 / 0268 , 0 0,00196 = 0,1798
t hitung 2 =
6 / 0268 , 0 0,00083 -= 0,0761
t hitung 3 =
Lampiran 10. (Lanjutan)
t hitung 4 =
6 / 0268 , 0
0,00003
= 0,0027
t hitung 5 =
6 / 0268 , 0
0,00071
= 0,0651
t hitung 6 =
6 / 0268 , 0
0,00008
= 0,0073
Dari hasil perhitungan diatas diperoleh semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar fosfor pada buah sirsak mandalika (Annona muricata L.) adalah: μ = X ± (t (α/2, dk) x SD / √n )
Lampiran 11. (Lanjutan)
Lampiran 12. Kadar Fosfor Setelah Penambahan Larutan Baku
Berat sampel
(g) Serapan Konsentrasi µg/ml
Kadar mg/100g
5,173 0,582 0,9933 9,5858
5,168 0,580 0,9898 9,5522
5,184 0,585 0,9984 9,6352
5,189 0,585 0,9984 9,6352
5,194 0,587 1,0018 9,6680
5,179 0,584 0,9967 9,6225
Berat rata-rata sampel recovery = 5,181 g Serapan (Y) = 0,582
Persamaan Regresi Y = 0,5813 x + 0,0046 Konsentrasi sampel X =
5813 , 0 0046 , 0 − y X = 5813 , 0 0046 , 0 582 , 0 −
= 0,9933 µg/ml
(g) Sampel Berat n pengencera Faktor x (ml) Volume x (µg/ml) i Konsentras Kadar =
Kadar =
g 181 , 5 10 x ml 50 µg/ml 0,9933 x
= 95,8589 µg/g = 0,0958 mg/g
Lampiran 13. Hasil Uji Perolehan Kembali (Recovery) No. Kadar sebelum
penambahn baku
Kadar setelah
penambahan baku % Recovery
1. 6,8726 9,5858 85,16%
2. 6,8726 9,5522 84,10%
3. 6,8726 9,6352 86,71%
4. 6,8726 9,6352 86,71%
5. 6,8726 9,6680 87,74%
6. 6,8726 9,6225 86,31%
Maka % perolehan kembali fosfor` = CF- CA x 100%
C*A
= 100%
mg/100g
3,1866
mg/100g 6,8726)
-(9,5858
x
Lampiran 14. Perhitungan Simpangan Baku Relatif (RSD)
No. X Xi-X (Xi-X )2
1 85,16 -0,96 0,9216
2 84,10 -2.02 4,0804
3 86,71 0,59 0,3481
4 86,71 0,59 0,3481
5 87,74 1,62 2,6244
6 86,31 0,19 0,0361
∑X = 516,73 ∑ (Xi-X )2 = 8,3587
X = 86,12
SD =
(
)
1 -n
X
-Xi 2
∑
=
1 6 8,3587
−
= 1,2929 RSD = x
X SD
_ 100%
= 100%
86,12 1,2929
x
Lampiran 15. Perhitungan Batas Deteksi dan Batas Kuantitasi Y = 0,5813 x + 0,0046
Slope = 0,5813
No.
X Y
Yi (Y-Yi) (Y-Yi)
Konsentrasi
(µg/ml) Serapan
1 0 0 0,0046 0,0046 0,00002
2 0,381 0,208 0,2260 -0,018 0,00003
3 0,572 0,346 0,3371 0,0089 0,00008
4 0,762 0,481 0,4476 0,0334 0,00011
5 0,953 0,532 0,5585 -0,0265 0,00007
6 1,079 0,639 0,6318 0,0072 0,00005
∑ = 0,00225
=
=
= 0,02121
Batas deteksi (LOD) =
slope X SY x 3 = 5813 , 0 02121 , 0 3x
= 0,1095 µg/ml
Batas kuantitasi (LOQ) =
slope X SY x 10 = 5813 , 0 02121 , 0 10x
DAFTAR PUSTAKA
Almatsier, S. (2004). Prinsip Dasar Ilmu Gizi. Jakarta: PT. Gedia Pustaka Umum. Halaman 243, 245.
Auliana, R., (1999). Gizi dan Pengolahan Pangan. Yogyakarta: Adicita Karya Nusa. Halaman 29-30.
Badrie, N., dan Alexander, G.S. (2010). Soursop (Annona muricata L.).
Composition, Nutritional Value, Medicinal Uses, and Toxicology.
Halaman 626-628.
Budianto, A.K. (2009). Dasar-dasar Ilmu Gizi. Edisi Kedua. Cetakan Keempat. Malang: UMM-Press. Halaman 85.
Ditjen, POM RI,. (1979). Farmakope Indonesia. Edisi ketiga. Direktorat Jendral
Pengawasan Obat dan Makanan Departemen Kesehatan RI. Jakarta:
Halaman 651, 772.
Ermer, J., dan John, H.McB.M. (2005). Method Validation in Pharmaceutical
Analysis. A guide to Best Practice. Dalam: E. Joachim. Linearity.
Weinhein: Wiley-VCH. Halaman 170.
Ervizal, A.M.Z. ( 2011). Bukti Kedahsyatan Sirsak Menumpas Kanker. Yunita Indah. Cet-1. Jakarta: Agromedia Pustaka. Halaman 1,7,8.
Gandjar, I.G., dan Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. Halaman 223, 235-236,240-243, 262, 464.
Hanum, C. (2009). Ekologi Tanaman. Medan: USU Press. Halaman 38- 46. Hariana, H.A. (2011). Tumbuhan Obat Dan Khasiatnya. Cetakan Ketiga. Jakarta:
Penebar Swadaya. Halaman 89.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metoda dan Cara
Perhitungannya. Jakarta: Departemen Farmasi FMIPA UI. Halaman
117-135.
Lancashire, R.J. (2006). Colourimetric Determination of Phosphate. http://wwwchem.uwimona.edu.jm Diakses tanggal 20 Mei 2012.
Lim, S. (1991). Determination of Phosphorus Concentration in Hydroponics
Solution. Australia: Agilent Technologies Inc. Halaman 1. Diakses 26 Juli
2012.
Satiadarma, K., Mulja, M., Tjahjono, D.H., dan Kartasasmita, R.E. (2004). Asas
Pengembangan Prosedur Analisis. Edisi Kesatu. Surabaya: Airlangga
University Press. Halaman 49, 87-90.
Sudjana. (2005). Metode Statistika. Edisi Keempat. Bandung: Penerbit Tarsito. Halaman 93, 145, 201, 371.
Trihendradi, C. (2013) Langkah Mudah Menguasai SPSS 21. Edisi Keempat. Penerbit C.V Andi Offset. Yogyakarta: Halaman 100-105.
Warisno, dan Kres, D. (2007). Daun Sirsak Langkah Alternatif Mengempur
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Farmasi Kuantitatif Fakultas Farmasi Universitas Sumatera Utara Medan pada bulan September 2015-Januari 2016.
3.2 Bahan-bahan 3.2.1 Sampel
Sampel yang digunakan dalam penelitian ini adalah buah Sirsak Biasa, Sirsak Ratu dari daerah perumahan warga Tanjung mulia, Tanjung Morawa, Medan dan Sirsak Mandalika (Annona muricata L.) dari daerah Padang Maninjau, Rantau Prapat.
3.2.2 Pereaksi
Pereaksi yang digunakan dalam penelitian ini adalah bahan yang berkualitas pro analis dari E. Merck yaitu Asam nitrat, Ammonium molibdat, Asam sulfat, Asam askorbat, Kalium dihidrogen fosfat, Kalium antimonil tatrat dan aquabides dari Laboratorium Penelitian Fakultas Farmasi USU.
3.3 Alat-alat
3.4 Pembuatan Pereaksi 3.4.1 Larutan HNO3 (1:1)
Larutan HNO3 65% b/v sebanyak 500 ml diencerkan dengan aquabides
hingga 500 ml (Ditjen POM RI., 1979). 3.4.2 Larutan H2SO4 5 N
Dipipet 70 ml H2SO4 96% v/v, dimasukan perlahan-lahan melalui dinding
ke dalam labu tentukur 500 ml yang telah berisi aquabides setengahnya, dicukupkan volumenya dengan aquabides hingga garis tanda (Lancashire, 2006). 3.4.3 Larutan Ammonium Molibdat 4% b/v
Ditimbang secara seksama 20 g ammonium molibdat, dilarutkan kedalam labu tentukur 500 ml dengan aquabides dan dicukupkan volumenya dengan aquabides hingga garis tanda (Lancashire, 2006).
3.4.4 Larutan Asam Askorbat 0,1 N
Ditimbang secara seksama 0,88 g asam askorbat dan dilarutkan dalam labu tentukur 50 ml dengan aquabides dan dicukupkan volumenya dengan aquabides hingga garis tanda (Lancashire, 2006).
3.4.5 Larutan Kalium Antimonil Tartrat 0,274% b/v
Ditimbang secara seksama 0,247 g kalium antimonil tartrat, dilarutkan dalam labu tentukur 100 ml dengan aquabides dan dicukupkan volumenya dengan aquabides hingga garis tanda (Lancashire, 2006).
3.4.6 Larutan Pengembang Warna Fosfor
3.5 Prosedur Penelitian 3.5.1 Penyiapan Sampel
Buah sirsak yang masak (Annona muricata L.) masing-masing ditimbang sebanyak ± 1/2 kg, kemudian dibersihkan dengan air mengalir, buahnya dipotong menjadi dua bagian lalu diambil bagian daging dan dipisahhkan dari bijinya. Daging buah dihaluskan dengan menggunakan blender.
3.5.2 Proses Desktruksi Basah
Sampel yang telah dihaluskan masing-masing ditimbang seksama sebanyak 5,0 g dalam kurs porselen, ditambahkan 5 ml asam nitrat 65% b/v, didiamkan selama 24 jam. Kemudian dipanaskan diatas hotplate, pada suhu 1000C dan ditambahkan kembali asam nitrat 65% b/v secara perlahan-lahan sebanyak 15 ml, dan dipanaskan hingga larutan berubah menjadi kuning jernih. Lalu didinginkan selama 1 jam.
3.5.4 Pembuatan Larutan Sampel
3.6 Analisis Fosfor
3.6.1 Analisis Kualitatatif Fosfor
Analisis kualitatif fosfor dapat dilakukan dengan pereaksi Ammonium Molibdat dan Barium Klorida, Analisis kualitatif dilakukan pada larutan sampel. 1. Kedalam tabung reaksi dimasukan 5,0 ml sampel, ditambah pereaksi
ammonium molibdat 4% b/v ± 2,0 ml, dikocok lalu diamkan, maka akan terbentuk endapan kuning jika mengandung fosfor (Ditjen POM RI., 1979). 2. Kedalam tabung reaksi dimasukan 5,0 ml sampel, ditambah pereaksi barium
klorida 4% b/v ± 2,0 ml, maka akan terbentuk endapan putih yang larut dalam asam nitrat encer jika mengandung fosfor (Ditjen POM RI., 1979).
3.6.2 Analisis Kuantitatif Fosfor
3.6.2.1 Pembuatan Larutan Induk Baku KH2PO4 (LIB I)
Ditimbang 0,1118 g KH2PO4 (berat fosfor 25,4 mg ) dimasukan ke
dalam labu tentukur 100 ml, ditambahkan aquabides dikocok hingga larut, dicukupkan volumenya hingga garis tanda. Diperoleh konsentrasi fosfor pada larutan induk baku (LIB I) adalah 254 µg/ml (Lancashire, 2006). Perhitugan pada Lampiran 6, halaman 40.
3.6.2.2 Pembuatan Larutan Induk Baku KH2PO4 (LIB II)
Di pipet 5,0 ml LIB I dimasukan ke dalam labu tentukur 100 ml, dicukupkan volume dengan aquabides sampai garis tanda, diperoleh konsentrasi larutan induk baku (LIB II) adalah 12,7 µg/ml.
3.6.2.3 Penentuan Panjang Gelombang Absorbansi Maksimum
warna fosfor, kemudian dicukupkan dengan aquabides hingga garis tanda. Diukur
serapan pada rentang λ 400-800 nm.
3.6.2.4 Penentuan Waktu Kerja
Dari LIB II dipipet 5,0 ml, dimasukan kedalam labu tentukur 50 ml, ditambahkan aquabides hingga ± 25 ml, ditambahkan 13 ml larutan pereaksi warna fosfor, kemudian dicukupkan dengan aquabides hingga garis tanda. Didiamkan, Kemudian diukur serapan pada λ maksimun 717 nm mulai menit ke-31 hingga menit ke-90 dengan interval waktu 1 menit. Dapat dilihat Lampiran 7, halaman 41.
2.6.2.5 Pembuatan Kurva Kalibrasi Larutan Baku Fosfor
Dari LIB II tersebut dipipet 3, 4,5, 6, 7,5 dan 8,5 ml, dimasukan ke dalam labu tentukur 100 ml ditambahkan aquabides hingga ± 50 ml, ditambahkan 13 ml larutan pereaksi warna fosfor, kemudian dicukupkan volumenya sampai garis tanda. Didapat konsentrasi larutan 0,381µg/ml, 0,572 µg/ml, 0,762 µg/ml, 0,953 µg/ml dan 1,079 µg/ml. Dikocok, didiamkan selama 30 menit. Diukur serapan pada λ maksimun 717 nm pada menit ke-80 dengan spektrofotometri sinar tampak.
3.6.3 Penetapan Kadar Fosfor Dalam Sampel
3.6.3.1 Penetapan Kadar Fosfor pada Buah Sirsak Biasa, Sirsak Ratu dan Sirsak Mandalika
717 nm. Pengukuran dilakukan pada menit ke-80. Dihitung konsentrasi fosfor dengan menggunakan persamaan garis regresi linear kurva kalibarsi.
Menurut Gandjar dan Rohman (2007), kadar mineral dalam sampel dapat dihitung dengan cara sebagai berikut:
(g) Sampel Berat
n pengencera Faktor
x (ml) Volume x
(µg/ml) i
Konsentras Kadar =
Keterangan : C = Konsentrasi larutan sampel setelah pengenceran (µg/ml) V = Volume labu kerja (ml)
Fp = Faktor pengenceran W = Berat sampel (g)
3.7 Analisis Data Secara Statistik 3.7.1 Penolakan Hasil Pengamatan
Menurut Sudjana (2005), Kadar fosfor yang diperoleh dari pengukuran masing-masing larutan sampel dianalisis secara statistik dengan cara menghitung standar deviasi menggunakan rumus sebagai berikut:
SD =
Keterangan : Xi = Kadar sampel SD = Standar Deviasi X = Kadar rata-rata sampel n = Jumlah pengulangan
Kadar yang diperoleh dari hasil pengukuran masing-masing ke enam larutan sampel, diuji secara statistik dengan uji T.
Untuk mengetahui data ditolak atau diterima dilakukan uji T yang dapat dihitung dengan menggunakan rumus:
dan untuk menentukan kadar mineral di dalam sampel dengan tingkat kepercayaan 95%, , dk = n-1, dapat digunakan rumus:
Keterangan : x = Kadar rata-rata sampel SD = Standar deviasi
dk = Derajat kebebasan (dk = n-1) = Tingkat kepercayaan
n = Jumlah pengulangan
3.7.2 Pengujian Beda Nilai Rata – rata (Uji ANOVA)
Untuk mengetahui perbedaan nilai rata-rata Sirsak biasa, Sirsak ratu dan Sirsak mandalika antar sampel dilakukan analisa statistik menggunakan uji ANOVA dengan Statistical Product Solution dengan taraf kepercayaan 95% Dengan uji Tukey. Uji ini digunakan untuk menguji apakah 2 populasi atau lebih memiliki nilai rata-rata (mean) yang dianggap sama atau tidak. Analisa sesudah ANOVA atau pasca ANOVA (post hoc) dilakukan jika hipotesis nol (H0) ditolak.
Namun jika hipotesis nol (H0) diterima, maka analisa sesudah anova tidak perlu
dilakukan (Trihendradi, 2013). 3.8 Validasi Metode
3.8.1 Uji Perolehan Kembali (Recovery
Menurut Sudjana (2005), persen perolehan kembali (ujii recovery) dapat dihitung dengan rumus di bawah ini:
% Perolehan Kembali = CF- CA x 100%
Keterangan : Cf = Kadar sampel setelah penambahan larutan baku
CA = Kadar sampel sebelum penambahan larutan baku
C*A = Kadar larutan baku yang ditambahkan
3.8.2 Simpangan Baku Relatif
Keseksamaan atau presisi diukur sebagai baku relatif atau koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang yang homogen. Nilai simpangan baku relatif yang memenuhi persyaratan menunjukan adanya keseksamaan metode yang dilakukan (Harmita, 2004).
Menurut Harmita (2004), simpangan baku relatif dapat dihitung dengan rumus dibawah ini.
RSD = ×100% X
SD
Keterangan: X = Kadar rata-rata sampel SD = Standar deviasi
RSD = Relative standar deviation 3.8.3 Penentuan Batas Deteksi dan batas Kuantitasi
Batas deteksi merupakan jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan. Sedangkan batas kuantitasi merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004).
Menurut Harmita (2004), batas deteksi dan batas kuantitasi ini dapat dihitung dengan rumus sebagai berikut:
Simpangan Baku ( X
SY ) =
(
)
2 2
− −
∑
n Yi Y
Batas deteksi (LOD) =
slope X SY x
3
Batas kuantitasi (LOQ) =
slope X SY x
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Sampel
Sampel didapat dari daerah perumahan warga Tanjung mulia, Tanjung morawa, Medan dan daerah Padang maninjau, Rantau Prapat. Pengambilan sampel dilakukan berdasarkan Indentifikasi buah sirsak yang dilakukan di Laboratorium Tumbuhan Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara. Gambar sampel yang digunakan dapat dilihat pada Lampiran 1, halaman 33.
4.2 Analisis Kualitatif Fosfor
[image:40.595.121.513.514.623.2]Analisis kualitatif dilakukan untuk mengetahui apakah sampel yang akan diuji kualitatif mengandung fosfor atau tidak. Hasil analisis kualitatif dapat dilihat pada Tabel 4.1 dibawah ini. Gambar hasil analisa kualitatif dapat dilihat di Lampiran 3, halaman 37.
Tabel 4.1 Hasil analisa kualitatif fosfor dengan pereaksi
NO. Mineral yang
dianalisa Pereaksi Hasil Reaksi Keterangan
1. Fosfor
Ammonium molibdat 4% b/v
± 2 ml
Endapan kuning
+
2. Fosfor Barium klorida 4% ± b/v 2 ml
Endapan
putih +
Keterangan : + = Mengandung fosfor
4.3 Analisis Kuantititatif
4.3.1 Penentuan Panjang Gelombang Absorbansi Maksimum
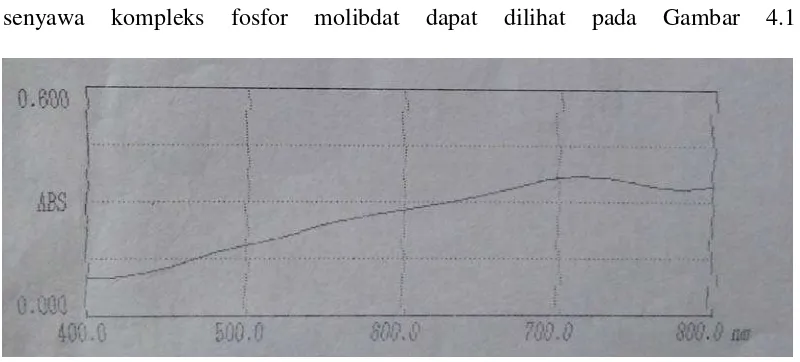
Penentuan panjang gelombang maksimum senyawa kompleks fosfor molibdat dilakukan dengan mengukur serapan dari larutan baku pada rentang panjang gelombang maksimum 400-800 nm dengan menggunakan spektrofotometer sinar tampak. Kurva penentuan panjang gelombang maksimum senyawa kompleks fosfor molibdat dapat dilihat pada Gambar 4.1
[image:41.595.112.512.249.430.2]Panjang gelombang
Gambar 4.1 Kurva Serapan Senyawa Kompleks Molibdenum dengan Konsentrasi 1,27 µg/ml
Dari pengukuran yang dilakukan, didapat serapan maksimum pada panjang gelombang 717 nm dengan absorbansi 0,389. Panjang gelombang yang diperoleh ini sesuai dengan literatur, yaitu pada rentang 610-750 nm yang merupakan rentang panjang gelombang untuk warna komplementer biru-hijau (Gandjar dan Rohman, 2007).
4.3.2 Penentuan Waktu Kerja Senyawa Kompleks Fosfor Molibdenum pada Panjang Gelombang Maksimum 717 nm
diukur pada panjang gelombang 717 nm mulai menit ke-31 sampai menit ke-90. Hasil pengukuran menunjukan serapan stabil pada menit 80 hingga menit ke-83. Data pengukuran waktu kerja kompleks fosfor molibdat, dapat dilihat pada Lampiran 7, halaman 41.
4.3.3 Kurva Kalibrasi Fosfor secara Spektrofotometri Sinar Tampak
[image:42.595.116.492.338.605.2]Kurva kalibrasi fosfor diperoleh dengan cara mengukur serapan larutan baku dengan konsentrasi 0,381 µg/ml, 0,572 µg/ml, 0,762 µg/ml, 0,953 µg/ml dan 1,079 µg/ml. Pada panjang gelombang 717 nm dalam waktu kerja yang telah diperoleh. Kurva kalibrasi larutan induk baku dapat dilihat pada Gambar 4.2
Gambar 4.2 Kurva kalibrasi fosfor pada panjang gelombang 717 nm
Dari pengukuran fosfor diperoleh persamaan regresi yaitu Y = 0,5813 x + 0,0046 dengan koefisien korelasi r = 0,9987. Berdasarkan kurva diatas, diperoleh hubungan linear antara konsentrasi dengan absorbansi. Menurut (Ermer dan McB. Miller 2005), Nilai r ≥ 0,97 menunjukkan adanya korelasi linear yang menyatakan adanya hubungan antara X (konsentrasi) dan Y (absorbansi).
Konsentrasi (µg/ml)
A
bs
o
r
ban
si
-0 -.,1
0 0 .,1
0 .,2
0 .,3
0 .,4
0 .,5
0 . ,6
,7
0 0 .,2 0., ,4 0., ,6 0 .,8 1,0 1 .,2
0 Y = 0,5813 x + 0,0046
4.4.3 Penetapan Kadar Fosfor dalam Sampel
Larutan hasil dekstrusi yang mengandung fosfor diukur dengan spektrofotometri sinar tampak pada panjang gelombang 717 nm, pengukuran menghasilkan serapan dan konsentrasi yang dapat dihitung berdasarkan persamann garis regresi.
Penetapan kadar fosfor dilakukan dengan menggunakan metode asam askorbat secara spektrofotometri sinar tampak. Sampel yang telah didekstruksi basah berupa fosfat bereaksi dengan ammonium molibdat dan kalium antimonil tartat dalam suasana asam penambahan asam sulfat membentuk senyawa fosfomolibdat lalu direduksi dengan asam askorbat, menjadi senyawa kompleks molibdenum yang berwarna biru dan stabil selama 4 menit, diukur pada menit ke- 80 pada panjang gelombang 717 nm.
[image:43.595.113.513.525.597.2]Selanjutnya dilakukan perhitungan statistik terhadap hasil analisis menggunakan uji ANOVA dengan taraf kepercayaan 95%. Hasil penetapan kadar fosfor dalam sampel dapat dilihat pada Tabel 4.2 dibawah ini.
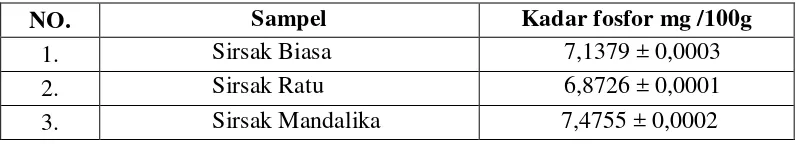
Tabel 4.2 Hasil Penetapan Kadar Fosfor dalam Sampel
NO. Sampel Kadar fosfor mg /100g
1. Sirsak Biasa 7,1379 ± 0,0003 2. Sirsak Ratu 6,8726 ± 0,0001 3. Sirsak Mandalika 7,4755 ± 0,0002
Berdasarkan Tabel 4.2 diatas dapat dilihat bahwa kadar fosfor pada sirsak biasa, sirsak ratu dan sirsak mandalika masing-masing adalah (7,1379 ± 0,0003) mg/100g, (6,8726 ± 0,0001) mg/100g dan (7,4755 ± 0,0002) mg/100g, lalu dianalisis secara uji ANOVA, didapat Fhitung fosfor 1034,524 dan Ftabel 3,59,
menyatakan ketiga sampel dari rata-rata populasi adalah sama dan H1 menyatakan
ketiga sampel dari rata-rata populasi adalah berbeda), maka dapat disimpulkan terdapat perbedaan yang signifikan antar sampel (Trihendradi, 2013). Perbedaan tersebut disebabkan oleh tempat tumbuh tanaman dan faktor lingkungan (iklim, pemupukan dan curah hujan) (Hanum, 2009). Perhitungan dapat dilihat pada Lampiran 10, halaman 47.
4.5 Validasi Metode Analisis
4.5.1 Uji Perolehan Kembali (Recovery)
Uji perolehan kembali dilakukan terhadap sampel yang sama dan dianalisis dengan cara yang sama dengan pengerjaan sampel awal dan dilakukan penambahan larutan baku (konsentrasi 12,7 µg/ml) pada 5,0 g daging buah sirsak yang segar. Uji perolehan dilakukan untuk mengetahui ketepatan metode yang digunakan.
Dari uji peroleh kembali yang dilakukan, didapat % perolehan kembali sebesar 85,16%. Maka dapat disimpulkan bahwa metode yang dilakukan memberikan akurasi yang memenuhi persyaratan yaitu 80-120% (Harmita, 2004). Contoh perhitungan dapat dilihat pada Lampiran 12-13, halaman 55-56.
4.5.2 Simpangan Baku Relatif
4.5.3 Penentuan Batas Deteksi dan Batas Kuantitasi
[image:45.595.114.495.193.238.2]Berdasarkan data kurva kalibarasi fosfor diperoleh batas deteksi dan batas kuantitasi. Batas deteksi dan batas kuantitasi dapat dilihat pada Tabel 4.3.
Tabel 4.3 Batas deteksi dan batas kuantitasi fosfor
No. Mineral Batas deteksi (µg/ml) Batas kuantitasi (µg/ml)
1. Fosfor 0,1095 0,3648
Dari hasil perhitungan diperoleh batas deteksi (LOD) sebesar 0,1095 µg/ml dan batas kuantitasi (LOQ) sebesar 0,3648 µg/ml.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkkan penelitian yang di lakukan, maka dapat disimpulkan bahwa: 1. Kadar fosfor pada sirsak biasa, sirsak ratu dan sirsak mandalika ( Annona
muricata L.) (7,1379 ± 0,0003) mg/100g, (6,8726 ± 0,0001) mg/100g dan
(7,4755 ± 0,0002) mg/100g.
2. Dari hasil uji ANOVA dengan taraf kepercayaan 95%, Kadar fosfor pada sirsak biasa, sirsak ratu dan sirsak mandalika (Annona muricata L.) terdapat perbedaan yang signifikan.
5.2 Saran
1. Disarankan kepada peneliti selanjutnya untuk dapat meneliti kadar mineral lain seperti besi dan magnesium pada sirsak biasa, sirsak ratu dan sirsak mandalika (Annona muricata L.).
BAB II
TINAJAUN PUSTAKA
2.1 Uraian umum
2.1.1 Tanaman Sirsak (Annona muricata L.)
Indonesia terletak di daerah tropis merupakan salah satu negara penghasil buah-buahan. Bermacam buah-buahan dengan berbagai varietas, bentuk, rasa, bau dan warna yang khas telah dikenal sejak lama. Sirsak merupakan tanaman dengan tinggi pohon sekitar 5-6 m (Badrie dan Schauss, 2010).
2.1.2 Klasifikasi Tanaman Sirsak
Menurut Warisno dan Dahana (2012), klasifikasi tanaman sirsak adalah sebagai berikut :
Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledoneae Ordo : Magnoliales Famili : Annonaceae Genus : Annona
Spesies : Annona muricata L. 2.1.3 Marfologi Tanaman Sirsak
cabang atau ranting juga sama dengan batangnya, namun saat masih muda berwarna hijau. Akar tanaman sirsak ada 2 jenis, yaitu akar tunggang (vertikal) dan akar serabut (horizontal), akar tunggang berfungsi untuk memperkuat berdirinya tanaman dan tumbuh kearah bawah sedangkan akar serabut memiliki fungsi untuk mencari unsur hara dan air, panjang akar tanaman sirsak dapat mencapai 1-2 m. Bunga sirsak berwarna kuning atau kehijauan, terdiri atas kelopak-kelopak bunga yang tersusun seperti membentuk kerucut, bunga sirsak dapat tumbuh pada cabang, ranting, bahkan batang. Buah sirsak memiliki bentuk dasar kerucut, tetapi bentuknya tidak beraturan, kulit buah berwarna hijau tua pada saat muda, namun berwarna kuning setelah masak, buahnya memiliki duri-duri lunak berwarna hijau yang menyelimuti seluruh buah, daging buah berwarna putih, beraroma khas, dan rasanya manis asam pada saat sudah masak. Biji sirsak berwarna hitam, lonjong, dan keras. Ujungnya memiliki bagian berwarna putih, yang merupakan titik tumbuh, biji biasanya akan tumbuh setelah disemaikan selama 2-3 minggu (Warisno dan Dahana, 2012).
2.1.4 Jenis-Jenis Tanaman Sirsak
buah nona, berbentuk bulat, daging buah berwarna kuning, bijinya banyak, rasanya manis, dan duri kulitnya lebih jarang (Zuhud, 2011).
2.1.5 Kandungan Kimia Tanaman Sirsak
Semua bagian dari tamanan sirsak mengandung senyawa aktif, buah sirsak mengandung protein, kalsium, fosfor, besi, vitamin A dan vitamin C. Batang, biji, akar dan daunnya kaya akan tanin, alkaloid, steroid/terpenoid, flavonoid, kumarin, fitosterol dan kalsium oksalat (Hariana, 2011).
2.1.6 Manfaat Tanaman Sirsak
setelah direbus, air rebusannya digunakan untuk pengobatan penyakit asma, batuk, obat penenang dan hipertensi (Warisno dan Dahana, 2012).
2.2 Mineral Fosfor
Mineral merupakan unsur yang dibutuhkan oleh tubuh manusia yang mempunyai peranan penting dalam pemeliharaan fungsi tubuh, baik pada tingkat sel, jaringan, organ, maupun fungsi tubuh secara keseluruhan. Unsur ini digolongkan kedalam mineral mikro dan makro. Mineral makro adalah mineral yang dibutuhkan dalam jumlah 100 mg sehari, misalnya natrium, klorida, kalsium, magnesium, sulfur, dan fosfor. Mineral mikro dibutuhkan kurang dari 100 mg sehari, misalnya besi, iodium, mangan dan tembaga (Almatsier, 2004).
Fosfor merupakan mineral kedua yang terbanyak didalam tubuh setelah kalsium, fosfor dan kalsium terdapat dalam jaringan tulang dan gigi, fosfor juga terdapat dalam semua sel hidup dan diperlukan untuk pelepasan energi. Fosfor mempunyai peranan dalam metabolisme karbohidrat, lemak, dan protein. Fosfor merupakan komponen esensial bagi banyak sel dan merupakan alat transport asam lemak. Fosfor berperan pula dalam mempertahankan keseimbangan tubuh. Pada umumnya bahan makanan yang mengandung banyak kalsium merupakan juga sumber fosfor, seperti susu, keju, daging, ikan, telur, dan sekitar 70% dari fosfor yang berada dalam makanan dapat diserap oleh tubuh. Penyerapan akan lebih baik bila fosfor dan kalsium dimakan dalam jumlah yang sama. Angka kecukupan fosfor rata-rata sehari adalah 400-500 mg (Almatsier, 2004).
fosfor tidak bisa dipenuhi oleh ASI (air susu ibu). Kelebihan fosfor karena makanan jarang terjadi. Bila kadar fosfor darah terlalu tinggi, ion fosfat akan mengikat kalsium sehingga dapat menimbulkan kejang (Budianto, 2009).
2.3 Metode Destruksi 2.3.1 Metode Destruksi Basah
Destruksi basah adalah perombakan sampel dengan asam-asam kuat baik tunggal maupun campuran, kemudian dioksidasi dengan menggunakan zat oksidator. Pelarut-pelarut yang dapat digunakan untuk destruksi basah antara lain asam nitrat, asam sulfat, asam perklorat, dan asam klorida. Semua pelarut tersebut dapat digunakan baik tunggal maupun campuran. Kesempurnaan destruksi ditandai dengan diperolehnya larutan jernih pada larutan destruksi, yang menunjukkan bahwa semua konstituen yang ada telah larut sempurna atau perombakan senyawa-senyawa organik telah berjalan dengan baik. Senyawa-senyawa garam yang terbentuk setelah didestruksi merupakan Senyawa-senyawa garam yang stabil dan disimpan selama beberapa hari (Raimon, 1993).
2.3.2 Metode Destruksi Kering
dilarutkan dengan pelarut asam yang encer baik tunggal maupun campuran, kemudian didekstruksi, hasil destruksi dianalisis dengan metode Spektrofotometeri Serapan Atom (Raimon, 1993).
Menurut Raimon (1993) ada beberapa faktor yang harus diperhatikan dalam hal menggunakan metode destruksi terhadap sampel, baik dengan destruksi basah atau dekstruksi kering, antara lain:
a. Sifat matriks dan konstituen yang terkandung didalamnya. b. Jenis logam yang akan dianalisis.
c. Metode yang akan digunakan untuk penentuan kadarnya.
2.4 Spektrofotometri UV-Visible
Spektrofotometri adalah pengukuran absorbansi energi cahaya oleh suatu sistem kimia pada panjang gelombang tertentu, biasanya digunakan untuk molekul dan ion organik atau kompleks dalam larutan, spektrum sinar ultraviolet dan sinar tampak sangat berguna untuk pengukuran secara kuantitatif. Sinar ultraviolet mempunyai panjang gelombang antara 200-400 nm, sementara sinar tampak mempunyai panjang gelombang 400-800 nm (Gandjar dan Rohman, 2007).
Menurut Gandjar dan Rohman (2007), ada beberapa hal yang harus diperhatikan dalam analisis dengan spektrofotometri ultraviolet dan sinar tampak terutama untuk senyawa yang tidak berwarna dan yang berwarna yang akan dianalisis yaitu:
a. Pembentukan molekul yang dapat menyerap sinar UV-Visible
b. Waktu kerja (operating time)
Tujuannya adalah untuk mengetahui waktu pengukuran yang stabil. c. Pemilihan panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal.
d. Pembuatan kurva baku
Dilakukan dengan membuat larutan baku dalam berbagai konsentrasi kemudian absorbansi tiap konsentrasi diukur.
e. Pembacaan absorbansi sampel
[image:53.595.123.502.436.525.2]Absorbansi yang terbaca pada spektrofotometer hendaknya terletak antara 0,2 sampai 0,6 (Gandjar dan Rohman, 2007).
Gambar Instrumen Spektrofotometer UV-Visible
(Gandjar dan Rohman, 2007). Menurut Gandjar dan Rohman (2007), bagian-bagian instrumentasi spektrofotometer UV-Visible sebagai berikut:
a. Sumber Cahaya
b. Monokromator
Monokromator berfungsi mengubah cahaya polikromatis menjadi cahaya yang monokromatis. Alatnya dapat berupa berupa prisma atau kisi difraksi. c. Sel
Sel yang digunakan untuk daerah tampak terbuat dari kaca sedang untuk daerah ultraviolet digunakan sel kuarsa atau kaca silika. Sel tampak dan ultraviolet yang khas mempunyai panjang lintasan 1 cm, namun tersedia juga sel dengan ketebalan kurang dari 1 ml, sampai 10 cm bahkan lebih.
d. Detektor
Peranan detektor adalah memberikan respon terhadap cahaya pada berbagai panjang gelombang.
e. Rekorder
Recorder digunakan sebagai perekam absorbansi yang dihasilkan dari pengukuran (Gandjar dan Rohman, 2007).
[image:54.595.114.515.553.757.2]Menurut Gandjar dan Rohman (2007), warna-warna yang dihubungkan dapat dinyatakan dalam tabel dibawah ini:
Tabel 2.1 Hubungan antara warna dengan panjang gelombang sinar tampak Panjang Gelombang Warna yang diserap Warna Komplementer 400 – 435 nm
450 – 480 nm 480 – 490 nm 490 – 500 nm 500 – 560 nm 560 – 680 nm 580 – 595 nm 595 – 610 nm 610 – 750 nm
2.5 Validasi Metode Analisis
Validasi adalah suatu tindakan penilaian terhadap parameter tertentu pada prosedur penetapan yang dipakai untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004).
Suatu metode analisis harus divalidasi untuk melakukan verifikasi bahwa parameter-parameter kerjanya cukup mampu untuk mengatasi masalah analisis dan untuk menjamin bahwa metode analisis akurat, dan spesifik. Validasi metode analisis dilakukan dengan uji laboratorium, dengan demikian dapat ditunjukkan bahwa karakteristik kinerjanya telah memenuhi persyaratan untuk diterapkan dalam analisis senyawa atau sediaan yang diuji (Satiadarma, dkk., 2004).
Beberapa parameter analisis yang harus dipertimbangkan dalam validasi metode analisis adalah sebagai berikut:
a. Akurasi (kecermatan)
Akurasi (kecermatan) adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit sebenarnya. Akurasi dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan dan dapat ditentukan melalui dua cara yaitu metode simulasi (spiked placebo recovery) dan metode penambahan bahan baku (standard addition method) (Harmita, 2004).
Metode simulasi (spiked placebo recovery) merupakan metode yang dilakukan dengan cara menambahkan sejumlah analit bahan murni kedalam suatu bahan pembawa sediaan farmasi (plasebo), lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan (kadar sebenarnya) (Harmita, 2004).
Metode penambahan bahan baku (standard addition method) merupakan metode yang dilakukan dengan cara menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang diperiksa, lalu dianalisis dengan metode yang akan divalidasi. Hasilnya dibandingkan dengan sampel yang dianalisis tanpa penambahan sejumlah analit. Persen perolehan kembali di tentukan dengan menentukan berapa persen analit yang ditambahkan ke dalam sampel (Harmita, 2004).
b. Presisi (keseksamaan)
Presisi (keseksamaan) merupakan ukuran yang menunjukan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang homogen. Presisi dinyatakan sebagai deviasi standar relatif dan simpangan baku relatif (Nilai RSD dinyatakan memenuhi persyaratan jika tidak lebih dari 16%) (Satiadarma, dkk., 2004).
b. Batas deteksi dan batas kuantitas
Batas deteksi merupakkan jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan, sedangkan batas kuantitasi merupakan kuantitasi terkecil analit dalam sampel yang masih memenuhi kriteria cermat dan seksama (Harmita, 2004).
d. Liniearitas
e. Pengujian beda nilai rata-rata
Untuk mengetahui perbedaan nilai rata-rata antar sampel dilakukan analisa statistik menggunakan uji ANOVA dengan Statistical Product Solution dengan taraf kepercayaan 95% dengan uji Tukey. Uji ini digunakan untuk menguji apakah 2 populasi atau lebih memiliki nilai rata-rata (mean) yang dianggap sama atau tidak. Analisa sesudah ANOVA atau pasca ANOVA (post hoc) dilakukan jika hipotesis nol (H0) ditolak. Namun jika hipotesis nol (H0) diterima, maka analisa
BAB I PENDAHULUAN
1.1Latar Belakang
Tanaman sirsak (Annona muricata L.) berasal dari bahasa Belanda, yakni
zuurzak berarti kantong asam (Zuhud, 2011). Buah sirsak memiliki bau dan rasa
yang khas dan dimanfaatkan sebagai buah segar dan minuman atau jus. Buah sirsak adalah jenis buah–buahan yang sangat digemari karena mempunyai nilai nutrisi sangat tinggi, selain enak dikonsumsi buahnya juga mempunyai khasiat untuk mengatasi sariawan, mengobati embeien, sakit pinggang, kanker, kolestrol dan masih banyak lagi manfaat lainnya (Badrie dan Schauss, 2010).
Buah sirsak mengandung vitamin, mineral serta serat yang baik untuk kesehatan menurut Warisno dan Dahana (2012), dalam daging buah sirsak mengandung vitamin C, vitamin B, kalsium, fosfor dan besi yang mana sangat dibutuhkan oleh tubuh manusia. Vitamin yang paling tinggi pada buah Sirsak ialah vitamin C, di mana senyawa tersebut berguna sebagai antioksidan di dalam tubuh,
yaitu membantu tubuh untuk melawan berbagai macam radikal bebas yang masuk ke
dalam tubuh serta memperlambat proses penuaan dan untuk mineral fosfor berfungsi
untuk memperkuat tulang dan pertumbuhan gigi. Selain komponen gizi, buah Sirsak
juga sangat kaya akan komponen non gizi, salah satunya ialah mengandung serat
pangan (Burhan, dkk., 2012).
terdapat sebagai garam kalsium fosfat di dalam tulang dan gigi yang tidak dapat larut. Fosfor di dalam tulang berada dalam perbandingan 1 : 2 dengan kalsium, selebihnya terdapat di dalam semua sel tubuh, separuhnya di dalam otot dan di dalam cairan ekstraseluler. Sebagai fosfolipid, fosfor merupakan komponen struktural dinding sel, yang memegang peranan penting dalam reaksi yang berkaitan dengan penyimpanan atau pelepasan energi (Almatsier, 2004). Menurut Badrie dan Schauss (2010), dalam 100 g buah sirsak mengandung 27,7 mg fosfor. Kadar fosfor dalam buah sirsak dipengaruhi oleh beberapa faktor yaitu tempat tumbuh tanaman, faktor lingkungan seperti (iklim, pemupukan, dan curah hujan) (Hanum, C., 2009).
Pemeriksaan kadar fosfor dapat dilakukan secara spektrofotometri sinar tampak dengan menggunakan 3 metode pereaksi warna yaitu asam vanomolibdofosfor, stanium klorida dan asam askorbat (Lim, 1991), untuk meneliti fosfor pada buah sirsak dilakukkan secara spektrofotometri sinar tampak dengan metode asam askorbat karena metode ini lebih sederhana.
1.2 Perumusan masalah
Berdasarkan uraian diatas, maka permasalahan dalam penelitian ini dapat di rumuskan sebagai berikut:
1. Berapakah kadar fosfor yang terdapat pada buah Sirsak Biasa, Sirsak Ratu, dan Sirsak Mandalika (Annona muricata L.).
2. Apakah terdapat perbedaan kadar fosfor pada Sirsak Biasa, Sirsak Ratu, dan Sirsak Mandalika (Annona muricata L.).
1.3 Hipotesis
Hipotesis dalam penelitian ini adalah:
1. Buah Sirsak Biasa, Sirsak Ratu, dan Sirsak Mandalika mengandung kadar fosfor dalam jumlah tertentu (Annona muricata L.).
2. Terdapat perbedaan kadar fosfor pada Sirsak Biasa, Sirsak Ratu, dan Sirsak Mandalika (Annona muricata L.).
1.4 Tujuan penelitian
Tujuan dari penelitian ini adalah:
1. Untuk mengetahui kadar fosfor yang terdapat pada buah Sirsak Biasa, Sirsak Ratu, dan Sirsak Mandalika (Annona muricata L.).
2. Untuk mengetahui perbedaan kadar fosfor pada buah Sirsak Biasa, Sirsak Ratu, dan Sirsak Mandalika (Annona muricata L.).
1.5 Manfaat Penelitian
ANALISIS KADAR FOSFOR PADA BEBERAPA MACAM BUAH SIRSAK (Annona muricata L.) SECARA SPEKTROFOTOMETRI SINAR
TAMPAK ABSTRAK
Buah sirsak memiliki bau dan rasa yang khas, buah sirsak dimanfaatkan sebagai buah segar dalam minuman atau jus, buah sirsak mengandung vitamin, mineral serta serat yang baik untuk kesehatan. salah satu mineral yang kandungannya cukup tinggi adalah fosfor, yaitu mineral esensial yang digunakan untuk pertumbuhan dan perbaikan sel-sel tubuh dan jaringan, Tujuan penelitian ini adalah mengetahui kadar fosfor serta perbedaan kadar fosfor pada beberapa macam buah sirsak.
Dalam penelitian ini dianalisis tiga macam buah sirsak, Penetapan kadar dilakukan dengan spektrofotometri sinar tampak dengan pereaksi warna fosfor, pada panjang gelombang 717 nm dengan waktu kerja pada menit ke-80 hingga menit ke-83.
Hasil penetapan kadar fosfor dari sirsak biasa, sirsak ratu dan sirsak mandalika adalah (7,1379 ± 0,00036) mg/100g, (6,8726 ± 0,00014) mg/100g dan (7,4755 ± 0,00028) mg/100g, dan hasil uji validasi metode yang dilakukan memberikan akurasi dan presisi yang memenuhi syarat yaitu persen perolehan
kembali 85,16%, RSD 1,5012%, Batas deteksi (LOD) 0,1095μg/mL dan Batas kuantitasi (LOQ) 0,3648μg/mL.
Berdasarkan hasil penelitian tersebut dapat disimpulkan, bahwa terdapat perbedaan yang signifikan terhadap kadar fosfor pada sirsak biasa, sirsak ratu dan sirsak mandalika.
ANALYSIS OF PHOSPHORUS IN SOME SOURSOPS (Annona muricata L.) BY VISIBLE SPECTROPHOTOMETRY
ABSTRACT
Annona muricata L. has aroma and feel typical that exploited as fresh
fruit and juice or beverage, content of are vitamin, mineral and also fibre which good to health. One of the mineral content which high enough is phosphorus, phosphorus is an essencial mineral which primarily is using for growth and repairing body cells and tissues. The purpose of this study was to detemine the level phosphorus as well differences in level of phosphorus are found in some soursops.
This study uses three hind of soursops, the level determination has did by Spectrophotometry visible of the reagent color phosphorus with wavelength of 717 nm, and operating time between 80th to 83rd minute.
The results of the determination phosphorus of ordinary soursop, queen soursop and mandalika soursop is (7.1379 ± 0.00036) mg/100g, (6.8726 ± 0.00014) mg/100g dan (7.4755 ± 0.00028) mg/100g. The limits of detection and quantitation indicated by phosphorus recovery percent 85.16%, RSD 1.501 %, (LOD) 0.1095µg /mL and (LOQ) 0.3648 µg /mL.
Based on these result it can be concluded that the levels a significant of phosphorus in ordinary soursop, queen soursop and mandalika soursop
ANALISIS KADAR FOSFOR PADA BEBERAPA MACAM
BUAH SIRSAK (
Annona muricata
L
.
)
SECARA
SPEKTROFOTOMETRI SINAR TAMPAK
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
YUSNAWATI
NIM 101501003
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
ANALISIS KADAR FOSFOR PADA BEBERAPA MACAM
BUAH SIRSAK (
Annona muricata
L
.
)
SECARA
SPEKTROFOTOMETRI SINAR TAMPAK
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh
Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
Diajukan sebagai salaDDDIDh satu syarat untuk memperoleh
G
OLEH:
YUSNAWATI
NIM 101501003
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
ANALISIS KADAR FOSFOR PADA BEBERAPA MACAM
BUAH SIRSAK
(Annona Muricata
L
.)
SECARA
SPEKTROFOTOMETRI SINAR TAMPAK
OLEH:
YUSNAWATI
NIM 101501003
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 10 Mei 2016 Disetujui oleh:
Pembimbing I, Panitia Penguji,
Dra. Sudarmi, M.Si., Apt. Drs. Fathur Rahman Harun, M.Si., Apt. NIP 195409101983032001 NIP 195201041980031002
Pembimbing II, Dra. Sudarmi, M.Si., Apt.embimbing II NIP 195409101983032001
Sri Yuliasmi, S,Farm,. M.Si, Apt. Drs. Nahitma Ginting, M.Si., Apt. NIP 1982070320081221 NIP 195406281983031002
Dra. Tuty Roida Pardede, M.Si., Apt. NIP 195401101980032001
Medan, Agustus 2016 Fakultas Farmasi
Universitas Sumatera Utara Pejabat Dekan,
KATA PENGANTAR
Puji syukur kehadirat Allah SWT yang telah memberikan karunia yang berlimpah sehingga penulis dapat menyelesaikan penyusunan skripsi yang berjudul “Analisis Kadar Fosfor pada Beberapa Macam Buah Sirsak (Annona
muricata L.) secara Spektrofotometri Sinar Tampak”. Skripsi ini diajukan untuk
melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan terima kasih kepada Ibu Dr. Masfria, M.S., Apt., selaku Dekan Fakultas Farmasi yang telah menyediakan fasilitas kepada penulis selama perkuliahan di Fakultas Farmasi. Penulis juga mengucapkan terimaksih yang sebesar-besarnya kepada Ibu Dra. Sudarmi, M.Si., Apt., dan Ibu Sri Yuliasmi, S. Farm,. M.Si., Apt., yang telah membimbing penulis dengan penuh kesabaran dan tanggung jawab, memberikan petunjuk, dan saran-saran selama penelitian hingga selesainya skripsi ini. Ucapan terima kasih juga penuliskan sampaikan kepada Bapak Drs. Fathur Rahman Harun, M.Si., Apt., selaku ketua penguji, Bapak Drs. Nahitma Ginting, M.Si., Apt., dan Ibu Dra. Tuty Roida Pardede, M.Si., Apt., selaku anggota penguji yang telah memberikan saran untuk menyempurnakan skripsi ini, dan Ibu Dwi Lestari P, S.Si., M.Si., Apt., selaku dosen penasehat akademik yang telah banyak membimbing penulis selama masa perkuliahan hingga selesai.
Muhammad Safi’i yang telah memberikan semangat dan kasih sayang yang tak ternilai dengan apapun. Penulis juga mengucapkan terima kasih kepada teman-teman mahasiswa/i Farmasi yang selalu mendoakan dan memberi semangat.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih belum sempurna. Oleh karena itu, penulis mengharapkan saran dan kritik yang membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, Agustus 2016 Penulis
SURAT PERNYATAAN
Saya yang bertanda tangan dibawah ini: Nama : Yusnawati
NIM : 101501003
Program Studi : S1- Reguler Farmasi
Judul Penelitian : Analisis Kadar Fosfor pada Beberapa Macam Buah Sirsak
(Annona muricata L.) secara Spektrofotometri Sinar
Tampak.
Dengan ini menyatakan bahwa skripsi ini ditulis berdasarkan data dari hasil pekerjaan yang saya lakukan sendiri, dan belum pernah diajukan oleh orang lain untuk memperoleh gelar kesarjanaan diperguruan tinggi lain, dan bukan plagiat karena kutipan yang ditulis telah disebutkan sumbernya didalam daftar pustaka.
Apabila dikemudian hari ada pengaduan dari pihak lain karena di dalam skripsi ini ditemukan plagiat karena kesalahan saya sendiri, maka saya bersedia menerima sanksi apapun oleh Program Studi Farmasi Fakultas Farmasi Universitas Sumatera Utara, dan bukan menjadi tanggung jawab pembimbing.
Demikianlah surat pernyataan ini saya perbuat dengan sebenarnya untuk dapat digunakan jika diperlukan sebagaimana mestinya.
Medan, Agustus 2016 Yang membuat pernyataan,
ANALISIS KADAR FOSFOR PADA BEBERAPA MACAM BUAH SIRSAK (Annona muricata L.) SECARA SPEKTROFOTOMETRI SINAR
TAMPAK ABSTRAK
Buah sirsak memiliki bau dan rasa yang khas, buah sirsak dimanfaatkan sebagai buah segar dalam minuman atau jus, buah sirsak mengandung vitamin, mineral serta serat yang baik untuk kesehatan. salah satu mineral yang kandungannya cukup tinggi adalah fosfor, yaitu mineral esensial yang digunakan untuk pertumbuhan dan perbaikan sel-sel tubuh dan jaringan, Tujuan penelitian ini adalah mengetahui kadar fosfor serta perbedaan kadar fosfor pada beberapa macam buah sirsak.
Dalam penelitian ini dianalisis tiga macam buah sirsak, Penetapan kadar dilakukan dengan spektrofotometri sinar tampak dengan pereaksi warna fosfor, pada panjang gelombang 717 nm dengan waktu kerja pada menit ke-80 hingga menit ke-83.
Hasil penetapan kadar fosfor dari sirsak biasa, sirsak ratu dan sirsak mandalika adalah (7,1379 ± 0,00036) mg/100g, (6,8726 ± 0,00014) mg/100g dan (7,4755 ± 0,00028) mg/100g, dan hasil uji validasi metode yang dilakukan memberikan akurasi dan presisi yang memenuhi syarat yaitu persen perolehan
kembali 85,16%, RSD 1,5012%, Batas deteksi (LOD) 0,1095μg/mL dan Batas kuantitasi (LOQ) 0,3648μg/mL.
Berdasarkan hasil penelitian tersebut dapat disimpulkan, bahwa terdapat perbedaan yang signifikan terhadap kadar fosfor pada sirsak biasa, sirsak ratu dan sirsak mandalika.
ANALYSIS OF PHOSPHORUS IN SOME SOURSOPS (Annona muricata L.) BY VISIBLE SPECTROPHOTOMETRY
ABSTRACT
Annona muricata L. has aroma and feel typical that exploited as fresh
fruit and juice or beverage, content of are vitamin, mineral and also fibre which good to health. One of the mineral content which high enough is phosphorus, phosphorus is an essencial mineral which primarily is using for growth and repairing body cells and tissues. The purpose of this study was to detemine the level phosphorus as well differences in level of phosphorus are found in some soursops.
This study uses three hind of soursops, the level determination has did by Spectrophotometry visible of the reagent color phosphorus with wavelength of 717 nm, and operating time between 80th to 83rd minute.
The results of the determination phosphorus of ordinary soursop, queen soursop and mandalika soursop is (7.1379 ± 0.00036) mg/100g, (6.8726 ± 0.00014) mg/100g dan (7.4755 ± 0.00028) mg/100g. The limits of detection and quantitation indicated by phosphorus recovery percent 85.16%, RSD 1.501 %, (LOD) 0.1095µg /mL and (LOQ) 0.3648 µg /mL.
Based on these result it can be concluded that the levels a significant of phosphorus in ordinary soursop, queen soursop and mandalika soursop
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
SURAT PERNYATAAN ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Uraian Umum ... 4
2.1.1 Sejarah Tanaman Sirsak ... 4
2.1.2 Klasifikasi Tanaman Sirsak ... 4
2.1.4 Jenis-Jenis Tanaman Sirsak ... 5
2.1.5 Kandungan Kimia Tanaman Sirsak ... 6
2.1.6 Manfaat Tanaman Sirsak ... 6
2.2 Mineral fosfor ... 7
2.3 Metode Destruksi ... 8
2.3.1 MetodeDestruksi Basah ... 8
2.3.2 Metode Destruksi Kering ... 8
2.4 Spektrofotometri UV-Visible ... 9
2.5 Validasi Metode ... 12
BAB III METODE PENELITIAN ... 15
3.1 Tempat Dan Waktu Penelitian ... 15
3.2 Bahan-bahan ... 15
3.2.1 Sampel ... 15
3.2.2 Pereaksi ... 15
3.3 Alat-alat ... 15
3.4 Pembuatan Pereaksi ... 16
3.4.1 Larutan HNO3 (1:1) ... 16
3.4.2 Larutan H2SO4 5 N ... 16
3.4.3 Larutan Ammonium molibdat 4% b/v ... 16
3.4.4 Larutan asam askorbat 0,1 N ... 16
3.4.5 Larutan kalium antimonil tartrat 0,274% ... 16
3.4.6 Larutan pembentuk warna fosfor ... 16
3.5 Prosedur Penelitian ... 17
3.5.2 Prosedur Destruksi Basah ... 17
3.5.3 Pembuatan Larutan Sampel ... 17
3.6 Analisis Fosfor ... 18
3.6.1 Analisis Kualitatif Fosfor ... 18
3.6.2 Analisis Kuantitatif Fosfor ... 18
3.6.2.1 Pembuatan larutan induk baku KH2PO4 (LIB I) ... 18
3.6.2.2 Pembuatan larutan induk baku KH2PO4 (LIB II) ... 18
3.6.2.3 Penentuan λ maksimum ... 18
3.6.2.4 Penentuana waktu kerja ... 19
3.6.2.5 Pembuatan kurva kalibrasi ... 19
3.6.3 Penetapan Kadar Fosfor dalam Sampel ... 19
3.7.3.1 Penetapan kadar fosfor dalam buah sirsak ... 19
3.7 Analisis Data Secara Statistik ... 20
3.7.1 Penolakan Hasil Pengamatan ... 20
3.7.2 Pengujian Beda Nilai Rata – rata (Uji ANOVA) ... 21
3.8 Validasi Metode ... 21
3.8.1 Uji Perolehan Kembali ... 21
3.8.2 Simpangan Baku Relatif ... 22
3.8.3 Penentuan Batas Deteksi (Limit of Detection) dan Batas Kuantitasi (Limit of Quantitation) ... 22
BAB IV HASIL DAN PEMBAHASAN ... 24
4.1 Sampel ... 24
4.2 Analisis Kualitatif Fosfor ... 24
4.3.1 Penentuan Panjang Gelombang Absorbansi
Maksimum ... 25
4.3.2 Penentuan Waktu Kerja Kompleks Molibdenum pada Panjang Gelombang Maksimum 717 nm ... 26
4.3.3 Kurva Kalibrasi Fosfor ... 26
4.3.4 Penetapan Kadar Fosfor dalam Sampel ... 27
4.3.5 Validasi Metode Analisis ... 28
4.3.5.1 Uji perolehan kembali (Recovery) ... 28
4.3.5.2 Simpangan baku relatif ... 28
4.3.5.3 Penentuan batas deteksi (Limit of Detection) dan batas kuantitasi (Limit of Quantitation) .. 29
BAB V KESIMPULAN DAN SARAN ... 30
5.1 Kesimpulan ... 30
5.2 Saran ... 30
DAFTAR PUSTAKA ... 31
DAFTAR TABEL
Tabel Halaman 2.1 Hubungan antara warna dengan panjang gelombang
Sinar tampak ... 11 4.1 Hasil analisis kuanlitatif fosfor dengan pereaksi ... 24 4.2 Hasil Analisis Kadar Fosfor pada sirsak biasa, sirsak ratu
dan sirsak mandalika ... 27 4.3 Hasil Batas Deteksi dan Batas Kuantitasi ... 29
DAFTAR GAMBAR
Gambar Halaman 3.1 Kurva Serapan Senyawa Kompleks Molibdenum dengan
DAFTAR GAMBAR DALAM LAMPIRAN
Gambar Halaman
1 Sirsak Biasa ... 36
2 Sirsak Ratu ... 36
3 Sirsak Mandalika ... 36
4 Sampel + Ammonium Molibdat ... 37
DAFTAR LAMPIRAN
Lampiran Halaman
1 Hasil Identifikasi Sampel ... 33
2 Gambar Sampel ... 36
3 Gambar Hasil Uji Kualitatif Sampel ... 37
4 Bagan Alir Proses Persiapan Sampel ... 38
5 Bagan Alir Proses Destruksi Basah ... 39
6 Perhitungan Konsentrasi Larutan Induk Baku ... 40
7 Data Penentuan Waktu Kerja pada Panjang Gelombang 717 nm ... 41
8 Data Kalibrasi Fosfor, Perhitungan Persamaan Regresi dan Koefisien Korelasi ... 42
9 Hasil Analisis Kadar Fosfor pada Sampel ... 44
10 Perhitungan Statistik Kadar Fosfor pada Sampel ... 47
11 Hasil Tabel Uji ANOVA ... 53
12 Kadar Fosfor Setelah Penambahan Larutan Baku ... 55
13 Hasil Uji Perolehan Ke