Kupersembahkan karya sederhana ini kepada :
Ayahanda alm. Haryanto dan Ibunda Yuliana, S.Pd. tercinta
Kakak dan adikku tersayang Engki Fandika dan Melania Fandika
Segenap Keluarga besarku yang selalu mendoakan keberhasilanku,
Sahabat dan teman-temanku yang selalu berbagi kebahagiaan,
Assalamu’alaikum Wr. Wb.
Alhamdulillah Puji dan syukur Penulis ucapkan atas kehadirat Allah SWT, karena
atas segala rahmat dan karunia-Nya skripsi ini dapat diselesaikan.
Skripsi dengan judul"PENGARUH BEBERAPA FAKTOR PADA MEDIUM KULTUR TERHADAP PRODUKSI ENZIM AMILASE DARI BAKTERI AMILOLITIK ISOLAT LOKAL"adalah salah satu syarat untuk memperoleh
gelar Sarjana Sains pada Jurusan Kimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam, Universitas Lampung.
Dalam pelaksanaan dan penulisan skripsi ini tidak lepas dari kesulitan dan
rintangan, namun itu semua dapat penulis lalui berkat rahmat dan ridha Allah
SWT serta bantuan dan dorongan semangat dari orang-orang yang hadir
dikehidupan penulis. Dalam kesempatan ini, penulis menyampaikan terima kasih
setulus-tulusnya kepada :
1. Bapak Mulyono, Ph.D., selaku pembimbing utama yang telah banyak
memberikan ilmu pengetahuan, bimbingan, gagasan, bantuan, dukungan,
semangat, kritik dan saran kepada penulis dalam proses perencanaan dan
skripsi ini terselesaikan dengan baik.
3. Bapak Dr. Ir. Yandri A.S., M.S., selaku pembahas yang telah memberikan
kritik, saran, arahan yang diberikan kepada penulis sehingga skripsi ini
terselesaikan dengan baik.
4. Ibu Dra. Ilim, M.S., selaku Pembimbing Akademik atas kesediaannya utuk
memberikan bimbingan, bantuan, nasehat dan informasi yang bermanfaat
kepada penulis.
5. Seluruh dosen FMIPA Unila yang telah mendidik dan memberikan ilmu
pengetahuan yang sangat berguna kepada penulis selama kuliah.
6. Bapak Andi Setiawan, Ph.D., selaku ketua Jurusan Kimia FMIPA Unila.
7. Bapak Prof. Suharso, Ph.D., selaku Dekan Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Lampung.
8. Kedua orang tuaku yang sangat aku cintai dan sayangi. Papaku tersayang alm.
Haryanto yang selalu hidup di dalam hatiku, yang tetap menjadi inspirasi dan
semangat bagiku untuk tetap terus berjuang menggapai apa yang aku citakan,
Papaku Sensuri Gomar yang selalu memberikan motivasi, semangat dan kasih
sayang yang sangat luar biasa, mengajarkanku untuk menjadi orang yang kuat
dan berguna bagi orang lain, panutan dan tauladan yang terhebat bagiku.
Ibunda Yuliana, S.Pd tersayang dan tercinta yang selalu memberikan kasih
sayang, senantiasa sabar dan mendoakan keberhasilanku, nasehat dan senyum
9. Kakak dan adik ku tersayang, Engki Fandika dan Melania Fandika, terima
kasih atas kebahagiaan, motivasi, keceriaan dan canda tawa yang tercipta
selama ini. Kehadiran kalian adalah hal yang tak ternilai harganya dalam
hidupku.
10. Keluarga besarku yang selalu memberikan motivasi, dukungan dan doa untuk
keberhasilanku.
11. Sahabat-sahabat terbaikku yang tersayang : Feraliana, S.Si., Tutik, S.Si.,
Kurratul Uyun, Rika Yana, Triana Widya Sari terima kasih atas persahahabatan terhebat, segala dukungan, kebahagiaan, kesedihan, kasih sayang, rasa
kebersamaan, keceriaan dan canda tawa yang selalu hadir disetiap
hari-hariku, aku sangat bersyukur dan bangga mengenal kalian, semoga Allah
selalu memberikan rahmat-Nya untuk keberhasilan kita.
12. Teman-teman seperjuangan angkatan 2006 : Nindya Qurrata’ayun S.Si., Ayu
Puspita Sari S.Si., Devi Cendekia S.Si., Harniati S.N. S.Si., Rusyda Ulfa S.Si., Nurma Hayati S.Si., Ni Putu Inda S.Si., Septiyana S.Si., Edwin Riski Safitra S.Si., Mustika Soraya S.Si.,Idra Herlina S.Si, Ekawati S.Si, Winda, Jibe, Nova, S.Si., Lince, S.Si., Putri Wulandari, S.Si., Fretti, Kartika (Boboci), Eka Eva Krisna, S.Si. (kiting), Nini, S.Si., Reni, S.Si., Okta, S.Si., Vera Septaria, S.Si., Prio, S.Si., Roni, S.Si. (kirun), Agung,, Tomi, S.Si., Slamet (slem), Hadi, Deri, Anju, Awan, Alex, Riski (kiki), dan Purwanto terima kasih untuk kebersamaan dan keceriaan selama menjalankan perkuliahan, tetap semangat dan jangan menyerah,
Akhir kata, Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan.
Penulis berharap semoga skripsi yang sederhana ini dapat berguna dan bermanfaat
bagi kita semua. Amin.
Bandar Lampung, 2 Februari 2012 Penulis
PENGARUH BEBERAPA FAKTOR PADA MEDIUM KULTUR TERHADAP PRODUKSI ENZIM AMILASE DARI
BAKTERI AMILOLITIK ISOLAT LOKAL
Oleh
Kartika Fandika
Peranan enzim sebagai biokatalisator semakin meningkat seiring dengan pesatnya perkembangan industri, khususnya industri makanan, minuman, industri tekstil, industri kulit, dan industri kertas. Pertumbuhan sel dan produksi enzim oleh suatu mikroorganisme sangat dipengaruhi oleh kondisi medium kultur yang digunakan seperti sumber C, sumber N, ion logam dan pH. Pada penelitian ini telah dilakukan uji pengaruh beberapa faktor kondisi kultur terhadap pertumbuhan sel dan produksi enzim amilase isolat LTE-6. Faktor yang diteliti meliputi: variasi sumber N (pepton, NaNO3, NH4NO3 dan CO(NH2)2), sumber C (glukosa,
arabinosa, fruktosa dan gula), ion logam (Fe, Mn, Mg, Zn) dan variasi pH (5, 6, 7 dan 8) dengan berbagai variasi konsentrasi, yakni antara 0,5 – 2 % (w/v). Pertumbuhan sel diamati melalui pengukuran OD sel pada 600nm. Jumlah
THE INFLUENCE OF SOME FACTORS IN THE GROWTH OF CELL MEDIUM CONDITIONS ON THE PRODUCTION OF AMYLASE
ENZYMES FROM AMILOLITIK LOCAL ISOLATE
By
Kartika Fandika
The role of the enzyme as biokatalisator are increasing with the rapid industrial development, particularly the food industry, beverage, textile industry, leather industry and paper industry. Cell growth and enzyme production by a microorganism is affected by the culture medium used as the source of C, N sources, metal ions and pH. This research has been done on testing the influence of some factors on the growth of cell culture conditions and the production of amylase enzymes LTE-6 isolates. Factors studied include: variations in N sources (peptone, NaNO3, NH4NO3 and CO (NH2) 2), C source (glucose, arabinose,
fructose and sugar), metal ions (Fe, Mn, Mg, Zn) and the variation of pH (5 , 6, 7 and 8) with various concentrations, ie between 0.5 - 2% (w / v). Cell growth was observed by measuring the OD of cells at 600Nm . Production quantities are
A. Enzim
Enzim adalah produk protein sel hidup yang berperan sebagai biokatalisator
dalam proses biokimia, baik yang terjadi di dalam sel maupun di luar sel
(Poedjadi, 1994). Berdasarkan cara menghasilkannya, enzim dibagi menjadi dua,
yaitu enzim ekstraseluler dan enzim intraseluler. Enzim ekstraseluler dapat
diperoleh dalam keadaan murni pada biakan cair dengan cara pemisahan dan
pemurnian yang tidak begitu rumit (Smith, 1990). Fungsi utama dari enzim
tersebut adalah melangsungkan perubahan-perubahan pada nutrien di sekitarnya
sehingga memungkinkan nutrien tersebut masuk ke dalam sel. Sedangkan enzim
intraseluler memiliki peran dalam mensintesis bahan seluler dan menguraikan
nutrien untuk menyediakan energi yang dibutuhkan oleh sel (Wirahadikusumah,
1989).
Enzim merupakan unit fungsional dari metabolisme sel. Semua enzim yang
diketahui hingga kini hampir seluruhnya adalah protein dan aktivitas katalitiknya
bergantung pada integritas strukturnya sebagai protein. Enzim, seperti protein
lain, memiliki berat molekul yang berkisar kira-kira 12.000 sampai lebih dari 1
juta. Oleh karena itu, enzim berukuran sangat besar dibandingkan substrat atau
1. Enzim Amilase
Amilase merupakan enzim pemecah pati, glikogen dan polisakarida lain dengan
cara menghidrolisis ikatan glikosidik α-1,4 atau ikatan glikosidik α-1,6. Amilase
dibagi menjadi empat golongan, yaitu: α-amilase, β-amilase, glukoamilase dan
enzim pemutus cabang. Berdasarkan produk akhir hidrolisisnya, enzim amilase
dibagi menjadi α-amilase sakarifikasi dan amilase likuifikasi. Golongan pertama
memberikan produk akhir gula bebas sedangkan golongan kedua adalah enzim
yang memecah pati tetapi tidak menghasilkan gula bebas, kedua golongan amilase
ini dibedakan secara eksperimen (Crueger, 1984).
Enzimα-amilase (α-1,4 glukan-glukanhidrolase), termasuk enzim pemecah dari
dalam molekul, bekerja menghidrolisisdengan cepat ikatan α-1,4 glukosida pada
pati. Berat molekul α-amilase ± 50 kDa (Suhartono, 1989). Enzim ini banyak
digunakan pada industrisirup, sari buah, dan selai. Enzim α-amilase mengandung
paling sedikit 1 atom kalsium permolekul dan melekat dengan erat pada molekul
enzim. Adanya kalsium tersebut menyebabkan enzim ini disebut “calcim metal
coenzyme”(Judoamidjojo dkk., 1989). Ion kalsium ini penting untuk stabilitas
dan aktivitas enzim. Afinitas ion kalsium pada α-amilase lebih kuat dari
kation lain. Masih belum jelas apakah ion kalsium dapat diganti oleh
kation-kation lain (Vihinen and Mantsala, 1989).
Mekanisme kerja enzim α-amilase pada amilosa dibagi dalam dua tahap, pertama
degradasi secara cepat molekul amilosa menjadi maltosa dan maltotriosa yang
terjadi secara acak. Pada tahap ini terjadi penurunan kekentalan dengan cepat.
maltosa dengan laju lebih lambat dan tidak secara acak (Winarno, 1995).
Aktivitas α-amilase dapat diukur berdasarkan penurunan kadar pati yang larut,
kadar dekstrin yang terbentuk, dan pengukuran viskositas atau jumlah gula
pereduksi yang terbentuk (Judoamidjojo dkk., 1989).
Pati bereaksi secara kimiawi dengan iodium, reaksi ini terlihat sebagai warna
biru-kehitaman. Warna biru-kehitaman ini terjadi bila molekul iodium masuk ke
dalam bagian yang kosong pada molekul zat pati (amilosa) yang berbentuk spiral.
Proses iodinisasi zat pati menghasilkan molekul yang mengabsorpsi semua
cahaya, kecuali warna biru. Bila zat pati ini telah diuraikan menjadi maltosa atau
glukosa, warna biru ini tidak terjadi karena tidak adanya bentuk spiral
(Lay, 1994).
Aktivitas enzim α-amilase ditentukan dengan mengukur penurunan kadar pati
yang larut dengan menggunakan substrat jenuh. Kejenuhan pati berpengaruh
terhadap laju reaksi enzimatis. Apabila larutan pati terlalu jenuh maka enzim sulit
terdifusi ke dalam larutan sehingga kerja enzim akan terhambat (Winarno, 1995).
β-amilase (β-1,4 glukan maltohidrolase), memutus dari luar molekul dan
menghasilkan unit-unit maltosa dari ujung nonpereduksi pada rantai polisakarida.
Bila tiba pada ikatan α-1,6 glikosida seperti yang dijumpai pada amilopektin atau
glikogen, aktivitas enzim ini akan terhenti. Enzim ini bekerja pada ikatan α-1,4
dengan menginversi konfigurasi posisi atom C (1) atau atom C nomor 1 molekul
glukosa dari α menjadi β. Enzim β-amilase memiliki pH optimum antara 5-6
Gamma amilase (γ –amilase), EC.3.2.1.3. disebut juga glukan 1,4-α–glukosidase,
amiloglukosidase, ekso-1,4-α–glukosidase, lisosomal α-glukosidase,
glukoamilase, 1,4-α-D-glukan glukohidrolase. Merupakan pemutus terakhir
ikatan glikosida pada bagi ujung nonreduksi dari amilosa dan amilopektin untuk
menghasilkan unit glukosa.
Pullulanase, EC.3.2.1.41. merupakan enzim pemutus cabang, menghidrolisis
hanya pada ikatan α-1,6 glikosida, seperti pullulan 6-glukanohydrolase. α
-Glukosidase,EC.3.2.1.20. Memutus ikatan α-1,4 glikosida dari molekul amilosa
ataupun amilopektin menjadi rantai-rantai pendek oligosakarida
(Hagiharaet al., 2001).
Berdasarkan arah memutusnya ikatan glikosida dari amilum, maka enzim amilase
dapat dikategorikan menjadi 2 kelompok (Reddyet al., 2003) yaitu endoamilase
dan ektoamilase. Endoamilase melakukan hidrolisis secara acak dari bagian
depan molekul amilum sehingga menghasilkan molekul oligosakarida dalam
bentuk rantai lurus maupun bercabang dengan panjang rantai yang bervariasi
sedangkan ektoamilase melakukan hidrolisis dari ujung nonreduksi dan dengan
produk akhir molekul yang pendek.
Enzim amilase secara konstitusi merupakan kelompok enzim yang sangat
dibutuhkan dalam bidang industri, dengan pangsa pasar mencapai hampir 25%
dari pasaran enzim di dunia (de Carvalhoet al., 2008). Penggunaan enzim
amilase dalam industri sangat luas mulai dari industri pembuatan roti, sirup,
pengujian limbah cair yang mengandung amilum, industri detergen, industri obat
dan suplemen enzim (Palmer, 1985).
2. Fungsi dan Cara Kerja Enzim
Enzim adalah satu atau beberapa gugus polipeptida (protein) yang berfungsi
sebagai katalis (senyawa yang mempercepat proses reaksi tanpa habis bereaksi)
dalam suatu reaksi kimia. Dimana suatu enzim dapat mempercepat reaksi 108
sampai 1011kali lebih cepat daripada reaksi tersebut dilakukan tanpa katalis.
Seperti katalis lainnya enzim dapat menurunkan energi aktivasi suatu reaksi
kimia.
Saat berlangsungnya reaksi enzimatik terjadi ikatan sementara antara enzim
dengan substrat (reaktan). Ikatan sementara ini bersifat labil dan hanya untuk
waktu yang singkat saja. Selanjutnya ikatan enzim-substrat akan pecah menjadi
enzim dan hasil akhir. Enzim yang terlepas kembali setelah reaksi dapat
berfungsi lagi sebagai biokatalisator untuk reaksi yang sama. Enzim bekerja
dengan dua cara, yaitu menurut Teori Kunci-Gembok (Lock and Key Theory) dan
Teori Kecocokan Induksi (Induced Fit Theory).
Menurut teori kunci-gembok, terjadinya reaksi antara substrat dengan enzim
karena adanya kesesuaian bentuk ruang antara substrat dengan situs aktif (active
site) dari enzim, sehingga sisi aktif enzim cenderung kaku. Substrat berperan
sebagai kunci masuk ke dalam situs aktif, yang berperan sebagai gembok,
Gambar 1. Pembentukan kompleks enzim-substrat berdasarkan Teori Kunci-Gembok (Lock and Key Theory) dan Teori Kecocokan Induksi (Induced Fit Theory).
Pada saat ikatan kompleks enzim-substrat terputus, produk hasil reaksi akan
dilepas dan enzim akan kembali pada konfigurasi semula. Berbeda dengan teori
kunci gembok, menurut teori kecocokan induksi reaksi antara enzim dengan
substrat berlangsung karena adanya induksi substrat terhadap situs aktif enzim
sedemikian rupa sehingga keduanya merupakan struktur yang komplemen atau
saling melengkapi. Menurut teori ini situs aktif tidak bersifat kaku, tetapi lebih
fleksibel (Murrayet al., 1997).
3. Faktor-Faktor Yang Mempengaruhi Reaksi Enzimatik
Terdapat beberapa faktor yang mempengaruhi reaksi enzimatik, antara lain:
a) Substrat (reaktan)
Kecepatan reaksi enzimatik umumnya dipengaruhi kadar substrat.
Penambahan kadar substrat sampai jumlah tertentu dengan jumlah
enzim yang tetap, akan mempercepat reaksi enzimatik sampai mencapai
maksimum. Penambahan substrat selanjutnya tidak akan menambah
b) Suhu
Seperti reaksi kimia pada umumnya, maka reaksi enzimatik dipengaruhi
oleh suhu. Kenaikan suhu sampai optimum akan diikuti pula oleh
kenaikan kecepatan reaksi enzimatik. Kepekaan enzim terhadap suhu
pada keadaan suhu melebihi optimum disebabkan terjadinya perubahan
fisikokimia protein penyusun enzim. Umumnya enzim mengalami
kerusakan (denaturasi) pada suhu diatas 50oC (Wolfe, 1993).
c) Keasaman (pH)
pH dapat mempengaruhi aktivitas enzim. Daya katalisis enzim menjadi
rendah pada pH rendah maupun tinggi, karena terjadi denaturasi protein
enzim. Enzim mempunyai gugus aktif yang bermuatan positif (+) dan
negatif (-). Aktivitas enzim akan optimum kalau terdapat
keseimbangan antara kedua muatan. Pada keadaan asam cenderung
bermuatan positif, dan pada keadaan basa cenderung bermuatan negatif,
sehingga aktivitas enzim menjadi berkurang atau bahkan menjadi tidak
aktif. pH optimum untuk masing-masing enzim tidak selalu sama
(Orten and Neuhaus, 1970).
d) Penghambat enzim (Inhibitor)
Inhibitor enzim adalah zat atau senyawa yang dapat menghambat
enzim. Ada beberapa cara penghambatan enzim, seperti penghambat
secara bersaing (kompetitif), penghambat tidak bersaing
(non-kompetitif), penghambat umpan balik (feed back inhibitor), dan
e) Waktu inkubasi
Waktu yang diperlukan oleh enzim untuk bereaksi secara optimum
dengan produk tidaklah seragam, ada beberapa yang membutuhkan
waktu yang lebih lama untuk bereaksi (Orten and Neuhaus, 1970).
B. Mikroorganisme
Sel merupakan unit struktural dan fungsional organisme hidup. Organisme
terkecil terdiri dari sel tunggal. Terdapat berbagai jenis sel yang amat bervariasi
dalam ukuran, bentuk, dan fungsi khususnya. Ada dua kelas utama sel, yaitu sel
prokariot dan sel eukariot (Albertet al., 1994). Sel yang paling tua dikenal
sebagai prokaryotis (dari kata “pro” yan artinya sebelum, dan “karyon” yang
artinya nukleus). Golongan ini terdiri dari dua golongan utama yaitu bakteri dan
sianobakteri (alga hijau-biru), dimana molekul nukleid terdapat secara langsung
pada sitoplasma tanpa ada sistem membran yang memisahkannya sebagai
kompartemen yang terpisah ( Wolfe, 1993).
Sel prokariot memiliki struktur yang sederhana, pertumbuhan selnya mudah dan
cepat, serta mekanisme yang relatif sederhana dalam proses reproduksi. Sel
prokariot bereproduksi dengan cara aseksual yang sangat sederhana. Organisme
ini tumbuh hingga ukurannya berlipat ganda, kemudian membelah diri menjadi sel
anak yang identik (Lehninger, 1988).
1. Nutrien Mikroba
Kebutuhan nutrien harus meliputi unsur makro esensial dan mikro esensial yang
mensintesis vitamin dan berperan dalam sporulasi. Nutrien dasar bagi
mikroorganisme harus mengandung sumber energi untuk tumbuh seperti unsur
karbon, nitrogen, dan logam. Nutrien yang tergolong sumber energi adalah
senyawa hasil oksidasi dari lemak, protein, amonium, karbohidrat, dan gula
sederhana. Kebutuhan sumber karbon dapat dipenuhi dengan adanya CO2atau
senyawa seperti gula, pati, dan karbohidrat lai. Kebutuhan akan nitrogen dapat
dipenuhi oleh NH4+ atau senyawa nitrat organik/anorganik. Untuk pertumbuhan
normal mikroorganisme membutuhkan ion logam yang berfungsi sebagai kofaktor
(Suhartono, 1989).
Histidin, ditiotreitol dan merkaptoetanol merupakan senyawa yang berperan
sebagai kofaktor enzim ini. Selain itu beberapa logam juga dapat berperan
sebagai kofaktor antara lain Ca2+, Ba2+, Mn2+, Ag+, dan Fe2+. Sedangkan Hg2+,
Cu2+, Mg2+, Rb2+, Fe3+, Al3+, Cd2+dan Ni2+merupakan inhibitorenzim α-amilase
(Schomburg and Salzmann, 1991).
2. Fase Pertumbuhan Mikroorganisme
Pertumbuhan mikroorganisme untuk menghasilkan produk tertentu mempunyai
siklus pertumbuhan tertentu tergantung produk yang akan dihasilkan. Fase
pertumbuhan mikroorganisme dibagi menjadi empat diantaranya fase lag, fase
esponensial, fase stasioner, dan fase menurun (kematian) (Dwidjoseputro, 1987).
a. Fase lag
Pada fase ini mikroorganisme melakukan metabolisme
belum terjadi pembelahan sel dan berlangsung cepat atau lambat
tergantung jenis mikroorganisme dan inokulum serta kondisi
lingkungan.
b. Fase eksponensial
Pada fase ini sel akan membelah diri sampai mencapai jumlah
maksimum sesuai dengan kondisi lingkungannya. Saat ini
mikroorganisme mengalami pertumbuhan yang tertinggi tetapi tidak
berlangsung sama karena pertumbuhan dibatasi oleh jumlah nutrien
dan penimbunan zat racun sebagai hasil metabolisme sekunder.
c. Fase stasioner
Pada fase ini pertumbuhan mikroorganisme seimbang dengan
kematiannya. Pertumbuhan mikroorganisme terhenti dan terjadi
akumulasi produk di dalam sel atau media fermentasi. Dengan
terakumulasinya produk pada media fermentasi akan mengganggu
proses sintesis enzim. Pada fase ini sel-sel menjadi lebih tahan
terhadap keadaan ekstrim seperti panas, dingin, radiasi, dan bahan
kimia.
d. Fase menurun (fase menuju kematian)
Pada fase ini sebagian mikroorganisme mulai mengalami kematian.
Jumlah sel yang mati semakin lama akan semakin banyak, dan
kecepatan kematian dipengaruhi oleh kondisi nutrien, lingkungan, dan
3. Amilase dari Mikroorganisme
Enzim yang digunakan untuk keperluan industri sebagian besar diisolasi
dari mikroba. Pemilihan mikroba sebagai sumber enzim mempunyai beberapa
keuntungan bila dibandingkan dengan enzim yang diisolasi dari tumbuhan
maupun hewan. Keuntungan itu antara lain sel mikroba lebih mudah untuk
ditumbuhkan dan kecepatan pertumbuhannya relatif lebih cepat, skala produksi
sel lebih mudah ditingkatkan apabila dikehendaki produksi yang lebih besar, biaya
produksinya relatif lebih murah, kondisi selama produksi tidak tergantung oleh
adanya perubahan musim dan waktu yang dibutuhkan dalam proses produksi lebih
singkat (Poernomo, 2003).
Amilase secara umum diproduksi oleh tumbuhan, hewan, manusia dan
mikroba, tetapi enzim amilase yang berasal dari fungi dan bakteri mendominasi
penggunaan enzim amilase di bidang industri. Beberapa dari jenisBacillus sp.dan
Actinomycetes,termasukTermomonosporadanThermoactinomycetesmerupakan
kelompok yang memiliki kemampuan besar dalam meproduksi enzim amilase.
Bacillus licheniformismemiliki kemampuan untuk menghasilkan enzim amilase
dalam kondisi lingkungan yang bersifat alkalis (Reddyet al., 2003). Enzim
amilase yang dihasilkan oleh mikroba terutama dari bakteri, merupakan jenis
enzim ekstraseluler (Palmer, 1985).
Bakteri menghasilkan enzim ekstraseluler di dalam sel dan menggunakannya di
luar sel, yaitu untuk menghidrolisis sumber makanan yang mengandung amilum
yang terdapat di lingkungannya. Molekul amilum tidak dapat masuk ke dalam sel
terlebih dahulu oleh enzim amilase ekstraselular menjadi molekul karbohidrat
yang lebih sederhana dan kecil ukuran molekulnya. Molekul hasil hidrolisis
amilum oleh enzim amilase tersebut selanjutnya akan diangkut masuk ke dalam
sel bakteri dan digunakan sebagai sumber karbon bagi aktivitas pertumbuhan dan
kehidupannya (Benson, 1994).
Enzim amilase ekstraseluler yang dihasilkan bakteri maupun fungi tersebut
dimanfaatkan sebagai katalisator dalam industri maupun untuk keperluaan dalam
bidang kesehatan. Untuk mendapatkan enzim amilase dari mikroba
tersebut maka kultur mikroba yang memproduksi enzim amilase ekstraseluler
tersebut disentrifugasi untuk mendapatkan supernatan yang mengandung enzim
amilase ekstraselular (Palmer, 1985).
4. Amilum
Amilum adalah polimer karbohidrat dengan rumus molekul (C6H10O5)n.
Karbohidrat golongan polisakarida ini banyak terdapat di alam, terutama pada
sebagian besar tumbuhan. Amilum dalam bahasa sehari-hari disebut juga pati
terdapat pada umbi, daun, batang dan biji-bijian. Amilum merupakan kelompok
terbesar karbohidrat cadangan yang dimiliki oleh tumbuhan sesudah selulosa (Liu,
2005). Butir-butir pati apabila diamati dengan mikroskop ternyata berbeda-beda
bentuknya dan ukurannya tergantung dari tumbuhan apa pati tersebut diperoleh
(Poedjiadi, 1994).
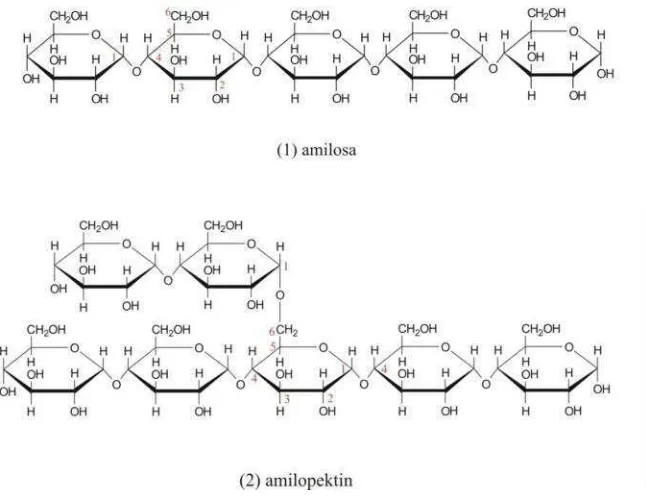
Amilum disusun oleh dua kelompok polisakarida yaitu amilosa, kira kira 20–28%
amilopektin memiliki monomer yang sama yaitu molekul glukopiranosa. Amilosa
terdiri dari 100-10000 unit D-glukopiranosa permolekulnya, yang tiap unitnya
berikatan lewat ikatan α-1,4 glikosida (Liu, 2005). Tiap rantai polimer
molekulnya memiliki satu ujung gula tereduksi dan satu ujungnya lagi gula
nonreduksi sehingga molekul amilosa merupakan rantai terbuka (Poedjiadi, 1994).
Amilosa merupakan bagian terdepan dari rantai amilum, bersifat larut
dalam air yang dipanaskan dan dapat membentuk endapan dalam air, yang
sifatnya tidak dapat balik (Aiyer, 2005). Amilopektin merupakan rantai molekul
polisakarida yang memiliki banyak percabangan. Molekul D-glukopiranosa yang
menjadi unit monomernya yang berikatan lewat ikatan α-1,4 glikosida seperti
pada amilosa yang membentuk rantai lurus dan ikatan α-1,6 glikosida yang
membentuk percabangan pada rantai amilopektin tersebut (Murrayet al., 2003).
Molekul amilopektin lebih besar dari molekul amilosa dengan berat moleklunya
berkisar antara 106–109 g permolnya (Liu, 2005). Molekul amilosa merupakan
molekul yang larut dalam air dan memberikan warna biru apabila tercampur
dengan larutan iodin, sedang amilopektin merupakan molekul yang tidak larut
dalam air dan akan kelihatan berwarna merah bila terkena iodin (Sale, 1961).
Butir-butir pati tidak larut dalam air dingin, tetapi apabila suspensi dalam
air dipanaskan terbentuk suatu larutan koloid yang kental. Bila pati dipanaskan
dan didilusi dengan asam, pati akan terhidrolisis menjadi dekstrin, maltosa dan
D-glukosa (Sale, 1961). Semua hasil hidrolisis ini memiliki sifat yang larut dalam
akanmengubah amilum menjadi maltosa dalam bentuk β-maltosa (Poedjiadi,
1994).
Gambar 3. Struktur Kimia dari (1) Amilosa dan (2) Amilopektin
Dalam kehidupan manusia amilum berperan sebagai sumber makanan penghasil
energi utama dari golongan karbohidrat, disamping itu amilum juga dapat
berperan sebagai bahan aditif pada proses pengolahan makanan, misalnya sebagai
penstabil dalam proses pembuatan puding. Amilum juga berperan dalam
A. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Agustus 2010 sampai dengan bulan April
2011 di Laboratorium Biokimia dan Laboratorium Instrumentasi Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
B. Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini antara lain spektrofotometer
UV-VIS, sentrifuga, mikropipet, shaker (orbit environ shaker), laminarair flow, pH
universal, autoklaf, jarum ose, pembakar spiritus, neraca analitik dan alat-alat
gelas laboratorium lainnya.
Bahan-bahan yang digunakan adalah pati singkong, pepton, NaNO3, NH4NO3,
CO(NH2)2, glukosa, fruktosa, maltosa, ekstrak ragi, NaCl, CaCl2,K2HPO4,
KH2PO4, MgSO4.7H2O, MnSO4.H2O, FeSO4,CaCl2, (NH4)2HPO4, NaOH,
pereaksi iodin, BSA (Bovine Serum Albumin), Na2CO3, Na-K- tartarat,
CuSO4.5H2O, reagenfolin ciocelteau,alkohol, spiritus, akuades serta isolat
C. Prosedur Penelitian
1. Penyiapan Medium dan Pereaksi
a. Pembuatan Pereaksi untuk Pengukuran Aktivitas Enzim Amilase MetodeFuwa(Fuwa, 1954)
Pembuatan pereaksi iodin yaitu dengan cara melarutkan 2 g KI dengan sedikit
akuades di dalam labu takar 100 mL, lalu ditambahkan 0,2 g I2dan ditambahkan
dengan akuades hingga tanda batas.
Pembuatan larutan pati yaitu dengan cara memasukkan 0,5 gram pati ke dalam
labu takar 100 mL kemudian ditambahkan 0,1 M buffer asetat hingga tanda batas,
lalu dipanaskan.
b. Pembuatan PereaksiLowryuntuk Pengukuran Kadar Protein (Lowryet al., 1951).
Pereaksi A dapat dibuat dengan cara melarutkan 2 g Na2CO3dengan 100 mL
NaOH 0,1N. Pereaksi B dapat dibuat dengan cara menambahkan 5 ml
CuSO4.5H2O 1% (w/v) ke dalam 5 mL larutan Na-K-tartarat 1% (w/v). Pereaksi
C dapat dibuat dengan cara menambahkan 2 mL pereaksi B dengan 100 mL
pereaksi A. Pereaksi D dapat dibuat dengan cara mengencerkan reagen
Folin-Ciocelteau dengan akuades 1:1.
2. Penumbuhan Mikroba
Diinokulasi 1 ose mikroba dari isolat terpilih yaitu isolat LTE-6 masing-masing
ke dalam erlenmeyer yang telah berisi medium NB cair steril. Tiap 100 mL
diinkubasi padashakerdengan kecepatan 180 rpm pada suhu 37 C selama 1
malam (overnight: 16-20 jam). Sebanyak 1% inokulum ini selanjutnya digunakan
untuk menginokulasi media kultur dengan volume yang lebih besar.
3. Penentuan Profil Pertumbuhan
Profil pertumbuhan mikroorganisme meliputi fase lag, fase ekspenensial, fase
stasioner dan fase kematian. Untuk mengetahui profil pertumbuhan tersebut
dilakukan pengukuranoptical density(OD) pada selang waktu (8, 31, 48, dan 55
jam). Pengukuran OD dilakukan pada panjang gelombang 600 nm.
4 Penentuan Profil Kadar Protein dan Aktivitas Enzim Amilase
Isolat LTE-6 dikultur selama 55 jam dan dilakukan sampling dengan kisaran
waktu 8, 24,31,48, dan 55 jam. Sampel kultur disentrifugasi dengan kecepatan
5000 rpm dan supernatan yang diperoleh diuji kadar proteinnya dengan metode
Lowrydan aktivitasnya menggunakan metodeFuwa, seperti yang dijelaskan pada
prosedur 5 dan 6.
5 Penentuan Kadar protein MetodeLowry
MetodeLowrydigunakan untuk mengetahui kadar protein (Lowryet al., 1951).
Sebanyak 0,1 mL enzim ditambahkan 0,9 mL akuades lalu direaksikan dengan 5
mL pereaksi C. Campuran diaduk secara merata dan dibiarkan selama 10 menit
pada suhu kamar. Kemudian ditambahkan dengan cepat 0,5 mL pereaksi D dan
diaduk dengan sempurna. Setelah itu didiamkan selama 30 menit pada suhu
dilakukan pada λ 600 nm. Konsentrasi protein enzim ditentukan dengan
menggunakan kurva standar BSA.
6 Penentuan Aktivitas Enzim MetodeFuwa
Aktivitasα-amilase ditentukan oleh metode iodin (Fuwa, 1954). Patisoluble
0,5% di dalam buffer asetat 0,1 M sebanyak 300μL ditambahkan dengan enzim
sebanyak 100μL dipanaskan pada suhu 55oC selama 10 menit lalu ditambahkan
0,2 M HCl sebanyak 40μL, ditambahkan larutan iodin 0,5 mL, dan ditambahkan
H2O hingga volumenya 10 mL, lalu diukur dengan spektrofotometer UV-VIS
padaλ700 nm. Kontrol dibuat dengan cara memanaskan enzim pada suhu 100oC
selama 30 menit. Aktivitas unit dihitung dari jumlah enzim yang mereduksi
warna biru 10% permenit.
7. Pengaruh Beberapa FaktorTerhadap Pertumbuhan Bakteri dan Produksi Enzim Amilase
a. Pengaruh Sumber N
Sumber N yang digunakan adalah pepton, NaNO3, CO(NH2)2dan NH4NO3.
Masing-masing sumber N sebesar 0,5% (w/v) ditambahkan ke dalam medium
standar. Medium kultur dengan komposisi tersebut kemudian diinokulasi dengan
starter dan ditumbuhkan seperti yang dijelaskan pada prosedur 4. Sampling
dilakukan pada rentang waktu 8, 24, 31, 48, dan 55 jam. Sampel kultur diukur
nilai OD, kadar protein, dan aktivitas enzim seperti pada prosedur 3, 5 dan 6.
Untuk sumber N terbaik kemudian dilakukan uji pengaruh variasi konsentrasi dari
b. Pengaruh Sumber C
Sumber C yang digunakan adalah glukosa, fruktosa, arabinosa, dan gula.
Masing-masing sumber C sebanyak 0,5% (w/v) ditambahkan ke dalam medium tanpa
perlakuan Medium kultur dengan komposisi tersebut kemudian diinokulasi
dengan starter dan ditumbuhkan seperti yang dijelaskan pada prosedur 4.
Sampling dilakukan pada setiap 24 jam selama 72 jam. Sampel kultur diukur nilai
OD, kadar protein, dan aktivitas enzim seperti pada prosedur 3, 5 dan 6. Untuk
sumber C terbaik kemudian dilakukan uji pengaruh variasi konsentrasi dari 0,5–
2 % (w/v) dan diukur sebagaimana tersebut di atas.
c Pengaruh Ion Logam
Sumber ion logam yang digunakan adalah MgSO4,ZnSO4, MnSO4,dan FeSO4.
Masing-masing sumber ion logam sebanyak 0,5% (w/v) ditambahkan ke dalam
medium tanpa perlakuan. Medium kultur dengan komposisi tersebut kemudian
diinokulasi dengan starter dan ditumbuhkan seperti yang dijelaskan pada prosedur
4. Sampling dilakukan pada rentang waktu 8, 24, 31, 48, dan 55 jam. Sampel
kultur diukur nilai OD, kadar protein, dan aktivitas enzim seperti pada prosedur 3,
5 dan 6. Untuk sumber ion logam terbaik kemudian dilakukan uji pengaruh
variasi konsentrasi dari 0,5–2% (w/v) dan diukur sebagaimana tersebut di atas.
d. Pengaruh pH
Medium yang digunakan untuk menginokulasi bakteri divariasikan pHnya dari pH
6 - 8. Medium kultur dengan komposisi tersebut kemudian diinokulasi dengan
dilakukan pada rentang waktu 8, 24, 31, 48, dan 55 jam. Sampel kultur diukur
nilai OD, kadar protein dan aktivitas enzim seperti pada prosedur 3, 5 dan 6.
Untuk pH terbaik kemudian dilakukan uji pengaruh variasi dari 6 - 8 dan diukur
Isolat Bakteri
Pengaruh Beberapa Faktor terhadap Pertumbuhan dan Produksi Enzim
Sumber N Sumber C Sumber Ion Logam
-diukur aktivitas dan kadar protein
-ditumbuhkan dalam medium tanpa perlakuan (24, 48, 72 jam)
A. Simpulan
Berdasarkan hasil yang diperoleh dari percobaan yang telah dilakukan maka
dapat ditarik simpulan sebagai berikut:
1. Kondisi optimum bagi pertumbuhan sel dan produksi enzim amilase isolat
LTE-6 adalah dengan menggunakan sumber N pepton 0,5% (w/v), sumber
C gula 0,5% (w/v), sumber ion logam Fe 0,5% (w/v) pada pH 6.0.
2. Bila dibandingkan dengan data yang dilaporkan oleh Mulatasih (2010),
maka kondisi kultur tersebut di atas memberikan pengaruh sebagai berikut:
• Pepton mempersingkat waktu produksi enzim yaitu 24 jam dengan
nilai aktivitas unit 9,8 U/ml.
• Gula memperlambat waktu produksi enzim menjadi 48 jam dengan
aktivitas unit 10,83 U/ml.
• Ion Fe pada kondisi sumber N dan sumber C optimum mampu
mengembalikan kecepatan produksi enzim ke 24 jam dengan
aktivitas unit 9,5 U/ml.
• pH 6.0 merupakan pH yang optimum bagi pertumbuhan sel dan
produksi enzim dengan aktivitas unit sebesar 8,7 U/ml dalam
B. Saran
Kondisi optimum yang diperoleh pada penelitian ini, kedepan diharapkan dapat
(Skripsi)
Oleh
KARTIKA FANDIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
niscaya Allah akan meninggikan orang-orang
yang beriman di antaramu dan orang-orang yang
diberi ilmu pengetahuan beberapa derajat. Dan
Allah Maha Mengetahui apa yang kamu kerjakan.
(QS. Al Mujaadilah : 11)
Tanda akal seseorang itu adalah pekerjaannya, dan
tanda ilmu seseorang itu adalah perkataannya.
(Imam Gozhali)
Orang yang luar biasa tidak pernah memperhatikan
hasil, tetapi mereka hanya memikirkan dan
mengerjakan prosesnya
(Asep Hilman)
If you want something you ve never had, you must
be willing to do something you ve never done
Penulis dilahirkan di Kotaagung, Tanggamus, Lampung pada tanggal 3 Mei 1988,
sebagai anak kedua dari tiga bersaudara, putri dari Bapak alm. Haryanto dan Ibu
Yuliana, S.Pd.
Jenjang pendidikan diawali dari Sekolah Dasar (SD) di SD Negeri 1 Pasar
Madang diselesaikan pada tahun 2000. Sekolah Menengah Pertama (SMP) di
SMP Negeri 1 Kotaagung diselesaikan pada tahun 2003, dan Sekolah Menengah
Atas (SMA) di SMA Negeri Alkautsar Bandar Lampung diselesaikan pada tahun
2006. Tahun 2006, penulis terdaftar sebagai Mahasiswa Jurusan Kimia FMIPA
Unila melalui jalur PKAB (Penelusuran Kemampuan Akademik dan Bakat).
Selama menjadi mahasiswa penulis pernah menjadi asisten praktikum Biokimia
untuk Fakultas Pertanian dan Jurusan Biologi Fakultas MIPA, serta menjadi
asisten mikrobiologi untuk Jurusan Analis Kimia Fakultas MIPA. Pada tahun
2008 penulis melakukan Praktek Kerja Lapangan di laboratorium Biokimia dan
Laboratorium Instrumentasi Jurusan Kimia FMIPA Unila, dan pada tahun 2010,
penulis memulai penelitiannya di tempat yang sama. Selama di Universitas,
penulis aktif dibeberapa organisasi internal diantaranya Rohis FMIPA sebagai
Kepala Biro Keputrian kepengurusan 2008/2009 dan Himaki sebagai anggota