ABSTRACT
ISOLATION, CHARACTERIZATION, AND ANTIOXIDANT ACTIVITY DETERMINATION OF ANTHOCYANINS FRACTION IN PURPLE
SWEET POTATO (Ipomea batatas)
By
Mirfat Salim Abdat
The extraction of the anthocyanins compound from purple sweet potato (Ipomea batatas) was performed by maceration method using aquadest + 0,1% concentrated HCl. Extract obtained from maceration concentrated by freeze drying method. Further separation using column chromatography with sephadex LH-20 as the stationary phase and methanol as the eluent. The separation continued by chromatotron method with buthanol: acetic acid: water (BAA) eluent with ratio 5: 1: 4. The purity of the compound was determined by TLC with BAA eluent (4: 1: 5).The isolated anthocyanins compound evidenced by TLC chromatogram showed one spot with BAA (4: 1: 5) eluent. Isolated compounds have a maximum wavelength at 281 nm and 522 nm, which indicates the isolated anthocyanin compounds as sianidin types. Determination of antioxidant activity performed by DPPH (2,2-diphenyl-1-picrylhydrazyl) method, EC50 value for crude extract is 1,0716 ppm and the EC50 value for isolated fraction is 2,5248 ppm.
ABSTRAK
ISOLASI, KARAKTERISASI, DAN UJI AKTIVITAS ANTIOKSIDAN FRAKSI ANTOSIANIN DALAM UMBI UBI JALAR UNGU
(Ipomea batatas)
Oleh
Mirfat Salim Abdat
Telah dilakukan isolasi antosianin dari umbi ubi jalar ungu (ipomoea batatas). Ekstraksi dilakukan dengan metode maserasi menggunakan pelarut akuades + 0,1% HCl pekat. Ekstrak hasil maserasi dipekatkan dengan menggunakan metode freeze drying. Selanjutnya dilakukan pemisahan dengan menggunakan kromatografi kolom dengan fasa diam sefadeks LH-20 dan eluen metanol. Pemisahan dilanjutkan dengan metode kromatotron dengan eluen BAA (5:1:4). Pengujian kemurnian senyawa dilakukan dengan metode KLT dengan eluen butanol: asam asetat: air (BAA) dengan perbandingan 4:1:5. Antosianin berhasil diisolasi dibuktikan dengan kromatogram KLT senyawa menunjukkan satu noda dengan eluen BAA (4:1:5). Senyawa hasil isolasi memiliki panjang gelombang maksimum pada 281 nm dan 522 nm, yang menunjukkan senyawa hasil isolasi merupakan golongan senyawa antosianin jenis sianidin. Pengujian aktivitas antioksidan dilakukan dengan metode DPPH (2,2-difenil-1-pikrilhidrazil), nilai EC50 untuk ekstrak kasar yaitu sebesar 1,0716 ppm dan nilai EC50 untuk senyawa hasil isolasi yaitu sebesar 2,5248 ppm.
ISOLASI, KARAKTERISASI, DAN UJI AKTIVITAS ANTIOKSIDAN FRAKSI ANTOSIANIN DALAM UMBI UBI JALAR UNGU
(Ipomea batatas)
(Skripsi)
Oleh
Mirfat Salim Abdat
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
iv
DAFTAR GAMBAR
Gambar Halaman
1. Ubi Jalar Ungu ... 5
2. Kerangka dasar flavonoid (Robinson, 1995) ... 7
3. Tiga jenis flavonoid (Achmad, 1986) ... 7
4. Struktur kimia dari beberapa jenis flavonoid (Tapas et al., 2008) ... 8
5. Kerangka dasar antosianidin dan namanya dengan substituen yang berbeda ... 9
6. Struktur silika penyusun fasa diam KLT (Sastrohamidjojo, 2002) ... 13
7. Corong pisah yang digunakan dalam ekstraksi cair-cair (Harvey, 2000) .... 14
8. Struktur kimia dari Sephadex LH-20 (Anonim, 2014) ... 16
9. Reaksi senyawa DPPH dan antioksidan (Pratiwi dkk.,2013) ... 22
10. Resonansi pada struktur DPPH (Pratiwidkk., 2013) ... 23
11. Kromatogram KLT ekstrak kasar dengan menggunakan eluen BAA ... 34
12. Pola KLT fraksi-fraksi pada KK7 menunjukkan adanya perbedaan ... 35
13. Pola KLT dari delapan kelompok fraksi yang didapatkan dari kromatografi kolom. ... 36
14. Kromatogram KLT fraksi-fraksi hasil kromatotron kedua ... 37
15. Spektrum UV-Vis senyawa hasil isolasi dalam pelarut 0,1% HCl dalam metanol. ... 38
16. Struktur senyawa sianidin-3-glukosida ... 38
v
18. Spektrum LC dari fraksi nomor 19 hasil kromatotron kedua. ... 40 19. Perubahan struktur antosianin menjadi kation flavilium dan hemiketal ... 41 20. Hasil KLT dari keempat sampel setelah disemprot dengan larutan DPPH
DAFTAR TABEL
Tabel Halaman
1. Kandungan pigmen antosianin dalam beberapa tanaman (Andarwulan dan Faradilla, 2012) ... 6 2. Sifat kimia dan fisika dari sefadeks LH-20 (Anonim, 2014) ... 16 3. Volume rata-rata sefadeks LH-20 setelah dikembangkan dalam pelarut
yang berbeda (Anonim, 2014) ... 17 4. Rentang serapan spektrum ultraungu-tampak untuk flavonoid (Markham,
MOTO
....”Sesungguhnya sesudah kesulitan itu ada kemudahan”. (Al -Insyirah : 6)
Rasulullah SAW bersabda : “Kerjakanlah apa yang bermanfaat untukmu, dan mintalah pertolongan kepada Allah. Jangan mudah menyerah, dan jangan pernah berkata
„kalau aku melakukan yang begini, pasti akan jadi begini‟. Tapi katakanlah, „Allah telah mentakdirkan, dan apa yang Dia kehendaki pasti akan Dia lakukan.” (Dalam La Tahzan –
Dr. „Aidh Al-Qarni)
Dan janganlah kamu (merasa) lemah, dan jangan (pula) bersedih hati, sebab kamu lebih tinggi (derajatnya), jika
PERSEMBAHAN
Kupersembahkan karya sederhana ini kepada :
Ayahanda Salim Abdat dan Ibunda Sri Dewi Wedani tercinta.
Adik-adikku tersayang Iqbal Salim Abdat dan Zayeed Salim Abdat.
Segenap keluarga besarku yang selalu mendoakan keberhasilanku.
Sahabat dan teman-temanku yang selalu berbagi kebahagiaan.
Seseorang yang kelak akan menjadi imamku.
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 12 Oktober 1994, sebagai anak pertama dari tiga bersaudara, dari Bapak Salim Abdat dan Ibu Sri Dewi Wedani. Penulis mulai menempuh pendidikan di TK Xaverius Sinar Laut, Kalianda, lulus pada tahun 1999 dan melanjutkan pendidikan di SD Negeri 2 Kalianda dan selesai pada tahun 2005. Kemudian penulis melanjutkan pendidikan di SMP Negeri 1 Kalianda dan selesai pada tahun 2008. Pada tahun yang sama, penulis melanjutkan pendidikan di SMA Negeri 1 Kalianda dan lulus pada tahun 2011. Pendidikan penulis dilanjutkan di Jurusan Kimia FMIPA Universitas Lampung pada tahun 2011 melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) Undangan.
SANWACANA
Alhamdulillahi robbil’alamin. Segala puji dan syukur hanya milik Allah SWT, Dzat yang senantiasa menganugerahkan ilmu pengetahuan kepada manusia dengan perantara kalam, sehingga atas kehendak dan izin-Nya penulis dapat menyelesaikan skripsi yang berjudul “Isolasi, Karakterisasi, Dan Uji Aktivitas Antioksidan Fraksi Antosianin Dalam Umbi Ubi Jalar Ungu (Ipomea
batatas)” dengan baik. Shalawat serta salam semoga selalu tercurah kepada Nabi Muhammad SAW beserta keluarga, sahabat, serta pengikutnya yang setia hingga Yaumil Akhir, amin.
Skripsi ini diajukan untuk memenuhi salah satu syarat memperoleh gelar sarjana pada Jurusan Kimia FMIPA Unila. Penyusunan skripsi ini tentu saja tidak akan terlaksana dengan baik tanpa adanya doa, bantuan, dukungan, serta dorongan dari berbagai pihak. Oleh karena itu, pada kesempatan ini penulis ingin menyampaikan terima kasih serta penghargaan sebesar-besarnya kepada semua pihak yang
terlibat langsung ataupun tidak langsung dalam proses penyusunan hingga terwujudnya skripsi ini, diantaranya kepada :
2. Ibu Dra. Husniati, M.Si. selaku pembimbing II penulis yang telah membimbing penulis, dan memberikan masukan-masukan yang sangat berguna dalam menyelesaikan skripsi ini.
3. Ibu Dr. Noviany, M.Si. selaku pembahas penulis yang telah memberikan bimbingan, arahan, dan nasihat kepada penulis sehingga skripsi ini dapat terselesaikan.
4. Bapak Andi Setiawan, Ph.D. selaku pembimbing akademik penulis, yang sejak awal penulis mulai menjadi mahasiswa, selalu memberikan nasihat dan arahan yang membangun, sehingga penulis dapat menempuh
pendidikan dengan baik di Jurusan Kimia, FMIPA, Unila ini.
5. Bapak Prof. Suharso, Ph.D. selaku dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
6. Bapak Dr. Eng. Suripto Dwi Yuwono, M.T. selaku ketua Jurusan Kimia FMIPA Unila dan seluruh Bapak dan Ibu dosen Jurusan Kimia FMIPA Unila atas ilmu yang telah diberikan kepada penulis selama penulis menuntut ilmu disini.
7. Terima kasih kepada BARISTAND selaku pemberi dana pada penelitan ini, sehingga penelitian ini bisa berjalan dengan lancar.
8. Mba Wiwit Kasmawati, selaku laboran Laboratorium Kimia Organik, atas bantuannya saat penulis melakukan penelitian di Laboratorium Kimia Organik.
10.Ribuan terima kasih yang takkan pernah cukup, penulis haturkan kepada kedua orang tua penulis, yang telah membesarkan, merawat, dan mendidik penulis dengan segala cinta, kasih sayang, dan kesabaran yang tulus. Serta kepada adinda Iqbal Salim Abdat dan adinda Zayeed Salim Abdat, atas segala cinta, keceriaan, dukungan, dan semangat yang diberikan kepada penulis.
11.Kakak-kakak tingkatku tersayang, Eka Eprianti, S.Si., M.Pd., Resca Ridhatama, S.Si., Purniawati, S.Si., Rhamadya Teta Parasta, S.Si., Mardiyah, S.Si., Chyntia Gustiyanda Patraini, S.Si., Rahmat Kurniawan, S.Si., M. Nurul Fajri, atas arahan, wejangan, dan motivasi yang telah diberikan kepada penulis.
12.Mychell Dendiko Pratangga, S.Si., atas segala pelajaran hidup, bimbingan, motivasi, semangat, dan kenangan manis yang pernah diberikan kepada penulis.
13.Partner penelitianku, Junaidi Permana dan Rio Febriansyah, yang telah memberikan semangat dan dukungan kepada penulis.
14.Rekan kerja Laboratorium Kimia Organik, Ridho Nahrowi, Jelita Siahaan, Yulia Ningsih, semoga selalu dilindungi dan dirahmati Allah SWT.
15.Yepi Triapriani dan Tiara Dewi Astuti, sebagai sahabat yang selalu memberikan nasihat dan selalu menjadi telinga yang mendengarkan curahan hati penulis, bahu tempat bersandar, dan tangan yang tidak pernah lepas menarik saat penulis merasa down.
Nurul Aini S.Si., Ayu Berliana, Ayu Fitriani, Aziez Nur Dwiansyah, Cindy Moyna Clara L.A., Daniar Febriliani P., Dewi Karlina S.Si., Dia Tamara, Endah Pratiwi, S.Si., Eva Dewi N. S., Fatimah Milasari, Fatma Maharani, Febri Windy Asmoro, Frederica Giofanny T.S., Irkham
Bariklana, Ivan Halomoan, S.Si., J. Julianser Nicho, Jelita Purnamasari S., Jelita Siahaan, S.Si., Junaidi Permana, Lewi Puji Lestari, Lusi Meliyana, S.Si., Mardian Bagus S., Mega Suci H.P., Melli Novita W., S.Si., Melly Antika, S.Si., Miftahur Rahman, S.Si., M. Andri Nosya, M. Yusry Ahmaddhani, Nico Mei Chandra, S.Si., Nira Dwi Puspita, Nopitasari, Pandegani Paraatmadja, Ramos Vicher, S.Si., Rina Wijayanti, Ridho Nahrowi, S.Si., Rio Wicaksono, Rio Febriansyah, Sanjaya Yudha
Gautama, Umi Fadillah, Uswatun Hasanah, Vevi Aristiani, Yulia Ningsih N., dan Yunia Hartina atas hari-hari penuh kenangan yang telah kita lalui bersama. Semoga persaudaraan kita tidak akan terpengaruh oleh waktu dan jarak.
17.Adik-Adik di Laboratorium Kimia Organik, Ismi Khomsiah, Ajeng Wulandari, Susi Isnaini, Putri Romadhona, Yepi Triapriani, Tiara Dewi Astuti, Tazkiya Nurul, Arif Nurhidayat, Radius Uly Artha, dan Ayu Setianingrum.
18.Seluruh mahasiswa kimia angkatan 2010, 2012, 2013, 2014, dan 2015. 19.Semua pihak yang telah mendukung penulisan skripsi ini, yang tidak dapat
Akhir kata, penulis memohon maaf kepada semua pihak apabila skripsi ini masih terdapat kesalahan dan kekeliruan, semoga skripsi ini dapat berguna dan bermanfaat sebagaimana mestinya, Aamiin.
Bandar Lampung, November 2015. Penulis,
DAFTAR ISI
Halaman
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
I. PENDAHULUAN A. Latar belakang ... 1
B. Tujuan penelitian ... 3
C. Manfaat penelitian ... 3
II. TINJAUAN PUSTAKA A. Ubi jalar ungu (I. Batatas) ... 4
B. Flavonoid ... 6
C. Antosianin ... 8
D. Teknik isolasi antosianin ... 11
1. Maserasi ... 11
2. Freeze drying ... 11
3. Kromatografi lapis tipis ... 12
4. Partisi (Ekstraksi cair-cair) ... 13
5. Kromatografi kolom ... 14
6. Kromatotron ... 17
E. Penentuan Struktur Antosianin ... 18
1. Spektrofotometri UV-Vis ... 18
2. SpektrofotometriLC-MS ... 20
ii
G. Pengujian Aktivitas Antioksidan Metode DPPH ... 21
III. METODE PENELITIAN A. Waktu dan Tempat Penelitian ... 24
B. Alat dan Bahan ... 24
1. Alat-alat yang digunakan ... 24
2. Bahan-bahan yang digunakan ... 24
C. Prosedur Penelitian ... 25
1. Pengumpulan dan persiapan sampel ... 25
2. Ekstraksi ... 25
3. Partisi ... 25
4. Pembuatan eluen Butanol: Asam Asetat: Air (4:1:5) ... 26
5. Kromatografi lapis tipis ... 26
6. Kromatografi kolom ... 26
7. Kromatotron ... 27
8. Analisis kemurnian ... 28
9. Spektrofotometri UV-Vis ... 28
10. Spektrofotometri LC-MS ... 28
11. Pengujian kandungan antosianin total (Supiyanti, dkk., 2010) ... 29
12. Pengujian aktivitas antioksidan metode DPPH (Supiyanti, dkk., 2010) ... 29
a. Metode Kualitatif ... 29
b. Metode Kuantitatif ... 30
IV. HASIL DAN PEMBAHASAN A. Persiapan dan ekstraksi sampel ... 32
B. Pemisahan dan pemurnian ... 34
C. Penentuan struktur senyawa antosianin ... 37
1. Spektroskopi ultraungu-tampak (UV-Vis) ... 37
2. Liquid Chromatography – Mass Spectroscopy (LC-MS) ... 40
D. Penentuan kandungan antosianin total dalam umbi ubi jalar ungu dengan metode perbedaan pH ... .. 41
E. Penentuan aktivitas antioksidan senyawa hasil isolasi ... 42
iii
2. Metode Kuantitatif ... 43
V. KESIMPULAN DAN SARAN A. Kesimpulan ... 45
B. Saran ... 46
DAFTAR PUSTAKA ... 47
LAMPIRAN ... 52
A. Penentuan kandungan antosianin total dalam umbi ubi jalar ungu dengan metode perbedaan pH (Supiyanti dkk., 2010). ... 52
B. Penentuan aktivitas antioksidan metode kuantitatif (Supiyanti dkk., 2010). ... 53
C. Diagram alir penelitian ... 56
I. PENDAHULUAN
A. Latar Belakang
Senyawa fenolik merupakan salah satu jenis yang utama dari senyawa metabolit sekunder. Senyawa fenolik memiliki struktur yang beragam, dan merupakan penyebab dari karakteristik organoleptik utama dari makanan dan minuman yang berasal dari tumbuhan, terutama warna dan rasanya. Senyawa fenolik juga berperan dalam kualitas nutrisi dari sayuran dan buah-buahan. Diantara jenis-jenis senyawa fenolik, flavonoid merupakan jenis seyawa fenolik yang paling banyak terdapat pada tanaman. Sejauh ini, lebih dari 8000 jenis senyawa flavonoid telah teridentifikasi (Tapas et al., 2008).
Salah satu senyawa yang termasuk dalam golongan flavonoid, yaitu antosianin, merupakan senyawa berwarna yang bertangggung jawab untuk kebanyakan warna merah, biru, dan ungu pada buah, sayur, dan tanaman hias. Antosianin umumnya terdapat dalam tumbuhan yang berwarna ungu, merah dan biru seperti cherry, raspberry, blackberry, blueberry, jeruk, tomat, anggur, red wine, jagung merah, bawang merah, kubis merah, kentang yang berkulit merah, terung, ubi jalar ungu, strawberry, dsb.
2
untuk mengobati penyakit hipertensi, pireksia, kelainan fungsi hati, disentri, diare, permasalahan saluran urin, dan demam biasa. Berbagai studi telah membuktikan bahwa ekstrak antosianin dapat memperbaiki pengelihatan, memiliki aktivitas antioksidan dan aktivitas penangkapan radikal, dapat pula berperan sebagai agen kemoprotektif. Antosianin juga memiliki sifat anti-diabetik seperti penurunan kadar lemak, sekresi insulin, dan efek vasoprotektif (Shipp and Abdel-Aal, 2010).
Salah satu sumber antosianin yang murah dan banyak terdapat di Indonesia adalah pada ubi jalar ungu karena pada ubi jalar ungu memiliki kandungan antosianin yang lebih besar dari pada ubi jalar dengan varietas yang lain.
Dipilihnya ubi jalar ungu dalam penelitian ini karena komoditas ini telah banyak di Indonesia, khususnya di Pulau Jawa sehingga mudah didapat, harganya relatif murah, tidak memberikan efek merugikan bagi kesehatan, memiliki kulit dan daging yang berwarna ungu sehingga kaya akan pigmen antosianin yang lebih tinggi bila dibandingkan dengan varietas lain sehingga dapat digunakan sebagai pewarna baik untuk minuman maupun untuk makanan (Winarti dkk., 2008).
Elham et al., (2006) telah mengekstrak antosianin dalam wortel hitam (Daucus carota L.) berupa serbuk kering jenis sianidin-3-glukosida sebanyak 434,83 mg/kg sampel. Jadmiko dan Ciptati (2013) mengisolasi senyawa
antosianin dari ubi jalar ungu. Antosianin yang didapatkan sebesar 0,132 g/100 g sampel basah. Dari hasil karakterisasi diketahui bahwa antosianin yang dikandung pada ubi jalar ungu ialah petunidin dan sianidin.
Antosianin merupakan senyawa yang diketahui dapat berfungsi sebagai antioksidan, sehingga perlu dilakukan pengujian aktivitas antioksidan terhadap antosianin hasil isolasi. Uji aktivitas antioksidan ini dilakukan dengan
2,2-difenil-1-3
pikrilhidrazil (DPPH) (Prakash dkk., 2013). Dalam pengukuran dengan metode DPPH ini, digunakan senyawa lain yang bersifat antioksidan kuat sebagai senyawa standar. Senyawa yang umum digunakan yaitu senyawa asam askorbat (vitamin C).
Pada penelitian ini, telah diisolasi senyawa antosianin dari umbi ubi jalar ungu (I. batatas). Selanjutnya antosianin hasil isolasi dikarakterisasi
menggunakan spektrofotometri UV-Vis dan spektrofotometri LC-MS, dan diuji aktivitas antioksidannya dengan metode DPPH dan dibandingkan dengan senyawa asam askorbat (vitamin C).
B. Tujuan Penelitian
Tujuan penelitian ini adalah
1. Mengisolasi senyawa antosianin dari umbi ubi jalar ungu (I. batatas) 2. Menentukan jenis senyawa antosianin yang diisolasi.
3. Menentukan kadar antosianin total dalam umbi ubi jalar ungu.
4. Menguji aktivitas antioksidan dari senyawa antosianin yang diisolasi.
C. Manfaat Penelitian
II. TINJAUAN PUSTAKA
A. Ubi Jalar Ungu (I. batatas)
Ubi jalar diduga merupakan tanaman yang berasal dari Amerika Tengah. Diperkirakan pada abad ke-16, tanaman ubi jalar tersebut mulai tersebar ke negara-negara tropis di seluruh dunia termasuk Indonesia. Pada tahun 1960, ubi jalar sudah tersebar ke hampir setiap provinsi di Indonesia. Adapun 5 daerah sentra produksi ubi jalar terbesar di Indonesia adalah Jawa Barat, Jawa Tengah, Jawa Timur, Papua, dan Sumatra. Namun, pada saat ini, baru Papua sajalah yang memanfaatkan ubi jalar sebagai makanan pokok, walaupun belum menyamai padi, jagung, dan ubi kayu (singkong) (Suprapti, 2003).
Adapun taksonomi dari tumbuhan ubi jalar ungu ditampilkan sebagai berikut :
Kingdom : Plantae
Divisio : Spermatophyta Subdivisio : Angiospermae Kelas : Dicotyledonae Ordo : Convolvulus Familia : Convolvulaceae Genus : Ipomoea
5
Terdapat banyak sekali varietas ubi jalar. Ada yang berwarna putih, kuning, oranye, merah, atau ungu. Semakin gelap warnanya, akan semakin baik karena menunjukkan bahwa kandungan senyawa karotennya juga lebih tinggi. Selain sebagai sumber karoten, ubi jalar juga mengandung vitamin C, vitamin B6, vitamin B2, mangan, tembaga biotin, asam pantothenat, dan serat. Setiap 100 gram ubi jalar mengandung sekitar 8,4 gram gula; 2 gram protein; 20,7 gram
karbohidrat; 3,3 gram serat; dan 90 kalori. Ubi jalar termasuk memiliki nilai GL rendah (8,6) dan GI sedang (54) sehingga sangat cocok sebagai sumber kalori diabetesi. Secara tradisional, ubi jalar telah digunakan oleh diabetesi sebagai pengganti nasi karena diyakini mengandung kalori yang lebih rendah.Gambar dari ubi jalar ungu ditunjukkan pada Gambar 1.
Gambar 1.Ubi Jalar Ungu.
6
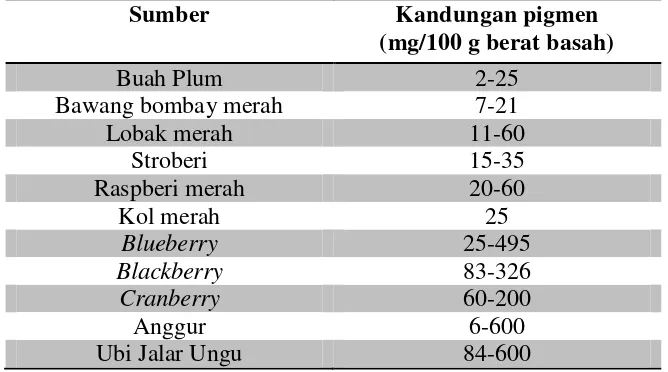
Tabel 1. Kandungan pigmen antosianin dalam beberapa tanaman (Andarwulan dan Faradilla, 2012).
Sumber Kandungan pigmen
(mg/100 g berat basah)
Buah Plum 2-25
Bawang bombay merah 7-21
Lobak merah 11-60
Stroberi 15-35
Raspberi merah 20-60
Kol merah 25
Flavonoid adalah sebuah kelas metabolit sekundertanaman.Flavonoid merupakan kandungan khas tumbuhan hijau dengan mengecualikan alga, dan hornwort. Flavonoid sebenarnya terdapat pada semua bagian tumbuhan termasuk daun, akar, kayu, kulit, tepung sari, nektar, bunga, buah buni, dan biji. Hanya sedikit saja catatan yang melaporkan adanya flavonoid pada hewan, misalnya dalam kelenjar bau berang-berang, „propolis‟ (sekresi lebah) dan di dalam sayap kupu-kupu; itu pun dengan anggapan bahwa flavonoid tersebut berasal dari
tumbuhan yang menjadi makanan hewan tersebut dan tidak di biosintesis di dalam tubuh mereka (Markham, 1988). Senyawa flavonoid adalah senyawa yang
7
Gambar 2. Kerangka dasar flavonoid (Robinson, 1995).
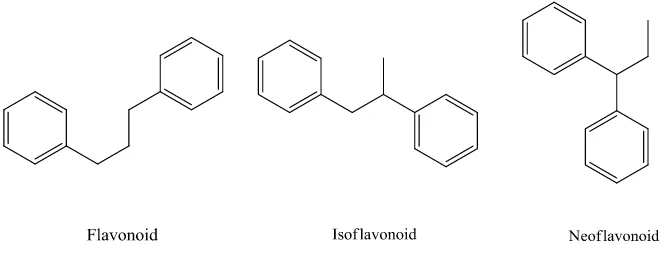
Susunan ini dapat menghasilkan tiga jenis struktur, yaitu flavonoid (1,3-diaril propana), isoflavonoid (1,2-(1,3-diaril propana), neoflavonoid (1,1-(1,3-diaril propana) seperti ditunjukkan pada Gambar 3.
Gambar 3. Tiga jenis flavonoid (Achmad, 1986).
8
menyebabkan flavonoid kurang efektif dan lebih mudah larut dalam air sehingga memungkinkan penyimpanan flavonoid (termasuk antosianin) di dalam vakuola sel, tempat di mana flavonoid bisa ditemukan (Markham, 1988).
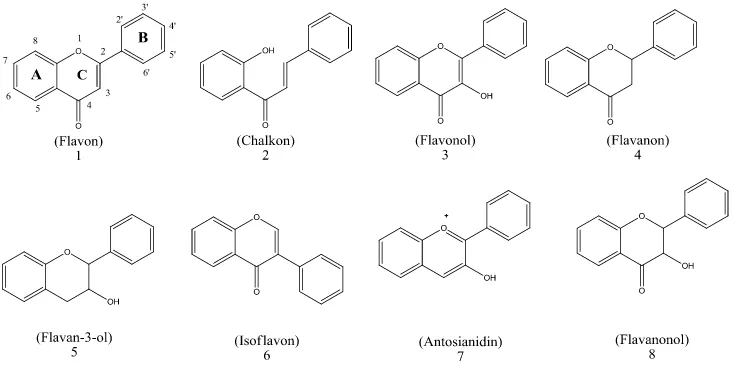
Senyawa flavonoid terdiri dari beberapa jenis, tergantung pada tingkat oksidasi rantai propana dari sistem 1,3-diaril propana. Struktur kimia dari beberapa jenis flavonoid ditunjukkan pada Gambar 4.
Gambar 4. Struktur kimia dari beberapa jenis flavonoid (Tapas et al., 2008).
C. Antosianin
Antosianin ialah pigmen daun bunga merah sampai biru yang biasa, (meskipun apigenidin kuning), banyaknya sampai 30% bobot kering dalam beberapa bunga. Antosianin terdapat juga dalam bagian lain tumbuhan tinggi dan seluruh dunia tumbuhan kecuali fungus. Tidak seperti golongan flavonoid lain, antosianin tampaknya selalu terdapat dalam bentuk glikosida kecuali aglikon antosianidin (Robinson, 1995).
9
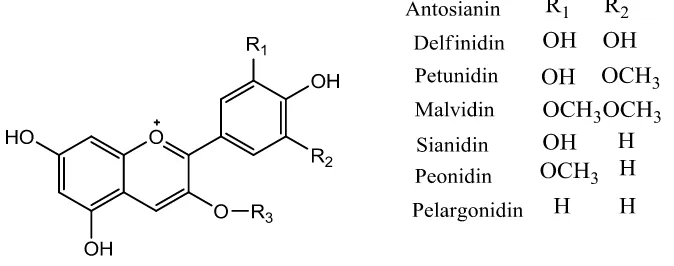
yang berwarna merah lembayung. Warna jingga disebabkan oleh pelargonidin yang gugus hidroksilnya kurang satu dibandingkan sianidin, sedang warna merah senduduk, lembayung, dan biru umumnya disebabkan oleh delfinidin yang gugus hidroksilnya lebih satu dibandingkan sianidin. Tiga jenis ester metil antosianidin juga sangat umum, yaitu peonidin yang merupakan turunan sianidin serta
petunidin dan malvidin yang terbentuk dari delfinidin. Masing-masing antosianidin tersebut sebagai sederetan glikosida (yaitu sebagai antosianin) dengan berbagai gula yang terikat. Keragaman utama adalah sifat gulanya (sering kali glukosa, tetapi mungkin juga galaktosa, ramnosa, xilosa, atau arabinosa), jumlah satuan gula (mono-, di-, atau triglikosida), dan letak ikatan gula (biasanya pada 3-hidroksi atau pada 3- dan 5-hidroksi) (Harborne, 1996).
Kerangka dasar antosianin dan jenis-jenis aglikon antosianin yang biasa ditemukan pada tanaman ditampilkan pada Gambar 5.
Gambar 5. Kerangka dasar antosianidin dan namanya dengan substituen yang berbeda.
10
kemungkinan esterifikasi pada gula. Saat ini telah ditemukan 19 jenis antosianidin yang terdapat di alam. 6 jenis antosianidin yang paling umum terdapat pada tanaman-tanaman pangan yaitu, pelargonidin, peonidin, cyanidin, malvidin, petunidin, dan delfinidin. Peonidin dan sianidin tersubstitusi pada posisi 3‟ dan 4‟;
petunidin, malvidin dan delfinidin tersubstitusi pada posisi 3‟, 4‟, dan 5‟;
sedangkan pelargonidin hanya tersubstitusi pada satu posisi (Welch et al., 2008). Sifat fisika dan kimia dari antosianin dilihat dari kelarutan antosianin larut dalam pelarut polar seperti metanol, aseton, atau kloroform, terlebih sering dengan air dan diasamkan dengan asam klorida atau asam format (Socaciu, 2007). Antosianin stabil pada pH 3,5 dan suhu 50°C mempunyai berat molekul 207,08 gram/mol dan rumus molekul C15H11O (Fennema, 1996). Antosianin dilihat dari penampakan berwarna merah, ungu dan biru mempunyai panjang gelombang maksimum 515-545 nm, bergerak dengan eluen BAA (n-butanol-asam asetat-air) (Harborne, 1996).
Sumber senyawa antosianin selain yang telah ditampilkan pada Tabel 1, yaitu Manggis (Chaovanalikit et al., 2012), kopi (Murthy et al., 2012), buah senggani (Kristiana dkk., 2012), blackberry dan sweet cherry (Oancea et al., 2013), bunga rosella (Moulana et al., 2012), buah sikaduduk ( Arja dkk., 2013), wortel hitam (Turker et al., 2004), buah arben (Tensiska dkk., 2007), buah salam (Ariviani, 2010) dll.
11
akar, atau biji. Campuran atau ekstrak yang kaya kandungan antosianin (walaupun belum dimurnikan), sejak dahulu telah digunakan untuk mengobati kondisi yang bermacam-macam, seperti hipertensi, pireksia, kelainan pada hati, disentri dan diare, permasalahan saluran urin seperti batu ginjal dan infeksi saluran kemih, serta demam biasa. Antosianin bahkan telah dikembangkan untuk memperbaiki pengelihatan dan sirkulasi darah ( Konczak and Zhang, 2004).
D. Teknik Isolasi Antosianin
1. Maserasi
Maserasi merupakan salah satu metode ekstraksi padat-cair. Prinsip teknik ini yaitu sampel ditempatkan dalam suatu wadah yang bertutup, dan selanjutnya ditambahkan pelarut yang dapat melarutkan analit yang
diinginkan. Sampel dibiarkan berada dalam pelarut selama beberapa jam hingga satu malam hingga ekstraksi berjalan optimal. Selama proses maserasi, sampel diaduk secara berkala.Selanjutnya larutan dipisahkan dari padatan sampel dengan menggunakan kertas saring atau dapat juga didekantir atau disentrifugasi untuk memisahkan larutan dari padatan yang tidak larut (Settle, 1997).
2. Freeze Drying
12
sehingga kandungan senyawa didalamnya tidak terdekomposisi atau hancur. Freeze drying atau liofilisasi adalah suatu metode pengeringan sampel tanpa menggunakan panas. Metode ini cocok dilakukan untuk sampel yang sensitif terhadap panas, sampel yang mengandung senyawa yang mudah teroksidasi dalam kondisi panas (termolabil), atau sampel yang memiliki kandungan analit yang volatil. Freeze drying mula-mula dilakukan dengan membekukan sampel, selanjutnya kandungan air di dalamnya dikeluarkan dari sampel yang beku tersebut dengan bantuan vakum (Settle, 1997).
3. Kromatografi Lapis Tipis
Kromatografi adalah teknik pemisahan dua atau lebih senyawa atau ion dengan cara distribusi senyawa tersebut diantara dua fase, yang satu bergerak, dan fase yang lainnya diam. Kedua fase ini dapat berupa padat-cair, cair-padat-cair, gas-padat, atau gas-cair. Kromatografi lapis tipis (KLT) adalah jenis kromatografi padat-cair, dengan fasa diamnya biasanya absorbent polar dan fasa geraknya dapat berupa satu jenis pelarut atau berupa campuran. KLT merupakan teknik pemisahan skala mikro yang cepat dan murah yang dapat digunakan untuk :
Menentukan jumlah komponen dalam campuran
Menguji identitas suatu senyawa
Memantau perkembangan suatu reaksi
Menentukan kondisi yang cocok untuk kromatografi kolom
13
pelarut. Pada KLT, fasa diam biasanya berupa alumina (Al2O3.xH2O)n atau silika gel (SiO2.xH2O)n. Ikatan kovalen pada absorben ini menyebabkan material ini sangat polar. Struktur silika ditunjukkan pada Gambar 6. (Sastrohamidjojo, 2002).
Gambar 6. Struktur silika penyusun fasa diam KLT (Sastrohamidjojo, 2002).
Untuk menghitung secara kualitatif, KLT juga memiliki pengukuran secara kromatografi yang dikenal sebagai nilai Rf. Nilai Rf merupakan nilai faktor retensi suatu senyawa yang nilainya berupa angka desimal. Nilai Rf dapat dihitung dengan cara:
R
f=
4. Partisi (ekstraksi cair-cair)
14
awalnya, zat terlarut hanya berada dalam satu fase, tetapi setelah ekstraksi zat terlarut terbagi menjadi terlarut dalam dua fase (Harvey, 2000). Untuk melakukan partisi, digunakan alat yang bernama corong pisah seperti yang ditunjukkan pada Gambar 7.
Gambar 7. Corong pisah yang digunakan dalam ekstraksi cair-cair (Harvey,2000).
5. Kromatografi Kolom
Kromatografi kolom adalah teknik pemisahan yang umum dan sangat berguna dalam kimia organik. Metode pemisahan ini memiliki prinsip yang sama dengan KLT, tapi dapat diaplikasikan untuk
memisahkan sampel dalam jumlah yang lebih besar dibandingkan KLT. Kromatografi kolom dapat digunakan baik dalam skala besar maupun skala kecil. Teknik ini dapat diaplikasikan pada berbagai disiplin ilmu, seperti biologi, biokimia, mikrobiologi, dan obat-obatan. Banyak jenis antibiotik yang telah dimurnikan dengan kromatografi kolom.
15
Sebagaimana pada metode KLT, alumina dan silika gel merupakan fasa diam yang paling populer digunakan dalam kromatografi kolom. Dengan menggunakan fasa diam ini, sampel yang lebih polar akan lebih lama berikatan dengan fasa diam, sementara sampel yang kurang polar akan terelusi terlebih dahulu dari kolom, diikuti dengan komponen dengan kepolaran yang semakin meningkat secara berurutan (Sastrohamidjojo, 2002).
Selain alumina dan silika gel, fasa diam yang biasa digunakan dalam kromatografi kolom adalah Sefadeks LH-20. Sefadeks LH-20 memisahkan komponen sampel berdasarkan ukuran molekulnya. Metode ini biasanya digunakan untuk memisahkan steroid, terpenoid, lipid, dan peptida dengan bobot molekul yang rendah (sekitar lebih dari 35 residu asam amino).
16
Gambar 8. Struktur kimia dari Sefadeks LH-20 (Anonim, 2014).
Beberapa sifat fisika dan kimia secara umum dari Sefadeks LH-20 ditampilkan pada Tabel 2.
Tabel 2. Sifat kimia dan fisika dari Sefadeks LH-20 (Anonim, 2014).
Parameter Keterangan
Ukuran partikel Kering : 18-111 µm Dalam Metanol : 27-163 µm Stabil dalam pH 2-13
Kestabilan kimia Stabil dalam sebagian besar larutan berair dan sistem pelarut
organik
Tidak stabil dalam pH < 2, dan dengan adanya agen oksidator Temperatur operasi 4 sampai 40o C
Daya simpan 5 tahun
17
pelarut yang hanya mengembangkan Sefadeks LH-20 hingga volume < 2,5 mL/g gel kering biasanya tidak digunakan.
Tabel 3. Volume rata-rata Sefadeks LH-20 setelah dikembangkan dalam pelarut yang berbeda (Anonim, 2014).
Pelarut Volume rata-rata (mL/gram gel
kering) Dimetil Sulfoksida 4.4–4.6
Piridina 4.2–4.4
Tetrahidrofuran 3.3–3.6
Dioxan 3.2–3.5
Aseton 2.4–2.6
Asetonitril 2.2–2.4
Karbon tetraklorida 1.8–2.2
Benzena 1.6–2.0
Ethil asetat 1.6–1.8
Toluena 1.5–1.6
6. Kromatotron
Kromatografi digunakan pada beberapa teknik pemisahan
18
spesies dapat berpisah sepanjang “migration medium”. Ketiga harus terdapat gaya tolakan selektif. Gaya yang terakhir ini dapat menyebabkan pemisahan dari bahan kimia yang dipertimbangkan (Sienko et al., 1984).
Kromatotron memiliki prinsip yang sama seperti kromatografi klasik dengan aliran fase gerak yang dipercepat oleh gaya sentrifugal. Kromatografi jenis ini menggunakan rotor yang dimiringkan dan terdapat dalam ruang tertutup oleh plat kaca kuarsa, sedangkan lapisan
penyerapnya berupa plat kaca yang dilapisi silika gel. Plat tersebut
dipasang pada motor listrik dan diputar dengan kecepatan 800 rpm. Pelarut pengelusi dimasukkan kebagian tengah plat melalui semacam alat infus, sehingga dapat mengalir dan merambat melalui plat silica karena adanya gaya sentrifugal.
Untuk mengetahui jalannya proses elusi, dimonitor dengan
menggunakan lampu UV. Gas nitrogen dialirkan kedalam ruang plat untuk mencegah pengembunan pelarut pengelusi dan mencegah oksidasi sampel. Pemasukan sampel diikuti dengan pengelusian menghasilkan pita-pita komponen berupa lingkaran sepusat. Pada tepi plat, pita-pita akan terputar keluar dengan gaya sentrifugal dan di tampung dalam botol fraksi,
diidentifikasi dengan KLT (Hossettmann et al., 1995).
E. Penentuan Struktur Antosianin
1. Spektrofotometri UV-Vis
Dalam spektoskopi UV-VIS penyerapan sinar tampak dan
19
energi elektronik molekul tersebut. Transisi tersebut pada umumnya antara orbital ikatan, orbital non-ikatan atau orbital anti-ikatan. Panjang gelaombang serapan yang muncul merupakan ukuran perbedaan tingkat-tingkat energi dari orbital suatu molekul (Sudjadi, 1983).
Metode Spektrofotometri ini berguna untuk mengetahui jenis flavonoid. Selain itu, kedudukan gugus fungsi hidroksil pada inti flavonoid dapat ditentukan dengan cara menambahkan pereaksi geser ke dalam larutan cuplikan dan mengamati pergeseran puncak yang terjadi. Spektrum khas flavonoid terdiri dari dua pita yaitu pada rentang 240-285 nm (Pita II) dan 300-550 nm (Pita I). Letak serapan pita tepat dan kekuatan dari pita tersebut akan memberikan informasi yang berguna mengenai sifat flavonoid (Markham, 1988). Rentang utama yang diperkirakan untuk setiap jenis flavonoid dapat dilihat pada Tabel 4.
Tabel 4. Rentang serapan spektrum ultraungu-tampak untuk flavonoid.
Pita II Pita I (nm) Jenis Flavonoid
250-280 310-350 Flavon
250-280 330-360 Flavonol (3-OH tersubstitusi) 250-280 350-385 Flavonol (3- OH bebas) 245-275 310-330 Isoflavon
275-295 300-390 Flavanon dan dihidroflavon 230-270 340-390 Calkon
230-270 380-430 Auron
270-280 465-560 Antosianidin dan antosianin
Dengan menggunakan data yang diperoleh dari analisis
20
Absorbansi (A) ini diperoleh dari data spektrum dimana terdapat puncak-puncak serapannya. Tebal sel (b) adalah ketebalan sel dalam alat yang digunakan, sedangkan konsentrasi (c) dapat diperoleh dengan menggunakan persamaan :
Konsentrasi (c) =
Keterangan: g = Massa senyawa hasil isolasi (gram) BM = Berat molekul relatif (gram/mol) L = Volume larutan yang digunakan (L)
2. Spektrofotometri LC- MS
21
Instrumen yang digunakan untuk melakukan kromatografi cair (LC) disebut liquid chromatograph. LC-MS yang digunakan adalah LC-MS jenis Shimadzu LC-20AD (Prominence Liquid Chromatography) Ultra Fast Liquid Chromatography (UFLC) dengan Spektrofotometri massa jenis AB SCIEX Triple quadrupole ion Trap (3200 Q TRAP LC/MS/MS System).
F. Pengukuran Kadar Antosianin Total Dengan Metode Perbedaan pH. Salah satu jenis senyawa flavonoid yang terkandung dalam ekstrak umbi ubi jalar ungu adalah antosianin. Karena itu perlu dilakukan penghitungan kadar antosianin total dalam ekstrak umbi ubi jalar ungu. Metode yang digunakan adalah metode perbedaan pH yang prinsipnya adalah mengukur absorbansi warna ungu dari antosianin dalam sistem pelarutnya pada panjang gelombang 520 nm dan 700 nm (Ariviani, 2010).
G. Pengujian Aktivitas Antioksidan Metode DPPH
Radikal bebas adalah suatu senyawa atau molekul yang mengandung satu atau lebih elektron tidak berpasangan pada orbital luarnya. Adanya elektron tidak berpasangan menyebabkan senyawa tersebut sangat reaktif mencari pasangan, dengan cara menyerang dan mengikat elektron yang berada di sekitarnya sehingga dapat memicu timbulnya penyakit (Sunarni, dkk., 2007).
22
antioksidan alami merupakan antioksidan hasil ekstraksi bahan alami dan antioksidan buatan (sintetik) merupakan antioksidan yang diperoleh dari hasil sintesa reaksi kimia. Karakter utama senyawa antioksidan adalah kemampuannya menangkap radikal bebas (Prakash, 2001). Antosianin diketahui dapat berfungsi sebagai antioksidan (Jordheim, 2007), sehingga nilai aktivitas antioksidan dari senyawa antosianin tertentu dapat diukur.
Pengujian aktivitas antioksidan dapat dilakukan dengan metode DPPH (2,2 difenil-1-pikrilhidrazil). Metode DPPH memberikan informasi reaktivitas
senyawa yang diuji dengan suatu radikal stabil. DPPH memberikan serapan kuat pada panjang gelombang 517 nm dengan warna violet gelap. Penangkap radikal bebas menyebabkan elektron menjadi berpasangan yang kemudian menyebabkan penghilangan warna yang sebanding dengan jumlah elektron yang diambil (Sunarni, dkk.,2007). Struktur DPPH sebelum dan setelah bereaksi dengan senyawa antioksidan ditunjukkan pada Gambar 9.
23
DPPH merupakan bentuk seyawa radikal yang stabil, karena DPPH dapat mengalami perpindahan elektron (resonansi) pada strukturnya. Gambar resonansi pada struktur DPPH ditampilkan pada Gambar 10.
Gambar 10. Resonansi pada struktur DPPH (Pratiwi dkk., 2013).
Metode DPPH dapat digunakan untuk sampel padat maupun cairan, dan tidak spesifik kepada salah satu bagian komponen antioksidan, melainkan
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Januari 2015 – Juli 2015, bertempat di Laboratorium Kimia Organik, Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung. Analisis spektroskopi yang digunakan adalah spektroskopi LC-MS dilakukan di LIPI Serpong, dan spektroskopi
Ultraungu-tampak (UV-Vis) dilakukan di Laboratorium Biokimia, Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
B. Alat dan Bahan
1. Alat-alat yang digunakan
Alat-alat yang digunakan dalam penelitian ini meliputi alat-alat gelas, penguap putar vakum, freeze dryer, satu set alat kromatografi kolom (KK), satu set alat kromatotron, lampu UV, pipet kapiler, spektrofotometer ultraungu-tampak (UV-Vis), dan spektrofotometer Massa.
2. Bahan-bahan yang digunakan
Bahan yang digunakan adalah umbi ubi jalar ungu (Ipomea batatas) yang diperoleh dari Desa Cilembu, Kecamatan Pamulihan,
25
analisis spektrofotometer berkualitas pro-analisis (p.a). Bahan kimia yang dipakai meliputi etil asetat (EtOAc), metanol (MeOH), butanol , n-heksana, akuades (H2O), HCl pekat, asam asetat glasial, sefadeks LH-20 untuk kromatografi kolom, untuk KLT digunakan plat KLT silika gel Merck kiesegel 60 F254 0,25 mm.
C. Prosedur Penelitian
1. Pengumpulan dan persiapan sampel
Sampel berupa umbi ubi jalar ungu selanjutnya dilakukan
determinasi untuk menentukan spesies di Herbarium Bogoriensis bidang Botani Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong, Jawa Barat.
Sampel kemudian dicuci dengan air, disikat, dikeringkan dengan tisu, dan diiris tipis. Selanjutnya sampel dicuci dengan pelarut n-heksana.
2. Ekstraksi
Sebanyak 1kg umbi ubi jalar ungu yang telah disiapkan,dimaserasi dengan aquadest + 0,1%HCl pekat selama 24 jam, maserasi dilakukan sebanyak tiga kali. Ekstrak aquadest yang diperoleh disaring kemudian dipekatkan dengan menggunakan alat freeze drying hingga didapatkan ekstrak pekat berwarna merah.
3. Partisi
26
volume ekstrak pekat. Campuran dikocok, dan dibiarkan hingga terlihat pemisahan yang sempurna. Fase atas dan fase bawah dipisahkan. Fase atas merupakan fase etil asetat berwarna kuning dan fase bawah merupakan fase aquades berwarna merah.
4. Pembuatan Eluen Butanol : Asam Asetat : Air (4: 1: 5)
Eluen BAA dibuat dengan cara mencampurkan 40 mL butanol, 10 mL asam asetat glasial, dan 50 mL aquades di dalam corong pisah.
Campuran dikocok, dan disetimbangkan selama 1 malam hingga terbentuk 2 fasa larutan. Yang digunakan sebagai eluen yaitu fasa atas sedangkan fasa bawahnya tidak digunakan.
5. Kromatografi Lapis Tipis
Sebelum difraksinasi, terlebih dahulu dilakukan uji KLT untuk melihat pola pemisahan komponen-komponen senyawa yang terdapat dalam ekstrak kasar. Uji KLT dilakukan menggunakan sistem campuran eluen menggunakan pelarut n-butanol : asam asetat : air (4: 1: 5). Bercak/noda dilihat dibawah lampu UV setelah dilakukan elusi terhadap plat KLT. Rf (Retention factor) dari setiap noda yang terbentuk dihitung dan dicatat.
6. Kromatografi Kolom
27
(tidak berongga) dan rata. Selanjutnya sampel dimasukkan ke dalam kolom yang telah berisi fasa diam dengan cara mengalirkan sampel secara perlahan melalui dinding kolom menggunakan pipet tetes. Pada saat sampel dimasukkan, usahakan supaya kolom tidak kering/kehabisan pelarut karena akan mengganggu fasa diam yang telah dikemas rapat, sehingga proses elusi akan terganggu. Proses memasukkan sampel juga harus dilakukan dengan hati-hati supaya tidak merusak permukaan fasa diam. Selanjutnya eluen dituangkan dengan hati-hati kedalam kolom dan proses elusi dimulai dan fraksi yang keluar ditampung dengan
menggunakan botol gelap dan diberi label.
7. Kromatotron
Pemurnian senyawa selanjutnya dilakukan dengan metode
kromatotron. Fraksi-fraksi hasil kromatografi kolom dimurnikan kembali dengan menggunakan metode kromatotron. Eluen yang akan digunakan untuk pemurnian menggunakan kromatotron adalah pelarut BAA (5:1:4) dan plat yang digunakan memiliki ketebalan 2 mm.
Pertama, plat dipasang pada rotor dan diputar dengan kecepatan 800 rpm. Selanjutnya plat dibasahi dengan cara mengalirkan pelarut nonpolar, yaitu n-heksana, melalui inlet yang digunakan untuk
28
Eluen BAA dimasukkan ke dalam alat infus, dan laju alir eluen diatur sekitar 4-6 mL per menit. Eluen BAA dialirkan menggunakan selang infus melalui inlet sehingga plat terbasahi dengan eluen BAA. Proses elusi dilakukan hingga semua sampel yang ada pada plat telah terelusi ke luar dari plat. Fraksi-fraksi ditampung ke dalam botol gelap dan diberi label.
8. Analisis Kemurnian
Uji kemurnian dilakukan dengan metode KLT. Uji kemurnian secara KLT menggunakan beberapa campuran eluen. Kemurnian senyawa ditunjukkan dengan timbulnya satu noda pada plat KLT.
9. Spektrofotometri UV-Vis
Sampel berupa larutan antosianin dalam metanol-HCl 0,1% diencerkan sebanyak 30 kali. Pertama, dilakukan pengukuran nilai absorbansi blanko. Blanko yang digunakan berupa larutan metanol-HCl 0,1%. Selanjutnya diukur absorbansi sampel. Pengukuran dilakukan pada panjang gelombang 200-800 nm. Nilai serapan maksimum untuk senyawa antosianin adalah sekitar 500-545 nm (Jadmiko dan Ciptati, 2013).
10. Spektrofotometri LC-MS
29
11. Pengujian Kandungan Antosianin Total (Supiyanti dkk., 2010). Umbi ubi jalar ungu yang telah diblender halus dilarutkan dengan dapar KCl pH 1,0 dan dengan dapar CH3COONa.3H2O pH 4,5. Lalu larutan dengan kondisi pH yang berbeda tersebut diukur serapannya pada panjang gelombang 520 nmdan 700 nm.
Kandungan antosianin total dalam umbi ubi jalar ungu dihitung menggunakan perhitungan dengan koefisien ekstingsi molar ( ) sebesar 29.600 (berdasarkan koefisien ekstingsi molar dari sianidin-3-glukosida) dan bobot molekul sebesar 449,2 sebagai berikut:
Keterangan :
A = (A520nm – A700nm)pH 1 – (A520nm – A700nm)pH4,5 MW = Bobot molekul
ε = Koefisien ekstingsi molar (L x mol-1 x cm-1) DF = Faktor Pengenceran
1 = Tebal kuvet (1 cm).
12. Pengujian Aktivitas Antioksidan metode DPPH (Supiyanti dkk., 2010).
a. Metode Kualitatif
30
Komponen ekstrak yang bersifat antioksidan menghasilkan bercak kuning pucat dengan latar belakang ungu dalam waktu 30 menit.
b. Metode Kuantitatif
Penentuan aktivitas antioksidan dilakukan dengan cara sebanyak 4,0 mL DPPH 0,1 mM dimasukkan ke dalam tabung reaksi, ditambahkan 50 µL ekstrak dengan kadar tertentu (0,04%; 0,08%; 0,12%; 0,16%; 0,20%) kemudian divortex 1 menit sampai tercampur rata lalu didiamkan 30 menit dalam tabung gelap. Fraksi hasil isolasi diperlakukan sama dengan ekstrak. Serapan larutan diukur secara spektofotometri pada panjang gelombang 515 nm. Blanko yang digunakan adalah metanol.
Kemudian dihitung % aktivitas antioksidan sampeldan vitamin C dengan rumus :
Keterangan :
Serapan kontrol : Serapan DPPH dengan konsentrasi 0,1 mM; Serapan larutan uji : Serapan hasil reaksi antara 4,0 mL DPPH
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Adapun kesimpulan dari pembahasan penelitian ini, yaitu :
1. Telah diisolasi senyawa antosianin dari sampel umbi ubi jalar ungu berbentuk larutan berwarna ungu sebanyak 30 mL.
2. Senyawa hasil isolasi memiliki panjang gelombang maksimum pada 522 nm, dan 281 nm. Nilai panjang gelombang maksimum ini mendekati nilai panjang gelombang maksimum milik sianidin -3-glukosida yaitu 275 nm dan 523 nm dan Sianidin-3-soporosida-5-glukosida yaitu 524 nm dalam pelarut 0,1% HCl dalam metanol sehingga senyawa hasil isolasi diperkirakan sebagai senyawa antosianin golongan sianidin.
3. Berdasarkan kromatogram LC, fraksi 19 hasil kromatotron masih
mengandung 3 senyawa, dibuktikan dengan adanya 3 puncak dengan waktu retensi 2,9 ; 3,8 ; dan 12,1.
4. Berdasarkan hasil perhitungan, didapatkan jumlah total antosianin dalam umbi ubi jalar ungu yaitu 326,33 mg/100 gram bobot umbi ubi jalar ungu. 5. Nilai EC50 untuk ekstrak kasar yaitu sebesar 1,0716 ppm dan nilai EC50 untuk
46
B. Saran
Adapun saran yang diberikan untuk penelitian selanjutnya yaitu :
1. Sebaiknya dilakukan pemurnian senyawa dengan menggunakan alat modern misalnya HPLC, supaya senyawa yang dihasilkan benar - benar murni. 2. Menggunakan resin penukar kation dalam proses isolasi senyawa antosianin,
DAFTAR PUSTAKA
Achmad, S.A. 1986.Kimia Organik Bahan Alam, Materi 4: Ilmu Kimia Flavonoid. Karunia Universitas Terbuka. Jakarta. Hal 39.
Achmad, S.A.,E.H.Hakim, L.J. Dewi, L. Makmur, dan Y.A. Maolana. 2006. Hakekat Perkembangan kimia Organik Bahan Alam Dari Tradisional ke Moderen dan Contoh terkait Dengan Tumbuhan Lauraceae, Moraceae, dan Dipterocarpaceae Indonesia. Akta Kimindo. 1 (2).Hal 55-66.
Andrawulan, Nuri, dan RH Fitri Farailla.2012. Pewarna Alami Untuk Pangan. SEAFAST Center IPB. Bogor, Indonesia. Hal 23-27.
Anonim. 2014. Sephadex LH-20 : Data file, High performance chromatography of steroids, terpenoids and low molecular weight peptide. Amersham Biosciences. Hal 1-2.
Ariviani, Setyaningrum. 2010. Kapasitas anti radikal ekstrak antosianin buah salam (Syzygium polyanthum (Wight.) Walp) segar dengan variasi proporsi pelarut. Jurnal Jurusan Ilmu dan Teknologi Pangan UNS.Hal. 123.
Ariviani, Setyaningrum. 2010. Total Antosianin Ekstrak Buah Salam dan Korelasinya Dengan Kapasitas Antiperoksidasi pada Sistem Linoleat. AGROINTEK. 4.(2). Hal. 123.
Arja, Fania Sari, Djaswir Darwis, dan Adlis Santoni. 2013. Isolasi, Identifikasi, dan uji antioksidan senyawa antosianin dari buah Sikaduduk (Melastoma malabathricum L.) serta aplikasi sebagai pewarna alami.Jurnal Kimia Unand (ISSN No. 2303-3401), 2(1),Hal 124-127.
Banwell, C.N. and E.M. McCash. 1994. Fundamental of Molecular Spectroscopy. McGraw-Hill Book Company. London.Hal 1204-1206.
Chaovanalikit, A., Mingmuang, A., Kitbunluewit, T., Choldumrongkool, N., Sondee, J., and Chupratum, S. 2012. Anthocyanins and total phenolics contents of mangosteen and effect of processing on the quality of
48
Fennema, O.R. 1996. Food Chemistry, Third Edition. Marcel Dekker Inc. New York : Hal 42-45.
Giusti , Monica and Wrolstad, R.E. 2001. Current Protocols in Food Analytical Chemistry. Characterization and Measurement of Anthocyanins by UV-Visible Spectroscopy. Unit F1.2.1.- F1.2.13. John Wiley & Sons Inc. Hal. 1-7
Gould, K., Davies M.K., and Winefield K. 2009. Anthocyanins : Biosynthesis, Functions, and Applications. New York : Springer.Hal 23-27.
Harborne, J.B. 1996. Metode Fitokimia. Penuntun Cara Modern Menganalisis Tumbuhan. Alih bahasa Kosasih Padmawinata. Institut Teknologi Bandung. Bandung. Hal 151.
Harvey, David.2000.Modern Analitical Chemistry. McGraw-Hil. USA. Hal. 369; 372; dan 402.
Jadmiko, Suryo dan Ciptati. 2013. Ekstraksi, Isolasi, Pemurnian, dan karakterisasi Antosianin dari Ubi Jalar Ungu (Ipomoea batatas L.). Prosiding Simposium Nasional Inovasi Pembelajaran dan Sains 2013 (SNIPS 2013). Bandung, Indonesia. Hal.367-370.
Jordheim, M. 2007. Isolation, Identification, and Properties of Pyranoanthocyanins and Anthocyanins form. Disertasi. Norway : Department of Chemistry, University of Bergen. Hal 23-27.
Konczak, Izabela and Wei Zhang. 2004. Anthocyanins-More Than Nature’s Colour. Journals of Biomedicine and Biotechnology.Hal 23-27. Kristiana, Herlina Dwi, Setyaningrum Ariviani, Lia Umi Khasanah. 2012.
Ekstraksi Pigmen Antosianin Buah Senggani (Melastoma malabathricum Auct. non Linn) dengan variasi jenis pelarut. Jurnal Teknosains Pangan. 1 (1)Hal. 105-109.
Lila, Marry Ann. 2004. Anthocyanins and Human Health : An In Vitro
Investigative Approach, Mini Review Article. Journal of Biomedicine and Biotechnology. Hal. 306.
Markham, K.R. 1988. Cara Mengidentifikasi Flavonoid. Alih Bahasa Kosasih Padmawinata. Institut Teknologi Bandung. Bandung:Hal 117.
49
Murthy, Pushpa S., M.R. Manjunatha, G. Sulochannama, dan M. Madhava Naidu. 2012. Extraction, Characterization and Bioactivity of Coffee
Anthocyanins. European Journal of iological Sciences 4 (1): Hal 13-19. Oancea, Simona, Alexandra Cotinghiu, Letitia Oprean. 2013. Studies
investigating the change in total anthocyanins in black currant with post harvest cold storage. Jurnal. Vol. XVI, Issue 1.Hal 23-27.
Prakash, Aruna, Fred Rigelholf, and Eugene Miller. 2013. Antioxidant Activity. Medallion Labs. Minnesota, USA. Hal 27-35.
Ratnawati, Julia., Yesi Desmiaty, Iin Inayati. 2008. Uji pendahuluan aktivitas antioksidan ekstrak etanol batang majamuju (Cuscuta australis r.br.). Jurusan Farmasi UNJANI Cimahi. Hal. 1.
Robinson, T. 1995. Kandungan Senyawa Organik Tumbuhan Tinggi, Terjemahan Padmawinata, K . ITB. Bandung: Hal 191-201.
Sastrohamidjojo, H. 2002. Kromatografi. Liberty. Yogyakarta. Hal 35-36. Settle, Frank A. 1997. Handbook of Instrumental Techniques for Analytical
Chemistry. Prentice-Hall, Inc. New Jersey. Hal. 25-30; 247-252; 309-311; 481-485.
Shipp, Jaclyn and El-Sayed M. Abdel-Aal. 2010. Food Applications and Physicological Effects of Anthocyanins as Functional Food Ingredients. The Open Food Science Journal, 4, Hal 7-22.
Socaciu, C. 2007. Food Colorants: Chemical and Functional Properties. CRCPress . London : Hal 35-37.
Sudjadi. 1983. Penentuan Struktur Senyawa Organik. Ghalia Indonesia. Jakarta. Hal 283.
Sunarni T., Suwidjiyo P., dan Ratna A. 2007. Flavonoid Antioksidan Penangkap Radikal dari Daun Kepel (Stelechocarpus burahol). Majalah Farmasi Indonesia. Volume 18. Nomor 3. Hal 111-116.
Supiyanti, Wiwin.,Endang Dwi Wulansari dan Lia Kusmita. 2010. Uji Aktivitas Antioksidan dan Penentuan Kandungan Antosianin Total Kulit Buah Manggis (Garcinia mangostana L.). Majalah Obat Tradisional, 15 (2), Hal 64-70.
50
Tapas, AR., DM Sakarkar, and RB Kakde. 2008. Flavonoids as nutraceuticals : A Review. Tropical Journal of Pharmaceutical Research. 7 (3): 1089-1099. Hal. 1090.
Tensiska, Betty Dewi Sofiah, Kanti Annisa Panca Wijaya. 2007. Aplikasi ekstrak pigmen dari buah arben (Rubus ideaus (Linn.)) pada minuman ringan dan kestabilannya selama penyimpanan. Jurnal. ISBN : 978-979, 16456-0-7. Hal 35-40.
Turker, Nuzhet, Salih Aksay, and H. Ibrahim Ekiz. 2004. Effect of Storage
Temperature on the Stability of Anthocyanins of a Fermented Black Carrot (Daucus carota var. L) Beverage : Shalgam. Journal of Agricultural and Food Chemistry. 52, Hal 3807-3813.
Welch, Cara R., Qingli Wu, and James E. Simon. 2008. Recent Advances in Anthocyanins Analysis and Characterization. NIH-Public Access Author Manuscript. Curr Anal Chem. 4(2): 75–101.