KECAP MANIS DAN MODEL PRODUK REAKSI
MAILLARD BERDASARKAN BERAT MOLEKUL
DEDIN FINATSIYATULL ROSIDA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
DAN SUMBER INFORMASI
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan dalam disertasi yang berjudul:
AKTIVITAS ANTIOKSIDAN FRAKSI-FRAKSI MOROMI,
KECAP MANIS DAN MODEL PRODUK REAKSI MAILLARD
BERDASARKAN BERAT MOLEKUL
Adalah gagasan atau hasil penelitian disertasi karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun
Semua data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor September 2009
DEDIN FINATSIYATULL ROSIDA. Antioxidant Activity of Fractions from Moromi, Soy Sauce and Model of Maillard Reaction Based on Molecular Weight. Under supervision of C. HANNY WIJAYA, ANTON APRIYANTONO and FRANSISCA RUNGKAT ZAKARIA.
Moromi is a fermented soy product which is used as raw material for making soy sauce. The browning reactions of soy sauce was considered to have antioxidant activity as well as strong impact on flavor and color of product. The brown pigments, mainly of melanoidin and other varieties of intermediates products are resulted by Maillard reactions. The objective of this study was to investigate antioxidant activity of fractions in moromi and soy sauce based on molecular weight. Four products i.e. moromi, heated moromi, soy sauce with coconut sugar and soy sauce with cane sugar were made. The heated moromi was made by heating for 20 minutes whereas soy sauce were added with sugar and heated for 65 minutes. The products were evaluated for water contents, protein, lipid, reducing sugar, amino acid and pH. The system models of Maillard reaction were prepared from sugar and amino acids. The models contained glucose – glycine - cysteine; glucose – glycine – cysteine - phenylalanine; glucose – glycine – cysteine – phenylalanine – isoleucine - tyrosine. All moromi, soy sauce and models were fractionated by ultrafiltration in a molecular weight ranging between 10 kDa to 100 kDa. The fractions with molecular weight >100 kDa and 30-100 kDa of moromi and heated moromi retarded oil oxidation and had DPPH radical scavenging activity stronger than fractions with molecular weight < 30 kDa equal with BHT antioxidant. The fractions with molecular weight <10 kDa and 10-30 kDa of soysauce retarded oil oxidation better than fractions with molecular weight > 30 kDa, whereas the fractions molecular weight 30-100 kDa and > 100 kDa had DPPH radical scavenging activity better than fractions with molecular weight < 30 kDa. The soy sauce with cane sugar showed the strongest antioxidant activity. The fractions with molecular weight 30-100 kDa of models stronger had DPPH radical scavenging activity than other fractions. The fractions with molecular weight > 10 kDa of models stronger retarded oil oxidation than fraction with molecular weight < 10 kDa. The fractions of soy sauce had better antioxidant activity that of the model. The fraction >100 kDa of soy sauce with cane sugar retarded better erythrocyte hemolysis comparing to the fraction <10 kDa. The compounds which has the role as antioxidant is the reaction Maillard product (MRP) were determined based on uv-vis absorption at wave length 306 nm, 348 nm and 403 nm and infra red spectrum indicated functional group of –OH…O from -diketon or C=R=R combination and CH, COC, >C=C<, >C=N, >NH, N+H, COO. The content of protein, alfa amino and phenol had no correlation with antioxidant activities.
Manis dan Model Produk Reaksi Maillard Berdasarkan Berat Molekul. Di bawah bimbingan C. HANNY WIJAYA, ANTON APRIYANTONO DAN FRANSISCA RUNGKAT ZAKARIA
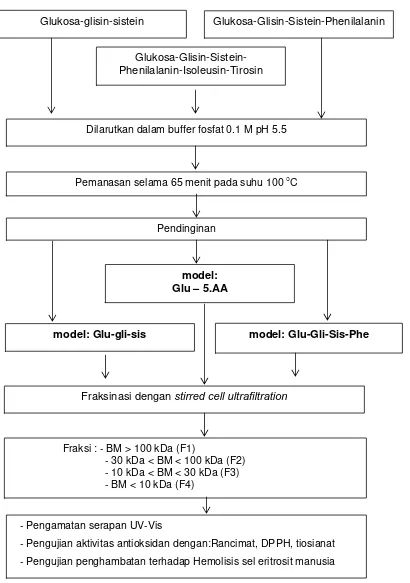
Kecap merupakan bahan penyedap yang banyak digunakan dalam berbagai produk pangan di Indonesia. Pada pembuatan kecap manis, moromi sebagai bahan baku kecap manis dimasak dengan penambahan gula merah dan bumbu. Pembentukan warna kecap terjadi selama fermentasi moromi dan proses pemasakan. Selama pemasakan terjadi pembentukan warna coklat yang disebabkan oleh terjadinya reaksi pencoklatan non enzimatis, yaitu reaksi Maillard dan karamelisasi. Reaksi ini selain berkontribusi dalam pembentukan warna, flavor dan tekstur juga memberikan potensi antioksidan yang cukup tinggi dalam produk kecap manis. Penelitian ini bertujuan mempelajari aktivitas antioksidan fraksi-fraksi pada moromi, kecap manis dan model reaksi Maillard berdasarkan berat molekul.
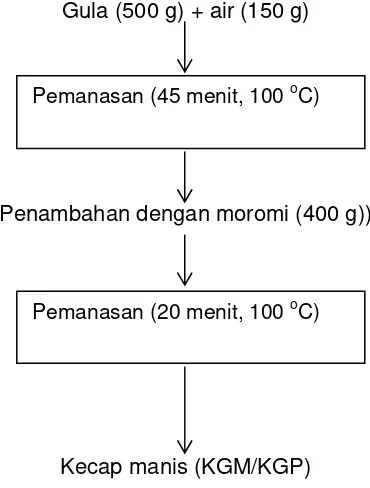
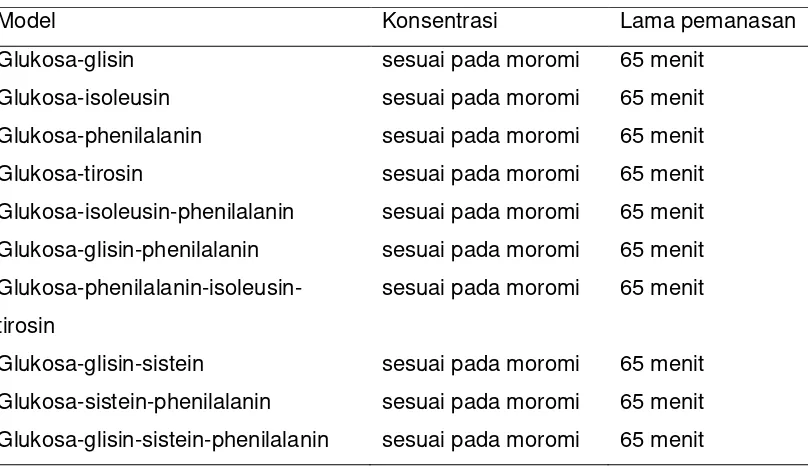
Bahan penelitian utama pada penelitian ini terdiri dari empat produk yang berupa: moromi (M), moromi yang dipanaskan (MP), kecap dengan gula merah (KGM) dan kecap dengan gula pasir (KGP). Pembuatan moromi menjadi produk moromi yang dipanaskan (MP) dengan memanaskan moromi pada suhu 100 oC selama 20 menit, sedangkan untuk produk kecap manis dengan gula merah (KGM) dan gula pasir (KGP) masing-masing dengan memanaskan moromi selama 65 menit pada suhu 100 oCdan penambahan gula sebanyak 48% dan air 14%. Pada moromi (M), moromi dipanaskan (MP), kecap manis dengan gula merah (KGM) dan kecap manis dengan gula pasir dilakukan analisis yang meliputi: kadar air, protein, lemak, pH, total padatan, gula pereduksi dan komposisi asam amino. Analisis kadar sukrosa, glukosa dan fruktosa pada gula merah dan gula pasir juga dilakukan dengan menggunakan HPLC (High Performance Liquid Chromatography). Tahapan selanjutnya dilakukan fraksinasi pada ke empat produk menggunakan ultrafiltrasi dengan membran 100 kDa, 30 kDa dan 10 kDa. Fraksinasi dilakukan untuk memperoleh empat fraksi yang terdiri dari: fraksi dengan berat molekul (BM) >100 kDa (F1), fraksi BM 30-100 kDa (F2), fraksi BM 10-30 kDa (F3) dan fraksi BM<10 kDa (F4). Pada tiap fraksi dari tiap produk dilakukan pengujian yang meliputi: kadar protein, -amino, total fenol, serapan uv-vis dan FTIR (Fourier Transformation Infra Red), TLC (Thin Layer Chromatography) dan HPLC serta uji aktivitas antioksidan. Pengujian aktivitas antioksidan pada masing-masing fraksi menggunakan metode rancimat, DPPH(1,1-diphenyl-2-picrylhydrazyl), penentuan bilangan TBA (Thiobarbituric acid) dan sistem linoleat-tiosianat. Pada penelitian ini juga dibuat model dari produkreaksi Maillard (Maillard reaction product/MRP) menggunakan gula dan asam amino untuk mengetahui kemampuan aktivitas antioksidan MRP dan membuktikan bahwa aktivitas antioksidan pada kecap manis disebabkan senyawa produk reaksi Maillard. Model terdiri dari: glukosa-glisin-sistein, glukosa-glisin-sistein-phenilalanin, glukosa-glisin-sistein-phenilalanin-isoleusin-tirosin. Pada semua model produk reaksi Maillard juga dilakukan fraksinasi dan menghasilkan empat fraksi sebagaimana pada moromi dan kecap manis. Pada tiap fraksi dari tiap model dilakukan analisis spektrum uv-vis dan aktivitas antioksidan. Pada fraksi kecap manis dengan gula pasir dan model glukosa-glisin-sistein-phenilalanin-isoleusin-tirosin dengan fraksi berat molekul > 100 kDa dan < 10 kDa dilakukan juga pengujian aktivitas antioksidan dalam sistem biologi secara in vitro menggunakan sel eritrosit.
mempunyai kemampuan menangkap radikal DPPH lebih kuat pada fraksi dengan berat molekul 30 kDa sampai lebih besar dari 100 kDa dan aktivitasnya sama dengan vitamin C 200 ppm. Penghambatan oksidasi minyak atau asam lemak lebih kuat pada fraksi dengan berat molekul < 10 kDa sampai 30 kDa dan aktivitasnya lebih besar dari BHT 200 ppm. Fraksi-fraksi dari semua produk mempunyai aktivitas antioksidan dengan Indeks protektif pada kisaran 1.31 - 2.34, sedangkan indek protektif BHT 1.60. Pada produk kecap manis dengan gula pasir memberikan aktivitas antioksidan yang paling kuat.
Aktivitas antioksidan pada model didapatkan pada berat molekul yang besar (> 30 kDa) mampu menghambat oksidasi minyak atau asam lemak dan menangkap radikal DPPH lebih kuat dibandingkan fraksi yang lain. Fraksi dengan berat molekul < 30 kDa hanya mampu menghambat oksidasi minyak atau asam lemak lebih kuat. Jenis asam amino lebih menentukan kekuatan akivitas antioksidan daripada jumlah dari asam amino.
Fraksi-fraksi pada kecap manis dengan gula pasir (KGP) dan model produk reaksi Maillard (glu-5.AA) mempunyai aktivitas antioksidan dalam sistem biologi. Fraksi pada kecap manis dengan gula pasir mampu menghambat hemolisis sel eritrosit lebih besar dari model terutama pada fraksi dengan berat molekul > 100 kDa. Produk kecap manis dengan gula pasir (KGP) dan model mempunyai aktivitas antioksidan cukup kuat baik secara kimia maupun secara biologis.
Senyawa yang berperan sebagai antioksidan dalam moromi dan kecap manis terutama disebabkan oleh senyawa produk reaksi Maillard. Kadar protein, alfa-amino dan fenol yang dapat berpotensi sebagai antioksidan, dalam penelitian ini tidak menunjukkan bahwa aktivitas antioksidan moromi dan kecap manis disebabkan oleh senyawa-senyawa tersebut. Kadar protein, alfa amino dan fenol pada tiap produk sebagian besar terdapat pada fraksi dengan berat molekul < 10 kDa dengan kisaran kadar protein 2.89-3.68 mg/ml, alfa-amino 2.29-2.99 mg/ml dan total fenol 362-713 ppm tidak menunjukkan korelasi dengan kuatnya aktivitas antioksidan. Kuatnya aktivitas antioksidan kecap manis (KGM dan KGP) dalam menghambat oksidasi minyak atau lemak pada fraksi dengan berat molekul < 10 kDa terutama disebabkan senyawa produk reaksi Maillard bukan fenol karena senyawa fenol potensial sebagai antioksidan dalam sistem aqueous, sedangkan dalam penelitian ini kekuatan aktivitas antioksidan fraksi dengan berat molekul< 10 kDa diperoleh dari sistem minyak atau asam lemak. Kurang kuatnya peran senyawa fenolik sebagai antioksidan dalam penelitian ini dapat disebabkan karena banyak yang rusak akibat proses pemanasan atau bergabung dengan senyawa produk reaksi Maillard untuk memberikan aktivitas sebagai antioksidan. Senyawa fenolik mampu mendonorkan residu dari gugus karbonilnya untuk fase awal reaksi Maillard.
Hasil analisis spektrum uv-vis tiap fraksi pada kisaran 306 nm, 348 nm dan 403 nm, spectra infra merah mengindikasikan gugus –OH...O dari -diketon atau kombinasi C=R=R dan gugus fungsional CH, COC, >C=C<, >C=N, >NH, N+H, COO dan nilai Rf 0.32-0.41 dari TLC menunjukkan fraksi-fraksi banyak terdiri dari senyawa produk reaksi Mailard.
© Hak cipta milik Institut Pertanian Bogor, tahun 2009
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa ijin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apapun, baik cetak, fotocopy,
KECAP MANIS DAN MODEL PRODUK REAKSI MAILLARD
BERDASARKAN BERAT MOLEKUL
DEDIN FINATSIYATULL ROSIDA
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor Pada sekolah Pascasarjana
Institut Pertanian Bogor
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Berat Molekul
Nama : Dedin Finatsiyatull Rosida Nomor Pokok : P09600007
Disetujui, Komisi Pembimbing
Prof.Dr.Ir.C.Hanny Wijaya, M.Agr Ketua
Dr.Ir.Anton Apriyantono, MS Prof.Dr.Ir.Fransisca R.Zakaria, MSc Anggota Anggota
Diketahui,
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Dr.Ir. Ratih Dewanti-Hariyadi MSc Prof.Dr.Ir.Khairil Anwar Notodiputro, MS
Penulis dilahirkan di Pasuruan Jawa-Timur pada tanggal 25 Desember 1970, sebagai anak ke empat dari pasangan Bahrudin dan Dra.Hj. Sudariyah. Pada tanggal 1 Agustus 2004 penulis menikah dengan Yadi STp dan saat ini telah dikaruniai 2 orang anak yaitu M. Hikari Reiziq Rahmaddinta dan M. Hageshii Mirzan Maulana.
Penulis menyelesaikan pendidikan Sekolah Dasar pada Tahun 1982, Sekolah Menengah Pertama pada tahun 1985, dan Sekolah Menengah Tingkat Atas pada tahun 1988.
Penulis diterima di universitas Jember pada tahun 1988 melalui jalur PMDK untuk program sarjana. Pada tahun 1989 penulis masuk di Jurusan Teknologi Pertanian Universitas Jember dan lulus pada tahun 1993. Pada tahun 1995 penulis meneruskan studi pada Jurusan Kesehatan Masyarakat Pascasarjana Universitas Airlangga dan lulus pada program Magister pada tahun 1997. Pada Tahun 2000 penulis meneruskan studi pada Program Studi Ilmu Pangan Sekolah Pascasarjana IPB.
Penulis hingga saat ini bekerja sebagai staf pengajar pada Jurusan Teknologi Pangan UPN “Veteran” Jawa Timur Jurusan Teknologi Pangan sejak tahun 1997. Pada Tahun 2004 penulis mendapatkan dana penelitian fundamental dari Dikti dengan judul “Kajian aktivitas antioksidan produk reaksi Maillard pada kecap manis.” digunakan untuk kelanjutan penelitian disertasi penulis.
Penulis mempublikasikan hasil penelitian ini pada Seminar Internasional
Alhamdulillahirrobbil ‘alamin, saya memanjatkan kehadirat Allah SWT yang senantiasa memberikan kasih sayang dan bimbingan kepada penulis sehingga dapat menyelesaikan penelitian dan penulisan disertasi ini. Disertasi berjudul “ Aktivitas antioksidan fraksi-fraksi Moromi, kecap Manis dan model produk reaksi Maillard berdasarkan berat molekul” merupakan salah satu syarat untuk memperoleh gelar Doktor pada Program Studi Ilmu Pangan Sekolah Pascasarjana IPB Bogor.
Pada kesempatan ini penulis mengucapkan terima kasih dan penghargaan yang setinggi-tingginya kepada Ibu Prof. Dr.Ir.C.Hanny Wijaya, M.Agr sebagai ketua komisi pembimbing, serta Bapak Dr.Ir.Anton Apriyantono, MS dan Ibu Prof.Dr.Ir.Fransisca R Zakaria, MSc sebagai anggota komisi pembimbing, atas segala saran, bimbingan, motivasi dan kemudahan yang diberikan selama studi.
Terima kasih kepada Ibu Dr.Ir.Dwi Setyaningsih, MS dan Dr.Ir.Endang Prangdimurti, MS sebagai penguji luar pada ujian tertutup, serta Ibu Prof.Dr. Ir.Latifah K.Darusman MS dan Bapak Dr.Ir. LBS Kardono sebagai penguji luar pada ujian terbuka, atas saran, masukan dan kebaikan yang diberikan.
Tarima kasih juga saya sampaikan kepada Dekan Sekolah Pascasarjana IPB Prof.Dr.Ir.Khairil Anwar Notodiputro,MS dan Rektor UPN “Veteran” Surabaya Ungkapan terima kasih yang tulus penulis sampaikan kepada Ibu saya Dra.Hj. Sudariyah, Bapak mertua Drs. Tadjudin Winata dan kakak-kakak saya yang selalu memberi bantuan materil dan spirituil. Terima kasih yang tak terhingga penulis sampaikan kepada suami tercinta Yadi STp dan buah hati tercinta M.Hikari Reiziq Rahmaddinta dan M.Hageshii Mirzan Maulana atas segala curahan kasih sayang, doa dan pengertian.
Ucapan terima kasih juga saya sampaikan kepada rekan-rekan IPN dan mas Taufik dan mbak Ari atas kerjasama dan bantuannya selama ini.
Pada disertasi ini mungkin masih terdapat kekurangan, oleh karena itu kritik dan saran akan penulis terima dengan senang hati. Semoga disertasi ini menjadi amalan bagi penulis dan bermanfaat bagi perkembangan ilmu pangan. Amien
Bogor, September 2009
Penguji Luar Komisi pada Ujian Tertutup: (Pelaksanaan Tanggal 5 Agustus 2009)
1. Dr. Ir. Endang Prangdimurti, Msi
(Departemen Ilmu dan Teknologi Pangan, FATETA IPB) 2. Dr. Ir. Dwi Setyaningsih, Msi
(Departemen Teknologi Industri Pertanian, FATETA IPB)
Penguji Luar Komisi pada Ujian Terbuka: (Pelaksanaan tanggal 2 September 2009)
1. Prof. Dr. Ir. Latifah K. Darusman, MS (Departemen Kimia, FMIPA IPB)
2. Dr. Ir. LBS. Kardono
DAFTAR ISI ... DAFTAR TABEL... DAFTAR LAMPIRAN ...
PENDAHULUAN ... 1
A. Latar Belakang... 1
B. Tujuan Penelitian ... 2
C. Manfaat Penelitian ... 2
D. Hipotesis Penelitian ... 3
II. TINJAUAN PUSTAKA ... 4
A. Moromi ... 4
B. Kecap ... 5
B.1. Kimia Kecap ... 5
B.2. Kecap dan Perubahan Kimia Selama Pengolahan ... 7
C. Reaksi Maillard ... 9
C.1 Dasar Reaksi Maillard ... 9
C.2 Faktor-faktor yang Mempengaruhi Reaksi Pencoklatan Non-Enzimatis ... 14
D. Antioksidan ... 15
D.1 Mekanisme Oksidasi Lemak ... 15
D.2 Reaksi Antioksidasi ... 16
D.3 Antioksidan dalam Produk Reaksi Maillard ... 19
E. Uji Aktivitas Antioksidan ... 23
F. Fraksinasi Produk Reaksi Maillard ... 25
III. METODOLOGI PENELITIAN ... 27
A. Tempat dan Waktu Penelitian ... 27
B. Bahan dan Alat ... 27
C. Metode Penelitian ... 28
Pembuatan produk MP, KGM dan KGP ... 28
Proses fraksinasi dengan ultrafiltrasi ... 30
Pembuatan Sistem Model ... 31
Karakterisasi kimia produk M,MP, KGM dan KGP ... 33
Penentuan Kadar Gula Sukrosa, Fruktosa dan Glukosa ... 35
Penentuan Kadar Gula Reduksi ... 35
Penentuan Kadar Total Fenol ... 36
Pengamatan Penyerapan UV-Vis tiap Faksi ... 37
Pengamatan Spectra IR tiap Fraksi ... 37
Pemisahan Senyawa yang terdapat dalam tiap Fraks ... 37
Pengujian Aktivitas Antioksidan dengan Rancimat ... 38
Pengujian Aktivitas Antioksidan dengan Penetapan Bilangan TBA ... 38
Pengujian Aktivitas Antioksidan dengan DPPH ... 39
Pengujian Aktivitas Antioksidan dengan Feritiosianat ... 39
Pengujian Terhadap Penghambatan Hemolisis Eritrosit Manusia ... 39
IV. HASIL DAN PEMBAHASAN ... 43
A.Karakteristik Kimia Moromi dan Kecap Manis ... 43
A.1 Reaksi Gula pada Moromi yang Dipanaskan ... 44
A.2 Beberapa Aspek yang Berhubungan dengan Asam Amino Kecap ... 48
B. Aktivitas Antioksidan Moromi dan Kecap Manis ... 51
a. Aktivitas Antioksidan dalam Sistem Minyak ... 52
b.Aktivitas Antioksidan dalam Sistem Aqueous ... 58
C. Karakteristik Kimia Fraksi-Fraksi Produk M, MP, KGM dan KGP ... 61
C..1 Perubahan Kadar Protein ... 61
C..2 Perubahan Kadar Alfa-Amino ... 62
C.3. Perubahan Kadar Total Fenol ... 63
C.4. Serapan Uv-Vis tiap Fraksi dari tiap Produk ... 65
C.5. Spectra IR... 72
D. Senyawa yang Berperan sebagai Antioksidan dalam Moromi dan Kecap ... 73
E. Mekanisme Senyawa Produk Reaksi Maillard sebagai Antioksidan ... 80
F. Aktivitas Antioksidan Produk Reaksi Maillard pada Sistem Model ... 83
F.1. Aktivitas Antioksidan dalam Sistem Model Glu-Gli-Sis ... 85
F.2. Aktivitas Antioksidan dalam Sistem Model Glu-Gli-Sis-Phe ... 89
F.3. Aktivitas Antioksidan dalam Sistem Model Glu- 5.AA ... 92
G. Pengujian Respon Perlindungan Sel Eritrosit Manusia Terhadap Proses Hemolisis oleh Fraksi-Fraksi Kecap Manis dan Model ... 96
V. KESIMPULAN DAN SARAN ... 103
Tabel 2.1 Komposisi gula pada kecap aren, kecap gula kelapa dan kecap tebu ... 7
Tabel 2.2 Beberapa dugaan struktur melanoidin... 13
Tabel 2.3 Deskripsi sistem model dan pangan yang mengalami browning non-enzimatis dan koefisien statistik aktivitas antioksidan dengan warna ... 21
Tabel 2.4 Efek oksidasi dan reduksi pada aktivitas pengkelat, intensitas warna dan berat molekul melanoidin... 23
Tabel 3.1 Pembuatan model 1 ... 32
Tabel 3.2 Pembuatan model 2 ... 32
Tabel 3.3 Pembuatan model 3 ... 33
Tabel 3.4 Pengujian penghambatan hemolisis dengan H2O2 ... 41
Tabel 3.5 Pengujian penghambatan hemolisis tanpa H2O2 ... 41
Tabel 4.1 Hasil analisis karakteristik kimia moromi dan kecap manis ... 44
Tabel 4.2 Kadar gula pada gula merah dan gula pasir ... 47
Tabel 4.3 Kadar asam amino pada moromi dan kecap manis ... 49
Tabel 4.4 Indeks protektif aktivitas antioksidan produk M, MP, KGM dan KGP ... 53
Tabel 4.5 Intensitas browning pada sistem model larutan glukosa-glisin ... 66
Tabel 4.6 Gugus fungsional pada fraksi-fraksi M, MP, KGM dan KGP ... 74
Tabel 4.7 Aktivitas antioksidan optimal pada M, MP, KGM dan KGP ... 73
Tabel 4.8 Karakteristik kimia dengan kadar tertinggi pada F4 ... 75
Tabel 4.9 Spektrum Uv-Vis fraksi-fraksi dalam tiap produk ... 76
Tabel 4.10 Spektrum uv-vis model produk reaksi Maillard dari literatur ... 76
Tabel 4.11 Nilai Rf dari fraksi BM>100 kDa dan BM< 10 kDa tiap produk... 78
Tabel 4.12 Aktivitas antioksidan berbagai sistem model ... 84
Tabel 4.13 Aktivitas antioksidan model dengan pemanasan 65 menit ... 85
Gambar 2.1 Skema reaksi Maillard ... 11
Gambar 2.2 Mekanisme Reaksi Maillard pada Produk Pangan ... 12
Gambar 2.3 Unit pengulangan melanoidin ... 13
Gambar 2.4 Mekanisme autooksidasi ... 16
Gambar 2.5 Reaksi ketengikan oksidatif pada lipida ... 17
Gambar 2.6 Struktur hidroksipiridone & piranone sebagai sekuestran Fe ... 22
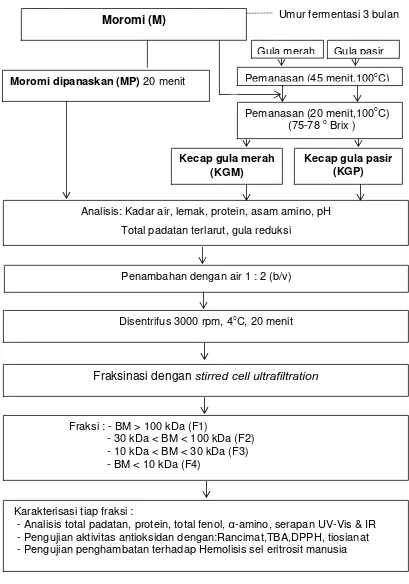
Gambar 3.1 Skema proses karakterisasi uji aktivitas antioksidan kecap manis ... 29
Gambar 3.2 Skema pembuatan kecap manis ... 30
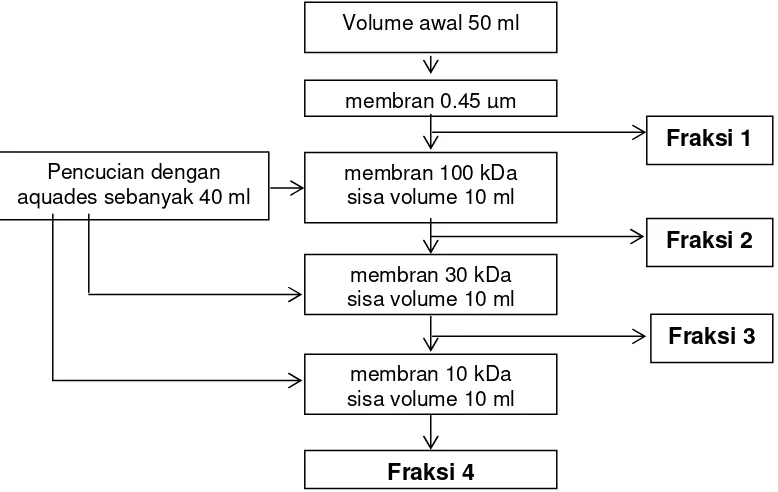
Gambar 3.3 Skema proses fraksinasi dengan ultrafiltrasi ... 31
Gambar 3.4 Skema proses pembuatan sistem model ... 34
Gambar 4.1 Spektrum UV-Vis produk M, MP, KGM dan KGP ... 45
Gambar 4.2 Spektrum UV-Vis gula merah ... 46
Gamabr 4.3 Aktivitas antioksidan dengan rancimat pada tiap fraksi produk ... 53
Gambar 4.4 Aktivitas antioksidan dengan metode linoleat-tiosianat pada M ... 55
Gambar 4.5 Aktivitas antioksidan dengan metode linoleat-tiosianat pada MP ... 55
Gambar 4.6 Aktivitas antioksidan dengan metode linoleat-tiosianat pada KGM ... 56
Gambar 4.7 Aktivitas antioksidan dengan metode linoleat-tiosianat pada KGP ... 57
Gambar 4.8 Aktivitas antioksidan dengan metode DPPH pada tiap fraksi produk ... 58
Gambar 4.9 Aktivitas antioksidan dengan metode TBA pada tiap fraksi produk... 60
Gambar 4.10 Kadar protein pada tiap fraksi produk ... 62
Gambar 4.11Kadar alfa-amino pada tiap fraksi produk ... 63
Gambar 4.12 Kadar fenol pada tiap fraksi produk ... 64
Gambar 4.13 Kadar total padatan pada tiap fraksi produk ... 65
Gambar 4.14 Penampakan F1 dan F4 pada produk M, MP, KGM dan KGP ... 67
Gambar 4.15. Spektrum UV-Vis tiap fraksi pada produk M ... 69
Gambar 4.16. Spektrum UV-Vis tiap fraksi pada produk MP... 69
Gambar 4.17 Spektrum UV-Vis tiap fraksi pada produk KGM ... 70
Gambar 4.18 Spektrum UV-Vis tiap fraksi pada produk KGP ... 71
Gambar 4.19 Struktur melanoidin ... 72
Gambar 4.20 Mekanisme reaksi imidazol dan radikal hidroksi ... 83
Gambar 4.21 Aktivitas antioksidan sistem model glu-gli-sis dengan rancimat ... 86
Gambar 4.22 Aktivitas antioksidan sistem model glu-gli-sis dengan DPPH ... 87
Gambar 4.26 Aktivitas antioksidan sistem model glu-gli-sis-phe dengan DPPH ... 90
Gambar 4.27 Aktivitas antioksidan sistem model glu-gli-sis-phe dengan tiosianat ... 91
Gambar 4.28. Spektrum uv-vis pada sistem model glu-gli-sis-phe ... 91
Gambar 4.29 Aktivitas antioksidan sistem model glu-5.AA dengan rancimat ... 92
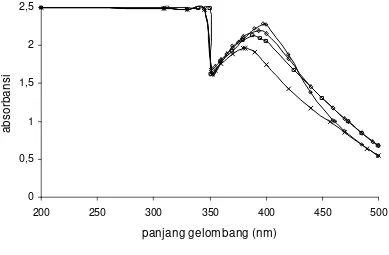
Gambar 4.30 Aktivitas antioksidan sistem model glu-5.AA dengan DPPH ... 93
Gambar 4.31 Aktivitas antioksidan sistem model glu-5.AA dengan tiosanat ... 94
Gambar 4.32. Spektrum uv-vis sistem model glu-5.AA ... 95
Gambar 4.33 Kemampuan fraksi sampel dan model menghambat hemolisis sel eritrosit manusia dengan penambahan oksidator H2O2 ... 97
Gambar 4.34 Persen penghambatan hemolisis sel eritrosit oleh fraksi sampel dan model dengan penambahan H2O2 ... 98
Gambar 4.35 Kemampuan fraksi sampel dan model menghambat hemolisis sel eritrosit manusia tanpa penambahan oksidator H2O2 ... 101
DAFTAR LAMPIRAN
Lampiran 1. Hasil analisis proksimat produk moromi dan kecap manis Lampiran 2. Kadar Protein produk moromi dan kecap manis
Lampiran 3. Kadar alfa amino produk moromi dan kecap manis Lampiran 4. Kadar air produk moromi dan kecap manis
Lampiran 5. Kadar total padatan produk moromi dan kecap manis Lampiran 6. kadar fenol produk moromi dan kecap manis
Lampiran 7. Hasil aktivitas antioksidan dengan rancimat pada moromi dan kecap Lampiran 8. Hasil penentuan dengan TBA pada moromi dan kecap manis
Lampiran 9. Hasil penentuan dengan DPPH pada moromi dan kecap manis Lampiran10. Hasil aktivitas antioksidan model dengan rancimat dan DPPH Lampiran 11. Aktivitas antioksidan model dengan tiosianat
Lampiran 12. Aktivitas antioksidan Moromi dan kecap Manis dengan tiosianat Lampiran 13. Proses pembuatan moromi di PT.Indofood Sukses Makmur Lampiran 14. Nilai absorbansi pencegahan hemolisis eritrosit dengan H2O2
Lampiran 15 Nilai absorbansi pencegahan hemolisis eritrosit tanpa H2O2
Lampiran 16. Kromatografi fraksi-fraksi moromi dan kecap manis dengan HPLC Lampiran 17. Spektra infra merah pada produk moromi dan kecap manis Lampiran 18. Spot-spot hasil TLC moromi dan kecap manis
I. PENDAHULUAN
A. Latar Belakang
Oksidasi terhadap bahan pangan yang mengandung lemak mempengaruhi bau dan flavornya. Umumnya pendekatan yang digunakan untuk mengatasi hal tersebut adalah dengan penggunaan bahan tambahan pangan (BTP) antioksidan. Antioksidan yang banyak digunakan dari jenis sintetis seperti Butil Hidroksi Anisol (BHA), Butil Hidroksi Toluen (BHT), propil galat dan tert-Butil Hidroksi Quinon (TBHQ). Selain antioksidan sintetis, antioksidan alami lebih aman penggunaannya di dalam bahan pangan. Antioksidan alami dapat berasal dari: senyawa antioksidan yang sudah ada dari satu atau dua komponen pangan, senyawa antioksidan yang terbentuk dari reaksi-reaksi selama pengolahan, senyawa antioksidan yang diisolasi dari sumber alami dan ditambahkan ke dalam makanan sebagai bahan tambahan pangan (Pratt 1992). Menurut Pratt dan Hudson (1990) serta Shahidi dan Naczk (1995) senyawa alami tumbuhan umumnya adalah senyawa fenolik atau polifenolik yang dapat berupa golongan flavonoid, turunan asam sinamat, kumarin, tokoferol dan asam-asam organik polifungsional.
Salah satu antioksidan yang dihasilkan dari proses pengolahan dapat dihasilkan dari reaksi Maillard. Penggunaan produk reaksi Maillard (Maillard reaction product/MRP) dapat mencegah oksidasi lipid (Bailey & Won Um 1992). Reaksi Maillard adalah reaksi yang terjadi antara gugus amino dari suatu asam amino bebas, residu rantai peptida atau protein dengan gugus karbonil dari suatu karbohidrat apabila keduanya dipanaskan atau tersimpan dalam waktu yang relatif lama. Gugus ∈-amino residu lisin yang terikat pada peptida dan protein berperan penting dalam reaksi disebabkan kereaktifannya yang relatif tinggi. Selain itu gugus α-amino terminal juga berperan dalam reaksi Maillard (Yokotsuka 1986).
merah dan bumbu. Kecap manis Indonesia memiliki warna dan flavor khas yang tidak dimiliki oleh negara lain.
Pembentukan warna kecap terjadi selama fermentasi moromi dan proses pemasakan. Selama pemasakan terjadi pembentukan warna coklat disebabkan terjadinya reaksi pencoklatan non enzimatis, yaitu reaksi Maillard dan karamelisasi. Reaksi pencoklatan non enzimatis merupakan fenomena yang sering dijumpai pada penyimpanan bahan makanan maupun pengolahan makanan. Reaksi ini selain berkontribusi dalam pembentukan warna, flavor dan tekstur diharapkan juga memberikan potensi antioksidan yang cukup tinggi dalam produk kecap manis.
B. Tujuan penelitian
Pada penelitian ini bertujuan mempelajari aktivitas antioksidan fraksi-fraksi moromi, kecap manis dan model reaksi Maillard berdasarkan berat molekul.
Tujuan khusus :
1. Mempelajari aktivitas antioksidan fraksi-fraksi moromi dan kecap manis berdasarkan berat molekul terkait dengan perlakuan perbedaan proses pemanasan dan penambahan gula
2. Mempelajari fraksi-fraksi moromi dan kecap manis yang mempunyai aktivitas antioksidan optimal
3. Mempelajari aktivitas antioksidan fraksi-fraksi model reaksi Maillard berdasarkan berat molekul
4. Membandingkan aktivitas antioksidan fraksi moromi dan kecap manis dengan fraksi model produk reaksi Maillard
5. Mempelajari peran komponen dalam fraksi-fraksi kecap manis dan model produk reaksi Maillard sebagai antioksidan dalam sistem biologi
C. Manfaat penelitian :
D. Hipotesis Penelitian
1. Kecap manis mengandung senyawa-senyawa yang berpotensi sebagai antioksidan
2. Proses pemanasan dan jenis gula menentukan aktivitas antioksidan kecap manis
3. Senyawa yang berpotensi sebagai antioksidan dalam kecap manis merupakan produk reaksi Maillard (MRP)
4. Aktivitas antioksidan produk reaksi Maillard mencakup penghambatan terhadap oksidasi lemak dan penangkapan radikal bebas
5. Produk reaksi Maillard (MRP) dengan berat molekul tertentu mempunyai aktivitas antioksidan tertinggi
6. Senyawa produk reaksi Maillard dalam kecap manis juga mempunyai aktivitas antioksidan dalam sistem biologi khususnya dapat menghambat hemolisis sel eritrosit
I. TINJAUAN PUSTAKA
A
.
MoromiDengan semakin berkembangnya industri pangan, khususnya produk penyedap rasa secara fermentasi maka keberadaan kecap manis semakin bertambah luas. Moromi sebagai bahan dasar kecap manis merupakan hasil fermentasi garam dari kedele yang menggunakan kapang Aspergillus sp. selama lebih dari 2 bulan. Ekstrak moromi dalam pembuatan kecap mengandung peptida atau protein nabati yang telah terakumulasi dengan asam-asam lemak dan gula sebagai hasil dari aktifitas kapang Aspergillus sp yang memberi cita rasa kecap sedap, namun juga spesifik dengan kandungan nutrisi yang tinggi. Ekstrak moromi mengandung zat gizi lengkap dengan asam-asam aminonya. Proses fermentasi dalam pembuatan kecap dari bahan kedelai melalui 2 tahap yaitu fermentasi padat dengan menggunakan jamur disebut koji dan fermentasi cair yang menggunakan bakteri asam yang disebut moromi. Keberhasilan fermentasi moromi sangat menentukan kualitas kecap yang dihasilkan. Prinsip pembuatan kecap secara fermentasi adalah proses hidrolisis protein dan senyawa-senyawa lainnya dari kedelai secara enzimatis oleh aktifitas mikroba. Moromi merupakan fermentasi lanjutan setelah fermentasi padat (Aspiyanto & Susilowati 2002).
Hal-hal yang berkaitan erat dengan moromi yaitu larutan garam dapur (NaCl) dan bakteri asam laktat. Garam ini merupakan salah satu jenis bahan pembantu dalam bahan pangan yang paling penting dalam pengawetan pangan. Berbagai fungsi garam selain sebagai bahan pengawet juga untuk menghilangkan sejumlah air yang tersedia untuk pertumbuhan mikroorganisme. Bakteri asam laktat secara morfologi terdiri dari 2 familia yaitu familia
mikroorganisme. Pada umumnya proses pembuatan moromi secara spontan. Pada proses fermentasi secara spontan, jenis mikroba yang tumbuh sangat banyak dan sulit dikontrol (Aspiyanto & Susilowati 2002).
Pangan yang difermentasi dapat memperbaiki nilai nutrisi. Pada proses fermentasi moromi prinsipnya adalah kerja proteolisis. Degradasi protein/asam amino tidak hanya berpengaruh pada nilai nutrisi tetapi juga berpengaruh terhadap karakteristik rasa dan flavor yang disebabkan pembentukan senyawa aromatik (Yanfang & Wenyi 2009). Tahapan utama yang berpengaruh terhadap flavor kecap adalah pada saat proses pemanasan bahan mentah (kedelai), fermentasi koji, fermentasi moromi termasuk saat aging dan pasteurisasi (Nunomura & Sasaki1993).
B. Kecap
Kecap merupakan produk fermentasi dari pemecahan protein, lemak dan karbohidrat oleh kapang, khamir dan bakteri menjadi fraksi-fraksi yang lebih sederhana: asam amino, asam lemak dan glukosa. Fraksi-fraksi tersebut akan menentukan rasa, aroma, warna dan komposisi kecap. Kecap yang dibuat dengan cara fermentasi biasanya lebih baik ditinjau dari segi rasa dan aromanya. Kecap hasil fermentasi mengandung senyawa-senyawa hasil fermentasi seperti asam-asam organik dan alkohol yang memberikan aroma yang khas (Hardjo 1964).
B.1. Kimia Kecap
Senyawa organik dalam kecap tidak hanya berasal dari kedele tapi juga berasal dari gula merah yang digunakan. Kecap manis mengandung gula yang tinggi dengan adanya penambahan gula kelapa pada saat pembuatannya. Senyawa organik tersebut yaitu: sitrat, tartarat, suksinat, laktat, format, piroglutamat, propionat dan butirat (Judoamidjojo et al. 1985, Itoh et al. 1985). Komposisi komponen volatile kecap manis banyak ditentukan oleh komponen volatile gula merah yang ditambahkan pada saat pembuatan kecap manis tersebut (40-50%). Hasil penelitian Nurhayati (1996) didapatkan bahwa terdapat penambahan jenis komponen volatil pada kecap manis dibandingkan dengan jenis komponen volatil gula merahnya. Pada kecap manis dengan gula kelapa terdapat senyawa aldehid, asam, furan, pirol, turunan benzen dan ester. Pada kecap manis dengan gula aren terdapat senyawa aldehid, alkohol, furan, hidrokarbon, turunan benzen dan ester. Sedangkan pada kecap manis dengan gula tebu terdapat senyawa keton, alkohol, asam, furan, turunan benzen dan hidrokarbon.
Komponen volatil pada gula merah adalah keton, alkohol, asam, furan, pirazin, pirol, turunan benzen, ester, hidrokarbon dan fenol. Terdapat perbedaan komposisi komponen volatile berbagai jenis gula merah. Pada gula merah yang berasal dari aren tidak terdapat senyawa aldehid, tiazol, dan senyawa piran. Pada gula merah yang berasal dari tebu tidak terdapat senyawa tiazol, sedangkan pada gula kelapa tidak terdapat senyawa piridin. Secara keseluruhan pada gula kelapa teridentifikasi 89 komponen volatile, gula aren 104 komponen volatile dan gula tebu 108 komponen volatile (Nurhayati, 1996).
Gula memegang peranan penting dalam kecap manis, gula dapat meningkatkan kemanisan dan karakteristik aroma, mempengaruhi warna dan flavor kecap melalui reaksi Maillard, karamelisasi dan menurunkan aw sehingga
dapat memperpanjang masa simpan dengan cara menghambat pertumbuhan mikroorganisme. Tiga jenis kecap yaitu: kecap dengan gula aren, kecap dengan gula kelapa, kecap dengan gula tebu mampu mendeteksi adanya rafinosa dan stakhiosa (Tabel 2.1)( Wiratma 1995).
Tabel 2.1 Komposisi gula pada kecap aren, kecap gula kelapa dan kecap tebu Jenis Gula Kecap Aren(%) Kecap Kelapa(%) Kecap Tebu(%)
Stakhiosa 2,4 2,1 2,7
Rafinosa 0,6 0,8 0,8
Sukrosa 53,0 49,5 46,5
Glukosa 4,2 4,6 4,1
Fruktosa 5,2 4,7 4,3
Total 65,4 61,7 58,3
Sumber : Wiratma (1995)
Pada tahap 1,2 enolisasi gula mengalami enolisasi menghasilkan senyawa 1,2 enol. Reaksi ini lebih cepat dalam kondisi basa dibandingkan kondisi asam Tahap selanjutnya adalah tahap dehidrasi atau fisi. Pada tahap dehidrasi, senyawa 1,2 enol mengalami dehidrasi menghasilkan senyawa 5-hidroksimetil-2-furaldehid yang merupakan salah satu prekursor pigmen coklat (Hodge & Rist 1953). Tahap yang terakhir adalah tahap pembentukan pigmen coklat. Pada tahap ini diduga terjadi serangkaian reaksi polimerisasi dan kondensasi dari senyawa-senyawa 5-hidroksimetil-2-furaldehid, gliseraldehid dan piruvaldehidrat (Eskin et al. 1971).
Sebagian besar kecap Indonesia menunjukkan perbedaan kandungan gula, komposisi asam dan konsentrasi asam amino yang berhubungan dengan perlakuan fermentasi. Sekitar 70% gula yang terdapat dalam kecap Indonesia terdiri dari sukrosa, glukosa dan fruktosa. Asam-asam dalam kecap tidak hanya diperoleh dari koji dan tahap fermentasi garam, tetapi juga diperoleh dari penambahan gula palm (Judoamidjojo et al. 1985).
B.2. Perubahan Komponen Kecap Selama Pengolahan
Kecap dapat dibuat dari tiga cara: cara fermentasi, hidrolisa asam dan campuran keduanya. Proses pembuatan kecap secara fermentasi dibagi menjadi dua tahap utama. Tahap pertama merupakan tahap penguraian sakarolitik dan proteolitik kedelai dan tepung oleh kapang Aspergillus sp., kemudian diikuti oleh tahap kedua yaitu fermentasi dalam larutan garam dapur. Fermentasi kapang berlangsung 2-3 hari. Fermentasi ini sangat dipengaruhi oleh faktor-faktor fisik seperti ketersediaan oksigen, morfologi substrat, difusi, aw dan produksi panas
fosfatase, trans glikosidase, peptidase, ribonukleodipolimerase, mononukleotida-fosfatase, adenil-deaminase dan purin-nukleosidase (Hasseltine & Wang 1972). Enzim yang paling berperan adalah protease dan amilase (Yong & Wood 1974). Fermentasi kapang menghasilkan asam organik seperti asam oksalat, asam sitrat, asam D-glukonat, asam malat, asam fumarat, asam suksinat dan asam laktat (Wolf & Wolf 1974).
Pada fermentasi garam akan terjadi fermentasi asam laktat oleh bakteri asam laktat yang dilanjutkan dengan fermentasi alkohol oleh khamir. Produk akhir yang dihasilkan berupa asam laktat, asam suksinat, asam asetat, piroglutamat dan yang utama asam glutamat (Hesseltine & Wang 1972). Selama fermentasi garam akan terjadi pembentukan dan pemantapan warna. Pembentukan warna terutama disebabkan oleh reaksi pencoklatan (browning) yang terjadi antara beberapa komponen flavor seperti asam-asam amino dan gula. Intensitas warna ditimbulkan oleh berbagai komponen pembentuk flavor kecap seperti asam asetat, asam vanilat dan vanilin yang memiliki intensitas warna terbesar diikuti oleh asam suksinat, asam laktat dan tirosol (Yokotsuka 1960).
Penelitian yang dilakukan oleh Okuhara et al (1975) menunjukkan rasio antara total nitrogen dengan formol nitrogen berhubungan pula dengan reaksi pencoklatan pada kecap. Nilai formol nitrogen filtrat moromi mencapai maksimum pada 1 bulan fermentasi garam seiring dengan tercapainya jumlah maksimum total asam amino bebas dan jumlah asam glutamat. Hal ini sejalan dengan yang disimpulkan oleh Roling et al. (1996) yang didasarkan pada pengamatan formol nitrogen dan asam glutamat yang jumlahnya meningkat sampai 20 hari fermentasi dan tidak meningkat secara tajam lagi sampai 120 hari fermentasi. Kecenderungan yang sama juga terjadi pada aktivitas enzim glutaminase, protease dan leusin aminopeptidase yang terdapat pada moromi. Hal ini diperkuat dengan penelitian yang dilakukan oleh Shikata et al (1971) yang menyatakan bahwa hidrolisa enzimatik bahan mentah kecap dengan penambahan enzim selulase, diastase dan protease meningkatkan intensitas warna kecap yang berkorelasi persentase antara formol nitrogen dengan pentosa.
fermentasi yang dilakukan pada suhu 35-40 C fermentasi dapat berlangsung selama 1 bulan. Pembuatan kecap secara hidrolisis asam merupakan hidrolisis protein menggunakan asam sehingga dihasilkan peptida dan asam-asam amino. Selama proses hidrolisis dapat terjadi kerusakan asam-asam amino dan gula , dan terbentuk senyawa menyimpang (off flavor) seperti asam levulinat dan H2S
(Nunomura & Sasaki 1986).
Pengaruh peptida dalam proses pencoklatan selama aging sangat besar, namun asam amino lebih aktif daripada peptida dalam proses pencoklatan kecap. Produk hasil hidrolisa proteolitik baik secara individu maupun kombinasi dengan komponen bahan pangan lainnya, berkontribusi pada flavor dan warna makanan hasil fermentasi kedele (Hashiba 1982)
C. REAKSI MAILLARD C.1. Dasar Reaksi Maillard
Reaksi pembentukan warna dan flavor kecap manis terutama terjadi karena reaksi Maillard. Reaksi Maillard merupakan reaksi antara gugus karbonil terutama dari gula pereduksi dengan gugus amino terutama dari asam amino, peptida dan protein (Whistler & Daniel 1985). Reaksi awal antara gugus aldehid atau keton dari molekul gula dan gugus amino bebas dari molekul asam amino atau protein, oleh karena itu sering disebut dengan istilah reaksi gula-amino. Hasil reaksi yang diinginkan pada produk pangan contohnya pada produk coklat, sedangkan yang tidak diinginkan misalnya pada chips kentang (Miller 1998).
Reaksi Maillard dapat dibagi dalam tiga tahapan yaitu tahap awal dimana terbentuk glikosilamin dan Amadori Rearrangement Product (ARP), tahap intermediet dimana terjadi dekomposisi ARP dan degradasi strecker, dan tahap akhir dimana terjadi perubahan senyawa karbonil (furfural, produk fisi, dehidroredukton atau aldehid hasil degradasi strecker) menjadi senyawa yang mempunyai berat molekul tinggi. Produk degradasi ARP selama pemanasan adalah hidroksimetil furfural (HMF) yang terbentuk melalui jalur 3 deoksiglukoson yang merupakan prekursor dalam pembentukan melanoidin (Yokotsuka 1986).
4,5 mM. Kato et al dalam Hashiba (1972) menunjukkan bahwa 3-deoxyozones dan glukoson merupakan senyawa intermediat yang penting dalam reaksi browning.
Tahap akhir dari reaksi Maillard ini menghasilkan pigmen-pigmen melanoidin yang berwarna coklat. HMF atau furfural, dehidro-redukton maupun produk-produk fisi yang dihasilkan pada tahap intermediet dapat membentuk aldol dan polimer tanpa N. Aldol kemudian terkondensasi dan dengan adanya senyawa amino akan membentuk melanoidin (Gambar 2.1) . Begitu juga dengan HMF atau furfural, dehdro-redukton, aldehid serta produk-produk fisi dapat secara langsung bereaksi dengan senyawa amino menghasilkan melanoidin (Bailey & Won Um 1992). Selain melanoidin, reaksi Maillard juga menghasilkan flavor pada berbagai produk pangan (Gambar 2.2). Secara keseluruhan reaksi Maillard menghasilkan :
a. Pigmen coklat, yang diketahui sebagai melanoidin, mengandung sejumlah nitrogen, berat molekul bervariasi dan larut dalam air.
b. Senyawa volatil yang potensial sebagai substansi aroma c. Agen flavoring
d. Senyawa dengan sifat reduksi tinggi e. Kehilangan asam amino essensial f. Senyawa dengan sifat mutagen
g. Senyawa yang dapat menyebabkan crosslinking protein (Belitz & Grosch 1999)
Senyawa amino -H2O
Amadori rearrangement
-3H2O -2H2O
+ asam amino-α
- CO2
(Degradasi strecker) -senyawa
amino
+ H2O -2H + 2H
+ senyawa +senyawa +senyawa seny. seny amino amino amino amino amino
Gambar 2.1. Skema Reaksi Maillard (Hodge dan Rist 1953)
.
aldosa
Glikosilamin N-substituted
Produk amadori rearrangement
(1-amino-1-deoxy-2-ketose)
Basa schiff dari
hidroksimetilfurfural
atau 2-furaldehid
gula
Produk fisi (asetol, diasetil,
piruvaldehid, dsb)
redukton
Dehidro-
redukton
aldehid
Hidroksimetilfurfural atau
2-furaldehid
Aldol dan polimer
bebas nitrogen
Produk Amadori atau Heyns rearrangement pH rendah pH tinggi
1,2-enolisasi
2,3-enolisasi
3-deoksioson 1-deoksioson 1-amino-1,4-dideoksioson fisi asam amino
Furfural furanon furan karbonil degradasi HMF sikloten dikarbonil Strecker
+ asam piranon Amino diasetil
Senyawa hidroksiaseton +asam amino aldehid
berwarna Piruvaldehid -amino keton Pirazin ammonia Oxazol merkapto Tiazol aldehid H2S
+Prolin asetaldehid
Flavor kulit roti flavor daging
+ H2S
Komponen siklik bersulfur
Tabel 2.2 Beberapa pendapat peneliti mengenai struktur melanoidin
struktur melanodin References
C9.4H11.4NO4.6 (dari sistem model glu-gly)
Hayase F dan Kato H, 1981
C8.9H10.6NO4.6 (dari sistem model xyl-gly)
C12.0 H14.2N5.4
C27H17N3O13 dan C27H15N3O12 (dalam kecap manis) Yokotsuka 1986
Unit pengulangan rantai karbon Ikan, 1996
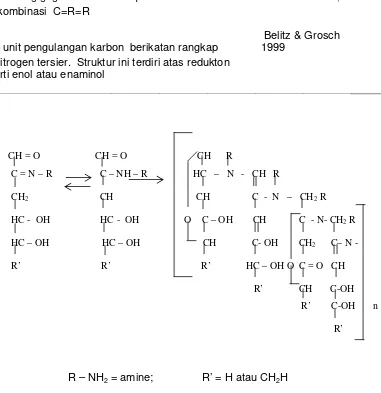
Mengandung gugus–OH..O- dari β-diketon Homma S et al,1997 atau kombinasi C=R=R
suatu unit pengulangan karbon berikatan rangkap
Belitz & Grosch 1999
dan nitrogen tersier. Struktur ini terdiri atas redukton
seperti enol atau enaminol
CH = O CH = O CH R
C = N – R C – NH – R HC – N - CH R
CH2 CH CH C - N – CH2 R
HC - OH HC - OH O C – OH CH C - N- CH2 R
HC – OH HC – OH CH C- OH CH2 C– N -
R’ R’ R’ HC – OH O C = O CH
R’ CH C-OH
R’ C-OH n
R’
R – NH2 = amine; R’ = H atau CH2H
Dari hasil penelitian Obretenov et al (1993) menunjukkan bahwa kenaikan temperatur dan waktu pemanggangan memberikan pembentukan produk dengan massa molekul yang lebih tinggi, kuantitasnya menurun pada suhu pemanggangan yang lebih tinggi disebabkan pembentukan polimer tidak larut air dan polimerisasi parsial melanoidin. Fraksi dengan massa molekul yang berbeda mempunyai karakteristik UV yang mirip.
C.2 Faktor-Faktor yang Mempengaruhi Reaksi Pencoklatan Non Enzimatis
Faktor-faktor yang mempengaruhi reaksi pencoklatan non enzimatis meliputi suhu, kadar air, pH, senyawa kimia seperti sulfur dioksida atau sulfit dan asam-asam organik (Eskin et al. 1971). Sedangkan menurut Miller (1998) faktor-faktor yang mempengaruhi pencoklatan karena reaksi Maillard meliputi suhu, konsentrasi gula dan gugus amina, pH dan jenis gula.
Peningkatan suhu pada saat proses pemanasan dapat meningkatkan kecepatan pembentukan warna coklat. Menurut Eskin et al (1971), penurunan suhu selama pengolahan dan penyimpanan dapat memperpanjang fase lag yang merupakan periode yang dibutuhkan untuk membentuk warna coklat pada produk.
Kadar air dan pH juga mempengaruhi pembentukan warna coklat, dimana pencoklatan akan semakin meningkat dengan bertambahnya kadar air dan meningkatnya pH (Hashiba 1978). Kebanyakan pengaruh pH berhubungan dengan protonasi gugus amino. Pada pH rendah , gugus amino banyak yang di protonasi sehingga sedikit yang tersedia untuk reaksi (Miller 1998).
Reaksi secara lambat terjadi pada pangan kering dan dalam larutan dengan kelarutan yang tinggi. Kebanyakan reaksi browning maksimum terjadi dalam pangan yang mempunyai kelembaban 10-15%. Hal ini disebabkan air penting untuk terjadinya suatu reaksi sehingga reaktan akan mudah dipisahkan. Air juga dapat bertindak sebagai penghambat reaksi disebabkan tahapan yang kompleks dalam tahapan reaksinya menyebabkan dehidrasi.
Komponen yang berperan pada pencoklatan kecap terbagi menjadi dua yaitu fraksi kation dan fraksi gabungan antara anion dengan fraksi netral. Fraksi anion terdiri dari asam amino, abu dan senyawa yang belum diketahui. Hanya fraksi kation yang bertambah gelap selama penyimpanan dengan adanya sedikit gula. Pembentukan warna merupakan proses yang kompleks, diduga dipengaruhi oleh faktor seperti gula, karbonil, komponen Amadori, redukton, asam organik, besi, tembaga, sodium klorida, total nitrogen, peptida dan asam amino. Senyawa redukton, komponen karbonil dan 3-DG (deoksiglukoson) dilaporkan mempunyai peranan penting dalam reaksi pencoklatan. Redukton diperoleh dari fraksi kation dalam jumlah sedikit dan dapat dielusi dengan HCl, sehingga fraksi kation yang mengandung redukton warnanya gelap (Hashiba 1978).
D. ANTIOKSIDAN
D.1. Mekanisme oksidasi lemak
Oksidasi lemak berjalan dengan dua tahap: 1) disebut sebagai periode induksi, selama tahap ini oksidasi berjalan lambat dengan laju kecepatan seragam, 2) Laju oksidasi pada tahap kedua beberapa kali lebih cepat dari tahap pertama. Umumnya lemak dan minyak mulai terasa tengik pada awal tahap kedua. Asam linoleat yang memiliki ikatan rangkap lebih banyak bereaksi lebih cepat dibanding metil oleat akibatnya periode induksinya lebih pendek (Meyer 1973 & Hamilton 1983).
Mekanisme oksidasi lipid tidak jenuh diawali dengan tahap inisiasi, yaitu terbentuknya radikal bebas (R*) bila lipida kontak dengan panas, cahaya, ion metal dan oksigen. Reaksi ini terjadi pada grup metilen yang berdekatan dengan ikatan rangkap –C=C- (Smith 1991).
tahap terminasi, dimana hidroperoksida yang sangat tidak stabil terpecah menjadi senyawa organik berantai pendek seperti aldehid, keton, alkohol dan asam (Gambar 2.4).
Inisiasi : ROOH* ROO. + H. ROOH RO. + ..OH
2ROOH RO. + H2O + ROO.
Propagasi : R. + O2 ROO.
ROO. + R1H ROOH + R1 Terminasi : ROO. + R1OO ROOR1 + O2
RO. + R1 ROR’
Gambar 2.4. Mekanisme autooksidasi (Gordon 1990)
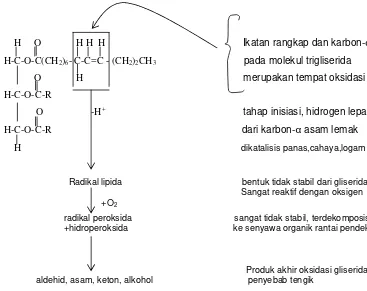
Menurut Sherwin (1990) terbentuknya radikal diawali dengan oksidasi pada ikatan rangkap dan karbon--α dalam molekul trigliserida. Tahap inisiasi hidrogen dihilangkan dari karbon-α. Hal ini dikatalisis oleh panas, sinar dan logam. Bentuk yang tidak stabil dari trigliserida ini sangat reaktif dengan oksigen sehingga mudah membentuk senyawa organik dengan rantai pendek. Pada akhirnya gliserida tersebut mengalami ketengikan dalam pangan. Untuk lebih jelasnya dapat dilihat pada Gambar 2. 5.
Faktor-faktor dan kondisi yang dapat ikut berperan pada oksidasi lipida adalah (a) panas, setiap peningkatan suhu sebesar 10 oC laju kecepatan meningkat dua kali, (b) cahaya, terutama ultraviolet yang merupakan inisiator dan katalisator kuat, (c) logam, logam terlarut seperti Fe, Cu merupakan katalisator kuat meski dalam jumlah kecil, (d) kondisi alkali, ion alkali merangsang radikal bebas, (e) tingkat ketidakjenuhan, jumlah dan posisi ikatan rangkap pada molekul lipida berhubungan langsung dengan kerentanan terhadap oksidasi (contoh, asam linolenat lebih rentan dibandingkan asam oleat), dan (f) ketesediaan oksigen (Smith 1991).
D.2. Reaksi Antioksidasi
1990). Untuk itu antioksidan harus mempunyai sifat: efektif pada konsentrasi rendah, aman, tidak memberi warna, odor atau flavor, tahan setelah pengolahan, stabil dalam produk akhir, larut dalam lemak, tersedia dengan harga yang relatif
H O H H H Ikatan rangkap dan karbon-α
H-C-O-C(CH2)6- C-C=C - (CH2)2CH3 pada molekul trigliserida
O H merupakan tempat oksidasi
H-C-O-C-R
O -H+ tahap inisiasi, hidrogen lepas
H-C-O-C-R dari karbon-α asam lemak
H dikatalisis panas,cahaya,logam
Radikal lipida bentuk tidak stabil dari gliserida
Sangat reaktif dengan oksigen +O2
radikal peroksida sangat tidak stabil, terdekomposisi +hidroperoksida ke senyawa organik rantai pendek
[image:34.595.138.505.168.459.2]
Produk akhir oksidasi gliserida aldehid, asam, keton, alkohol penyebab tengik
Gambar 2.5. Reaksi ketengikan oksidatif pada lipida (Sherwin 1990)
rendah dan kelihatan “natural” pada kemasan (Cuppett et al 1996). Antioksidan dapat berperan sebagai inhibitor atau pemecah peroksida.
a. Inhibitor
Jumlah rantai reaksi yang paling mungkin dihentikan oleh satu molekul inhibitor adalah dua. Oleh karena itu reaksi antara suatu inhibitor dengan sebuah radikal peroksi berlangsung melalui dua tahap:
ROO + AH2 ROOH + AH AH + AH A + AH2 • AH : antioksidan
Mekanisme lain melalui pembentukan kompleks antara radikal peroksi dan inhibitor. Kompleks ini kemudian bereaksi dengan radikal peroksi lain menghasilkan produk terminasi. Fase ini yang menentukan kecepatan reaksi.
ROO + AH (ROO AH) (ROO AH) + AH produk terminasi
Pada umumnya antioksidan dapat menghentikan rantai reaksi oksidatif sebagai berikut : (1) dengan donasi elektron pada radikal peroksi; (2) dengan donasi atom hidrogen pada radikal peroksi; (3) dengan adisi pada radikal peroksi sebelum atau sesudah terjadi oksidasi parsial, dan (4) dengan metode lain yang mungkin berkaitan dengan radikal hidrokarbon
b.Pemecah peroksida
Mekanisme ini meliputi dekomposisi katalitik hidroperoksida yang mula-mula terdapat dalam sistem, atau mungkin terbentuk sebagai akibat serangan langsung oksigen pada substrat atau pada inhibitor. Hasil stabil primernya bukanlah radikal bebas. Dekomposisi dapat berlangsung dengan proses stoikhiometrik, dengan proses yang menghasilkan radikal bebas dan dalam beberapa hal dengan pengaturan ionik. Beberapa senyawa sulfur adalah pemecah peroksida yang efektif. Peranan ini dapat berupa reaksi transfer satu elektron, dan struktur permulaannya mungkin hanya prekursor inhibitor aktif (Smith 1991).
(A*) sehingga menjadi stabil. Antioksidan sekunder dapat memperlambat laju reaksi autooksidasi. Mekanisme kerjanya seperti: mengikat ion metal, menangkap oksigen, memecah hidroperoksida menjadi non radikal, menyerap radiasi ultra violet atau mendeaktifkan oksigen singlet (Gordon 1990).
Berdasarkan sumbernya, antioksidan dibagi dalam dua kelompok, yaitu antioksidan sintetik (BHA, BHT, TBHQ, propil gallat, dll) dan antioksidan alami (tocopherol, karoten , flavonoid, diterpen, senyawa produk reaksi Maillard, dll). Peranan antioksidan sintetis semakin menurun digantikan posisinya oleh antioksidan alami karena adanya kekhawatiran penyebab kanker.
Ada beberapa senyawa fenolik pada kedelai yang memiliki aktivitas antioksidan, salah satunya adalah flavonoid. Flavonoid kedelai unik karena dari semua flavonoid yang teridentifikasi adalah isoflavon. Senyawa antioksidan alami isoflavon kedelai adalah 5,7,5’-trihidroksiisoflavon-7-O-monoglukosida (geninstein), 7,4’-dihidroksiisoflavon-7-O-monoglukosida (daidzein), dan 7,4’-dihidroksi-6-metoksi-isoflavon-7-O-monoglukosida (glycitein). Isoflavon yang terdapat pada produk kedelai yang difermentasi yaitu 6,7,4’-trihidroksiisoflavon (Pratt 1992). Selain isoflavon, kedelai dan produk-produk kedelai merupakan sumber berbagai macam senyawa antioksidan yang merupakan golongan dari turunan asam sinamat, fosfolipida, tokoferol, asam amino dan peptida (Shahidi & Naczk 1995)
D.3 Antioksidan dalam Produk Reaksi Maillard
Antioksidan dikelompokkan ke dalam dua kategori: menangkap radikal bebas dan mengkelat logam/metal (Lu & Baker 1986). Efek menangkap radikal dari ovalbumin semakin meningkat dengan adanya konyugasinya dengan dekstran atau galaktomanan melalui reaksi Maillard antara gugus amino bebas dalam protein dan gugus karbonil pereduksi dalam polisakarida (Nakamura et al. 1992).
Redukton sebagai agen pereduksi organik mempunyai gugus fungsional yang berasal dari konyugasi enediol dan karbonil. Peneliti yang lain menunjukkan bahwa analog amino dimana gugus hidroksilnya digantikan oleh NH2 atau gugus
karbonilnya digantikan oleh gugus –C=NR menjadi agen pereduksi yang kuat. Menurut Bailey & Won Um (1992), tiga jalan utama yang berperan pada pembentukan senyawa intermediat dalam antioksidan dan pembentukan pigmen dari senyawa Amadori, yaitu 1-deoksioson, 1-deoksiredukton dan 3-deoksioson. Jalur ke empat dari degradasi strecker. Pembentukan enol dari 1-deoksioson (1-deoksiredukton) dengan degradasi menghasilkan piruvaldehid, diasetil, asetaldehid, asam asetat dan redukton. Senyawa-senyawa ini potensial sebagai prekursor antioksidan, khususnya ketika pemanasan amina.
Amino redukton kemungkinan lebih efektif dan stabil dibandingkan dengan enediol. Redukton amino lebih baik sebagai antioksidan disebabkan nitrogennya menyumbangkan gugus elektrofilik yang mampu mengkelat ion metal seperti copper dan Fe yang diketahui mempunyai aktivitas katalitik.
Gugus penting lainnya dari senyawa yang dibentuk oleh dehidrasi senyawa 2,3-enolisasi (2,3-osone) yang diikuti rekondensasi dengan amina adalah amina redukton, yang kemungkinan mempunyai aktivitas sebagai antioksidan. Reaksi ini dapat berasal dari degradasi D-Fruktoseamine dalam larutan alkali
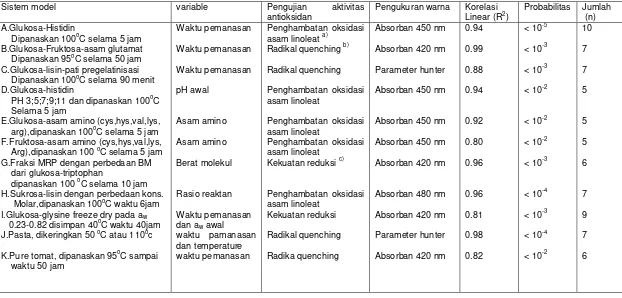
Produk reaksi Maillard dengan perlakuan panas dari sistem model glukosa-glisin menghambat lebih dari 90 % radikal OH. Mekanisme penghambatannya tidak hanya menangkap radikal OH secara langsung tetapi juga dengan menekan pembentukan radikal OH melalui pengkelatan dengan logam Fe2+ (reaksi Fenton). Kemampuan pengkelatan metal dari produk reaksi Maillard dengan berat molekul yang besar adalah lebih tinggi dibandingkan dengan yang mempunyai berat molekul kecil (Yoshimura et al 1997). Pada Tabel 2.3 memperlihatkan banyak sistem model produk reaksi Maillard mempunyai aktivitas sebagai antioksidan.
Tabel 2.3 .Deskripsi Sistem Model dan Pangan yang Mengalami Browning Non-Enzimatis dan Koefisien Statistik Aktivitas Antioksidan dengan Warna
a). Dengan pengukuran polarografik konsumsi oksigen,gas kromatografi-head space atau deteksi bilangan peroksida b). Pengamatan spektroskopik penghambatan crocin bleaching
c). Dengan Potasium Ferisianida
(Manzocco L et al. 2001)
Sistem model variable Pengujian aktivitas
antioksidan
Pengukuran warna Korelasi
Linear (R2)
Probabilitas Jumlah
(n) A.Glukosa-Histidin
Dipanaskan 100oC selama 5 jam
B.Glukosa-Fruktosa-asam glutamat
Dipanaskan 95oC selama 50 jam
C.Glukosa-lisin-pati pregelatinisasi
Dipanaskan 100oC selama 90 menit
D.Glukosa-histidin
PH 3;5;7;9;11 dan dipanaskan 100oC
Selama 5 jam
E.Glukosa-asam amino (cys,hys,val,lys,
arg),dipanaskan 100oC selama 5 jam
F.Fruktosa-asam amino (cys,hys,val,lys,
Arg),dipanaskan 100 oC selama 5 jam
G.Fraksi MRP dengan perbedaan BM dari glukosa-triptophan
dipanaskan 100 oC selama 10 jam
H.Sukrosa-lisin dengan perbedaan kons.
Molar,dipanaskan 100oC waktu 6jam
I.Glukosa-glysine freeze dry pada aw
0.23-0.82 disimpan 40oC waktu 40jam
J.Pasta, dikeringkan 50 oC atau 110oc
K.Pure tomat, dipanaskan 95oC sampai
waktu 50 jam
Waktu pemanasan Waktu pemanasan Waktu pemanasan pH awal Asam amino Asam amino Berat molekul Rasio reaktan Waktu pemanasan
dan aw awal
waktu pamanasan dan temperature waktu pemanasan
Penghambatan oksidasi
asam linoleat a)
Radikal quenching b)
Radikal quenching
Penghambatan oksidasi asam linoleat
Penghambatan oksidasi asam linoleat
Penghambatan oksidasi asam linoleat
Kekuatan reduksi c)
Penghambatan oksidasi asam linoleat
Kekuatan reduksi
Radikal quenching
Radika quenching
Absorban 450 nm
Absorban 420 nm
Parameter hunter
Absorban 450 nm
Absorban 450 nm
Absorban 450 nm
Absorban 420 nm
Absorban 480 nm
Absorban 420 nm
Parameter hunter
Absorban 420 nm
0.94 0.99 0.88 0.94 0.92 0.80 0.96 0.96 0.81 0.98 0.82
< 10-5 < 10-3 < 10-3 < 10-2
< 10-2 < 10-2 < 10-3
< 10-4 < 10-3 < 10-4 < 10-2
(Bailey & Won Um 1992). Contoh yang lain aktivitas antioksidan produk reaksi Maillard juga berpengaruh terhadap stabilitas oksidasi pada margarin.
Produk reaksi Maillard non volatil yang telah dilaporkan berfungsi sebagai antioksidan adalah produk reaksi Maillard berberat molekul tinggi (melanoidin) dan berberat molekul rendah (Bailey & Won Um 1992). Salah satu penelitian yang dilakukan oleh Schlüsselw rter (2001) menggunakan melanoidin standar yang ditambahkan pada minyak wijen dan efeknya dibandingkan dengan α-tokoferol dan sesamol, yaitu senyawa antioksidan yang terdapat pada minyak wijen. Hasilnya menunjukkan bahwa efek antioksidannya meningkat dengan semakin meningkatnya suhu pemanasan biji wijen.
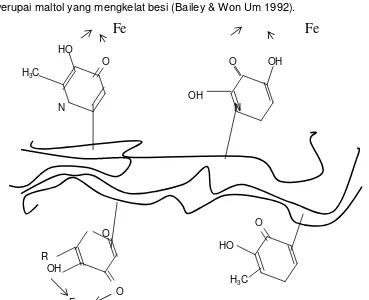
Dua mekanisme yang mungkin yang dapat menjelaskan sifat antioksidan melanoidin adalah pembentukan radikal bebas (sebagai inhibitor) dan pembentukan struktur reduktone (enaminol). Struktur melanoidin mengindikasikan adanya tipe redukton yang berperan sebagai antioksidan (mengkelat metal sebagaimana aktivitas reduksi). Hal ini menunjukkan struktur hidroksi piridone atau seperti piranone (Gambar 2.6) dalam melanoidin yang mengkompleks besi (Fe+++) dan mereduksi aktivitas katalitiknya. Struktur ini menyerupai maltol yang mengkelat besi (Bailey & Won Um 1992).
Fe
Fe
HO
O O OH H3C
OH
N N
O O HO
R OH
H3C O
[image:39.595.139.508.408.708.2]Fe
Enediol dan enaminol pada melanoidin mempunyai aktivitas pereduksi. Perubahan bentuk oksidasi-reduksi dari redukton melanoidin berpengaruh pada intensitas warna, pengkelat metal dan disosiasi gugus fungsional (Tabel 2.4 ).
Tabel 2.4 .Efek oksidasi dan reduksi pada aktivitas pengkelat, intensitas warna dan berat molekul melanoidin
Aktivitas Pengkelat
Melanoidin berikatan Cu
(µg Cu/mg melanoidin) E1%500nm BM
peak positif peak negatif
utuh 22.9 8.4 30.4 32000
teroksidasi 29.8 8.8 20.8 51000
terreduksi 9.1 2.3 19.0 41000
(Homma S et.al 1997)
Melanoidin merupakan reduktone dan polimer amfoter. Pada proses pengolahan kecap, melanoidin mengalami oksidasi-reduksi. Enediol dan enaminol dalam melanoidin termasuk dalam aktivitas reduksi dan antioksidan. Perubahan dalam bentuk oksidasi-reduksi dari redukton dalam melanoidin mempengaruhi warna, aktivitas mengkelat metal dan disosiasi gugus fungsional.
E. Uji Aktivitas Antioksidan
schaal, uji masa simpan dan Rancimat. Pengujian secara tidak langsung didasarkan pada pengukuran selain produk utama atau sekunder oksidasi lipida, seperti misalnya jumlah oksigen yang diperlukan untuk oksidasi. Contohnya uji OBT, sistem emulsi -karoten-linoleat, penyemprotan larutan -karoten dan metode penimbangan.
Uji AOM
Metode ini memprediksi stabilitas lemak dengan cara mengalirkan udara dengan kecepatan, suhu dan konsentrasi oksigen tertentu ke dalam cairan lemak. Metode ini juga berdasarkan evaluasi periodik kandungan peroksida dalam lemak yang teroksidasi. Pada pengujian AOM, sampel cairan diletakkan dalam tube aerasi khusus yang dimasukkan dalam wadah. Udara tersaring dihembuskan melalui sampel dan di awasi secara hati-hati. Sampel diletakkan pada suhu 97oC kemudian secara periodik, sampel lemak dianalisa kandungan peroksidanya berdasarkan reaksi dengan indikator pati-yodida. Metode ini sering dipergunakan untuk penelitian, pengawasan mutu dan tujuan pemasaran (Raharjo 2004).
Nilai TBA
Oksidasi lemak pada fase lanjut (terminasi) menghasilkan senyawa-senyawa aldehid seperti 2-enal dan 2-dienal. Senyawa aldehid ini bisa bereaksi dengan asam 2-thiobarbiturat (TBA) sehingga bisa dilakukan pengukuran terhadapnya. Hasil reaksinya akan membentuk warna merah yang dapat diukur menggunakan spektrofotometer. Meskipun semula metode ini dimaksudkan mengukur kadar malonaldehid, namun uji TBA ini juga bisa bereaksi dengan aldehid lain termasuk dengan senyawa fenol pada produk yang diasapi. Penerjemahan nilai TBA mirip seperti angka peroksida (Raharjo 2004).
Rancimat
Autooksidasi lipida disebabkan oleh aliran udara bersuhu 100 oC dalam suatu model alat Rancimat. Pengukuran didasarkan pada penentuan nilai konduktivitas senyawa volatil sebagai produk sekunder dari oksidasi lipid.
Metode Tiosianat
akan mengoksidasi Fe2+ menjadi Fe3+ yang dengan tiosianat membentuk warna merah (Tressl dan Wondrak, 1998).
Metode Menangkap Radikal
Menangkap radikal adalah mekanisme utama antioksidan dalam pangan. Beberapa metode yang dikembangkan dengan menangkap radikal sintetik dalam pelarut organik polar, seperti metanol dalam suhu ruangan. Radikal yang sering dipergunakan yaitu 2,2-diphenyl-1-picrylhydrazil (DPPH) dan 2,2’-azinobis (3-ethylbenzthiazoline-sulphonic acid) (ABTS). Dalam pengujian dengan DPPH, aktivitas menangkap radikal DPPH oleh suatu antioksidan dimonitor dengan penurunan absorbansi. Reaksi cepat radikal DPPH terjadi dengan beberapa phenol seperti -tokoferol, reaksi selanjutnya secara lambat menyebabkan penurunan absorbansi sampai dicapai keadaan stabil selama beberapa jam. Banyak peneliti menggunakan metode DPPH dengan waktu reaksi manangkap radikal selama 15 atau 30 menit (Gordon et al 2001).
Uji Aktivitas Antioksidan dalam Sistem Biologi
Uji aktivitas antioksidan dalam sistem biologi dapat dilakukan dengan menggunakan sel eritrosit, karena fungsinya yang penting dalam tubuh dan kerentanannya terhadap oksidasi maka banyak peneliti menggunakan eritrosit sebagai model untuk mempelajari kerusakan oksidatif biomembran. Pada umumnya parameter yang dipergunakan untuk mengetahui terjadinya kerusakan pada membran adalah persentase hemolisis yang terjadi pada eritrosit. Semakin tinggi persentase hemolisis yang terjadi menandakan semakin parahnya kerusakan yang terjadi pada membran, begitu pula sebaliknya, semakin rendah persentase hemolisis yang terjadi menandakan bahwa semakin tahan membran sel terhadap kerusakan. Tersedianya antioksidan di dalam plasma mengurangi kerusakan oksidatif pada eritrosit (Zhu et al 2002).
F. Fraksinasi Produk Reaksi Maillard
rendah (<100000 Da) ( Hofmann et al 1999). Pada penelitian yang lain Hofmann (1998b) mengukur intensitas pencoklatan pada berbagai fraksi dari sistem model glukosa-glisin. Intensitas pencoklatan semakin besar terdapat pada fraksi dengan berat molekul yang semakin kecil.
Yaylayan dan Kaminsky (1998) mendapatkan tiga fraksi (A, B1, B2) pada berat molekul diantara 10000 Da dan 20000 Da dengan fraksinasi menggunakan gel filtrasi pada sistem model glukosa-glisin. Formula empiris untuk polimer A (C7H11N1O4) dan untuk polimer B1 dan B2 sama dengan D-glukosa (C1H2O1).
Polimer A mengandung nitrogen tersusun atas senyawa intermediat Amadori atau turunannya, sedangkan polimer B1 dan B2 tersusun atas glukoson dan atau 3- atau 1-deoksiglukoson. Hofmann (1998a) mendapatkan 2 peak yang intens menggunakan HPLC pada sistem model kasein dan furan-2-karboksaldehide yang menghasilkan melanoidin dengan berat molekul >10000 Da. Keduanya teridentifikasi sebagai kromophore asam amino (S)-2-amino-6-4-[(E)-1-formil-2-(2-furil)ethenil]-5-(2-furil) metilidene]-2,3-dihidro-3-oxo-1 H-pirol-1-yl} asam heksanoat dan isomer 2-[(Z)-(2-furil)metiliden]. Senyawa melanodin ini dihasilkan dari reaksi silang antara khromophore berat molekul rendah dan biopolimer dengan berat molekul tinggi yang tidak berwarna.
II. METODOLOGI PENELITIAN
Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Kimia dan Biokimia, Pusat Antar Universitas Pangan dan Gizi dan di Laboratorium Kimia Pangan dan Gizi, Jurusan Teknologi Pangan dan Gizi, Fakultas Teknologi Pertanian, Institut Pertanian Bogor dan di Laboratorium Fisika Universitas Indonesia, Jakarta. Penelitian dilaksanakan mulai bulan Agustus 2002 sampai dengan Juni 2005 dan November 2007 sampai Juni 2008
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah moromi yang diperoleh dari PT. Indofood Sukses Makmur dengan umur fermentasi 3 bulan, gula merah (gula kelapa) dan gula pasir.(sukrosa). Bahan kimia yang digunakan untuk penetapan kadar α-amino nitrogen adalah trinitrobenzene sulfonic acid (TNBS, Sigma - Aldrich), HCl 1N dan 0,02 M, leusin, dan untuk penetapan kadar protein dengan metode Kjeldahl digunakan K2SO4, H2SO4, HGO, H2BO3,Na2S2O3,
NaOH, indikator metil merah dan biru, sedangkan untuk penetapan kadar protein terlarut dengan metode Lowry digunakan pereaksi Folin-Ciocalteau, Na-K tartarat, tembaga sulfat, Natrium karbonat, larutan bovine serum albumin (BSA, E. Merck). Untuk penetapan kadar fenol digunakan etanol 95%, Na2CO3 5% dan
asam tanat. Untuk pengukuran kadar gula digunakan larutan Fehling, dekstrosa standar, metilen biru, CaCO3, Pb-acetat, Na-oksalat dan asam sulfat. untuk uji
sifat antioksidan digunakan minyak kedelai, air bebas ion, tween-80, asam thiobarbiturat, 1,1-diphenyl-2-picrylhydrazyl, asam linoleat, buffer fosfat, NH4SCN, FeCl2 dan HCl. Untuk uji antioksidan dalam sistem biologi digunakan
phosphat bufer saline, biru triphan, H2O2 dan darah dari donor yang sehat
berjenis kelamin laki-laki.
Metode Penelitian
Secara umum penelitian dilakukan mengikuti alur seperti pada Gambar 3.1. Tahapan penelitian ini meliputi :
1. Pengukuran kadar gula sukrosa, fruktosa, glukosa pada gula merah dan gula pasir
2. Pembuatan produk: moromi yang dipanaskan (MP), kecap manis dengan gula merah (KGM) dan kecap manis dengan gula pasir (KGP). Kemudian dilakukan beberapa analisis yang meliputi: kandungan air, protein, lemak, total padatan terlarut, gula pereduksi, dan komposisi asam amino
3. Fraksinasi terhadap ke empat jenis produk menggunakan membran ultrafiltrasi cut off 10; 30; dan 100 kDa. Pada masing-masing produk didapatkan 4 fraksi meliputi:
Fraksi 1: BM > 100 kDa
Fraksi 2: BM 30 kDa – 100 kDa Fraksi 3: BM 10 kDa – 30 kDa Fraksi 4: BM < 10 kDa