KEMAMPUAN ISOLAT BAKTERI KITINOLITIK DALAM
MENGENDALIKAN PENYAKIT JAMUR AKAR PUTIH
(Rigidoporus microporus) PADA BIBIT TANAMAN KARET
TESIS
Oleh:
RAHMIATI
117030035/BIO
PROGRAM PASCASARJANA BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERNYATAAN ORISINALITAS
KEMAMPUAN ISOLAT BAKTERI KITINOLITIK DALAM MENGENDALIKAN PENYAKIT JAMUR AKAR PUTIH (Rigidoporus
microporus)
PADA BIBIT TANAMAN KARET
TESIS
Dengan ini saya nyatakan bahwa saya mengakui semua karya tesis ini adalah hasil kerja saya sendiri kecuali kutipan dan ringkasan yang tiap satunya telah dijelaskan sumbernya dengan benar,
Medan, Agustus 2013
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademika Universitas Sumatera Utara, saya yang bertanda tangan di bawah ini:
Nama : Rahmiati
NIM : 117030036
Program Studi : Biologi Jenis Karya Ilmiah : Tesis
demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Eksklusif (Non-Exclusive Royalty Free Right) atas Tesis saya yang berjudul:
KEMAMPUAN ISOLAT BAKTERI KITINOLITIK DALAM MENGENDALIKAN PENYAKIT JAMUR AKAR PUTIH (Rigidoporus
microporus)
PADA BIBIT TANAMAN KARET
Beserta perangkat yang ada (jika diperlukan). Dengan hak bebas Royalti noneksklusif ini, Universitas Sumatera Utara berhak menyimpan, mengalih media, memformat, mengelola dalam bentuk data base, merawat dan mempublikasikan tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan sebagai pemegang dan atau sebagai pemilik hak cipta.
Demikian surat pernyataan ini dibuat dengan sebenarnya.
Medan, Agustus 2013
Telah diuji pada
Tanggal :……….
PANITIA PENGUJI TESIS
Ketua : Prof. Dr. Dwi Suryanto, M.Sc
Anggota : 1. Prof. Dr. Erman Munir, M.Sc
2. Dr. It Jamilah, M. Sc
DAFTAR RIWAYAT HIDUP
DATA PRIBADI
Nama lengkap berikut gelar : Rahmiati, S.Si Tempat dan Tanggal lahir : Medan, 04 Mei 1988
Alamat Rumah : Jalan Bunga Cempaka VII, Lingkungan III No. 60 Padang Bulan, Medan
Telepon/ Faks/ HP : 085276673282
e-mail : rahmiati.rahmiati@ymail.com
DATA PENDIDIKAN
SD : SD Negeri 064024 Tamat : 2000
SMP : SMP Negeri 1 Medan Tamat : 2003
KATA PENGANTAR
Puji dan syukur penulis sampaikan ke hadirat Allah SWT yang telah melimpahkan rahmat dan karunia Nya, serta salawat beriring salam penulis sampaikan kepada Nabi Muhammad SAW, sehingga penulis dapat menyelesaikan tesis yang berjudul, kemampuan isolat bakteri kitinolitik dalam mengendalikan penyakit jamur akar putih (Rigidoporus microporus) pada tanaman karet, sebagai salah satu syarat untuk meraih gelar Magister Sains Program Pascasarjana Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara Medan.
Dalam kesempatan ini penulis mengucapkan terima kasih kepada Bapak Prof. Dr. Dwi Suryanto, M.Sc dan Prof. Dr. Erman Munir, M.Sc sebagai Dosen Pembimbing 1 dan Dosen Pembimbing 2, Ibu Dr. It Jamilah, M.Sc dan Dr. Yunasfi selaku dosen penguji yang telah memberikan waktu, bimbingan, perhatian, saran, kritik dalam penulisan hasil penelitian ini. Ketua Program Studi Pascasarjana Biologi Bapak Prof. Syafruddin Ilyas, M. Biomed dan seluruh pengajar dan pegawai di Program Studi Pascasarjana Biologi.
Penelitian ini didanai oleh DIKLITABMAS DIKTI melalui Hibah Unggulan Perguruan Tinggi Universitas Sumatera Utara. Terima kasih kepada Sekretaris Jendral Pendidikan Tinggi (SEKJEN DIKTI) yang telah memberikan beasiswa pendidikan S2 melalui beasiswa unggulan. Terima kasih juga ditujukan kepada Balai Penelitian Karet Sei Putih yang telah memberikan banyak masukan, saran, dan informasi yang menunjang keberhasilan penelitian ini.
Medan, Agustus 2013
KEMAMPUAN ISOLAT BAKTERI KITINOLITIK DALAM MENGENDALIKAN PENYAKIT JAMUR AKAR PUTIH
(Rigidoporusmicroporus) PADA BIBIT TANAMAN KARET
ABSTRAK
Bakteri kitinolitik diketahui memiliki kemampuan untuk mengendalikan serangan jamur patogen pada tanaman. Pada penelitian ini kemampuan bakteri kitinolitik dalam mengendalikan penyakit jamur akar putih yang disebabkan oleh Rigidoporus microporus telah dilakukan. Tiga isolat bakteri kitinolitik yaitu Bacillus sp. BK17, Enterobacter sp. PB17, dan PB08 digunakan untuk mengendalikan penyakit jamur akar putih pada bibit tanaman karet. Isolat bakteri diaplikasikan ke tanah satu hari dan tiga puluh hari setelah inokulasi jamur patogen. Ketiga isolat bakteri kitinolitik dapat menurunkan intensitas serangan jamur akar putih dan hasilnya menunjukkan perawakan tanaman yang lebih baik dibandingkan dengan kontrol. Enterobacter sp. PB17 dan PB08 mampu menurunkan intensitas serangan sebesar 37.5%. Enterobacter sp. PB17 dan PB08 menunjukkan nilai intensitas serangan dan luas serangan terendah masing-masing sebesar 20% dan 60% pada aplikasi isolat satu hari dan tiga puluh hari setelah inokulasi patogen. Pengamatan mikroskopis menunjukkan bahwa hifa R. microporus yang dihambat oleh isolat bakteri kitinolitik mengalami abnormalitas yaitu bentuk hifa bengkok, lisis, melilit dan menggulung. Aplikasi Enterobacter sp. PB17, PB08, dan Bacillus sp. BK17 pada bibit tanaman karet mampu menambah tinggi tanaman, diameter batang dan jumlah daun.
THE ABILITY OF CHITINOLYTIC BACTERIAL ISOLATES TO CONTROL WHITE ROOT DISEASE (Rigidoporus microporus) IN RUBBER SEEDLINGS
ABSTRACT
Chitinolytic bacteria have been known for their ability to control various fungal diseases of plants. In this study potential of chitinolytic bacterial isolates to control white root disease of rubber plant caused by Rigidoporus microporus was examined. Three chitinolytic bacterial isolates Bacillus sp. BK17, Enterobacter sp. PB17, and PB08 were used to control white root disease in rubber seedlings. Rubber seedling were planted in soil-sand (2:1) growing media in polyethene plastic bag. Isolates were applied in soil one day and thirty days after fungal conidia inoculation. All three chitinolytic bacteria decreased disease intensity of white root disease and resulted in better plant performance to some extent. Enterobacter sp. PB17 and PB08 showed to decrease white root infection by 37.5%. Enterobacter sp. PB17 and PB 08 might decline disease intensity and severity to 20% and 60%, respectively thirty day and one day after fungal conidia inoculation. Microscopic observations showed that R. microporus hyphae was abnormal i. e. curved, lysis, twisting and rolled. Moreover, Enterobacter sp. PB17, PB08, and Bacillus sp. BK17 increased plant height, diameter, and leaf number.
DAFTAR ISI
Halaman
PENGESAHAN i
PERNYATAAN ORISINALITAS ii
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH iii
DAFTAR RIWAYAT HIDUP v
2.2 Penyakit Jamur Akar Putih (JAP) 6
2.3 Bakteri Kitinolitik dan Enzim Kitinase 8
2.4 Potensi Bakteri Kitinolitik Sebagai agen Pengendali Hayati 10
BAB 3 BAHAN DAN METODE 12
3.1 Waktu dan Tempat 12
3.2 Alat dan Bahan 12
3.3 Sumber Isolat 13
3.4 Pengamatan Gejala Serangan 13
3.5 Uji Antagonis Isolat Bakteri Kitinolitik dengan R. microporus 13
3.6 Pengamatan Abnormalitas Hifa R. microporus 14
3.7 Uji Penghambatan dan Pengendalian Serangan R. microporus Secara in vivo
14 3.8 Pengamatan Intensitas Serangan dan Luas Serangan JAP pada Bibit
Tanaman Karet
15 3.9 Reisolasi Jamur Patogen dan Bakteri Kitinolitik 16 BAB 4 HASIL DAN PEMBAHASAN
Uji Antagonis
4.4 Kemampuan Bakteri Kitinolitik dalam Mengendalikan Serangan R. microporus Pada Bibit Tanaman Karet
24 4.5 Pengaruh Infeksi JAP Terhadap Tinggi Tanaman, Jumlah Daun,
Dan Diameter Batang
28 4.6 Reisolasi R. microporus dan Bakteri Kitinolitik Dari Akar Bibit
Tanaman Karet
33 4.7 Reisolasi bakteri kitinolitik dari tanah perlakuan bibit karet 35
BAB 5 KESIMPULAN DAN SARAN 37
5.1 Kesimpulan 37
5.2 Saran 37
DAFTAR PUSTAKA 38
DAFTAR GAMBAR
Halaman
Gambar 2.2.1 Rhizomorf pada akar karet 7
Gambar 2.2.2 Karakteristik Rigidoporus microporus 8
Gambar 3.5.1 Metode pengukuran zona hambat bakteri terhadap koloni jamur patogen
14
Gambar 4.1.1 Daun yang terserang Rigidoporus microporus 18
Gambar 4.1.2 Leher akar yang dipenuhi rhizomorf 19
Gambar 4.1.3 Isolasi akar tanaman karet yang terserang JAP 19 Gambar 4.2.1 Kemampuan antagonis isolat bakteri kitinolitik
dalam menghambat Rigidoporus microporus
20
Gambar 4.3.1 Hifa abnormal R. microporus setelah uji antagonis 23 Gambar 4.4.1 Perbandingan nilai intensitas serangan dari
masing-masing perlakuan
24
Gambar 4.4.2 Penampakan leher akar, daun, dan akar bibit tanaman karet perlakuan kontrol negatif yang bebas dari infeksi jamur akar putih
28
Gambar 4.5.1 Pertambahan tinggi rata-rata tanaman setelah 60 hari masa perlakuan
29
Gambar 4.5.2 Pertambahan nilai diameter rata-rata batang tanaman selama masa perlakuan
31
Gambar 4.5.3 Gejala penyakit bibit karet pada kontrol positif 32 Gambar 4.5.4 Pertambahan rata-rata jumlah daun pada tiap
perlakuan
33
Gambar 4.6.1 Hasil Reisolasi kontrol positif 33
Gambar 4.6.2 Hasil Reisolasi bakteri kitinolitik dari akar tanaman karet
34
Gambar 4.7.1 Hasil reisolasi bakteri kitinolitik dari tanah perlakuan
35 Gambar 4.7.2 Jumlah koloni bakteri kitinolitik hasil reisolasi dari
tanah perlakuan metode cawan tuang
DAFTAR TABEL
Halaman Tabel 4.2.1 Besarnya zona hambat (mm) pada uji in vitro
masing-masing isolat terhadap R.microporus
21
Tabel 4.4.1 Pengamatan Intensitas serangan awal R. microporus pada dengan cara aplikasi isolat 30 hari setelah inokulasi patogen.
25
Tabel 4.4.2 Persentase (%) luas serangan R. microporus pada bibit tanaman karet
DAFTAR LAMPIRAN
Halaman 1 Komposisi Media MGMK Padat dan Cara Pembuatannya 43 2 Pembuatan Koloidal Kitin dengan Cara Hidrolisis Parsial 44
3 Alur Kerja Uji Antagonis 45
4 Alur Kerja Pengamatan Hifa Abnormal 45
KEMAMPUAN ISOLAT BAKTERI KITINOLITIK DALAM MENGENDALIKAN PENYAKIT JAMUR AKAR PUTIH
(Rigidoporusmicroporus) PADA BIBIT TANAMAN KARET
ABSTRAK
Bakteri kitinolitik diketahui memiliki kemampuan untuk mengendalikan serangan jamur patogen pada tanaman. Pada penelitian ini kemampuan bakteri kitinolitik dalam mengendalikan penyakit jamur akar putih yang disebabkan oleh Rigidoporus microporus telah dilakukan. Tiga isolat bakteri kitinolitik yaitu Bacillus sp. BK17, Enterobacter sp. PB17, dan PB08 digunakan untuk mengendalikan penyakit jamur akar putih pada bibit tanaman karet. Isolat bakteri diaplikasikan ke tanah satu hari dan tiga puluh hari setelah inokulasi jamur patogen. Ketiga isolat bakteri kitinolitik dapat menurunkan intensitas serangan jamur akar putih dan hasilnya menunjukkan perawakan tanaman yang lebih baik dibandingkan dengan kontrol. Enterobacter sp. PB17 dan PB08 mampu menurunkan intensitas serangan sebesar 37.5%. Enterobacter sp. PB17 dan PB08 menunjukkan nilai intensitas serangan dan luas serangan terendah masing-masing sebesar 20% dan 60% pada aplikasi isolat satu hari dan tiga puluh hari setelah inokulasi patogen. Pengamatan mikroskopis menunjukkan bahwa hifa R. microporus yang dihambat oleh isolat bakteri kitinolitik mengalami abnormalitas yaitu bentuk hifa bengkok, lisis, melilit dan menggulung. Aplikasi Enterobacter sp. PB17, PB08, dan Bacillus sp. BK17 pada bibit tanaman karet mampu menambah tinggi tanaman, diameter batang dan jumlah daun.
THE ABILITY OF CHITINOLYTIC BACTERIAL ISOLATES TO CONTROL WHITE ROOT DISEASE (Rigidoporus microporus) IN RUBBER SEEDLINGS
ABSTRACT
Chitinolytic bacteria have been known for their ability to control various fungal diseases of plants. In this study potential of chitinolytic bacterial isolates to control white root disease of rubber plant caused by Rigidoporus microporus was examined. Three chitinolytic bacterial isolates Bacillus sp. BK17, Enterobacter sp. PB17, and PB08 were used to control white root disease in rubber seedlings. Rubber seedling were planted in soil-sand (2:1) growing media in polyethene plastic bag. Isolates were applied in soil one day and thirty days after fungal conidia inoculation. All three chitinolytic bacteria decreased disease intensity of white root disease and resulted in better plant performance to some extent. Enterobacter sp. PB17 and PB08 showed to decrease white root infection by 37.5%. Enterobacter sp. PB17 and PB 08 might decline disease intensity and severity to 20% and 60%, respectively thirty day and one day after fungal conidia inoculation. Microscopic observations showed that R. microporus hyphae was abnormal i. e. curved, lysis, twisting and rolled. Moreover, Enterobacter sp. PB17, PB08, and Bacillus sp. BK17 increased plant height, diameter, and leaf number.
BAB 1
PENDAHULUAN
1.1Latar Belakang
Karet (Hevea brasiliensis) diketahui sebagai tanaman perkebunan yang memiliki peranan penting bagi subsektor perkebunan di Indonesia. Penyakit pada tanaman karet sering menjadi kendala utama dalam pengelolaan perkebunan karet. Penyakit yang menyerang tanaman karet menyebabkan kerugian ekonomi yang cukup besar, bukan hanya karena hilangnya produksi akibat kerusakan tanaman, tetapi juga karena biaya yang diperlukan untuk pengendalian penyakit sangat besar (Muharni & Widjajanti 2011).
Salah satu penyakit yang banyak menyerang tanaman karet ialah jamur akar putih (JAP). Penyakit JAP disebabkan oleh jamur Rigidoporus microporus yang menyebabkan lapuk pada akar dan leher akar sehingga menyebabkan kematian tanaman. Penyakit JAP mengakibatkan kerugian finansial yang cukup besar yang disebabkan kematian tanaman karet maupun akibat biaya pengendaliannya. Kerugian finansial akibat kematian tanaman diperkirakan sekitar Rp. 3.3 trilliun per tahun (Suwandi 2008). Berdasarkan data Badan Pusat Statistik tahun 2012 nilai ekspor karet Sumut mencapai US$614,24 juta dan nilai ekspor karet mengalami penurunan pada tahun 2013 yaitu sebesar 3,4% menjadi US$593,36 juta (Badan Pusat Statistik 2013).
lingkungan. Pengendalian hayati penyakit tanaman dapat dilakukan dengan menggunakan mikroorganisme seperti jamur dan bakteri (Suryanto & Munir 2006).
Sejauh ini agen pengendali hayati yang digunakan untuk mengendalikan penyakit JAP adalah Trichoderma sp. Trichoderma diketahui bersifat antagonis terhadap jamur patogen melalui proses mikoparasitisme, antibiosis, dan kompetisi. Pencarian isolat baru yang potensial untuk mengendalikan penyakit tanaman masih harus terus dilakukan. Salah satu agen pengendali hayati yang saat ini sedang dikembangkan adalah bakteri kitinolitik yang menghasilkan enzim kitinase.
Pengendalian hayati jamur dengan menggunakan bakteri kitinolitik didasarkan pada kemampuan bakteri ini menghasilkan enzim kitinase dan β 1-3 glukanase yang dapat melisiskan dinding sel jamur (El- Katatny et al. 2000). Genus bakteri yang sudah banyak dilaporkan memiliki kitinase antara lain Enterobacter (Wahyuni 2011; Suryanto et al. 2012), Pseudomonas sp, Alcaligenes denitrificans, Aeromonas hydrophila (Brezezinska & Donderski 2006), Bacillus dan Pyrococcus (Lorito et al.
1992), Stenotrophomonas sp. (Soeka & Sulistiani 2011). Aeromonas caviae diketahui efektif dalam mengontrol serangan Rhizoctonia solani dan Fusarium oxysporum pada kapas, dan Scelrotium rolfsii pada buncis (Muharni & Widjajanti 2011). Penelitian Suryanto et al. (2012) menyebutkan bahwa isolat bakteri kitinoitik Bacillus sp. BK17 berhasil menurunkan serangan Ganoderma boninense penyebab busuk pangkal batang pada tanaman kelapa sawit.
Aktivitas kitinase dari bakteri kitinolitik sangat potensial digunakan sebagai pengendali hayati penyakit tanaman termasuk JAP yang disebabkan Rigidoporus microporus. Sejauh ini, pengujian bakteri kitinolitik terhadap jamur R. microporus
1.2Permasalahan
Bakteri kitinolitik dan enzim kitinase diketahui telah banyak digunakan sebagai agen pengendali hayati jamur patogen pada tanaman, diantaranya Rhizoctonia solani dan Fusarium oxysporum pada kapas, Ganoderma boninense pada kelapa
sawit, serta Colletotrichum sp. pada kakao. Sampai saat ini, belum diketahui kemampuan isolat bakteri kitinolitik (Enterobacter sp. PB17, Bacillus sp. BK13, Enterobacter sp. BK15, Bacillus sp. BK17, PB08, dan PB15) dalam menghambat
penyakit JAP secara in vitro dan in vivo. Isolat bakteri diharapkan mampu mengendalikan penyakit JAP pada bibit tanaman karet.
1.3Tujuan Penelitian
1. Mengetahui kemampuan isolat bakteri kitinolitik (Enterobacter sp. PB17, Bacillus sp. BK13, Enterobacter sp. BK15, Bacillus sp. BK17, PB08, dan PB15) dalam menghambat pertumbuhan R. microporus secara in vitro.
2. Mengetahui kemampuan isolat bakteri kitinolitik dalam menghambat serangan JAP yang disebabkan oleh R. microporus pada bibit tanaman karet secara in vivo.
1.4Hipotesis
1. Isolat bakteri kitinolitik (Enterobacter sp. PB17, Bacillus sp. BK13, Enterobacter sp. BK15, Bacillus sp. BK17, PB08, dan PB15) dapat menghambat pertumbuhan R. microporus secara in vitro.
1.5Manfaat Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1 Tanaman Karet
Karet diketahui sebagai salah satu komoditas ekspor yang sangat penting sebagai sumber devisa negara. Setelah Thailand dan Malaysia, Indonesia diketahui sebagai produsen karet terbesar di dunia yang memberikan kontribusi sebesar 26% dari total produksi karet alam di dunia. Keberadaan industri karet memberikan manfaat selain untuk meningkatkan pendapatan petani, masyarakat, serta negara juga berguna dalam menghasilkan produk industri berupa ban atau produk lainnya seperti kebutuhan kesehatan, bangunan, bidang farmasi, dan juga peranannya dalam upaya pelestarian lingkungan (Kusdiana & Alchemi 2011).
Tanaman karet berasal dari negara Brazil, Amerika Selatan. Henry Wickham merupakan orang yang berhasil mengembangkan tanaman karet di wilayah Asia Tenggara. Di Indonesia, Malaysia dan Singapura tanaman karet mulai dibudidayakan sejak tahun 1876. Tanaman karet pertama di Indonesia ditanam di Kebun Raya Bogor (Tim Karya Tani Mandiri 2010).
biasanya ada tiga atau enam sesuai jumlah ruang. Bunga pada tajuk dengan membentuk mahkota bunga pada setiap bagian bunga yang tumbuh (Tim Karya Tani Mandiri 2010).
2.2 Penyakit Jamur Akar Putih (JAP)
Penyakit jamur akar putih disebabkan oleh jamur Rigidoporus microporus yang berasal dari kelas Basidiomycetes, ordo Polyporales, famili Polyporaceae dan genus Rigidoporus. Rigidoporus microporus memiliki banyak sinonim. Menurut Van
Overiem & Weesw ada 35 nama; nama ilmiah yang digunakan antara lain adalah Fomes lignosus (Klotzh.), Fomes semitosus (Petch.), Rigidoporus lignosus (Klotzh.)
Imazeki dan R. microporus (Swatz) Van Ov. (Semangun 2008).
Berdasarkan konsep segitiga penyakit, penyebaran penyakit JAP ini tergantung pada karet (sebagai inang), R. microporus (sebagai patogen) serta kondisi lingkungan. Jika ketiga faktor saling mendukung, tanaman akan terserang penyakit. Sampai saat ini belum ditemukan adanya karet yang resisten (tahan) terhadap serangan jamur akar putih. Chatarina (2012) menyebutkan bahwa, penyakit JAP dapat menyerang tanaman mulai dari pembibitan sampai dewasa. Penyakit ini dapat menyerang tanaman muda, usia 3-4 tahun sampai tanaman menghasilkan atau produktif. Komponen lingkungan yang berperan meningkatkan penyebaran penyakit JAP ini adalah tanah. Sifat-sifat tanah sangat penting untuk menunjang perkembangan penyakit ini diantaranya pH tanah, suhu, kandungan nutrisi dan kelembaban tanah (Prasetyo et al. 2009).
Gejala awal tanaman yang terkena penyakit akar putih yaitu daunnya tampak kusam (tidak mengkilat) dan agak menggulung ke atas. Pada tingkat serangan permulaan, akar lateral dan sebagian besar akar tunggang serta leher akar masih terserang ringan. Pada tahapan serangan selanjutnya daun-daun mulai layu dan menguning. Benang-benang cendawan mulai menembus kulit akar yang menyebabkan pembusukan setempat pada kulit akar. Pada tahap serangan tingkat lanjut, daun-daun mengering dan tetap menggantung pada pohon. Ranting serta cabang-cabang mulai mengering disertai dengan gugurnya daun dan pada akhirnya tanaman akan mati (Setyamidjaja 1993).
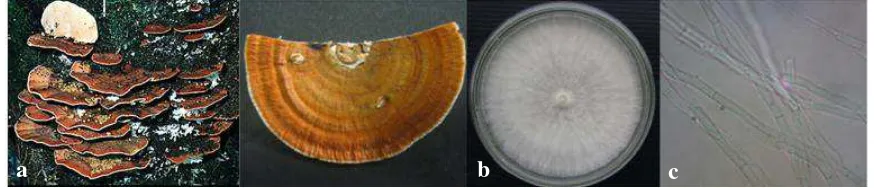
Tanaman yang terserang JAP membentuk buah lebih awal pada tanaman muda yang seharusnya belum cukup waktunya untuk berbuah. Apabila sistem perakaran dibuka, pada permukaan akar terdapat semacam benang-benang berwarna putih kekuningan (Gambar 2.2.1) menyerupai akar rambut yang menempel kuat dan sulit dilepas. Gejala selanjutnya yaitu akar membusuk, lunak dan berwarna cokelat (Semangun 2008).
Jamur akar putih sering membentuk tubuh buah pada leher akar tanaman sakit, pada tunggul, atau pada akar sakit yang terbuka. Tubuh buah mirip dengan kipas tebal, permukaan atasnya jingga kuning, dan pemukaan bawahnya jingga, merah, atau kecoklatan (Gambar 2.2.2). Jika dipotong akan tampak lapisan atas yang berwarna Gambar 2.2.1 Rizomorf pada akar karet (Hevea beasiliensis) (a) akar karet dan
(b) rizomorf
muda dan lapisan bawah berwarna coklat kemerahan. Jamur membentuk banyak tubuh buah yang tersusun bertingkat (Semangun 2008).
Jamur akar putih merupakan organisme polifaga, yaitu dapat menyerang bermacam-macam tanaman. Beberapa penelitian menyebutkan kemampuan jamur ini menyerang tanaman lain selain karet, diantaranya: jambu mete (Anacardium occidentale) (Chatarina 2012), teh (Camellia sinensis) (Hastuti 2000), akasia (Acacia
mangium), sentang (Azadirachta excels) dan jati (Tectona grandis) (Farid et al. 2009).
Semangun (2008) menyatakan bahwa R. microporus juga menyerang tanaman kopi, kelapa sawit, kakao, mangga, cengkeh, sengon, meranti serta tanaman perkebunan lain. Jamur akar putih yang menyerang karet yang dibudidayakan semula berasal dari pohon-pohon hutan yang sakit. Dari sisa-sisa akar atau tunggul pohon-pohon hutan inilah Rigidoporus dapat menginfeksi tanaman karet.
2.3 Bakteri Kitinolitik dan Enzim Kitinase
Kitin adalah homopolimer dari β-1,4 N-asetil glukosamin dan merupakan polimer kedua terbanyak setelah selulosa. Kitin dapat dijumpai pada cangkang udang, kepiting, moluska, serangga, annelida, serta pada dinding sel jamur terutama dari kelas Ascomycetes, Zygomycetes, Basidiomycetes dan Deuteromycetes. Kitin berbentuk padat dan sifatnya tidak larut dalam air atau senyawa organik lainnya. Pada dinding sel jamur, kitin berbentuk mikrofibril yang memiliki panjang yang berbeda Gambar 2.2.2 tik Karateristik Rigidoporus microporus (a) tubuh buah (b) koloni pada
media potato dekstrosa agar (PDA) (c) hifa. (Sumber: (a) Kaewachai & Soytong 2010, (b) dan (c) Rahmiati).
struktur dinding sel jamur yang terdiri atas rantai-rantai polisakarida yang saling bersilangan membentuk anyaman (Rajarathanam et al. 1998). Kandungan kitin pada dinding sel jamur bervariasi tergantung pada jenis jamurnya. Beberapa isolat Sclerotium rolfsii yang telah diteliti menunjukkan bahwa hifa cendawan ini mempunyai kandungan kitin berkisar antara 12-31% (Zang et al. 2001).
Kitin dapat didegradasi dengan menggunakan enzim kitinase yang dapat memecah kitin dengan cara menghidrolisisnya. Bakteri yang memiliki kemampuan mendegradasi kitin disebut bakteri kitinolitik. Saat ini bakteri kitinolitik banyak dimanfaatkan untuk mengendalikan serangan jamur patogen dengan menjadikan kitin sebagai sumber karbon dan nitrogen (Gohel et al. 2006; Kamil et al. 1993). Pujiyanto et al. (2002) berhasil mengisolasi 55 isolat bakteri kitinolitik dari ekosistem air hitam
Kalimantan Tengah. Dari hasil uji in vitro diperoleh dua isolat bakteri yang memiliki kemampuan menghambat pertumbuhan jamur patogen Rhizoctonia solani dan Helmintosporium oryzae. Bakteri kitinolitik Aeromonas caviae digunakan untuk mengontrol serangan R. solani dan F. oxysporum pada kapas serta S. rolfsii pada buncis (Ferniah et al. 2011). Bacillus spp. yang dikombinasikan dengan pestisida nabati, diketahui dapat mengendalikan penyakit JAP dan meningkatkan produksi pada tanaman jambu mete (Tombe 2008).
Mekanisme kerja enzim kitinase dalam menghidrolisis kitin pada jamur patogen, terkait dengan kandungan kitin pada dinding sel jamur tersebut yang akan dimanfaatkan sebagai substratnya (El-Katatny et al. 2000). Berdasarkan cara kerjanya kitinase dikelompokkan menjadi tiga tipe, yaitu: (i) endokitinase, yang memotong secara acak polimer kitin secara internal sehingga menghasilkan oligomer pendek, (ii) eksokitinase, yang memotong unit trimer ketobiosa pada ujung terminal polimer kitin, (iii) N-asetilglukosamidase, yang memotong unit monomer pada ujung terminal polimer kitin (Pudjihartati 2006). Kitinase juga dikelompokkan berdasarkan urutan asam aminonya dan dibagi atas tiga famili yaitu famili 18, 19 dan 20. Famili 18 meliputi kitinase dari bakteri, jamur, serangga, tanaman (kelas III dan V) dan hewan. Famili 19 diidentifikasi dari tanaman (kelas I, II, dan IV) dan bakteri gram positif Streptomyces, sedangkan famili 20 dari Vibrio harvei (Watanabe et al. 1999; Patil et
Kitinase memiliki banyak manfaat selain sebagai agen pengendali hayati. Herdyastuti et al (2009) menyebutkan bahwa kitinase dapat dimanfaatkan dalam penanganan limbah terutama limbah yang mengandung kitin seperti limbah pabrik pembekuan udang. Senyawa-senyawa hasil degradasi kitinase pada kitin membentuk seyawa turunan kitin seperti karboksimetil kitin, hidroksietil kitin dan etil kitin dapat dimanfaatkan dalam berbagai bidang seperti dalam bidang kedokteran senyawa tersebut dimanfaatkan untuk membuat benang operasi. Monomer kitin seperti N-asetil D-glukosamin dimanfaatkan dalam bidang farmasi untuk obat penurun gula darah dan dalam bidang kosmetik sebagai senyawa penghambat pembentukan melanin.
2.3 Potensi Bakteri Kitinolitik sebagai Agen Pengendali Hayati
Indonesia merupakan negara dengan biodiversitas yang sangat tinggi, sehingga kesempatan untuk menemukan agen pengendali hayati terhadap penyakit tanaman masih sangat besar. Penggunaan agen pengendali hayati memberikan beberapa keunggulan diantaranya (i) aman bagi manusia dan musuh alami, (ii) dapat mencegah timbulnya ledakan patogen sekunder, (iii) produk tanaman yang dihasilkan bebas dari residu pestisida, (iv) terdapat di sekitar area menanam sehingga dapat mengurangi ketergantungan petani terhadap pestisida sintetis; dan (v) biaya yang dikeluarkan lebih sedikit (Nurhayati 2011). Jika dibandingkan dengan penggunaan senyawa kimia, pengendalian dengan agen hayati membutuhkan waktu yang lebih lama.
menyatakan bahwa, Bacillus spp. merupakan salah satu kelompok mikroorganisme yang dapat berfungsi baik sebagai agen hayati untuk mengendalikan penyakit tanaman maupun stimulator pertumbuhan tanaman.
Kitinase diketahui ikut berperan dalam mekanisme pertahanan tanaman
terhadap infeksi jamur karena enzim ini dapat menghidrolisis ikatan β-1,4 diantara subunit N-asetilglukosamin pada kitin. Hasil penelitian Pudjihartati et al. (2006) menunjukkan bahwa, aktivitas enzim kitinase pada jaringan tanaman kacang tanah yang terserang S. rolfsii meningkat jauh lebih tinggi dibandingkan jaringan kacang tanah yang sehat. Infeksi S. rolfsii pada jaringan leher akar kacang tanah ternyata meningkatkan aktivitas kitinolitik. Beberapa jenis tanaman memproduksi kitinase dan
β 1,3 glukanase secara bersamaan sebagai pertahanan melawan infeksi patogen.
BAB 3
BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan mulai dari bulan Februari 2013 sampai dengan Juni, di Laboratorium Mikrobiologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara Medan.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ialah cawan Petri, tabung reaksi, rak tabung reaksi, spatula, magnetic stirer, sprayer, autoklaf, oven, cork borer, jarum ose, mikroskop, gelas obyek, gelas penutup, pinset, vortex, labu Erlenmeyer, lampu Bunsen, jangka sorong, mistar, kamera digital, batang pengaduk, inkubator mesofil dan hot plate.
3.3 Sumber Isolat
Isolat-isolat bakteri kitinolitik yang digunakan merupakan koleksi Laboratorium Mikrobiologi Fakultas Matematika dan ilmu Pengetahuan Alam Universitas Sumatera Utara Medan yaitu Enterobacter sp. PB17, Bacillus sp. BK13, Enterobacter sp. BK15 dan Bacillus sp. BK17, PB08, dan PB15. Sedangkan isolat
jamur patogen Rigidoporus microporus diperoleh dari Laboratorium Proteksi Balai Penelitian Karet Sei Putih Galang Sumatera Utara. Isolat bakteri ditumbuhkan pada media NA dan isolat jamur ditumbukan pada media PDA. Keseluruhan isolat disimpan pada inkubator suhu ruang (± 28-30° C) untuk digunakan selanjutnya.
3.4 Pengamatan Gejala Serangan
Gejala serangan tanaman yang terserang JAP diamati pada bagian daun dan batang. Diamati perubahan warna daun serta batang. Untuk memastikan serangan dari Rigidoporus microporus dilakukan pembongkaran leher akar.
3.5 Uji Antagonis Isolat Bakteri Kitinolitik dengan Rigidoporus microporus
Kemampuan bakteri kitinolitik dalam menghambat pertumbuhan R. microporus dilakukan secara in vitro. Isolat bakteri diremajakan di media MGMK,
diinkubasi pada suhu ruang selama 72 jam. Bagian hifa terluar dari R. microporus dicetak dengan cork borer dan diinokulasikan pada bagian tengah media MGMK, diinkubasi selama 24 jam pada suhu ruang (± 28-30° C). Selanjutnya, sebanyak 0,01
ml suspensi bakteri kitinolitik dengan konsentrasi ≈ 108
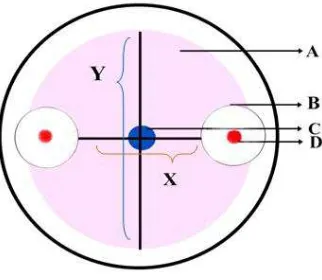
Gambar 3.5.1 Metode pengukuran zona hambat bakteri terhadap koloni jamur patogen; A. koloni jamur, B. zona hambat bakteri terhadap koloni jamur, C. Titik tengah jamur diletakkan, D. Koloni bakteri, X. diameter koloni jamur yang terhambat, Y Diameter koloni jamur normal (Suryanto 2006).
3.6 Pengamatan Abnormalitas Hifa R. microporus
Pengamatan abnormalitas hifa R. microporus dilakukan dengan dua cara yaitu secara makroskopis dengan melihat kenampakan koloni dan mikroskopis. Pengamatan secara makroskopis dilakukan dengan cara melihat zona/luas pertumbuhan hifa jamur patogen. Pengamatan secara mikroskopis dilakukan dengan cara mengamati ujung hifa pada daerah zona hambat R. microporus (Suryanto et al. 2012). Ujung hifa R. microporus pada media MGMK dipotong berbentuk kotak block square, kemudian diletakkan pada gelas objek. Abnormalitas pertumbuhan hifa fungi patogen diamati, berupa pembengkokan ujung hifa, hifa pecah, hifa berbelah, hifa bercabang, hifa lisis dan hifa tumbuh kerdil (Lorito et al. 1992).
3.6Uji Penghambatan dan Pengendalian Serangan R. microporus Secara in vivo
Bibit karet yang digunakan ialah bibit yang berumur 3-4 bulan. Bibit karet dipindahkan ke dalam polybag yang berukuran 17 x 35 cm. Pengujian in vivo dilakukan dengan 2 cara yaitu aplikasi isolat bakteri kitinolitik satu hari setelah pemberian inokulum patogen dan 30 hari setelah pemberian inokulum patogen. Potongan akar tanaman karet yang sudah terserang JAP dan sudah dipenuhi hifa R. microporus diletakkan pada media tanam dengan jarak tanam ± 5 cm dari bibit
tanaman karet. Sebanyak 10 ml suspensi bakteri kitinolitik dengan kerapatan ≈ 108 sel/ml disiram pada permukaan tanah hingga merata. Pengamatan Dilakukan setiap 7 hari sekali selama 60 hari dimulai dari hari ketujuh setelah inokulasi jamur patogen.
3.7 Pengamatan Intensitas Serangan dan Luas Serangan JAP pada Bibit Tanaman Karet
Parameter yang diamati yaitu intensitas serangan dan luas serangan R. microporus. Pengamatan intensitas serangan dilakukan dengan mengamati gejala di
atas permukaan tanah dengan mengamati kondisi leher akar. Pengamatan intensitas serangan di bawah tanah dilakukan sekali yaitu pada akhir penelitian (60 hari setelah aplikasi). Pengamatan dilakukan dengan cara membongkar tanah pada tanaman karet, intensitas serangan dapat dihitung dengan menggunakan rumus Townsend & Heuberger (1963) sebagai berikut:
n = jumlah tanaman dari berbagai kategori serangan (skala 1, 2, 3 dan 4) N = jumlah akar tanaman yang diamati
Z = nilai skoring tertinggi
v = nilai skoring serangan penyakit tiap individu tanaman
0 = tanaman sehat, akar tanaman bebas patogen
1 = permukaan akar tanaman telah ditumbuhi hifa jamur
2 = kulit akar tanaman telah terinfeksi, dan terjadi perubahan warna pada kulit akar 3 = bagian kulit dan akar tanaman telah terinfeksi oleh patogen
4 = tanaman hampir mati atau mati karena jaringan akar tanaman telah membusuk.
Luas serangan jamur ditentukan dengan rumus: A =
n = jumlah tanaman yang terserang spesies patogen N = jumlah seluruh tanaman yang diamati
3.8 Reisolasi Jamur Patogen dan Bakteri Kitinolitik
Reisolasi jamur dan bakteri dari akar tanaman karet dilakukan dengan metode Radu & Kqueen (2002) yang dimodifikasi. Bagian akar tanaman dipotong sepanjang ± 1 cm dan dicuci dengan air mengalir selama 20 menit. Selanjutnya permukaan akar tanaman disterilisasi dengan merendam secara berurutan dalam: etanol 75% selama 2 menit, sodium hypoklorit 5,3% selama 5 menit dan etanol 75% selama 30 detik, selanjutnya dibilas dengan akuades steril sebanyak 2 kali, lalu dikeringanginkan. Jamur diisolasi dengan media PDA, sedangkan bakteri diisolasi dengan media MGMK. Inkubasi dilakukan pada suhu ruang selama ± 3 hari. Koloni jamur yang muncul pada media PDA selanjutnya dimurnikan, dan diamati struktur hifanya di bawah mikroskop cahaya.
BAB 4
HASIL DAN PEMBAHASAN
4.1 Gejala Serangan Rigidoporus microporus pada Bibit Tanaman Karet
Gejala awal serangan R. microporus pada bibit karet yang terserang penyakit adalah terjadinya perubahan warna daun atau sebagian dari helaian daun. Pada bibit karet yang teserang penyakit, daun terlihat berwarna kuning dan hijau kekuningan, terlihat adanya bintik-bintik kuning pada permukaan daun (Gambar 4.1.1). Daun-daun tua serta batang tanaman layu, bagian ujung daun mengering berwarna coklat muda. Beberapa helai daun gugur sebelum seluruh daun tanaman rontok. Semangun (2008) menyebutkan bahwa tanaman yang diserang JAP warna daunnya tampak kusam, kurang mengkilat, dan melengkung ke bawah. Selanjutnya daun-daun akan menguning dan rontok.
Gambar 4.1.1 Daun yang terserang Rigidoporus microporus (a) bercak coklat pada permukaan daun, (b) daun berwarna hijau kekuningan dan (c) ujung daun kering dan berwarna coklat muda
Gejala pada bagian atas tanah mirip dengan gejala yang disebabkan oleh penyakit-penyakit akar pada umumnya. Untuk memastikan penyebab penyakit harus dilakukan pembongkaran akar (Semangun 2008). Pembukaan leher akar bibit karet terlihat adanya miselium (Gambar 4.1.2). Miselium (rizomorf) tampak berwarna putih dan memenuhi leher akar.
Gambar 4.1.2 Leher akar yang dipenuhi rizomorf
Akar tanaman yang telah terserang JAP digunakan sebagai sumber inokulum untuk menginfeksi bibit tanaman karet yang sehat (Gambar 4.1.3). Akar ditumbuhkan pada media PDA dan dikoleksi jenis jamur yang muncul untuk disesuaikan ciri-cirinya dengan R. microporus. Menurut Semangun (2008) basidiospora pada tubuh buah tidak dapat menimbulkan infeksi pada pohon karet yang sehat. Oleh karena itu dalam penelitian ini sumber inokulum yang digunakan diperoleh dari akar tanaman karet yang sudah terserang JAP.
Gambar 4.1.3 (a) Akar tanaman karet yang terserang JAP, (b) Isolasi potongan akar pada media PDA dan (c) Biakan murni Rigidoporus microporus umur 5 hari di media PDA pada suhu ruang (± 28-30°C)
Akar tanaman yang dipenuhi rizomorf diinokulasikan pada bagian akar bibit tanaman karet yang sehat. Pengamatan selama 60 hari menunjukkan gejala yang sama seperti pengamatan di lapangan yaitu ditunjukkan dengan daun yang layu dan mengalami perubahan warna.
4.2 Kemampuan Antagonis Bakteri Kitinolitik Terhadap R. microporus
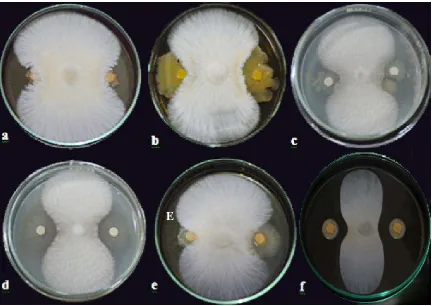
Hasil uji antagonis isolat bakteri kitinolitik terhadap R. microporus menunjukkan keenam isolat memiliki kemampuan yang berbeda-beda dalam menghambat pertumbuhan R. microporus. Kemampuan antagonis isolat ditandai dengan adanya zona hambat yang terbentuk pada daerah pertemuan koloni bakteri dengan jamur. Zona hambat yang terbentuk berupa cerukan penipisan elevasi (Gambar 4.2.1).
Gambar 4.2.1 Kemampuan antagonis isolat (a) Bacillus sp. BK13 (b) Enterobacter sp. BK15 (c) Bacillus sp. BK17 (d) PB 08 (e) PB15 dan (f) Enterobacter sp. PB17 dalam menghambat R. microporus
Zona hambat terbentuk karena adanya interaksi antara bakteri kitinolitik yang mendesak hifa jamur R. microporus. Interaksi antara bakteri kitinolitik dengan jamur patogen yang dinding selnya disusun oleh kitin merupakan interaksi yang menguntungkan bagi bakteri kitinolitik tetapi merugikan bagi jamur itu sendiri. Bakteri menghasilkan senyawa bioaktif yang dapat merusak komponen struktural jamur patogen. Adanya enzim hidrolitik, misalnya kitinase pada bakteri kitinolitik, mampu mendegradasi kitin penyusun dinding sel jamur tersebut (Ferniah et al. 2011).
kitinolitik dalam menghambat pertumbuhan jamur R. microporus ditandai dengan terhambatnya pertumbuhan jamur tersebut di sekitar koloni bakteri kitinolitik.
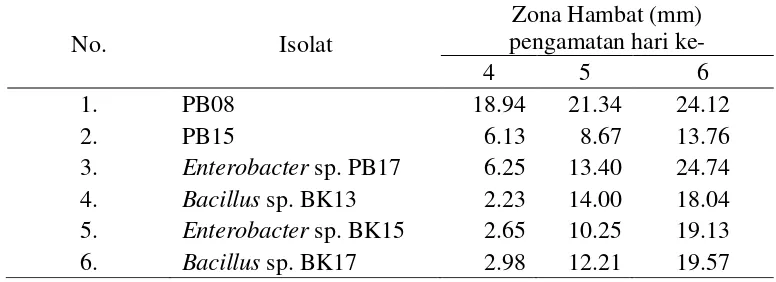
Zona hambat dapat diamati pada hari keempat dan nilainya terus bertambah sampai hari keenam tidak ada lagi penambahan besarnya zona hambat. Besarnya nilai zona hambat yang terbentuk dapat dilihat pada Tabel 4.2.1.
Tabel 4.2.1 Besarnya zona hambat (mm) pada uji in vitro masing-masing isolat terhadapR.microporus
Zona hambat yang dibentuk setiap isolat menunjukkan hasil yang berbeda-beda yaitu berkisar anatara 2,23 - 24,74 mm. Diameter zona hambat terus bertambah sejalan dengan lamanya masa inkubasi. Pada hari ke-7 pengamatan, koloni jamur patogen sudah memenuhi cawan uji sehingga zona hambat sudah tidak dapat dihitung. Hasil uji menunjukkan bahwa zona hambat tertinggi pada pengamatan hari keenam ditunjukkan oleh isolat Enterobacter sp. PB17 yaitu sebesar 24.74 mm, diikuti oleh isolat PB08 yaitu sebesar 24.12 mm dan Bacillus sp. BK17 yaitu sebesar 19.57 mm. PB15 merupakan isolat yang menunjukkan nilai penghambatan terendah yaitu sebesar 13.76 mm. Enterobacter sp. PB17, PB08, dan Bacillus sp. BK17 merupakan isolat dengan nilai zona hambat terbesar. Oleh karena itu ketiga isolat ini selanjutnya digunakan untuk uji in vivo. Perbedaan kemampuan masing-masing isolat bakteri kitinolitik dalam menghambat pertumbuhan R. microporus mungkin disebabkan perbedaan jenis kitinase yang dihasilkan oleh masing-masing isolat tersebut. Berbagai organisme menghasilkan aneka jenis kitinase dengan spesifikasi dan karakteristik terhadap substrat yang bervariasi. Bakteri biasanya menghasilkan kitinase sebagai sarana memperoleh nutrisi dan agen parasitisme.
Beberapa hal yang mempengaruhi besar kecilnya zona hambat yang dibentuk bakteri kitinolitik terhadap jamur patogen antara lain: interaksi antara kemampuan bakteri kitinolitik dalam menghasilkan enzim hidrolitik, umur biakan bakteri, jumlah enzim yang dihasilkan, komposisi medium dan waktu inkubasi. Penurunan zona hambat juga dapat terjadi karena isolat bakteri sudah masuk fase kematian disebabkan sumber nutrisi pada media terbatas, kitin sebagai induser kitinase dalam media berkurang sehingga sekresi kitinase berkurang dan perkembangan R. microporus yang tumbuh vertikal sehingga dapat melewati daerah zona hambat (Dewi 2011).
Enzim kitinase disintesis secara induktif, yaitu hanya akan dihasilkan jika ada senyawa kitin sebagai indusernya (Ferniah et al. 2011). Keberadaan kitin pada media memacu isolat bakteri kitinolitik untuk memproduksi kitinase yang dapat mendegradasi dinding sel jamut patogen. Ketika kitin yang ada di sekitar koloni sudah terurai enzim kitinase akan mengkolonisasi miselium jamur untuk menguraikan kitin yang ada pada dinding sel jamur tersebut. Penguraian kitin pada dinding sel jamur menyebabkan penghambatan bagi pertumbuhan jamur. Adanya senyawa metabolit lain selain kitinase juga menjadi salah satu penyebab perbedaan daya hambat isolat bakteri kitinolitik terhadap pertumbuhan jamur patogen tanaman (Johansson 2003).
Besarnya nilai zona hambat juga dipengaruhi oleh besarnya kandungan kitin pada dinding sel jamur patogen. Menurut Rajarathanam et al. (1998) semakin besar kandungan kitin pada dinding sel, semakin besar zona hambat yang terbentuk. Kandungan kitin pada jamur bervariasi mulai dari 4-9% berat kering sel, tergantung jenis atau strain jamur itu sendiri.
4.3 Pengamatan Mikroskopis Hifa Abnormal R. microporus Setelah Uji Antagonis
Pengamatan hifa abnormal dilakukan pada hari keenam masa pengamatan. Mekanisme antagonis yang terjadi antara bakteri kitinolitik dengan R. microporus yaitu pertumbuhan miselium fungi patogen terhambat dan terjadi penipisan dinding
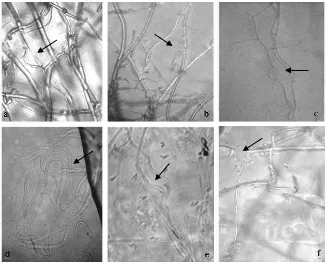
antara isolat dengan R.microporus. Abnormalitas yang terjadi yaitu berupa hifa mengalami lisis, hifa bengkok, hifa melilit dan hifa menggulung (Gambar 4.3.1).
Dari Gambar 4.3.1 terlihat perubahan hifa R. microporus yang terjadi akibat adanya interaksi antara isolat bakteri kitinolitik dengan jamur patogen. Keenam isolat bakteri kitinolitik memiliki kemampuan untuk merusak dinding sel jamur R. microporus. Penelitian Wahyuni (2011) yang melakukan pengujian antagonis antara
isolat bakteri kitinolitik dengan jamur Colletotrichum sp. juga menunjukkan hasil bahwa hifa jamur mengalami pertumbuhan yang abnormal yaitu hifa menggulung, bengok, dan lisis.
kitinolitik mampu menghidrolisis dinding R. microporus. Hifa jamur patogen yang mengalami pembengkokan dan menggulung diduga sebagai mekanisme pertahanan dari patogen terhadap serangan bakteri kitinolitik. Deskripsi gejala antagonis yang terjadi antara bakteri kitinolitik dengan R. microporus antara lain pertumbuhan fungi patogen terhambat, hifa kering, menipis dan mengalami abnormalitas.
4.4 Kemampuan Bakteri Kitinolitik dalam Mengendalikan Serangan R. microporus Pada Bibit Tanaman Karet
Efektifitas bakteri kitinolitik dalam mengendalikan serangan R. microporus dilihat berdasarkan gejala serangan yang dilihat dari intensitas serangan dan luas serangan yang diamati setelah hari ke-7 selama 60 hari. Pengamatan intensitas serangan penyakit pada aplikasi isolat bakteri kitinolitik 30 hari setelah pemberian inokulum patogen pertama kali dilakukan 30 hari setelah aplikasi patogen. Hal ini dilakukan untuk mengetahui skala awal serangan penyakit. Hasil pengamatan intensitas serangan awal penyakit menunjukkan rata-rata serangan penyakit pada bibit karet yaitu sebesar 35-40% (Tabel 4.4.1). Pengamatan selanjutnya dilakukan pada hari ke-60 (masa akhir pengamatan).
Tabel 4.4.1 Pengamatan intensitas serangan awal R. microporus dengan cara aplikasi isolat 30 hari setelah inokulasi jamur patogen
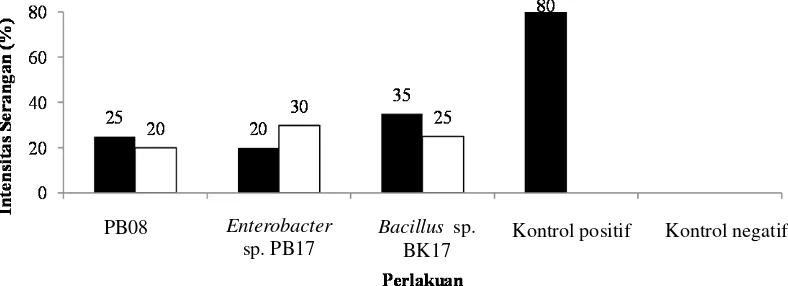
intensitas serangan yang lebih rendah yaitu 12,5%. Perbandingan nilai intensitas serangan setelah 60 hari percobaan pada tiap perlakuan disajikan pada Gambar 4.4.1.
Nilai intensitas serangan terendah pada aplikasi isolat 30 hari setelah inokulasi patogen ditunjukkan oleh isolat Enterobacter sp. PB17 yaitu sebesar 20%, yang tertinggi ditunjukkan isolat Bacillus sp. BK17 sebesar 35%. Jika dibandingkan dengan cara aplikasi isolat satu hari setelah inokulasi patogen besarnya intensitas serangan terendah ditunjukkan isolat PB08 sebesar 20% dan yang tertinggi ditunjukkan oleh isolat Enterobacter sp. PB17 sebesar 35%. Nilai intensitas serangan ini diperoleh pada tahap akhir pengamatan yaitu 60 hari setelah perlakuan. Ketiga isolat bakteri kitinolitik yang digunakan pada uji in vivo dapat digunakan untuk pengendalian dan penurunan serangan JAP pada bibit tanaman karet. Nilai intensitas serangan dari bibit karet yang sudah diaplikasikan dengan isolat lebih rendah dibandingkan dengan kontrol positif yang hanya diberi inokulum patogen saja. Nilai intensitas serangan yang ditunjukkan oleh kontrol positif sangat tinggi yaitu 80%, sedangkan pada kontrol negatif tidak ada tanaman yang terserang JAP. Akar tanaman pada kontrol negatif steril, tanpa ada rizomorf R. microporus.
Bacillus merupakan genus bakteri yang sudah banyak digunakan sebagai agen
pengendali hayati penyakit tanaman. Ayu et al. (2012) melaporkan bahwa isolat bakteri kitinolitik Bacillus sp. BK13 mampu mengendalikan jamur A. niger penyebab busuk pangkal akar pada tanaman kacang tanah. B. pantotheinticus dan B. brevis juga Gambar 4.4.1 Perbandingan nilai intensitas serangan dari masing-masing perlakuan
dilaporkan berpotensi sebagai agen biokontrol R. solani (Yuliar 2008). Kombinasi antara Bacillus sp. BC 26 dengan Pseudomonas fluoresen PF 101 dalam bentuk tepung dapat mengendalikan penyakit layu bakteri pada tanaman nilam. Spesies Bacillus menghasilkan paling sedikit 66 jenis antibiotik dan strain tertentu dari Bacillus merupakan agen biokontrol (Chrisnawati, 2011).
Isolat bakteri kitinolitik Enterobacter sp. PB17 dilaporkan mampu menghambat pertumbuhan Saprolegnia sp. penyebab infeksi pada telur ikan gurame (Dewi 2011). Chernin et al. (1995) menyatakan bahwa bakteri kitinolitik E. agglomerans digunakan sebagai agen biokontrol fungi patogen tanaman R. solani. Kemampuan isolat bakteri kitinolitik dalam mengendalikan jamur patogen pada tanaman tidak terlepas dari kemampuannya menghasilkan enzim kitinase yang dapat melisiskan kitin penyusun dinding sel jamur. Luas serangan R. microporus disajikan pada Tabel 4.4.2.
Tabel 4.4.2 Persentase (%) luas serangan R. microporus pada bibit tanaman karet Luas serangan (%)
menyerap makanan terus-menerus dari sel inang untuk memenuhi kebutuhannya, mengganggu metabolisme sel dengan toksin yang dihasilkannya, enzim atau zat pengatur tumbuh yang disekresikannya, menghambat transportasi makanan, hara mineral, dan air melalui jaringan pengangkut. Terjadinya perubahan fisiologis menimbulkan gejala terutama dalam hal fotosintesis. Nekrosis yang meluas seperti bercak daun yang merusak jaringan daun serta pengguguran daun yang disebabkan oleh patogen. Hal ini mengakibatkan fotosintesis menurun karena permukaan daun yang berfotosintesis menjadi berkurang.
Pada kontrol negatif tidak menunjukkan adanya gejala serangan dari R. microporus. Berdasarkan pengamatan di lapangan karakteristik bibit karet pada
perlakuan kontrol negatif yaitu: tanaman sehat dan terlihat subur. Perawakan tanaman tidak terlalu tinggi, tapi daunnya berwarna hijau tua tanpa ada bercak kuning pada permukaannya, daun tua berguguran dan digantikan daun muda pada pucuk tanaman. Pembongkaran akar menunjukkan bahwa akar steril dari rizomorf JAP (Gambar 4.4.2).
4.5 Pengaruh Infeksi JAP Terhadap Tinggi Tanaman, Jumlah Daun, Dan Diameter Batang
Infeksi patogen di akar tanaman akan mengakibatkan terhambatnya fungsi jaringan xilem. Jaringan xilem pada tanaman mempunyai fungsi yang sangat vital yaitu sebagai jalur masuknya unsur hara dan air menuju ke bagian daun. Gambar 4.4.2 Penampakan leher akar, daun, dan akar bibit tanaman karet perlakuan
Terhambatnya jaringan xilem ini, membuat tanaman menjadi kekurangan bahan makanan dan air sedangkan proses fotosintesis dan transpirasi pada tanaman terus-menerus terjadi, akibatnya tanaman lama-kelamaan menjadi layu dan mati (Amiruddin et al. 2012). Hal ini akan berpengaruh terhadap tinggi, diameter batang dan jumlah
daun pada tanaman uji.
Tinggi rata-rata bibit karet setelah 60 hari masa pengamatan disajikan pada Gambar 4.5.1 berikut ini.
Pertambahan tertinggi pada aplikasi 30 hari dan satu hari setelah inokulasi patogen ditunjukkan oleh perlakuan dengan Enterobacter sp. PB17 dengan nilai masing-masing 12,46 cm dan 17,4 cm. Pertambahan tinggi tanaman untuk isolat PB08 dengan aplikasi 30 hari setelah inokulasi patogen sebesar 11,2 dan 13,1 cm pada aplikasi satu hari setelah inokulasi patogen. Tanaman yang diaplikasikan isolat Bacillus sp. BK17 menunjukkan perawakan yang lebih pendek jika dibandingkan
dengan perlakuan dua isolat lainnya, yaitu sebesar 12 cm dengan aplikasi pada aplikasi satu hari setelah inokulasi patogen dan 8.2 cm dengan aplikasi satu bulan setelah inokulasi patogen. Kontrol positif menunjukkan pertambahan tinggi terendah yaitu 3,6 cm, pertambahan tinggi tanaman pada perlakuan kontrol negatif yaitu 14,24 cm dan tidak lebih tinggi jika dibandingkan dengan tanaman yang diaplikasikan Enterobacter sp. PB17.
Tinggi tanaman karet pada masing-masing perlakuan bervariasi. Hal ini Gambar 4.5.1 Pertambahan tinggi rata-rata tanaman setelah 60 hari masa perlakuan
Kontrol positif
Bacillus sp. BK17 Kontrol negatif
air dan nutrisi yang mengganggu pertumbuhan bibit karet (Ayu et al. 2012). Jamur patogen yang merusak bagian akar tanaman atau menyumbat xilem atau floem, sangat mengganggu penyerapan air dan nutrisi anorganik dan organik di dalam tanaman. Terganggunya penyerapan air dan nutrisi dapat menyebabkan tanaman yang terserang jamur patogen akan mati (Agrios 2004).
Berdasarkan uraian di atas dapat dilihat bahwa perlakuan dengan penambahan Enterobacter sp. PB 17 menunjukkan nilai tinggi tanaman yang lebih besar
dibandingkan kontrol negatif yang akarnya sehat tanpa ada infeksi patogen. Hal ini mengindikasikan bahwa ada sesuatu yang disumbangkan oleh isolat bakteri kitinolitik yang menunjang pertumbuhan tanaman. Isolat bakteri kitinolitik yang disiram ke permukaan tanah akan masuk ke bagian akar tanaman, dan hidup di sekitar daerah perakaran tanaman atau dapat kita sebut sebagai rizobakteria. Timmusk (2003) menyebutkan rizobakteria adalah bakteri yang hidup dan berkembang di daerah sekitar perakaran tanaman. Rizobakteria dapat berfungsi sebagai pemacu pertumbuhan tanaman dan sebagai agen antagonis terhadap patogen tanaman.
Rizobakteria sering digunakan untuk memacu pertumbuhan tanaman (plant growthpromoting rhizobacteria. Beberapa bakteri yang sering digunakan yaitu
Pseudomonas sp.,Azospirillum sp., Azotobacter sp., Enterobacter sp., Bacillus sp. dan
Serratia sp. (Sutariati 2006). Hasil penelitian menunjukkan bahwa rhizobakteri yang
Pertambahan diameter batang yang dibentuk masing-masing isolat tidak menunjukkan perbedaan yang terlalu jauh dengan kisaran diameter sebesar 0,1-0,22 cm. Pertambahan nilai diameter batang terbesar ditunjukkan oleh perlakuan kontrol negatif yaitu sebesar 0,23 cm. Enterobacter sp. PB17 memiliki pertambahan diameter terbesar yaitu 0,22 cm pada aplikasi isolat satu bulan setelah inokulasi patogen.
Bibit karet yang diaplikasikan Enterobacter sp. PB17 satu hari setelah inokulasi patogen memiliki pertambahan diameter yang lebih rendah jika dibandingkan aplikasi 30 hari setelah inokulasi patogen. Hal ini bisa saja disebabkan karena adanya faktor lingkungan yang mempengaruhi kemampuan bakteri pada perlakuan tersebut dalam menunjang pertambahan diameter batang. Misalnya suhu, pH serta kelembaban. Selain itu bisa saja terjadi kompetisi antara isolat bakteri kitiolitik dengan jamur patogen dalam hal memperebutkan makanan yang sama, sehingga berdampak pada kemampuan bakteri tersebut dalam menunjang pertambahan diameter batang. Nilai pertambahan diameter yang ditunjukkan tidak terlalu jauh sehingga mungkin diperlukan waktu pengamatan yang lebih lama untuk melihat pengaruh penambahan isolat terhadap pertambahan diameter batang.
Kontrol positif menunjukkan pertambahan nilai diameter batang terkecil yaitu Gambar 4.5.2 Pertambahan nilai diameter rata-rata batang tanaman selama masa
diameter terbesar ditunjukkan oleh isolat PB08 sebesar 0,16 cm. Kontrol positif menunjukkan angka terendah mungkin disebabkan karena adanya patogen yang menginfeksi bagian akar tanaman, sehingga mengganggu aktifitas akar dan menghambat pembesaran batang tanaman. Hal ini dapat dilihat dari gejala yang tampak pada tanaman dengan perlakuan kontrol positif yaitu ukuran daun kecil, berwarna hijau kusam. Beberapa helai kuning dan dipenuhi bercak kuning. Bagian ujung daun melengkung ke atas. Batang tanaman tampak layu dan kurus (Gambar 4.5.3).
Hasil penelitian menunjukkan nilai pertambahan rata-rata jumlah daun yang berbeda-beda pada setiap perlakuan. Aplikasi bakteri satu hari setelah inokulasi patogen untuk perlakuan setiap isolat tidak menunjukkan perbedaan yang jauh yaitu berkisar 8-8,4 helai. Pertambahan rata-rata daun terbanyak ditunjukkan oleh isolat Enterobacter sp. PB17 yaitu 8,2 helai. Aplikasi isolat 30 hari setelah inokulasi patogn
menunjukkan isolat PB08 memiliki pertambahan daun paling banyakyaitu 23,2 helai. Untuk perlakuan dengan isolat Enterobacter sp. PB17 jumlah rata-rata daun yaitu 8,4 helai. Sedangkan perlakuan dengan Bacillus sp. BK17 sebanyak 14,2 helai. Kontrol positif tidak menunjukkan pertambahan jumlah daun. Kontrol negatif menunjukkan jumlah daun yang lebih sedikit dari perlakuan dengan isolat bakteri kitinolitik yaitu 2,0 helai. Histogram perbandingan jumlah rata-rata daun disajikan pada Gambar 4.5.4 berikut ini.
4.6 Reisolasi R. microporus dan Bakteri Kitinolitik Dari Akar Bibit Tanaman
Karet
Reisolasi jamur patogen terhadap kontrol positif dilakukan dengan Uji Postulat Koch. Hasil reisolasi menunjukkan jamur yang tumbuh memiliki ciri-ciri yang sama dengan R. microporus yang digunakan sebagai inokulum patogen pada uji in vitro. Ini sesuai dengan Postulat Koch yang digunakan untuk membuktikan bahwa
suatu penyakit disebabkan oleh mikroba tertentu (Pelczar & Chan 1986). Hasil reisolasi disajikan pada Gambar 4.6.1
Gambar 4.5.4 Pertambahan rata-rata jumlah daun pada tiap perlakuan
Reisolasi pada kontrol negatif juga dilakukan pada bagian akar bibit karet yang sudah disterilisasi permukaannya. Hasil reisolasi menujukkan bakteri yang tumbuh tidak mampu mendegradasi kitin, sehingga tidak ada zona jernih yang terbentuk. Hasil reisolasi akar karet dari perlakuan dengan ketiga isolat untuk setiap metode gambar menunjukkan adanya degradasi pada media MGMK sehingga membentuk zona jernih (Gambar 4.6.2).
potensi sebagai antimikroba. Mikroba endofit dapat diisolasi dari jaringan tanaman dan ditumbuhkan pada medium fermentasi tertentu. Di dalam medium fermentasi tersebut mikroba endofit umumnya dapat menghasilkan senyawa sejenis yang terkandung pada tanaman inang dengan bantuan aktivitas suatu enzim.
4.7 Reisolasi bakteri kitinolitik dari tanah perlakuan bibit karet
Reisolasi pada tanah bekas perlakuan dilakukan dengan metode cawan tuang dengan faktor pengenceran 104. Hasil reisolasi didapatkan adanya aktivitas kitinase dari rizosfer akar, terbukti dari hasil inokulasi tanah yang diberi perlakuan PB08, Enterobacter sp. PB17 dan Bacillus sp BK17 pada media kitin ditemukan adanya
zona jernih (Gambar 4.7.1).
Gambar 4.7.1 Reisolasi bakteri kitinolitik dari tanah perlakuan, (a) PB08 30 hari setelah inokulasi patogen, (b) Bacillus sp. BK17 30 hari setelah inokulasi patogen, (c) PB08 satu hari setelah inokulasi patogen, (d) Enterobacter sp. PB17 30 hari setelah inokulasi patogen, (e) Bacillus sp. BK17 satu hari setelah inokulasi patogen dan (e) Enterobacter sp. PB17 satu hari setelah inokulasi patogen.
Gambar 4.7.2 Jumlah bakteri kitinolitik hasil reisolasi dari tanah perlakuan dengan metode cawan tuang pengamatan hari ke-60
Hasil reisolasi dari tanah perlakuan menunjukkan bahwa jumlah isolat terbanyak ditemukan pada tanah perlakuan yang diaplikasikan isolat PB08 baik dengan cara aplikasi isolat 30 hari dan satu hari setelah inokulai patogen. Pada perlakuan kontrol negatif dan kontrol positif juga ditemukan bakteri yang tumbuh dan mampu mendegradasi kitin. Bakteri ini mungkin berasal dari tanah yang digunakan sebagai media tanam, karena tanah yang digunakan untuk aplikasi in vivo tidak disterilkan. Schlegel & Schmidt (1994) menyebutkan bahwa di dalam setiap gram tanah mengandung 106 sel mikroorganisme yang mampu menguraikan kitin, adanya zona jernih di sekitar pertumbuhan bakteri mengindikasikan bahwa adanya aktivitas kitinolitik yang mensekresian enzim ke dalam media pertumbuhan (Plebanet al. 1997). Bakteri diketahui dapat menghidrolisis kitin setelah 72-96 jam ditumbuhkan pada media campuran agar yang dicampur dengan kolidal kitin sebagai sumber karbonnya (Chernin et al. 1995).
Kontrol negatif Kontrol positif
PB08 Enterobacter sp. PB17
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari penelitian yang dilakuan dapat disimpulkan bahwa:
1. Seluruh isolat bakteri kitinolitik yang diujikan memiliki kemampuan dalam menghambat pertumbuhan R. microporus.
2. PB08, Enterobacter sp. PB17 dan Bacillus BK17 merupakan isolat yang memiliki zona hambat terbesar terhadap R. microporus.
3. PB08, Enterobacter sp. PB17 dan Bacillus sp. BK17 mampu menghambat pertumbuhan dan mengendalikan serangan R. microporus.
4. PB08, Enterobacter sp. PB17 dan Bacillus sp. BK17 dapat dijadikan kandidat untuk mengendalikan serangan penyakit jamur akar putih pada bibit tanaman karet.
5.2 Saran
DAFTAR PUSTAKA
Agrios GN. 1988. Plant Pathology. Department. of Plant Pathology University of Florida. Ginesville Press Inc.
Amiruddin, Taufik M & Andi KR. 2012. Aplikasi agens hayati dan Arachis pintoi dalam memacu pertumbuhan vegetatif dan ketahanan tanaman lada (Piper ningrum L.) terhadap penyakit kuning. Penelitian Agronomi 1(1): 47-56.
Ayu A. 2012. Potensi bakteri kitinolitik dalam pengendalian Aspergillus niger penyebab penyakit busuk pangkal akar pada tanaman kacang tanah.Saintia Biologi 1(1): 59-65.
Brezezinska MS & Donderski W. 2006. Chitinolytic bacteria in two lakes of different trophic status. Pol. Ecol 54(2): 295-301.
Chatarina TS. 2012. Strategi pengelolaan untuk memperkecil serangan jamur akar putih (Rigidoporus microporus) pada perkebunan jambu mente. Ganec Swara 6(1): 69-73.
Chernin L, Ismailov Z, Haran S & Chet I. 1995. Chitinolytic Enterobacter aggiomerans antagonistic to fungal plant pathogens. App. Enviro. Microbiol 61(5): 1720-1727.
Chrisnawati. 2011. Pengujian formula agensia hayati Bacillus sp. dan Pseudomonas fluoresen untuk mengendalikan penyakit layu bakteri nilam. Jurnal Embrio 4(2): 99-107.
Dewi RR. 2011. Pengendalian Saprolegnia sp. pada telur gurami (Osphronemus gouramy) menggunakan isolat bakteri kitinoitik. Tesis. Departemen Biologi FMIPA USU. Medan.
El-Katatny MH, Somitsch W, Robra K-H, El-Katatny MS & Gübitz GM. 2000.
Production of chitinase and β-1,3-glucanase by Trichoderma harzianum for control of the phytopathogenic fungus Sclerotium rolfsii. Food Technol Biotechnol 38: 173–180.
Farid AH, Lee SS, Maziah Z & Patanayah M. 2009. Pathogenicity of Rigidoporus microporus and Phellinus noxius againts four major plantation tree species in Peninsular Malaysia. J Tropical Forest Science 21(4): 289-298.
Gohel V, Singh A, Vimal M, Ashwini D & Chatpar HS. 2006. Bioprospecting and antifungal potential of chitinolytic microorganism. Afri J Biotechnol 5(2): 54-72.
Hasanuddin GE. 2003. Peningkatan peranan mikroorganisme dalam sistem pengendalian penyakit tumbuhan secara terpadu. Medan, Indonesia: USU Digital Library.
Hastuti AE. 2000. Sebaran penyakit akar putih (Rigidoporus microporus (Swatz) Van Ov.) pada tanaman teh (Camellia sinensis (L) O. Kuntze) di lapangan dan eksplorasi beberapa cendawan antagonis. Skripsi. IPB. Jurusan Hama dan Penyakit Tumbuhan.
Herdyastuti N, Raharjo TJ, Mudasir & Matsjeh S. 2009. Kitinase dan mikroorganisme kitinolitik : isolasi, karakterisasi dan manfaatnya. Indones J Chem 9(1): 37-47.
Huang CJ, Tang-Kai W, Shun-Chun C & Chao Ying C. 2005. Identification of an antifungal chitinase from a potential biocontrol agent, Bacillus cereus 28-9. J Biochem Mol Biol 38(1): 82-88.
Johansson PM. 2003. Biocontrol of Fusarium in wheat introducing bacteria to a system of complex interactions. Thesis Doctoral. Plant Pathology and Biocontrol Unit. Uppsala Swedia. Swedish University of agriculture Science. Kaewachai S & Soytong E. 2010. Application of biofungicides against Rigidoporus
microporus causing white root diseases of rubber trees. J Agric Technol 6(2): 349-363.
Kamil Z, Heikel N & Fahmy F. 1993. Extracellular chitinase from Streptomyces species and its antifungal activity. Acta Pharmaceutica Turcica 35: 135-143. Kusdiana & Alchemi P.J. 2011. Eksplorasi dan identifikasi cendawan antagonis
terhadap Rigidoporus lignosus penyebab jamur akar putih pada karet. Departemen Proteksi Tanaman. Fakultas Pertanian. Institut Pertanian Bogor. Bogor.
Lorito MG, Harman E, Hayes CK, Broadway RM, Tronsmo SL, Woo & Di Pietro A. 1992. Chitinolytic enzymes produced by Trichoderma harzianum: antifungal activity or purified endochitinase and chitobiosidase. Phytopathol 83:302-307.
Muharni & Widjajanti H. 2011. Skrining bakteri kitinolitik antagonis terhadap pertumbuhan jamur akar putih (Rigidoporus lignosus) dari rizosfir tanaman karet. Penelitian Sains 14(1): 51-56.
Patil RS, Ghormade V & Despande MV. 2000. Chitinolytic enzymes: An exploration. Enzyme Microb Technol 26: 473-483.
Pelczar MJ & Chan ECS. 1986. Dasar-dasar mikrobiologi. Terjemahan. Jilid 1. Jakarta UI Press.
Pleban S, Chernin L & Chet I. 1997. Chitinolytic activity of an endophytic strain of Bacillus cereus. Lett Appl Microbiol 25:284-288.
Prasetyo J, Aeny TN, & Suharjo R. 2009. The correlations between white root (Rigidoporus lignosus L.) incidence and soil characters of rubber ecosystem in Penumangan Baru, Lampung. J. HPT Tropika 9(2): 149-157.
Pudjihartati E, Siswanto, Satrias I & Sudarsono. 2006. Aktivitas enzim kitinase kasar pada kacang tanah yang sehat dan terinfeksi Sclerotium rolfsii. Hayati 13(2):73-78.
Pujiyanto S. 2002. Isolasi dan karakterisasi bakteri kitinolitik serta kloning shotgun gen kitinase dari Ekosistem Air Hitam, Kalimantan Tengah. Tesis. IPB. Bogor.
Radu S & Kqueen CY. Preliminary screening of endophytic fungi from medicinal plants in Malaysia for antimicrobial antitumor activity. Malaysian J Med Sci 9(2): 23-33.
Rajarathanam S, Shasrieka & Bano Z. 1998. Biodegradative and biosynthetic capacities of mushroom. Present and future strategies. Crit Rev Biotech 18: 23-91.
Rodriquez-Kabana, Godoy R, Morgan-Jones G & Shelby RA. 1983. The determination of soil chitinase activity: Condition for assay and ecological studies. Plant soil 75: 95-106.
Schlegel HG & Schmidt K. 1994. Mikrobiologi. Edisi ke-6 cetakan pertama. Terjemahan RMT Baskoro. Yogyakarta: UGM Press.
Semangun H. 2008. Penyakit tanaman perkebunan di Indonesia. Gadjah Mada University Press: Yogyakarta. Hlm.11-19.
Setyamidjaja D. 1993. Karet budidaya dan pengolahan. Yogyakarta: Kanisius. Hlm 101-102.
Soeka YS & Sulistiani. 2011. Seleksi, karakterisasi, dan indentifikasi bakteri penghasil kitinase yang diisolasi dari Gunung Bromo Jawa Timur. Nature Indonesia 13(2): 155-161.
Strobel GA. 2001. Microbial gifts from rain forest. J Plant Pathol 24:14-20.
Strobel GA & Daisy B. 2003. Bioprospecting for microbial endophytes and their natural products. Microbiol & Mol. Biology Rev 67(4): 491-502.
Suryanto D & Munir E. 2006. Potensi isolat bakteri kitinolitik lokal untuk pengendalian hayati jamur. Prosiding Seminar Hasil-Hasil Penelitian USU 2006. Medan. Hlm. 15-25.
Suryanto D, Wibowo RH, Siregar EBM & Munir E. 2012. A possibility of chitinolytic bacteria utilization to control basal stems disease caused by Ganoderma boninense in oil palm seedling. Afr J Microbiol Res 6(9): 2053-2059.
Sutariati GAK, Widodo, Sudarsono & Ilyas S. 2006. Pengaruh perlakuan rhizobakter pemacu pertumbuhan tanaman terhadap viabilitas benih serta pertumbuhan bibit tanaman cabai. Bul Agron 34(1): 4-54.
Suwandi. 2008. Evaluasi kombinasi isolat Trichoderma mikoparasit dalam mengendalikan penyakit akar putih pada bibit karet. J HPT Tropika 8(1): 55-62.
Taufik M. 2010. Pertumbuhan dan produksi tanaman cabai yang diaplikasikan plant growth promoting rhizobakteria. J Agrivigor 10(1): 99-107.
Tim Karya Tani Mandiri. 2010. Pedoman Bertanam Karet. Bandung: Nuassa Aulia. Hlm 24-25.
Timmusk S. 2003. Mechanism of action of the plant growth promoting rhizobacterium Paenibacillus polymyxa. Disertation. Uppsala Sweden. Departemen of Cell and Molecular Biology. Uppsala University.
Timmusk S & Wagner H. 1999. The plant growth promoting rhizobacterium Paenibacillus polymyxa induces changes in Arabidopsis thaliana gene expression: a possible connection between biotic and abiotic stress responses. MPMI 12(1): 951-959.
Toharisman. 2007. Peluang pemanfaatan enzim kitinase di industry gula. Makalah P3GI.
Tombe, M. 2008. Pemanfaatan pestisida nabati dan agensia hayati untuk pengendalian penyakit busuk jamur akar putih pada jambu mete. Bul Littro 19(1): 68-77. Wahyuni A. 2011. Pengendalian serangan Colletotrichum sp. pada tanaman kakao